Способ ферментной регенерации окислительно-восстановительных кофакторов - RU2635087C2
Код документа: RU2635087C2
Чертежи









Описание
Предпосылки создания изобретения
Настоящее изобретение относится к способу ферментной регенерации окислительно-восстановительных кофакторов NAD+/NADH и NADP+/NADPH в совместной реакции, в котором в результате по меньшей мере двух катализируемых ферментами окислительно-восстановительных реакций, протекающих в одной и той же реакционной массе (реакций образования продукта) один из двух окислительно-восстановительных кофакторов накапливается в восстановленной форме, а другой, соответственно, в окисленной форме.
Предшествующий уровень техники
Катализируемые ферментами окислительно-восстановительные реакции используются в промышленности, например, в производстве хиральных спиртов, α-аминокислот и α-оксикислот. В промышленных окислительно-восстановительных реакциях преимущественно применяются кофакторы, например, NADH или NADPH. Особый интерес среди катализируемых ферментами окислительно-восстановительных реакций представляют те, в которых окислительно-восстановительные кофакторы регенерируются в ходе реакции с помощью регенерационных систем. Это объясняется тем, что появляется возможность расходовать только каталитические количества дорогостоящих кофакторов (NAD(P)+/NAD(P)H). Наличие соответствующих дегидрогеназ и других ферментов привело к созданию различных систем регенерации кофакторов.
Известные системы можно классифицировать следующим образом: связанные ферментами, связанные субстратами, in vivo (системы регенерации природных кофакторов в живых организмах), фотохимические, химические и электроферментные. В заявленном способе используется связанная ферментами система регенерации. Преимущества связанных ферментами систем заключаются в высокой селективности, пригодности для получения различных продуктов и высокой степени повторного использования кофактора (полное число оборотов - TTN).
В середине 90-х годов первая система связанной ферментами регенерации кофакторов была задействована в промышленном масштабе в объеме нескольких тонн. В ней использовалась дегидрогеназа из Candida boidinii. В известных промышленных процессах, как правило, один окислительно-восстановительный фермент служит для синтеза продукта, а другой - для регенерации кофактора.
От таких способов следует отличать процессы, в которых в одной реакционной среде без промежуточного разделения имеют место две или более ферментных окислительно-восстановительных реакций, связанных с получением продукта, и две ферментные системы регенерации кофактора (одновременной или последовательной). В последнее время такие ферментные каскадные реакции, именуемые здесь совместными реакциями, привлекают большое внимание, поскольку они существенно сокращают производственные затраты, экономят время и снижают нагрузку на окружающую среду. Кроме того, ферментные каскады окислительно-восстановительных реакций облегчают преобразования, которые нелегко осуществить с помощью обычных химических реакций.
Однако осуществить одновременно несколько реакций (окисления и восстановления) в одной совместной реакции с параллельной регенерацией кофактора затруднительно, поскольку часто для отдельных преобразований требуются совершенно разные условия реакции. На сегодняшний день выполнено незначительное число опытов ведения совместных реакций, включающих окислительные и восстановительные реакции с задействованными системами регенерации кофакторов.
В литературе (Advanced Synth. Catal., 2008, Volume 351, Issue 9, p. 1303-1311) описана экспериментальная совместная реакция с участием 7α-гидроксистероид-дегидрогеназы, (HSDH), 7β-HSDH и 12α-HSDH. В этом процессе окисление, как региоселективное, так и стереоселективное, имеет место в положениях 7 и 12 холевой кислоты, с последующим регио- и стереоселективным восстановлением в положении 7. При этом системами регенерации кофактора служат как лактат-дегидрогеназа (NAD+-зависимая), так и глюкозо-дегидрогеназа (NADP+-независимая). Косубстратами являются пируват и глюкоза. Хотя изначально этот процесс замышлялся как совместный, в конце его окислительные и восстановительные реакции выполняются раздельно. При этом разделение этапов окисления и восстановления осуществляют в так называемом реакторе типа «чайный пакет» или в мембранном реакторе. Такое разделение необходимо, чтобы избежать образования побочных продуктов ввиду низкой селективности NADPH-глюкозо-дегидрогеназы по отношению к кофактору. Однако в ходе совместной реакции NADP+ в глюкозо-дегидрогеназе частично преобразуется в NAD+, что препятствует окислению. В описанном способе используется всего 12.5 мМ (~0,5%) субстрата - холевой кислоты, что делает способ неинтересным с экологической точки зрения.
Более того, описана также попытка осуществить дерацемизацию рацематов вторичных спиртов через промежуточный прохиральный кетон с использованием совместной реакции (J. Am. Chem. Soc, 2008, Volume 130, p. 13969-13972). Дерацемизацию вторичных спиртов осуществляют через две спиртовые дегидрогеназы (S- и R-специфичные), обладающие различной специфичностью по отношению к кофактору. В данной системе NADP регенерируют NADPH-оксидазой (создающей перекись водорода), a NADH - формиатной дегидрогеназой. Косубстратами служат формиат и кислород. В этой системе используют 4 фермента, а стадии окисления и восстановления не разделяются. Недостатком способа является крайне низкая концентрация используемого субстрата - 0.2-0.5%, что непригодно для промышленных масштабов.
Еще одна совместная реакция описана в WO 2009/121785 А2. Здесь стереоизомер оптически активного вторичного спирта окисляют до кетона, а затем восстанавливают до соответствующего оптического антипода с применением двух спиртовых дегидрогеназ, имеющих противоположную стереоселективность и различную специфичность по отношению к кофактору. Кофакторы регенерируют с помощью так называемой «системы переноса гидрида», с только одним дополнительным ферментом. Для регенерации кофакторов используют различные ферменты, например, формиат-дегидрогеназу, глюкозо-дегидрогеназу, лактат-дегидрогеназу. Недостатком данного процесса является низкая концентрация субстратов.
Общим недостатком известных ферментных совместных способов с участием систем регенерации кофакторов является очень низкая концентрация субстрата, недостаточная для промышленных процессов.
Напротив, уже известны многие индивидуальные ферментные окислительно-восстановительные реакции, в которых используются системы регенерации кофакторов. Описаны опыты с цельными микроорганизмами, лизатами клеток или выделенными ферментами, которым сопутствует регенерация NAD(P)H или NAD(P)+. К известным ферментным системам регенерации кофакторов относятся, например, формиат-дегидрогеназа для NADH (косубстратом служит формиат), спиртовая дегидрогеназа из Pseudomonas sp. для NADH (косубстратом служит 2-пропанол), гидрогеназа для NADH и NADPH (косубстратом служит Н2), глюкоза-6-фосфат-дегидрогеназа из L. mesenteroides для NADPH (косубстратом служит глюкоза-6-фосфат), глюкозо-дегидрогеназа для NADH и NADPH (косубстратом служит глюкоза), NADH оксидаза для NADH (косубстратом служит О2) и фосфит-дегидрогеназа для NADH (косубстратом служит фосфит).
В качестве примера можно привести использование таких индивидуальных окислительно-восстановительных реакций в производстве хиральных гидроксисоединений, начиная с соответствующих прохиральных кетосоединений. Здесь кофактор регенерируют с помощью дополнительного фермента. Общим для этих способов является то, что реакция восстановления протекает изолированно и что регенерируется NAD(P)H (см., например, ЕР 1152054).
Описаны ферментные процессы с использованием гидроксистероидных дегидрогеназ в сочетании с системой регенерации кофактора, которые протекают при повышенных концентрациях субстрата (> около 1%) (ЕР 1731618; WO 2007/118644; Appl. Microbiol. Biotechnol., 2011 Volume 90 p. 127-135). В таких способах кофакторы NAD(P)H или NAD(P) регенерируют с помощью различных ферментов, например, лактат-дегидрогеназы (косубстратом служит пируват), спиртовой дегидрогеназы из Т. brockii (косубстратом служит изопропанол), спиртовой дегидроненазы из L. brevis, L. minor, Leuconostoc carnosum, Т. ethanolicus, Clostridium beijerinckii. Однако эти известные способы относятся только к изолированным одиночным реакциям окисления гидроксисоединения или восстановления оксосоединения.
Уже была описана система регенерации кофактора для NADH с использованием малат-дегидрогеназы («малатного фермента») (Can. J. Chem. Eng. 1992, Volume 70, p. 306-312). В этой публикации речь идет о восстановительном аминировании пирувата аланин-дегидрогеназой. Пируват, образующийся при регенерации кофактора, далее используют в реакции образования продукта.
В WO 2004/022764 также описана регенерация NADH малат-дегидрогеназой. В отличие от предыдущей публикации, пируват, образующийся при окислительном декарбоксилировании малата, далее не используется.
Описан пример ферментного восстановления D-ксилозы до ксилита с применением системы регенерации кофактора (FEBS J., 2005, Volume 272, р. 3816-3827). Ферментом, регенерирующим кофактор, служит NADPH-зависимый мутант фосфит-дегидронегазы из Pseudomonas sp. Здесь также имеет место одиночная реакция образования целевого продукта.
Опубликованы и другие примеры ферментативного получения обогащенных хиральными энантиомерами органических соединений - спиртов, аминокислот и т.п. (Organic Letters, 2003, Volume 5, p. 3649-3650; US 7,163,815; Biochem. Eng. J., 2008, Volume 39(2) p. 319-327; ЕР 1285962). В этих системах ферментом, регенерирующим кофактор, служит NAD(P)H-зависимая оксидаза из Lactobacillus brevis или Lactobacillus sanfranciscensis. Речь идет подобным образом об одиночной реакции образования целевого продукта.
В WO 2011/000693 описаны 17-бета-гидроксистероид-дегидрогеназа и способ, позволяющие осуществить окислительно-восстановительные реакции в положении 17 4-андростен-3,17-диона. Это опять-таки одиночная восстановительная реакция. Все рассмотренные индивидуальные реакции окисления или восстановления не обладают преимуществами совместной реакции - низкой себестоимостью за счет экономии времени и материалов и лучшей кратностью оборота за счет ферментных каскадных реакций.
Задача изобретения и описание способа
Задачей настоящего изобретения является создание способа регенерации окислительно-восстановительных кофакторов NAD+/NADH и/или, например, и NADP+/NADPH для экономически эффективного осуществления двух или более катализируемых ферментами окислительно-восстановительных реакций в одной реакционной массе.
В соответствии с изобретением поставленная задача достигается тем, что в указанном выше способе ферментной регенерации окислительно-восстановительных кофакторов NAD+/NADH и/или, например, и NADP+/NADPH, путем совместной реакции, в котором в результате по меньшей мере двух катализируемых ферментами окислительно-восстановительных реакций в одной реакционной массе (реакций образования целевого продукта) один из двух окислительно-восстановительных кофакторов накапливается в восстановленной форме, а другой, соответственно, в окисленной форме, указанный способ отличается тем, что
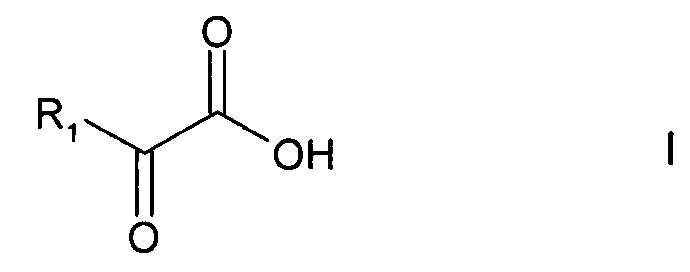
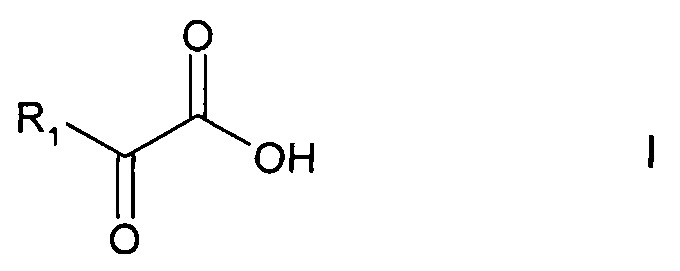
а) в реакции регенерации, при которой восстановленный кофактор преобразуется в исходную окисленную форму, восстанавливают кислород или соединение общей формулы

где R1 - линейная или разветвленная (С1-С4-алкильная группа или (С1-С4)-карбоксиалкильная группа, а
b) в реакции регенерации, в которой окисленный кофактор преобразуется в исходную восстановленную форму, окисляют (С4-С8)-циклоалканол или соединение общей формулы
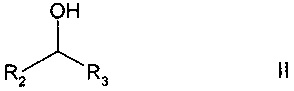
где R2 и R3 независимо друг от друга выбраны из группы, включающей Н, (C1-С6) алкил, где алкил является линейным или разветвленным, (C1-С6) алкенил, где алкенил является линейным или разветвленным и содержит от одной до трех двойных связей, арил, в частности, С6-С12 арил, карбоксил или (С1-С4) карбоксиалкил, в частности, циклоалкил, например, С3-C8 циклоалкил.
Способ, заявленный в настоящем изобретении, также называется «способом в соответствии с настоящим изобретением».
В ином аспекте в соответствии с настоящим изобретением заявлен способ ферментной регенерации окислительно-восстановительных кофакторов NAD+/NADH и/или, например, и NADP+/NADPH, путем совместной реакции, где в результате по меньшей мере двух дальнейших катализируемых ферментами окислительно-восстановительных реакций в той же реакционной массе (реакций образования целевого продукта) один из двух окислительно-восстановительных кофакторов накапливается в восстановленной форме, а другой, соответственно, в окисленной форме, отличающийся тем, что
a) в ходе регенерации окисленного кофактора восстанавливают соединение общей формулы

где R1 - замещенная или незамещенная С1-С4 алкильная группа, а
b) в ходе регенерации восстановленного кофактора окисляют соединение общей формулы

где R2 и R3 независимо друг от друга выбраны из группы, включающей
1) - H,
2) - (С1-С6) алкил, где алкил является линейным или разветвленным,
3) - (C1-С6) алкенил, где алкенил является линейным или разветвленным и выборочно содержит от одной до трех двойных связей,
4) - циклоалкил, в частности, С3-C8 циклоалкил.
5) - арил, в частности, С6-С12 арил,
6) - (С1-С4) карбоксиалкил, а в случае, если соединение формулы I является пируватом, и выборочно, также карбоксил.
В еще одном аспекте в способе в соответствии с изобретением R2 и R3 независимо друг от друга выбраны из группы, включающей Н, (С1-С6) алкил, где алкил является линейным или разветвленным, (C1-С6) алкенил, где алкенил является линейным или разветвленным и содержит от одной до трех двойных связей, арил, в частности, С6-С12 арил, карбоксил или (С1-С4) карбоксиалкил.
По сравнению с уровнем техники способ в соответствии с изобретением существенно усовершенствует процессы, в которых соединения подвергаются как ферментному окислению, так и восстановлению, поскольку позволяет вести необходимые реакции окисления и восстановления, а также сопутствующие реакции регенерации кофактора, в одной реакционной массе, используя гораздо более высокие, чем в известных способах, концентрации субстрата.
В способе в соответствии с данным изобретением используются кофакторы NADH и/или NADPH. NAD+ означает окисленную форму, a NADH - восстановленную форму никотинамидаденин динуклеотида, тогда как NADP+ означает окисленную форму, a NADPH - восстановленную форму никотинамидаденин динуклеотидфосфата.
Катализируемые ферментами окислительно-восстановительные реакции, которые не связаны с регенерацией кофактора, а в способе в соответствии с изобретением участвуют в образовании целевого продукта, называются «окислительными реакциями» и «восстановительными реакциями». «Окислительные реакции» и «восстановительные реакции» объединены термином «реакции образования продукта». В способе в соответствии с данным изобретением в каждом случае имеет место по меньшей мере одна окислительная реакция и по меньшей мере одна восстановительная реакция.
Если NAD+ служит кофактором для окислительной реакции (реакций), то NADPH является кофактором для восстановительной реакции (реакций). Если NADP+ служит кофактором для окислительной реакции (реакций), то NADH является кофактором для восстановительной реакции (реакций).
В способе в соответствии с настоящим изобретением окислительную реакцию (реакции) и восстановительную реакцию (реакции) можно вести хронологически параллельно или в хронологической последовательности, предпочтительно хронологически параллельно в одной реакционной массе.
Соединения, используемые для получения целевого продукта, далее называются субстратами. Соединения, которые реагируют при регенерации кофакторов, далее называются косубстратами.
В способе в соответствии с настоящим изобретением могут использоваться один или несколько субстратов. При этом окислительные и/или восстановительные реакции могут протекать как на одном субстрате (основной молекулярной цепи), так и на разных субстратах, предпочтительно на одном субстрате. Далее, в способе в соответствии с настоящим изобретением восстановительные и/или окислительные реакции могут протекать на одной или разных функциональных группах.
Способ в соответствии с настоящим изобретением пригоден для разнообразных реакций, например, для инверсии конфигурации стереоизомерных гидроксисоединений путем окисления до соответствующего кетона с последующим восстановлением до противоположного стереоспецифического гидроксисоединения.
Процесс, в котором для образования продукта используются две или более ферментные окислительно-восстановительные реакции, а две ферментные системы для регенерации кофакторов действуют в одной реакционной массе без выделения промежуточных соединений, здесь называется «совместной реакцией».
Если здесь упоминается какая-либо кислота или соль кислоты, подразумеваются ее соответствующие неназванные соединения. Подобным образом упоминание кислот, в частности, желчных кислот, подразумевает все производные эфиры таких кислот. Далее, упоминание какого-либо вещества подразумевает наличие защитных групп, в т.ч. частичных.
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что окислительная реакция и восстановительная реакция протекают хронологически параллельно.
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что окислительная реакция и восстановительная реакция протекают на одной основной молекулярной цепи.
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что в качестве соединения формулы I (2-оксокислоты) используют пируват (косубстрат), который восстанавливают до лактата с помощью лактат-дегидрогеназы, т.е. в реакции регенерации, при которой восстановленный кофактор возвращают в исходную окисленную форму, пируват восстанавливают до лактата с помощью лактат-дегидрогеназы.
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что в качестве соединения формулы II (вторичного спирта) используют 2-пропанол (изопропиловый спирт, IPA) (косубстрат), который окисляют до ацетона с помощью спиртовой дегидрогеназы, т.е. в реакции регенерации, при которой окисленный кофактор возвращают в исходную восстановленную форму, 2-пропанол окисляют до ацетона с помощью спиртовой дегидрогеназы.
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что используют кислород, восстановленный с помощью NADH оксидазы.
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что в качестве вторичного спирта используют малат (косубстрат), который окисляют до пирувата и СО2 с помощью декарбоксилирующей оксалоацетат малат-дегидрогеназы («малатного фермента»), т.е. в реакции регенерации, при которой окисленный кофактор возвращают в исходную восстановленную форму, малат окисляют до пирувата и СО2 с помощью с помощью малат-дегидрогеназы.
В этом варианте образующийся пируват вступает в последующую окислительно-восстановительную реакцию, которая не связана с образованием целевого продукта, а представляет собой реакцию регенерации второго кофактора.
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что его используют для проведения по меньшей мере одной окислительной реакции и по меньшей мере одной восстановительной реакции соответственно в той же реакционной массе на соединениях общей формулы
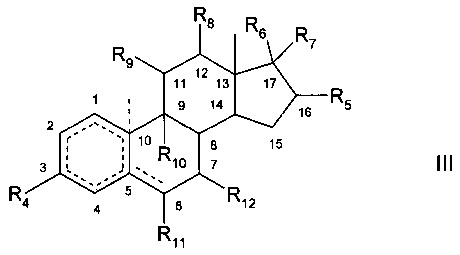
где
R4 - водород, метальная группа, гидроксигруппа или оксогруппа,
R5 - водород, гидроксигруппа, оксогруппа или метальная группа,
R6 - водород или гидроксигруппа,
R7 - водород, -COR13, где R13 - С1-С4 алкильная группа, незамещенная или замещенная гидроксигруппой, или С1-С4 карбоксиалкильная группа, замещенная, в частности, гидроксигруппой или незамещенная,
или R6 и R7 вместе представляют собой оксогруппу,
R8 - водород, метильная группа, гидроксигруппа или оксогруппа,
R9 - водород, метильная группа, гидроксигруппа или оксогруппа,
R10 - водород, метильная группа или галоген,
R11 - водород, метильная группа, гидроксигруппа, оксогруппа или галоген, а
R12 - водород, гидроксигруппа, оксогруппа или метильная группа,
где структурный элемент
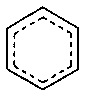
означает бензольное кольцо или кольцо, содержащее 6 атомов углерода и 0, 1 или 2 С-С-двойные связи;
причем субстрат (субстраты) предпочтительно присутствуют в концентрации <5 мас. % в реакционной массе для восстановительной реакции (реакций), связанных с образованием целевого продукта.
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что имеет место ферментное преобразование дегидроэпиандростерона (DHEA) формулы
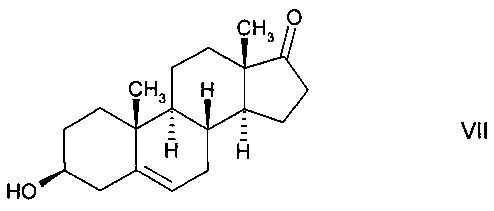
в тестостерон формулы
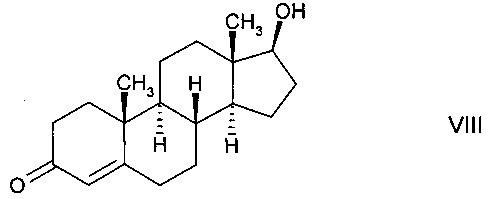
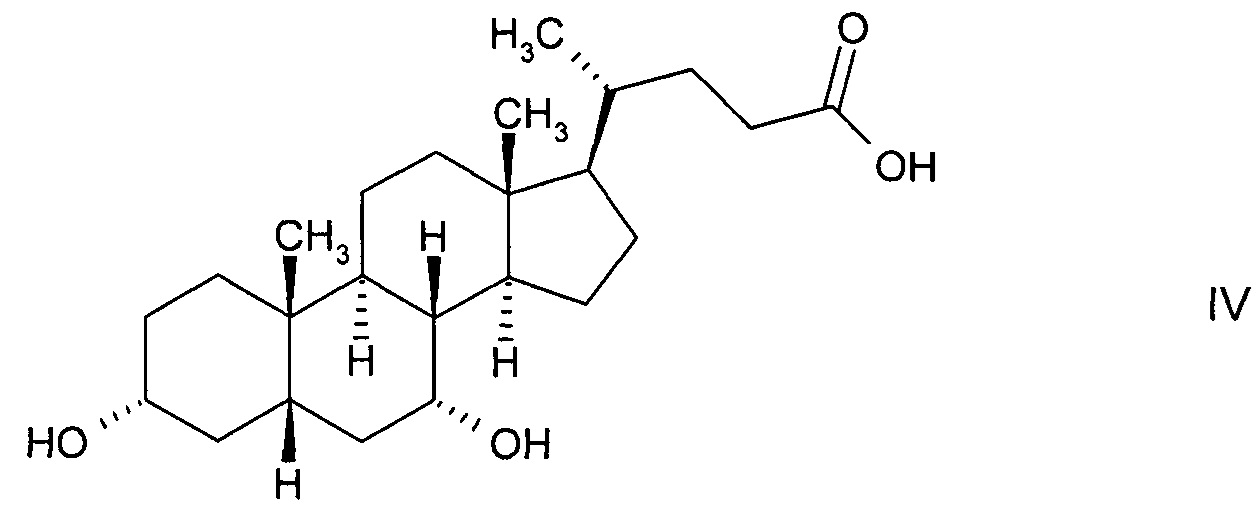
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что ферментная эпимеризация гидроксистероидного соединения 3α,7α-дигидрокси-5β-холановой кислоты (хенодеоксихолевой кислоты, CDC) формулы
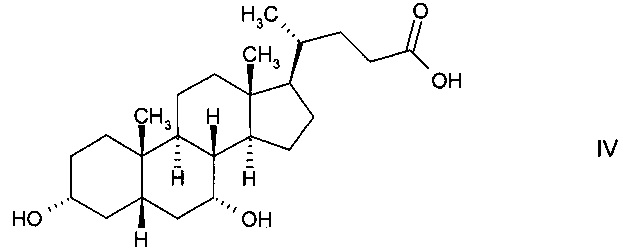
происходит путем окисления до кетолитохолевой кислоты (KLC) формулы

и восстановления до 3α,7β-дигидрокси-5β-холановой кислоты (урсодеоксихолевой кислоты, UDC) формулы
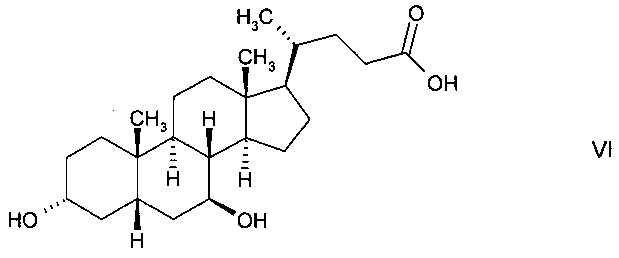
например, с использованием двух противоположных стереоспецифических гидроксистероидных дегидрогеназ.
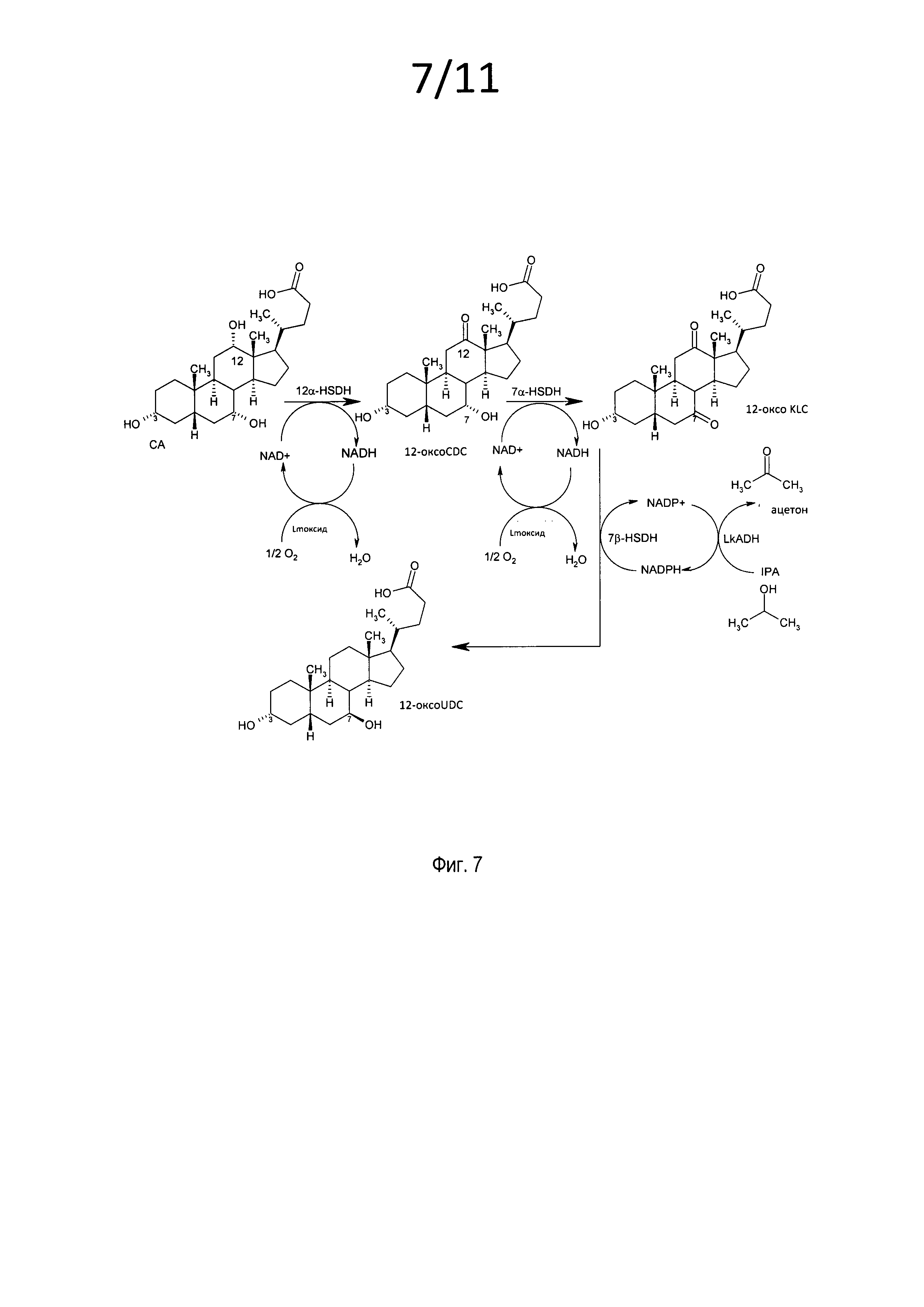
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что его используют для ферментной эпимеризации гидроксистероидного соединения 3α,7α,12α-тригидрокси-5β-холановой кислоты (холевой кислоты) формулы
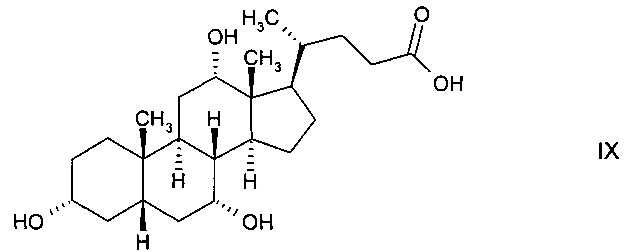
путем либо
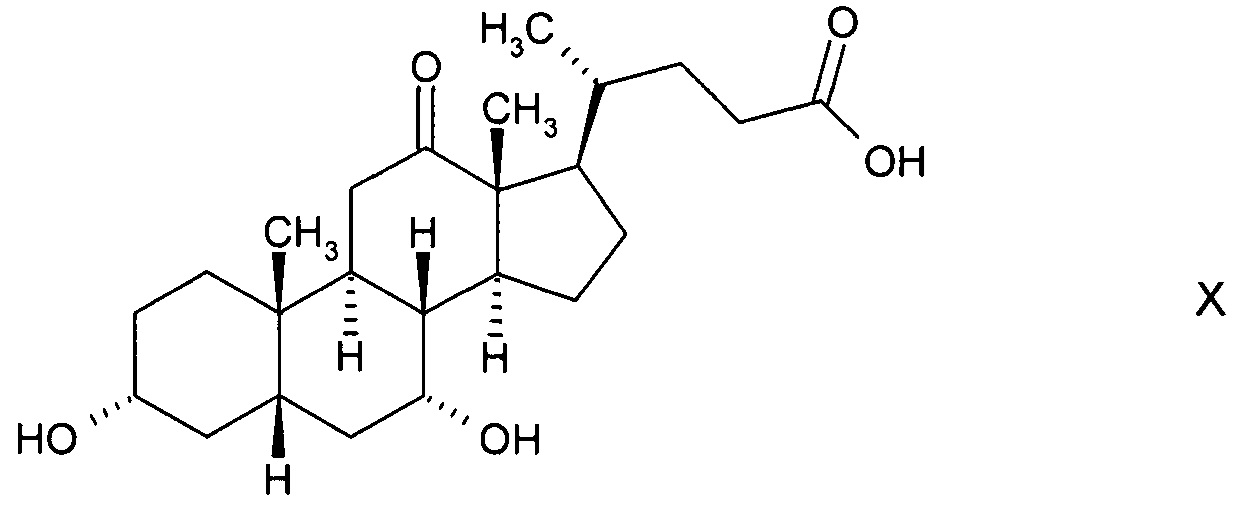
А) окисления с получением 3α,7α-дигидрокси-12-оксо-5β-холановой кислоты (12-оксо-CDC) формулы
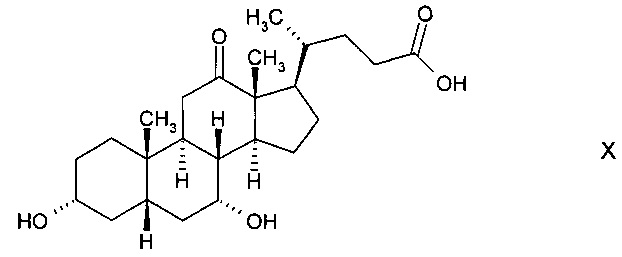
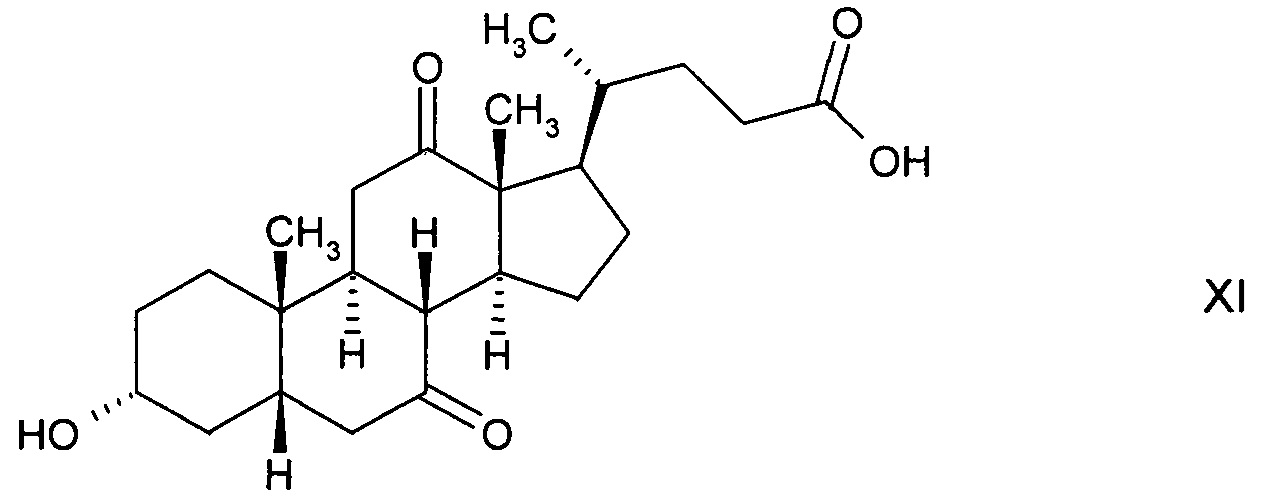
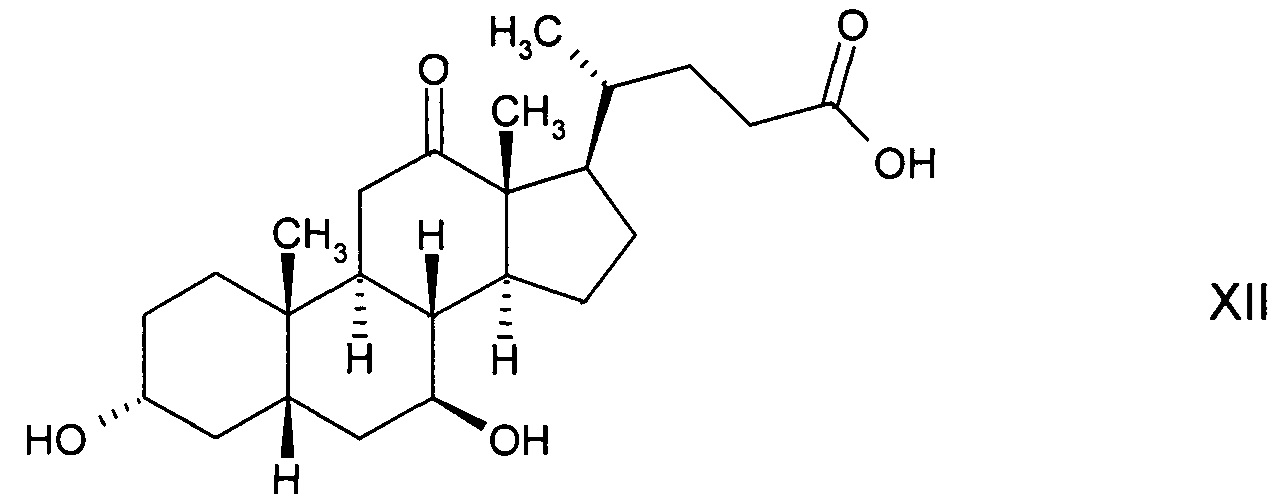
которая далее реагирует с получением 3α-гидрокси-7,12-диоксо-5β-холановой кислоты (12-оксо-KLC) формулы
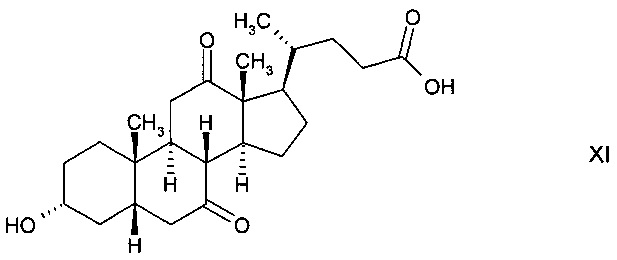
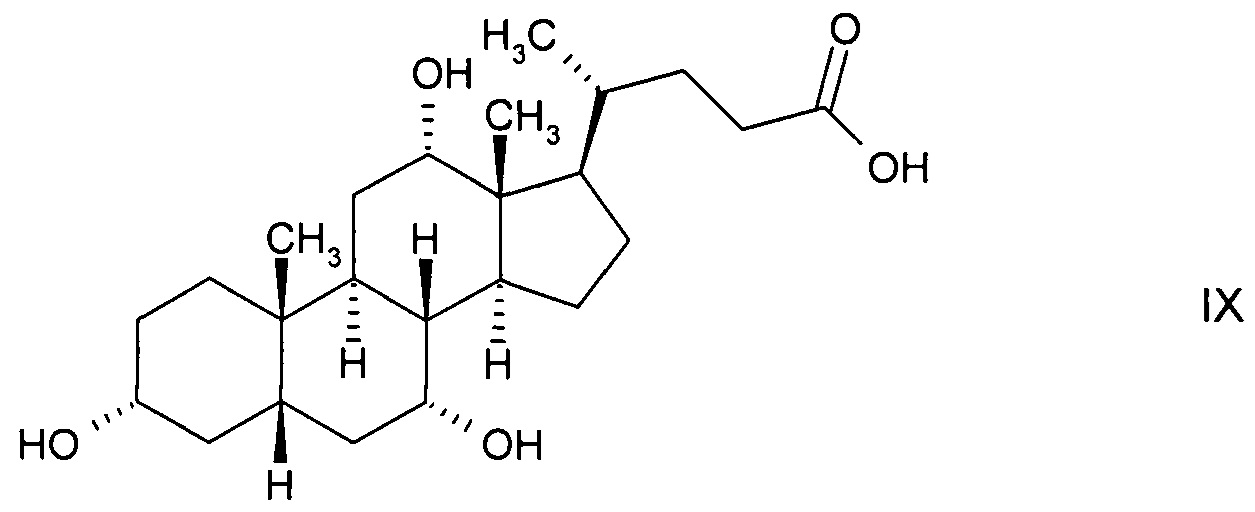
и последующего восстановления до стереоизомерного гидроксисоединения 3α,7β-дигидрокси-12-оксо-5β-холановой кислоты (12-кето-урсодеоксихолевой кислоты) формулы
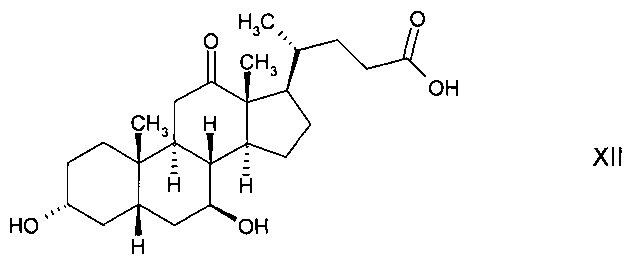
либо
В) путем окисления с получением 3α,12α-дигидрокси-7-оксо-5β-холановой кислоты формулы
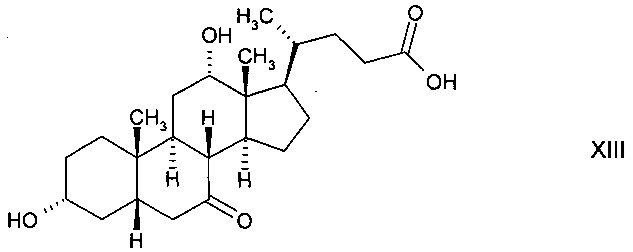
с последующим ферментным окислением с получением 3α-гидрокси-7,12-диоксо-5β-холановой кислоты (12-оксо-KLC) формулы XI и последующим восстановлением до стереоизомерного гидроксисоединения 3α,7β-дигидрокси-12-оксо-5β-холановой кислоты (12-кето-урсодеоксихолевой кислоты) формулы XII, либо
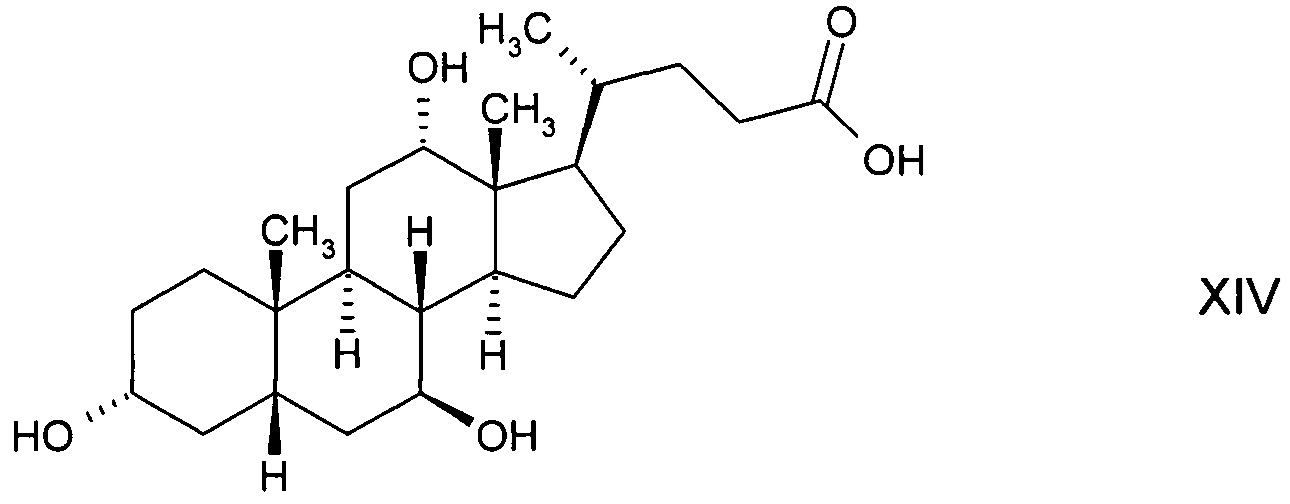
С) путем окисления с получением 3α,12α-дигидрокси-7-оксо-5β-холановой кислоты формулы XIII с последующим ферментным восстановлением до 3α,7β,12α-тригидрокси-5β-холановой кислоты формулы

и с последующим окислением с получением стереоизомерного гидроксисоединения 3α,7β-дигидрокси-12-оксо-5β-холановой кислоты (12-кето-урсодеоксихолевой кислоты) формулы XII;
либо
с помощью любой комбинации А), В) и/или С),
например, с использованием 3 стереоспецифичных гидроксистероидных дегидрогеназ, 2 из которых обладают противоположной стереоспецифичностью.
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что в качестве субстрата используют С5- или С6-сахар, например, способ используют для изомеризации С5- или С6-сахаров.
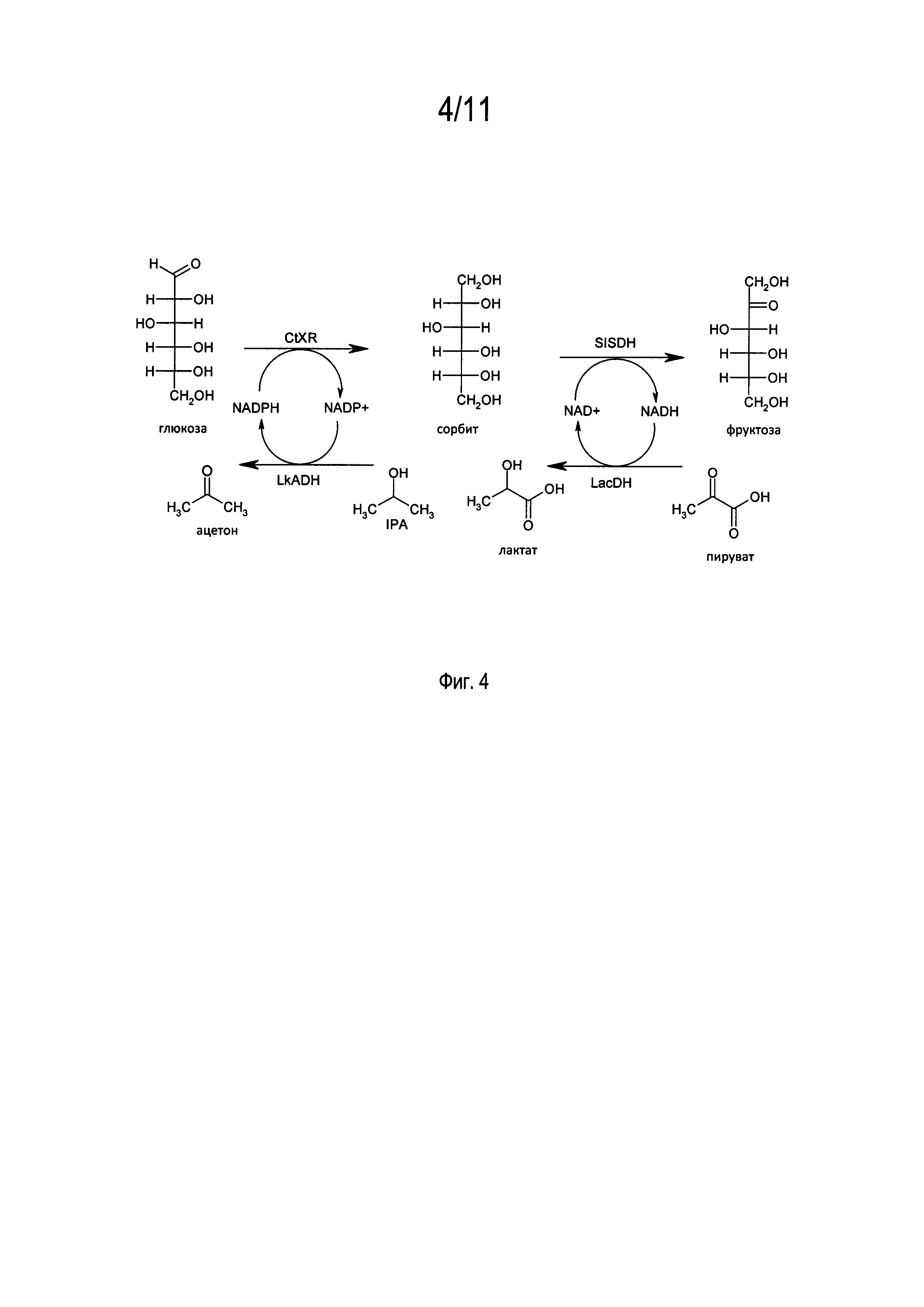
В предпочтительном варианте осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что изомеризацию глюкозы осуществляют путем восстановления до сорбита и окисления до фруктозы, например, способ используют для изомеризации глюкозы путем ее восстановления до сорбита и последующего окисления до фруктозы.
Способ в соответствии с настоящим изобретением предпочтительно осуществляют в водной системе, где субстрат для реакции восстановления и окисления частично присутствует в нерастворенном состоянии в виде суспензии и/или в виде второй жидкой фазы.
В одном из вариантов осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что субстрат (субстраты) для окислительной реакции (реакций), связанных с получением продукта, вводят в реакционную массу в концентрации по меньшей мере 5 мас. % и более, предпочтительно 7 мас. % и более, особенно предпочтительно 9 мас. % и более, в пределах от 5 до 20 мас. %, например, 5-15 мас. %, например, 5-12 мас. %, например, 5-10 мас. %.
В одном из вариантов осуществления изобретения способ в соответствии с настоящим изобретением отличается тем, что в реакциях получения продукта в целом достигается конверсия >70%, в частности, >90%.
В способе в соответствии с настоящим изобретением в водную систему можно добавлять буфер. Пригодными буферами являются, например, фосфат калия, Tris-HCl и глицин с pH от 5 до 10, предпочтительно от 6 до 9. В дополнение или вместо них в систему можно вводить для стабилизации ферментов ионы, например, Mg2+, или другие добавки. В способе в соответствии с настоящим изобретением концентрация введенных кофакторов NAD(P)+ и NAD(P)H обычно составляет от 0.001 мМ до 10 мМ, предпочтительно от 0.01 мМ до 1 мМ.
В зависимости от используемых ферментов способ в соответствии с настоящим изобретением можно осуществлять при температуре от 10°С до 70°С, предпочтительно от 20°С до 45°С.
Гидроксистероидные дегидрогеназы (HSDH) - это ферменты, которые катализируют окисление гидроксигрупп в соответствующие кетогруппы или, наоборот, восстановление кетогрупп до соответствующих гидроксигрупп в стероидном скелете.
Пригодные гидроксистероидные дегидрогеназы, которые могут использоваться для окислительно-восстановительных реакций на гидроксистероидах, - это, например, 3α-HSDH, 3β-HSDH, 7α-HSDH, 7β-HSDH или 17β-HSDH.
Пригодные ферменты с активностью 7α-HSDH можно получить, например, из Clostridia (Clostridium absonum, Clostridium sordelii), Escherichia coli или Bacteroides fragilis.
Пригодные ферменты с активностью 7β-HSDH можно получить, например, из Ruminococcus sp. или Clostridium absonum.
Пригодные лактат-дегидрогеназы можно получить, например, из Oryctolagus cuniculus.
Пригодные спиртовые дегидрогеназы можно получить, например, из Lactobacillus kefir.
Пригодную ксилозо-редуктазу можно получить, например, из Candida tropicalis.
Пригодные сорбит-дегидрогеназы можно получить, например, из печени овец, Bacillus subtilis или Malus domestica.
Пригодные NADH-оксидазы можно получить, например, из Leuconostoc mesenteroides, Streptococcus mutans, Clostridium aminovalericum.
В способе в соответствии с настоящим изобретением ферменты преимущественно используются как белки, имеющие рекомбинантную сверхпродукцию в Е. coli, а лизаты соответствующих клеток преимущественно используются повторно без дальнейшей очистки. Поэтому единица фермента 1 U соответствует количеству фермента, необходимому для реакции с 1 мкмолем субстрата в минуту.
Описание чертежей
На фиг. 1 представлена схема реакции эпимеризации хенодеоксихолевой кислоты в урсодеоксихолевую кислоту через промежуточную 3α-гидрокси-7-оксо-5β-холановую кислоту, причем для регенерации кофактора используют 2-пропанол и пируват.
На фиг. 2 представлена схема реакции эпимеризации хенодеоксихолевой кислоты в урсодеоксихолевую кислоту через промежуточную 3α-гидрокси-7-оксо-5β-холановую кислоту, причем для регенерации кофактора используют малат и пируват.
На фиг. 3 представлена схема реакции эпимеризации хенодеоксихолевой кислоты в урсодеоксихолевую кислоту через промежуточную 3α-гидрокси-7-оксо-5β-холановую кислоту, причем для регенерации кофактора используют 2-пропанол и кислород.
На фиг. 4 представлена схема реакции изомеризации глюкозы в фруктозу, причем для регенерации кофактора используют 2-пропанол и пируват.
На фиг. 5 представлена схема реакции изомеризации глюкозы в фруктозу, причем для регенерации кофактора используют 2-пропанол и кислород.
На фиг. 6 представлена схема реакции эпимеризации холевой кислоты в 3α,7β-дигидрокси-12-оксо-5β-холановую кислоту через промежуточные 3α,7α-дигидрокси-12-оксо-5β-холановую кислоту и 3α-гидрокси-7,12-диоксо-5β-холановую кислоту, причем для регенерации кофактора используют 2-пропанол и пируват.
На фиг. 7 представлена схема реакции эпимеризации холевой кислоты в 3α,7β-дигидрокси-12-оксо-5β-холановую кислоту через промежуточные 3α,7α-дигидрокси-12-оксо-5β-холановую кислоту и 3α-гидрокси-7,12-диоксо-5β-холановую кислоту, причем для регенерации кофактора используют 2-пропанол и кислород.
На фиг. 8 и фиг. 9 представлены схемы реакции эпимеризации холевой кислоты в 3α,7β-дигидрокси-12-оксо-5β-холановую кислоту через промежуточные 3α,7α-дигидрокси-12-оксо-5β-холановую кислоту и 3α-гидрокси-7,12-диоксо-5β-холановую кислоту, причем для регенерации кофактора используют 2-пропанол, пируват и кислород.
На фиг. 10 представлены возможные схемы реакции эпимеризации холевой кислоты в 3α,7β-дигидрокси-12-оксо-5β-холановую кислоту через различные промежуточные соединения и с различными системами регенерации кофакторов. Для регенерации NAD+ используют либо лактат-дегидрогеназу (субстратом служит пируват), либо NADH-оксидазу (субстратом служит кислород). Для регенерации NADPH используют спиртовую дегидрогеназу (субстратом служит изопропанол).
На фиг. 11 представлена схема реакции эпимеризации хенодеоксихолевой кислоты в урсодеоксихолевую кислоту через промежуточную 3α-гидрокси-7-оксо-5β-холановую кислоту (7-кетолитохолевую кислоту = 7K-LCA=KLC), причем для регенерации кофактора используют 2-пропанол и 2-пентанол (то и другое для спиртовой дегидрогеназы), а также пируват (для лактат-дегидрогеназы) и кислород (для NADH-оксидазы).
На чертежах приняты следующие сокращения:
В нижеследующих примерах все данные о температуре приведены в градусах Цельсия (°С). Использованы следующие сокращения:
Пример 1
Эпимеризации хенодеоксихолевой кислоты в урсодеоксихолевую кислоту 7α-гидроксистероидной дегидрогеназой и 7β-гидроксистероидной дегидрогеназой с системой регенерации зависимых от лактат-дегидрогеназы и спиртовой дегидрогеназы кофакторов
Используют 0.5 мл загрузки, включающей 50 мг хенодеоксихолевой кислоты, 12 U рекомбинантной 7α-гидроксистероидной дегидрогеназы из Escherichia coli, 6 U рекомбинантной 7β-гидроксистероидной дегидрогеназы из Ruminococcus torques, а также 0.5 мМ NAD+ и 0.3 мМ NADPH. Для регенерации NAD+ используют 6 U рекомбинантной лактат-дегидрогеназы и 350 мМ пирувата натрия. Для регенерации NADPH используют 6 U рекомбинантной спиртовой дегидрогеназы из Lactobacillus kefir и поначалу 2.4 мас. % IPA. Реакцию проводят в водной среде с буфером - фосфатом калия (100 мМ, рН 7.8) при 25°С и при непрерывном перемешивании (850 об/мин). Система используется все время открытой, чтобы способствовать испарению ацетона и сдвигу реакции в сторону урсодеоксихолевой кислоты. Через 6 часов дополнительно дозируют 1.6 мас. % IPA, через 16 часов - еще 2.4 мас. % IPA, через 24 часа - 3.9 мас. % IPA и через 40 часов - 0.8 мас. % IPA. Кроме того, через 24 часа добавляют 20 мкл 4-метил-2-пентанола. Через 46 часов добавляют 200 мкл 2-пентанола и 1.6 мас. % IPA. Через 48 часов доля урсодеоксихолевой кислоты среди всех желчных кислот в реакционной смеси составляет >97%.
Пример 2
Эпимеризации хенодеоксихолевой кислоты в урсодеоксихолевую кислоту 7α-гидроксистероидной дегидрогеназой и 7β-гидроксистероидной дегидрогеназой с системой регенерации зависимых от лактат-дегидрогеназы и малат-дегидрогеназы кофакторов
Используют 0.5 мл загрузки, включающей 50 мг хенодеоксихолевой кислоты, 20 U рекомбинантной 7α-гидроксистероидной дегидрогеназы из Escherichia coli, 20 U рекомбинантной 7β-гидроксистероидной дегидрогеназы из Ruminococcus torques, а также 1 мМ NAD+ и 1 мМ NADPH. Для регенерации NAD+ используют 10 U лактат-дегидрогеназы (фирмы Sigma-Aldrich), а для запуска реакции - 16.5 мМ пирувата натрия. Для регенерации NADPH используют 20 U рекомбинантной малат-дегидрогеназы из Escherichia coli и 320 мМ малата натрия. Реакцию проводят в водной среде с буфером - фосфатом калия (100 мМ, рН 7.8) при 25°С и при непрерывном перемешивании (850 об/мин). Система используется все время открытой, чтобы способствовать выделению образующегося СО2. Через 16 часов и через 40 часов дополнительно дозируют 20 U 7α-HSDH и 10 U лактат-дегидрогеназы. Через 20, 24, 44 и 48 часов дополнительно дозируют 10 U 7β-HSDH. Наконец, через 40 часов добавляют 10 U малат-дегидрогеназы. Через 72 часа доля урсодеоксихолевой кислоты среди всех желчных кислот в реакционной смеси составляет около 90%.
Пример 3
Эпимеризации хенодеоксихолевой кислоты в урсодеоксихолевую кислоту 7α-гидроксистероидной дегидрогеназой и 7β-гидроксистероидной дегидрогеназой с системой регенерации зависимых от NADH-оксидазы и спиртовой дегидрогеназы кофакторов
Используют 0.5 мл загрузки, включающей 50 мг хенодеоксихолевой кислоты, 12 U рекомбинантной 7α-гидроксистероидной дегидрогеназы из Escherichia coli, 7.5 U рекомбинантной 7β-гидроксистероидной дегидрогеназы из Ruminococcus torques, а также 1 мМ NAD+ и 1 мМ NADPH. Для регенерации NAD+ используют 20 U рекомбинантной NADH-оксидазы из Clostridium aminovalericum. Для регенерации NADPH используют 5 U рекомбинантной спиртовой дегидрогеназы из Lactobacillus kefir и поначалу 2% мас. IPA. Реакцию проводят в водной среде с буфером - фосфатом калия (100 мМ, рН 6) при 25°С и при непрерывном перемешивании (850 об/мин). Система используется все время открытой, чтобы способствовать испарению ацетона и сдвигу реакции в сторону урсодеоксихолевой кислоты. Через 18 часов, 22 часа, 26 часов и 41 час дополнительно дозируют по 2 мас. % IPA, а через 41 час и 48 часов - еще по 5% IPA. Через 24 часа добавляют 20 U NADH-оксидазы, а через 41 час - 7,5 U 7β-гидроксистероидной дегидрогеназы и 5 U спиртовой дегидрогеназы. Через 48 часов доля урсодеоксихолевой кислоты среди всех желчных кислот в реакционной смеси составляет около 95-98%.
Пример 4
Переработка и анализ желчных кислот
По завершении реакций, описанных в примерах 1-3, реакционную смесь экстрагируют EtOAc. Затем растворитель удаляют выпариванием. Выпаренный осадок растворяют в смеси МеОН:ацетонитрил:буферный фосфат натрия с рН 3, 0.78 г/л (40:30:37) и контролируют конверсию хенодеоксихолевой кислоты в урсодеоксихолевую кислоту высокоточной жидкостной хроматографией. Для этого используют сепарационную колонку с обратной фазой (ZORBAX®Eclipse® XDB С18, расход 0.8 мл/мин) и детектор рефракции света (RID) модели Agilent 1260 Infinity®, оба фирмы Agilent Technologies Inc.
Пример 5
Конверсия глюкозы в фруктозу с помощью ксилозо-редуктазы и сорбит-дегидрогеназы при использовании спиртовой дегидрогеназы для регенерации NADPH и лактат-дегидрогеназы для регенерации NAD+
Загрузка 0.5 мл содержит 50 мг/мл глюкозы и 6 U/мл рекомбинантной ксилозо-редуктазы из Candida tropicalis (сверхпродуцированной в E. coli BL21 (DE3)) и 0.1 мМ NADP+. Для регенерации кофактора добавляют 7% IPA и рекомбинантную спиртовую дегидрогеназу из Lactobacillus kefir (сверхпродуцированную в E. coli BL21 (DE3)). Ферменты применяют в виде лизатов клеток. Реакцию проводят в течение 24 часов при 40°С и рН 9 (50 мМ буфера Tris-HCl) в открытой системе с непрерывным перемешиванием (900 об/мин). Открытость системы позволяет удалять ацетон, что способствует сдвигу реакции в сторону образования сорбита. В открытой системе вода и IPA также испаряются, поэтому их дополнительно дозируют через 6 часов и через 21 час. Таким образом, в системе постоянно поддерживается общий объем 0.5 мл и концентрация IPA 7 об. %. Через 24 часа реакционную массу инкубируют в вакууме при 60°С с целью инактивации ферментов и испарения органических растворителей. После охлаждения до комнатной температуры добавляют рекомбинантную сорбит-дегидрогеназу из Bacillus subtilis (сверхпродуцированную в E. coli BL21 (DE3)) в конечной концентрации 5 U/мл, ZnCb в конечной концентрации 1 мМ и NAD+ в конечной концентрации 0.1 мМ. Для регенерации кофактора используют 5 U/мл (конечная концентрация) лактат-дегидрогеназы из мышечной массы кролика (фирмы Sigma Aldrich) и 300 мМ пирувата. Загрузку доливают водой до объема 0.5 мл. Реакцию проводят еще 24 часа при 40°С в закрытой системе с непрерывным перемешиванием (900 об/мин). Достигается конверсия D-глюкозы в D-фруктозу >90%.
Пример 6
Конверсия глюкозы в фруктозу с помощью ксилозо-редуктазы и сорбит-дегидрогеназы при использовании спиртовой дегидрогеназы для регенерации NADPH и NADH-оксидазы для регенерации NAD+
Загрузка 0.5 мл содержит 50 мг/мл глюкозы, 6 U/мл рекомбинантной ксилозо-редуктазы из Candida tropicalis (сверхпродуцированной в E.coli BL21 (DE3)) и 0.1 мМ NADP+. Для регенерации кофактора добавляют 7 об. % IPA и рекомбинантную спиртовую дегидрогеназу из Lactobacillus kefir (сверхпродуцированную в E. coli BL21 (DE3)). Ферменты применяют в виде лизатов клеток. Реакцию проводят в течение 24 часов при 40°С и рН 8 (50 мМ буфера Tris-HCl) в открытой системе с непрерывным перемешиванием (900 об/мин). Открытость системы позволяет удалять ацетон, что способствует сдвигу реакции в сторону образования сорбита. В открытой системе вода и IPA также испаряются, поэтому их дополнительно дозируют через 6 часов и через 21 час. Таким образом, в системе постоянно поддерживается общий объем 0.5 мл и концентрация IPA 7 об. %. Через 24 часа реакционную массу инкубируют в вакууме при 60°С с целью инактивации ферментов и испарения IPA и любых органических растворителей. После охлаждения до комнатной температуры добавляют рекомбинантную D-сорбит-дегидрогеназу из Bacillus subtilis (сверхпродуцированную в E. coli BL21 (DE3)) в конечной концентрации 5 U/мл, CaCl2 в конечной концентрации 1 мМ и смесь NAD+ и NADH в конечной концентрации 0.1 мМ. Для регенерации кофактора используют 10 U/мл (конечная концентрация) NADH-оксидазы из Leuconostoc mesenteroides (сверхпродуцированной в E. coli BL21 (DE3)). Ферменты применяют в виде лизатов клеток. Загрузку доливают водой до объема 0.5 мл. Реакцию проводят 24 часа при 40°С в открытой системе с непрерывным перемешиванием (900 об/мин), чтобы обеспечить достаточное поступление кислорода из воздуха для NADH-оксидазы. В этой открытой системе вода испаряется. Поэтому через 6 часов и через 21 час ее доливают водой до объема 0,5 мл. Достигается конверсия D-глюкозы в D-фруктозу около 98%.
Пример 7
Переработка и анализ сахаров
Загрузку инкубируют при 65°С 10 мин для инактивации ферментов и затем центрифугируют. Супернатант фильтруют сквозь фильтр из ПВДФ 0,2 мкм и анализируют лигандообменной высокоточной жидкостной хроматографией (аппаратура фирмы Agilent Technologies Inc.). При этом сахара и полиолы разделяют через свинцовую колонку фирмы Showa Denko К.К. (Shodex® Sugar SP0810) с расходом 0.5 мл/мин воды (VWR International GmbH, HPLC Grade) при 80°C. Используют детектор рефракции света (RID, Agilent 1260 Infinity®, Agilent Technologies Inc.). Также применяют встроенный фильтр фирмы Agilent Technologies Inc. и предварительные колонки - анионообменную (Shodex® Axpak-WAG), с обратной фазой (Shodex® Asahipak® ODP-50 6Е) и предварительную сахарную колонку (SUGAR SP-G) фирмы Showa Denko К.К.
Пример 8
Биоконверсия холевой кислоты в 3α,7β-дигидрокси-12-оксо-5β-холановую кислоту с помощью 12α-гидроксистероидной дегидрогеназы, 7α-гидроксистероидной дегидрогеназы и 7β-гидроксистероидной дегидрогеназы с системой регенерации зависимых от лактат-дегидрогеназы и спиртовой дегидрогеназы кофакторов
Загрузка 0,5 мл содержит 25 мг холевой кислоты, 12,5 U рекомбинантной 12α-гидроксистероидной дегидрогеназы из Eggertella lenta or Lysinibacillus sphaericus, 16 U рекомбинантной 7α-гидроксистероидной дегидрогеназы из Escherichia coli, 6 U рекомбинантной 7β-гидроксистероидной дегидрогеназы из Ruminococcus torques, а также 1 мМ NAD+ и 1 мМ NADPH. Для регенерации NAD+ используют 12.5 U рекомбинантной лактат-дегидрогеназы из Oryctolagus cuniculus (мышечная изоформа) и 200 мМ пирувата натрия. Для регенерации NADPH используют 5 U рекомбинантной спиртовой дегидрогеназы из Lactobacillus kefir и поначалу 2 мас. % IPA. Реакцию проводят в водной среде с буфером - фосфатом калия (100 мМ, рН 7.8) при 25°С и при непрерывном перемешивании (850 об/мин). Система используется все время открытой, чтобы способствовать испарению ацетона и сдвигу реакции в сторону 3α,7β-дигидрокси-12-оксо-5β-холановой кислоты. Через 18 часов и 24 часа дополнительно дозируют по 2 мас. % IPA. Через 48 часов 61% холевой кислоты прореагировали с образованием 3α,7α-дигидрокси-12-оксо-5β-холановой кислоты.
Пример 9
Биоконверсия холевой кислоты в 3α,7β-дигидрокси-12-оксо-5β-холановую кислоту с помощью 12α-гидроксистероидной дегидрогеназы, 7α-гидроксистероидной дегидрогеназы и 7β-гидроксистероидной дегидрогеназы с системой регенерации зависимых от лактат-дегидрогеназы, NADH-оксидазы и спиртовой дегидрогеназы кофакторов
Загрузка 0,5 мл содержит 25 мг холевой кислоты, 12,5 U рекомбинантной 12α-гидроксистероидной дегидрогеназы из Eggertella lenta or Lysinibacillus sphaericus, 16 U рекомбинантной 7α-гидроксистероидной дегидрогеназы из Escherichia coli, 6 U рекомбинантной 7β-гидроксистероидной дегидрогеназы из Ruminococcus torques, а также 1 мМ NAD+ и 1 мМ NADPH. Для регенерации NAD+ используют 5 U рекомбинантной NADH-оксидазы из Leuconostoc mesenteroides и 12.5 U рекомбинантной лактат-дегидрогеназы из Oryctolagus cuniculus (мышечная изоформа) и 200 мМ пирувата натрия. Для регенерации NADPH используют 5 U рекомбинантной лактат-дегидрогеназы из Oryctolagus cuniculus (мышечная изоформа) и 200 мМ пирувата натрия. Для регенерации NADPH используют 5 U рекомбинантной спиртовой дегидрогеназы из Lactobacillus kefir и первоначально 2 мас. % IPA. Реакцию проводят в водной среде с буфером - фосфатом калия (100 мМ, рН 7.8) и при 25°С и при непрерывном перемешивании (850 об/мин).
Система используется все время открытой, чтобы способствовать испарению ацетона и сдвигу реакции в сторону 3α,7β-дигидрокси-12-оксо-5β-холановой кислоты. Через 18 часов и 24 часа дополнительно дозируют по 2 мас. % IPA. Через 48 часов 70% холевой кислоты прореагировали с образованием 3α,7α-дигидрокси-12-оксо-5β-холановой кислоты.
Пример 10
Эпимеризация хенодеоксихолевой кислоты в урсодеоксихолевую кислоту 7α-гидроксистероидной дегидрогеназой и 7β-гидроксистероидной дегидрогеназой с системой регенерации зависимых от лактат-дегидрогеназы и спиртовой дегидрогеназы кофакторов. Преимущества добавления хлорида марганца (MnCl2)
Используют 0.5 мл загрузки, включающей 50 мг хенодеоксихолевой кислоты, 12 U рекомбинантной 7α-гидроксистероидной дегидрогеназы из Escherichia coli, 6 U рекомбинантной 7β-гидроксистероидной дегидрогеназы из Ruminococcus torques, а также 0.5 мМ NAD+ и 0.3 мМ NADPH. Для регенерации NAD+ используют 6 U рекомбинантной лактат-дегидрогеназы и 350 мМ пирувата натрия. Для регенерации NADPH используют 6 U рекомбинантной спиртовой дегидрогеназы из Lactobacillus kefir и поначалу 2.4 мас. % IPA. Реакцию проводят в водной среде с буфером - фосфатом калия (100 мМ, рН 7.8) и 5 мМ MnCl2 при 25°С и при непрерывном перемешивании (850 об/мин). Система используется все время открытой, чтобы способствовать испарению ацетона и сдвигу реакции в сторону урсодеоксихолевой кислоты. Через 6 часов дополнительно дозируют 1.6 мас. % IPA, через 16 часов - еще 2.4 мас. % IPA и через 24 часа - 3.9 мас. % IPA. Через 36 часов добавляют 200 мкл 2-пентанола и 3 мас. % IPA, а через 48 часов - 100 мкл 2-пентанола и 4 мас. %» IPA. Через 64 часа доля урсодеоксихолевой кислоты среди всех желчных кислот в реакционной смеси составляет >99%. В частности, на хенодеоксихолевую кислоту приходится около 0.3%. В контрольных опытах без добавления MnCl2 доля хенодеоксихолевой кислоты составляет около 2%, а доля урсодеоксихолевой кислоты - около 97.5% (средняя величина по 5 опытам в каждой группе).
Пример 11
Эпимеризация хенодеоксихолевой кислоты в урсодеоксихолевую кислоту 7α-гидроксистероидной дегидрогеназой и 7β-гидроксистероидной дегидрогеназой с системой регенерации зависимых от спиртовой дегидрогеназы кофакторов, а также комбинированной системой регенерации зависимых от лактат-дегидрогеназы и NADH-оксидазы кофакторов
Используют 0.5 мл загрузки, включающей 50 мг хенодеоксихолевой кислоты, 12 U рекомбинантной 7α-гидроксистероидной дегидрогеназы из Escherichia coli, 6 U рекомбинантной 7β-гидроксистероидной дегидрогеназы из Ruminococcus torques, а также 0.5 мМ NAD+ и 0.3 мМ NADPH. Для регенерации NAD+ используют 6 U рекомбинантной лактат-дегидрогеназы и 350 мМ пирувата натрия. Дополнительно для регенерации NAD+ используют 9 U рекомбинантной NADH-оксидазы из Leuconostoc mesenteroides и 6 U рекомбинантной NADH-оксидазы из Clostridium aminovalericum.. Для регенерации NADPH используют 6 U рекомбинантной спиртовой дегидрогеназы из Lactobacillus kefir и первоначально 2.4 мас. % IPA. Реакцию проводят в водной среде с буфером - фосфатом калия (100 мМ, рН 7.8) при 25°С и при непрерывном перемешивании (850 об/мин). Система используется все время открытой, чтобы способствовать испарению ацетона и сдвигу реакции в сторону урсодеоксихолевой кислоты. Через 6 часов дополнительно дозируют 1.6 мас. % IPA, через 16 часов - еще 2.4 мас. % IPA и через 24 часа - 3.9 мас. % IPA. Через 36 часов добавляют 200 мкл 2-пентанола и 3 мас. % IPA, а через 48 часов - 100 мкл 2-пентанола и 4 мас. % IPA. Через 64 часа доля урсодеоксихолевой кислоты среди всех желчных кислот в реакционной смеси составляет >99%. В частности, на хенодеоксихолевую кислоту приходится около 0.2%. В контрольных опытах без добавления NADH-оксидазы доля хенодеоксихолевой кислоты составляет около 2%, а доля урсодеоксихолевой кислоты - около 97.5% (средняя величина по 5 опытам в каждой группе).
Пример 12
Эпимеризации хенодеоксихолевой кислоты в урсодеоксихолевую кислоту 7α-гидроксистероидной дегидрогеназой и 7β-гидроксистероидной дегидрогеназой с системой регенерации зависимых от спиртовой дегидрогеназы кофакторов, а также комбинированной системой регенерации зависимых от лактат-дегидрогеназы и NADH-оксидазы кофакторов. Эффект от добавлении 2-пентанола и 2-пропанола
Используют 50 мл загрузки, включающей 5 г хенодеоксихолевой кислоты, 24 U/мл рекомбинантной 7α-гидроксистероидной дегидрогеназы из Escherichia coli, 12 U/мл рекомбинантной 7β-гидроксистероидной дегидрогеназы из Ruminococcus torques, а также 0.55 мМ NAD+ и 0.3 мМ NADPH. Для регенерации NAD+ используют 12 U/мл рекомбинантной лактат-дегидрогеназы и 350 мМ пирувата натрия. Дополнительно для регенерации NAD+ используют 18 U/мл рекомбинантной NADH-оксидазы из Leuconostoc mesenteroides и 12 U/мл рекомбинантной NADH-оксидазы из Clostridium aminovalericum.. Для регенерации NADPH используют 12 U/мл рекомбинантной спиртовой дегидрогеназы из Lactobacillus kefir и поначалу 1.5 мас. % IPA. Реакцию проводят в водной среде с буфером - фосфатом калия (100 мМ, рН 7.8) и 5 мМ МnСl2 при 25°С. В трехгорлышковой колбе перемешивание осуществляется прецизионной стеклянной мешалкой со скоростью около 100 об/мин. Ацетон, выделяющийся в ходе реакции, отводят потоком воздуха через реакционный сосуд (около 400-600 мл/мин). Поскольку при этом испаряется и 2-пропанол, необходимо его дополнительное дозирование, например, в количестве 0.75 мл (1,5 часа), 0.75 мл (3 часа), 0.5 мл (4 часа), 0.75 мл (6 часов), 0.75 мл (8 часов), 0.5 мл (11 часов), 0.5 мл (14 часов), 0.5 мл (17 часов), 0.5 мл (21 час), 1 мл (23 часа), 2.5 мл (25 часов), 4 мл (29 часов). Через примерно 30 часов добавляют 20 мл 2-пентанола и 2 мл 2-пропанола. Через 46 часов с начала реакции доля 7-кетолитохолевой кислоты составляет около 1% (от суммы хенодеоксихолевой, урсодексихолевой и 7-кетолитохолевой кислот). Далее добавляют 2-пропанол: 3 мл (46 часов), 4 мл (52 часа), 4 мл (54 часа), а также 10 мл 2-пентанола. Через 72 часа реакции содержание 7-кетолитохолевой кислоты может быть сведено до менее 0.2%. Доля урсодеоксихолевой кислоты составляет >99%.
Пример 13
Исследование и анализ желчных кислот
После завершения реакций, описанных в примерах 8-12, можно анализировать желчные кислоты, присутствующие в опытах, по методике, приведенной в примере 4.
Реферат
Изобретение относится к способу ферментной регенерации окислительно-восстановительных кофакторов NAD/NADH и/или, в частности, и NADP/NADPH в совместной реакции, в котором в результате по меньшей мере двух катализируемых ферментами окислительно-восстановительных реакций, протекающих в одной реакционной массе (реакций образования продукта), один из двух окислительно-восстановительных кофакторов накапливается в восстановленной форме, а другой, соответственно, в окисленной форме, a) в реакции регенерации, при которой восстановленный кофактор преобразуется в исходную окисленную форму, восстанавливают кислород или соединение общей формулыгде R- линейная или разветвленная (С-С)-алкильная группа или (С-С)-карбоксиалкильная группа, а b) в реакции регенерации, при которой окисленный кофактор преобразуется в исходную восстановленную форму, окисляют (С-С)-циклоалканол или соединение общей формулыгде Rи Rнезависимо друг от друга выбраны из группы, включающей Н, (C-C) алкил, где алкил является линейным или разветвленным, (C-C) алкенил, где алкенил является линейным или разветвленным и содержит от одной до трех двойных связей, арил, в частности С-Cарил, карбоксил, или (C-С) карбоксиалкил, в частности также циклоалкил, например С-Сциклоалкил, где окислительная реакция (реакции) и восстановительная реакция (реакции) протекают на одной и той же основной молекулярной цепи. Технический результат: создан способ регенерации окислительно-восстановительных кофакторов NAD/NADH и/или, в частности, NADP/NADPH для экономически эффективного осуществления двух или более катализируемых ферментами окислительно-восстановительных реакций в одной реакционной массе. 13 з.п. ф-лы, 11 ил., 13 пр.
Формула










Комментарии