Клетка микроорганизма, плазмидный вектор, способ создания клетки микроорганизма и способ получения l-метионина - RU2280687C2
Код документа: RU2280687C2
Описание
Настоящее изобретение относится к способу получения L-метионина путем ферментации.
Аминокислота метионин играет исключительно важную роль в рационе питания животных. Метионин относится к незаменимым аминокислотам, которые не могут образовываться в процессе метаболизма в организме позвоночных животных. Поэтому в животноводческом секторе необходимо обеспечивать поступление метионина в организм животных в достаточных количествах с потребляемым ими кормом. Поскольку, однако, в традиционных кормовых растениях (таких как соя или злаки), используемых прежде всего в свиноводстве и птицеводстве, метионин обычно содержится в слишком малых для обеспечения оптимального питания животных количествах, его целесообразно примешивать в виде добавки к корму для животных. То важное место, которое метионин занимает в рационе питания животных, обусловлено также тем, что он наряду с L-цистеином (соответственно L-цистином) является источником серы, играющим решающую роль в процессе метаболизма. При этом в результате метаболизма, происходящего в организме животных, метионин может превращаться в цистеин, но не наоборот.
По имеющимся из уровня техники данным ежегодное производство метионина путем его химического синтеза составляет более 100000 тонн. При этом для получения метионина путем химического синтеза сначала акролеин и метилмеркаптан превращают в 3-метилтиопропионовый альдегид, из которого в свою очередь его взаимодействием с цианидом, аммиаком и монооксидом углерода получают гидантоин. Последний в конечном итоге можно гидролизовать до рацемата, представляющего собой эквимолярную смесь обоих стереоизомеров - D-, соответственно L-метионина. Поскольку биологически активной формой молекулы является только L-форма, содержащаяся в корме D-форма должна сначала перейти в процессе метаболизма за счет ее дез- и переаминирования в активную L-форму.
Известны далее методы, позволяющие получать чистый энантиомер L-метионин путем разделения рацематов или с помощью гидантоиназ. Однако эти методы из-за высоких затрат на их осуществление не нашли до настоящего времени широкого применения в комбикормовой промышленности.
Полностью в отличие от метионина большинство других встречающихся в естественных условиях протеиногенных аминокислот получают в настоящее время преимущественно путем ферментации с использованием микроорганизмов. При этом используется способность микроорганизмов к синтезу встречающихся в естественных условиях аминокислот, основанная на соответствующих механизмах биосинтеза. Помимо этого многие методы ферментации благодаря использованию для их проведения дешевых эдуктов, таких как глюкоза и минеральные соли, позволяют достичь исключительно низкой себестоимости получаемого при их осуществления продукта и обеспечивают, кроме того, получение соответствующей аминокислоты в ее биологически активной L-форме.
Однако процессы биосинтеза аминокислот у штаммов дикого типа находятся под строгим метаболическим контролем, который обеспечивает продуцирование аминокислот только в таких количествах, которые необходимы для удовлетворения собственных потребностей клетки в таких аминокислотах. Поэтому для эффективного получения аминокислот в промышленном масштабе важно располагать соответствующими микроорганизмами, которые в отличие от микроорганизмов дикого типа способны в результате их жизнедеятельности продуцировать требуемую аминокислоту в существенно больших количествах.
Подобные микроорганизмы, способные к сверхпродуцированию аминокислот, можно создавать классическими методами мутации/отбора и/или современными методами целенаправленной рекомбинации ("метаболическое конструирование"). В последнем случае сначала идентифицируют гены или аллели, которые в результате их изменения, активации или инактивации вызывают сверхпродуцирование аминокислот. Затем такие гены/аллели вводят методами молекулярной биологии в штамм микроорганизма или инактивируют таким образом, чтобы обеспечить оптимальное сверхпродуцирование аминокислот. Однако действительно эффективного продуцирования микроорганизмами аминокислот часто удается достичь лишь за счет использования нескольких различных мер в их сочетании.
Биосинтез L-метионина в микроорганизмах является исключительно сложным процессом. Аминокислотный каркас молекулы образуется исходя из L-аспартата, который через образование промежуточного аспарагинового полуальдегида/аспартилфосфата превращается в L-гомосерин. В этой молекуле затем гидроксильная группа в три стадии ферментации (через получение промежуточных O-сукцинилгомосерина и цистатионина) заменяется на тиольную группу, которая мобилизуется из молекулы цистеина, в результате чего образуется гомоцистеин. В завершение на последней стадии биосинтеза в результате метилирования тиольной группы образуется L-метионин. Источником метильной группы при этом служит метаболизируемый серии.
Таким образом, с формальной точки зрения метионин в ходе происходящего в микроорганизме метаболизма в свою очередь синтезируется из таких аминокислот, как аспартат, серин и цистеин, и тем самым процесс его биосинтеза по сравнению с другими аминокислотами отличается высокой сложностью. При этом необходимо оптимальное согласование условий не только основного пути синтеза (аспартат-гомосерин-гомоцистеин), но и биосинтеза цистеина, а тем самым и сложной фиксации неорганической серы, а также С1-метаболизма.
По указанным выше причинам до настоящего времени не велось интенсивных работ по разработке способов ферментативного получения L-метионина. Однако с учетом значительного прогресса, которого в последние годы удалось достичь в оптимизации метаболизма серина и цистеина, более реалистичной представляется возможность получения L-метионина и ферментативным путем. Первые работы в этом направлении кратко представлены ниже в описании уровня техники.
Для ферментативного получения L-метионина из уровня техники известны следующие гены/аллели, применение которых может приводить к сверхпродуцированию L-метионина:
- metA-аллели, которые описаны в заявке на изобретение от 11.10.2002, авторами которого являются авторы настоящего изобретения, или в заявке JP 2000-139471 А: эти metA-аллели кодируют O-гомосеринтранссукцинилазы с пониженным ингибированием обратной связи L-метионином, благодаря чему образование O-сукцинилгомосерина оказывается практически не связанным с уровнем метионина в клетке;
- metJ-делеция, описанная в заявке JP 2000-139471 А: ген metJ кодирует регуляторную последовательность центрального гена метаболизма метионина и тем самым играет решающую роль в контроле экспрессии гена биосинтеза метионина.
Из уровня техники следует далее, что известные меры, которые позволяют повысить эффективность синтеза L-серина и L-цистеина, оказывают положительное влияние и на продуцирование L-метионина.
В основу настоящего изобретения была положена задача создать штамм микроорганизма, который обладал бы способностью сверхпродуцировать L-метионин. Еще одна задача изобретения состояла в разработке способа получения L-метионина с использованием такого штамма микроорганизма.
Первая из указанных выше задач решается с помощью штамма микроорганизма, создаваемого из исходного штамма и отличающегося тем, что он обладает повышенной по сравнению с исходным штаммом активностью продукта гена yjeH или генного продукта гомолога гена yjeH.
Согласно настоящему изобретению повышение активности продукта гена yjeH имеет место и в том случае, когда в результате увеличения количества генного продукта в клетке повышается общая его активность в клетке и тем самым несмотря на практически неизменную удельную активность генного продукта активность продукта гена yjeH из расчета на одну клетку возрастает.
Ген yjeH бактерии Escherichia coli, который был идентифицирован при секвенировании генома (Blattner и др., Science 277, 1997, c.1453-1462) в виде открытой рамки считывания, кодирует протеин, состоящий из 418 аминокислот. До настоящего времени с геном yjeH не удавалось соотнести какой-либо физиологической функции. Поиск протеинов с гомологией последовательностей в банке данных (с использованием алгоритма FASTA из пакета программ GCG Wisconsin Package, разработанного фирмой Genetics Computer Group (GCG), Мэдисон, шт. Висконсин) также не дал практически никаких результатов, поскольку было выявлено сходство лишь с теми протеинами, функции которых также неизвестны.
Ген yjeH и продукт гена yjeH (протеин YjeH) характеризуются последовательностями SEQ ID No.1, соответственно SEQ ID No.2. В контексте настоящего изобретения под гомологами гена yjeH подразумеваются те гены, идентичность последовательностей которых по данным анализа с использованием алгоритма BESTFIT (пакет программ GCG Wisconsin Package фирмы Genetics Computer Group (GCG), Мэдисон, шт. Висконсин) составляет более 30%, предпочтительно более 53%. Наиболее предпочтительны при этом гены, последовательность которых идентична гену yjeH более чем на 70%.
Равным образом под протеинами, которые являются гомологами генного продукта YjeH, подразумеваются протеины, идентичность последовательностей которых (по данным анализа с использованием алгоритма BESTFIT (пакет программ GCG Wisconsin Package фирмы Genetics Computer Group (GCG), Мэдисон, шт. Висконсин) составляет более 30%, предпочтительно более 53%. Наиболее предпочтительны при этом протеины, последовательность которых идентична генному продукту YjeH более чем на 70%.
В соответствии с этим к гомологам гена yjeH относятся также аллельные варианты гена yjeH и прежде всего те его функционально активные варианты, которые можно получить из представленной в SEQ ID No.1 последовательности путем делеции, инсерции или замены нуклеотидов, при этом, однако, соответствующий генный продукт должен сохранять ферментативную активность.
Предлагаемые в изобретении микроорганизмы, которые обладают повышенной по сравнению с исходным штаммом активностью продукта гена yjeH, можно получать стандартными методами молекулярной биологии.
В качестве исходного штамма в принципе можно использовать все те микроорганизмы, которые способны к биосинтезу L-метионина и которые допускают возможность применения к ним методов рекомбинации и их культивирования путем ферментации. Такими микроорганизмами могут служить грибы, дрожжи или бактерии. Предпочтительны при этом бактерии, относящиеся к филогенетической группе Eubacteria. Наиболее предпочтительны микроорганизмы из семейства Enterobacteriaceae и прежде всего вида Escherichia coli.
Повышение активности продукта гена yjeH в предлагаемом в изобретении микроорганизме достигается, например, за счет усиления экспрессии гена yjeH. При этом можно увеличивать количество копий гена yjeH в микроорганизме и/или повышать экспрессию гена yjeH с помощью соответствующих промоторов. Под усиленной экспрессией при этом преимущественно подразумевается экспрессия гена yjeH, которая по меньшей мере в два раза превышает экспрессию, характерную для исходного штамма.
Увеличивать количество копий гена yjeH в микроорганизме можно с помощью известных специалисту методов. Так, например, ген yjeH можно клонировать в плазмидных векторах, способных многократно увеличивать количество копий на одну клетку (например, в плазмидах pUC19, pBR322, pACYC184 для Escherichia coli), и затем встраивать в микроорганизм. В другом варианте ген yjeH можно многократно интегрировать в хромосому микроорганизма. Для такой интеграции можно использовать известные системы с симбиотическими (умеренными) бактериофагами или интеграционные плазмиды либо осуществлять интеграцию путем гомологичной рекомбинации (см., например, Hamilton и др., J. Bacteriol., 171, 1989, c.4617-4622).
Увеличивать количество копий гена yjeH предпочтительно путем его клонирования в плазмидных векторах под контролем промотора. Наиболее предпочтительно при этом увеличивать количество копий гена yjeH в Escherichia coli путем его клонирования в плазмиде, являющейся производной плазмиды pACYC, такой, например, как плазмида pACYC184-LH (которая в соответствии с Будапештским договором была депонирована 18.08.1995 г. в Немецкой коллекции микроорганизмов и клеточных культур (DSMZ), Брауншвейг, под регистрационным номером DSM 10172).
В качестве контролирующей области для экспрессии кодируемого плазмидой гена yjeH могут служить встречающиеся в естественных условиях промоторная и операторная области гена.
Однако усиленной экспрессии гена yjeH можно достичь прежде всего и с помощью других промоторов. Соответствующие промоторные системы, которыми, например, для Escherichia coli являются конститутивный GAPDH-промотор гена gapA или индуцибельный lac-, tac-, trc-, lambda-, ara- либо tet-промотор, хорошо известны в данной области (Makrides S.C., Microbiol. Rev. 60, 1996, c.512-538). Такие конструкции можно согласно известным методам использовать в составе плазмид или встраивать в хромосому.
Помимо этого усиленной экспрессии можно достичь при наличии в соответствующей конструкции расположенных в оптимальной последовательности сигналов инициации трансляции, таких, например, как сайт связывания рибосомы или инициирующий кодон гена, либо в результате замены редко встречающихся кодонов на основе данных о "наиболее часто встречающихся кодонах" на более часто встречающиеся кодоны.
Штаммы микроорганизмов, имеющие указанные модификации, являются предпочтительными объектами изобретения.
Клонировать ген yjeH в плазмидных векторах можно, например, путем специфической амплификации с помощью полимеразной цепной реакции с использованием специфических праймеров, действие которых распространяется на весь ген yjeH, и последующего лигирования с фрагментами векторной ДНК.
Предпочтительными векторами, используемыми для клонирования гена yjeH, являются плазмиды, которые уже содержат промоторы, обеспечивающие усиленную экспрессию, например, содержат конститутивный GAPDH-промотор гена gapA Escherichia coli.
В соответствии с этим изобретение относится также к плазмиде, которая отличается тем, что она содержит ген yjeH совместно с промотором.
Кроме того, особо предпочтительны векторы, которые уже содержат ген/аллель, использование которого приводит к уменьшению ингибирования обратной связи пути метаболизма L-метионина, например, содержат мутантный metA-аллель (описанный в заявке DE-A-10247437). Подобные векторы позволяют создавать предлагаемые в изобретении штаммы микроорганизмов, обладающие высокой способностью к сверхпродуцированию аминокислот непосредственно из любого штамма микроорганизма, поскольку такая плазмида уменьшает ингибирование обратной связи пути метаболизма метионина в микроорганизме.
В соответствии с этим изобретение относится также к плазмиде, которая отличается тем, что она содержит генетический элемент, обусловливающий нарушение регуляции пути метаболизма метионина, а также ген yjeH совместно с промотором.
Содержащие ген yjeH плазмиды можно встраивать в микроорганизмы традиционными методами трансформации (например путем электоропорации) и осуществлять отбор несущих плазмиду клонов, например, по признаку устойчивости к антибиотикам.
В соответствии с этим изобретение относится также к способу создания предлагаемых в нем штаммов микроорганизмов, который отличается тем, что в исходный штамм встраивают предлагаемую в изобретении плазмиду.
Наиболее предпочтительными штаммами для трансформации с использованием предлагаемых в изобретении плазмид являются штаммы, которые уже содержат в хромосоме аллели, которые также способствуют продуцированию L-метионина, например
- имеющие делецию гена metJ (согласно JP 2000-139471 А),
- аллели, которые приводят к увеличению продуцирования серина, такие как устойчивые к действию обратной связи варианты гена serA (которые описаны, например, в ЕР 0620853 В1 или ЕР 0931833 А2), или
- гены, приводящие к увеличению продуцирования цистеина, такие как устойчивые к действию обратной связи варианты гена cysE (которые описаны, например, в WO 97/15673).
L-метионин получают с использованием предлагаемого в изобретении штамма микроорганизма в ферментере согласно хорошо известным методам.
В соответствии с этим изобретение относится также к способу получения L-метионина, который отличается тем, что для ферментации используют предлагаемый в изобретении штамм микроорганизма и образовавшийся L-метионин выделяют из сбраживаемой среды.
Выращивать штамм микроорганизма в ферментере можно путем непрерывного культивирования, периодического культивирования или предпочтительно периодического культивирования с подпиткой. В процессе ферментации наиболее предпочтительно добавлять источник углерода.
В качестве источника углерода предпочтительно добавлять сахара, сахароспирты или органические кислоты. При осуществлении предлагаемого в изобретении способа в качестве источника углерода наиболее предпочтительно использовать глюкозу, лактозу или глицерин.
Источник углерода предпочтительно добавлять в такой форме, чтобы его содержание в ферментере в процессе ферментации составляло от 0,1 до 50 г/л. Наиболее предпочтительное содержание источника углерода в ферментере составляет от 0,5 до 10 г/л.
В качестве источника азота при осуществлении предлагаемого в изобретении способа предпочтительно использовать аммиак, аммониевые соли или протеиновые гидролизаты. При использовании аммиака в качестве корректирующего средства для стабилизации значения рН такой источник азота следует регулярно добавлять в процессе ферментации.
В качестве других добавок к сбраживаемой среде можно использовать соли таких элементов, как фосфор, хлор, натрий, магний, азот, калий, кальций и железо, а также в следовых количествах (т.е. в микромолярных концентрациях) соли таких элементов, как молибден, бор, кобальт, марганец, цинк и никель.
Помимо этого к сбраживаемеой среде можно добавлять органические кислоты (например, в виде ацетата, цитрата), аминокислоты (например, лейцин) и витамины (например, b1, B12).
В качестве комплексных источников питательных веществ можно использовать, например, дрожжевой экстракт, жидкость, образующуюся после замачивания зерен кукурузы до набухания, соевую муку или солодовый экстракт.
Температура инкубации для мезофильных микроорганизмов составляет предпочтительно от 15 до 45°С, наиболее предпочтительно от 30 до 37°С.
Процесс ферментации предпочтительно проводить в аэробных условиях роста микроорганизмов. Вводить кислород в сбраживаемую среду, содержащуюся в ферментере, можно подачей в него сжатого воздуха или чистого кислорода.
Значение рН сбраживаемой среды в процессе ферментации составляет предпочтительно от 5,0 до 8,5, наиболее предпочтительно 7,0.
Для получения L-метионина в процессе ферментации можно добавлять источник серы. В этом случае предпочтительно использовать сульфаты или тиосульфаты.
Микроорганизмы, с использованием которых проводят ферментацию в соответствии с описанным выше способом, в периодическом процессе или в периодическом процессе с подпиткой после фазы роста в течение 10-150 ч выделяют L-метионин в культуральную среду.
Образовавшийся L-метионин можно выделять из сбраживаемой среды с помощью стандартных методов выделения аминокислот (например, ионообменной хроматографией, кристаллизацией и т.д.).
Ниже изобретение более подробно рассмотрено на примерах. В соответствии с Будапештским договором в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung für Mikroorganismen und Zeilkulturen GmbH (DSMZ), D-38142, Брауншвейг) в качестве штамма бактерии, содержащего предлагаемую в изобретении плазмиду, несущую ген yjeH, который пригоден для предлагаемого в изобретении получения L-метионина, был депонирован штамм W3110Δ J/pKP450 под регистрационным номером DSM 15421.
Пример 1: Клонирование основного вектора рКР228
С целью поместить ген yjeH под контроль конститутивного промотора сначала конструировали основной вектор, несущий конститутивный GAPDH-промотор гена gapA, кодирующего глицеринальдегид-3-дегидрогеназу Escherichia coli. Для этого проводили полимеразную цепную реакцию с использованием следующих праймеров:
GAPDHfw (SEQ. ID. NO:3):

Mlu I GAPDHrevl (SEQ. ID. NO:4):

Рас I Bgl II
и хромосомной ДНК штамма Е.coli W3110 (АТСС 27325). Образовавшийся фрагмент ДНК очищали с помощью электрофореза на агарозном геле и после этого выделяли (набор для гель-экстракции Qiaquick Gel Extraction Kit фирмы Qiagen, Гильден, Германия). Затем этот фрагмент обрабатывали рестриктазами PacI и MluI и клонировали в также расщепленном с помощью PacI/MluI векторе pACYC184-LH (который в соответствии с Будапештским договором депонирован в Немецкой коллекции микроорганизмов и клеточных культур, Брауншвейг, 18.08.1995 г. под регистрационным номером DSM 10172). Новую конструкцию обозначили как рКР228.
Пример 2: Клонирование гена yjeH
Ген yjeH из штамма Escherichia coli W3110 амплифицировали с помощью полимеразной цепной реакции. При этом в качестве специфических праймеров использовали следующие олигонуклеотиды:
yjeH-fw (SEQ. ID. NO:5):
5'-АТТ GCT GGT TTG CTG CTT-3' и
yjeH-rev (SEQ. ID. NO:6):
5'-AGC АСА AAA TCG GGT GAA-3',
а также хромосомную ДНК штамма Е.coli W3110 (АТСС 27325) в качестве матрицы. Образовавшийся фрагмент ДНК очищали с помощью электрофореза на агарозном геле и выделяли (набор для гель-экстракции Qiaquick Gel Extraction Kit фирмы Qiagen, Гильден, Германия). Клонирование осуществляли путем лигирования дефосфорилированного конца с расщепленным с помощью BglII вектором рКР228, 5', выступающие концы которого были обработаны фрагментом Кленова. Подобный подход позволяет поместить ген yjeH за GAPDH-промотором таким образом, чтобы транскрипция могла инициироваться из этого положения. Полученный вектор обозначили как рКР450.
Пример 3: Комбинация гена yieH с устойчивым к действию обратной связи metA-аллелем
Путем полимеразной цепной реакции амплифицировали metA-аллель, который описан в заявке DE-A-10247437 от 11.10.2002 г. и который кодирует устойчивую к действию обратной связи O-гомосеринтранссукцинилазу, с использованием при этом вектора рКР446 в качестве матрицы (который также описан в DE-A-10247437) и следующих праймеров:
metA-fw (SEQ. ID. NO:7):
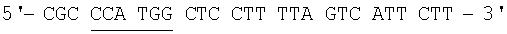
NcoI
metA-rev (SEQ. ID. NO:8):

SacI.
При этом образовывались концевые сайты рестрикции, распознаваемые рестриктазами NcoI и SacI. Полученный фрагмент ДНК расщепляли этими рестриктазами, очищали и клонировали в расщепленном с помощью NcoI/SacI векторе рКР450. Полученную плазмиду обозначили как рКР451.
Для создания контрольной плазмиды, которая содержит metA-аллель, но у которой отсутствует ген yjeH, осуществляли делецию гена yjeH из плазмиды рКР451. Для этого плазмиду рКР451 расщепляли с помощью Ec113 611 и PacI, выступающие концы обрабатывали фрагментом Кленова и повторно лигировали с получением вектора. Полученную таким образом плазмиду обозначили как рКР446АС.
Пример 4: Хромосомная metJ-мутация
Гены metJ/B амплифицировали с помощью полимеразной цепной реакции с использованием следующих праймеров:
metJ-fw(SEQ.ID.NO:9):
5'-GAT CGC GGC CGC TGC AAC GCG GCA TCA TTA AAT TCG A-3' и
metJ-rev (SEQ. ID. NO:10);
5'-GAT CGC GGC CGC AGT TTC AAC CAG TTA АТС AAC TGG-3'
и хромосомной ДНК из штамма Escherichia coli W3110 (АТСС 27325). Полученный фрагмент, содержащий 3,73 т.п.н., очищали, расщепляли рестриктазой NotI и клонировали в расщепленном с помощью NotI векторе pACYC184-LH (см. пример 1). После этого в ген metJ во внутренний сайт рестрикции, распознаваемый рестриктазой AflIII, встраивали кассету, обусловливающую устойчивость к канамицину. Для этого сначала осуществляли расщепление с помощью AflIII и путем обработки фрагментом Кленова получали затупленные концы. Кассету, придающую устойчивость к канамицину, в свою очередь получали путем расщепления вектора pUK4K (фирма Amersham Pharmacia Biotech, Фрейбург, Германия) рестриктазой PvuII и встраивали путем лигирования в ген metJ. Из созданного таким образом вектора рКР440 путем его расщепления с помощью NotI получали кассету metJ::kan в виде линеаризованного фрагмента и согласно методу Winans и др. (J. Bacteriol., 161, 1985, c.1219-1221) интегрировали в хромосому штамма recBC/sbcB JC7623 (регистрационный номер в Центре хранения генетического материала Е. coli CGSC5188). На завершающей стадии осуществляли мутацию metJ::kan путем Р1-трансдукции (Miller, Cold Spring Harbour Laboratory, New York, 1972, c. 201-205) в штамм дикого типа W3110 (АТСС 27325), в результате чего получили штамм W3110ΔJ.
После проверки правильности встраивания metJ::kan штамм W3110ΔJ трансформировали несущими ген yjeH плазмидами, соответственно контрольными плазмидами и отбирали соответствующие трансформанты с использованием тетрациклина.
Пример 5: Получение предварительной культуры штамма-продуцента для ферментации
Для получения предварительной культуры для ферментации в 20 мл среды LB (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl), которая дополнительно содержала 15 мг/л тетрациклина, вносили штаммы-продуценты и инкубировали в шюттель-аппарате при 30°С и 150 об/мин. Через 7 ч всю смесь переносили в 100 мл среды SM1 (12 г/л К2HPO4, 3 г/л КН2PO4, 5 г/л (NH4)2SO4, 0,3 г/л MgSO4 ×7H2O, 0,015 г/л CaCl2×2H2O, 0,002 г/л FeSO4×7H2O, 1 г/л Na3-цитрата ×2Н2O, 0,1 г/л NaCl, 1 мл/л раствора микроэлементов, содержащего 0,15 г/л Na2MoO4× 2H2O, 2,5 г/л Na3BO3, 0,7 г/л CoCl2 ×6H2O, 0,25 г/л CuSO4×5H2O, 1,6 г/л MnCl2×4H2 O, 0,3 г/л ZnSO4×7H2O), дополненной 5 г/л глюкозы, 0,5 мг/л витамина B1 и 15 мг/л тетрациклина. Дальнейшую инкубацию проводили в течение 17 ч при 30°С и 150 об/мин.
Пример 6: Ферментативное получение L-метионина
В качестве ферментера использовали аппарат Biostat В фирмы Braun Biotech (Мельзунген, Германия) с максимальной вместимостью для культуральной среды 2 л. В ферментер, содержащий 900 мл среды SM1, дополненной 15 г/л глюкозы, 10 г/л триптона, 5 г/л дрожжевого экстракта, 3 г/л Na2S2O3×5H2O, 0,5 мг/л витамина B1, 30 мг/л витамина В12 и 15 мг/л тетрациклина, вносили описанную в примере 5 предварительную культуру (оптическая плотность которой при 600 нм составляла приблизительно 3). В процессе ферментации температуру устанавливали на 32°С, а значение рН поддерживали на постоянном уровне 7,0 путем добавления 25%-ного раствора аммиака. Культуру барботировали обеззараженным сжатым воздухом с расходом 5 ед. объема на ед. объема среды в минуту и перемешивали мешалкой, вращавшейся с частотой 400 об/мин. После снижения степени насыщения среды кислородом на 50% частоту вращения мешалки повышали с помощью регулятора до 1500 об/мин для поддержания степени насыщения среды кислородом на этом 50%-ном уровне (степень насыщения кислородом определяли с помощью pO2-зонда, откалиброванного на 100%-ное насыщение при 900 об/мин). После снижения концентрации глюкозы в ферментере с первоначальных 15 г/л до приблизительно 5-10 г/л добавляли 56%-ный раствор глюкозы. При этом глюкозу добавляли с расходом 6-12 мл/ч, поддерживая ее концентрацию в ферментере на постоянном уровне в пределах от 0,5 до 10 г/л. Концентрацию глюкозы определяли с помощью анализатора глюкозы фирмы YSI (Йеллоуспрингс, шт. Огайо, США). Продолжительность ферментации составляла 48 ч. По истечении этого времени брали пробы культуральной среды и клетки отделяли от нее центрифугированием. Образовавшуюся в результате надосадочную жидкость культуры анализировали с помощью ЖХВР с обращенной фазой на колонке типа LUNA 5 μ С 18(2) (фирма Phenomenex, Ашаффенбург, Германия) при скорости потока 0,5 мл/мин. В качестве элюента использовали разбавленную фосфорную кислоту (0,1 мл концентрированной фосфорной кислоты на 1 л). В таблице 1 представлены данные о достигнутом содержании L-метионина в надосадочной жидкости культуры.





Реферат
Изобретение относится к биотехнологии. L-метионин получают культивированием штамма микроорганизма, трансформированного плазмидой, включающей ген yjeH или гомологичный ему более чем на 30% ген, - продуцент L-метионина. Полученный L-метионин выделяют из среды. Заявленное изобретение позволяет получить L-метионин с высокой степенью эффективности. 4 н. и 7 з.п. ф-лы, 1 табл.

Комментарии