Средства и способы получения амидных соединений с меньшим количеством акриловой кислоты - RU2730624C2
Код документа: RU2730624C2
Чертежи






Описание
Настоящее изобретение относится к способам получения амидного соединения из нитрильного соединения с применением микроорганизма, продуцирующего нитрилгидратазу (NHase) и амидазу, в качестве биокатализатора, где микроорганизм предварительно обработан посредством стадии высушивания перед введением в контакт с указанным нитрильным соединением, а также к применению такого микроорганизма для получения амидного соединения из нитрильного соединения. Кроме того, изобретение относится к способу уменьшения образования побочных продуктов акриловой кислоты при получении амидного соединения из нитрильного соединения с помощью микроорганизма, продуцирующего нитрилгидратазу и амидазу, а также к применению способа высушивания для увеличения NHase/амидазы или уменьшения активности амидазы такого микроорганизма. Также обеспечивается водное соединение амида, полученное способами по изобретению, а также композиция, содержащая акриламид или полиакриламид, а также высушенный микроорганизм, имеющий соотношение активности NHase/амидаз, по меньшей мере, равное 400 при введении в контакт с нитрильным соединением для превращения указанного нитрильного соединения в амидное соединение.
Акриламид используется в качестве мономера для образования полимеров и сополимеров акриламида. Для этих реакций полимеризации и сополимеризации можно использовать водные растворы акриламида, полученные биоконверсией. Однако было обнаружено, что высокое содержание акриловой кислоты в растворах акриламида приводит к снижению эффективности получаемых полимеров и сополимеров акриламида. Более конкретно, присутствие акриловой кислоты может значительно ухудшить физические свойства акриламидного полимерного и сополимерного материала, что приводит к уменьшению растворимости и рабочих характеристик в различных применениях, таких как обработка воды, производство бумаги, извлечение нефти или горная промышленность.
С момента открытия нитрилгидратазы (NHase). микробного фермента, который гидролизует нитрилы до амидов, микроорганизмы, обладающие активностью NHase, интенсивно используются для промышленного получения амидных соединений. Из-за более мягких условий реакции по сравнению с химическим синтезом амидов все больше возрастает применение микроорганизмов, продуцирующих NHase, в качестве биокатализаторов.
Фактически, одним из наиболее известных коммерческих примеров биоконверсии нитрила с помощью микроорганизмов, продуцирующих NHase, является производство акриламида из акрилонитрила.
Однако сложной проблемой при использовании микроорганизмов, продуцирующих NHase в качестве биокатализаторов, является возникновение побочной реакции, опосредованной ферментом амидазой. Хотя NHase гидролизует нитрильное соединение до соответствующего амидного соединения, амидаза дополнительно превращает амидное соединение в соответствующую карбоновую кислоту, в частности, в акриловую кислоту.
Техническая проблема, лежащая в основе настоящего изобретения, заключается в решении проблем, возникающих в связи с образованием акриловых кислот в качестве побочных продуктов при получении амидных соединений из нитрильных соединений с применением микроорганизмов, продуцирующих NHase и амидазу в качестве биокатализаторов.
Техническая проблема решается путем обеспечения вариантов выполнения, отраженных в формуле изобретения, описанных в описании и проиллюстрированных в примерах и чертежах, которые следуют ниже.
К немалому удивлению авторы настоящего изобретения обнаружили, что получение карбоновой кислоты, в частности, образование акриловой кислоты в качестве побочного продукта при биоконверсии нитрильного соединения в амидное соединение, значительно снижается, если микроорганизм, который продуцирует нитрилгидратазу (NHase) и амидазу, и который служит в качестве биокатализатора, для биоконверсии, предварительно подвергают стадии высушивания перед введением в контакт с нитрильным соединением. Без привязки к какой-либо теории, очевидно, что вследствие введения стадии высушивания, которой такой микроорганизм подвергается, активность амидазы может быть уменьшена, таким образом уменьшая образование акриловой кислоты из амида, который образуется благодаря активности NHase. Другими словами, у такого высушенного микроорганизма, по-видимому, отношение между активностью NHase и амидазной активностью такое, что преобладает активность NHase, то есть соотношение активности NHase к активности амидазы >1,0, такое как, по меньшей мере >10, >50, >100, 200, 300 или >400.
Фактически, как показано в прилагаемых примерах, очевидно, что микроорганизм, который предварительно проходил стадию высушивания перед введением в контакт с нитрильным соединением, которое затем подвергается биологической конверсии указанным микроорганизмом, имеет наибольшее значение NHase/амидазная активность. Учитывая тот факт, что исходное сырье содержало почти равные количества биокатализаторов (что было отражено посредством величины «активность NHase в исходном сырье», см. Таблицы 1 и 2), очевидно, что стадия высушивания, то есть воздействие на биокатализатор посредством стадии высушивания перед приведением его в контакт с нитрильным соединением, существенно влияет на количество побочной акриловой кислоты. Это означает, что на стадии высушивания активность амидазы снижается до такой степени, что такие высушенные микроорганизмы продуцируют амидное соединение с меньшей долей акриловой кислотой в качестве побочного продукта, что видно из самой правой колонки. В целом, поскольку параметры реакции поддерживаются одинаковыми для различных загрузок, очевидно, что улучшение в уменьшении количества акриловой кислоты может быть приписано стадии высушивания.
Соответственно, настоящее изобретение относится к способу получения амидного соединения из нитрильного соединения, включающему контактирование нитрильного соединения с микроорганизмом, продуцирующим нитрилгидратазу (NHase) и амидазу. причем указанный микроорганизм предварительно обрабатывают посредством стадии высушивания перед контактом с указанным нитрильным соединением.
Настоящее изобретение также обеспечивает способ получения амидного соединения из нитрильного соединения, включающий стадии (а) высушивания микроорганизма, продуцирующего NHase и амидазу; и (b) контактирования нитрильного соединения с указанным микроорганизмом.
Кроме того, в соответствии с неожиданным обнаружением авторов настоящего изобретения в настоящем документе обеспечивается способ снижения образования акриловой кислоты при получении амидного соединения из нитрильного соединения, включающий контактирование акрилонитрила с микроорганизмом, продуцирующим NHase и амидазу, причем используются указанные микроорганизмы, как определено в настоящем документе.
Также обеспечивается способ получения микроорганизма с повышенным соотношением активности NHase/амидазы, включающий высушивание микроорганизма, продуцирующего NHase и амидазу.
Аналогично, в настоящем документе обеспечивается способ получения микроорганизма с пониженной активностью амидазы, включающий сушку микроорганизма, продуцирующего NHase и амидазу.
Кроме того, настоящее изобретение обеспечивает применение микроорганизма, продуцирующего NHase и амидазу, как определено в настоящем документе для получения амидного соединения из нитрильного соединения.
Подобным образом, настоящее изобретение обеспечивает применение способа высушивания для увеличения соотношения активности NHase/амидазы микроорганизма, продуцирующего NHase и амидазу. или. альтернативно или дополнительно, обеспечивает применение способа высушивания для снижения амидазной активности NHase и амидазы, продуцирующих микроорганизм.
Поскольку раствор амида, в соответствии с результатами авторов настоящего изобретения, содержит меньше акриловой кислоты в качестве побочного продукта превращения нитрильного соединения в амидное соединение, настоящее изобретение обеспечивает водный раствор амидного соединения, полученного способами в соответствии с настоящим изобретением.
Дополнительно в соответствии с находками авторов настоящего изобретения обеспечивается композиция, содержащая акриламид или полиакриламид и микроорганизм, продуцирующий NHase и амидазу, причем указанный микроорганизм предпочтительно демонстрирует соотношение активности NHase/амидазы по меньшей мере, равное 400.
Далее настоящее изобретение будет подробно описано со ссылкой на несколько примерных вариантов выполнения. Будут предложены многочисленные конкретные детали, чтобы обеспечить полное понимание вариантов выполнения настоящего изобретения. При дальнейшем определении и уточнении отдельных отличительных признаков способов, композиций или применений в соответствии с настоящим изобретением такие определения и спецификации применимы ко всему: к способам изобретения, композициям в соответствии с изобретением и применениям изобретения, как описано и представлено в настоящем документе.
Кроме того, для специалиста в данной области техники очевидно, что варианты выполнения могут быть осуществлены на практике без некоторых или всех конкретных деталей, изложенных ниже. В других случаях хорошо известные стадии процесса подробно не описаны для того, чтобы не затемнять чрезмерно настоящее изобретение.
Как оказалось в соответствии с находками настоящего изобретения, микроорганизм, продуцирующий NHase и амидазу, способен превращать нитрильное соединение в амидное соединение, но. в отличие от других таких микроорганизмов, продуцирующих NHase и амидазу, производит меньше карбоновой кислоты, в частности акриловую кислоту, когда указанный микроорганизм предварительно обрабатывают посредством стадии высушивания до того, как он будет приведен в контакт с нитрильным соединением, которое должно подвергаться биоконверсии в амидное соединение. Это свойство такого высушенного микроорганизма является преимуществом, поскольку именно акриловая кислота вызывает проблемы в последующей реакции полимеризации из амида в полиакриламид. Таким образом, выдающимся достижением авторов настоящего изобретения является обеспечение биокатализатора в форме микроорганизма, который обладает низкой активностью амидазы, в то время как его активность по NHase практически не изменяется, так что микроорганизм продуцирует амидное соединение с низким количеством/концентрацией карбоновой кислоты, в частности акриловой кислоты. Следует отметить, что авторы настоящего изобретения достигли этого достижения без генетического конструирования микроорганизма, продуцирующего NHase и амидазу, или воздействия на такой микроорганизм мутагенными агентами или без чрезмерного скрининга для нахождения (случайного) такого встречающегося в природе микроорганизма, но путем тщательного исследования, которое показало, что подвергание микроорганизма, продуцирующего NHase и амидазу, посредством стадии высушивания перед контактированием указанного микроорганизма с нитрильным соединением в ходе его биоконверсии в амидное соединение.
Соответственно, настоящее изобретение обеспечивает способ получения амидного соединения из нитрильного соединения, включающий контактирование нитрильного соединения с микроорганизмом, продуцирующим нитрилгидратазу (NHase) и амидазу, причем указанный микроорганизм предварительно подвергают обработке посредством высушивания на стадии перед контактированием с нитрильным соединением.
Кроме того, настоящее изобретение обеспечивает способ получения амидного соединения из нитрильного соединения, включающий стадии: (а) сушку микроорганизма, продуцирующего NHase и амидазу; и (b) контактирование нитрильного соединения с указанным микроорганизмом.
Кроме того, настоящее изобретение относится к высушенным микроорганизмам, которые способны продуцировать NHase и амидазу, причем отношение между активностью NHase и амидазы равно >1,0, например, по меньшей мере, >10, >50, >100, >200, >300 или >400, Указанные высушенные микроорганизмы способны продуцировать амидное соединение с гораздо меньшим количеством акриловой кислотой в качестве побочного продукта по сравнению с тем же микроорганизмом, который не был высушен перед контактом с нитрильным соединением, которое должно подвергаться (био-)конверсии в амидное соединение.
Термин «предварительно обработанный посредством стадии высушивания перед контактированием» означает, что микроорганизм обрабатывают с помощью средств и/или способов для высушивания указанного микроорганизма до его применения в любом из способов и применений настоящего изобретения. В частности, микроорганизм высушивают до того, как он контактирует с нитрильным соединением, которое должно подвергаться (био-) конверсии указанным микроорганизмом. Соответственно, предпочтительный микроорганизм по настоящему изобретению высушивают (подвергают стадии высушивания) до того, как он контактирует (или приводится в контакт) с нитрильным соединением, которое должно подвергаться (био-)конверсии указанным высушенным микроорганизмом в амидное соединение. Предпочтительно, стадия высушивания приводит к микроорганизму, имеющему остаточное содержание воды не более 30, 25, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 или 5 массовых процентов (% мас.) от общей массы микроорганизма. Таким образом, «общая масса микроорганизма» не обязательно ограничивается массой микроорганизма как такового (хотя это, конечно, возможно, например, когда микроорганизмы были промыты водой до стадии высушивания), но могут дополнительно включать ингредиенты, присутствие которых может быть приписано культивированию микроорганизмов и/или стадиям промывки и т.д. Из этого следует, что «общая масса микроорганизма» может дополнительно включать (помимо микроорганизма) остаточное количество буферных компонентов/солей для хранения, таких как буферы на основе TRJS, солевые буферы и т.д. и/или остаточные количества культуральной среды. питательной среды. питательных растворов, ферментационных бульонов, например ферментационного бульона, который был использован для культивирования микроорганизмов и т.д.. стабилизаторов, добавок (например, сухих добавок) и т.д.
Термин «микроорганизм(ы)» при использовании в настоящем документе охватывает «микроорганизм, производящий нитрилгидратазу и амидазу» или, альтернативно, «микроорганизм(ы), продуцирующий NHase и амидазу». Микроорганизм в контексте настоящего изобретения предпочтительно является бактерией, грибком или дрожжами. Микроорганизм по настоящему изобретению предпочтительно предварительно обрабатывают посредством стадии высушивания перед введением в контакт с нитрильным соединением, которое подвергается биоконверсии указанным микроорганизмом в амидное соединение. Микроорганизм по настоящему изобретению предпочтительно не иммобилизуют перед высушиванием. «Иммобилизованный», как используется в настоящем документе, относится к любому методу иммобилизации, известному специалисту в данной области техники, включая, без ограничения, связывание или адсорбцию микроорганизма на матрице носителя, захват или капсулирование микроорганизма в матрице носителя.
В настоящем изобретении «микроорганизмы, продуцирующие NHase и амидазу» используются или могут использоваться в качестве биокатализатора для превращения нитрильного соединения в соответствующее амидное соединение. Как упоминалось, такие микроорганизмы предпочтительно предварительно обрабатывают с помощью стадии высушивания перед введением в контакт с нитрильным соединением, которое подвергается биоконверсии в амидное соединение. В результате такие микроорганизмы способны продуцировать амидное соединение с гораздо меньшим количеством акриловой кислоты в качестве побочного продукта по сравнению с тем же самым микроорганизмом, который был не высушен перед контактом с нитрильным соединением, которое должно быть превращено в амидное соединение.
«Нитрильное соединение» превращается микроорганизмом по настоящему изобретению в амидное соединение под действием NHase. Нитрильное соединение представляет собой любое органическое соединение, которое имеет функциональную группу -C=N. Предпочтительным нитрильным соединением является акрилонитрил. В способах, описанных в настоящем документе, также предполагается использовать метакрилонитрил. ацетонитрил или 3-цианопиридин.
«Амидное соединение» превращается при помощи амидазы в амидное соединение. Амидное соединение имеет функциональную группу RnC(O)xNR'2, в котором R и R' могут быть Н или органическими группами. Для органических амидов n=1, х=1. Примером амидного соединения является акриламид. Другими примерами амидных соединений, которые предусматриваются в соответствие способами по настоящему изобретению, являются метакриламид, ацетамид или никотинамид.
В настоящем изобретении «микроорганизм, продуцирующий NHase и амидазу», может представлять собой любой микроорганизм, который способен продуцировать ферменты NHase и амидазу. В этом отношении для настоящего изобретения не имеет значения, будет ли этот микроорганизм естественным образом кодировать NHase и амидазу или же он был генетически модифицирован для кодирования указанных ферментов. Кроме того, биокатализатор может представлять собой микроорганизм, который, естественно кодирует NHase и амидазу и который, кроме того, генетически модифицирован, например, для увеличения продукции NHase или для увеличения стабильности и/или экспорта NHase или для уменьшения продукции амидазы или для повышения стабильности и/или экспорта амидазы.
В контексте настоящего изобретения «микроорганизмы, продуцирующие NHase и амидазу», которые не кодируют в природе NHase, могут представлять собой генетически модифицированные микроорганизмы, которые в природе не содержат ген, кодирующий NHase, но которые модифицировали таким образом, что они стали содержать полинуклеотид, кодирующий NHase (например, посредством трансформации, трансдукции. трансфекции. конъюгации или других способов, подходящих для переноса или вставки полинуклеотида в клетку, как известно в данной области техники, смотрите Sambrook and Russeii 2001. Motecutar Cloning: A Laboratory Manuat, CSH Press, Cold Spring Harbor. NY. USA), что позволяет микроорганизмам вырабатывать и стабильно поддерживать фермент NHase. Для этой цели может также потребоваться введение дополнительных полинуклеотидов, которые могут быть необходимы для обеспечения транскрипции и трансляции гена NHase или мРНК, соответственно. Такие дополнительные полинуклеотиды могут содержать, среди прочего, промоторные последовательности или точки начала репликации или другие последовательности, контролирующие плазмиды. В этом контексте такие генетически модифицированные микроорганизмы, которые, в природе не содержат ген, кодирующий NHase, но которых модифицировали таким образом, что они стали содержать полинуклеотид, кодирующий NHase, могут быть прокариотическими или эукариотическими микроорганизмами. Примерами таких прокариотических микроорганизмов являются, например, представители вида Escherichia coli. Примеры таких эукариотических микроорганизмов включают, например, дрожжи (например, Saccharomyces cerevisiae).
Аналогичным образом, «микроорганизмы, продуцирующие NHase и амидазу», которые не кодируют в природе амидазу, могут представлять собой генетически модифицированные микроорганизмы, которые в природе не содержат ген, кодирующий амидазу, но которых модифицировали таким образом, что они стали содержать полинуклеотид, кодирующий амидазу (например, с помощью трансформации, трансдукции, трансфекции, конъюгации или других способов, подходящих для переноса или вставки полинуклеотида в клетку, как известно в данной области техники, смотрите Sambrook and Russell 2001, Molecular Cloning: A Laboratory Manual, CSH Press, Cold Spring Harbor, NY, USA), что позволяет микроорганизмам вырабатывать и стабильно поддерживать фермент амидазу. Для этой цели может также потребоваться введение дополнительных полинуклеотидов, которые могут быть необходимы для обеспечения транскрипции и трансляции гена амидазы или мРНК, соответственно. Такие дополнительные полинуклеотиды могут содержать, среди прочего, промоторные последовательности или точки начала репликации или другие последовательности, контролирующие плазмиды. В этом контексте такие генетически модифицированные микроорганизмы, которые в природе не содержат ген. кодирующий амидазу. но которые были модифицированы таким образом, что стали содержать полинуклеотид. кодирующий амидазу, могут быть прокариотическими или эукариотическими микроорганизмами. Примерами таких прокариотических микроорганизмов являются, например, представители вида Escherichia coli. Примеры таких эукариотических микроорганизмов включают, например, дрожжи (например, Saccharomyces cerevisiae).
«Микроорганизмы, продуцирующие NHase и амидазу», которые (естественно или неестественно) кодируют NHase, как правило, также способны продуцировать и стабильно поддерживать NHase. Однако в соответствии с настоящим изобретением также возможно, что такие микроорганизмы продуцируют NHase только во время культивирования (или ферментации) микроорганизмов - поэтому содержащие NHase, будучи высушенными и/или приведенными контакт с нитрильным соединением. В этом случае, возможно, что микроорганизмы не продуцируют NHase в описанных и обеспечиваемых в настоящем документе способах, но они действуют только через молекулы NHase, которые они продуцировали до высушивания и которые они все еще содержат после высушивания. Как легко понятно специалисту в данной области техники, также возможно, что некоторые молекулы NHase могут покидать микроорганизм (например, вследствие лизиса микроорганизма) и свободно действовать в растворе в качестве биокатализатора.
Аналогичным образом, «микроорганизмы, продуцирующие NHase и амидазу», которые (естественным или неестественным образом) кодируют амидазу, как правило, также способны продуцировать и стабильно поддерживать амидазу. Однако в соответствии с настоящим изобретением также возможно, что такие микроорганизмы продуцируют только амидазу во время культивирования (или ферментации) микроорганизмов - поэтому содержащие амидазу - будучи высушенными и/или приведенными контакт с нитрильным соединением. В этом случае, возможно, что микроорганизмы не продуцируют NHase в описанных и обеспечиваемых в настоящем документе способах, но они действуют только через молекулы NHase. которые они продуцировали до высушивания и которые они все еще содержат после высушивания.
В контексте настоящего изобретения, «микроорганизмы, продуцирующие NHase и амидазу». в природе кодирующие NHase и амидазу, включают в себя, в частности, бактерии рода Rhodococcus, Aspergillus, Acidovorax, Agrobacterium, Bacillus, Bradyrhizobium, Brevibacterium, Burkholderia, Escherichia, Geobacillus, Klebsiella, Mesorhizobium, Moraxella, Pantoea, Pseudomonas, Rhizobium, Rhodopseudomonas, Serratia, Amycolatopsis, Arthrobacter, Brevibacterium, Corynebacterium, Microbacterium, Micrococcus, Nocardia, Pseudonocardia, Trichoderma, Myrothecium, Aureobasidium, Candida, Cryptococcus, Debaryomyces, Geotrichum, Hanseniaspora, Kluyveromyces, Pichia, Rhodotorula, Comomonas, и Pyrococcus. В предпочтительных вариантах выполнения изобретения микроорганизм выбирается из бактерий рода Rhodococcus, Pseudomonas, Escherichia и Geobacillus.
В частности, «микроорганизм, продуцирующий NHase и амидазу» включает в себя, среди прочего, следующие виды Rhodococcus rhodochrous, Rhodococcus pyridinovorans, Rhodococcus erythropolis, Rhodococcus equi, Rhodococcus ruber, Rhodococcus opacus, Aspergillus niger, Acidovorax avenae, Acidovorax facilis, Agrobacterium tumefaciens, Agrobacterium radiobacter, Bacillus subtilis, Bacillus pallidus, Bacillus smithii, Bacillus sp.BR449, Bradyrhizobium oligotrophicum, Bradyrhizobium diazoeffciens, Bradyrhizobium japonicum, Burkholderia cenocepacia, Burkholderia gladioli, Escherichia coli, Geobacillus sp. RAPc8, Klebsiella oxytoca, Klebsiella pneumonia, Klebsiella variicola, Mesorhizobium ciceri, Mesorhizobium opportunistum, Mesorhizobium sp. F28, Moraxella, Pantoea endophytica, Pantoea agglomerans, Pseudomonas chlororaphis, Pseudomonas putida, Rhizobium, Rhodopseudomonas palustris, Serratia liquefaciens, Serratia marcescens, Amycolatopsis, Arthrobacter, Brevibacterium sp. CH1, Brevibacterium sp. CH2, Brevibacterium sp. R312, Brevibacterium imperiale, Corynebacterium nitrilophilus, Corynebacterium pseudodiphteriticum, Corynebacterium glutamicum, Corynebacterium hoffmanii, Microbacterium imperiale, Microbacterium smegmatis, Micrococcus luteus, Nocardia gioberuta. Nocardia rhodochrous, Pseudonocardia thermophila. Trichoderma, Myrothecium verrucaria, Aureobasidium pullulans, Candida famata, Candida guilliermondii, Candida tropicalis. Cryptococcus flavus. Cryptococcus sp. UFMG- Y28, Debaryomyces hanseii, Geotrichum candidum. Geotrichum sp. JR1. Hanseniaspora. Kluyveromyces thermotolerans, Pichia kluyveri, Rhodotorula glutinis. Comomonas testosteroni, Pyrococcus abyssi. Pyrococcus furiosus, Pyrococcus horikoshii. Brevibacterium casei или Nocardia sp. 163.
В предпочтительных вариантах выполнения изобретения «микроорганизм, продуцирующий NHase и амидазу», представляет собой бактерию вида Rhodococcus rhodochrous или Rhodococcus pyridinovorans. Предпочтительными представителями этих видов являются Rhodococcus rhodochrous (NCIMB 41164), Rhodococcus rhodochrous (FERM BP-1478), Rhodococcus rhodochrous M8 и Rhodococcus rhodochrous M33.
В контексте настоящего изобретения «нитрилгидратаза» («NHase») относится к микробному ферменту, который катализирует гидратацию нитрилов до их соответствующих амидов (IUBMB Enzyme Nomenclature ЕС 4.2.1.84). Однако термины «нитрилгидратаза» и «NHase», как они используются в настоящем документе, также включают модифицированные или улучшенные ферменты, которые, например, способны быстрее превращать нитрильное соединение (например, акрилонитрил) в амидное соединение (например, акриламид) или которое может быть получено с более высоким соотношением выход/время, или которые являются более стабильными, до тех пор, пока они способны катализировать превращение (т.е. гидратацию) нитрильного соединения (например, акрилонитрила) в амидное соединение (например, акриламид).
Способы определения способности данного биокатализатора (например, «микроорганизма, продуцирующих NHase и амидазу») превращать акрилонитрил в акриламид хорошо известны в данной области техники. В качестве примера, в контексте настоящего изобретения, активность данного биокатализатора, который может быть способен превращать акрилонитрил в акриламид в соответствие со смыслом настоящего изобретения, может быть определена следующим образом:
сначала проводят реакцию 100 мкл клеточной суспензии, клеточного лизата. растворенного ферментного порошка или любого другого препарата, содержащего предполагаемую нитрилгидратазу. с 875 мкл 50 мМ калий-фосфатного буфера и 25 мкл акрилонитрила при 25°С на шейкере Эппендорфа при 1000 об/мин в течение 10 минут. Через 10 минут времени реакции образцы могут быть отобраны и реакция в них немедленно остановлена путем добавления равного объема 1,4%-ной соляной кислоты. После перемешивания образца, клетки можно удалять посредством центрифугирования в течение 1 минуты при 10000 об/мин, и количество образованного акриламида определяли анализом прозрачного супернатанта с помощью ВЭЖХ. Для подтверждения того, что фермент является нитрилгидратазой в контексте настоящего изобретения, концентрация акриламида должна быть в пределах от 0,25 до 1,25 ммоль/л - если необходимо, образец должен быть разбавлен соответствующим образом, и конверсия должна быть повторена. Активность фермента затем может быть рассчитана из концентрации акриламида путем деления концентрации акриламида, полученного при анализе ВЭЖХ, на время реакции, которое составляет 10 минут, и путем умножения этого значения на коэффициент разбавления между образцом ВЭЖХ и исходным образцом. Активность>5 Ед/мг массы сухих клеток, предпочтительно >25 Ед/мг массы сухих клеток, более предпочтительно >50 Ед/мг массы сухих клеток, наиболее предпочтительно >100 Ед/мг массы сухих клеток, указывает на присутствие функционально экспрессированной нитрилгидратазы и рассматривается в качестве нитрилгидратазы в контексте настоящего изобретения.
В контексте настоящего изобретения нитрилгидратаза может быть полипептидом, кодируемым полинуклеотидом, который содержит или состоит из нуклеотидной последовательности, которая составляет по меньшей мере 70%, предпочтительно по меньшей мере 75%, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95%, более предпочтительно по меньшей мере 96%, более предпочтительно по меньшей мере 97%, более предпочтительно по меньшей мере 98%, более предпочтительно по меньшей мере 99%, более предпочтительно по меньшей мере 99,5% и наиболее предпочтительно 100% идентичности нуклеотидной последовательности SEQ ID N0:1 (альфа-субъединица нитрилгидратазы R. rhodochrous:

и/или нуклеотидной последовательности SEQ ID NO: 3 (бета-субъединица нитрилгидратазы R. rhodochrous:







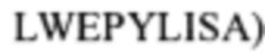
Степень идентичности между двумя или более последовательностями (например, последовательностями нуклеиновой кислоты или аминокислотными последовательностями) может быть легко определена с помощью методов, известных в данной области техники, например, с помощью анализа BLAST. В общем случае в контексте настоящего изобретения, если две последовательности (например, полинуклеотидные последовательности или аминокислотные последовательности), которые должны сравниваться, например, при сравнении последовательностей, отличаются по идентичности, тогда термин «идентичность» может относиться к более короткой последовательности, а та часть более длинной последовательности. соответствует указанной более короткой последовательности. Поэтому. когда сравниваемые последовательности различаются по длине, степень идентичности может предпочтительно либо относиться к проценту нуклеотидных остатков в более короткой последовательности, которая идентична остаткам нуклеотидов в более длинной последовательности, либо к процентному содержанию нуклеотидов в более длинной последовательности, которая идентична нуклеотидной последовательности в более короткой последовательности. В этом контексте специалист в данной области техники легко может определить ту часть более длинной последовательности, которая соответствует более короткой последовательности. Кроме того, как используется в настоящем документе, уровни идентичности последовательностей нуклеиновых кислот или аминокислотных последовательностей могут относиться ко всей длине соответствующей последовательности и, предпочтительно, оцениваться в паре, при этом каждый гэп должен учитываться как одно несоответствие. Эти определения для сравнений последовательностей (например, установления значений «идентичности») должны применяться для всех описанных и раскрытых в настоящем документе последовательностей.
Кроме того, используемый в настоящем документе термин «идентичность» означает, что существует функциональная и/или структурная эквивалентность между соответствующими последовательностями. Последовательности нуклеиновой кислоты/ аминокислотные последовательности, имеющие заданные уровни идентичности с описанными в настоящем документе конкретными последовательностями нуклеиновой кислоты/аминокислотными
последовательностями, могут представлять производные/варианты этих последовательностей, которые, предпочтительно имеют одну и ту же биологическую функцию. Они могут быть либо природными вариациями, например, последовательностями из других вариететов, видов и т.д., либо мутациями, и указанные мутации могут образоваться естественным путем или могут быть продуцированы преднамеренным мутагенезом. Кроме того, вариации могут быть синтетически полученными последовательностями. Варианты могут быть встречающимися в природе вариантами или синтетически полученными вариантами или вариантами, полученными методами рекомбинантной ДНК. Отклонения от вышеописанных последовательностей нуклеиновой кислоты могут быть получены, например, путем делеции, замены, присоединения, инсерции и/или рекомбинации. Термин «присоединение» относится к присоединению по меньшей мере одного остатка нуклеиновой кислоты/аминокислоты к концу данной последовательности, тогда как «инсерция» относится к вставке по меньшей мере одного остатка нуклеиновой кислоты/аминокислоты в пределах данной последовательности. Термин «делеция» относится к делетированию или удалению по меньшей мере, одного остатка нуклеиновой кислоты или аминокислотного остатка в данной последовательности. Термин «замена» относится к замене, по меньшей мере, одного остатка нуклеиновой кислоты/аминокислотного остатка в данной последовательности. Опять-таки, эти определения, используемые в настоящем документе, применяются, с необходимыми изменениями, для всех последовательностей, предусмотренных и описанных в настоящем документе.
Как правило, в контексте настоящего описания термины «полинуклеотид» и «нуклеиновая кислота» или «молекула нуклеиновой кислоты» должны толковаться как синонимы. Как правило, молекулы нуклеиновых кислот могут содержать, среди прочего, молекулы ДНК, молекулы РНК, олигонуклеотидные тиофосфаты, замещенные рибо-олигонуклеотиды или молекулы ПНК. Кроме того, термин «молекула нуклеиновой кислоты» может относиться к ДНК или РНК или их гибридам или любой их модификации, которая известна в данной области техники (см., например, US 5525711, US 4711955, US 5792608 или ЕР 302175 в качестве примеров модификаций). Эта полинуклеотидная последовательность может быть одно- или двухцепочечной, линейной или кольцевой, природной или синтетической и без каких-либо ограничений по размеру. Например, полинуклеотидная последовательность может представлять собой геномную ДНК, кДНК, митохондриальную ДНК, мРНК, антисмысловую РНК, рибозимную РНК или ДНК, кодирующую такие РНК или химеропласты (Gamper, Nucleic Acids Research, 2000, 28, 4332-4339). Указанная полинуклеотидная последовательность может быть в форме вектора, плазмиды или вирусной ДНК или РНК. Также в настоящем документе описаны молекулы нуклеиновых кислот, которые являются комплементарными молекулам нуклеиновых кислот, описанных выше, и молекулам нуклеиновых кислот, которые способны гибридизоваться с молекулами нуклеиновых кислот, описанными в настоящем документе. Молекула нуклеиновой кислоты, описанная в настоящем документе, также может быть фрагментом молекул нуклеиновой кислоты в контексте настоящего изобретения. В частности, такой фрагмент является функциональным фрагментом. Примерами таких функциональных фрагментов являются молекулы нуклеиновых кислот, которые могут служить в качестве праймеров.
«Амидаза» относится к микробному ферменту, который катализирует гидролиз амидов до их соответствующих карбоновых кислот (IUBMB Enzyme Nomenclature ЕС 3.5.1.4. «Амидаза»). Амидаза предпочтительно относится в настоящем документе к амидазе, которая соэкспрессируется с NHase и, которая превращает амид, продуцируемый NHase, далее в соответствующую карбоновую кислоту. Используемый в настоящем документе термин «амидаза» также включает модифицированные или поврежденный ферменты, если такие ферменты по-прежнему обладают амидазной активностью.
Не ограничиваясь какой-либо теорией, полагаем, что высушивание биокатализатора (то есть микроорганизма) снижает активность амидазы, поэтому считается, что активность NHase снижается в меньшей степени или остается неизменной. Фактически, авторы настоящего изобретения отметили, что активность NHase была выше, чем активность амидазы, когда микроорганизм, продуцирующий NHase и амидазу, предварительно подвергался предварительной обработке посредством стадии высушивания перед введением в контакт с нитрильным соединением, которое должно подвергаться биоконверсии (нитрильное соединение в амидное соединение) посредством указанного микроорганизма.
Как упоминалось выше, авторы настоящего изобретения отметили, что микроорганизм, предварительно обработанный посредством стадии высушивания перед контактированием с нитрильным соединением, которое должно быть превращено указанным микроорганизмом в амидное соединение, указанный микроорганизм способен продуцировать амидное соединение с меньшим количеством акриловой кислоты по сравнению с тем же самым микроорганизмом, который не подвергался предварительной обработке посредством стадии высушивания перед введением в контакт с указанным нитрильным соединением.
Соответственно, микроорганизм по настоящему изобретению предпочтительно имеет соотношение активности NHase/амидазы, составляющее по меньшей мере 400 единиц. Активность NHase предпочтительно определяют, как описано выше.
Также в соответствии с результатами настоящего изобретения стадию контактирования, упомянутую в способах по настоящему изобретению, проводят с высушенным микроорганизмом. Согласно варианту выполнения стадия контактирования, упомянутая в способах по настоящему изобретению, проводится с восстановленным микроорганизмом. Восстановленный микроорганизм представляет собой высушенный микроорганизм, который суспендирован, т.е. присутствует в суспензии или растворен в водном растворе, таком как вода или буферный раствор, имеющий физиологический рН, или в водной композиции. Последняя может содержать один или несколько дополнительных ингредиентов, таких как глюкоза. Восстановление относится в настоящем документе к добавлению водной композиции к высушенному микроорганизму до того, как микроорганизм контактирует с нитрильным соединением. Соответственно, в любом из способов, описанных в настоящем документе, стадию контактирования можно проводить с высушенным микроорганизмом, который суспендирован в водной композиции. Такие водные композиции включают, без ограничения воду (например, деионизированную воду) и буфер (например, фосфатный буфер).
Учитывая вышеизложенное, предпочтительно, чтобы стадия контактирования, упомянутая в способах по настоящему изобретению, проводилась с микроорганизмом, который находится в форме порошка, гранулы и/или суспензии. Также возможно использовать связанный с матрицей микроорганизм для проведения стадии контактирования.
Как объяснялось выше, соотношение активности NHase к активности амидазы микроорганизма по настоящему изобретению, которое также применяется в способах и применениях, описанных в настоящем документе, увеличивается по сравнению с эталонным микроорганизмом.
Фактически, как показано в прилагаемых примерах, очевидно, что микроорганизм, который предварительно обрабатывался посредством стадии высушивания перед введением в контакт с нитрильным соединением, которое затем подвергается биологической конверсии указанным микроорганизмом, имеет самое низкое значение содержания акриловой кислоты по сравнению с микроорганизмами, которые предварительно не обрабатывают посредством стадии высушивания. Это открытие означает, что активность амидазы высушенного микроорганизма, по-видимому, снижается или ослабляется, поскольку невысушенные микроорганизмы производят больше акриловой кислоты в качестве побочного продукта, в результате чего акриловая кислота является результатом превращения амидного соединения в акриловую кислоту. В результате активность NHase - если сравнивать с (уменьшенной) активностью амидазы - повышается. Действительно, в результате стадии высушивания активность амидазы снижается до такой степени, что такие высушенные микроорганизмы продуцируют амидное соединение с меньшим количеством акриловой кислоты в качестве побочного продукта, что видно из самой правой колонки в таблице 1 и 2. В целом, так как параметры реакции, применяемые в Примерах 1 и 2, поддерживаются одинаковыми для разных загрузок, очевидно, что улучшение в уменьшении количества акриловой кислоты может быть приписано стадии высушивания.
В качестве «эталонного микроорганизма», упоминаемого в настоящем документе, можно использовать невысушенный биокатализатор (то есть микроорганизм). Соответственно, эталонным микроорганизмом является такой микроорганизм, который не подвергался предварительной обработке посредством стадии высушивания перед введением в контакт с нитрильным соединением, которое должно быть превращено в амидное соединение микроорганизмом по настоящему изобретению, которое предварительно обрабатывается посредством стадии высушивания перед тем, контактирует с указанным нитрильным соединением. Подходящим «эталонным микроорганизмом» является, например, не высушенный микроорганизм того же штамма, что и микроорганизм, используемый в качестве биокатализатора в способе (способах) по изобретению. Кроме того, «эталонный микроорганизм» может соответствовать биокатализатору (то есть микроорганизму), используемому в способе изобретения перед высушиванием. В этом случае можно определить активность NHase/амидазы микроорганизма, используемого в качестве биокатализатора до и после стадии высушивания а) способ, и сравнение обеих активностей NHase/амидаза, чтобы определить, увеличивает ли высушивание активность NHase/амидазы микроорганизма. Кроме того, Rhodococcus rhodochrous (NCIMB 41164) может быть использован в качестве «эталонного микроорганизма». Чтобы определить, будет ли процесс высушивания, выполняемый на стадии а) увеличивать соотношение активности NHase/амидазы используемого микроорганизма, можно дополнительно или альтернативно подвергнуть Rhodococcus rhodochrous (NCIMB 41164) процессу высушивания, осуществляемому на стадии а). В случае, когда соотношение активности NHase/амидазы Rhodococcus rhodochrous (NCIMB 41164) увеличивается благодаря высушиванию, проводимом на стадии а), следует предположить, что соотношение активности NHase/амидазы микроорганизма, используемого в качестве биокатализатора в способе по изобретению уменьшается подобным образом благодаря высушиванию, проводимой на стадии а).
В рамках настоящего изобретения микроорганизм предпочтительно не культивируется между высушиванием микроорганизма и контактированием высушенного микроорганизма с нитрильным соединением. «Культивируется», как это используется в настоящем документе, означает, что микроорганизм суспендируется в культуральной среде и выдерживают в условиях, позволяющих рост микроорганизма.
Между высушиванием микроорганизма и контактированием высушенного микроорганизма с нитрильным соединением микроорганизм предпочтительно выдерживают в условиях, которые ингибируют восстановление микроорганизмом своего соотношения активности NHase/амидазы перед высушиванием.
Увеличение соотношения активности NHase к активности амидазы ((активность NHase (в единицах))/(активность амидазы (в единицах)) предпочтительно происходит в по меньшей мере 1,4 раз или более, например, в 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4 или 2,5 раз или даже больше.
Аналогично, уменьшение соотношения активности амидазы к активности NHase ((активность амидазы (в единицах))/(активность NHase (в единицах)) предпочтительно происходит в по меньшей мере 0,7 раз или менее, например, в 0,6, 0,5, 0,4, 0,3, 0,2 или 0,1 раз или даже меньше. В соответствии с открытиями настоящего изобретения предложен способ получения амидного соединения из нитрильного соединения, включающий стадии: (а) высушивания микроорганизма, продуцирующего NHase и амидазу; и (b) контактирование нитрильного соединения с указанным микроорганизмом.
Предполагается без привязки к какой-либо теории, что стадия (а), увеличивает соотношение активности NHase к активности амидазы ((активность NHase (в единицах))/(активность амидазы (в единицах))).
Активность NHase измеряется и определяется в соответствии с общими знаниями специалиста в данной области техники, например, как описано выше.
Аналогично, активность амидазы измеряется и определяется в соответствии с общими знаниями специалиста в данной области техники, т.е. активность амидазы может быть оценена при комнатной температуре путем измерения содержания аммиака, выделяющегося при разложении акриламида при 630 нм.
Соответственно, как описано в настоящем документе, высушивание микроорганизма, используемого в качестве биокатализатора, увеличивает соотношение активности NHase/амидазы указанного микроорганизма. Предпочтительно высушивание опосредуется распылительной сушкой, лиофилизацией, термической сушкой, высушиванием на воздухе, вакуумной высушиванием, сушкой в псевдоожиженном слое и/или распылительной грануляцией. С этой точки зрения высушивание распылением и лиофильная сушка являются предпочтительными, поскольку, как правило, с применением биокатализатора, который был подвергнут распылительной или лиофильной сушке, наблюдается более высокое уменьшение образования акриловой кислоты во время получения амидного соединения из нитрила по сравнению с применением микроорганизма, который был высушен с применением других способов. В любом из способов, описанных в настоящем документе, высушивание микроорганизма может быть проведена непосредственно перед тем, как высушенный микроорганизм контактирует с нитрильным соединением. Альтернативно, микроорганизм может храниться между высушиванием и контактированием высушенного микроорганизма с нитрильным соединением. Для хранения микроорганизма между стадией высушивания и контактирования высушенный микроорганизм может храниться в сухом состоянии (т.е. микроорганизм не восстанавливается), может быть заморожен, может быть защищен от тепла, может быть защищен от влаги и/или может не культивироваться.
Особых ограничений по форме высушенного микроорганизма нет в тот момент, когда высушенный микроорганизм контактирует с нитрильным соединением. Высушенный микроорганизм может быть сухим и/или в форме продукта высушивания, достигаемого любым из описанных в настоящем документе способов высушивания, таких как распылительная сушка или лиофильная сушка. Соответственно, в любом из способов и дополнительных вариантов выполнения, описанных в настоящем документе, стадия контактирования может быть проведена с микроорганизмом, имеющим остаточное содержание воды не более 30, 25, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6 или 5 мас. %. от общей массы микроорганизма. Специалисту в данной области техники известны методы определения остаточного содержания воды. Например, в контексте настоящего изобретения остаточное содержание воды в образце высушенного микроорганизма может быть определено посредством термогравиметрического анализа. В начале термогравиметрического анализа определяется начальная масса образца. Затем образец нагревают и вода испаряется. Нагревание продолжается до тех пор, пока масса образца не станет постоянной. Разница между постоянной массой в конце анализа и начальной массой представляет собой количество воды, выпаренное в ходе анализа, что позволяет рассчитывать остаточное содержание воды в образце. Для определения содержания остаточной воды посредством термогравиметрического анализа образец микроорганизма может быть, например, проанализирован на анализаторе влажности «Mettler Toledo HB43-S Halogen», работающем при 130°С до тех пор, пока масса образца не будет оставаться постоянной по меньшей мере 30 секунд. Таким образом, «общая масса микроорганизма» не обязательно ограничивается массой микроорганизма как такового (хотя это, конечно, возможно, например, когда микроорганизмы были промыты водой до стадии высушивания), но могут дополнительно включать ингредиенты, присутствие которых может быть приписаны культивированию микроорганизмов и/или стадиям промывки и т.д. Далее следует, что «общая масса микроорганизма» может дополнительно включать (помимо микроорганизма) остаточное количество буферных компонентов/солей для хранения, таких как буферы на основе TRIS, буферы на основе физиологического раствора и т.д. и/или остаточные количества культуральной среды, питательной среды, питательных растворов, ферментационных бульонов, например ферментационного бульона, который был использован для культивирования микроорганизмов и т.д., стабилизаторов, добавок (например, сухих добавок) и т.д.
Настоящее изобретение дополнительно обеспечивает в соответствии с открытиями авторов настоящего изобретения способ получения микроорганизма с повышенным соотношением активности NHase/амидазы, включающий высушивание микроорганизма, продуцирующего NHase и амидазу, а также способ получения микроорганизма с пониженной амидазной активностью, включающий высушивание микроорганизма, продуцирующего NHase и амидазу. Как объяснялось выше, основной целью, достигаемой настоящим изобретением, является амидное соединение, полученное посредством биоконверсии (биоконверсией из нитрильного соединения) с меньшим количеством или уменьшенным количеством акриловой кислотой в качестве побочного продукта, так как известно, что акриловая кислота вызывает трудности при последующей полимеризации амидного соединения. Соответственно, это достижение находит отражение в обеспечении способа уменьшения образования акриловой кислоты при получении амидного соединения из нитрильного соединения, включающего контактирование акрилонитрила с микроорганизмом, продуцирующим NHase и амидазу, причем указанный микроорганизм предварительно обрабатывают на стадии высушивания перед приведением в контакт с указанным нитрильным соединением. В частности, авторы изобретения обнаружили, что при использовании микроорганизма, который был предварительно обработан на стадии высушивания перед контактом с нитрильным соединением, как описано в настоящем документе, образование акриловой кислоты может быть уменьшено по меньшей мере на 15%, предпочтительно при по меньшей мере 20%, более предпочтительно по меньшей мере на 25%, еще более предпочтительно по меньшей мере на 30%, еще более предпочтительно по меньшей мере на 40% и наиболее предпочтительно на по меньшей мере на 50% по сравнению с контрольным способом.
Авторы настоящего изобретения далее считают, что реакции биоконверсии, особенно в промышленном масштабе, предпочтительно проводить довольно простым способом. В частности, что касается биоконверсии нитрильного соединения в амидное соединение с применением NHase, которая содержит биокатализатор по изобретению, авторы настоящего изобретения считают, что предпочтительно поддержание молярной концентрации буфера в реакционной смеси сравнительно низким, насколько это возможно, имеет ряд преимуществ для процесса биоконверсии. Например, если в реакционной смеси присутствует сравнительно большое количество буфера, то оно, следовательно, будет присутствовать в сточных водах в сравнительно больших количествах. Это означает, что буфер снова должен быть удален из сточных вод, что приведет к дополнительным техническим трудозатратам и материальным затратам. Кроме того, присутствие сравнительно большого количества буфера в продукте, то есть амидном растворе, может отрицательно влиять на последующие стадии реакции, такие как, например, реакции полимеризации или сополимеризации.
Следовательно, если к реакционной смеси биоконверсии добавляют сравнительно большое количество буфера, то он либо должен быть отделен от амидного раствора перед дальнейшими реакционными стадиями, что будет сопровождаться дополнительными техническими трудозатратами и материальными затратами, либо буфер может привести к снижению качества продукта. Следовательно, биоконверсию нитрильного соединения в амидное соединение предпочтительно проводят в водном растворе в присутствии сравнительно небольших количеств буфера.
Для получения реакционной смеси для биоконверсии нитрильного соединения в амидное соединение высушенный биокатализатор, который был получен способами по настоящему изобретению, например, путем распылительной сушки или лиофильной сушки, может быть, как правило, суспендировано в воде, и указанную водную смесь, содержащую биокатализатор, можно затем переносить в реактор, в котором осуществляется биоконверсия, и где биокатализаторы контактируют с водной смесью и нитрильным соединением, которое должно быть превращено в соответствующий амид. Однако авторы настоящего изобретения неожиданно обнаружили, что если высушенный биокатализатор по изобретению смешивается с незабуференным водным раствором, рН водной смеси, содержащей биокатализатор, будет находиться в слабокислом диапазоне (например, рН 5-6,5). Это удивительно, так как до высушивания, например, распылительной сушке или лиофильной сушке, влажный биокатализатор находится в среде, которая обычно имеет нейтральный рН (например, рН 6,7-7,5). Более того, реакционная смесь во время биоконверсии является довольно слабоосновной. Не желая связывать себя какой-либо теорией, полагают, что во время стадии высушивания аммиак (NH3) удаляется из среды, что приводит к слабокислым рН высушенного биокатализатора при смешивании с водным раствором перед биоконверсией.
В этом отношении авторы настоящего изобретения неожиданно обнаружили, что кислый рН водной смеси высушенного биокатализатора приводит к уменьшению активности NHase и что это уменьшение может быть необратимым, что означает, что активность NHase будет оставаться уменьшенной, даже если биоконверсию проводят в реакционной смеси, которая имеет нейтральный или слегка щелочной рН.
Авторы настоящего изобретения провели различные эксперименты и обнаружили, что если высушенный биокатализатор активируют суспендированием его в буферном водном растворе перед биоконверсией, где раствор имеет нейтральный или слегка щелочной рН (например, рН 6,6-9), биокатализатор будет иметь существенно увеличенную активность NHase. Эта высокая активность по NHase сохраняется даже в том случае, если активирующая смесь (то есть забуференная водная смесь, содержащая биокатализатор) переносится в незабуференный водный раствор, чтобы получить реакционную смесь. Благодаря этой повышенной активности NHase общее время реакции биоконверсии существенно уменьшается по сравнению со временем реакции биоконверсии, в которой такое же количество биокатализатора суспендировалось в воде без буфера после высушивания распылением. Более того, простое добавление буфера в реакционную смесь не приводит к такому же эффекту, как если бы высушенный биокатализатор ресуспендировали в буфере в качестве активации перед добавлением в реакционную смесь. Согласно дополнительным экспериментам, проведенным авторами настоящего изобретения, биокатализатор также обладает существенно повышенной активностью NHase, когда буфер добавляется к суспензии клеток после ферментации, а биокатализатор высушивается с буфером и затем повторно суспендируется в воде или буфере.
Как указано выше, активацию биокатализатора можно осуществлять путем суспендирования высушенного биокатализатора в водном растворе, содержащем буфер. Такая активация может быть выполнена в небольшом масштабе, то есть реакционный объем, необходимый для активации, сравнительно невелик. С другой стороны, реакционная смесь, в которой биоконверсия нитрильного соединения в амидное соединение выполняется, как правило, имеет сравнительно большой объем. Из-за малого объема активирующей смеси по сравнению с объемом реакционной смеси буферный компонент разбавляется в реакционной смеси, когда активирующая смесь переносится в реактор для биоконверсии нитрильного соединения в амидное соединение. Тем не менее, благоприятный эффект буфера при активации сохраняется в биоконверсии. Как сказано выше, вследствие повышенной активности NHase биоконверсия нитрильного соединения в амидное соединение с применением биокатализатора демонстрирует более высокую скорость реакции, если используется такое же количество биокатализатора. Кроме того, количество биокатализатора может быть уменьшено при достижении скорости реакции, которая даже выше, чем скорость реакции, при использовании неуменьшенного количества биокатализатора, который не подвергся стадии активации, то есть биокатализатор, ресуспендированный в простой воде после высушивания.
Таким образом, настоящее изобретение также относится к способу получения амидного соединения из нитрильного соединения в водной смеси, включающему: (а) предварительную обработку биокатализатора посредством стадии высушивания; (b) стадию активации, включающую смешивание высушенного биокатализатора по изобретению с водным раствором с получением активирующей смеси, где активирующая смесь содержит буфер; и (с) превращение нитрильного соединения в амидное соединение с применением биокатализатора по изобретению в реакционной смеси, где реакционная смесь содержит указанный буфер со стадии (b), и где отношение молярной концентрации буфера в активирующей смеси к молярной концентрации указанного буфера в реакционной смеси составляет около 2:1 или более. В частности, отношение молярной концентрации буфера в активирующей смеси к молярной концентрации указанного буфера в реакционной смеси составляет около 2:1 или более до окончания конверсии. В любом из раскрытых в настоящем документе способов не требуется, чтобы это отношение поддерживалось постоянным во время конверсии. Скорее, отношение может меняться во время конверсии, если отношение составляет около 2:1 или более. Например, это отношение может увеличиться во время конверсии. Это может иметь место, если реагенты добавляются в реакционную смесь во время конверсии, которые разбавляют реакционную смесь и тем самым уменьшают концентрацию буфера в реакционной смеси. Например, нитрильное соединение и/или воду можно подавать в качестве реагентов в реакционную смесь во время конверсии. Это увеличивает объем реакционной смеси и, таким образом, уменьшает молярную концентрацию буфера в реакционной смеси. В результате уменьшения молярной концентрации буфера в реакционной смеси увеличивается отношение молярной концентрации буфера в активирующей смеси к молярной концентрации буфера в реакционной смеси. Таким образом, как можно видеть из этого примера, молярное отношение может изменяться в течение реакции конверсии.
Кроме того, предполагается, что отношение молярной концентрации буфера в активирующей смеси к молярной концентрации указанного буфера в реакционной смеси может составлять около 3:1 или более, предпочтительно около 4:1 или более, более предпочтительно около 5:1 или более, еще более предпочтительно около 7:1 или более, еще более предпочтительно около 10:1 или более, еще более предпочтительно около 20:1 или более, еще более предпочтительно около 50:1 или более, наиболее предпочтительно около 100:1 или более. В частности, эти отношения присутствуют перед окончанием конверсии. Что касается молярной концентрации буфера в активирующей смеси и молярной концентрации буфера в реакционной смеси, эти концентрации указаны в молях/л (моль на литр). При расчете отношения молярной концентрации буфера в активирующей смеси и молярной концентрации буфера в реакционной смеси как молярная концентрация буфера в активирующей смеси, так и молярная концентрация буфера в реакционной смеси выражаются в моль/л. В соответствии с настоящим изобретением также предполагается, что буфер активирующей смеси может быть по меньшей мере частично удален после стадии активации и до того, как биокатализатор контактирует с нитрильным соединением. В качестве иллюстративного примера - это может быть сделано посредством центрифугирования активирующей смеси с последующим отбрасыванием надосадочной жидкости, необязательно с последующим контактированием биокатализатора с другим водным раствором или, как еще один иллюстративный пример, посредством фильтрации. В таком случае биокатализатор (суспензия), как правило, все еще содержит остаточный буфер, когда биокатализатор контактирует с нитрильным соединением. Специалист в данной области техники понимает, что чем меньше присутствует остаточного буфера в биокатализаторе, тем выше может быть отношение молярной концентрации буфера в активирующей смеси к молярной концентрации указанного буфера в реакционной смеси.
Используемый в настоящем документе термин «активация» в контексте высушенного биокатализатора в общем случае относится к смешиванию высушенного биокатализатора с водным раствором с получением водной смеси, содержащей биокатализатор и буфер. Упомянутую смесь также называют в настоящем документе «активирующей смесью». В соответствии с любым из способов, описанных в настоящем документе, активирующая смесь может быть получена путем смешивания буфера с водным раствором с получением забуференного водного раствора и последующего растворения или суспендирования высушенного биокатализатора в забуференном водном растворе. Активирующую смесь можно также получить смешиванием высушенного биокатализатора с буферными компонентами, в частности сухими буферными компонентами, и последующим добавлением воды к смеси или добавлением смеси к воде и растворением буферных компонентов, а также растворением или повторным суспендированием высушенного биокатализатора.
Используемый в настоящем документе термин «реакционная смесь» относится к водной смеси, содержащей биокатализатор и нитрильное соединение и/или амидное соединение. В некоторых вариантах выполнения реакционная смесь по любому из способов, описанных в настоящем документе, может быть создана путем объединения биокатализатора, который подвергся стадии активации, водного раствора и нитрильного соединения. Как правило, биокатализатор катализирует превращение нитрильного соединения в амидное соединение в реакционной смеси. Таким образом, термин «реакционная смесь» обычно относится к смеси, включающей воду, биокатализатор и нитрил и/или амидное соединение, в любое время процесса превращения, в том числе в начале реакции, когда в водном растворе биокатализатор сначала контактирует с нитрильным соединением, а также после того, как превращение останавливается или прекращается, но когда водный раствор, биокатализатор и амидное или нитрильное соединение все еще присутствуют в смеси.
Термин «перед окончанием конверсии», как используется в настоящем документе, относится к любому времени, пока превращение нитрила в амид в реакционной смеси все еще продолжается. Обычно это относится к любому времени, в котором присутствует реакционная смесь и в котором конверсия еще не закончилась или не прекратилась.
В описанных в настоящем документе способах также предусматривается, что буфер может быть добавлен в суспензию или раствор биокатализатора до того, как биокатализатор будет подвергнут стадии высушивания по изобретению с получением высушенного биокатализатора. Биокатализатор можно также промывать перед добавлением буфера. Посредством добавления буфера перед стадией высушивания высушенный биокатализатор содержит высушенные компоненты буфера, которые были добавлены до стадии высушивания. Таким образом, при контактировании высушенного биокатализатора, содержащего буфер, с водным раствором, буферные компоненты растворяются, что вместе с биокатализатором дает активирующую смесь. Кроме того, в описанных в настоящем документе способах также предусматривается, что биокатализатор, обработанный буфером перед тем, как биокатализатор подвергается стадии высушивания с получением высушенного биокатализатора, который впоследствии может быть растворен или ресуспендирован в буферном растворе с получением активирующей смеси.
Когда биокатализатор активируют буфером в соответствии с раскрытыми в настоящем документе способами, указанная активация не требует длительного периода времени. Предпочтительно указанную активацию биокатализатора проводят в течение около 1 минуты или более, более предпочтительно в течение около 5 минут или более, еще более предпочтительно от около 10 минут до около 10 часов, еще более предпочтительно от около 20 минут до около 5 часов, наиболее предпочтительно от около 30 минут до около 2 часов. Когда высушенный биокатализатор обрабатывают забуференным водным раствором с получением активирующей смеси, указанную активирующую смесь обычно используют непосредственно для биоконверсии, то есть смешивают непосредственно с водным раствором и нитрильным соединением с получением реакционной смеси. С другой стороны, если биокатализатор активируют буферным раствором или буферной солью перед стадией высушивания, высушенный биокатализатор может быть впоследствии храниться в течение нескольких месяцев, перед объединением указанного активированного биокатализатора с водным раствором с получением активирующей смеси и для дальнейшего смешивания указанной активирующей смеси с водным раствором и нитрильным соединением с получением реакционной смеси. Как установлено авторами настоящего изобретения, указанный биокатализатор незначительно теряет активность в течение периода хранения. Это можно рассматривать как дополнительное преимущество указанных вариантов активации.
Кроме того, согласно раскрытым в настоящем документе способам, буфер, содержащийся в активирующей смеси, имеет рКа в интервале от около 6 до около 9, предпочтительно от около 6,5 до около 8. В настоящем документе буфер может содержать один компонент или может быть смесью более чем одного буферного компонента. Также понятно, что один компонент может иметь более одного значения рКа. Буфер обычно имеет рКа в диапазоне от около 6 до около 9, если он содержит буферный компонент, который имеет рКа в диапазоне от около 6 до около 9. Например, фосфат имеет три значения рКа, 2,1, 7,2 и 12,7. Так как одно из значений рКа фосфата находится в интервале от около 6 до около 9, буфер, содержащий фосфат, можно понимать как буфер, имеющий рКа в интервале от около 6 до около 9.
Предусматривается также, что активирующая смесь имеет значение рН от около 6,6 до около 9, предпочтительно от около 6,6 до около 8,8, более предпочтительно от около 6,7 до около 8,6, еще более предпочтительно от около 6,8 до около 8,4, еще более предпочтительно от около 6,9 до около 8,2, наиболее предпочтительно от около 7 до около 8.
Также рассматриваемое изобретение состоит в том, что различные буферы хорошо подходят для использования в раскрытых в настоящем документе способах, то есть для увеличения активности NHase биокатализатора. Предполагается, что буфер содержит неорганический буфер или органический буфер. Кроме того, предполагается, что буфер может содержать буфер не сульфоновой кислоты или буфер карбоновой кислоты. Подходящие буферы, которые могут быть использованы в настоящем изобретении, могут включать соединение, выбранное из группы, состоящей из фосфата, цитрата, карбоната, 2-[(2-гидрокси-1,1-бис(гидроксиметил)этил)амино]этансульфоновой кислоты (TES), 1,4-пиперазинэтансульфокислоты (PIPES), N-(2-ацетамидо)-2-аминоэтансульфоновой кислоты (ACES) и трис(гидроксиметил) аминометана (TRIS) и любой их комбинации. В частности, буфер содержит фосфатный буфер или цитратный буфер или их комбинацию. Предпочтительно буфер представляет собой фосфатный буфер.
Кроме того, предполагается, что буфер находится в концентрации в активирующей смеси от около 10 мМ до около 1 М, предпочтительно от около 20 мМ до около 500 мМ, более предпочтительно от около 50 мМ до около 200 мМ, еще более предпочтительно около от 70 мМ до около 130 мМ, наиболее предпочтительно от около 80 мМ до около 120 мМ.
Кроме того, предполагается, что концентрация буфера в реакционной смеси составляет около 100 мМ или менее, предпочтительно около 50 мМ или менее, более предпочтительно около 20 мМ или менее, еще более предпочтительно около 10 мМ или менее, еще более предпочтительно от около 5 мМ до около 1 пМ, еще более предпочтительно от около 4 мМ до около 1 пМ, еще более предпочтительно от около 3 мМ до около 1 пМ, еще более предпочтительно от около 2 мМ до около 1 пМ, еще более предпочтительно от около 1 мМ до около 1 пМ, еще более предпочтительно от около 0,8 мМ до около 1 пМ, еще более предпочтительно от около 0,5 мМ до около 1 пМ, еще более предпочтительно от около 0,4 мМ до около 1 пМ, еще более предпочтительно от около 0,3 мМ до около 1 пМ, еще более предпочтительно от около 0,2 мМ до около 1 пМ, наиболее предпочтительно от около 0,1 мМ до около 1 пМ.
Предусматривается также, что температура активации находится в диапазоне от около 0°С до около 50°С, предпочтительно от около 10°до около 40°С, более предпочтительно от около 20°С до около 37°С.
Однако настоящее изобретение охватывает не только способы, но также охватывает следующие виды применения.
Применение микроорганизма, продуцирующего NHase и амидазу, как описано в настоящем документе для получения амидного соединения из нитрильного соединения.
Применение метода высушивания для увеличения соотношения активности NHase/амидазы микроорганизма, продуцирующего NHase и амидазу.
Применение метода высушивания для уменьшения амидазной активности микроорганизма, продуцирующего NHase и амидазу.
Варианты и определения, описанные в настоящем документе в контексте способов настоящего изобретения, в равной степени применимы к применениям настоящего изобретения с соответствующими изменениями.
В другом аспекте настоящее изобретение относится к водному раствору амидного соединения, полученному способами настоящего изобретения. Такой раствор водного раствора амидного соединения предпочтительно характеризуется пониженным содержанием акриловой кислоты по сравнению с водным раствором амидного соединения, полученного из того же самого организма, который, однако, не подвергался предварительной обработке посредством стадии высушивания перед введением в контакт с нитрильным соединением. В частности, концентрация акриловой кислоты в таком водном растворе амидного соединения составляет 1500 частей на миллион или менее, предпочтительно 1200 частей на миллион или менее, более предпочтительно 1000 частей на миллион или менее, более предпочтительно 750 частей на миллион или менее, еще более предпочтительно 500 частей на миллион или менее, еще более предпочтительно 300 частей на миллион или менее, еще более предпочтительно 200 частей на миллион или менее и наиболее предпочтительно 100 частей на миллион или менее, причем каждое значение частей на миллион относятся к массовым частям и относятся к общей массе водного раствора амидного соединения.
Кроме того, настоящее изобретение обеспечивает композицию, содержащую акриламид или полиакриламид и микроорганизм, продуцирующий NHase и амидазу, причем указанный микроорганизм обладает соотношением активности NHase/амидазы по меньшей мере 400 Единиц и/или соотношением активности NHase к активности амидазы, которое увеличивается в 1,7 раза по сравнению с эталонным микроорганизмом.
Если иное не требуется в контексте, термины в единственном числе должны включать термины во множественном числе, а термины во множественном числе должны включать термины в единственном числе. Как используется в настоящем документе и в прилагаемой формуле изобретения, форма единственного числа включает ссылки на множественное число, если контекст явно не указывает иное. Так, например, ссылка на «реагент» включает один или несколько таких различных реагентов, а ссылка на «способ» включает ссылку на эквивалентные стадии и способы, известные специалистам в данной области техники, которые могут быть модифицированы или заменены описанными в настоящем документе методами.
В используемом в настоящем документе значении термин «и/или» в сочетании между множественными перечисляемыми элементами понимается как охватывающий как индивидуальные, так и комбинированные варианты. Например, когда два элемента соединены «и/или», первый вариант относится к применимости первого элемента без второго. Второй вариант относится к применимости второго элемента без первого. Третий вариант относится к применимости первого и второго элементов вместе. Подразумевается, что любой из этих вариантов попадает в значение и, следовательно, удовлетворяет требованию термина «и/или», как используется в настоящем документе. Параллельная применимость более чем одного из вариантов также понимается как подпадающая под значение и, следовательно, удовлетворяющая требованию термина «и/или», как используется в настоящем документе.
Если не указано иное, термин «по меньшей мере», предшествующий ряду элементов, следует понимать как относящийся к каждому элементу серии.
Специалисты в данной области техники признают или смогут установить, используя не более чем рутинные эксперименты, многие эквиваленты конкретных вариантов выполнения изобретения, описанных в настоящем документе. Предполагается, что такие эквиваленты охватываются настоящим изобретением.
В настоящем описании и последующих пунктах формулы изобретения, если контекст не требует иного, слово «содержать» и варианты, такие как «содержит» и «содержащий», будут пониматься как подразумевающие включение указанного целого числа или шага или группы целых чисел или шагов, но не исключение какого-либо другого целого числа или шага или группы целого числа или шага. При использовании в настоящем документе термин «содержащий» может быть заменен термином «имеющий в своем составе» или иногда используемым в настоящем документе термином «имеющий».
Как описано в настоящем документе, «предпочтительный вариант выполнения» или «предпочтительный аспект» означает «предпочтительный вариант выполнения настоящего изобретения» или «предпочтительный аспект настоящего изобретения». Аналогичным образом, как описано в настоящем документе, «варианты выполнения», «еще один вариант выполнения», «аспект», «другой аспект» означает «варианты выполнения настоящего изобретения», «другой вариант выполнения настоящего изобретения», «аспект настоящего изобретения» и «еще один аспект настоящего изобретения» соответственно.
Если не определено иначе, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые обычно понимаются специалистами в данной области техники. Способы и методики настоящего изобретения обычно выполняются в соответствии с общепринятыми способами, хорошо известными в данной области техники. Специалисты в данной области техники поймут или смогут установить, используя не более чем рутинные эксперименты, многие эквиваленты конкретных вариантов выполнения изобретения, описанных в настоящем документе. Предполагается, что такие эквиваленты охватываются настоящим изобретением.
В тексте данного описания приводятся несколько документов. Каждый из упомянутых в настоящем документе документов (включая все патенты, заявки на патенты, научные публикации, спецификации изготовителя, инструкции и т.д.), как выше, так и ниже, включен в настоящее описание посредством ссылки во всей их полноте. Ничто в настоящем документе не должно истолковываться как признание того, что изобретение не имеет права передавать такое раскрытие в силу предшествующего изобретения.
Краткое описание чертежей
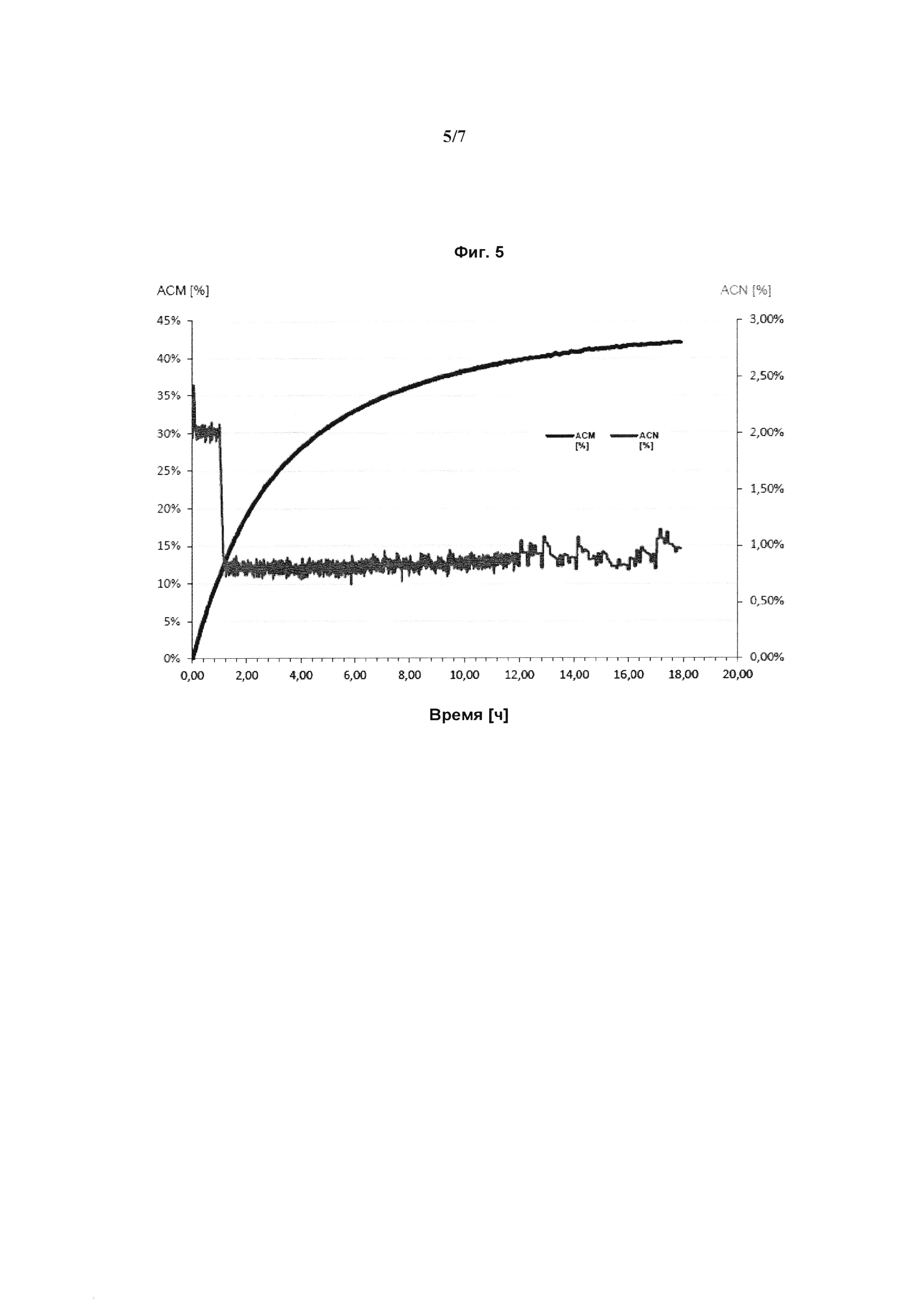
Фиг. 1: Зависимость от времени концентрации акриламида (АСМ, изображенного темно-серым) [%] и акрилонитрила (ACN, изображенного светло-серым) [%] в мас. % при биоконверсии акрилонитрила в акриламид с применением высушенного с помощью распылительной сушки Rhodococcus rhodochrous NCIMB 41164 в качестве биокатализатора. Высушенный биокатализатор был ресуспендирован в воде после распылительной сушки. Использовали общее количество 3,36 г высушенного биокатализатора (партия Ch10), который имел активность NHase 116 кЕ/г, измеренную до начала биоконверсии. Реакцию проводили в масштабе 4 л (л = литр) при 26°С. В начале реакции в реактор добавляли ресуспендированный биокатализатор, соответствующий 2,4 г высушенного биокатализатора. Концентрацию ACN от 0 ч до 1 ч после начала биоконверсии поддерживали при 2 мас. % подачей ACN в реактор. Через 1 ч после начала биоконверсии в реактор добавляли ресуспендированный биокатализатор, соответствующий 0,96 г высушенного биокатализатора. Через 1 ч после начала биоконверсии концентрацию ACN поддерживали на уровне 0,8 мас. %, пока в реактор не добавили всего 1553 г акрилонитрила. Общее время реакции до полного превращения (<100 частей на миллион остаточного ACN) составило 13,78 ч.
Фиг. 2: Зависимость от времени концентрации акриламида (АСМ, изображенного в темно-серым) [%] и акрилонитрила (ACN, изображенного светло-серым) [%] в мас. % при биоконверсии акрилонитрила в акриламид с применением высушенного с помощью распылительной сушки Rhodococcus rhodochrous NCIMB 41164 в качестве биокатализатора. Высушенный биокатализатор ресуспендировали в 33 мл 100 мМ фосфатного буфера (рН 7,0) после распылительной сушки, что соответствует стадии активации, как описано в настоящем документе. Стадию активации проводили в течение 1,0 ч. Использовали общее количество 3,36 г высушенного биокатализатора (партия Ch10), который имел активность NHase 116 кЕ/г, измеренную до начала биоконверсии. Реакцию проводили в масштабе 4 л (л = литр) при 26°С. В начале реакции в реактор добавляли ресуспендированный биокатализатор, соответствующий 2,4 г высушенного биокатализатора. Концентрацию ACN от 0 ч до 1 ч после начала биоконверсии поддерживали при 2 мас. % подачей ACN в реактор. Через 1 ч после начала биоконверсии в реактор добавляли ресуспендированный биокатализатор, соответствующий 0,96 г высушенного биокатализатора. Через 1 ч после начала биоконверсии концентрацию ACN поддерживали на уровне 0,8 мас. %, пока в реактор не добавили всего 1553 г акрилонитрила. Общее время реакции до полного превращения (<100 частей на миллион остаточного ACN) составляло 2,31 ч.
Фиг. 3: Зависимость от времени концентрации (АСМ, изображенного в темно-серым) [%] и акрилонитрила (ACN, изображенного светло-серым) [%] в мас. % при биоконверсии акрилонитрила в акриламид с применением высушенного с помощью распылительной сушки Rhodococcus rhodochrous NCIMB 41164 в качестве биокатализатора. Высушенный биокатализатор был ресуспендирован в воде после распылительной сушки. Использовали общее количество 3,36 г высушенного биокатализатора (партия Ch10), который имел активность NHase 116 кЕ/г, измеренную до начала биоконверсии. Реакцию проводили в масштабе 4 л (л = литр) при 26°С.Непосредственно перед добавлением биокатализатора в реактор добавляли 33 мл 100 мМ фосфатного буфера (рН 7,0), что соответствует количеству буфера, который использовался на стадии активации эксперимента, изображенного на Фиг. 2. В начале в реактор добавляют ресуспендированный биокатализатор, соответствующий 2,4 г высушенного биокатализатора. Концентрацию ACN от 0 ч до 1 ч после начала биоконверсии поддерживали при 2 мас. % подачей ACN в реактор. Через 1 ч после начала биоконверсии в реактор добавляли ресуспендированный биокатализатор, соответствующий 0,96 г высушенного биокатализатора. Через I ч после начала биоконверсии концентрацию ACN поддерживали на уровне 0,8 мас. %, пока в реактор не добавили всего 1553 г акрилонитрила. Общее время реакции до полной конверсии (<100 частей на миллион остаточного ACN) составило 11,98 ч.
Фиг. 4: Зависимость от времени концентрации акриламида (АСМ, изображенного темно-серым) [%] и акрилонитрила (ACN, изображенного светло-серым) [%] в мас. % в биоконверсии акрилонитрила в акриламид с применением распылительной сушки Rhodococcus rhodochrous NCIMB 41164 в качестве биокатализатора. Высушенный биокатализатор ресуспендировали в 30 мл 100 мМ фосфатного буфера (рН 7,0), что соответствует описанной в настоящем документе стадии активации. Стадию активации проводили в течение 0,5 ч. Использовали 1,8 г высушенного биокатализатора (партия Ch10), который имел активность NHase 116 кЕ/г, измеренную до начала биоконверсии. Реакцию проводили в масштабе 4 л (л = литр) при 23°С. В начале реакции в реактор добавляли ресуспендированный биокатализатор, соответствующий 1,8 г высушенного биокатализатора. Концентрацию ACN после начала биоконверсии поддерживали равной 1 мас. % подачей ACN в реактор до тех пор, пока в реактор не добавили всего 1553 г акрилонитрила. Общее время реакции до полного превращения (<100 частей на миллион остаточного ACN) составляло 7,13 ч.
Фиг. 5: Зависимость от времени концентрации акриламида (АСМ, изображенного темно-серым) [%] и акрилонитрила (ACN, изображенного светло-серым) [%] в мас. % при биоконверсии акрилонитрила в акриламид с применением Rhodococcus rhodochrous NCIMB 41164 в качестве биокатализатора, высушенного с помощью распылительной сушки в качестве биокатализатора. Высушенный биокатализатор ресуспендируют в воде. Использовали общее количество 1,29 г высушенного биокатализатора (партия V3), который имел активность NHase 172 кЕ/г, измеренную до начала биоконверсии. Реакцию проводили в масштабе 4 л (л = литр) при 26°С. В начале реакции в реактор добавляли ресуспендированный биокатализатор, соответствующий 0,92 г высушенного биокатализатора. Концентрацию ACN от 0 ч до 1 ч после начала биоконверсии поддерживали при 2 мас. % подачей ACN в реактор. Через 1 ч после начала биоконверсии в реактор добавляли ресуспендированный биокатализатор, соответствующий 0,37 г высушенного биокатализатора. Через 1 ч после начала биоконверсии концентрацию ACN поддерживали на уровне 0,8 мас. %, пока в реактор не добавили всего 1553 г акрилонитрила. Полной конверсии (<100 частей на миллион остаточного ACN) не было достигнуто через 20 ч.
Фиг. 6: Зависимость от времени концентрации акриламида (АСМ, изображенного темно-серым) [%] и акрилонитрила (ACN, изображенного светло-серым) [%] концентрация в мас. % при биоконверсии акрилонитрила в акриламид с применением Rhodococcus rhodochrous NCIMB 41164 в качестве биокатализатора, высушенного с помощью распылительной высушивания в качестве биокатализатора. Высушенный биокатализатор ресуспендировали в 30 мл 100 мМ фосфатного буфера (рН 8,0), что соответствует стадии активации. Стадию активации проводили в течение 0,5 ч. Использовали общее количество 1,29 г высушенного биокатализатора (партия V3), который имел активность NHase 172 кЕ/г, измеренную до начала биоконверсии. Реакцию проводили в масштабе 4 л (л = литр) при 26°С. В начале реакции в реактор добавляли ресуспендированный биокатализатор, соответствующий 0,92 г высушенного биокатализатора. Концентрацию ACN от 0 ч до 1 ч после начала биоконверсии поддерживали при 2 мас. % подачей ACN в реактор. Через 1 ч после начала биоконверсии в реактор добавляли ресуспендированный биокатализатор, соответствующий 0,37 г высушенного биокатализатора. Через 1 ч после начала биоконверсии концентрацию ACN поддерживали на уровне 0,8 мас. %, пока в реактор не добавили всего 1553 г акрилонитрила. Общее время реакции до полного превращения (<100 частей на миллион остаточного ACN) составляло 4,4 ч.
Фиг. 7: Зависимость от времени концентрации акриламида (АСМ, изображенного темно-серым) [%] и акрилонитрила (ACN, изображенного светло-серым) [%] в мас. % при биоконверсии акрилонитрила в акриламид с применением Rhodococcus rhodochrous NCIMB 41164 в качестве биокатализатора, высушенного с помощью распылительной сушки. Высушенный биокатализатор ресуспендировали в 30 мл 100 мМ цитратного буфера (рН 7,0), что соответствует стадии активации. Стадию активации проводили в течение 0,5 ч. Использовали общее количество 1,29 г высушенного биокатализатора (партия V3), который имел активность NHase 172 кЕ/г, измеренную до начала биоконверсии. Реакцию проводили в масштабе 4 л (л = литр) при 26°С. В начале реакции в реактор добавляли ресуспендированный биокатализатор, соответствующий 0,92 г высушенного биокатализатора. Концентрацию ACN от 0 ч до 1 ч после начала биоконверсии поддерживали при 2 мас. % подачей ACN в реактор. Через 1 ч после начала биоконверсии в реактор добавляли ресуспендированный биокатализатор, соответствующий 0,37 г высушенного биокатализатора. Через 1 ч после начала биоконверсии концентрацию ACN поддерживали на уровне 0,8 мас. %, пока в реактор не добавили всего 1553 г акрилонитрила. Общее время реакции до полного превращения (<100 частей на миллион остаточного ACN) составляло 7,25 ч.
Примеры
Следующие примеры дополнительно описывают и иллюстрируют предлагаемое изобретение без ограничения изобретения любыми спецификациями или вариантами выполнения, определенными в нем.
Было проведено три эксперимента в связи с получением амидного соединения из нитрильного соединения. Инокулятом для производства являлся ферментационный бульон, содержащий биокатализатор, концентрат упомянутого биокатализатора, высушенный распылением биокатализатор или лиофилизированный биокатализатор. Концентрат представляет собой форму биокатализатора перед его предварительной обработкой на стадии высушивания перед введением в контакт с указанным нитрильным соединением для превращения в амидное соединение. Концентрат означает, что ферментационный бульон концентрируют посредством уменьшения жидкого ферментационного бульона, например, центрифугированием. Таким образом, ферментационный бульон, концентрат и высушенный порошок, используемые в этом примере, содержат один и тот же биокатализатор.
Соотношение активности между NHase и амидазой, а также активность NHase определяли в соответствии с общеизвестными процедурами. Активность NHase загрузке означает, что во всех загрузках содержится одинаковое количество биокатализатора, так как это отражается в практически одинаковой активности NHase. Следовательно, условия были одинаковыми для ферментационного бульона, концентрата и высушенного порошка. Кроме того, определяли концентрацию акриловой кислоты. Эти данные суммированы в таблице 1 ниже, а также в конце реакции биоконверсии.
Пример 1: воду и 20 г ACN помещали в реактор. Количество воды регулировали так, чтобы общее количество воды + биокатализатор составляло 2447 г. В независимых экспериментах использовались три различные формы био катал изатора:
(i) ферментационный бульон, содержащий Rhodococcus rhodochrous NCIMB 41164. Содержание воды: 88,2% (мас. %).
(ii) концентрат, для которого ферментационный бульон из (i) концентрируют центрифугированием. Содержание воды: 83,5% (мас. %).
(iii) сухой порошок, полученный распылительной сушкой концентрата из (ii). Содержание остаточной воды в сухом порошке: 8,05% (мас. %). Распылительную сушку проводили при температуре на входе 115°С и температуре выпуска газа 65°С.
Биокатализатор добавляли в реактор, в результате чего начиналась реакция. Во время реакции добавляли 1533 г дополнительного акрилонитрила, так что общая масса реакционной партии в конце составляла 4000 г. Во время реакции температуру поддерживали постоянной при 26°С. Концентрацию ACN измеряли с помощью он-лайн FTIR, и скорость добавления ACN регулировали таким образом, чтобы концентрация ACN в реакционной смеси поддерживалась постоянной при 0,8±0,1% (мас. %) до тех пор, пока весь ACN не был добавлен в реакцию. Реакция прекращалась после уменьшения концентрации ACN до <100 частей на миллион вследствие конверсии. По окончании реакции концентрация акриламида (АСМ) в каждом примере составляла ≥51% (мас. %).
Пример 2: Воду и 60 г ACN помещали в реактор. Количество воды регулировали так, чтобы общее количество воды + биокатализатор составляло 2447 г. В независимых экспериментах использовались три различные формы биокатализатора:
(i) ферментационный бульон, содержащий Rhodococcus rhodochrous NCIMB 41164. Содержание воды: 91,8% (мас. %).
ii) концентрат, для которого ферментационный бульон (i) концентрируют центрифугированием. Содержание воды: 85,3% (мас. %).
(iii) сухой порошок, полученный распылительной высушиванием концентрата из (ii). Содержание остаточной воды в сухом порошке: 6,8% (мас. %). Распылительную сушку проводили при температуре на входе 115°С и температуре выпуска газа 60°С.
Биокатализатор добавляли в реактор, в результате чего начиналась реакция. Во время реакции добавляли 1493 г дополнительного акрилонитрила, так что общая масса реакционной партии в конце составляла 4000 г.Во время реакции температуру поддерживали постоянной при 26°С. Концентрацию ACN измеряли с помощью он-лайн FTIR, и скорость добавления ACN регулировали так, чтобы контролировать концентрацию ACN в реакционной смеси. В течение первого часа реакции концентрацию ACN поддерживали постоянной при 2,0±0,15% (мас. %), после чего поддерживали постоянной при 0,8%±0,15% (мас. %) до тех пор, пока весь ACN не был добавлен в реакцию. Реакция прекращалась после снижения концентрации ACN до <100 частей на миллион вследствие конверсии. В конце реакции концентрация АСМ в каждом примере составляла ≥50% (мас. %).
Пример 3: Воду и 60 г ACN помещали в реактор. Количество воды регулировали так, чтобы общее количество воды + биокатализатор составляло 2447 г. В независимых экспериментах использовались две различные формы биокатализатора:
(i) концентрат, для которого ферментационный бульон, содержащий Rhodococcus rhodochrous NCIMB 41164, концентрируют центрифугированием. Содержание воды: 81% (мас. %).
(ii) сухой порошок, полученный лиофильной сушкой концентрата из (i). Содержание остаточной воды в сухом порошке: 6,8% (мас. %).
Биокатализатор добавляли в реактор, в результате чего начиналась реакция. Во время реакции добавляли 1493 г дополнительного акрилонитрила, так что общая масса реакционной партии в конце составляла 4000 г.Во время реакции температуру поддерживали постоянной при 26°С.Концентрацию ACN измеряли с помощью он-лайн FTIR, и скорость добавления ACN регулировали таким образом, чтобы контролировать концентрацию ACN в реакционной смеси. В течение первого часа реакции концентрация ACN поддерживали постоянной при 2,0±0,15% (мас. %), после чего поддерживали постоянной при 0,8%±0,15% (мас. %) до тех пор, пока весь ACN не был добавлен в реакцию. Реакция прекращалась после снижения концентрации ACN до <100 частей на миллион вследствие конверсии. В конце реакции концентрация АСМ в каждом примере составляла ≥50% (мас. %).


Очевидно, что микроорганизм, который предварительно обрабатывался посредством стадии высушивания перед введением в контакт с нитрильным соединением, которое затем подвергается биологической конверсии указанным микроорганизмом, имеет самое высокое значение соотношения активностей NHase/амидаза. Учитывая тот факт, что в каждой реакции (загрузке) использовалось практически одинаковое количество биокатализатора (что определялось по активности NHase каждой из использованных форм биокатализатора, а именно: ферментация/концентрат/распылительная сушка/лиофильная сушка), очевидно, что стадия высушивания, то есть подвергание биокатализатора стадии высушивания перед тем, как привести его в контакт с нитрильным соединением, значительно влияет на количество побочной акриловой кислоты. Это означает, что вследствие стадии высушивания активность амидазы снижается до такой степени, что такие высушенные микроорганизмы продуцируют амидное соединение с меньшим количеством акриловой кислоты в качестве побочного продукта, что видно из самой правой колонки. В целом, поскольку параметры реакции поддерживаются одинаковыми между различными загрузками, очевидно, что улучшение, которое выражается в уменьшении количества акриловой кислоты может быть приписано стадии высушивания.
Пример 4: Лиофильно высушенный порошок получали посредством лиофилизации концентрированного ферментационного бульона в лабораторной сушильной установке Christ Alpha 2-4 LSCplus. Концентрат сначала замораживали в течение ночи при -20°С и затем сушили. Во время высушивания температура в полке составляла -25°С, температура конденсатора составляла -82°С, а давление в камере составляло 0,25 мбар.
Воду и 18 г ACN помещали в реактор. Количество воды регулировали так, чтобы общее количество воды + биокатализатор составляло 1835 г.В независимых экспериментах использовались две различные формы биокатализатора:
(i) ферментационный бульон, содержащий Rhodococcus rhodochrous J1. Содержание воды: 96,1% (мас. %).
(ii) сухой порошок, полученный концентрированием (i) посредством центрифугирования до содержания воды 83,6% (мас. %) и лиофильной сушкой концентрата.
Биокатализатор добавляли в реактор, в результате чего начиналась реакция. Во время реакции добавляли 1147 г дополнительного акрилонитрила, так что общая масса реакционной партии в конце составляла 3000 г. Во время реакции температуру поддерживали постоянной при 23°С. Концентрацию ACN измеряли с помощью он-лайн FTIR, и скорость добавления ACN регулировали таким образом, чтобы концентрацию ACN в реакционной смеси поддерживалась постоянной при 1,0±0,1% (мас. %) до тех пор, пока весь ACN не был добавлен к реакции. Реакция прекращалась после снижения концентрации ACN до <100 частей на миллион вследствие конверсии. По окончании реакции концентрация АСМ в каждом примере составляла ≥51% (мас. %).
Пример 5: Эксперименты проводили, как описано выше в примере 4, за исключением того, что концентрацию ACN в реакционной смеси поддерживали во время реакции при 0,3±0,1% (мас. %).
Результаты из примеров 4-5 показаны в таблице 2 ниже.


Пример 6: Активация биокатализатора, высушенного распылительной сушкой
Высушенный распылительной сушкой биокатализатор взвешивают в центрифужной пробирке (Falcon®) и суспендируют в 30 мл буфера для стадии активации, как описано в настоящем документе. Если не указано иное, указанный буфер представляет собой 100 мМ фосфатный буфер, рН 7,0. Биокатализатор обрабатывают буфером в течение 0,5 ч при комнатной температуре. Затем суспензию биомассы (биокатализатора) переносят в реактор и дополнительно инкубируют в течение 1 ч. После добавления суспензии биомассы в реактор, центрифужную пробирку промывают водой, и растворитель переносят также в реактор. Это количество воды рассматривается как вода, введенная в реактор.
Пример 7: Общий протокол для биоконверсии
Гидратацию акрилонитрила обычно проводят в реакторе с мешалкой (об/мин =250, объем V=4 л) с внешней циркуляционной петлей для охлаждения. Для этого в реактор загружают 2,4 л воды и биокатализатор. Биомассу добавляют в виде высушенных распылительной сушкой клеток Rhodococcus rhodochrous, которые предварительно суспендировали в воде. Как описано в настоящем документе, высушенные распылением клетки также могут быть непосредственно суспендированы в буфере в соответствии со стадией активации, описанной в настоящем документе. Для того чтобы начать реакцию, акрилонитрил дозируют в реактор с мешалкой, используя систему управления процессом. Постоянная концентрация акрилонитрила от 0,5 до 5 мас. % регулируется с помощью онлайн- анализа с ИК с преобразованием Фурье (FTIR), который непосредственно связан с блоком управления процессом (Labview). Температуру реакции поддерживают постоянную на уровне от 20 до 29°С.Добавление акрилонитрила прекращается после добавления 1553 г акрилонитрила. После полной конверсии остаточного акрилонитрила, то есть при достижении остаточной концентрации ACN <100 частей на миллион и получения 52 мас. % акриламида, реакция заканчивается.
Пример 8: Определение концентрации акриловой кислоты, акриламида. акриловой кислоты и акрилонитрила в полученных водных растворах акриламида методом ВЭЖХ
Для определения содержания акриламида, акриловой кислоты и акрилонитрила применялись следующие условия:
Колонка: Aqua С18, 250*4,6 мм (Phenomenex)
Защитная колонка: C18 Aqua
Температура: 40°С
Скорость потока: 1,00 мл/мин
Объем образца: 1,0 мкл
Обнаружение: УФ-детектор, длина волны 210 нм
Время остановки: 8,0 минут
Время восстановления колонки после анализа: 0,0 минут
Максимальное давление: 250 бар
Элюент А: 10 мМ KH2PO4, рН 2,5
Элюент В: Ацетонитрил
Градиент:

Матрица: ферментационные бульоны, биоконверсионные смеси
Образец фильтруют через фильтр 0,22 мкм
Аналиты:

Пример 9
Высушенный распылительной сушкой Rhodococcus rhodochrous (NCIMB 41164) партии Ch10 был использован для реакций биоконверсии акрилонитрила в акриламид. Реакции биоконверсии проводили согласно протоколу примера 7.
В примере 1 (изображенном на Фиг. 1) использовали 3,36 г биокатализатора, который был ресуспендирован в воде (в начале биоконверсии добавляли 2,4 г биокатализатора, через 1 ч добавляли 0,96 г биокатализатора). В примере 2 (изображенном на Фиг. 2) использовали 3,36 г биокатализатора (в начале биоконверсии добавляли 2,4 г биокатализатора, через 1 ч добавляли 0,96 г биокатализатора), который активировали 100 мМ фосфатным буфером (рН 7,0), в соответствии с изобретением. Активацию проводили в соответствии с примером 6. В примере 3 (изображенном на Фиг. 3) использовали 3,36 г биокатализатора, который ресуспендировали в воде (в начале биоконверсии добавляли 2,4 г биокатализатора, через 1 ч добавляли 0,96 г биокатализатора), но такое же количество фосфатного буфера, которое было использовано на стадии активации в примере 2, непосредственно добавляли в реактор до добавления биокатализатора. В примере 4 (изображенном на Фиг. 4) использовали 1,8 г биокатализатора (1,8 г биокатализатора добавляли в начале биоконверсии), который был обработан буфером 100 мМ фосфатным буфером (рН 7,0) в соответствии с примером 6. Результаты приведены в таблице ниже.

Как можно видеть из примера 2 (Фиг. 2), активация высушенного биокатализатора с применением фосфатного буфера снижает общее время реакции с 13,78 ч (пример 1, Фиг. 1) до 2,31 ч. Пример 3 (Фиг. 3) показывает, что добавление фосфатного буфера к реакционной смеси без активации высушенного биокатализатора практически не влияет на время реакции по сравнению с примером 1. Пример 4 (Фиг. 4) демонстрирует, что если высушенный биокатализатор активирован с применением фосфатного буфера, количество биокатализатора может быть уменьшено с 3,36 г до 1,8 г, в то время как общее время реакции все же меньше, чем при использовании 3,36 г биокатализатора, не обработанного буфером, как в примере 1.
Пример 10:
Высушенный распылением Rhodococcus rhodochrous (NCIMB 41164) партия V3 был использован для реакций биоконверсии акрилонитрила в акриламид. Реакции биоконверсии проводили согласно протоколу примера 7.
В примере 5 (изображенном на Фиг. 5) использовали 1,29 г биокатализатора, который был ресуспендирован в воде (0,29 г биокатализатора добавляли в начале биоконверсии, 0,37 г биокатализатора добавляли через 1 ч). В примере 6 (изображенном на Фиг. 6) использовали 1,29 г биокатализатора (0,29 г биокатализатора добавляли в начале биоконверсии, 0,37 г биокатализатора добавляли через 1 ч), который активировали 100 мМ фосфатным буфером (рН 8,0), как раскрыто в настоящем документе. Активация проводилась в соответствии с примером 6. В примере 7 (изображенном на Фиг. 7) использовали 1,29 г биокатализатора (0,29 г биокатализатора добавляли в начале биоконверсии, 0,37 г биокатализатора добавляли через 1 ч), который активировали 100 мМ цитратного буфера (РН 7,0). Результаты приведены в таблице ниже.
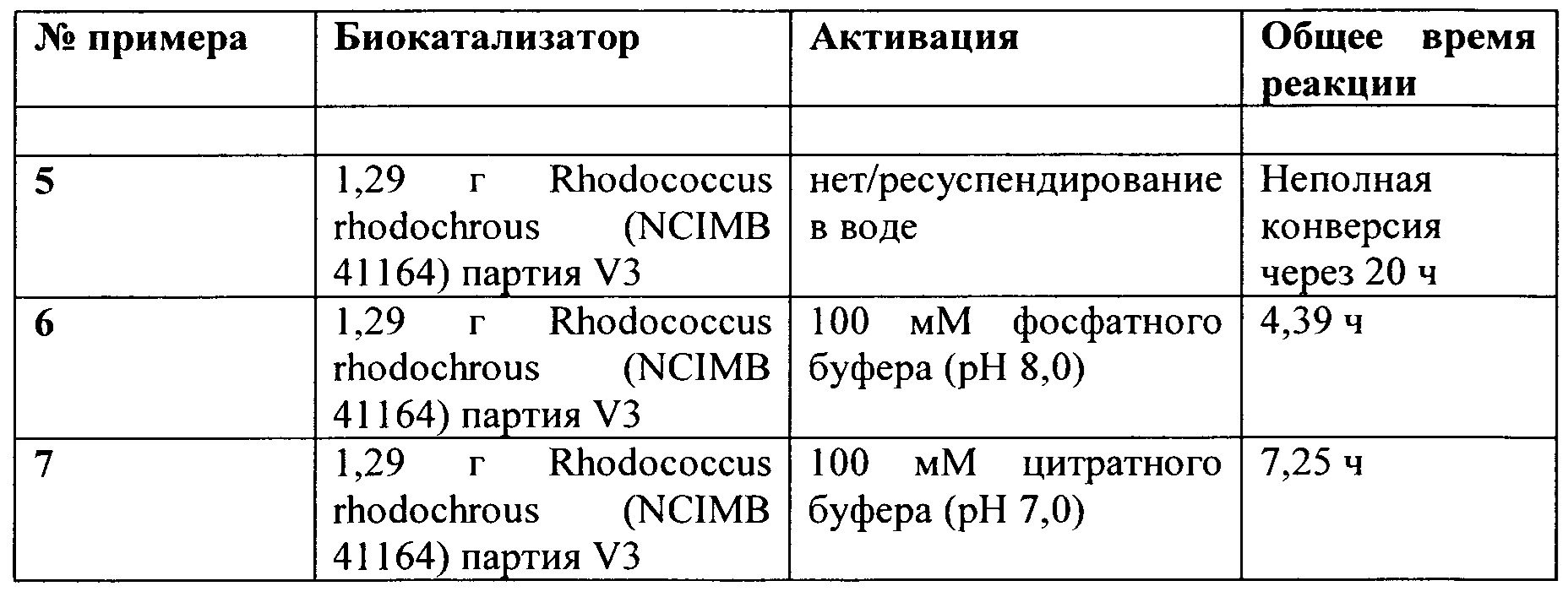
Как видно из примеров 6 и 7 (Фиг. 6 и 7), как стадия активации Rhodococcus rhodochrous (NCIMB 41164) партии V3 с фосфатным буфером (100 мМ, рН 8,0), так и цитратным буфером (100 мМ, рН 7,0) приводит к резкому снижению общего времени реакции от неполной конверсии через 20 ч до полной конверсии через 4,3 ч и 7,25 ч соответственно.
--->
Перечень последовательностей
<110> BASF SE
<120> СРЕДСТВА И СПОСОБЫ ПОЛУЧЕНИЯ АМИДНЫХ СОЕДИНЕНИЙ С МЕНЬШИМ КОЛИЧЕСТВОМ АКРИЛОВОЙ КИСЛОТЫ
<130> BAS15078PCT
<150> EP14003378.8
<151> 2014-09-30
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 612
<212> ДНК
<213> Rhodococcus rhodochrous
<220>
<223> альфа-субъединица нитрилгидратазы Rhodococcus rhodochrous
<400> 1
gtgagcgagc acgtcaataa gtacacggag tacgaggcac gtaccaaggc gatcgaaacc 60
ttgctgtacg agcgagggct catcacgccc gccgcggtcg accgagtcgt ttcgtactac 120
gagaacgaga tcggcccgat gggcggtgcc aaggtcgtgg ccaagtcctg ggtggaccct 180
gagtaccgca agtggctcga agaggacgcg acggccgcga tggcgtcatt gggctatgcc 240
ggtgagcagg cacaccaaat ttcggcggtc ttcaacgact cccaaacgca tcacgtggtg 300
gtgtgcactc tgtgttcgtg ctatccgtgg ccggtgcttg gtctcccgcc cgcctggtac 360
aagagcatgg agtaccggtc ccgagtggta gcggaccctc gtggagtgct caagcgcgat 420
ttcggtttcg acatccccga tgaggtggag gtcagggttt gggacagcag ctccgaaatc 480
cgctacatcg tcatcccgga acggccggcc ggcaccgacg gttggtccga ggaggagctg 540
acgaagctgg tgagccggga ctcgatgatc ggtgtcagta atgcgctcac accgcaggaa 600
gtgatcgtat ga 612
<210> 2
<211> 203
<212> PRT
<213> Rhodococcus rhodochrous
<220>
<223> альфа-субъединица нитрилгидратазы Rhodococcus rhodochrous
<400> 2
Val Ser Glu His Val Asn Lys Tyr Thr Glu Tyr Glu Ala Arg Thr Lys
1 5 10 15
Ala Ile Glu Thr Leu Leu Tyr Glu Arg Gly Leu Ile Thr Pro Ala Ala
20 25 30
Val Asp Arg Val Val Ser Tyr Tyr Glu Asn Glu Ile Gly Pro Met Gly
35 40 45
Gly Ala Lys Val Val Ala Lys Ser Trp Val Asp Pro Glu Tyr Arg Lys
50 55 60
Trp Leu Glu Glu Asp Ala Thr Ala Ala Met Ala Ser Leu Gly Tyr Ala
65 70 75 80
Gly Glu Gln Ala His Gln Ile Ser Ala Val Phe Asn Asp Ser Gln Thr
85 90 95
His His Val Val Val Cys Thr Leu Cys Ser Cys Tyr Pro Trp Pro Val
100 105 110
Leu Gly Leu Pro Pro Ala Trp Tyr Lys Ser Met Glu Tyr Arg Ser Arg
115 120 125
Val Val Ala Asp Pro Arg Gly Val Leu Lys Arg Asp Phe Gly Phe Asp
130 135 140
Ile Pro Asp Glu Val Glu Val Arg Val Trp Asp Ser Ser Ser Glu Ile
145 150 155 160
Arg Tyr Ile Val Ile Pro Glu Arg Pro Ala Gly Thr Asp Gly Trp Ser
165 170 175
Glu Glu Glu Leu Thr Lys Leu Val Ser Arg Asp Ser Met Ile Gly Val
180 185 190
Ser Asn Ala Leu Thr Pro Gln Glu Val Ile Val
195 200
<210> 3
<211> 690
<212> ДНК
<213> Rhodococcus rhodochrous
<220>
<223> бета-субъединица нитрил гидратазы Rhodococcus rhodochrous
<400> 3
atggatggta tccacgacac aggcggcatg accggatacg gaccggtccc ctatcagaag 60
gacgagccct tcttccacta cgagtgggag ggtcggaccc tgtcaattct gacttggatg 120
catctcaagg gcatatcgtg gtgggacaag tcgcggttct tccgggagtc gatggggaac 180
gaaaactacg tcaacgagat tcgcaactcg tactacaccc actggctgag tgcggcagaa 240
cgtatcctcg tcgccgacaa gatcatcacc gaagaagagc gaaagcaccg tgtgcaagag 300
atccttgagg gtcggtacac ggacaggaag ccgtcgcgga agttcgatcc ggcccagatc 360
gagaaggcga tcgaacggct tcacgagccc cactccctag cgcttccagg agcggagccg 420
agtttctctc tcggtgacaa gatcaaagtg aagagtatga acccgctggg acacacacgg 480
tgcccgaaat atgtgcggaa caagatcggg gaaatcgtcg cctaccacgg ctgccagatc 540
tatcccgaga gcagctccgc cggcctcggc gacgatcctc gcccgctcta cacggtcgcg 600
ttttccgccc aggaactgtg gggcgacgac ggaaacggga aagacgtagt gtgcgtcgat 660
ctctgggaac cgtacctgat ctctgcgtga 690
<210> 4
<211> 229
<212> PRT
<213> Rhodococcus rhodochrous
<220>
<223> бета-субъединица нитрил гидратазы Rhodococcus rhodochrous
<400> 4
Met Asp Gly Ile His Asp Thr Gly Gly Met Thr Gly Tyr Gly Pro Val
1 5 10 15
Pro Tyr Gln Lys Asp Glu Pro Phe Phe His Tyr Glu Trp Glu Gly Arg
20 25 30
Thr Leu Ser Ile Leu Thr Trp Met His Leu Lys Gly Ile Ser Trp Trp
35 40 45
Asp Lys Ser Arg Phe Phe Arg Glu Ser Met Gly Asn Glu Asn Tyr Val
50 55 60
Asn Glu Ile Arg Asn Ser Tyr Tyr Thr His Trp Leu Ser Ala Ala Glu
65 70 75 80
Arg Ile Leu Val Ala Asp Lys Ile Ile Thr Glu Glu Glu Arg Lys His
85 90 95
Arg Val Gln Glu Ile Leu Glu Gly Arg Tyr Thr Asp Arg Lys Pro Ser
100 105 110
Arg Lys Phe Asp Pro Ala Gln Ile Glu Lys Ala Ile Glu Arg Leu His
115 120 125
Glu Pro His Ser Leu Ala Leu Pro Gly Ala Glu Pro Ser Phe Ser Leu
130 135 140
Gly Asp Lys Ile Lys Val Lys Ser Met Asn Pro Leu Gly His Thr Arg
145 150 155 160
Cys Pro Lys Tyr Val Arg Asn Lys Ile Gly Glu Ile Val Ala Tyr His
165 170 175
Gly Cys Gln Ile Tyr Pro Glu Ser Ser Ser Ala Gly Leu Gly Asp Asp
180 185 190
Pro Arg Pro Leu Tyr Thr Val Ala Phe Ser Ala Gln Glu Leu Trp Gly
195 200 205
Asp Asp Gly Asn Gly Lys Asp Val Val Cys Val Asp Leu Trp Glu Pro
210 215 220
Tyr Leu Ile Ser Ala
225
<---
Реферат
Группа изобретений относится к биотехнологии, а именно к средствам и способам получения амидного соединения из нитрильного соединения с меньшим количеством акриловой кислоты в качестве побочного продукта с применением микроорганизма, продуцирующего нитрилгидратазу (NHase) и амидазу, в качестве биокатализатора. Микроорганизм представляет собой Rhodococcus rhodochrous. Для получения амидного соединения из нитрильного соединения указанный микроорганизм предварительно обрабатывают посредством высушивания распылительной сушкой или лиофилизацией перед контактированием с нитрильным соединением. Амидное соединение представляет собой по меньшей мере одно соединение, выбранное из акриламида и метакриламида, а нитрильное соединение представляет собой по меньшей мере одно соединение, выбранное из акрилонитрила и метакрилонитрила. Соотношение активности NHase к активности амидазы указанного микроорганизма увеличивается по сравнению с эталонным микроорганизмом, который не был предварительно обработан посредством высушивания. Изобретения позволяют увеличить соотношения активности NHase/амидазы микроорганизма, уменьшить активность амидазы и таким образом уменьшить образование акриловой кислоты из амида при получении амидного соединения из нитрильного соединения. 8 н. и 11 з.п. ф-лы, 7 ил., 4 табл., 10 пр.
Формула
Документы, цитированные в отчёте о поиске
Штамм rhodococcus rhodochrous ncimb 41164 и его применение в качестве продуцента нитрилгидратазы

Комментарии