Способ получения полиненасыщенных жирных кислот - RU2038377C1
Код документа: RU2038377C1
Чертежи

Описание
Изобретение относится к способу получения полиненасыщенных жирных кислот, таких как, например, арахидоновая или эйкозапентановая кислоты. Полиненасыщенные жирные кислоты широко используются в пищевой или парфюмерной промышленности. Например, арахидоновая кислота имеет важное значение как предшественник лейкотриенов и простагландинов, являющихся важными элементами для регулирования функционирования некоторых клеток и физиологических функций. Эйкозапентановая кислота играет важную роль при снижении риска заболевания тромбозом или артериосклерозом.
Известен способ получения
полиненасыщенных жирных кислот [1] путем ферментативной реакции с использованием микроорганизма типа Mortierella или даже культуры этого
микроорганизма в присутствии углеводорода и жирной кислоты
[2]
Известен также способ получения ненасыщенных жирных кислот [3] который включает культивацию микроорганизма типа Conidiobolus в
среде, содержащей в качестве источника углерода ненасыщенную
жирную кислоту.
Известен способ [4] получения эйкозапентановой кислоты из морских водорослей, относящихся к классу Corallina.
Целью изобретения является создание простого способа получения в больших количествах полиненасыщенных жирных кислот из природных источников, например мхов.
Предлагаемый способ получения полиненасыщенных жирных кислот включает культивирование растительного материала, получение биомассы клеток, ее выращивание и экстракцию целевого продукта, причем в качестве растительного материала используют споры мха одного из видов: Eurhynchium striatum, Brachythecium rutabulum, Brachythecium salebrosum, Rhytidiadelphus squarrogus, Scleropodium purum и Rhytidiadelphus Triquetrus, и культивирование осуществляют на полутвердой среде Мурасиге-Скуга в течение 1-4 мес при температуре 15-30оС и освещенности 2000-7000 лк при продолжительности светового дня 14-18 ч и ночи 6-10 ч, выращивание биомассы проводят в жидкой безгормональной питательной среде Мурасиге-Скуга, дополнительно содержащей 0-25 г/л глюкозы, в течение 2-6 нед. при температуре 15-30оС, освещенности 2000-7000 лк, при продолжительности светового дня 14-18 ч и ночи 6-10 ч, при рН питательной среды 5,5-7,0, и экстракцию целевого продукта осуществляют хлороформом, метанолом, изопропанолом, гексаном или смесью указанных соединений. Причем рН можно устанавливать путем добавления в питательную среду 0,05-0,2%-ной 2-морфолиноэтансульфоновой кислоты.
Используемая питательная среда предпочтительно Мурасиге-Скуга может быть разбавлена до 8-12 мас.
Одно из преимуществ предлагаемого изобретения состоит в том, что с его помощью можно получать стабилизированную культуру клеток определенного мха, продуцирующую целевые полиненасыщенные жирные кислоты постоянным и воспроизводимым образом.
Другим преимуществом изобретения является возможность получения с его помощью ненасыщенных жирных кислот, связанных обычно в гликолипиды, которые могут использоваться в косметических продуктах.
Мхи обычно состоят из двух частей, а именно: гаплоидной или гаметофитной и диплоидной или спорофитной фаз. Гаплоидные споры продуцируются спорофитом в результате мейоза. Эти споры могут развиваться за счет прорастания, образуя гаметофит.
Для осуществления способа в соответствии с предлагаемым изобретением можно использовать капсулы, содержащие указанные споры. Предпочтительно это должны быть зрелые споры. Собранные капсулы подвергают стерилизации, например, путем погружения в разбавленный раствор хлорида натрия, последующего погружения на короткое время в этанол и промывки дистиллированной водой, или любым другим способом, позволяющим удалить с их поверхности микробов.
Стерилизованные капсулы вскрывают и находящиеся в них споры помещают в культуральную среду, обычно использующуюся в таких случаях, например в среду Murashige b Skoog (T. Murashige u Skoog F. (1962), Physiol. Plant. 15, 473-497). Расход клеток для засева культурной среды составляет, например, 0,1-0,8 мг (в расчете на сухое вещество) на 1 мл среды.
рН жидкой культурной среды устанавливают в пределах 5,5-7,0, например, путем добавления биологического буферного раствора, обычно использующегося в тканевых культурах. Такая стабилизация рН обеспечивает быструю дифференциацию клеток и более интенсивное продуцирование биомассы.
В процессе культивации среды перемешивают целиком или частично, например, с помощью мешалки, вращающейся со скоростью 100-120 об/мин.
После окончания инкубации клетки отделяют путем фильтрации или центрифугирования.
Выделенные клетки могут быть затем гомогенизированы, например, в растворе, содержащем 1-3 мас.ч. хлороформа на 1 мас.ч. метанола, в растворе гексана, изопропанола или их смеси. Перед экстракцией клетки обрабатывают путем погружения на 2-6 мин в кипящий изопропанол для ингибирования активности липаз. Полученный экстракт осветляют при необходимости путем фильтрации и затем высушивают, например в ротационном испарителе при 35-40оС и пониженном давлении. Полученная в результате липидная фракция содержит целевые полиненасыщенные жирные кислоты, а также другие жирные кислоты.
Присутствующие в липидной фракции различные полиненасыщенные жирные кислоты могут быть разделены. Так, для получения метиловых эфиров целевых полиненасыщенных жирных кислот используют переэтерификацию, осуществляемую с помощью ацетилхлорида. Полученные метиловые эфиры экстрагируют, например гексаном. Полученные таким образом эфиры идентифицируют с помощью, например, газовой хроматографии путем сравнения с известными характеристиками стандартных соединений или с помощью масс-спектрометрии.
Полученные таким образом полиненасыщенные жирные кислоты могут использоваться в пищевых и/или косметических продуктах.
П р и м е р 1. 200 мл разбавленной до 10 мас. жидкой культурной среды Murashige и Skoog, не содержащей гормонов роста и витаминов и содержащей 10 г/л глюкозы, засевают 100 мг сухих клеток Rhytidiadelphus squarrosuc. рН культурной среды устанавливают равным 6,5, добавляя к ней 0,1%-ную (мас.) 2-морфолиноэтансульфоновую кислоту. Клетки выдерживают при 20оС и освещенности 5000 лк в течение 16 ч и затем в течение 8 ч в темноте при постоянном перемешивании со скоростью вращения мешалки 110 об./мин.
После инкубации в течение 3 нед суспензию фильтруют, получая в результате 820 мг клеток в расчете на сухое вещество.
Полученные клетки погружают на 2 мин в раствор изопропанола при 80-90оС, после чего суспендируют в растворе, содержащем 2 мас.ч. хлороформа на 1 мас. ч. метанола. Полученный экстракт фильтруют и высушивают в ротационном испарителе при 40оС и пониженном давлении, после чего подвергают очистке путем экстракции 0,88%-ным (мас.) раствором KCl. В результате получают 52,5 мг липидной фракции, т.е. 6,4 мас. от исходного количества сухих клеток.
52,5 мг липидной фракции подвергают переэтерификации ацетилхлоридом. Образующиеся в результате метиловые эфиры экстрагируют гексаном. Полученные эфиры разделяют с помощью газовой хроматографии и идентифицируют путем сравнения их масс-спектра с масс-спектром стандартных соединений.
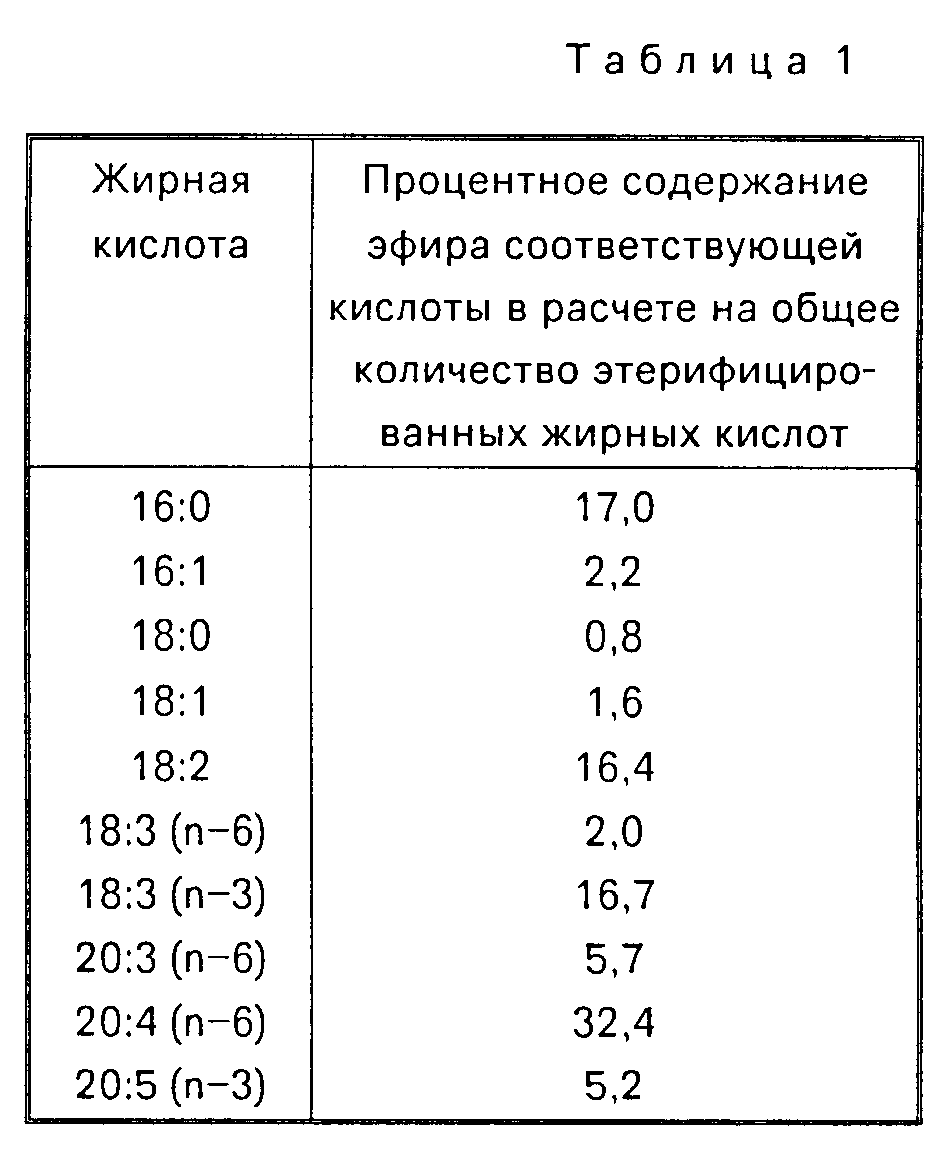
В нижеприведенной табл. 1 эфиры жирных кислот определяются числом атомов углерода и числом и положением двойных связей в исходной жирной кислоте.
Экстракт метиловых эфиров
содержит все жирные кислоты упомянутой липидной фракции в этерифицированной форме и имеет следующий состав (мас.):
В
результате получают 5,8 мг метиларахидоната (20:4, n-6) и 0,98 мг
метилэйкозапентаноата (20:5, n-3).
П р и м е р 2. 100 мг сухих клеток различных мхов засевают как это описано в примере 1 в жидкую культурную среду Murashige и Skoog, которая может быть разбавлена и рН которой устанавливают равным 6,5 путем добавления 0,1%-ной (мас.) 2-морфолиноэтансульфоновой кислоты (МES-кислота).
Содержание арахидоновой (АА) и эйкозапентановой (ЕРА) кислот определяют в мас. в расчете на общее количество жирных кислот (1) и в мг на г сухих клеток мха (11).
При этом получают следующие результаты, приведенные в табл. 2.
Для различных мхов используют следующие культурные среды:
для B. rutabulum, R. triquetrus и
R.squarrosus разбавленную до 10 мас. среду Murashige и Skoog, содержащую
MES-кислоту (рН 6,5);
для B. salebrosum неразбавленную среду Murashige и Skoog, содержащую MES-кислоту (рН 6,5);
для S.purum неразбавленную среду Murashige и Skoog (рН 5,8);
для E.striatum разбавленную до 10 мас. среду Murashige и Skoog (рН 5,8).
П р и м е р 3. 40 мл культурной среды Murashige и Skoog, не содержащей гормонов и витаминов и содержащей 10 г/л глюкозы (рН 5,8), засевают 20 г сухих клеток R.squarrosus. Клетки выдерживают при 20оС и освещенности 5000 лк в течение 16 ч и затем в темноте в течение 8 ч при постоянном перемешивании при вращении мешалки со скоростью 110 об/мин. После инкубации в течение 3 нед суспензию фильтруют, получая в результате 30 мг клеток в расчете на сухое вещество.
Полученные клетки погружают на 2 мин в раствор изопропанола при 80-90оС и затем суспендируют их в растворе, содержащем 2 мас.ч. хлороформа на 1 мас. ч. метанола. Экстракт фильтруют, высушивают и подвергают очистке таким же образом, как это описано в примере 1. В результате получают 4,7 мг липидной фракции, т.е. 15,6 мас. в расчете на исходное количество сухих клеток. Липидную фракцию подвергают переэтерефикации с помощью ацетилхлорида, и образующиеся метиловые эфиры экстрагируют гексаном. В результате после разделения получают 0,40 мг метиларахидоната, т.е. 13,2 мг/г сухих клеток, и 0,06 мг метилэйкозапентаноата, т.е. 2,1 мг/г сухих клеток.
Реферат
Использование: биотехнология, культивирование клеток и тканей растений, биохимия, фармакология. Сущность изобретения: полиненасыщенные жирные кислоты получают при экстракции культивируемой биомассы клеток ряда видов мха на питательных средах, основанных на прописи Мурасеге-Скуга. 2 з.п. ф-лы.

Комментарии