Способ биокаталитического окисления с применением продукта гена alkl - RU2573900C2
Код документа: RU2573900C2
Чертежи



















Описание
Область изобретения
Настоящее изобретение относится к биокаталитическому способу окисления органических соединений с применением продукта гена alkL, а также микроорганизмам, применяемым в этом способе.
Уровень техники
Ген alkL содержится, например, в плазмиде ОСТ из Pseudomonas putida. Кроме того, эта плазмида кодирует генные продукты, отвечающие за деградацию алканов.
Эти гены деградации алканов расположены на плазмиде ОСТ Pseudomonas в двух alk-оперонах; первый кодирует генные продукты AlkB, AlkF, AlkG, AIkH, AlkJ, AlkK и AlkL, а второй AlkS и AlkT, причем AlkS осуществляет регуляторное воздействие на экспрессию первого alk-оперона. Подробный обзор и функция прочих генов этих alk-оперонов приведены в публикации Chen et al., J Bacteriol. 1995 Dec, 177(23): 6894-901.
Кроме того, из европейского патента ЕР 277674 известен микробиологический способ терминального гидроксилирования аполярных алифатических соединений с 6-12 атомами углерода, как, например, синтез 1-октанола, посредством микроорганизмов из рода Pseudomonas putida, которые устойчивы к аполярным фазам, причем в числе прочего применяют содержащую ген alkL плазмиду pGEc47, которая также несет оба alk-оперона из Pseudomonas putida. Ген alkL находится под контролем нативного промотора оперона, и поэтому транскрипция и трансляция его осуществляются совместно с alkB, alkF, alkG, alkH, alkJ и alkK.
В международной заявке W02002022845 описан способ синтеза N-бензил-4-гидроксипиперидина путем гидроксилирования N-бензил-4-пиперидина клетками Е. coli, которые несут вышеуказанную плазмиду pGEc47.
В европейском патенте ЕР 0502524 изложено описание микробиологического способа терминального гидроксилирования этиловых групп на ароматических 5-членных или 6-членных гетероциклах с помощью выработки различных генных продуктов alk-оперонов, например, через плазмиду pGEc41, которая кодирует продукты генов alkB, alkG, alkH, alkT и alkS, но не alkL. В той же заявке дополнительно описана плазмида pGMK921, которая, как и pGEc41, содержит гены alkB, alkG, alkH, alkT и alkS - но не alkL - экспрессия которых, однако, возможна не только индукцией нативного промотора алканами, но и благодаря индукции промотора tac IPTG (смотрите также патент США US 5306625).
Schneider et al. описывают в публикации Appi Environ Microbiol. 1998 Oct; 64(10): 3784-90 биоконверсию насыщенных жирных кислот в их ω-1-, ω-2- и ω-3-гидрокси-жирные кислоты в Е. coli с помощью цитохром P-450BM-3-монооксигеназы и вышеупомянутой плазмиды pGEc47.
Favre-Bulle et al. в публикации Nature Bio/Technology 9, 367-371 (April 1991) описывают способ синтеза 1-октановой кислоты путем биотрансформации октана с помощью используемой как биокатализатор бактерии Е. coli, несущей pGEc47. В описанном способе происходит полная экспрессия обоих alk-оперонов.
Ту же цель преследуют Rothen et al. в публикации Biotechnol Bioeng. 1998 May 20; 58(4): 356-65.
Недостаток изобретений, описанных в уровне техники, состоит в том, что применяемые в качестве биокатализатора клетки избыточным образом вырабатывают генные продукты, не вносящие существенный вклад в желательный процесс окисления, и, таким образом, производительность клеток снижается.
Кроме того, у ненужных продуктов генов alk, синтезируемых параллельно, имеется, возможно, нежелательная ферментативная активность, которая отрицательно сказывается на формировании желательного продукта, например, из-за того, что промежуточный продукт расходуется на нежелательные побочные продукты. При желательном ω-гидроксилировании органического остатка продукт гена alkJ ведет к образованию соответствующего альдегида. Если же при этом присутствует, например, продукт гена alkH, то происходит дальнейшее окисление образующегося альдегида до карбоновой кислоты.
Так, в европейском патенте ЕР 0502524 для создания желательного гидроксилированного продукта процесса необходимы только продукты генов alkB, alkG и alkT, в силу чего, например, гены alkF, alkJ, alkH и alkS излишни. Кроме того, неблагоприятно то, что синтез прочих продуктов генов alk задает высокие требования к метаболическим возможностям организма-хозяина. AlkJ, например, представляет собой FAD-содержащий фермент (Chen et al., J. Bacteriol, (1995), 6894-6901). Пул FAD хозяина, однако, уже нагружен обязательной выработкой alkT, который также содержит FAD. Поскольку способность к синтезу FAD, например, у Е. coli ограничена, и также необходима для жизненного обмена веществ клетки, при ненужной выработке alkJ получается нагрузка на клетку, и этой нагрузки можно избежать.
Далее, продукты генов alkB, alkJ и alkH зафиксированы на цитоплазматической мембране или ассоциированы с цитоплазматической мембраной. В этой области располагается также и дыхательная цепь. Избыточная выработка мембранных белков приводит к изменениям в клеточной мембране, вплоть до отделения мембранных везикул, которые мигрируют в цитозоль (Nieboer et al., Molecular Microbiology (1993) 8(6), 1039-1051).
Это, в конце концов, приводит к преждевременному лизису клеток (Wubbolts et al., Biotechnolgy and Bioengineering (1996), Vol 52, 301-308), причем как раз там, где для промышленных процессов крайне необходима ферментация при высокой плотности клеток.
Аналогичным образом в публикации Schneider et al. происходит излишний параллельный синтез продуктов генов alkB, alkF, alkG, alkH, alkJ, alkK, alkS и alkT, поскольку фермент, собственно, применяемый для желательной реакции, - это цитохро-P-450BM-3-монооксигеназа.
Применительно к промышленным процессам использование кодируемых плазмидами метаболических путей затруднительно. С увеличением объема ферментатора применение антибиотиков для поддержания давления отбора, которое улучшает стабильность плазмиды, во-первых, становится очень дорогим, а во-вторых, критичным в связи с проблемой сточных вод. Поэтому крупномасштабные ферментации почти всегда проходят без какого-либо введения антибиотиков.
Тем не менее для обеспечения генетической стабильности искусственных окислительных метаболических путей, желательна интеграция используемых генов в геном микроорганизма-хозяина. Достичь этой цели тем проще, чем меньше подлежащая интеграции генная конструкция. Поскольку рассматриваемый здесь минимальный генный комплект alkBGTL уже весьма велик, необходимо избегать какой-либо иной нуклеотидной последовательности, применение которой не является категорически обязательным.
Помимо уменьшения объема необходимых молекулярно-биологических работ и повышения вероятности успеха конструкция минимального размера также способствует стабильности генома организма-хозяина.
Задача настоящего изобретения состоит в том, чтобы представить способ, который позволяет избежать по меньшей мере одного из упомянутых недостатков нынешнего технического уровня.
Описание изобретения
Неожиданно было обнаружено, что описанный далее способ и генетически модифицированные клетки вносят определенный вклад в решение поставленной задачи.
Поэтому объектами настоящего изобретения являются способ получения окисленного органического вещества с применением продукта гена alkL, как описано в пункте 1 формулы изобретения, а также применяемые при реализации этого способа рекомбинантные клетки.
Также объектом настоящего изобретения является применение продукта гена alkL для повышения скорости окисления.
Преимущества состоят в оптимальном использовании имеющихся при реализации способа ресурсов, например, в том, что касается клеточного метаболизма, особенно в условиях ферментации с высокой плотностью клеток.
Настоящее изобретение описывает способ окисления органического вещества с применением по меньшей мере одного окисляющего фермента и по меньшей мере одного продукта гена alkL, отличающийся тем, что продукт гена alkL обеспечивается независимо от по меньшей мере еще одного генного продукта, кодируемого содержащим ген alkL alk-опероном.
Описанные в связи с настоящим изобретением гены alk кодируют белковые последовательности, которые аналогично обозначают как AlkX. Если одновременно описывают несколько генов alkX, alkY и alkZ, то применяют номенклатуру alkXYZ, а для белков - аналогичным образом AlkXYZ.
Под понятием «окисление органического вещества» в связи с настоящим изобретением подразумевают, например, гидроксилирование или эпоксидирование, реакцию спирта с преобразованием в альдегид или кетон, преобразование альдегида в карбоновую кислоту или гидратацию двойной связи. Равным же образом это понятие охватывает многоэтапные окислительные процессы, которые, в частности, можно реализовать благодаря применению нескольких окисляющих ферментов, как, например, гидроксилирование алкилового остатка в нескольких местах, например в ω-положении и в ω-1-положении, катализируемое различными монооксигеназами.
Под формулировкой «с применением по меньшей мере одного окисляющего фермента и по меньшей мере одного продукта гена alkL» в связи с настоящим изобретением подразумевают целенаправленное обеспечение ферментов и генных продуктов, а именно в той форме, в которой каждый отдельный фермент или генный продукт, рассматриваемый как таковой, в природе отсутствует. Это можно осуществить, например, путем гетерологической выработки или избыточной выработки применяемых белков в клетке или путем представления по меньшей мере частично очищенных белков; в это понятие включается также, однако, и измененное окружение по сравнению с ферментом, встречающимся в природе, например, так, что естественная клетка, содержащая фермент, подверглась модификации, таким образом, что она, например, вырабатывает определенные другие белки в измененном виде, как, например, в меньшей или большей степени несущие точечные мутации.
Под термином «продукт гена alkL» в связи с настоящим изобретением подразумевают белки, которые удовлетворяют по меньшей мере одному из двух нижеследующих условий.
1.) Белок идентифицируется как член надсемейства белков OmpW (семейство белков 3922 в «Банке данных консервативных доменов» (Conserved Domain Database, CDD) Национального центра биотехнологической информации (National Center for Biotechnology Information, NCBI)), причем это соответствие определяют путем совмещения аминокислотной последовательности белка с записями в банке данных CDD NCBI, размещенных до 22.03.2010, с использованием стандартных поисковых параметров, значение е менее 0,01 и с применением алгоритма „blastp 2.2.23+",
2.) при поиске белкового домена, содержащего данную аминокислотную последовательность, в NCBI CDD (версия 2.20) с помощью RPS-BLAST присутствие консервативного домена „OmpW, внешний мембранный белок W" (COG3047) определяется со значением е менее 1×10-5 (.”domain hit”).
Под формулировкой «обеспечивают независимо от по меньшей мере еще одного генного продукта, кодируемого содержащим ген alkL alk-опероном» в контексте настоящего изобретения подразумевают обеспечение продукта гена alkL, независимое от по меньшей мере еще одного продукта гена alk, который во встречающейся в природе форме связан с возникновением продукта гена alkL. Например, в опероне, включающем в себя гены alkBFGHJKL, продукты генов alk, в каждом случае от alkBFGHJ и К, связаны с образованием продукта гена alkL, поскольку их обеспечивает один и тот же промотор.
Все указанные данные в процентах (%), если не указано иное, представляют собой проценты по массе.
В зависимости от используемого окисляющего фермента способ согласно изобретению можно применять для окисления любых органических веществ, которые этот окисляющий фермент принимают в качестве субстрата; предпочтительные органические вещества выбраны из группы, в состав которой входят, а предпочтительно - которую образуют
разветвленные или неразветвленные, предпочтительно неразветвленные,
насыщенные или ненасыщенные, предпочтительно ненасыщенные,
при необходимости замещенные
алканы, алкены, алкины, спирты, альдегиды, кетоны, карбоновые кислоты, сложные эфиры карбоновых кислот, амины и эпоксиды,
причем они включают в себя предпочтительно от 3 до 22, в особенности от 6 до 18, еще более предпочтительно от 8 до 14, в особенности 12 атомов углерода.
Особенно предпочтительные органические вещества при реализации способа согласно изобретению выбраны из группы, в состав которой входят, а предпочтительно - которую образуют
карбоновые кислоты и их соответствующие сложные эфиры, в частности, с 3-22, предпочтительно с 6-18, особенно предпочтительно - с 8-14, атомами углерода, в особенности карбоновые кислоты алканов, в частности неразветвленные карбоновые кислоты алканов, в особенности лауриновая кислота и ее эфиры, в частности метиловый и этиловый эфиры лауриновой кислоты, декановая кислота, эфиры декановой кислоты, миристиновая кислота и эфиры миристиновой кислоты,
незамещенные алканы с 3-22, предпочтительно с 6-18, особенно предпочтительно с 8-14 атомами углерода, предпочтительно неразветвленные, в особенности выбранные из группы, в состав которой входят, а предпочтительно - которую образуют, октан, декан, додекан и тетрадекан,
незамещенные алкены с 3-22, предпочтительно с 6-18, особенно предпочтительно с 8-14 атомами углерода, предпочтительно неразветвленные, в особенности выбранные из группы, в состав которой входят, а предпочтительно - которую образуют, транс-окт-1-ен, транс-нон-1-ен, транс-дец-1-ен, транс-ундец-1-ен, транс-додец-1-ен, транс-тридец-1-ен, транс-тетраде-1-цен, цис-окт-1-ен, цис-нон-1-ен, цис-дец-1-ен, цис-ундец-1-ен, цис-додец-1-ен, цис-тридец-1-ен, цис-тетраде-1-цен, транс-окт-2-ен, транс-нон-2-ен, транс-дец-2-ен, транс-ундец-2-ен, транс-додец-2-ен, транс-тридец-2-ен и транс-тетрад ец-2-ен, транс-окт-3-ен, транс-нон-3-ен, транс-дец-3-ен, транс-ундец-3-ен, транс-додец-3-ен, транс-тридец-3-ен и транс-тетрадец-3-ен, транс-окт-4-ен, транс-нон-4-ен, транс-дец-4-ен, транс-ундец-4-ен, транс-додец-4-ен, транс-тридец-4-ен, транс-тетрадец-4-ен, транс-дец-5-ен, транс-ундец-5-ен, транс-додец-5-ен, транс-тридец-5-ен, транс-тетрадец-5-ен, транс-додец-6-ен, транс-тридец-6-ен, транс-тетрадец-6-ен и транс-тетрадец-7-ен,
особенно предпочтительно в состав которой входят транс-окт-1-ен, транс-дец-1-ен, транс-додец-1-ен, транс-тетраде-1-цен, цис-окт-1-ен, цис-дец-1-ен, цис-додец-1-ен, цис-тетраде-1-цен, транс-окт-2-ен, транс-дец-2-ен, транс-додец-2-ен и транс-тетрадец-2-ен, транс-окт-3-ен, транс-дец-3-ен, транс-додец-3-ен и транс-тетрадец-3-ен, транс-окт-4-ен, транс-дец-4-ен, транс-додец-4-ен, транс-тетрадец-4-ен, транс-дец-5-ен, транс-додец-5-ен, транс-тетрадец-5-ен, транс-додец-6-ен, транс-тетрадец-6-ен и транс-тетрадец-7-ен,
незамещенные одноатомные спирты с 3-22, предпочтительно с 6-18, особенно предпочтительно с 8-14 атомами углерода, предпочтительно неразветвленные, в особенности выбранные из группы, в состав которой входят, а предпочтительно - которую образуют, 1-октанол, 1-нонанол, 1-деканол, 1-ундеканол, 1-додеканол, 1-тридеканоли 1-тетрадеканол,
особенно предпочтительно в состав которой входят 1-октанол, 1-деканол, 1-додеканоли 1-тетрадеканол,
незамещенные альдегиды с 3-22, предпочтительно с 6-18, особенно предпочтительно с 8-14 атомами углерода, предпочтительно неразветвленные, в особенности выбранные из группы, в состав которой входят, а предпочтительно - которую образуют, октаналь, нонаналь, деканаль, додеканаль и тетрадеканаль,
незамещенные одноатомные амины с 3-22, предпочтительно с 6-18, особенно предпочтительно с 8-14 атомами углерода, предпочтительно неразветвленные, в особенности выбранные из группы, в состав которой входят, а предпочтительно - которую образуют, 1-амино-октан, 1-амино-нонан, 1-амино-декан, 1-амино-ундекан, 1-амино-додекан, 1-амино-тридекан и 1-амино-тетрадекан,
особенно предпочтительно в состав которой входят 1-амино-октан, 1-амино-декан, 1-амино-додекан и 1-амино-тетрадекан,
а также замещенные соединения, которые, в частности, в качестве прочих заместителей несут одну или несколько гидроксигрупп, аминных групп, кетогрупп, карбоксильных, циклопропильных групп или эпоксигрупп, в особенности выбранные из группы, в состав которой входят, а предпочтительно - которую образуют, 1,8-октандиол, 1,9-нонандиол, 1,10-декандиол, 1,11-ундекандиол, 1,12-додекандиол, 1,13-тридекандиол, 1,14-тетрадекандиол, 8-амино-[1-октанол], 9-амино-[1-нонанол], 10-амино-[1-додеканол], 11-амино-[1-ундеканол], 12-амино-[1-додеканол], 13-амино-[1-тридеканол], 14-амино-[1-тетрадеканол], 8-гидрокси-[1-октаналь], 9-гидрокси-[1-нонаналь], 10-гидрокси-[1-деканаль], 11-гидрокси-[1-ундеканаль], 12-гидрокси-[1-додеканаль], 13-гидрокси-[1-тридеканаль], 14-гидрокси-[1-тетрадеканаль], 8-амино-[1-октаналь], 9-амино-[1-нонаналь], 10-амино-[1-деканаль], 11-амино-[1-ундеканаль], 12-амино-[1-додеканаль], 13-амино-[1-тридеканаль], 14-амино-[1-тетрадеканаль],
8-гидрокси-[1-октановая кислота], 9-гидрокси-[1-нонановая кислота], 10-гидрокси-[1-декановая кислота], 11-гидрокси-[1-ундекановая кислота], 12-гидрокси-[1-додекановая кислота], 13-гидрокси-[1-ундекановая кислота], 14-гидрокси-[1-тетрадекановая кислота], метиловый эфир 8-гидрокси-[1-октановой кислоты], метиловый эфир 9-гидрокси-[1-нонановой кислоты], метиловый эфир 10-гидрокси-[1-декановой кислоты], метиловый эфир 11-гидрокси-[1-ундекановой кислоты], метиловый эфир 12-гидрокси-[1-додекановой кислоты], метиловый эфир 13-гидрокси-[1-ундекановой кислоты], метиловый эфир 14-гидрокси-[1-тетрадекановой кислоты], этиловый эфир 8-гидрокси-[1-октановой кислоты], этиловый эфир 9-гидрокси-[1-нонановой кислоты], этиловый эфир 10-гидрокси-[1-декановой кислоты], этиловый эфир 11-гидрокси-[1-ундекановой кислоты], этиловый эфир 12-гидрокси-[1-додекановой кислоты], этиловый эфир 13-гидрокси-[1-ундекановой кислоты], этиловый эфир 14-гидрокси-[1-тетрадекановой кислоты],
особенно предпочтительно в состав которой входят 1,8-октандиол, 1,10-декандиол, 1,12-додекандиол, 1,14-тетрадекандиол, 8-амино-[1-октанол], 10-амино-[1-додеканол], 12-амино-[1-додеканол], 14-амино-[1-тетрадеканол], 8-гидрокси-[1-октаналь], 10-гидрокси-[1-деканаль], 12-гидрокси-[1-додеканаль], 14-гидрокси-[1-тетрадеканаль], 8-амино-[1-октаналь], 10-амино-[1-деканаль], 12-амино- [1-додеканаль], 14-амино-[1-тетрадеканаль],
8-гидрокси-[1-октановая кислота], 10-гидрокси-[1-декановая кислота], 12-гидрокси-[1-додекановая кислота], 14-гидрокси-[1-тетрадекановая кислота], метиловый эфир 8-гидрокси-[1-октановой кислоты], метиловый эфир 10-гидрокси-[1-декановой кислоты], метиловый эфир 12-гидрокси-[1-додекановой кислоты], метиловый эфир 14-гидрокси-[1-тетрадекановой кислоты], этиловый эфир 8-гидрокси-[1-октановой кислоты], этиловый эфир 10-гидрокси-[1-декановой кислоты], этиловый эфир 12-гидрокси-[1-додекановой кислоты] и этиловый эфир 14-гидрокси-[1-тетрадекановой кислоты].
Причем лауриновая кислота и ее эфиры, в особенности метиловый и этиловый эфиры лауриновой кислоты, особенно предпочтительны.
Посредством способа согласно изобретению можно изготовить различные продукты окисления в зависимости от применяемого окисляющего фермента и применяемого органического вещества, в особенности спирты, альдегиды, кетоны и карбоновые кислоты.
Эти продукты окисления можно, например, получать посредством способа согласно изобретению путем преобразования одного из перечисленных ниже органических веществ следующим образом:
алкана, алкена, алкина в спирт (например, с помощью монооксигеназы);
спирта в альдегид (например, посредством алькогольдегидрогеназы или алкогольоксидазы);
спирта в кетон (например, посредством алькогольдегидрогеназы или алкогольоксидазы);
альдегида в карбоновую кислоту (например, посредством альдегиддегидрогеназы);
эпоксида в циангидрин (например, посредством галогидрин-дегалогеназы).
В связи с этим предпочтительно изготовление посредством способа согласно изобретению спиртов и альдегидов, предпочтительно спиртов, в особенности ω-спиртов, крайне предпочтительно - ω-гидроксикарбоновых кислот, в особенности в виде реакции гидроксилирования.
При реализации способа согласно изобретению органические вещества, в особенности карбоновые кислоты и эфиры карбоновых кислот, можно выгодным образом окислять в ω-положении.
При реализации способа согласно изобретению можно применять все известные специалисту окисляющие ферменты, поскольку функция представленного продукта гена alkL от этого не зависит. Такие ферменты в достаточной мере известны специалисту под названием «оксидоредуктаза» и приведены в систематической номенклатуре Комиссии по ферментам Международного союза биохимии и молекулярной биологии (International Union of Biochemistry and Molecular Biology) в классе ферментов ЕС 1.X.X.X.
В качестве окисляющего фермента при реализации способа согласно изобретению предпочтительно применяют алканмонооксигеназу, ксилолмонооксигеназу, альдегиддегидрогеназу, алкогольоксидазу или алкогольдегидрогеназу, предпочтительно - алканмонооксигеназу.
Ген, подходящий для ксилолмонооксигеназы, - это, например, ген xylM или xylA, причем плазмида, содержащая оба этих гена, в банке генов представлена под номером доступа M37480.
Особенно предпочтительная алканмонооксигеназа в связи с этим отличается тем, что она представляет собой цитохром-P450-монооксигеназу, в особенности цито-хром-P450-монооксигеназу из дрожжей, в частности Pichia, Yarrowia и Candida, например H3Candida tropicalis или Candida maltosa, или же из растений, например из Cicer arietinum L., или же из млекопитающих, например из Rattus norvegicus, в особенности CYP4A1. Генные последовательности подходящих цитохром-Р450-монооксигеназ из Candida tropicalis раскрыты, например, в международной заявке на патент WO-A-00/2056, в то время как генные последовательности подходящих цитохром-Р450-монооксигеназ из турецкого гороха приведены, например, у Barz et al. в „Cloning and characterization of eight cytochrome P450 cDNAs from chickpea (Cicer arietinum L.) cell suspension cultures". Plant Science, Vol.155, стр.101-108 (2000).
Еще одна предпочтительная алканмонооксигеназа кодируется геном alkB alk-оперона из Pseudomonas putida GPo1.
Изоляция генной последовательности alkB описана, например, van Beilen et al. в публикации „Functional Analysis of Alkane Hydroxylases from Gram-Negative and Gram-Positive Bacteria", Journal of Bacteriology, Vol.184 (6), стр.1.733-1.742 (2002). Информация о прочих гомологах гена alkB приведена также у van Beilen et al. в „Oil & Gas Science and Technology", Vol.58 (4), стр.427-440 (2003).
Прочие предпочтительные алканмонооксигеназы - это такие продукты гена alkB, которые кодируются генами alkB из организмов, выбранных из группы грамотрицательных бактерий, в особенности из группы псевдомонад, из рода Pseudomonas, в особенности Pseudomonas mendocina, из рода Oceanicaulis, предпочтительно Oceanicaulis alexandrii HTCC2633, из рода Caulobacter, предпочтительно Caulobacter sp.K31, из рода Marinobacter, предпочтительно Marinobacter aquaeolei, особенно предпочтительно Marinobacter aquaeolei VT8, из рода Alcanivorax, предпочтительно Alcanivorax borkumensis, из рода Acetobacter, Achromobacter, Acidiphilium, Acidovorax, Aeromicrobium, Alkalilimnicola, Alteromonadales, Anabaena, Aromatoleum, Azoarcus, Azospirillum, Azotobacter, Bordetella, Bradyrhizobium, Burkholderia, Chlorobium, Citreicella, Clostridium, Colwellia, Comamonas, Conexibacter, Congregibacter, Corynebacterium, Cupriavidus, Cyanothece, Delftia, Desulfomicrobium, Desulfonatronospira, Dethiobacter, Dinoroseobacter, Erythrobacter, Francisella, Glaciecola, Gordonia, Grimontia, Hahella, Haloterrigena, Halothiobacillus, Hoeflea, Hyphomonas, Janibacter, Jannaschia, Jonquetella, Klebsiella, Legionella, Limnobacter, Lutiella, Magnetospirillum, Mesorhizobium, Methylibium, Methylobacterium, Methylophaga, Mycobacterium, Neisseria, Nitrosomonas, Nocardia, Nostoc, Novosphingobium, Octadecabacter, Paracoccus, Parvibaculum, Parvularcula, Peptostreptococcus, Phaeobacter, Phenylobacterium, Photobacterium, Polaromonas, Prevotella, Pseudoalteromonas, Pseudovibrio, Psychrobacter, Psychroflexus, Ralstonia, Rhodobacter, Rhodococcus, Rhodoferax, Rhodomicrobium, Rhodopseudomonas, Rhodospirillum, Roseobacter, Roseovarius, Ruegeria, Sagittula, Shewanella, Silicibacter, Stenotrophomonas, Stigmatella, Streptomyces, Sulfitobacter, Sulfurimonas, Sulfurovum, Synechococcus, Thalassiobium, Thermococcus, Thermomonospora, Thioalkalivibrio, Thiobacillus, Thiomicrospira, Thiomonas, Tsukamurella, Vibrio или Xanthomonas, причем таковые из Alcanivorax borkumensis, Oceanicaulis alexandrii HTCC2633, Caulobacter sp. K31 и Marmobacter aquaeolei VT8 особенно предпочтительны. В связи с этим целесообразно, если дополнительно к AlkB имеются продукты генов alkG и alkT; это могут быть либо генные продукты, которые можно изолировать из организма, привносящего продукт гена alkB, либо же это могут быть alkG и alkT из Pseudomonas putida GPol.
Предпочтительная алкогольдегидрогеназа - это фермент, кодируемый геном alkJ (ЕС 1.1.99.8), в особенности кодируемый геном alkJ-Gen фермент из Pseudomonas putida GPol (van Beilen et al. Molecular Microbiology, (1992) 6(21), 3121-3136). Генные последовательности генов alkJ из Pseudomonas putida GPo1, Alcanivorax borkumensis, Bordetella parapertussis, Bordetella bronchiseptica или из Roseobacter denitrificans приведены, например, в банке данных генов KEGG (Kyoto Encyclopedia of Genes and Genomes). Прочие предпочтительные алкогольдегидрогеназы - это те, которые кодируются генами alkJ из организмов, выбранных из группы грамотрицательных бактерий, в особенности из группы псевдомонад, из рода Pseudomonas, в особенности Pseudomonas mendocina, из рода Oceanicaulis, предпочтительно Oceanicaulis alexandrii HTCC2633, из рода Caulobacter, предпочтительно Caulobacter sp. K31, из рода Marinobacter, предпочтительно Marinobacter aquaeolei, особенно предпочтительно Marinobacter aquaeolei VT8, из рода Alcanivorax, предпочтительно Alcanivorax borkumensis, из рода Acetobacter, Achromobacter, Acidiphilium, Acidovorax, Aeromicrobium, Alkalilimnicola, Alteromonadales, Anabaena, Aromatoleum, Azoarcus, Azospirillum, Azotobacter, Bordetella, Bradyrhizobium, Burkholderia, Chlorobium, Citreicella, Clostridium, Colwellia, Comamonas, Conexibacter, Congregibacter, Corynebacterium, Cupriavidus, Cyanothece, Delftia, Desulfomicrobium, Desulfonatronospira, Dethiobacter, Dinoroseobacter, Erythrobacter, Francisella, Glaciecola, Gordonia, Grimontia, Hahella, Haloterrigena, Halothiobacillus, Hoeflea, Hyphomonas, Janibacter, Jannaschia, Jonquetella, Klebsiella, Legionella, Limnobacter, Lutiella, Magnetospirillum, Mesorhizobium, Methylibium, Methylobacterium, Methylophaga, Mycobacterium, Neisseria, Nitrosomonas, Nocardia, Nostoc, Novosphingobium, Octadecabacter, Paracoccus, Parvibaculum, Parvularcula, Peptostreptococcus, Phaeobacter, Phenylobacterium, Photobacterium, Polaromonas, Prevotella, Pseudoalteromonas, Pseudovibrio, Psychrobacter, Psychroflexus, Ralstonia, Rhodobacter, Rhodococcus, Rhodoferax, Rhodomicrobium, Rhodopseudomonas, Rhodospirillum, Roseobacter, Roseovarius, Ruegeria, Sagittula, Shewanella, Silicibacter, Stenotrophomonas, Stigmatella, Streptomyces, Sulfitobacter, Sulfurimonas, Sulfurovum, Synechococcus, Thalassiobium, Thermococcus, Thermomonospora, Thioalkalivibrio, Thiobacillus, Thiomicrospira, Thiomonas, Tsukamurella, Vibrio или Xanthomonas.
Предпочтительные продукты гена alkL, применяемые при реализации способа согласно изобретению, отличаются тем, что выработка продукта гена alkL в нативном организме-хозяине индуцируется дициклопропилкетоном; в связи с этим также предпочтительно, чтобы происходила экспрессия гена alkL как части группы генов, например, в регулоне, как, например, в опероне.
Продукты гена alkL, применяемые при реализации способа согласно изобретению, предпочтительно кодируются генами alkL из организмов, выбранных из группы грамотрицательных бактерий, в особенности из группы, включающей в себя, а предпочтительно - состоящей из псевдомонад, в особенности Pseudomonas putida, в частности Pseudomonas putida GPo1 и P1, Azotobacter, Desulfitobacterium, Burkholderia, предпочтительно Burkholderia cepacia, Xanthomonas, Rhodobacter, Ralstonia, Delftia и Rickettsia, рода Oceanicaulis, предпочтительно Oceanicaulis alexandriii HTCC2633, рода Caulobacter, предпочтительно Caulobacter sp. K31, рода Marinobacter, предпочтительно Marinobacter aquaeolei, особенно предпочтительно Marinobacter aquaeolei VT8 и рода Rhodopseudomonas.
Выгодно, чтобы продукт гена alkL имел происхождением другой организм, нежели применяемый согласно изобретению окисляющий фермент.
В связи с этим крайне предпочтительные продукты гена alkL кодируются генами alkL из Pseudomonas putida GPol и PI, которые отображаются последовательностями Seq ID №1 и Seq ID №3, а также белками с полипептидной последовательностью Seq ID №2 или Seq ID №4 или с полипептидной последовательностью, у которой вплоть до 60%, предпочтительно до 25%, особенно предпочтительно до 15%, в особенности 10, 9, 8, 7, 6, 5, 4, 3, 2, 1% аминокислотных остатков изменены в сравнении с Seq ID №2 или Seq ID №4 делецией, инсерцией, замещением или сочетанием таковых, и которые еще обладают по меньшей мере 50%, предпочтительно 65%, особенно предпочтительно 80%, в особенности более 90%, активности белка с соответствующей исходной последовательностью Seq ID №2 или Seq ID №4, причем под 100% активности исходного белка подразумевают повышение активности применяемых в качестве биокатализатора клеток, то есть количество вещества, проходящего реакцию за единицу времени, нормированное на применяемое количество клеток (единиц на грамм сухой клеточной массы [ЕД/г сухой клеточной массы]) в сравнении с активностью биокатализатора в отсутствие исходного белка, причем в такой системе, какая описана в примерах выполнения настоящего изобретения, где в качестве окисляющих ферментов применяют генные продукты alkBGT из Р. putida GPo1 для преобразования метилового эфира лауриновой кислоты в метиловый эфир 12-гидроксилауриновой кислоты в клетке Е. coli. Оптимальный метод для определения скорости окисления приведен в примерах выполнения настоящего изобретения.
Для определения единиц в данном случае используют обычное в ферментативной кинетике определение. 1 единица биокатализатора преобразует в продукт 1 мкмоль субстрата в минуту.
1 ЕД = 1 мкмоль/мин
Изменения аминокислотных остатков данной полипептидной последовательности, которые не приводят к каким-либо существенным изменениям свойств или функции данного полипептида, известны специалисту. Так, например, некоторые аминокислоты можно без каких-либо сложностей менять на другие; примеры таких подходящих замен аминокислот следующие: Ala на Ser; Арr на Lys; Asn на Gln или His; Asp на Glu; Cys на Ser; Gln на Asn; Glu на Asp; Gly на Pro; His на Asn или Gln; Ile на Leu или Val; Leu на Met или Val; Lys на Arg, или Gln, или Glu; Met на Leu или Ile; Phe на Met, или Leu, или Tyr; Ser на Thr; Thr на Ser; Trp на Tyr; Tyr на Trp или Phe; Val на Ile или Leu. Равным же образом известно, что изменения (в особенности на N- или C-конце полипептида) в форме, например, инсерций или делеций аминокислот часто не оказывают никакого существенного влияния на функцию полипептида.
Предпочтительный согласно изобретению способ отличается тем, что другой генный продукт выбирают по меньшей мере из одного из группы, состоящей из AlkB, AlkF, AlkG, AIkH, AlkJ и AlkK,
в особенности состоящей из AlkF, AlkG, AIkH, AlkJ и AlkK,
причем другие генные продукты, в частности, выбраны из группы, содержащей, а предпочтительно - состоящей из генных комбинаций:
alkBF, alkBG, alkFG, alkBJ, alkFJ, alkGJ, alkBH, alkFH, alkGH, alkJH, alkBK, alkFK, alkGK, alkJK, alkHK, alkBFG, alkBFJ, alkBFH, alkBFK, alkBGJ, alkFGJ, alkBGH, alkFGH, alkBGK, alkFGK, alkBJH, alkFJH, alkGJH, alkBJK, alkFJK, alkGJK, alkFHK, alkBHK, alkFHK, alkGHK, alkBGJH, alkBGJK, alkBGHK, alkBFGJ, alkBFGH, alkFGJH, alkBFGK, alkFGJK, alkGJHK, alkBFJH, alkBFJK, alkFJHK, alkBFHK, alkBFGJH, alkBFGJK и alkBFGJHK,
в особенности alkFHJK и alkBFGHJK.
Для способа согласно изобретению выгодно, чтобы окисляющий фермент и продукт гена alkL были обеспечены микроорганизмом. При этом оба фермента можно подготавливать в каждом случае по отдельности в каждом случае в одном микроорганизме либо же совместно в одном и том же микроорганизме, причем последнее предпочтительно. Следовательно, предпочтительный способ согласно изобретению отличается тем, что его реализуют по меньшей мере в одном микроорганизме, обеспечивающем окисляющий фермент и продукт гена alkL, или в среде, окружающей такой по меньшей мере один микроорганизм.
В связи с этим предпочтительно, чтобы окисляющий фермент и продукт гена alkL по меньшей мере в одном микроорганизме обеспечивались рекомбинантным образом.
Нижеследующее изложение, касающееся рекомбинантной выработки, относится как к окисляющему ферменту, так и к продукту гена alkL.
В принципе, повышения рекомбинантной выработки можно добиться, увеличивая количество копий генетической последовательности или генетических последовательностей, которые кодируют белок, применяя модифицированный промотор, изменяя использование кодонов гена, повышая различным образом время полуобмена мРНК или фермента, модифицируя регуляцию экспрессии гена или используя ген или аллель, кодирующие соответствующий фермент с повышенной активностью, а также при необходимости сочетая эти меры. Клетки с таким генным оснащением создают, например, путем трансформации, трансдукции, конъюгации или сочетания этих методов с вектором, который содержит желательный ген, аллель этого гена или их части и промотор, дающий возможность экспрессии гена. Возможность гетерологической экспрессии получают, в частности, путем интеграции гена или аллелей в хромосому клетки или в вектор с внехромосомной репликацией.
Обзор возможностей для рекомбинантной выработки в клетках на примере изоцитратлиазы представлен в европейском патенте EP 0839211, который настоящим введен как ссылка и содержание публикации которого в отношении возможностей для рекомбинантной выработки в клетках образует составную часть изложения настоящего изобретения.
Представление, либо же выработку, либо же экспрессию вышепоименованных и всех приведенных ниже белков или генов можно продемонстрировать с помощью одномерного или двухмерного гель-электрофореза с последующим оптическим определением концентрации белка в геле с помощью соответствующего аналитического программного обеспечения. Если обнаруженная экспрессионная мощность основана исключительно на повышении экспрессии соответствующего гена, то количественное определение рекомбинантной экспрессии возможно простым образом, путем сравнения результатов одномерного или двухмерного разделения белков в геле у дикого типа и у генетически модифицированной клетки. Известный метод подготовки белковых гелей коринеформных бактерий и идентификации белков - это метод, описанный Hermann et al. (Electrophoresis, 22: 1712.23 (2001). Также можно анализировать концентрацию белков путем гибридизации с использованием вестерн-блоттинга с антителом, специфичным для подлежащего определению белка (Sambrook et al. Molecular Cloning: a laboratory manual, 2nd Ed. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. USA, 1989), и последующей оптической оценки с помощью соответствующего программного обеспечения для измерения концентрации (Lohaus und Meyer (1989) Biospektrum, 5: 32-39; Lottspeich (1999), Angewandte Chemie 111: 2630-2647).
Если рекомбинантную экспрессию обеспечивают повышением интенсивности синтеза белка, то для этого, например, увеличивают количество копий соответствующих генов или вызывают мутацию области промотора или регуляции или участка связывания рибосом, находящегося в последовательности перед структурным геном. Кроме того, с помощью индуцируемых промоторов можно повышать экспрессию в произвольный момент времени. Помимо этого к гену белка можно в качестве регуляторных последовательностей добавить так называемые «энхансеры», которые также вызывают повышение экспрессии гена благодаря более интенсивному взаимодействию между РНК-полимеразой и ДНК. Экспрессию улучшают также меры по продлению срока жизни маточной РНК.
Для повышения рекомбинантной экспрессии определенных генов используют, например, эписомальные плазмиды. В качестве плазмид, либо же векторов, можно, в принципе, использовать все доступные специалисту в этих целях формы исполнения. Информация о таких плазмидах и векторах приведена, например, в брошюрах фирм Novagen, Promega, New England Biolabs, Clontech или Gibco BRL. Прочие предпочтительные плазмиды и векторы можно найти в следующих изданиях: Glover, D.М. (1985), DNA cloning: a practical approach. Vol.I-III, IRL Press Ltd., Oxford; Rodriguez, R.L. and Denhardt, D.Т (eds) (1988, Vectors: a survey of molecular cloning vectors and their uses, 179-204, Butterworth, Stoneham; Goeddel, D.V. (1990), Systems for heterologous gene expression. Methods Enzymol. 185, 3-7; Sambrook, J.; Fritsch, E.F. and Maniatis, T. (1989), Molecular cloning: a laboratory manual, 2nd ed., Cold Spring Harbour Laboratory Press, New York.
Затем плазмидный вектор, содержащий подлежащий амплификации ген, переносят в нужный штамм методом конъюгации или трансформации. Метод конъюгации описан, например, в Schafer et al., Applied and Environmental Microbiology 60: 756-759 (1994). Методы трансформации описаны, например, в Thierbach et al., Applied Microbiology and Biotechnology 29: 356-362 (1988), Dunican und Shivnan, Bio/Technology 7: 1067-1070(1989) и Tauch et al., FEMS Microbiology Letters 123: 343-347 (1994). После гомологической рекомбинации с помощью кроссинговера итоговый штамм содержит по меньшей мере две копии надлежащего гена.
Поэтому при реализации способа согласно изобретению предпочтительно, чтобы применялись рекомбинантные микроорганизмы, ввиду хорошей генетической доступности микроорганизм предпочтительно выбирают из группы бактерий, в особенности грамотрицательных, особенно из группы, включающей в себя, а предпочтительно - состоящей из E. coli, Pseudomonas sp., Pseudomonas fluorescens, Pseudomonas putida, Pseudomonas acidovorans, Pseudomonas aeruginosa, Acidovorax sp., Acidovorax temperans, Acinetobacter sp., Burkholderia sp., Cyanobakterien, Klebsiella sp., Salmonella sp., Rhizobium sp. и Rhizobium meliloti, причем E. coli особенно предпочтительна.
Клетки, используемые в способе согласно изобретению, также являются составной частью настоящего изобретения.
Таким образом, микроорганизмы, которые были генно-инженерным путем изменены так, что они усиленно синтезируют фермент, окисляющий по меньшей мере одно органическое вещество, и по меньшей мере один продукт гена alkL, причем синтез генного продукта alkL происходит независимо от другого, кодируемого содержащим ген alkL alk-опероном, генного продукта, являются предметом настоящего изобретения.
Предпочтительные в данном контексте окисляющие ферменты - это те же окисляющие ферменты, которые предпочтительно применяются при реализации способа согласно изобретению; аналогичное высказывание справедливо применительно к предпочтительным генным продуктам alkL, предпочтительным генным продуктам, кодируемым содержащим ген alkL alk-опероном, предпочтительным органическим веществам, а также предпочтительным микроорганизмам.
Еще один предмет настоящего изобретения - это применение генного продукта alkL, предпочтительно в микроорганизме, для повышения уровня окисления по меньшей мере одного фермента, окисляющего органическое вещество, отличающееся тем, что применение продукта гена alkL осуществляется независимо от другого, кодируемого содержащим ген alkL alk-опероном, генного продукта.
В этом контексте окисление предпочтительно представляет собой окисление органического вещества до альдегида или спирта, в особенности до спирта. Таким образом, в этом контексте предпочтительно повышается скорость гидроксилирования, в особенности в ω-положении у карбоновых кислот, предпочтительно в том, что касается преобразования карбоновых кислот и их эфиров в соответствующие ω-гидроксилированные соединения, в особенности метилового эфира додекановой кислоты в метиловый эфир гидроксидодекановой кислоты.
Предпочтительные в данном контексте окисляющие ферменты - это те же окисляющие ферменты, которые предпочтительно применяются при реализации способа согласно изобретению; аналогичное высказывание справедливо применительно к предпочтительным продуктам генов alkL, предпочтительным генным продуктам, кодируемым содержащим ген alkL alk-опероном, предпочтительным органическим веществам, а также предпочтительным микроорганизмам.
В приведенных ниже примерах настоящее исполнение описано в качестве примеров, причем изобретение, широта применения которого явствует из всего описания и формулы изобретения, не ограничивается формами исполнения, названными в примерах.
Составной частью примеров являются следующие чертежи:
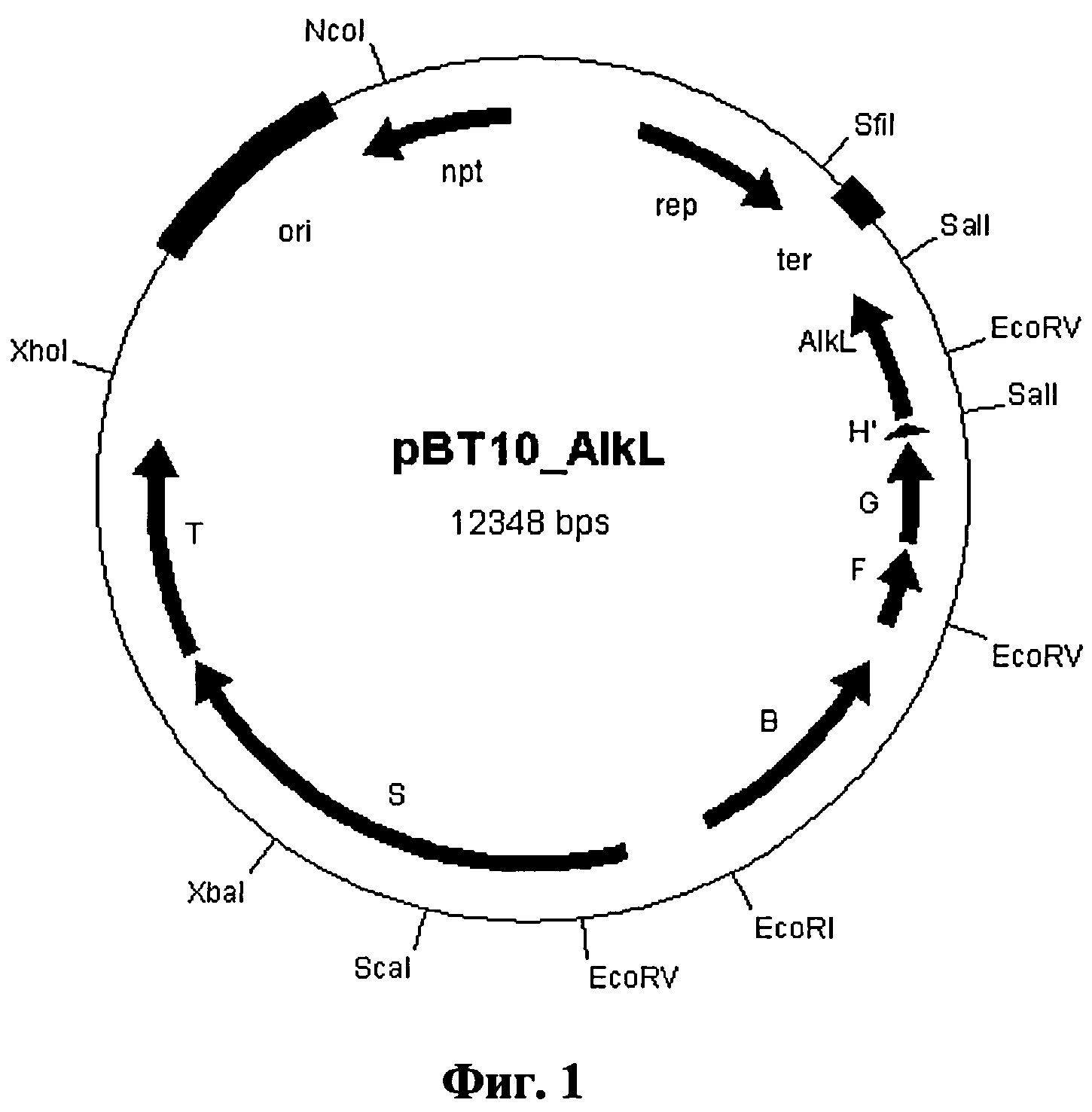
Фиг.1: плазмида Е. coli „pBT10_alkL"
Примеры:
Контрольный пример 1: Экспрессионный вектор для системы алкангидроксилазы AlkBGT из Pseudomonas putida GPol без alkL
Используя системы pCOM (Smits et al., 2001 Plasmid 64: 16-24), изготовили конструкцию pBT10 (Seq ID №5), которая содержит три компонента: алкангидроксилазу (AlkB), рубредоксин (AlkG) и рубредоксин-редуктазу (AlkT) из Pseudomonas putida. Для экспресии трех генов генную последовательность alkBFG поставили под контроль промотора alkB, а ген alkT - под контроль промотора alkS.
Для упрощения клонирования alkB и alkG лежащий между ними ген alkF амплифицировали и клонировали вместе с alkB и alkG. AlkF не имеет значения для подлежащей катализу реакции.
Подробное описание изготовления вектора pBT10 изложено в международной заявке WO 2009077461.
Пример 1: Экспрессионный вектор для системы алкангидроксилазы AlkBGT из Pseudomonas putida GPo1 с alkL
В другом опыте целенаправленно клонировали ген alkL в alkBFG-оперон, чтобы иметь возможность синтезировать его вместе с необходимым для окисления минимальным набором ферментов.
Для этого с помощью ПЦР амплифицировали ген alkL из pGEc47 (Eggink et al., 1987, J Biol Chem 262, 17712-17718).
Праймеры P1 и P2, использованные для этого, для клонирования в сайт рестрикции SalI плазмиды pBT10 также содержат сайты рестрикции SalI вне целевой последовательности. Кроме того, в прямой праймер P1 следом за точкой SalI встроили стоп-кодон, чтобы закончить возможную трансляцию остатков alkH.
P1 ACGCGTCGACCTGTAACGACAACAAAACGAGGGTAG (Seq ID №6)
P2 ACGCGTCGACCTGCGACAGTGACAGACCTG (Seq ID №7)
Для амплификации использовали полимеразу Finnzyme Phusion (New England Biolabs).
Согласно указаниям производителя смешали 34 мкл H2O, 10 мкл буфера 5x Phusion HF, 1 мкл dNTPs (по 10 мМ), 1,25 мкл P1, 1,25 мкл P2 (для получения конечной концентрации праймера в 0,5 мкМ), 2 мкл pGEc47 раствора плазмиды (150 нг/мкл) и 0,5 мкл полимеразы Phusion и использовали их для ПЦР в тонкостенных сосудах Eppendorf для ПЦР.
По предложению изготовителя полимеразы задали следующую программу ПЦР:
[98°C/30 сек], ([98°C/10 сек] [72°C/60 сек]) 30x, [72°C/10 мин]
Образовавшийся продукт ПЦР длиной 754 пары оснований очистили с помощью набора „peqGOLD cycle pure Kits” (PEQLAB Biotechnology GmbH, Эрланген) согласно инструкции производителя и подвергли фосфорилированию T4 полинуклеотидкиназой. Для этого смешали 15 мкл полученного с очистки раствора продукта ПЦР с 2 мкл раствора АТФ (100 мМ), 2 мкл киназного буфера и 1 мкл T4 полинуклеотидкиназы и инкубировали при 37°C в течение 20 минут. Затем фермент умертвили нагревом до 75°C на 10 минут.
Подготовленный таким образом продукт ПЦР затем лигировали в вектор pSMART фирмы lucigen согласно инструкции производителя. С помощью теплового шока (42°C на 45 с) 2 мкл лигационного раствора трансформировали в обладающие химической компетентностью клетки Е. coli DH5α.
После инкубации на протяжении ночи на пластинках с канамицином отобранные колонии выращивали в жидкой культуре (5 мл среды LB с 30 мкг/мл канамицина) в течение ночи при 37°C, а плазмиды изолировали с помощью набора peqGOLD Miniprep Kits (PEQLAB Biotechnologie GmbH (Эрланген)).
Правильно лигированные плазмиды идентифицировали посредством рестрикционного расщепления по SalI и последующего гель-электофореза.
Одну такую плазмиду подготовили в относительно большем количестве и расщепили с помощью SalI. Образовавшийся фрагмент размером 693 пары оснований изолировали очисткой из агарозного геля (peqGOLD Gel Extraction Kit).
Плазмиду pBT10 также подготовили в большем количестве, расщепили SalI, a концы дефосфорилировали щелочной фосфатазой (calf intestin [alkaline] phosphatase, CIP) (NEB).
Эти процедуры провели одновременно в одном реакционном сосуде. Для этого 13,3 мкл ДНК плазмиды смешали с 4 мкл буфера, 19,2 мкл воды, 2 мкл щелочной фосфатазы и 1,5 мкл SalI (NEB) и инкубировали в течение 2 ч при 37°C. Разрезанный и дефосфорилированный вектор также, как описано выше, очистили через агарозный гель.
Для установления правильного соотношения вектора и инсерта при лигации концентрацию соответствующих растворов ДНК определяли гель-электрофорезом в агарозе.
Для лигации 10 мкл раствора разрезанной ДНК вектора смешали с 5 мкл раствора ДНК инсерта, так что массовое соотношение ДНК составляло 1:5, добавили 2 мкл лигазного буфера, 1 мкл воды, а также 1 мкл лигазы, после чего инкубировали 2 ч при 22°C, а затем на протяжении ночи при 4°C.
5 мкл этой смеси трансформировали электропорацией в клетки Е. coli линии DH5α.
Резистентные к канамицину колонии выращивали в 5 мл среды LB с антибиотиком в течение ночи, а плазмиды подготовили, как описано выше.
Рестрикционное расщепление плазмидной ДНК из 5 клонов посредством EcoRV в трех случаях продемонстрировало по три полосы, в каждом случае с 8248, 2234 и 1266 парами оснований. Эта картина подтверждает правильное введение alkL клонированием.
Полученную плазмиду назвали pBT10_alkL (см. фиг.1), она имеет последовательность под идентичным номером 8.
Пример 2: Преобразование метилового эфира лауриновой кислоты в метиловый эфир ω-гидроксилауриновой кислоты
Для биотрансформации плазмиды pBT10 или pBT10_alkL трансформировали тепловым шоком при 42°C в течение 2 минут в обладающий химической компетентностью штамм Е. coli W3110 (Hanahan D, DNA cloning: A practival approach. IRL Press, Oxford, 109-135). Для синтеза метилового эфира гидроксилауриновой кислоты в течение ночи культивировали Е. coli W3110-pBT10 и W3110-pBT10_alkL при 30°C и 180 об/мин в 100 мл среды M9 (Na2HPO4 6 г/л, KH2PO4 3 г/л, NaCl 0,5 г/л, NH4Cl 1 г/л, 2 мМ MgSO4, 0,1 мМ CaCl2, 0,5% глюкозы) с 30 мг/л канамицина и собрали их центрифугированием. Часть биомассы стерильным образом ресуспендировали в 250 мл среды M9 с 0,5% глюкозы и 30 мг/л канамицина до достижения оптической плотности при 450 нм (OD450) 0,2 и продолжили культивацию в колбах со встряхиванием при 30°C и 180 об/мин. Экспрессию генов alk индуцировали через 4 ч роста добавлением 0,025% (об./об.) дициклопропилкетона и еще 4 часа встряхивали культуру при тех же условиях. Затем клетки отделили центрифугированием, клеточную гранулу ресуспендировали в калиево-фосфатном буфере (50 мМ, рН 7,4) и поместили в биореактор с поддержанием в нем температуры 30°C. Концентрацию биомассы задали на уровне приблизительно 1,8 г сухой клеточной массы на литр (CDW/L). При интенсивном перемешивании (1500 мин-1) и подаче воздуха 2 vvm (объем на объем и минуту) добавляли субстрат метиловый эфир лауриновой кислоты в соотношении 1:2 к клеточной суспензии (100 мл клеточной суспензии, 50 мл метилового эфира лауриновой кислоты). Температуру поддерживали постоянной на уровне 30°C.
Образование метилового эфира гидроксилауриновой кислоты подтвердили ГХ-анализом реакционной смеси. Для этого через восходящую трубу реактора шприцом отобрали пробы в момент времени 0 мин (отрицательный контроль) и через 150 минут и центрифугировали их в сосуде Eppendorf емкостью 2 мл на настольной центрифуге Eppendorf при 13200 об/мин на протяжении 5 минут до разделения фаз. Органическую фазу анализировали методом газовой хроматографии (Thermo Trace GC Ultra). В качестве колонки использовали Varian Inc.
FactorFourTM VF-5m, длина: 30 м, толщина пленки: 0,25 мкм, внутренний диаметр: 0,25 мм.
Условия анализа:
Измеренную скорость формирования метилового эфира 12-гидроксилауриновой кислоты можно теперь пересчитать в активность биокатализатора и нормировать на использованную клеточную массу.
На линейном участке кинетики преобразования для активности справедливо
Активность [ЕД] = кол-во преобразованного вещества [мкмоль]/время [мин]
Обычная в описании ферментов единица «ЕД» - мера эффективности такого катализатора в начале реакции
Благодаря дополнительно экспрессированному alkL начальную активность удалось повысить в 26,7 раз.
Реферат
Группа изобретений относится к области биохимии. Предложен способ окисления органического вещества. Указанный способ осуществляется с применением окисляющего фермента и продукта гена alkL, причем продукт гена alkL обеспечивают в составе оперона alkBFGL. Также предложен микроорганизм, измененный генно-инженерным путем и содержащий оперон alkBFGL. Группа изобретений позволяет повысить скорость окисления фермента, окисляющего органическое вещество. 3 н. и 13 з.п. ф-лы, 1 ил., 1 табл., 3 пр.
Формула
причем продукт гена alkL обеспечивают независимо от природной формы alk-оперона (alkBFGHJKL), а именно в составе оперона alkBFGL, а продукт гена alkL выбирают из группы, состоящей из белка, кодируемого геном alkL из Pseudomonas putida, и внешнего мембранного белка W (OmpW),
причем органическое вещество выбирается из группы, состоящей из разветвленных или неразветвленных, насыщенных или ненасыщенных, при необходимости замещенных алканов, алкенов, алкинов, спиртов, альдегидов, кетонов, карбоновых кислот, сложных эфиров карбоновых кислот, аминов и эпоксидов, содержащих от 3 до 22 атомов углерода, и
причем окисляющий фермент выбирают из алканмонооксигеназы, ксилолмонооксигеназы, альдегиддегидрогеназы, алкогольоксидазы или алкогольдегидрогеназы.
причем органическое вещество выбрано из группы, состоящей из разветвленных или неразветвленных, насыщенных или ненасыщенных, при необходимости замещенных алканов, алкенов, алкинов, спиртов, альдегидов, кетонов, карбоновых кислот, сложных эфиров карбоновых кислот, аминов и эпоксидов, содержащих от 3 до 22 атомов углерода, причем окисляющий фермент выбирают из алканмонооксигеназы, ксилолмонооксигеназы, альдегиддегидрогеназы, алкогольоксидазы или алкогольдегидрогеназы, и
причем микроорганизм выбран из группы бактерий.
причем органическое вещество выбрано из группы, состоящей из разветвленных или неразветвленных, насыщенных или ненасыщенных, при необходимости замещенных алканов, алкенов, алкинов, спиртов, альдегидов, кетонов, карбоновых кислот, сложных эфиров карбоновых кислот, аминов и эпоксидов, содержащих от 3 до 22 атомов углерода, и
причем окисляющий фермент выбирают из алканмонооксигеназы, ксилолмонооксигеназы, альдегиддегидрогеназы, алкогольоксидазы или алкогольдегидрогеназы.

Комментарии