Фармацевтические композиции, включающие модулятор s1р - RU2487703C2
Код документа: RU2487703C2
Описание
Настоящее изобретение относится к фармацевтическим композициям, включающим модулятор рецептора сфингозин-1 фосфата, прежде всего, агонист рецептора сфингозин-1 фосфата.
Сфингозин-1 фосфат (S1P) является природным сывороточным липидом. В настоящее время известны восемь рецепторов S1P, а именно S1P1-S1P8. Агонисты рецептора S1P ускоряют хоминг лимфоцитов.
Агонисты рецептора S1P представляют собой иммуномодуляторы, вызывающие лимфопению в результате перераспределения, предпочтительно обратимого, лимфоцитов из кровотока во вторичные лимфатические ткани, и не вызывающие при этом генерализованного иммунодепрессантного действия. Наивные клетки секвестируются и стимулируется миграция Т-клеток CD4 и CD8 и В-клеток из кровотока в лимфатические узлы (ЛУ) и пееровые бляшки (ПБ), таким образом, подавляется инфильтрация клеток в трансплантированные органы.
Различные известные модуляторы рецептора S1P характеризуются сходной структурой, что приводит к возникновению аналогичных проблем при получении пригодного состава. Существует необходимость в разработке состава, содержащего модулятор рецептора S1P, пригодного для перорального введения в твердой форме, например, таблетки или капсулы. Кроме того, пероральный способ обычно является наиболее приемлемым для введения лекарственного средства, однако, к сожалению у многих пациентов возникают проблемы при проглатывании, например, вследствие неприятного вкуса лекарственного средства или отсутствия воды во время приема лекарственно средства. Таким образом, существует необходимость в разработке модулятора рецептора S1P в виде перорального состава, который легко проглатывается, например, детьми или пожилыми пациентами. Более того, существует необходимость в разработке простого способа получения лекарственных форм модулятора рецептора S1P, содержащих различные дозы.
В настоящем изобретении предлагаются различные фармацевтические композиции, содержащие модулятор рецептора S1P и соответствующие приведенным критериям. Состав композиции позволяет вводить простым системным способом агонист рецептора S1P и другие модуляторы, при этом исключены недостатки жидких составов для инъекций или перорального введения. Композиции по настоящему изобретению характеризуются улучшенными физико-химическими свойствами и стабильностью при хранении. Прежде всего, композиции по настоящему изобретению характеризуются высоким уровнем однородности распределения модулятора рецептора S1P в составе композиций, а также высокой стабильностью. Композиции по настоящему изобретению получают при использовании автоматического оборудования с высоким сдвигом, при этом не требуется проводить инкапсулирование вручную.
В некоторых объектах настоящего изобретения предлагаются быстро диспергирующиеся лекарственные формы, которые быстро распадаются во ротовой полости и при этом не требуется применения подсластителей или ароматизаторов, маскирующих вкус, а также присутствия жидкости для смывания лекарственной формы. Указанные лекарственные формы способны распадаться в ротовой полости, прежде всего, в слюне. Предпочтительно лекарственные формы характеризуются приятным вкусовым ощущением и при этом исключено преждевременное высвобождение лекарственного средства в ротовой полости. Быстрая распадаемость твердой фармацевтической композиции увеличивает растворимость активного ингредиента(ов). Прежде всего, такая распадаемость приводит к повышенной растворимости лекарственного средства в слюне по сравнению с растворимостью в тонком кишечнике.
Фармацевтические композиции по настоящему изобретению получают с использованием стандартных методов, например, стандартным смешиванием, грануляцией, растворением или лиофилизацией. Используемые методы известны в данной области техники и описаны, например, в книге L.Lachman и др., The Theory and Practice of Industrial Pharmacy, 3-е изд. (1986), H.Sucker и др., Pharmazeutische Technologie, Thieme (1991), Hagers Handbuch der pharmazeutischen Praxis, 4-е изд., Springer Verlag (1971) и Remington's Pharmaceutical Sciences, 13-е изд., Mack Publ., Co. (1970) или в более поздних изданиях.
Композиции по настоящему изобретению могут характеризоваться достаточно высокой стабильностью, по данным стандартных испытаний на стабильность, например, срок хранения составляет до одного, двух или трех лет и даже более. Предпочтительно композиции стабильны в течение по крайней мере шести месяцев при КТ. Стабильность можно определить, например, при оценке продуктов разложения активного агента методом ЖХВР после хранения в течение определенного времени при определенной температуре, например, 20°, 40° или 60°C.
Композиции, содержащие покрытие
Фармацевтические композиции будут легче проглатываться, если на ядро таблетки, пеллета или поверхность капсулы наносить покрытие, при этом повышается степень согласия пациентов с курсом лечения, так как уменьшается или маскируется неприятный вкус.
В одном объекте настоящего изобретения предлагается пероральная фармацевтическая композиция, включающая модулятор рецептора S1P, например, агонист рецептора S1P, при этом композиция включает покрытие, состоящее из следующих компонентов:
(а) одна или более полимерных смол
(б) один или более оксидов металла.
Твердые композиции представлены в форме пеллетов различного размера, при этом покрытие наносят на каждый пеллет, множество которых находится, например, в капсуле или пакетике.
Твердые композиции получают из порошкообразных ингредиентов, которые необязательно тонко измельчают и прессуют в композиции, характеризующиеся различной твердостью.
В одном варианте на порошкообразные компоненты прессованной композиции перед прессованием наносят покрытие.
В другом варианте на прессованную композицию наносят покрытие после прессования.
В еще одном варианте покрытие наносят как до прессования, так и после него.
Жидкие пероральные композиции включают капсулы, заполненные жидкой композицией, при этом на капсулу нанесено покрытие.
В другом варианте покрытие наносят на внешнюю часть капсулы.
В еще одном варианте покрытие диспергируют в составе внешней фазы капсулы.
Однако, капсулы не ограничиваются капсулами с жидким содержимым и кроме гомогенного жидкого содержимого могут содержать твердые композиции в форме порошков, пеллетов или гетерогенных суспензий.
Если твердая композиция находится в форме пеллетов или гранул, то после нанесения покрытия, как описано выше, ее используют саму по себе или перед введением заполняют полученной смесью капсулы, например, твердые желатиновые капсулы или другие емкости для хранения, например, пакетики.
Пеллеты и гранулы характеризуются диаметром от 2 до 0,3 мм, например, «стандартные пеллеты» характеризуются размером от 1 до 0,6 мм, а «гранулированные» пеллеты характеризуются размерами от 0,4 до 0,8 мм.
Композиции для покрытия по настоящему изобретению прежде всего пригодны для нанесения на таблетки, как описано в данном контексте, например, на ядра таблеток.
В одном варианте композиции для покрытия наносят на прессованные таблетки, включающие модулятор S1P, например, агонист S1P.
Ядро таблетки представляет собой любую твердую композицию, предназначенную для перорального введения.
Термин «ядро» включает в широком смысле не только таблетки, пеллеты или гранулы, но и капсулы, например, мягкие или твердые желатиновые или крахмальные капсулы. Ядра получают по известным методикам.
При использовании ядер таблеток они предпочтительно характеризуются твердостью от приблизительно 10 до 70 Н. Прочность на разрыв ядра таблетки составляет менее 38 Н/см2, например, менее 22 Н/см2.
Твердость ядра таблетки, включающего модулятор S1P, например, агонист S1P, можно повысить при нанесении покрытия, как описано в данном контексте. Покрытие позволяет получить таблетки, характеризующиеся достаточно высокой структурной целостностью ядер, прочность на разрыв которых составляет менее 38 Н/см2 (2,5 кПа), т.е. таких ядер, которые в ином случае считаются слишком непрочными для практического применения. Прочность на разрыв ядер может составлять менее 30 Н/см2 (2,0 кПа), предпочтительно менее 22 Н/см2 (1,5 кПа).
Ядра получают при прессовании с низкой степенью сжатия, что позволяет использовать компоненты с покрытием и хрупкие компоненты, такие как капсулы, в составе смеси для прессования с минимальным повреждением или без повреждений.
Ядро таблетки может содержать адьювант и модулятор S1P, например, агонист S1P.
Ядро таблетки может содержать пригодный ингредиент для таблетирования, включая разбавители, дезинтегрирующие агенты, замасливатели, смачивающие агенты, глиданты, ПАВ, агенты, ускоряющие высвобождение, красители, шипучие агенты и т.п.
Ядро таблетки можно получить при использовании любого состава, известного специалистам в данной области.
Ядра таблеток могут включать, без ограничения перечисленным, наполнители, такие как полиолы, например, порошкообразный маннит, или другие сахариды или сахара, альдиты, и т.п., например, лактозу, сахарозу, декстрозу, маннит и крахмал.
Состав ядра таблетки может также включать или в другом варианте включать связующие, такие как ПВП, например, целлюлоза, микрокристаллическая целлюлоза, полиэтиленгликоли, поливинилпирролидон, крахмальный клейстер, аравийская камедь, альгининовая кислота, карбоксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, декстрин, этилцеллюлоза, желатин, глюкоза, гуаровая камедь, гидроксипропилметилцеллюлоза, магнийалюмосиликат, кальтодекстрин, метилцеллюлоза, полиэтиленоксид, повидон, альгинат натрия и гидрированные растительные масла.
Композиции для ядер таблеток могут также включать или в другом варианте включать дезинтегрирующие агенты (содержащие или не содержащие шипучие агенты), например, сшитую натриевую соль карбоксиметилцеллюлозы (кросскарамелозу), кроссповидон или натриевую соль гликолята крахмала.
Композиции для ядер таблеток могут также включать или в другом варианте включать замасливатели, например, стеарат магния, стеарат кальция, стеарилфумарат натрия, коллоидный гидроксид кремния или тальк.
В одном варианте ядро таблетки включает от 1,5 до 2% замасливателя, например, стеарата магния или кальция.
Композиции для ядер таблеток могут также включать или в другом варианте включать глиданты, например, диоксид кремния.
Композиции для ядер таблеток могут также включать или в другом варианте включать ПАВ, например, лаурилсульфат натрия или докузат натрия.
Композиции для ядер таблеток могут также включать или в другом варианте включать ароматизаторы.
Композиции для ядер таблеток могут также включать или в другом варианте включать шипучие агенты, например, бикарбонат натрия или лимонную кислоту.
Композиции для ядер таблеток могут также или в другом варианте включать подсластители.
Композиции для ядер таблеток могут также включать или в другом варианте включать регулирующие pH агенты, например, лимонную или фумаровую кислоты.
Композиции для ядер таблеток могут также включать или в другом варианте включать добавки для контролируемого высвобождения. Например, лекарственное средство включают в гидрофобную полимерную матрицу, которая обеспечивает постепенное высвобождение активного агента из нее при контактировании с жидкими средами организма.
В другом варианте лекарственное средство включают в гидрофильную матрицу, которая постепенно или быстро растворяется в присутствии жидких сред организма. Ядро таблетки может включать два или более слоя с различной скоростью высвобождения. Слои могут быть гидрофильными, гидрофобными или представлять собой смесь гидрофильного и гидрофобного слоев. Соседние слои в многослойном ядре таблетки можно отделять друг от друга с использованием нерастворимого защитного слоя или гидрофильного слоя. Нерастворимый защитный слой может состоять из материалов, используемых для формирования нерастворимой оболочки. Гидрофильный разделяющий слой можно формировать из материалов, обладающих большей растворимостью по сравнению с другими слоями ядра таблетки и, таким образом, сначала растворяется разделяющий слой, затем экспонируются слои, высвобождающие лекарственное средство.
Пригодные контролирующие скорость высвобождения полимеры включают, полиметакрилаты, этилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, кальциевую соль карбоксиметилцеллюлозы, полимер акриловой кислоты, полиэтиленгликоль, полиэтиленоксид, каррагинан, ацетат целлюлозы, зеин и т.п.
Ядро таблетки может, кроме того, включать материалы, набухающие при контактировании с водными растворами, и которые можно включать в композицию, включая полимерные материалы, например, сшитую натриевую соль карбоксиметилцеллюлозы, сшитую гидроксипропилцеллюлозу, высокомолекулярную гидроксипропилцеллюлозу, карбоксиметиламид, калиевую соль сополимера метакрилата и дивинилбензола, полиметилметакрилат, сшитый поливинилпирролидон и высокомолекулярные поливиниловые спирты.
Ядра таблеток могут включать дополнительные фармацевтически активные ингредиенты, наряду с модулятором S1P, например, агонистом S1P.
В одном варианте, если композиция ядра таблетки представляет собой стандартную лекарственную форму, каждая стандартная доза включает от 0,5 до 10 мг модулятора рецептора S1P, например, агониста S1P.
Пригодные способы получения ядер таблетки включают смешивание всех ингредиентов и прессование в таблетки, а, кроме того, грануляцию и прессование гранул в таблетки.
В одном варианте предлагается композиция ядра таблетки, включающая альдит. Пример состава ядра таблетки, включающей модулятор рецептора S1P, например, агонист S1P, приведен в патенте WO 2004/089341, в котором описан состав, включающий модулятор S1P и альдит.
Альдит можно использовать в качестве разбавителя, носителя, наполнителя или придающего объем агента, и соответственно он представляет собой маннит, мальтит, инозит, ксилит или лактит, предпочтительно в основном негигроскопичный альдит, например, маннит (D-маннит). Используют один альдит или смесь двух или более альдитов, например, смесь маннита и ксилита, например, в соотношении от 1:1 до 4:1.
В одном варианте предлагается композиция ядра, включающая микрокристаллическую целлюлозу и модулятор рецептора S1P, например, агонист S1P, в отсутствие альдита.
Предпочтительно компоненты ядра и покрытия таблетки тонко измельчены.
В другом варианте твердый состав характеризуется высокой скоростью распадаемости.
Предпочтительно количество активного ингредиента составляет от 0 до 1000 мг.
Покрытие получают на порошкообразной или жидкой основе.
Покрытие может характеризоваться пригодными электрическими свойствами и плавиться при температуре, пригодной для его применения в качестве материала для покрытия при нанесении покрытия на ядра фармацевтических таблеток.
Примеры полимерных смол включают, без ограничения перечисленным, полиметакрилаты, например, метакрилат аммония, целлюлозу и ее производные, простые и сложные эфиры целлюлозы и фталат-ацетат целлюлозы.
Предпочтительно полимерные смолы не обладают проводящими свойствами.
Композиции для покрытия могут включать полиэтиленгликоль или альдит, например, ксилит.
Композиции для покрытия могут также или в другом варианте, кроме того, включать другие пригодные материалы, включая воски и масла или алкоголяты восков и масел, полоксамеры, алкилфталаты, например, диэтилфталат, лимонную кислоту или сложные эфиры.
Композиции для покрытия могут также включать или в другом варианте, кроме того, включать один или более полимеров или сополимеров акриловой кислоты, и их производные, например, полиметилакрилат, полиалкены и их производные, включая сложные эфиры и ариловые сложные эфиры и их производные, поливиниловые спирты и сложные эфиры, целлюлозу и ее производные, например, простые и сложные эфиры целлюлозы (сшитые или несшитые), например, этилцеллюлозу, и один или более энтеросолюбильных полимеров, например, фталат-ацетат целлюлозы, фталат гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозу, один или более биодеградабельных полимеров, например, один или более полилактидов, полигликолидов, полигидроксибутиратов, полигидроксивалиратов, сополимеры этилена и винилацетата и полиангидриды (гомо- или гетерополимеры) или полиэтиленоксид.
Композиции для покрытия могут также включать или в другом варианте, кроме того, включать диспергирующий агент, например, лаурилсульфат натрия, докузат натрия, твины (сложные эфиры сорбита и жирных кислот), полоксамеры и цетостеариловый спирт.
Композиции для покрытия могут также включать или в другом варианте, кроме того, включать кондиционеры текучести для снижения трения и/или других сил, возникающих между частицами порошкообразного материала покрытия, для улучшения текучести порошка, например, диоксид титана, коллоидный диоксид кремния, тальк или их комбинации.
Композиции для покрытия могут также включать или в другом варианте включать дезинтегрирующий агент, например, натриевую соль гликолята крахмала (сшитую), натриевую соль карбоксиметилцеллюлозы (сшитую), природный крахмал, сшитый поливинилпирролидон (кроссповидон), карбонат натрия, гидрокарбонат натрия или глицинат натрия.
Композиции для покрытия могут также включать или в другом варианте, кроме того, включают красители, например, оксиды металлов или пигменты (например, пигменты на основе алюминия), оксид железа или другие красители.
Композиции для покрытия могут также включать или в другом варианте, кроме того, включать модификаторы вкуса, например, аспартам, ацесульфам К, цикламаты, сахарин, сахара или альдиты.
Композиции для покрытия могут, кроме того, включать ароматизаторы.
В одном варианте композиция для покрытия включает:
(а) сополимер метакриловой кислоты
(б) целлюлозу
(в) один или более оксидов металла.
В настоящем изобретении, кроме того, предлагается способ получения фармацевтических композиций с покрытием для перорального введения, который заключается
(а) в получении ядра таблеток, включающего модулятор рецептора S1P и
(б) нанесение покрытия, как описано выше.
В одном варианте способ заключается:
(а) в смешивании агониста рецептора S1P или другого модулятора с альдитом,
(б) в измельчении и/или грануляции смеси, полученной в п. (а) и
(в) в смешивании измельченной смеси, полученной в п. (б) с замасливателем
(г) в смешивании необязательно с другим растворителем, ароматизатором или консервантом в пропиленгликоле и в добавлении глицерина и
(д) в нанесении композиции для покрытия по настоящему изобретению.
При использовании указанного способа получают композиции, характеризующиеся достаточно высокими содержанием и однородностью (например, в основном однородным распределением модулятора рецептора S1P в композиции), временем растворения и стабильностью.
В случае композиции ядра таблетки, включающего агонист рецептора S1P, например, гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола, перед стадией (а) для удаления крупных агрегатов композицию необязательно тонко измельчают и/или предварительно просеивают, например, через сито с диаметром ячеек от 400 до 500 мкм. Смешивание на стадии (а) может включать смешивание агониста рецептора S1P и альдита, например, маннита в пригодном смесителе или миксере, например, при скорости от 100 до 400 оборотов.
Способ можно проводить при смешивании сухих компонентов. В этом варианте измельчение на стадии (б) может включать пропускание полученной на стадии (а) смеси через сито предпочтительно с диаметром ячеек от 400 до 500 мкм. Стадия (а) может включать смешивание всего количества агониста рецептора S1P или другого модулятора сначала с небольшим количеством альдита, например, от 5 до 25 мас.% в расчете на общую массу альдита, при этом получают предварительную смесь. Затем в предварительную смесь добавляют остальное количество альдита. Стадия (а) может, кроме того, включать добавление в смесь связующего раствора, например, метилцеллюлозы и/или ксилита, например, водного раствора.
Измельченную смесь, полученную на стадии (б), можно снова перемешивать перед добавлением замасливателя. Замасливатель, например, стеарат магния, перед смешиванием предпочтительно предварительно просеивают, например, через сито с диаметром ячеек от 800 до 900 мкм.
В другом варианте применяют способ влажной грануляции. В этом варианте модулятор рецептора S1P предпочтительно предварительно смешивают в сухом состоянии с требуемым альдитом, например, маннитом, и полученную смесь альдита с модулятором рецептора S1P затем смешивают в сухом состоянии со связующим, таким как гидроксипропилцеллюлоза или гидроксипропилметилцеллюлоза. Затем добавляют воду и смесь гранулируют, например, в автоматическом грануляторе. Гранулят сушат и измельчают.
При необходимости в полученную на стадии (б) смесь на стадии (в) добавляют дополнительное количество связующего.
Способ может включать стадию таблетирования или инкапсулирования смеси, полученной на стадии (в), например, в твердые желатиновые капсулы при использовании автоматической машины для инкапсулирования. Капсулы необязательно окрашивают или маркируют для придания индивидуального внешнего вида и быстрого распознавания. Для улучшения внешнего вида и распознавания капсул используют красители. Пригодные для использования в фармацевтике красители включают каротиноиды, оксиды железа и хлорофилл. Предпочтительно капсулы маркируют с использованием кода.
Прежде всего, в случае ядер таблеток с покрытием смесь для покрытия можно получать экструзией из расплава смеси полимера, красителя и других добавок при необходимости с последующим тонким измельчением полученного экструдата (от 7 до 10 мкм). Порошки для покрытия стабильны в пригодной упаковке и их можно использовать для нанесения на продукт в течение по крайней мере одного года после их получения.
Покрытие на ядро таблетки наносят методом электростатического осаждения порошка, содержащего легкоплавкие частицы.
Указанный способ позволяет получать тонкую непрерывную пленку на поверхности ядра таблетки. В общем случае пленка покрывает от 25 до 100%, предпочтительно от 50 до 100% поверхности ядра таблетки. Прочность на разрыв ядра таблетки составляет по крайней мере 50 Н/см2, 60 Н/см2, наиболее предпочтительно по крайней мере 70 Н/см2.
В одном варианте применяют следующий способ нанесения покрытия.
Сначала ядро фиксируют (в вакууме) на вращающемся диске, придают ядру заряд, пропускают через камеру для нанесения покрытия, при этом противоположно заряженный порошок для покрытия осаждается на поверхности ядра. Затем ядро, покрытое слоем порошка, перемещают на диске к инфракрасной лампе, при этом покрытие плавится. Затем ядро переносят на второй вращающийся диск и способ повторяют для нижней части ядра таблетки.
Толщина пленки: 20-50 мкм.
Обычно масса покрытия составляет 3-4% в расчете на массу ядра, например, покрытие массой 6 мг наносят на двояковыпуклую таблетку диаметром 10 мм. Максимальная масса покрытия для круглого ядра диаметром 12 мм составляет 20 мг. Покрытие предпочтительно является высокогомогенным и характеризуется равномерной толщиной.
Стадия нагрева включает нагревание таблетки от КТ до температуры поверхности таблетки приблизительно 100°C, а температура ядра таблетки составляет приблизительно 70°C в течение приблизительно 20 с. Общее время воздействия температуры значительно меньше по сравнению со стандартным покрытием пленкой (от 60 до 70°C в течение 1-2 ч).
Предпочтительно композиция для покрытия не обладает проводящими свойствами и характеризуется температурой плавления ниже 103°C, например, плавится в течение 5 с при 130°C.
Предпочтительно ядро обладает проводящими свойствами. Если ядро не является проводящим, то предпочтительно включает от 3 до 5% соли, например, NaCl, KCl, лактита или лимонной кислоты.
В одном объекте модулятор S1P придает проводящие свойства ядру таблетки.
Таким образом, предлагается способ получения композиций с покрытием, включающих модулятор S1P, который заключается:
(а) в получении композиции, включающей модулятор S1P, например, агонист S1P,
(б) в нанесении электростатического покрытия на композицию,
(в) в фиксации покрытия.
В одном предпочтительном варианте способа содержание модулятора S1P составляет по крайней мере 50% в расчете на массу проводящего компонента композиции ядра, например, по крайней мере 60%, обычно более 75%.
Модулятор S1P необязательно является единственным проводящим компонентом композиции ядра.
Покрытие, кроме того, можно наносить методом распыления. Ядра можно обрабатывать при КТ или перед распылением их нагревают до 40°C, например, в потоке теплого воздуха при температуре от 40°-70°C. Чтобы исключить слипание ядер распыление предпочтительно прерывают через определенные интервалы и ядра снова нагревают. Однако, можно проводить распыление без прерывания, например, с использованием автоматического регулирования количества распыляемого вещества с учетом температуры отработанного воздуха и/или ядер.
Для придания конечному продукту с покрытием определенного внешнего вида используют различные варианты дизайна, печати, формы и т.п.
Давление при распылении может изменяться в широких пределах, в общем случае удовлетворительные результаты получают при распылении при давлении от приблизительно 1 до приблизительно 1,5 бар.
Композиции, содержащие дезинтегрирующий агент
Упростить проглатывание можно также при использовании быстро распадающихся лекарственных форм, например, быстро распадающихся таблеток.
В другом объекте настоящего изобретения предлагается быстро распадающихся твердая фармацевтическая композиция, включающая
(а) модулятор S1P, например, агонист S1P
(б) силикат щелочноземельного металла
(в) дезинтегрирующий агент
где соотношение силикат/дезинтегрирующий агент составляет от 2:1 до 10:1.
Силикат щелочноземельного металла включает силикат кальция или магния.
Дезинтегрирующий агент может, кроме того, содержать шипучие агенты.
Примеры дезинтегрирующих агентов включают, без ограничения перечисленным, кросскармеллозу, целлюлозу, кроссповидон и натриевую соль гликолята крахмала.
Композиция, кроме того, может содержать наполнители, выбранные из группы, включающей, например, желатин, альдиты, например, маннит, сорбит, декстрозу, сахарозу, лактозу, мальтозу, сорбит, мальтодекстрины, твердый кукурузный сироп или другие сахариды или сахара, трегалозу, поливинилпирролидон, полиэлектролитный гель хондроитинсульфата A, целлюлозу, производные крахмала, пуллулан, глицин, докузат Na, поливиниловый спирт, HPC-SL, маннит & глицерин, ксантановую камедь/каррагинан/аравийскую камедь/гуаровую камедь/трагакант, маннит, полисорбат 60, додецилсульфат натрия, жирные кислоты, соли желчных кислот, метилгидроксибензоат натрия, пропилгидроксибензоат натрия и крахмал.
Композиции также включают или в другом варианте, кроме того, могут содержать замасливатели, например, стеарат магния, стеарат кальция, стеарилфумарат натрия, коллоидный диоксид кремния или тальк.
Композиция, кроме того, может включать дополнительные связующие, такие как ПВП, например, целлюлоза, полиэтиленгликоль, поливинилпирролидон, крахмальный клейстер, аравийскую камедь, альгининовую кислоту, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, декстрин, этилцеллюлозу, желатин, глюкозу, гуаровую камедь, гидроксипропилметилцеллюлозу, магнийалюмосиликат, кальтодекстрин, метилцеллюлозу, полиэтиленоксид, повидон, альгинат натрия или гидрированные растительные масла.
Композиция, кроме того, также включает или в другом варианте может включать ПАВ, например, лаурилсульфат натрия или докузат натрия.
Композиция, кроме того, также включает или в другом варианте может включать шипучие вещества, например, бикарбонат натрия или лимонную кислоту.
Композиция, кроме того, также включает или в другом варианте может включать ароматизаторы.
Композиция, кроме того, также включает или в другом варианте может включать глиданты, например, диоксид кремния.
Композиция, кроме того, также включает или в другом варианте может включать подсластители.
Композиция, кроме того, также включает или в другом варианте может включать агенты, регулирующие pH, например, лимонную или фумаровую кислоты.
В одном варианте предлагается композиция, включающая:
от 0,1 до 1% модулятора S1P, например, агониста S1P,
от 60 до 90% наполнителя, например, альдита,
от 20 до 45% силиката и
от 4 до 10% дезинтегрирующего агента.
Композиции по настоящему изобретению представляют собой, например, таблетки, капсулы, микротаблетки, лепешки, пиллюли, минитаблетки, пеллеты, шарики или гранулы.
Если твердая композиция находится в форме пеллетов или гранул, такую композицию можно использовать саму по себе или для заполнения капсул, например, твердых желатиновых капсул, или других емкостей для хранения перед введением, например, пакетиков.
Пеллеты и гранулы характеризуются диаметром от 2 до 0,3 мм, например, «стандартный пеллет» характеризуется размером от 1 до 0,6 мм, а «гранулированный пеллет» характеризуется размером от 0,4 до 0,8 мм.
Композицию необязательно включают в гидрофильную матрицу, которая постепенно или быстро растворяется в присутствии физиологической жидкости.
Композиция может, кроме того, включать материалы, набухающие при контактировании с водными растворами, которые включены в композицию, включая полимерные материалы, выбранные из группы, включающей сшитую натриевую соль карбоксиметилцеллюлозы, сшитую гидроксипропилцеллюлозу, высокомолекулярную гидроксипропилцеллюлозу, карбоксиметиламид, калиевую соль сополимера метакрилата и дивинилбензола, полиметилметакрилат, сшитый поливинилпирролидон и высокомолекулярные поливиниловые спирты.
Предпочтительно время распадаемости (BP) композиции составляет менее 60 с при контактировании с жидкостью, например, водой или слюной.
Предпочтительно BP составляет 30 с.
Твердость таблеток можно изменять, чтобы конкретная композиция характеризовалась определенным значением BP. Композиции по настоящему изобретению могут характеризоваться различной твердостью.
Соответственно, композиции по настоящему изобретению могут характеризоваться, например, прочностью на разрыв от 30 Н/см2 до 80 Н/см2.
Предпочтительно после распада композиции образуются частицы размером от 1 нм до 10 мм, например, от 50 нм до 200 нм, которые могут растворяться или образовывать тонкую суспензию.
Для обеспечения быстрой распадаемости соотношение силиката, например, силиката кальция и дезинтегрирующего агента составляет от 2:1 до 10:1, например, от 3:1 до 7:1, обычно 6:1, 5:1 или 4:1.
В одном варианте соотношение силиката кальция и дезинтегрирующего агента составляет 5:1. Например, соотношение силиката кальция и кроссповидона или кроскармеллозы может составлять 5:1.
В другом варианте предлагается капсула, содержащая множество пеллетов, характеризующихся быстрой распадаемостью по настоящему изобретению.
Быстрая распадаемость или повышение эффективности распадаемости может обеспечивать более высокую растворимость активного агента. Повышенная растворимость лекарственного соединения может приводить к более высокой биодоступности, так как снижается риск осаждения в жидких средах организма.
Биодоступность модуляторов рецептора S1P, прежде всего агонистов рецептора S1P, можно повысить при добавлении участка буккальной абсорбции к участку пероральной абсорбции, что позволяет снизить пресистемный метаболизм. Если модуляторы рецептора S1P абсорбируются через буккальный участок подъязычным способом, через слизистую оболочку ротовой полости, пищевода и/или миндалин, то биодоступность повышается, поскольку буккальная абсорбция происходит раньше, чем абсорбция в желудочно-кишечном тракте и снижается эффект пресистемного метаболизма в печени. Увеличение биодоступности позволяет снизить дозу, что приводит к улучшению профиля безопасности.
Фармацевтические лекарственные формы, предназначенные для применения в медицине для введения в ротовую полость для буккальной, сублингвальной или десенной абсорбции, можно использовать в присутствии или в отсутствии усилителей абсорбции, таких как, без ограничения перечисленным, описанные в разделе Примеры.
Примеры указанных лекарственных форм включают, без ограничения перечисленным, буккальный спрей, шипучие таблетки, гранулы, пероральные распадающиеся таблетки, тонкие пленки или пластинки и мукоадгезивные диски или пластыри.
Предпочтительно доза активного ингредиента составляет от 0 до 1000 мг, например, от 0 до 500 мг.
Композиции, включающие лиофильно высушенные лекарственные формы
В другом объекте настоящего изобретения предлагается быстро распадающаяся фармацевтическая композиция, содержащая лиофильно высушенную лекарственную форму модулятора S1P, например, агониста S1P.
В одном варианте композиции содержат лиофильно высушенную лекарственную форму, содержащую один или более модуляторов S1P, например, агонист S1P, на частицы которого не нанесено или нанесено покрытие из полимера или липидного материала, что обеспечивает минимальное высвобождение лекарственного средства в ротовой полости.
Этот эффект достигается, например, при использовании крупных частиц лекарственного средства с покрытием и изменении вязкости суспензии за счет снижения температуры во время обработки суспензии, чтобы свести к минимуму осаждение частиц без изменения физических свойств высушенных частиц.
Полученная лекарственная форма характеризуется замедленным высвобождением лекарственного средства в течение времени, достаточного по крайней мере для маскирования вкуса в ротовой полости перед проглатыванием, и обычно в течение более продолжительного периода времени для обеспечения контролированного или замедленного высвобождения лекарственного средства после проглатывания.
Материал носителя, образующий сетку или матрицу, содержащую модулятор S1P, например, агонист S1P, после лиофильного высушивания, представляет собой любой фармацевтически приемлемый водорастворимый или диспергируемый в воде материал, инертный в отношении фармацевтически активного соединения, который способен образовывать быстро распадающуюся сетку, т.е. способен распадаться в ротовой полости в течение, например, 10 с или менее.
Действие лиофильно высушенной лекарственной формы заключается в том, что такая лекарственная форма быстро диспергируется и в результате способна быстро распадаться. Таким образом, композиции могут образовывать тонкие суспензии или растворы при контактировании со слюной в ротовой полости.
Предпочтительный материал носителя представляет собой желатин, обычно фармацевтически чистый желатин. Другие вещества, которые можно использовать в качестве носителей, включают, например, гидролизованную декстрозу, декстран, декстрин, мальтодекстрин, альгинаты, гидроксиэтилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, микрокристаллическую целлюлозу, твердый кукурузный сироп, пектин, каррагинан, агар, хитозан, смолу плодов рожкового дерева, ксантановую камедь, гуаровую камедь, аравийскую камедь, трагакант, муку конджак, рисовый порошок, клейковину пшеницы, натриевую соль гликолята крахмала, протеин соевых волокон, протеин картофеля, папаин, пероксидазу хрена, глицин и маннит.
Композиция, кроме того, может содержать дополнительные эксципиенты, например, целлюлозу или альдит.
Можно использовать дополнительные эксципиенты, не используемые в качестве носителей, их выбирают, например, из группы, включающей альдиты, например, маннит, сорбит, декстрозу, сахарозу, лактозу, мальтозу, сорбит, мальтодекстрины, твердый кукурузный сироп, трегалозу, поливинилпирролидон, полиэлектролитный гель хондроитинсульфата А, целлюлозу, производные крахмала, пуллулан, глицин, докузат натрия, ПВС, HPC-SL, маннит & глицерин, ксантановую камедь/каррагинан/аравийскую камедь/гуаровую камедь/трагакант, маннит, полисорбат 60, додецилсульфат натрия, жирные кислоты, соли желчных кислот, натрий метилгидроксибензоат натрия, пропилгидроксибензоат натрия, полиолы и крахмал.
Композицию необязательно включают в гидрофильную матрицу, которая постепенно или быстро растворяется в присутствии жидкой среды организма.
Композиция может, кроме того, включать материалы, которые набухают при контактировании с водными растворами, и которые включены в композицию, включая полимерные материалы, выбранные из группы, включающей сшитую натриевую соль карбоксиметилцеллюлозы, сшитую гидроксипропилцеллюлозу, высокомолекулярную гидроксипропилцеллюлозу, карбоксиметиламид, калиевую соль сополимера метакрилата и дивинилбензола, полиметилметакрилат, сшитый поливинилпирролидон и высокомолекулярный поливиниловый спирт.
В одном варианте композиция включает желатин и полисахарид, например, пуллулан, или альдит, и лиофильно высушенную лекарственную форму агониста рецептора S1P или другого модулятора.
В другом варианте альдит служит структурирующим агентом.
В еще одном варианте желатин и альдит содержатся в соотношении от 3:1 до 1:3, например, от 2:1 до 1:2, обычно 1:1.
В другом варианте желатин содержится в количестве от 2 до 10%, например, от 2 до 4%, а альдит содержится в количестве от 0,1 до 15%, например, от 0,5 до 8%.
Композиция также включает или в другом варианте, кроме того, может содержать связующие, такие как ПВП, например, целлюлозу, полиэтиленгликоль, поливинилпирролидон, крахмальный клейстер, аравийскую камедь, альгининовую кислоту, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу,
гидроксипропилметилцеллюлозу, декстрин, этилцеллюлозу, желатин, глюкозу, гуаровую камедь, алюмосиликат магния, калтодекстрин, метилцеллюлозу, полиэтиленоксид, повидон, альгинат натрия или гидрированные растительные масла.
Композиция может также включать или в другом варианте включать дезинтегрирующие агенты (в присутствии или в отсутствии шипучих агентов), например, сшитую карбоксиметилцеллюлозу (кросскармеллозу), кроссповидон или натриевую соль гликолята крахмала.
Композиции могут, кроме того, включать или в другом варианте включать замасливатели, например, стеариновую кислоту, стеарат магния, стеарат кальция, стеарат цинка, глицерилпальмитостеарат, стеарилфумарат натрия, масло канолы, гидрированные растительные масла, такие как гидрированное касторовое масло (например, Cutina® или Lubriwax® 101), минеральное масло, лаурилсульфат натрия, оксид магния, коллоидный диоксид кремния, полиэтиленгликоль, поливиниловый спирт, бензоат натрия, тальк, полоксамер или смесь любых указанных соединений.
Композиция, кроме того, может включать или в другом варианте содержать ПАВ, например, лаурилсульфат натрия, докузат натрия.
Композиция, кроме того, может включать или в другом варианте содержать глиданты, например, диоксид кремния.
Композиция, кроме того, может включать или в другом варианте содержать ароматизаторы.
Композиция, кроме того, может включать или в другом варианте содержать шипучие агенты, например, бикарбонат натрия или лимонную кислоту.
Композиция, кроме того, может включать или в другом варианте содержать подсластители.
Композиция, кроме того, может включать или в другом варианте содержать регулирующие pH агенты, например, лимонную или фумаровую кислоты.
Композиция, кроме того, может также или в другом варианте содержать увеличивающие вязкость агенты.
Композиция по настоящему изобретению может находиться, например, в форме таблеток, капсул, микротаблеток, лепешек, пиллюль, минитаблеток, пеллетов, шариков или гранул.
Если твердая композиция находится в форме пеллетов или гранул, то после нанесения покрытия, как описано выше, до введения они могут использоваться как сами по себе, так и для заполнения капсул, например, твердых желатиновых капсул или других емкостей для хранения, например, пакетиков.
Пеллеты или гранулы характеризуются диаметром от 2 мм до 0,3 мм, например, «стандартный пеллет» характеризуется размером от 1 до 0,6 мм, а «гранулированный пеллет» характеризуется размером от 0,4 до 0,8 мм.
В одном варианте предлагается капсула, содержащая множество пеллетов, характеризующихся быстрой распадаемостью по настоящему изобретению.
Быстрая распадаемость или более высокая эффективность может обеспечивать более высокую растворимость активного соединения. Более высокая растворимость лекарственного средства приводит к повышению биодоступности, так как снижается риск осаждения в физиологических жидкостях.
Термин «быстрая распадаемость», использованный в данном контексте, означает, что твердая лекарственная форма распадается в воде при 37°C в течение 60 с или менее. Лекарственная форма обычно распадается в течение от 5 до 20 с, обычно от 5 до 10 с или менее, по данным определения распадаемости согласно стандарту Disintegration Test for Tablets, Брит, фармакология (1973), описанному в патенте Великобритании №1548022.
Биодоступность модуляторов рецептора S1P, прежде всего агонистов рецептора S1P, можно увеличить при добавлении буккального участка абсорбции к пероральному участку абсорбции, что приводит к снижению пресистемного метаболизма. Если модуляторы рецептора S1P абсорбируются буккально подъязычным способом через слизистую оболочку ротовой полости, пищевода и/или миндалин, то биодоступность повышается, поскольку буккальная абсорбция происходит раньше, чем абсорбция в желудочно-кишечном тракте и снижается эффект пресистемного метаболизма в печени. Увеличение биодоступности позволяет снизить дозу, что приводит к улучшению профиля безопасности.
Фармацевтические лекарственные формы, предназначенные для применения в медицине для введения в ротовую полость для буккальной, сублингвальной или десенной абсорбции, можно использовать в присутствии или отсутствии усилителей адсорбции, таких как, без ограничения перечисленным, описанные в разделе Примеры.
Примеры указанных лекарственных форм включают, без ограничения перечисленным, буккальный спрей, шипучие таблетки, гранулы, перорально распадающиеся таблетки, тонкие пленки или пластинки и мукоадгезивные диски или пластыри.
Предпочтительно доза активного ингредиента составляет от 0 до 1000 мг, например, от 0 до 500 мг.
Лекарственные формы получают по известным методикам, при этом получают суспензии и т.п. Жидкие суспензии затем разделяют на дозы, например, разливают в углубления, сформированные в пригодной пресс-форме. В другом варианте суспензия находится в виде твердых частиц, например, замороженных частиц или гелеобразных частиц, при этом материал носителя легко образует гель. Обычно каждая лекарственная форма включает до 250 мг лекарственного средства, например, от 10 до 100 мг. Стандартные лекарственные формы лекарственного средства в быстро распадающейся форме включены в объем настоящего изобретения.
Суспензию частиц в материале носителя предпочтительно разделяют на отдельные формы, которые формируют при распределении суспензии во множество углублений необходимой формы и размера, при этом получают пероральную лекарственную форму. Форма для получения лекарственных форм предпочтительно включает множество углублений в листе пленкообразующего материала, подобного материалу, который обычно используют в фармацевтической промышленности для получения блистерных упаковок.
Другие способы формирования суспензии в виде отдельных замороженных или гелеобразных форм включают отверждение смесей капельным способом. Например, суспензию пропускают через одно или более отверстий для формирования капель, сфер или спрея мелких частиц, которые отверждают при пропускании в потоке холодного газа или жидкости, например, в потоке жидкого азота. В другом варианте капли, сферы или спрей отверждают при контактировании с холодной жидкостью, несмешивающейся с раствором или суспензией, и которая характеризуется плотностью, достаточной для отверждения капель в процессе осаждения в несмешивающейся жидкости или в процессе их всплывания на поверхности несмешивающейся жидкости.
Удаление непрерывной фазы из суспензии дискретных частиц, включающих фармацевтически активное вещество, проводят по методикам, известным в данной области техники. Например, если дискретные частицы находятся в жидкой форме, перед высушиванием их обычно замораживают или желируют. Суспензию, находящуюся в ячейках пригодной формы, замораживают, например, при пропускании газообразной охлаждающей среды, такой как жидкий азот, через форму или при помещении формы в камеру для замораживания при распылении жидкого азота. В другом варианте форму охлаждают при продвижении над холодной поверхностью. После того, как лекарственная форма заморожена, формы до высушивания можно хранить в холодильнике.
Замороженные дискретные частицы можно сушить лиофильно по известным методикам. Непрерывную фазу, например, воду, сублимируют в процессе лиофильной сушки при пониженном давлении, при этом растворитель в твердой фазе (лед) превращается напрямую в пар. Процесс лиофильной сушки обычно проводят в лиофильной сушке в вакууме от 0,1 до 1,0 мбар в течение от 180 до 500 мин.
В настоящем изобретении, кроме того, предлагается способ получения фармацевтической композиции, который заключается:
(а) в смешивании лиофильно высушенных лекарственных форм агониста рецептора S1P или другого модулятора со структурирующим агентом,
(б) в получении водной суспензии, содержащей менее 50% твердого вещества и
(в) необязательно в проведении лиофильной сушки.
В одном варианте суспензию перед стадией лиофилизации охлаждают до температуры от 10 до 20°C, например, до 15°C.
Композиции, полученные в отсутствии альдита
В еще одном объекте настоящего изобретения предлагается твердая фармацевтическая композиция для перорального введения, включающая:
(а) модулятор рецептора S1P, например, агонист рецептора S1P и
(б) микрокристаллическую целлюлозу
и композиция не включает альдит.
Композиция может содержать замасливатель.
Пригодные замасливатели включают стеариновую кислоту, стеарат магния, стеарат кальция, стеарат цинка, глицерилпальмитостеарат, стеарилфумарат натрия, масло канолы, гидрированное растительное масло, например, гидрированное касторовое масло (например Cutina® или Lubriwax® 101), минеральное масло, лаурилсульфат натрия, оксид магния, коллоидный диоксид кремния, полиэтиленгликоль, поливиниловый спирт, бензоат натрия, тальк, полоксамер или смесь любых указанных соединений.
Предпочтительный замасливатель означает стеарат магния или гидрированное растительное масло.
Композиция предпочтительно включает от 0,01 до 5 мас.% замасливателя, более предпочтительно от 1 до 3 мас.%, например, приблизительно 2 мас.% в расчете на общую массу композиции.
Композиция может содержать один или более других эксципиентов, таких как носители, связующие или разбавители.
Композиция может включать дополнительное связующее, например, метилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, дикальцийфосфат, ПВП, например, целлюлозу, полиэтиленгликоль, поливинилпирролидон, крахмальный клейстер, аравийскую камедь, альгининовую кислоту, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, декстрин, этилцеллюлозу, желатин, гуаровую камедь, гидроксипропилметилцеллюлозу, алюмосиликат магния, калтодекстрин, метилцеллюлозу, полиэтиленоксид, повидон, альгинат натрия или гидрированные растительные масла.
Композиция, кроме того, может включать или в другом варианте содержать глиданты, например, диоксид кремния.
Композиция может представлять собой порошок, гранулы или пеллеты или стандартную лекарственную форму, например, таблетку или капсулу. Композиции пригодны для заполнения капсул для перорального введения, прежде всего, твердых желатиновых капсул. В другом варианте композиции прессуют в таблетки.
На таблетки можно наносить покрытие, например, тальк или полисахарид (например, целлюлозу) или гидроксипропилметилцеллюлозу.
Композиция может, кроме того, содержать дезинтегрирующий агент. Примеры дезинтегрирующих агентов включают, например, кросскармеллозу, целлюлозу, кроссповидон и натриевую соль гликолята крахмала.
Композиция может также включать или в другом варианте содержать ПАВ, например, лаурилсульфат натрия или докузат натрия.
Композиция может также включать или в другом варианте содержать шипучие агенты, например, бикарбонат натрия или лимонную кислоту.
Композиция может, кроме того, содержать добавки, контролирующие высвобождение лекарственного средства. Например, лекарственное средство можно включать в гидрофобную полимерную матрицу и, таким образом, лекарственное средство постепенно высвобождается из нее при контактировании с жидкими средами организма.
В другом варианте лекарственное средство включают в гидрофильную матрицу, которая постепенно или быстро растворяется в присутствии жидких сред организма. Ядро таблетки может содержать два или более слоя с различными скоростями высвобождения. Слои являются гидрофильными, гидрофобными или представлять собой смесь гидрофильного и гидрофобного слоев. Соседние слои в многослойном ядре таблетки можно разделять нерастворимым защитным слоем или гидрофильным разделяющим слоем. Нерастворимый защитный слой состоит из материалов, используемых для получения нерастворимой оболочки. Гидрофильный разделяющий слой состоит из материала, который характеризуется большей растворимостью по сравнению с другими слоями ядра таблетки и, таким образом, при растворении разделяющего слоя экспонируются слои ядра таблетки, высвобождающие лекарственное средство.
Пригодные контролирующие высвобождение лекарственного средства полимеры включают полиметакрилаты, этилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, кальциевую соль карбоксиметилцеллюлозы, полимеры акриловой кислоты, полиэтиленгликоль, полиэтиленоксид, каррагинан, ацетат целлюлозы, зеин и т.п.
Композиция, кроме того, может содержать материалы, набухающие при контактировании с водными растворами, и которые можно включать в композицию, включая полимерные материалы, выбранные из группы, включающей сшитую натриевую соль карбоксиметилцеллюлозы, сшитую гидроксипропилцеллюлозу, высокомолекулярную гидроксипропилцеллюлозу, карбоксиметиламид, калиевую соль сополимера метакрилата и дивинилбензола, полиметилметакрилат, сшитый поливинилпирролидон и высокомолекулярные поливиниловые спирты.
В одном варианте композиция включает диоксид кремния.
Микрокристаллическая целлюлоза может служить разбавителем, носителем, наполнителем или придающим объем агентом, и может представлять собой Avicel®.
Размер частиц микрокристаллической целлюлозы можно изменять.
Использование микрокристаллической целлюлозы в композиции может способствовать более равномерному распределению модулятора рецептора S1P в микрокристаллической целлюлозе, содержащейся в композиции. Площадь поверхности можно увеличивать при получении препаратов микрокристаллической целлюлозы, содержащих частицы с меньшим средним размером и/или частицы с неровной поверхностью.
Было установлено, что использование микронизированной микрокристаллической целлюлозы, например, со средним размером частиц 30 мкм или менее, кроме того, повышает способность к прессованию и твердость таблеток, полученных на основе композиции.
Композиция предпочтительно включает от 75 до 99,99 мас.% микрокристаллической целлюлозы, например, от 85 до 99,9%, например, от 90 до 99,5 мас.% в расчете на общую массу композиции.
Обычно альдит включает лактозу, сахарозу, декстрозу, маннит или сорбит.
Композиции по настоящему изобретению представляют собой, например, таблетки, капсулы, микротаблетки, лепешки, пиллюли, минитаблетки, пеллеты, шарики или гранулы.
Если твердая композиция находится в форме пеллетов или гранул, то после нанесения покрытия, как описано в данном контексте, ими можно заполнять капсулы, например, твердые желатиновые капсулы, или другие емкости для хранения перед введением, например, пакетики.
Пеллеты и гранулы могут характеризоваться диаметром от 2 до 0,3 мм, например, «стандартный пеллет» характеризуется размерами от 1 до 0,6 мм, а «гранулированный пеллет» характеризуется размерами от 0,4 до 0,8 мм.
В настоящем изобретении, кроме того, предлагается способ получения фармацевтической композиции, который заключается:
(а) в смешивании агониста рецептора S1P или другого модулятора с микрокристаллической целлюлозой, например, Avicel®,
(б) в измельчении и/или грануляции полученной на стадии (а) смеси и
(в) необязательно в смешивании измельченной смеси, полученной на стадии (б), с замасливателем.
При использовании указанного способа получают композицию, характеризующуюся высоким содержанием активного агента и однородностью смеси (т.е. достаточно однородным распределением модулятора рецептора S1P в композиции), достаточно малым временем растворения и высокой стабильностью.
Модулятор рецептора S1P, например, гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола или другой агонист рецептора S1P, можно тонко измельчать и/или предварительно просеивать, например, через сито с диаметром ячеек от 400 до 500 мкм, перед проведением стадии (а) для удаления крупных агрегатов. Стадия смешивания (а) может включать смешивание антагониста рецептора S1P и микрокристаллической целлюлозы, например, Avicel®, в любом пригодном блендере или смесителе, например, при скорости вращения от 100 до 400 оборотов.
Способ можно проводить при смешивании сухих компонентов. В этом случае стадия измельчения (б) может включать пропускание смеси, полученной на стадии (а), через сито, предпочтительно с диаметром ячеек от 400 до 500 мкм. Стадия (а) может включать смешивание общего количества агониста рецептора S1P сначала с небольшим количеством микрокристаллической целлюлозы, например, Avicel®, например, от 5 до 25 мас.% в расчете на общую массу микрокристаллической целлюлозы, например, Avicel®, при этом получают промежуточную смесь. Соответственно остальное количество микрокристаллической целлюлозы, например, Avicel®, добавляют в промежуточную смесь. Стадия (а), кроме того, может включать добавление в смесь раствора связующего, например, метилцеллюлозы и/или ксилита, например, водного раствора.
Измельченную смесь, полученную на стадии (б), можно дополнительно измельчать перед смешиванием с замасливателем. Замасливатель, например, стеарат магния, перед смешиванием предпочтительно предварительно просеивают, например, через сито с диаметром ячеек от 800 до 900 мкм.
В другом варианте применяют способ влажной грануляции. В этом варианте модулятор рецептора S1P предпочтительно предварительно смешивают в сухом виде с требуемым количеством микрокристаллической целлюлозы, например, Avicel®, и полученную смесь, например, микрокристаллическая целлюлоза Avicel®/модулятор рецептора S1P затем смешивают в сухом виде со связующим, например, гидроксипропилцеллюлозой или гидроксипропилметилцеллюлозой. Затем добавляют воду и смесь гранулируют, например, в автоматическом грануляторе. Гранулят высушивают и измельчают.
При необходимости в смесь, полученную на стадии (б), на стадии (в) добавляют дополнительное количество связующего.
Способ может включать дополнительную стадию таблетирования или инкапсулирования смеси, полученной на стадии (в), например, в твердые желатиновые капсулы в автоматической машине для инкапсулирования. Капсулы можно окрашивать или на них наносят маркировку для придания индивидуального внешнего вида и для улучшения распознаваемости. Для улучшения внешнего вида и идентификации капсул используют красители. Пригодные для использования в фармацевтике красители включают каротиноиды, оксиды железа и хлорофилл. Предпочтительные капсулы маркируют кодом.
Композиции, включающие покрытие, содержащее агонист рецептора S1P
При нанесении на фармацевтическую композицию покрытия, включающего модулятор рецептора S1P, можно получать продукты, содержащие различные дозы или комбинации.
Соответственно, в еще одном объекте настоящего изобретения предлагается фармацевтическая композиция, содержащая покрытие, содержащее модулятор рецептора S1P, например, агонист рецептора S1P.
Фармацевтическая композиция обычно включает ядро с покрытием, содержащим модулятор рецептора S1P, например, агонист рецептора S1P.
Ядро может представлять собой любую твердую композицию для перорального введения.
Термин «ядро» в широком смысле включает не только таблетки, пеллеты или гранулы, но и капсулы, например, мягкие или твердые желатиновые или крахмальные капсулы. Прежде всего, ядро может представлять собой гранулы, пеллеты, таблетку или минитаблетку. Указанные ядра получают по известным методикам.
В некоторых вариантах ядро, кроме того, включает модулятор рецептора S1P, например, агонист рецептора S1P. В других вариантах агонист рецептора S1P в ядре отсутствует.
Твердые композиции получают в виде пеллетов различного размера, покрытие при этом наносят на каждый пеллет, множество которых помещают, например, в капсулу или пакетик.
Твердые композиции можно получать из порошкообразных ингредиентов, которые можно тонко измельчать и прессовать в композиции различной твердости.
В одном варианте на порошкообразные компоненты прессованной композиции перед прессованием наносят покрытие.
В другом варианте на прессованную композицию наносят покрытие после прессования.
В еще одном варианте покрытие наносят как перед прессованием, так и после него.
Жидкие пероральные композиции включают капсулы, содержащие жидкую композицию, при этом капсула включает покрытие.
В одном варианте покрытие наносят на внешнюю поверхность капсулы.
В другом варианте покрытие диспергируют в составе внешней фазы капсулы.
Капсулы не ограничиваются капсулами с жидким содержимым и кроме гомогенных жидкостей могут содержать твердые композиции в форме порошков, пеллетов или гетерогенных суспензий.
Если твердая композиция находится в форме пеллетов или гранул, после нанесения покрытия, как описано в данном контексте, ее можно использовать саму по себе или ею заполняют капсулы, например, твердые желатиновые капсулы или другие емкости для хранения перед введением, например, пакетики.
Пеллеты и гранулы характеризуются диаметром от 2 до 0,3 мм, например, «стандартный пеллет» характеризуется размером от 1 до 0,6 мм, а «гранулированный пеллет» характеризуется размером от 0,4 до 0,8 мм.
Композиция для покрытия по настоящему изобретению пригодны для применения в виде таблеток, описанных в данном контексте, например, ядер таблеток.
В одном варианте композицию для покрытия используют для нанесения покрытия на прессованное ядро таблетки, содержащее модулятор рецептора S1P, например, агонист S1P.
Если используют ядра таблетки, то они предпочтительно характеризуются твердостью от приблизительно 10 до 70 Н. Ядро таблетки характеризуется величиной прочности на разрыв менее 38 Н/см2, например, менее 22 Н/см2.
Ядра можно получать прессованием с низкой степенью сжатия, что позволяет использовать компоненты с покрытием и хрупкие компоненты, такие как капсулы, в составе смеси для прессования с минимальным повреждением или без повреждения.
Ядро может содержать адьювант и модулятор рецептора S1P, например, агонист рецептора S1P.
Ядро может содержать пригодные ингредиенты для таблетирования, включая разбавители, дезинтегрирующие агенты, замасливатели, смачивающие агенты, глиданты, ПАВ, ускоряющие высвобождение агенты, красители, шипучие агенты и т.п.
Ядро получают из любых составов, известных специалистам в данной области.
Ядро может содержать, без ограничения перечисленным, наполнители, такие как полиолы, например, порошкообразный маннит или другие полисахариды или сахара, альдиты, например, лактозу, сахарозу, декстрозу, маннит и крахмал.
Композиции ядер, кроме того, могут содержать или в другом варианте включать связующие, такие как ПВП, например, целлюлозу, микрокристаллическую целлюлозу, полиэтиленгликоль, поливинилпирролидон, крахмальный клейстер, аравийскую камедь, альгининовую кислоту, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, декстрин, этилцелллюлозу, желатин, глюкозу, гуаровую камедь, гидроксипропилметилцеллюлозу, алюмосиликат магния, калтодекстин, метилцеллюлозу, полиэтиленоксид, повидон, альгинат натрия и гидрированные растительные масла.
Композиции ядер, кроме того, могут включать или в другом варианте содержать дезинтегрирующие агенты (в присутствии или в отсутствии шипучих агентов), например, сшитую натриевую соль карбоксиметилцеллюлозы (кроскармеллозу), кросповидон или натриевую соль гликолята крахмала.
Композиции ядер, кроме того, могут включать или в другом варианте содержать замасливатели, например, стеарат магния, стеарат кальция, натриевую соль стеарилфумарата, коллоидный диоксид кремния или тальк.
В одном варианте ядро включает от 1,5 до 2% замасливателя, например, стеарата магния или кальция.
Композиции ядер, кроме того, могут включать или в другом варианте содержать глиданты, например, диоксид кремния.
Композиции ядер, кроме того, могут включать или в другом варианте содержать ПАВ, например, лаурилсульфат натрия или докузат натрия.
Композиции ядер, кроме того, могут включать или в другом варианте содержать ароматизаторы.
Композиции ядер, кроме того, могут включать или в другом варианте содержать шипучие агенты, например, бикарбонат натрия или лимонную кислоту.
Композиции ядер, кроме того, могут включать или в другом варианте содержать подсластители.
Композиции ядер, кроме того, могут включать или в другом варианте содержать регулирующие pH агенты, например, лимонную кислоту или фумаровую кислоту.
Ядро может содержать добавки, контролирующие скорость высвобождения. Например, лекарственное средство может содержаться в гидрофобной полимерной матрице и постепенно вымываться из нее при контактировании с жидкими средами организма.
В другом варианте лекарственное средство включено в гидрофильную полимерную матрицу, постепенно или быстро растворяющуюся в присутствии жидких сред организма. Ядро может содержать два или более слоя, с различной скоростью высвобождения. Слои являются гидрофильными, гидрофобными или представляют собой смесь гидрофильных и гидрофобных слоев. Соседние слои в многослойном ядре разделены нерастворимым защитным слоем или гидрофильным разделяющим слоем. Нерастворимый защитный слой может состоять из материала, используемого для формирования нерастворимой оболочки. Гидрофильный разделяющий слой может состоять из материала, характеризующегося более высокой растворимостью по сравнению с другими слоями ядра таблетки, и таким образом, при растворении разделяющего слоя экспонируются высвобождающие лекарственное средство слои ядра таблетки.
Пригодные контролирующие скорость высвобождения полимеры включают полиметакрилаты, этилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, кальциевую соль карбоксиметилцеллюлозы, полимеры акриловой кислоты, полиэтиленгликоль, полиэтиленоксид, каррагинан, ацетат целлюлозы, зеин и т.п.
Ядро может, кроме того, содержать материалы, набухающие при контактировании с водными растворами, и включенные в композицию, включая полимеры, такие как натриевая соль сшитой карбоксиметилцеллюлозы, сшитая гидроксипропилцеллюлоза, высокомолекулярная гидроксипропилцеллюлоза, карбоксиметиламид, калиевую соль сополимера метакрилата и дивинилбензола, полиметилметкарилат, сшитый поливинилпирролидон и высокомолеклярные поливиниловые спирты.
Ядро может содержать дополнительные фармацевтически активные ингредиенты наряду с модулятором рецептора S1P, например, агонистом S1P.
В одном варианте, если композиция ядра находится в виде стандартной лекарственной формы, каждая стандартная доза включает от 0,5 до 10 мг модулятора рецептора S1P, например, агониста S1P.
Пригодные способы получения ядер таблетки включают смешивание всех ингредиентов с последующим прессованием в таблетки, и грануляцию с последующим прессованием гранул в таблетки.
В одном варианте предлагается композиция ядра, содержащая альдит. Пример состава ядра таблетки, включающего модулятор рецептора S1P, например, агонист S1P, описан в заявке WO 2004/089341, в которой описана композиция, содержащая модулятор S1P в смеси с альдитом.
Альдит может служить разбавителем, носителем, наполнителем или увеличивающим объем агентом и включает маннит, мальтит, инозит, ксилит или лактит, предпочтительно в значительной степени негигроскопичный альдит, например, маннит (D-маннит). Используют один альдит или смесь двух или более альдитов, например, смесь маннита и ксилита, например, в соотношении от 1:1 до 4:1.
В другом варианте предлагается композиция ядра, содержащая микрокристаллическую целлюлозу, и модулятор рецептора S1P, например, агонист S1P, в отсутствии альдита.
Предпочтительно компоненты ядра и покрытия тонко измельчают.
В одном варианте твердая композиция характеризуется быстрой распадаемостью.
Предпочтительно количество активного ингредиента составляет от 0 до 1000 мг.
Композиция для покрытия представляет собой порошок или жидкость.
Композиция для покрытия может содержать полимерную смолу.
Примеры полимерных смол включают, без ограничения перечисленным, полиметакрилаты, например, метакрилат аммония, целлюлозу и ее производные, простые и сложные эфиры целлюлозы и фталат-ацетат целлюлозы.
Композиция для покрытия может содержать полиэтиленгликоль или альдит, например, ксилит.
Композиция для покрытия может также включать или в другом варианте содержать другие материалы, включая воски и масла или алкоголяты восков и масел, полоксамеры, алкилфталаты, например, диэтилфталат, лимонную кислоту или сложные эфиры.
Композиция для покрытия может также включать или в другом варианте содержать один или более следующих компонентов: акриловая кислота, полимеры и сополимеры акриловой кислоты и их производные, например, полиметилакрилат, полиалкены и их производные, включая сложные эфиры и ариловые эфиры и их производные, поливиниловые спирты и сложные эфиры, целлюлозу и ее производные, например, простые и сложные эфиры целлюлозы (сшитые или не сшитые), например, этилцеллюлозу, и один или более энтеросолюбильных полимеров, например, фталат-ацетат целлюлозы, фталат гидроксипропилметилцеллюлозы, гидроксипропилцеллюлозу, один или более биодеградабельных полимеров, например, один или более полилактидов, полигликолидов, полигидроксибутиратов, полигидроксивалератов, сополимеры этилена и винилацетата и полиангидриды (гомо- или гетерополимеры) или полиэтиленоксид.
Композиция для покрытия может также включать или в другом варианте содержать диспергирующий агент, например, лаурилсульфат натрия, докузат натрия, твины (сложные эфиры сорбита и жирных кислот), полоксамеры и цетостеариловый спирт.
Композиция для покрытия может также включать или в другом варианте содержать антифрикционный компонент для снижения силы трения и/или других сил, возникающих между частицами порошка в материале для покрытия, и для повышения текучести порошка, например, диоксид титана, коллоидный диоксид кремния, тальк или крахмал или комбинацию указанных соединений.
Композиция для покрытия может также включать или в другом варианте содержать дезинтегрирующий агент, например, натриевую соль гликолята крахмала (сшитую), натриевую соль карбоксиметилцеллюлозы (сшитую), природный крахмал, сшитый поливинилпирролидон (кросповидон), карбонат натрия, гидрокарбонат натрия или глицинат натрия.
Композиция для покрытия может также включать или в другом варианте содержать красители, например, оксиды металлов или пигменты (например, пигменты на основе алюминия), оксиды железа или красители.
Композиция для покрытия может также включать или в другом варианте содержать модификаторы вкуса, например, аспартам, ацесульфам к, цикламаты, сахарин, сахара или альдиты.
Композиция для покрытия может также включать или в другом варианте содержать ароматизаторы.
Композиция может содержать одно или более покрытий. Композицию может отделить от содержащего лекарственное средство покрытия защитным слоем. В другом варианте на содержащее лекарственное средство покрытие можно наносить внешнее покрытие. Каждое следующее покрытие может содержать полимерный материал, например, гидроксипропилметилцеллюлозу или гидроксипропилцеллюлозу. Указанные покрытия получают и наносят на композицию с использованием известных способов.
В настоящем изобретении, кроме того, предлагается способ получения фармацевтических композиций с покрытием, который заключается:
(а) в получении композиции ядра и
(б) в нанесении на ядро покрытия, содержащего модулятор рецептора S1P.
Композицию ядра получают с использованием любой методики, описанной в данном контексте.
Покрытие можно наносить на ядро с использованием известных в данной области техники способов, например, методом псевдоожиженного слоя.
Модуляторы S1P
Каждая из различных композиций, описанных в данном контексте, включает модулятор S1P. В варианте каждой композиции, описанной в данном контексте, модулятор S1P означает агонист S1P.
Агонисты рецептора SIP обычно означают аналоги сфингозина, такие как 2-замещенный 2-аминопропан-1,3-диол или производные 2-аминопропанола. Примеры пригодных агонистов рецептора S1P включают, например,
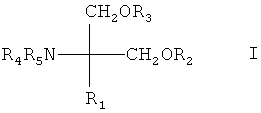
соединения, описанные в заявке EP 627406 A1, например, соединение формулы I
где
R1 означает (C12-C22)углеводород с прямой или разветвленной цепью,
содержащий в цепи связь или гетероатом, выбранный из группы, включающей двойную связь, тройную связь, О, S, NR6, где R6 означает Н, алкил, аралкил, ацил или алкоксикарбонил и карбонил и/или
содержащий заместитель, выбранный из группы, включающей алкоксигруппу, алкенилоксигруппу, алкинилоксигруппу, аралкилоксигруппу, ацил, алкиламиногруппу, алкилтиогруппу, ациламиногруппу, алкоксикарбонил, алкоксикарбониламиногруппу, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, аминогруппу, гидроксииминогруппу, гидроксигруппу или карбоксигруппу, или
R1 означает фенилалкил, где алкил означает (C6-C20)углеводород с прямой или разветвленной цепью или
фенилалкил, где алкил означает (C1-C30)углеводород с прямой или разветвленной цепью, где указанный фенилалкил включает в качестве заместителя
(C6-C20)углеводород с прямой или разветвленной цепью, необязательно замещенный атомом галогена,
(C6-C20)алкоксигруппу, необязательно замещенную атомом галогена,
(C6-C20)алкенилоксигруппу,
фенилалкоксигруппу, галогенфенилалкоксигруппу, фенилалкоксиалкил, феноксиалкоксигруппу или феноксиалкил,
циклоалкил, содержащий в качестве заместителя (C6-C20)алкил с прямой или разветвленной цепью,
гетероарилалкил, содержащий в качестве заместителя (C6-C20)углеводород с прямой или разветвленной цепью,
гетероциклический алкил, где указанный алкил означает (C6-C20)углеводород с прямой или разветвленной цепью, или
гетероциклический алкил, содержащий в качестве заместителя (C2-C20)углеводород с прямой или разветвленной цепью,
и где алкильный остаток может содержать в углеводородной цепи связь или гетероатом, выбранный из группы, включающей двойную связь, тройную связь, О, S, сульфинил, сульфонил или NR6, где R6 определен выше,
и в качестве заместителя алкоксигруппу, алкенилоксигруппу, алкинилоксигруппу, аралкилоксигруппу, ацил, алкиламиногруппу, алкилтиогруппу, ациламиногруппу, алкоксикарбонил, алкоксикарбониламиногруппу, ацилоксигруппу, алкилкарбамоил, нитрогруппу, галоген, аминогруппу, гидроксигруппу или карбоксигруппу, и
каждый R2, R3, R4 и R5,независимо означает H, C1-C4алкил или ацил,
или их фармацевтически приемлемую соль,
соединения, описанные в EP 1002792 A, например, соединение формулы II

где
m равно от 1 до 9, и
каждый R2, R3, R4 и R5 независимо означает H, алкил или ацил, или его фармацевтически приемлемую соль,
соединения, описанные в заявке EP 0778263 A1, например, соединение формулы III
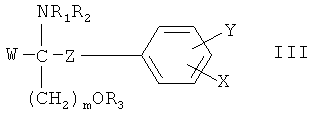
где
W означает H, (C1-C6)алкил с прямой или разветвленной цепью, (C2-C6)алкенил или (C2-C6)алкинил, незамещенный или замещенный OH-группой фенил, R4O(CH2)n, или (C1-C6)алкил с прямой или разветвленной цепью, содержащий от 1 до 3 заместителей, выбранных из группы, включающей галоген, циклоалкил, фенил и замещенный OH-группой фенил,
X означает H или незамещенную или замещенную алкильную группу с прямой цепью, содержащую p атомов углерода, или незамещенную или замещенную алкоксигруппу с прямой цепью, содержащую (p-1) атомов углерода, например, содержащую от 1 до 3 заместителей, выбранных из группы, включающей алкил, OH, алкоксигруппу, ацилоксигруппу, аминогруппу, алкиламиногруппу, ациламиногруппу, оксогруппу, галоген, незамещенный фенил или фенил, содержащий от 1 до 3 заместителей, выбранных из группы, включающей алкил, OH, алкоксигруппу, ацил, ацилоксигруппу, аминогруппу, алкиламиногруппу, ациламиногруппу, галогеналкил или галоген,
Y означает H, алкил, OH, алкоксигруппу, ацил, ацилоксигруппу, аминогруппу, алкиламиногруппу, ациламиногруппу, галогеналкил или галоген,
Z означает простую связь или алкилен с прямой цепью, содержащий q атомов углерода,
p и q каждый независимо равен целому числу от 1 до 20, при условии, что 6≤p+q≤23,
m равно 1, 2 или 3,
n равно 2 или 3,
каждый R1, R2, R3 и R4 независимо означает H, алкил или ацил,
или их фармацевтически приемлемую соль,
соединения, описанные в заявке WO 02/18395, например, соединения формулы IVa или IVb

где
X означает O, S, NR1 или группу -(CH2)n-, незамещенную или содержащую в качестве заместителя от 1 до 4 атомов галогена,
n равно 1 или 2,
R1 означает H или C1-C4алкил, незамещенный или замещенный галогеном,
R1a означает H, OH, C1-C4алкил или O(C1-C4)алкил, где алкил незамещен или замещен 1-3 атомами галогена,
R1b означает H, OH или C1-C4алкил, где алкил незамещен или замещен галогеном,
каждый R2 независимо выбирают из группы, включающей Н или C1-C4алкил, где алкил незамещен или замещен галогеном,
R3 в случае соединения формулы IVa означает H, OH, галоген или O(C1-C4)алкил, где алкил незамещен или замещен галогеном,
R3 в случае соединения формулы IVb означает H, OH, галоген, C1-C4алкил, где алкил незамещен или замещен гидроксигруппой, или означает O(C1-C4)алкил, где алкил незамещен или замещен галогеном,
Y означает -CH2-, -C(O)-, -CH(OH)-, -C(=NOH)-, O или S,
R4 означает (C4-C14)алкил или (C4-C14)алкенил,
или его фармацевтически приемлемую соль или гидрат,
соединения, описанные в заявке WO 02/06268 или JP-14316985, например, соединение формулы VII

где
каждый R1 и R2 независимо означает H или аминозащитную группу,
R3 означает водород или гидроксизащитную группу,
R4 означает C1-C6алкил,
n равно целому числу от 1 до 6,
X означает этилен, винилен, этинилен, группу формулы -D-CH2- (где D означает карбонил), группу формулы -CH(OH)-, O, S или N), арил или арил, содержащий вплоть до трех заместителей, выбранных из группы, описанной ниже,
Y означает простую связь, C1-C10алкилен, C1-C10алкилен, замещенный 1-3 заместителями, выбранными из групп a и b, C1-C10алкилен, содержащий атомы O или S в центральном или в концевом фрагменте углеводородной цепи, или C1-C10алкилен, содержащий атомы O или S в центральном или в концевом фрагменте углеводородной цепи, которая, в свою очередь замещена 1-3 заместителями, выбранными из групп a и b,
R5 означает водород, циклоалкил, арил, гетероциклическую группу, циклоалкил, замещенный 1-3 заместителями, выбранными из групп a и b, арил, замещенный 1-3 заместителями, выбранными из групп a и b, или гетероциклическую группу, замещенную 1-3 заместителями, выбранными из групп a или b, и
каждый R6 и R7 независимо означают Н или заместитель, выбранный из группы a,
<группа a> означает галоген, (низш.)алкил, галоген(низш.)алкил, (низш.)алкоксигруппу, (низш.)алкилтиогруппу, карбоксил, (низш.)алкоксикарбонил, гидроксигруппу, (низш.)алифатический ацил, аминогруппу, моно(низш.)алкиламиногруппу, ди(низш.)алкиламиногруппу, (низш.)алифатическую ациламиногруппу, цианогруппу и нитрогруппу,
<группа b> означает циклоалкил, арил, гетероцикл, каждый из которых необязательно включает вплоть до трех заместителей, выбранных из группы a,
при условии, что если R5 означает водород, Y означает простую связь, или C1-C10алкилен с прямой цепью, например, (2R)-2-амино-4-[3-(4-циклогексилоксибутил)бензо[b]тиен-6-ил]-2-метил бутан-1-ол,
или фармакологически приемлемые соль или сложный эфир указанного соединения.
Если в соединениях формулы I углеводородная цепь R1 включает заместитель, то заместитель предпочтительно выбирают из группы, включающей галоген, нитрогруппу, аминогруппу, гидроксигруппу или карбоксигруппу. Если углеводородная цепь прервана необязательно замещенным фениленом, то цепь предпочтительно незамещена. Если остаток фенилена включает заместитель, то заместитель предпочтительно означает галоген, нитрогруппу, аминогруппу, метоксигруппу, гидроксигруппу или карбоксигруппу. Ацил означает остаток R-CO-, где R означает C1-C6алкил, C3-C6циклоалкил, фенил или фенил(C1-C4)алкил.
Предпочтительные соединения формулы I включают соединения, в которых R1 означает алкил с прямой или разветвленной цепью, предпочтительно с прямой цепью, содержащий от 13 до 20 атомов углерода, необязательно замещенный нитрогруппой, галогеном, аминогруппой, гидроксигруппой или карбоксигруппой, более предпочтительно R1 означает фенилалкил, замещенный C6-C14алкилом с прямой или разветвленной цепью, необязательно замещенный галогеном, и алкильный остаток означает C1-C6алкил, необязательно замещенный гидроксигруппой. Более предпочтительно R1 означает фенил(C1-C6)алкил, замещенный C6-C14алкилом с прямой или разветвленной цепью, предпочтительно с прямой цепью. C6-С14алкил находится в орто-, мета- или пара-положении, предпочтительно в пара-положении.
Предпочтительно каждый R2-R5 означает H.
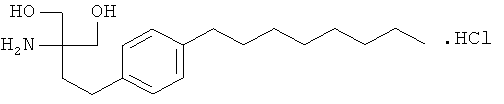
Предпочтительным соединением формулы I является 2-амино-2-тетрадецил-1,3-пропандиол. Прежде всего, предпочтительным агонистом рецептора SIP формулы I является 2-амино-2-[2-(4-октилфенилэтил)]пропан-1,3-диол в свободной форме или в форме фармацевтически приемлемой соли (в данном контексте соединение А), например, гидрохлорид, т.е. FTY720:
Предпочтительным соединением формулы II является соединение, где каждый R2-R5 означает H, a m равно 4, т.е. 2-амино-2-{2-[4-(1-оксо-5-фенилпентил)фенил]этил}пропан-1,3-диол (в данном контексте соединение В) в свободной форме или в форме фармацевтически приемлемой соли, например, гидрохлорид.
Предпочтительным соединением формулы IVa является фосфат соединения A (R2 означает H, R3 означает OH, X означает O, R1a и R1b означают OH). Предпочтительным соединением формулы V является фосфат соединения В (R1 означает CH2OH, R3 означает H, X означает O, m равно 1, R2 означает фосфат, а R означает 2-[4-(1-оксо-5-фенилпентил)фенил]этил.
Если соединения формул I-VII содержат в молекуле один или более асимметричных центров, то подразумеваются различные оптические изомеры, а, также, рацематы, диастереомеры и их смеси.
Примеры фармацевтически приемлемых солей соединений формулы I-VII включают соли неорганических кислот, такие как гидрохлорид, гидробромид и сульфат, соли органических кислот, такие как ацетат, фумарат, малеат, бензоат, цитрат, малат, метансульфонат и бензенсульфонат, или, в соответствующих случаях, соли металлов, таких как натрий, калий, кальций и алюминий, соли аминов, таких как триэтиламин, и соли двухосновных аминокислот, таких как лизин. Соединения и соли по настоящему изобретению включают гидраты и сольваты.
Композиция по настоящему изобретению может содержать одну или более солей и/или свободных кислот модуляторов S1P.
Композиция по настоящему изобретению предпочтительно содержит от 0,01 до 20 мас.% модулятора рецептора S1P, более предпочтительно от 0,1 до 10 мас.%, например, от 0,5 до 5 мас.% в расчете на общую массу композиции.
Если стандартной лекарственной формой является капсула, то каждая стандартная форма может содержать от 0,5 до 10 мг модулятора рецептора S1P.
Применение
Фармацевтические композиции по настоящему изобретению используют в отдельности или в комбинации с другими активными агентами, предназначенными для лечения или профилактики состояний, описанных, например, в заявках US 5604229, WO 97/24112, WO 01/01978, US 6004565, US 6274629 и JP-14316985, содержание которых включено в настоящее описание в качестве ссылок.
Композиции, описанные в данном контексте, могут ускорять абсорбцию и проницаемость модулятора S1P через гематоэнцефалический барьер в мозг. Прежде всего, фармацевтические композиции используют:
а) для лечения и профилактики отторжения трансплантатов органов или тканей, например, для лечения реципиентов после пересадки сердца, легких, сердца-легких, печени, почек, поджелудочной железы, кожи или роговицы, и для профилактики заболевания трансплантат-против-хозяина, которое иногда развивается после пересадки костного мозга, прежде всего для лечения острого или хронического отторжения алло- и ксенотрансплантатов, или после пересадки инсулинпродуцирующих клеток, например, островковых клеток поджелудочной железы,
б) для лечения и профилактики аутоиммунных заболеваний или воспалительных состояний, например, рассеянного склероза, артрита (например, ревматоидного артрита), воспаления кишечника, гепатита и т.п.
в) для лечения и профилактики вирусного миокардита и вирусных заболеваний, вызванных вирусным миокардитом, включая гепатит и СПИД.
В одном варианте настоящего изобретения предлагается лечение воспалительных состояний. Например, настоящее изобретение относится к композициям для контроля и/или подавления активации тучных клеток и секреции с целью снижения интенсивности воспалительных состояний, например, мозга при рассеянном склерозе.
Кроме того, предлагается способ защиты субъектов при рассеянном склерозе от нейродегенеративного воспаления мозга, и указанный способ заключается во введении указанным субъектам описанной в данном контексте композиции, например, композиции, включающей агонист рецептора S1P или другой модулятор.
Композиции по настоящему изобретению и любой концентрат, предназначенный для разбавления, и полученный из него фармацевтический раствор вводят в терапевтически эффективном количестве для лечения заболевания или состояния, которое поддается лечению при введении модулятора рецептора S1P.
Точное количество модулятора рецептора S1P или его фармацевтически приемлемой соли для введения можно изменять в широком интервале. Доза зависит от конкретного соединения, курса лечения, способа введения, концентрации конкретного концентрата или применяемого фармацевтического раствора, природы заболевания или состояния, подлежащего лечению, пола, возраста и массы тела пациента. Доза, кроме того, зависит от развития, природы и тяжести любых отрицательных побочных эффектов, которые наблюдаются при введении концентрата или фармацевтической композиции. Обычно детям вводят дозу от 0,5 до 5 мг модулятора рецептора S1P, например соединения А.
Композицию по настоящему изобретению и любой концентрат, предназначенный для разбавления, и полученный из него фармацевтический раствор можно вводить в комбинации с другими иммунодепрессантом(ами), стероидом(ами), такими как преднизолон, метилпреднизолон, дексаметазон, гидрокортизон и т.п., или нестероидным противовоспалительным агентом. Комбинацию активных агентов можно вводить одновременно или последовательно, причем сначала вводят один из активных агентов. Дозировка активных агентов при комбинированном лечении зависит от эффективности и участка действия каждого активного агента, а, также, от синергетического эффекта агентов, использованных для комбинированного лечения.
Настоящее изобретение иллюстрируется следующими примерами.
Пример 1
Тонко измельченное соединение: гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола (FTY720) просеивали и смешивали с микрокристаллической целлюлозой, например, Avicel PH 102. Смесь измельчали в измельчителе Frewitt MGI (Key International Inc., США) при использовании сита 30 меш. Стеарат магния просеивали через сито 20 меш и смешивали со смесью FTY720/целлюлоза. Для получения готовой композиции добавляли кроскармелозу.
Пример состава ядра круглых таблеток диаметром 6 мм, массой 80 мг, полученных прямым прессованием, показан ниже.
В другом варианте ядро таблетки получали при уплотнении композиции в прессе для таблетирования с использованием пуансона размером 7 мм, при этом получали таблетки массой 120 мг, например, как описано ниже.
1 мг FTY720 в свободной форме соответствует 1,12 мг гидрохлорида FTY720.
Пример 2
В данном примере использовали способ, описанный в примере 1, но вместо стеарата магния добавляли продукт Cutina® (гидрированное касторовое масло).
Пример 3
В данном примере таблетки получали, как описано в примерах 1 и 2, но вместо FTY720 в каждом случае использовали гидрохлорид 2-амино-2-{2-[4-(1-оксо-5-фенилпентил)фенил]этил}пропан-1,3-диола.
Примеры 4-7
Получали таблетки, содержащие следующие ингредиенты (мг):
FTY720, D-маннит и ксилит помещали в гранулятор с псевдоожиженным слоем (модель МР-01, Powrex), перемешивали в течение 5 мин, гранулировали при распылении связующего раствора и сушили до температуры отработанного воздуха 40°C. Условия грануляции приведены ниже. Сухой порошок пропускали через сито 24 меш, добавляли к определенному количеству наполнителя и замасливателя и перемешивали в смесителе (трубчатый смеситель, WAB) в течение 3 мин, при этом получали порошок для прессования.
Полученный порошок прессовали на машине для таблетирования (Cleanpress correct 12 HUK, Kikushui Seisakusho) с пуансоном с внутренним диаметром 7 мм × радиус 7,5 мм, сила сжатия 9800 Н.
Условия грануляции:
Пример 8
Пример порошкообразной композиции для покрытия
Компоненты предварительно смешивали при высоком сдвиге, затем гранулировали во влажном состоянии, смешивая с водой при высоком сдвиге. Гранулированную смесь сушили в сушилке с псевдоожиженным слоем до остаточного содержания влаги менее 3 мас.%. Высушенные гранулы измельчали и получали порошок.
Пример 9
Пример порошкообразной композиции для покрытия
Пример 10
Пример жидкой композиции для покрытия (водная дисперсия)
На стадиях плавления или сушки к поверхности ядра необходимо прикладывать энергию, чтобы расплавить порошок или высушить жидкость, при этом получают однородное покрытие на экспонированной поверхности ядра. Подачу энергии обеспечивают фокусированным облучением предпочтительно в инфракрасной области, требуемая энергия определяется материалом покрытия. После плавления или сушки покрытие отверждают охлаждением с использованием вентилятора.
Пример 10
Пример круглой таблетки массой 127 мг, диаметром 7 мм с быстрой распадаемостью по настоящему изобретению
Таблетки получали по известным методикам. Например, таблетку получали смешиванием всех ингредиентов и прессованием в таблетки и/или грануляцией и/или измельчением с последующим прессованием гранул в таблетки.
Пример 11
Получали композицию, характеризующуюся быстрой распадаемостью, содержащую желатин (3%), маннит в качестве структурирующего агента (1-5%), подсластители, ароматизаторы.
Желатин и маннит добавляли в воду и нагревали до 40°C для растворения. Раствор желатина/маннита охлаждали до 23°C и смешивали с активным ингредиентом, например, агонистом или другим модулятором S1P. Общее содержание твердого вещества составляет менее 50%. Перед началом лиофилизации суспензию (с покрытием или без покрытия) охлаждали до 15°C для предотвращения осаждения.
Пример 12
Композицию получали, как описано в примере 11, но вместо маннита использовали сорбит.
Пример 13
Измельченный гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола (FTY720) просеивали и смешивали с микрокристаллической целлюлозой, например, Avicel PH 102. Затем смесь измельчали на измельчителе Frewitt MGI (Key International Inc. США) и сите с диаметром ячеек 30 меш. Стеарат магния просеивали через сито 20 меш и смешивали со смесью FTY720/целлюлоза. Для получения готовой композиции добавляли кросскармелозу.
Пример ядра круглой таблетки массой 80 мг и диаметром 6 мм, полученного прямым прессованием показан ниже.
Пример 14
Измельченное соединение А, например, гидрохлорид 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола (FTY720), просеивали и 116,7 г просеянного соединения смешивали с 9683,3 г микрокристаллической целлюлозы. Смесь измельчали с использованием измельчителя Frewitt MGI (Key International Inc., США), диаметр ячеек 30 меш. Стеарат магния просеивали с использованием сита с диаметром ячеек 20 меш и 200 г просеянного соединения смешивали с FTY720, при этом получали готовую композицию.
Композицию затем уплотняли на прессе для таблетирования с использованием пуансона 7 мм, при этом получали таблетки массой 120 мг, каждая из которых содержит:
Пример 15
В следующем примере повторяли методику, описанную в примере 14, но вместо стеарата магния использовали продукт Cutina® (гидрированное касторовое масло).
Пример 16
Соединение А, например, FTY720, и микрокристаллическую целлюлозу, например, Avicel PH 102,каждое в отдельности Просеивали с использованием сита с диаметром ячеек 18 меш. 1,9 г просеянного FTY720 смешивали с 40 г просеянной микрокристаллической целлюлозы (120 вращений в блендере при скорости 32 об/мин). Смесь FTY720 затем просевали через сито 35 меш.
Просеянную смесь FTY720 помещали в гранулятор и добавляли еще 340,1 г микрокристаллической целлюлозы, например, Avicel PH 102 и 12 г гидроксипропилцеллюлозы. Смесь перемешивали в течение 3 мин. Затем добавляли воду со скоростью 100 мл/мин и смесь гранулировали в течение 2 мин. Гранулят переносили в лотковую сушку и сушили при 50°C в течение 150 мин.
Смесь затем измельчали в измельчителе Frewitt MGI с использованием сита с диаметром ячеек 35 меш. Стеарат магния просеивали и 6 г просеянного соединения смешивали с FTY720 (90 вращений при скорости 32 об/мин), при этом получали композицию, характеризующуюся однородным распределением агониста рецептора S1P в смеси с микрокристаллической целлюлозой, например, Avicel PH 102.
Готовой композицией заполняли твердые желатиновые капсулы размера 3 в машине для инкапсулирования Н&К 400. В каждую капсулу помещали 120 мг композиции. Таким образом, каждая капсула включает:
Пример 17
В указанном примере композицию получали, как описано в примере 16, но вместо стеарата магния использовали продукт Cutina® (гидрированное касторовое масло).
Пример 18
В указанном примере композицию получали, как описано в примере 16, но вместо гидроксипропилцеллюлозы использовали гидроксипропилметилцеллюлозу.
Пример 19
Измельченное соединение А, например, FTY720, просеивали через сито с диаметром ячеек 425 мкм (40 меш). 58,35 г просеянного соединения смешивали с 4841,65 г микрокристаллической целлюлозы, например, Avicel PH 102, в бункерном смесителе 25L Bohle в течение 240 циклов вращения. Смесь измельчали в измельчителе Frewitt MGI, с использованием сита с диаметром ячеек 425 мкм и измельченную смесь снова перемешивали. Стеарат магния просеивали и 100 г просеянного соединения смешивали со смесью FTY720, при этом получали готовую композицию, характеризующуюся достаточно однородным распределением агониста рецептора S1P в смеси.
Полученной композицией заполняли твердые желатиновые капсулы размера 3 в машине для инкапсулирования Н&К 400. В каждую капсулу помещали 120 мг композиции. Таким образом, каждая капсула включает:
Примеры 20 и 21
В указанных примерах композицию получали, как описано в примере 19, но каждая капсула включает следующие количества компонентов:
Примеры 22-24
В указанных примерах композицию получали, как описано в примерах 19-21, но вместо стеарата магния в каждом случае использовали продукт Cutina® (гидрированное касторовое масло).
Примеры 25-35
В указанных примерах композицию получали, как описано в примерах 13-23, но вместо FTY720 в каждом случае использовали гидрохлорид 2-амино-2-{2-[4-(1-оксо-5-фенилпентил)фенил]этил}пропан-1,3-диола.
Примеры 36-38
Получали фармацевтические композиции, содержащие следующие ингредиенты:
FTY720 и часть микрокристаллической целлюлозы, например, Avicel РН 102, эквивалентную удвоенной массе FTY720, смешивали в смесителе Microspeed Mixer типа MS-5 (Palmer, США) в течение 2 мин при скорости 1200 об/мин. В смесь добавляли остальное количество микрокристаллической целлюлозы и перемешивали в течение еще 2 мин. 80 или 60 мл 5% раствора метилцеллюлозы SM-25 добавляли из бункера и гранулировали в аналогичных условиях. Смесь экструдировали через сито с диаметром ячеек 0,4 мм на экструдере типа RG-5. Экструдат сушили при 65°C в грануляторе с псевдоожиженным слоем типа STREA I (Patheon, Canada) и просеивали через сита с диаметром ячеек 24 меш. Мелкие частицы, проходящие через сито 60 меш, отделяли. Полученными тонкоизмельченными гранулами заполняли капсулы в машине для инкапсулирования Zuma (100 мг в каждую капсулу).
Пример 39
Пример композиции для получения таблетки, содержащий 1,25 мг FTY720, полученной влажной грануляцией.
Композиция для влажной грануляции.
Микрокристаллическую целлюлозу гранулировали методом влажной грануляции с водным раствором FTY720 и ГПМЦ. После высушивания смесь просеивали и смешивали с маннитом, диоксидом кремния, кроскармеллозой и стеаратом магния, полученную смесь прессовали в круглые таблетки массой 100 мг и диаметром 6 мм.
В другом варианте композицию получали в отсутствии альдитов, таких как маннит, который заменяли на микрокристаллическую целлюлозу.
Пример 40
Пример композиции для покрытия, содержащей FTY720.
Композиция для покрытия пеллетов, минитаблеток и небольших таблеток.
Полимер ГПМЦ можно заменить, например, на ГПЦ или другой подобный полимер. Покрытие, содержащее FTY720, можно наносить на пеллеты, содержащие активный ингредиент, или пеллеты-плацебо, минитаблетки или небольшие таблетки, разделенные, например, защитным покрытием (например, ГПЦ) и/или содержащие дополнительное покрытие (например, ГПМЦ). Указанной лекарственной формой можно заполнять капсулы (например, из ГПМЦ или твердые желатиновые капсулы) или другую упаковку, таким образом, можно получать любые композиции, содержащие различную дозу активного агента или различные комбинации агентов.
Реферат
Настоящее изобретение относится к медицине и описывает твердую фармацевтическую композицию, пригодную для перорального введения, включающую: модулятор рецептора S1P, который представляет собой 2-амино-2-[2-(4-октилфенилэтил)]пропан-1,3-диол в свободной форме или в форме фармацевтически приемлемой соли или его фосфат и микрокристаллическую целлюлозу, в отсутствие сахарного спирта. Изобретение обеспечивает повышение стабильности композиции при хранении. 8 з.п. ф-лы, 40 пр.
Формула
(а) модулятор рецептора S1P, который представляет собой 2-амино-2-[2-(4-октилфенилэтил)]пропан-1,3-диол в свободной форме или в форме фармацевтически приемлемой соли или его фосфат и
б) микрокристаллическую целлюлозу в отсутствие сахарного спирта.
Документы, цитированные в отчёте о поиске
Фармацевтическая композиция

Комментарии