Вакцинные композиции, характеризующиеся улучшенной стабильностью и иммуногенностью - RU2730625C2
Код документа: RU2730625C2
Чертежи












































































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[001] Настоящая заявка включает в себя раскрытия предварительных заявок США с серийным номером 62/213947, поданной 3 сентября 2015 г.; 62/255786, поданной 16 ноября 2015 г., 62/309216, поданной 16 марта 2016 г. и 62/350973, поданной 16 июня 2016 г., во всей своей полноте для всех целей.
ОПИСАНИЕ ТЕКСТОВОГО ФАЙЛА, ПОДАННОГО В ЭЛЕКТРОННОМ ВИДЕ
[002] Содержание текстового файла, поданного в электронном виде с данным документом, включено в данный документ посредством ссылки во всей полноте: Копия перечня последовательностей в машиночитаемом формате (имя файла: NOVV_060_03US_SeqList_ST25.txt, дата записи 6 сентября 2016 г.; размер файла 91 килобайт).
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в целом относится к наночастицам, пригодным для стимуляции иммунных ответов. Наночастицы обеспечивают доставку антигенов, например, гликопротеиновых антигенов, ассоциированных с ядром, содержащим детергент, и их обычно получают с помощью подходов с использованием рекомбинантных методик. Наночастицы характеризуются улучшенной стабильностью и усиленной презентацией эпитопов. В настоящем изобретении также предусмотрены композиции, содержащие наночастицы, способы их получения и способы стимуляции иммунных ответов.
УРОВЕНЬ ТЕХНИКИ
[003] Инфекционные заболевания остаются проблемой во всем мире. Несмотря на то, что имеется прогресс при разработке вакцин против некоторых патогенов, многие остаются угрозой для здоровья человека. Наиболее известным является ВИЧ, для которого получение вакцины остается труднодостижимым. Были предприняты попытки получения вакцин против определенных патогенов, однако они оказались неэффективными, что приводило к дополнительным проявлениям патологии. Другие патогены также продолжают представлять собой проблему, в том числе вирус Эбола, который спорадически появляется в виде эпидемий, особенно в Африке, и приводит к гибели людей и глобальному влиянию на экономику. Вирус гриппа представляет собой еще один вирус, к которому имеющиеся вакцины обеспечивают некоторую защиту, однако технические проблемы, связанные с получением вируса, означают, что вакцины против сезонного гриппа могут обеспечивать недостаточную защиту.
[004] Применение эффективной вакцины основано на комбинации достижений. Вакцина должна стимулировать эффективный иммунный ответ, который ослабляет инфекцию или заболевание в достаточной степени, чтобы быть эффективной. Вакцина также должна быть достаточно стабильной для применения в сложных условиях среды, где хранение при низких температурах может быть недоступным.
[005] Таким образом, имеется постоянный интерес в получении вакцин против вирусов, которые представляют проблемы для здоровья во всем мире, и остается необходимость в получении эффективных вакцин с высокой стабильностью.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[006] В настоящем изобретении предусмотрены наночастицы, пригодные для индуцирования иммунных ответов в отношении патогенов. Наночастицы предусматривают улучшенную стабильность, а также эффективную иммуногенность. В конкретных аспектах патоген представляет собой вирус, и обычно антиген, используемый для получения вирусной наночастицы, представляет собой вирусный гликопротеин.
[007] В одном аспекте в настоящем изобретении предусмотрены наночастицы, содержащие вирусные белки, которые характеризуются повышенной стабильностью. В некоторых вариантах осуществления в настоящем изобретении предусмотрена вакцинная композиция, содержащая наночастицу, содержащую неионный детергент, вирусный гликопротеин и фармацевтический буфер. В типичных вариантах осуществления неионный детергент может быть выбран из группы, состоящей из PS20, PS40, PS60, PS65 и PS80. В некоторых вариантах осуществления композиция не содержит какой-либо свободный неионный детергент. Одна или более гликопротеиновых молекул антигена окружают содержащее детергент ядро, которое содержит неионный детергент, и это представляет собой структуру наночастицы, которая способствует иммуногенности и ингибирует распад антигена.
[008] В некоторых вариантах осуществления антиген выбран из группы, состоящей из F-белка RSV, белка HA вируса гриппа, белка NA вируса гриппа и их комбинации. Можно применять другие антигены, в том числе антиген вируса Эбола. Обычно антиген представляет собой гликопротеин.
[009] Необязательно F-белок RSV представляет собой тримерный F-белок RSV. F-белок RSV индуцирует продукцию нейтрализующих антител. В дополнительных вариантах осуществления нейтрализующие антитела распознают F-белок RSV в состоянии после слияния и/или состоянии перед слиянием. В дополнительном аспекте каждая частица PS80 может содержать от 4 до 7 F-белков RSV.
[010] В некоторых вариантах осуществления композиция на основе F-белка RSV может содержать фосфат натрия в концентрации от 15 мМ до 25 мМ; NaCl в концентрации от 125 мМ до 175 мМ; гистидин от 0,25% до 2% вес./об.; и значение pH композиции составляет от 5,8 до 7,2.
[011] В некоторых вариантах осуществления композиция на основе HA или NA вируса гриппа может содержать фосфат натрия в концентрации от 15 мМ до 25 мМ; NaCl в концентрации от 125 мМ до 300 мМ; гистидин от 0,25% до 2% вес./об.; и значение pH композиции обычно составляет свыше рН 6,8 и обычно менее приблизительно pH 8,0.
[012] В некоторых вариантах осуществления композиция содержит адъювант. В дополнительных вариантах осуществления адъювант представляет собой квасцы или Martrix M™. В некоторых вариантах осуществления композиция не содержит адъювант.
[013] В некоторых вариантах осуществления способ предупреждения инфекции предусматривает введение одной или более доз вакцинной композиции. В некоторых вариантах осуществления способа вводят одну дозу композиции, и она индуцирует защитный иммунный ответ. В некоторых вариантах осуществления способа каждая доза содержит от приблизительно 100 мкг до приблизительно 150 мкг белкового антигена. В дополнительных вариантах осуществления способа одну или более доз вводят подкожно. В некоторых вариантах осуществления способа композиция содержит адъювант. В дополнительном варианте осуществления способа адъювант представляет собой квасцы. В некоторых вариантах осуществления способа композиция не содержит адъювантов.
[014] В некоторых вариантах осуществления способа одну или более доз композиции вводят взрослому человеку. В дополнительных вариантах осуществления способа взрослым человеком является женщина и женщина может быть беременной. В дополнительных вариантах осуществления возраст взрослого человека составляет более 65 лет или более 60 лет. В некоторых вариантах осуществления способа одну или более доз композиции вводят ребенку. В дополнительных вариантах осуществления способа ребенок является новорожденным или грудным ребенком.
[015] В случае вакцины на основе RSV в некоторых вариантах осуществления, композиция содержит гетерологичную популяцию из по меньшей мере трех типов наночастиц на основе F-белка RSV, где каждая наночастица содержит по меньшей мере один тример F-белка RSV, окружающий содержащее детергент ядро, которое содержит PS80, и где первый тип наночастиц на основе F-белка RSV содержит анизотропные стержни, где второй тип наночастиц на основе F-белка RSV содержит сферические олигомеры, и где третий тип наночастиц на основе F-белка RSV содержит промежуточные формы между анизотропными стержнями и сферическими олигомерами.
[016] В некоторых вариантах осуществления способ получения наночастиц на основе F-белка RSV предусматривает получение экстракта на основе F-белка RSV из клетки-хозяина с помощью первого детергента и замену первого детергента на второй детергент, где вторым детергентом является PS80, и при этом наночастица характеризуется повышенной стабильностью. В дополнительном варианте осуществления способа первым детергентом является NP-9. В некоторых вариантах осуществления способа повышенная стабильность выбрана из устойчивости к протеазам, устойчивости к окислительному стрессу, устойчивости к тепловому стрессу и устойчивости к перемешиванию. В некоторых вариантах осуществления способа молярное соотношение PS80: F-белок RSV составляет от приблизительно 35 до приблизительно 65.
[017] В некоторых вариантах осуществления наночастица на основе F-белка RSV содержит один или более тримеров F-белка RSV, ассоциированных с ядром, содержащим детергент PS80. В случае наночастицы на основе F-белка RSV наночастица имеет средний диаметр от приблизительно 20 нм до приблизительно 60 нм, как измерено с помощью динамического светорассеяния. В некоторых вариантах осуществления наночастицы на основе F-белка RSV каждый тример F-белка RSV содержит F-белок RSV, выбранный из группы, состоящей из F-белков RSV, имеющих делецию 1-10 аминокислот, соответствующих остаткам 137-146 из SEQ ID NO:2. В некоторых вариантах осуществления наночастицы на основе F-белка RSV каждый тример F-белка RSV содержит F-белок RSV, выбранный из группы, состоящей из F-белков RSV, имеющих делецию из 1-10 аминокислот, соответствующих остаткам 137-146 под SEQ ID NO:2, и инактивированный сайт первичного расщепления белка слияния.
[018] В некоторых вариантах осуществления наночастицы на основе F-белка RSV F-белок RSV предусматривает делецию десяти аминокислот, соответствующих остаткам 137-146 из SEQ ID NO:2, и инактивацию сайта первичного расщепления фурином в результате мутации остатков аргинина в положениях 133, 135 и 136 с заменой на глутамин. В дополнительных вариантах осуществления наночастицы на основе F-белка RSV F-белок RSV содержит или состоит из SEQ ID NO:19, которая представляет собой зрелый пептид. В определенных вариантах осуществления наночастицы на основе F-белка RSV F-белок RSV содержит или состоит из SEQ ID NO:8. Вакцинные составы, содержащие наночастицы на основе F-белка RSV, содержат фактически зрелый пептид с некоторым количеством полноразмерного пептида (SEQ ID NO:8). Со временем небольшое количество усеченного F-пептида RSV может образовываться в результате протеолиза. Предпочтительно, однако, наночастицы на основе F-белка RSV, раскрытые в данном документе, сводят к минимуму такой распад и обеспечивают повышенную стабильность.
[019] В настоящей заявке также раскрыты наночастицы против вируса гриппа с повышенной термостабильностью. В отличие от предшествующих наночастиц против вируса гриппа, способы и композиции, предусмотренные в данном документе, характеризуются устойчивостью к трипсину и повышенной термостабильностью и, тем самым, иммуногенностью.
[020] Что касается вируса Эбола, предусматриваются наночастицы против вируса Эбола, содержащие гликопротеиновый (GP) тример вируса Эбола, присоединенный к содержащему неионный детергент ядру, а также вакцинные композиции, содержащие наночастицы, необязательно в комбинации с сапониновым адъювантом Matrix M. Кроме того, в настоящем изобретении предусмотрены способы индуцирования иммунного ответа на вирус Эбола у человека с помощью введения композиции, содержащей наночастицу против вируса Эбола и сапониновый адъювант. Также предусмотрены способы защиты от инфекции, вызываемой вирусом Эбола.
[021] Аналогичным образом, предусмотрены наночастицы, содержащие белки вируса гриппа, либо HA, либо NA, либо и то и другое. Предусмотрены наночастицы на основе HA, характеризующиеся устойчивостью к трипсину, являющейся показателем надлежащего фолдинга. Также предусмотрены способы защиты от инфекции, вызываемой вирусом гриппа, с помощью наночастиц против вируса гриппа в вакцинных составах.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[022] На фигуре 1A и 1B представлены первичные структуры белка F-белков RSV, сопровождаемые полипептидной последовательностью. На фигуре 1A представлена первичная структура белка дикого типа штамма А2 RSV по сравнению с таковой модифицированного F-белка RSV. Сайты расщепления фурином отмечены треугольниками. На фигуре 1B представлена аминокислотная последовательность модифицированного F-белка RSV (SEQ ID NO:19); при этом F1-домен представлен в тексте ненасыщенного цвета (остатки 1-84), F2-домен представлен в тексте насыщенного цвета (остатки 85-539), черные линии связывают цистеины, которые образуют дисульфидные связи, подчеркнутые аспарагины указывают на N-связанные сайты гликозилирования, ненасыщенные вертикальные пунктирные линии указывают на сайт расщепления фурином и насыщенные вертикальные пунктирные линии указывают на основной сайт расщепления.
[023] На фигуре 2 представлены пики разделения F-белков RSV с помощью обращенно-фазовой HPLC, где идентифицируют четыре основные молекулы, и они соответствуют 4 основным пикам. Пик, содержащий молекулы с наименьшей молекулярной массой (~51,2 кДа - ~51,3 кДа), соответствует растворимому тримеру; следующий пик представляет собой полноразмерный тример (~64,5 кДа), у которого отсутствуют жирные кислоты, и конечные два основных пика представляют собой полноразмерные тримеры, где тримеры содержат пальмитолеиновую кислоту (~64,7 кДа) и пальмитиновую кислоту (64,788 кДа), соответственно.
[024] На фигуре 3 представлено разделение F-белков RSV в восстанавливающем SDS-PAGE. Белки с самой большой молекулярной массой представляют собой высокомолекулярные молекулы, за которыми следуют варианты, содержащие F1- и F2-домены, затем только F1-домен и его варианты, за которыми следуют только F2-домены.
[025] На фигуре 4 представлен хроматографический выход LC-UV пептидного картирования, который охватывает 90% аминокислот, составляющих первичную структуру белка F-белка RSV. Было обнаружено, что охват объединенной последовательности, в том числе рано элюируемых пептидов, составляет 98%, подтверждая аминокислотную последовательность F-белка RSV.
[026] На фигуре 5 представлен гликоанализ очищенного F-белка RSV с помощью HPLC в сочетании с флуоресцентной детекцией (FLD). Основные выявленные гликановые структуры представляют собой фукозилированные гликаны Man3.
[027] На фигуре 6 представлена электронная микрофотография наночастиц на основе F-белка RSV с тримерами F-белка RSV, ассоциированными с ядрами из PS80. На фигуре дополнительно представлена характеристика одного тримера F-белка RSV, показывающая ориентацию F1- и F2-доменов, антигенного сайта II, который распознается антителом паливизумабом, и C- и N-концы F1-домена, дополнительно содержащего жирные кислоты, такие как пальмитиновые и пальмитолеиновые кислоты.
[028] На фигуре 7 представлены измерения динамического светорассеяния (DLS) размера частиц наночастиц на основе F-белка RSV. Измерения DLS показывают, что размер наночастиц модулируется как концентрацией доступного PS80, так и F-белка RSV. Повышение PS80 при фиксированной концентрации F-белка RSV приводит к снижению среднего размера наночастицы (Z-ave).
[029] На фигуре 8 представлены дискретные распределения молекулярной массы концентрации образцов в зависимости от молекулярной массы наночастиц, причем концентрация F-белка RSV и процент PS80 варьируются. Наибольшая интенсивность сигнала наночастиц достигается при 0,2% PS80 и 1 мг/мл F-белка RSV, предполагая более высокую однородность наночастиц и подтверждая модулирование размера частиц в виде комбинации концентраций PS80 и RSV.
[030] На фигурах 9A и 9B представлена форма типов наночастиц на основе F-белка RSV, получаемых с помощью различных процентов PS80 и концентраций F-белка RSV. На фигуре 9A представлено, что композиция с применением 0,2% PS80 и 0,22 мг/мл F-белка RSV приводит к образованию трех первичных типов, мономерных/димерных анизотропных стержней, сферических олигомеров и их промежуточных форм. На фигуре 9B представлено, что композиция с применением 0,05% PS80 и 0,22 мг/мл F-белка RSV приводит к образованию популяции, в которой преобладают мономерные/димерные анизотропные стержни, при этом композиция с применением 0,05% PS80 и 1,0 мг/мл F-белка RSV приводит к образованию популяции, в которой преобладают сферические олигомеры.
[031] На фигуре 10 представлены эффекты стрессовых факторов на определенные подсекции F-белка RSV в наночастице, как представлено в пептидной карте после восстановления и обработки Lys-C при относительном избытке по сравнению с контролем. Стрессоры представляют собой 50°C в течение двух недель, значение pH 3,7 при 25°C в течение одной недели, значение pH 10 при 25°C в течение одной недели, окисление белка пероксидом водорода при 25°C в течение одной недели и перемешивание при 25°C в течение одной недели.
[032] На фигуре 11 представлена стабильность антигенного сайта 2 (сайт паливизумаба), подверженного различным стрессовым условиям. Проценты представлены в виде относительного избытка по сравнению с контролем. Чем ближе к 100% или свыше, тем большей является стрессоустойчивость в свете стрессовых условий. Данные показывают, что наночастицы сохраняют высокое постоянство антигенного сайта, тем самым приводя к стабильному иммунному ответу. NSELLSLINDMPITNDQK/K; SEQ ID NO:20 и LMSNN (SEQ ID NO:21) являются участками антигенного сайта II.
[033] На фигурах 12A, 12B, 12C и 12D представлена стабильность композиции на основе наночастиц на основе F-белка RSV, характеризующейся иммуногенностью в организме мыши после того, как композиции на основе наночастиц были подвержены стрессовым факторам окружающей среды. У мышей отбирали образцы на 21-й день на наличие IgG к F-белку RSV, на 35-й день - для определения титров PCA и на 35-й день - для определения титров нейтрализующих антител RSV/A. На фигуре 12A представлены результаты для контроля при -70°C. На фигуре 12B представлены результаты для композиции, подверженной воздействию 50°C в течение двух недель. На фигуре 12C представлены результаты для композиции, подверженной воздействию значения pH 10 при 25°C в течение двух недель. На фигуре 12D представлены результаты для композиции, подверженной воздействию 0,5% пероксида водорода при 25°C в течение одной недели.
[034] На фигуре 13 представлена повышенная устойчивость к протеазам наночастиц, имеющих более высокое содержание PS80. В течение периода 18 месяцев наночастицы на основе F-белка RSV, составленные в присутствии более высокого процента PS80 (0,03%), характеризовались меньшим распадом при действии протеаз по сравнению с наночастицами на основе F-белка RSV, составленными в присутствии более низкого процента PS80 (0,015%), как оценивали с помощью SDS-PAGE. Кроме того, меньше высокомолекулярных (HMW) структур наблюдали при более высоких количествах PS80.
[035] На фигуре 14 представлено сравнение mAb, связывающихся с наносчастицами на основе F-белка RSV по сравнению с вирусным белком штамма А F-белка RSV, где константа равновесного распада для сайта I, II и IV антител показывает, что связывание антител mAb в каждом из сайтов является сопоставимым.
[036] На фигуре 15 представлены результаты анализов конкурентного связывания, в которых антитела, присутствующие в сыворотках от хлопковых крыс, подверженных воздействию условий плацебо, инфекции RSV/A, инактивированного формальдегидом RSV, наночастиц на основе F-белка RSV и наночастиц на основе F-белка RSV с квасцами, сравнивали друг с другом в отношении связывания с сайтом I, II и IV.
[037] На фигуре 16 представлена схема технологического процесса для способа получения наночастиц, раскрытых в данном документе.
[038] На фигуре 17 представлена схема технологического процесса для способа получения частиц на основе HA, раскрытых в данном документе. Клетки Sf9, содержащие экспрессируемый бакуловирусом HA, выращивают и затем экстрагируют HA с помощью неионного детергента NP9. Экстракт подвергают дальнейшей очистке и стадии замены детергента в аффинной колонке с лектином, а затем фильтруют и составляют в нерасфасованное лекарственное вещество.
[039] На фигурах 18A-18F представлены стадии и результаты, полученные с помощью способа получения наночастиц против вируса гриппа с применением гликопротеинов HA в качестве примера. На фигуре 18A представлены стадии последовательной очистки от клеточной инфекции посредством лизиса клеток и трех колонок, используемых для получения очищенных наночастиц (колонка на основе TMAE (триметиламиноэтила), за которой следует колонка, содержащая лектин чечевицы, за которой следует колонка, содержащая сульфат (SO3-)). На фигуре 18B представлена хроматограмма, полученная с помощью колонки на основе TMAE. На фигуре 18C представлена хроматограмма, полученная с помощью стадии очистки на колонке, содержащей лектин чечевицы. На фигуре 18D представлена хроматограмма, полученная с помощью стадии очистки на колонке, содержащей сульфат. На фигуре 18E представлен гель (верхняя правая панель) из стадий очистки на колонках, содержащих TMAE и LL. На нижнее панели представлен вестерн-блоттинг геля. Полосы представлены, как показано в верхней левой панели. На фигуре 18F представлен гель с элюатом из колонки, содержащей S03-.
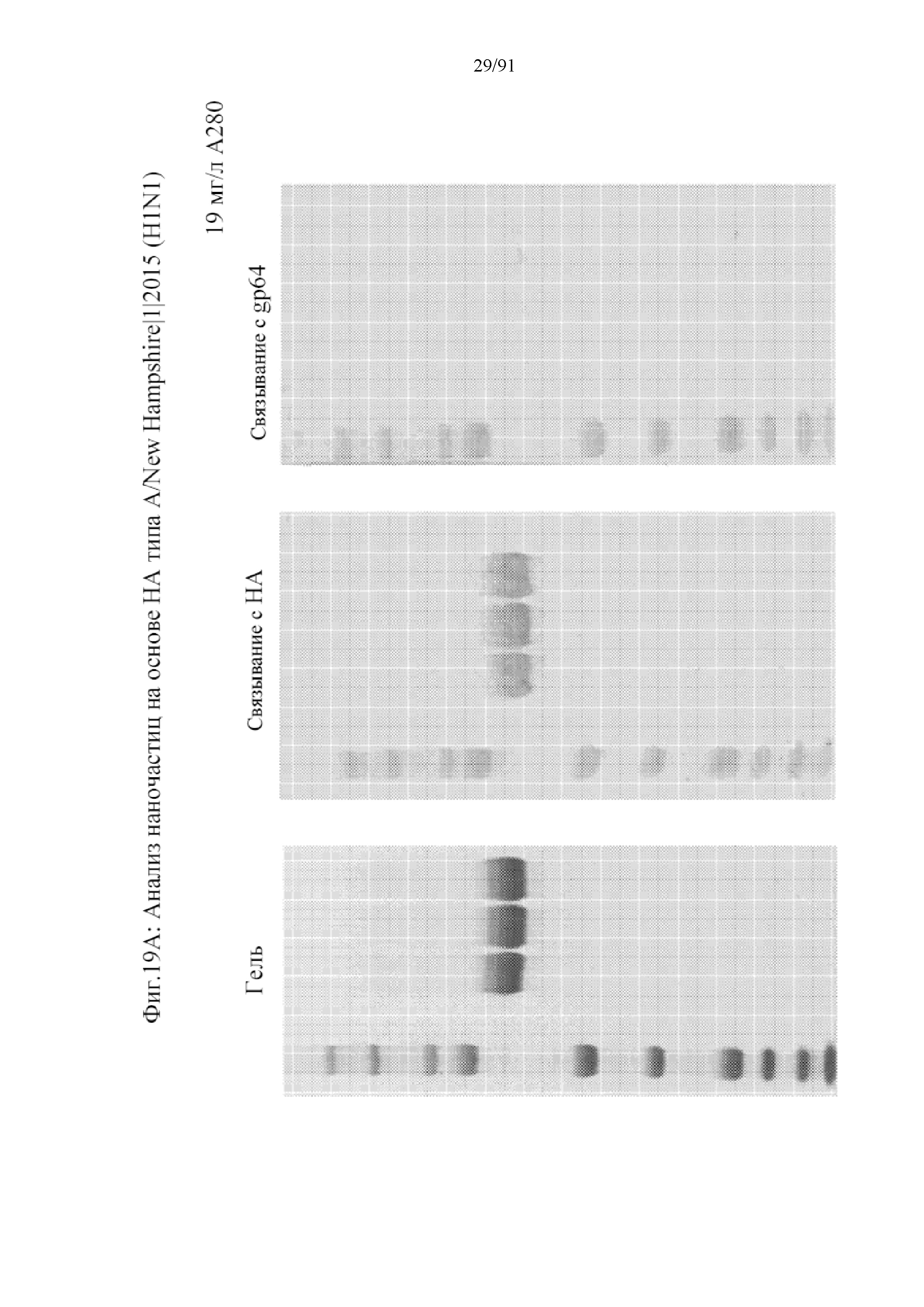
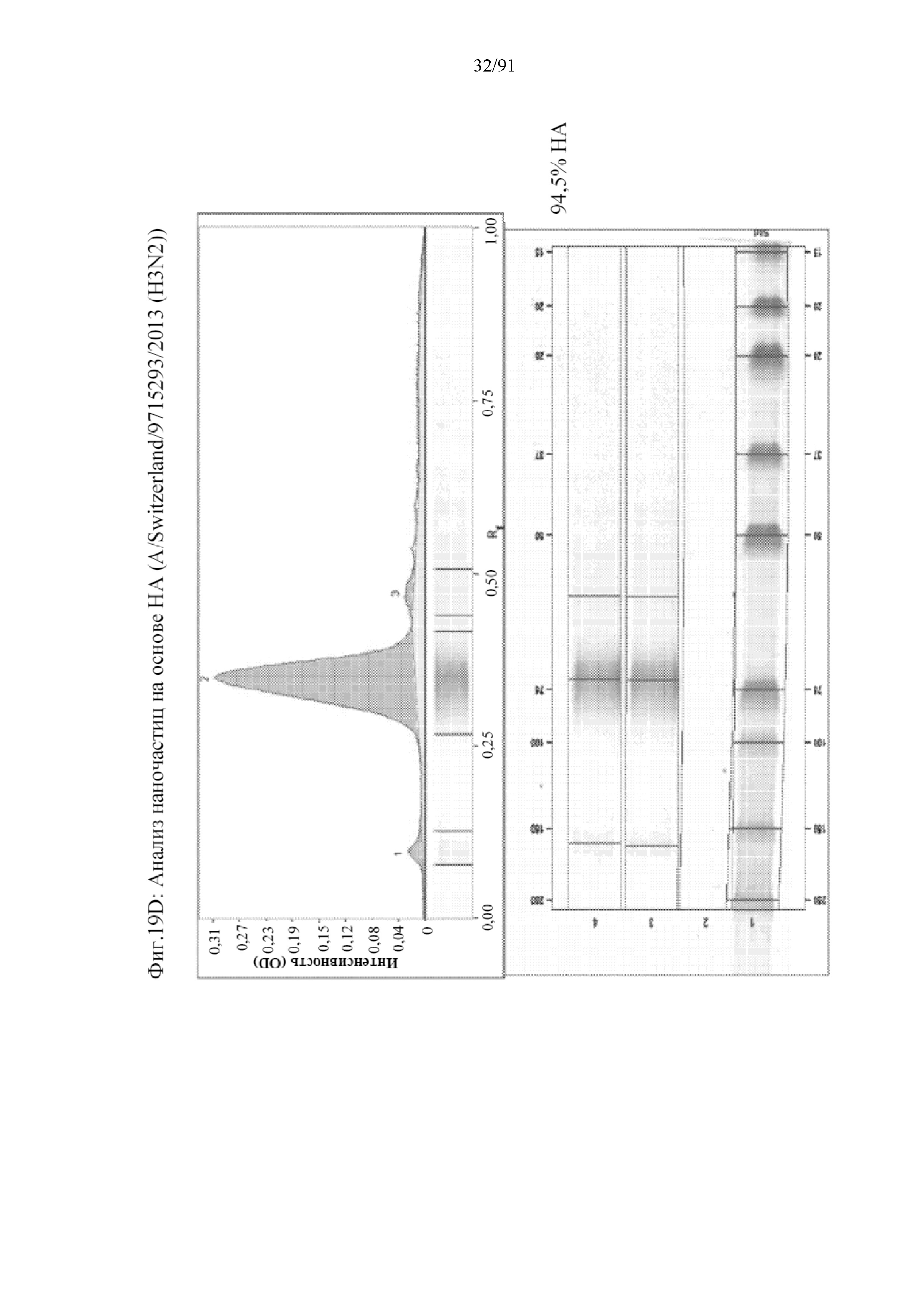
[040] На фигурах 19A-19J представлен анализ чистоты наночастиц на основе HA, полученных с помощью различных подтипов и в различных клеточных линиях насекомых. На фигуре 19A представлен гель, вестерн-блоттинг для HA и gp64 для наночастиц на основе HA, содержащих HA типа A/New Hampshire/1/2015. На фигуре 19B представлено количественное определение полосы HA и с помощью денситометрии показано, что HA является на 99,1% чистым. На фигуре 19C показан гель, вестерн-блоттинг для HA и gp64 для наночастиц на основе HA, содержащих HA типа A/Switzerland/9715293/2013. На фигуре 19D представлено количественное определение полосы HA и с помощью денситометрии показано, что HA является на 94,5% чистым. На фигуре 19E показан гель, вестерн-блоттинг для HA и gp64 для наночастиц на основе HA, содержащих HA типа A/Hong Kong/4801/2014. На фигуре 19F представлено количественное определение полосы HA и с помощью денситометрии показано, что HA является на 93,3% чистым. На фигуре 19G представлен гель, вестерн-блоттинг для HA и gp64 для наночастиц на основе HA, содержащих HA типа B/Phuket/3073/2013 в клетках Sf9 и Sf22a. На панели справа представлено количественное определение полосы HA и с помощью денситометрии показано, что HA является на 95,4% чистым. На фигуре 19H представлен гель, вестерн-блоттинг для HA и gp64 для наночастиц на основе HA, содержащих HA типа B/Brisbane/60/2008 в клетках Sf9. На панели справа представлено количественное определение полосы HA и с помощью денситометрии показано, что HA является на 96,7% чистым. На фигуре 19I представлены измерения чистоты HA с помощью RP-HPLC. На фигуре 19J обобщены данные для наночастиц на основе HA с применением трех подтипов вируса гриппа типа А и двух подтипов вируса гриппа типа В.
[041] На фигуре 20 представлены наночастицы на основе HA на электронных микрофотографиях.
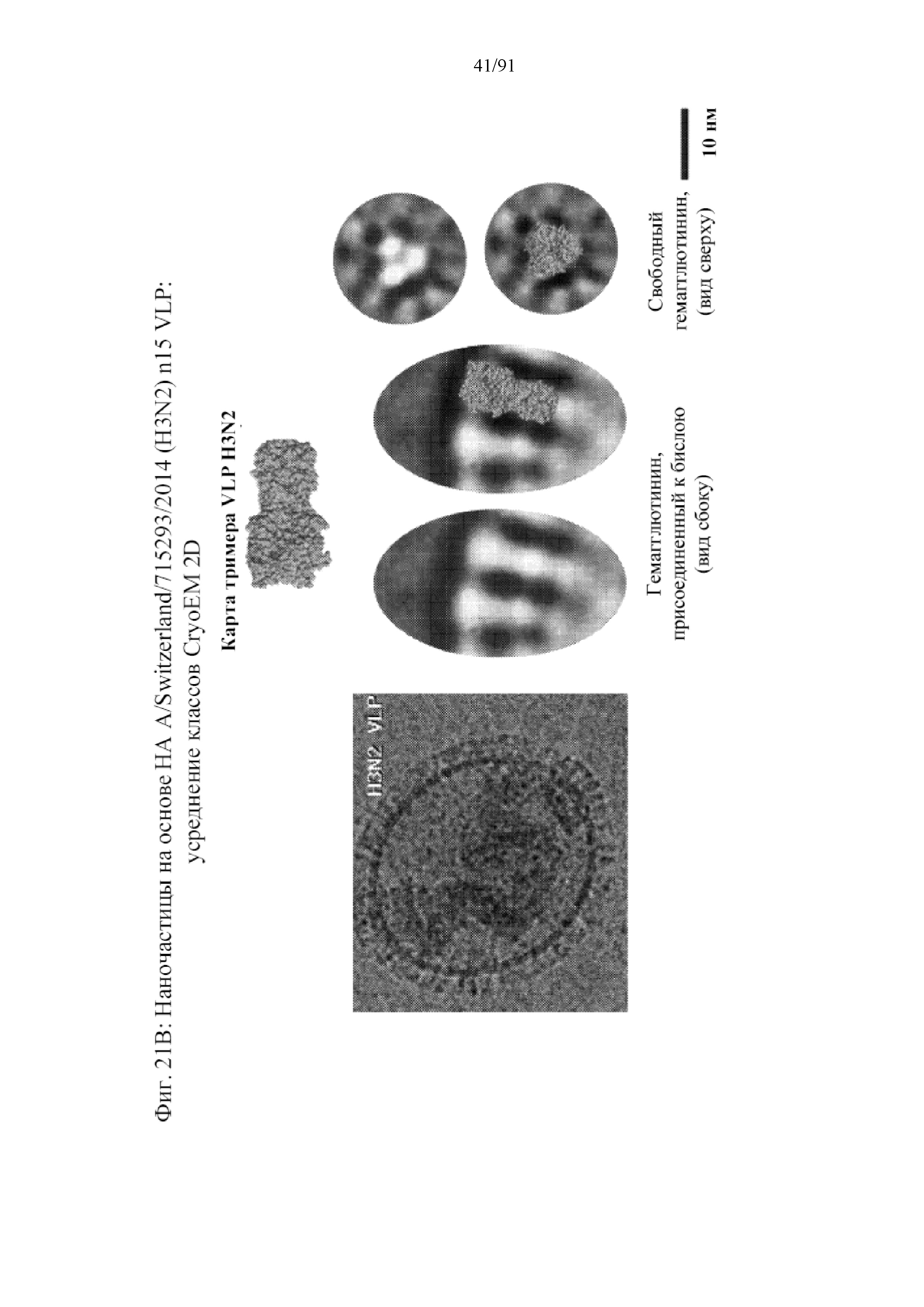
[042] На фигурах 21A и 21B представлено сравнение докинга тримеров HA на структуры cryoEM для наночастиц на основе HA (фиг. 21A) и для тримеров HA на VLP вируса гриппа, содержащих как белки HA, так и NA (фигура 21B).
[043] На фигуре 22 представлено исследование с применением композиции на основе комбинированных наночастиц, содержащей наночастицы на основе F-белка RSV, и типичной наночастицы на основе HA.
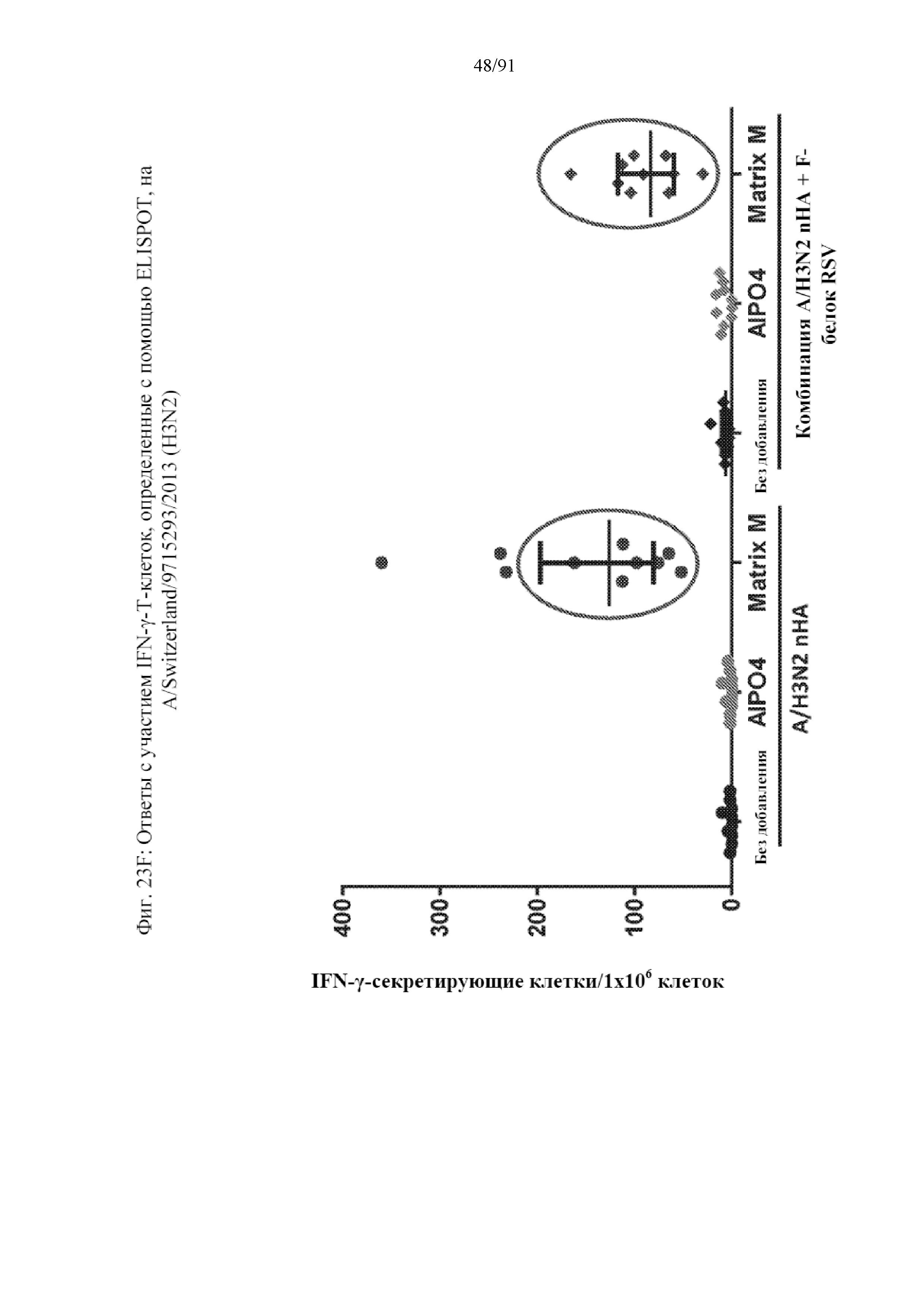
[044] На фигурах 23A-23F представлены результаты, полученные в соответствии с исследованием на фигуре 22. На фиг. 23A представлен титр HAI по отношению к гомологичному штамму. На фиг. 23B представлен титр гетерологичного HAI по отношению к гетерологичному штамму. На фиг. 23C представлены конкурирующие антитела к паливизумабу. На фиг. 23D представлены нейтрализующие антитела к штамму А RSV. На фиг. 23E представлены T-клеточные ответы на F-белок RSV. Ответ, полученный с применением наночастиц с добавленным в качестве адъюванта Matrix, является значительным. На фиг. 23F представлены T-клеточные ответы на белок вируса гриппа.
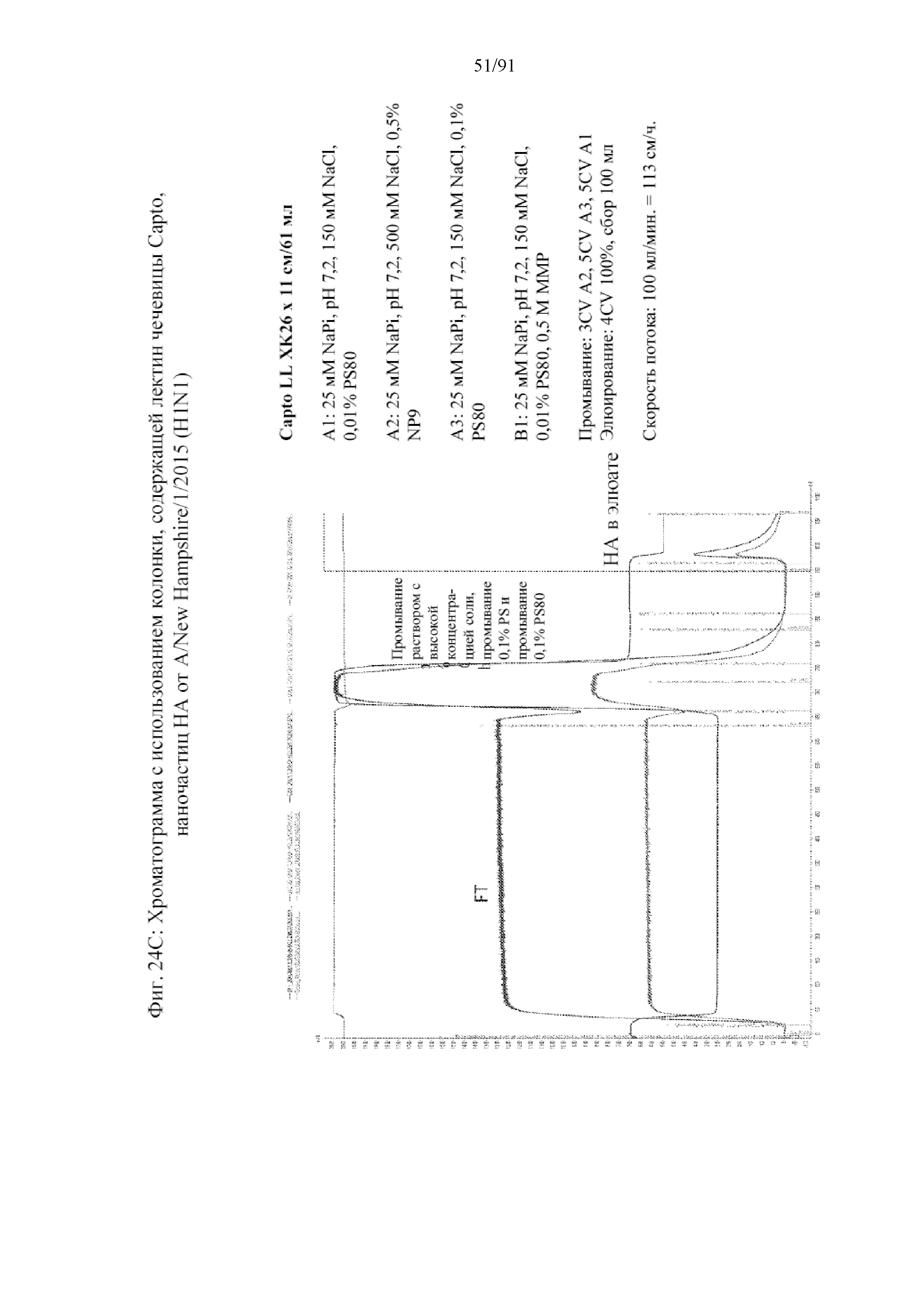
[045] На фигурах 24A-24C представлены способ и результаты получения наночастиц на основе HA, которые имеют повышенную стабильность. Примечательно, что диапазон значений pH во время этой очистки находится в нейтральном диапазоне от значений pH 7,0 до значений pH 7,4. На фигуре 24A представлены стадии очистки, начиная от применения размороженных клеток, экспрессирующих белок HA, до продукта на основе нерасфасованного лекарственного вещества (BDS). На фигуре 24B представлена хроматограмма от типичной наночастицы с применением штамма A/New Hampshire/1/2015. Элюат из колонки собирают с устранением нежелательных продуктов. На фигуре 24C представлена хроматограмма для стадии замены детергента на колонке, содержащей лектин чечевицы. Элюат из колонки снимают в виде тонкого слоя. Элюирование выполняют с помощью 0,01% PS80. Буферы являются следующими: A1: 25 мМ фосфата натрия, pH 7,2, 150 мМ NaCl, 0,01% PS80, A2: 25 мМ фосфата натрия, pH 7,2, 500 мМ NaCl, 0,5% NP9, A3: 25 мМ фосфата натрия, pH 7,2, 150 мМ NaCl, 0,1% PS80, B1: 25 мМ фосфата натрия, pH 7,2, 150 мМ. Наночастицы на основе HA затем концентрируют и хранят в 0,05% буфере на основе PS80, представленном на фиг. 24A.
[046] На фигурах 25A-25D представлены результаты очистки устойчивых к трипсину наночастиц от нескольких штаммов. На фигуре 25A представлен типичный штамм для подтипа H1N1, A/New Hampshire/1/2015. На фигуре 25B представлен типичный штамм для вируса гриппа типа В, B/Brisbane/60/08 HA. На фигуре 25С представлен типичный штамм для подтипа H1N1, A/New Hampshire/1/2015. В каждом случае данные представляют высокие уровни получения и высокую очистку.
На фигуре 25D представлено сравнение дифференциальной сканирующей калориметрии (DSC) устойчивых к трипсину наночастиц по сравнению с наночастицами, полученными с помощью способа, в котором они подвергаются воздействию низкого значения pH, приблизительно значения pH 6,0. Данные DSC показывают более высокую термостабильность в случае способа с нейтральным значением pH, указывая на то, что белок HA в наночастице должным образом свернут.
[047] На фигурах 26A-26C представлены результаты, демонстрирующие повышенную устойчивость к трипсину, для устойчивых к трипсину наночастиц от нескольких штаммов, экспрессируемых в клетках Sf9. Очищенные наночастицы на основе HA, полученные в клетках насекомых Sf9, представляют собой HA0. При воздействии трипсина HA0 расщепляется на HA1 и HA2 в Arg AA344 в H1. Должным образом свернутые тримеры HA будут противостоять дальнейшему расщеплению при инкубировании с возрастающими концентрациями трипсина. На фигуре 26A показано, что очищенный при нейтральном значении pH B/Brisbane/60/08 является устойчивым к трипсину, поэтому является должным образом свернутым (левая панель), в то время как очищенный при кислом значении pH B/Brisbane/60/08 HA1 является чувствительным к трипсину, поэтому является неправильно свернутым (правая панель). На фигуре 26B показано, что очищенные в кислой среде, а не очищенные в нейтральной среде наночастицы на основе HA от A/Hong Kong/4801/2014, являются неправильно свернутыми. На фигуре 26C показана устойчивость к трипсину очищенных при нейтральном значении pH наночастиц на основе HA A/New Hampshire/1/2015 (H1N). Соответствующие очищенные при кислом значении pH наночастицы были чувствительными к трипсину (не представлено).
[048] На фигуре 27 представлена чувствительность к трипсину коммерческой вакцины против гриппа с очищенным в курином яйце вирусом (левая панель) и коммерческой рекомбинантной вакцины против гриппа (правая панель). HA0 расщепляется на HA1 и HA2 в левой панели. Однако должным образом свернутый HA1 является устойчивым к дополнительному воздействию трипсина. В отличие от этого, коммерческая рекомбинантная вакцина характеризуется тем, что HA1 распадается в присутствии трипсина, указывая на то, что в вакцине присутствует неправильно свернутый белок.
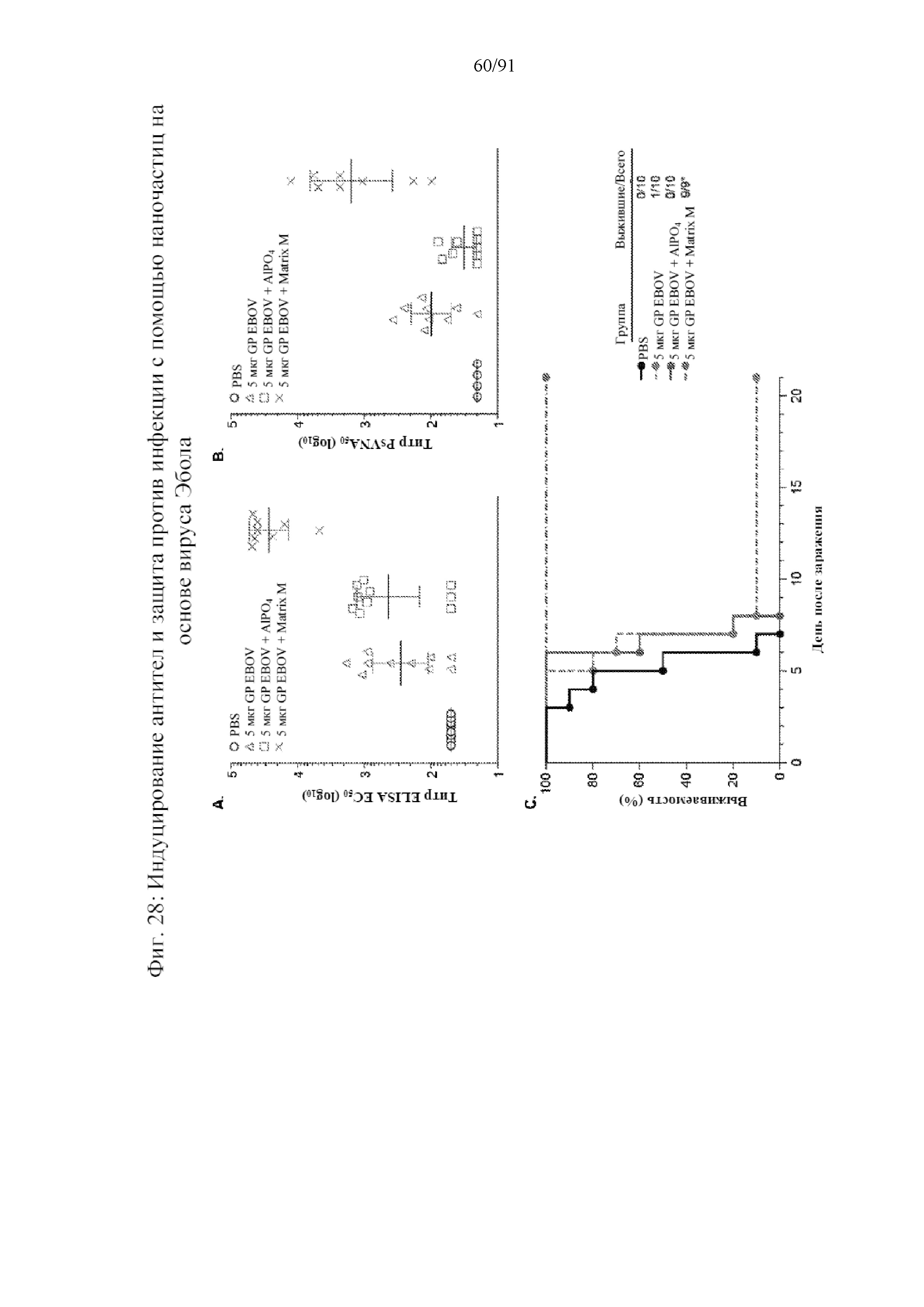
[049] На фигурах 28A-28C показана индукция антител и защита от инфекции. Мышей иммунизировали подкожно на 0-й, 14-й и 28-й дни с помощью 5 мкг GP EBOV/Mak, 5 мкг GP EBOV с добавлением в качестве адъюванта 50 мкг AlPO4 или 5 мкг GP EBOV/Mak с добавлением в качестве адъюванта 5 мкг Matrix M. Сыворотку получали на 28-й день и оценивали с помощью ELISA на наличие IgG к GP EBOV/Mak (фиг. 28A) или нейтрализующего антитела к белку вируса Эбола (фиг. 28B). Черные столбцы представляют групповое GMT, а планки погрешностей указывают на 95% доверительные интервалы GMT. На 42-й день мышей инфицировали с помощью 1000 pfu на мышь адаптированного вируса Эбола Zaire штамма 1976 Mayinga. После заражения мышей наблюдали ежедневно на наличие заболеваемости и смертности в течение периода времени, составляющего 21 день. На фиг. 28C представлена кривая выживаемости Каплана-Мейера для инфицированных мышей.
[050] На фигурах 29A-29C показано, что Matrix M усиливал ответы IgG и подклассов IgG, специфичных в отношении GP EBOV/Mak. Мышей иммунизировали внутримышечно на 0-й и 21-й дни с помощью 5 мкг GP EBOV/Mak отдельно или в комбинации либо с 2,5, либо с 5 мкг Matrix M, либо с 50 мкг AlPO4. Мыши получали PBS в качестве контроля плацебо. На 21-й, 28-й и 60-й дни после первой инъекции образцы сыворотки собирали и исследовали на наличие IgG (фиг. 29A), IgG1 (фиг. 29B) и IgG2a (фиг. 29C) к GP EBOV/Mak. Результаты типичны для двух отдельных экспериментов. Черные столбцы представляют групповое GMT, а планки погрешностей указывают на 95% доверительные интервалы GMT.
[051] На фигурах 30A-30D показано, что наночастицы против вируса Эбола с Matrix M индуцировали устойчивый ответ с участием CD4+ T-клеток и CD8+ T-клеток, и мультифункциональных T-клеток. Клетки селезенки стимулировали пептидными пулами GP Ebola/Mak, охватывающими всю последовательность GP. Среду для культивирования или PMA (50 нг/мл) совместно с иономицином (200 нг/мл) использовали в качестве отрицательных и положительных контролей. IFN-γ-положительные бляшки на 28-й (фиг. 30A) и 60-й (фиг. 30B) дни подсчитывали и анализировали с помощью ридера ELISPOT и соответствующей компьютерной программы. Фоновые количества средовых контролей вычитали из количества стимулированных пептидами лунок и среднее получали из тройных повторностей. Клетки от всех пяти мышей в одной и той же группе на 28-й день объединяли и инкубировали либо со средой в отдельности, либо с пептидными пулами GP, либо с PMA совместно с иономицином в течение 6 часов при 37°C в присутствии BD Golgi-stop/Golgi-plug. Затем клетки собирали и окрашивали на наличие маркеров клеточной поверхности и внутриклеточных цитокинов. Частоту образования цитокинов анализировали с помощью компьютерной программы Flowjo и булевой функции Flowjo с помощью гейтирования по отношению к живым CD3+CD44+CD62-CD4+ эффекторным T-клеткам памяти или живым CD3+CD44+CD62-CD8+ эффекторным T-клеткам памяти (фиг. 30C и 30D). Значение для единичных цитокинов, двойных цитокинов или тройных цитокинов представляет сумму частоты образования клеток, экспрессирующих любой один из трех цитокинов (IFN-γ, TNFα и IL-2), любые два из трех цитокинов или все три цитокина. Результат является репрезентативным для двух отдельных экспериментов. Черные столбцы указывают на групповые средние, а планки погрешностей представляют стандартное отклонение.
[052] На фигурах 31A-31E показано, что Matrix M усиливал ответ с участием клеток зародышевого центра (GC). Свежие спленоциты окрашивали на наличие B-клеток GC и данные получали, как описано в разделе «Материалы и способы». Данные анализировали с помощью компьютерной программы Flowjo. Погибшие клетки исключали из анализа с помощью фиксируемого желтого красителя LIVE/DEADTM Invitrogen (фиг. 31A), клетки GC определяли как CD95+GL-7+ в отношении B220+ B-клеточного гейта, и числа на точечной диаграмме для репрезентативных мышей указывают на среднее и стандартное отклонение частоты образования GC у всех пяти мышей в одной и той же группе на 28-й день. Частоты образования клеток GC от отдельных мышей показаны на 28-й (фиг. 31B) и 60-й (фиг. 31C) дни. Абсолютное количество клеток GC на селезенку на 28-й (фиг. 31D) и 60-й (фиг. 31E) дни рассчитывали умножением частоты образования клеток GC на общее количество спленоцитов в селезенке. Черные столбцы указывают на групповые средние, а планки погрешностей представляют стандартное отклонение.
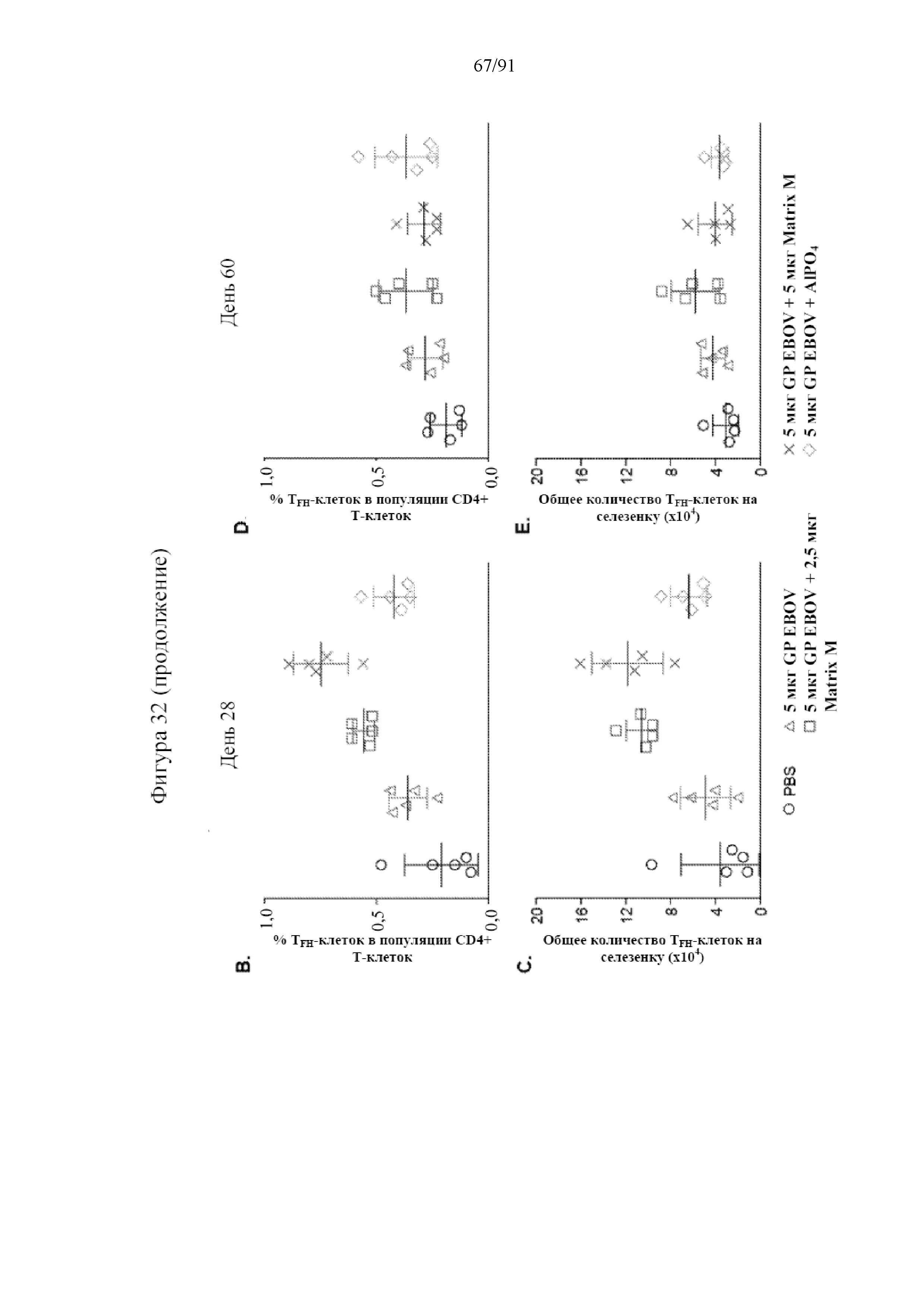
[053] На фигурах 32A-32E показано, что Matrix M усиливал частоту образования и абсолютное количество TFH-клеток в селезенке. TFH-клетки, определяемые как CXCR5+PD-1+ T-клетки в B220-CD49b- CD3+CD4+ T-клеточном гейте, идентифицировали в селезенках на 28-й день и 60-й день. Показан типичный точечный график анализа TFH-клеток из каждой группы (фиг. 32A). Количество в точечном графике представляет собой среднюю частоту и стандартное отклонение на 28-й день. Показана частота TFH-клеток в популяции CD4+ T-клеток на 28-й (фиг. 32B) и 60-й (фиг. 32D) дни. Абсолютное количество TFH-клеток на селезенку на 28-й (фиг. 32C) и 60-й (фиг. 32E) дни рассчитывали умножением частоты TFH-клеток на общее количество спленоцитов в селезенке. Черные столбцы указывают на групповые средние, а планки погрешностей представляют стандартное отклонение.
[054] На фигурах 33A-33B показано, что Matrix M индуцировал долгоживующие плазматические клетки в костном мозге. Клетки селезенки и костного мозга инкубировали в течение ночи в планшетах ELISPOT, покрытых GP EBOV/Mak. Бляшки IgG, специфичных в отношении GP EBOV/Mak, выявляли с помощью инкубирования с козьим антителом к мышиному IgG, конъюгированному с HRP, после образования бляшек. Количества бляшек подсчитывали и анализировали с помощью ридера ELISPOT. Показано количество секретирующих антитела клеток (ASC) на миллион клеток, на фиг. 33A - на 60-й день - число ASC с IgG к GP EBOV/Mak в селезенке; на фиг. 33B - на 60-й день - число ASC с IgG к GP EBOV/Mak в костному мозге. Черные столбцы указывают на групповые средние, а планки погрешностей представляют стандартное отклонение.
[055] На фигурах 34A-34B представлены характеристики гликопротеина вируса Эбола. На фигуре 34A представлена структура домена. На фигуре 34B представлена аминокислотная последовательность GP с отщепленным сигнальным пептидом и N- и C-концами зрелого белка и последовательность сайта расщепления фурином (SEQ ID NO: 22).
[056] На фигурах 35A-35C представлены электронные микрофотографии наночастиц по настоящему изобретению. Следует обратить внимание, что на фигуре 35B представлено содержащее неионный детергент ядро, которое содержит до 5 копий тримеров, присоединенных к ядру. В некоторых случаях дополнительные тримеры находятся вне поля зрения. На фигуре 35C представлено исследование докинга с тримерами GP, наложенными на наночастицу из микрофотографии.
[057] На фигуре 36 представлена способность трех моноклональных антител к белку вирусу Эбола выявлять наночастицы против вируса Эбола.
[058] На фигуре 37 представлены данные поверхностного плазмонного резонанса (SPR) по связыванию антител с эпитопами наночастиц на основе GP вируса Эбола (SEQ ID NO:23-25).
[059] На фигуре 38 представлена высокая активность связывания антитела 13C6 с наночастицами по настоящему изобретению.
[060] На фигуре 39 представлена схема исследования иммуногенности у бабуинов. В группе 1 вводили 60 мкг наночастиц на основе GP без адъюванта. В группе 2 вводили 60 мкг наночастиц с 800 мкг адъюванта на основе AlPO4. В группе 3 вводили 60 мкг наночастиц с 50 мкг адъюванта Matrix M. В группе 4 вводили 5 мкг наночастиц с 50 мкг адъюванта Matrix M.
[061] На фигурах 40A-40B представлены результаты исследования иммуногенности у бабуинов на фигуре 39. На 21-й день титры EC90 повышали для групп 2 и 3. На фигуре 40A показано, что титры были примерно одинаковыми в обеих группах и также по отношению к наночастицам, содержащим гликопротеины из вируса Эбола Makona и штамма Mayinga, который является прототипным вариантом штамма Zaire вируса Эбола. На 31-й день иммунный ответ был выраженным во всех случаях и особенно для композиций, содержащих GP и адъювант Matrix M. Примечательно, что более низкая доза GP (5 мкг) действовала также, как и более высокая доза (60 мкг), подчеркивая эффект щадящего режима дозирования Matrix M.
[062] На фигуре 41 представлен длительный иммунный ответ, достигаемый в результате действия композиций на основе наночастиц. Данные представлены в виде ответов GMT EC50 для IgG после введения на 0-й день и 21-й день. Наночастицы с GP и Matrix M характеризуются лучшими ответами, чем адъювант на основе квасцов, и ответы сохраняются на более высоком уровне с течением времени.
[063] На фигуре 42 представлена стимуляция иммунного ответа, включающая высвобождающие IFN-γ клетки. Matrix M в комбинации с 5 мкг наночастиц на основе GP приводил к максимальному ответу после более высокой дозы наночастиц на основе GP (60 мкг). Применение квасцов приводило к низкому, но подлежащему выявлению повышению числа мононуклеарных клеток периферической крови (PBMC), секретирующих IFN-γ.
[064] На фигуре 43 представлены профили высвобождения IFN-γ и TNFα из CD4+ и CD8+ T-клеток, выделенных от бабуинов, которым вводили вакцинные композиции, содержащие наночастицы на основе GP, раскрытые в данном документе.
[065] На фигуре 44 представлены профили высвобождения цитокинов из T-клеток, выделенных от бабуинов, которым вводили вакцинные композиции, содержащие наночастицы на основе GP, раскрытые в данном документе. Данные показывают, что композиции на основе наночастиц на основе GP с добавлением в качестве адъюванта Matrix M стимулируют иммунные ответы, имеющие более широкие профили высвобождения цитокинов.
[066] На фигуре 45 представлена схема исследования вакцины, выполненная на макаках-крабоедах. Животным вводили вакцинную композицию из 5 мкг GP + 50 мкг Matrix M на 0-й и 21-й дни, затем заражали на 42-й день. Животных 33360, 33362 и 33355 обрабатывали вакцинной композицией. Плацебо вводили животному 33356.
[067] На фигуре 46 представлены титры IgG, полученные в исследовании на макаках-крабоедах. На 28-й день титры EC50 превышали 105.
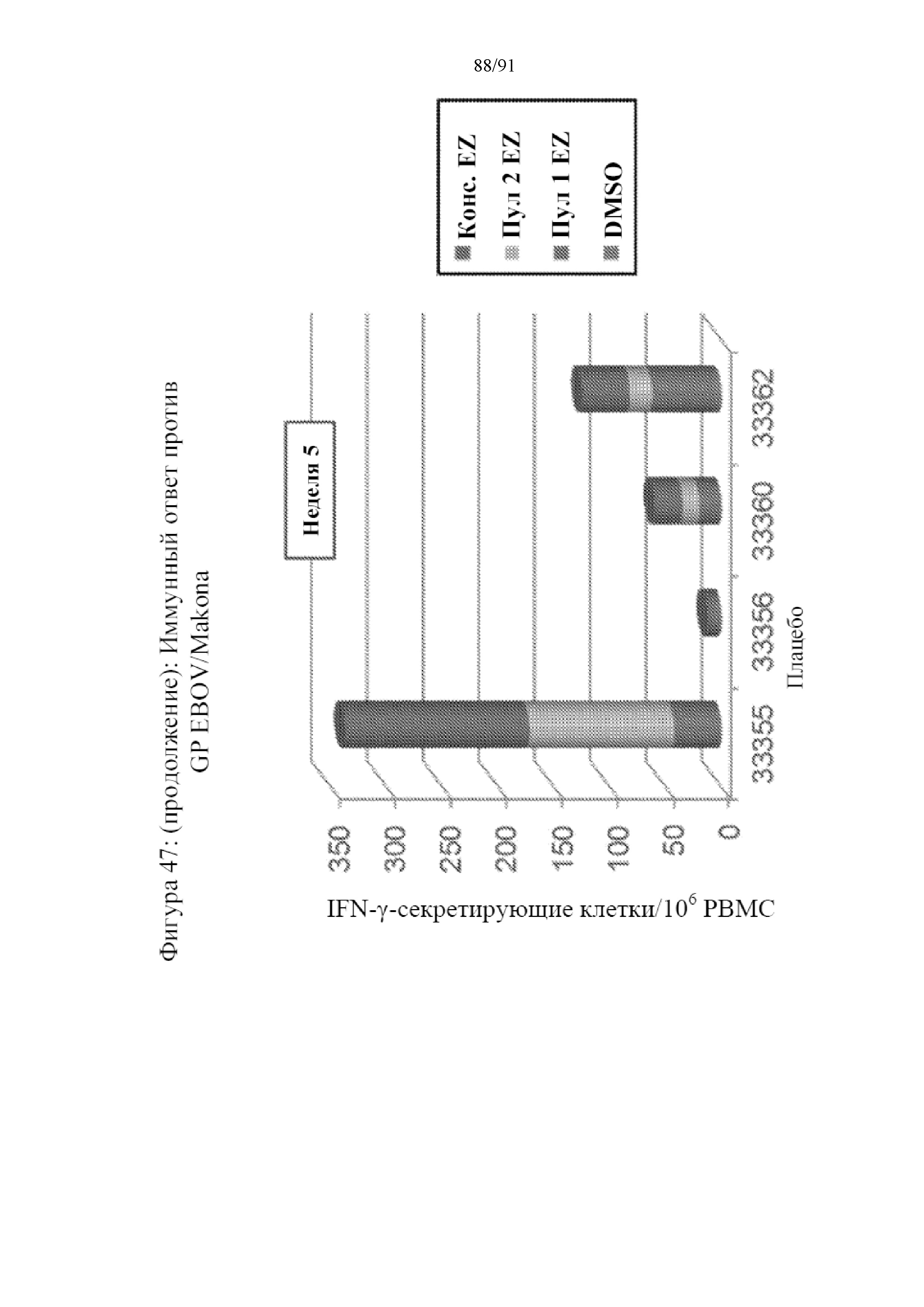
[068] На фигуре 47 показана индукция IFN-γ-секретирующих клеток PBMC, выделенных от обработанных макаков. Пептиды, полученные из GP штамма Zaire вируса Эбола объединяли и использовали в анализе. Также исследовали консенсусный пептид, полученный из штаммов Zaire и Sudan. Представленные данные показывают клетки, отвечающие на эти пептиды на 0-й неделе (верхняя панель), 3-й неделе (средняя панель) и 5-й неделе (нижняя панель). У контрольного животного, которому вводили плацебо, практически не проявлялся какой-либо ответ. В противоположность этому, обработанные вакцинами животные характеризовались устойчивым повышением количества клеток, высвобождающих IFN-γ в ответ на различные исследованные пептиды.
[069] На фигуре 48 представлена вирусная нагрузка и выживаемость у макаков. На 7-й день после заражения животное из группы плацебо характеризовалось значительным повышением содержания вирусной нуклеиновой кислоты, указывая на инфекцию, вызываемую вирусом Эбола. На 9-й день животное выводили из эксперимента. Все вакцинированные животные выживали. Только животное 33360 характеризовалось подлежащим выявлению повышением содержания вирусной нуклеиновой кислоты, которое составляло приблизительно предел обнаружения. На 10-й день даже у этого одного животного уровни вирусной РНК снижались ниже способности RT-PCR обнаруживать их.
[070] На фигуре 49 представлена схема исследования вакцины для дополнительного исследования на макаках. Животным вводили солевой раствор или 5 мкг GP + 50 мкг Matrix M. В группе F получали вакцину на 0-й и 6-й неделях. В группе G получали вакцину на 0-й и 3-й неделях. Обе группы заражали через 6 недель после введения буст-вакцины.
[071] На фигуре 50 представлены результаты второго исследования. В обеих группах получали значительные повышения антител к GP вируса Эбола. На 18-й день после заражения живым вирусом выживаемость для контрольных животных, получавших солевой раствор, составляла 0%. В отличие от этого, оба животных в каждой из групп F и G выживали, что указывало на то, что вакцинные композиции оказывали защитный эффект.
ПОДРОБНОЕ ОПИСАНИЕ
[072] В данном документе раскрыты наночастицы для индуцирования иммунных ответов, способы получения и введения их и вакцинные композиции, содержащие их. Наночастица представляет собой антиген, окружающий содержащее детергент ядро и ассоциированный с ним, что приводит к образованию структуры, которая обеспечивает повышенную стабильность за счет нескольких показателей. Ядро, содержащее детергент, и антиген ассоциируются посредством физико-химического взаимодействия, опосредованного свойствами антигена и детергента. Кроме того, наночастицы обеспечивают особенно высокий уровень презентации антигена иммунным системам, что, как считается, не ограничиваясь теорией, приводит к ориентации антигенов вокруг ядра, содержащего детергент.
[073] В одном аспекте в настоящем изобретении предусмотрены композиции, содержащие наночастицы на основе рекомбинантных вирусных гликопротеинов. В конкретных аспектах гликопротеины рекомбинантно экспрессируются в подходящей клетке-хозяине. В одном варианте осуществления клетка-хозяин является клеткой насекомого. В иллюстративном варианте осуществления клеткой насекомого является клетка Sf9.
[074] В конкретных аспектах в настоящем изобретении предусмотрены иммуногенные композиции, содержащие одну или более вирусных гликопротеиновых молекул в структуре наночастицы, где гликопротеин находится в форме тримера и каждая наночастица содержит по меньшей мере один тример, ассоциированный с ядром, содержащим неионный детергент. В конкретных аспектах наночастица состоит из антигена, такого как вирусный гликопротеин, от только одного патогена.
[075] Наночастицы можно применять для предупреждения и/или лечения вирусной инфекции. Таким образом, в другом аспекте в настоящем изобретении предусмотрен способ индуцирования иммунного ответа на вирус. Способ предусматривает введение иммунологически эффективного количества композиции, содержащей наночастицу, субъекту.
[076] В настоящем изобретении предусмотрены вакцинные композиции, содержащие наночастицу. Композиции могут содержать наночастицы, имеющие антигены от разных патогенов. В некоторых аспектах вакцинная композиция может содержать наночастицы с антигенами от более одного вирусного штамма от одного и того же вида вируса. В некоторых аспектах вакцинная композиция может содержать наночастицы с антигенами от различных видов вирусов. В другом варианте осуществления в настоящем изобретении предусмотрена фармацевтическая упаковка или набор, содержащий один или более контейнеров, заполненных одним или более компонентами вакцинных композиций.
[077] В другом варианте осуществления в настоящем изобретении предусмотрен способ составления вакцинной композиции, которая индуцирует иммунитет к инфекции или по меньшей мере к одному симптому данного заболевания у млекопитающего, предусматривающий добавление к композиции эффективной дозы наночастицы. Раскрываемые наночастицы пригодны для получения композиций, которые стимулируют иммунный ответ, который обеспечивает иммунитет или значительный иммунитет к возбудителям инфекционных заболеваний. Таким образом, в одном варианте осуществления в настоящем изобретении предусмотрен способ индуцирования иммунитета к инфекциям или по меньшей мере к одному симптому данного заболевания у субъекта, предусматривающий введение по меньшей мере одной эффективной дозы наночастицы.
[078] В некоторых вариантах осуществления наночастицы вводят с адъювантом. В других аспектах наночастицы вводят без адъюванта. В некоторых аспектах адъювант может быть связан с наночастицей, например, с помощью нековалентного взаимодействия. В других аспектах адъювант вводят совместно с наночастией, однако адъювант и наночастица не взаимодействуют в значительной степени.
[079] В данном документе также предусмотрены способы получения наночастиц и вакцинных композиций. Предпочтительно способы предусматривают наночастицы, которые фактически не содержат примесей других белков, таких как белки, ассоциированные с рекомбинантной экспрессией беков в бакуловирусных системах/системах Sf9.
Определения
[080] Как используется в данном документе и прилагаемой формуле изобретения, формы единственного числа включают ссылки на форму множественного числа, если в контексте четко не указано иное. Так, например, отсылка на «белок» может относиться к одному белку или к смеси такого белка, а отсылка на «способ» включает отсылку на равноценные стадии и/или способы, известные специалистам в данной области, и т.д.
[081] Используемый в данном документе термин «адъювант» относится к соединению, которое при применении в комбинации с иммуногеном усиливает или иным образом изменяет или модифицирует иммунный ответ, индуцированный против иммуногена. Модификация иммунного ответа может предусматривать повышение эффективности или расширение спектра специфичности каждого из гуморального или клеточного иммунного ответа или обоих.
[082] Используемый в данном документе термин «приблизительно» или «примерно», когда предшествует числовому значению, указывает на значение плюс или минус диапазон, составляющий 10%. Например, «приблизительно 100» охватывает 90 и 110.
[083] Используемые в данном документе термины «иммуноген», «антиген» и «эпитоп» относятся к веществам, таким как белки, в том числе гликопротеины, и пептиды, которые способы вызвать иммунный ответ.
[084] Используемый в данном документе термин «иммуногенная композиция» представляет собой композицию, которая содержит антиген, где введение композиции субъекту приводит к развитию у субъекта гуморального и/или клеточного иммунного ответа на антиген.
[085] Используемый в данном документе термин «субъединичная» композиция, например, вакцина, включает один или более антигенов, но не все антигены от патогена. Такая композиция фактически не содержит интактного вируса или лизата таких клеток или частиц, и обычно ее получают из по меньшей частично очищенных, часто фактически очищенных иммуногенных полипептидов от патогена. Антигены в субъединичной композиции, раскрытые в данном документе, обычно получают рекомбинантным путем, часто с помощью бакуловирусной системы.
[086] Используемый в данном документе термин «фактически» относится к выделению вещества (например, соединения, полинуклеотида или полипептида), таким образом, что вещество образует большую часть процента образца, в котором оно содержится. Например, в образце фактически очищенный компонент составляет 85%, предпочтительно 85%-90%, более предпочтительно по меньшей мере 95%-99,5% и наиболее предпочтительно по меньшей мере 99% образца. Если компонент фактически замещен, то количество, остающееся в образце, составляет менее или равно от приблизительно 0,5% до приблизительно 10%, предпочтительно от менее приблизительно 0,5% до приблизительно 1,0%.
[087] Термины «обрабатывать», «обработка» и «обрабатывающий», как используется в данном документе, относятся к подходу для получения полезных или желательных результатов, например, клинических результатов. Для целей настоящего изобретения полезные или желательные результаты могут включать ингибирование или подавление инициации или прогрессирования инфекции или заболевания; уменьшение интенсивности или ослабление развития симптомов инфекции или заболевания; или их комбинации.
[088] Термин «предупреждение», как используется в данном документе, используется взаимозаменяемо с термином «профилактика» и может означать полное предупреждение инфекции или заболевания, или предупреждение развития симптомов этой инфекции или заболевания; задержку наступления инфекции или заболевания или его симптомов; или снижение тяжести в дальнейшем развивающейся инфекции или заболевания или его симптомов.
[089] Используемый в данном документе термин «эффективная доза» или «эффективное количество» относится к количеству иммуногена, достаточному для индуцирования иммунного ответа, который ослабляет по меньшей мере один симптом инфекции, вызываемой патогенами. Эффективную дозу или эффективное количество можно определить, например, путем измерения количеств нейтрализующих секреторных и/или сывороточных антител, например, с помощью реакции подавления бляшкообразования, реакции связывания комплемента, твердофазного иммуноферментного анализа (ELISA) или реакции микронейтрализации.
[090] Используемый в данном документе термин «вакцина» относится к иммуногенной композиции, такой как иммуноген, полученный от патогена, который используется для индуцирования иммунного ответа против патогена, который обеспечивает защитный иммунитет (например, иммунитет, который защищает субъекта от инфекции, вызываемой патогеном, и/или ослабляет тяжесть заболевания или состояния, вызываемого инфекцией вследствие патогена). Защитный иммунный ответ может включать формирование антител и/или клеточно-опосредованный ответ. В зависимости от контекста, термин «вакцина» может также относиться к суспензии или раствору иммуногена, который вводят позвоночному для выработки защитного иммунитета.
[091] Используемый в данном документе термин «субъект» включает людей и других животных. Обычно субъектом является человек. Например, субъектом может быть взрослый человек, подросток, ребенок (в возрасте от 2 лет до 14 лет), грудной ребенок (в возрасте от 1 месяца до 24 месяцев) или новорожденный (до 1 месяца). В некоторых аспектах взрослыми являются пожилые люди в возрасте приблизительно 65 лет или старше, или в возрасте 60 лет или старше. В некоторых аспектах субъектом является беременная женщина или женщина, собирающаяся стать беременной. В других аспектах субъект не является человеком; например, отличным от человека приматом; например, бабуином, шимпанзе, гориллой или макаком. В определенных аспектах субъект может представлять собой домашнее животное, такое как собака или кошка.
[092] Используемый в данном документе термин «фармацевтически приемлемый» означает, что он является одобренным регулирующим органом федерального правительства или правительства штата США или перечислен в Фармакопее США, Европейской фармакопее или в других общепризнанных фармакопеях для применения у млекопитающих, и, более конкретно, у человека. Эти композиции можно применять в качестве вакцины и/или антигенных композиций для индуцирования защитного иммунного ответа у позвоночного.
[093] Используемый в данном документе термин «приблизительно» означает плюс или минус 10% от указанного числового значения.
Краткое описание
[094] Антигены, полученные от патогенов, были объединены с неионными детергентами с получением наночастиц, окружающих ядро, содержащее детергент, которые характеризуются повышенной стабильностью и высокой иммуногенностью. В настоящем изобретении также предусмотрены способы и композиции для вакцинирования субъекта против патогенов. В конкретных аспектах патоген представляет собой вирус. Антиген обычно представляет собой белок, часто - гликопротеин. Также раскрыты композиции, содержащие наночастицы, которые находят применение в качестве вакцинных композиций. Также раскрыты способы получения наночастиц и получение вакцинных композиций.
Структура и морфология наночастиц
[095] Наночастицы по настоящему изобретению содержат антигены, ассоциированные ядром, с содержащим неионный детергент. На верхней панели фигуры 6 представлен пример множественных антигенов на основе F-белка RSV, ассоциированных с ядром, содержащим детергент. На фигуре 35 представлены наночастицы против вируса Эбола. Предпочтительно наночастицы имеют повышенную устойчивость к стрессовым факторам окружающей среды, например, они обеспечивают повышенную стабильность.
[096] В конкретных вариантах осуществления наночастицы состоят из нескольких тримеров белка, окружающих ядро, содержащее неионный детергент. Например, каждая частица может содержать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или 15 тримеров. Обычно каждая наночастица содержит от 2 до 9 тримеров. В конкретных вариантах осуществления каждая наночастица содержит от 2 до 6 тримеров. Композиции, раскрытые в данном документе, могут содержать наночастицы, имеющие различные количества тримеров. Например, композиция может содержать наночастицы, где количество тримеров варьирует от 2 до 9; в других вариантах осуществления наночастицы могут содержать от 2 до 6 тримеров. В конкретных вариантах осуществления композиции содержат гетерогенную популяцию наночастиц, имеющих от 2 до 6 тримеров на наночастицу или от 2 до 9 тримеров на наночастицу. В других вариантах осуществления композиции могут содержать фактически гомогенную популяцию наночастиц. Например, популяция может содержать приблизительно 95% наночастиц, имеющих 5 тримеров.
[097] Антигены ассоциированы с содержащим неионный детергент ядром наночастицы. Обычно детергент выбран из полисорбата-20 (PS20), полисорбата-40 (PS40), полисорбата-60 (PS60), полисорбата-65 (PS65) и полисорбата-80 (PS80). Наличие детергента облегчает образование наночастиц в результате образования ядра, которое обеспечивает упорядоченное расположение и презентацию антигенов. Таким образом, в определенных вариантах осуществления наночастицы могут содержать антигены, собранные в наночастицы из мультиолигомерного гликопротеина и детергента белка PS80 с участком головки, выступающим наружу, и гидрофобными участками и детергентом PS80, образующими центральное ядро, окруженное антигенами.
[098] Наночастицы, раскрытые в данном документе, варьируют по размеру Z-ave от приблизительно 20 нм до приблизительно 60 нм, от приблизительно 20 нм до приблизительно 50 нм, от приблизительно 20 нм до приблизительно 45 нм или от приблизительно 25 нм до приблизительно 45 нм. Размер частиц (Z-ave) измеряется с помощью динамического светорассеяния (DLS) с применением a Malvern Zetasizer, если не указано иное.
[099] Несколько типов наночастиц можно включать в вакцинные композиции в данном документе. В некоторых аспектах тип наночастиц находится в форме анизотропного стержня, который может представлять собой димер или мономер. В других аспектах тип наночастиц представляет собой сферический олигомер. В еще одних аспектах наночастицу можно описать как наночастицу промежуточной формы, имеющую седиментационные свойства, которые являются промежуточными между первыми двумя типами. Образование типов наночастиц можно регулировать с помощью контролирования концентрации детергента и белка во время производственного процесса. Тип наночастиц можно определять с помощью измерения коэффициента седиментации. См. фигуру 9A и 9B в качестве примеров, показывающих наночастицы на основе F-белка RSV. См. также фигуру 8, представляющую контроль размера наночастиц в результате регуляции концентраций детергента и белка.
Получение наночастиц
[0100] Наночастицы по настоящему изобретению представляют собой не встречающиеся в природе продукты, компоненты которых не встречаются в природе совместно. Как правило, в способах, раскрытых в данном документе, применяют подход на основе замены детергентов, где первый детергент применяют для выделения белка, и затем этот первый детергент заменяют на второй детергент с образованием наночастиц.
[0101] Антигены, содержащиеся в наночастицах, обычно образуются в результате рекомбинантной экспрессии в клетках-хозяевах. Можно применять стандартные рекомбинантные методики. Обычно белки экспрессируются в клетках-хозяевах насекомых с помощью бакуловирусной системы. В предпочтительных вариантах осуществления бакуловирус представляет собой бакуловирус с нокаутом по катепсину L. В других предпочтительных вариантах осуществления бакуловирус представляет собой бакуловирус с нокаутом по хитиназе. В еще одних предпочтительных вариантах осуществления бакуловирус представляет собой двойной нокаут как по катепсину L, так и по хитиназе. Высокий уровень экспрессии можно получить в системах экспрессии на основе клеток насекомых. Неограничивающими примерами клеток насекомых являются клетки Spodoptera frugiperda (Sf), например, Sf9, Sf21, клетки Trichoplusia ni, например, клетки High Five и клетки S2 Drosophila.
[0102] Для культивирования клеток можно применять обычные способы трансфекции и выращивания клеток. Векторы, например, векторы, содержащие полинуклеотиды, которые кодируют слитые белки, можно трансфицировать в клетки-хозяева в соответствии со способами, хорошо известными из уровня техники. Например, введения нуклеиновых кислот в эукариотические клетки можно достичь посредством совместной преципитации с фосфатом кальция, электропорации, микроинъекции, липофекции и трансфекции с использованием полиаминных реагентов для трансфекции. В одном варианте осуществления вектор представляет собой рекомбинантный бакуловирус.
[0103] Способы выращивания клеток-хозяев включают без ограничения техники периодических, периодических с подпиткой, непрерывных и перфузионных клеточных культур. Клеточная культура означает рост и размножение клеток в биореакторе (камере сбраживания), где клетки размножаются и экспрессируют белок (например, рекомбинантные белки) для очистки и выделения. Типично культивирование клеток проводят в стерильных условиях с контролируемыми температурой и атмосферой в биореакторе. Биореактор представляет собой камеру, используемую для культивирования клеток, в которой условия окружающей среды, такие как температуру, атмосферу, перемешивание и/или pH, можно контролировать. В одном варианте осуществления биореактор представляет собой камеру из нержавеющей стали. В другом варианте осуществления биореактор представляет собой предварительно простерилизованный пластиковый пакет (например, Cellbag®, Wave Biotech, Бриджуотер, Нью-Джерси). В другом варианте осуществления предварительно стерилизованные пластиковые пакеты представляют собой пакеты от приблизительно 50 л до 3500 л.
Экстракция посредством детергента и очистка наночастиц
[0104] После выращивания клеток-хозяев белок можно собирать из клеток-хозяев с помощью детергентов и протоколов очистки. После того, как клетки выращивали в течение 48-96 часов, клетки выделяют из среды и содержащий детергент раствор добавляют для солюбилизации клеточной мембраны, высвобождения белка в экстракт детергента. Как и Triton X-100, так и тергитол, также известный как NP-9, является предпочтительным детергентом для экстракции. Детергент можно добавлять до конечной концентрации от приблизительно 0,1% до приблизительно 1,0%. Например, концентрация может составлять приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,5%, приблизительно 0,7%, приблизительно 0,8% или приблизительно 1,0%. В определенных вариантах осуществления диапазон может составлять от приблизительно 0,1% до приблизительно 0,3%. Предпочтительно концентрация составляет приблизительно 0,5%.
[0105] В других аспектах другие первые детергенты можно применять для выделения белка из клетки-хозяина. Например, первый детергент может представлять собой бис(полиэтиленгликоль бис[имидазоилкарбонил]), ноноксинол-9, бис(полиэтиленгликоль бис[имидазоилкарбонил]), Brij® 35, Brij®56, Brij® 72, Brij® 76, Brij® 92V, Brij® 97, Brij® 58P, Cremophor® EL, декаэтиленгликольмонододециловый эфир, N-деканоил-N-метилглюкамин, н-децил-альфа-D-глюкопиранозид, децил-бета-D-мальтопиранозид, н-додеканоил-N-метилглюкамид, н-додецил-альфа-D-мальтозид, н-додецил-бета-D-мальтозид, н-додецил-бета-D-мальтозид, гептаэтиленгликольмонодециловый эфир, гептаэтиленгликольмонододециловый эфир, гептаэтиленгликольмонотетрадециловый эфир, н-гексадецил-бета-D-мальтозид, гексаэтиленгликольмонододециловый эфир, гексаэтиленгликольмоногексадециловый эфир, гексаэтиленгликольмонооктадециловый эфир, гексаэтиленгликольмонотетрадециловый эфир, Igepal CA-630, Igepal CA -630, метил-6-0-(N -гептилкарбамоил)-альфа-D-глюкопиранозид, нонаэтиленгликольмонододециловый эфир, N-нонаноил-N-метилглюкамин, N-нонаноил-N-метилглюкамин, октаэтиленгликольмонодециловый эфир, октаэтиленгликольмонодедециловый эфир, октаэтиленгликольмоногексадециловый эфир, октаэтиленгликольмонооктадециловый эфир, октаэтиленгликольмонотетрадециловый эфир, октил-бета-D-глюкопиранозид, пентаэтиленгликольмонодециловый эфир, пентаэтиленгликольмонододециловый эфир, пентаэтиленгликольмоногексадециловый эфир, пентаэтиленгликольмоногексиловый эфир, пентаэтилегнликольмонооктадециловый эфир, пентаэтиленгликольмонооктиловый эфир, полиэтиленгликольдиглицидиловый эфир, полиэтиленгликолевый эфир W-1, полиоксиэтилен (10) тридециловый эфир, полиоксиэтилен (100) стеарат, полиоксиэтилен (20) изогексадециловый эфир, полиоксиэтилен (20) олеиловый эфир, полиоксиэтилен (40) стеарат, полиоксиэтилен (50) стеарат, полиоксиэтилен (8) стеарат, полиоксиэтиленбис(имидазолилкарбонил), полиоксиэтилен (25) пропиленгликольстеарат, сапонин из коры килайя, Span® 20, Span® 40, Span® 60, Span® 65, Span® 80, Span® 85, тергитол типа 15-S-12, тергитол типа 15-S-30, тергитол типа 15-S-5, тергитол типа 15-S-7, тергитол типа 15-S-9, тергитол типа NP-10, тергитол типа NP-4, тергитол типа NP-40, тергитоол типа NP-7, тергитол типа NP-9, тергитол типа TMN-10, тергитол типа TMN-6, Triton X-100 или их комбинации.
Затем наночастицы можно выделять из клеточных остатков с помощью центрифугирования. В некоторых вариантах осуществления можно применять градиентное центрифугирование, например, с помощью хлорида цезия, сахарозы и йодиксанола. Другие методики можно применять в качестве альтернативы или в дополнение, такие как стандартные методики очистки, в том числе, например, ионообменную, аффинную и гель-фильтрационную хроматографию.
[0107] Например, первая колонка может представлять собой колонку, содержащую смолу для ионообменной хроматографии, такую как Fractogel® EMD TMAE (EMD Millipore), вторая колонка может содержать смолу на основе лектина чечевицы (Lens culinaris) для аффинной хроматографии, и третья колонка может представлять собой катионообменную колонку, такую как колонку, содержащую смолу Fractogel® EMD SO3 (EMD Millipore) . В других аспектах катионообменная колонка может представлять собой колонку MMC или колонку Nuvia C Prime (Bio-Rad Laboratories, Inc). Предпочтительно в способах, раскрытых в данном документе, не применяют колонку для экстракции детергента, например, колонку с гидрофобным взаимодействием. Такую колонку часто применяют для удаления детергентов во время очистки, однако она может отрицательно влиять на способы, раскрытые в данном документе.
Замена детергента
[0108] Для образования наночастиц первый детергент, применяемый для экстракции белка из клетки-хозяина, фактически замещают вторым детергентом с получением структуры наночастицы. NP-9 представляет собой предпочтительный детергент для экстракции. Обычно наночастицы не содержат подлежащего выявлению NP-9 при измерении с помощью HPLC. Второй детергент обычно выбирают из группы, состоящей из PS20, PS40, PS60, PS65 и PS80. Предпочтительно второй детергент представляет собой PS80. Для поддержания стабильности составов на основе наночастиц соотношение второго детергента и белка поддерживают в пределах определенного диапазона.
[0109] В конкретных аспектах замену детергента выполняют с помощью аффинной хроматографии для связывания гликопротеинов посредством их углеводного фрагмента. Например, в аффинной хроматографии можно применять колонку, содержащую лектин бобовых. Лектины бобовых представляют собой белки, изначально идентифицированные в растениях, и которые, как обнаружено, специфически и обратимо взаимодействуют с углеводными остатками. См., например, Sharon and Lis, “Legume lectins--a large family of homologous proteins,” FASEB J. 1990 Nov;4(14):3198-208; Liener, “The Lectins: Properties, Functions, and Applications in Biology and Medicine,” Elsevier, 2012. Подходящие лектины включают в себя конканавалин A (con A), лектин гороха, лектин эспарцета и лектин чечевицы. Колонка с лектином чечевицы представляет собой предпочтительную колонку для замены детергента благодаря своим связывающим способностям. См., например, пример 10. Колонки, содержащие лектин, являются коммерчески доступными, например, лектин чечевицы Capto доступен от GE Healthcare. В определенных аспектах в колонке, содержащей лектин чечевицы, можно применять рекомбинантный лектин. На молекулярном уровне считается, что углеводные фрагменты связываются с лектином чечевицы, высвобождая аминокислоты из белка с коалесцированием возле детергента, приводя к образованию содержащего детергент ядра, что обеспечивает наночастицы, имеющие нескольких копий антигена, например, гликопротеиновые олигомеры могут представлять собой димеры, тримеры или тетрамеры, заякоренные в детергенте.
[0110] Детергент при инкубировании с белком с образованием наночастиц во время замены детергента может присутствовать в количестве до приблизительно 0,1% (вес./об.) во время ранних стадий очистки, и это количество снижается для получения конечных наночастиц, имеющих оптимальную стабильность. Например, неионный детергент (например, PS80) может составлять от приблизительно 0,03% до приблизительно 0,1%. Предпочтительно для повышенной стабильности наночастица содержит от приблизительно 0,03% до приблизительно 0,05% PS80. Количества ниже приблизительно 0,03% PS80 в составах не характеризуются высокой стабильностью. Кроме того, если PS80 присутствует в количестве свыше приблизительно 0,05%, то образуются агрегаты. Соответственно, количество PS80 от приблизительно 0,03% до приблизительно 0,05% обеспечивает структурные преимущества и преимущества стабильности, которые способствуют долговременной стабильности наночастиц при сниженном распаде.
[0111] Замену детергента можно выполнять с помощью белков, очищенных, как обсуждается выше, и очищенных, замороженных для хранения и затем размороженных для замены детергента.
Повышенная стабильность и повышенная иммуногенность наночастиц
[0112] Не ограничиваясь теорией, считается, что ассоциирование антигена с содержащим неионный детергент ядром придает более высокий уровень стабильности и презентации антигена. Наночастицы, раскрытые в данном документе, обеспечивают неожиданным образом высокую стабильность и иммуногенность. Предпочтительная стабильность особенно пригодна для вакцин, используемых в странах, в которых отсутствует надлежащее хранение; например, в определенных местностях в Африке могут отсутствовать холодильники и, таким образом, вакцины против заболеваний, распространенных в областях, таких как вирус Эбола и RSV, подвергаясь сложным условиям хранения, выигрывают от повышенной стабильности. Кроме того, наночастицы на основе HA вируса гриппа, получаемые с помощью подхода с применением нейтрального значения pH, характеризуются более эффективным сворачиванием по сравнению с известными рекомбинантными вакцинами против гриппа.
[0113] Примечательно, что предшествующие подходы к использованию детергентов с получением вакцин на основе RSV, включающие сплит-вакцины, такие как описанные в US 2004/0028698 Colau et al., не привели к получению эффективных структур. Вместо наночастиц, имеющих белки, окружающие ядро, содержащее детергент, как описано в данном документе, композиции Colau et al содержали аморфное вещество, в котором отсутствовали подлежащие идентификации вирусные структуры, предположительно приводя к неспособности обеспечивать эффективную презентацию эпитопов иммунной системе. Кроме того, раскрытые наночастицы характеризуются особенно повышенной стабильностью, поскольку ориентация антигенов, часто гликопротеинов, вокруг ядра, содержащего детергент, стерически препятствует доступу ферментов и других химических веществ, которые вызывают распад белков.
[0114] Наночастицы характеризуются повышенной стабильностью, как определяется по их способности сохранять иммуногенность после воздействия различных стрессовых факторов. Стабильность можно измерять различными путями. В одном подходе можно получить пептидную карту для определения целостности антигенного белка после различных обработок, разработанных для подвергания стрессовым факторам наночастиц в результате имитации жестких условий хранения. Таким образом, показатель стабильности представляет собой относительный избыток антигенных пептидов в подвергнутом стрессовым факторам образце по сравнению с контрольным образцом. На фигуре 12 показано, что даже после различных стрессовых факторов в отношении композиции на основе наночастиц на основе F-белка RSV достигают устойчивых иммунных ответов. На фигуре 13 представлена повышенная устойчивость к протеазам, обеспечиваемая наночастицами с помощью уровней PS80 свыше 0,015%. Примечательно, что через 18 месяцев PS80 в концентрации 0,03% приводит к 50% снижению образования усеченных молекул по сравнению с 0,015% PS80. Наночастицы, раскрытые в данном документе, стабильны при 2-8°C. Предпочтительно, однако, чтобы они также были стабильны при 25°C в течение по меньшей мере 2 месяцев. В некоторых вариантах осуществления композиции стабильны при 25°C в течение по меньшей мере 3 месяцев, по меньшей мере 6 месяцев, по меньшей мере 12 месяцев, по меньшей мере 18 месяцев или по меньшей мере 24 месяцев. В случае наночастиц на основе F-белка RSV стабильность можно измерять по образованию усеченного белка F1, как показано на фигуре 13. Предпочтительно, чтобы наночастицы на основе F-белка RSV, раскрытые в данном документе, предпочтительно сохраняли интактный антигенный сайт II при избытке от 90 до 100%, как измерено с помощью пептидного картирования, по сравнению с контрольным F-белком RSV, в ответ на различные стрессовые факторы, в том числе pH (pH 3,7), высокое значение pH (pH 10), повышенная температура (50°C в течение 2 недель) и даже окисление пероксидом, как показано на фигуре 12.
[0115] Считается, что положение гликопротеина, заякоренного в ядро, содержащее детергент, обеспечивает повышенную стабильность в результате ослабления нежелательных взаимодействий. Например, повышенную защиту против протеазного распада можно достичь посредством экранирующего эффекта, при этом заякоривание гликопротеинов в ядро при молярных соотношениях, раскрытых в данном документе, приводит к стерическому несоответствию, блокирующему доступ протеаз.
[0116] Таким образом, в конкретных аспектах в данном документе раскрыты наночастицы на основе F-белка RSV и композиции, содержащие то же самое, в которых сохраняется от 90% до 100% пептида с интактным сайтом II по сравнению с необработанным контролем в ответ на одну или более обработок, выбранных из группы, состоящей из инкубации при 50°C в течение 2 недель, инкубации при значении pH 3,7 в течение 1 недели при 25°C, инкубации при значении рН 10 в течение 1 недели при 25°C, перемешивании в течение 1 недели при 25°C и инкубации с окислителем, таким как пероксид водорода, в течение 1 недели при 25°C. Кроме того, после таких обработок функциональность композиций сохраняется. См. фигуры 12A-12D. Например, титры нейтрализующих антител, IgG к RSV и PCA сохраняются по сравнению с контролем.
[0117] Повышенную иммуногенность иллюстрируют с помощью перекрестной нейтрализации, достигаемой наночастицами против вируса гриппа. Считается, что ориентация антигенов вируса гриппа, выступающих из ядра, обеспечивает более эффективную презентацию эпитопов иммунной системе.
Антигены наночастиц
[0118] В типичных вариантах осуществления антигены, используемые для получения наночастиц, представляют собой вирусные белки. В некоторых аспектах белки могут быть модифицированными, однако сохраняют способность стимулировать иммунные ответы на природный пептид. В некоторых аспектах белок по природе содержит трансмембранный домен или адаптирован к содержанию его для стимуляции ассоциации белка в ядро, содержащее детергент. Часто белок представляет собой встречающийся в природе гликопротеин.
Антигены RSV
[0119] В одном аспекте вирус представляет собой респираторно-синцитальный вирус (RSV), а вирусный антиген представляет собой слитый гликопротеин (F). Структура и функция F-белков RSV хорошо описана. См. фигуру 1 в качестве примера структуры дикого типа. Подходящие F-белки RSV для применения в композициях, описанных в данном документе, можно получить из штаммов RSV, таких как A2, Long, ATCC VR-26, 19, 6265, E49, E65, B65, RSB89-6256, RSB89-5857, RSB89-6190 и RSB89-6614. В определенных вариантах осуществления F-белки RSV являются мутированными по сравнению с их природными вариантами. Эти мутации придают желательные характеристики, такие как повышенная экспрессия белка, повышенная иммуногенность и т.п. Дополнительную информацию, в которой описана структура F-белка RSV, можно найти в Swanson et al. A Monomeric Uncleaved Respiratory Syncytial Virus F Antigen Retains Prefusion-Specific Neutralizing Epitopes. Journal of Virology, 2014, 88, 11802-11810. Jason S. McLellan et al. Structure of RSV Fusion Glycoprotein Trimer Bound to a Prefusion-Specific Neutralizing Antibody. Science, 2013, 340, 1113-1117.
[0120] Сайт первичного расщепления белка слияния расположен в остатках 131-136, соответствующих SEQ ID NO:2. Инактивации сайта первичного расщепления белка слияния можно достичь с помощью мутирования остатков в сайте, при этом результатом будет то, что фурин не сможет больше распознавать консенсусную последовательность. Например, инактивации сайта первичного расщепления фурином можно достичь в результате введения по меньшей мере одной аминокислотной замены в положениях, соответствующих аргинину 133, аргинину 135 и аргинину 136 F-белка RSV дикого типа (SEQ ID NO:2). В конкретных аспектах один, два или все три из аргининов являются мутированными с заменой на глутамин. В других аспектах инактивацию осуществляют в результате мутирования сайта дикого типа с заменой на одну из следующих последовательностей: KKQKQQ (SEQ ID NO: 14), QKQKQQ (SEQ ID NO:15), KKQKRQ (SEQ ID NO: 16) и GRRQQR (SEQ ID NO: 17).
[0121] В конкретных аспектах от 1 до 10 аминокислот, соответствующих аминокислотам 137-145 под SEQ ID NO: 2, можно удалить, в том числе в конкретных примерах подходящих F-белков RSV, показанных ниже. Каждую из SEQ ID NO 3-13 можно необязательно получить с активным сайтом первичного расщепления белка слияния KKRKRR (SEQ ID NO:18). Штамм дикого типа в SEQ ID NO:2 имеет ошибки секвенирования (A по отношению к P, V по отношению к I и V по отношению к M), которые исправлены в SEQ ID NO:3-13. После экспрессии F-белка RSV в клетке-хозяине N-концевой сигнальный пептид отщепляется с образованием конечных последовательностей. Обычно сигнальный пептид отщепляется с помощью протеаз клеток-хозяев. Однако в других аспектах можно выделить полноразмерный белок из клетки-хозяина, и сигнальный пептид отщепляется впоследствии. N-концевой сигнальный пептид F-белка RSV состоит из аминокислот под SEQ ID NO: 26 (MELLILKANAITTILTAVTFCFASG). Таким образом, например, после отщепления сигнального пептида от SEQ ID NO:8 во время экспрессии и очистки зрелый белок, имеющий последовательность под SEQ ID NO: 19, получают и применяют для получения вакцины на основе наночастиц на основе F-белка RSV. См. фиг. 1B. Необязательно одну или более вплоть до всех аминокислот сигнального пептида F-белка RSV можно удалить, мутировать или весь сигнальный пептид можно удалить и заменить другим сигнальным пептидом для усиления экспрессии. Исходный остаток метиоина сохраняется для инициации экспрессии.

[0122] В некоторых аспектах F-белок RSV, раскрытый в данном документе, лишь изменен от штамма дикого типа в результате делеций в домене слияния, необязательно с инактивацией сайта первичного расщепления. В других аспектах можно выполнить дополнительные изменения F-белка RSV. Обычно остатки цистеина являются мутированными. Обычно N-связанные сайты гликозилирования не являются мутированными. См. фигуру 1B. Кроме того, антигенный сайт II, также называемый в данном документе как сайт паливизумаба в связи со способностью паливизумаба связываться с этим сайтом, сохраняется. Антитело мотавизумаб также связывается с сайтом II. Дополнительные подходящие F-белки RSV, включенные посредством ссылки, встречаются в публикации США US 2011/0305727, в том числе, в частности, F-белки RSV, содержащие последовательности, охватывающие остатки 100-150, как раскрыто на фигуре 1C в том документе.
[0123] В определенных других аспектах F1- или F2-домены RSV могут иметь модификации по отношению к штамму дикого типа, как показано в SEQ ID NO:2. Например, F1-домен может иметь 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 изменений, которые могут представлять собой мутации или делеции. Аналогично, F2-домен может иметь 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 изменений, которые могут представлять собой мутации или делеции. Каждый из F1- и F2-доменов может независимо быть на по меньшей 90%, на по меньшей мере 94%, на по меньшей мере 95%, на по меньшей мере 96%, на по меньшей мере 98%, на по меньшей мере 99% или на по меньшей мере 100% идентичен последовательности дикого типа.
[0124] В конкретном примере лекарственный продукт на основе наночастиц на основе RSV может содержать от приблизительно 0,025% до приблизительно 0,03% PS80 с F-белком RSV в диапазоне от приблизительно 270 мкг/мл до приблизительно 300 мкг/мл или от приблизительно 60 мкг/мл до приблизительно 300 мкг/мл. В других аспектах лекарственный продукт на основе наночастиц может содержать от приблизительно 0,035% до приблизительно 0,04% PS80 в композиции с F-белком RSV в концентрации от 300 мкг/мл до приблизительно 500 мкг/мл. В других аспектах лекарственный продукт на основе наночастиц может содержать от приблизительно 0,035% до приблизительно 0,04% PS80 в композиции с F-белком RSV в концентрации 350-500 мкг/мл.
[0125] Поскольку концентрации антигена и детергента могут варьировать, то количества каждого можно упоминать как молярное соотношение неионный детергент:белок. Например, молярное соотношение PS80 к белку рассчитывают с помощью концентрации PS80 и концентрации белка антигена, измеренной с помощью ELISA/A280, и их соответствующих молекулярных масс. Молекулярная масса PS80, используемая для расчета, составляет 1310, а с применением F-белка RSV в качестве примера молекулярная масса F-белка RSV составляет 65 кД. Молярное соотношение рассчитывают следующим образом: (концентрация PS80 ×10×65000) ÷ (1310×концентрация F-белка RSV в мг/мл). Таким образом, например, как показано на фигуре 13, концентрация наночастиц, измеренная с помощью белка, составляет 270 мкг/мл, а концентрации PS80 составляют 0,015% и 0,03%. Они имеют молярное соотношение PS80 к F-белку RSV, составляющее 27:1 (то есть, 0,015 x 10 x 65000 / (1310 x 0,27)) и 55:1, соответственно.
[0126] В конкретных аспектах молярное соотношение находится в диапазоне от приблизительно 30:1 до приблизительно 80:1, от приблизительно 30:1 до приблизительно 70:1, от приблизительно 30:1 до приблизительно 60:1, от приблизительно 40:1 до приблизительно 70:1 или от приблизительно 40:1 до приблизительно 50:1. Часто замещаемый неоинный детергент представляет собой PS80, а молярное соотношение PS80:белок составляет от приблизительно 30:1 до приблизительно 50:1. В случае F-гликопротеина RSV наночастицы, имеющие молярное соотношение в диапазоне от 35:1 до приблизительно 65:1, и, в частности, соотношение, составляющее приблизительно 45:1, являются особенно стабильными.
Антигены вируса гриппа
[0127] Платформа на основе наночастиц является особенно пригодной для презентации антигенов вируса гриппа иммунной системе субъекта. В предыдущих подходах получения вакцин на основе наночастиц против вируса гриппа применяли колонки с гидрофобным взаимодействием для удаления детергента, или содержались лишь минимальные количества детергента для снижения неспецифических взаимодействий, которые возникали во время очистки продуктов. Однако было обнаружено, что при выполнении стадии замены детергента можно получить наночастицы, имеющие ядро, содержащее неионный детергент, характеризующиеся отличными свойствами. Наночастицы характеризуются высокой стабильностью, что подтверждается устойчивостью к разрушению под воздействием стрессовых факторов окружающей среды , что обеспечивает длительные периоды хранения, что является особенно важным свойством для вакцин. Кроме того, структура наночастицы является такой, что она обеспечивает презентацию антигенов особенно предпочтительным образом.
[0128] Наночастицы против вируса гриппа особенно пригодны в качестве вакцин, поскольку антитела, которые они индуцируют, включают в себя в широком смысле нейтрализующие антитела. Таким образом, антитела, индуцируемые наночастицей, введенной в один год, могут нейтрализовать штаммы вируса гриппа, возникающие в результате процесса «дрейфа» в последующие годы. Считается, что такие эпитопы, которые индуцируют в широком смысле нейтрализующие антитела, не подвергались воздействию вообще или подвергались эффективному воздействию в предыдущих вакцинах против гриппа, или что такие эпитопы были недостаточно стабильны в предыдущих составах. С помощью наночастиц, раскрытых в данном документе, решаются эти проблемы в результате презентации перекрестных защитных эпитопов, заякоренных вокруг ядра, содержащего неионный детергент с повышенной стабильностью.
[0129] В конечном итоге в способах, раскрытых в данном документе, предусмотрен особенно высокий выход наночастиц против вируса гриппа с высокой чистотой, что является предпочтительным экономически в целом и особенно ценным для вирусов, которые требуют быстрого получения в больших количествах, таких как пандемический вирус гриппа.
[0130] В определенных вариантах осуществления наночастица может содержать белок HA или белок NA. Например, наночастица может содержать белок HA, выбранный из подтипов H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 и H16. Наночастица может содержать белок NA, выбранный из подтипов N1, N2, N3, N4, N5, N6, N7, N8 и N9. Филогенетически белки HA и NA разделяются на две группы. В случае HA группа 1 содержит H1, H2, H5, H6, H8, H9, H11, H12, H13 и H16, и группа 2 содержит H3, H4, H7, H10, H14 и H15. NA также образуют две группы: группа 1 содержит N1, N4, N5 и N8, и группа 2 содержит N2, N3, N6, N7 и N9. В определенных аспектах антиген может быть на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 97% или на по меньшей мере 99% идентичным белку HA или белку NA нативного вируса гриппа.
[0131] Белки HA и NA, применяемые для наночастиц, обычно представляют собой полноразмерные последовательности. В определенных аспектах участки C-конца можно удалить.
[0132] Предпочтительно композиции, имеющие белки вируса гриппа, могут индуцировать ответы против гетерологичных штаммов вируса гриппа, даже в случае, если дополнительные патогенные наночастицы, раскрытые в данном документе, вводят совместно. При индуцировании ответов против гетерологичных штаммов вируса гриппа достигают более широкой защиты. Таким образом, в конкретных вариантах осуществления титр гомологичных HAI, индуцированный композициями с добавлением в качестве адъюванта Matrix M, составляет от приблизительно 800 до приблизительно 2000. В конкретных аспектах титр гетерологичных HAI составляет приблизительно 1300. В конкретных аспектах титр гетерологичных HAI, индуцированный композициями с добавлением в качестве адъюванта Matrix M, составляет от приблизительно 200 до приблизительно 400; например, титр гетерологичных HAI может составлять приблизительно 300.
[0133] В определенных аспектах наночастицы против вируса гриппа представляют собой устойчивые к трипсину наночастицы, полученные с помощью очистки при нейтральном значении pH. Устойчивость к трипсину достигают с помощью диапазона нейтральных значений pH, составляющих от свыше 6,8 до 8,5 во время очистки и составления наночастиц на основе HA. В конкретных аспектах диапазон значений pH во время очистки и составления наночастиц на основе HA составляет от 7,0 до 8,5, от 7,0 до 7,5 или от 7,2 до 7,5. Стабильность наночастиц на основе HA можно измерять с помощью дифференциальной сканирующей калориметрии (DSC). С помощью DSC измеряется термодинамический профиль макромолекул в растворе, в частности, с помощью измерения разницы захвата тепловой энергии между раствором образца и соответствующим эталоном (буфером/растворителем) при изменении температуры контролируемым образом. С помощью DSC предоставляются данные, такие как точки перехода (Tm), определяемые как температуры, при которых половина белка денатурируется/разворачивается и половина находится в нативном/свернутом состоянии. В определенных аспектах устойчивые к трипсину наночастицы на основе HA в данном документе имеют пик Tm в диапазоне от приблизительно 60°C до 75°C; например, Tm может составлять 60°C, 65°C, 70°C или 75°C.
[0134] Устойчивость к трипсину указывает на то, что белок HA должным образом свернут, и, таким образом, приводит к образованию вакцинного продукта, имеющего более высокую стабильность и иммуногенность. Чувствительность белков HA варьирует от штамма к штамму и получение при нейтральных значениях pH, раскрытое в данном документе, таким образом, предусматривает доведение способа до максимума иммуногенности для всех штаммов, особенно чувствительных к значению pH штаммов. Не ограничиваясь теорией, считается, что комбинация замены детергента и нейтральных уровней pH сохраняет белок HA в той структуре, которая делает его устойчивым к протеазам, в частности, трипсину. Таким образом, при наличии белка HA, ассоциированного вокруг содержащего неионный детергент ядра в комбинации с очисткой при нейтральных значениях pH, получают белки HA с особенно высокой стабильностью и иммуногенностью. Кроме того, способы получения наночастиц обеспечивают высокие уровни белка для применения в вакцине. В конкретных аспектах получают наночастицы на основе HA, как измерено с помощью A280, в концентрации от приблизительно 10 мг/л клеточной культуры до приблизительно 30 мг/л или выше, от приблизительно 20 мг/л до приблизительно 30 мг/л.
[0135] Устойчивые к трипсину наночастицы на основе HA можно получить, как описано на фигуре 24. Вкратце, различные стадии, в том числе замены детергента, выполняют с буферами со значением свыше рН 7,0; часто в диапазоне от приблизительно pH 7,2 до приблизительно pH 7,4. На фигуре 25D представлен пример более высокой термостабильности, достигаемой с помощью устойчивых к трипсину наночастиц. Производственные партии TFF и MMC получали с помощью нейтральных значений pH, в то время как партия с неправильным сворачиванием при низком значении pH была фактически разрушенной и/или неправильно свернутой.
Антигены вируса Эбола
[0001] В настоящем изобретении также предусмотрены способы и композиции для лечения, облегчения или предупреждения инфекции и/или заболевания, вызванного вирусом Эбола. В частности, композиции представляют собой вакцинные композиции. Предпочтительно вакцинные композиции, раскрытые в данном документе, обеспечивают 100% выживаемость в ответ на летальное заражение в животных моделях. Композиции также поддерживают вирусную нагрузку приблизительно или ниже подлежащего выявлению предела при применении RT-PCR для выявления вирусной нуклеиновой кислоты.
[0002] В одном аспекте в настоящем изобретении предусмотрены композиции, содержащие наночастицы на основе рекомбинантного гликопротеина вируса Эбола (GP) в комбинации с адъювантами на основе сапонинов.
[0003] В конкретных аспектах в настоящем изобретении предусмотрены иммуногенные композиции, содержащие один или более белков GP вируса Эбола в структуре наночастицы, где белок GP находится в форме тримера и каждая наночастица содержит по меньшей мере один тример, присоединенный к содержащему неионный детергент ядру.
[0004] Наночастицу на основе GP вируса Эбола можно применять для предупреждения и/или лечения инфекции, вызываемой вирусом Эбола. В другом аспекте в настоящем изобретении предусмотрены фармацевтически приемлемые вакцинные композиции, содержащие наночастицы на основе GP вируса Эбола. В некоторых аспектах наночастицы от более одного штамма находятся в вакцине. В другом варианте осуществления в настоящем изобретении предусмотрена фармацевтическая упаковка или набор, содержащий один или более контейнеров, заполненных одним или более компонентами вакцинных составов.
Гликопротеины вируса Эбола
[0005] Антиген вируса Эбола, применяемый для получения наночастицы, обычно представляет собой гликопротеиновый (GP) антиген вируса Эбола. Антиген может быть получен от множества штаммов. Композиции, раскрытые в данном документе, могут содержать наночастицы от одного, двух, трех, четырех, пяти или шести отдельных штаммов вируса Эбола. Например, штамм может представлять собой Makona, Sudan, Zaire, Reston. В других аспектах GP вируса Эбола может быть идентичен по аминокислотам или нуклеиновым кислотам одному или более из этих штаммов. Например, GP может быть на приблизительно 80% идентичен, на приблизительно 85% идентичен, на приблизительно 90% идентичен, на приблизительно 95% идентичен, на приблизительно 97% идентичен, на приблизительно 98% идентичен или на приблизительно 99% идентичен одному или более из GP от вирусов штаммов Makona, Sudan, Zaire или Reston, где идентичность измеряют по полной длине белка или нуклеиновой кислоты. В некоторых аспектах GP вируса Эбола может содержать или состоять из SEQ ID NO:27 или 28, или белка, идентичного ей.
[0006] Типичная последовательность штамма Zaire представлена под номером доступа в GenBank AAB81004 (SEQ ID NO:27). В первом подчеркнутом участке показан N-конец белка GP1. Предшествующий сигнальный пептид отщепляется во время процессинга после экспрессии в клетке перед очисткой и составлением в вакцину. Жирным шрифтом показан сайт расщепления фурином. После текста жирным шрифтом показан N-конец белка GP2. На фигуре 7A представлен эскиз структуры белка.
MGVTGILQLPRDRFKRTSFFLWVIILFQRTFSIPLGVIHNSTLQVSDVDKLVCRDKLSSTNQLRSVGLNLEGNGVATDVPSATKRWGFRSGVPPKVVNYEAGEWAENCYNLEIKKPDGSECLPAAPDGIRGFPRCRYVHKVSGTGPCAGDFAFHKEGAFFLYDRLASTVIYRGTTFAEGVVAFLILPQAKKDFFSSHPLREPVNATEDPSSGYYSTTIRYQATGFGTNETEYLFEVDNLTYVQLESRFTPQFLLQLNETIYTSGKRSNTTGKLIWKVNPEIDTTIGEWAFWETKKNLTRKIRSEELSFTVVSNGAKNISGQSPARTSSDPGTNTTTEDHKIMASENSSAMVQVHSQGREAAVSHLTTLATISTSPQSLTTKPGPDNSTHNTPVYKLDISEATQVEQHHRRTDNDSTASDTPSATTAAGPPKAENTNTSKSTDFLDPATTTSPQNHSETAGNNNTHHQDTGEESASSGKLGLITNTIAGVAGLITGGRRTRREAIVNAQPKCNPNLHYWTTQDEGAAIGLAWIPYFGPAAEGIYIEGLMHNQDGLICGLRQLANETTQALQLFLRATTELRTFSILNRKAIDFLLQRWGGTCHILGPDCCIEPHDWTKNITDKIDQIIHDFVDKTLPDQGDNDNWWTGWRQWIPAGIGVTGVIIAVIALFCICKFVF
[0007] Последовательность изолята Makona представлена под номером доступа в GenBank AJG44192 (SEQ ID NO:28). Как представлено выше, в первом подчеркнутом участке показан N-конец белка GP1. Предшествующий сигнальный пептид отщепляется во время процессинга. Жирным шрифтом показан сайт расщепления фурином. После текста жирным шрифтом показан N-конец белка GP2. См. также фигуру 7B.
MGVTGILQLPRDRFKRTSFFLWVIILFQRTFSIPLGVIHNSTLQVSDVDKLVCRDKLSSTNQLRSVGLNLEGNGVATDVPSVTKRWGFRSGVPPKVVNYEAGEWAENCYNLEIKKPDGSECLPAAPDGIRGFPRCRYVHKVSGTGPCAGDFAFHKEGAFFLYDRLASTVIYRGTTFAEGVVAFLILPQAKKDFFSSHPLREPVNATEDPSSGYYSTTIRYQATGFGTNETEYLFEVDNLTYVQLESRFTPQFLLQLNETIYASGKRSNTTGKLIWKVNPEIDTTIGEWAFWETKKNLTRKIRSEELSFTAVSNGPKNISGQSPARTSSDPETNTTNEDHKIMASENSSAMVQVHSQGRKAAVSHLTTLATISTSPQPPTTKTGPDNSTHNTPVYKLDISEATQVGQHHRRADNDSTASDTPPATTAAGPLKAENTNTSKSADSLDLATTTSPQNYSETAGNNNTHHQDTGEESASSGKLGLITNTIAGVAGLITGGRRTRREVIVNAQPKCNPNLHYWTTQDEGAAIGLAWIPYFGPAAEGIYTEGLMHNQDGLICGLRQLANETTQALQLFLRATTELRTFSILNRKAIDFLLQRWGGTCHILGPDCCIEPHDWTKNITDKIDQIIHDFVDKTLPDQGDNDNWWTGWRQWIPAGIGVTGVIIAVIALFCICKFVF
[0008] Способность вакцинных композиций стимулировать иммунные ответы подтверждали в трех животных моделях. Во-первых, применяли мышиную модель. Оценивали вакцину на основе наночастиц на основе полноразмерного GP EBOV/Mak, составленную с Matrix M, AlPO4 или солевым раствором. Иммунизация мышей не содержащим адъюванта или с добавлением в качестве адъюванта AlPO4 GP EBOV/Mak индуцировала умеренные ответы антител и клеточные ответы; однако при добавлении в качестве адъюванта Matrix M очищенные наночастицы на основе GP EBOV/Mak были высокоиммуногенными и защитными в мышиной модели заражения. Иммунизация мышей с помощью GP EBOV/Mak с добавлением в качестве адъюванта Matrix M приводила к значительному повышению IgG к GP EBOV/Mak и нейтрализующего антитела к белку вируса Эбола. Иммунизация с помощью GP EBOV/Mak с добавлением в качестве адъюванта Matrix M обеспечивала 100% защиту от летального заражения вирусом Эбола, в то время как GP EBOV/Mak без добавления адъюванта оказывало лишь на 10% защитный эффект, и защитного эффекта не наблюдалось у мышей, иммунизированных GP EBOV/Mak с AlPO4. Таким образом, в конкретных аспектах композиции, раскрытые в данном документе, предупреждают инфекцию, вызываемую вирусом Эбола.
[0009] Совместное введение GP EBOV/Mak с Matrix M индуцировало получение сбалансированного ответа подклассов IgG1 и IgG2a. В отсутствие адъюванта или с AlPO4 выявляли минимальное содержание антитела IgG2a. Blaney et al. Antibody quality and protection from lethal Ebola virus challenge in nonhuman primates immunized with rabies virus based bivalent vaccine. PLoS Pathog. 2013;9(5): показано в модели химерной вакцины бешенство/EBOV у отличных от человека приматов (NHP), что изотип антитела играл роль в нейтрализации вирусов и защите от заражения вирусом Эбола. Мышиное антитело IgG2a является эквивалентным человеческому антителу IgG1, которое эффективно связывается с рецепторами к Fc IgG (FcγR) и комплементом (C1q) (Bruhns, P. Properties of mouse and human IgG receptors and their contribution to disease models Blood. 2012;119: 5640-5649; Vidarsson G, Dekkers G, Rispens T. IgG subclasses and allotypes: from structure to effector functions. Front. Immunol. 2014;5:520) и может способствовать разрешению проблемы вирусных инфекций, например, посредством антителозависимой клеточноопосредованной цитотоксичности. Все антитела, которые были полностью защитными in vivo, принадлежали к подклассу IgG2a; т.е., тому же, что и человеческий IgG1. Таким образом, композиции, раскрытые в данном документе, стимулируют продукцию антител IgG1 в качестве части защитного иммунного ответа.
[0010] Применение адъюванта Matrix M обеспечивало дозозависимое повышение частоты образования секретирующих цитокины CD4+ и CD8+ T-клеток, а также количество мультифункциональных T-клеток, продуцирующих более одного цитокина. Было отмечено, что защита от летального заражения, вызываемого вирусом Эбола, наблюдавшаяся лишь в группе с GP EBOV/Mak с добавлением в качестве адъюванта Matrix M, коррелировала с повышенной продукцией мультифункциональных Т-клеток.
[0011] Применение Matrix M повышало частоту образования B-клеток GC в селезенке и долгоживущих плазматических клеток в костном мозге. GC представляют собой микроанатомические зоны B-клеточной дифференциации, соматической гипермутации, переключения класса антител и образования B-клеток памяти. Совместное введение GP EBOV/Mak с сапониновым адъювантом Matrix M также приводило к повышению количеств TFH-клеток, которые облегчают дифференциацию и развитие B-клеток GC. Повышенные частоты образования GC и TFH-клеток, индуцированных добавлением в качестве адъюванта Matrix M, коррелировали с повышенной величиной ответа антител и индукцией больших количеств долгоживущих плазматических клеток, предполагая, что вакцина на основе GP EBOV/Mak с добавлением в качестве адъюванта Matrix M может индуцировать особенно длительный ответ антител.
[0012] Каждая доза GP вируса Эбола может быть объединена с адъювантом. Введение адъюванта Matrix M с очищенными наночастицами на основе GP EBOV/Mak обеспечивает устойчивую стимуляцию иммунного ответа к GP EBOV/Mak, приводя к 100% защитной эффективности в мышиной модели. В композициях и способах, раскрытых в данном документе, предусмотрено более быстрое появление IgG к GP EBOV/Mak и нейтрализующих антител к белкам вируса Эбола, повышенная концентрация IgG2a, а также повышенная частота образования мультифункциональных CD4+ и CD8+ T-клеток, TFH-клеток, B-клеток зародышевого центра и жизнестойкость специфичных в отношении GP EBOV/Mak плазматических B-клеток в костном мозге.
[0013] Таким образом, анализ исследования на мышах подтверждает, что композиции, раскрытые в данном документе, обеспечивали полную защиту. Для дополнительного обоснования защитного эффекта исследования выполняли в двух отдельных моделях отличных от человека приматов: бабуинах и макаках. См. Perry et al., “The Baboon (Papio spp.) as a model of human Ebola virus infection,” Viruses. 2012 Oct 23;4(10):2400-16; Geisbert et al., “Pathogenesis of Ebola hemorrhagic fever in cynomolgus macaques: evidence that dendritic cells are early and sustained targets of infection,” Am J Pathol. 2003 Dec;163(6):2347-70. Соответственно, в некоторых аспектах настоящего изобретения защитный эффект включает снижение вирусной нагрузки ниже способности выявления посредством RT-PCR через приблизительно 7 дней, через приблизительно 10 дней, через приблизительно 14 дней или через приблизительно 21 день после вирусного воздействия.
[0014] Исследования на отличных от человека приматах дополнительно подтвердили, что композиции, раскрытые в данном документе, являются защитными. Наночастицы на основе GP вируса Эбола оценивали без адъюванта, и либо с адъювантами на основе квасцов, либо с адъювантами Matrix M. См. пример 23. Иммунные ответы у бабуинов были чрезвычайно устойчивыми и длительными. Примечательно, что включение Matrix M приводило к более высокому иммунному ответу по сравнению с квасцами. Результаты с применением модели на макаках были особенно неожиданными. См. примеры 24 и 24. Композиции не только защищали от заражения вакциной на основе живого вируса Эбола, но и количество РНК вируса Эбола не подлежало выявлению через 10 дней после заражения живым вирусом. См. фигуру 48. Примечательно, что у одного субъекта-макака наблюдали незначительный сигнал на приблизительно 7-й день; однако на 10-й день уровни возвращались ниже предела выявления. В отличие от этого, воздействие на необработанных животных живого вируса Эбола приводило к инфекции и заболеванию таким образом, что субъекта выводили из эксперимента на 9-й день.
Модифицированные антигены
[0136] Антигены, раскрытые в данном документе, охватывают вариации и мутанты этих антигенов. В определенных аспектах антиген может быть идентичен раскрытому антигену. В целом и, если конкретно не указано в контексте специфически идентифицируемых антигенов, процент идентичности может составлять по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97% или по меньшей мере 98%. Процент идентичности можно рассчитать с помощью программы выравнивания ClustalW2, доступной по адресу www.ebi.ac.uk/Tools/msa/clustalw2/. Следующие параметры по умолчанию можно применять для попарного выравнивания: матрица сравнения аминокислот = Gonnet; штраф за открытие гэпа = 10; штраф за продление гэпа = 0,1.
[0137] В конкретных аспектах белок, содержащийся в наночастицах, состоит из этого белка. В других аспектах белок, содержащийся в наночастицах, включает в себя этот белок. Дополнения к самому белку можно выполнять для различных целей. В некоторых аспектах антиген может быть удлинен на N-конце, C-конце или на обоих. В некоторых аспектах удлинение представляет собой метку, пригодную для функции, такой как очистка или выявление. В некоторых аспектах метка содержит эпитоп. Например, метка может представлять собой полиглутаминовую метку, метку FLAG, метку HA, метку polyHis (имеющую приблизительно 5-10 гистидинов), метку Myc, метку глутатион-S-трансферазу, метку зеленого флуоресцентного белка, метку мальтозосвязывающего белка, метку тиреодоксина или метку Fc. В других аспектах удлинение может представлять собой N-концевой пептидный сигнал, слитый с белком для усиления экспрессии. Несмотря на то, что такие сигнальные пептиды часто отщепляются во время экспрессии в клетке, некоторые наночастицы могут содержать антиген с интактным сигнальным пептидом. Таким образом, если наночастица содержит антиген, то антиген может содержать удлинение и, таким образом, может представлять собой слитый белок при включении в наночастицы. В целях расчета идентичности с последовательностью удлинения не включают.
[0138] В некоторых аспектах антиген может быть усечен. Например, N-конец может быть усечен на приблизительно 10 аминокислот, на приблизительно 30 аминокислот, на приблизительно 50 аминокислот, на приблизительно 75 аминокислот, на приблизительно 100 аминокислот или на приблизительно 200 аминокислот. C-конец может быть усечен вместо N-конца или в дополнение к N-концу. Например, С-конец может быть усечен на приблизительно 10 аминокислот, на приблизительно 30 аминокислот, на приблизительно 50 аминокислот, на приблизительно 75 аминокислот, на приблизительно 100 аминокислот или на приблизительно 200 аминокислот. В целях расчета идентичности белка, имеющего усечения, идентичность измеряют в оставшемся участке белка.
Комбинированные наночастицы
[0139] Комбинированная наночастица, как используется в данном документе, относится к наночастице, которая индуцирует иммунные ответы против двух или более различных патогенов. В зависимости от конкретной комбинации, патогены могут представлять собой различные штаммы или подтипы одного и того же вида, или патогены могут представлять собой разные виды. Для получения комбинированной наночастицы гликопротеины от нескольких патогенов могут быть объединены в одной наночастице с помощью связывания их на стадии замены детергента. Связывание гликопротеинов с колонкой после замены детергента способствует тому, что несколько типов гликопротеинов находится вокруг содержащего детергент ядра, с целью получения комбинированной наночастицы.
[0140] В настоящем изобретении также предусмотрены вакцинные композиции, которые индуцируют иммунные ответы против двух или более различных патогенов в результате объединения двух или более наночастиц, каждая из которых индуцирует ответ против различного патогена. Необязательно вакцинные композиции могут содержать одну или более комбинированных наночастиц по отдельности или объединенных с дополнительными наночастицами с целью доведения до максимума иммунного ответа против нескольких патогенов, при этом снижается количество вакцинных композиций, вводимых субъекту.
[0141] Такие композиции особенно желательны, если патогены связаны в некотором аспекте. В одном примере композиция может содержать наночастицы против штаммов, идентифицируемых ежегодно официальными властями в качестве приводящих к появлению сезонного гриппа определенного года. Обычно в случае вакцины против сезонного гриппа вакцинная композиция содержит наночастицы на основе HA и/или NA, которые индуцируют иммунные ответы против штамма из трех, четырех или пяти подтипов вируса гриппа. Таким образом, различные штаммы вируса гриппа могут быть объединены в вакцинной композиции. В некоторых аспектах комбинированная наночастица может содержать белок HA от первого штамма и белок NA от второго штамма. В других аспектах наночастица может содержать один или более белков HA и один или более белков NA от одного и того же или различных подтипов. Например, наночастица может включать в себя наночастицы на основе одного или нескольких HA, выбранных из подтипов H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 и H16 и/или наночастицы на основе одного или более NA, выбранных из подтипов N1, N2, N3, N4, N5, N6, N7, N8 и N9. Филогенетически белки HA и NA разделяются на две группы. В случае HA группа 1 содержит H1, H2, H5, H6, H8, H9, H11, H12, H13 и H16, и группа 2 содержит H3, H4, H7, H10, H14 и H15. Белки NA также образуют две группы: группа 1 содержит N1, N4, N5 и N8, и группа 2 содержит N2, N3, N6, N7 и N9. В определенных аспектах антиген может быть на по меньшей мере 90%, на по меньшей мере 95%, на по меньшей мере 97% или на по меньшей мере 99% идентичным белку HA и/или белку NA нативного вируса гриппа.
[0142] В другом примере как вирус гриппа, так и RSV вызывают заболевание дыхательной системы и, таким образом, HA, NA и/или F-белок RSV могут быть смешаны в комбинированной наночастице или несколько наночастиц могут быть объединены в вакцинной композиции для индуцирования ответов против RSV и одного или более штаммов вируса гриппа.
Вакцинные композиции
[0143] Композиции, раскрытые в данном документе, можно применять либо профилактически, либо терапевтически, но обычно они будут профилактическими. Соответственно в настоящем изобретении предусмотрены способы лечения или предупреждения инфекции. В способах предусмотрено введение субъекту терапевтического или профилактического количества иммуногенных композиций по настоящему изобретению. Предпочтительно фармацевтическая композиция представляет собой вакцинную композицию, которая обеспечивает защитный эффект. В других аспектах защитный эффект может включать облегчение симптома, ассоциированного с инфекцией у процента подверженной воздействию популяции. Например, в зависимости от патогена, композиция может предупреждать или ослаблять один или более симптомов вирусного заболевания, выбранных из: усталости на фоне лихорадки, мышечной боли, головной боли, боли в горле, рвоты, диареи, сыпи, симптомов нарушения работы почек и печени, внутреннего кровотечения и наружного кровотечения, по сравнению с не получавшим лечение субъектом.
[0144] Наночастицы можно составлять для введения в виде вакцин в присутствии различных дополнительных веществ, буферов и т.п. Например, вакцинные композиции могут содержать фосфат натрия, хлорид натрия и/или гистидин. Фосфат натрия может присутствовать в количестве от приблизительно 10 мМ до приблизительно 50 мМ, от приблизительно 15 мМ до приблизительно 25 мМ или приблизительно 25 мМ; в конкретных случаях присутствует приблизительно 22 мМ фосфата натрия. Гистидин может присутствовать в количестве приблизительно 0,1% (вес./об.), приблизительно 0,5% (вес./об.), приблизительно 0,7% (вес./об.), приблизительно 1% (вес./об.), приблизительно 1,5% (вес./об.), приблизительно 2% (вес./об.) или приблизительно 2,5% (вес./об.). Хлорид натрия, при наличии, может составлять приблизительно 150 мМ. В определенных композициях, например, вакцинах против вируса гриппа, хлорид натрия может присутствовать в более высоких количествах, в том числе приблизительно 200 мМ, приблизительно 300 мМ или приблизительно 350 мМ.
[0145] Определенные наночастицы, в частности, наночастицы на основе F-белка RSV, характеризуются повышенной стабильностью при слегка кислых уровнях pH. Например, диапазон значений pH для композиций, содержащих наночастицы, может составлять от приблизительно pH 5,8 до приблизительно pH 7,0, от приблизительно pH 5,9 до приблизительно pH 6,8, от приблизительно pH 6,0 до приблизительно pH 6,5, от приблизительно pH 6,1 до приблизительно pH 6,4, от приблизительно pH 6,1 до приблизительно pH 6,3, или приблизительно pH 6,2. Обычно композиция в случае наночастиц на основе F-белка RSV имеет приблизительно pH 6,2. В других наночастицах композиция может стремиться к нейтральному значению; например, наночастицы на основе белка вируса гриппа могут иметь значение от приблизительно pH 7,0 до pH 7,4; часто приблизительно pH 7,2.
Адъюванты
[0146] В определенных вариантах осуществления композиции, раскрытые в данном документе, могут быть объединены с одним или более адъювантами для усиления иммунного ответа. В других вариантах осуществления композиции получают без адъювантов, и, таким образом, они доступны для введения в виде не содержащих адъювант композиций. Предпочтительно не содержащие адъювант композиции, раскрытые в данном документе, могут обеспечивать защитные ответы при введении в виде одноразовой дозы. Не содержащие квасцов композиции, которые индуцируют устойчивые иммунные ответы, особенно пригодны для взрослых в возрасте приблизительно 60 лет и старше.
Адъюванты на основе алюминия
[0147] В некоторых вариантах осуществления адъювант может представлять собой квасцы (например, AlPO4 или Al(OH)3). Обычно наночастицы фактически связаны с квасцами. Например, по меньшей мере 80% наночастиц могут быть связаны, по меньшей мере 85% связаны, по меньшей мере 90% связаны или по меньшей мере 95% связаны с квасцами. Часто от 92% до 97% наночастиц связаны с квасцами в композиции. Количество квасцов, присутствующих на дозу, обычно находится в диапазоне от приблизительно 400 мкг до приблизительно 1250 мкг. Например, квасцы могут присутствовать в количестве на дозу от приблизительно 300 мкг до приблизительно 900 мкг, от приблизительно 400 мкг до приблизительно 800 мкг, от приблизительно 500 мкг до приблизительно 700 мкг, от приблизительно 400 мкг до приблизительно 600 мкг или от приблизительно 400 мкг до приблизительно 500 мкг. Обычно квасцы присутствуют в количестве от приблизительно 400 мкг на дозу 120 мкг белковой наночастицы.
Сапониновые адъюванты
[0148] Адъюванты, содержащие сапонин, также могут быть объединены с иммуногенами, раскрытыми в данном документе. Сапонины представляют собой гликозиды, полученные из коры дерева Quillaja saponaria Molina. Обычно сапонины получают с помощью многостадийного процесса очистки, приводящего к образованию нескольких фракций. Используемый в данном документе термин «сапониновая фракция из Quillaja saponaria Molina» используется в общем для описания полуочищенной или определенной сапониновой фракции Quillaja saponaria или ее фактически очищенной фракции.
Сапониновые фракции
[0149] Подходящими являются несколько подходов для получения сапониновых фракций. Фракции A, B и C описаны в патенте США №6352697 и могут быть получены следующим образом. Липофильную фракцию из Quil A, неочищенного водного экстракта Quillaja saponaria Molina, отделяют с помощью хроматографии и элюируют с помощью 70% ацетонитрила в воде для извлечения липофильной фракции. Эту липофильную фракцию затем отделяют с помощью полупрепаративной HPLC с элюированием с использованием градиента от 25% до 60% ацетонитрила в кислой воде. Фракция, называемая в данном документе «фракцией A» или «QH-A», представляет собой фракцию или соответствует таковой, которую элюируют с помощью примерно 39% ацетонитрила. Фракция, называемая в данном документе «фракцией В» или «QH-В», представляет собой фракцию или соответствует таковой, которую элюируют с помощью примерно 47% ацетонитрила. Фракция, называемая в данном документе «фракцией С» или «QH-С», представляет собой фракцию или соответствует таковой, которую элюируют с помощью примерно 49% ацетонитрила. Дополнительная информация касательно очистки фракций содержится в патенте США №5057540. При получении, как описано в данном документе, каждая из фракций A, B и C Quillaja saponaria Molina представляет собой группы или семейства химически близко связанных молекул с подлежащими определению свойствами. Хроматографические условия, при которых их получают, представляют собой таковые, при которых воспроизводимость от серии к серии с точки зрения профиля элюирования и биологической активности является высокоустойчивой.
[0150] Были описаны другие сапониновые фракции. Фракции B3, B4 и B4b описаны в EP 0436620. Фракции QA1-QA22 описаны в EP03632279 B2, Q-VAC (Nor-Feed, AS, Дания), Quillaja saponaria Molina Spikoside (lsconova AB, Ultunaallén 2B, 756 51, Уппсала, Швеция). Можно применять фракции QA-1, QA-2, QA-3, QA-4, QA-5, QA-6, QA-7, QA-8, QA-9, QA-10, QA-11, QA-12, QA-13, QA-14, QA-15, QA-16, QA-17, QA-18, QA-19, QA-20, QA-21 и QA-22 из EP 0 3632 279 B2, особенно QA-7, QA-17, QA-18 и QA-21. Их получают, как описано в EP 0 3632 279 B2, особенно на странице 6 и в примере 1 на странице 8 и 9.
[0151] Сапониновые фракции, описанные в данном документе и применяемые для получения адъювантов, часто представляют собой фактически чистые фракции; т.е., фракции фактически не содержат примеси других веществ. В конкретных аспектах фактически чистая сапониновая фракция может содержать до 40% по весу, до 30% по весу, до 25% по весу, до 20% по весу, до 15% по весу, до 10% по весу, до 7% по весу, до 5% по весу, до 2% по весу, до 1% по весу, до 0,5% по весу или до 0,1% по весу других соединений, таких как другие сапонины или другие адъювантные вещества.
Структуры ISCOM
[0152] Сапониновые фракции можно вводить в форме клеточноподобной частицы, называемой ISCOM (Immune Stimulating COMplex). ISCOM можно получать, как описано в EP0109942B1, EP0242380B1 и EP0180546 B1. В конкретных вариантах осуществления можно применять транспортный антиген и/или антиген-пассажир, как описано в EP 9600647-3 (PCT/SE97/00289).
Матричные адъюванты
[0153] В некоторых аспектах ISCOM представляет собой матричный комплекс ISCOM. Матричный комплекс ISCOM содержит по меньшей мере одну сапониновую фракцию и липид. Липид представляет собой по меньшей мере стерин, например, холестерин. В конкретных аспектах матричный комплекс на основе ISCOM также содержит фосфолипид. Матричные комплексы ISCOM также могут содержать одно или более других иммуномодулирующих (адъювант-активных) веществ, необязательно гликозид, и могут быть получены, как описано в EP 0436620 B1.
[0154] В других аспектах ISCOM представляет собой комплекс ISCOM. Комплекс ISCOM содержит по меньшей мере один сапонин, по меньшей мере один липид и по меньшей мере один вид антигена или эпитопа. Комплекс ISCOM содержит антиген, ассоциированный с помощью обработки детергентами таким образом, что часть антигена интегрируется в наночастицу. В отличие от этого, матрицу ISCOM составляют в виде примеси с антигеном и ассоциация между частицами матрицы ISCOM и антигеном опосредуется электростатическими и/или гидрофобными взаимодействиями.
[0155] В соответствии с одним вариантом осуществления сапониновую фракцию, интегрированную в матричный комплекс на основе ISCOM или комплекс ISCOM, или по меньшей мере один дополнительный адъювант, который также интегрирован в ISCOM или матричный комплекс ISCOM, или смешан с ними, выбирают из фракции A, фракции B или фракции C Quillaja saponaria, полуочищенного препарата Quillaja saponaria, очищенного препарата Quillaja saponaria или любой очищенной подфракции, например, QA 1-21.
[0156] В конкретных аспектах каждая частица ISCOM может содержать по меньшей мере две сапониновые фракции. Можно применять любые комбинации вес.% различных сапониновых фракций. Можно применять любую комбинацию вес.% любых двух фракций. Например, частица может содержать любой вес.% фракции A и любой вес.% другой сапониновой фракции, такой как неочищенная сапониновая фракция или фракция С, соответственно. Соответственно, в конкретных аспектах каждая частица матрицы ISCOM или каждая частица комплекса ISCOM может содержать от 0,1 до 99,9% по весу, от 5 до 95% по весу, от 10 до 90% по весу, от 15 до 85% по весу, от 20 до 80% по весу, от 25 до 75% по весу, от 30 до 70% по весу, от 35 до 65% по весу, от 40 до 60% по весу, от 45 до 55% по весу, от 40 до 60% по весу или 50% по весу одной сапониновой фракции, например, фракции A, и оставшуюся часть до 100% в каждом случае другого сапонина, например, любой неочищенной фракции или любой другой фракции, например, фракции C. Вес рассчитывают в виде общего веса сапониновых фракций. Примеры адъювантов на основе матричного комплекса на основе ISCOM и комплекса ISCOM раскрыты в опубликованной заявке на патент США №2013/0129770.
[0157] В конкретных вариантах осуществления матрица ISCOM или комплекс ISCOM содержит от 5 до 99% по весу от одной фракции, например, фракции A, и оставшуюся часть до 100% по весу другой фракции, например, неочищенной сапониновой фракции или фракции C. Вес рассчитывают в виде общего веса сапониновых фракций.
[0158] В другом варианте осуществления матрица ISCOM или комплекс ISCOM содержит от 40% до 99% по весу от одной фракции, например, фракции A, и от 1% до 60% по весу другой фракции, например, неочищенной сапониновой фракции или фракции C. Вес рассчитывают в виде общего веса сапониновых фракций.
[0159] В еще одном варианте осуществления матрица ISCOM или комплекс ISCOM содержит от 70% до 95% по весу от одной фракции, например, фракции A, и от 30% до 5% по весу другой фракции, например, неочищенной сапониновой фракции или фракции C. Вес рассчитывают в виде общего веса сапониновых фракций. В других вариантах осуществления сапониновая фракция из Quillaja saponaria Molina выбрана из любого из QA 1-21.
[0160] Помимо частиц, содержащих смеси сапониновых фракций, каждая из частиц матрицы ISCOM и частиц комплекса ISCOM могут быть образованы с помощью лишь одной сапониновой фракции. Композиции, раскрытые в данном документе, могут содержать несколько частиц, где каждая частица содержит лишь одну сапониновую фракцию. Иными словами, определенные композиции могут содержать один или более различных типов частиц матричных комплексов ISCOM и/или одного или нескольких типов частиц комплексов ISCOM, где каждая отдельная частица содержит одну сапониновую фракцию из Quillaja saponaria Molina, где сапониновая фракция в одном комплексе отличается от сапониновой фракции в других частицах комплекса.
[0161] В конкретных вариантах осуществления один тип сапониновой фракции или неочищенной сапониновой фракции может быть интегрирован в матричный комплекс или частицу ISCOM, а другой тип фактически чистой сапониновой фракции или неочищенной сапониновой фракции может быть интегрирован в другой матричный комплекс или частицу ISCOM. Композиция или вакцина могут содержать по меньшей мере два типа комплексов или частиц, при этом каждый тип имеет один тип сапонинов, интегрированных в физически отличающиеся частицы.
[0162] В композициях можно применять смеси частиц матричного комплекса ISCOM и/или частиц комплекса ISCOM, в которых одну сапониновую фракцию Quillaja saponaria Molina и другую сапониновую фракцию Quillaja saponaria Molina отдельно включают в различные частицы матричного комплекса ISCOM и/или частицы комплекса ISCOM.
[0163] Частицы матрицы ISCOM или частицы комплекса ISCOM, каждая из которых имеет одну сапониновую фракцию, могут присутствовать в композиции в любой комбинации вес.%. В конкретных аспектах композиция может содержать от 0,1% до 99,9% по весу, от 5% до 95% по весу, от 10% до 90% по весу, от 15% до 85% по весу, от 20% до 80% по весу, от 25% до 75% по весу, от 30% до 70% по весу, от 35% до 65% по весу, от 40% до 60% по весу, от 45% до 55% по весу, от 40 до 60% по весу или 50% по весу матрицы или комплекса ISCOM, содержащего первую сапониновую фракцию с оставшейся частью, состоящей из матрицы или комплекса ISCOM, содержащего другую сапониновую фракцию. В некоторых аспектах оставшаяся часть представляет собой одну или несколько матриц или комплексов ISCOM, где каждая частица матрицы или комплекса содержит лишь одну сапониновую фракцию. В других аспектах частицы матрицы или комплекса ISCOM могут содержать одну или несколько сапониновых фракций.
[0164] В конкретных композициях сапониновая фракция в первой частице матрицы ISCOM или комплекса ISCOM представляет собой фракцию A, а сапониновая фракция во второй частице матрицы ISCOM или комплекса ISCOM представляет собой фракцию C.
[0165] Предпочтительные композиции содержат первую матрицу ISCOM, содержащую фракцию A, и вторую матрицу ISCOM, содержащую фракцию C, где матрица ISCOM фракции А составляет приблизительно 70% по весу от всего сапонинового адъюванта, а матрица ISCOM фракции С составляет приблизительно 30% по весу от всего сапонинового адъюванта. В другой предпочтительной композиции матрица ISCOM фракции А составляет приблизительно 85% по весу от всего сапонинового адъюванта, а матрица ISCOM фракции С составляет приблизительно 15% по весу от всего сапонинового адъюванта. Таким образом, в определенных композициях матрица ISCOM фракции А присутствует в диапазоне от приблизительно 70% до приблизительно 85%, а матрица ISCOM фракции С присутствует в диапазоне от приблизительно 15% до приблизительно 30% от всего сапонинового адъюванта в композиции. Иллюстративные фракции QS-7 и QS-21, их получение и их применение описано в патентах США №№5057540; 6231859; 6352697; 6524584; 6846489; 7776343 и 8173141, которые включены посредством ссылки для этих изобретений.
Другие адъюванты
[0166] В некоторых композициях можно применять другие адъюванты в дополнение или в качестве альтернативы. Включение любого адъюванта, описанного в Vogel et al., "A Compendium of Vaccine Adjuvants and Excipients (2nd Edition)", включенного в данный документ посредством ссылки в своей полноте для всех целей, предусматривается в пределах объема настоящего изобретения. Другие адъюванты включают полный адъювант Фрейнда (неспецифический стимулятор иммунного ответа, содержащий убитые Mycobacterium tuberculosis), неполные адъюванты Фрейнда и адъювант на основе гидроксида алюминия. Другие адъюванты представляют собой GMCSP, BCG, соединения MDP, такие как thur-MDP и nor-MDP, CGP (MTP-PE), липид A и монофосфориллипид A (MPL), MF-59, RIBI, которые содержат три компонента, выделенные из бактерий, MPL, трегалозу димиколят (TDM) и каркас клеточной стенки (CWS) в 2% эмульсии сквалена/Tween®80. В некоторых вариантах осуществления адъювант может представлять собой олиголамеллярную липидную везикулу; например, Novasomes®. Novasomes® представляют собой олиголамеллярные нефосфолипидные везикулы размером в диапазоне от приблизительно 100 нм до приблизительно 500 нм. Они содержат Brij 72, холестерин, олеиновую кислоту и сквален. Было показано, что Novasomes является эффективным адъювантом (см., патенты США №№5629021, 6387373 и 4911928.
Введение и дозировка
[0167] Композиции, раскрытые в данном документе, можно вводить через системный путь или слизистый путь, или трансдермальный путь, или непосредственно в конкретную ткань. Используемый в данном документе термин «системное введение» включает парентеральные пути введения. В частности, парентеральное введение включает подкожную, интраперитонеальную, внутривенную, внутриартериальную, внутримышечную или внутригрудинную инъекцию, внутривенные или почечные диалитические инфузионные методики. Обычно системное парентеральное введение представляет собой внутримышечную инъекцию. Используемый в данном документе термин «слизистое введение» включает пероральное, интраназальное, интравагинальное, интраректальное, интратрахеальное, кишечное и офтальмическое введение. Предпочтительно введение является внутримышечным.
[0168] Композиции можно вводить по схеме одноразовой дозы или по схеме многоразовой дозы. Множественные дозы можно применять в первичной схеме иммунизации или в схеме бустер-иммунизации. В схеме множественных доз различные дозы можно вводить посредством одного и того же или различных путей, например, парентерального прайма и слизистого буста, слизистого прайма и парентерального буста и т.д. В некоторых аспектах последующую буст-дозу вводят через приблизительно 2 недели, через приблизительно 3 недели, через приблизительно 4 недели, через приблизительно 5 недель или через приблизительно 6 недель после предыдущей дозы. Однако обычно композиции, раскрываемые в данном документе, вводят только один раз, при этом по-прежнему обеспечивая защитный иммунный ответ.
[0169] В некоторых вариантах осуществления доза, измеренная в мкг, может представлять собой всю дозу, включая раствор, или массу наночастиц на основе F-белка RSV, или массу F-белка RSV. Дозу измеряют с помощью анализа концентрации белка либо с помощью A280, либо с помощью ELISA.
[0170] Доза антигена, в том числе для введения детям, может находиться в диапазоне от приблизительно 30 мкг до приблизительно 300 мкг, от приблизительно 90 мкг до приблизительно 270 мкг, от приблизительно 100 мкг до приблизительно 160 мкг, от приблизительно 110 мкг до приблизительно 150 мкг, от приблизительно 120 мкг до приблизительно 140 мкг или от приблизительно 140 мкг до приблизительно 160 мкг. В конкретных вариантах осуществления доза составляет приблизительно 120 мкг, вводимые с квасцами. В некоторых аспектах доза для детей может находиться в диапазоне от приблизительно 30 мкг до приблизительно 90 мкг. В определенных популяциях можно проводить введение с адъювантами или без таковых. Например, при введении пожилым людям предпочтительно, чтобы квасцы отсутствовали. В определенных аспектах композиции могут не содержать добавленного адъюванта. В таких обстоятельствах дозу можно повышать на приблизительно 10%.
[0171] В некоторых вариантах осуществления дозу можно вводить в объеме от приблизительно 0,1 мл до приблизительно 1,5 мл, от приблизительно 0,3 мл до приблизительно 1,0 мл, от приблизительно 0,4 мл до приблизительно 0,6 мл или приблизительно 0,5 мл, что является типичным количеством.
[0172] В конкретных вариантах осуществления в случае вакцины против RSV доза может содержать концентрацию F-белка RSV от приблизительно 175 мкг/мл до приблизительно 325 мкг/мл, от приблизительно 200 мкг/мл до приблизительно 300 мкг/мл, от приблизительно 220 мкг/мл до приблизительно 280 мкг/мл или от приблизительно 240 мкг/мл до приблизительно 260 мкг/мл.
[0173] Все патенты, патентные заявки, ссылки и журнальные статьи, цитируемые в настоящем изобретении, явным образом включены в данный документ с помощью ссылки во всей своей полноте для всех целей.
ПРИМЕРЫ
ПРИМЕР 1
Экспрессия и очистка F-белка RSV
[0174] F-белок RSV, имеющий SEQ ID NO: 8, экспрессировали в бакуловирусной системе и рекомбинантные бляшки, экспрессирующие F-белок RSV, собирали и подтверждали. Рекомбинантный вирус затем амплифицировали с помощью инфицирования клеток насекомых Sf9. Культуру клеток насекомых инфицировали при ~3 MOI (множественность заражения = вирусные ffu или pfu/клетка) бакуловирусом. Культуру и супернатант собирали через 48-72 часа после инфицирования. Неочищенный сбор клеток, примерно 30 мл, осветляли центрифугированием в течение 15 минут при примерно 800 x g. Полученные неочищенные сборы клеток, содержащие F-белок RSV, очищали, как описано ниже.
[0175] Неионное поверхностно-активное вещество тергитол® NP-9 (нонилфенолэтоксилат) использовали в протоколе экстракции мембранного белка. Неочищенный экстракт, полученный с помощью NP-9, дополнительно очищали посредством пропускания через анионообменную хроматографическую колонку, аффинную колонку, содержащую лектин чечевицы/HIC, и катионообменую хроматографическую колонку. Промытые клетки лизировали с помощью обработки детергентами и затем подвергали обработке с помощью низких значений pH, что приводило к преципитации ДНК и белка BV и клеток-хозяев Sf9. Нейтрализованный при обработке с помощью низких значений pH лизат осветляли и дополнительно очищали на анионообменной и аффинной хроматографической колонке перед выполнением второй обработки при низких значениях pH.
[0176] Аффинную хроматографию использовали для удаления белков Sf9/BV, ДНК и NP-9, а также концентрировали F-белок RSV. Вкратце, лектин чечевицы представляет собой металлопротеин, содержащий кальций и марганец, который обратимо связывает полисахариды и гликозилированные белки, содержащие глюкозу или маннозу. Содержащий F-белок RSV анионообменный поток через фракцию загружали в смолу для аффинной хроматографии на основе лектина чечевицы (Capto Lentil Lectin, GE Healthcare). Гликозилированный F-белок RSV избирательно связывался со смолой, в то время как негликозилированные белки и ДНК удаляли в потоке колонки. Слабосвязанные гликопротеины удаляли с помощью буферов, содержащих высокую концентрацию соли и низкую молярную концентрацию метил-альфа-D-маннопиранозида (MMP).
[0177] Кроме того, промывки колонок также использовали для замены детергента - детергента NP-9 на поверхностно-активное вещество полисорбат 80 (PS80). Для выполнения замены детергента колонку инкубировали с 0,1% PS80 после связывания F-гликопротеина RSV с колонкой, содержащей лектин чечевицы. F-белок RSV элюировали из колонки, содержащей лектин чечевицы, с помощью высокой концентрации MMP. После элюирования тримеры F-белка RSV собираются в мицеллярные наночастицы, состоящие из тримеров F-белка RSV и PS80, содержащегося в ядре, содержащем детергент. После замены детергента следовала стадия инактивации при низком значении pH с последующей инкубацией на сульфатной колонке в присутствии буфера с PS80 в концентрации 0,1%.
[0178] Элюированное вещество разбавляли в растворе, содержащем PS80, достаточным для получения лекарственного вещества (DS) для хранения в нерасфасованном виде при молярном соотношении PS80:F-белок RSV, составляющим приблизительно 50. Соответствующую композицию DS получали с помощью объединения наночастиц на основе F-белка RSV в растворе, содержащем фосфатный буфер с 22 мМ фосфата натрия, 0,03% PS80 и pH 6,2. На каждой стадии во время и после замены детергента соотношение антигена к PS80 в композиции поддерживали при молярном соотношении от 35 до 60. Молярное соотношение рассчитывали с помощью концентрации PS80 и концентрации F-белка RSV, как измерено с помощью ELISA/A280, и соответствующих молекулярных масс. Молекулярная масса PS80 составляет 1310 и в случае RSV составляет 65 кДа.
ПРИМЕР 2
Получение вакцинной композиции
[0179] Для получения наночастиц для вводимого вакцинного продукта лекарственное вещество разводили в лекарственном продукте при молярном соотношении PS80:белок RSV, составляющем приблизительно 50. Лекарственное вещество размораживали, разводили и наполняли стеклянные флаконы, или предварительно наполняли шприцы для хранения при 2-8°C до введения. Наночастицы связывались с адъювантом на основе квасцов. Адъювант на основе квасцов добавляли и смешивали для обеспечения того, чтобы приблизительно 95% наночастиц были связаны с квасцами, что означает приблизительно 0,4 мг на 120 мкг дозы наночастиц на основе F-белка RSV в объеме 0,5 мл.
ПРИМЕР 3
Характеристика F-гликопротеинов RSV в наночастицах
[0180] Структуру белка в наночастицах анализировали с помощью различных аналитических методик. На фигуре 3 показано, что максимальный пик продуцируемого F-белка RSV содержит пальмитолеиновую кислоту (пик 2A). Второй максимальный пик содержит пальмитиновую кислоту (пик 2B). Получали остаточные пики, у которых отсутствовали либо жирная кислота (пик 5), либо в растворимой форме (пик 1). С помощью анализа на геле SDS-PAGE разделяли дополнительные варианты, в том числе части F1+2 белок, F1, F1A, F1B и F1C, а также F2. См. фигуру 4. Анализ пептидной структуры выполняли с помощью пептидного картирования. См. фигуру 5. Для оценки гликановых структур в F-гликопротеинах RSV выполняли HPLC-FLD. Результаты показали, что основные гликановые структуры были фукозилированы.
ПРИМЕР 4
Исследование наночастиц на основе F-белка RSV с помощью электронной микроскопии
[0181] Наночастицы, полученные в примере 1, визуализировали с помощью электронного микроскопа. Результаты подтвердили образование наночастиц, содержащих F-гликопротеины RSV, окружающие ядро, содержащее детергент. Точный состав ядра, содержащего детергент, остается неясным. На фигуре 6 показаны типы полученных наночастиц. F-белки RSV поддерживали тримерную структуру даже после замены детергента. Получали несколько типов наночастиц, которые варьируют по числу тримеров/наночастиц и по морфологии. На фигуре 6 показано, что множественные тримеры можно обнаружить вокруг ядра, содержащего детергент. В подсвеченном участке показаны семь тримеров, окружающих детергент. На основной панели на фигуре 6 показан диапазон тримеров вокруг ядра, содержащего детергент, которые получены. На структуре в виде эскиза тримера F-белка RSV в нижней левой панели представлена ориентация тримеров с нижней частью, ассоциированной с ядром, содержащим детергент, облегченная жирными кислотами, присоединенными к каждому F-гликопротеину RSV.
ПРИМЕР 5
Характеристика частиц наночастиц на основе F-белка RSV
[0182] Динамическое светорассеяние (DLS) использовали для определения профиля распределения размеров наночастиц с помощью измерения изменений характеров светорассеяния частиц при броуновском движении. Размеры наночастиц можно было определять в виде линейной функции от концентрации ионного детергента в зависимости от концентрации наночастиц на основе F-белка RSV (см. фигуры 7 и 8).
[0183] Аналитическое ультрацентрифугирование (AUC) использовали для измерения движения концентрации образца по отношению к оси профиля вращения в результате применяемой центрифужной силы. На фигуре 8 показано, что возникали преимущественно две формы наночастиц на основе концентрации присутствующих наночастиц. Типы полученных наночастиц включают мономерные и димерные анизотропные стержни и сферические олигомеры. Структурные промежуточные формы между этими двумя типами наночастиц образуются при концентрациях между значениями, которые приводят к образованию анизотропных стержней и сферических олигомеров. На фигуре 9 показано, что тип наночастиц можно контролировать с помощью модулирования концентрации F-белка RSV, при этом более высокие концентрации (1 мг/мл) приводили к образованию преимущественной популяции сферических олигомеров, в то время как более низкие концентрации (0,22 мг/мл) приводили к образованию преимущественных популяций из мономерных/димерных анизотропных стержней. Эти данные показывают, что количество детергента и концентрацию F-белка RSV можно контролировать для достижения того, чтобы наночастица имела определенный диаметр (z-ave) от 20 нм до 60 нм.
ПРИМЕР 6
ПОВЫШЕННАЯ СТАБИЛЬНОСТЬ НАНОЧАСТИЦ: МОЛЕКУЛЯРНАЯ ХАРАКТЕРИСТИКА
[0184] Пять используемых стрессовых факторов представляли собой тепловой стресс при 50°C с временными точками через 48 часов, одну неделю и две недели; низкое значение pH (3,7 при 25°C) с временными точками через 48 часов, четыре дня и одну неделю; высокое значение pH (10 при 25°C) с временными точками через 24 часов, 48 часов и одну неделю; окисление пероксидом водорода при 25°C с временными точками через 12 часов, 48 часов и одну неделю; и физическое перемешивание при 25°C с временными точками через четыре часа, 24 часа и одну неделю.
[0185] После различных стрессовых обработок оценивали различия первичной структуры. На фигуре 10 показано сравнение того, как определенные участки переносили стресс по сравнению с контролем. Данные показывают, что наночастицы характеризовались высокой стабильностью во всем белке, и что только при особенно жестком тесте на окисление с применением пероксида водорода белок мог разрушаться до какой-либо определенной степени. Однако даже такая обработка не снижала структурной целостности антигенного сайта II, который является мишенью паливизумаба. Действительно, даже при жестком окислении F-белок RSV лишь нарушался структурно в положениях 63-82, 237-258 и 360-364. Соответственно, даже после перенесения воздействия жесткого стресса наночастицы оставались фактически интактными.
[0186] На фигуре 11 представлено дополнительное количественное определение стабильности касательно антигенного сайта II. Данные показывают, что в ответ на каждое воздействие из теплового стресса, низкого значения pH, высокого значения pH и перемешивания, этот антигенный сайт II оставался интактным до степени, составляющей 90% в каждом из образцов.
ПРИМЕР 7
ПОВЫШЕННАЯ СТАБИЛЬНОСТЬ НАНОЧАСТИЦ: ПОДДЕРЖИВАЕМЫЕ ИММУНОГЕННЫЕ СВОЙСТВА
[0187] Подверженные стрессовым факторам вакцинные композиции, описанные в примере 6, оценивали на иммуногенность в мышиной модели. Вакцины вводили мышам посредством двух внутримышечных инъекций в диапазоне доз F-белка RSV, состоящих из 0,15, 0,45, 1,3, 4 и 12 мкг/мл F-белка RSV. Вводили композиции на основе F-белка RSV, подверженные стрессовым факторам при следующих условиях, сопровождаемые контролем (размороженным после хранения при -70°C): 50°C в течение двух недель, значение pH 10 при 25°C в течение одной недели, 0,5% пероксида водорода при 25°C в течение одной недели.
[0188] Иммунный ответ оценивали в отношении наличия IgG к F-белку RSV, титров PCA и наличия нейтрализующих антител RSV A. Физические и химические стрессоровые факторы значимо не влияли in vivo на иммуногенность F-белка RSV. Подверженные стрессу образцы индуцировали аналогичные титры антитела IgG к F-белку RSV и сопоставимые титры функциональных PCA и нейтрализующих антител RSV A по сравнению с таковыми не подверженной стрессу контрольной вакцинной композиции на основе наночастиц на основе F-белка RSV (см. фигуры 12A-12D). В совокупности эти исследования вынужденного распада указывают на то, что даже в случае воздействия сильных стрессовых факторов среды наночастицы индуцируют мощные иммунные ответы.
ПРИМЕР 8
УСТОЙЧИВОСТЬ НАНОЧАСТИЦ К ПРОТЕАЗАМ
[0189] Образование наночастиц с повышенной стабильностью зависело от количества PS80, применяемого для получения наночастиц. На фигуре 13 представлено значительное повышение стабильности до 18 месяцев в случае, если наночастицы получали с помощью 0,03% PS80 (т.е. молярное соотношение, составляющее 55) по сравнению с 0,015% (т.е. молярное соотношение, составляющее 27). На левой панели показаны наночастицы после SDS-PAGE, полученные при двух концентрациях в нулевой момент времени. Данные показывают, что аналогичные результаты по сравнению с эталонным препаратом получали для обоих препаратов на основе наночастиц. В частности, оба характеризовались устойчивыми сигналами в отношении F1 и F1+2, указывая на фактическое отсутствие распада. Аликвоты каждого препарата затем инкубировали при 4°C в течение 18 месяцев и затем снова прогоняли на SDS-PAGE. Данные на правой панели, а также в таблице показывают, что наночастицы, содержащие лишь 0,015% в частице, приводили к образованию усеченного F1. В отличие от этого, наночастицы, полученные при содержании 0,03% в частице, характеризовались высокой устойчивостью к протеазе. Предположительно поддержание надлежащего соотношения детергента и белка приводило к образованию наночастицы, имеющей ориентацию гликопротеина с защищенными восприимчивыми участками к протеазам, возможно благодаря некоторому механизму стерического несоответствия. Дополнительно наблюдали, что концентрации PS80 на уровне 0,06% или выше повышали образование агрегатов. Совместно данные показывают, что оптимальные уровни PS80 составляют от приблизительно 0,03% до приблизительно 0,05% для стабильности наночастиц.
ПРИМЕР 9
ОЧИСТКА НАНОЧАСТИЦ НА ОСНОВЕ HA
[0190] Колонку, содержащую TMAE, предварительно уравновешивали буфером A1 (25 мМ Трис pH 7,5, 70 мМ NaCl, 0,02% NP9 для 0,5 CV при скорости потока: 91,7 см, 30 мл/мин. Образцы загружали при 20 мл/мин. (время контакта 25 мин.) и затем промывали буфером EQ A1 (25 мМ Трис pH 7,5, 70 мМ NaCl, 0,02% NP-9). Затем очищенный образец элюировали с помощью 1,25 CV 15% буфера B (25 мМ Tris pH 8, 1 M NaCl, 0,02% NP9) с последующим применением 1,1 cv 100% B. Типичная хроматограмма представлена на фигуре 18B. Продукт из колонки на основе TMAE наносили на колонку для аффинной хроматографии, содержащую лектин чечевицы, предварительно уравновешенную буфером A11: 25 мМ фосфата натрия pH 6,0, 10 мМ NaCl, 0,05% PS80 для 3 CV (скорость потока: 147 см/ч., 13 мл/мин.). Образец загружали на время контакта 9,4 минуты - 6,5 мл/мин. - 73,5 см/ч. После загрузки выполняли промывание с высоким содержанием соли с помощью 3 CV буфера A12 (25 мМ фосфат натрия, pH 6,0, 500 мМ NaCl, 0,5% NP-9). После первой промывки выполняли замену детергента с помощью промывки колонки 6CV буфера A11 (25 мМ фосфата натрия, pH 6,0, 10 мМ NaCl, 0,05% PS80). Наночастицы, содержащие PS80, затем элюировали с помощью 100% B для 3 CV, B1: буфер B: 25 мМ фосфата натрия, pH 6,0, 10 мМ NaCl, 0,05% PS80, 500 мМ метил-альфа-D-маннопиронозид. Типичная хроматограмма представлена на фигуре 18С. Продукт, полученный из колонки, содержащей лектин чечевицы, наносили на сульфатную колонку с помощью 3 CV буфера A1 (25 мМ фосфата натрия, pH 6,0, 10 мМ NaCl, 0,05% PS80), промывали с помощью 2 CV буфера A1, затем элюировали с помощью 100% буфера B1 (25 мМ фосфата натрия, pH 7,5, 500 мМ NaCl, 0,05% PS80). Элюированный продукт затем объединяли в соотношении 1:1 с 50 мМ фосфата натрия pH 9 и фильтровали в стерильных условиях. Конечный продукт имел значение pH 7,2. Хроматограмма представлена на фигуре 18D. На фигуре 18E представлены гель и вестерн-блоттинг различных продуктов, полученных во время процесса очистки из колонок на основе TMAE и LL. На фигуре 18F показан элюат из колонки, содержащей SО3-.
ПРИМЕР 10
АНАЛИЗ ЧИСТОТЫ НАНОЧАСТИЦ НА ОСНОВЕ HA
[0191] Наночастицы на основе HA получали, как описано на фиг. 17 и 18. Измеряли чистоту нескольких препаратов наночастиц на основе HA с помощью последовательностей HA, полученных от различных штаммов (A/New Hampshire/1/2015, A/Switzerland/9715293/2013, A/Hong Kong/4801/2014, B/Phuket/3073/2013 и B/Brisbane/60/2008). Данные показывают, что препараты с высокой чистотой получали во всех случаях. Анализ с помощью гель-денситометрии показал чистоту, составляющую свыше 93% и варьирующую от 93% до 97%. См. фигуры от 19A до 19H. Также анализировали чистоту трех штаммов подтипа А с помощью RP-HPLC и обнаружили, что чистота составляла от 83% до 85%. См. фигуру 19I. Кроме того, измеряли размер наночастиц. Наночастицы характеризовались диаметром от 22,0 нм до 29,9 нм. См. фиг. 19.
ПРИМЕР 11
АНАЛИЗ УЛЬТРАСТРУКТУРЫ HA
[0192] Электронную микроскопию выполняли для оценки структуры наночастиц на основе HA. Обнаружили, что подобно другим гликопротеинам, гликопротеины HA образовывали тримеры, которые были ассоциированы с ядром, содержащим детергент PS80. Каждое ядро, содержащее детергент, содержало несколько тримеров. См. фигуру 20. С помощью усреднения класса 2D cryo-EM подвергали докингу тримеры HA на наночастицы. На фигуре 21A представлены результаты этих in silico экспериментов по докингу. На верхних панелях показано соответствие в случае тримера HA в отношении первой наночастицы. На нижней панели показано соответствие на другом стебле наночастицы.
[0193] Для сравнения выполняли докинг на VLP. VLP содержали липидный бислой, в который заякоривали белок HA. См. фиг. 21B. Центральные панели показывают структуру белка HA, наложенную на стебель, выступающий из бислоя. На правой панели и нижних панелях представлена свободный HA, показанный на EM микрофотографии прямо внизу на тримерах HA, в отдельности (верхняя панель) и с соответствующим структурой HA, наложенной на EM фотографию (нижняя панель).
ПРИМЕР 12
АНАЛИЗ ИММУНОГЕННОСТИ НАНОЧАСТИЦ НА ОСНОВЕ HA, ВВОДИМЫХ СОВМЕСТНО С НАНОЧАСТИЦАМИ НА ОСНОВЕ F-БЕЛКА RSV
[0194] Оценивали иммуногенность наночастиц в вакцинах в мышиной модели. Вводили комбинированную наночастицу, содержащую два антигена (белок вируса гриппа HA от подтипа H3 A/Switzerland и F-белок RSV). Каждую наночастицу вводили отдельно. Вакцины вводили отдельно или с адъювантами AlPO4, или сапониновым адъювантом Matrix M. На фигуре 22 показаны обработки, вводимые в группах 1-10. Группу 10, контроль, оставляли без обработки. Обработки вводили на 0-й и 21-й дни. Измеряли HAI против гетерологичных и гомологичных заражений. См. фиг. 23A и 23B. На фиг. 23A показано, что наночастицы на основе НА с добавлением в качестве адъюванта Matrix стимулировали особенно устойчивые ответы против гетерологичного заражения. На фиг. 23B показано, что устойчивый ответ HAI также получали против гетерологичного штамма вируса гриппа A/Texas/50/2012 при введении с Matrix M, и на этот ответ не влияло совместное введение наночастиц на основе F-белка RSV.
[0195] Также измеряли способность компонента наночастиц на основе F-белка RSV индуцировать образование антител, которые конкурируют с паливизумабом. На фиг. 23C данные показывают, что наночастицы на основе F-белка RSV, вводимые в отдельности и либо с AlPO4, либо с Matrix M, индуцировали значительный титр антител от 80 мкг/мл до около 700 мкг/мл. Если индуцировали как наночастицы на основе F-белка RSV, так и белка гриппа, то сниженный ответ от около 20 мкг/мл до 40 мкг/мл получали в отсутствие адъюванта или с AlPO4. Однако, с Matrix M ответ F-белка RSV был устойчивым при введении в отдельности или в комбинации с наночастицами на основе HA. Измерение нейтрализующих антител к белку RSV показало аналогичный характер антител PCA. См. фиг. 23D.
[0196] В дополнение к ответам антител измеряли T-клеточные ответы, индуцированные вакцинами против RSV и против гриппа A/Switzerland/9715293/2013. Фиг. 23E и 23F. Данные показывают устойчивую индукцию IFN-γ против мишеней при использовании Matrix M в качестве адъюванта.
ПРИМЕР 13
ПОЛУЧЕНИЕ УСТОЙЧИВЫХ К ТРИПСИНУ НАНОЧАСТИЦ
[0197] Определенные подходы получения вируса гриппа могут приводить к чувствительности к трипсину белка HA, что изменяет сворачивание, приводя к сниженному уровню иммунногенности и стабильности вакцинных композиций. Для получения устойчивых к трипсину наночастиц на основе HA использовали подход на основе замены детергента с применением буферов с нейтральными значениями pH. См. фиг. 24A-C.
[0198] Клетки Sf9 инфицировали векторами BV с наночастицами на основе HA, MOI = 0,1; 3E6 клеток/мл. Клетки собирали на 3-й день и лизировали с забуференным 0,5% NP9; pH 7,5. Затем выполняли анионообменную хроматографию (Fractogel TMAE; EMD). На фиг.24B представлена иллюстративная хроматография. Поток содержит HA. После анионообменной колонки замену детергента выполняли с помощью колонки, содержащей лектин чечевицы Capto (GE), с помощью раствора для промывания с высоким содержанием соли/детергента, содержащего 0,01% PS80; pH 7,2 и также элюировали в 0,01% PS80. На фиг. 24C представлена иллюстративная хроматограмма для процесса замены детергента. В конечном итоге использовали тангенциальную проточную фильтрацию (TFF): 50 кД фильтр MWCO; pH 7,2 для образования нерасфасованного лекарственного вещества (BDS), используемого для хранения продукта. На стадии TFF и после PS80 поддерживали на уровне 0,05% в буфере с pH 7,2.
ПРИМЕР 14
АНАЛИЗ УСТОЙЧИВЫХ К ТРИПСИНУ НАНОЧАСТИЦ
[0199] Оценивали наночастицы на основе HA от различных штаммов, полученные с помощью с способа, описанного в примере 13, и получение. На фигуре 25A показано, что выход штамма A/New Hampshire/1/2015 (H1N1) составлял приблизительно 20 мг/л. Наночастицы на основе штамма B вируса гриппа также характеризовались высокой продуктивностью и чистотой. На фигуре 25B показан выход и чистота штамма B, HA B/Brisbane/60/08, оцениваемого в виде нерасфасованного лекарственного вещества. Выход составлял приблизительно 30 мг/л. На фигуре 25C показан выход штамма H3N2, показывающий, что в способ приводил к приблизительно 96% чистоте, а выход составлял приблизительно 20 мг/л.
Анализ термодинамической стабильности
[0200] На фигуре 25D представлено сравнение термодинамического профиля между наночастицами на основе HA, получаемыми с помощью подхода с применением устойчивых к трипсину нейтральных значений pH, описанных в примере 13, и подходами с применением стадий очистки при низких значениях рН, таких как показано на фигуре 18. Способ на основе дифференциальной сканирующей калориметрии использовали для определения термодинамического профиля макромолекул в растворе, в частности, с помощью измерения разницы захвата тепловой энергии между раствором образца и соответствующим эталоном (буфером/растворителем) при изменении температуры контролируемым образом. В отношении образцов HA вируса гриппа с помощью DSC обеспечивали визуализацию данных, таких как точки перехода (Tm), определяемые как температуры, при которых половина белка денатурируется/разворачивается и половина находится в нативном/свернутом состоянии.
[0201] Кроме того, DSC давал информацию касательно конформации белка, а оцененные профили стабильности можно было приблизительно экстраполировать для каждого штамма HA, подвергающегося условиям различных способов. Разница между HA, очищенным с помощью стадии способа, в котором HA подвергали воздействию pH 6,0 во время очистки, и очищенным HA в результате альтернативной стадии (например, смолы MMC или мембраны TFF) представлена с помощью HA B/Brisbane в качестве примера. Данные показывают, что значения Tm были более высокими по интенсивности, характеризовались сдвигом к более высокому началу появления Tm для основного пика и более острыми пикам, предполагая надлежащее сворачивание HA при очистке с помощью альтернативной стадии. Однако данные для HA, подвергнутого воздействию pH 6,0, показали, что значения Tm, которые в равной степени были значительно уменьшенными по интенсивности, характеризовались более ранним началом появления в случае Tm основного пика, имели значимо расширенные пики, характеризующиеся медленным асимметричным разворачиванием, и/или содержали неправильно свернутые белки и агрегационные пики при более высоких температурах. Аналогичные результаты наблюдали для других штаммов (A/Cal, A/Hong Kong, A/ New Hampshire). Несмотря на то, что низкие значения pH приводили к образованию частиц, описанных выше, и несмотря на то, что они могли иметь определенное применение, на основании этих трех наблюдений в данных DSC, делали заключение о том, что стадии альтернативного способа/условия с применением нейтральных значений рН приводили к выходу белка HA со значимо более высокими термодинамическими и потенциально повышенными профилями стабильности.
Устойчивость к трипсину
[0202] На фигуре 26 показана повышенная стабильность к трипсину при получении наночастиц, как описано в примере 13. Для исследования чувствительности к трипсину образцы HA разбавляли до 0,24 мг/мл, инкубировали со снижающимися концентрациями трипсина при 37°C в течение 60 минут, добавляли ингибитор трипсина для остановки расщепления и затем проводили анализ SDS-PAGE. Сравнение левой панели и правой панели фиг. 26 показало повышенную устойчивость к трипсину. Очищенные наночастицы на основе HA, полученные в клетках насекомых Sf9, представляли собой HA0. При воздействии трипсина HA0 расщеплялся на HA1 и HA2 в Arg AA344 в H1. Должным образом свернутые тримеры HA противостояли дальнейшему расщеплению при инкубировании с возрастающими концентрациями трипсина. Очищенный при нейтральных значениях pH B/Brisbane/60/08 был устойчивым к трипсину и должным образом свернут (левая панель). Очищенный при кислых значениях pH B/Brisbane/60/08 HA1 был чувствителен к трипсину и неправильно свернут (правая панель). На фигурах 26B и 26C показано, что устойчивость к трипсину достигали для ряда штаммов. На фигуре 26B показан штамм A/Hong Kong/4801/2014. Очищенный при нейтральных значениях pH A/Hong Kong/4801/2014 (H3N2) был устойчивым к трипсину и, таким образом, должным образом свернут (левая панель). Очищенный при кислых значениях рН A/Hong Kong/4801/2014 (H3N2) HA1 был чувствительным к трипсину и неправильно свернут (правая панель).
[0203] Аналогичные данные получали в случае A/New Hampshire/1/2015 и подтипа H1N1. Аналогично другим штаммам, очищенный при кислых условиях H1N1 был неправильно свернут (данные не показаны), при этом очищенный белок при нейтральных значениях pH был устойчивым к трипсину и правильно свернут.
Сравнение с коммерческими вакцинами
[0204] Предыдущие подходы получения рекомбинантных вакцин против гриппа не получили повсеместного успеха. Для исследования того, характеризовалась ли устойчивостью к трипсину полученная с помощью куриного яйца вакцина или полученная рекомбинантным путем вакцина против гриппа, сравнивали чувствительность к трипсину у полученных с помощью куриного яйца вакцин и рекомбинантных вакцин (Fluzone® и Flublok® соответственно) с помощью тех же самых протоколов, что и выше. В частности, неразведенные вакцины инкубировали с различными количествами трипсина при 37°C в течение 60 минут, затем добавляли трипсиновый ингибитор, добавляли 2x буфер образца и нагревали при 70°C в течение 10 минут перед SDS PAGE.
[0205] Было обнаружено, что полученный с помощью куриного яйца вариант характеризовался устойчивостью к трипсину. В частности, коммерческая трехвалентная полученная с помощью куриного яйца высокодозированная вакцина Fluzone, которая расщеплялась на HA1 и HA2 и HA1, была устойчивой к расщеплению трипсином. В отличие от этого, коммерческая трехвалентная рекомбинантная вакцина на основе HA Flublok при испытании воздействия трипсина превращалась в полипептиды HA1 и HA2 и HA1, и была чувствительной к трипсину. Фиг. 27 (правая панель). Эти результаты показали, что по меньшей мере один из штаммов денатурировался, возможно в результате очистки при значении pH 5,89 (см., например, Wang et al. Vaccine. 24 (2006); 2176.).
[0206] Таким образом, рекомбинантные вакцины против гриппа, которые являются коммерчески доступными, страдают от неправильного сворачивания, которое могло возникнуть в результате получения в условиях низких значений pH, и что, вероятно, объясняет по меньшей мере отчасти их слабую иммуногенность и отсутствие повсеместно распространенного внедрения к настоящему времени.
[0207] В отличие от этого, способы, раскрытые в данном документе, подтверждают, что очистка наночастиц на основе HA с помощью буфера с по меньшей мере pH 7,0 снижает или устраняет неправильное сворачивание белка HA, которое происходит в случае, если белки HA испытывают воздействие кислых условий во время очистки.
ПРИМЕР 15
Конструкция наночастиц на основе гликопротеина вируса Эбола
[0208] Ген дикого типа полноразмерного немодифицированного гликопротеина (GP) EBOV от вируса Эбола 2014 Makona клонировали в рекомбинантном бакуловирусе и экспрессировали в клетках насекомых Spodoptera frugiperda Sf9. После экспрессии N-концевой сигнальный пептид отщеплялся и зрелый белок очищали и составляли в наночастицы. Очищенные наночастицы на основе GP вируса Эбола (EBOV/Mak GP) состояли из нескольких GP тримеров, собранных в сферические частицы размером 36±4 нм (как измеряется с помощью динамического светорассеяния). Рекомбинантные наночастицы на основе GP имели область ядра, которое содержало «субъединицы слияния» гликопротеина 2 (GP2) с 2-9 или до 15 «субъединиц присоединения» тримеров «чашечкообразного» гликопротеина 1 (GP1), выступающих наружу.
[0209] В случае совместного введения с Matrix M применяли сапониновый адъювант, состоящий из двух популяций отдельно образованных частиц с Matrix размером 40 нм. Применяемый Matrix M представлял собой на 85% Matrix A и на 15% Matrix C. Частицы Matrix были образованы в результате составления очищенного сапонина из Quillaja saponaria Molina с холестерином и фосфолипидом.
ПРИМЕР 16
Иммунизация и протоколы
[0210] Мышей Balb/c (в возрасте 6-8 недель; Harlan Laboratories Inc., Фредерик, Мериленд) расселяли в группы по 10 и иммунизировали с помощью подкожного (SC) или внутримышечного (IM) введения. Фосфатно-буферный солевой раствор (PBS) использовали в качестве плацебо. Образцы крови для сыворотки собирали через ретроорбитальный путь. Перед забором крови животных анестезировали изофлураном.
[0211] Мышей (n = 10 на группу) иммунизировали с помощью IM введения (объем инъекции 50 мкл) на 0-й и 21-й дни GP EBOV/Mak отдельно или в смеси с AlPO4 (50 мкг) или адъювантом Matrix M (2,5 мкг или 5 мкг). Образцы крови собирали на 0-й, 14-й, 21-й, 28-й и 60-й дни. Образцы селезенки и костного мозга собирали на 28-й и 60-й дни. Образцы селезенки и костного мозга суспендировали в PBS, содержащем 2% фетальной бычьей сыворотки (FBS) для дальнейшего получения.
[0212] Образцы крови на 28-й день оценивали на нейтрализующие антитела к EBOV/Mak в Институте медицинских исследований инфекционных заболеваний СВ США, Фредерик, Мериленд, с помощью репортерного анализа нейтрализации псевдовириона. ДНК-вакцину против хантавирусного легочного синдрома (HPS), доставляемую с помощью пружинно-поршневого безыгольного шприца вызывала мощный ответ нейтрализующих антител у кроликов и отличных от человека приматов. Curr Gene Ther. 2014;14: 200-210. В случае этого анализа G-белок вируса везикулярного стоматита удаляли и замещали люциферазным репортером. Это экспрессирующее люциферазу ядро VSV псевдотипировали с помощью плазмиды pWRG/EBOV-Z76 (opt), которая экспрессирует GP штамма Zaire вируса Эбола 1976 (Mayinga). Плазмида, используемая для обеспечения псевдотипирования GP вируса Эбола, представляла собой pWRG/EBOV/Mak-Z76 (opt), экспрессирующая GP штамма Zaire вируса Эбола 1976 (Mayinga). PsV получали в клетках 293T. Мышиные сыворотки инактивировали нагреванием при 56°C в течение 30 минут и затем готовили исходное разведение 1:20 после пятикратных последовательных разведений в минимальной эссенциальной среде Игла (EMEM) (Life Technologies) с добавлением 10% (об./об.) инактивированной нагреванием FBS, 100 МЕ/мл пенициллина и 100 мкг/мл стрептомицина (cEMEM). PsV на основе GP вируса Эбола разводили в cEMEM. Равный объем раствора PsVs, содержащего 4×103 бляшкообразующих единиц и 10% комплемента морской свинки (Cedarlane) добавляли к сывороточным разведениям для получения конечного исходного разведения, составляющего 1:40, и затем инкубировали в течение ночи при 4°C. Монослои клеток Vero, засеянные в черные 96-луночные планшеты с прозрачным дном (Corning), инфицировали 50 мкл каждой смеси PsV и сыворотки и затем инкубировали при 37°C в течение дополнительных 18-24 часов. Среду удаляли, клетки лизировали и люциферазный субстрат добавляли в соответствии с протоколом Renilla Luciferase Assay System (Promega #E2820). Мгновенный люциферазный сигнал измеряли с помощью микропланшетного ридера Tecan M200. Первичные данные экспортировали в GraphPad Prism версии 6.04, где данные корректировали с поправкой на исходный уровень по отношению к сигналу необработанных PsVs. Данные приводили к четырехпараметрическим логистическим моделям нелинейной регрессии с помощью GraphPad Prism и затем нейтрализирующие титры PsVNA 50% (PsVNA50) интерполировали, исходя из кривых для каждого образца. Каждый образец анализировали в трех повторностях. Положительный по анализу контроль представлял собой сыворотку от кролика, вакцинированного три раза pWRG/EBOV-Z76 (opt), ДНК-вакциной на основе GP штамма Zaire вируса Эбола 1976 Mayinga.
[0213] GP EBOV/Mak специфические сывороточные антитела количественно определяли с помощью твердофазного иммуноферментного анализа (ELISA). Вкратце, микротитрационные планшеты NUNC MaxiSorp покрывали 2 мкг/мл GP EBOV/Mak (Novavax) в течение ночи при 2-8°C. Не вступившую в реакцию поверхность блокировали блокирующим буфером StartingBlock (Pierce) на один час при комнатной температуре (RT). Планшеты приводили в реакцию последовательно при RT с 5-кратными последовательными разведениями образцов сыворотки, начиная с 1:100 (два часа), козьим антителом к мышиному IgG (или IgG1 и IgG2a), конъюгированным с пероксидазой хрена (HRP) (Southern Biotech) (один час), пероксидазным субстратом 3,3,5,5-тетраметилбензидином (TMB) (Sigma) (десять минут) и останавливающим буфером TMB (Scy Tek Laboratories). Планшеты промывали три раза PBS/Tween (Quality Biologicals) перед добавлением конъюгата HRP и реагента TMB.
[0214] Планшеты считывали при 450 нм в планшетных ридерах SpectraMax plus (Molecular Devices). Компьютерную программу SoftMax pro (Molecular Devices) использовали для доведения концентрационных ответов на 4-параметрическую кривую приближения. Титры антител определяли как реципрокные от максимального разведения, при котором наблюдается 50% максимальное связывания антител (EC50). Если титр сывороточного IgG находился за пределами нижнего диапазона обнаружения, то сообщали о титре <100 (исходное разведение) и значение 50 придавали образцу для расчета группового среднего геометрического титра (GMT). Мышиное моноклональное (mAb) антитело к GP EBOV/Mak (4F3) от IBT Bioservices (Гейтерсбург, Мериленд) использовали в качестве положительного контроля.
Анализ ELISPOT по оценке IFN-γ и специфичных в отношении GP EBOV/Mak IgG-секретирующих клеток
[0215] Суспензии отдельных клеток готовили из отдельных селезенок с помощью аккуратного измельчения тканей с помощью поршня шприца. Суспензии отдельных клеток костного мозга готовили с помощью пропускания PBS, содержащей 2% FBS через кость с помощью шприца с иглой 21 калибра. Клетки промывали дважды PBS, содержащим 2% FBS, и подсчитывали. Анализы ELISPOT по оценке IFN-γ проводили с помощью наборов ELISPOT мышиного IFN-γ (eBioscience, Сан-Диего, Калифорния) в соответствии с процедурой производителя. Вкратце, антитело к IFN-γ (15 мкг/мл в PBS) использовали для покрытия планшетов ELISPOT (Millipore, Дармштадт, Германия) при 100 мкл/лунку в течение ночи при 4°C. Планшеты промывали четыре раза PBS и блокировали средой RPMI1640 совместно с 5% FBS в течение 1-2 часов при комнатной температуре. Всего 3×105 спленоцитов в объеме 200 мкл стимулировали пулами из 15-меров пептидов GP EBOV с 11 перекрывающимися аминокислотами (2,5 мкг/мл), охватывающими все последовательность GP EBOV. Форболмиристатацетат (PMA) (50 нг/мл) совместно с иономицином (200 нг/мл) использовали в качестве положительного контроля и среду в качестве отрицательного контроля. Каждое условие стимуляции выполняли в трех повторностях. Планшеты для анализа инкубировали в течение ночи при 37°C в 5% CO2 инкубаторе и сигналы обрабатывали на основании инструкций производителя. Бляшки подсчитывали и анализировали с помощью ридера ELISPOT и компьютерной программы Immunospot (Cellular Technology, Ltd., Шейкер Хайтс, Огайо). Число специфических по GP вируса Эбола бляшек получали с помощью вычитания фонового числа средовых контролей из стимулированных пептидом GP лунок. Данные, представленные на графике, представляют собой среднее из лунок при трехкратных повторностях. Для измерения GP-специфичных IgG-секретирующих клеток планшеты ELISPOT покрывали GP EBOV/Mak (2,5 мкг/мл в PBS) и инкубировали в течение ночи при 4°C. Планшеты промывали и блокировали, как описано выше. Тройные повторности из 3-5×105 спленоцитов или клеток костного мозга помещали в планшеты и планшеты инкубировали в течение ночи при 37°C. На второй день планшеты промывали и добавляли окрашенное HRP козье антитело к мышиному IgG и инкубировали в течение 1,5 часов. Бляшки обрабатывали и подсчитывали, как описано выше. Рассчитывали и представляли среднее число бляшек от лунок с тройными повторностями.
Окрашивание поверхности на клеточные фенотипы и внутриклеточное окрашивание на цитокины
[0216] В случае окрашивания поверхности клетки сначала инкубировали с антителом к CD16/32 (клон 2.4 G2) для блокирования Fc-рецептора. Для характеристики клеток зародышевого центра 1×106 свежих спленоцитов инкубировали при 4°C в течение 30 минут со смесью следующих антител: B220-PerCP, CD19-APC, GL7-BV421, CD95-PE-Cy7 (BD Biosciences, Калифорния) и желтым красителем LIVE/DEAD® (Life Technologies, Нью-Йорк). Клетки промывали дважды и суспендировали для анализа в PBS, содержащем 2% FBS. Для окрашивания T-фолликулярных хелперных клеток 1×106 свежих спленоцитов инкубировали с CXCR5-биотином, промывали два раза, затем инкубировали со смесью антител, в том числе CD3-BV650, B220-PerCP, CD4-PE-Cy7, стрептавидином-BV421, PD-1-APC, CD69-FITC и CD49b-PE (BD Biosciences, Калифорния) и желтым красителем LIVE/DEAD® (Life Technologies). Клетки промывали дважды и суспендировали для анализа в PBS, содержащем 2% FBS.
[0217] В случае внутриклеточного окрашивания на цитокины спленоциты культивировали в 96-луночном планшете с U-образным дном при содержании 1×106 клеток на лунку. Пептидную стимуляцию выполняли, как описано для культур ELISPOT. Планшет инкубировали в течение 6 часов при 37°C в присутствии BD GolgiPlug™ и BD GolgiStop™ (BD Biosciences). Клетки промывали дважды, инкубировали в течение 20 минут при 4°C со смесью антител на поверхностные маркеры клеток, в том числе CD3-BV 650, CD4-PerCP, CD8-FITC, CD44-APC-Cy7 и CD62L-PE-Cy7 (BD Pharmingen, Калифорния) и желтый краситель LIVE/DEAD® (Life Technologies, Нью-Йорк). После двух промывок клетки фиксировали с Cytofix/Cytoperm (BD Biosciences) в течение 30 минут при 4°C, после чего выполняли две промывки с помощью BD Perm/Wash™ (BD Biosciences). Клетки инкубировали с антителами к IFN-γ-APC, IL-2-BV 421 и TNFα-PE (BD Biosciences) в течение ночи при 4°C. Клетки промывали и ресуспендировали в 1×BD Perm/Wash буфере для сбора данных. Все окрашенные образцы собирали с помощью проточного цитометра LSR-Fortessa (Becton Dickinson, Сан-Хосе, Калифорния) и данные анализировали с помощью компьютерной программы Flowjo версии Xv10 (Tree Star Inc., Ашленд, Орегон).
[0218] Статистический анализ выполняли с помощью компьютерной программы SAS версии 9.4. При попарных сравнениях с поправкой Тьюки на основе ANOVA использовали группу в качестве независимой переменной и логарифмический трансформированный результат в качестве зависимой переменной для определения значимости различий между группами.
Пример 17
GP EBOV/Mak индуцировал ответ антител и эффективность защиты.
[0219] Иммуногенность вакцины на основе наночастиц на основе GP EBOV/Mak оценивали в мышиной модели с адъювантом и без такового. Мышей вакцинировали на 0-й, 14-й и 28-й дни с помощью SC инъекции 5 мкг GP EBOV/Mak в отдельности или GP EBOV/Mak, составленного в адъюванте Matrix M или адъюванте на основе AlPO4. Анализ сывороток, полученных на 28-й день (через 14 дней после второй иммунизации), указывал на то, что GP EBOV/Mak с добавлением в качестве адъюванта Matrix M индуцировал высокие уровни антиген-специфических антител IgG к GP Mayinga со средним геометрическим титром (GMT), составляющим 26991. Ответ, полученный после иммунизации GP EBOV/Mak с Matrix M, был значимо более высоким, чем таковые, индуцированные GP EBOV/Mak отдельно (GMT = 266, p = 0,001) или GP EBOV/Mak с добавлением в качестве адъюванта AlPO4 (GMT = 436, p = 0,0001) (фиг. 28A). Адъювант AlPO4 обеспечивал лишь незначительное увеличение IgG к GP EBOV/Mak по сравнению с GP EBOV/Mak в отдельности.
[0220] Нейтрализующую активность сывороток на 28-й день анализировали с помощью псевдовирионов с GP вируса Эбола (PsVs) (фиг. 28B). В отсутствие адъюванта GMT титр нейтрализующих антител в сыворотках от мышей, иммунизированных GP EBOV/Mak в отдельности составлял 197, а при добавлении к GP EBOV/Mak в качестве адъюванта AlPO4 наблюдали более низкие титры (GMT = 49, p= 0,1). Титры нейтрализующих антител в сыворотке от мышей, иммунизированных GP EBOV/Mak с Matrix M, составляли GMT, составляющий 6463, в тридцать два раза выше, чем таковой, полученный в случае GP EBOV/Mak в отдельности. В этом анализе PsV, экспрессирующие GP штамма Mayinga 1976 EBOV, которые использовали в качестве PsV, экспрессирующих GP штамма EBOV/Mak 2014, были недоступны. Таким образом, в анализе измеряли перекрестную нейтрализующую активность GP EBOV/Mak к GP штамма Mayinga.
[0221] На 42-й день, через две недели после третьей вакцинации, выполняемой на 28-й день, мышей заражали с помощью интраперитонеальной инокуляции, составляющей 1000 pfu на мышь, адаптированного штамма 1976 Mayinga Zaire вируса Эбола. Контрольные мыши подвергались инфекции через три дня, в то время как мыши, вакцинированные GP EBOV/Mak в отдельности или GP EBOB/Mak с добавлением в качестве адъюванта AlPO4 заболевали на пятый или шестой день, соответственно. Через двадцать один день после заражения инфекцией всех мышей вакцинировали GP EBOV/Mak с добавлением в качестве адъюванта Matrix M, и одна мышь, вакцинированная GP EBOV/Mak в отдельности, была живой и здоровой. В отличие от этого, все другие мыши погибали или их выводили из эксперимента на 8-й день после инфицирования вирусом Эбола (фиг. 28C).
ПРИМЕР 18
Кинетика ответов IgG , IgG1 и IgG2a к GP вируса Эбола
[0222] Для дальнейшей более подробной характеристики иммунных ответов на GP EBOV/Mak с добавлением в качестве адъюванта Matrix M двум группам мышей Balb/c (10/группа) вводили 5 мкг GP EBOV/Mak с добавлением в качестве адъюванта либо 2,5, либо 5 мкг Matrix M. Группы мышей, которым вводили PBS, GP EBOV/Mak в отдельности или GP EBOV/Mak с AlPO4, служили в качестве контролей. На 14-й, 21-й, 28-й и 60-й дни специфичные в отношении GP EBOV/Mak подклассы IgG и IgG (IgG1 и IgG2a) измеряли с помощью ELISA.
[0223] На 14-й день после первой инъекции на всех мышах, которым вводили GP EBOV/Mak с Matrix M (2,5 или 5 мкг), показан ответ с участием специфичных в отношении GP EBOV/Mak IgG (GMT = 755 и 1499 соответственно, данные не представлены). Ни одна из 10 мышей в группе GP EBOV/Mak и GP EBOV/Mak с AlPO4не вырабатывала специфичных в отношении IgG GP EBOV/Mak (данные не представлены). На 21-й день ответ IgG к GP EBOV/Mak возрастал дополнительно в группах с добавлением в качестве адъюванта Matrix M (фиг. 29A). Ответ отсутствовал в группах, в которых вводили GP EBOV/Mak в отдельности или GP EBOV/Mak с AlPO4. Все мыши получали вторую инъекцию на 21-й день. На 28-й день наблюдали устойчивое повышение ответов IgG у мышей, получавших Matrix M (2,5 или 5 мкг), при этом титры GMT ELISA составляли 3,0×105 и 4,9×105, соответственно (фиг. 29A). На 28-й и 60-й дни в группах GP EBOV/Mak в отдельности и с AlPO4 специфические ответы IgG выявляли у некоторых из мышей, однако они были значимо ниже, чем у мышей, иммунизированных GP EBOV/Mak с Matrix M (фиг. 29A). На 60-й день титры IgG к GP, индуцируемых GP EBOV/Mak с 2,5 или 5 мкг Matrix M, не были снижены значимо по сравнению с 28-м днем и были в 67 и 139 раз выше, соответственно, чем в группах GP EBOV/Mak с AlPO4(фиг. 29A).
[0224] Также определяли ответы с участием специфичных в отношении GP EBOV/Mak IgG1 и IgG2a. Аналогично общему IgG, вакцина на основе GP EBOV/Mak с добавлением в качестве адъюванта Matrix M индуцировала высокие уровни IgG1 и IgG2a к GP на 28-й и 60-й дни (фиг. 29B и 29C). В отличие от этого, лишь одна из 10 мышей, которым вводили GP EBOV/Mak в отдельности, и четыре из 10 мышей, которым вводили GP EBOV/Mak с AlPO4, продуцировала низкие уровни IgG1 на 28-й день (фиг. 29B). На 60-й день антиген-специфический IgG1 выявляли в сыворотке от всех пяти оставшихся мышей в группе, которой вводили GP EBOV/Mak с AlPO4, однако средний титр был в 51 и 41 раза ниже, чем в группах, которым вводили GP EBOV/Mak с 2,5 или 5,0 мкг Matrix M (фиг. 29B) соответственно. Кроме того, GP EBOV/Mak отдельно не индуцировал подлежащего выявлению антитела IgG2a на 28-й и 60-й дни.
ПРИМЕР 19
Ответ CD4+, CD8+ и многофункциональных T-клеток
[0225] Далее оценивали T-клеточный ответ на различные составы на основе GP EBOV/Mak с помощью измерения количества IFN-γ-секретирующих T-клеток после стимуляции клеток селезенки ex vivo пептидами GP EBOV/Mak в анализе ELISPOT. На 28-й день количество IFN-γ-секретирующих клеток возрастало в зависимости от дозы Matrix M в селезенках от мышей, иммунизированных GP EBOV/Mak с Matrix M (фиг. 30A, 30B). Среднее количество IFN-γ-секретирующих клеток в группах, получавших GP EBOV/Mak с 5,0 и 2,5 мкг Matrix M, было в 17 и 10 раз выше соответственно, чем в группе, получающей GP EBOV/Mak в отдельности и в 8 и 5 раз выше соответственно, чем в группе, получающей GP EBOV/Mak с AlPO4 (фиг. 30A).
[0226] На 60-й день число IFN-γ-секретирующих клеток в селезенках от мышей, иммунизированных GP EBOV/Mak с 5 мкг Matrix M, по-прежнему было в 12 раз выше в селезенках от мышей, иммунизированных GP EBOV/Mak в отдельности, и в 3 раза выше, чем в селезенках от мышей, иммунизированных GP EBOV/Mak с AlPO4 (фиг. 30B). Повышенные количества IFN-γ-секретирующих клеток в селезенках от мышей, иммунизированных GP EBOV/Mak с 2,5 мкг Matrix M, также поддерживались на 60-й день, однако на более низком уровне, чем с 5 мкг Matrix M.
[0227] Дополнительно оценивали индуцированные Matrix M ответы CD4+ и CD8+ T-клеток с помощью внутриклеточного окрашивания цитокинов в комбинации с маркерами клеточной поверхности. Анализ спленоцитов с помощью проточно-цитометрического окрашивания на 28-й день показал, что как CD4+, так и CD8+ T-клетки из групп с GP EBOV/Mak с Matrix M секретировали IFN-γ, TNFα и IL-2 (фиг. 30C и 30D). Частота секретирующих цитокины CD4+ и CD8+ T-клеток была намного выше в селезенках из групп с GP EBOV/Mak с Matrix M, чем ответы исходного уровня или минимальные ответы, наблюдаемые у контрольных мышей, мышей, получавших GP EBOV/Mak отдельно или GP EBOV/Mak с AlPO4 (фиг. 30C и 30D). Частоту T-клеток, которые одновременно продуцировали два или более цитокинов (IFN-γ, TNFα и IL-2), оценивали на 28-й день. Как CD4+, так и CD8+ T-клетки, продуцирующие два или три цитокина, выявляли при заметных уровнях лишь в селезенках мышей, иммунизированных GP EBOV/Mak с Matrix M.
ПРИМЕР 20
Ответы клеток зародышевого центра и T-фолликулярных хелперных клеток
[0228] Частоту и абсолютное количество GC B-клеток в селезенке анализировали с помощью проточно-цитометрического окрашивания (фиг. 31A). Анализ показал, что на 28-й день (через семь дней после 2-й инъекции вакцины) GP EBOV/Mak с добавлением в качестве адъюванта 2,5 и 5 мкг Matrix M индуцировал ответы с частотой GC, составляющей 1,22 и 2,12%, соответственно, по сравнению с плацебо, GP EBOV/Mak отдельно или GP EBOV/Mak с AlPO4 (0,38, 0,41 и 0,44%, соответственно) (фиг. 31B). Соответственно, абсолютное число клеток GC в селезенке также повышалась в группах, получавших Matrix M (фиг. 31C). На 60-й день частота и абсолютное число возвращались к исходному уровню (фиг. 31D и 31E).
[0229] Анализ частот TFH-клеток на 28-й день показал, что GP EBOV/Mak с 2,5 или 5 мкг Matrix M индуцировал образование TFH-клеток с более высокой частотой, чем GP EBOV/Mak отдельно или с AlPO4 (фиг. 32A и 32B). Соответственно, абсолютное число TFH-клеток также повышалось при воздействии GP EBOV/Mak с Matrix M по сравнению с GP EBOV/Mak отдельно или с AlPO4 (фиг. 32C). На 60-й день частота и абсолютное число TFH-клеток возвращались к почти исходным уровням (фиг. 32 D и 32E).
ПРИМЕР 21
Специфичные в отношении GP EBOV/Mak плазматические клетки
[0230] Для оценки влияния Matrix M на специфичные в отношении GP EBOV/Mak плазматические клетки анализировали число IgG-продуцирующих клеток в селезенке и костном мозге на 60-й день после иммунизации. Анализ на 60-й день показал образование лишь незначительного числа специфичных в отношении GP EBOV/Mak IgG-секретирующих клеток (< 6/106 спленоцитов) в селезенках мышей, иммунизированных вакциной на основе GP EBOV/Mak с добавлением в качестве адъюванта Matrix M (фиг. 33A). Не выявляли IgG-секретирующих клеток в селезенках от мышей, иммунизированных GP EBOV/Mak отдельно и GP EBOV/Mak с AlPO4 (фиг. 33A). В отличие от этого, высокие количества специфичных в отношении GP EBOV/Mak IgG-секретирующих клеток появлялись в костном мозге мышей, получавших GP EBOV/Mak с добавлением в качестве адъюванта Matrix M (фиг. 33B), при этом показано образование долгоживущих плазматических B-клеток.
ПРИМЕР 22
Характеристика связывания антител с наночастицами
[0231] Исследовали способность нескольких антител к белку вируса Эбола связываться с наночастицами. Антитела представляли собой 13C6, 13F6, 6D8 и KZ52. Кривая и значения EC50 представлены на фигуре 36 и дополнительные данные кинетики связывания представлены на фигуре 37. На фигуре 38 представлены данные активности с применением 13C6 в качестве эталона. Три из четырех антител характеризовались высоким связыванием с GP.
ПРИМЕР 23
Исследование на отличных от человека приматах: бабуины
[232]Для подтверждения результатов, полученных у мышей в модели отличных от человека приматов, проводили исследование на бабуинах. Схему исследования разрабатывали, как представлено на фигуре 39. Формировали четыре группы. Группа 1 была контролем. В группе 2 получали антиген с AlPO4. В группах 2 и 3 получали антиген, 60 мкг и 5 мкг соответственно с Matrix M по 50 мкг. Бабуинов иммунизировали на 0-й и 21-й дни. Устойчивые ответы получали как на GP Makona, так и на GP Mayinga. См. фигуру 40. Дополнительные анализы подтвердили, что ответ носил длительный характер. На фигуре 41 показаны значения EC50 для IgG к Makona в более поздние временные точки. Данные указывают на то, что ответ являлся длительным.
[0233] Дополнительные исследования подтвердили, что уровни IFN-γ значительно повышались после иммунизации. На фигуре 42 показано, что Matrix M в комбинации с GP приводил к большему повышению, чем с адъювантом на основе квасцов. Интересно отметить, что более низкая доза GP, 5 мкг, приводила к более выраженному повышению уровней IFN-γ. Ответы TNFα и IFN-γ в T-клетках представлены на фигуре 43 с ответами цитокинов, представленными на фигуре 44. Снова ответ был более выраженным в случае GP и Matrix M в каждом случае, чем в случае с квасцами. Эти данные подчеркивают устойчивый иммунный ответ раскрытых составов в бабуиновой модели.
ПРИМЕР 24
Исследование на отличных от человека приматах: исследование на макаках 1
[0234] Для дополнительного подтверждения защитного эффекта наночастиц выполняли исследование на макаках, как указано на фигуре 45. Макак иммунизировали внутримышечно на 0-й и 21-й дни вакциной, как показано, и заражали на 42-й день. Ответы антител к GP измеряли на 0-й и 28-й дни. Как показано на фигуре 46, иммунизированные макаки характеризовались выраженной индукцией антител к IgG. Иммунный ответ характеризовали, как показано на фигуре 47. IFN-γ-секретирующие клетки в ответ на различные пептидные пулы измеряли на 0-й, 3-й и 5-й неделях. Результаты показали, что иммунизированные макаки индуцировали IFN-γ-секретирующие клетки у иммунизированных макаков.
[0235] Выживаемость животных была заметной. Фигура 48. На 7-й день нагрузка вирусом Эбола у плацебо-обрабатываемых макаков составляла 107. На 9-й день животное группы плацебо выводили из эксперимента. В отличие от этого, 100% обработанных животных выживали. Примечательно, что иммунный ответ был способен сделать вирусную нагрузку не подлежащей выявлению с помощью RT-PCR у почти всех животных почти во все временные точки. Животное 33362 характеризовалось вирусной нагрузкой на 7-й день, которая была на приблизительно 10% выше подлежащего выявлению предела. Однако на 10-й день уровни опустились ниже способности анализа выявлять их.
ПРИМЕР 25
Исследование на отличных от человека приматах: исследование на макаках 2
[0236] Второе исследование выполняли на макаках. Животным вводили дозы 5 мкг GP + 50 мкг Matrix M на нулевых неделях, с последующим бустингом либо через 3 недели, либо через 6 недель. Иммунизированных животных затем заражали вирусом Эбола дикого типа через 9 недель и 12 недель, соответственно. Фигура 49.
[0237] Данные ELISA для IgG представлены на фигуре 50. В левой панели показано, что через 3 недели после первой инъекции высокие титры появились и удерживались. В правой панели показаны результаты у животных с 6-недельным перерывом между введениями. Эти животные характеризовались значительным повышением через две недели после бустерного введения, указывая на полезный эффект подхода на основе примирования-бустинга.
[0238] Вакцинная композиция была полностью защитной у макак. Через 18 дней после заражения живым вирусом все контрольные мыши, обработанные солевым раствором, погибли. В отличие от этого, 100% макак, иммунизированных вакцинными композициями, пережили заражение. В общей сложности, эти данные подтверждают то, что иммунные ответы, стимулированные композициями, являются защитными независимо от того, происходит ли бустинговое введение через 3 недели или через 6 недель.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> НОВАВАКС, ИНК.
СМИТ, Гейл
ЛЮ, Е
ТЯНЬ, Цзин-Хуэй
МАССАРЕ, Майкл Дж.
БОДДАПАТИ, Саратхи
ШЕЙН, Эрика
ОЛИВЕР, Синтия
<120> ВАКЦИННЫЕ КОМПОЗИЦИИ, ХАРАКТЕРИЗУЮЩИЕСЯ УЛУЧШЕННОЙ СТАБИЛЬНОСТЬЮ И ИММУНОГЕННОСТЬЮ
<130> NOVV-060/03US 305047-2730
<150> US 62/350973
<151> 2016-06-16
<150> US 62/309216
<151> 2016-03-16
<150> US 62/255786
<151> 2015-11-16
<150> US 62/213947
<151> 2015-09-03
<160> 29
<170> PatentIn версия 3.5
<210> 1
<211> 1725
<212> ДНК
<213> Респираторно-синцитальный вирус
<400> 1
atggagttgc taatcctcaa agcaaatgca attaccacaa tcctcactgc agtcacattt 60
tgttttgctt ctggtcaaaa catcactgaa gaattttatc aatcaacatg cagtgcagtt 120
agcaaaggct atcttagtgc tctgagaact ggttggtata ccagtgttat aactatagaa 180
ttaagtaata tcaaggaaaa taagtgtaat ggaacagatg ctaaggtaaa attgataaaa 240
caagaattag ataaatataa aaatgctgta acagaattgc agttgctcat gcaaagcaca 300
ccaccaacaa acaatcgagc cagaagagaa ctaccaaggt ttatgaatta tacactcaac 360
aatgccaaaa aaaccaatgt aacattaagc aagaaaagga aaagaagatt tcttggtttt 420
ttgttaggtg ttggatctgc aatcgccagt ggcgttgctg tatctaaggt cctgcaccta 480
gaaggggaag tgaacaagat caaaagtgct ctactatcca caaacaaggc tgtagtcagc 540
ttatcaaatg gagttagtgt cttaaccagc aaagtgttag acctcaaaaa ctatatagat 600
aaacaattgt tacctattgt gaacaagcaa agctgcagca tatcaaatat agaaactgtg 660
atagagttcc aacaaaagaa caacagacta ctagagatta ccagggaatt tagtgttaat 720
gcaggtgtaa ctacacctgt aagcacttac atgttaacta atagtgaatt attgtcatta 780
atcaatgata tgcctataac aaatgatcag aaaaagttaa tgtccaacaa tgttcaaata 840
gttagacagc aaagttactc tatcatgtcc ataataaaag aggaagtctt agcatatgta 900
gtacaattac cactatatgg tgttatagat acaccctgtt ggaaactaca cacatcccct 960
ctatgtacaa ccaacacaaa agaagggtcc aacatctgtt taacaagaac tgacagagga 1020
tggtactgtg acaatgcagg atcagtatct ttcttcccac aagctgaaac atgtaaagtt 1080
caatcaaatc gagtattttg tgacacaatg aacagtttaa cattaccaag tgaaataaat 1140
ctctgcaatg ttgacatatt caaccccaaa tatgattgta aaattatgac ttcaaaaaca 1200
gatgtaagca gctccgttat cacatctcta ggagccattg tgtcatgcta tggcaaaact 1260
aaatgtacag catccaataa aaatcgtgga atcataaaga cattttctaa cgggtgcgat 1320
tatgtatcaa ataaagggat ggacactgtg tctgtaggta acacattata ttatgtaaat 1380
aagcaagaag gtaaaagtct ctatgtaaaa ggtgaaccaa taataaattt ctatgaccca 1440
ttagtattcc cctctgatga atttgatgca tcaatatctc aagtcaacga gaagattaac 1500
cagagcctag catttattcg taaatccgat gaattattac ataatgtaaa tgctggtaaa 1560
tccaccacaa atatcatgat aactactata attatagtga ttatagtaat attgttatca 1620
ttaattgctg ttggactgct cttatactgt aaggccagaa gcacaccagt cacactaagc 1680
aaagatcaac tgagtggtat aaataatatt gcatttagta actaa 1725
<210> 2
<211> 574
<212> БЕЛОК
<213> Респираторно-синцитальный вирус
<400> 2
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Pro Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Arg Lys Arg Arg Phe Leu Gly Phe Leu Leu Gly Val
130 135 140
Gly Ser Ala Ile Ala Ser Gly Val Ala Val Ser Lys Val Leu His Leu
145 150 155 160
Glu Gly Glu Val Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys
165 170 175
Ala Val Val Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val
180 185 190
Leu Asp Leu Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn
195 200 205
Lys Gln Ser Cys Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln
210 215 220
Gln Lys Asn Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn
225 230 235 240
Ala Gly Val Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu
245 250 255
Leu Leu Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys
260 265 270
Leu Met Ser Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile
275 280 285
Met Ser Ile Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro
290 295 300
Leu Tyr Gly Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro
305 310 315 320
Leu Cys Thr Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg
325 330 335
Thr Asp Arg Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe
340 345 350
Pro Gln Ala Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp
355 360 365
Thr Met Asn Ser Leu Thr Leu Pro Ser Glu Ile Asn Leu Cys Asn Val
370 375 380
Asp Ile Phe Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr
385 390 395 400
Asp Val Ser Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys
405 410 415
Tyr Gly Lys Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile
420 425 430
Lys Thr Phe Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Met Asp
435 440 445
Thr Val Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly
450 455 460
Lys Ser Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro
465 470 475 480
Leu Val Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn
485 490 495
Glu Lys Ile Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu
500 505 510
Leu His Asn Val Asn Ala Gly Lys Ser Thr Thr Asn Ile Met Ile Thr
515 520 525
Thr Ile Ile Ile Val Ile Ile Val Ile Leu Leu Ser Leu Ile Ala Val
530 535 540
Gly Leu Leu Leu Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser
545 550 555 560
Lys Asp Gln Leu Ser Gly Ile Asn Asn Ile Ala Phe Ser Asn
565 570
<210> 3
<211> 573
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137 (delta 1)
<400> 3
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Leu Gly Phe Leu Leu Gly Val Gly
130 135 140
Ser Ala Ile Ala Ser Gly Val Ala Val Ser Lys Val Leu His Leu Glu
145 150 155 160
Gly Glu Val Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala
165 170 175
Val Val Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val Leu
180 185 190
Asp Leu Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn Lys
195 200 205
Gln Ser Cys Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln Gln
210 215 220
Lys Asn Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn Ala
225 230 235 240
Gly Val Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu
245 250 255
Leu Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu
260 265 270
Met Ser Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met
275 280 285
Ser Ile Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro Leu
290 295 300
Tyr Gly Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro Leu
305 310 315 320
Cys Thr Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr
325 330 335
Asp Arg Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe Pro
340 345 350
Gln Ala Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp Thr
355 360 365
Met Asn Ser Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Val Asp
370 375 380
Ile Phe Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr Asp
385 390 395 400
Val Ser Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr
405 410 415
Gly Lys Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys
420 425 430
Thr Phe Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp Thr
435 440 445
Val Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys
450 455 460
Ser Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu
465 470 475 480
Val Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu
485 490 495
Lys Ile Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu
500 505 510
His Asn Val Asn Ala Gly Lys Ser Thr Thr Asn Ile Met Ile Thr Thr
515 520 525
Ile Ile Ile Val Ile Ile Val Ile Leu Leu Ser Leu Ile Ala Val Gly
530 535 540
Leu Leu Leu Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser Lys
545 550 555 560
Asp Gln Leu Ser Gly Ile Asn Asn Ile Ala Phe Ser Asn
565 570
<210> 4
<211> 572
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-138 (delta 2)
<400> 4
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Gly Phe Leu Leu Gly Val Gly Ser
130 135 140
Ala Ile Ala Ser Gly Val Ala Val Ser Lys Val Leu His Leu Glu Gly
145 150 155 160
Glu Val Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala Val
165 170 175
Val Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val Leu Asp
180 185 190
Leu Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn Lys Gln
195 200 205
Ser Cys Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln Gln Lys
210 215 220
Asn Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn Ala Gly
225 230 235 240
Val Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu Leu
245 250 255
Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu Met
260 265 270
Ser Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met Ser
275 280 285
Ile Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro Leu Tyr
290 295 300
Gly Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro Leu Cys
305 310 315 320
Thr Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr Asp
325 330 335
Arg Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe Pro Gln
340 345 350
Ala Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp Thr Met
355 360 365
Asn Ser Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Val Asp Ile
370 375 380
Phe Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr Asp Val
385 390 395 400
Ser Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr Gly
405 410 415
Lys Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys Thr
420 425 430
Phe Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp Thr Val
435 440 445
Ser Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser
450 455 460
Leu Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val
465 470 475 480
Phe Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu Lys
485 490 495
Ile Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu His
500 505 510
Asn Val Asn Ala Gly Lys Ser Thr Thr Asn Ile Met Ile Thr Thr Ile
515 520 525
Ile Ile Val Ile Ile Val Ile Leu Leu Ser Leu Ile Ala Val Gly Leu
530 535 540
Leu Leu Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser Lys Asp
545 550 555 560
Gln Leu Ser Gly Ile Asn Asn Ile Ala Phe Ser Asn
565 570
<210> 5
<211> 571
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-139 (delta 3)
<400> 5
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Phe Leu Leu Gly Val Gly Ser Ala
130 135 140
Ile Ala Ser Gly Val Ala Val Ser Lys Val Leu His Leu Glu Gly Glu
145 150 155 160
Val Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala Val Val
165 170 175
Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val Leu Asp Leu
180 185 190
Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn Lys Gln Ser
195 200 205
Cys Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln Gln Lys Asn
210 215 220
Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn Ala Gly Val
225 230 235 240
Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser
245 250 255
Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu Met Ser
260 265 270
Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met Ser Ile
275 280 285
Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly
290 295 300
Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro Leu Cys Thr
305 310 315 320
Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg
325 330 335
Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe Pro Gln Ala
340 345 350
Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp Thr Met Asn
355 360 365
Ser Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Val Asp Ile Phe
370 375 380
Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr Asp Val Ser
385 390 395 400
Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys
405 410 415
Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe
420 425 430
Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp Thr Val Ser
435 440 445
Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu
450 455 460
Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe
465 470 475 480
Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu Lys Ile
485 490 495
Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu His Asn
500 505 510
Val Asn Ala Gly Lys Ser Thr Thr Asn Ile Met Ile Thr Thr Ile Ile
515 520 525
Ile Val Ile Ile Val Ile Leu Leu Ser Leu Ile Ala Val Gly Leu Leu
530 535 540
Leu Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser Lys Asp Gln
545 550 555 560
Leu Ser Gly Ile Asn Asn Ile Ala Phe Ser Asn
565 570
<210> 6
<211> 570
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-140 (delta 4)
<400> 6
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Leu Leu Gly Val Gly Ser Ala Ile
130 135 140
Ala Ser Gly Val Ala Val Ser Lys Val Leu His Leu Glu Gly Glu Val
145 150 155 160
Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala Val Val Ser
165 170 175
Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val Leu Asp Leu Lys
180 185 190
Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn Lys Gln Ser Cys
195 200 205
Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln Gln Lys Asn Asn
210 215 220
Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn Ala Gly Val Thr
225 230 235 240
Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser Leu
245 250 255
Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu Met Ser Asn
260 265 270
Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met Ser Ile Ile
275 280 285
Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly Val
290 295 300
Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro Leu Cys Thr Thr
305 310 315 320
Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg Gly
325 330 335
Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe Pro Gln Ala Glu
340 345 350
Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp Thr Met Asn Ser
355 360 365
Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Val Asp Ile Phe Asn
370 375 380
Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr Asp Val Ser Ser
385 390 395 400
Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys Thr
405 410 415
Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe Ser
420 425 430
Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp Thr Val Ser Val
435 440 445
Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu Tyr
450 455 460
Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe Pro
465 470 475 480
Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu Lys Ile Asn
485 490 495
Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu His Asn Val
500 505 510
Asn Ala Gly Lys Ser Thr Thr Asn Ile Met Ile Thr Thr Ile Ile Ile
515 520 525
Val Ile Ile Val Ile Leu Leu Ser Leu Ile Ala Val Gly Leu Leu Leu
530 535 540
Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser Lys Asp Gln Leu
545 550 555 560
Ser Gly Ile Asn Asn Ile Ala Phe Ser Asn
565 570
<210> 7
<211> 569
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-141 (delta 5)
<400> 7
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Leu Gly Val Gly Ser Ala Ile Ala
130 135 140
Ser Gly Val Ala Val Ser Lys Val Leu His Leu Glu Gly Glu Val Asn
145 150 155 160
Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala Val Val Ser Leu
165 170 175
Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val Leu Asp Leu Lys Asn
180 185 190
Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn Lys Gln Ser Cys Ser
195 200 205
Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln Gln Lys Asn Asn Arg
210 215 220
Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn Ala Gly Val Thr Thr
225 230 235 240
Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser Leu Ile
245 250 255
Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu Met Ser Asn Asn
260 265 270
Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met Ser Ile Ile Lys
275 280 285
Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly Val Ile
290 295 300
Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro Leu Cys Thr Thr Asn
305 310 315 320
Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg Gly Trp
325 330 335
Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe Pro Gln Ala Glu Thr
340 345 350
Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp Thr Met Asn Ser Leu
355 360 365
Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Val Asp Ile Phe Asn Pro
370 375 380
Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr Asp Val Ser Ser Ser
385 390 395 400
Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys Thr Lys
405 410 415
Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe Ser Asn
420 425 430
Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp Thr Val Ser Val Gly
435 440 445
Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu Tyr Val
450 455 460
Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe Pro Ser
465 470 475 480
Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu Lys Ile Asn Gln
485 490 495
Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu His Asn Val Asn
500 505 510
Ala Gly Lys Ser Thr Thr Asn Ile Met Ile Thr Thr Ile Ile Ile Val
515 520 525
Ile Ile Val Ile Leu Leu Ser Leu Ile Ala Val Gly Leu Leu Leu Tyr
530 535 540
Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser Lys Asp Gln Leu Ser
545 550 555 560
Gly Ile Asn Asn Ile Ala Phe Ser Asn
565
<210> 8
<211> 564
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-146 (delta 10)
<400> 8
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Ala Ile Ala Ser Gly Val Ala Val
130 135 140
Ser Lys Val Leu His Leu Glu Gly Glu Val Asn Lys Ile Lys Ser Ala
145 150 155 160
Leu Leu Ser Thr Asn Lys Ala Val Val Ser Leu Ser Asn Gly Val Ser
165 170 175
Val Leu Thr Ser Lys Val Leu Asp Leu Lys Asn Tyr Ile Asp Lys Gln
180 185 190
Leu Leu Pro Ile Val Asn Lys Gln Ser Cys Ser Ile Ser Asn Ile Glu
195 200 205
Thr Val Ile Glu Phe Gln Gln Lys Asn Asn Arg Leu Leu Glu Ile Thr
210 215 220
Arg Glu Phe Ser Val Asn Ala Gly Val Thr Thr Pro Val Ser Thr Tyr
225 230 235 240
Met Leu Thr Asn Ser Glu Leu Leu Ser Leu Ile Asn Asp Met Pro Ile
245 250 255
Thr Asn Asp Gln Lys Lys Leu Met Ser Asn Asn Val Gln Ile Val Arg
260 265 270
Gln Gln Ser Tyr Ser Ile Met Ser Ile Ile Lys Glu Glu Val Leu Ala
275 280 285
Tyr Val Val Gln Leu Pro Leu Tyr Gly Val Ile Asp Thr Pro Cys Trp
290 295 300
Lys Leu His Thr Ser Pro Leu Cys Thr Thr Asn Thr Lys Glu Gly Ser
305 310 315 320
Asn Ile Cys Leu Thr Arg Thr Asp Arg Gly Trp Tyr Cys Asp Asn Ala
325 330 335
Gly Ser Val Ser Phe Phe Pro Gln Ala Glu Thr Cys Lys Val Gln Ser
340 345 350
Asn Arg Val Phe Cys Asp Thr Met Asn Ser Leu Thr Leu Pro Ser Glu
355 360 365
Val Asn Leu Cys Asn Val Asp Ile Phe Asn Pro Lys Tyr Asp Cys Lys
370 375 380
Ile Met Thr Ser Lys Thr Asp Val Ser Ser Ser Val Ile Thr Ser Leu
385 390 395 400
Gly Ala Ile Val Ser Cys Tyr Gly Lys Thr Lys Cys Thr Ala Ser Asn
405 410 415
Lys Asn Arg Gly Ile Ile Lys Thr Phe Ser Asn Gly Cys Asp Tyr Val
420 425 430
Ser Asn Lys Gly Val Asp Thr Val Ser Val Gly Asn Thr Leu Tyr Tyr
435 440 445
Val Asn Lys Gln Glu Gly Lys Ser Leu Tyr Val Lys Gly Glu Pro Ile
450 455 460
Ile Asn Phe Tyr Asp Pro Leu Val Phe Pro Ser Asp Glu Phe Asp Ala
465 470 475 480
Ser Ile Ser Gln Val Asn Glu Lys Ile Asn Gln Ser Leu Ala Phe Ile
485 490 495
Arg Lys Ser Asp Glu Leu Leu His Asn Val Asn Ala Gly Lys Ser Thr
500 505 510
Thr Asn Ile Met Ile Thr Thr Ile Ile Ile Val Ile Ile Val Ile Leu
515 520 525
Leu Ser Leu Ile Ala Val Gly Leu Leu Leu Tyr Cys Lys Ala Arg Ser
530 535 540
Thr Pro Val Thr Leu Ser Lys Asp Gln Leu Ser Gly Ile Asn Asn Ile
545 550 555 560
Ala Phe Ser Asn
<210> 9
<211> 568
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-142 (delta 6)
<400> 9
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Gly Val Gly Ser Ala Ile Ala Ser
130 135 140
Gly Val Ala Val Ser Lys Val Leu His Leu Glu Gly Glu Val Asn Lys
145 150 155 160
Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala Val Val Ser Leu Ser
165 170 175
Asn Gly Val Ser Val Leu Thr Ser Lys Val Leu Asp Leu Lys Asn Tyr
180 185 190
Ile Asp Lys Gln Leu Leu Pro Ile Val Asn Lys Gln Ser Cys Ser Ile
195 200 205
Ser Asn Ile Glu Thr Val Ile Glu Phe Gln Gln Lys Asn Asn Arg Leu
210 215 220
Leu Glu Ile Thr Arg Glu Phe Ser Val Asn Ala Gly Val Thr Thr Pro
225 230 235 240
Val Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser Leu Ile Asn
245 250 255
Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu Met Ser Asn Asn Val
260 265 270
Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met Ser Ile Ile Lys Glu
275 280 285
Glu Val Leu Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly Val Ile Asp
290 295 300
Thr Pro Cys Trp Lys Leu His Thr Ser Pro Leu Cys Thr Thr Asn Thr
305 310 315 320
Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg Gly Trp Tyr
325 330 335
Cys Asp Asn Ala Gly Ser Val Ser Phe Phe Pro Gln Ala Glu Thr Cys
340 345 350
Lys Val Gln Ser Asn Arg Val Phe Cys Asp Thr Met Asn Ser Leu Thr
355 360 365
Leu Pro Ser Glu Val Asn Leu Cys Asn Val Asp Ile Phe Asn Pro Lys
370 375 380
Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr Asp Val Ser Ser Ser Val
385 390 395 400
Ile Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys Thr Lys Cys
405 410 415
Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe Ser Asn Gly
420 425 430
Cys Asp Tyr Val Ser Asn Lys Gly Val Asp Thr Val Ser Val Gly Asn
435 440 445
Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu Tyr Val Lys
450 455 460
Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe Pro Ser Asp
465 470 475 480
Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu Lys Ile Asn Gln Ser
485 490 495
Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu His Asn Val Asn Ala
500 505 510
Gly Lys Ser Thr Thr Asn Ile Met Ile Thr Thr Ile Ile Ile Val Ile
515 520 525
Ile Val Ile Leu Leu Ser Leu Ile Ala Val Gly Leu Leu Leu Tyr Cys
530 535 540
Lys Ala Arg Ser Thr Pro Val Thr Leu Ser Lys Asp Gln Leu Ser Gly
545 550 555 560
Ile Asn Asn Ile Ala Phe Ser Asn
565
<210> 10
<211> 567
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-143 (delta 7)
<400> 10
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Val Gly Ser Ala Ile Ala Ser Gly
130 135 140
Val Ala Val Ser Lys Val Leu His Leu Glu Gly Glu Val Asn Lys Ile
145 150 155 160
Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala Val Val Ser Leu Ser Asn
165 170 175
Gly Val Ser Val Leu Thr Ser Lys Val Leu Asp Leu Lys Asn Tyr Ile
180 185 190
Asp Lys Gln Leu Leu Pro Ile Val Asn Lys Gln Ser Cys Ser Ile Ser
195 200 205
Asn Ile Glu Thr Val Ile Glu Phe Gln Gln Lys Asn Asn Arg Leu Leu
210 215 220
Glu Ile Thr Arg Glu Phe Ser Val Asn Ala Gly Val Thr Thr Pro Val
225 230 235 240
Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser Leu Ile Asn Asp
245 250 255
Met Pro Ile Thr Asn Asp Gln Lys Lys Leu Met Ser Asn Asn Val Gln
260 265 270
Ile Val Arg Gln Gln Ser Tyr Ser Ile Met Ser Ile Ile Lys Glu Glu
275 280 285
Val Leu Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly Val Ile Asp Thr
290 295 300
Pro Cys Trp Lys Leu His Thr Ser Pro Leu Cys Thr Thr Asn Thr Lys
305 310 315 320
Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg Gly Trp Tyr Cys
325 330 335
Asp Asn Ala Gly Ser Val Ser Phe Phe Pro Gln Ala Glu Thr Cys Lys
340 345 350
Val Gln Ser Asn Arg Val Phe Cys Asp Thr Met Asn Ser Leu Thr Leu
355 360 365
Pro Ser Glu Val Asn Leu Cys Asn Val Asp Ile Phe Asn Pro Lys Tyr
370 375 380
Asp Cys Lys Ile Met Thr Ser Lys Thr Asp Val Ser Ser Ser Val Ile
385 390 395 400
Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys Thr Lys Cys Thr
405 410 415
Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe Ser Asn Gly Cys
420 425 430
Asp Tyr Val Ser Asn Lys Gly Val Asp Thr Val Ser Val Gly Asn Thr
435 440 445
Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu Tyr Val Lys Gly
450 455 460
Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe Pro Ser Asp Glu
465 470 475 480
Phe Asp Ala Ser Ile Ser Gln Val Asn Glu Lys Ile Asn Gln Ser Leu
485 490 495
Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu His Asn Val Asn Ala Gly
500 505 510
Lys Ser Thr Thr Asn Ile Met Ile Thr Thr Ile Ile Ile Val Ile Ile
515 520 525
Val Ile Leu Leu Ser Leu Ile Ala Val Gly Leu Leu Leu Tyr Cys Lys
530 535 540
Ala Arg Ser Thr Pro Val Thr Leu Ser Lys Asp Gln Leu Ser Gly Ile
545 550 555 560
Asn Asn Ile Ala Phe Ser Asn
565
<210> 11
<211> 566
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-144 (delta 8)
<400> 11
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Gly Ser Ala Ile Ala Ser Gly Val
130 135 140
Ala Val Ser Lys Val Leu His Leu Glu Gly Glu Val Asn Lys Ile Lys
145 150 155 160
Ser Ala Leu Leu Ser Thr Asn Lys Ala Val Val Ser Leu Ser Asn Gly
165 170 175
Val Ser Val Leu Thr Ser Lys Val Leu Asp Leu Lys Asn Tyr Ile Asp
180 185 190
Lys Gln Leu Leu Pro Ile Val Asn Lys Gln Ser Cys Ser Ile Ser Asn
195 200 205
Ile Glu Thr Val Ile Glu Phe Gln Gln Lys Asn Asn Arg Leu Leu Glu
210 215 220
Ile Thr Arg Glu Phe Ser Val Asn Ala Gly Val Thr Thr Pro Val Ser
225 230 235 240
Thr Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser Leu Ile Asn Asp Met
245 250 255
Pro Ile Thr Asn Asp Gln Lys Lys Leu Met Ser Asn Asn Val Gln Ile
260 265 270
Val Arg Gln Gln Ser Tyr Ser Ile Met Ser Ile Ile Lys Glu Glu Val
275 280 285
Leu Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly Val Ile Asp Thr Pro
290 295 300
Cys Trp Lys Leu His Thr Ser Pro Leu Cys Thr Thr Asn Thr Lys Glu
305 310 315 320
Gly Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg Gly Trp Tyr Cys Asp
325 330 335
Asn Ala Gly Ser Val Ser Phe Phe Pro Gln Ala Glu Thr Cys Lys Val
340 345 350
Gln Ser Asn Arg Val Phe Cys Asp Thr Met Asn Ser Leu Thr Leu Pro
355 360 365
Ser Glu Val Asn Leu Cys Asn Val Asp Ile Phe Asn Pro Lys Tyr Asp
370 375 380
Cys Lys Ile Met Thr Ser Lys Thr Asp Val Ser Ser Ser Val Ile Thr
385 390 395 400
Ser Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys Thr Lys Cys Thr Ala
405 410 415
Ser Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe Ser Asn Gly Cys Asp
420 425 430
Tyr Val Ser Asn Lys Gly Val Asp Thr Val Ser Val Gly Asn Thr Leu
435 440 445
Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu Tyr Val Lys Gly Glu
450 455 460
Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe Pro Ser Asp Glu Phe
465 470 475 480
Asp Ala Ser Ile Ser Gln Val Asn Glu Lys Ile Asn Gln Ser Leu Ala
485 490 495
Phe Ile Arg Lys Ser Asp Glu Leu Leu His Asn Val Asn Ala Gly Lys
500 505 510
Ser Thr Thr Asn Ile Met Ile Thr Thr Ile Ile Ile Val Ile Ile Val
515 520 525
Ile Leu Leu Ser Leu Ile Ala Val Gly Leu Leu Leu Tyr Cys Lys Ala
530 535 540
Arg Ser Thr Pro Val Thr Leu Ser Lys Asp Gln Leu Ser Gly Ile Asn
545 550 555 560
Asn Ile Ala Phe Ser Asn
565
<210> 12
<211> 565
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-145 (delta 9)
<400> 12
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Gln Lys Gln Gln Ser Ala Ile Ala Ser Gly Val Ala
130 135 140
Val Ser Lys Val Leu His Leu Glu Gly Glu Val Asn Lys Ile Lys Ser
145 150 155 160
Ala Leu Leu Ser Thr Asn Lys Ala Val Val Ser Leu Ser Asn Gly Val
165 170 175
Ser Val Leu Thr Ser Lys Val Leu Asp Leu Lys Asn Tyr Ile Asp Lys
180 185 190
Gln Leu Leu Pro Ile Val Asn Lys Gln Ser Cys Ser Ile Ser Asn Ile
195 200 205
Glu Thr Val Ile Glu Phe Gln Gln Lys Asn Asn Arg Leu Leu Glu Ile
210 215 220
Thr Arg Glu Phe Ser Val Asn Ala Gly Val Thr Thr Pro Val Ser Thr
225 230 235 240
Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser Leu Ile Asn Asp Met Pro
245 250 255
Ile Thr Asn Asp Gln Lys Lys Leu Met Ser Asn Asn Val Gln Ile Val
260 265 270
Arg Gln Gln Ser Tyr Ser Ile Met Ser Ile Ile Lys Glu Glu Val Leu
275 280 285
Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly Val Ile Asp Thr Pro Cys
290 295 300
Trp Lys Leu His Thr Ser Pro Leu Cys Thr Thr Asn Thr Lys Glu Gly
305 310 315 320
Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg Gly Trp Tyr Cys Asp Asn
325 330 335
Ala Gly Ser Val Ser Phe Phe Pro Gln Ala Glu Thr Cys Lys Val Gln
340 345 350
Ser Asn Arg Val Phe Cys Asp Thr Met Asn Ser Leu Thr Leu Pro Ser
355 360 365
Glu Val Asn Leu Cys Asn Val Asp Ile Phe Asn Pro Lys Tyr Asp Cys
370 375 380
Lys Ile Met Thr Ser Lys Thr Asp Val Ser Ser Ser Val Ile Thr Ser
385 390 395 400
Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys Thr Lys Cys Thr Ala Ser
405 410 415
Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe Ser Asn Gly Cys Asp Tyr
420 425 430
Val Ser Asn Lys Gly Val Asp Thr Val Ser Val Gly Asn Thr Leu Tyr
435 440 445
Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu Tyr Val Lys Gly Glu Pro
450 455 460
Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe Pro Ser Asp Glu Phe Asp
465 470 475 480
Ala Ser Ile Ser Gln Val Asn Glu Lys Ile Asn Gln Ser Leu Ala Phe
485 490 495
Ile Arg Lys Ser Asp Glu Leu Leu His Asn Val Asn Ala Gly Lys Ser
500 505 510
Thr Thr Asn Ile Met Ile Thr Thr Ile Ile Ile Val Ile Ile Val Ile
515 520 525
Leu Leu Ser Leu Ile Ala Val Gly Leu Leu Leu Tyr Cys Lys Ala Arg
530 535 540
Ser Thr Pro Val Thr Leu Ser Lys Asp Gln Leu Ser Gly Ile Asn Asn
545 550 555 560
Ile Ala Phe Ser Asn
565
<210> 13
<211> 565
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Делеция 137-145 (delta 9) с сайтом расщепления фурином дикого типа
<400> 13
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly Gln Asn Ile Thr Glu Glu Phe
20 25 30
Tyr Gln Ser Thr Cys Ser Ala Val Ser Lys Gly Tyr Leu Ser Ala Leu
35 40 45
Arg Thr Gly Trp Tyr Thr Ser Val Ile Thr Ile Glu Leu Ser Asn Ile
50 55 60
Lys Glu Asn Lys Cys Asn Gly Thr Asp Ala Lys Val Lys Leu Ile Lys
65 70 75 80
Gln Glu Leu Asp Lys Tyr Lys Asn Ala Val Thr Glu Leu Gln Leu Leu
85 90 95
Met Gln Ser Thr Pro Ala Thr Asn Asn Arg Ala Arg Arg Glu Leu Pro
100 105 110
Arg Phe Met Asn Tyr Thr Leu Asn Asn Ala Lys Lys Thr Asn Val Thr
115 120 125
Leu Ser Lys Lys Arg Lys Arg Arg Ser Ala Ile Ala Ser Gly Val Ala
130 135 140
Val Ser Lys Val Leu His Leu Glu Gly Glu Val Asn Lys Ile Lys Ser
145 150 155 160
Ala Leu Leu Ser Thr Asn Lys Ala Val Val Ser Leu Ser Asn Gly Val
165 170 175
Ser Val Leu Thr Ser Lys Val Leu Asp Leu Lys Asn Tyr Ile Asp Lys
180 185 190
Gln Leu Leu Pro Ile Val Asn Lys Gln Ser Cys Ser Ile Ser Asn Ile
195 200 205
Glu Thr Val Ile Glu Phe Gln Gln Lys Asn Asn Arg Leu Leu Glu Ile
210 215 220
Thr Arg Glu Phe Ser Val Asn Ala Gly Val Thr Thr Pro Val Ser Thr
225 230 235 240
Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser Leu Ile Asn Asp Met Pro
245 250 255
Ile Thr Asn Asp Gln Lys Lys Leu Met Ser Asn Asn Val Gln Ile Val
260 265 270
Arg Gln Gln Ser Tyr Ser Ile Met Ser Ile Ile Lys Glu Glu Val Leu
275 280 285
Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly Val Ile Asp Thr Pro Cys
290 295 300
Trp Lys Leu His Thr Ser Pro Leu Cys Thr Thr Asn Thr Lys Glu Gly
305 310 315 320
Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg Gly Trp Tyr Cys Asp Asn
325 330 335
Ala Gly Ser Val Ser Phe Phe Pro Gln Ala Glu Thr Cys Lys Val Gln
340 345 350
Ser Asn Arg Val Phe Cys Asp Thr Met Asn Ser Leu Thr Leu Pro Ser
355 360 365
Glu Val Asn Leu Cys Asn Val Asp Ile Phe Asn Pro Lys Tyr Asp Cys
370 375 380
Lys Ile Met Thr Ser Lys Thr Asp Val Ser Ser Ser Val Ile Thr Ser
385 390 395 400
Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys Thr Lys Cys Thr Ala Ser
405 410 415
Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe Ser Asn Gly Cys Asp Tyr
420 425 430
Val Ser Asn Lys Gly Val Asp Thr Val Ser Val Gly Asn Thr Leu Tyr
435 440 445
Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu Tyr Val Lys Gly Glu Pro
450 455 460
Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe Pro Ser Asp Glu Phe Asp
465 470 475 480
Ala Ser Ile Ser Gln Val Asn Glu Lys Ile Asn Gln Ser Leu Ala Phe
485 490 495
Ile Arg Lys Ser Asp Glu Leu Leu His Asn Val Asn Ala Gly Lys Ser
500 505 510
Thr Thr Asn Ile Met Ile Thr Thr Ile Ile Ile Val Ile Ile Val Ile
515 520 525
Leu Leu Ser Leu Ile Ala Val Gly Leu Leu Leu Tyr Cys Lys Ala Arg
530 535 540
Ser Thr Pro Val Thr Leu Ser Lys Asp Gln Leu Ser Gly Ile Asn Asn
545 550 555 560
Ile Ala Phe Ser Asn
565
<210> 14
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутированный сайт расщепления фурином
<400> 14
Lys Lys Gln Lys Gln Gln
1 5
<210> 15
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутированный сайт расщепления фурином
<400> 15
Gln Lys Gln Lys Gln Gln
1 5
<210> 16
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутированный сайт расщепления фурином
<400> 16
Lys Lys Gln Lys Arg Gln
1 5
<210> 17
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> мутированный сайт расщепления фурином
<400> 17
Gly Arg Arg Gln Gln Arg
1 5
<210> 18
<211> 6
<212> БЕЛОК
<213> Неизвестен
<220>
<223> сайт расщепления фурином
<400> 18
Lys Lys Arg Lys Arg Arg
1 5
<210> 19
<211> 539
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный F-белок RSV
<400> 19
Gln Asn Ile Thr Glu Glu Phe Tyr Gln Ser Thr Cys Ser Ala Val Ser
1 5 10 15
Lys Gly Tyr Leu Ser Ala Leu Arg Thr Gly Trp Tyr Thr Ser Val Ile
20 25 30
Thr Ile Glu Leu Ser Asn Ile Lys Glu Asn Lys Cys Asn Gly Thr Asp
35 40 45
Ala Lys Val Lys Leu Ile Lys Gln Glu Leu Asp Lys Tyr Lys Asn Ala
50 55 60
Val Thr Glu Leu Gln Leu Leu Met Gln Ser Thr Pro Ala Thr Asn Asn
65 70 75 80
Arg Ala Arg Arg Glu Leu Pro Arg Phe Met Asn Tyr Thr Leu Asn Asn
85 90 95
Ala Lys Lys Thr Asn Val Thr Leu Ser Lys Lys Gln Lys Gln Gln Ala
100 105 110
Ile Ala Ser Gly Val Ala Val Ser Lys Val Leu His Leu Glu Gly Glu
115 120 125
Val Asn Lys Ile Lys Ser Ala Leu Leu Ser Thr Asn Lys Ala Val Val
130 135 140
Ser Leu Ser Asn Gly Val Ser Val Leu Thr Ser Lys Val Leu Asp Leu
145 150 155 160
Lys Asn Tyr Ile Asp Lys Gln Leu Leu Pro Ile Val Asn Lys Gln Ser
165 170 175
Cys Ser Ile Ser Asn Ile Glu Thr Val Ile Glu Phe Gln Gln Lys Asn
180 185 190
Asn Arg Leu Leu Glu Ile Thr Arg Glu Phe Ser Val Asn Ala Gly Val
195 200 205
Thr Thr Pro Val Ser Thr Tyr Met Leu Thr Asn Ser Glu Leu Leu Ser
210 215 220
Leu Ile Asn Asp Met Pro Ile Thr Asn Asp Gln Lys Lys Leu Met Ser
225 230 235 240
Asn Asn Val Gln Ile Val Arg Gln Gln Ser Tyr Ser Ile Met Ser Ile
245 250 255
Ile Lys Glu Glu Val Leu Ala Tyr Val Val Gln Leu Pro Leu Tyr Gly
260 265 270
Val Ile Asp Thr Pro Cys Trp Lys Leu His Thr Ser Pro Leu Cys Thr
275 280 285
Thr Asn Thr Lys Glu Gly Ser Asn Ile Cys Leu Thr Arg Thr Asp Arg
290 295 300
Gly Trp Tyr Cys Asp Asn Ala Gly Ser Val Ser Phe Phe Pro Gln Ala
305 310 315 320
Glu Thr Cys Lys Val Gln Ser Asn Arg Val Phe Cys Asp Thr Met Asn
325 330 335
Ser Leu Thr Leu Pro Ser Glu Val Asn Leu Cys Asn Val Asp Ile Phe
340 345 350
Asn Pro Lys Tyr Asp Cys Lys Ile Met Thr Ser Lys Thr Asp Val Ser
355 360 365
Ser Ser Val Ile Thr Ser Leu Gly Ala Ile Val Ser Cys Tyr Gly Lys
370 375 380
Thr Lys Cys Thr Ala Ser Asn Lys Asn Arg Gly Ile Ile Lys Thr Phe
385 390 395 400
Ser Asn Gly Cys Asp Tyr Val Ser Asn Lys Gly Val Asp Thr Val Ser
405 410 415
Val Gly Asn Thr Leu Tyr Tyr Val Asn Lys Gln Glu Gly Lys Ser Leu
420 425 430
Tyr Val Lys Gly Glu Pro Ile Ile Asn Phe Tyr Asp Pro Leu Val Phe
435 440 445
Pro Ser Asp Glu Phe Asp Ala Ser Ile Ser Gln Val Asn Glu Lys Ile
450 455 460
Asn Gln Ser Leu Ala Phe Ile Arg Lys Ser Asp Glu Leu Leu His Asn
465 470 475 480
Val Asn Ala Gly Lys Ser Thr Thr Asn Ile Met Ile Thr Thr Ile Ile
485 490 495
Ile Val Ile Ile Val Ile Leu Leu Ser Leu Ile Ala Val Gly Leu Leu
500 505 510
Leu Tyr Cys Lys Ala Arg Ser Thr Pro Val Thr Leu Ser Lys Asp Gln
515 520 525
Leu Ser Gly Ile Asn Asn Ile Ala Phe Ser Asn
530 535
<210> 20
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> участки антигенного сайта II
<400> 20
Asn Ser Glu Leu Leu Ser Leu Ile Asn Asp Met Pro Ile Thr Asn Asp
1 5 10 15
Gln Lys Lys
<210> 21
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> участки антигенного сайта II
<400> 21
Leu Met Ser Asn Asn
1 5
<210> 22
<211> 676
<212> БЕЛОК
<213> вирус Эбола
<400> 22
Met Gly Val Thr Gly Ile Leu Gln Leu Pro Arg Asp Arg Phe Lys Arg
1 5 10 15
Thr Ser Phe Phe Leu Trp Val Ile Ile Leu Phe Gln Arg Thr Phe Ser
20 25 30
Ile Pro Leu Gly Val Ile His Asn Ser Thr Leu Gln Val Ser Asp Val
35 40 45
Asp Lys Leu Val Cys Arg Asp Lys Leu Ser Ser Thr Asn Gln Leu Arg
50 55 60
Ser Val Gly Leu Asn Leu Glu Gly Asn Gly Val Ala Thr Asp Val Pro
65 70 75 80
Ser Val Thr Lys Arg Trp Gly Phe Arg Ser Gly Val Pro Pro Lys Val
85 90 95
Val Asn Tyr Glu Ala Gly Glu Trp Ala Glu Asn Cys Tyr Asn Leu Glu
100 105 110
Ile Lys Lys Pro Asp Gly Ser Glu Cys Leu Pro Ala Ala Pro Asp Gly
115 120 125
Ile Arg Gly Phe Pro Arg Cys Arg Tyr Val His Lys Val Ser Gly Thr
130 135 140
Gly Pro Cys Ala Gly Asp Phe Ala Phe His Lys Glu Gly Ala Phe Phe
145 150 155 160
Leu Tyr Asp Arg Leu Ala Ser Thr Val Ile Tyr Arg Gly Thr Thr Phe
165 170 175
Ala Glu Gly Val Val Ala Phe Leu Ile Leu Pro Gln Ala Lys Lys Asp
180 185 190
Phe Phe Ser Ser His Pro Leu Arg Glu Pro Val Asn Ala Thr Glu Asp
195 200 205
Pro Ser Ser Gly Tyr Tyr Ser Thr Thr Ile Arg Tyr Gln Ala Thr Gly
210 215 220
Phe Gly Thr Asn Glu Thr Glu Tyr Leu Phe Glu Val Asp Asn Leu Thr
225 230 235 240
Tyr Val Gln Leu Glu Ser Arg Phe Thr Pro Gln Phe Leu Leu Gln Leu
245 250 255
Asn Glu Thr Ile Tyr Ala Ser Gly Lys Arg Ser Asn Thr Thr Gly Lys
260 265 270
Leu Ile Trp Lys Val Asn Pro Glu Ile Asp Thr Thr Ile Gly Glu Trp
275 280 285
Ala Phe Trp Glu Thr Lys Lys Asn Leu Thr Arg Lys Ile Arg Ser Glu
290 295 300
Glu Leu Ser Phe Thr Ala Val Ser Asn Gly Pro Lys Asn Ile Ser Gly
305 310 315 320
Gln Ser Pro Ala Arg Thr Ser Ser Asp Pro Glu Thr Asn Thr Thr Asn
325 330 335
Glu Asp His Lys Ile Met Ala Ser Glu Asn Ser Ser Ala Met Val Gln
340 345 350
Val His Ser Gln Gly Arg Lys Ala Ala Val Ser His Leu Thr Thr Leu
355 360 365
Ala Thr Ile Ser Thr Ser Pro Gln Pro Pro Thr Thr Lys Thr Gly Pro
370 375 380
Asp Asn Ser Thr His Asn Thr Pro Val Tyr Lys Leu Asp Ile Ser Glu
385 390 395 400
Ala Thr Gln Val Gly Gln His His Arg Arg Ala Asp Asn Asp Ser Thr
405 410 415
Ala Ser Asp Thr Pro Pro Ala Thr Thr Ala Ala Gly Pro Leu Lys Ala
420 425 430
Glu Asn Thr Asn Thr Ser Lys Ser Ala Asp Ser Leu Asp Leu Ala Thr
435 440 445
Thr Thr Ser Pro Gln Asn Tyr Ser Glu Thr Ala Gly Asn Asn Asn Thr
450 455 460
His His Gln Asp Thr Gly Glu Glu Ser Ala Ser Ser Gly Lys Leu Gly
465 470 475 480
Leu Ile Thr Asn Thr Ile Ala Gly Val Ala Gly Leu Ile Thr Gly Gly
485 490 495
Arg Arg Thr Arg Arg Glu Val Ile Val Asn Ala Gln Pro Lys Cys Asn
500 505 510
Pro Asn Leu His Tyr Trp Thr Thr Gln Asp Glu Gly Ala Ala Ile Gly
515 520 525
Leu Ala Trp Ile Pro Tyr Phe Gly Pro Ala Ala Glu Gly Ile Tyr Thr
530 535 540
Glu Gly Leu Met His Asn Gln Asp Gly Leu Ile Cys Gly Leu Arg Gln
545 550 555 560
Leu Ala Asn Glu Thr Thr Gln Ala Leu Gln Leu Phe Leu Arg Ala Thr
565 570 575
Thr Glu Leu Arg Thr Phe Ser Ile Leu Asn Arg Lys Ala Ile Asp Phe
580 585 590
Leu Leu Gln Arg Trp Gly Gly Thr Cys His Ile Leu Gly Pro Asp Cys
595 600 605
Cys Ile Glu Pro His Asp Trp Thr Lys Asn Ile Thr Asp Lys Ile Asp
610 615 620
Gln Ile Ile His Asp Phe Val Asp Lys Thr Leu Pro Asp Gln Gly Asp
625 630 635 640
Asn Asp Asn Trp Trp Thr Gly Trp Arg Gln Trp Ile Pro Ala Gly Ile
645 650 655
Gly Val Thr Gly Val Ile Ile Ala Val Ile Ala Leu Phe Cys Ile Cys
660 665 670
Lys Phe Val Phe
675
<210> 23
<211> 17
<212> БЕЛОК
<213> вирус Эбола
<400> 23
His Asn Thr Pro Val Tyr Lys Leu Asp Ile Ser Glu Ala Thr Gln Val
1 5 10 15
Glu
<210> 24
<211> 17
<212> БЕЛОК
<213> вирус Эбола
<400> 24
Ala Thr Gln Val Glu Gln His His Arg Arg Thr Asp Asn Asp Ser Thr
1 5 10 15
Ala
<210> 25
<211> 17
<212> БЕЛОК
<213> вирус Эбола
<400> 25
Ala Thr Gln Val Gly Gln His His Arg Arg Ala Asp Asn Asp Ser Thr
1 5 10 15
Ala
<210> 26
<211> 25
<212> БЕЛОК
<213> Респираторно-синцитальный вирус
<400> 26
Met Glu Leu Leu Ile Leu Lys Ala Asn Ala Ile Thr Thr Ile Leu Thr
1 5 10 15
Ala Val Thr Phe Cys Phe Ala Ser Gly
20 25
<210> 27
<211> 676
<212> БЕЛОК
<213> вирус Эбола
<400> 27
Met Gly Val Thr Gly Ile Leu Gln Leu Pro Arg Asp Arg Phe Lys Arg
1 5 10 15
Thr Ser Phe Phe Leu Trp Val Ile Ile Leu Phe Gln Arg Thr Phe Ser
20 25 30
Ile Pro Leu Gly Val Ile His Asn Ser Thr Leu Gln Val Ser Asp Val
35 40 45
Asp Lys Leu Val Cys Arg Asp Lys Leu Ser Ser Thr Asn Gln Leu Arg
50 55 60
Ser Val Gly Leu Asn Leu Glu Gly Asn Gly Val Ala Thr Asp Val Pro
65 70 75 80
Ser Ala Thr Lys Arg Trp Gly Phe Arg Ser Gly Val Pro Pro Lys Val
85 90 95
Val Asn Tyr Glu Ala Gly Glu Trp Ala Glu Asn Cys Tyr Asn Leu Glu
100 105 110
Ile Lys Lys Pro Asp Gly Ser Glu Cys Leu Pro Ala Ala Pro Asp Gly
115 120 125
Ile Arg Gly Phe Pro Arg Cys Arg Tyr Val His Lys Val Ser Gly Thr
130 135 140
Gly Pro Cys Ala Gly Asp Phe Ala Phe His Lys Glu Gly Ala Phe Phe
145 150 155 160
Leu Tyr Asp Arg Leu Ala Ser Thr Val Ile Tyr Arg Gly Thr Thr Phe
165 170 175
Ala Glu Gly Val Val Ala Phe Leu Ile Leu Pro Gln Ala Lys Lys Asp
180 185 190
Phe Phe Ser Ser His Pro Leu Arg Glu Pro Val Asn Ala Thr Glu Asp
195 200 205
Pro Ser Ser Gly Tyr Tyr Ser Thr Thr Ile Arg Tyr Gln Ala Thr Gly
210 215 220
Phe Gly Thr Asn Glu Thr Glu Tyr Leu Phe Glu Val Asp Asn Leu Thr
225 230 235 240
Tyr Val Gln Leu Glu Ser Arg Phe Thr Pro Gln Phe Leu Leu Gln Leu
245 250 255
Asn Glu Thr Ile Tyr Thr Ser Gly Lys Arg Ser Asn Thr Thr Gly Lys
260 265 270
Leu Ile Trp Lys Val Asn Pro Glu Ile Asp Thr Thr Ile Gly Glu Trp
275 280 285
Ala Phe Trp Glu Thr Lys Lys Asn Leu Thr Arg Lys Ile Arg Ser Glu
290 295 300
Glu Leu Ser Phe Thr Val Val Ser Asn Gly Ala Lys Asn Ile Ser Gly
305 310 315 320
Gln Ser Pro Ala Arg Thr Ser Ser Asp Pro Gly Thr Asn Thr Thr Thr
325 330 335
Glu Asp His Lys Ile Met Ala Ser Glu Asn Ser Ser Ala Met Val Gln
340 345 350
Val His Ser Gln Gly Arg Glu Ala Ala Val Ser His Leu Thr Thr Leu
355 360 365
Ala Thr Ile Ser Thr Ser Pro Gln Ser Leu Thr Thr Lys Pro Gly Pro
370 375 380
Asp Asn Ser Thr His Asn Thr Pro Val Tyr Lys Leu Asp Ile Ser Glu
385 390 395 400
Ala Thr Gln Val Glu Gln His His Arg Arg Thr Asp Asn Asp Ser Thr
405 410 415
Ala Ser Asp Thr Pro Ser Ala Thr Thr Ala Ala Gly Pro Pro Lys Ala
420 425 430
Glu Asn Thr Asn Thr Ser Lys Ser Thr Asp Phe Leu Asp Pro Ala Thr
435 440 445
Thr Thr Ser Pro Gln Asn His Ser Glu Thr Ala Gly Asn Asn Asn Thr
450 455 460
His His Gln Asp Thr Gly Glu Glu Ser Ala Ser Ser Gly Lys Leu Gly
465 470 475 480
Leu Ile Thr Asn Thr Ile Ala Gly Val Ala Gly Leu Ile Thr Gly Gly
485 490 495
Arg Arg Thr Arg Arg Glu Ala Ile Val Asn Ala Gln Pro Lys Cys Asn
500 505 510
Pro Asn Leu His Tyr Trp Thr Thr Gln Asp Glu Gly Ala Ala Ile Gly
515 520 525
Leu Ala Trp Ile Pro Tyr Phe Gly Pro Ala Ala Glu Gly Ile Tyr Ile
530 535 540
Glu Gly Leu Met His Asn Gln Asp Gly Leu Ile Cys Gly Leu Arg Gln
545 550 555 560
Leu Ala Asn Glu Thr Thr Gln Ala Leu Gln Leu Phe Leu Arg Ala Thr
565 570 575
Thr Glu Leu Arg Thr Phe Ser Ile Leu Asn Arg Lys Ala Ile Asp Phe
580 585 590
Leu Leu Gln Arg Trp Gly Gly Thr Cys His Ile Leu Gly Pro Asp Cys
595 600 605
Cys Ile Glu Pro His Asp Trp Thr Lys Asn Ile Thr Asp Lys Ile Asp
610 615 620
Gln Ile Ile His Asp Phe Val Asp Lys Thr Leu Pro Asp Gln Gly Asp
625 630 635 640
Asn Asp Asn Trp Trp Thr Gly Trp Arg Gln Trp Ile Pro Ala Gly Ile
645 650 655
Gly Val Thr Gly Val Ile Ile Ala Val Ile Ala Leu Phe Cys Ile Cys
660 665 670
Lys Phe Val Phe
675
<210> 28
<211> 676
<212> БЕЛОК
<213> вирус Эбола
<400> 28
Met Gly Val Thr Gly Ile Leu Gln Leu Pro Arg Asp Arg Phe Lys Arg
1 5 10 15
Thr Ser Phe Phe Leu Trp Val Ile Ile Leu Phe Gln Arg Thr Phe Ser
20 25 30
Ile Pro Leu Gly Val Ile His Asn Ser Thr Leu Gln Val Ser Asp Val
35 40 45
Asp Lys Leu Val Cys Arg Asp Lys Leu Ser Ser Thr Asn Gln Leu Arg
50 55 60
Ser Val Gly Leu Asn Leu Glu Gly Asn Gly Val Ala Thr Asp Val Pro
65 70 75 80
Ser Val Thr Lys Arg Trp Gly Phe Arg Ser Gly Val Pro Pro Lys Val
85 90 95
Val Asn Tyr Glu Ala Gly Glu Trp Ala Glu Asn Cys Tyr Asn Leu Glu
100 105 110
Ile Lys Lys Pro Asp Gly Ser Glu Cys Leu Pro Ala Ala Pro Asp Gly
115 120 125
Ile Arg Gly Phe Pro Arg Cys Arg Tyr Val His Lys Val Ser Gly Thr
130 135 140
Gly Pro Cys Ala Gly Asp Phe Ala Phe His Lys Glu Gly Ala Phe Phe
145 150 155 160
Leu Tyr Asp Arg Leu Ala Ser Thr Val Ile Tyr Arg Gly Thr Thr Phe
165 170 175
Ala Glu Gly Val Val Ala Phe Leu Ile Leu Pro Gln Ala Lys Lys Asp
180 185 190
Phe Phe Ser Ser His Pro Leu Arg Glu Pro Val Asn Ala Thr Glu Asp
195 200 205
Pro Ser Ser Gly Tyr Tyr Ser Thr Thr Ile Arg Tyr Gln Ala Thr Gly
210 215 220
Phe Gly Thr Asn Glu Thr Glu Tyr Leu Phe Glu Val Asp Asn Leu Thr
225 230 235 240
Tyr Val Gln Leu Glu Ser Arg Phe Thr Pro Gln Phe Leu Leu Gln Leu
245 250 255
Asn Glu Thr Ile Tyr Ala Ser Gly Lys Arg Ser Asn Thr Thr Gly Lys
260 265 270
Leu Ile Trp Lys Val Asn Pro Glu Ile Asp Thr Thr Ile Gly Glu Trp
275 280 285
Ala Phe Trp Glu Thr Lys Lys Asn Leu Thr Arg Lys Ile Arg Ser Glu
290 295 300
Glu Leu Ser Phe Thr Ala Val Ser Asn Gly Pro Lys Asn Ile Ser Gly
305 310 315 320
Gln Ser Pro Ala Arg Thr Ser Ser Asp Pro Glu Thr Asn Thr Thr Asn
325 330 335
Glu Asp His Lys Ile Met Ala Ser Glu Asn Ser Ser Ala Met Val Gln
340 345 350
Val His Ser Gln Gly Arg Lys Ala Ala Val Ser His Leu Thr Thr Leu
355 360 365
Ala Thr Ile Ser Thr Ser Pro Gln Pro Pro Thr Thr Lys Thr Gly Pro
370 375 380
Asp Asn Ser Thr His Asn Thr Pro Val Tyr Lys Leu Asp Ile Ser Glu
385 390 395 400
Ala Thr Gln Val Gly Gln His His Arg Arg Ala Asp Asn Asp Ser Thr
405 410 415
Ala Ser Asp Thr Pro Pro Ala Thr Thr Ala Ala Gly Pro Leu Lys Ala
420 425 430
Glu Asn Thr Asn Thr Ser Lys Ser Ala Asp Ser Leu Asp Leu Ala Thr
435 440 445
Thr Thr Ser Pro Gln Asn Tyr Ser Glu Thr Ala Gly Asn Asn Asn Thr
450 455 460
His His Gln Asp Thr Gly Glu Glu Ser Ala Ser Ser Gly Lys Leu Gly
465 470 475 480
Leu Ile Thr Asn Thr Ile Ala Gly Val Ala Gly Leu Ile Thr Gly Gly
485 490 495
Arg Arg Thr Arg Arg Glu Val Ile Val Asn Ala Gln Pro Lys Cys Asn
500 505 510
Pro Asn Leu His Tyr Trp Thr Thr Gln Asp Glu Gly Ala Ala Ile Gly
515 520 525
Leu Ala Trp Ile Pro Tyr Phe Gly Pro Ala Ala Glu Gly Ile Tyr Thr
530 535 540
Glu Gly Leu Met His Asn Gln Asp Gly Leu Ile Cys Gly Leu Arg Gln
545 550 555 560
Leu Ala Asn Glu Thr Thr Gln Ala Leu Gln Leu Phe Leu Arg Ala Thr
565 570 575
Thr Glu Leu Arg Thr Phe Ser Ile Leu Asn Arg Lys Ala Ile Asp Phe
580 585 590
Leu Leu Gln Arg Trp Gly Gly Thr Cys His Ile Leu Gly Pro Asp Cys
595 600 605
Cys Ile Glu Pro His Asp Trp Thr Lys Asn Ile Thr Asp Lys Ile Asp
610 615 620
Gln Ile Ile His Asp Phe Val Asp Lys Thr Leu Pro Asp Gln Gly Asp
625 630 635 640
Asn Asp Asn Trp Trp Thr Gly Trp Arg Gln Trp Ile Pro Ala Gly Ile
645 650 655
Gly Val Thr Gly Val Ile Ile Ala Val Ile Ala Leu Phe Cys Ile Cys
660 665 670
Lys Phe Val Phe
675
<210> 29
<211> 644
<212> БЕЛОК
<213> вирус Эбола
<400> 29
Ile Pro Leu Gly Val Ile His Asn Ser Thr Leu Gln Val Ser Asp Val
1 5 10 15
Asp Lys Leu Val Cys Arg Asp Lys Leu Ser Ser Thr Asn Gln Leu Arg
20 25 30
Ser Val Gly Leu Asn Leu Glu Gly Asn Gly Val Ala Thr Asp Val Pro
35 40 45
Ser Val Thr Lys Arg Trp Gly Phe Arg Ser Gly Val Pro Pro Lys Val
50 55 60
Val Asn Tyr Glu Ala Gly Glu Trp Ala Glu Asn Cys Tyr Asn Leu Glu
65 70 75 80
Ile Lys Lys Pro Asp Gly Ser Glu Cys Leu Pro Ala Ala Pro Asp Gly
85 90 95
Ile Arg Gly Phe Pro Arg Cys Arg Tyr Val His Lys Val Ser Gly Thr
100 105 110
Gly Pro Cys Ala Gly Asp Phe Ala Phe His Lys Glu Gly Ala Phe Phe
115 120 125
Leu Tyr Asp Arg Leu Ala Ser Thr Val Ile Tyr Arg Gly Thr Thr Phe
130 135 140
Ala Glu Gly Val Val Ala Phe Leu Ile Leu Pro Gln Ala Lys Lys Asp
145 150 155 160
Phe Phe Ser Ser His Pro Leu Arg Glu Pro Val Asn Ala Thr Glu Asp
165 170 175
Pro Ser Ser Gly Tyr Tyr Ser Thr Thr Ile Arg Tyr Gln Ala Thr Gly
180 185 190
Phe Gly Thr Asn Glu Thr Glu Tyr Leu Phe Glu Val Asp Asn Leu Thr
195 200 205
Tyr Val Gln Leu Glu Ser Arg Phe Thr Pro Gln Phe Leu Leu Gln Leu
210 215 220
Asn Glu Thr Ile Tyr Ala Ser Gly Lys Arg Ser Asn Thr Thr Gly Lys
225 230 235 240
Leu Ile Trp Lys Val Asn Pro Glu Ile Asp Thr Thr Ile Gly Glu Trp
245 250 255
Ala Phe Trp Glu Thr Lys Lys Asn Leu Thr Arg Lys Ile Arg Ser Glu
260 265 270
Glu Leu Ser Phe Thr Ala Val Ser Asn Gly Pro Lys Asn Ile Ser Gly
275 280 285
Gln Ser Pro Ala Arg Thr Ser Ser Asp Pro Glu Thr Asn Thr Thr Asn
290 295 300
Glu Asp His Lys Ile Met Ala Ser Glu Asn Ser Ser Ala Met Val Gln
305 310 315 320
Val His Ser Gln Gly Arg Lys Ala Ala Val Ser His Leu Thr Thr Leu
325 330 335
Ala Thr Ile Ser Thr Ser Pro Gln Pro Pro Thr Thr Lys Thr Gly Pro
340 345 350
Asp Asn Ser Thr His Asn Thr Pro Val Tyr Lys Leu Asp Ile Ser Glu
355 360 365
Ala Thr Gln Val Gly Gln His His Arg Arg Ala Asp Asn Asp Ser Thr
370 375 380
Ala Ser Asp Thr Pro Pro Ala Thr Thr Ala Ala Gly Pro Leu Lys Ala
385 390 395 400
Glu Asn Thr Asn Thr Ser Lys Ser Ala Asp Ser Leu Asp Leu Ala Thr
405 410 415
Thr Thr Ser Pro Gln Asn Tyr Ser Glu Thr Ala Gly Asn Asn Asn Thr
420 425 430
His His Gln Asp Thr Gly Glu Glu Ser Ala Ser Ser Gly Lys Leu Gly
435 440 445
Leu Ile Thr Asn Thr Ile Ala Gly Val Ala Gly Leu Ile Thr Gly Gly
450 455 460
Arg Arg Thr Arg Arg Glu Val Ile Val Asn Ala Gln Pro Lys Cys Asn
465 470 475 480
Pro Asn Leu His Tyr Trp Thr Thr Gln Asp Glu Gly Ala Ala Ile Gly
485 490 495
Leu Ala Trp Ile Pro Tyr Phe Gly Pro Ala Ala Glu Gly Ile Tyr Thr
500 505 510
Glu Gly Leu Met His Asn Gln Asp Gly Leu Ile Cys Gly Leu Arg Gln
515 520 525
Leu Ala Asn Glu Thr Thr Gln Ala Leu Gln Leu Phe Leu Arg Ala Thr
530 535 540
Thr Glu Leu Arg Thr Phe Ser Ile Leu Asn Arg Lys Ala Ile Asp Phe
545 550 555 560
Leu Leu Gln Arg Trp Gly Gly Thr Cys His Ile Leu Gly Pro Asp Cys
565 570 575
Cys Ile Glu Pro His Asp Trp Thr Lys Asn Ile Thr Asp Lys Ile Asp
580 585 590
Gln Ile Ile His Asp Phe Val Asp Lys Thr Leu Pro Asp Gln Gly Asp
595 600 605
Asn Asp Asn Trp Trp Thr Gly Trp Arg Gln Trp Ile Pro Ala Gly Ile
610 615 620
Gly Val Thr Gly Val Ile Ile Ala Val Ile Ala Leu Phe Cys Ile Cys
625 630 635 640
Lys Phe Val Phe
<---
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая вакцинную композицию для индуцирования защитного иммунного ответа на вирус и способ предупреждения вирусной инфекции, предусматривающий введение вакцинной композиции, где вирус выбран из группы, состоящей из респираторно-синцитального вируса (RSV), вируса бешенства, вируса Эбола и вируса гриппа. В одном из вариантов реализации изобретения вакцинная композиция содержит в себе наночастицу, содержащую ядро, которое содержит неионный детергент, и ассоциированный с ядром вирусный гликопротеин, причем вирусный гликопротеин выбран из группы, состоящей из F-гликопротеина RSV, гликопротеина вируса Эбола, G-белка вируса бешенства, белка гемагглютинина (HA) вируса гриппа, белка нейраминидазы (NA) вируса гриппа и их комбинаций. Изобретение расширяет арсенал средств для индуцирования иммунного ответа на вирус. 2 н. и 21 з.п. ф-лы, 50 ил., 1 табл., 25 пр.

Комментарии