Адъювант на основе полиинозиновой кислоты - полицитидиловой кислоты - RU2383552C2
Код документа: RU2383552C2
Чертежи

Описание
Область, к которой относится изобретение
Изобретение в целом относится к адъювантным композициям и способам их применения при усилении иммунного ответа, конкретнее к соединениям, вакцинам и способам усиления иммуногенности антигена, а конкретнее к полинуклеотидным адъювантным композициям, вакцинам, включающим полинуклеотидные адъювантные композиции, и к способам применения указанных полинуклеотидных адъювантных композиций и вакцин для усиления иммунного ответа у хозяина.
Предпосылки изобретения
1. Описание предшествующего уровня техники
Иммунная система может проявлять как специфический, так и неспецифический иммунитет. В целом, В- и Т-лимфоциты, которые проявляют специфические рецепторы для данного антигена на их клеточной поверхности, обеспечивают специфический иммунитет. Иммунная система может реагировать на различные антигены двумя путями: 1) гуморально опосредованный иммунитет, который включает стимуляцию В-клеток и продукцию антител или иммуноглобулинов, представляющие антиген клетки (APCs) и Т-клетки хелперы (Th1 и Th2), и 2) клеточно-опосредованный иммунитет (CMI), который в целом вовлекает Т-клетки, включая цитотоксические Т-лимфоциты (CTLs), хотя в генерирование реакции CTL также вовлечены другие клетки (например, клетки Th1 и/или Th2 и APCs).
Неспецифический иммунитет охватывает различные клетки и механизмы, наряду с другими, такие как фагоцитоз (поглощение инородных частиц или антигенов) макрофагами или гранулоцитами и активность клеток-натуральных киллеров (NK). Неспецифический иммунитет основан на механизмах, менее эволюционно продвинутых, и не проявляет приобретенной природы специфичности и памяти, которые представляют собой иллюстративные вехи специфического иммунного ответа. Ключевые различия между специфическим и неспецифическим иммунитетом основаны на специфичности В- и Т-клеток. Эти клетки преимущественно приобретают свою реактивность после активации специфическим антигеном и имеют механизмы для проявления памяти в случае будущего контакта с этим специфическим антигеном. В результате вакцинация (вовлекающая специфичность и память) является эффективным протоколом для защиты против вредных патогенов.
Адъюванты в целом представляют собой соединения, которые при введении с антигеном (или смешанные с антигеном, или введенные перед введением антигена) усиливают или модифицируют иммунный ответ на этот определенный антиген.
Примеры адъювантов, которые использовались для усиления иммунного ответа, включают соединения алюминия (все в целом именуемые “Alum”), эмульсии масла в воде (полный адъювант Фрейнда (CFA) представляет собой эмульсию масла в воде, содержащую высушенные, убитые нагреванием организмы Mycobacterium tuberculosis), сапонин (выделенный из коры Quillaja Saponoria, адъювантно активный компонент, известный как Quile A), CpG ODN (синтетический олигодеоксинуклеотид, содержащий неметилированные динуклеотиды CpG), MPL (полученные из полисахарида Salmonella Minnesota Re595), липосомы (обычно изготовленные из биологически разлагаемых материалов, таких как фосфолипиды) и микрочастицы биологически разлагаемых полимеров (изготовленные из разнообразных полимеров, таких как PLGA, полифосфазен и полиангидриды). Оценивались адъювантные свойства этих соединений, причем каждый адъювант проявил преимущества и недостатки.
Самой большой проблемой применения адъювантов для человеческих вакцин, в частности для обычных детских вакцин, является токсичность и побочные эффекты большинства адъювантных препаративных форм. Применение новых технологий при разработке вакцин ведет к получению очищенных субъединичных и синтетических антигенов, которые имеют тенденцию к низкой иммуногенности. Разработка новых адъювантов для повышения иммуногенности/эффективности и снижения побочных эффектов представляет одну из главных проблем исследования и разработки вакцин.
Полинуклеотидные комплексы исследовали в плане их различных видов применения, включая действие в качестве адъювантов. Двухнитевые РНК ((dsRNAs) представляют собой очень активные биологические модификаторы, которые в наномолярных концентрациях могут оказывать глубокое влияние на клетки. Модулирующие эффекты dsRNA включают широкий спектр видов действия на молекулярном и клеточном уровне.
На молекулярном уровне dsRNAs могут вызвать биологические эффекты, такие как синтез интерферона, индукция протеин-киназы, усиление антигена тканевой совместимости и ингибирование метаболизма. А на клеточном уровне dsRNAs могут вызвать биологические эффекты, такие как пирогенность, митогенность, активация макрофагов, активация клеточно-опосредованного иммунитета и индукция противовирусного состояния. Один перспективный потенциал dsRNAs состоит в их иммуномодулирующем эффекте при способах противомикробного лечения. В патенте США № 4124702 раскрыто, что двухнитевые полинуклеотиды вызывали индукцию интерферона в клетках живых животных. В патенте США № 3906092 раскрыто, что реакция антител на вакцину адъювантного типа усиливалась включением в вакцину полинуклеотида или комплекса полинуклеотидов. Houston et al. установили PICLC (комплекс полиинозиновой кислоты, полицитидиловой кислоты, поли-L-лизинкарбоксиметилцеллюлозы) как сильнодействующий адъювант увеличением первичной реакции антител без содействия дополнительного адъюванта (Houston et al., Infection and Immunity, 14:318-9, 1976C). Было обнаружено, что миковирусная dsRNA значительно усиливает гемагглютинирующую реакцию антител на бараньи эритроциты (sRBC) (Wright and Adler-Moore, Biochemical and Biophysical Research Communications, 131:949-45, 1985).
Однако PIC (полиинозиновая кислота, полицитидиловая кислота) проявляет тяжелую токсичность при применении у животных. Например, Phillips et al. сообщили, что тяжелые токсические проявления были вызваны у собак после субхронического введения PIC в дозе 2,0 мг/кг. Токсичность характеризовалась сниженной спонтанной активностью, плохой координацией, рвотой, анорексией, потерей массы тела, гематологическими изменениями, отражающими сниженный гематопоэзиз, сниженной активностью щелочной фосфатазы и трансаминазы, дегенерацией тимуса, деструкцией костного мозга, расширением печеночных синусоидальных капилляров в центрально-долевых областях, некрозом клеток печени, коллапсом структур печени и генерализованным артритом (см. Phillips et al., Toxicology and Applied Pharmacology, 18:220-30, 1971).
PIC, один из наиболее изученных полинуклеотидных комплексов, был неэффективен при использовании у обезьян и людей ввиду его неустойчивости в организме после введения. Таким образом, PIC был модифицирован множественными путями для преодоления одного или другого недостатка. Например, комплекс полирибоинозиновой-полирибоцитидиловой кислоты с поли-L-лизингидробромидом примерно в 5-15 раз устойчивее к гидролизу панкреатической рибонуклеазой, чем материнский PIC. Другим примером является полиICLC dsRNA, или сокращенно PICLC, который, как было обнаружено, высоко эффективен в качестве противовирусного или противоопухолевого средства. PICLC представляет собой синтетическую dsRNA, составленную из нитей полирибоинозиновой и полирибоцитидиловой кислот (PIC). Хотя PICLC представляет собой перспективный иммуностимулятор, который имеет большой потенциал при способах противомикробного и противоракового лечения, было показано, что он вызывает серьезные побочные эффекты у людей, особенно при введении препарата во множественных, высоких дозах. Некоторые из отмеченных побочных эффектов включают лихорадку, гипотонию, лейкопению, миалгию, тромбоцитопению и полиартралгию. Присущую проблему токсичности необходимо преодолеть для придания PICLC безопасности с целью применения у людей. Кроме того, терапевтическая эффективность поли ICLC ограничена устойчивостью in vivo.
Противовирусное средство, состоящее из полиинозиновой кислоты-полицитидиловой кислоты (поли I:C), канамицина и кальция (Av-PICKCa), используется для лечения вирусных инфекций. Было показано, что Av-PICKCa способен индуцировать продукцию интерферона и интерлейкина-2. Av-PICKCa, введенный отдельно в качестве противовирусного препарата, стимулирует неспецифический иммунный ответ, т.е. стимулирует форму интерферона, которая не специфична для любого конкретного антигена. Эта противовирусная реакция глубоко отлична от специфического для антигена иммунного ответа, генерированного при введении адъюванта в сочетании с антигеном.
Важнее то, что автор настоящего изобретения обнаружил, что у Av-PICKCa были свойства адъюванта, т.е. способность вызывать специфический иммунный ответ при введении с антигеном. Далее, автор изобретения, кроме того, обнаружил, что Av-PICKCa был эффективным адъювантом при применении вместе с антигенами бешенства и геморрагической лихорадки.
Lin et al. описали, что Av-PICKCa можно применять в качестве адъюванта (Lin, et al., A new immunostimulatory complex (PICKCa) in experimental rabies: antiviral and adjuvant effects, Arch Virol, 131:307-19, 1993; и патент Китая № 93105862.7). В патенте Китая № 93105862.7 раскрыто применение общей композиции поли I:C, канамицина и кальция (PICKCa) в качестве адъюванта в вакцине для применения у людей и млекопитающих.
Образцы Av-PICKCa являются гетерогенными в отношении размера и массы молекул. Av-PICKCa описан в литературе с точки зрения среднего или диапазона величин коэффициента осаждения, по данным измерения Svedberg S. Противовирусный препарат Av-PICKCa существует в одном варианте осуществления от 5S до 8S (источник А), см. Zhung J.C., Research recollection of polyinosinic-polycytidylic acid (PIC). Доклад, представленный на 5-й Китайской конференции “fifth Chinese interferon conference in clinical application and theory”, Siam 1985, pp.23-28. В других вариантах осуществления Av-PICKCa существует с коэффициентом осаждения от 4S до 12S при среднем коэффициенте 6S (источник В) или от 5S до 12S при среднем коэффициенте 7S (источник С), или от 8S до 10S (источник D), см. Hu Q.G., Tianjin Av-PICKCa's laboratory research and clinical application, Fujian Medical Journal, 1983.12; (6) 28-30 and Hu Q.G. Chinese Medical and Pharmaceutical Industry Journal, 1983 (9) 3134.
Коэффициент осаждения этой гетерогенной коллекции молекул в Av-PICKCa можно перевести в эквивалентную молекулярную массу (мм в дальтонах) с использованием формулы перевода мм = 1,100×S2,2 Su B.X. et al.; Introduction of Biochemical Technology, 1st Edition, Zhongshan University, 1978, 356-357). Результаты перевода в дальтоны представлены ниже в таблице.
Оригинальное исследование Av-PICKCa в качестве адъюванта Lin et al. проводилось с образцом, имеющим молекулы, которые имели свойства, аналогичные источнику А, т.е. коэффициент осаждения от 5S до 8S, то есть эквивалентную молекулярную массу молекул в диапазоне от 38000 дальтон до 107000 дальтон (см. Lin et al. выше).
Считалось, что все формы PICKCa одинаково безопасны и эффективны при условии, что Av-PICKCa представляет собой по существу форму PICKCa, и, кроме того, при условии традиционного применения Av-PICKCa в качестве противовирусного препарата. Однако оказалось, что это не так. Исследование, проведенное автором изобретения, демонстрирует, что эффективность и токсичность PICKCa при использовании в качестве адъюванта в комбинации с антигеном, в действительности, варьируется в зависимости от различной молекулярной массы. Автор изобретения обнаружил, что Av-PICKCa не обеспечивает оптимальный профиль эффективности/безопасности для применения в качестве адъюванта и что PICKCa в определенных условиях вызывает неприемлемые, неблагоприятные побочные эффекты. Таким образом, остается потребность в адъюванте, который более подходит для применения у людей и который безопасен и эффективен при обеспечении желаемого иммуногенного эффекта. Настоящее изобретение направлено на эту потребность и предоставляет другие преимущества, которые будут очевидны при ссылке на подробное описание.
Литература
Интерес могут представлять следующие ссылки:
Патент Японии 1093540А2;
Патент США № 4124702;
Патент США № 3692899;
Патент США № 3906092;
Патент США № 4389395;
Патент США № 4349538;
Патент США № 4024241;
Патент США № 3952097;
Houston et al., Infection and Immunity, 14: 318-9, 1976C;
Wright and Adler-Moore, Biochemical and Biophysical Research Communications, 131: 949-45, 1985;
Phillips et al., Toxicology and Applied Pharmacology, 18: 220-30, 1971;
Lin, et al., A new immunostimulatory complex (PICKCa) in experimental rabies: antiviral and adjuvant effects, Arch Virol, 131: 307-19, 1993;
China Patent 93105862.7;
Zhung J.C., Research recollection of polyinosinic-polycytidylic acid (PIC). The paper of fifth Chinese interferon conference in clinical application and theory, Siam 1985, pp.23-28;
Hu Q.G., Tianjin Av-PICKCa's laboratory research and clinical application, Fujian Medical Journal, 1983,12; (6): 28-30;
Hu Q.G. Chinese Medical and Pharmaceutical Industry Journal, 1983 (9) 3134;
Su B.X. et al; Introduction of Biochemical Technology, 1st Edition, Zhongshan University, 1978, 356-357;
Gupta R.K. et al., Adjuvants - a balance between toxicity and adjuvanticity, Vaccine, 11:293-306, 1993;
Arnon, R. (Ed.) Synthetic Vaccines 1:83-92, CRC Press, Inc., Boca Raton, Fla., 1987;
Sela, M., Science 166:1365-1374 (1969);
Патент США № 6008200;
Ellouz et al., Biochem & Biophy. Res. Comm., 59:1317, 1974;
Патент США № 4094971;
Патент США № 4101536;
Патент США № 4153684;
Патент США № 4235771;
Патент США № 4323559;
Патент США № 4327085;
Патент США № 4185089;
Патент США № 4082736;
Патент США № 4369178;
Патент США № 4314998;
Патент США № 4082735;
Патент США № 4186194;
Патент США № 6468558;
New Trends and Developments in Vaccines, edited by Voller et al., University Park Press, Baltimore, Md., USA, 1978;
Klein, J., et al., Immunology (2nd), Blackwell Science Inc., Boston (1997);
Gupa R.K. and Siber G.R., Adjuvants for human vaccines-current status, problems and future prospects, Vaccine, 13 (14): 1263-1276, 1995;
Richard T., Kenney et al., Meeting Report - 2nd meeting on novel adjuvants currently in/close to human clinical testing, Vaccine 20 2155-2163, 2002;
Laboratory Techniques in Rabies Edited by F.X.Meslin, M.M.Kaplan, H.Koprowski 4th Edition ISBN 92 4 1544 1.
Краткое описание сущности изобретения
Настоящее изобретение относится к полинуклеотидной адъювантной композиции и способам ее применения при индукции иммунного ответа. Настоящее изобретение также относится к иммуногенной композиции, включающей композицию полинуклеотидного адъюванта вместе с антигеном (например, в качестве вакцины). Адъювантные композиции по изобретению имеют определенные физические свойства (например, молекулярную массу, размер, концентрацию и рН), которые направлены на удовлетворение потребности в эффективном и безопасном адъюванте для индукции усиленного иммунного ответа. Настоящее изобретение, кроме того, относится к способам применения таких адъювантных композиций, в частности, при индукции иммунного ответа на антигенное соединение.
В одном варианте осуществления изобретение относится к полинуклеотидной адъювантной композиции, включающей полирибоинозиновую-полирибоцитидиловую кислоту (PIC), антибиотик и положительный ион, где антибиотик может представлять собой канамицин, а положительный ион может представлять собой двухвалентный ион, такой как кальций. Настоящее изобретение также относится к иммуногенной композиции, включающей полинуклеотидную адъювантную композицию вместе с антигеном или вакциной.
Настоящее изобретение служит для углубления накопленных знаний путем определения новой композиции, которую можно безопасно и эффективно использовать в качестве адъюванта для усиления и/или модификации иммунного ответа у хозяина-животного или человека. Хотя в предшествующих описаниях демонстрируется применение противовирусного препарата Av-PICKCa для применения в качестве адъюванта, эта форма PICKCa, по наблюдениям, вызывала ограниченный специфический иммунный ответ при введении с антигеном. Кроме того, было обнаружено, что PICKCa в определенных условиях вызывает неприемлемые неблагоприятные побочные эффекты.
Настоящее изобретение направлено на решение этих проблем предоставлением адъювантной композиции, в целом именуемой здесь “PIKA”, которую можно наиболее эффективно и безопасно вводить в качестве адъюванта у животных, включая людей.
PIKA представляет собой композицию, включающую полинуклеотид, антибиотик и положительный ион, который был специально разработан в качестве адъюванта. В изобретение включены композиции, имеющие необычные свойства продукта, которые делают его наиболее подходящим для применения в качестве адъюванта в иммуногенной композиции, подлежащей введению животным и/или людям.
Конкретнее - настоящее изобретение относится к полинуклеотидной адъювантной композиции, включающей полинуклеотид, антибиотик и положительный ион, где полинуклеотид может представлять собой полирибоинозиновую-полирибоцитидиловую кислоту (PIC), антибиотик представляет собой канамицин, антрациклин, бутирозинсульфат, гентамицин, гигромицин, амикацин, дибекацин, небрамицин, метрзамид, неомицин, пуромицин, стрептомицин или стрептозоцин и ион представляет собой кальций, кадмий, литий, магний, церий, цезий, хром, кобальт, дейтерий, галлий, йод, железо или цинк.
Конкретнее - настоящее изобретение относится к спецификации, включающей молекулярную массу, концентрацию и рН, композиции, включающей полинуклеотид, антибиотик и положительный ион, которая направлена на удовлетворение потребности в безопасном адъюванте, который вызывает максимальный желаемый иммунный ответ.
Настоящее изобретение также относится к иммуногенной композиции, включающей полинуклеотидную адъювантную композицию и антиген или вакцину.
В определенных вариантах осуществления настоящее изобретение представлено в форме набора, включающего полинуклеотидный адъювант и иммуногенное соединение.
Кроме того, настоящее изобретение относится к способу усиления иммунного ответа на антигенное соединение введением хозяину иммуногенной композиции. Хозяин может представлять собой человека или животное. Введение можно осуществлять инъекцией, такой как внутримышечная, внутрибрюшинная, внутривенная или подкожная инъекция, или ингаляцией. В других вариантах осуществления иммуногенную композицию можно доставлять ректально, вагинально, интраназально, перорально, в глаза, местно, трансдермально или интрадермально.
Соответственно, настоящее изобретение относится к адъюванту и иммуногенной композиции, которую можно безопасно применять у людей и животных.
Соответственно, в одном аспекте изобретение характеризует полинуклеотидную адъювантную композицию, включающую полирибоинозиновую-полирибоцитидиловую кислоту (PIC), антибиотик и положительный ион, где композиция содержит молекулы адъюванта, гетерогенные по молекулярной массе, причем молекулярная масса составляет примерно от 66000 до 1200000 дальтон.
В родственных вариантах осуществления молекулы полинуклеотидной адъювантной композиции гетерогенны по молекулярной массе, причем молекулярная масса составляет примерно от 300000 до 1200000 дальтон, или примерно от 66000 до 660000 дальтон, или примерно от 300000 до 660000 дальтон, или примерно от 300000 до 2000000 дальтон, или примерно от 300000 до 4000000 дальтон, или примерно от 500000 до 1000000 дальтон, или примерно от 1000000 до 1500000, или примерно от 1500000 до 2000000 дальтон, или примерно от 2000000 до 2500000 дальтон, или примерно от 2500000 до 3000000 дальтон, или примерно от 3000000 до 3500000 дальтон, или примерно от 3500000 до 4000000 дальтон, или примерно от 4000000 до 4500000 дальтон, или примерно от 4500000 до 5000000 дальтон.
В родственных вариантах осуществления молекулы полинуклеотидной адъювантной композиции в композиции имеют среднюю молекулярную массу, равную или больше чем 150000 дальтон, или равную или больше чем 250000 дальтон, или равную или больше чем 350000 дальтон, или равную или больше чем 500000 дальтон, или равную или больше чем 650000 дальтон, или равную или больше чем 750000 дальтон, или равную или больше чем 1000000 дальтон, или равную или больше чем 1200000 дальтон, или равную или больше чем 1500000 дальтон, или равную или больше чем 2000000 дальтон.
Соответственно, в одном аспекте изобретение характеризует полинуклеотидную адъювантную композицию, включающую полирибоинозиновую-полирибоцитидиловую кислоту (PIC), антибиотик и положительный ион, где композиция содержит молекулы адъюванта, гетерогенные по размеру молекул, имеющих коэффициент осаждения в Svedbergs (сведбергах) (S) примерно от 6,43S до 24,03S.
В родственных вариантах осуществления молекулы полинуклеотидной адъювантной композиции гетерогенны по молекулярному размеру, причем молекулярный размер составляет примерно от 12,8S до 24,03S, или примерно от 6,43S до 18,31S, или примерно от 12,8S до 18,31S, или примерно от 12,8S до 30,31S, или примерно от 12,8S до 41,54S, или примерно от 13,5S до 18,31S, или примерно от 13,5S до 24,03S, или примерно от 16,14S до 22,12S, или примерно от 22,12S до 26,6S, или примерно от 26,6S до 30,31S, или примерно от 30,31S до 35,55S, или примерно от 33,55S до 36,45S, или примерно от 36,45S до 39,1S, или примерно от 39,1S до 41,54S, или примерно от 41,54S до 43,83S, или примерно от 43,83S до 45,95S.
В других родственных вариантах осуществления полинуклеотидная адъювантная композиция имеет средний коэффициент осаждения (в сведбергах) больше чем 9, или больше чем 12, или больше чем 13,5, или больше чем 15, или больше чем 16, или больше чем 17, или больше чем 18, или больше чем 19, или больше чем 20, или больше чем 21, или больше чем 22, или больше чем 25, или больше чем 30.
В родственном варианте осуществления антибиотик в композиции представляет собой канамицин, неомицин, антрациклин, бутирозин сульфат, гентамицин, гигромицин, амикацин, дибекацин, небрамицин, метрзамид, пуромицин, стрептомицин или стрептозоцин.
В еще одном родственном варианте осуществления адъювантная композиция, кроме того, включает источник ионов кальция.
В другом родственном варианте осуществления положительный ион в композиции представляет собой кальций, кадмий, литий, магний, церий, цезий, хром, кобальт, дейтерий, галлий, йод, железо или цинк. Положительный ион может быть представлен в форме неорганических солей или органических комплексов.
Источник ионов кальция может быть обеспечен, например, хлоридом кальция, карбонатом кальция, фторидом кальция, гидроксидом кальция, фосфатом кальция или сульфатом кальция.
В одном аспекте, представляющем особый интерес, изобретение относится к полинуклеотидной адъювантной композиции, включающей полирибоинозиновую-полирибоцитидиловую кислоту (PIC), канамицин и кальций, причем композиция включает молекулы адъюванта, гетерогенные по молекулярной массе, составляющей примерно от 66000 до 1200000 дальтон.
В родственных вариантах осуществления молекулы полирибоинозиновой-полирибоцитидиловой кислоты (PIC), канамицина и кальция имеют молекулярную массу примерно от 300000 до 1200000 дальтон, или примерно от 66000 до 660000 дальтон, или примерно от 300000 до 660000 дальтон, или примерно от 300000 до 2000000 дальтон, или примерно от 300000 до 4000000 дальтон, или примерно от 500000 до 1000000, или примерно от 1000000 до 1500000 дальтон, или примерно от 1500000 до 2000000 дальтон, или примерно от 2000000 до 2500000 дальтон, или примерно от 2500000 до 3000000 дальтон, или примерно от 3000000 до 3500000 дальтон, или примерно от 3500000 до 4000000 дальтон, или примерно от 4000000 до 4500000 дальтон, или примерно от 4500000 до 5000000 дальтон.
В других родственных вариантах осуществления молекулы полирибоинозиновой-полирибоцитидиловой кислоты (PIC), канамицина и кальция адъюванта, гетерогенного по молекулярной массе, имеют молекулярную массу, равную или больше чем 150000 дальтон, равную или больше чем 250000 дальтон, или равную или больше чем 350000 дальтон, или равную или больше чем 500000 дальтон, или равную или больше чем 650000 дальтон, или равную или больше чем 750000 дальтон, или равную или больше чем 1000000 дальтон, или равную или больше чем 1200000 дальтон, или равную или больше чем 1500000 дальтон, или равную или больше чем 2000000 дальтон.
В одном аспекте, представляющем особый интерес, изобретение относится к полинуклеотидной адъювантной композиции, включающей полирибоинозиновую-полирибоцитидиловую кислоту (PIC), канамицин и кальций, причем композиция включает молекулы адъюванта, гетерогенные по молекулярному размеру, имеющие коэффициент осаждения в Svedbergs (сведбергах) (S) примерно от 6,43S до 24,0S.
В родственных вариантах осуществления молекулы полинуклеотидной адъювантной композиции являются гетерогенными по молекулярному размеру, причем молекулярный размер составляет примерно от 12,8S до 24,03S, или примерно от 6,43S до 18,31S, или примерно от 12,8S до 18,31S, или примерно от 12,8S до 30,31S, или примерно от 12,8S до 41,54S, или примерно от 13,5S до 18,31S, или примерно от 13,5S до 24,03S, или примерно от 16,14S до 22,12S, или примерно от 22,12S до 26,6S, или примерно от 26,6S до 30,31S, или примерно от 30,31S до 3,55S, или примерно от 33,55S до 36,45S, или примерно от 36,45S до 39,1S, или примерно от 39,1S до 41,54S, или примерно от 41,54S до 43,83S, или примерно от 43,83S до 45,95S.
В других родственных вариантах осуществления полирибоинозиновая-полирибоцитидиловая кислота (PIC), канамицин и кальций имеют средний коэффициент осаждения больше чем 9, или больше чем 12, или больше чем 13,5, или больше чем 15, или больше чем 16, или больше чем 17, или больше чем 18, или больше чем 19, или больше чем 20, или больше чем 21, или больше чем 22, или больше чем 25, или больше чем 30.
В некоторых вариантах осуществления изобретение относится к полинуклеотидной адъювантной композиции, включающей полирибоинозиновую-полирибоцитидиловую кислоту (PIC), канамицин и кальций, причем может быть предпочтительно, чтобы из композиции были исключены молекулы, в частности, в такой степени, чтобы такие исключенные молекулы не оказывали значимого иммуногенного эффекта, причем исключенные молекулы имеют молекулярную массу примерно или меньше чем 30000 дальтон, примерно или меньше чем 40000 дальтон, примерно или меньше чем 50000 дальтон, примерно или меньше чем 60000 дальтон, примерно или меньше чем 70000 дальтон, примерно или меньше чем 80000 дальтон, примерно или меньше чем 90000 дальтон, примерно или меньше чем 100000 дальтон, примерно или меньше чем 150000 дальтон, примерно или меньше чем 200000 дальтон, примерно или меньше чем 300000 дальтон, примерно или меньше чем 350000 дальтон, примерно или меньше чем 400000 дальтон, примерно или меньше чем 450000 дальтон, примерно или меньше чем 500000 дальтон, примерно или меньше чем 600000 дальтон, примерно или меньше чем 700000 дальтон, примерно или меньше чем 800000 дальтон, примерно или меньше чем 900000 дальтон, примерно или меньше чем 1000000 дальтон.
В некоторых вариантах осуществления изобретение относится к полинуклеотидной адъювантной композиции, включающей полирибоинозиновую-полирибоцитидиловую кислоту (PIC), канамицин и кальций, причем может быть предпочтительно, чтобы из композиции были исключены молекулы, в частности, в такой степени, чтобы такие исключенные молекулы не оказывали значимого иммуногенного эффекта, причем исключенные молекулы имеют молекулярный размер примерно или меньше чем 4,49S, примерно или меньше чем 5,12S, примерно или меньше чем 5,67S, примерно или меньше чем 6,16S, примерно или меньше чем 6,6S, примерно или меньше чем 7,02S, примерно или меньше чем 7,4S, примерно или меньше чем 7,77S, примерно или меньше чем 9,34S, примерно или меньше чем 10,64S, примерно или меньше чем 11,78S, примерно или меньше чем 12,8S, примерно или меньше чем 13,73S, примерно или меньше чем 14,59S, примерно или меньше чем 15,39S, примерно или меньше чем 16,14S, примерно или меньше чем 17,54S, примерно или меньше чем 18,81S, примерно или меньше чем 19,99S, примерно или меньше чем 21,09S, примерно или меньше чем 22,12S.
В одном аспекте, представляющем особый интерес, изобретение относится к иммуногенной композиции для усиления антигенности антигенного соединения, включающего полинуклеотидную адъювантную композицию.
В родственных вариантах осуществления иммуногенная композиция включает полинуклеотидный адъювант и антиген.
В родственных вариантах осуществления источником антигена является человеческий антиген, антиген животного, отличного от человека, растительный антиген, бактериальный антиген, грибковый антиген, вирусный антиген, паразитарный антиген или раковый антиген.
В родственных вариантах осуществления иммуногенная композиция включает полинуклеотидную адъювантную композицию и антиген бешенства.
В определенных вариантах осуществления антигены могут быть очищены из натурального источника, синтезированы посредством твердофазного синтеза или могут быть получены посредством рекомбинантной генетики. Антиген может включать белковый фрагмент, включающий одну или более иммуногенных областей молекулы. Антигены могут также быть предоставлены цельными клетками или микроорганизмами (например, цельными вирусными частицами), которые могут быть живыми, ослабленными или усеченными, или убитыми.
В других вариантах осуществления антигены включают один или несколько антигенов из инфекционных агентов, растительного антигена, ракового антигена, аллергенных агентов и другой человеческий антиген, такой как для развития аутоиммунных заболеваний. В других вариантах осуществления антигены включают один или несколько инфекционных агентов из любого из вируса, бактерии, микобактерии, грибов и паразитов.
Полинуклеотидная адъювантная композиция по настоящему изобретению может также использоваться для усиления иммунного ответа против антигенов, продуцируемых применением вакцин ДНК. Последовательности ДНК в этих вакцинах, кодирующие антиген, могут быть или «голыми», или содержащимися в системе доставки, такой как липосомы.
В еще одних вариантах осуществления антиген бешенства выбран из вакцины человеческих диплоидных клеток (HDCV), или очищенной вакцины против бешенства, инактивированной почечными клетками хомячка (HKC-IPRV), или неочищенной вакцины против бешенства, инактивированной почечными клетками хомячка (HKC-ICRV), или очищенной вакцины против бешенства из клеток vero (PVRV), или очищенных клеток куриного эмбриона (РСЕС), или очищенной вакцины утиного эмбриона (PDEV), или очищенного антигена бешенства, инактивированного почечными клетками хомячка (HKC-IPRA), или неочищенного антигена бешенства, инактивированного почечными клетками хомячка (HKC-ICRA).
В одном аспекте, представляющем особый интерес, изобретение относится к иммуногенной композиции для усиления антигенности антигенного соединения, включающего полинуклеотидную адъювантную композицию, которая способна вызвать специфический для антигена клеточно-опосредованный иммунный ответ.
В одном аспекте, представляющем особый интерес, изобретение относится к иммуногенной композиции для усиления антигенности антигенного соединения, включающего полинуклеотидную адъювантную композицию, которая способна вызвать специфический для антигена В клеточный иммунный ответ.
В одном аспекте, представляющем особый интерес, изобретение предоставляет иммуногенную композицию для усиления антигенности антигенного соединения, включающего полинуклеотидную адъювантную композицию, которая способна вызвать комбинированный специфический для антигена Т- и В-клеточный иммунный ответ.
В одном аспекте, представляющем особый интерес, изобретение относится к иммуногенной композиции для усиления антигенности соединения, включающего полинуклеотидную адъювантную композицию и очищенный антиген бешенства, инактивированный почечными клетками хомячка, где присутствие антигена бешенства должно достигать минимального количества, такого как более чем 1 Международной Единицы (МЕ).
В родственных вариантах осуществления иммуногенная композиция включает полинуклеотидную адъювантную композицию и очищенный антиген бешенства, инактивированный почечными клетками хомячка, где присутствие антигена бешенства должно достигать минимального количества, такого как более чем 0,25 Международных Единиц, более чем 0,5 Международных Единиц, более чем 1,2 Международных Единиц, более чем 1,4 Международных Единиц, более чем 1,6 Международных Единиц, более чем 1,8 Международных Единиц, более чем 2,0 Международных Единиц, более чем 2,2 Международных Единиц, более чем 2,4 Международных Единиц, более чем 2,6 Международных Единиц, более чем 2,8 Международных Единиц, более чем 3,0 Международных Единиц, более чем 3,2 Международных Единиц, более чем 3,4 Международных Единиц, более чем 3,6 Международных Единиц, более чем 3,8 Международных Единиц или более чем 4,00 Международных Единиц.
В одном аспекте, представляющем особый интерес, изобретение относится к иммуногенной композиции для усиления антигенности соединения, включающего полинуклеотидную адъювантную композицию и очищенный антиген бешенства, инактивированный почечными клетками хомячка, где адъювант и антиген бешенства присутствуют в соотношении примерно 1:1.
В родственных вариантах осуществления иммуногенная композиция включает полинуклеотидную адъювантную композицию и очищенный антиген бешенства, инактивированный почечными клетками хомячка, где адъювант и антиген бешенства присутствуют в соотношении менее чем 1:10, примерно 1:9, примерно 1:8, примерно 1:7, примерно 1:5, примерно 1:4, примерно 1:3, примерно 1:2, примерно 2:1, примерно 3:1, примерно 4:1. примерно 5:1, примерно 6:1, примерно 7:1, примерно 8:1, примерно 9:1, примерно 10:1, более чем 10:1.
В одном аспекте, представляющем особый интерес, изобретение относится к адъювантной композиции или к иммуногенной композиции, где иммуногенная композиция или адъювантная композиция, содержащаяся в иммуногенной композиции, представлена в твердой или жидкой форме или в растворе, или в суспензии.
В одном аспекте, представляющем особый интерес, изобретение относится к адъювантной композиции или к иммуногенной композиции, включающей адъювантную композицию, где адъювантная композиция или иммуногенная композиция лиофилизирована.
В родственных вариантах осуществления изобретение относится к набору, включающему адъювантную композицию и антигенное соединение.
В одном аспекте, представляющем особый интерес, изобретение относится к применению полинуклеотидной адъювантной композиции для получения лекарственного средства для усиления иммуногенной реакции хозяина.
В одном аспекте, представляющем особый интерес, изобретение относится к способу усиления иммунных ответов на антигенное соединение, включающему введение хозяину иммуногенной композиции для усиления антигенности антигенного соединения, включающего полинуклеотидную адъювантную композицию.
В родственных вариантах осуществления способ введения хозяину иммуногенной композиции может осуществляться одним путем, выбранным из группы, включающей парентеральную инъекцию, внутримышечную инъекцию, внутрибрюшинную инъекцию, внутривенную инъекцию, подкожную инъекцию, ингаляцию, ректальную доставку, вагинальную доставку, интраназальную доставку, пероральную доставку, внутриглазную доставку, местную доставку, трансдермальную доставку или интрадермальную доставку.
В одном аспекте, представляющем особый интерес, изобретение относится к способу усиления иммунных ответов на антигенное соединение, включающему введение хозяину иммуногенной композиции для усиления антигенности антигенного соединения, включающего полинуклеотидную адъювантную композицию, где хозяин представляет собой человека.
В одном аспекте, представляющем особый интерес, изобретение относится к способу усиления иммунных ответов на антигенное соединение, включающему введение хозяину иммуногенной композиции для усиления антигенности антигенного соединения, включающего полинуклеотидную адъювантную композицию, где хозяин представляет собой животное.
Эти и другие признаки и преимущества изобретения станут очевидны из следующего подробного описания предпочтительных вариантов его осуществления в связи с сопровождающими чертежами.
Краткое описание чертежей
На фиг.1 показана относительная молекулярная масса для образцов Av-PICKCa и PIKA.
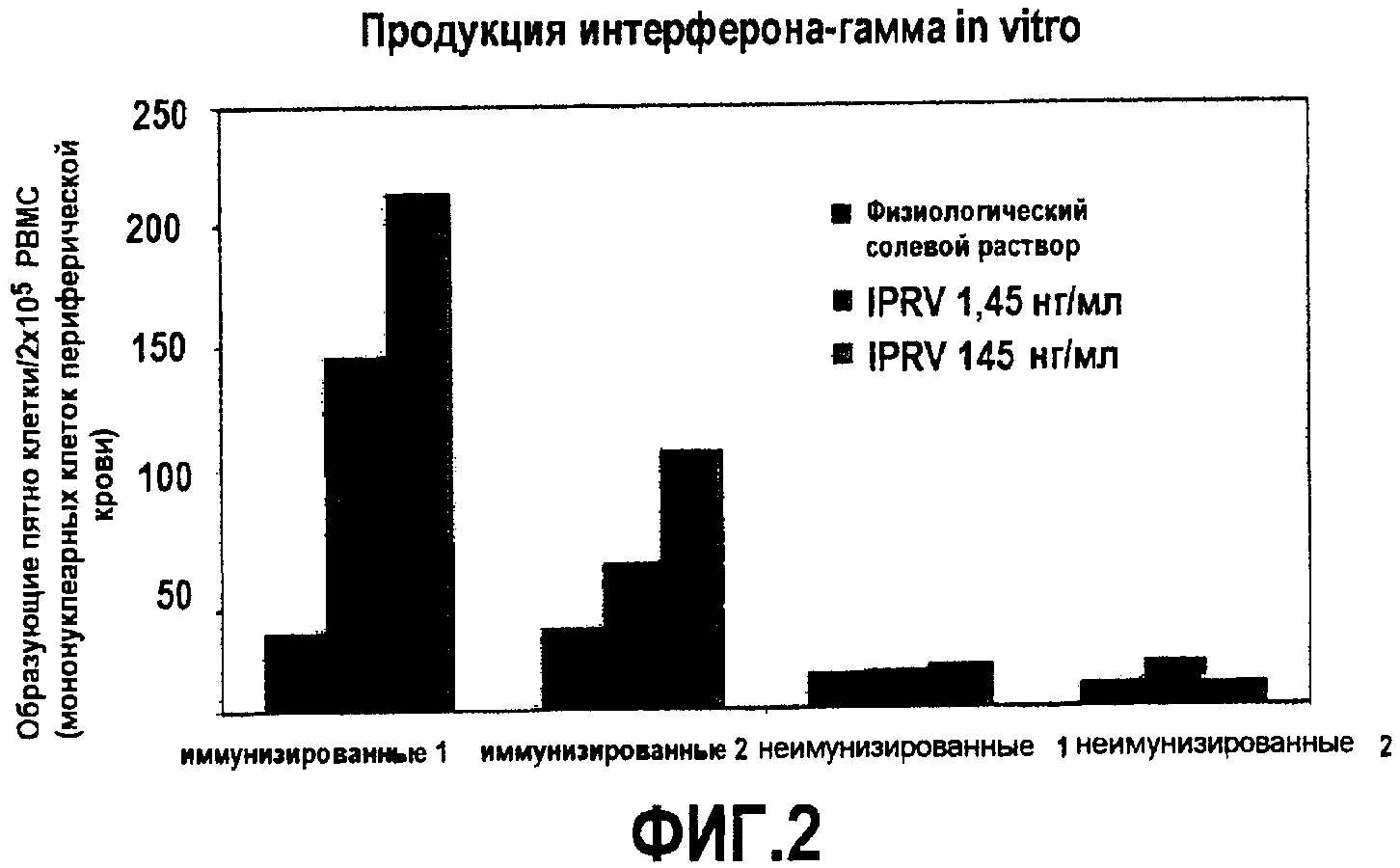
На фиг.2 показано, что PIKA вызывает зависимую от дозы продукцию специфического цитокина интерферона-гамма.
Подробное описание иллюстративных вариантов осуществления изобретения
Настоящее изобретение можно легче понять при ссылке на следующее подробное описание определенных вариантов осуществления изобретения и включенные сюда примеры.
По описанию при ссылке на публикации описания этих публикаций полностью включены сюда в качестве ссылки для более полного описания состояния области, к которой относится изобретение.
Перед дальнейшим описанием настоящего изобретения следует понимать, что это изобретение не ограничивается конкретными описанными вариантами осуществления, поскольку они, конечно, могут варьироваться. Следует также понимать, что используемая здесь терминология предназначена только для цели описания определенных вариантов осуществления, а не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничен только прилагаемой формулой изобретения.
При отсутствии других определений все используемые здесь технические и научные термины имеют такое же значение, которое обычно понятно среднему специалисту в данной области, к которой относится настоящее изобретение. Хотя при осуществлении или тестировании настоящего изобретения можно использовать любые способы и материалы, аналогичные или эквивалентные способам и материалам, описанным здесь, теперь описаны предпочтительные способы и материалы. Все указанные здесь публикации включены сюда в качестве ссылки для раскрытия и описания способов и/или материалов, в связи с которыми приведены эти ссылки.
Необходимо отметить, что пока в контексте нет других ясных указаний, используемые здесь и в прилагаемой формуле изобретения формы единственного числа неопределенного артикля, союза «и» и определенного артикля включают соответствующие формы множественного числа. Таким образом, например, ссылка на «текст» включает множество таких текстов, а ссылка на «сегмент» включает ссылку на один или несколько сегментов и их эквивалентов, известных специалистам в данной области, и т.д. Кроме того, отмечается, что формула изобретения может быть составлена с исключением любого необязательного элемента. Само указание предназначено служить в качестве предшествующей основы для использования такой исключительной терминологии как «исключительно», «только» и им подобной в связи со ссылкой на элементы пунктов формулы, или использования «отрицательного» ограничения.
Определение терминов
Перед изложением деталей настоящего изобретения может быть полезно для их понимания изложение определений нескольких терминов, которые используются в настоящем описании.
Используемый здесь термин «адъювант» относится к любому веществу или смеси веществ, которое увеличивает или диверсифицирует иммунный ответ хозяина на антигенное соединение. В частности:
1. Термин “PICKCa” в целом относится к композиции поли I:C, канамицина и кальция, независимо от определенных физических и иммуногенных свойств.
2. Термин “Av-PICKCa” относится к форме PICKCa, промышленно используемой в качестве противовирусного лекарственного препарата.
3. Термин “PIKA” относится к композиции по изобретению, включающей поли I:C, антибиотик (например, канамицин) и положительный ион (например, кальций), где PIKA характеризуется физическими характеристиками (например, молекулярной массой, размером и им подобными, как описано здесь), так что после введения PIKA проявляет характеристики адъюванта со сниженными неблагоприятными побочными эффектами (например, сниженной токсичностью) относительно, например, PICKCa и большей активностью (например, стимулирует усиленный иммунный ответ) относительно, например, Av-PICKCa.
«Молекула, содержащая PIC» или «соединение, содержащее PIC», относится без ограничения к PIC, который может необязательно образовывать комплексы или иным образом комбинироваться, по меньшей мере, с одним или с обоими из антибиотика (например, канамицина) и положительного иона (например, кальция), присутствующего в композиции, содержащей молекулу, содержащую PIC.
Термин «гетерогенная», используемый в контексте адъювантных композиций по изобретению, указывает, что компоненты композиции, например молекулы, содержащие PIC, неоднородны в отношении физических характеристик молекулярной массы, размера или их обеих.
Термин «животное» включает людей и всех домашних и диких животных и птицу, включая без ограничения крупный рогатый скот, лошадей, коров, свиней, овец, коз, собак, кошек, кроликов, оленей, норок, кур, уток, гусей, индюшек, куропаток и им подобных.
Термин «антитело» включает поликлональные и моноклональные антитела, а также фрагменты таких антител, связывающие антигенное соединение, включая фрагменты Fab, F(ab')2, Fd, Fv и их одноцепочечные производные. Кроме того, термин «антитело» включает естественно встречающиеся антитела, а также неестественно встречающиеся антитела, включая, например, химерные, бифункциональные и гуманизированные антитела, и родственные синтетические изоформы.
Используемый здесь термин «антигенное соединение» относится к любому веществу, которое может распознать иммунная система (например, к связанному антителом или обработанному таким образом, чтобы вызвать клеточный иммунный ответ в соответствующих условиях).
«Антиген» относится к веществу, включая композиции в форме вакцины, где сама вакцина включает антигенное соединение, и может включать или не включать адъювант, отличный от PIKA, который при введении соответствующим путем (например, парентерально) вызывает иммунный ответ, например образование антител, включая антитела, которые специфически связывают антиген. 2 отличительных признака антигенов представляют собой иммуногенность, то есть их способность вызывать иммунный ответ in vivo, и их антигенность, то есть их способность быть селективно распознанными антителами, происходящими из антигенов.
Термины «клеточно опосредованный иммунитет» и «клеточно опосредованный иммунный ответ» предназначены для обозначения иммунологической защиты, обеспечиваемой лимфоцитами, такой как защита, обеспечиваемая Т-клеточными лимфоцитами, когда они вступают в контакт с их клетками-жертвами. Клеточно опосредованный иммунный ответ обычно включает пролиферацию лимфоцитов. При измерении «пролиферации лимфоцитов» измеряется способность лимфоцитов пролиферировать в ответ на специфический антиген. Пролиферация лимфоцитов предназначена для обозначения пролиферации В-клеток, Т-хелперных клеток или цитотоксических Т-лимфоцитов (CTL).
«Эффективное количество антигенного соединения» относится к количеству антигенного соединения, которое, в необязательной комбинации с адъювантом, вызовет у пациента продукцию специфической иммунологической реакции на антигенное соединение.
Выражение «усиленный иммунный ответ» или аналогичное ему означает, что иммунный ответ повышен, улучшен или усилен в интересах хозяина относительно предшествующего статуса иммунного ответа, например, перед введением иммуногенной композиции по изобретению.
Термины «гуморальный иммунитет» и «гуморальный иммунный ответ» относятся к форме иммунитета, в которой молекулы антитела продуцируются в ответ на антигенную стимуляцию.
Термин «иммунный ответ» относится к любой реакции иммунной системы позвоночного индивидуума на антигенное соединение. Иллюстративные иммунные ответы включают без ограничения клеточный, а также местный и системный гуморальный иммунитет, такой как реакции CTL, включая специфическую для антигена индукцию реакций CD8+ CTL, хелперных Т-клеток, включая Т-клеточные пролиферативные реакции и высвобождение цитокина, и В-клеточные реакции, включая Т-клеточные пролиферативные реакции и высвобождение цитокина, и В-клеточные реакции, включая реакцию антител.
Термин «вызов иммунного ответа» используется здесь в целом для охвата индукции и/или потенцирования иммунного ответа.
Термин «индукция иммунного ответа» относится к иммунному ответу, который стимулирован, инициирован или вызван.
Термин «потенцирование иммунного ответа» относится к ранее существовавшему иммунному ответу, который улучшен, получил содействие, усилен, повышен, увеличен или продлен.
Термин «поли I:C» или «PIC» относится к композиции, содержащей полирибоинозиновую и полирибоцитидиловую нуклеиновые кислоты, которые могут также именоваться соответственно полиинозиновой кислотой-полицитидиловой кислотой.
Термин «иммуногенное количество» относится к количеству антигенного соединения, достаточному для стимуляции иммунного ответа при введении с композицией по изобретению по сравнению с иммунным ответом, наблюдаемым в отсутствие полинуклеотидного адъюванта.
Термин «иммунопотенцирующее количество» относится к количеству адъюванта, необходимому для осуществления увеличения титра антител и/или клеточно-опосредованного иммунитета при введении с антигенным соединением в композиции по изобретению по сравнению с увеличением уровня опосредованного антителами и/или клеточно-опосредованного иммунитета, наблюдавшегося в отсутствие полинуклеотидного адъюванта.
Используемый здесь термин «смешивание» включает любой способ, используемый для объединения компонентов композиции; такие способы включают без ограничения смешивание, распределение, растворение, эмульгирование, коагулирование, суспендирование или другое физическое объединение компонентов композиции.
«Фармацевтически приемлемая соль» соединения означает соль, которая фармацевтически приемлема и которая обладает желаемой фармакологической активностью материнского соединения. Такие соли включают: (1) кислотно-аддитивные соли, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и им подобные; или образованные с органическими кислотами, такими как уксусная кислота, пропионовая кислота, гексаноевая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, циннамовая кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, глюкогептоновая кислота, 4,4'-метиленбис-(3-гидрокси-2-ен-1-карбоновая кислота); 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтоевая кислота, салициловая кислота, стеариновая кислота, муконовая кислота и им подобные; или (2) соли, образованные, когда кислотная протонная часть в материнском соединении или замещена ионом металла, например ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия; или координируется с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и им подобные.
Термин «лечение» охватывает любое лечение заболевания у позвоночного животного, в частности человека, и включает: (i) предотвращение возникновения заболевания у пациента, который может быть предрасположен к заболеванию, но у которого еще оно не было диагностировано; (ii) ингибирование заболевания, т.е. остановку развития; или (iii) облегчение заболевания, т.е. вызывание обратного развития заболевания.
Используемый здесь термин «стандартная лекарственная форма» относится к физически дискретным единицам, подходящим в качестве унитарных дозировок для индивидуумов-людей и животных, причем каждая единица содержит заданное количество соединений по настоящему изобретению, рассчитанное в количестве, достаточном для оказания желаемого эффекта, в сочетании с фармацевтически/физиологически приемлемым разбавителем, носителем или основой.
Рассмотрение изобретения
Настоящее изобретение направлено на соединения и способы, которые можно использовать для усиления иммунного ответа, который может быть гуморальным и/или клеточно-опосредованным, у человека, животного или клеточной культуры. В целом, композиция состоит из иммуногенной композиции, содержащей адъювант. Присутствие адъюванта усиливает или модифицирует иммунный ответ. Таким образом, гуморальные и/или клеточно-опосредованные иммунные ответы более эффективны в присутствии адъюванта. Кроме того, адъювант может изменять качество иммунного ответа воздействием на подклассы (изотипы) иммуноглобулинов и продуцируемых цитокинов. Ключевые характеристики адъюванта представляют собой его способность стимулировать желаемый уровень и тип иммунного ответа, не вызывая неблагоприятных побочных эффектов. В настоящее время имеется лишь ограниченное количество адъювантов, утвержденных для применения у людей, которые имеют такую комбинацию характеристик. Стандарты безопасности для иммуногенных веществ и, в частности, вакцин являются жесткими и строго соблюдаемыми. Поэтому существенным сдерживающим фактором для разработки успешного адъюванта является разработка продукта, который является достаточно сильнодействующим с тем, чтобы вызвать соответствующий иммунный ответ, в то же самое время не вызывая неблагоприятных побочных эффектов.
Предпочтительный вариант осуществления изобретения представляет собой полинуклеотидный адъювант, где полинуклеотид представляет собой полирибоинозиновую-полирибоцитидиловую кислоту (PIC). Было показано, что одна PIC является эффективным адъювантом, но проявляет неприемлемый профиль безопасности и неустойчива у людей и приматов. Настоящее изобретение относится к композиции PIC в комбинации с антибиотиком и положительным ионом, который усиливает желаемые иммуногенные атрибуты адъюванта, в то же самое время улучшая профиль безопасности и устойчивости.
Настоящее изобретение, кроме того, основано на открытии того, что физические и биологические характеристики молекул PIKA адъювантной композиции влияют на характеристики иммунного ответа и неблагоприятные побочные эффекты. В ходе научных исследований неожиданно было обнаружено, что подбором определенных характеристик полинуклеотидного адъюванта он становится более или менее сильнодействующим и/или более или менее токсичным путями, которые далее описаны ниже. Поэтому путем определения композиции адъюванта с точки зрения ее физических характеристик можно точнее описать атрибуты адъювантной композиции, которая обеспечивает предпочтительную иммуногенную реакцию и предпочтительный профиль безопасности/устойчивости.
Адъювант по настоящему изобретению, для удобства именуемый здесь адъювант PIKA, поэтому полностью определяется комбинацией его химической композиции плюс фундаментальные физические атрибуты молекул, которые составляют адъювант. Таким образом, определенная форма PIKA, которая проявляет значимо превосходящие иммуногенные свойства, в то же самое время, будучи безопасной для использования у животных и людей, наилучшим образом определяется одним или более, обычно, комбинацией определенных атрибутов, включающих: состав, молекулярную массу, размер молекул и рН.
PIKA в целом включает полинуклеотид, антибиотик и положительный ион, где полинуклеотид может представлять собой полирибоинозиновую-полирибоцитидиловую кислоту (PIC), а антибиотик - аминогликозид (например, канамицин, стрептомицин, тобрамицин), неомицин, антрациклин, бутирозин сульфат, гентамицин, гигромицин, амикацин, дибекацин, небрамицин, метрзамид, пуромицин или стрептозоцин, а ион представляет собой кальций, кадмий, литий, магний, церий, цезий, хром, кобальт, дейтерий, галлий, йод, железо или цинк.
«Аминогликозидные» антибиотики относятся к антибиотикам, чья структура содержит аминосахара, присоединенные к аминоциклитоловому кольцу (гексозное ядро) гликозидными связями. Аминогликозидные антибиотики получают из различных видов Streptomyces и Micromonospora или получают синтетически. Например, канамицин представляет собой аминогликозидный антибиотик, полученный из почвенной бактерии Streptomyces Kanamycetics, используемый при лечении различных инфекций, особенно инфекций, вызванных грамотрицательными бактериями.
Композиция PIKA изготавливается посредством смешивания полиинозиновой кислоты, полицитидиловой кислоты, антибиотика и источника положительного иона в растворе хлорида натрия/фосфатного буфера, который имеет рН от рН 6 до рН 8. Полиинозиновая кислота и полицитидиловая кислота в целом предоставляются в концентрации от 0,1 до 10 мг/мл, предпочтительно, от 0,5 до 5 мг/мл, а предпочтительнее, от 0,5 до 2,5 мг/мл. Величина гиперхромности должна быть более чем 10%, предпочтительно, больше чем 15%, а предпочтительнее, больше чем 20%. Получение PIC и объединение с канамицином и кальцием предпочтительно проводится в соответствии со стандартами качества, согласующимися с Международными нормами должного процесса изготовления.
В некоторых вариантах осуществления настоящего изобретения канамицин в полинуклеотидной адъювантной композиции может использоваться вместе или замещаться одним или более антибиотиков, выбранных из группы, включающей тобрамицин, антрациклины, бутирозинсульфат, гентамицины, гигромицин, амикацин, дибекацин, небрамицин, метрзамид, неомицин, пуромицин, стрептомицин и стрептозоцин. Антибиотик (например, канамицин или ему подобный) в полинуклеотидной адъювантной композиции по изобретению в целом обеспечивается в концентрации примерно от 10 до 100000 единиц/мл, предпочтительно, примерно от 100 до 100000 единиц/мл, предпочтительнее, примерно от 500 до 5000 единиц/мл.
В некоторых вариантах осуществления настоящего изобретения полинуклеотидная адъювантная композиция, кроме того, включает положительный ион (катион), обычно двухвалентный катион, типично, катион щелочного металла. Положительный ион в целом обеспечивается в композиции по изобретению в качестве источника положительных ионов, такого как соль или комплекс, органическая или неорганическая соль или комплекс, обычно неорганическая соль или органический комплекс. Примеры положительных ионов включают без обязательного исключения кальций, кадмий, литий, магний, церий, цезий, хром, кобальт, дейтерий, галлий, йод, железо или цинк.
Положительный ион (например, кальций) может присутствовать в композиции по изобретению в концентрации в диапазоне примерно от 10 мкмоль до 10 ммоль/мл, предпочтительно, примерно от 50 мкмоль до 5 ммоль/мл, а предпочтительнее, примерно от 100 мкмоль до 1 ммоль/мл.
Как отмечено выше, положительный ион может быть в форме любой подходящей соли или органического комплекса, включая без обязательного ограничения хлорид, фторид, гидроксид, фосфат или сульфат. Например, когда положительный ион представляет собой кальций, то ион может быть в форме карбоната кальция, хлорида кальция, фторида кальция, гидроксида кальция, фосфата кальция или сульфата кальция.
Когда положительный ион в адъювантной композиции по изобретению представляет собой кальций, то он может быть в комбинации или замещен другими положительными ионами, включая кадмий, литий, магний, церий, цезий, хром, кобальт, дейтерий, галлий, йод, железо и цинк, причем ионы могут быть в форме неорганических солей или органических комплексов.
Полученная композиция далее трансформируется в PIKA посредством дополнительного способа изготовления, который включает выделение молекул определенного молекулярного размера и/или массы. Отделение молекул полинуклеотида с определенными характеристиками, используя фильтрацию, хроматографию, термическую обработку, центрифужное отделение, электрофорез и аналогичные методы, которые представляют собой стандартные способы, известные специалистам в данной области.
В некоторых вариантах осуществления настоящего изобретения полинуклеотидная адъювантная композиция, кроме того, определяется физической характеристикой молекулярной массы. В ходе исследования неожиданно было обнаружено, что существует положительная корреляция между молекулярной массой и эффективностью полинуклеотидной адъювантной композиции. Наблюдаемый уровень активности иммуногенной композиции, содержащей полинуклеотидную адъювантную композицию, включая способность вызывать продукцию иммуноглобулинов и цитокинов, увеличивается по мере увеличения молекулярной массы полинуклеотидной адъювантной композиции. Молекулярную массу полинуклеотидного адъюванта можно определить электрофорезом на агарозном геле, как описано в примере 1.
Как проиллюстрировано в разделе «Примеры» ниже, автор изобретения обнаружил, что вакцинные композиции, содержащие адъювант PIKA разнообразных молекулярных масс, проявляли прямую корреляцию между молекулярной массой и специфической для антигена защитной активностью (см. пример 2). Аналогичным образом автор изобретения обнаружил, что существует прямая корреляция между молекулярной массой адъювантных композиций PIKA и способностью вызывать продукцию интерферона-гамма при введении хозяину в комбинации с антигеном бешенства (см. пример 3).
Автор изобретения во время испытаний в 1996 г. у людей в Китае с использованием вакцины против бешенства с адъювантом, включающим PICKCa спецификации с особенно высокой молекулярной массой, кроме того, установил, что, как было показано, полученная композиция, к удивлению, имеет неприемлемый уровень неблагоприятных побочных эффектов. Результаты клинического испытания в 1996 г., которые ранее не были опубликованы, представлены в примере 4. Исследование молекулярной массы представлено в примерах 5 и 6. Испытание проводилось под юрисдикцией Китайской Администрации Пищевых Продуктов и Лекарственных Средств. Таким образом, адъювант не вводился бы людям в условиях контролируемого клинического испытания, если бы такие побочные эффекты предвиделись бы на основании имевшихся в то время представлений.
Автор изобретения обнаружил, что адъювантные композиции PIKA по изобретению в преклинических исследованиях при молекулярных массах до 1,0×106 и композициях вакцин, включающих адъювантные композиции PIKA с молекулярными массами до 5,5×105 продемонстрировали широкий предел безопасности в тестах специфической токсичности (см. пример 7). PIKA с максимальной молекулярной массой 1,2×106 была успешно использована в преклинических исследованиях (см. пример 3). Дальнейшее исследование, проведенное автором изобретения, демонстрирует безопасность PIKA при использовании в сочетании с соединением антигена в форме вакцины (см. пример 8).
Результаты последующего эксперимента, проведенного автором изобретения в Китае в 2002 г., также демонстрируют, что применение PIKA позволяет получить безопасный и эффективный адъювант для введения человеку. Результаты этого эксперимента, ранее не опубликованные, представлены в примере 9.
На основании представленных выше наблюдений предпочтительный вариант осуществления PIKA поэтому включает молекулы, имеющие физические характеристики молекулярной массы и/или размера, которые обеспечивают благоприятный эффект от увеличения активности и эффективности, в то же самое время обеспечивая адекватную степень пределов безопасности с тем, чтобы не вызывать каких-либо неблагоприятных побочных эффектов. Молекулы, присутствующие в нижней части интервала молекулярной массы Av-PICKCa, могут быть эффективны в качестве противовирусной композиции, но являются значительно менее эффективными, чем молекулярная композиция PIKA при использовании в качестве адъюванта в иммуногенной композиции. Кроме того, было показано, что PIKA имеет профиль безопасности, который предпочтительнее, чем у PICKCa.
Таким образом, один аспект настоящего изобретения представляет собой молекулярную массу PIKA композиции по изобретению.
Композиция PIKA по изобретению в целом включает коллекцию или популяцию молекул, причем молекулы имеют физические характеристики, например, молекулярной массы и/или размера, которые обеспечивают желаемый эффект индукции иммунного ответа, в то же самое время, предпочтительно, ослабляя или избегая неблагоприятных побочных эффектов (таких как эффекты, связанные с введением PICKCa). В целом, молекулы PIKA являются неоднородными по молекулярной массе и/или размеру.
В целом и пока нет других специальных указаний, используемый здесь термин «PIKA», адъювантная композиция по изобретению, включает PIC, которая может образовывать комплексы с антибиотиком (например, канамицином) и положительным ионом (например, кальцием). Молекулы в PIKA являются неоднородными по молекулярной массе (например, по данным оценки в дальтонах) или размеру (например, по данным оценки коэффициентом осаждения).
Когда для гетерогенной характеристики молекул PIKA используется диапазон (например, молекулярной массы или размера), ссылка здесь на такой диапазон указывает приблизительные нижние и верхние пределы величин молекулярной массы и размеров молекул PIKA в композиции, но не подразумевает и не предназначен для указания, что композиция содержит молекулу PIKA, которая имеет молекулярную массу или размер, которые являются репрезентативными для каждой молекулярной массы или размера в пределах этого диапазона. Таким образом, например, диапазон молекулярной массы примерно от 66000 до 1200000 дальтон указывает, что в композиции содержатся молекулы PIKA примерно от 66000 дальтон до 1200000 дальтон, но не требуется, чтобы в композиции присутствовали молекулы PIKA 88000 дальтон (хотя они, конечно, могут присутствовать).
Когда физические характеристики молекул PIKA в композиции по изобретению определяются диапазоном молекулярных масс, то молекулы PIKA являются гетерогенными по молекулярной массе, причем диапазон молекулярной массы составляет примерно от 300000 до 660000 дальтон, примерно от 300000 до 1200000 дальтон, примерно от 66000 до 660000 дальтон или примерно от 66000 до 1200000 дальтон.
Изобретение также относится к композициям, имеющим молекулы PIKA, гетерогенные по молекулярной массе, причем диапазон молекулярной массы составляет примерно от 300000 до 2000000 дальтон, примерно от 300000 до 4000000 дальтон, примерно от 500000 до 1000000 дальтон, примерно от 1000000 до 1500000 дальтон, примерно от 1500000 до 2000000 дальтон, примерно от 2000000 до 2500000 дальтон, примерно от 2500000 до 3000000 дальтон, примерно от 300000 до 3500000 дальтон, примерно от 3500000 до 4000000 дальтон, примерно от 4000000 до 4500000 дальтон или примерно от 4500000 до 5000000 дальтон. В композиции присутствуют молекулы PIKA, имеющие молекулярные массы у верхних и нижних пределов этих диапазонов, а также в пределах этих диапазонов.
Когда физические характеристики молекул PIKA в композиции по изобретению определяются средней молекулярной массой, то молекулы PIKA могут иметь среднюю молекулярную массу, равную или больше чем 150000 дальтон, равную или больше чем 250000 дальтон, равную или больше чем 350000 дальтон, равную или больше чем 500000 дальтон, равную или больше чем 650000 дальтон, равную или больше чем 750000 дальтон, равную или больше чем 1000000 дальтон, равную или больше чем 1200000 дальтон, равную или больше чем 1500000 дальтон, или равную или больше чем 2000000 дальтон.
Когда физические характеристики молекул PIKA в композиции по изобретению определяются коэффициентом осаждения, который представляет собой меру молекулярной массы и размера, молекулы PIKA могут иметь коэффициентом осаждения больше чем 9, или больше чем примерно 12, или больше чем примерно 13,5, или больше чем 15, или больше чем 16, или больше чем 17, или больше чем 18, или больше чем 19, или больше чем 20, или больше чем 21, или больше чем 22, или больше чем 25, или больше чем 30.
В некоторых вариантах осуществления изобретение относится к полинуклеотидной адъювантной композиции, включающей полирибоинозиновую-полирибоцитидиловую кислоту (PIC), канамицин и кальций, где композиция исключает выявляемое количество молекул, которые имеют молекулярную массу примерно и ниже 30000 дальтон, примерно и ниже 40000 дальтон, примерно и ниже 50000 дальтон, примерно и ниже 60000 дальтон, примерно и ниже 70000 дальтон, примерно и ниже 80000 дальтон, примерно и ниже 90000 дальтон, примерно и ниже 100000 дальтон, примерно и ниже 150000 дальтон, примерно и ниже 200000 дальтон, примерно и ниже 250000 дальтон, примерно и ниже 300000 дальтон, примерно и ниже 350000 дальтон, примерно и ниже 400000 дальтон, примерно и ниже 450000 дальтон, примерно и ниже 500000 дальтон, примерно и ниже 600000 дальтон, примерно и ниже 700000 дальтон, примерно и ниже 800000 дальтон, примерно и ниже 900000 дальтон, или примерно и ниже 1000000 дальтон. В этом варианте осуществления особый интерес представляет исключение таких молекул с низкой молекулярной массой до такой степени, чтобы такие исключенные молекулы не оказывали значимого иммуногенного эффекта.
Автор изобретения показал, что PIKA, включающая молекулы с молекулярной массой до 1,0×106 дальтон, безопасна у животных при тестах специфической токсичности (см. пример 7). PIKA, включающая молекулы с молекулярной массой до 1,2×106 дальтон, безопасно применялась в преклинических исследованиях (см. пример 3). Было также показано, что PIKA безопасна при использовании в иммуногенной композиции (см. пример 8). Такая композиция PIKA обеспечивает благоприятные эффекты с точки зрения эффективности. PIKA, включающая молекулы с молекулярной массой до 6,6×105 дальтон, также вызывает эффективный иммунный ответ с более широким пределом безопасности при применении у людей и животных. Увеличение молекулярной массы самых маленьких присутствующих молекул до 6,6×105 дальтон, а предпочтительно, до 3,0×105 дальтон, повышает эффективность адъюванта, не нарушая стандартов безопасности.
Кроме того, было обнаружено, что концентрация полинуклеотидной адъювантной композиции может воздействовать на молекулярную массу молекул, содержащихся в композиции. Было показано, что молекулярная масса PICKCa увеличивается по мере увеличения концентрации адъювантной композиции (см. пример 5). Автор изобретения наблюдал, что увеличение концентрации полинуклеотидного адъюванта может привести к слипанию (или агрегации) молекул PICKCa, приводя к образованию молекул с большой молекулярной массой. Было показано, что этот процесс необратим. Таким образом, последующее разбавление полинуклеотидной адъювантной композиции в подходящей среде не приводит к снижению молекулярной массы молекул адъюванта. Как наблюдалось в примере 6, когда концентрированная крупномолекулярная форма полинуклеотидной адъювантной композиции комбинируется с антигеном бешенства, в результате получается композиция, которая сохраняет свой широкий диапазон молекулярной массы. Вакцина против бешенства, образованная таким путем, продемонстрировала неблагоприятные побочные эффекты в клинических испытаниях у людей (см. пример 4).
Композиция PIKA по изобретению может быть предоставлена в любом физиологически приемлемом буфере, который можно использовать здесь, но предпочтительны фосфатные буферы. Другие приемлемые буферы, такие как ацетатный, трис, бикарбонатный, карбонатный или им подобные, можно использовать в качестве заместителей фосфатных буферов.
рН водного компонента предпочтительно должен составлять от 4,0 до 10,0, хотя предпочтительно довести рН системы до интервала от 6 до 8,5, в котором рН значимо не снижает устойчивости других компонентов композиции и не является физиологически неподходящей в других аспектах. В некоторых вариантах осуществления изобретения водная часть иммуногенной композиции представляет собой забуференный солевой раствор. Когда эти композиции предназначены для парентерального введения, предпочтительно приготовить эти растворы так, чтобы тоничность, т.е. осмоляльность, была по существу такой же, как у обычных физиологических жидкостей, для предотвращения набухания после введения или быстрого всасывания композиции ввиду различной концентрации ионов между композицией и физиологическими жидкостями.
Количество забуференного солевого раствора, используемого в этих композициях, должно составлять то количество, которое необходимо для доведения величины композиции до единства. То есть количество забуференного солевого раствора, достаточное для получения 100%, смешивается с другими компонентами для доведения объема композиции до нужной величины.
В некоторых вариантах осуществления антигены могут быть очищены из натурального источника, синтезированы посредством твердофазного синтеза или могут быть получены посредством рекомбинантной генетики. Антиген может включать белковый фрагмент, включающий одну или более иммуногенных областей молекулы. Антиген может быть предоставлен цельными клетками или микроорганизмами (например, цельными вирусными частицами), которые могут быть живыми, ослабленными, усеченными или убитыми.
В других вариантах осуществления антигены включают один или более агентов из инфекционных агентов, растительный антиген, раковый антиген, аллергенные агенты и другой человеческий антиген, такой как для развития аутоиммунных заболеваний. В других вариантах осуществления антигены включают один или более инфекционных агентов из любого из вирусов, бактерий, микобактерий, грибов и паразитов.
Полинуклеотидную адъювантную композицию по настоящему изобретению можно также использовать для усиления иммунного ответа против антигенов, продуцируемых применением вакцин ДНК. Последовательности ДНК в этих вакцинах, кодирующие антиген, могут быть или «голыми», или содержаться в системе доставки, такой как липосомы.
В некоторых вариантах осуществления полинуклеотидную адъювантную композицию можно использовать в комбинации с вакцинами. Не имеет значения, содержит ли вакцина адъюванты или нет. Включенные классы вакцин представляют собой вакцины против инфекционных заболеваний, против рака, против аллергии, против аутоиммунных заболеваний и для иммуноконтрацепции.
Изобретение также относится к применению полинуклеотидного адъюванта по изобретению в комбинации с любым подходящим антигеном бешенства.
В некоторых вариантах осуществления антиген бешенства может представлять собой инактивированный неочищенный антиген бешенства, такой как неочищенный антиген бешенства, инактивированный почечными клетками хомячка (HKC-ICRA), или очищенный антиген бешенства, инактивированный почечными клетками хомячка (HKC-IPRA).
В некоторых вариантах осуществления полинуклеотидную адъювантную композицию можно использовать с вакциной против бешенства. Подходящие вакцины против бешенства имеются в продаже или в исследовательских разработках, включая инактивированные, субъединичные, рекомбинантные и пептидные вакцины, такие как вакцины человеческих диплоидных клеток (HDCV), или очищенная вакцина против бешенства, инактивированная почечными клетками хомячка (HKC-IPRV), или неочищенная вакцина против бешенства, инактивированная почечными клетками хомячка (HKC-ICRV), или очищенная вакцина против бешенства из клеток vero (PVRV), или очищенные клетки куриного эмбриона (РСЕС), или очищенная вакцина утиного эмбриона (PDEV). Однако не все вакцины против бешенства вызывают клеточно опосредованный иммунный ответ, который важен при иммунизации до и после контакта с патогеном. Когда полинуклеотидная адъювантная композиция (например, PIKA) вводится с вакциной против бешенства, то вызванные иммунные ответы включают: неспецифические реакции (например, увеличенные функции макрофагов), гуморальные реакции (например, увеличенная продукция специфических антител) и клеточно-опосредованные реакции (например, продукция цитокинов, включая интерферон и интерлейкин-2).
В некоторых вариантах осуществления изобретение относится к набору, включающему полинуклеотидный адъювант и иммуногенное соединение.
Иммуногенная композиция, включающая PIKA, способна вызвать специфический иммунный ответ двумя путями: i) гуморально опосредованным иммунитетом, который включает стимуляцию В-клеток и продукцию антител или иммуноглобулинов (другие клетки также вовлечены в генерирование реакции антител, например представляющие антиген клетки (APCs, включая макрофаги) и хелперные Т-клетки (Th1 и Th2)), и ii) клеточно опосредованный иммунитет, который в целом вовлекает Т-клетки, включая цитотоксические Т-лимфоциты (CTLs), хотя другие клетки также вовлечены в генерирование реакции CTL (например, клеток Th1 и/или Th2 и APCs). Способы оценки гуморального и/или клеточного ответа у индивидуума хорошо известны в данной области (см. примеры 10, 11, 12 и 13).
Кроме того, полинуклеотидная адъювантная композиция может изменять качество иммунного ответа воздействием на подклассы (изотипы) продуцируемых иммуноглобулинов (IgG1, IgG2, IgG3 и IgG4 для человеческих IgGs; IgG1, IgG2a, IgG2b и IgG3 для мышиных IgGs), а также их аффинитеты.
Ответ, регулируемый клетками Th1 у мышей, индуцирует IgG1, IgG2a, IgG2b и в меньшей степени IgG3, а также содействует клеточно опосредованному иммунному ответу на антиген. Если реакция IgG на антиген регулируется клетками типа Th2, то она преимущественно усилит продукцию IgG1 и IgA.
Тесты активности NIH (Национальных институтов здоровья) с использованием композиции адъюванта PIKA и инактивированного почечными клетками хомячка очищенного антигена бешенства показали, что иммуногенная активность композиции требует минимального присутствия антигена (см. пример 14). Активность композиции быстро возрастает относительно присутствия дополнительного антигена бешенства при избытке 1 МЕ антигена. Таким образом, наблюдалось, что скорость увеличения активности композиции была самой большой примерно при от 1,5 МЕ до 2,5 МЕ антигена бешенства, присутствующего в композиции. Тест активности NIH описан в документе: Laboratory Techniques in Rabies, Edited by F.X.Meslin, M.M.Kaplan, H.Koprowski, 4th Edition, ISBN 92 4 1544 1.
Тесты с использованием композиции адъюванта PIKA и инактивированного почечными клетками хомячка очищенного антигена бешенства показали, что иммуногенная активность композиции увеличивалась по мере того как количество присутствующего адъюванта превышало количество присутствующего антигена. Активность увеличивалась, когда увеличивалось отношение PIKA к инактивированному почечными клетками хомячка очищенному антигену бешенства, причем предпочтительное отношение составляет больше чем 3:1 (см. пример 15).
Изобретение предусматривает способы применения полинуклеотидного адъюванта по изобретению с антигеном, например, для того, чтобы вызывать у индивидуума специфический для антигена гуморальный ответ и/или специфический клеточный (например, Т-клеточный) ответ. Вызванный иммунный ответ может быть ответом на антиген у интактного индивидуума или может служить для усиления существующего иммунного ответа (например, как в агенте повторной иммунизации).
В некоторых вариантах осуществления адъювантная композиция PIKA и иммуногенная композиция, включающая адъювант PIKA и антигенное соединение, могут быть высушены замораживанием (лиофилизированы) для длительной устойчивости и хранения в твердой форме. Способ лиофилизации известен специалистам в данной области. Растворение иммуногенной композиции, содержащей PIKA и антигенное соединение, продемонстрировало длительное сохранение уровня эффективности (см. пример 16). Иммуногенную композицию можно получить в виде средства для инъекции, жидкого раствора, суспензии или эмульсии. Получение препаративных форм желаемой иммуногенной композиции в целом описано в документе New Trends and Developments in Vaccines, под редакцией Voller et al., University Park Press, Baltimore, Md., USA, 1978. Иммуногенную композицию по настоящему изобретению можно использовать в таких формах, как капсулы, жидкие растворы, эмульсии или суспензии. Предпочтительно, используется любой инертный носитель, такой как солевой раствор или солевой раствор с фосфатным буфером, или любой такой носитель, в котором соединения, используемые в способе по настоящему изобретению, имеют подходящие свойства растворимости для использования в способах по настоящему изобретению.
Иммуногенную композицию по настоящему изобретению можно вводить пациенту, используя разнообразные способы, известные в данной области. В некоторых вариантах осуществления иммуногенную композицию можно доставлять парентерально, инъекцией, такой как внутримышечная, внутрибрюшинная, внутривенная или подкожная инъекция, или путем ингаляции. В других вариантах осуществления иммуногенную композицию можно доставлять ректально, вагинально, интраназально, перорально, в глаза, местно, трансдермально или интрадермально. Когда способом введения является инъекция, то инкапсулированное антигенное соединение может оставаться в участке инъекции до 2 недель, таким образом обеспечивая депо антигена, которое обеспечит длительное высвобождение или пульсирующее высвобождение in vivo. Такая система доставки может обеспечить возможность получения иммуногенных препаративных форм, вводимых однократной инъекцией антигенных соединений, которые в противном случае потребовали бы множественных инъекций для вызова иммунного ответа.
Например, для парентерального введения в водном растворе раствор должен быть при необходимости подходящим образом забуферен, и жидкому разбавителю нужно сначала придать изотоничность достаточным количеством солевого раствора или глюкозы. Эти конкретные водные растворы особенно подходят для внутривенного и внутрибрюшинного введения. В этой связи стерильные водные среды, которые можно использовать, будут известны специалистам в данной области в свете настоящего описания. Примеры инъекционных сред, которые можно использовать в настоящем изобретении, включают буфер с диспергирующими агентами и/или консервантами или без них и пищевое масло, минеральное масло, масло печени трески, сквален, моно-, ди- или триглицерид и их смеси.
Точное требуемое количество таких композиций будет варьироваться от пациента к пациенту в зависимости от вида, возраста, массы и общего состояния пациента, тяжести заболевания, инфекции или состояния, которое подвергается лечению или профилактике, определенного используемого соединения, способа его введения и им подобных факторов. Средний специалист в данной области может определить соответствующее количество, используя лишь обычное экспериментирование с учетом изложенных здесь положений. После первоначального введения пациенты могут получать одну или несколько повторных иммунизаций через адекватные промежутки времени.
Приведенное выше описание в целом раскрывает настоящее изобретение. Следующие примеры помогут пониманию настоящего изобретения. Эти примеры описаны исключительно в целях иллюстрации и не предназначены для ограничения объема изобретения. В зависимости от обстоятельств или целесообразности предусмотрены изменения формы и замещение эквивалентов. Хотя здесь были использованы специфические термины, такие термины предназначены для использования в описательном смысле, а не в целях ограничения.
ПРИМЕРЫ
Пример 1
Определение молекулярной массы PIKA и Av-PICKCa
Этот пример иллюстрирует, как определялась молекулярная масса для адъюванта PIKA в сравнении с Av-PICKCa.
Электрофорез на агарозном геле известен специалистам в данной области, так что здесь описаны только особенности, присущие настоящему изобретению. Агарозный гель, использованный в настоящем изобретении, имел концентрацию 1,5% агарозы. Молекулярные маркеры представляли собой лестницы ДНК из 100 пар нуклеотидов от 100 пар нуклеотидов до 1000 пар нуклеотидов, соответствующие диапазону молекулярной массы от 6,6×104 до 6,6×105 дальтон. Нагружающие образцы представляли собой 4 мкл при 1 мг/мл. На фиг.1 показана репрезентативная картина результата образцов на агарозном геле в соответствии с положениями этого абзаца. Пять (5) различных испытанных серий проявили широкий диапазон распределения их молекулярных масс. Верхние пределы их молекулярных масс находились в диапазоне от 2,3×105 дальтон для Av-PICKCa до 5,28×105 дальтон для PIKA.
Пример 2
Иммунная эффективность PIKA в сравнении с Av-PICKCa
Этот пример демонстрирует различие между активностью Av-PICKCa с максимальной молекулярной массой 230000 дальтон и образцами PIKA с максимальной молекулярной массой до 528000 дальтон.
3 серии адъюванта PIKA с различной молекулярной массой и 1 серию с молекулами, имеющими молекулярную массу, соответствующую молекулярной массе Av-PICKCa, объединяли с очищенным антигеном бешенства, инактивированным почечными клетками хомячка (HKC-IPRA). Полученные композиции подвергали тесту эффективности NIH.
Тест NIH представляет собой строгое по условиям и экстенсивное сравнительное исследование между исследуемой вакциной против бешенства и стандартизированной вакциной против бешенства. Вакцинированных мышей инфицируют штаммом живого вируса бешенства и измеряют их выживание. Различным группам мышей вводят различные разведения вакцины против бешенства. Сравнение показателей выживаемости между группами мышей, подвергнутых воздействию экспериментальной и стандартизированной вакцин, определяет активность экспериментальной вакцины (Laboratory Techniques in Rabies, Edited by F.X.Meslin, M.M.Kaplan, H.Koprowski, 4th Edition, ISBN 92 4 1544 1).
Эффективность каждой комбинированной вакцины была нормализована в отношении стандарта некомбинированной вакцины, где эффективность необъединенной вакцины была обозначена как 1, а относительная эффективность была обозначена как количество раз, в которое эффективность комбинированной вакцины увеличилась по сравнению с некомбинированной вакциной. В таблице 1 суммированы результаты. Как видно из таблицы 1, чем выше молекулярная масса адъюванта PICKCa, тем выше эффективность увеличения титра вакцины против бешенства.
Пример 3
Сравнение продукции интерферона между PIKA и Av-PICKCa
Пример демонстрирует разность способности вызывать продукцию интерферона между образцами Av-PICKCa с максимальной молекулярной массой 230000 дальтон и образцами PIKA с максимальной молекулярной массой 1200000 дальтон.
2 серии PIKA с верхними пределами молекулярной массы 1,2×106 дальтон и 4,6×105 дальтон сравнивали с серией Av-PICKCa с верхним пределом молекулярной массы 2,3×105 дальтон.
Композиции PIKA и Av-PICKCa объединяли с очищенным антигеном бешенства, инактивированным почечными клетками хомячка (HKC-IPRA). Композиции инъецировали подкожно мышам. Через 2 ч у каждой мыши определяли присутствие интерферона. Общая процедура измерения уровня интерферона известна специалистам в данной области. Вкратце, в каждую лунку 96-луночной планшеты вносили клетки L929 в объеме 0,15 мл/лунку примерно с 30000 клеток. Через три (3) дня, когда клетки вырастали до слияния, в лунки добавляли образцы сывороток (0,1 мл/лунку) при разведении сывороток от 1:20 до 1:640. Для каждого разбавленного образца использовали 3 лунки. Лунки инкубировали в течение ночи при 37°С. Образцы сыворотки смывали. Частицы вируса везикулярного стоматита VSV использовали для выявления продукции интерферона. В таблице 2 показана продукция интерферона, вызванная смесями. Как видно из таблицы 2, чем выше молекулярная масса образцов PIKA, тем лучше индуцировалась продукция интерферона.
Пример 4
Клиническое испытание у людей 1996 г (с токсическими побочными эффектами)
Этот пример демонстрирует, что адъювант PICKCa при комбинации с вакциной генерирует неприемлемый уровень побочных эффектов при введении людям.
Целью исследования была оценка безопасности и иммунного ответа вакцины против бешенства, включающей адъювант PICKCa, в концентрации 11,95 мг/мл и с молярной массой 69700 (следует отметить, что в данном случае молярная масса не является эквивалентом дальтонам, см. пример 5) и неочищенный антиген бешенства, инактивированный почечными клетками хомячка (HKC-ICRA). Результаты и выводы указанного выше клинического испытания ранее не были опубликованы.
40 пациентов, участвовавших в испытании, были разделены на 2 группы по 20 человек. Каждая группа получала пять (5) доз по 2 мл, вводившихся внутримышечно в 1-й, 3-й, 7-й и 30-й дни. Одна группа получала антиген бешенства с адъювантом PICKCa, а другая группа получала антиген бешенства с адъювантом “alum”.
В целях безопасности контролировали температуру тела, местные и системные симптомы через 24 ч, 48 ч и 72 ч после каждой инъекции. При наблюдении выявлены следующие побочные эффекты.
Системные побочные эффекты включают: повышение температуры (1), сыпь (2), боль в суставах (2), лимфатический узел (1), отек гортани (1). Местные побочные эффекты включают: покраснение кожи в месте инъекции (6).
Последующие исследования, проведенные автором изобретения, определили связь наблюдавшихся побочных эффектов с молекулярной массой молекул в адъюванте (см. примеры 5 и 6).
Пример 5
Связь между концентрацией PICKCa и его молекулярной массой
Этот пример демонстрирует, что увеличение концентрации адъюванта PICKCa приводит к получению композиции с увеличенной молекулярной массой.
PICKCa может быть получен в различных концентрациях. Была высказана гипотеза, что PICKCa как комплекс полимеров может существовать в различных формах при его получении в различных концентрациях. Для этой цели использовали рассеивание лазерного света. Рассеивание лазерного света широко использовалось для определения средневзвешенной молекулярной массы (Mw) и радиуса вращения (Rg). Инструменты имеются в продаже, а способ известен специалистам в данной области. В таблице 4 показано, что наблюдавшаяся молекулярная масса PICKCa по рассеиванию лазерного света коррелировалась с его концентрацией.
Пример 6
Связь между предварительной концентрацией PICKCa и молекулярной массой вакцины
Этот пример демонстрирует корреляцию между увеличенной молекулярной массой адъюванта PICKCa и итоговой молекулярной массой композиции, которая включает адъювант PICKCa и неочищенный антиген бешенства, инактивированный почечными клетками хомячка.
Предполагалось также, что концентрация PICKCa перед объединением будет воздействовать на антигены в вакцинах. Образцы PICKCa объединяли с неочищенным антигеном бешенства, инактивированным почечными клетками хомячка. С этой целью использовали рассеивание лазерного света. Рассеивание лазерного света широко использовалось для определения средневзвешенной молекулярной массы (Mw) и радиуса вращения (Rg). Инструменты имеются в продаже, а способ известен специалистам в данной области. В таблице 5 показано, что увеличение концентраций PICKCa перед объединением привело к увеличению Mw вакцин против бешенства.
Пример 7
Тест токсичности PIKA
Этот пример демонстрирует характеристики безопасности адъюванта PIKA, когда имеется ограничение максимальной молекулярной массы.
Тест токсичности проводили в соответствии с положениями Национального Лекарственного Стандарта Китая (WSI-XG-050-2000). Вкратце, пяти (5) мышам с массой тела примерно 18-22 г внутривенно инъецировали 0,5 мл/мышь раствора хлорида натрия, содержащего 0,3 мг адъюванта PIKA, имеющего верхний предел молекулярной массы от примерно 525000 до примерно 1000000 дальтон. Мышей после инъекции наблюдали в течение 7 дней и взвешивали в конце периода наблюдения. В таблице 6 суммированы результаты, которые показали, что молекулярная масса адъюванта PIKA может достигать 1,0×106 дальтон без очевидной токсичности.
Пример 8
Исследование токсичности PIKA в вакцинной композиции
Целью этого эксперимента является обоснование безопасности адъюванта PIKA.
Адъювант PIKA (молекулярная масса от 66000 дальтон до 660000 дальтон) объединяли с очищенным антигеном, инактивированным почечными клетками хомячка (HKC-IPRA) в соотношении PIKA:HKC-IPRA 4:1.
Вакцинную композицию PIKA и HKC-IPRA сравнивали с имеющейся в продаже инактивированной очищенной вакциной против бешенства (IPRV), которая включала адъювант “alum”.
Мышам вводили пять (5) доз вакцинной композиции в 0-й день, 3-й день, 7-й день, 14-й день и 28-й день. Введенная доза была эквивалентна дозе, приблизительно в 300 раз превышает дозу для взрослого человека в условиях обычной схемы иммунизации людей против бешенства.
Результаты наблюдений токсичности представлены ниже в таблице 7.
Сделанный вывод состоит в том, что комбинация PIKA/HKC-IPRA безопаснее, чем имеющаяся в продаже IPRV.
Пример 9
Безопасное применение адъюванта PIKA у людей
В 2002 г. пятерых (5) добровольцев иммунизировали композицией PIKA (молекулярная масса от 66000 до 660000 дальтон) и очищенного антигена бешенства, инактивированного почечными клетками хомячка (HKC-IPRA). Добровольцам вводили вакцинную композицию в 0-й день, 3-й день, 7-й день, 14-й день и 30-й день.
Ни у одного из пациентов после каждой из вакцинаций не наблюдались местные или системные побочные эффекты.
Активность вакцины измеряли, используя стандартный тест NIH, с результатами, представленными в таблице 8 ниже.
Результаты указывают на то, что вакцинная композиция PIKA и HKC-IPRA индуцирует специфический иммунный ответ и вызывает продукцию защитных нейтрализующих антител.
Пример 10
Тест после воздействия антигена (клеточно-опосредованный иммунитет)
Тест после воздействия антигена представляет собой наиболее определенное доказательство того, что вакцина способна искоренить патогены из организма хозяина после инфекции. Как таковой, он указывает на клеточно-опосредованный иммунный ответ, индуцированный вакциной.
В тесте после воздействия антигена мышам инъецировали дикий штамм вируса бешенства и в последующем заражали: очищенным антигеном бешенства, инактивированным почечными клетками хомячка (HKC-IPRA), в комбинации с адъювантом PIKA (диапазон молекулярной массы от 1,65×105 до 1,2×106 дальтон), или HKC-IPRA в комбинации с адъювантом гидроксида алюминия (alum), имеющейся в продаже очищенной вакциной против бешенства из клеток vero (PVRV), или раствором фосфатного буфера (PBS). Результаты убедительно показывают, что адъювант PIKA улучшал показатели выживаемости, см. таблицу 9.
9.1 Смертность после лечения
9.2. Выживаемость после лечения
Мышей, инфицированных подкожной инъекцией живым вирусом бешенства, лечили вакциной через 6 ч, 1 день, 2 дня и 3 дня после инфекции.
Пример 11
Продукция интерферона-гамма при антиген-специфическом клеточно-опосредованном иммунном ответе
Продукция интерферона-гамма представляет собой показатель активности клеточно-опосредованного иммунитета.
В этом эксперименте образцы крови брали у двух включенных в испытание пациентов и двух контрольных индивидуумов. Пациентов-добровольцев вакцинировали вакциной против бешенства PIKA, которая содержала PIKA (диапазон молекулярной массы от 66000 до 660000 дальтон) и очищенный антиген бешенства, инактивированный почечными клетками хомячка (HKC-IPRA) за 2,5 г до взятия образцов крови.
Результаты на фиг.2 иллюстрируют значимое различие интерферона-гамма, продуцируемого у двоих включенных в испытание пациентов, при сравнении с контрольными индивидуумами.
Изолированные моноциты из образцов крови инкубировали с такой же HKC-IPRA, которую использовали в первоначальном испытании. После трех дней инкубации собирали бесклеточные надосадочные жидкости и интерферон-гамма в надосадочных жидкостях анализировали цитокин-специфическим ELISPOT (иммуноферментным спот-анализом). Наблюдали зависимый от дозы эффект.
Выводы по представленным выше наблюдениям следующие:
- вакцина против бешенства, которая включала адъювант PIKA по изобретению, способна индуцировать продукцию интерферона-гамма и, следовательно, вызывать клеточно-опосредованный иммунный ответ;
- реакция интерферона-гамма является специфической (т.е. в отличие от неспецифической реакции реакция была направлена на антиген бешенства). Если бы реакция интерферона-гамма была неспецифической, то не было бы изменения уровня продукции интерферона-гамма в крови вакцинированных пациентов по мере увеличения концентрации антигенного стимулятора.
Пример 12
Тест эффективности PIKA
Целью этого эксперимента является демонстрация способности PIKA вызывать продукцию интерферона-гамма и интерлейкина 12 (IL-12).
Образцы спленоцитов от нормальных здоровых мышей инкубировали в течение 3 дней в присутствии PIKA (диапазон молекулярной массы от 66000 до 660000) в чистой среде. В конце этого периода уровень цитокинов в надосадочных жидкостях анализировали тестами ELISA, специфичными для IL-12(p40) и интерферона-гамма. Результаты эксперимента представлены ниже в таблице 10.
Вывод из описанного выше эксперимента состоит в том, что PIKA вызывает зависимую от дозы продукцию интерферона-гамма и IL-12 цитокинов и, таким образом, вызывает клеточно-опосредованный иммунный ответ.
В еще одном эксперименте четырем (4) мышам вводили по 500 мкг/мышь PIKA (диапазон молекулярной массы от 66000 до 660000) внутрибрюшинной инъекцией. Раствор фосфатного буфера использовали в качестве отрицательного контрольного теста. Через 5 ч после инъекции брали образец крови и получали сыворотку. Уровень цитокинов в сыворотке анализировали тестами ELISA, специфичными для IL-12(p40) и интерферона-гамма. Результаты эксперимента представлены ниже в таблице 11.
Вывод из описанного выше эксперимента состоит в том, что PIKA эффективен при стимуляции клеточно-опосредованного иммунного ответа.
Пример 13
Применение PIKA с инактивированным очищенным антигеном бешенства из клеток vero
Целью этого эксперимента является оценка эффективности PIKA в комбинации с инактивированной очищенной вакциной против бешенства из клеток vero (PVRV).
PIKA с диапазоном молекулярной массы от 66000 до 660000 дальтон объединяли с PVRV для образования вакцины против бешенства. Тест NIH использовали для оценки активности полученной вакцинной композиции. Результаты представлены ниже в таблице 12.
Сделанный вывод состоит в том, что PIKA увеличивает активность инактивированной очищенной вакцины против бешенства из клеток vero.
Пример 14
Доза антигена
Этот эксперимент демонстрирует потребность в наличии минимального количества очищенного антигена бешенства, инактивированного почечными клетками хомячка (HKC-IPRA), присутствующего в композиции, вместе с адъювантом (диапазон молекулярной массы от 66000 до 660000 дальтон) запускать существенно повышенный уровень специфического иммунного ответа.
Увеличенные количества антигена бешенства добавляли к постоянному объему 0,1 мг адъюванта PIKA. Активность измеряли, используя стандартный тест активности вакцины против бешенства NIH. После прогнозируемого первоначального увеличения активности отчетливое и резкое увеличение наблюдалось перед тем, как активность выравнивалась, как ожидалось, при добавлении антигена (см. таблицу 13).
Маргинальное увеличение активности представляет собой увеличение активности вакцины HKC-IPRA/PIKA, наблюдаемое при добавлении 1 МЕ присутствующего HKC-IPRA.
Сделанный вывод состоит в том, что минимальное присутствие антигена необходимо перед индукцией существенного иммунного ответа. Кроме того, избыточный антиген сверх пусковой точки вызывает лишь маргинальный прибавочный возврат активности.
Пример 15
Соотношение антигена и адъюванта
Этот эксперимент демонстрирует оптимальную смесь очищенного антигена бешенства, инактивированного почечными клетками хомячка (HKC-IPRA) и адъюванта PIKA (диапазон молекулярной массы от 66000 до 660000 дальтон).
Различные количества антигена смешивали с различными количествами адъюванта с PBS, добавленным для обеспечения согласованного общего объема. Активность полученных вакцин определяли, используя тест активности NIH. Данные представлены в таблице 14.
Рассмотрение результатов комбинированного теста указывает на то, что оптимальной комбинацией вакцины является отношение PIKA к антигену в диапазоне, по меньшей мере, 3:1.

Пример 16
Хранение в лиофилизированном виде PIKA и PIKA в комбинации с вакциной против бешенства
Этот пример демонстрирует, что PIKA устойчив в лиофилизированной форме.
Технология лиофилизации использовалась для длительного хранения вакцин против бешенства до трех лет. Автор изобретения стремился к испытанию того, оказало ли бы благоприятное воздействие хранение в лиофилизированном виде PIKA (с диапазоном молекулярной массы от 66000 до 660000 дальтон) и вакцин против бешенства, содержащих PIKA. Следующие композиции использовали для теста хранения в лиофилизированном виде: i) незамороженный PIKA, добавленный к растворенному очищенному антигену бешенства, инактивированному почечными клетками хомячка (HKC-IPRA), ii) растворенную лиофилизированную композицию PIKA плюс HKC-IPRA, iii) растворенную лиофилизированную, имеющуюся в продаже вакцину против бешенства (без добавления PIKA), и iv) незамороженную, имеющуюся в продаже вакцину против бешенства. В таблице 15 показано, что лиофилизированный PIKA и вакцины против бешенства, содержащие PIKA, были идеальными для длительного хранения вакцин против бешенства.
Хотя настоящее изобретение было описано со ссылкой на определенные варианты осуществления, следует понимать, что эти варианты осуществления являются иллюстративными и что объем изобретения не ограничивается ими. Альтернативные варианты осуществления настоящего изобретения станут очевидными для средних специалистов в данной области, к которым относится настоящее изобретение. Считается, что такие альтернативные варианты осуществления включены в сущность и объем настоящего изобретения. Соответственно, объем настоящего изобретения описан прилагаемой формулой изобретения и подтверждается предшествующим описанием.
Реферат
Изобретение касается полинуклеотидной адъювантной композиции на основе полирибоинозиновой-полирибоцитидиловой кислоты (PIC) и способам ее применения для индукции иммунного ответа. Настоящее изобретение также относится к набору для иммуногенной композиции и иммуногенной композиции, включающей полинуклеотидную адъювантную композицию вместе с антигеном (например, в качестве вакцины). Адъювантные композиции (варианты) по изобретению имеют особые физические свойства (например, молекулярную массу, концентрацию и pH), которые удовлетворяют потребность в безопасном адъюванте для вызывания усиленного иммунного ответа. Изобретение, кроме того, относится к способу получения иммуногенной композиции и применению иммуногенных адъювантных композиций, в частности, при индукции иммунного ответа на антигенное соединение. Адъювантные композиции по изобретению безопасны и эффективны при обеспечении желаемого иммуногенного эффекта у людей. 11 н. и 14 з.п. ф-лы, 2 ил., 15 табл.
Формула
полирибоинозиновую-полирибоцитидиловую кислоту (PIC), антибиотик и положительный ион, причем полинуклеотидная адъювантная композиция имеет среднюю молекулярную массу, равную или больше чем 150000 Да или имеет средний размер молекул, равный или больше чем размер 9,3 сведбергов.

Комментарии