Измельченная форма (s)-2-этокси-3-[4-(2-{4-метансульфонилоксифенил}этокси)фенил]пропановой кислоты - RU2248966C2
Код документа: RU2248966C2
Описание
Настоящее изобретение относится к форме с уменьшенным размером частиц соединения (S)-2-этокси-3-[4-(2-{4-метансульфонилоксифенил}этокси)фенил]пропановая кислота, описываемого формулой 1 ниже

или его фармацевтически приемлемой соли или сольвата любого из них. Данное изобретение также касается способов лечения одного или более чем одного состояния, ассоциированного с синдромом инсулинорезистентности, путем применения формы с уменьшенным размером частиц этого соединения или его фармацевтически приемлемой соли в изготовлении лекарства для использования при одном или более чем одном указанном состоянии. Данное изобретение также касается фармацевтических композиций, содержащих форму с уменьшенным размером частиц этого соединения или его фармацевтически приемлемой соли, или их сольвата, в качестве активного ингредиента, а также способов изготовления формы с уменьшенным размером частиц этого соединения или его фармацевтически приемлемой соли.
При приготовлении препарата композиций лекарственных средств важно, чтобы лекарственное вещество находилось в той форме, в которой его удобно обрабатывать и перерабатывать. Это важно с точки зрения изготовления фармацевтических препаратов, содержащих это активное соединение.
Вышеуказанное соединение полезно для лечения метаболических нарушений, таких как синдром инсулинорезистентности (IRS), определяемый как пониженная чувствительность к действиям инсулина во всем организме или в отдельных тканях, таких как скелетная мышца, миокард, жир и печень, распространенный у многих индивидуумов с наличием или без наличия сахарного диабета. IRS подразумевает группу проявлений, включающую в себя инсулинорезистентность с сопутствующей гиперинсулинемией, возможно, сахарным диабетом II типа, артериальной гипертензией, центральным (висцеральным) ожирением, дислипидемией, наблюдаемой как ненормальные уровни липопротеинов, обычно характеризующиеся повышенной концентрацией VLDL (липопротеинов очень низкой плотности) и пониженной концентрацией HDL (липопротеинов высокой плотности) и пониженным фибринолизом.
Недавнее эпидемиологическое исследование засвидетельствовало, что индивидуумы с инсулинорезистентностью подвержены значительно большему риску сердечно-сосудистых заболеваний и смертности, особенно они страдают от инфаркта миокарда и инсульта. При сахарном диабете II типа эти связанные с атеросклерозом состояния являются причиной до 80% всех смертей.
В клинической медицине существует осознание необходимости увеличения чувствительности к инсулину при IRS и таким образом коррекции дислипидемии, которая, как предполагается, вызывает ускоренное развитие атеросклероза. Однако это заболевание не является универсально определяемым.
В публикации международной заявки WO 9962872 раскрыто соединение формулы I и фармацевтическая композиция на его основе, которая полезна при клинических состояниях, ассоциированных с резистентностью к инсулину.
Задача настоящего изобретения заключается в том, чтобы предложить новую форму соединения формулы I с уменьшенным размером частиц, позволяющую добиться получения однородных препаратов указанного соединения с равномерной нагрузкой активного ингредиента как в пределах одной партии, так и между партиями препарата.
Авторы обнаружили форму с уменьшенным размером частиц соединения, описанного выше. Это является основой настоящего изобретения. Когда соединение формулы I находится в форме с уменьшенным размером частиц, можно достичь значительных преимуществ, например, в эксплуатационных качествах соединения при его обработке с тем, чтобы добиться получения однородных препаратов с равномерной нагрузкой активного ингредиента в пределах партии, а также между партиями. Кроме того, снижения размера частиц обычно связаны с увеличением скоростей растворения при пероральном введении и улучшенной пероральной биодоступностью, когда пероральная биодоступность лимитируется скоростью растворения активного ингредиента.
Таким образом, в настоящем изобретении предложена форма с уменьшенным размером частиц (S)-2-этокси-3-[4-(2-{4-метансульфонилоксифенил}этокси)фенил]пропановой кислоты, описываемой формулой 1 ниже
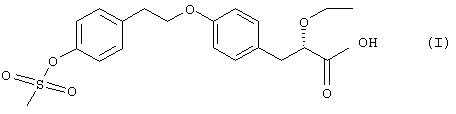
или ее фармацевтически приемлемой соли или сольвата любого из них.
При помощи выражения "уменьшенный размер частиц" авторы обозначают твердое Соединение 1 или его фармацевтически приемлемую соль или сольват любого из них, превращенные при помощи подходящих методов обработки в твердое вещество с меньшим размером частиц и, следовательно, большей площадью поверхности. Для уменьшения размера частиц твердого вещества можно использовать любое количество методов обработки, известных в фармацевтической области, таких как дробление, размалывание и микронизация, за более исчерпывающим обзором следует обратиться к Remington: The Science and Practise of Pharmacy, 19th Ed., pages 1598-1602.
В использованное выражение "сольватированный" авторы включили гидратированный.
Таким образом, еще одним аспектом изобретения является способ получения формы с уменьшенным размером частиц соединения формулы I или его фармацевтически приемлемой соли или сольвата любого из них, при котором измельчают твердую форму соединения формулы I или его фармацевтически приемлемой соли, или сольвата любого из них в течение достаточного промежутка времени до тех пор, пока не получится желаемый размер частиц соединения формулы I или его фармацевтически приемлемой соли или сольвата любого из них.
Диапазон размеров частиц, предпочтительных в этом изобретении, начинается, с увеличением предпочтения, от умеренно тонкого порошка, тонкого порошка, очень тонкого порошка, микротонкого порошка до, наиболее предпочтительно, сверхтонкого порошка.
Вышеуказанные ссылки на размеры частиц взяты из Британской Фармакопеи 1993, Том II, Приложение XVIIB, A193 (British Pharmacopoeia 1993, Volume II, Appendix XVII В, А193), и воспроизведены ниже для справки.
Умеренно тонкий порошок
Порошок, все частицы которого проходят через сито с номинальным размером ячеек сита 355 мкм и не более 40,0% по массе проходит через сито с номинальным размером ячеек сита 250 мкм.
Тонкий порошок
Порошок, все частицы которого проходят через сито с номинальным размером ячеек сита 180 мкм и не более 40,0% по массе проходит через сито с номинальным размером ячеек сита 125 мкм.
Очень тонкий порошок
Порошок, все частицы которого проходят через сито с номинальным размером ячеек сита 125 мкм и не более 40,0% по массе проходит через сито с номинальным размером ячеек сита 45 мкм.
Микротонкий порошок
Порошок, не менее 90% по массе частиц которого проходят через сито с номинальным размером ячеек сита 45 мкм.
Сверхтонкий порошок
Порошок, не менее 90% по массе частиц которого проходят через сито с номинальным размером ячеек сита 10 мкм.
Конкретные сита, которые следует использовать при определении размера частиц, описаны в Британской Фармакопее 1993, Том II, Приложение XVIIB, A193-A194, и эта часть включена в данное описание изобретения ссылкой.
Аспектом изобретения является форма с уменьшенным размером частиц соединения формулы I, как описано выше, для применения в терапевтическом лечении.
Согласно еще одному аспекту изобретения предложена фармацевтическая композиция, которая содержит форму с уменьшенным размером частиц соединения формулы I, как описано выше, в сочетании с фармацевтически приемлемым разбавителем, адъювантом или носителем.
Эта композиция может находиться в форме, пригодной для перорального применения, например таблетки, капсулы, водного или масляного раствора, суспензии или эмульсии; для местного применения, например крема, мази, геля или водного, или масляного раствора, или суспензии; для назального применения, например лекарства для вдыхания через нос, назального спрея или назальных капель; для вагинального или ректального применения, например суппозитория; для введения путем ингаляции, например в виде тонкоизмельченного порошка, такого как сухой порошок или жидкий аэрозоль; для подъязычного или защечного применения, например таблетки или капсулы; или для парентерального применения (включая внутривенное, подкожное, внутримышечное, внутрисосудистое или инфузию), например стерильного водного или масляного раствора или суспензии. В общем, вышеуказанные композиции можно приготовить традиционным способом, используя традиционные эксципиенты.
Количество формы с уменьшенным размером частиц соединения формулы I, как описано выше, которое объединяют с одним или более чем одним эксципиентом с получением отдельной лекарственной формы, обязательно будет меняться в зависимости от организма "хозяина", которого лечат, и конкретного пути введения. Например, препарат, предназначенный для перорального введения людям, обычно содержит, например, от 0,01 мг до 50 мг активного агента, в смеси с соответствующим и подходящим количеством эксципиента(ов), которое может варьировать от приблизительно 20 до приблизительно 99,99 процентов по массе от всей композиции. Формы единичной дозировки обычно содержат от приблизительно 0,0001 мг до приблизительно 1 мг активного ингредиента.
Данное изобретение также включает в себя применение соединения по изобретению, как описано выше, в приготовлении лекарства для использования в:
(1) лечении дислипидемии;
(2) лечении сахарного диабета II типа;
(3) лечении гипергликемии;
(4) лечении гиперлипидемии;
(5) лечении гиперинсулинемии;
(6) лечении артериальной гипертензии; и/или
(7) лечения абдоминального ожирения.
Изобретение также включает в себя способ получения эффекта, как описано ранее, или лечения заболевания или нарушения, как описано ранее, при котором теплокровному животному, нуждающемуся в таком лечении, вводят эффективное количество формы с уменьшенным размером частиц соединения формулы I, как описано выше.
Величина дозы формы с уменьшенным размером частиц соединения по изобретению, как описано выше, для терапевтических или профилактических целей, естественно, будет меняться в зависимости от природы и тяжести медицинского состояния, возраста и пола животного или пациента, которого лечат, и пути введения, в соответствии с известными медицинскими принципами. Подходящие суточные дозы соединений по изобретению при терапевтическом лечении людей составляют приблизительно 0,001-10 мг/кг массы тела, предпочтительно 0,01-1 мг/кг массы тела.
Измельченную форму соединения формулы I можно вводить как единственное терапевтическое средство, или их можно вводить в сочетании с другими фармакологически активными агентами, такими как антидиабетический, антигипертензивный, мочегонный или антигиперлипидемический агент. Данное изобретение далее проиллюстрировано следующими неограничивающими Примерами.
Пример 1
Синтез (S)-2-этокси-3-[4-[4-(метилсульфонилокси)фенетил]
окси]фенил]рпропановой кислоты
1-(Метилсульфонилокси)-2-[4-(метилсульфонилокси)фенил]этан
2-(4-Гидроксифенил)этанол (356 г, 2,58 моль, 1,0 эквивалент) растворяли в метиленхлориде (3500 мл) и триэтиламине (653 г, 6,44 моль, 2,5 эквивалента). Смесь охлаждали до -20°С. Затем добавляли метансульфонилхлорид (657 г, 5,74 моль, 2,2 эквивалента), поддерживая температуру между -25°С и -15°С. Когда степень конверсии составляла свыше 95%, образовывались соли, которые отфильтровывали и промывали метиленхлоридом (600 мл). Органический слой промывали сначала насыщенным раствором гидрокарбоната натрия (700 мл) при 20°С, а затем водой (700 мл). Метиленхлорид выпаривали до сухости и оставшийся остаток затем использовали на следующей стадии.
Этиловый эфир (S)-2-этокси-3-[4-[[4-(метилсульфонилокси)
фенетил]окси]фенил]]пропановой кислоты
Этиловый эфир (S)-2-этокси-3-(4-гидроксифенил)-пропановой кислоты (325 г, 1,36 моль, 1,0 эквивалент) растворяли в ацетонитриле (2600 мл). Когда образовывался гомогенный раствор, добавляли карбонат калия (560 г, 4,05 моль, 3,0 эквивалента) и сульфат магния (110 г, (0,2 г/г КаСО3)). В ацетонитрильный раствор загружали 1-(метилсульфонилокси)-2-[4-(метилсульфонилокси)фенил]этан (приблизительно 2050 мл (0,3 г/мл, 2,21 моль, 1,65 эквивалента)) и смесь оставляли взаимодействовать при кипячении с обратным холодильником, 82°С, в течение 24 часов с интенсивным перемешиванием. Когда была достигнута степень конверсии свыше 98%, реакционную смесь охлаждали до комнатной температуры. Оставшиеся соли отфильтровывали и промывали ацетонитрилом (800 мл). Фильтрат выпаривали до сухости. Маслянистый остаток затем использовали на следующей стадии.
(S)-2-Этокси-3-[4-[[4-(метилсульфонилокси)фенетил]окси]
фенил]]пропановая кислота
К маслянистому этиловому эфиру (S)-2-этокси-3-[4-[[4-(метилсульфонилокси)
фенетил]окси]фенил]]пропановой кислоты (723 г (анализ 71, 2%), 1,18 моль, 1,0 эквивалент) добавляли тетрагидрофуран (THF) (3900 мл). Когда образовывался гомогенный раствор, добавляли воду (900 мл). Смесь охлаждали до +10°С. Через 1 час добавляли раствор гидроксида лития (390 мл, 4 М, 1,45 эквивалент). Температуру затем поднимали до + 30°С и реакцию оставляли протекать при этой температуре в течение 2-3 часов. Реакцию останавливали, когда степень конверсии составляла свыше 99%. Добавляли этилацетат (500 мл) и смесь охлаждали до комнатной температуры. Раствор перемешивали в течение приблизительно 30 минут и выпаривали THF. Когда приблизительно 80-90% THF было выпарено, добавляли воду (1900 мл). Выпаривание продолжали до исчезновения в смеси THF. Щелочной водный раствор затем промывали этилацетатом (1000 мл, 2×1250 мл, и 950 мл). рН водного раствора (S)-2-этокси-3-[4-[[4-(метилсульфонилокси)фенетил]окси]фенил]]пропановой кислоты затем доводили до 2,0-2,5 с помощью НС1 (водной) (550 мл, 3,0 М). Добавляли этилацетат (2500 мл) и фазы разделяли. Этилацетатный раствор (S)-2-этокси-3-[4-[[4-(метилсульфонилокси)фенетил]окси]фенил]]пропановой кислоты затем промывали водой (700 мл) и после разделения выпаривали до сухости. Оставшееся масло затем использовали в последующей кристаллизации.
Кристаллизация (S)-2-Этокси-3-[4-[[4-(метилсульфонилокси)
фенетил]окси]фенил]]пропановой кислоты
Масло из 3 партий (S)-2-этокси-3-[4-[[4-(метилсульфонилокси)
фенетил]окси]фенил]]пропановой кислоты (1262 г, 3,09 моль, 1,0 эквивалент) растворяли в толуоле (2500 мл) при 50°С. Когда был получен прозрачный раствор, этот раствор упаривали для уменьшения присутствующего количества этилацетата. Объем перед упариванием составлял 6750 мл. Добавляли другую часть толуола (2500 мл), причем объем после добавления составлял 7750 мл, и продолжали упаривание. К раствору затем добавляли третью часть толуола, объем перед добавлением составлял 6300 мл, объем после добавления составлял 8800 мл. Упаривание продолжали до тех пор, пока не образовывался непрозрачный раствор, объем 8200 мл. Затем к раствору добавляли изооктан (1000 мл), который был подогрет до 40°С. Кристаллизацию инициировали внесением затравки при 40°С. Смесь интенсивно перемешивали до тех пор, пока не образовывалась суспензия. Затем скорость перемешивания снижали. Суспензию оставляли кристаллизоваться в течение ночи. Затем суспензию фильтровали и промывали смесью толуол:изооктан 5:1 (1800 мл). Кристаллы затем сушили при пониженном давлении при 40°С.
Пример 2
Получение формы с уменьшенным размером частиц соединения I
Пример 2:1:
Соединение 1 диспергировали в 600 г воды при перемешивании на интенсивной ножевой мешалке.
Добавляли гидроксипропилцеллюлозу LF и перемешивание продолжали до тех пор, пока суспензия не становилась гомогенной. Суспензию закачивали в шаровую мельницу, снабженную приблизительно 500 мл 1,0-1,5 мм стеклянных шариков, используя перистальтический насос при приблизительно 70 г/мин. Измельчение производили при 2000 оборотах в минуту. Первые 200 г измельченной суспензии были загружены снова. Смеситель, сосуд, шланги и корпус мельницы промывали 400 г воды.
Анализ размера частиц осуществляли в суспензии до и после измельчения, используя Coulter LS. Средний размер частиц был определен как 24,93 мкм и 7,086 мкм соответственно.
Пример 2:2:
Соединение 1 диспергировали в 400 г воды при перемешивании на интенсивной ножевой мешалке.
Добавляли гидроксипропилцеллюлозу LF и перемешивание продолжали до тех пор, пока суспензия не становилась гомогенной. Суспензию закачивали в шаровую мельницу, снабженную приблизительно 500 мл 1,0-1,5 мм стеклянных шариков, используя перистальтический насос при приблизительно 80 г/мин. Измельчение производили при 2000 оборотах в минуту. Первые 200 г измельченной суспензии были загружены снова. Смесь, сосуд, шланги и корпус мельницы промывали 600 г воды.
Анализ размера частиц осуществляли в суспензии до и после измельчения, используя Coulter LS. Средний размер частиц был определен как 14,79 мкм и 7,614 мкм соответственно.
Пример 2:3:
Соединение 1 диспергировали в 4000 г воды при перемешивании на интенсивной ножевой мешалке.
Добавляли гидроксипропилцеллюлозу LF и перемешивание продолжали до тех пор, пока суспензия не становилась гомогенной. Суспензию закачивали в шаровую мельницу, снабженную приблизительно 500 мл 1,0-1,5 мм стеклянных шариков, используя перистальтический насос при приблизительно 75 г/мин. Измельчение производили при 2000 оборотах в минуту. Первые 200 г измельченной суспензии были загружены снова. Смесь, сосуд, шланги и корпус мельницы промывали 4000 г воды.
Анализ размера частиц осуществляли в суспензии до и после измельчения, используя Coulter LS. Средний размер частиц был определен как 48,35 мкм и 6,822 мкм соответственно.
Реферат
Настоящее изобретение относится к форме с уменьшенным размером частиц соединения (S)-2-этокси-3-[4-(2-{4-метансульфонилоксифенил} этокси)фенил]пропановая кислота, описываемого формулой (I), или его фармацевтически приемлемой соли или сольвата любого из них.

Вышеуказанное соединение полезно для лечения метаболических нарушений, таких как синдром инсулинорезистентности (IRS), определяемый как пониженная чувствительность к действиям инсулина. Данное изобретение также касается фармацевтических композиций, содержащих форму с уменьшенным размером частиц этого соединения, или его фармацевтически приемлемой соли, или их сольвата, в качестве активного ингредиента, а также способов получения формы с уменьшенным размером частиц этого соединения или его фармацевтически приемлемой соли. 7 н. и 5 з.п. ф-лы.
Формула


Комментарии