Твердая дисперсия пароксетина (варианты), способ ее получения (варианты), способ лечения депрессии у теплокровного животного - RU2185820C2
Код документа: RU2185820C2
Чертежи

Описание
Данное изобретение относится к области твердых дисперсий слабо растворимых в воде лекарственных средств, к способам их приготовления и их применению в фармацевтических композициях. Конкретно, данное изобретение относится к твердым дисперсиям, образующимся из способов сплавления или способов с применением растворителя для включения слабо растворимых в воде лекарственных средств в фармацевтически приемлемые носители. Более конкретно, данное изобретение относится к твердым дисперсиям пароксетина, способам приготовления таких твердых дисперсий, фармацевтическим композициям, содержащим твердые дисперсии, и их применению в терапии.
Предпосылки к созданию изобретения
Соединение (-)-транс-4-(4'-фторфенил)-3-(3',
4'-метилендиоксифеноксиметил)-пиперидин,
обычно известное как пароксетин, представляет собой вязкое масло и слабо растворимое в воде лекарственное средство, в отношении которого существует
коммерческая потребность в связи с ценными
фармацевтическими композициями. Твердая дисперсия пароксетина или его кислотно-аддитивной соли, до сих пор никогда не обсуждаемая в литературе, обеспечила
бы твердый продукт в коммерческом масштабе с
хорошими позволяющими манипулирование свойствами и физиологической приемлемостью без необходимости или расходов для приготовления кристаллических
материалов.
Фармацевтические композиции с хорошим растворением и биодоступностью могут быть приготовлены из твердых дисперсий фармацевтически активных ингредиентов. Преимущества, заявленные для фармацевтических твердых дисперсий, включают в себя потенциальное применение в композициях регулируемого высвобождения (композициях пролонгированного действия), стабилизацию лекарственного средства в отношении полиморфных превращений, улучшение свойств, позволяющих манипулирование лекарственными веществами, и защиту некоторых лекарственных средств против разложения во время введения. Твердые дисперсии фармацевтически активных ингредиентов могут быть образованы из целого ряда фармацевтически приемлемых носителей. В Патенте Соединенных Штатов 4933360 описан новый способ и продукт, содержащий хлорталидон в качестве фармацевтически активного ингредиента и поливинилпирролидон (ПВП) в качестве фармацевтически приемлемого носителя. Эти способы были описаны в общем W. L. Chiou et al., J. Pharm. Sci. 60(28) (1971) и S. Riegelman et al., U.S. Pat. 4151273. Как определено в статье Chiou, термин "дисперсия твердого состояния" обозначает дисперсию одного или нескольких активных ингредиентов в инертном носителе или матриксе в твердом состоянии, полученную способом плавления (сплавления), способом с растворителем или комбинированным способом расплава-растворителя. Дисперсия активного ингредиента в твердом носителе или разбавителе, полученная посредством традиционного механического смешивания, не входит в определение этого термина.
В "способе с растворителем" активный ингредиент общепринятым образом диспергируют в водорастворимом носителе посредством растворения физической смеси, содержащей активный ингредиент и фармацевтически приемлемый носитель, в обычном органическом растворителе и последующего удаления этого растворителя выпариванием. Полученную твердую дисперсию извлекают и используют в приготовлении подходящих фармацевтических композиций, изготовляемых при помощи общепринятых способов.
Приготовление твердых дисперсий способом сплавления или "расплава" включает в себя комбинацию фармацевтически приемлемого носителя и слабо растворимого в воде лекарственного средства, где этим двум компонентам позволяют расплавиться при температурах при точке плавления или выше точки плавления как лекарственного средства, так и носителя. В этом способе сплавления лекарственное средство и носитель сначала физически смешивают и затем оба компонента расплавляют. Затем расплавленную смесь быстро охлаждают с получением застывшей массы, которую затем размалывают с получением порошка. Способы достижения застывания при распылении, используемые для получения гранул, были описаны Kanig (J. Pharm. Sci. 53, 188 (1964)) для дисперсий, содержащих маннит, и Kreuschner et al. (Acta Pharm. Tech. 26, 159 (1989)) для фенилбутазона-мочевины.
В общем, проблемы, которые могут быть связаны с известными способами сплавления (плавления), растворения, расплава-растворения и соосаждения, могут включать в себя использование избытка растворителя, идентификацию комбинаций носителя/лекарственного средства, которые могут быть подходящим образом расплавлены (сплавлены) или совместно растворены, применение нагревания для выполнения растворения или сплавления, которое может приводить к разложению лекарственного средства и/или носителя, и идентификацию условий и свойств, вызывающих соосаждение. Соли лекарственного средства могут создавать конкретные проблемы с идентификацией органических растворителей или растворителей, способных растворять как лекарственное средство, так и фармацевтически приемлемый носитель.
В Патенте Соединенных Штатов 4007196 описаны пароксетин в качестве ингибитора поглощения 5-гидрокситриптамина (5НТ) и, следовательно, терапевтическое применение его в качестве антидепрессанта. Пароксетин хорошо известен и широко распространен в продаже в качестве лекарственного агента. Как описано в Патенте Соединенных Штатов 4007196, пароксетин получают в виде свободного основания и затем превращают в его малеатную соль. Однако пароксетин является слабо растворимым в воде лекарственным средством и из него трудно готовить применимые фармацевтические композиции.
В Патенте Соединенных Штатов 4721723 показано, что вследствие его основности, предпочтительно использование пароксетина в качестве терапевтического агента в форме кислотно-аддитивной соли. Это свободное основание является вязким маслом, которым трудно манипулировать и которое трудно формовать в окончательную дозированную форму для терапевтического применения. В самом Патенте Соединенных Штатов 4721723 описан кристаллический полугидрат гидрохлорида пароксетина в качестве нового материала с улучшенными позволяющими манипулирование свойствами, чем свойства манипулирования безводного гидрохлорида пароксетина, который является гигроскопическим твердым веществом с плохими свойствами манипулирования.
Как правило, гидрохлоридная соль основного соединения является предпочтительной для терапевтического применения вследствие ее физиологической приемлемости. Кроме того, фармацевтически активный ингредиент не должен содержать ощутимых количеств связанного или несвязанного органического растворителя. Сразу же после образования этой соли она должна быть выделена из растворителей фильтрованием или другими средствами, чтобы эта соль пароксетина была подходящим образом приготовлена в виде фармацевтической композиции. Многие растворители, в том числе вода, образуют сольваты или клатраты гидрохлорида пароксетина, в которых растворитель не может быть удален обычными способами высушивания, такими как сушка в вакуумном термостате. В Патенте Соединенных Штатов 4721723 описана полугидратная сольватная форма гидрохлорида пароксетина, тогда как в Международной публикации WO 96/24595 описаны сольваты гидрохлорида пароксетина, иные, чем сольват пропан-2-ола, в качестве предшественников в получении гидрохлорида пароксетина, по существу свободного от связанного органического растворителя. Кроме того, в Международной публикации WO 96/24595 описаны также четыре новых ангидрата (безводных) гидрохлорида пароксетина, по существу не содержащие связанного растворителя. Однако ни одна из этих публикаций не описывает специально стабильность или гигроскопичность некристаллических ангидратов гидрохлорида пароксетина в твердой дисперсии.
Данное изобретение относится к новым способам для включения пароксетина, слабо растворимого в воде лекарственного средства, в твердую дисперсию и ее применению в содержащих ее фармацевтических композициях.
Заявители неожиданно обнаружили, что твердые дисперсии безводного гидрохлорида пароксетина могут быть приготовлены способом сплавления с использованием свободного основания пароксетина и сухого газообразного хлористого водорода при температурах, существенно более низких, чем точка плавления гидрохлорида пароксетина, с использованием фармацевтически приемлемого носителя с точкой плавления, значительно более низкой, чем точка плавления безводного гидрохлорида пароксетина. Полученная твердая дисперсия по существу не содержит органического растворителя, является безводной и имеет улучшенные позволяющие манипулирование свойства.
Кроме того, было обнаружено, что твердые дисперсии безводных солей пароксетина, предпочтительно солей хлористоводородной кислоты, могут быть приготовлены при помощи нового способа с растворителем с использованием фармацевтически приемлемого носителя, свободного основания пароксетина, неводного растворителя и раствора или газа кислотно-аддитивной соли.
Приготовление некристаллических ангидратов гидрохлорида пароксетина в виде твердой дисперсии улучшает формообразование свободного основания пароксетина, обеспечивает твердое вещество, которое легко формуется в коммерческую дозированную форму, устраняет дополнительные стадии приготовления кристаллического материала для целей манипулирования и предположительно снижает затраты, связанные с этими стадиями.
Сущность
изобретения
Описаны твердые дисперсии слабо растворимых лекарственных средств, которые готовят при
помощи способа с растворителем или способа сплавления. Такие дисперсии готовят со свободным
основанием лекарственного средства, в частности свободным основанием пароксетина, маслом, и это
приготовление позволяет применять низкую температуру для способа сплавления, уменьшенные объемы
органического растворителя для способа с растворителем и получать соль пароксетина во время процесса
приготовления твердой дисперсии.
Подробное описание изобретения
В первом
варианте изобретение обеспечивает способ приготовления водорастворимой дисперсии твердого состояния
пароксетина и фармацевтически приемлемого полимерного носителя, предусматривающий:
(a)
образование раствора водорастворимого фармацевтически приемлемого полимерного носителя и неводного
растворителя;
(b) растворение свободного основания пароксетина в этом растворе, причем
весовое отношение водорастворимого фармацевтически приемлемого полимерного носителя к пароксетину
находится в диапазоне ~4:1-~1:1;
(c) контактирование свободного основания пароксетина в
растворе с по меньшей мере одним эквивалентом кислоты, причем эта кислота является нетоксичной
неорганической или органической кислотой, с образованием фармацевтически приемлемой соли пароксетина в
растворе; и
(d) удаление неводного растворителя выпариванием под вакуумом.
В предпочтительном варианте изобретение обеспечивает способ приготовления водорастворимой дисперсии твердого состояния, в которой полимерный носитель представляет собой полиэтиленгликоль или поливинилпирролидон.
В более предпочтительном варианте изобретение обеспечивает способ
приготовления водорастворимой дисперсии твердого состояния пароксетина и фармацевтически
приемлемого полимерного носителя, предусматривающий:
(a) образование раствора полиэтиленгликоля и
этанола;
(b) растворение свободного основания пароксетина в этом растворе, причем
весовое отношение полиэтиленгликоля к пароксетину находится в диапазоне ~4: 1-~1:1;
(c)
контактирование свободного основания пароксетина в растворе с по меньшей мере одним эквивалентом
сухого хлористого водорода, причем сухой хлористый водород растворен в метаноле или этаноле, с
образованием фармацевтически приемлемого гидрохлорида пароксетина в растворе; и
(d) удаление
неводного растворителя выпариванием под вакуумом.
В еще более предпочтительном
варианте изобретение обеспечивает способ приготовления водорастворимой дисперсии твердого состояния
пароксетина и фармацевтически приемлемого полимерного носителя, предусматривающий:
(a)
образование раствора поливинилпирролидона и этанола;
(b) растворение свободного основания
пароксетина в этом растворе, причем весовое отношение поливинилпирролидона к пароксетину находится в
диапазоне ~ 4:1-~1:1;
(c) контактирование свободного основания пароксетина в растворе с
по меньшей мере одним эквивалентом сухого хлористого водорода, причем сухой хлористый водород растворен
в метаноле или этаноле, с образованием фармацевтически приемлемого гидрохлорида пароксетина в
растворе; и
(d) удаление неводного растворителя выпариванием под вакуумом.
Во
втором варианте изобретение обеспечивает способ приготовления водорастворимой дисперсии твердого
состояния пароксетина и фармацевтически приемлемого полимерного носителя, предусматривающий:
(a) контактирование водорастворимого фармацевтически приемлемого полимерного носителя со
свободным основанием пароксетина с образованием тонкоизмельченной смеси, причем весовое отношение
водорастворимого фармацевтически приемлемого полимерного носителя к свободному основанию пароксетина
находится в диапазоне ~4:1-~1:1;
(b) нагревание этой смеси с образованием расплавленного
гомогенного расплава полимерного носителя и свободного основания пароксетина;
(c)
контактирование расплавленного гомогенного расплава полимерного носителя и свободного основания пароксетина с
по меньшей мере одним эквивалентом сухого хлористого водорода с образованием
фармацевтически приемлемого гидрохлорида пароксетина в расплавленном гомогенном расплаве; и
(d) охлаждение
расплавленного гомогенного расплава с образованием водорастворимой дисперсии
твердого состояния.
В предпочтительном втором варианте изобретение обеспечивает способ приготовления
водорастворимой дисперсии твердого состояния пароксетина и фармацевтически
приемлемого полимерного носителя, предусматривающий:
(a) контактирование полиэтиленгликоля со свободным основанием
пароксетина с образованием тонкоизмельченной смеси, причем весовое
отношение полиэтиленгликоля к свободному основанию пароксетина находится в диапазоне ~4:1-~ 1:1;
(b) нагревание этой смеси с
образованием расплавленного гомогенного расплава
полиэтиленгликоля и свободного основания пароксетина;
(c) контактирование расплавленного гомогенного расплава полиэтиленгликоля и свободного
основания пароксетина с по меньшей мере одним
эквивалентом сухого хлористого водорода с образованием фармацевтически приемлемого гидрохлорида пароксетина в расплавленном гомогенном расплаве; и
(d) охлаждение расплавленного гомогенного
расплава с образованием водорастворимой дисперсии твердого состояния.
В третьем варианте изобретение обеспечивает дисперсию твердого состояния, содержащую фармацевтически приемлемый полимерный носитель и пароксетин.
В четвертом варианте изобретение обеспечивает дисперсию твердого состояния, содержащую один или несколько фармацевтически приемлемых наполнителей и дисперсию твердого состояния, содержащую пароксетин и фармацевтически приемлемый полимерный носитель.
В пятом варианте изобретение обеспечивает способ лечения депрессии у теплокровного животного, предусматривающий введение этому животному дисперсии твердого состояния, содержащей пароксетин и фармацевтически приемлемый полимерный носитель, причем количество гидрохлорида пароксетина в этой дисперсии является эффективным для лечения депрессии.
"Пароксетин" является характерным для определенного класса названием для соединения, описанного в примере 2 Патента Соединенных Штатов 4007196, также известного как (-)-транс-4-(4'-фторфенил)-3-(3',4'-метилендиоксифеноксиметил) -пиперидин, и его фармацевтически приемлемых солей. Таким образом, в применении здесь, термин пароксетин относится к "свободному основанию пароксетина" или "соли пароксетина". Термин "свободное основание пароксетина", или просто "свободное основание", относится конкретно к пароксетину как материалу, который представляет собой вязкое масло при стандартных температуре и давлении. Термин "соль пароксетина" используют для описания кислотно-аддитивного продукта пароксетина. Например, в случае гидрохлорида кислотно-аддитивный продукт называют "гидрохлоридом пароксетина" или просто "гидрохлоридной солью".
Соединение пароксетин, описанное здесь, имеет два асимметричных центра. Если нет иных указаний, предпочтительным изомером является (-)-транс-изомер. Однако все хиральные, диастереомерные и рацемические формы включены в данное изобретение. В данной области хорошо известно, как получить оптически активные формы, например разделением рацемических форм или посредством синтеза из оптически активных исходных материалов. Подразумевается использование всех хиральных, диастереомерных, рацемических форм, если особо не указана конкретная стереохимия или форма изомера.
В применении здесь термин "неводный растворитель" относится к любому из растворителей, таких как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол, втор-бутанол, толуол, бензол, надкритический жидкий СО2, хлороформ, метиленхлорид, ацетонитрил, кетоны (например, но без ограничения ими, диметилкетон, метилэтилкетон и диэтилкетон), диметилформамид, диметилсульфоксид, сложные эфиры (например, но без ограничения им, этилацетат), простые эфиры (например, но без ограничения ими, диэтиловый эфир и дипропиловый эфир), 1,4-диоксан, тетрагидрофуран, пентаны, гексаны, гептаны, трихлорэтен или их подходящие смеси.
Предпочтительно растворитель должен быть (а) способным растворять как активный ингредиент, так и носитель, (b) химически инертным в отношении активного ингредиента и носителя и (с) достаточно летучим для возможности удаления выпариванием с использованием общепринятых способов. Ожидается, что алканолы, имеющие один-четыре атома углерода, как правило, могли бы быть применимыми для приготовления дисперсий твердого состояния способом с растворителем. Было обнаружено, что в данном изобретении важными являются дополнительные характеристики. Органический растворитель должен быть (d) способным растворять как свободное основание, так и фармацевтически приемлемую соль активного ингредиента; (е) химически инертным в отношении как свободного основания активного ингредиента, так и соли, образованной после реакции с подкисленным органическим растворителем; и (f) способным растворять достаточное количество кислоты для возможности полного или почти полного превращения свободного основания в соль.
В применении здесь термин "фармацевтически приемлемый полимерный носитель" или "полимерный носитель" относится к любому из соединений, таких как гидроксипропилцеллюлоза, метилцеллюлоза, карбоксиметилцеллюлоза, натрийкарбоксиметилцеллюлоза, ацетат-фталат целлюлозы, ацетат-бутират целлюлозы, гидроксиэтилцеллюлоза, этилцеллюлоза, поливиниловый спирт, полипропилен, декстраны, декстрины, гидроксипропил-бета-циклодекстрин, хитозан, сополимеры молочной кислоты и гликолевой кислоты, поли(ортоэфир), поли(ангидрат ?), поливинилхлорид, поливинилацетат, этиленвинилацетат, лектины, карбополы, кремнийсодержащие эластомеры, полиакриловые полимеры, мальтодекстрины, лактоза, фруктоза, инозит, трегалоза, мальтоза, рафиноза, поливинилпирролидон (ПВП), полиэтиленгликоль (ПЭГ) и альфа-, бета- и гамма-циклодекстрины или их подходящие смеси.
Было обнаружено, что в данном изобретении важными являются дополнительные характеристики. Фармацевтически приемлемый носитель должен быть (а) способным смешиваться как со свободным основанием, так и солевой формой лекарственного средства, (b) способным сохранять эту соль в гомогенной некристаллической дисперсии твердого состояния после удаления растворителя выпариванием и (с) химически инертным в отношении свободного основания активного ингредиента, соли свободного основания и подкисленного органического растворителя.
В применении здесь термин "фармацевтически приемлемая соль" относится к производным пароксетина, в которых пароксетин модифицирован путем приготовления кислотно-аддитивных солей этого соединения. Примеры фармацевтически приемлемых солей включают в себя, но не ограничиваются ими, соли минеральных или органических кислот основного пиперидинового остатка и т.п. Фармацевтически приемлемые соли пароксетина включают в себя общепринятые нетоксичные соли или соли четвертичного аммония, например, из нетоксичных неорганических или органических кислот. Например, такие общепринятые нетоксичные соли включают в себя соли, произведенные из неорганических кислот, таких как хлористоводородная, бромистоводородная, серная, сульфамовая, фосфорная, азотная и т.п.; и роли, полученные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, яблочная, винная, аскорбиновая, памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая, сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этансульфоновая, этандисульфоновая, щавелевая, изэтионовая и т.п.
Фармацевтически приемлемые соли пароксетина могут быть получены в соответствии со способом данного изобретения, который мог бы включать в себя введение или доставку кислотной части молекулы различными способами. В способе сплавления кислотная часть молекулы вводилась бы в чистом виде. В способе с растворителем кислотная часть молекулы могла бы вводиться в чистом виде или при помощи неводного растворителя, который впоследствии удаляют. В общем, соли получают реакцией свободного основания со стехиометрическими количествами или с избытком желательной солеобразующей неорганической или органической кислоты.
Перечни подходящих солей можно найти в справочнике Remington's Pharmaceutical Sciences, 17 th ed., Mack Publishing Company, Easton, PA, 1985, p. 1418, описание которого включено здесь в качестве ссылки.
В применении здесь термин "сухой газообразный хлористый водород" относится к газу хлористому водороду, коммерчески доступному в цилиндрах, содержащих сжатый газ, который сушат перед применением. Обычно сухой газообразный хлористый водород готовят коммерчески барботированием газа хлористого водорода через концентрированную серную кислоту или сравнимый с ней осушитель.
Описание всех используемых здесь ссылок включено тем самым в качестве ссылки.
Задачей данного изобретения является обеспечение усовершенствованных способов приготовления водорастворимых твердых дисперсий слабо растворимых в воде лекарственного средства или комбинации лекарственных средств, получаемых по способу сплавления и/или способу с растворителем для получения твердых дисперсий. Способы данного изобретения, в качестве примера и без ограничения, могут быть дополнительно объяснены при помощи нижеследующих описательных процедур.
Общий способ приготовления твердой дисперсии по способу с растворителем осуществляется посредством (1) образования раствора, содержащего фармацевтически приемлемый носитель и неводный растворитель. Предпочтительный полимерный носитель выбран из одного или нескольких носителей, таких как поливинилпирролидон, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, метилцеллюлоза, блок-сополимеры этиленоксида и пропиленоксида и полиэтиленгликоль, причем более предпочтительным полимерным носителем является либо полиэтиленгликоль (ПЭГ), имеющий среднюю молекулярную массу от ~1000 до ~ 20000, либо поливинилпирролидон (ПВП), имеющий среднюю молекулярную массу от ~ 2500 до ~3000000. Наиболее предпочтительным полимерным носителем является поливинилпирролидон, имеющий среднюю молекулярную массу от ~10000 до ~ 450000. Предпочтительным неводным растворителем является спирт, выбранный из метанола, этанола, н-пропанола, изопропанола, н-бутанола, изобутанола и втор-бутанола, причем более предпочтительным растворителем является метанол или этанол, а наиболее предпочтительным растворителем является этанол. Предпочтительно также, чтобы неводный растворитель был сухим или безводным. Понятно, что при образовании раствора полимерного носителя и неводного растворителя нагревание раствора является допустимым, но необязательным, при условии, что температура не приводит к разложению или деградации каких-либо материалов.
После образования вышеупомянутого раствора этот способ продолжается (2) растворением свободного основания слабо растворимого в воде лекарственного средства в образованном таким образом растворе. Как и в стадии (1), нагревание является допустимым, но необязательным. Понятно, что добавление слабо растворимого в воде лекарственного средства не ограничивается одним лекарственным средством, а может включать в себя комбинацию одного или нескольких лекарственных средств, при условии, что по меньшей мере одно лекарственное средство является слабо растворимым в воде лекарственным средством в форме свободного основания. Предпочтительно, чтобы слабо растворимым в воде лекарственным средством в форме свободного основания был пароксетин. Отношение по весу водорастворимого фармацевтически приемлемого полимерного носителя к пароксетину находится в диапазоне ~5:1-~1:1, предпочтительно ~ 4: 1-~ 1:1, более предпочтительно ~3:1-~1,5:1, наиболее предпочтительно ~2:1.
Понятно также, что порядок добавления для полимерного носителя, неводного растворителя и свободного основания слабо растворимого в воде лекарственного средства является взаимозаменяемым. Например, лекарственное средство в виде свободного основания могло бы быть растворено в неводном растворителе, после чего добавляют полимерный носитель.
После растворения свободного основания лекарственного средства способ продолжается (3) превращением этого свободного основания в фармацевтически приемлемую соль. Соль свободного основания, предпочтительно соль пароксетина, может быть образована добавлением неорганической или органической кислоты, которая предпочтительно является нетоксичной и фармацевтически приемлемой. Эту кислоту добавляют либо в виде газа, жидкости, либо в виде твердого вещества, растворенного в неводном растворителе. Предпочтительной кислотой является сухой хлористый водород, и молярное количество кислоты, добавляемое к раствору свободного основания пароксетина и носителя, может быть либо в стехиометрическом соотношении со свободным основанием пароксетина, либо в избытке относительно молярного количества свободного основания пароксетина, в частности, при добавлении в виде газа. Например, предпочтительным диапазоном добавляемого хлористого водорода является, но не ограничивается им, диапазон, превышающий в ~1,0-~1,8 раз молярное количество свободного основания пароксетина. Хотя сухой хлористый водород добавляют в виде газа, предпочтительным способом добавления хлористого водорода является его добавление в форме хлористого водорода, растворенного в неводном растворителе, предпочтительно в виде насыщенного хлористым водородом метанола или этанола. Понятно, что после добавления кислоты образованная соль свободного основания остается растворенной в растворе с полимерным носителем.
Наконец, после образования соли свободного основания этот способ продолжается (4) извлечением неводного растворителя с образованием дисперсии твердого состояния соли свободного основания в полимерном носителе. Имеется в виду любой способ удаления неводного растворителя, который образует гомогенную дисперсию твердого состояния, хотя предпочтительными являются способы выпаривания под вакуумом. Предпочтительные способы выпаривания под вакуумом включают в себя ротационное выпаривание, сушку в стационарном вакууме и их комбинации. Понятно, что специалист в области приготовлений фармацевтических композиций сможет определить приемлемую температуру, при которой может быть удален неводный растворитель, при условии, что эта температура не является такой высокой, чтобы вызвать деградацию или разложение материалов; однако, предпочтительно, чтобы выпаривание происходило при ~20oС-~50o С. Предпочтительно также, чтобы выпаривание неводного растворителя производило дисперсию твердого состояния, которая является гомогенной и по существу свободной от неводного растворителя. Под выражением "по существу свободная" подразумевают, что дисперсия твердого состояния содержит менее 20% по весу остаточного неводного растворителя, предпочтительно менее 10%, более предпочтительно менее 5%, наиболее предпочтительно менее 1%.
Отношение свободного основания пароксетина к фармацевтически приемлемому носителю может варьироваться в широком диапазоне и зависит от концентрации пароксетина, требующейся во вводимой в конечном счете фармацевтической дозированной форме. Однако предпочтительным диапазоном пароксетина в твердой суспензии является диапазон ~ 16%-~50% общего веса твердой дисперсии, более предпочтительно ~ 20%-~ 50%, даже более предпочтительно ~25%-~40%, наиболее предпочтительно ~33% общего веса дисперсии.
Альтернативно, общий способ получения твердой дисперсии может осуществляться в виде способа сплавления, в котором водорастворимый фармацевтически приемлемый полимерный носитель смешивают со слабо растворимым в воде лекарственным средством, предпочтительно свободным основанием пароксетина, или комбинацией лекарственных средств с образованием тонкоизмельченной смеси. Эту смесь нагревают при температуре или около температуры наивысшей точки плавления либо фармацевтически приемлемого носителя, либо слабо растворимого в воде лекарственного средства или комбинации лекарственных средств с получением таким образом расплава. Предпочтительным полимерным носителем является полиэтиленгликоль. Предпочтительное весовое отношение водорастворимого фармацевтически приемлемого полимерного носителя к слабо растворимому в воде лекарственному средству находится в диапазоне ~5:1-~1:1, предпочтительно ~4:1-~1:1, более предпочтительно ~3:1-~1,5:1, наиболее предпочтительно ~ 2:1.
Понятно, что добавление слабо растворимого лекарственного средства не ограничивается одним лекарственным средством, но может включать в себя комбинацию одного или нескольких лекарственных средств, при условии, что по меньшей мере одно лекарственное средство является слабо растворимым в воде лекарственным средством в форме свободного основания. Предпочтительно, чтобы слабо растворимым в воде лекарственным средством в форме свободного основания был пароксетин.
Альтернативно, водорастворимый фармацевтически приемлемый полимерный носитель может быть нагрет до расплавленного состояния, после чего слабо растворимое в воде лекарственное средство в виде свободного основания может быть добавлено к расплавленному носителю с образованием таким образом расплавленного гомогенного расплава.
После образования этого расплавленного гомогенного расплава способ продолжается (2) диффундированием сухого газообразного хлористого водорода через
расплавленную смесь
лекарственное средство/носитель для осуществления образования соли лекарственного средства,
Наконец, после образования соли свободного основания способ продолжается (4)
охлаждением
расплавленного гомогенного расплава общепринятыми способами с образованием водорастворимой дисперсии твердого состояния.
Отношение свободного основания пароксетина к фармацевтически приемлемому носителю может варьироваться в широком диапазоне и зависит от концентрации пароксетина, требующейся во вводимой в конечном счете фармацевтической дозированной форме. Однако предпочтительным диапазоном пароксетина в твердой суспензии является диапазон ~ 16%-~50% общего веса твердой дисперсии, более предпочтительно ~ 20%-~ 50%, даже более предпочтительно ~25%-~40%, наиболее предпочтительно ~33% общего веса дисперсии.
Альтернативно, общий способ получения твердой дисперсии может осуществляться путем комбинирования способа сплавления и способа с применением растворителя.
Конкретно, слабо растворимым в воде лекарственным средством является пароксетин; для способа сплавления предпочтительным фармацевтически приемлемым носителем является полиэтиленгликоль; для способа с растворителем предпочтительным фармацевтически приемлемым носителем является поливинилпирролидон или полиэтиленгликоль, предпочтительным растворителем является этанол, предпочтительной фармацевтически приемлемой солью является гидрохлорид, предпочтительным способом добавления хлористого водорода является добавление его в форме раствора хлористого водорода в этаноле и предпочтительным способом извлечения растворителя является извлечение выпариванием при ~20oС-~ 50oС путем комбинирования выпаривания и стационарной вакуумной сушки.
Данное изобретение обеспечивает также фармацевтическую композицию, содержащую фармацевтически приемлемые наполнители и дисперсию твердого состояния гидрохлорида пароксетина и фармацевтически приемлемого полимерного носителя. Примеры фармацевтически приемлемых наполнителей включают в себя разбавители, связывающие вещества, дезинтеграторы, красящие агенты, улучшающие вкус и запах агенты, смазывающие вещества и/или консерванты. Фармацевтическая композиция может быть приготовлена общепринятыми способами смешивания, такими как смешивание (компаундирование), наполнение, гранулирование и прессование. Эти агенты могут быть использованы общепринятым образом, например способом, сходным со способом, уже используемым клинически для антидепрессантов.
Эта композиция обычно представлена в виде композиции унифицированной (стандартной) дозы, содержащей от 1 до 200 мг, более обычно от 5 до 100 мг, например 10-50 мг, такой как 12,5, 20, 25 или 30 мг. Такая композиция обычно принимается от 1 до 6 раз в день, например 2, 3 или 4 раза в день, так что общее количество вводимого активного агента находится в диапазоне 5-400 мг.
Предпочтительные унифицированные (стандартные) дозированные формы представляют собой таблетки или капсулы.
Данное изобретение обеспечивает также способ лечения депрессии у млекопитающих, в том числе у человека, предусматривающий введение эффективного количества фармацевтически приемлемой дисперсии твердого состояния гидрохлорида пароксетина.
Кроме того, данное изобретение обеспечивает дисперсию твердого состояния гидрохлорида пароксетина для применения в лечении депрессии.
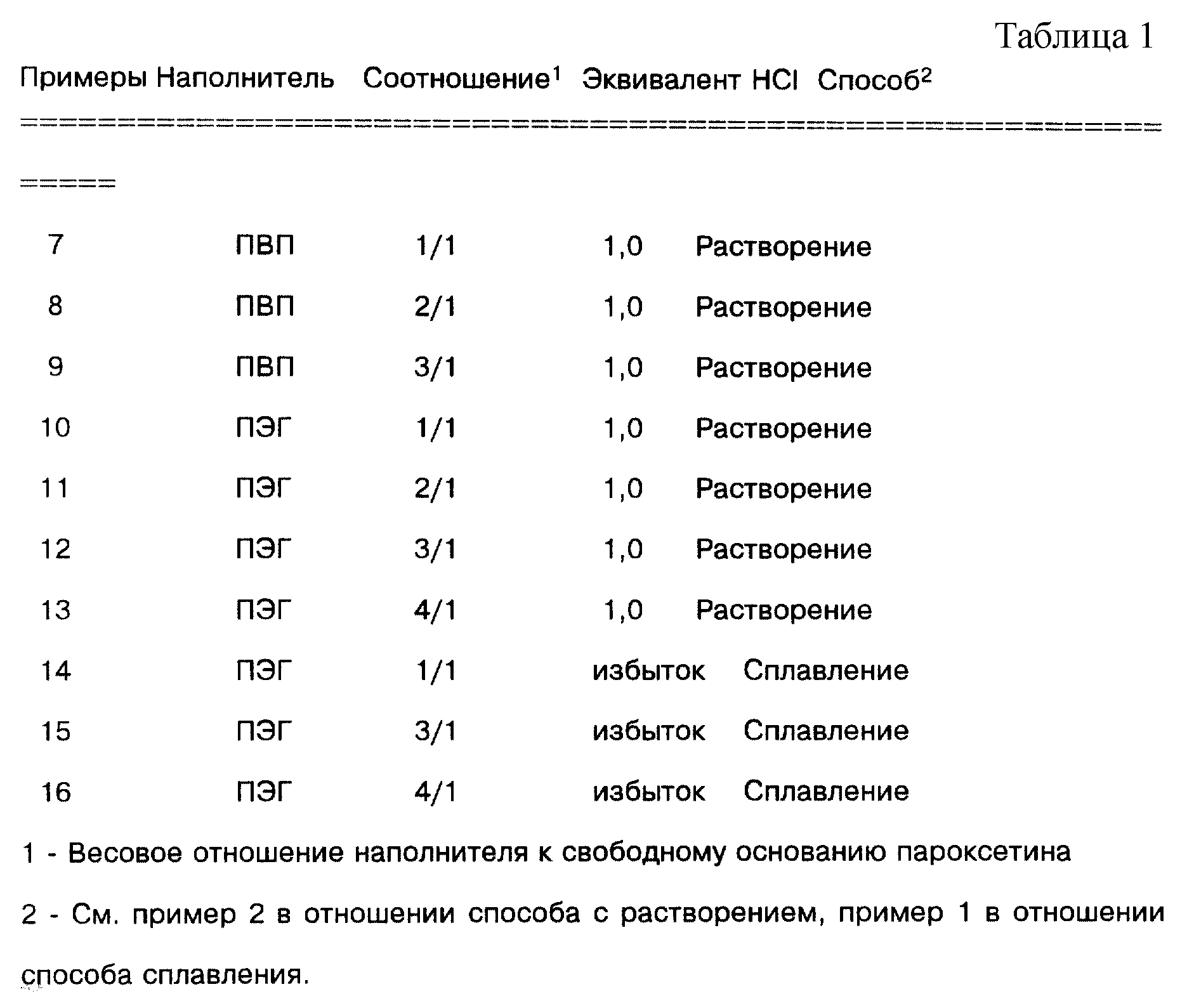
Следующие ниже примеры иллюстрируют данное изобретение. Примеры 1-16 показывают получение дисперсий твердого состояния, тогда как примеры 17 и 18 приводят фармацевтические композиции.
Пример 1
ПЭГ-8000/свободное основание
пароксетина, весовое соотношение 2:1; способ сплавления
В грушеобразную круглодонную колбу на 50 мл (снабженную небольшим перемешивающим стержнем магнитной
мешалки, резиновой мембраной и
стеклянной пипеткой) добавляли ПЭГ-8000 (2,009 г) и свободное основание пароксетина (0,75 г). Колбу погружали в водяную баню, которую нагревали до температуры,
достаточной для плавления ПЭГ. После
достижения свободной текучести стеклянную пипетку осторожно опускали ниже уровня расплава и поток газообразного хлористого водорода (высушенного пропусканием
через концентрированную серную кислоту)
барботировали через эту пипетку в течение 30 минут. Перемешивание поддерживали во время этого процесса. После введения газа пипетку и перемешивающий стержень
удаляли и смеси давали охлаждаться при
комнатной температуре в течение ночи. Отвержденный продукт осторожно выскребали из колбы. Этот материал мог быть необязательно измельчен/размолот до
желательного размера частиц.
1H-ЯМР-анализ (CDCl3) был в полном соответствии со смесью ПЭГ и гидрохлорида пароксетина, и он показывает ожидаемый резонанс для ПЭГ (3,63, м) и характерный сигнал для гидрохлорида пароксетина (2,03, шир. д).
Элементный анализ: Рассчитано для 2,009 : 0,83 (весового соотношения) ПЭГ-8000 и пароксетин-HCl: % С, 56,82; % Н, 8,07;% N, 1,04;% Cl, 2,83. Найдено: % С, 56, 71;% Н, 8,28;% N, 1,00;% Cl, 3,44.
Пример 2
ПЭГ-8000/свободное основание пароксетина. весовое соотношение 2:1: способ
растворения
В круглодонную колбу на 200 мл
(снабженную небольшим перемешивающим стержнем магнитной мешалки, резиновой мембраной) добавляли ПЭГ-8000 (10,0 г) и метанол (140 мл). Добавляли
свободное основание пароксетина (4,994 г) и перемешивали
в течение приблизительно 5 минут до полного растворения.
В отдельной процедуре готовили раствор HCl в метаноле барботированием газообразного HCl (9,81 г) во взвешенный раствор метанола (50 мл). Этот стандартный раствор (0,196 г/мл) мог бы быть использован для других экспериментов.
Раствор HCl в метаноле (5 мл), приготовленный, как описано выше, добавляли в колбу на 200 мл и перемешивание продолжали в течение 10 минут. Перемешивающий стержень удаляли, колбу помещали на роторный испаритель и концентрировали с температурой бани 35oС. После получения густой пасты колбу помещали под стационарный вакуум высокого давления, который продолжался в течение 18 часов. Иногда материал соскребали с боковых стенок колбы для содействия удалению остаточных летучих компонентов. Продукт выскребали из колбы, и он мог быть измельчен/размолот до приемлемого размера частиц.
1H-ЯМР-анализ (СDСl3) был в полном соответствии со смесью ПЭГ и гидрохлорида пароксетина, и он показывает ожидаемый резонанс для ПЭГ (3,63, м) и характерный сигнал для гидрохлорида пароксетина (2,03, шир. д). Остаточный метанол не был обнаружен.
Элементный анализ: Рассчитано для 10000 : 5,54 (весового соотношения) ПЭГ-8000 и пароксетин-HCl: % С, 57, 31;% Н, 7,86;% N, 1,27;% Cl, 3,43. Найдено: % С, 57,31;% Н, 8,07;% N, 1,21;% Cl, 4, 38.
Пример 3
ПЭГ-8000/свободное основание пароксетина, весовое соотношение 4:1; способ
растворения
С использованием ПЭГ-8000 (4,013 г) и свободного основания
пароксетина (1,015 г) и раствора HCl в метаноле (1 мл раствора 0,19 г/мл) и способа примера 2 готовили твердую
дисперсиию ПЭГ/гидрохлорида пароксетина с весовым соотношением 4:1.
1H-ЯМР-анализ (CDCl3) был в полном соответствии со смесью ПЭГ и гидрохлорида пароксетина, и он показывает ожидаемый резонанс для ПЭГ (3,63, м) и характерный сигнал для гидрохлорида пароксетина (2,03, шир. д). Остаточный метанол не был обнаружен.
Элементный анализ: Рассчитано для 4,013 : 1,126 (весового соотношения) ПЭГ-8000 и пароксетин-HCl: % С, 56,23;% Н, 8,32; % N, 0,78;% Cl, 2,11. Найдено: % С, 56,11;% Н, 8,60;% N, 0,72;% Cl, 2,63.
Пример 4
ПЭГ-8000/свободное основание пароксетина, весовое соотношение 1:1; способ растворения с
использованием раствора HCI в этаноле
Раствор HCl в этаноле готовили барботированием газообразного HCl
(3,23 г) в раствор (50 мл) абсолютного этанола.
С использованием ПЭГ-8000 (2,007 г) и свободного основания пароксетина (2,066 г) в смеси этанола (15 мл) и метанола (8 мл), к которой добавляли раствор HCl в этаноле (3 мл), и способа примера 2 готовили твердую дисперсию ПЭГ/гидрохлорида пароксетина с весовым соотношением 1:1.
1H-ЯМР-анализ (CDCl3) был в полном соответствии со смесью ПЭГ и гидрохлорида пароксетина, и он показывает ожидаемый резонанс для ПЭГ (3,63, м) и характерный сигнал для гидрохлорида пароксетина (2,03, шир. д). Был обнаружен остаточный метанол (5% по весу).
Элементный анализ: Рассчитано для 2,007 : 2,292 (весового соотношения) ПЭГ-8000 и пароксетин-HCl: % С, 58,77;% Н, 7,29;% N, 1,90;% Cl, 5,15. Найдено: % С, 59,18;% Н, 7,72;% N, 1,98;% Cl, 4,95.
Пример
5
ПВП 29/32К/свободное основание пароксетина, весовое соотношение 2:1; способ растворения
С использованием
ПВП 29/32К (2,077 г), свободного основания пароксетина (1,088 г), метанола
(28 мл), раствора HCl в метаноле (1,0 мл раствора 0,196 г/мл) и способа примера 2 готовили твердую дисперсию
ПВП/гидрохлорида пароксетина с весовым соотношением 2:1.
1 H-ЯМР-анализ (CDCl3) был в полном соответствии со смесью ПВП и гидрохлорида пароксетина, и он показывает ожидаемый резонанс для ПВП (ряд шир. м 3,4-1,6) и характерный сигнал для гидрохлорида пароксетина (2,03, шир. д). Был обнаружен остаточный метанол (4% по весу).
Элементный анализ: Рассчитано для 2,077 : 1,118 (весового соотношения) ПВП и пароксетин-HCl: % С, 61,13;% Н, 7,74;% N, 8,82;% Cl, 5,89. Найдено: % С, 62,49;% Н, 7,63;% N, 9,12;% Cl, 6,33.
Пример 6
ПЭГ-8000/свободное основание пароксетина, весовое соотношение 2:1; способ с
растворителем
Как и в примере 2, с использованием этанола вместо метанола в качестве растворителя, раствора
HCl в этаноле (раствора, приготовленного в примере 4), готовили ПВП 29/32К
/свободное основание пароксетина, весовое соотношение 2,006 : 1,048.
1H-ЯМР-анализ (CDCl3) был в полном соответствии со смесью ПВП и гидрохлорида пароксетина, и он показывает ожидаемый резонанс для ПВП (ряд шир. м 3,4-1,6) и характерный сигнал для гидрохлорида пароксетина (2,03, шир. д). Был обнаружен остаточный этанол (14% по весу).
Элементный анализ: Рассчитано для 2,006 : 1,048: 0,124 (весового соотношения) ПВП/пароксетин-HCl/HCl: % С, 59,96;% Н, 7,23;% N, 8,59;% Cl, 7,07. Найдено: % С, 61,39;% Н, 7,32;% N, 8,67;% Cl, 7,96.
С использованием вышеописанных способов и их модификаций специалистом в данной области могли бы быть приготовлены следующие дополнительные примеры, представленные в табл.1.
Доза и
состав
Соединения данного изобретения могут быть введены любым способом, который производит контакт
активного агента с местом действия агента, ингибирования повторного поглощения серотонина,
в теле млекопитающего. Они могут быть введены любым общепринятым способом, пригодным для применения в
сочетании с фармацевтическими веществами, либо в виде индивидуальных терапевтических агентов, либо
в комбинации терапевтических агентов.
Вводимая доза новых соединений этого изобретения будет, конечно, варьироваться в зависимости от известных факторов, таких как фармакодинамические характеристики конкретного агента и его схема введения и путь введения; возраст, состояние здоровья и вес реципиента; характер и степень симптомов; тип сопутствующего лечения; частота введения лекарственных средств и желательный эффект. Можно ожидать, что суточная доза активного ингредиента будет ~0,001-10 миллиграммов на килограмм веса тела.
Дозированные формы (композиции, пригодные для введения) содержат от ~0,1 мг до ~ 100 мг активного ингредиента на единицу. В этих фармацевтических композициях активный ингредиент обычно будет присутствовать в количестве ~ 0,5-50% по весу на основе общего веса композиции.
Активный ингредиент может вводиться перорально в твердых дозированных формах, таких как капсулы, таблетки и порошки.
Желатиновые капсулы содержат активный ингредиент и порошкообразные носители, такие как лактоза, крахмал, производные целлюлозы, стеарат магния, стеариновая кислота и т.п. Те же самые разбавители могут быть использованы для получения прессованных таблеток. Как таблетки, так и капсулы могут быть приготовлены в виде продуктов пролонгированного действия для обеспечения непрерывного высвобождения лекарственного средства на протяжении периода нескольких часов. Прессованные таблетки могут иметь сахарное покрытие или пленочное покрытие для маскировки неприятного вкуса и защиты таблетки от наружной атмосферы или энтеросолюбильное покрытие для избирательной дезинтеграции в желудочно-кишечном тракте.
Подходящие фармацевтические наполнители описаны в "Remington's Pharmaceutical Sciences", Mack Publishing Company, стандартном справочнике в этой области.
Применимые фармацевтические дозированные формы для введения соединений этого изобретения
могут быть проиллюстрированы, как представлено ниже:
Капсулы
Большое количество
унифицированных капсул получают заполнением состоящих из двух частей твердых желатиновых капсул,
каждая из которых содержит 10 мг порошкообразного активного ингредиента, 150 мг лактозы, 50 мг
целлюлозы и 6 мг стеарата магния.
Мягкие желатиновые капсулы
Готовят смесь
активного ингредиента в усвояемом масле, таком как соевое масло, хлопковое масло или оливковое
масло, и вводят при помощи нагнетающего поршневого насоса в желатин с получением мягких желатиновых
капсул, содержащих 10 мг активного ингредиента. Капсулы промывают и сушат.
Таблетки
Большое количество таблеток готовят общепринятыми процедурами, так чтобы эта дозированная
единица содержала 10 мг активного ингредиента, 0,2 мг коллоидального диоксида кремния, 5 мг
стеарата магния, 275 мг микрокристалллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы. Для улучшения
вкусовых качеств или задержки абсорбции (всасывания) могут быть нанесены соответствующие
покрытия.
Нижеследующие примеры дополнительно иллюстрируют характерный вариант данного изобретения и рассматриваются как иллюстративное, а не ограничительное описание этого изобретения.
Пример 17
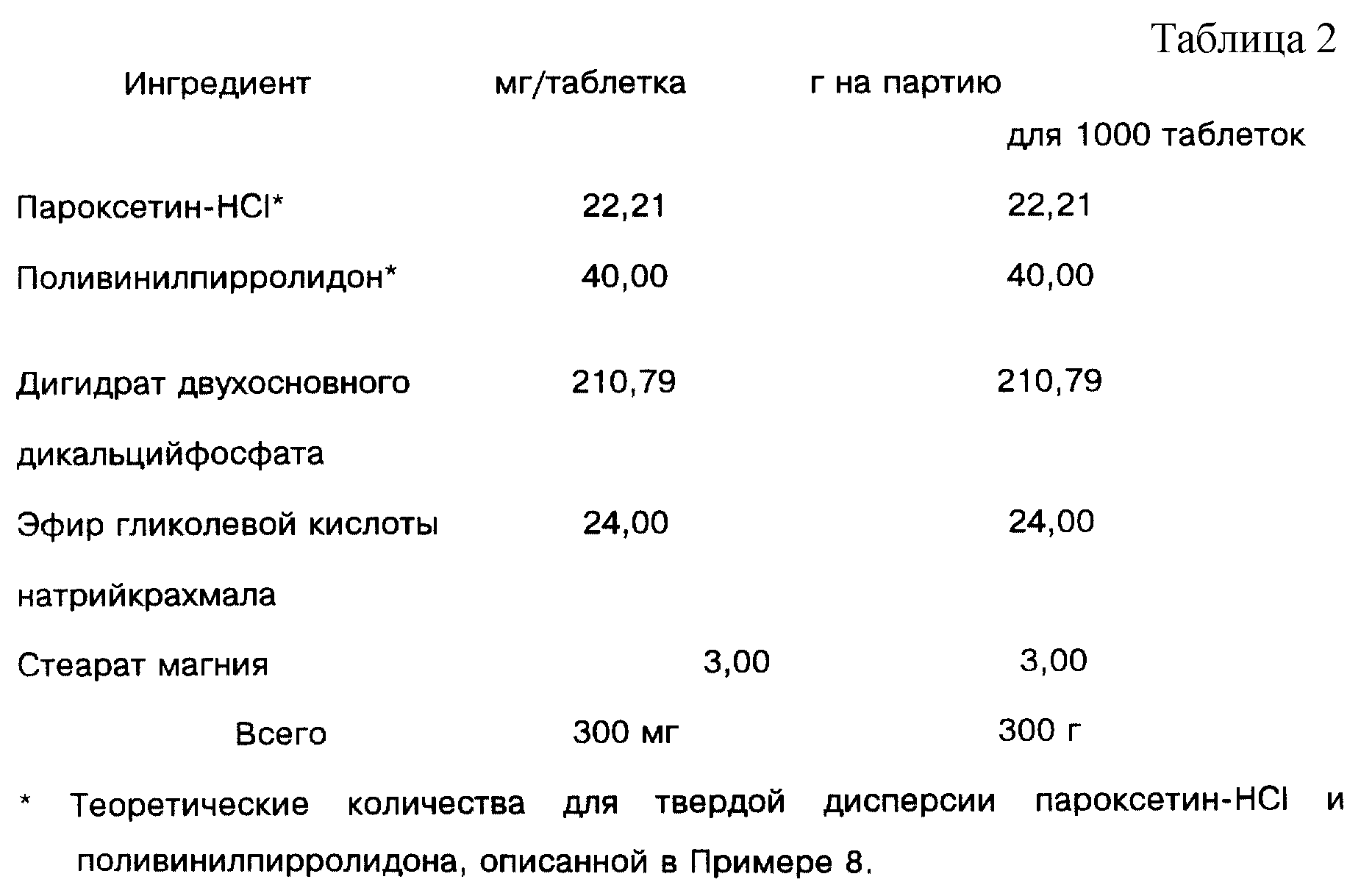
Содержащая 20 мг основания пароксетина (в виде соли HCl) таблетка,
использующая твердую дисперсию, описанную в примере 8 (см. табл.2).
Процедура: Измельчите твердую дисперсию пароксетин-HCl/поливинилпирролидона пропусканием через сито 20 меш. Смешайте измельченную твердую дисперсию с дигидратом двухосновного дикальцийфосфата, эфиром гликолевой кислоты натрийкрахмала и стеаратом магния. Спрессуйте таблетки до веса 300 мг с твердостью таблеток приблизительно 17 единиц Strong-Cobb.
Пример 18
Содержащая 20
мг основания пароксетина (в виде соли HCl) таблетка, использующая твердую дисперсию, описанную в примере 11
(см.табл.3)
Процедура: Измельчите твердую дисперсию
пароксетин-HCl/полиэтиленгликоля пропусканием через сито 20 меш. Смешайте измельченную твердую дисперсию с дигидратом двухосновного
дикальцийфосфата, эфиром гликолевой кислоты натрийкрахмала и
стеаратом магния. Спрессуйте таблетки до веса 300 мг с твердостью таблеток приблизительно 17 единиц Strong-Cobb.
Реферат
Изобретение относится к фармацевтике. Твердые дисперсии фармацевтически приемлемого носителя и некристаллического дегидрата гидрохлорида пароксетина. Дисперсии готовят растворением свободного основания пароксетина, контактированием с кислотой и удалением неводного растворителя либо сплавлением свободного основания пароксетина с фармацевтическим носителем, контактирование с хлористым водородом, охлаждение расплава. Изобретение позволяет улучшить формование продукта. 11 с. и 16 з.п. ф-лы, 3 табл.

Комментарии