Фармацевтическая композиция на основе фитонутриентов с повышенной биодоступностью, обладающая противоопухолевой активностью, и способ ее получения (варианты) - RU2494733C1
Код документа: RU2494733C1
Чертежи








Описание
Изобретение относится к области фармации и касается новых фармацевтических композиций для пероральной доставки фитонутриентов, обладающих противоопухолевой активностью.
Роль соединений растительного происхождения в создании новых лекарственных препаратов в последние годы вызывает небывалый интерес. Этому вопросу посвящены многочисленные исследования, в результате которых выявлен ряд соединений, обладающих широким спектром биологических активностей, таких как флавоноиды, флавины, катехины и др. (John Boik (2012) Natural Compounds in Cancer Therapy, book, 521).
Наибольший интерес вызывают следующие фитонутриенты: дииндолилметан (является индолом растений, найденным в крестоцветных овощах, таких как брокколи, брюссельская и цветная капуста; формула соединения - C17H14N2), эпигаллокатехин-3-галлат (это тип катехина, содержащийся в больших количествах в чае; формула соединения - C22H18O11), гинестеин (изофлавон, являющийся натуральным компонентом, одним из источником которого является соя; формула соединения - C15H10O5), ресвератрол (природный фитоалексин, содержащийся в кожуре красного винограда и некоторых других ягод и растений, выделяемый ими в качестве защитной реакции против паразитов, таких как бактерии или грибы; формула соединения - C14H12O3) куркумин (основной куркуминоид, входящий в состав корня куркумы, к куркуминоидам также относятся диметоксикуркумин и бис-диметоксикуркумин; формула соединения - C21H20O6).
Установлено, что эти соединения растительного происхождения ингибируют пролиферацию опухолевых клеточных линий различного происхождения in vitro. Максимальные эффекты наблюдаются в диапазоне 5-50 микромолей. Такие концентрации не достижимы при употреблении этих веществ с пищей. Попытка воспроизвести противоопухолевую активность этих веществ in vivo не всегда приводит к успеху.
Детальное изучение молекулярных механизмов противоопухолевого действия показало, что эти вещества подавляют многочисленные сигнальные каскады управляющие ростом и метастазированием опухолей. Они восстанавливают апоптотические свойства трансформированных клеток, что приводит к их естественной смерти через механизм программируемой гибели. Детально изучены антиангиогенные свойства этих веществ, которые вносят существенный вклад в их противоопухолевое действие, подавляя рост новых сосудов в растущей опухоли. Недавно описана способность некоторых фитонутриентов избирательно ингибировать жизнеспособность опухолевых стволовых клеток. Вероятно, это уникальное свойство обусловлено действием на эмбриональные сигнальные каскады. Установлено, что этот класс соединений повышает чувствительность опухолей к действию цитостатиков и предотвращает развитие радиорезистентности, развивающейся в процессе лучевой терапии. Таким образом, не вызывает сомнений огромный терапевтический потенциал фитонутриентов (Fazlul H. Sarkar, Yiwei Li, Zhiwei Wang and Dejuan Kong (2009) Cellular signaling perturbation by natural products. Cell Signal, 21(11), 1541-1547; Sanjeev Banerjee, Dejuan Kong, Zhiwei Wang, Bin Bao, Gilda G. Hillman, Fazlul H. Sarkar (2011) Attenuation of multi-targeted proliferation-linked signaling by 3,30-diindolylmethane (DIM): From bench to clinic, Mutation Research, 728(1-2), 47-66). Активному внедрению в практику лекарственных средств на их основе, по общему мнению, препятствует их низкая биодоступность. Для многих из них установлено, что при пероральном введении даже значительных доз фитонутриентов, достигающих граммов не удается достичь эффективных концентраций в крови и органах-мишенях.
Для решения этой задачи, предпринимаются значительные усилия и разрабатываются различные подходы. Описано использование плюроников для улучшения биодоступности гинестеина (Suk Hyung Kwon, Sun Young Kim, Kyoung Wook Ha et al. (2007) Pharmaceutical Evaluation of Genistein-loaded Pluronic Micelles for Oral Delivery, Arch Pharm Res, 30(9), 1138-1143). Продолжается поиск новых формуляций для других фитонутриентов (Imtiaz A. Siddiqui, Vaqar M. Adhami, Nihal Ahmad and Hasan Mukhtar (2010) Nanochemoprevention: Sustained Release of Bioactive Food Components for Cancer Prevention, Nutr Cancer, 62(7), 883-890; Lu Y, Ding N, Yang C, Huang L, Liu J, Xiang G. (2012) Preparation and in vitro evaluation of a folate-linked liposomal curcumin formulation, Liposome Research, 22(2), 110-119).
Авторами разработаны технологические решения, позволяющие повысить биодоступность дииндолилметана (DIM) и эпигаллокатехин-3-галлата(EGCG). Наиболее близкими к предложенным являются фармацевтические композиции для пероральной доставки дииндолилметана и способ их получения, описанные в патенте РФ №2409363. Фармацевтическая композиция для перорального введения содержит 3,3-дииндолилметан (DIM) в качестве активного компонента и целевую добавку - блок-сополимер оксиэтилена и оксипропилена, в котором содержание гидрофобного блока составляет менее 50 мас.%, а молекулярная масса гидрофильного блока составляет 2250 Да и более, при соотношении активного компонента и выбранного блок-сополимера 10:1-2:1. В качестве блок-сополимера оксиэтилена и оксипропилена композиция содержит предпочтительно Плюроник F127, дополнительно может содержать Плюроник L10, а также фармацевтически приемлемый носитель. Один из возможных способов получения фармацевтической композиции включает растворение Плюроника F127 в этиловом спирте, растворение DIM в этиловом спирте, смешивание растворов, обработку их ультразвуком, удаление этанола на роторном растворителе или «спидваке» и выпаривание под вакуумом.
Применение различных подходов для решения задачи повышения биодоступности DIM показало, что каждое из соединений требует индивидуальных решений. В частности, использование плюроников для работы с DIM позволило не только существенно увеличить биодоступность, но разработать промышленную технологию получения субстанции DIM в новой, биодоступной формуляции. Аналогичный подход в работе с EGCG улучшал биодоступность вещества, но не позволил решить проблему масштабного производства. Использование плюроников для получения биодоступных композиции на примере других фитонутриентов, в частности катехинов зеленого чая, также не позволило разработать промышленную технологию получения препарата.
Следует отметить, что сочетанное применение этих веществ приводит к выраженному синергетическому эффекту. То есть получение комбинированных препаратов на основе фитонутриентов открывает дополнительные возможности в их использовании в клинической практике. С этой целью необходимы универсальные технологические решения, которые позволяли бы усилить биодоступность этих соединений, получать комбинированные препараты, содержащие два и более соединений и, соответствовали требованиям, предъявляемым фармтехнологиям в условиях промышленного производства.
Задачей настоящего изобретения явилось расширение арсенала фармацевтических композиций на основе фитонутриентов и способов их получения, а именно, получение новых наномицеллярных структур, содержащих фитонутриенты и обеспечивающих высокую биодоступность при пероральном применении и стабильность при хранении.
Задача решается тем, что в фармацевтической композиции для перорального введения, обладающей противоопухолевой активностью, включающей, по меньшей мере, один фитонутриент и солюбилизатор, согласно изобретению, по меньшей мере, один фитонутриент выбранный из ряда: эпигаллокатехин-3-галлат, дииндолилметан, гинестеин, ресвератрол, куркумин, а в качестве солюбилизатора композиция включает привитый сополимер поливинилкапролактам/поливинилацетат /полиэтиленгликоль со средней молекулярной массой 90000-140000 г/моль при массовом соотношении, по меньшей мере, одного фитонутриента и солюбилизатора от 1:5 до 1:1.
Кроме того, композиция может дополнительно включать фармацевтически приемлемый носитель.
Задача также решается способом получения фармацевтической композиции для перорального введения (по первому варианту), обладающей противоопухолевой активностью, заключающимся в том, что растворяют солюбилизатор в органическом растворителе, растворяют, по меньшей мере, один фитонутриент в таком же органическом растворителе, смешивают полученные растворы и отгоняют растворитель в вакууме, при этом согласно изобретению используют, по меньшей мере, один фитонутриент, выбранный из ряда: эпигаллокатехин-3-галлата, дииндолилметан, гинестеин, ресвератрол, куркумин, в качестве солюбилизатора используют привитый сополимер поливинилкапролактам/ поливинилацетат/ полиэтиленгликоль со средней молекулярной массой 90000-140000 г/моль, при массовом соотношении, по меньшей мере, одного фитонутриента и солюбилизатора от 1:1 до 1:5, после смешивания растворов нагревают полученную смесь до 45-50°C при постоянном перемешивании, а после отгонки сушат продукт в вакууме.
Кроме того, в качестве органического растворителя может быть использован этанол, или ацетон, или изопропанол.
Кроме того, после сушки в полученный продукт может быть введен фармацевтически приемлемый носитель.
Задача также решается способом получения фармацевтической композиции для перорального введения (по второму варианту), заключающимся в том, что смешивают порошок солюбилизатора, в качестве которого используют привитый сополимер поливинилкапролактам/ поливинилацетат/ полиэтиленгликоль со средней молекулярной массой 90000-140000 г/моль и порошок, по меньшей мере, одного фитонутриента, выбранного из ряда эпигаллокатехин-3-галлата, дииндолилметан, гинестеин, ресвератрол, куркумин, при массовом соотношении, по меньшей мере, одного фитонутриента и солюбилизатора от 1:1 до 1:5, перемешивают смесь до получения однородного порошка.
Кроме того, при смешивании может быть добавлен порошкообразный фармацевтически приемлемый носитель.
Предложенный способ по второму варианту (метод сухого смешения) является более простым и дешевым. И хотя увеличение биодоступности фитонутриента при использовании этого варианта способа существенно меньше, чем при использовании первого варианта, этого часто бывает достаточно для решения профилактических задач, когда не нужны высокие концентрации активных веществ.
В качестве фармацевтически приемлемого носителя могут использоваться общепринятые в фармацевтической практике вспомогательные вещества, включающие разбавители, например лактоза, крахмал, производные крахмала, микрокристаллическая целлюлоза, маннит, инвертированый сахар, декстроза и др., дезинтегрирующие агенты, такие как натрий карбокиметилцеллюлоза, кроскармелоза, желатинированный крахмал, связующие, выбранные из поливинилпирролидона, желатина, производных целлюлозы, природных камедей, полиэтиленгликолей, альгината натрия, антифрикционные агенты, например стеариновая кислота и/или ее соли, коллоидный диоксид кремния, тальк, бензоат натрия, красители, подсластители и др.
В случае если композиция включает носитель, его вводят дополнительно после сушки массы твердой дисперсии. Затем смесь может быть сформована в виде подходящей для перорального введения лекарственной формы. При этом фармацевтическая композиция может представлять любую пригодную для перорального введения лекарственную форму, предпочтительно, она может представлять собой таблетку, или лиофилизированный порошок, или суспензию, или капсулу.
Полученные заявляемым способом композиции проявляют активность, обусловленную активной субстанцией - фитонутриентом и их смесями.
В одном из предпочтительных вариантов, предлагаемым способом можно получить фармацевтическую композицию для лечения или профилактики опухолевых заболеваний.
Привитый сополимер поливинилкапролактам/ поливинилацетат /полиэтиленгликоль выпускается в частности фирмой BASF под торговым наименованием Soluplus" и имеет формулу:

Сополимер способен образовывать "твердые растворы" с малорастворимыми активными ингредиентами лекарственных средств, повышая тем самым их усвояемость организмом человека. Он был разработан в 2007 году, а в 2009 году впервые представлен широкой публике в качестве инновационного наполнителя.
Данный продукт разработан специально для современного способа производства лекарств путем экструзии из расплава. Эта технология получает все более широкое распространение, поскольку она позволяет создавать технологии получения готовых лекарственных форм с лекарственными веществами, которые характеризуются малой растворимостью и низкой всасываемостью из желудочно-кишечного тракта. Суть способа состоит в следующем: отдельные компоненты, входящие в состав лекарства, помещаются в экструдер, перемешиваются и расплавляются при высокой температуре с последующим добавлением полимерного продукта Soluplus®. При этом активные фармацевтические ингредиенты растворяются в полимере, образуя так называемые "твердые растворы". В итоге те лекарственные вещества, которые при использовании иных вариантов готовых лекарственных форм характеризуются низкой биологической доступностью, гораздо лучше усваиваются организмом при приеме препаратов с новой основой для готовых лекарственных форм (http://www.pharma-ingredients.basf.com/Documents/ENP/Poster/EN/GNOMD387.pdf).
Фитонутриенты, представляющие собой активные субстанции, согласно предлагаемому способу имеют различную растворимость, например эпигаллокатехин-3-галлат растворим в воде, а куркумин - практически не растворим. Проблема заключается в том, что все они не выдерживают высоких температур, поэтому получать их лекарственные формы известным способом не представляется возможным.
Нами неожиданно было установлено, что если фитонутриенты подвергнуть процессу молекулярного содиспегирования с полимерным компонентом в подобранном со-растворителе, выбранном из этанола, изопропанола, ацетона с последующим высушиванием, можно получить стабильную фармацевтическую композицию с улучшенной биодоступностью.
При этом образуется твердый водорастворимый продукт, который при смешении с водной средой формирует коллоидные мицеллы, лучше усвояемые организмом.
В твердые растворы можно ввести от 20 до 50% (в зависимости от природы вещества) активной фармацевтической субстанции, такой как дииндолилметан, эпигаллокатехин-3-галлат, гинестеин, ресвератрол, куркумин, или их смесей.
Изобретение поясняется следующими графическими материалами:
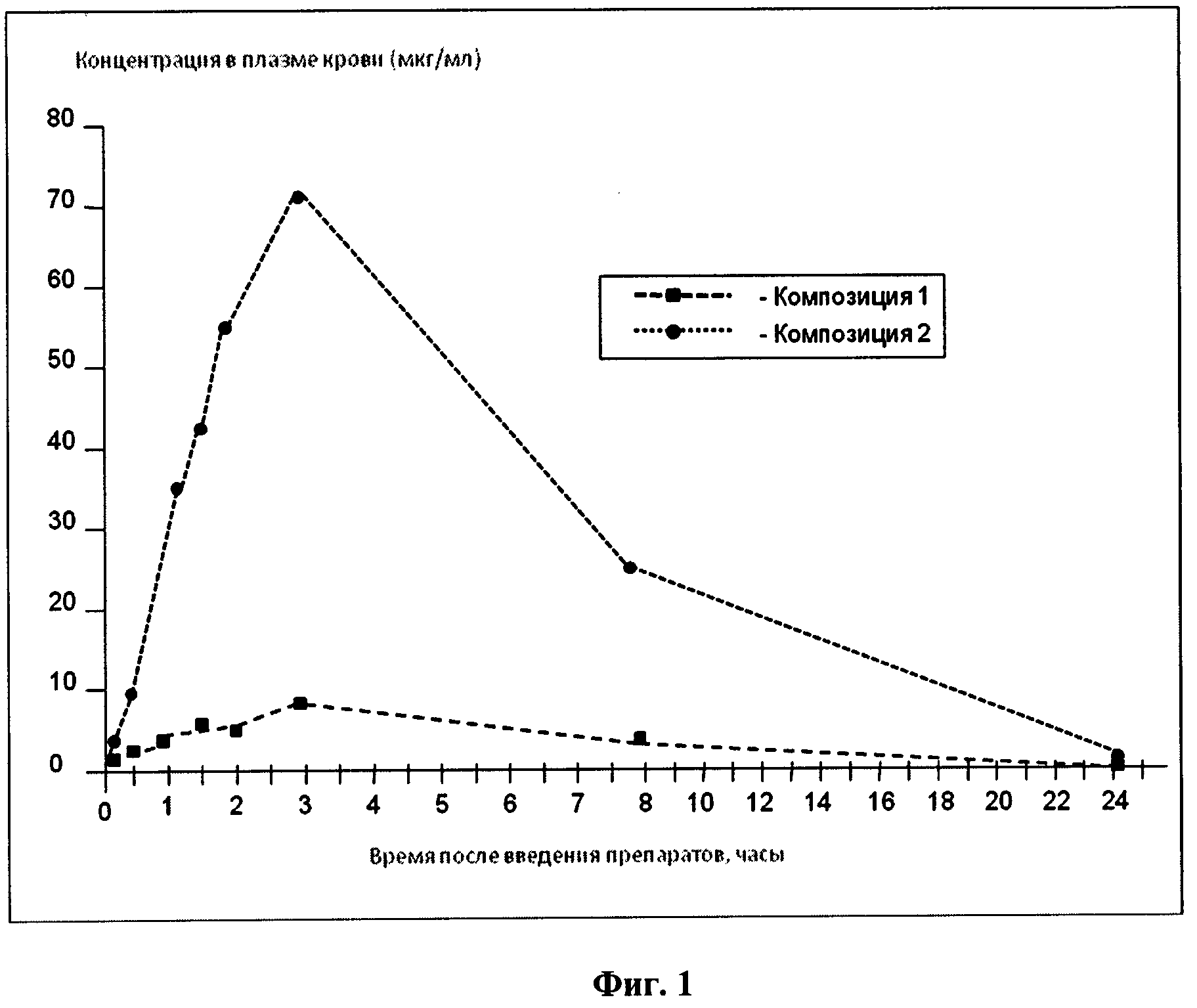
Фиг.1 - фармакокинетический профиль эпигаллокатехин-3-галлата в плазме крыс.
Композиция 1 - Эпигаллокатехин-3-галлат
Композиция 2 - формуляция по примеру 1
Фиг.2 - фармакокинетический профиль генистина в плазме крыс.
Композиция 1 - Гинестеин
Композиция 2 - формуляция по примеру 2
Фиг.3 - фармакокинетический профиль ресвератрола в плазме крыс.
Композиция 1 - Ресвератрол
Композиция 2 - формуляция по примеру 3
Фиг.4 - фармакокинетический профиль куркумина в плазме крыс.
Композиция 1 - Куркумин
Композиция 2 - формуляция по примеру 4
Фиг.5 - фармакокинетический профиль дииндолилметан а в плазме крыс.
Композиция 1 - Дииндолилметан
Композиция 2 - формуляция по примеру 5
Фиг.6 - результаты исследования противоопухолевой эффективности фитонутриентов в экспериментах in vivo.
Композиция 1 - Контроль
Композиция 2 - Контроль: Soluplus®
Композиция 3 - Дииндолилметан
Композиция 4 - формуляция по примеру 5
Композиция 5 - Эпигаллокатехин-3-галлат
Композиция 6 - формуляция по примеру 1
Композиция 7 - Куркумин
Композиция 8 - формуляция по примеру 4
Композиция 9 - Ресвератрол
Композиция 10 - формуляция по примеру 3
Композиция 11 - Гинестеин
Композиция 12 - формуляция по примеру 2
Фиг.7 - результаты исследования противоопухолевого действия комбинированного препарата (дииндолилметан и куркумин).
Композиция 1 - Контроль
Композиция 2 - Контроль: Soluplus®
Композиция 3 - Дииндолилметан
Композиция 4 - формуляция по примеру 5
Композиция 5 - Куркумин
Композиция 6 - формуляция по примеру 4
Композиция 7 - формуляция по примеру 6
Фиг.8 - результаты исследования противоопухолевого действия комбинированного препарата (дииндолилметан и ресвератрол).
Композиция 1 - Контроль
Композиция 2 - Контроль: Soluplus®
Композиция 3 - Дииндолилметан
Композиция 4 - формуляция по примеру 5
Композиция 5 - Ресвератрол
Композиция 6 - формуляция по примеру 3
Композиция 7 - формуляция по примеру 7
Фиг.9 - результаты исследования противоопухолевого действия комбинированного препарата (эпигаллокатехин-3-галлат и гинестеин).
Композиция 1 - Контроль
Композиция 2 - Контроль: Soluplus®
Композиция 3 - Эпигаллокатехин-3-галлат
Композиция 4 - Формуляция по примеру 1
Композиция 5 - Гинестеин
Композиция 6 - Формуляция по примеру 2
Композиция 7 - Формуляция по примеру 8
Изобретение иллюстрируется следующими примерами.
Пример 1.
Получение формуляции эпигаллокатехин-3-галлата.
Привитый сополимер поливинилкапролактам/ поливинилацетат /полиэтиленгликоль со средней молекулярной массой, определенной методом гель-проникающей хроматографии, 90000 г/моль в количестве 5 г растворяют при перемешивании в 50 мл этанола. Отдельно получают раствор 1 г эпигаллокатехин-3-галлата в 20 мл изопропанола соответственно. Затем при перемешивании добавляют раствор эпигаллокатехин-3-галлата к раствору полимера. Полученный раствор нагревают до 45°C при постоянном перемешивании, после чего отгоняют растворитель досуха и сушат в вакуум-сушильном шкафу. Получают твердый слегка окрашенный продукт.
Пример 2.
Получение формуляции гинестеина.
5 г привитого сополимера поливинилкапролактам/ поливинилацетат /полиэтиленгликоль со средней молекулярной массой, определенной методом гель-проникающей хроматографии 140000 г/моль растворяют при перемешивании в 50 мл ацетона. Отдельно получают раствор 2 г гинестеина в 20 мл этанола. Затем при перемешивании добавляют раствор гинестеина к раствору полимера. Полученный раствор нагревают до 50°C при постоянном перемешивании, после чего отгоняют растворитель досуха и сушат в вакуум-сушильном шкафу. Получают твердый слегка окрашенный продукт.
Пример 3. Получение формуляции ресвератрола.
5 г привитого сополимера поливинилкапролактам/ поливинилацетат /полиэтиленгликоль 600 со средней молекулярной массой, определенной методом гель-проникающей хроматографии 110000 г/моль растворяют при перемешивании в 50 мл изопропанола. Отдельно получают раствор 3 г ресвератрола в 20 мл этанола. Затем при перемешивании добавляют раствор ресвератрола к раствору полимера. Полученный раствор нагревают до 45°C при постоянном перемешивании, после чего отгоняют растворитель досуха и сушат в вакуум-сушильном шкафу. Получают твердый слегка окрашенный продукт.
Пример 4.
Получение формуляции куркумина.
5 г привитого сополимера поливинилкапролактам/ поливинилацетат /полиэтиленгликоль со средней молекулярной массой, определенной методом гель-проникающей хроматографии 90000 г/моль растворяют при перемешивании в 50 мл ацетона. Отдельно получают раствор 4 г куркумина в 20 мл ацетона. Затем при перемешивании добавляют раствор куркумина к раствору полимера. Полученный раствор нагревают до 50°C при постоянном перемешивании, после чего отгоняют растворитель досуха и сушат в вакуум-сушильном шкафу. Получают твердый слегка окрашенный продукт.
Пример 5.
Получение формуляции дииндолилметана.
5 г привитого сополимера поливинилкапролактам/ поливинилацетат /полиэтиленгликоль со средней молекулярной массой, определенной методом гель-проникающей хроматографии 140000 г/моль растворяют при перемешивании в 50 мл этанола. Отдельно получают раствор 5 г дииндолилметана в 20 мл этанода. Затем при перемешивании добавляют раствор дииндолилметана к раствору полимера. Полученный раствор нагревают до 45°C при постоянном перемешивании, после чего отгоняют растворитель досуха и сушат в вакуум-сушильном шкафу. Получают твердый слегка окрашенный продукт.
Пример 6.
Получение формуляции дииндолилметана + куркумин
5 г привитого сополимера поливинилкапролактам/ поливинилацетат /полиэтиленгликоль со средней молекулярной массой, определенной методом гель-проникающей хроматографии 140000 г/моль растворяют при перемешивании в 50 мл этанола. Отдельно получают раствор 3 г дииндолилметана и 2 г куркумина в 20 мл изопропанола. Затем при перемешивании добавляют раствор фитонутриентов к раствору полимера. Полученный раствор нагревают до 45°C при постоянном перемешивании, после чего отгоняют растворитель досуха и сушат в вакуум-сушильном шкафу. Получают твердый слегка окрашенный продукт.
Пример 7.
Получение формуляции дииндолилметана+ресвератрол
5 г привитого сополимера поливинилкапролактам/ поливинилацетат /полиэтиленгликоль со средней молекулярной массой, определенной методом гель-проникающей хроматографии 140000 г/моль растворяют при перемешивании в 50 мл этанола. Отдельно получают раствор 2 г дииндолилметана и 2 г ресвератрола в 20 мл изопропанола. Затем при перемешивании добавляют раствор фитонутриентов к раствору полимера. Полученный раствор нагревают до 45°C при постоянном перемешивании, после чего отгоняют растворитель досуха и сушат в вакуум-сушильном шкафу. Получают твердый слегка окрашенный продукт.
Пример 8.
Получение формуляции эпигаллокатехин-3-галлата+гинестеин
5 г привитого сополимера поливинилкапролактам/ поливинилацетат /полиэтиленгликоль со средней молекулярной массой, определенной методом гель-проникающей хроматографии 140000 г/моль растворяют при перемешивании в 50 мл этанола. Отдельно получают раствор 1 г эпигаллокатехин-3-галлат и 2 г гинестеина в 20 мл изопропанола. Затем при перемешивании добавляют раствор фитонутриентов к раствору полимера. Полученный раствор нагревают до 45°C при постоянном перемешивании, после чего отгоняют растворитель досуха и сушат в вакуум-сушильном шкафу. Получают твердый слегка окрашенный продукт.
Пример 9.
Фармакокинетические исследования образцов изготовленных в примерах 1-6.
В экспериментах использовали лабораторных крыс породы Sprague-Dawley весом 250-350 г. Все исследования на животных проводили в соответствии "Guidelines for Care and Use of Experimental Animal".
Пероральное введение контрольных препаратов проводили в дозе 50 мг/кг. Образцы формуляции фитонутриентов вводили животным в дозах 50 мг/кг. После фиксированных интервалов времени (10, 30 мин, 1, 1.5, 2, 3, 8 и 24 часа) у животных забирали образцы крови из которых после центрифугирования отбирали плазму для анализа, замораживали и хранили при -80°C до проведения исследований.
Для проведения аналитических исследований образцы плазмы размораживали, центрифугировали и разделяли по аликвотам объемом 0,1 мл. Образцы экстрагировали 3 раза в 2 мл этилацетата в течение 5 мин при постоянном встряхивании. После экстракции образцы центрифугировали при 1000 об/мин 10 мин. Супернатант отделяли и помещали в стеклянную пробирку. Органическую фазу выпаривали и высушенные образцы хранили при -80°C до хроматографического анализа.
Графическая презентация данных показана на рисунках, отображающих фармакокинетический профиль фитонутриентов в плазме крыс (см. Фиг.1-5).
Пример 10.
Изучение противоопухолевой эффективности препаратов фитонутриентов с повышенной биодоступностью в экспериментах in vivo.
Самки мышей линии С3Н/Не (6-8 недель) содержались в стандартных клетках в отдельных комнатах при 12-часовом режиме освещения и свободном доступе к корму и воде. Температура воздуха в помещении поддерживалась на уровне 20-25°C, относительная влажность - 50-70%. Все манипуляции с лабораторными животными проводились в соответствии с «Правилами проведения работ с использованием экспериментальных животных».
Для индукции солидных опухолей клетки линии МВТ-2 (рак мочевого пузыря) (5×105) в 50 мкл фосфатно-солевого буфера вводили животным подкожно в правую дорсальную боковую область, после чего 4 раза в неделю измеряли массу тела животного, потребление корма, а также размер опухоли. Объем опухоли рассчитывали по формуле:
V=π/6×L (мм)×W2 (мм2),
где L - длинный, а W - короткий диаметр опухоли.
В экспериментах по изучению лечебного противоопухолевого действия фитонутриентов, изучаемые соединения начинали вводить на 15 день (14 дней спустя) после имплантации опухолевых клеток животным с пальпируемой опухолью (узлом). Конечный размер опухоли оценивали на 29-й день эксперимента: животных умерщвляли (под эфирным наркозом), опухоли удаляли и взвешивали. Как видно из рисунка (см. Фиг.6), изучаемые препараты фитонутриентов на основе матричного привитого сополимера, оказывают выраженный противоопухолевый эффект. В опытной группе животных, получавших исходные вещества перорально в количестве 10 мг ежедневно средний объем опухоли составлял 80% от контроля, в то время как у мышей, получавших фитонутриенты с повышенной биодоступностью в количестве 10 мг ежедневно, средний объем опухоли составлял менее 30% от контроля.
Полученные данные убедительно свидетельствуют о существенном увеличении противоопухолевого действия изучаемых веществ с противоопухолевым действием базовых аналогов. Очевидно, что обнаруженное нами существенное повышение опухоль-супрессорной активности фитонутриентов обусловлено повышенной биодоступностью активных веществ.
Таким образом, препараты обладают выраженным противоопухолевым действием в отношении экспериментальных опухолей мочевого пузыря на животной модели in vivo.
Гистологическое исследование опухолевой ткани животных, получавших исследуемые препараты показало, что данные препараты в применявшихся дозах не вызывают каких-либо изменений клеточной морфологии печени, почек и других функционально важных органов, а также не влияют на вес экспериментальных животных.
Пример 11.
Исследование противоопухолевой эффективности комбинированного препарата, содержащего дииндолилметан и куркумин по примеру 6.
В экспериментах по изучению лечебного противоопухолевого действия комбинированного препарата, исследуемый препарат вводили перорально на 15 день (14 дней спустя) после имплантации опухолевых клеток животным с пальпируемой опухолью (узлом). Конечный размер опухоли оценивали на 29-й день эксперимента. Комбинированный препарат получали простым смешением образцов, полученных в примерах 4 и 5. Мыши получали суммарно по 5 мг каждого их из препаратов ежедневно. Полученные данные представлены на рисунке (см. Фиг.7). Полученные результаты убедительно свидетельствуют о существенном увеличении противоопухолевого действия комбинации веществ по сравнению с противоопухолевым действием базовых аналогов, а также по сравнению с препаратами введенными отдельно. Очевидно, что обнаруженное нами существенное повышение опухоль-супрессорной активности дииндолилметана и куркумина обусловлено синергитическим эффектом комбинации двух веществ и повышенной биодоступностью активных веществ.
Пример 12.
Исследование противоопухолевой эффективности комбинированного препарата, содержащего дииндолилметан и ресвератрол по примеру 7.
Эксперименты проводились аналогично экспериментам по примеру 11, результаты представлены на Фиг.8. Полученные результаты убедительно свидетельствуют о существенном увеличении противоопухолевого действия комбинации веществ по сравнению с противоопухолевым действием базовых аналогов, а также по сравнению с препаратами введенными отдельно. Очевидно, что обнаруженное нами существенное повышение опухоль-супрессорной активности дииндолилметана и ресвератрола обусловлено синергитическим эффектом комбинации двух веществ и повышенной биодоступностью активных веществ.
Пример 13.
Исследование противоопухолевой эффективности комбинированного препарата, содержащего эпигаллокатехин-3-галлат и гинестеин по примеру 8.
Эксперименты проводились аналогично экспериментам по примеру 11, результаты представлены на Фиг.9. Полученные результаты убедительно свидетельствуют о существенном увеличении противоопухолевого действия комбинации веществ по сравнению с противоопухолевым действием базовых аналогов, а также по сравнению с препаратами введенными отдельно. Очевидно, что обнаруженное нами существенное повышение опухоль-супрессорной активности эпигаллокатехин-3-галлата и гинестеина обусловлено синергитическим эффектом комбинации двух веществ и повышенной биодоступностью активных веществ.
Пример 14.
Получение формуляции фитонутриентов методом сухого смешения.
Привитый сополимер поливинилкапролактам/ поливинилацетат /полиэтиленгликоль со средней молекулярной массой, определенной методом гель-проникающей хроматографии, 90000 г/моль в количестве 10 г смешивали с 1,5-10 г фитонутриента выбранного из ряда: эпигаллокатехин-3-галлат, дииндолилметан, гинестеин, ресвератрол, куркумин. Полученную сухую смесь тщательно перемешивали на миксере до получения однородного порошка. Полученный порошок использовали для фармакокинетических исследований.
В таблице 1 приведены данные по биодоступности фитонутриентов при получении предложенной композиции сухим смешением.
Реферат
Изобретение относится к области фармации и касается новых фармацевтических композиций для пероральной доставки фитонутриентов. Фармацевтическая композиция включает, по меньшей мере, один фитонутриент из ряда: эпигаллокатехин-3-галлат, дииндолилметан, гинестеин, ресвератрол, куркумин, и солюбилизатор - привитый сополимер поливинилкапролактам/поливинилацетат/полиэтиленгликоль со средней молекулярной массой 90000-140000 г/моль при массовом соотношении, по меньшей мере, одного фитонутриента и солюбилизатора от 1:5 до 1:1. Способ получения указанной фармацевтической композиции по первому варианту заключается в том, что растворяют солюбилизатор в органическом растворителе, растворяют, по меньшей мере, один фитонутриент в таком же органическом растворителе, смешивают полученные растворы и отгоняют растворитель в вакууме, при этом согласно изобретению после смешивания растворов нагревают полученную смесь до 45-50°C при постоянном перемешивании, а после отгонки сушат продукт в вакууме. Способ получения указанной фармацевтической композиции по второму варианту заключается в сухом смешивании порошков солюбилизатора и, по меньшей мере, одного фитонутриента. Полученные композиции являются стабильными и имеют высокую биодоступность. 3 н. и 4 з.п. ф-лы, 1 табл., 9 ил., 14 пр.

Комментарии