Композиция для перорального приема, эффективная в оценке способности метаболизировать пиридин - RU2429883C2
Код документа: RU2429883C2
Чертежи


Описание
Настоящее изобретение относится к композиции для перорального приема, которая может эффективно использоваться для высокоточной оценки наличия или степени расстройства емкости метаболизма пиридина, скорости пиримидинового метаболизма и т.д. Настоящее изобретение также относится к процессу получения указанной композиции для перорального приема.
УРОВЕНЬ ТЕХНИКИ
5-фторурацил (в дальнейшем иногда называемый "5-FU"), его различные производные (такие как тегафур, кармофур, доксифлуридин и т.д.), а также другие лекарственные средства на основе фторурацила в настоящее время широко используются в качестве противоопухолевых препаратов. Известно, что 5-FU, введенный в организм, вначале расщепляется под действием дигидропиримидиндегидрогеназы (в дальнейшем иногда называемой "DPD"), которая является первым ферментом в пиримидиновом метаболическом пути. Поэтому считается, что совместное применение препарата, который ингибирует ферментативную активность DPD, является эффективным в поддержании действия фторурациловых лекарственных средств, таких как 5-FU и т.п. С другой стороны, известно, что когда фторурациловое лекарственное средство, такое как 5-FU, вводят субъекту с дефицитом DPD или с пониженной активностью DPD, препарат не метаболизируется правильно, что приводит к ненормально высокой концентрации фторурацилового препарата в крови, вызывая, таким образом, тяжелые побочные эффекты (например, миелосупрессию, нарушения пищеварения и т.д.).
Таким образом, чтобы эффективно проявлять действие фторурациловых лекарственных средств или предотвращать побочные эффекты фторурациловых лекарственных средств, диагностика емкости пиримидинового метаболизма, то есть наличия, степени и т.д. нарушения пиримидинового метаболизма у субъекта, до введения фторурацилового лекарственного средства, как полагают, является важной.
Сообщалось о способе диагностики пиримидиновой метаболической активности у субъекта, в котором субъекту вводят меченое изотопом пиримидиновое соединение, а затем оценивают показатель экскреции меченого изотопом продукта метаболизма, выведенного из организма, чтобы определить емкость пиримидинового метаболизма, то есть наличие, степень и т.д. нарушения пиримидинового метаболизма у субъекта (например, Патентный Документ 1). Гранулы и тонкие гранулы, содержащие меченые изотопом пиримидиновые соединения и носители уже известны в качестве препаратов для диагностики емкости пиримидинового метаболизма и используются в вышеуказанном способе.
Однако, меченые изотопом пиримидиновые соединения, такие как13C-урацил, обладают, помимо низкой растворимости, обычно высокой когезионной способностью, хотя нефасованные порошки таких соединений представляют собой мелкие частицы размером несколько микрон. Поэтому гранулы и тонкие гранулы, приготовленные из меченых изотопом пиримидиновых соединений с применением стандартных методик, не растворяются быстро, и отчасти из-за этого указанные соединения имеют ряд недостатков, таких как низкая и неоднородная скорость абсорбции в живом организме и изменения скорости абсорбции из-за индивидуальных различий. Поэтому, чтобы осуществлять диагностику емкости пиримидинового метаболизма с более высокой точностью, желательно преодолевать вышеупомянутые недостатки таким образом, чтобы можно было уменьшить изменение во времени экскреции и количестве меченых изотопом продуктов метаболизма, а также снизить неоднородность точности диагностики из-за индивидуальных различий.
Патентный Документ 1: Международная Публикация № WO 02/072153, брошюра.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, РЕШАЕМЫЕ НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
Цель настоящего изобретения состоит в том, чтобы получить композицию для перорального приема, которая может использоваться для диагностики наличия, степени и т.д. нарушения емкости пиридинового метаболизма, с высокой точностью и с небольшим изменением из-за индивидуальных различий.
СПОСОБЫ РЕШЕНИЯ ЗАДАЧ
Авторы настоящего изобретения провели обширное исследование, чтобы решить вышеуказанные проблемы, и установили, что композиция для перорального приема, приготовленная с использованием порошкового материала, полученного путем смешивания и измельчения (a) меченого изотопом соединения и/или его метаболита и (b) сахара и/или сахароспирта, позволяет провести диагностику емкости пиримидинового метаболизма с высокой точностью и с небольшим изменением из-за индивидуальных различий. Настоящее изобретение было осуществлено с помощью дополнительных усовершенствований, основанных на указанном открытии.
Настоящее изобретение предлагает следующие композиции для перорального приема, производственные процессы для этого и т.д.
Пункт 1. Композиция для перорального приема, приготовленная с использованием порошкового материала, полученного путем смешивания и измельчения (a) меченого изотопом соединения и/или его метаболита, в которой, по крайней мере, один из атомов углерода, атомов кислорода и атомов азота помечен изотопом, и (b) сахара и/или сахароспирта.
Пункт 2. Композиция для перорального приема по пункту 1, где диаметр частиц 50% порошкового материала составляет 40 мкм или меньше.
Пункт 3. Композиция для перорального приема по пункту 1, которая включает компонент (a) в пропорции 5-20 вес. %.
Пункт 4. Композиция для перорального приема по пункту 1, где компонент (a) представляет собой меченый изотопом урацил.
Пункт 5. Композиция для перорального приема по пункту 1, где компонент (b) представляет собой маннит.
Пункт 6. Композиция для перорального приема по пункту 1, где компонент (a) представляет собой меченый изотопом урацил, а компонент (b) представляет собой маннит.
Пункт 7. Композиция для перорального приема по пункту 1, которая представляет собой гранулированную композицию.
Пункт 8. Композиция для перорального приема по пункту 7, которая получена с помощью экструзионного гранулирования порошкового материала.
Пункт 9. Композиция для перорального приема по пункту 7, где гранулированная композиция имеет средний диаметр частиц 1400 мкм или меньше.
Пункт 10. Композиция для перорального приема по пункту 1, которая представляет собой композицию для диагностики емкости пиримидинового метаболизма.
Пункт 11. Композиция для перорального приема по пункту 1, которая представляет собой композицию для определения способности опорожнения желудка.
Пункт 12. Композиция для перорального приема по пункту 1, которая представляет собой композицию для диагностики расстройства пищеварения.
Пункт 13. Способ приготовления композиции для перорального приема, включающий следующие стадии:
(1) получение порошкового материала путем смешивания и измельчения (a) пиримидинового соединения и/или его метаболита, в котором, по крайней мере, один из атомов углерода, атомов кислорода и атомов азота помечен изотопом, и (b) сахара и/или сахароспирта; и
(2) включение порошкового материала, полученного в предыдущей стадии (1), в композицию.
Пункт 14. Способ по пункту 13, где диаметр частиц порошкового материала, полученного в стадии (1), составляет 40 мкм или меньше.
Пункт 15. Способ по пункту 13, где композиция для перорального приема содержит компонент (a) в пропорции 5-20 вес. %.
Пункт 16. Способ по пункту 13, где компонент (a) представляет собой меченый изотопом урацил.
Пункт 17. Способ по пункту 13, где компонент (b) представляет собой маннит.
Пункт 18. Способ по пункту 13, где компонент (a) представляет собой меченый изотопом урацил, а компонент (b) представляет собой маннит.
Пункт 19. Способ по пункту 13, где композиция для перорального приема представлена в форме гранул.
Пункт 20. Способ по пункту 19, где стадия (2) представляет собой стадию включения порошкового материала, полученного в стадии (1), в композицию с помощью экструзионного гранулирования.
Пункт 21. Способ по пункту 19, где композиция для перорального приема представляет собой гранулированную композицию, имеющую средний диаметр частиц 1400 мкм или меньше.
Пункт 22. Способ по пункту 13, где композиция для перорального приема представляет собой композицию для диагностики емкости пиримидинового метаболизма.
Пункт 23. Способ по пункту 13, где композиция для перорального приема представляет собой композицию для определения способности опорожнения желудка.
Пункт 24. Способ по пункту 13, где композиция для перорального приема представляет собой композицию для диагностики расстройства пищеварения.
Пункт 25. Применение порошкового материала, полученного путем смешивания и измельчения (a) пиримидинового соединения и/или его метаболита, в котором, по крайней мере, один из атомов углерода, атомов кислорода и атомов азота помечен изотопом, и (b) сахара и/или сахароспирта, для получения композиции для диагностики емкости пиримидинового метаболизма.
Пункт 26. Применение порошкового материала, полученного путем смешивания и измельчения (a) пиримидинового соединения и/или его метаболита, в котором, по крайней мере, один из атомов углерода, атомов кислорода и атомов азота помечен изотопом, и (b) сахара и/или сахароспирта, для получения композиции для определения способности опорожнения желудка.
Пункт 27. Применение порошкового материала, полученного путем смешивания и измельчения (a) пиримидинового соединения и/или его метаболита, в котором, по крайней мере, один из атомов углерода, атомов кислорода и атомов азота помечен изотопом, и (b) сахара и/или сахароспирта, для получения композиции для диагностики расстройства пищеварения.
ТЕХНИЧЕСКИЙ РЕЗУЛЬТАТ ИЗОБРЕТЕНИЯ
Композицию для перорального приема настоящего изобретения получают посредством включения порошкового материала, полученного путем смешивания и измельчения (a) меченого изотопом соединения и/или его метаболита и (b) сахара и/или сахароспирта в композицию. Имеющая такой состав композиция для перорального приема настоящего изобретения позволяет диагностировать емкость пиримидинового метаболизма и способность опорожнения желудка с высокой точностью и с небольшим изменением из-за индивидуальных различий. В результате поведение меченого изотопом метаболического продукта может быть правильно определено одним или малым количеством измерений по истечении 20-30 минут после введения композиции, благодаря чему можно сократить время, требуемое для определения, и количество измерений, снижая, таким образом, обременение пациентов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
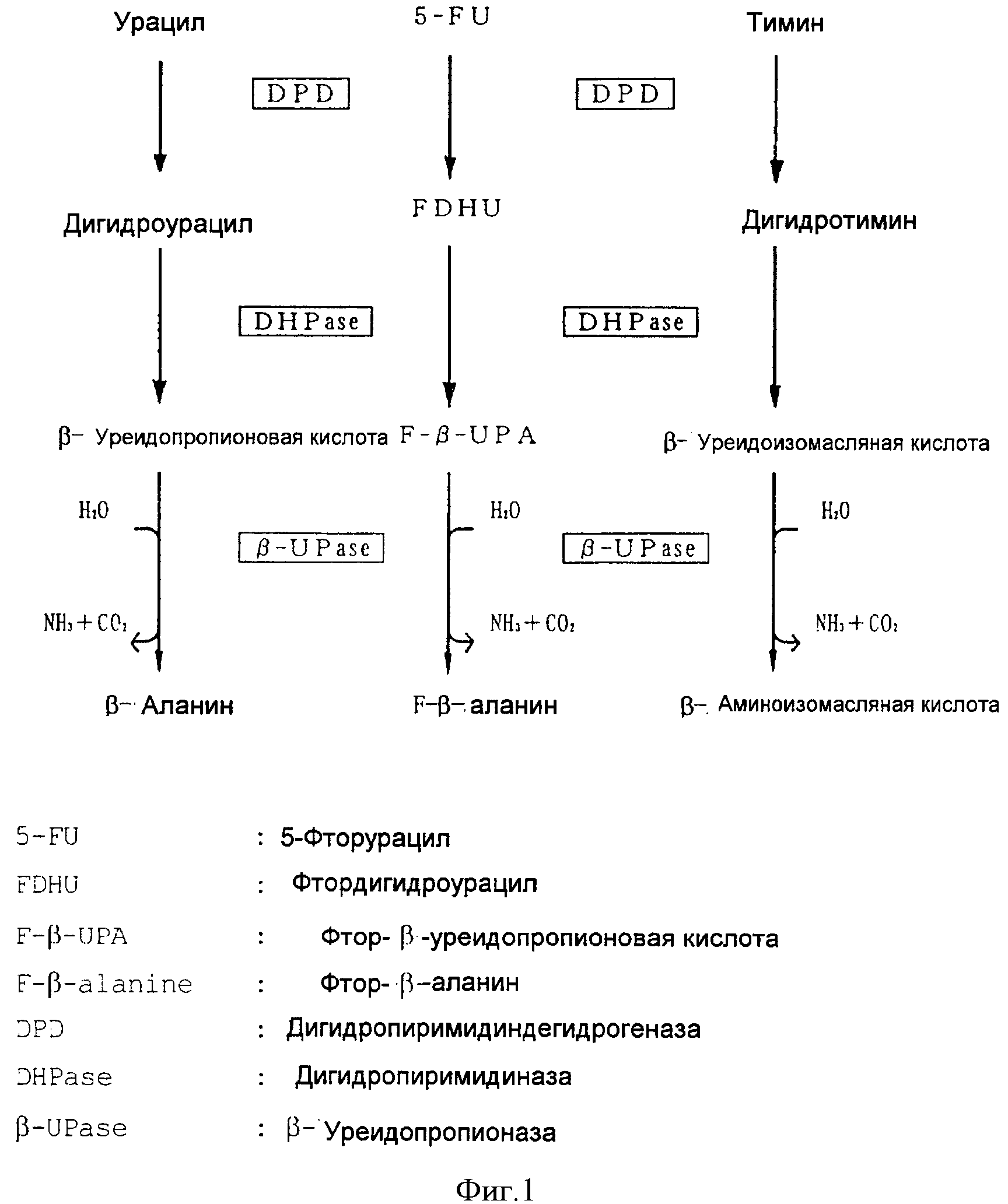
[Фигура 1] На фигуре 1 показан характер деградации (метаболизма) пиримидиновых соединений (урацила, 5-фторурацила (5-FU) и тимина) группой пиримидин-метаболизирующих ферментов (дигидропиримидиндегидрогеназа (DPD), дигидропиримидиназа (DHPase) и β-уреидопропионаза β-UPase)).
[Фигура 2] На фигуре 2 сравниваются результаты наблюдения, в динамике времени, показателя13CО2, выделяемого с выдыхаемым воздухом тремя здоровыми субъектами (Субъекты A, B и C), которым ввели гранулированную композицию Примера 2.
[Фигура 3] На фигуре 3 сравниваются результаты наблюдения, в динамике времени, показателя13CО2, выделяемого с выдыхаемым воздухом тремя здоровыми субъектами (Субъекты A, B и C), которым ввели гранулированную композицию Сравнительного Примера 2.
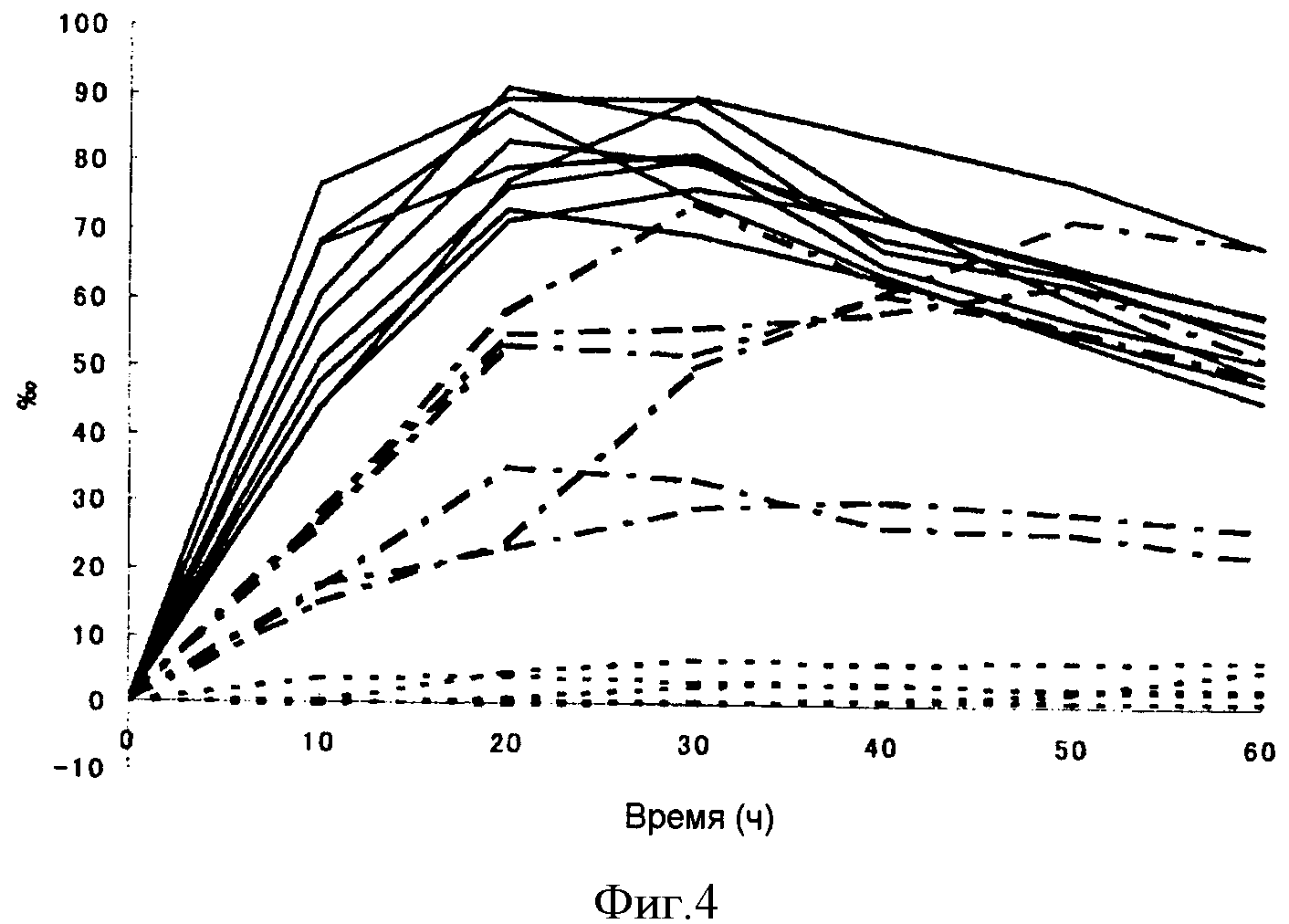
[Фигура 4] На фигуре 4 показан, в динамике времени, показатель13CO2, выделяемого с выдыхаемым воздухом 20 пациентами, подозреваемыми на наличие гастропареза, которым ввели композицию Примера 1 в Тестовом Примере 5.
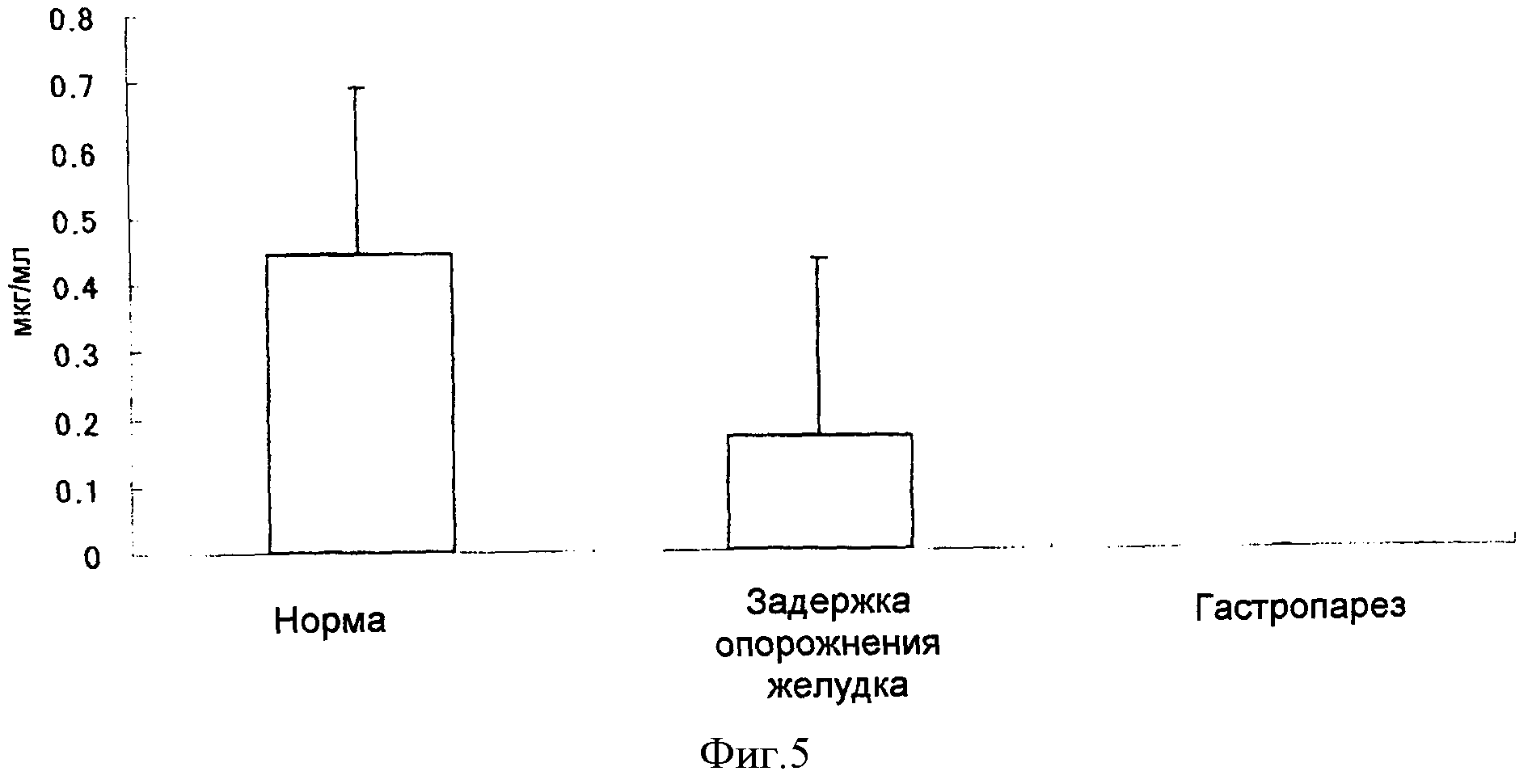
[Фигура 5] На фигуре 5 показана концентрация в плазме 2-13C урацила у пациентов, разделенных на три группы (нормальная способность опорожнения желудка, пониженная способность опорожнения желудка и недостаточная способность опорожнения желудка), на основе результатов, показанных на фиг.4, через 20 минут после введения композиции Примера 1.
НАИЛУЧШИЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение подробно описано ниже.
Композиция для перорального приема настоящего изобретения включает меченое изотопом пиримидиновое соединение и/или его метаболит (в дальнейшем они иногда упоминаются как "Компонент (a)").
Пиримидиновое соединение для применения в настоящем изобретении может представлять собой любое соединение из большого разнообразия соединений, имеющих пиримидиновый скелет, и предпочтительно являться соединением, которое служит субстратом для пиримидин-метаболизирующего фермента, в особенности дигидропиримидиндегидрогеназы (DPD), которая является первым ферментом в пиримидиновом метаболическом пути в живом организме. Конкретные примеры указанных пиримидиновых соединений включают урацил, тимин и их производные. Производные урацила и тимина используются без каких-либо ограничений, если они служат субстратами для DPD, и если их конечные продукты метаболизма, образованные по пиримидиновому метаболическому пути, высвобождаются с выделениями, такими как выдыхаемый воздух, моча или пот. Конкретные примеры указанных производных включают галогениды урацила, такие как 5-фторурацил, 5-бромурацил и т.д.; галогениды тимина, такие как 5-фтортимин, 5- бромтимин и т.д.; и т.п. Предпочтительные примеры пиримидиновых соединений включают урацил, тимин и 5-фторурацил.
Применяемые пиримидиновые соединения, в дополнение к вышеупомянутым соединениям, которые служат прямыми субстратами для DPD, включают соединения, которые служат косвенными субстратами для фермента, то есть предшественники (включая про-лекарства), которые метаболизируются или расщепляются in vivo с образованием субстратов для DPD (таких как урацил, тимин, 5-фторурацил и т.д.). Примеры указанных предшественников включают предшественники урацила, такие как цитозин, уридин и их фосфаты (например, уридиловая кислота); предшественники тимина, такие как 5-метилцитозин, тимидин и их фосфаты (например, тимидиловая кислота); и предшественники (про-лекарства) 5-фторурацила, такие как тегафур, кармофур, доксифлуридин и т.д.
Метаболит пиримидинового соединения представляет собой соединение, которое соответствует промежуточному продукту метаболизма пиримидинового соединения и которое служит субстратом для пиримидин-метаболизирующего фермента, в особенности для дигидропиримидиназы (в дальнейшем иногда называемой "DHPase"), которая является вторым ферментом в пиримидиновом метаболическом пути в живом организме, или β-уреидопропионазы (в дальнейшем иногда называемой "β-UPase"), которая является третьим ферментом. Конкретные примеры метаболитов пиримидиновых соединений включают дигидроурацил, дигидротимин и их производные (например, галогениды дигидроурацила, такие как 5-фтордигидроурацил и т.п.), которые служат субстратами для DHPase, а также β-уреидопропионовую кислоту, β-уреидоизомасляную кислоту и их производные (например, галогениды β-уреидопропионовой кислоты, такие как фтор-β-уреидопропионовая кислота, а также галогениды β-уреидоизомасляной кислоты), которые служат субстратами для β-UPase.
В настоящем изобретении Компонент (a) предпочтительно представляет собой пиримидиновое соединение, более предпочтительно, урацил, тимин или 5-фторурацил, а наиболее предпочтительно, 5-фторурацил.
В пиримидиновом соединении и/или его метаболите, используемых в настоящем изобретении, по крайней мере, один из атомов углерода, атомов кислорода и атомов азота в молекуле помечен изотопом. Конкретные примеры изотопа включают, помимо прочего,13C,14C,18О и15N. Изотоп может быть радиоактивным или нерадиоактивным, но13C,18О или15N, которые являются нерадиоактивными, предпочтительны с точки зрения безопасности.
Пиримидиновое соединение и/или его метаболит для использования в настоящем изобретении могут содержать один изотоп в молекуле или могут содержать два или более изотопов одинаковых или различных элементов. Хотя это и не является ограничением, но предпочтительно, чтобы атом углерода или атом кислорода в пиримидиновом соединении или его метаболите был помечен таким образом, чтобы, по крайней мере, часть CО2 (C или О), образованного по пиримидиновому метаболическому пути, была помечена изотопом. Примеры указанных пиримидиновых соединений включают соединения, которые содержат меченый изотопом атом углерода в положении 2 пиримидинового скелета. Конкретные примеры включают 2-13C-меченый урацил и 2-13C-меченый фторурацил.
Может использоваться любая методика мечения пиримидинового соединения и/или его метаболита изотопом, как упомянуто выше, причем может использоваться большое разнообразие стандартных методик (Sasaki, "5.1 Application of Stable Isotopes in Clinical Diagnosis"; Kagaku no Ryoiki (Journal of Japanese Chemistry) 107, "Application of Stable Isotopes in Medicine, Pharmacy, and Biology", Nankodo, pp. 149-163 (1975); Kajiwara, "RADIOISOTOPES", 41, 45-48 (1992) и т.д.). Некоторые из указанных меченых изотопами пиримидиновых соединений и их метаболитов коммерчески доступны, при этом указанные коммерческие продукты используются стандартно.
Содержание Компонента (a) в композиции для перорального приема настоящего изобретения обычно составляет, например, 5-20 вес. %, предпочтительно, 6-18 вес. % и, наиболее предпочтительно, 8-15 вес. %.
Композиция для перорального приема настоящего изобретения содержит, в дополнение к Компоненту (a), сахар и/или сахароспирт (в дальнейшем, они иногда упоминаются как "Компонент (b)").
В настоящем изобретении может использоваться любой сахар, который является фармацевтически приемлемым. Примеры такого сахара включают глюкозу, галактозу, фруктозу, ксилозу, арабинозу, маннозу и другие моносахариды; мальтозу, изомальтозу, целлобиозу, лактозу, сахарозу, трегалозу и дугие дисахариды, и т.д. Среди перечисленного предпочтительными являются глюкоза и сахароза. В настоящем изобретении может использоваться любой сахароспирт, который является фармацевтически приемлемым. Конкретные примеры сахароспиртов включают эритрит, маннит, ксилит, сорбит, мальтит, восстанавливающую паратинозу, лактит и т.д. Среди перечисленного предпочтительными являются маннит, ксилит и эритрит, а наиболее предпочтительным является маннит.
В настоящем изобретении Компонент (b) предпочтительно представляет собой сахароспирт, более предпочтительно, маннит, ксилит или эритрит, а наиболее предпочтительно, маннит.
Содержание Компонента (b) в композиции для перорального приема настоящего изобретения обычно составляет, например, 80-95%, предпочтительно, 82-94% и, наиболее предпочтительно, 85-92% от общего веса композиции.
Соотношение Компонента (b) к Компоненту (a) в композиции для перорального приема настоящего изобретения составляет, например, 400-1900 весовых частей, предпочтительно, 450-1550 весовых частей и, наиболее предпочтительно, 550-1150 весовых частей Компонента (b) на 100 весовых частей Компонента (a). Совместное использование Компонентов (a) и (b) в указанном соотношении дополнительно улучшает точность диагностики нарушений пиримидинового метаболизма.
Композицию для перорального приема настоящего изобретения получают посредством включения в композицию порошкового материала, содержащего Компоненты (a) и (b). Порошковый материал, используемый для приготовления композиции для перорального приема настоящего изобретения, получают путем смешивания Компонентов (a) и (b) в вышеупомянутом соотношении с последующим измельчением полученной смеси.
Композиция для перорального приема настоящего изобретения после измельчения может иметь тот же состав, что и порошковый материал, или может содержать другие компоненты в дополнение к порошковому материалу. Таким образом, пропорции Компонентов (a) и (b) в порошковом материале соответствующим образом выбраны согласно пропорциям Компонентов (a) и (b) в окончательной форме композиции для перорального приема, стадиям приготовления композиции для перорального приема и т.д.
Порошковый материал может быть получен путем смешивания и измельчения фармацевтически приемлемых добавок вместе с Компонентами (a) и (b), если это отрицательно не влияет на эффекты настоящего изобретения. Указанные добавки представляют собой такие же добавки, как и те, которые могут быть добавлены при включении порошкового материала в композицию. Конкретные примеры соответствующих добавок приведены далее.
Частицы порошкового материала могут иметь любой диаметр, если указанный диаметр частицы приобретают вследствие смешивания и измельчения Компонентов (a) и (b), однако в целях повышения точности диагностики емкости пиримидинового метаболизма желательно, чтобы диаметр 50% частиц был равен 40 мкм или меньше, предпочтительно, 30 мкм или меньше и, наиболее предпочтительно, 5-20 мкм.
Предпочтительные примеры порошкового материала представляют собой порошковые материалы, имеющие такое распределение размера частиц, что диаметр 50% частиц составляет 40 мкм или меньше, а диаметр 90% частиц составляет 200 мкм или меньше; более предпочтительными примерами являются те примеры, в которых распределение размера частиц такое, что диаметр 50% частиц составляет 30 мкм или меньше, а диаметр 90% частиц составляет 100 мкм или меньше; и наиболее предпочтительными примерами являются те примеры, в которых распределение размера частиц такое, что диаметр 50% частиц составляет 5-20 мкм, а диаметр 90% частиц составляет 10-70 мкм. Использование порошкового материала, имеющего указанное распределение размера частиц, для приготовления композиции для перорального приема позволяет, чтобы Компонент (a) был абсорбирован живым организмом с высокой и однородной скоростью, что, таким образом, обеспечивает более высокую точность диагностики емкости пиримидинового метаболизма.
Используемые здесь понятия диаметра 50% частиц и диаметра 90% частиц порошкового материала имеют следующее значение: объем частиц порошкового материала суммируют, начиная от частицы с наименьшим диаметром, до тех пор, пока суммарный объем не достигнет 50% или 90% от полного объема частиц порошкового материала, и, таким образом, диаметр последней включенной частицы представляет собой диаметр 50% или 90% частиц. Диаметр 50% частиц и диаметр 90% частиц может быть измерен с помощью сухого лазерного метода (условия измерения: фокусное расстояние 100 мм, количество усредняющих процессов 10, усредняющий интервал 5 миллисекунд и давление воздуха 0,4 МПа).
Может использоваться любой вид обработки измельчением, которая используется для приготовления порошкового материала, однако обработка измельчением с использованием мельницы сухого измельчения является предпочтительной. Конкретные примеры мельниц сухого измельчения включают молотковые мельницы, штифтовые мельницы, струйные мельницы и т.д.
Композицию для перорального приема настоящего изобретения приготавливают, добавляя к порошковому материалу, при необходимости, вспомогательные вещества, такие как наполнители, связующие добавки, регуляторы pH, дезинтеграторы, усилители абсорбции, смазки, красители, модификаторы, ароматизаторы и т.д., после чего полученную смесь вводят в композицию путем такого способа обработки, как гранулирование, или с помощью другого метода формирования, который выбирается в зависимости от формы композиции. Когда композиция для перорального приема настоящего изобретения представляет собой порошковую композицию, порошковый материал может также использоваться в качестве композиции для перорального приема в готовой форме.
Конкретные примеры вспомогательных веществ, которые могут быть введены в композицию, включают лактозу, крахмал, рафинированный белый сахар, декстрин, маннит, ксилит, сорбит, эритрит, дигидрофосфат кальция, хлорид натрия, глюкозу, карбонат кальция, каолин, кристаллическую целлюлозу, силикат и другие наполнители; воду, этанол, простой сироп, растворы глюкозы, растворы крахмала, растворы желатина, карбоксиметилцеллюлозу, натрий карбоксиметилцеллюлозу, шеллак, метилцеллюлозу, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, поливинилпирролидон, поливиниловый спирт, желатин, декстрин, пуллулан и другие связующие добавки; лимонную кислоту, лимонный ангидрид, цитрат натрия, дигидрат цитрата натрия, безводный моногидрофосфат натрия, безводный дигидрофосфат натрия, гидрофосфат натрия и другие регуляторы pH; кальций кармелозу, мало-замещенную гидроксипропилцеллюлозу, кармелозу, натрий кроскармелозу, натрий карбоксиметилкрахмал, кросповидон и другие дезинтеграторы; полисорбат 80, четвертичные основания аммония, лаурилсульфат натрия и другие усилители абсорбции; очищенный тальк, стеарат, полиэтиленгликоль, коллоидную кремневую кислоту, жирные кислоты сахарной свеклы, гидрогенизированные масла и другие смазки; желтый оксид железа, желтый полуторный оксид железа, полуторный оксид железа, β-каротин, оксид титана, пищевые красители (например, Пищевой Синий № 1), медный хлорофилл, рибофлавин и другие красители; аскорбиновую кислоту, аспартам, лист сладкой гортензии, хлорид натрия и другие модификаторы, и т.п.
Форма композиции для перорального приема настоящего изобретения может быть любой, если она представляет собой твердую композицию, кроме того, в качестве желательных могут быть выбраны тонкие гранулы, гранулы, порошки, таблетки (включая таблетки без покрытия и таблетки с покрытием), капсулы, пилюли и другие формы. Среди перечисленного, для дополнительного усиления эффектов настоящего изобретения, предпочтительными являются гранулированные композиции, такие как тонкие гранулы и гранулы, а в особенности гранулированные композиции, полученные с помощью экструзионного гранулирования.
Когда композиция для перорального приема настоящего изобретения представляет собой гранулированную композицию, средний диаметр частиц композиции обычно равен, например, 1400 мкм или меньше, предпочтительно, 50-1200 мкм и, наиболее предпочтительно, 100-1000 мкм. Когда гранулированная композиция имеет указанный диаметр частиц, гранулированная композиция позволяет проводить диагностику емкости пиримидинового метаболизма с более высокой точностью. Диаметр частиц композиции может быть измерен с помощью метода вибрационного просеивания (в частности, используя измерительный прибор Robot Shifter RPS-95 (Seishin Enterprise Co., Ltd.) на 5 уровне вибрации, время встряхивания 5 минут, с интервалом между импульсами 1 секунда).
После введения композиции для перорального приема настоящего изобретения емкость пиримидинового метаболизма, то есть наличие или степень нарушения пиримидинового метаболизма, скорость пиримидинового метаболизма и т.д. у субъекта может быть оценена путем оценки показателя экскреции меченого изотопом продукта метаболизма, выведенного из организма. Таким образом, композиция для перорального приема настоящего изобретения может использоваться в качестве композиции для определения емкости пиримидинового метаболизма. Дополнительно, как здесь далее описано, так как способность опорожнения желудка может также быть оценена по результатам оценки емкости пиримидинового метаболизма, и особенно по результатам измерения скорости пиримидинового метаболизма, композиция для перорального приема настоящего изобретения может также использоваться в качестве композиции для определения способности опорожнения желудка. Варианты осуществления композиции для определения емкости пиримидинового метаболизма и композиция для определения способности опорожнения желудка подробно описаны ниже.
Композиция для определения емкости пиримидинового метаболизма
Так как композиция для перорального приема настоящего изобретения может использоваться для определения емкости пиримидинового метаболизма в отношении наличия, степени и т.д. нарушения пиримидинового метаболизма, композиция применима для детектирования, измерения и диагностики нарушения пиримидинового метаболизма. Конкретные условия, способ и т.д. использования композиции для перорального приема настоящего изобретения в качестве композиции для определения емкости пиримидинового метаболизма являются следующими.
Когда композицию для перорального приема настоящего изобретения вводят субъекту с нормальной емкостью пиримидинового метаболизма, у кого или у которого группы пиримидин-метаболизирующих ферментов (DPD, DPHase и β-UPase) функционируют нормально в живом организме (в дальнейшем иногда называемого "здоровый субъект"), пиримидиновое соединение, содержавшееся в композиции как Компонент (a), метаболически расщепляется с образованием таких метаболических продуктов, как β-аланин, F-β-аланин, β-аминоизомасляная кислота, NH3, СО2 и т.д., как показано на фиг.1.
Конечный продукт метаболизма СО2, образованный таким образом в ходе метаболизма, выделяется с выдыхаемым воздухом, а β-аланин, F-β-аланин, β-аминоизомасляная кислота выделяются главным образом с мочой. Из конечных продуктов метаболизма, выделенных таким образом, по крайней мере, один из СО2 и конечного продукта метаболизма, выбранного из β-аланина, F-β-аланина и β- аминоизомасляной кислоты, помечен изотопом, в зависимости от меченого изотопом сайта пиримидинового соединения и/или его метаболита, используемых в качестве Компонента (a). Такая изотопная метка используется в качестве индекса для оценки показателя экскреции (показатель количества экскреции или скорости экскреции в течение времени) указанных конечных продуктов метаболизма с использованием в качестве тестовой пробы выдыхаемого воздуха, когда меченым является СО2, или мочи, когда помечены β-аланин, F-β-аланин, β-аминоизомасляная кислота или аммиак.
Емкость пиримидинового метаболизма субъекта может быть определена по оцененному таким образом показателю экскреции (показатель количества экскреции или скорости экскреции в течение времени) меченого изотопом продукта метаболизма.
Когда композиция для перорального приема настоящего изобретения используется для определения емкости пиримидинового метаболизма, доза композиции для перорального приема настоящего изобретения не ограничена, но предпочтительно представляет собой количество, соответствующее 1-2000 мг и, предпочтительно, 10-300 мг Компонента (a).
При использовании композиции для перорального приема настоящего изобретения для определения емкости пиримидинового метаболизма в качестве Компонента (a) предпочтительно использовать пиримидиновое соединение и/или его метаболит, которые обеспечивают экскрецию меченого изотопом СО2 в выдыхаемый воздух в результате метаболизма. При использовании такой композиции емкость пиримидинового метаболизма субъекта может быть определена по показателю экскреции (показатель количества экскреции или скорости экскреции в течение времени) меченого изотопом СО2, который может быть обнаружен при введении композиции субъекту с последующим измерением меченого изотопом СО2, экскретированного в выдыхаемый воздух субъекта.
Когда композиция содержит в качестве активного компонента пиримидиновое соединение, которое образует меченое изотопом соединение, отличное от меченого изотопом СО2, такое как β-аланин, фтор-β-аланин, β-аминоизомасляную кислоту или другое соединение, вместо выдыхаемого воздуха в качестве тестовой пробы используются такие выделения, как моча, пот или другие.
Когда в качестве тестовой пробы используется выдыхаемый воздух, способ измерения меченого изотопом СО2, содержавшегося в выдыхаемом воздухе, меняется в зависимости от того, является ли используемый изотоп радиоактивным или нерадиоактивным. Могут применяться стандартные аналитические методы, включая метод жидкостного сцинтилляционного счета, масс-спектрометрию, инфракрасную спектрометрию, эмиссионную спектрометрию, магнитно-резонансную спектрометрию и т.д. С точки зрения точности измерения предпочтительными являются инфракрасная спектрометрия и масс-спектрометрия. Когда в качестве тестовой пробы используются такие выделения, как моча, пот или другие, меченое изотопом пиримидиновое соединение (или меченый изотопом метаболит пиримидина), меченые изотопом промежуточные продукты метаболизма и меченые изотопом продукты метаболизма, содержавшиеся в тестовой пробе, могут быть выделены одновременно и проанализированы в тот же момент с помощью совместного применения таких методов разделения, как жидкостная хроматография, газовая хроматография и т.д. Таким образом, показатель экскреции меченых изотопом метаболитов может быть оценен селективно.
Емкость пиримидинового метаболизма у субъекта может быть оценена, например, путем сравнения показателя экскреции (показателя количества экскреции или скорости экскреции в течение времени) меченого радиоактивным изотопом метаболического продукта у субъекта, который измеряют так, как описано выше, с показателем экскреции меченого радиоактивным изотопом метаболического продукта у здорового субъекта, имеющего нормальную емкость пиримидинового метаболизма, измеренную таким же образом. В конкретном варианте, когда меченый изотопом СО2, экскретированный в выдыхаемый воздух, измеряют как меченый изотопом продукт метаболизма, количество меченого изотопом СО2 в предопределенное время после введения композиции для перорального приема, значение Δ (‰) диоксида углерода (различие в соотношении концентрации меченого изотопом13СО2/12СО2 между пробами выдыхаемого воздуха, собранными до и после введения композиции для перорального приема), или начальная скорость экскреции меченого изотопом СО2 в выдыхаемый воздух могут использоваться в качестве индекса показателя экскреции меченого изотопом продукта метаболизма. Например, используя значение Δ (‰) диоксида углерода или начальную скорость у здорового субъекта в качестве стандарта, субъект, имеющий более низкое значение Δ (‰) диоксида углерода или более низкую начальную скорость, диагностируется, как имеющий пониженную емкость пиримидинового метаболизма.
Дополнительно у испытываемого субъекта можно сравнить, вместо или в дополнение к показателю экскреции меченого изотопом продукта метаболизма, область под кривой (AUC), скорость экскреции (особенно начальную скорость экскреции), максимальную концентрацию экскреции (Cmax), или схожий параметр, предпочтительно фармакокинетический параметр, с соответствующим параметром у здорового субъекта.
Дефицит или наличие фермента, метаболизирующего пиримидин (по крайней мере, один из DPD, DHPase и β-UPase), могут быть определены на основании наличия или отсутствия экскреции меченого изотопом продукта метаболизма без сравнения с показателем экскреции здорового субъекта. Наличие уменьшения или увеличения емкости пиримидинового метаболизма (заболевания, связанного с метаболизмом пиримидина) и их степень (степень заболевания) можно определить путем сравнения показателя экскреции у субъекта или по параметру, полученному из этого, с соответствующим показателем экскреции или параметром у здорового субъекта.
Композиция для определения способности опорожнения желудка
При использовании композиции для перорального введения настоящего изобретения для определения способности опорожнения желудка предпочтительно использовать в качестве Компонента (a) пиримидиновое соединение и/или его метаболит, который в результате метаболизма опосредует экскрецию меченого изотопом СО2 в выдыхаемый воздух. При оральном введении субъекту композиция для перорального введения настоящего изобретения попадает в желудок и в конечном итоге высвобождается через пилорус путем сокращения-расслабления и перестальтики желудка. После высвобождения из пилоруса Компонент (a) быстро абсорбируется в двенадцатиперстной кишке и в нижних частях желудочно-кишечного тракта (двенадцатиперстная кишка, тонкая кишка, подвздошная кишка и т.д.), метаболизируется и экскретируется с выдыхаемым воздухом в виде меченого изотопом СО2. Компонент (a), используемый в композиции для перорального приема настоящего изобретения, абсорбируется в желудке не полностью или плохо, но после высвобождения из желудка компонент быстро поглощается, усваивается и выделяется с выдыхаемым воздухом в виде меченого изотопом СО2. Таким образом, показатель экскреции меченого изотопом СО2 в выдыхаемый воздух (выраженный как, например, отношение меченого изотопом СО2к12СО2, экскретируемому в выдыхаемый воздух (меченый изотопом СО2/12СО2)) зависит от скорости высвобождения из желудка (время высвобождения из желудка) Компонента (a), содержавшегося в композиции настоящего изобретения для перорального приема.
Доза композиции для перорального приема настоящего изобретения может быть такой же, как в случае, когда композиция настоящего изобретения для перорального приема используется для определения емкости пиримидинового метаболизма.
Содержание меченого изотопом СО2 в выдыхаемом воздухе может быть измерено с использованием того же метода, как в случае, когда композиция настоящего изобретения для перорального приема используется для определения емкости пиримидинового метаболизма.
Способность опорожнения желудка у субъекта может быть оценена с использованием, в качестве индекса полного опорожнения желудка, количества меченого изотопом СО2 в предопределенное время после введения композиции для перорального приема, значения Δ (‰) диоксида углерода (различие в соотношении концентрации меченого изотопом СО2/12СО2 между образцами выдыхаемого воздуха, собранными до и после введения композиции для перорального приема), или начальной скорости экскреции меченого изотопом СО2. Например, используя значение Δ (‰) диоксида углерода или начальную скорость у здорового субъекта в качестве стандарта, субъект, имеющий более низкое значение Δ (‰) диоксида углерода или более низкую начальную скорость, диагностируется, как имеющий сниженную способность опорожнения желудка.
Композиции для перорального приема настоящего изобретения можно вводить отдельно, либо одновременно, либо непосредственно до или после пробного приема пищи. Предпочтительно, композиция настоящего изобретения для определения емкости опорожнения желудка вводится непосредственно после пробного приема пищи. Пробный прием пищи не ограничивается, пока не ухудшает эффект использования композиции настоящего изобретения для определения емкости опорожнения желудка, и может присутствовать в виде твердой пищи, мягкой пищи или жидкой пищи.
Главная причина расстройства пищеварения (не язвенный синдром верхнего желудочно-кишечного тракта) состоит в нарушении моторики желудочно-кишечного тракта и, в частности, снижении способности опорожнения желудка. Таким образом, композиция настоящего изобретения для перорального приема может эффективно использоваться в качестве композиции для диагностического исследования на выявление расстройства пищеварения и, в частности, расстройства пищеварения, вызванного главным образом недостаточной способностью опорожнения желудка (например, расстройство пищеварения, подобное расстройству при нарушении моторики).
Дополнительно, использование композиции для перорального приема настоящего изобретения для определения способности опорожнения желудка позволяет определить эффективность или терапевтические эффекты на отдельных субъектов желудочно-кишечных лекарственных средств и, в частности, лекарственных средств, связанных с желудочно-кишечными моторными функциями. В частности, определение может быть выполнено путем измерения способности опорожнения желудка с использованием композиции для перорального приема настоящего изобретения до, и после введения желудочно-кишечного лекарственного средства, и в особенности лекарственного средства, связанного с функцией моторики желудка, с последующим сравнением двух полученных значений. Это позволяет оценить эффективность лекарственного средства непосредственно. Дополнительно, так как терапевтические эффекты препарата на отдельных субъектов также могут быть оценены, композиция для перорального приема может использоваться также для того, чтобы выбрать лекарственные средства, которые подходят для отдельных субъектов. Примеры лекарственных средств, связанных с желудочно-кишечными моторными функциями, включают лекарственные средства, которые управляют перистальтикой желудка, повышая или подавляя ее, такие как средства, улучшающие желудочно-кишечную моторную функцию, средства, усиливающие желудочно-кишечную моторную функцию, и активаторы желудочно-кишечной моторной функции (в частности, агонисты ацетилхолина, антагонисты рецептора допамина, антагонисты D2 рецептора допамина, агонисты рецептора серотонина, опиатные агонисты и средства китайской медицины (Liu Jun Zi Tang, Ban Xia Xie Xin Tang и An Zhong San), а также средства-супрессоры желудочно-кишечной моторной функции (антихолинергические лекарственные средства, антагонисты мускаринового рецептора и т.д.)) и т.п. Такое определение также может быть проведено в отношение пациента, страдающего расстройством пищеварения, и в особенности пациента с расстройством желудка, вызванным главным образом недостаточными желудочными моторными функциями (пациент с расстройством пищеварения, подобным расстройству при нарушении моторики), в качестве исследуемого субъекта. В указанном случае могут быть определены фармакотерапевтические эффекты на отдельных пациентов, страдающих расстройством желудка, что, таким образом, позволяет выбрать подходящее лекарственное средство, связанное с желудочно-кишечными моторными функциями (средство, улучшающее желудочно-кишечную моторную функцию, средство, усиливающее желудочно-кишечную моторную функцию, или активатор желудочно-кишечной моторной функции, как упомянуто выше).
ПРИМЕРЫ
Настоящее изобретение описано ниже посредством Примеров и Тестовых Примеров, в которых приведены примеры получения и оценки свойств композиций. Однако возможности настоящего изобретения не ограничены указанными Примерами и Испытательными Примерами.
Примеры приготовления композиций
Пример 1
Двадцать граммов13C урацила и 380 г D-маннита (Mannit, продукция Kyowa Hakko Kogyo Co., Ltd.) были смешаны, помещены в мельницу для препаратов (KIIWG-1F, продукция Fuji Paudal Co., Ltd.), перемешаны и измельчены (условия измельчения: при скорости измельчающего ротора 12800 об/мин и скорости подающего препараты двигателя около 10 об/мин, с использованием экрана с перфорированными отверстиями диаметром 1 мм), в результате чего был приготовлен порошковый материал. Навеска 200 г полученного порошкового материала была внесена в скоростную мешалку (NSK-150, продукция Okada Seiko Co., Ltd.), затем было добавлено 20 г очищенной воды с последующим перемешиванием. Полученный влажный порошок был продавлен через экструзионный гранулятор (Dome Gran DG-L, продукция Fuji Paudal Co., Ltd.), оборудованный куполообразной головкой с отверстиями диаметром 1 мм, и высушен с использованием воздушной сушилки (SPHH-200, продукция Espec Corp.) при 60°C. Те частицы высушенной композиции, которые прошли через сито, имеющее размер ячейки 1400 мкм, и не прошли через сито, имеющее размер ячейки 355 мкм, были получены в форме гранулированной композиции, содержащей 5 вес. %13C урацила.
Диаметр частиц полученной таким образом гранулированной композиции, содержащей 5% от веса13C урацила, был измерен методом вибрационного просеивания (в частности, с использованием измерительного прибора Robot Shifter RPS85 (продукция Seishin Enterprise Co., Ltd.) на 5 уровне вибрации, время встряхивания 5 минут, с интервалом между импульсами 1 секунда). Результаты приведены в Таблице 1.
Сравнительный Пример 1
Десять граммов13C урацила и 190 г D-маннита (Mannit, продукция Kyowa Hakko Kogyo Co., Ltd.) были помещены в скоростную мешалку (NSK-150, продукция Okada Seiko Co., Ltd.) и перемешаны, а затем, без измельчения, было добавлено 20 г очищенной воды с последующим перемешиванием. Затем провели гранулирование, сушку и регулировку размера частиц просеиванием при тех же условиях, как и в Примере 1, в результате чего получили гранулированную композицию, содержащую 5 вес. %13C урацила. Диаметр частиц полученной таким образом гранулированной композиции, содержащей 5 вес. %13C урацила, был измерен с использованием того же метода, как и в Примере 1. Результаты приведены в Таблице 2.
Пример 2
Двадцать граммов13C урацила и 180 г D-маннита (Mannit, продукция Kyowa Hakko Kogyo Co., Ltd.) были смешаны, помещены в мельницу для препаратов (KIIWG-1F, продукция Fuji Paudal Co., Ltd.), смешаны и измельчены (при скорости измельчающего ротора 12800 об/мин и скорости подающего препараты двигателя около 10 об/мин, с использованием экрана с перфорированными отверстиями диаметром 1 мм), в результате чего был приготовлен порошковый материал. Навеска 144 г полученного порошкового материала была внесена в скоростную мешалку (NSK-150, продукция Okada Seiko Co., Ltd.), затем было добавлено 14,4 г очищенной воды с последующим перемешиванием. Полученный влажный порошок был продавлен через экструзионный гранулятор (Dome Gran DG-L, продукция Fuji Paudal Co., Ltd.), оборудованный куполообразной головкой с отверстиями диаметром 1 мм, и высушен с использованием воздушной сушилки (SPHH-201, продукция Espec Corp.) при 60°C. Те частицы высушенной композиции, которые прошли через сито, имеющее размер ячейки 1400 мкм, и не прошли через сито, имеющее размер ячейки 355 мкм, были получены в форме гранулированной композиции, содержащей 10 вес. %13C урацила.
Сравнительный Пример 2
Двадцать граммов13C урацила и 180 г D-маннита (Mannit, продукция Kyowa Hakko Kogyo Co., Ltd.) были тщательно смешаны и помещены в скоростную мешалку (NSK-150, продукция Okada Seiko Co., Ltd.). К смеси добавили двадцать граммов очищенной воды с последующим перемешиванием. Затем провели гранулирование, сушку и регулировку размера частиц просеиванием при тех же условиях, как и в Примере 2, в результате чего получили гранулированную композицию, содержащую 10 вес. %13C урацила.
Сравнительный Пример 3 (таблетки)
Сто граммов13C урацила, 60 г лактозы (продукция H.M.S), 25 г кукурузного крахмала (продукция Nihon Shokuhin Kako Co., Ltd.), 10 г кристаллической целлюлозы (Ceolus PH301, продукция Asahi Kasei Co.) и 4 г гидроксипропилцеллюлозы (HPC-L тонкий порошок, продукция Nippon Soda Co., Ltd.) были помещены в скоростную мешалку (NSK-150, продукция Okada Seiko Co., Ltd.) и перемешаны. Затем к смеси были добавлены сорок граммов очищенной воды с последующим перемешиванием. Далее полученный перемешанный порошок был гранулирован с использованием скоростной мельницы (ND-02, продукция Okada Seiko Co., Ltd.), оборудованной экраном с перфорированными отверстиями диаметром 3 мм, и высушен с использованием воздушной сушилки (SPHH-200, продукция Espec Corp.) при 70°C. Высушенные гранулы были просеяны через сито № 16 для регулирования размера частиц, после чего к 199 г гранул, с уже отрегулированным размером частиц, был добавлен 1 г стеарата магния (продукция Taihei Chemical Industrial Co., Ltd.), в результате чего были получены гранулы для таблеток. Гранулы для таблеток были спрессованы в таблетки весом по 200 мг с использованием одноударной таблетирующей машины (No. 2B, продукция Kikusui Seisakusho Ltd.), оборудованной ударниками и пресс-формами с диаметром 8 мм, с округленными углами.
Пример 3
Двадцать граммов13C урацила и 180 г D-маннита (Mannit, продукт Kyowa Hakko Kogyo Co., Ltd.) были тщательно смешаны и помещены в мельницу для препаратов (SAM, продукция Nara Machinery Co., Ltd.), а затем смешаны и измельчены (форма размалывающих лезвий: иглообразная; скорость ротора: 4000 об/мин; экран: экран с перфорированными отверстиями диаметром 3 мм), в результате чего была получена порошковая композиция.
Сравнительный Пример 4
Двадцать граммов13C урацила были просеяны через сито № 30, в результате чего была получена порошковая композиция.
Сравнительный Пример 5
Двести граммов13C урацила были помещены в мельницу для препаратов (SAM, продукция Nara Machinery Co., Ltd.) и измельчены при тех же условиях, как и в Примере 3, в результате чего была получена порошковая композиция.
Оценка свойств композиций
Тестовый Пример 1: Измерение распределения размера частиц
Распределение размера частиц порошковых композиций Примера 3 и Сравнительных Примеров 4 и 5 было оценено с использованием прибора для измерения распределения размера сухих частиц (LDSA-1500A, продукция Tohnichi Computer) при следующих условиях: фокусное расстояние 100 мм, количество усредняющих процессов 10, усредняющий интервал 5 миллисекунд и давление воздуха 0,4 МПа. По измеренному распределению размера частиц были вычислены диаметр 10% частиц (10%D), диаметр 50% частиц (50%D) и диаметр 90% частиц (90%D). Результаты приведены в Таблице 3.
Как показано в Таблице 3, в порошковой композиции Сравнительного Примера 4, которая была получена путем просеивания одного13C урацила, и в порошковой композиции Сравнительного Примера 5, которая была получена путем измельчения одного13C урацила, диаметр частиц не был уменьшен, что указывает на недостаточный эффект измельчения, тогда как в порошковой композиции Примера 3, которая была получена путем смешивания и измельчения, диаметр частиц был уменьшен, демонстрируя при этом достаточный эффект измельчения.
Тестовый Пример 2: Оценка растворимости композиций
Сто миллилитров водопроводной воды были добавлены в каждую мензурку на 200 мл при комнатной температуре. Затем, при перемешивании с помощью магнитной мешалки (RCN-7D, продукция EYELA) при 200 об/мин, в каждую мензурку было добавлено по 2000 мг каждой из гранулированных композиций Примера 1 и Сравнительного Примера 1, а время, требуемое для растворения композиций, было оценено визуально. Далее, через три минуты после добавления гранулированных композиций, были визуально оценены количества нерастворенных остатков композиций.
Результаты показаны в Таблице 4. Как видно из результатов, композиции Сравнительного Примера 1 требовалось много времени для растворения, и большое количество композиции осталось нерастворенным; тогда как композиция Примера 1 растворялась быстро, и лишь малое количество композиции осталось нерастворенным.
Тестовый Пример 3: Оценка растворимости композиций
Шесть таблеток, полученных в Сравнительном Примере 3, были подвергнуты испытанию на распадаемость согласно Japanese pharmacopoeia, 14th Edition, General Test Procedures, Disintegration Test. В результате все таблетки имели время распада 15 минут или дольше.
Тестовый Пример 4: Оценка точности диагностики нарушения емкости пиридинового метаболизма
После перорального введения композиций Примера 2 и Сравнительного Примера 2 трем здоровым субъектам (Субъекты A, B и C), воздух, выдыхаемый субъектами, собирали в течение времени, после чего концентрация13C диоксида углерода в выдыхаемом воздухе была измерена с использованием GC-MS анализатора (ABCA-G, продукция Europa Scientific).
На фигуре 2 показано изменение концентрации13C диоксида углерода в выдыхаемом воздухе после введения композиции Примера 2; а на фигуре 3 показано изменение концентрации13C диоксида углерода после введения композиции Сравнительного Примера 2. На фигурах 2 и 3 ось ординат показывает значения Δ13C (‰), которые представляют собой разность между значением δ13C (‰) (отношение концентрации13CО2/12CО2) выдыхаемого воздуха, собранного перед введением композиции для определения емкости пиримидинового метаболизма, и значениями δ13C (‰) выдыхаемого воздуха, собранного в различные промежутки времени после введения композиции. Ось абсцисс показывает периоды (мин), в которые собирали выдыхаемый воздух после введения композиции. Когда была введена композиция Сравнительного Примера 2, изменение концентрации13C диоксида углерода было маленьким у одного из трех субъектов, показывая различие среди субъектов (см. фигуру 3). Напротив, когда композицию Примера 2 вводили тем же трем субъектам, изменения концентрации13C диоксида углерода по субъектам были сходными, показывая лишь малое различие среди отдельных лиц. Настоящие результаты демонстрируют, что нарушение емкости пиридинового метаболизма может диагностироваться быстро, с высокой точностью и лишь с малым различием среди отдельных лиц, путем введения композиции Примера 2 и диагностики емкости пиридинового метаболизма с использованием в качестве показателя концентрации13C диоксида углерода в выдыхаемом воздухе, собранном через 20-30 минут после введения композиции (см. фигуру 2).
Тестовый Пример 5: Диагностика способности опорожнения желудка
Композицию Примера 1 вводили перорально в дозировке, соответствующей 100 мг 2-13C урацила, людям (20 случаев), подозреваемым на наличие постоперативного гастропареза, через 20 дней после того, как пациенты подверглись операциям по удалению желудка. Воздух, выдыхаемый пациентами, собирали через 10, 20, 30, 40, 50 и 60 минут после введения, а затем концентрации13СО2 полученных проб выдыхаемого воздуха вместе с концентрациями13СО2 проб выдыхаемого воздуха, собранных тем же способом перед введением, были измерены с использованием GC/MS. Далее, было вычислено количественное изменение концентрации13СО2 (Δ13С (‰)) в выдыхаемом воздухе. Результаты показаны на фигуре 4.
Как показано на фигуре 4, исследование выдыхаемого воздуха с использованием композиции настоящего изобретения позволило разделить пациентов (20 случаев) на тех, у кого нормальная способность опорожнения желудка (нормальный тип: сплошная линия), тех, у кого пониженная способность опорожнения желудка (тип с задержкой опорожнения желудка: ломаная линия), и тех, у кого недостаточная способность опорожнения желудка (недостаточный тип: пунктирная линия). Когда через 20 минут после введения композиции были измерены концентрации 2-13C урацила в плазме указанных пациентов, наблюдалось снижение концентраций 2-13C урацила в плазме в соответствии со способностью опорожнения желудка у пациентов с пониженной способностью опорожнения желудка (с задержкой опорожнения желудка) и у пациентов с недостаточной способностью опорожнения желудка. Указанный факт демонстрирует, что исследование выдыхаемого воздуха с использованием композиции для перорального приема настоящего изобретения эффективно отражает способность опорожнения желудка.
Реферат
Изобретение относится к композиции для перорального приема, предназначенной для диагностирования нарушений емкости пиридинового метаболизма и определения способности опорожнения желудка. Композиция по изобретению включает пиримидиновое соединение, являющееся субстратом для фермента дигидропиримидиндегидрогеназы или его метаболита, который является субстратом для дигидропиримидиназы или β-уреидопропионазы, в котором, по крайней мере, один из атомов углерода, атомов кислорода и атомов азота помечен изотопом, и сахар и/или сахароспирт. Изобретение также относится к способу получения указанной композиции, который включает смешивание и измельчение порошкового материала, включающего пиримидиновое соединение и сахар или сахароспирт с получением порошка с размерами частиц от 5 до 70 мкм. Изобретение позволяет диагностировать пиримидиновый метаболизм и способность опорожнения желудка с высокой точностью и небольшим изменением из-за индивидуальных различий. 2 н. и 14 з.п. ф-лы, 4 табл., 5 ил.
Формула
(a) пиримидинового соединения, являющегося субстратом для фермента дигидропиримидиндегидрогеназы или его метаболита, который является субстратом для дигидропиримидиназы или β-уреидопропионазы, в котором, по крайней мере, один из атомов углерода, атомов кислорода и атомов азота помечен изотопом, и
(b) сахара и/или сахароспирта, где диаметр 50% частиц порошкового материала составляет 5-20 мкм, а диаметр 90% частиц порошкового материала составляет 10-70 мкм.
(a) представляет собой меченый изотопом урацил.
(b) представляет собой маннит.
(1) получение порошкового материала путем смешивания и измельчения
(a) пиримидинового соединения, являющегося субстратом для фермента дигидропиримидиндегидрогеназы или его метаболита, который является субстратом для дигидропиримидиназы или β-уреидопропионазы, в котором, по крайней мере, один из атомов углерода, атомов кислорода и атомов азота помечен изотопом, и
(b) сахара и/или сахароспирта, где диаметр 50% частиц порошкового материала составляет 5-20 мкм, а диаметр 90% частиц порошкового материала составляет 10-70 мкм,
(2) введение порошкового материала, полученного в вышеприведенной стадии (1), в композицию.

Комментарии