Замещенные индолы, противовирусный активный компонент, способ получения и применения - RU2436786C1
Код документа: RU2436786C1
Описание
Настоящее изобретение относится к новому противовирусному активному компоненту, фармацевтической композиции, противовирусному лекарственному средству, способу профилактики и лечения вирусных заболеваний, особенно вызываемых вирусами гепатита С (HCV).
Вирусные инфекции могут вызывать множество заболеваний, что создает серьезную угрозу для здоровья и жизни человечества. За последние 20 лет обнаружено не менее 30 совершенно новых возбудителей инфекционных болезней: СПИДа, вирусных гепатитов, острых и хронических диарей, геморрагических лихорадок (Эбола, венесуэльской, бразильской, долины Рифт) [a) Lednicky J.A., Rayner J.O. Uncommon respiratory pathogens. Curr. Opin. Pulm. Med. 2006, 12(3), 235-239. b) Hayden F.G.Respiratory viral threats. Curr. Opin. Infect. Dis. 2006, 79(2), 169-178]. В частности, особую тревогу вызывает возможность заболевания человека так называемым «птичьим гриппом» [a) Liu J.P. Avian influenza-a pandemic waiting to happen? J. Microbiol. Immunol. Infect. 2006, 39(1), 4-10. b) Henter J.I.; Chow C.B.; Leung C.W, Lau Y.L. Cytotoxic therapy for severe avian influenza A (H5N1) infection. Lancet. 2006 367(9513), 870-873. Review]. Согласно статистическим данным 60-65 % эпидемических инфекций имеют вирусную этиологию. Из-за сложности взаимодействия в триаде «вирус - организм хозяина - лекарство» большинство современных противовирусных препаратов в процессе терапии проявляют побочные эффекты и формируют резистентные вирусные штаммы [Jain R., Clark N.M., Diaz-Linares M., Grim S.A. Limitations of current antiretroviral agents and opportunities for development. Curr. Pharm. Des. 2006, 12(9), 1065-1074]. В настоящее время количество противовирусных лекарственных препаратов, которые могут быть использованы в клинической практике, чрезвычайно ограничено - всего 43 низкомолекулярных вещества [http://integrity.prous.com/integrity], что далеко не удовлетворяет потребности профилактики и лечения вирусных заболеваний. Кроме того, существует значительное число вирусных инфекций, вызывающих заболевания, для лечения которых в настоящее время не существует химиотерапевтических средств. Это относится, например, к заболеваниям, вызываемым вирусами папилломы, аденовирусам, герпеса-6, оспы, синдрома SARS, геморрагических лихорадок, лихорадки Западного Нила, птичьего гриппа и т.д. [De Clercq E. Recent highlights in the development of new antiviral drugs. Curr Opin Microbiol. 2005, 8(5), 552-560].
Таким образом, большое значение имеет создание новых противовирусных препаратов, в особенности, обладающих новым механизмом противовирусного действия, высокой активностью и низкой токсичностью.
Опубликованы международные заявки WO 2009039246 А2 и WO 2009039248 А2, в которых описаны новые противовирусные активные ингредиенты, представляющие собой Клемезол I и его аналоги, например бензимидазол II, предназначенные для профилактики и лечения вирусных заболеваний, вызываемых вирусами гепатита С (HCV). µМ
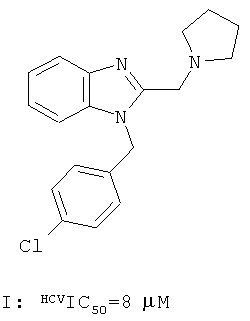
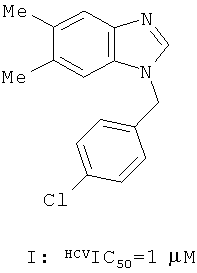
Однако многие замещенные индолы, обладающие активностью по отношению к HCV, до настоящего времени не были известны.
Поиск высокоэффективных противовирусных лекарственных препаратов в настоящее время по-прежнему является одним из основных направлений создания новых фармакологических средств для лечения широкого и разнообразного круга вирусных инфекций.
Ниже приведены определения терминов, которые использованы в описании этого изобретения.
«Азагетероцикл» означает ароматическую или неароматическую моноциклическую или полициклическую систему, содержащую в цикле, по крайней мере, один атом азота. Азагетероцикл может иметь один или более «заместителей циклической» системы. «Активный компонент» (лекарственное вещество, лекарственная субстанция, drug-substance) означает физиологически активное вещество синтетического или иного (биотехнологического, растительного, животного, микробного и прочего) происхождения, обладающее фармакологической активностью и являющееся активным началом фармацевтической композиции, используемой для производства и изготовления лекарственного препарата (средства).
«Алкил» означает алифатическую углеводородную линейную или разветвленную группу с 1-12 атомами углерода в цепи. Разветвленная означает, что алкильная цепь имеет один или несколько «низших алкильных» заместителей. Алкил может иметь один или несколько одинаковых или различных заместителей («алкильных заместителей»), включая галоген, алкенилокси, циклоалкил, арил, гетероарил, гетероциклил, ароил, циано, гидрокси, алкокси, карбокси, алкинилокси, аралкокси, арилокси, арилоксикарбонил, алкилтио, гетероарилтио, аралкилтио, арилсульфонил, алкилсульфонилгетероаралкилокси, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, RkaRk+1aNC(=S)-, RkaRk+1aNSO2, где Rka и Rk+1a независимо друг от друга представляют собой «заместители аминогруппы», например атом водорода, алкил, арил, аралкил, гетероаралкил, гетероциклил или гетероарил, или Rka и Rk+1a вместе с атомом N, с которым они связаны, образуют через Rka и Rk+1a 4-7 членный гетероциклил или гетероцикленил. Предпочтительными алкильными группами являются метил, трифторметил, циклопропилметил, циклопентилметил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, н-пентил, 3-пентил, метоксиэтил, карбоксиметил, метоксикарбонилметил, этоксикарбонилметил, бензилоксикарбонилметил, метоксикарбонилметил и пиридилметилоксикарбонилметил. Предпочтительными «алкильными заместителями» являются циклоалкил, арил, гетероарил, гетероциклил, гидрокси, алкокси, алкоксикарбонил, аралкокси, арилокси, алкилтио, гетероарилтио, аралкилтио, алкилсульфонил, арилсульфонил, алкоксикарбонил, аралкоксикарбонил, гетероаралкилоксикарбонил или RkaRk+1aN-, RkaRk+1aNC(=O)-, аннелированный арилгетероцикленил, аннелированный арилгетероциклил.
«Аминогруппа» означает RkaRk+1aN - группу, замещенную или незамещенную «заместителем аминогруппы» Rka и Rk+1a, значение которых определено в данном разделе, например, амино (H2N-), метиламино, диэтиламино, пирролидин, морфолин, бензиламино или фенетиламино.
«Арил» означает ароматическую моноциклическую или полициклическую систему, включающую от 6 до 14 атомов углерода, преимущественно от 6 до 10 атомов углерода.
Арил может содержать один или более «заместителей циклической системы», которые могут быть одинаковыми или разными. Представителями арильных групп являются фенил или нафтил, замещенный фенил или замещенный нафтил. Арил может быть аннелирован с неароматической циклической системой или гетероциклом. «Гидрат» означает сольват, в котором вода является молекулой или молекулами растворителя.
«Заместитель» означает химический радикал, который присоединяется к скэффолду (фрагменту), например «заместитель алкильный», «заместитель аминогруппы», «заместитель карбамоильный», «заместитель циклической системы».
«Заместитель аминогруппы» означает заместитель, присоединенный к аминогруппе. Заместитель аминогруппы представляет собой водород, алкил, циклоалкил, арил, гетероарил, гетероциклил, ацил, ароил, алкилсульфонил, арилсульфонил, гетероарилсульфонил, алкиламинокарбонил, ариламинокарбонил, гетероариламинокарбонил, гетероциклиламинокарбонил, алкиламинотиокарбонил, ариламинотиокарбонил, гетероариламинотиокарбонил, гетероциклиламинотиокарбонил, аннелированный гетероарилциклоалкенил, аннелированный гетероарилциклоалкил, аннелированный гетероарилгетероцикленил, аннелированный гетероарилгетероциклил, аннелированный арилциклоалкенил, аннелированный арилциклоалкил, аннелированный арилгетероцикленил, аннелированный арилгетероциклил, алкоксикарбонилалкил, аралкоксикарбонилалкил, гетероаралкилоксикарбонилалкил. «Замещенная аминогруппа» означает RkaRk+1aN - группу, в которой Rka и Rk+1aпредставляют собой заместители аминогруппы, значение которых определено в данном разделе.
«Лекарственное средство (препарат)» - вещество (или смесь веществ в виде фармацевтической композиции) в виде таблеток, капсул, инъекций, мазей и других готовых форм, предназначенное для восстановления, исправления или изменения физиологических функций у человека и животных, а также для лечения и профилактики болезней, диагностики, анестезии, контрацепции, косметологии и прочего.
«Необязательно замещенный радикал» означает радикал без заместителей или содержащий один или несколько заместителей.
«Низший алкил» означает линейный или разветвленный алкил с 1-4 атомами углерода.
«Терапевтический коктейль» представляет одновременно администрируемую комбинацию двух и более лекарственных препаратов, обладающих различным механизмом фармакологического действия и направленных на различные биомишени, участвующие в патогенезе заболевания.
«Фармацевтическая композиция» обозначает композицию, включающую в себя активный компонент и, по крайней мере, один из компонентов, выбранных из группы, состоящей из фармацевтически приемлемых и фармакологически совместимых наполнителей, растворителей, разбавителей, носителей, вспомогательных, распределяющих и воспринимающих средств, средств доставки, таких как консерванты, стабилизаторы, наполнители, измельчители, увлажнители, эмульгаторы, суспендирующие агенты, загустители, подсластители, отдушки, ароматизаторы, антибактериальные агенты, фунгициды, лубриканты, регуляторы пролонгированной доставки, выбор и соотношение которых зависит от природы и способа назначения и дозировки. Примерами суспендирующих агентов являются этоксилированный изостеариловый спирт, полиоксиэтилен, сорбитол и сорбитовый эфир, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, а также смеси этих веществ. Защита от действия микроорганизмов может быть обеспечена с помощью разнообразных антибактериальных и противогрибковых агентов, например, таких как парабены, хлорбутанол, сорбиновая кислота и подобные им соединения. Композиция может включать также изотонические агенты, например сахара, хлористый натрий и им подобные. Пролонгированное действие композиции может быть обеспечено с помощью агентов, замедляющих абсорбцию активного начала, например моностеарат алюминия и желатин. Примерами подходящих носителей, растворителей, разбавителей и средств доставки являются вода, этанол, полиспирты, а также их смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры (такие как этилолеат). Примерами наполнителей являются лактоза, молочный сахар, цитрат натрия, карбонат кальция, фосфат кальция и им подобные. Примерами измельчителей и распределяющих средств являются крахмал, алгиновая кислота и ее соли, силикаты. Примерами лубрикантов являются стеарат магния, лаурилсульфат натрия, тальк, а также полиэтиленгликоль с высоким молекулярным весом. Фармацевтическая композиция для перорального, сублингвального, трансдермального, внутримышечного, внутривенного, подкожного, местного или ректального введения активного начала, одного или в комбинации с другим активным началом, может быть введена животным и людям в стандартной форме введения, в виде смеси с традиционными фармацевтическими носителями. Пригодные стандартные формы введения включают пероральные формы, такие как таблетки, желатиновые капсулы, пилюли, порошки, гранулы, жевательные резинки и пероральные растворы или суспензии, сублингвальные и трансбуккальные формы введения, аэрозоли, имплантаты, местные, трансдермальные, подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения и ректальные формы введения.
«Фармацевтически приемлемая соль» означает относительно нетоксичные органические и неорганические соли кислот и оснований, заявленных в настоящем изобретении. Эти соли могут быть получены in situ в процессе синтеза, выделения или очистки соединений или приготовлены специально. В частности, соли оснований могут быть получены специально, исходя из очищенного свободного основания заявленного соединения и подходящей органической или неорганической кислоты. Примерами полученных таким образом солей являются гидрохлориды, гидробромиды, сульфаты, бисульфаты, фосфаты, нитраты, ацетаты, оксалаты, валериаты, олеаты, пальмитаты, стеараты, лаураты, бораты, бензоаты, лактаты, тозилаты, цитраты, малеаты, фумараты, сукцинаты, тартраты, мезилаты, малонаты, салицилаты, пропионаты, этансульфонаты, бензолсульфонаты, сульфаматы и им подобные (Подробное описание свойств таких солей дано в Berge S.M., et al., "Pharmaceutical Salts" J. Pharm. Sci. 1977, 66: 1-19). Соли заявленных кислот также могут быть специально получены реакцией очищенной кислоты с подходящим основанием, при этом могут быть синтезированы соли металлов и аминов. К металлическим относятся соли натрия, калия, кальция, бария, цинка, магния, лития и алюминия, наиболее желательными из которых являются соли натрия и калия. Подходящими неорганическими основаниями, из которых могут быть получены соли металлов, являются гидроксид, карбонат, бикарбонат и гидрид натрия, гидроксид и бикарбонат калия, поташ, гидроксид лития, гидроксид кальция, гидроксид магния, гидроксид цинка. В качестве органических оснований, из которых могут быть получены соли заявленных кислот, выбраны амины и аминокислоты, обладающие достаточной основностью, чтобы образовать устойчивую соль, и пригодные для использования в медицинских целях (в частности, они должны обладать низкой токсичностью). К таким аминам относятся аммиак, метиламин, диметиламин, триметиламин, этиламин, диэтиламин, триэтиламин, бензиламин, дибензиламин, дициклогексиламин, пиперазин, этилпиперидин, трис(гидроксиметил)аминометан и подобные им. Кроме того, для солеобразования могут быть использованы гидроокиси тетраалкиламмония, например, такие как холин, тетраметиламмоний, тетраэтиламмоний и им подобные. В качестве аминокислот могут быть использованы основные аминокислоты - лизин, орнитин и аргинин.
Предметом данного изобретения является новый противовирусный активный компонент, представляющий собой замещенный индол общей формулы 1 и его фармацевтически приемлемые соли
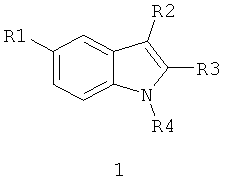


где: R1 представляет собой атом водорода, необязательно замещенный С1-С4алкил, С6 циклоалкил, фенил, этоксикарбонил, нитро группу;
R2 представляет собой атом водорода;
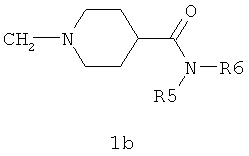
R3 представляет собой N-моно- или N,N-дизамещенный 1-метилен-пиперидин-3-карбоксамид общей формулы 1а или N-моно- или N,N-дизамещенный 1-метилен-пиперидин-4-карбоксамид общей формулы 1b;
R4 представляет собой атом водорода, необязательно замещенный С1-С3 алкил, группу -CH2-R12, где R12 представляет собой атом водорода или необязательно замещенный галогеном или C1-C4алкилом фенил;
или
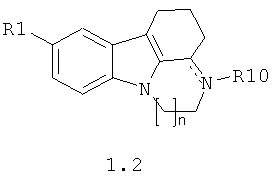
R2, R3 и R4 вместе с атомами, с которыми они связаны, образуют два замещенных аннелированных с пиррольным кольцом и друг с другом шести- или шести- и семичленных цикла с образованием азагетероцикла общей формулы 1.2;
или
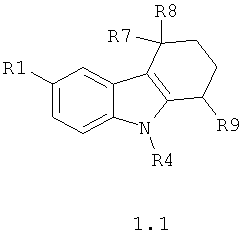
R2 и R3 вместе с атомами углерода, с которыми они связаны, образуют замещенный шестичленный насыщенный и аннелированный с пиррольным кольцом цикл с образованием 2,3,4,9-тетрагидро-1H-карбазола общей формулы 1.1, в которой R1 представляет собой метил, этоксикарбонил, нитро группу; R4 представляет собой атом водорода, метил, С2-С3алкил, замещенный N-бензиламином; R7 и R8 представляют собой атомы водорода или R7 и R8 вместе с атомом углерода, с которым они связаны, образуют группу С=O;
R5 и R6 необязательно одинаковые представляют собой атом водорода, необязательно замещенный C1-С3алкил или С3-С6циклоалкил;
или R5 и R6 вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 5- или 6-членный азагетероциклил, содержащий один или два атома азота, возможно конденсированный с бензольным кольцом, или образуют группу
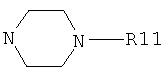
R9 представляет собой азагетероциклил, содержащий по крайней мере один атом азота, незамещенный формамид, или фенил, замещенный этоксикарбонильной или нитро группой;
R10 представляет собой атом водорода, необязательно замещенный C1-С3алкил; замещенный ацетил, где заместители выбраны из 5-6-членного азотсодержащего гетероциклила или 5-6-членной азотсодержащей гетероарилтиа-группы;
n=1 или 2;
пунктирная линия с сопровождающей ее сплошной линией

Предпочтительным является противовирусный активный компонент, представляющий собой замещенный амид 1-[(1Н-индол-2-ил)метил]пиперидин-4-карбоновой кислоты общей формулы 1.3.1 или замещенный амид 1-[(1Н-индол-2-ил)метил]пиперидин-3-карбоновой кислоты общей формулы 1.3.2 и их фармацевтически приемлемые соли.

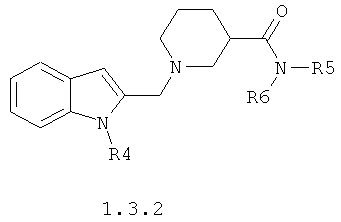
где R4, R5 и R6 имеют вышеуказанное значение.
Более предпочтительным является противовирусный активный компонент, представляющий собой замещенный амид 1-[(1Н-индол-2-ил)метил]пиперидин-4-карбоновой кислоты общей формулы 1.3.1.1 и его фармацевтически приемлемую соль

где R11 представляет собой C1-С3алкил; R12 представляет собой атом водорода или необязательно замещенный галоидом или C1-С3алкилом фенил.
Более предпочтительным является противовирусный активный компонент, обладающий противовирусной активностью по отношению к HCV, представляющий собой замещенный индол общей формулы 1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1 или его фармацевтически приемлемую соль.
Предметом данного изобретения является также фармацевтическая композиция, обладающая противовирусной активностью, содержащая фармацевтически эффективное количество противовирусного активного компонента, представляющего собой, по крайней мере, один замещенный индол общей формулы 1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1 или его фармацевтически приемлемую соль.
Более предпочтительной является фармацевтическая композиция, обладающая противовирусной активностью в отношении вируса гепатита С (HCV), содержащая в качестве активного компонента, по крайней мере, один замещенный индол общей формулы 1,1.1,1.2,1.3,1.3.1,1.3.1.1,1.3.2.1 или его фармацевтически приемлемую соль.
Фармацевтические композиции могут включать фармацевтически приемлемые эксципиенты. Под фармацевтически приемлемыми эксципиентами подразумеваются применяемые в сфере фармацевтики разбавители, вспомогательные агенты и/или носители. Фармацевтическая композиция наряду с замещенным индолом общей формулы 1, 1.1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1 или его фармацевтически приемлемой солью по настоящему изобретению может включать и другие активные ингредиенты, при условии, что они не вызывают нежелательных эффектов, например аллергических реакций.
При необходимости использования фармацевтических композиций по настоящему изобретению в клинической практике они могут смешиваться с другими компонентами для изготовления различных форм, при этом они могут включать в свой состав традиционные фармацевтические носители; например, пероральные формы (такие как таблетки, желатиновые капсулы, пилюли, растворы или суспензии); формы для инъекций (такие как растворы или суспензии для инъекций, или сухой порошок для инъекций, который требует лишь добавления воды для инъекций перед использованием); местные формы (такие как мази или растворы).
Носители, используемые в фармацевтических композициях по настоящему изобретению, представляют собой носители, которые применяются в сфере фармацевтики для получения распространенных форм, в том числе: в пероральных формах используются связующие вещества, смазывающие агенты, дезинтеграторы, растворители, разбавители, стабилизаторы, суспендирующие агенты, бесцветные агенты, корригенты вкуса; в формах для инъекций используются антисептические агенты, солюбилизаторы, стабилизаторы; в местных формах используются основы, разбавители, смазывающие агенты, антисептические агенты.
Предметом настоящего изобретения также является способ получения фармацевтической композиции.
Поставленная цель достигается смешением, по крайней мере, одного противовирусного активного компонента, представляющего собой замещенный индол общей формулы 1, 1.1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1 или его фармацевтически приемлемую соль, с инертным наполнителем и/или растворителем.
Предметом данного изобретения является также лекарственное средство, предназначенное для лечения вирусных заболеваний, включающее в свой состав новый противовирусный компонент, представляющий собой, по крайней мере, один замещенный индол общей формулы 1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1 или его фармацевтически приемлемую соль, или новую фармацевтическую композицию, включающую этот активный компонент, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку.
Согласно данному изобретению более предпочтительным лекарственным средством является лекарственное средство, предназначенное для лечения заболеваний, обусловленных вирусами HCV, включающее в свой состав новый противовирусный компонент, представляющий собой, по крайней мере, один замещенный индол общей формулы 1,1.1,1.2,1.3,1.3.1,1.3.1.1,1.3.2.1 или его фармацевтически приемлемую соль, или новую фармацевтическую композицию, включающую этот активный компонент, в форме таблеток, капсул или инъекций, помещенных в фармацевтически приемлемую упаковку.
Лекарственные средства могут вводиться перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно). Клиническая дозировка фармацевтической композиции или лекарственного средства, содержащих противовирусный активный компонент общей формулы 1, 1.1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1, у пациентов может корректироваться в зависимости от: терапевтической эффективности и биодоступности активных ингредиентов в организме, скорости их обмена и выведения из организма, а также в зависимости от возраста, пола и стадии заболевания пациента, при этом суточная доза у взрослых обычно составляет 10~500 мг, предпочтительно 50~300 мг. Поэтому во время приготовления из фармацевтической композиции лекарственного средства по настоящему изобретению в виде единиц дозировки необходимо учитывать вышеназванную эффективную дозировку, при этом каждая единица дозировки препарата должна содержать 10~500 мг активного начала общей формулы 1, 1.1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1, предпочтительно 50~300 мг. В соответствии с указаниями врача или фармацевта данные препараты могут приниматься несколько раз в течение определенных промежутков времени (предпочтительно - от одного до шести раз).
Предметом настоящего изобретения является также терапевтический коктейль для профилактики и лечения вирусных заболеваний, в том числе заболеваний, обусловленных вирусами гепатита С, включающий в свой состав новый активный компонент или новую фармацевтическую композицию, содержащие, по крайней мере, один замещенный индол общей формулы 1, 1.1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1 или его фармацевтически приемлемую соль.
Терапевтические коктейли для профилактики и лечения гепатита С наряду с лекарственными средствами по данному изобретению могут включать: ингибиторы инозин-5-монофосфат дегидрогеназы, например Рибавирин (разрешен) и Рибамидин;
ингибиторы NS3 протеазы гепатита С, например Телапревир, Силупревир и SCH-503034; ингибиторы РНК-полимеразы NS5B, например XTL-2125; ингибиторы альфа-глюкозидазы, например аминоуглевод Селгозивир; а также агонисты TLR-рецепторов, гепатопротекторы, циклоспорины, различные белки (например, интерфероны), антитела, вакцины и т.д.
Предметом данного изобретения является также способ профилактики и лечения вирусных заболеваний животных и людей.
В соответствии с данным изобретением способ профилактики и лечения вирусных заболеваний животных и людей, в том числе вызванных вирусами гепатита С, заключается во введении теплокровному животному или человеку нового лекарственного средства, новой фармацевтической композиции или нового терапевтического коктейля, содержащих в эффективном количестве новый противовирусный активный компонент общей формулы 1, 1.1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1 или его фармацевтически приемлемую соль.
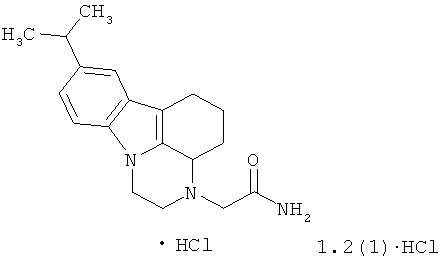
Предметом данного изобретения является также неизвестный ранее 2-(8-изопропил-1,2,3а,4,5,6-гексагидро-3Н-пиразино[3,2,1-Jk]карбазол-3-ил)ацетамид и его гидрохлорид формулы 1.2(1)·НСl

Предметом данного изобретения являются неизвестные ранее замещенные амиды 1-[(1Н-индол-2-ил)метил]пиперидин-4-карбоновой кислоты общей формулы 1.3.1 и замещенные амиды 1-[(1Н-индол-2-ил)метил]пиперидин-3-карбоновой кислоты общей формулы 1.3.2 и их фармацевтически приемлемые соли.


где R4, R5 и R6 имеют вышеуказанное значение.
Предметом данного изобретения являются неизвестные ранее замещенные амиды 1-[(1Н-индол-2-ил)метил]пиперидин-4-карбоновой кислоты общей формулы 1.3.1.1 и замещенные амиды 1-[(1Н-индол-2-ил)метил]пиперидин-3-карбоновой кислоты общей формулы 1.3.2.1 и их фармацевтически приемлемые соли.

где R11 представляет собой C1-С3алкил; R12 представляет собой атом водорода или необязательно замещенный галоидом или C1-С3алкилом фенил.
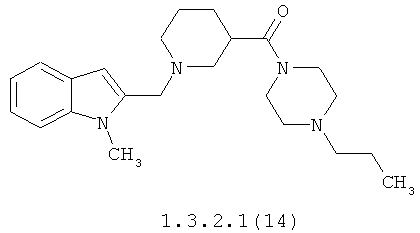
Более предпочтительными замещенными амидами являются {1-[1-(4-хлорбензил)-1H-индол-2-илметил]-пиперидин-4-ил}-(4-пропилпиперазин-1-ил)-метанона 1.3.1.1(13), {1-[1-(4-хлорбензил)-1H-индол-2-илметил]-пиперидин-3-ил}-(4-пропилпиперазин-1-ил)-метанона 1.3.2.1(13) [1-(1-метил-1H-индол-2-илметил)-пиперидин-4-ил]-(4-пропилпиперазин-1-ил)-метанона 1.3.1.1 (14), [1-(1-метил-1H-индол-2-илметил)-пиперидин-3-ил]-(4-пропилпиперазин-1-ил)-метанона 1.3.2.1(14) и их гидрохлориды.
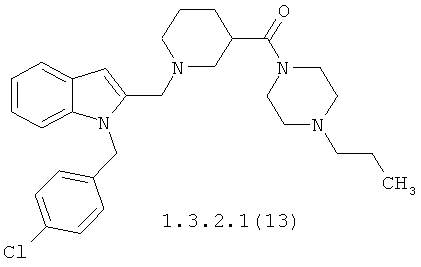

Предметом данного изобретения является также способ получения замещенных амидов 1-(1Н-индол-2-илметил)-пиперидин-карбоновой кислоты общей формулы 1.3.1, 1.3.2 и их фармацевтически приемлемых солей, который заключается во взаимодействии замещенных 1-(1Н-индол-2-илметил)-пиперидин-карбоновых кислот общей формулы 2.1, 2.2 с аминами 3. Оптимальные результаты были достигнуты при проведении реакции в присутствии 1,1'-карбонилдиимидазола. Фармацевтически приемлемые соли амидов 1.3.1, 1.3.2 получают при взаимодействии оснований 1.3.1, 1.3.2 с соответствующими кислотами в среде подходящего органического растворителя.

где R4, R5 и R6 имеют вышеуказанное значение.
Предметом данного изобретения является также способ получения гидрохлорида 2-(8-изопропил-1,2,3а,4,5,6-гексагидро-3Н-пиразино[3,2,1-Jk]карбазол-3-ил)ацетамида формулы 1.2(1)·НСl гидрированием 9-[2-(дибензиламино)этил]-6-изопропил-3,4-дигидро-2H-карбазол-1(9H)-она в присутствии 10% Pd/C с последующим алкилированием образующегося 2-(8-изопропил-1,2,3а,4,5,6-гексагидро-3H-пиразино[3,2,1-jk]карбазола хлорацетамидом и превращением полученного основания в гидрохлорид по приведенной ниже схеме:

Ниже приводятся конкретные примеры, которые иллюстрируют, но не ограничивают объема настоящего изобретения.
Пример 1. Определение противовирусной активности соединений общей формулы 1 в отношении вирусов гепатита С.
Определение противовирусной активности соединений общей формулы 1,1.1,1.2, 1.3, 1.3.1, 1.3.1.1, в отношении HCV проводилось на культуре клеток Huh7. Использовался иммунный in vitro тест ИФА на кор-антиген вируса HCV. С помощью этого теста измерялась эффективность ингибирования тестируемыми соединениями продукции антигена (и, следовательно, репликации вируса) в клетках, инфицированных вирусом JFH-1. Использованная в данном эксперименте культура клеток Huh7 способна, будучи инфицированной вирусом HCV, поддерживать полный цикл вирусной репликации.
Рекомбинантный вирус JFH-1 HCV, использованный в эксперименте, был получен путем трансфекции клеток Huh7 РНК JFH-1, полученной путем транскрипции in vitro. ДНК JFH-1 (NCBI, каталожный номер АВ047639 [Wakita, Т. и др. Production of Infectious Hepatitis C Virus in Tissue Culture from a Cloned Viral Genome. Nature Medicine 2005, 11:791-796]), использованная в качестве матричной ДНК для транскрипции, была синтезирована химически.
Клетки Huh7 были высеяны в 96-луночные платы (3,0×103 клеток на лунку) в среде Huh-7 (50 мкл на каждую лунку). Для каждого тестируемого соединения приготовили 9 растворов в среде Huh-7 в диапазоне концентраций 0,09-200 мкМ. Спустя 4 часа после высеивания клеток, исходный раствор был удален при помощи аспирации, после чего к каждой лунке добавили 50 мкл раствора тестируемого соединения, а также 50 мкл препарата JFH-1 ВГС. Таким образом, финальные концентрации тестируемых соединений были в диапазоне 0,045-100 мкМ. В случае необходимости этап инфицирования проводили спустя 24 часа после добавления тестируемых соединений. После инкубации в течение 16 часов вирусная среда была удалена при помощи аспирации, и к культурам были добавлены тестируемые соединения в исходных концентрациях до конечного объема 200 мкл. Клетки и тестируемые соединения инкубировали дополнительно в течение 4 дней при 37°С в атмосфере воздуха, содержащей 5% углекислого газа СO2. После удаления питательной среды клетки были зафиксированы 250 мкл смеси ацетон-метанол (1:1) в течение 1 минуты, трижды промыты фосфатным буфером (буфер PBS и затем они были блокированы 10% раствором FBS-PBS (150 мкл/лун) в течение 1 часа при комнатной температуре. Каждую лунку трижды промывали раствором PBS, инкубировали с моноклональными мышиными антителами к кор-антигену HCV (Affinity BioReagents, каталожный номер МА 1-080), растворенными в буфере FBS-PBS (100 мкл/лун раствора, приготовленного из исходного концентрата, разведенного в соотношении 1:500 в 10% FBS- PBS), в течение 2 часов при 37°С. Каждую лунку промывали три раза раствором PBS, инкубировали с антителами, специфичными к мышиным иммуноглобулинам, конъюгированными с пероксидазой хрена (HRP, 100 мкл/лун раствора, приготовленного из исходного концентрата, разведенного в соотношении 1:2500 в 10% FBS- PBS) в течение 1 часа при 37°С. Промывали каждую лунку три раза раствором PBS, затем обрабатывали 100 мкл/лун раствора OPD (приготовлен растворением 1 таблетки OPD в 12 мл цитратфосфатного буфера с добавлением 5 мкл 30% H2O2) в течение 30 минут в темноте при комнатной температуре. Реакцию останавливали добавлением к каждой лунке 100 мкл 2N H2SO4, после чего измеряли поглощение при длине волны 490 нм. Величину IС50, представляющую собой концентрацию тестируемого соединения, при которой репликация вируса понижается вдвое, определяли для каждого тестируемого соединения при помощи программы Xlfit по методу, описанному в [Wakita, Т. и др. (2005). Production of Infectious Hepatitis С Virus in Tissue Culture from a Cloned Viral Genome. Nature Medicine; 11: 791-796].
В таблице представлены величины IС50 замещенных индолов общей формулы 1, 1.1, 1.2, 1.3, 1.3.1, 1.3.1.1, отражающие их способность ингибировать вирус гепатита С.
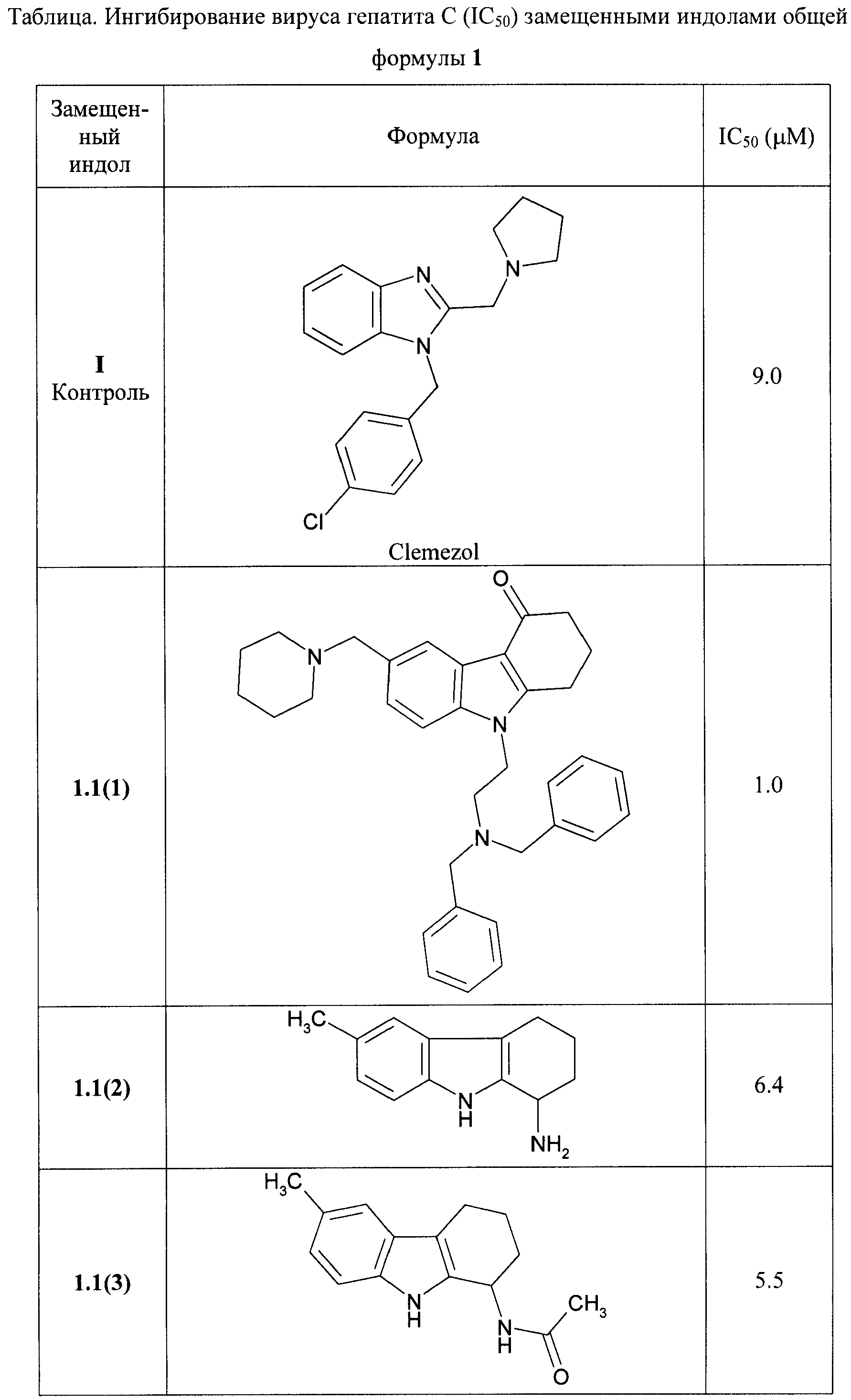




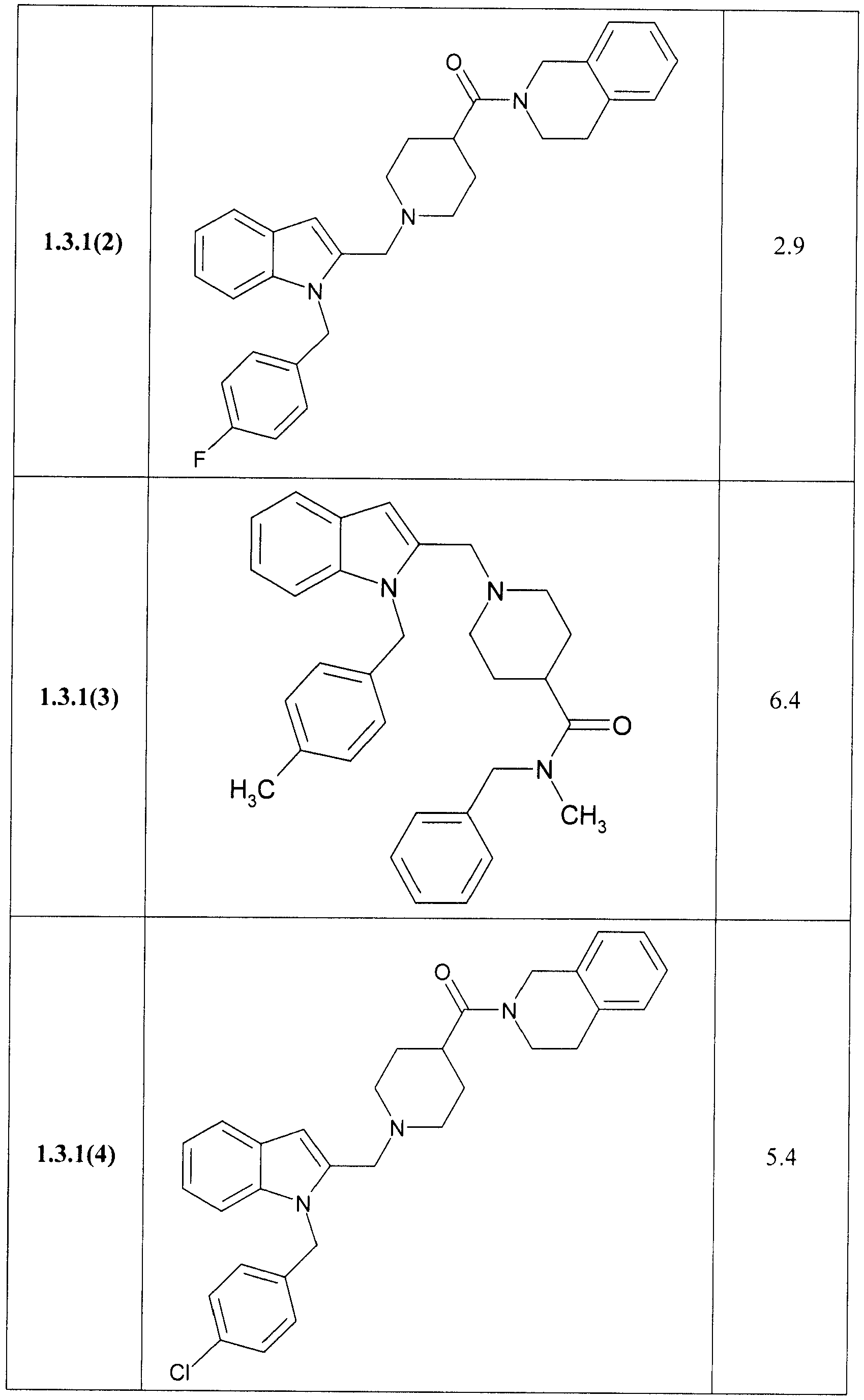



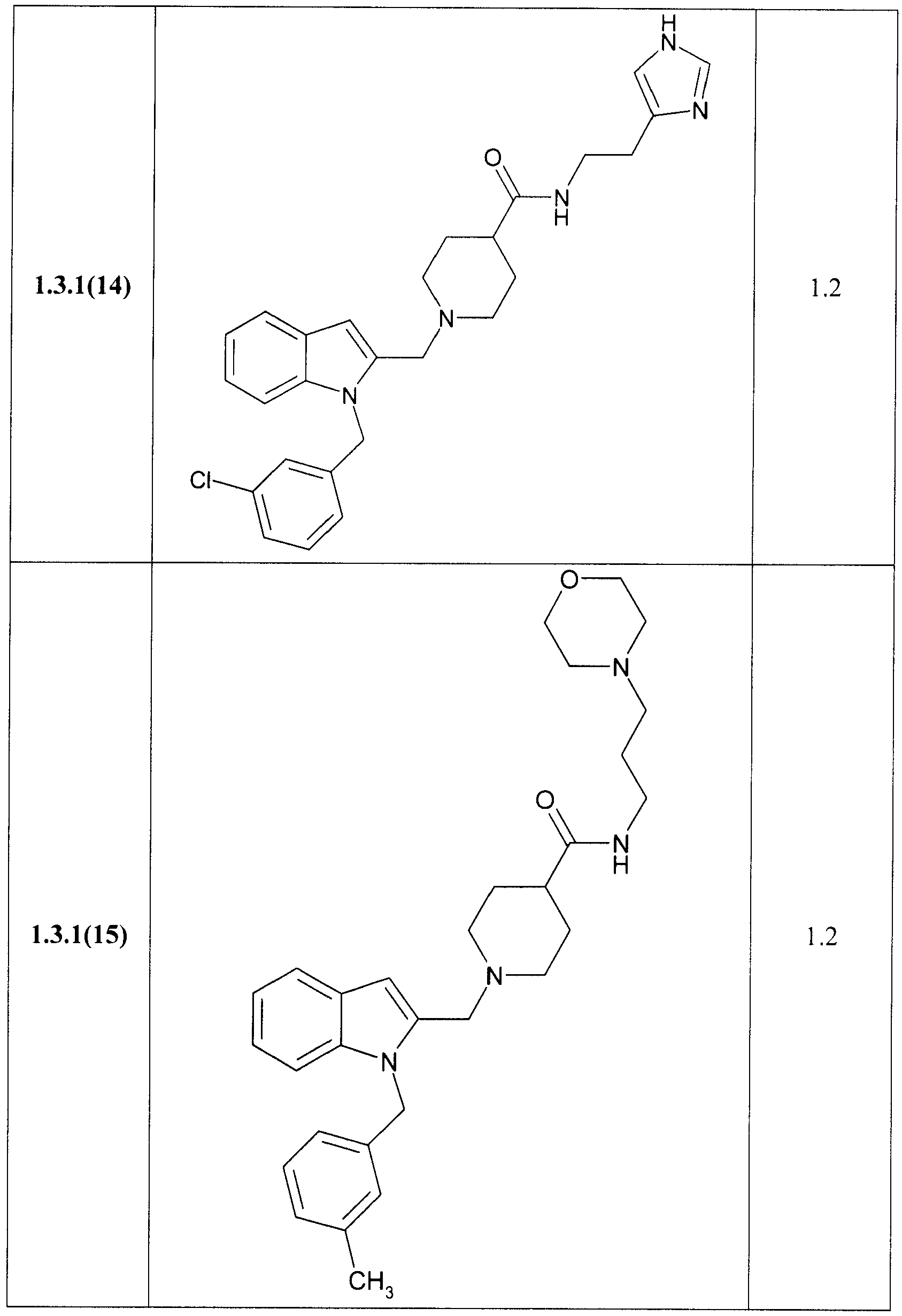

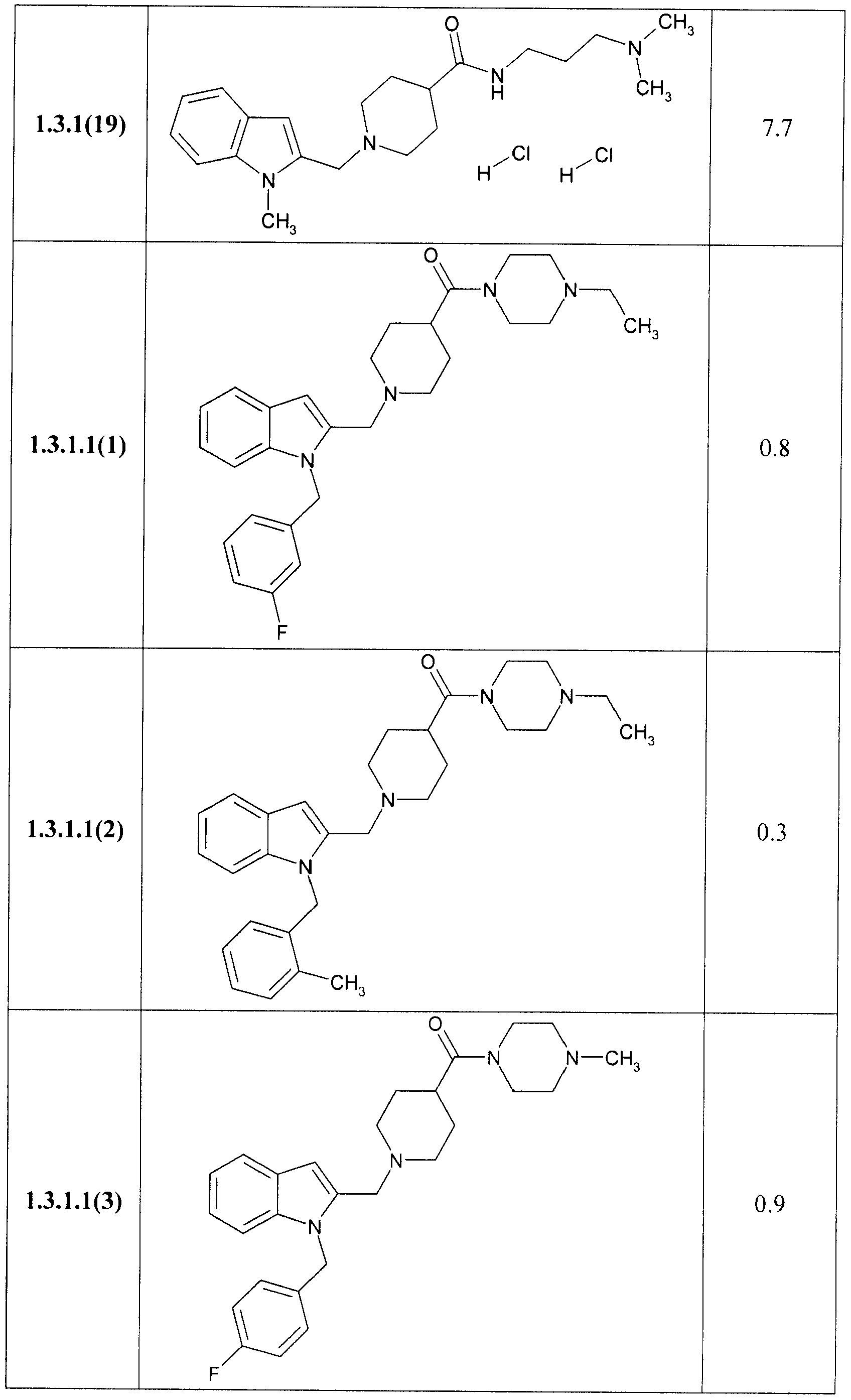
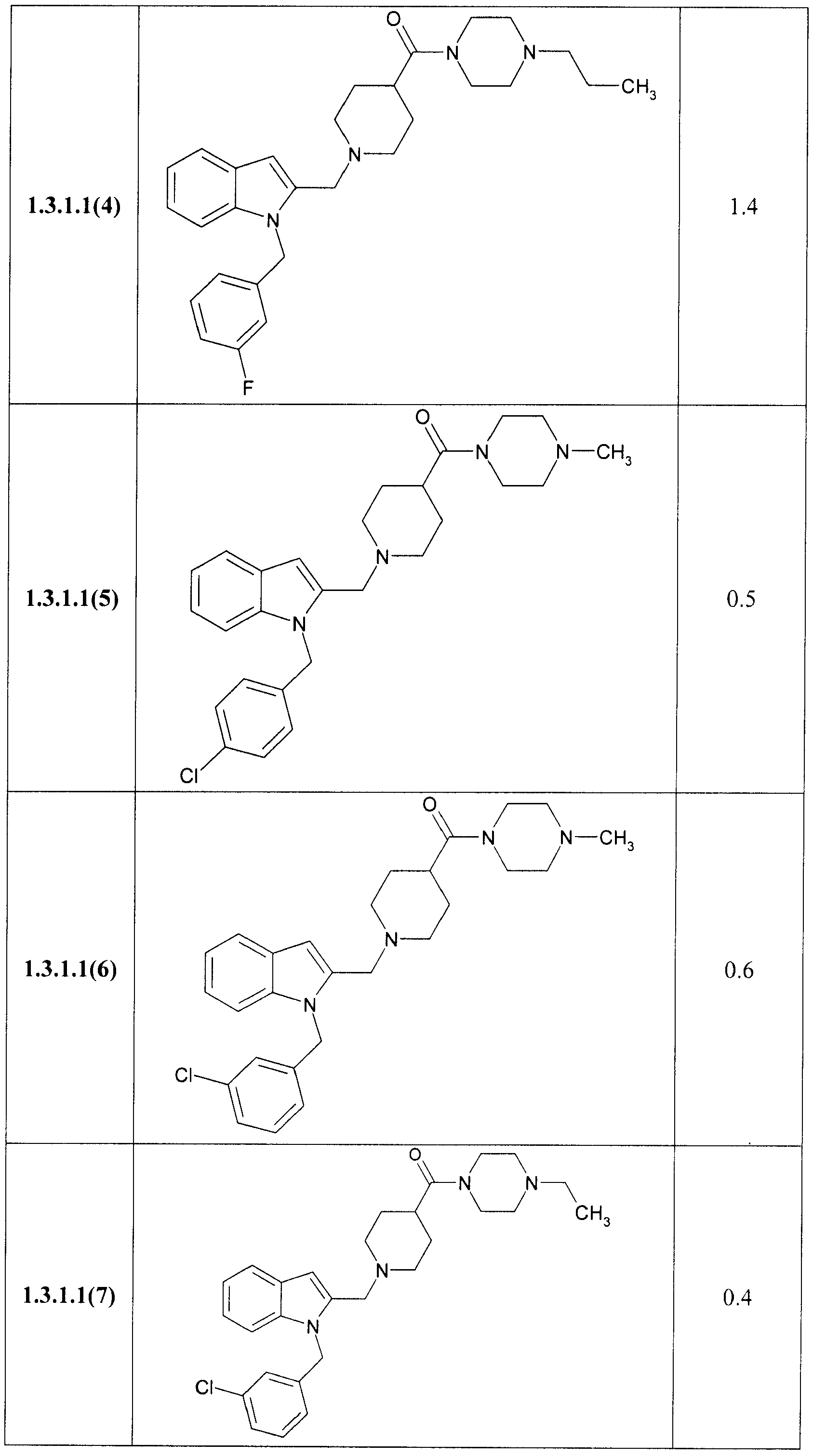

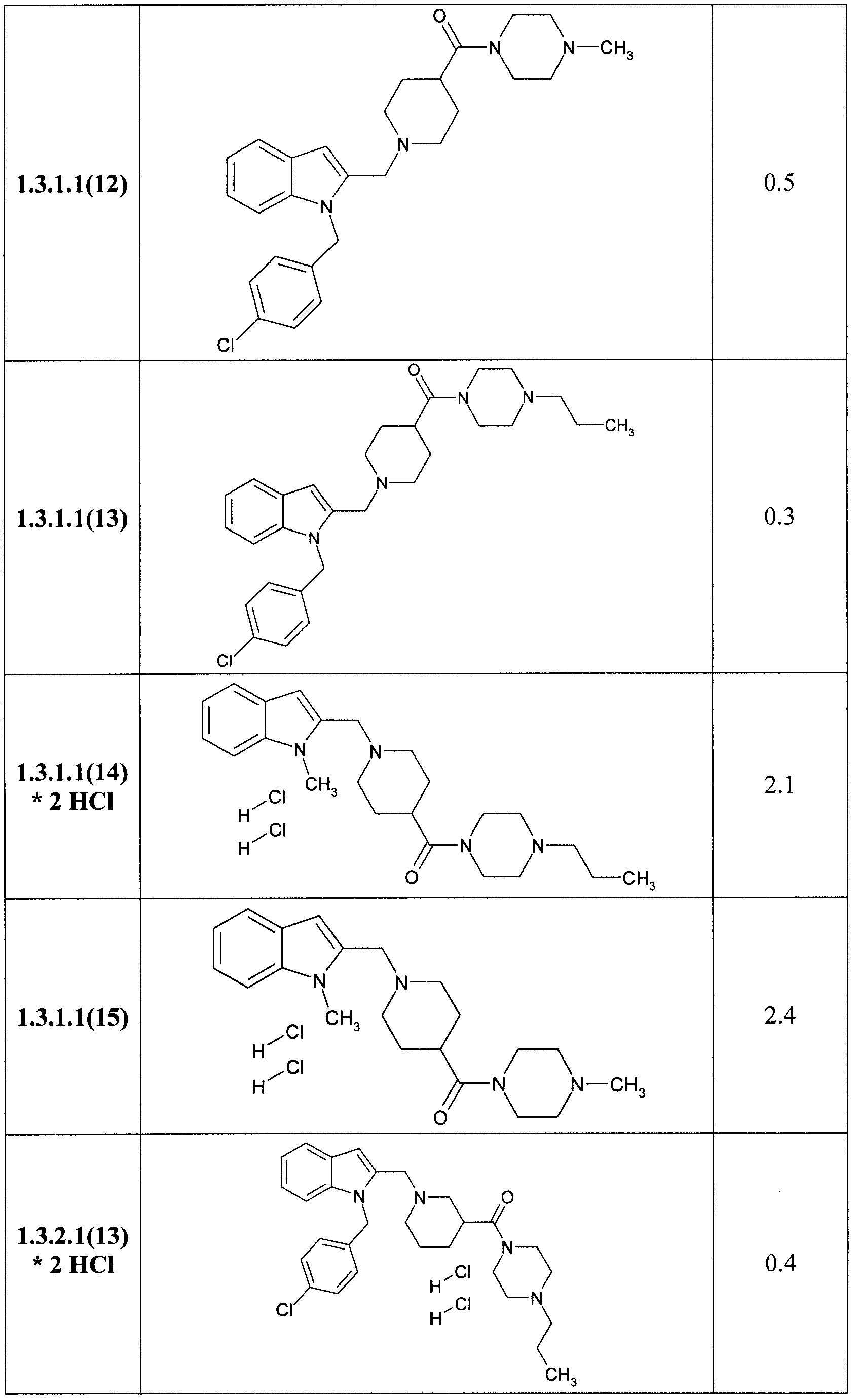
Замещенные индолы общей формулы 1, 1.1, 1.2, 1.3, 1.3.1, 1.3.1.1, 1.3.2.1 обладают высокой активностью по отношению к HCV (Таблица). Как правило, они более активны, чем известные препараты I и II [WO 2009039246 А2, WO 2009039248 А2]. Так, например, соединения 1.3.1.1(2) и 1.3.1.1(13) имеют IC50 = 0,3 µМ, а соединения 1.1(8), 1.3.1(2) и 1.3.1.1(7) имеют IС50 = 0,4 µМ.
Пример 2. Гидрохлорид 2-(8-изопропил-1,2,3а,4,5,6-гексагидро-3H-пиразино[3,2,1-jk]карбазол-3-ил)-ацетамида 1.2(1)·НСl. Раствор 8.45 г (18.8 ммоль) 9-[2-(дибензиламино)этил]-6-изопропил-3,4-дигидро-2H-карбазол-1(9H)-она. в 80 мл метанола гидрируют в автоклаве с 0.5 г 10 % Pd/C при 30 атм в течение 24 ч при 70°С. Раствор фильтруют через целит и упаривают в вакууме. Остаток образующегося 2-(8-изопропил-1,2,3а,4,5,6-гексагидро-3H-пиразино[3,2,1-jk]карбазола кипятят с 1.93 г (20.6 ммоль) хлорацетамида и 3.88 г К2СО3 в 50 мл ацетонитрила в течение 12 ч. Растворитель отгоняют в вакууме, остаток обрабатывают водой и экстрагируют СН2Сl2. Экстракт сушат над Na2SO4, упаривают и перекристаллизовывают из спирта. Получают 3.27 г (56 %) 2-(8-изопропил-1,2,3а,4,5,6-гексагидро-3H-пиразино[3,2,1-jk]карбазол-3-ил)-ацетамида 1.2(1). LCMS (М+H)+ 312.1Н ЯМР (CDCl3, 400 МГц) δ 7.34 (с, 1Н), 7.21 (д, J = 8.4 Гц, 1Н), 7.10 (дд, J1 = 8.4 Гц, J2 = 1.2 Гц, 1Н), 7.02 (уш. с, 1Н), 5.50 (уш. с, 1Н), 4.18 (дд, J1 = 11.6 Гц, J2= 3.6 Гц, 1Н),3.84 (дт, J1 = 11.6 Гц, J2 = 4.8 Гц, 1Н), 3.59 (м, 1Н), 3.53 (д, J1 = 12.8 Гц, 1Н), 3.23 (дд, J1= 12.4 Гц, J2 = 4.8 Гц, 1Н), 3.06 (м. 3Н), 2.82 (дд, J1 = 11.6 Гц, J2 = 6.4 Гц, 1Н), 2.70 (м, 1Н), 2.22 (м, 2Н), 1.86 (м, 1Н), 1.53 (м, 1Н), 1.32 (д, J1 = 6.8 Гц, 6H). Гидрохлорид 2-(8-изопропил-1,2,3а,4,5,6-гексагидро-3H-пиразино[3,2,1-jk]карбазол-3-ил)-ацетамида 1.2(1)·НСl высаживают добавлением 5%-ного избытка 3N раствора НСl в диоксане к раствору основания 1.2(1) в CH2Cl2.1Н ЯМР (ДМСО-d6, 400 МГц) δ 10.89 (уш. с, 1Н), 8.16 (уш. с, 1Н), 7.75 (уш. с, 1Н), 7.34 (д, J = 8.0 Гц, 1Н), 7.31 (с, 1Н), 7.10 (д, J = 8.0 Гц, 1Н), 4.77 (уш. м, 1Н), 4.46 (д, J = 6.4 Гц, 1Н), 4.25 (уш. м, 1Н), 3.95 (уш. м, 4Н), 2.97 (п, J = 6.8 Гц, 1Н), 2.73 (уш. д, J = 15.6 Гц, 1Н), 2.58 (уш. м, 1Н), 2.35 (уш. м, 1Н), 2.20 (уш. м, 1Н), 1.78 (уш. м, 2Н), 1.24 (д, J = 6.8 Гц, 6H).
Пример 3. Амиды 1-(1Н-индол-2-илметил)пиперидин-карбоновых кислот общей формулы 1.3.1, 1.3.2 (общая методика). К суспензии 10 ммоль кислоты 6 в 45 мл сухого ацетонитрила добавляют 1.95 г (12 ммоль) 1,1'-карбонилдиимидазола. Смесь перемешивают три часа при 70°С (контроль за образованием имидазолида осуществляют по ТСХ), охлаждают до комнатной температуры, добавляют 12 ммоль соответствующего пиперазина и перемешивают при 70°С в течение 12 часов (контроль по LCMS). По окончании реакции смесь выливают в воду, выпавший осадок отфильтровывают, промывают несколько раз водой и сушат в вакууме. Получают амиды 1.3.1, 1.3.2.
Дигидрохлориды амидов 1.3.1, 1.3.2 получают добавлением 5% избытка 3 N НС1 в диоксане к раствору амидов в эфире (5 г в 500 мл).
1-Метил-2-({4-[(4-пропилпиперазин-1-ил)карбонил]пиперидин-1-ил}метил)-1H-индол 1.3.1.1(14). Выход 28%. LCMS (M+H)+ 383.1Н ЯМР (ДМСО-d6 400 МГц) δ 11.29 (уш. с, 1Н), 10.80 (уш. с, 1Н), 7.60 (д, J = 8.0 Гц, 1Н), 7.51 (д, J = 8.0 Гц, 1 Н), 7.23 (м, 1Н), 7.09 (м, 1Н), 6.80 (с, 1Н), 4.55 (уш. с, 2Н), 4.39 (уш. м, 1Н), 4.11 (уш. м, 1Н), 3.85 (с, 3Н), 3.59 (уш. м, 1Н), 3.51 (уш. м, 2Н), 3.43 (уш. м, 2Н), 3.12 (м, 1Н), 2.98 (уш. м, 5Н), 2.86 (уш. м, 2Н), 2.73 (с, 3Н), 1.96 (уш. м, 2Н), 1.82 (уш. м, 2Н), 1.72 (м, 2Н), 0.90 (т, J = 7.2 Гц, 3Н).
1-Метил-2-({4-[(4-метилпиперазин-1-ил)карбонил]пиперидин-1-ил}метил)-1H-индол 1.3.1.1(15). Выход 56%. LCMS (M+H)+ 355.1Н ЯМР (ДМСО-d6, 400 МГц) δ 11.41 (уш.с, 1Н),10.93 (уш.с, 1Н),7.60 (д, J = 7.6 Гц, 1Н), 7.51 (д, J = 8.4Гц, 1Н), 7.23(м, 1Н), 7.08 (м, 1Н), 6.81 (с, 1Н), 4.54 (уш. с, 2Н), 4.40 (уш. м, 1Н), 4.12 (уш. м, 1Н), 3.85 (с, 3Н), 3.50 (уш. м, 5Н), 3.00 (уш. м, 4Н), 2.87 (уш. м, 2Н), 2.73 (с, 3Н), 1.98 (уш. м, 2Н), 1.82 (уш. м, 2Н).
1-Метил-2-({3-[(4-метилпиперазин-1-ил)карбонил]пиперидин-1-ил}метил)-1H-индол дигидрохлорид 1.3.2.1(1). Выход 46%. LCMS (M+H)+ 355.1Н ЯМР (ДМСО-d6, 400 МГц) δ 11.28 (уш.с, 1Н), 11.14 (уш.с, 1Н), 7.59 (д, J = 8.0 Гц, 1Н), 7.50 (д, J = 8.0 Гц, 1Н), 7.22 (м, 1Н), 7.07 (м, 1Н), 6.83 (уш. м, 1Н), 4.57 (уш. с, 2Н), 4.37 (уш. м, 1Н), 4.07 (уш. м, 1Н), 3.87 (с, 3Н), 3.55 (уш. м, 1Н), 3.42 (уш. м, 4Н), 3.14 (уш. м, 2Н), 3.02 (уш. м, 3Н), 2.89 (уш. м, 1Н), 2.72 (уш. м, 3Н), 1.98 (уш. м, 1 Н), 1.86 (уш. м, 2Н), 1.44 (уш. м, 1Н).
1-Метил-2-({3-[(4-пропилпиперазин-1-ил)карбонил]пиперидин-1-ил}метил)-1H-индол дигидрохлорид 1.3.2.1(2). Выход 47%. LCMS (M+H)+ 383.1Н ЯМР (ДМСО-d6 400 МГц) δ 11.19 (уш. м, 2Н), 7.59 (д, J = 7.6 Гц, 1Н), 7.50 (д, J = 8.0 Гц, 1Н), 7.22 (м, 1Н), 7.07 (м, 1Н), 6.83 (уш. м, 1Н), 4.56 (уш. с, 2Н), 4.37 (м, 1Н), 4.05 (м, 1Н), 3.87 (с, 3Н), 3.61 (м, 1Н), 3.44 (уш. м, 5Н), 3.14 (уш. м, 2Н), 2.98 (уш. м, 4Н), 2.86 (уш. м, 1Н), 1.98 (уш. м, 1Н), 1.86 (уш. м, 2Н), 1.70 (уш. м, 2Н), 1.44 (уш. м, 1Н), 0.89 (уш. м, 3Н).
1-(4-хлорбензил)-2-({3-[(4-метилпиперазин-1-ил)карбонил]пиперидин-1-ил}метил)-1H-индол дигидрохлорид 1.3.2.1(12). Выход 79 %. LCMS (М+Н)+ 465, 467.1Н ЯМР (ДМСО-d6, 400 МГц) δ 11.07 (уш. м, 2Н), 7.63 (д, J = 7.6 Гц, 1Н), 7.44 (д, J = 7.6 Гц, 1Н), 7.34 (д, J = 8.0 Гц, 2Н), 7.17 (м, 1Н), 7.09 (м, 1Н), 6.98 (уш. м, 1Н), 6.93 (д, J = 8.0 Гц, 2Н), 5.69 (уш. с, 2Н), 4.50 (уш. с, 2Н), 4.38 (уш. м, 1Н), 4.07 (уш. м, 1Н), 3.49 (уш. м, 5Н), 3.16 (уш. м, 2Н), 3.00 (уш. м, 3Н), 2.89 (уш. м, 1Н), 2.74 (уш. м, 3Н), 1.95 (уш. м, 1Н), 1.86 (уш. м, 2Н), 1.43 (уш. м, 1Н).
1-(4-хлорбензил)-2-({3-[(4-пропилпиперазин-1-ил)карбонил]пиперидин-1-ил}метил)-1H-индол дигидрохлорид 1.3.2.1(13). Выход 78 %. LCMS (M+H)+ 493,495.1H ЯМР (ДМСО-d6, 400 МГц) δ 11.12 (уш. м, 2Н), 7.63 (д, J = 7.6 Гц, 1Н), 7.44 (д, J = 8.0 Гц, 1Н), 7.34 (д, J = 8.0 Гц, 2Н), 7.17 (м, 1Н), 7.09 (м, 1Н), 6.99 (уш. м, 1Н), 6.93 (д, J = 8.0 Гц, 2Н), 5.69 (уш. с, 2Н), 4.51 (уш. с, 2Н), 4.37 (уш. м, 1Н), 4.06 (уш. м, 1Н), 3.59 (м, 1Н), 3.41 (уш. м, 5Н), 3.14 (уш. м. 2Н), 2.98 (уш. м, 4Н), 2.85 (уш. м, 1Н), 1.96 (уш. м, 1Н), 1.86 (уш. м, 2Н), 1.70 (уш. м, 2Н), 1.43 (уш. м, 1Н), 0.90 (уш. м, 3Н).
1-Метил-2-({3-[(4-пропилпиперазин-1-ил)карбонил]пиперидин-1-ил}метил)-1H-индол дигидрохлорид 1.3.2.1(14). Выход 47%. LCMS (M+H)+ 383.1Н ЯМР (ДМСО-d6. 400 МГц) δ 11.19 (уш. м, 2Н), 7.59 (д, J = 7.6 Гц, 1Н), 7.50 (д, J = 8.0 Гц, 1Н), 7.22 (м, 1Н), 7.07 (м, 1Н), 6.83 (уш. м, 1Н), 4.56 (уш. с, 2Н), 4.37 (м, 1Н), 4.05 (м, 1Н), 3.87 (с, 3Н), 3.61 (м, 1Н), 3.44 (уш. м, 5Н), 3.14 (уш. м, 2Н), 2.98 (уш. м, 4Н), 2.86 (уш. м, 1Н), 1.98 (уш. м, 1Н), 1.86 (уш. м, 2Н), 1.70 (уш. м, 2Н), 1.44 (уш. м, 1Н), 0.89 (уш. м, 3Н).
Пример 4. Получение лекарственного средства в форме таблеток. Смешивают 1600 мг крахмала, 1600 мг измельченной лактозы, 400 мг талька и 1000 мг дигидрохлорида [1-(1-метил-1H-индол-2-илметил)-пиперидин-4-ил]-(4-пропил-пиперазин-1-ил)-метанона 1.3.1.1(14). Полученный брусок измельчают в гранулы и просеивают через сита, собирая гранулы размером 14-16 меш. Полученные гранулы таблетируют в подходящую форму таблетки весом 560 мг каждая.
Пример 5. Получение лекарственного средства в форме капсул. Тщательно смешивают дигидрохлорид [1-(1-метил-1H-индол-2-илметил)-пиперидин-4-ил]-(4-пропилпиперазин-1-ил)-метанона 1.3.1.1(14) с порошком лактозы в соотношении 2:1. Полученную порошкообразную смесь упаковывают по 300 мг в желатиновые капсулы подходящего размера.
Пример 6. Получение лекарственного средства в форме инъекционных композиций для внутримышечных, внутрибрюшинных или подкожных инъекций. Смешивают 500 мг дигидрохлорида [1-(1-метил-1H-индол-2-илметил)-пиперидин-4-ил]-(4-пропилпиперазин-1-ил)-метанона 1.3.1.1(14) с 300 мг хлорбутанола, 2 мл пропиленгликоля и 100 мл инъекционной воды. Полученный раствор фильтруют и помещают по 1 мл в ампулы, которые запаивают.
Реферат
Настоящее изобретение относится к новым противовирусным активным компонентам - замещенным индолам общей формулы 1 и их фармацевтически приемлемым солям, которые могут быть использованы для лечения и/или профилактики вирусных заболеваний, вызываемых вирусами гепатита С (HCV). В общей формуле 1 ! ! R1 представляет собой атом водорода, необязательно замещенный С1-С4алкил, С6циклоалкил, фенил, этоксикарбонил, нитрогруппу; R2 представляет собой атом водорода; R3 представляет собой N-моно- или N,N-дизамещенный 1-метилен-пиперидин-3-карбоксамид общей формулы 1а или N-моно- или N,N-дизамещенный 1-метилен-пиперидин-4-карбоксамид общей формулы 1b; R4 представляет собой атом водорода, необязательно замещенный С2-С3алкил, группу -CH2-R12, где R12 представляет собой атом водорода или необязательно замещенный галогеном или С1-С4алкилом фенил; или R2, R3 и R4 вместе с атомами, с которыми они связаны, образуют замещенный азагетероцикл общей формулы 1.2; или R2 и R3 вместе с атомами углерода, с которыми они связаны, образуют замещенный 2,3,4,9-тетрагидро-1Н-карбазол общей формулы 1.1, в которой R1 представляет собой метил, этоксикарбонил, нитрогруппу; R4 представляет собой атом водорода, метил, С2-С3алкил, замещенный N-бензиламином; R7 и R8 представляют собой атомы водорода или R7 и R8 вместе с атомом углерода, с которым они связаны, образуют группу С=O; R5 и R6 необязательно одинаковые представляют собой атом водорода, необязательно замещенный C1-С3алкил или С3-С6циклоалкил; или R5 и R6 вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 5- или 6- членный азагетероциклил, содержащий один или два атома азота и др. 6 н. и 5 з.п. ф-лы, 1 табл.
Формула



где R1 представляет собой атом водорода, необязательно замещенный С1-С4алкил, С6циклоалкил, фенил, этоксикарбонил, нитрогруппу;
R2 представляет собой атом водорода;
R3 представляет собой N-моно- или N,N-дизамещенный 1-метилен-пиперидин-3-карбоксамид общей формулы 1а или N-моно- или N,N-дизамещенный 1-метилен-пиперидин-4-карбоксамид общей формулы 1b;
R4 представляет собой атом водорода, необязательно замещенный C2-С3алкил, группу -CH2-R12, где R12 представляет собой атом водорода или необязательно замещенный галогеном или С1-С4алкилом фенил;
или
R2, R3 и R4 вместе с атомами, с которыми они связаны, образуют замещенный азагетероцикл общей формулы 1.2;
или
R2 и R3 вместе с атомами углерода, с которыми они связаны, образуют замещенный 2,3,4,9-тетрагидро-1Н-карбазол общей формулы 1.1,

в которой R1 представляет собой метил, этоксикарбонил, нитрогруппу; R4 представляет собой атом водорода, метил, С2-С3алкил, замещенный N-бензиламином;
R7 и R8 представляют собой атомы водорода или R7 и R8 вместе с атомом углерода, с которым они связаны, образуют группу С=O;
R5 и R6 необязательно одинаковые представляют собой атом водорода, необязательно замещенный C1-С3алкил или С3-С6циклоалкил;
или R5 и R6 вместе с атомом азота, с которым они связаны, образуют необязательно замещенный 5- или 6-членный азагетероциклил, содержащий один или два атома азота, возможно конденсированный с бензольным кольцом, или образуют группу
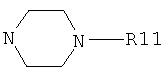
где R11 представляет собой водород, C1-С6алкил, С3-С6циклоалкил;
R9 представляет собой азагетероциклил, содержащий по крайней мере один атом азота, незамещенный формамид или фенил, замещенный этоксикарбонильной или нитрогруппой;
R10 представляет собой атом водорода, необязательно замещенный C1-С3алкил; замещенный ацетил, где заместители выбраны из 5-6-членного азотсодержащего гетероциклила или 5-6-членной азотсодержащей гетероарилтиагруппы;
n=1 или 2;
пунктирная линия с сопровождающей ее сплошной линией



где R4, R5 и R6 имеют вышеуказанное значение.

где R11 и R12 имеют вышеуказанные значения.


где R4, R5 и R6 имеют вышеуказанное значение.
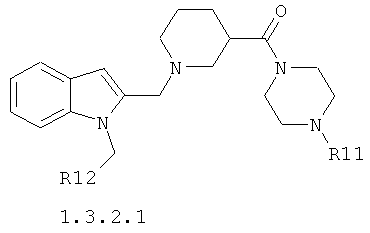
где R11 представляет собой C1-С3алкил; R12 представляет собой атом водорода или необязательно замещенный галоидом или C1-С3 алкилом фенил.



Комментарии