Продукты для доставки терапевтических/диагностических соединений к сердцу - RU2721778C2
Код документа: RU2721778C2
Чертежи














Описание
Область техники, к которой относится изобретение
Настоящее изобретение представляет собой инновационную терапевтическую стратегию для лечения заболеваний сердца. В частности, настоящее изобретение относится к способу получения продукта, содержащего одну или несколько частиц фосфата кальция, инкапсулирующих одно или несколько диагностических/терапевтических соединений, а также к продукту, полученному с использованием такого способа. Изобретение также относится к применению продукта по изобретению для лечения заболеваний сердца посредством ингаляционного введения.
Уровень техники
Недавние исследования в области медицины были нацелены на создание и разработку многофункциональных наночастиц (NP) для специфической доставки лекарственного средства к выбранному органу с целью получения селективного и эффективного терапевтического подхода для лечения определенных патологических состояний. Однако некоторые ключевые проблемы все еще ограничивают фармакологическое применение таких наночастиц, как то: i) физико-химическая природа используемых наноматериалов, их биоразлагаемость, биосовместимость и собственная потенциальная цитотоксичность; ii) неэффективность введения; iii) неселективность тканеспецифической доставки, ассоциируемая с возникновением побочных эффектов; iv) неконтролируемое высвобождение лекарственного средства в кровоток; v) медленное растворение/накопление в клетках; vi) низкая эффективность в отношении пересечения биологических барьеров. Таким образом, до сих пор крайне важной задачей является разработка подходящих наночастиц, которые посредством подходящего пути введения могут селективно достигать представляющего интерес органа.
Материалы на основе фосфата кальция (CaP) широко используются в различных биомедицинских областях применения благодаря их биосовместимости и биоразлагаемости. Трансфекция с использованием материалов на основе CaP использовалась для доставки генов в различные типы клеток in vitro в течение более чем 40 лет (Graham, F. L.; Erb, A. J. V. d. A new technique for the assay of infectivity of human adenovirus 5 DNA. Virology, 1973, 52, 456-467; V. Sokolova, M. Epple. Inorganic nanoparticles as carriers of nucleic acids into cells. Angew Chem Int Ed Engl, 47 (8) (2008), pp. 1382–1395). Общий метод заключается в инкапсулировании генов в осадке, который спонтанно образуется после смешивания подходящих концентраций ионов кальция и фосфата при определенных значениях рН (выше 7). Этот способ имеет много преимуществ, таких как: простота осуществления, низкие затраты и высокая эффективность связывания нуклеотидов и нуклеиновых кислот. Кроме того, материалы на основе CaP обладают рН-зависимой стабильностью, обеспечивая, таким образом, быстрое растворение в кислой среде (т.е. эндосомы, лизосомы). Полное растворение CaP в его ионных компонентах предотвращает нежелательное накопление материала в клетках и тканях, что является недостатком, часто встречающимся у других неорганических и металлических соединений. Таким образом, частицы CaP могут селективно и безопасно высвобождать включенный в них агент только после интернализации клетками.
Однако самой большой проблемой получения частиц CaP является их тенденция к образованию агрегатов и росту, что вызывает серьезные проблемы, связанные с воспроизводимостью при синтезе, и ограничивает их оптимальную коллоидную стабильность. Эти осложнения замедлили их разработку и, соответственно, их применение in vitro и in vivo. Фактически, крупные частицы CaP (микрометрового масштаба) могут также привести к нарушениям внутриклеточного гомеостаза кальция с последующей гибелью самой клетки (Neumann, S. et al. The use of size-defined DNA-functionalized calcium phosphate nanoparticles to minimize intracellular calcium disturbance during transfection. Biomaterials, 2009, 30 (35), 6794-802). Таким образом, было бы интересно получить наночастицы CaP, которые способны доставлять нуклеиновые кислоты или другие соединения, обеспечив защиту их от внешней среды и, тем самым, предотвратив их преждевременное высвобождение или деградацию. Для стабилизации наночастиц CaP и предотвращения их неконтролируемого роста, а также для обеспечения их способности к конъюгации с терапевтическим агентом, использовали покрытия, содержащие синтетические полимерные материалы (полиэтиленгликоль (PEG) (Kakizawa, Y.; Kataoka, K. Block Copolymer Self-Assembly into Monodispersive Nanoparticles with Hybrid Core of Antisense DNA and Calcium Phosphate. Langmuir, 2002, 18 (12), 4539-4543); полиэтиленимин (PEI) (T. Devarasu, et al. Potent calcium phosphate nanoparticle surface coating for in vitro and in vivo siRNA delivery: a step toward multifunctional nanovectors); хитозан (Giger, E. V. et al. Gene delivery with bisphosphonatestabilized calcium phosphate nanoparticles. Journal of controlled release: official journal of the Controlled Release Society, 2011, 150 (1), 87-93), бисфосфонаты (Lee, K. et al. Stabilized calcium phosphate nano-aggregates using a dopachitosan conjugate for gene delivery. International journal of pharmaceutics, 2013, 445 (1-2), 196-202) или липиды (Li, J.; Yang, Y.; Huang, L. Calcium phosphate nanoparticles with an asymmetric lipid bilayer coating for siRNA delivery to the tumor. Journal of controlled release: official journal of the Controlled Release Society, 2012, 158 (1), 108-14). Однако такие синтетические полимерные материалы, как правило, не являются полностью биоразлагаемыми и могут вызывать аллергические реакции.
При лечении опухолей наночастицы на основе CaP получали и покрывали полиэтиленимином для конъюгации с длинной цепью микроРНК (Hyosook Jung et al “Long chain microRNA conjugates in calcium phosphate nanoparticles for efficient formulation and delivery”, Arch. Pharm.Research, 2014). Эти конъюгаты успешно высвобождались in vitro в клетках рака предстательной железы.
Сердечнососудистые заболевания являются ведущей причиной смерти, и предпринимались попытки их лечения, в том числе посредством применения наночастиц. Однако разработка и применение эффективных наночастиц для терапевтического лечения сердечнососудистых заболеваний по-прежнему находится на начальном этапе. Фактически, до настоящего времени только дендримеры, липосомы или наночастицы на основе небиомиметических синтетических полимеров исследовались для доставки различных терапевтических молекул в клетки миокарда в условиях in vivo. Это ограничение обусловлено несколькими проблемами, которые затрудняют перевод наночастиц на клиническое применение, как то: i) низкая биоразлагаемость и биосовместимость; ii) токсичные побочные продукты; iii) низкая эффективность инкапсулирования; iv) низкая стабильность при хранении; v) неконтролируемое высвобождение лекарственного средства в кровоток; vi) ограниченная специфичность в отношении клетки-мишени; vii) медленное растворение/накопление в клетке; viii) низкая эффективность подходов на основе системного введения; ix) низкая эффективность в отношении пересечения биологических барьеров. Таким образом, требуются новые подходы для безопасной, эффективной и специфической в отношении сердца доставки терапевтических лекарственных средств. Недавно (Michele Miragoli et al., “Functional interaction between charges nanoparticles and cardiac tissue: a new paradigm for cardiac arrhythmia?” Nanomedicine (2013)8(5),725-737) было описано, каким образом наночастицы (с размерами 50 нм) на основе полистирольного латекса, в зависимости от их поверхностного электрического заряда, могут взаимодействовать с поляризованными клетками сердца (кардиомиоцитами). В частности, было показано, каким образом применение наночастиц с отрицательным поверхностным зарядом содействует вхождению наночастиц внутрь кардиомиоцита посредством формирования транзиентных нанопор, совместимых с жизнеспособностью клеток, в отличие от апоптотического ответа и последующей гибели клеток, вызванной применением положительно заряженных наночастиц. Однако, несмотря на частичную эффективность введений in vitro, потенциал этих отрицательно заряженных наночастиц полистирольного латекса в качестве возможных носителей лекарственных средств значительно ограничен для хронических введений вследствие возникновения серьезных побочных эффектов, таких как изменения электрофизиологических характеристик и сенсибилизация к аритмии, что значительно ограничивает их потенциальное терапевтическое применение in vivo.
Целью настоящего изобретения является разработка подхода, основанного на применении наночастиц фосфата кальция (CaP-NP), для лечения заболеваний сердца, у которого отсутствовали бы недостатки предшествующего уровня техники, к которым относится изменение электрофизиологических характеристик сердца.
Сущность изобретения
Авторы настоящего изобретения неожиданно обнаружили способ получения продукта, состоящего из одной или нескольких наночастиц фосфата кальция (CaP-NP), способных инкапсулировать одно или более диагностических/терапевтических лекарственных средств и/или поверхностно функционализироваться одним или несколькими диагностическими/терапевтическими лекарственными средствами, который, как оказалось, может стать терапевтическим подходом к лечению сердечнососудистых заболеваний без вызывания аритмии или изменения электрофизиологических характеристик клеток сердца и отличается прямой доставкой в миокард путем неинвазивного ингаляционного пути введения. Кроме того, можно использовать другие энтеральные и парентеральные пути введения (то есть внутривенное, интраперитонеальное, пероральное, сублингвальное, ректальное, внутриглазное, местное или трансдермальное введение). Кроме того, когда поверхность функционализирована диагностическими/терапевтическими соединениями, не специфическими в отношении клеток сердца, настоящее изобретение можно использовать для нацеливания на другие ткани, отличные от сердца.
Таким образом, настоящее изобретение относится к способу получения продукта, содержащего одну или несколько наночастиц фосфата кальция (CaP-NP) с отрицательным поверхностным зарядом, имеющих ζ-потенциал в диапазоне от -41,0 мВ до -27,0 мВ, включающему следующие стадии:
а) поддержание смеси, имеющей значение рН в диапазоне от 7 до 10 и содержащей водный раствор кальция, водный раствор фосфата и раствор цитрат-ионов, при температуре в диапазоне от 20°С до 40°С в течение периода времени от 30 секунд до 10 минут;
b) удаление непрореагировавших ионов из раствора, полученного на стадии а), с получением, таким образом, суспензии одной или нескольких наночастиц фосфата кальция (CaP-NP);
c) извлечение продукта, содержащего одну или несколько наночастиц фосфата кальция (CaP-NP), из суспензии, полученной на стадии b).
Способ по изобретению позволяет получить продукт, состоящий из одной или нескольких наночастиц CaP-NP с ζ-потенциалом в диапазоне от -41,0 мВ до -27,0 мВ и имеющий коэффициент расщепления (SF) не более 1,76, при этом одна или несколько наночастиц CaP-NP способны поступать в клетки сердца, не вызывая изменения электрофизиологических характеристик сердца. Продукт по изобретению, как оказалось, обладает преимуществами в форме наночастиц со сфероидальной морфологией.
В предпочтительном и выгодном аспекте изобретения способ по изобретению включает добавление на стадии а) водного раствора одного или нескольких терапевтических/диагностических соединений.
Неожиданно в предпочтительном способе по изобретению продукт по изобретению, получаемый в соответствии с предпочтительным и выгодным аспектом настоящего изобретения, состоит из одной или нескольких наночастиц фосфата кальция (CaP-NP), инкапсулирующих одно или несколько диагностических/терапевтических соединений. Неожиданно оказалось, что продукт по изобретению, инкапсулирующий одно или несколько диагностических/терапевтических соединений, состоит из одной или нескольких отрицательно заряженных наночастиц фосфата кальция (CaP-NP), имеющих ζ-потенциал в диапазоне от -41,0 мВ до -27,0 мВ и среднее значение гидродинамического диаметра (измеренное в виде показателя Z-среднее) в диапазоне от 150 до 231 нм. Оказалось, что продукт по изобретению обладает преимуществами в форме наночастиц со сфероидальной морфологией.
Таким образом, выгодным образом настоящее изобретение предусматривает добавление к смеси, полученной на стадии а), раствора одного или нескольких терапевтических/диагностических соединений. Изобретение с добавлением раствора одного или нескольких диагностических/терапевтических соединений позволяет получить наночастицы с определенными размерами и зарядом и с инкапсулированными в них одним или несколькими диагностическими/терапевтическими соединениями.
Таким образом, авторы удивительным образом обнаружили, что низкая температура образования наночастиц, инкапсулирующих одно или несколько диагностических/терапевтических соединений, обеспечивает мгновенное образование CaP низкой кристалличности, схожей по кристаллографической структуре с аморфным CaP, и с размерами в диапазоне от 150 до 231 нм. Не связывая себя какой-либо теорией, авторы настоящего изобретения полагают, что выбор температурных и временных условий, а также присутствие цитрат-иона, который является более «био-дружественным» стабилизирующим агентом по сравнению с агентами, используемыми в предшествующем уровне техники, обеспечивает стабилизацию наночастиц CaP-NP, инкапсулирующих одно или несколько диагностических/терапевтических соединений, особенно благодаря цитрат-иону смеси, который путем связывания с поверхностью предотвращает дальнейший рост частиц и делает их стабильными на коллоидном уровне. Кроме того, присутствие цитрата на поверхности, как будет показано в экспериментальной части, может сделать поверхность наночастиц CaP-NP отрицательно заряженной и сместить поверхностный потенциал в сторону более отрицательных значений, что делает их стабильными на коллоидном уровне. Кроме того, оказалось, что наночастицы CaP-NP, получаемые способом по настоящему изобретению, обладают низкой кристалличностью, имея коэффициент расщепления (SF) не более 1,76, и обеспечивают инкапсулирование/поверхностную функционализацию более высокими количествами диагностических/терапевтических соединений. По мнению авторов изобретения, низкая кристалличность фактически приводит к большей неупорядоченности структуры и, следовательно, образованию большого количества свободных ионных центров, способных связываться с терапевтическими/диагностическими соединениями. Кроме того, было обнаружено, что наночастицы CaP-NP согласно предпочтительному и выгодному варианту осуществления изобретения имеют среднее значение гидродинамического диаметра (измеренного в виде показателя Z-среднее) в диапазоне от 150 до 231 нм, что выгодным образом обеспечивает их применимость в лечении заболеваний сердца.
Другой выгодный отличительный признак настоящего изобретения заключается в примешивании терапевтического/диагностического соединения непосредственно во время синтеза наночастиц CaP-NP.
Кроме того, низкая степень кристалличности (выраженная в виде коэффициента расщепления (SF), равного не более 1,76), достигаемая с использованием этой процедуры, увеличивает время разлагаемости наночастиц CaP-NP, способствуя, тем самым, более быстрому высвобождению терапевтического/диагностического соединения. Кроме того, повышение степени кристалличности, достигаемой с использованием этой процедуры, уменьшает время разлагаемости наночастиц CaP-NP, что способствует медленному высвобождению терапевтического/диагностического соединения.
Другой выгодный отличительный признак настоящего изобретения заключается в возможной поверхностной функционализации конечного продукта CaP-NP, что способствует выраженным потребностям специфичности нацеливания лекарственного средства (т.е. связывания внеклеточной мишени для клеточно-специфического направления и/или активации/ингибирования рецепторов).
В настоящем изобретении используются следующие термины/определения:
- «терапевтическое/диагностическое соединение(я)» означает одно или несколько лекарственных соединений, например нуклеиновых кислот, пептидов, синтетических соединений или диагностических зондов для высвобождения в представляющем интерес органе;
- показатель «Z-среднее» в диапазоне от 150 нм до 231 нм означает средний гидродинамический диаметр, определенный с помощью динамического рассеяния света (Dynamic Light Scattering, DLS);
- «отрицательно заряженные наночастицы CaP-NP с ζ-потенциалом в диапазоне от -27,0 мВ до -41,0 мВ» означают наночастицы CaP-NP с ζ-потенциалом, определенным с помощью электрофоретического светорассеяния (Electrophoretic Light Scattering, ELS);
- «коэффициент расщепления (SF)» измеряет степень кристалличности, рассчитан из FT-IR-спектров наночастиц в соответствии с Weiner S. и Bar-Yosef O. (1990). States of preservation of bones from prehistoric sites in the Near East: a survey. Journal of Archaeological Science 17, 187–196.
В другом своем аспекте изобретение относится к продукту, получаемому с помощью способа по изобретению, для применения в качестве носителя в лечении сердечно-сосудистых заболеваний посредством ингаляционного введения.
В следующем и выгодном своем аспекте изобретение относится к продукту, получаемому с помощью способа по изобретению в его предпочтительном и выгодном варианте осуществления с использованием одного или нескольких соединений, инкапсулированных в одну или несколько наночастиц CaP-NP, для применения в лечении сердечно-сосудистых заболеваний посредством ингаляционного введения.
Таким образом, изобретение является особенно выгодным в области наномедицины, относящейся к неинвазивному лечению сердечно-сосудистых заболеваний посредством ингаляционного введения.
Удивительным образом, авторы настоящего изобретения интуитивно использовали продукт по изобретению для лечения сердечно-сосудистых заболеваний посредством ингаляционного введения, что позволило продукту по изобретению достичь миокарда по оси сердце-легкое. Как следствие, и удивительным образом, лечение путем ингаляции продукта по изобретению обеспечило прохождение легочного барьера и транслокацию в кровоток, вхождение, тем самым, в кровоток правых отделов сердца и достижение сердца, где находятся целевые ткани/клетки сердца, а также взаимодействие и интернализацию продукта поляризованными кардиомиоцитами. Это способствовало высвобождению терапевтического/диагностического соединения в миокарде.
Кроме того, настоящее изобретение относится к продукту, получаемому с использованием способа по изобретению, который можно вводить с помощью других энтеральных и парентеральных путей введения (т.е. внутривенного, интраперитонеального, перорального, сублингвального, ректального, внутриглазного, местного или трансдермального пути введения).
Авторы настоящего изобретения также интуитивно использовали наночастицы фосфата кальция (CaP-NP) для инкапсулирования соединений, подлежащих высвобождению в миокарде. В исследовании, которое привело к созданию данного изобретения, наночастицы CaP-NP согласно способу по изобретения обладали удивительными свойствами в отношении интернализации соединения как в клетках сердца in vitro, так и в миокарде in vivo. Не связывая себя какой-либо теорией, авторы установили, что в специфическом применении наночастицы CaP-NP, полученные в соответствии с изобретением и заряженные отрицательно, были менее токсичны по отношению к клеткам и содействовали эндоцитоз-зависимой интернализации, совместимой с клеточной жизнеспособностью. Удивительным образом, присутствие отрицательного заряда сделало наночастицы CaP-NP, как таковые, или инкапсулирующие одно или несколько соединений, подлежащих высвобождению в миокарде, совместимыми с жизнеспособной интернализацией в клетках, имеющих гиперполяризованные мембраны (например, кардиомиоциты), и позволило избежать побочных эффектов, таких как возникновение аритмий. В другом аспекте изобретения наночастицы CaP-NP могут быть поверхностно функционализированы нацеливающими лигандами (то есть антителами, пептидами, аптамерами) для прямого клеточно-специфического связывания, интернализации и внутриклеточного высвобождения функциональных терапевтических лекарственных средств в желаемом органе, повышая, тем самым, эффективность лекарственного средства при одновременном сведении к минимуму системного воздействия лекарственного средства и неблагоприятных побочных эффектов в тканях, отличных от миокарда.
Настоящее изобретение будет теперь описано более подробно и проиллюстрировано ниже в экспериментальной части.
Краткое описание фигур
На фиг. 1 показаны эффекты цитрата на наночастицы CaP-NP, полученные в соответствии с изобретением. (A, B) Оценка коллоидной стабильности и размеров наночастиц CaP-NP, синтезированных без цитрата и с возрастающими количествами цитрата; (А) Z-среднее как показатель среднего гидродинамического диаметра и (B) число фотонов в секунду измеряли непрерывно в течение часа методом DLS.
На фиг. 2 показаны эффекты времени созревания на образование наночастиц CaP-NP. ИК-спектроскопия с использованием преобразования Фурье (FTIR) наночастиц CaP-NP при разном времени синтеза и при использовании концентрации цитрата 80 мМ. Пики при 560 и 603 коррелируют со степенью кристалличности.
На фиг. 3 показана (А) проводимость раствора для диализа как функция времени, и (В) стабильность наночастиц CaP-NP в растворе после 6 часов диализа, оцененная методом DLS посредством измерения показателя Z-среднее.
На фиг. 4 показан анализ методом просвечивающей электронной микроскопии (TEM) наночастиц CaP-NP, синтезированных с использованием концентрации цитрата 80 мМ, до диализа (А) и после 6 часов диализа (B); и (С) анализ наночастиц CaP-NP, показанных на фиг. 2В, методом энергодисперсионной рентгеновской спектрометрии (Energy Dispersive x-ray Spectrometry, EDX).
На фиг. 5 показан анализ методом просвечивающей электронной микроскопии (TEM) наночастиц CaP-NP-miR с использованием начальной концентрации miR 10 мкг/мл.
На фиг. 6 показана (А) оценка клеточной цитотоксичности, проанализированная с использованием эксклюзионного анализа с окрашиванием трипановым синим, красителем, способным избирательно метить только мертвые клетки. Ингибиторы клатрина или динамина использовали для выделения эндоцитотических процессов, вовлеченных в интернализацию наночастиц CaP-NP. (B) Оценка уровней клеточного апоптоза с помощью анализа активности каспазы-3-7. (С) Флуоресцентное изображение, полученное с помощью конфокальной микроскопии клеток HL-1, обработанных CaP-NP-FITC. Сигнал CaP-NP-FITC идентифицирует интернализацию CaP-NP-FITC во внутриклеточных компартментах. DAPI = краситель ядра.
На фиг. 7 показан эффект CaP-NP на электрофизиологию HL-1 после 24 часов воздействия 20 мкг/мл CaP-NP. В частности, показана блочная диаграмма пассивных свойств [мембранный потенциал покоя (RMP) (вверху), мембранная емкость (Cm) (в середине) и мембранное сопротивление (Rm) (внизу)] для клеток HL-1, не подвергнутых воздействию (черный цвет) и подвергнутых воздействию (серый цвет) 20 мкг/мл CaP-NP.
На фиг. 8 показаны эффекты CaP-NP на электрофизиологию HL-1 после 24 часов воздействия 20 мкг/мл CaP-NP. В частности, показаны (А) кривые I-V, полученные с помощью ramp-протоколов в контрольных (слева, черный цвет: среднее значение + SD; SD показано в виде полосы) и подвергнутых воздействию (справа, серый цвет) клетках HL-1. Нижний ряд. Наложение двух кривых (слева) и кривая средней разности суммарного мембранного тока (справа). (B) Репрезентативные кривые натриевого тока для обоих состояний. Нижняя часть. Пиковые натриевые токи I-V и потенциал-зависимости активации натриевого канала (g/gmax, справа) для контрольных (черный цвет) и подвергнутых воздействию (серый цвет) клеток HL-1.
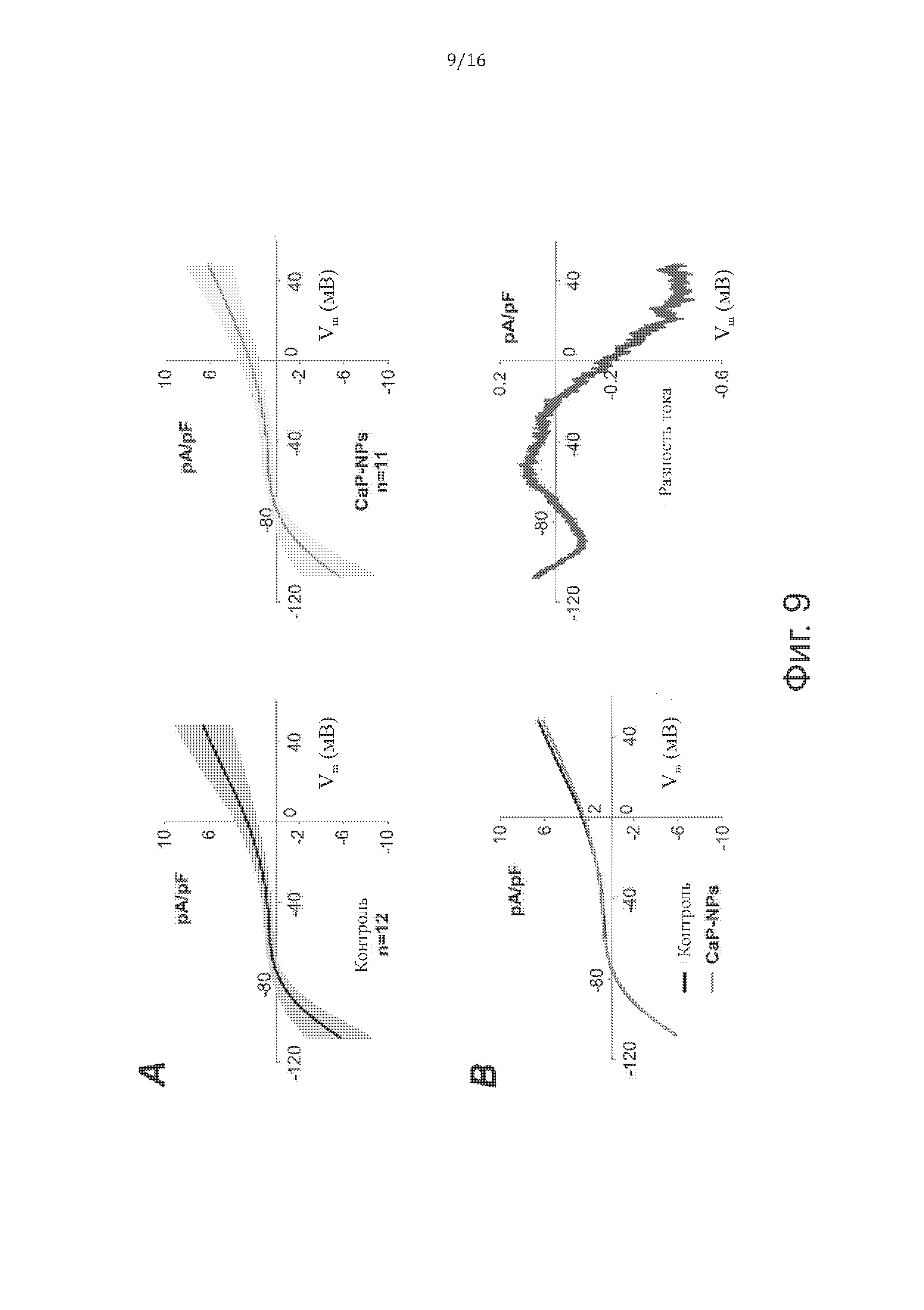
На фиг. 9 показаны эффекты CaP-NP на электрофизиологию желудочковых кардиомиоцитов взрослых мышей после 5 часов воздействия 20 мкг/мл СаР-NP. В частности, (A) кривые I-V, полученные с помощью ramp-протоколов, в контрольных (слева, черный цвет: среднее значение + SD; SD показано в виде полосы) и подвергнутых воздействию (справа, серый цвет) взрослых желудочковых миоцитах. (Б) Наложение двух кривых (слева) и кривая средней разности суммарного мембранного тока (справа).
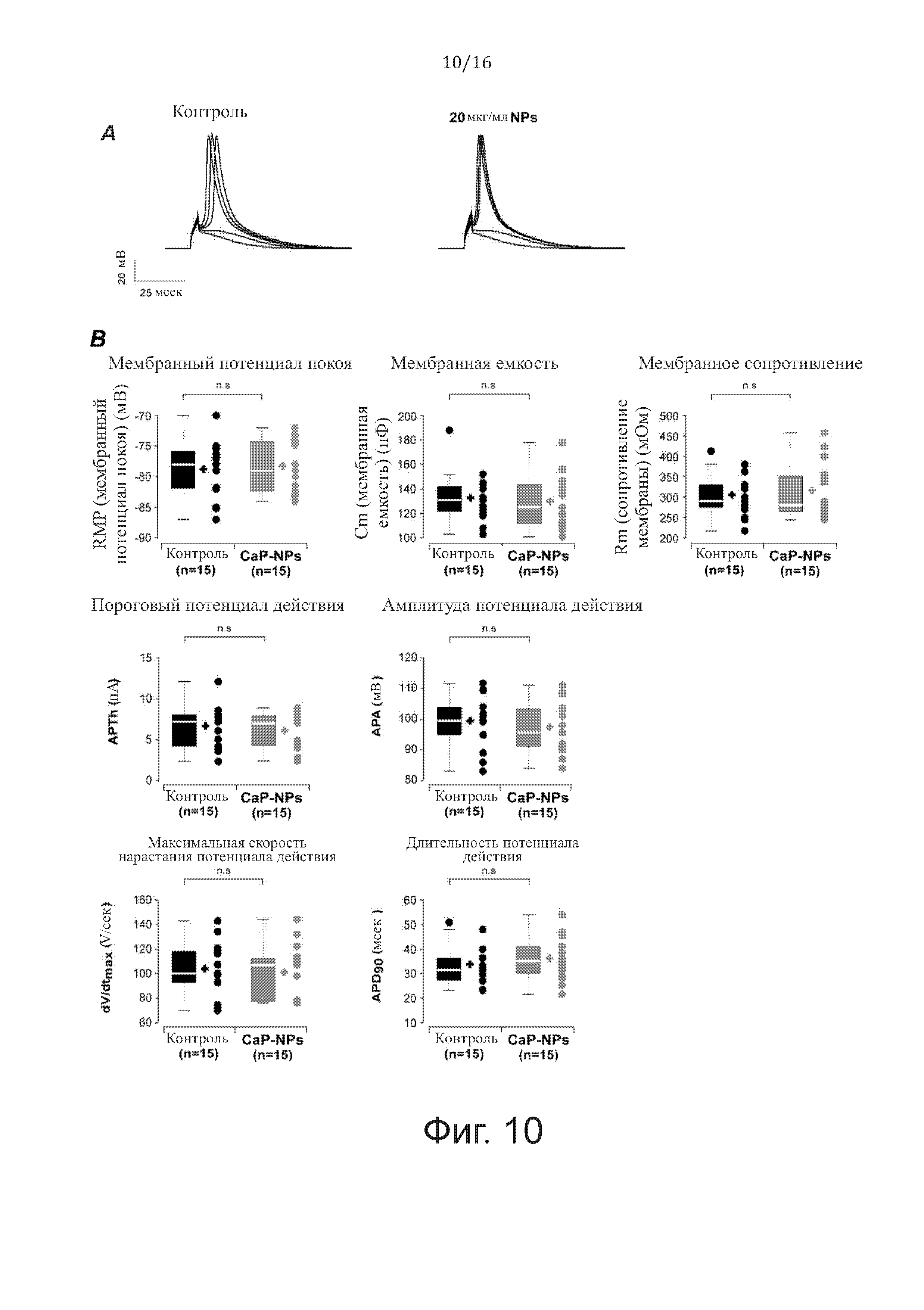
На фиг. 10 показаны эффекты CaP-NP на электрофизиологию желудочковых кардиомиоцитов взрослых мышей после 5 часов воздействия 20 мкг/кг СаР-NP. В частности, (A) репрезентативные потенциалы действия, записанные в конфигурации «whole cell current clamp configuration» в контрольных состояниях и после применения 20 мкг/мл CaP-NP. (В) Эффект CaP-NP на мембранный потенциал (Vm), мембранную емкость (Cm) и мембранное сопротивление (Rm) (сверху) взрослых кардиомиоцитов. Эффект CaP-NP на пороговый потенциал действия (APth) и амплитуду AP (APA) (в середине), максимальную скорость подъема AP (dV/dtmax) и длительностью AP на уровне 90% фазы реполяризации (APD90) (внизу).
На фиг. 11 показаны эффекты CaP-NP на электрофизиологию желудочковых кардиомиоцитов взрослых мышей после 5 часов воздействия 20 мкг/мл СаР-NP. В частности, (A) репрезентативные натриевые токи, записанные в конфигурации «whole cell current clamp configuration» в контрольных состояниях и после введения 20 мкг/мл CaP-NP (сверху). Наложение средних плотностей пиковых натриевых токов как функция контрольного потенциала (протоколы «voltage steps») и кривые потенциал-зависимости активации в устойчивом состоянии, полученные в контрольных состояниях (черный) и после применения 20 мкг/мл CaP-NP (серый) (внизу). (В) Репрезентативные кальциевые токи, записанные в конфигурации «whole cell current clamp configuration» в контрольных состояниях и после введения 20 мкг/мл CaP-NP (вверху). Наложение средних плотностей пиковых кальциевых токов как функция контрольного потенциала (протоколы «voltage steps») и кривые потенциал-зависимости активации в устойчивом состоянии, полученные в контрольных состояниях (черный) и после применения 20 мкг/мл CaP-NP (серый) (внизу).
На фиг. 12 показаны эффекты СаР-NP на уровни цитозольного кальция (кальциевых транзиентов) в клетках HL-1 после воздействия 20 мкг/мл СаР-NP в течение 24 часов. Кальциевые транзиенты отражают циклические изменения иона при смене систолических/диастолических фаз кардиомиоцитов. Клетки, подвергнутые анализу с помощью системы видеомикроскопии IonOptix, нагружали чувствительным к кальцию флуорофором Fura2.
На фиг. 13 показаны результаты интернализации miR-133 после введения возрастающих доз CaP-NP-miR в клетки НЕК293. Количество интернализованной miR-133 измеряли с помощью количественной ПЦР (PCR) на экстракте тотальной РНК. В качестве положительного контроля трансфекции miR-133 с липосомами использовали липофектамин.
На фиг. 14 показаны электрограммы, записанные у взрослых крыс после трахеального введения только солевого раствора (контроль) или наночастиц по изобретению (CaP-NP).
На фиг. 15 показан анализ методом двухфотонной микроскопии на миокардиальной ткани животного, обработанного CaP-NP-FICT посредством трахеальной инстилляции. На изображениях показано фактическое достижение наночастицами CaP-NP-FITC желудочковой ткани. На изображениях препарата в нижней части наночастицы CaP-NP-FITC также присутствуют внутри сосуда.
На фиг. 16 показан терапевтический потенциал миметического пептида (MP), описанного в заявке РСТ PCT/EP2015/051376, в мышиной модели диабетической кардиомиопатии. Миметический пептид (MP) представляет собой короткий пептид-9aa, который относится к новому классу препаратов с положительным инотропным действием (инотропы). Действуя посредством нетрадиционных механизмов (т.е. нормализация плотности потенциал-зависимого кальциевого канала L-типа на клеточной поверхности, который является триггерным элементом, приводящим к кальций-зависимому систолическому сокращению, и без изменения свойства регуляции канала), миметический пептид восстанавливает силу сердцебиения и не имеет вредных недостатков инотропов предыдущего класса (т.е. аритмогенез и кислородная недостаточность миокарда). (А) Эхо, эхокардиография. Показатель фракции укорочения (%) по данным эхокардиографии у мышей, обработанных стрептозотоцином (STZ) и миметическим пептидом, не инкапсулированным в CaP-NP (MP), наночастицами CaP-NP, нагруженными конкурентом (НА) (CaP-NP-HA), или наночастицами CaP-NP, нагруженными миметическим пептидом (CaP-NP-MP). (n=10) (B) Измерения Ca2+-тока в кардиомиоцитах, выделенных из взрослых обработанных мышей. Показано отношение I/V (n>16). Данные представлены в виде среднего значения ± SEM; ****, P <0,0001.
Подробное описание изобретения
Таким образом, изобретение относится к способу получения продукта, содержащего одну или несколько наночастиц фосфата кальция (CaP-NP) с отрицательным поверхностным зарядом, имеющих ζ-потенциал в диапазоне от -41,0 мВ до -27,0 мВ, включающему следующие стадии:
а) выдерживание смеси, имеющей значение рН в диапазоне от 7 до 10 и содержащей водный раствор кальция, водный раствор фосфата и раствор цитрат-ионов, при температуре в диапазоне от 20°C до 40°C в течение периода времени от 30 секунд до 10 минут;
b) удаление непрореагировавших ионов из раствора, полученного на стадии а), с получением, таким образом, суспензии одной или нескольких наночастиц фосфата кальция (CaP-NP);
c) извлечение одной или нескольких наночастиц фосфата кальция (CaP-NP) в качестве продукта из суспензии, полученной на стадии b).
В соответствии с изобретением водный раствор кальция в смеси на стадии а) предпочтительно представляет собой раствор хлорида кальция, имеющий молярность в диапазоне от 20 до 200 мМ.
В соответствии с изобретением водный раствор фосфата в смеси на стадии а) предпочтительно представляет собой раствор Na2HPO4, имеющий молярность в диапазоне от 24 мМ до 140 мМ.
Температура на стадии а) находится в диапазоне от 20°С до 40°С. Предпочтительно она находится в диапазоне от 35°С до 40°С, более предпочтительно составляет около 37°С.
Время выдерживания смеси при температуре в диапазоне от 20°С до 40°С на стадии а) составляет от 30 секунд до 10 минут, предпочтительно составляет около 5 минут.
Раствор цитрат-ионов предпочтительно представляет собой водный раствор цитрата натрия, имеющий молярность в диапазоне от 40 мМ до 800 мМ.
Смесь на стадии а) имеет значение рН в диапазоне от 7 до 10, более предпочтительно значение рН смеси равно 10.
В конце стадии а) смесь подвергают процессу удаления непрореагировавших ионов. Предпочтительно указанную стадию осуществляют с использованием диализной мембраны. В качестве альтернативы можно использовать электрофоретическое осаждение или молекулярную эксклюзионную хроматографию.
При использовании в изобретении диализной мембраны, она предпочтительно представляет собой целлюлозную мембрану, имеющую порог отсечения по молекулярной массе 3500 Дальтон. Стадию удаления b), осуществляемую с использованием диализной мембраны, предпочтительно осуществляют в течение от 5 до 24 часов, более предпочтительно в течение 6 часов.
В конце стадии удаления непрореагировавших ионов b) получают суспензию наночастиц, которая может быть подвергнута добавлению бидистиллированной воды и лиофилизации с получением CaP-NP стадии с). В альтернативном варианте продукт, полученный на стадии b), может быть подвергнут лиофилизации для получения порошков.
Способ по изобретению позволяет получить продукт, состоящий из одной или нескольких наночастиц CaP-NP с ζ-потенциалом в диапазоне от -41,0 мВ до -27,0 мВ, которые способны поступать в клетки сердца и не вызывать изменение электрофизиологических характеристик сердца, как будет показано в экспериментальной части. Оказалось, что продукт по изобретению обладает преимуществами в форме наночастиц со сфероидальной морфологией. Кроме того, оказалось, что наночастицы, получаемые с помощью способа по изобретению, имеют низкую кристалличность, измеренную в виде коэффициента расщепления наночастиц, что позволяет инкапсулировать более высокие количества диагностических/терапевтических соединений. Наночастицы, получаемые способом по изобретению, имеют низкую кристалличность, сравнимую с кристалличностью аморфного фосфата кальция (как будет видно из следующей далее экспериментальной части), что фактически приводит к большей структурной неупорядоченности и, таким образом, к большому количеству свободных ионных центров, способных связываться с терапевтическими/диагностическими соединениями. В предпочтительном и преимущественном аспекте изобретения способ по изобретению включает добавление на стадии а) водного раствора одного или нескольких терапевтических/диагностических соединений. В альтернативном варианте в следующем предпочтительном и выгодном аспекте изобретения способ по изобретению включает добавление стадии поверхностной функционализации конечного продукта одним или несколькими терапевтическими/диагностическими соединениями. Поверхностную функционализацию CaP-NP диагностическими/терапевтическими соединениями, например, можно осуществлять путем смешивания в течение различных периодов времени суспензий CaP-NP с растворами диагностических/терапевтических соединений с последующими промывочными процедурами. Стабильное связывание между диагностическими/терапевтическими соединениями и CaP-NP может возникать, главным образом, посредством электростатических взаимодействий.
Одно или несколько терапевтических/диагностических соединений предпочтительно выбраны из групп, состоящих из нуклеиновых кислот, пептидов, синтетических соединений и диагностических зондов.
Присутствие на стадии а) раствора одного или нескольких представляющих интерес диагностических/терапевтических соединений позволяет получить в конце стадии с) наночастицы CaP-NP, содержащие инкапсулированное в структуре терапевтическое/диагностическое соединение(я).
Таким образом, продукт по изобретению, получаемый в соответствии с предпочтительным и выгодным аспектом изобретения, неожиданно включает одну или несколько наночастиц CaP-NP, инкапсулирующих одно или несколько диагностических/терапевтических соединений, и/или одно или несколько поверхностно-функциональных терапевтических/диагностических соединений. Неожиданно оказалось, что продукт по изобретению, инкапсулирующий одно или несколько диагностических/терапевтических соединений, содержит одну или несколько отрицательно заряженных наночастиц CaP-NP с ζ-потенциалом в диапазоне от -41,0 мВ до -27,0 мВ и показателем Z-среднее в диапазоне от 150 нм до 231 нм. Оказалось, что продукт по изобретению, содержащий терапевтическое/диагностическое соединение(я), инкапсулированное в структуре, обладает преимуществами в форме наночастиц CaP-NP, имеющих сфероидальную морфологию.
В другом своем аспекте изобретение относится к продукту, получаемому с помощью способа по изобретению, для применения в качестве носителя в лечении сердечно-сосудистых заболеваний посредством ингаляционного введения.
Сердечнососудистые заболевания по настоящему изобретению включают сердечную недостаточность, снижение миокардиального сокращения, фибрилляцию, диабетическую кардиомиопатию, дилатационную кардиомиопатию, генетические заболевания (такие как синдром Бругады, синдром Тимоти или синдром короткого интервала QT, мышечная дистрофия), гипертрофию сердца, гипотонию, гипертиреоз, гипотиреоз, острую сердечную недостаточность, хроническую сердечную недостаточность, инфаркт миокарда.
В следующем и предпочтительном аспекте изобретение относится к продукту, получаемому с помощью способа по изобретению в его предпочтительном и выгодном варианте осуществления с одним или несколькими соединениями, инкапсулированными в одну или несколько наночастиц СаР-NP, для применения в лечении сердечно-сосудистых заболеваний посредством ингаляционного введения, как объясняется выше и показано в экспериментальной части. Кроме того, изобретение относится к продукту, получаемому с помощью способа по изобретению, вводимому посредством других энтеральных и парентеральных путей введения (т.е. внутривенного, интраперитонеального, перорального, сублингвального, ректального, внутриглазного, местного или трансдермального пути введения).
Экспериментальная часть
Пример 1А. Получение наночастиц фосфата кальция (CaP-NP) по изобретению
Готовили раствор, содержащий: 12,5 объемов раствора CaCl2 (10-50 мМ) и Na3 (C6H5O7) (40-200 мМ), 1 объем раствора NaOH (0,1-0,5 М) и 12,5 объемов раствора Na2HPO4 (12-60 мМ), а затем помещали на водяную баню при температуре 37°С на 5 мин.
Для удаления непрореагировавших реагентов раствор CaP-NP подвергали диализу в течение 6 часов, используя целлюлозную диализную мембрану, имеющую порог отсечения по молекулярной массе 3500 Дальтон, и погружали в 400 мл бидистиллированной воды. Затем раствор извлекали и хранили в холодильнике при 4°С. Количество CaP оценивали путем лиофилизации образца и последующего взвешивания неорганического остатка. Конечная концентрация водной суспензии CaP находилась в диапазоне от 60 мкг/мл до 300 мкг/мл в зависимости от концентрации реагентов.
Для получения наночастиц реакцию синтеза между Ca2 + и PO43- проводили при рН 10, регулируя значение рН путем добавления раствора NaOH (0,1-0,5 М) для предотвращения образования других химических веществ. Цитрат натрия, присутствующий в исходном растворе вместе с солями кальция и фосфата, служил в качестве стабилизирующего агента, который позволял частицам CaP формировать кристаллы контролируемым образом (путем изменения уровня пересыщения Ca2 + и PO43).
Суспензию наночастиц анализировали с использованием динамического рассеяния света (DLS), определяя показатель Z-среднее, который находился в диапазоне 100-200 нм.
Конечная концентрация водной суспензии CaP-NP, полученной на стадии b), находилась в диапазоне от 60 мкг/мл до 300 мкг/мл в зависимости от концентрации реагентов.
Анализ с помощью просвечивающей электронной микроскопии (TEM) продукта по изобретению, то есть наночастиц CaP-NP, позволил определить показатель Z-среднее, который составил около 50 нм в диаметре.
Пример 1B: Эффекты цитрат-иона, а также температурных и временных условий на наночастицы CaP-NP по изобретению.
Для оценки важности присутствия цитрат-ионов на стадии а) эффект цитрата на размеры и коллоидную стабильность СаР-NP предварительно оценивали с использованием динамического рассеяния света (DLS).
Равные объемы растворов Na2HPO4(24 мМ) и CaCl2 (20 мМ) + Na3Cit (20, 40, 80 мМ) смешивали напрямую в одноразовой кювете, выдерживали при 37°С в течение 5 минут и подвергали измерениям методом DLS для оценки размера и стабильности осадка CaP-NP в отсутствие или в присутствии цитрата. Использовали различные концентрации цитрата натрия (20, 40, 80 мМ).
Гидродинамический диаметр и число фотонов в секунду измеряли в течение непрерывного периода, составляющего 60 минут, с использованием DLS (Фиг. 1А, В).
Данные, представленные на фиг. 1А, где измеряли показатель Z-среднее наночастиц СаР-NP, синтезированных в присутствии и в отсутствие цитрата, в зависимости от времени кристаллизации, ясно показывают, что среднее значение гидродинамического диаметра наночастиц СаР-NP, кристаллизованных в отсутствие цитрата, уже через несколько секунд кристаллизации составило около 2 мкм и оставалось стабильным в течение 60 минут. С другой стороны, показатель Z-среднее наночастиц СаР-NP, синтезированных в присутствии цитрата, через несколько секунд оказался значительно меньше по сравнению с наночастицами CaP-NP, полученными в отсутствие цитрата (около 100 нм). Среднее значение гидродинамического диаметра наночастиц CaP-NP, синтезированных в присутствии цитрата, медленно увеличивалось с течением времени по сравнению с контрольным образцом без цитрата, что указывает на то, что цитрат стабилизирует размер наночастиц и уменьшает тенденцию наночастиц СаР-NP к образованию агрегатов. Кроме того, эти данные показывают, что при увеличении количества цитрата во время синтеза показатель Z-среднее наночастиц СаР-NP увеличивается более медленно, и что независимо от концентрации при низких временах кристаллизации цитрат проявляет свою роль по стабилизацию размера наночастиц.
На фиг. 1В показано, что число фотонов в секунду для CPC, синтезированных без цитрата или с цитратом в количестве 20 мМ, уменьшается с течением времени, так что количество материала в кювете уменьшается после его осаждения на дно кюветы. С другой стороны, число фотонов, детектированных в случае наночастиц СаР-NP, синтезированных в присутствии цитрата в количестве 40 мМ и 80 мМ, остается стабильными в течение времени, что указывает на превосходную коллоидную стабильность наночастиц СаР-NP, синтезированных таким способом. Наконец, наночастицы CaP-NP, кристаллизованные в присутствии цитрата, показали более высокую размерную и коллоидную стабильность, поэтому присутствие цитрата важно для обеспечения стабильности частиц.
После оценки эффекта цитрата оценивали оптимальное время кристаллизации. Образцы наночастиц CaP-NP, кристаллизованных в присутствии 80 мМ цитрата, готовили при различных временах кристаллизации (то есть 5, 10, 20 и 60 минут). Продукты реакции промывали три раза водой путем центрифугирования при 5000 оборотах в минуту (3,689 х g) в течение 10 минут и характеризовали методами DLS, инфракрасной спектроскопии с использованием преобразования Фурье (FTIR) и просвечивающей электронной микроскопии (TEM). Количество наночастиц СаР-NP оценивали путем взвешивания неорганического остатка после промывки и лиофилизации.
Записывали FTIR-спектры (фиг. 2) наночастиц СаР-NP, синтезированных в течение различных периодов времени, для оценки химической структуры частиц. Во всех случаях выделяли полосы, типичные для CaP. В частности, можно видеть полосы, соответствующие основным функциональным группам, присутствующим в этой структуре, такие как: 2 полосы при около 1040 см-1и 1100 см-1, соответствующие валентным колебаниям фосфатов; два пика при 603 см-1и 560 см-1, соответствующие изгибным колебаниям фосфатов; две небольшие полосы вблизи 1450 см-1,соответствующие валентным колебаниям карбонат-ионов. Поскольку наночастицы CaP-NP получали в неконтролируемой атмосфере, карбонат-ионы могут спонтанно проникать в кристаллическую структуру материала. Это явление обычно наблюдается также в биологических апатитах. Во всех материалах более интенсивная полоса наблюдается при около 1600 см-1, соответствующая валентному колебанию карбоксильной группы цитрата. Таким образом, может быть подтверждено фактическое присутствие цитрата, связанного на поверхности CaP. При увеличении времени кристаллизации наблюдалась четкая трансформация из материала с низкой степенью дальнего порядка, схожего с аморфным материалом, в более кристаллический материал.
При увеличении времени кристаллизации показатель Z-среднее наночастиц CaP-NP увеличивался до значения, равного около 2 мкм, в наночастицах, синтезированных через 60 минут. Только в случаях, когда наночастицы СаР-NP были синтезированы через 5 и 10 минут, среднее значение гидродинамического радиуса отвечало характеристикам, требуемым для применения в настоящем изобретении.
Степень кристалличности рассчитывали из FTIR-спектров, показанных на фиг. 2, путем оценки коэффициента расщепления (SF) (Weiner S. и Bar-Yosef O. (1990). States of preservation of bones from prehistoric sites in the Near East: a survey. Journal of Archaeological Science 17, 187–196.). Коэффициент расщепления (SF) измеряли по сумме высот пиков валентных колебаний фосфатов при 603 см-1 и 560 см-1, деленной на высоту точки минимума между ними. Все высоты измеряли выше базовой линии, проходящей приблизительно от 780 см-1 до 495 см-1. Чем выше SF, тем выше кристалличность материала, как показано в таблице 1 ниже. Коэффициент расщепления (SF) СаР-NP после 5 минут кристаллизации не поддавался измерению, поскольку полосы фосфатов при 603 см-1 и 560 см-1не были расщеплены, что указывает на очень низкую степень кристалличности. С другой стороны, значение SF возрастало с увеличением времени кристаллизации, что свидетельствует о том, что время кристаллизации влияет на степень кристалличности материала.
Таблица 1
При временах кристаллизации, составляющих более 10 минут, уровень кристалличности, достигаемый в конечном итоге, был слишком высок, так что продукт становится неподходящим для предполагаемой области применения. Уменьшение времени разлагаемости наночастиц СаР-NP выгодным образом обеспечило возможность медленного высвобождения терапевтического/диагностического соединения, тогда как повышение уровня кристалличности, достигаемое с помощью этой процедуры, уменьшило время разлагаемости наночастиц CaP-NP, обуславливая, таким образом, медленное высвобождение терапевтического/диагностического соединения.
Пример 1С: Эффекты стадии b) по изобретению
Для удаления непрореагировавших ионов в процессе кристаллизации использовали диализ, как указано в примере 1A.
Для определения оптимального времени, в течение которого все избыточные ионы в реакционной среде удаляются путем диализа, оценивали проводимость диализной среды во времени и наблюдали плато через 6 часов (фиг. 3А). Достигнутое плато проводимости указывает на то, что ионный обмен из реакционной среды в диализную среду завершился, и что большинство непрореагировавших ионов было перенесено в промывочную воду. Измеряли ζ-потенциал наночастиц СаР-NP после диализа в течение указанного времени, как показано в таблице 2 ниже.
Таблица 2
Результаты указывают на то, что увеличение времени диализа уменьшает среднее значение гидродинамического диаметра наночастиц CaP-NP, тогда как ζ-потенциал остается постоянным. Стабильность CaP-NP после 6 часов диализа подтверждали методом DLS (фиг. 3B). На фиг. 3В показано значение Z-среднее CaP-NP после 6 часов диализа в зависимости от времени. Можно видеть, что изменений в размерах CaP-NP не наблюдалось вплоть до 300 минут, фактически, размерная величина, по-видимому, оставалась постоянной во времени. Вставка на фиг. 3В показывает число фотонов, детектированных в секунду в течение периода до 300 минут. Этот анализ позволил определить оптимальную коллоидную стабильность СаР-NP после 6 часов диализа в растворе, так как число фотонов оставалось постоянным в течение 300 минут.
На фиг. 4 показан анализ TEM наночастиц CaP-NP до диализа (фиг. 4А) и после 6 часов диализа (фиг. 4В). Можно видеть, что до диализа наночастицы CaP-NP (узнаваемые по сферической размерности и более темному цвету, и с размерами около 20-30 нм в диаметре) покрыты слоем органического материала, которым, скорее всего, является цитрат, оставшийся в растворе, физически не связанный с наночастицами CaP-NP. Напротив, наночастицы CaP-NP после 6 часов диализа также в этом случае имели сфероидальную морфологию и размеры около 30-50 нм, но были более четкими и визуально без поверхностной органической части. Анализы методом энергодисперсионной рентгеновской спектроскопии (EDX) (фиг. 4C) на выбранной области проводили на наночастицах CaP-NP после 6 часов диализа, и они показали сигналы, соответствующие элементам Са, Р (дополнительно к сигналам, соответствующим Cu, обусловленным держателем образца, и сигналам, соответствующим О и С, обусловленным образцом и внешней средой), подтверждая, что наночастицы CaP-NP в основном состоят из фосфата кальция и никакой другой фазы во время диализа не образуется.
Пример 2: Мечение СаР-NP по изобретению
Для оценки клеточной интернализации наночастиц, полученных в примере 1А, наночастицы метили флуоресцеин-изотиоцианатом (FITC).
Наночастицы CaP-NP получали, как описано в примере 1А, но с включением соединения FITC, как описано далее.
Раствор, содержащий: 12,5 объемов раствора CaCl2 (10-50 мМ) и Na3 (C6H5O7) (40-200 мМ),1 объем раствора NaOH (0,1-0,5 М) и 12,5 объемов раствора Na2HPO4 (12-60 мМ) готовили и затем помещали в водяную баню при температуре 37°С на 5 минут. Для удаления непрореагировавших реагентов раствор СаР-NP подвергали диализу в течение 6 часов, используя целлюлозную диализную мембрану, имеющую порог отсечения по молекулярной массе 3500 Дальтон, и погружали в 400 мл бидистиллированной воды. Затем получали суспензию наночастиц CaP-NP.
Вначале, FITC конъюгировали с 3-аминопропилтриэтоксисиланом (APTS) (далее в настоящем документе эта смесь называется FITC-APTS) согласно следующему протоколу: FITC (0,025 ммоль) и APTES (0,25 ммоль) добавляли в 10 мл этанола и выдерживали в темноте в течение 24 часов при перемешивании при 600 оборотах в минуту.
Затем 100 мкл FITC-APTS, 100 мкл гидроксида аммония (28 масс.% NH3 в H2O) и 100 мкл тетраэтилортосиликата (TEOS) добавляли к водной суспензии наночастиц СаР-NP. Эту суспензию выдерживали при перемешивании при 600 оборотах в минуту в темноте в течение 24 часов. Наночастицы CaP-NP-FITC промывали 3 раза бидистиллированной водой путем центрифугирования для удаления непрореагировавшего FITC.
Полученные наночастицы CaP-NP-FITC использовали в следующих примерах для оценки биологической активности.
Пример 3: Получение наночастиц СаР-NP, инкапсулирующих микроРНК (пример терапевтического соединения) (CaP-NP-miR)
Получение наночастиц CaP-NP с инкапсулированием микроРНК осуществляли, в точности следуя протоколу получения, описанному в примере 1А, путем включения соединения микроРНК, как описано далее. МикроРНК, соответствующая микроРНК miR-133, представляет собой синтетическую нуклеотидную последовательность (синтезированную фирмой IBA, Germany).
Готовили раствор, содержащий: 12,5 объемов раствора CaCl2 (10-50 мМ) и Na3 (C6H5O7) (40-200 мМ), 1 объем раствора NaOH (0,1-0,5 М), 12,5 объемов раствора Na2HPO4 (12-60 мМ), с различными концентрациями микроРНК (0,5-10). Затем раствор помещали в водяную баню при температуре 37°С на 5 минут. Затем суспензию подвергали диализу в течение 6 часов и хранили при 4°С. Полученные наночастицы CaP-NP, инкапсулирующие miR-133 (далее в настоящем документе кратко обозначаемые как CaP-NP-miR), затем анализировали в отношении размеров, ζ-потенциала и морфологии. Затем раствор извлекали и хранили в холодильнике при 4°С.
Конечная концентрация водной суспензии наночастиц CaP-NP-miR находилась в диапазоне от 60 мкг/мл до 300 мкг/мл (смотри таблицу 3).
Характеристики CaP-NP-miR показаны ниже в таблице 3.
Таблица 3
Суспензию наночастиц CaP-NP-miR анализировали методом DLS, определяя показатель Z-среднее, находящийся в диапазоне 150-231 нм, и ζ-потенциал, находящийся в диапазоне от -41,0 мВ до -27,0 мВ. Кроме того, индекс полидисперсности (PDL) имел значения, близкие нулю, что указывает на узкое распределение размеров образца. Анализ с помощью ТЕМ продукта по изобретению, то есть наночастиц CaP-NP-miR, показал, что размер каждой отдельной частицы равен около 50 нм (фиг. 5).
Пример 4: Оценка количества miR-133, инкапсулированной в CaP-NP-miR согласно изобретению в примере 3
Для оценки точного количества miR-133, инкапсулированной в CaP-NP-miR, измерение с помощью количественной PCR (qPCR) проводили на общих нуклеиновых кислотах, выделенных из CaP-NP-miR. Из трех препаратов CaP-NP-miR, как описано в примере 3, и используя различные концентрации miR-133 (2, 25, 50 мкг), используемые во время синтеза, 500 мкл раствора CaP-NP-miR использовали для выделения РНК с помощью реагента Purezol (Promega). Затем в общей сложности 40 нг РНК, выделенной для каждого препарата CaP-NP-miR, обратно-транскрибировали с использованием универсального набора cDNA Synthesis II kit (Exiqon). Затем 1/40 реакции обратной транскрипции использовали для последующей miR-133-специфической qPCR, которую проводили в трех повторах на системе PCR в реальном времени VIIa™ 7 (Applied Biosystem) с использованием SYBR® Select Master Mix (Invitrogen). Точное количество miR-133 затем определяли с помощью абсолютного метода количественного определения, используя серийные разведения кДНК, полученной из известного количества синтетического олигонуклеотида miR-133 (разведение 1:10 от начальной точки 40 фентомолей). Количество miR-133, связанной с СаР-NP, оценивали путем сопоставления со значениями Ct на линейной стандартной кривой. Количество miR-133a, связанной с СаР-NP, показано в таблице 4. Результаты показывают, что более 50% микроРНК, используемой во время реакции, было инкапсулировано внутри CaP-NP.
Таблица 4
Пример 5: Оценка in vitro СаР-NP и токсичности
Наночастицы CaP-NP, полученные в примере 1А, тестировали in vitro на биосовместимость и токсичность, подвергая линию клеток сердца HL-1 воздействию возрастающих доз наночастиц CaP-NP (0-500 мкг/мл). В качестве первой стадии оценку цитотоксичности проводили с помощью эксклюзионного анализа с окрашиванием трипановым синим, красителем, способным селективно метить только мертвые клетки. Как показано на фиг. 6А, линия HL-1 переносила введение тестируемых количеств, при этом увеличение клеточной смертности наблюдалось только при высоких дозах (>125 мкг/мл). Затем использовали анализ каспазы-3-7 для оценки любых апоптотических ответов, индуцированных после введения СаР-NP. Как показано на фиг. 6B, значительные различия в отношении апоптотической активности наблюдались только при высоких концентрациях CaP-NP ≥250 мкг/мл. Таким образом, оба анализа выбрали наночастицы CaP-NP в качестве потенциального носителя для интернализации представляющих интерес соединений в миокарде.
Пример 6: Оценка интернализации СаР-NP
Для оценки клеточной интернализации CaP-NP клетки HL-1 подвергали воздействию концентрации 20 мкг/мл наночастиц CaP-NP-FITC, полученных в примере 2, и анализировали методом конфокальной микроскопии через 24 часа после введения. Как показано на фиг. 6С, четкая интернализация CaP-NP-FITC была достигнута в отдельных внутриклеточных везикулярных компартментах. Для определения, действительно ли эта интернализация обусловлена механизмами активного эндоцитоза, использовали клатрин- или динамин-специфические ингибиторы, белки, участвующие в инвагинации и эндоцитозе плазматической мембраны. Таким образом, клетки HL-1 предварительно обрабатывали этими ингибиторами, а затем подвергали воздействию возрастающих концентраций CaP-NP. Как показано на фиг. 6A, ингибирование клатрин/динамин-опосредованного эндоцитоза значительно снижало клеточную токсичность (в эксклюзионном анализе с окрашиванием трипановым синим), индуцированную CaP-NP при всех дозах, отражая, таким образом, ингибирование поглощения клетками СаР-NP.
Пример 7: Оценка in vitro СаР-NP и электрофизиологических свойств
Одной из основных проблем в применении наночастиц на основе кальция на возбудимых клетках, таких как кардиомиоциты, является потенциальный эффект на электрофизиологические свойства. Поэтому изучали биофизические свойства двух типов клеток (HL-1 и желудочковых кардиомиоцитов взрослых мышей). Вначале анализировали характеристики потенциала действия (AP) в клетках HL-1 после острого и хронического введения 20 мкг/мл наночастиц CaP-NP, полученных в примере 1А. В частности, через 24 часа после введения HL-1 использовали для экспериментов по хроническому введению (24 часа инкубации с СаР-NP), тогда как мышиные кардиомиоциты использовали для экспериментов по острому введению (4 часа инкубации с СаР-NP). Как в условиях хронического, так и острого введения, электрофизиологические эксперименты, проведенные с помощью метода «patch-clamp» в конфигурации «whole-cell», не показали какого-либо значительного различия между обработанным и контрольными образцами, как в отношении биофизических свойств покоящихся клеток, так и в отношении характеристик потенциала действия, полученных после надпороговой электростимуляции (фиг. 7-11). Таким образом, можно видеть, что параметры, которые определяют электрический фенотип этих клеток и которые наделяют клетки типичными характеристиками возбудимости, такие как мембранный потенциал (Vm), мембранная емкость (Cm), мембранное сопротивление (Rm), пороговый потенциал действия (AP), ширина AP (APA), максимальная скорость подъема (dV/dTmax) и продолжительность AP (APD), значительно не изменились после введения CaP-NP при указанных выше концентрациях. Кроме того, анализы, также с помощью метода «patch-clamp», основных ионных токов, обычно присутствующих в этих двух типах клеток, исследованных на основе типичной характеристики AP клеток сердца (токи калия, натрия и кальция), не показали существенных различий между контрольными и обработанными наночастицами СаР-NP образцами как в хронических, так и острых условиях).
И, наконец, проводили оценку изменений уровней кальция в цитозоле (кальциевый транзиент), отражающих циклические изменения кальция при чередовании систолических/диастолических фаз кардиомиоцитов. Как показано на фиг. 12, значительного изменения между различными состояниями не наблюдалось.
В заключение, приведенные выше данные показывают, что наночастицы CaP-NP эффективно входят во внутриклеточное цитоплазматическое пространство без изменения физиологических свойств клеток кардиомиоцитов.
Пример 8: Эффекты наночастиц CaP-NP с инкапсулированными диагностическими/терапевтическими соединениями
Оценивали клеточную интернализацию CaP-NP с инкапсулированным в них синтетическим олигонуклеотидным дуплексом, имитирующим miR-133 (используемую в примере 3). Таким образом, продукт по изобретению получали в виде наночастиц CaP-NP, конъюгированных с miR-133 (CaP-NP-miR), согласно примеру 3 и с использованием раствора синтетической miR-133. miR133, мышечно-специфическая микроРНК, которая, как известно, является отрицательным модулятором бета-адренергических рецепторов.
Интернализацию соединения по изобретению затем подтверждали методом qPCR (количественная PCR), проводимой на цельной РНК, выделенной из клеток, обработанных ранее нарастающими дозами CaP-NP-miR. Как показано на фиг. 13, каждая обработка нарастающими дозами CaP-NP-miR соответствовала приращению значений внутриклеточной miR-133.
Эти данные свидетельствуют о том, что соединение miR-133, инкапсулированное в частицы CaP-NP-miR, действительно активно интернализуется в клетках. Таким образом, такое свидетельство подтверждает применение СаР-NP для эффективной внутриклеточной доставки терапевтических/диагностических соединений.
Пример 9: Оценка in vivo потенциальных неблагоприятных эффектов на сердечную функцию после введения продукта по изобретению
Для того, чтобы оценить, достигают ли успешно наночастицы CaP-NP, полученные в примере 1А), миокарда без вредного воздействия на активность сердца, проводили испытание in vivo на взрослых крысах. Животным, анестезированным, как описано в документе Rossi et al. AJP 2008, вводили трахеальным путем солевой раствор как таковой (CTL) или содержащий наночастицы CaP-NP при концентрации 3 мг на кг массы тела животного. Через 4 часа после обработки животных подвергали электрофизиологическому анализу. На фиг. 15 показаны электрограммы, записанные при наложении электродов на эпикардиальную поверхность. Как показано на фиг. 14 и в таблице 5 ниже, электрограммы не показали качественных различий между двумя экспериментальными группами в отношении P, PQ, QRS, QT, ERP, RR.
Таблица 5. Электрограммы животных, обработанных солевым раствором как таковым (CTL) или содержащим наночастицы CaP-NP
Таким образом, отсутствие изменения параметров ЭКГ сердца подтвердило, что введение наночастиц CaP-NP не привело к какой-либо форме модуляции возбудимости сердца, таким образом предвосхищая физиологическую толерантность сердца к продукту по изобретению и решение технической проблемы, ожидаемой при применении наночастиц другой природы.
В заключение, для оценки фактической доставки наночастиц CaP-NP в сердце крыс подвергали однократному внутритрахеальному введению солевого раствора, содержащего наночастицы CaP-NP-FITC (флуоресцеин-изотиоцианат) (3 мг/кг), полученные, как показано в примере 1В. Через 4 часа после введения сердце изолировали и анализировали с помощью двухфотонной микроскопии. Неожиданно было обнаружено широкое распределение продукта по изобретению в сердечной ткани, с особенно высоким содержанием в левом желудочке, что дает основание предположить, что посредством трахеального введения продукт по изобретению действительно достигает сердца. Этот результат показан на флуоресцентном изображении сердечной ткани на фиг. 15. Кроме того, подход, основанный на многократном введении (один раз в сутки в течение трех дней и через день), привел к увеличению флуоресценции, главным образом в левой камере желудочка сердца, что дает основание предположить, что сердечная биодоступность, относящаяся к сердечной ткани, увеличивалась дозозависимым образом.
Пример 10: Терапевтический потенциал продукта по изобретению в мышиной модели болезни сердца (диабетическая кардиомиопатия)
Для дальнейшего изучения потенциального терапевтического применения, наночастицы CaP-NP получали, как описано в примере 1А), путем включения миметического пептида (MP), как описано для микроРНК в примере 3. Миметический пептид (MP) представляет собой короткий пептид-9аа (синтезированный фирмой Genescript, USA), который относится к новому классу препаратов с положительным инотропным действием (инотропы). Действуя посредством нетрадиционных механизмов (т.е. нормализация плотности потенциал-зависимого кальциевого канала L-типа на клеточной поверхности, который является триггерным элементом, вызывающим кальций-зависимое систолическое сокращение, и без изменения свойств регуляции канала), миметический пептид (MP) восстанавливает силу сердцебиения в состоянии дисфункции сердца, когда снижена плотность кальциевых каналов L-типа (LTCC) и, соответственно, сердечная сократимость (т.е. диабетическая кардиомиопатия, DM). Для индукции диабетической кардиомиопатии (DM) мышам инъецировали стрептозотоцин (STZ), соединение, которое является токсичным для продуцирующих инсулин бета-клеток поджелудочной железы. Интересно, что через 10 дней ингаляционного лечения мышей с диабетической кардиомиопатией (DM) наночастицами MP-CaP-NP полностью восстанавливалась сердечная функция, в то время как эффектов не наблюдалось при введении только миметического пептида (MP) или наночастиц конкурент-CaP-NP (CaP-NP-HA) (фиг. 16). К тому же, функциональный анализ кардиомиоцитов, выделенных у тех же обработанных мышей, показал, что наночастицы MP-CaP-NP восстанавливали кальциевый ток (Ica) (фиг. 16B).
Реферат
Изобретение относится к фармацевтической промышленности, а именно к способу получения продукта, продукту для лечения сердечно-сосудистых заболеваний (варианты), применению продукта. Способ получения продукта, содержащего одну или несколько наночастиц фосфата кальция (CaP-NP) с отрицательным поверхностным зарядом, имеющих ζ-потенциал в диапазоне от -41,0 мВ до -27,0 мВ, включающий следующие стадии: а) выдерживание смеси, имеющей значение рН в диапазоне от 7 до 10 и содержащей водный раствор ионов кальция, водный раствор ионов фосфата и раствор цитрат-ионов, при температуре в диапазоне от 20°С до 40°С в течение периода времени от 30 секунд до 10 минут; b) удаление непрореагировавших ионов из раствора, полученного на стадии а), с образованием, таким образом, суспензии одной или нескольких наночастиц фосфата кальция (CaP-NP); c) извлечение продукта, содержащего одну или несколько наночастиц фосфата кальция (CaP-NP), из суспензии, полученной на стадии b). Продукт для лечения сердечно-сосудистых заболеваний, содержащий одну или несколько наночастиц CaP-NP, полученных вышеуказанным способом, где наночастицы (NP) имеют отрицательный поверхностный заряд, характеризуются ζ-потенциалом в диапазоне от -41,0 мВ до -27,0 мВ и имеют коэффициент расщепления (SF) не более 1,76. Продукт для лечения сердечно-сосудистых заболеваний, содержащий одну или несколько наночастиц CaP-NP, полученных вышеуказанным способом, в котором наночастицы (NP) инкапсулируют одно или несколько терапевтических/диагностических соединений, имеют отрицательный поверхностный заряд, характеризуются ζ-потенциалом в диапазоне от -41,0 мВ до -27,0 мВ и показателем Z-среднее в диапазоне от 150 нм до 231 нм. Применение продукта, полученного вышеуказанным способом в лечении сердечно-сосудистых заболеваний. Вышеуказанный способ позволяет получать и применять продукт (варианты) для эффективной внутриклеточной доставки терапевтических/диагностических соединений. 4 н. и 15 з.п. ф-лы, 16 ил., 5 табл., 10 пр.

Комментарии