Способ получения наночастиц нитрида бора для доставки противоопухолевых препаратов - RU2565432C1
Код документа: RU2565432C1
Описание
Изобретение относится к области наномедицинских технологий, а именно к созданию нанотранспортеров лекарственных препаратов для противоопухолевой химиотерапии.
Снижение эффективности противоопухолевой химиотерапии при лечении онкологических больных связано прежде всего с прогрессированием злокачественных новообразований и появлением в ходе опухолевой прогрессии клеток, обладающих так называемой множественной лекарственной устойчивостью, связанной с активацией мембранных транспортеров, выводящих противоопухолевые препараты из клеток. Кроме того, ряд лекарственных препаратов, применяемых в терапии онкологических заболеваний, обладает низкой гидрофильностью, а также оказывает токсическое действие на здоровые ткани организма. Эти проблемы могут быть преодолены путем использования нанотранспортеров, доставляющих лекарственные вещества в опухолевые клетки.
Известен способ получения сферических наночастиц нитрида бора методом химического осаждения из газовой фазы (US 20110033707, опубл. 10.02.2011). Данный способ позволяет получать наночастицы нитрида бора диаметром менее 50 нм. Способ включает в себя нагрев смеси эфира, борной кислоты и азота в среде аммония и аргона, приводящий к образованию реакционного продукта, его последующую кристаллизацию, приводящую к образованию прекурсоров сферических наночастиц, и последующий нагрев прекурсоров в инертном газе.
Недостатком данного способа является малый размер частиц и их гладкая поверхность, что не позволяет депонировать лекарственный препарат в количестве, необходимом для эффективной противоопухолевой терапии, ограничивает прикрепление таких частиц к опухолевым клеткам и их проникновение внутрь клеток.
Известен способ получения наночастиц для доставки лекарства (WO 2014124329, опубл. 14.08.2014).
В данном способе используются сферические магнитные частицы железа или оксида железа, в том числе покрытые золотом или оксидом кремния. Для терапии онкологических заболеваний закрепление лекарственного препарата на магнитных наночастицах происходит за счет использования связующего компонента, например эфира. Под воздействием внешнего нагрева или электромагнитного поля частицы нагреваются, что вызывает внутримолекулярную циклизацию связующего, приводя к высвобождению лекарства. Способ позволяет осуществлять контролируемое высвобождение лекарственного препарата, тем самым сводя к минимуму побочные эффекты и повышая терапевтическую эффективность обычных фармацевтических препаратов.
Недостатком описанного способа является необходимость использования дополнительного внешнего воздействия для получения терапевтического эффекта. Еще одним недостатком данного способа является то, что некоторые формы магнитных частиц могут приводить к появлению токсичности.
Известен способ получения наноконтейнеров, фармацевтических составов и комплексов наноносителей лекарственного препарата для терапии онкологических заболеваний (US 20140147508, опубл. 29.05.2014).
Данное изобретение описывает наноносители противоопухолевых препаратов, которые состоят из сферической металлической наночастицы и полинуклеотида для закрепления лекарства. Данный способ позволяет оказывать терапевтическое воздействие на опухолевые клетки за счет контролируемого высвобождения лекарства в зоне поражения.
Недостатком описанного способа является то, что наноконтейнеры не осуществляют доставку лекарства непосредственно внутрь опухолевых клеток, а выход лекарства осуществляется в непосредственной близости от клеток, что снижает эффективность метода за счет включения в опухолевых клетках механизмов множественной лекарственной устойчивости.
Также известен способ доставки противораковых препаратов в организм с помощью металлических наночастиц (US 20130331764, опубл. 12.12.2013). Доставка противоопухолевого препарата осуществляется с помощью золотых частиц размером 5-15 нм, чувствительных к кислотности среды. При введении в организм сферические металлические наночастицы попадают в клетки, имеющие нейтральную или щелочную среду и, выборочно, агломерируются в раковых клетках с кислой средой. Терапевтический эффект по данному способу достигается за счет химического воздействия противоопухолевого препарата и фототермического воздействия нагреваемых агломератов частиц под действием облучения в ближнем ИК-диапазоне, которое глубоко проникает в тело пациента.
Недостатком описанного способа является необходимость проведения дополнительной процедуры ИК-облучения и отсутствие терапевтического эффекта от проникновения материала без дополнительного внешнего воздействия на организм пациента. Кроме того, частицы лишь выборочно агломерируются в опухолевых клетках, что не позволяет прогнозировать эффективность метода. Кроме того, размер частиц 5-15 нм не желателен с точки зрения быстрого поглощения ретикулоэндотелиальной системой.
В качестве прототипа выбран способ получения нанотрубок нитрида бора, функционализированных мезопористым оксидом кремния для внутриклеточной доставки химиотерапевтических препаратов (X. Ли, Ч. Жи, Н. Ханагата, М. Ямагучи, Е. Бандо, Д. Гольберг. Нанотрубки нитрида бора, функционализированные мезопористым оксидом кремния, для внутриклеточной доставки химиотерапевтических препаратов. Журнал «Chem. Commun», 2013, 49, 7337). Способ заключается в получении нанотрубок нитрида бора методом химического осаждения из газовой фазы, их окислении на воздухе в течение 5 часов, формировании мезопористой оболочки оксида кремния гидролизом ТЭОСа и последующим насыщением противоопухолевым препаратом. Данный способ позволяет увеличить эффективность противоопухолевого препарата доксорубицина в 3-4 раза по сравнению со свободным доксорубицином.
Основным недостатком данного способа является неблагоприятная морфология нитрида бора с точки зрения поглощения клетками. Известно, что наночастицы в форме нанотрубок имеют недостаточную активность поглощения клетками и могут быть токсичными. Кроме того, нанотрубки нитрида бора определенной длины могут быть токсичными для клеток
Технический результат, достигаемый в предложенном изобретении, заключается в повышении эффективности противоопухолевой химиотерапии, за счет повышения активности поглощения клетками наноконтейнеров с противоопухолевым препаратом, предотвращения токсичности наноконтейнеров для клеток вследствие применения диспергированных наночастиц нитрида бора размером 50-300 нм с развитой наружной поверхностью.
Указанный технический результат достигается следующим образом.
Способ получения наночастиц нитрида бора для доставки противоопухолевого препарата в опухолевые клетки включает синтез сферических наночастиц нитрида бора размером 50-300 нм с развитой наружной поверхностью методом химического осаждения из газовой фазы с применением реакционного газа, в качестве которого используют аммиак, транспортного газа, в качестве которого используют аргон, и порошковых смесей, состоящих из аморфного бора и реагент-окислителей.
Химическое осаждение проводят при следующих условиях
1000≤Т≤1430
1.2≤ξ≤8,
где
Т - температура порошковой смеси,
ξ - отношение удельных потоков газов FAr/FNH3,
где
FAr - удельный поток транспортного газа,
FNH3 - удельный поток реакционного газа
Далее проводят диспергирование агломератов полученных наночастиц нитрида бора методом ультразвуковой обработки. Затем осуществляют насыщение наночастиц нитрида бора противоопухолевым препаратом методом сорбции. Далее проводят промывку наночастиц нитрида бора в дистиллированной воде.
В качестве реагент-окислителей используют борную кислоту, и/или оксид магния, и/или оксид железа (II), и/или оксид олова (II), или их смеси.
Содержание оксида железа и аморфного бора в порошковой смеси выбирают из следующего соотношения, вес. %:
оксид железа - 70-91
аморфный бор - 9-30
Содержание оксида магния и аморфного бора в порошковой смеси выбирают из следующего соотношения, вес. %:
оксид магния - 65-84
аморфный бор - 16-35.
Содержание оксида олова и аморфного бора в порошковой смеси выбирают из следующего соотношения, вес. %:
оксид олова - 75-95
аморфный бор - 5-25.
Содержание оксида олова и аморфного бора в порошковой смеси выбирают из следующего соотношения, вес. %:
борная кислота - 85-92
аморфный бор - 8-15.
Содержание оксида железа, оксида магния и аморфного бора в порошковой смеси выбирают из следующего соотношения, вес. %:
оксид железа - 59-86
оксид магния - 5-12
аморфный бор - 9-32.
Содержание борной кислоты, оксида магния и аморфного бора в порошковой смеси выбирают из следующего соотношения, вес. %:
борная кислота - 65-91
оксид магния - 3-10
аморфный бор - 6-25.
Диспергирование наночастиц нитрида бора проводят при мощности 40-100 Вт в течение 30 минут.
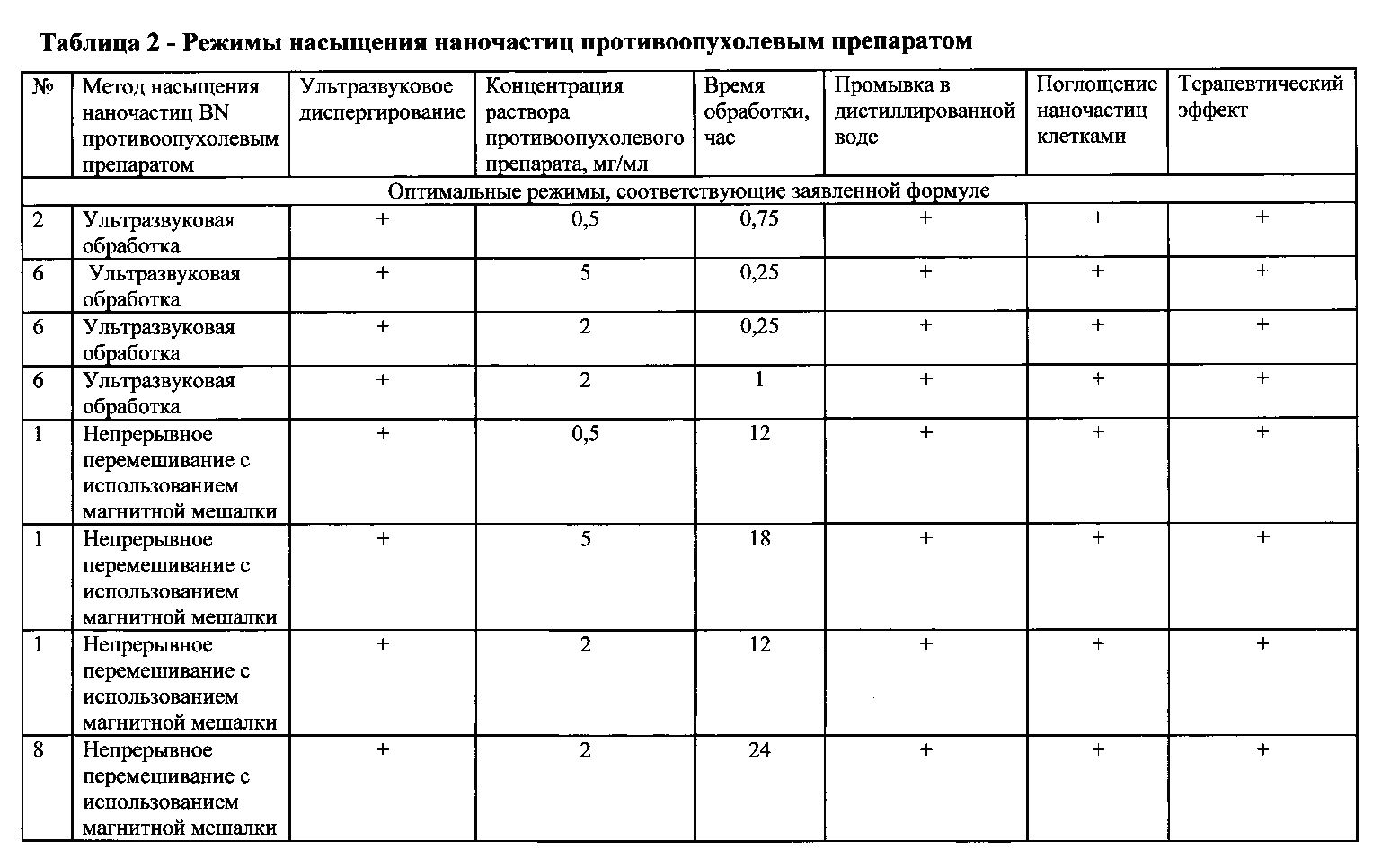
Сорбцию противоопухолевого препарата наночастицами нитрида бора осуществляют путем непрерывного перемешивания диспергированных наночастиц, помещенных в раствор противоопухолевого препарата с концентрацией 0.5-5.0 мг/мл в течение 12-24 часов с использованием магнитной мешалки при частоте вращения до 250 об/мин.
Сорбцию противоопухолевого препарата наночастицами нитрида бора могут также осуществлять путем ультразвуковой обработки диспергированных наночастиц, помещенных в раствор противоопухолевого препарата с концентрацией 0.5-5.0 мг/мл при мощности 150 Вт в течение 15-60 минут.
В качестве противоопухолевого препарата выбираются синтетические или природные противоопухолевые препараты.
В качестве синтетического противоопухолевого препарата выбирают алкилирующие или антиметаболиты или синтетические препараты других групп.
В качестве алкилирующего синтетического противоопухолевого препарата выбирают хлорэтиламины или этиленамины или производные нитрозомочевины или производные метансульфоновой кислоты.
В качестве синтетического противоопухолевого препарата группы антиметаболитов выбирают антагонисты фолиевой кислоты, или антагонисты пурина, или антагонисты пиримидина.
В качестве синтетического противоопухолевого препарата других групп выбирают проспидин, или спиразидин, или дикарбазин, или натулан, или цисплатин, или имидазолкарбоксамид.
В качестве природного противоопухолевого препарата выбирают антибиотики или средства растительного происхождения.
В качестве природного противоопухолевого препарата группы антибиотиков выбирают адриамицин, или блеомицин, или дактиномицин, или рубомицин, или брунеомицин, или митомицин С.
В качестве природного противоопухолевого препарата растительного происхождения выбирают колхамин, или винбластин, или винкристин.
Наночастицы нитрида бора с развитой наружной поверхностью представляют из себя полые сферы, покрытые многочисленными лепестками, образованными тонкими нанолистами гексагонального нитрида бора. За счет высокой пористости и увеличенной в несколько раз удельной поверхности, наноконтейнеры нитрида бора способны удерживать молекулы лекарственного препарата и обеспечивать их транспортировку в опухолевые клетки вследствие чего повышается эффективность противоопухолевой химиотерапии.
Изобретение осуществляется следующим образом.
Приготавливают порошковую смесь, состоящую из реагентов-окислителей и бора аморфного. При этом применяют следующие реактивы: борную кислоту, и/или оксид магния, и/или оксид железа (II), и/или оксид олова (II), или их смеси.
Порошок оксида магния предварительно отжигают в муфельной или трубчатой электропечи на воздухе при температуре 400°С.
Компоненты порошковой смеси взвешивают на лабораторных весах, обеспечивающих точность 0.1 мг.
Синтез сферических наночастиц нитрида бора проводят с использованием высокотемпературной установки индукционного нагрева. Тигель с порошковой смесью помещают на дно реактора из нитрида бора, который устанавливают внутри графитового нагревателя в рабочей камере установки.
Реактор представляет собой разборную цилиндрическую конструкцию с наружным диаметром 75 мм, внутренним диаметром 55 мм и высотой - 340 мм. В боковой стенке верхней части реактора сделано отверстие диаметром 3 мм для выхода синтезированных сферических наночастиц нитрида бора. Графитовый нагреватель установки отделен от стенок рабочей камеры футеровкой из углерод-углеродного композиционного материала. Конструкция установки обеспечивает подачу транспортного газа - аргона - снизу, а реакционного газа - аммиака - сверху.
Контроль размера и химического состава наночастиц осуществляется с применением сканирующего электронного микроскопа JEOL JSM-7600F (JEOL Япония) с приставкой рентгеноспектрального микроанализа.
Средний размер сферических наночастиц варьируется в интервале 50-300 нм и определяется, главным образом, рабочей температурой и величинами потоков транспортного газа (аргон) и реакционного газа (аммиак).
Температура проведения экспериментов влияет на объемную долю наночастиц нитрида бора в продуктах синтеза и их морфологию. С целью получения наночастиц нитрида бора заданного размера и морфологии в количестве более 80% (по объемной доле), синтез проводят в интервале температур порошковой смеси 1000-1430°С. При температурах ниже 1000°С рост структур нитрида бора существенно замедляется в связи с низкой скоростью реакции между бором и реагентом-окислителем, а при температурах выше 1430°С снижается объемная доля сферических наночастиц нитрида бора требуемого размера.
В результате реакции между аморфным бором и реагентом-окислителем образуются летучие оксиды бора, которые переносятся транспортным газом (аргон) в зону реакции с аммиаком, где происходит синтез наноструктур.
Соотношение потоков транспортного газа аргона и реакционного газа аммиака определяет кинетику синтеза наночастиц нитрида бора, что, в свою очередь, определяет диаметр наноструктур. Высокая объемная доля наночастиц (>80 об. %), имеющих размер 50-300 нм, получается при соотношении потоков ξ=FAr/FNH3 в диапазоне 1.2≤ξ≤8.
В случае соотношения потоков газов ξ≤1.2, поток аммиака достигает порошковой смеси, на ее поверхности образуется слой микрочастиц нитрида бора, препятствующий дальнейшему выходу газообразного оксида бора, что существенно тормозит процесс синтеза сферических наночастиц нитрида бора и резко ограничивает выход конечного продукта.
При использовании соотношения потоков газов ξ≥8, газообразный оксид бора не успевает полностью прореагировать с аммиаком, что, в свою очередь, также приводит к снижению выхода сферических наночастиц нитрида бора и образованию значительной примеси твердофазного оксида бора.
Соотношения компонентов в порошковой смеси выбирают из диапазонов, указанных выше.
При выходе за пределы указанных диапазонов, сферические наночастицы нитрида бора либо не образуются, либо происходит изменение их размера, либо наблюдается резкое снижение количества сферических наночастиц нитрида бора требуемого размера в продуктах синтеза.
Сферические наночастицы нитрида бора с развитой наружной поверхностью возникают в результате взаимодействия паров оксида бора и аммиака в ограниченном интервале температур (1000-1430°С) при определенном соотношении газовых потоков транспортного газа аргона, переносящего газообразный оксид бора и реакционного газа аммиака в процессе синтеза.
В продуктах синтеза сферические наночастицы нитрида бора часто агломерированы. Для получения суспензии, содержащей индивидуальные наночастицы нитрида бора, проводят ультразвуковое диспергирование при мощности 40-100 Вт в течение 30 минут в объеме дистиллированной воды 40 мл. Выбор мощности ультразвукового диспергатора в диапазоне 40-100 Вт обусловлен тем, что при меньшей мощности исходные агломераты наночастиц нитрида бора не разделяются на индивидуальные наночастицы, а при большей мощности наблюдаются большие потери исходного материала вследствие выплескивания раствора из емкости. Для диспергирования агломератов наноструктур нитрида бора на индивидуальные наночастицы после химического синтеза проводят обработку ультразвуком в дистиллированной воде. При времени диспергирования менее 30 минут не достигается требуемая степень разбиения агломератов, в то время как диспергирование более 30 минут может приводить к разрушению самих наночастиц.
Для придания наночастицам нитрида бора способности к деструкции опухолевых клеток их насыщают противоопухолевым препаратом.
Насыщение наночастиц нитрида бора лекарственным препаратом осуществляют методом сорбции путем непрерывного перемешивания диспергированных наночастиц в растворе лекарственного препарата с концентрацией 0.5-5.0 мг/мл в течение 12-24 часов с использованием магнитной мешалки Heidolph MR (Hei-Standard, Германия) при частоте вращения 250 об/мин. Концентрация менее 0.5 мг/мл не обеспечивает требуемого терапевтического эффекта, а при концентрации более 5.0 мг/мл суспензия наночастиц BN не сохраняется более 24 часов.
Время, необходимое для насыщения наночастиц нитрида бора лекарственным препаратом, составляет не менее 12 часов. При обработке менее 12 часов не достигается предельного насыщения наночастиц лекарственным препаратом. Обработка в течение 12-24 часов достаточна для предельного насыщения поверхности частиц противоопухолевым препаратом. Время обработки более 24 часов не приводит к дополнительной сорбции противоопухолевого препарата наночастицами.
В качестве альтернативного способа насыщения частиц лекарственным препаратом применяют ультразвуковую обработку на установке Bandelin Sonoplus HD2200, Германия при мощности 150 Вт в течение 15-60 минут.
Большая мощность и более продолжительное время обработки могут приводить к деструкции молекул противоопухолевого препарата, а значения ниже указанных диапазонов не будут обеспечивать закрепление противоопухолевого препарата на частицах нитрида бора.
Исследования биосовместимости наночастиц нитрида бора показали, что размер наночастиц 50-300 нм является оптимальным с точки зрения их дальнейшего поглощения опухолевыми клетками. Кроме того, поверхность более мелких частиц не обеспечивает транспорт достаточного количества лекарственного препарата для эффективной деструкции опухолевых клеток, а более крупные частицы не поглощаются опухолевыми клетками.
Сферические наночастицы нитрида бора с развитой наружной поверхностью обеспечивают требуемую сорбцию лекарственного препарата и его последующую доставку в опухолевые клетки.
В таблице 1 приведены варианты осуществления изобретения при различных параметрах синтеза наночастиц нитрида бора с развитой наружной поверхностью. В таблице 2 показаны варианты осуществления изобретения при различных режимах насыщения наночастиц противоопухолевым препаратом.
Пример 1
Синтез сферических наночастиц нитрида бора осуществлен методом химического осаждения из газовой фазы в высокотемпературной установке индукционного нагрева ВИН-1,6-20 (ООО Фирма «Вак ЭТО», Россия). Тигель с тщательно гомогенизированной порошковой смесью массой 10.88 г состава: оксид железа - 59 вес. %, оксид марганца - 12 вес. %, аморфный бор - 29 вес. %, размещался в реакторе установки. Рабочая камера установки прогревалась до температуры 300°С с постоянной откачкой вакуумным насосом для удаления воды и кислорода, сорбированных на поверхности компонентов рабочей камеры установки. Затем камера заполнялась аргоном до атмосферного давления. После нагрева установки до температуры 850°С в рабочую камеру установки были открыты потоки транспортного газа аргона и реакционного аммиака. После нагрева до температуры 1310°С, температура поддерживалась постоянной в течение 200 минут. После окончания синтеза рабочая камера охлаждалась до температуры 40-50°С, затем камера реактора вентилировалась воздухом и открывалась.
В результате проведенного синтеза в тигле для сбора наночастиц был получен снежно-белый рыхлый порошок в количестве 280 мг. Результаты структурных исследований с помощью просвечивающего электронного микроскопа показали, что полученный белый порошок представляет собой агломераты наночастиц нитрида бора размером 1-5 мкм. Внутри агломератов наблюдались сферические наночастицы гексагональной модификации нитрида бора с развитой наружной поверхностью размером 100-150 нм.
Получение устойчивой суспензии индивидуальных наночастиц нитрида бора с развитой наружной поверхностью осуществляли в ультразвуковом диспергаторе Sonoplus HD2200, (Bandelin, Германия). Для разделения полученных агломератов на индивидуальные наночастицы проводилась их ультразвуковая обработка в дистиллированной воде объемом 40 мл в течение 30 минут при мощности диспергатора 100 Вт. Концентрация наночастиц нитрида бора в суспензии составляла 2 мг/мл. Изучение гранулометрического состава частиц после ультразвукового диспергирования показало, что более 80% частиц имело размер 100-200 нм.
Насыщение сферических частиц нитрида бора противоопухолевым препаратом осуществлялось путем непрерывного перемешивания частиц нитрида бора в растворе препарата в течение 12 часов на магнитной мешалке Heidolph MR (Hei-Standard, Германия). Для отделения наночастиц от жидкой фазы используют центрифугу Eppendorf (Германия). Концентрация водного раствора противоопухолевого препарата, в качестве которого был использован доксорубицин, составляла 0,5 мг/мл. После насыщения противоопухолевым препаратом наночастицы нитрида бора подвергались трехкратной отмывке в дистиллированной воде и центрифугированию для удаления остатков лекарственного препарата с поверхности наночастиц.
Для оценки поглощения неопластическими клетками наночастиц, насыщенных лекарственным препаратом, использовали конфокальную микроскопию культуры клеток, окрашенных Alexa488-фаллоидином. Для оценки выживаемости неопластических клеток при воздействии наночастиц, насыщенных лекарственным препаратом, оценивали изменения динамики пролиферации трансформированных клеток при культивировании в среде с добавлением наночастиц с препаратом в течение 7 суток по сравнению с контролем с использованием флуоресцентной микроскопии и окрашивания DAPI.
Методом конфокальной микроскопии было показано, что наночастицы нитрида бора, насыщенные доксорубицином, способны проникать в трансформированные (опухолевые) клетки линии IAR-6-1. При оценке выживаемости неопластических клеток при воздействии наночастиц, насыщенных доксорубицином, было установлено, что в опухолевой клетке доксорубицин выходит из частиц, приводя к гибели клетки.
Пример 2
Подготовленная порошковая смесь массой 11.76 г состава: борная кислота - 78 вес. %, оксид марганца - 4 вес. %, аморфный бор - 18 вес. %, размещалась в реакционном тигле в реакторе установки. После предварительной очистки реактора от примесей, наполнения инертным газом, нагрева до рабочей температуры и включения потоков транспортного и реакционного газов (по методике, аналогичной описанной в примере 1), установка выдерживалась в режиме синтеза в течение 320 минут при температуре 1190°С. В результате синтеза получен снежно-белый рыхлый порошок в количестве 345 мг, представляющий собой агломераты сферических наночастиц нитрида бора размером 70-100 нм.
Ультразвуковое диспергирование проводили в дистиллированной воде в течение 30 минут при мощности 80 Вт. Концентрация наночастиц нитрида бора составляла 2 мг/мл. Оценка распределения частиц по размеру показала, что количество наночастиц и их агломератов размером более 250 нм не превышало 1%.
Насыщение наночастиц нитрида бора противоопухолевым препаратом осуществлялось путем ультразвуковой обработки наночастиц в водном растворе доксорубицина с концентрацией 5 мг/мл в течение 15 минут.
Проведенные биологические тесты с использованием трансформированных (опухолевых) клеток IAR-6-1 по методике, описанной в примере 1, показали, что клетки успешно поглощали наночастицы, насыщенные доксорубицином, что приводило к их гибели.

Реферат
Изобретение относится к области наномедицинских технологий, а именно к созданию нанотранспортеров лекарственных препаратов, и описывает способ получения наночастиц нитрида бора для доставки противоопухолевого препарата в опухолевые клетки. Способ характеризуется тем, что синтезируют сферические наночастицы нитрида бора размером 50-300 нм с развитой наружной поверхностью методом химического осаждения из газовой фазы с применением реакционного и транспортного газов, а так же порошковых смесей, состоящих из аморфного бора и реагент-окислителей, проводят диспергирование агломератов полученных наночастиц нитрида бора методом ультразвуковой обработки, насыщение наночастиц нитрида бора противоопухолевым препаратом методом сорбции и промывку наночастиц в дистиллированной воде. Способ позволяет улучшать эффективность противоопухолевой химиотерапии за счет повышения активности поглощения клетками наноконтейнеров с противоопухолевым препаратом, предотвращения токсичности наноконтейнеров для клеток. 18 з.п. ф-лы, 2 пр., 2 табл.
Формула


где
T - температура порошковой смеси, °C,
ξ - отношение удельных потоков газов FAr/FNH3,
где
FAr - удельный поток транспортного газа,
FNH3 - удельный поток реакционного газа,
последующее диспергирование агломератов полученных наночастиц нитрида бора проводят методом ультразвуковой обработки, насыщение наночастиц нитрида бора противоопухолевым препаратом осуществляют методом сорбции и далее проводят промывку наночастиц нитрида бора в дистиллированной воде.
оксид железа - 70-91
аморфный бор - 9-30.
оксид магния - 65-84
аморфный бор - 16-35.
оксид олова - 75-95
аморфный бор - 5-25.
борная кислота - 85-92
аморфный бор - 8-15.
оксид железа - 59-86
оксид магния - 5-12
аморфный бор - 9-32.
борная кислота - 65-91
оксид магния - 3-10
аморфный бор - 6-25.

Комментарии