Полимерный носитель лекарственных средств для доставки под визуальным контролем - RU2477146C2
Код документа: RU2477146C2
Чертежи






Описание
ОБЛАСТЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Изобретение относится к доставке лекарственных средств под визуальным контролем, основанной на полимерсомах в качестве носителей лекарственных средств. Конкретнее, настоящее изобретение относится к наблюдаемой или управляемой с помощью магнитно-резонансной томографии (МРТ) доставке биоактивных веществ, таких как лекарственные или диагностические средства (далее в данном описании называемые «лекарственные средства»). Кроме того, настоящее изобретение относится к основанным на химических обменных переносчиках насыщения (CEST) контрастным веществам для магнитно-резонансной томографии (МРТ), в частности к веществам, которые подходят для применения в качестве носителей лекарственных средств.
УРОВЕНЬ ТЕХНИКИ
Многие заболевания, которые в основном локализуются в определенной ткани, лечат системно вводимыми лекарственными средствами. Хорошо известный пример стандартной терапии рака представляет собой системную химиотерапию, сопровождающуюся значительными побочными эффектами для пациента вследствие нежелательного биораспределения и токсичности. Терапевтическое окно указанных лекарственных средств обычно определяется, с одной стороны, минимальной необходимой терапевтической концентрацией в больной ткани и, с другой стороны, токсическими эффектами в органах, не являющихся органами-мишенями, например в печени, селезенке. Локализованное лечение, например местное высвобождение цитостатиков из наноносителей, обещает более эффективное лечение и большее терапевтическое окно по сравнению со стандартными лекарственными средствами. Локализованная доставка лекарственных средств также важна, если другие лечебные воздействия, такие как операция, слишком рискованны, как часто случается в случае рака печени. Локализованная доставка лекарственного средства также становится предпочтительным лечебным средством для многих проявлений сердечно-сосудистых заболеваний (ССЗ), таких как атеросклероз коронарных артерий.
Магнитно-резонансная томография представляет собой важную диагностическую методику, которую, в общем случае, применяют в больницах для диагностики заболевания. МРТ позволяет получать изображение мягкой ткани неинвазивным способом с прекрасной разрешающей способностью.
В качестве успешного развития его диагностического применения, МРТ также предложено для наблюдения за доставкой биоактивных веществ, таких как лекарственные или диагностические средства. Т.е. МРТ может быть использовано не только для планирования лечения, но также для локальной доставки лекарственного средства под визуальным контролем.
В этой связи ссылкой является Ponce et al., J Natl Cancer Inst 2007; 99: 53-63. В данном документе лекарственное средство, доксорубицин, находится в термочувствительной липосоме, которая является твердой при нормальной температуре тела и плавится при повышенной на несколько градусов (41-42°С). Таким образом, высвобождение лекарственного средства можно облегчить применением тепла, так как такое нагревание вызовет открытие липосомы, вследствие чего высвобождение лекарственного средства больше не определяется диффузией (если имеется) через липосомальную оболочку. Для наблюдения за высвобождением лекарственного средства с помощью МРТ, соль марганца добавляют к композиции в качестве контрастного вещества для МРТ.
Большинство МРТ-сканирований основаны на изображении всей массы молекул воды, которые представлены в очень высокой концентрации в тканях всего тела. Если контрастность между различными тканями недостаточна для получения клинической информации, вводят МРТ-контрастные средства (КС), такие как низкомолекулярные комплексы гадолиния. Данные парамагнитные комплексы уменьшают продольное (Т1) и поперечное (Т2) время релаксации протонов молекул воды. Также ионы марганца действуют в качестве Т1 контрастного вещества.
Марганцевое контрастное средство в вышеуказанном носителе лекарственного средства будет действовать при его воздействии на молекулы воды, которая может быть определена МРТ, т.е. оно будет вызывать немедленное улучшение МРТ-контрастирования соответственно открытию липосомальной оболочки выше температуры плавления липидов после воздействия тепла.
Как описано, МРТ, применяемую в указанном процессе высвобождения лекарственного средства, действительно используют для наблюдения за текущим высвобождением, которое подтверждает, что термочувствительные липосомы действительно работают. Т.е. попросту предоставляют информацию ex post facto.
Кроме того, вышеуказанную доставку лекарственного средства осуществляют, используя липосому в качестве носителя. Липосомы, в общем случае, характеризуются липидным бислоем, заключающим в себе полость. Настоящее изобретение относится к области полимерсом, т.е. полимерных пузырьков, в частности микропузырьков и нанопузырьков. На основе полимерсом может быть достигнут ряд преимуществ по сравнению с липосомами. Полимерсомы считают менее склонными к поглощению макрофагами и, следовательно, длительно циркулирующими. Также, по сравнению с липосомами, полимерсомы более ригидны, менее подвижны и более универсальны.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Предпочтительно наблюдать за поведением носителя лекарственного средства, начиная с его введения.
Для лучшего соответствия вышеуказанному требованию в одном аспекте представлен химический обменный переносчик насыщения (CEST) контрастное вещество для магнитно-резонансной томографии (МРТ), который содержит полимерсому, снабженную парамагнитным веществом, полимерсому, включающую бислой амфифильного полимера, окружающий полость, в которой полость содержит запас протонного аналита и в которой оболочка допускает диффузию протонного аналита.
В еще одном аспекте представлен носитель лекарственного средства, приспособленный для локализованной доставки лекарственного средства, содержащий контрастное вещество для CEST МРТ, который содержит полимерсому, в частности чувствительную к условиям окружающей среды полимерсому, и лекарственное средство.
В дополнительном аспекте представлен способ для направленной МРТ доставки биоактивного средства пациенту, включающий введение носителя лекарственного средства, содержащего полимерсому, являющегося CEST МРТ-контрастным веществом, указанному пациенту, воспроизведение МР-изображения, используя CEST усиление контрастности, предоставляемое данным носителем лекарственного средства, и высвобождение биоактивного средства носителем лекарственного средства.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В широком смысле изобретение может быть описано ссылкой на основанное на полимерсоме CEST контрастное вещество, подходящее для применения в качестве носителя лекарственного средства для локализованной доставки лекарственного средства. Пригодность носителя лекарственного средства для локализованной доставки лекарственного средства может относиться к различным путям, которыми носитель лекарственного средства, нагруженный лекарственным средством, может быть активирован к высвобождению лекарственного средства локально, например, применением контролируемой внешней силы или доставкой достаточной энергии. Указанное относится, например, к носителям лекарственных средств, чувствительных к условиям внешней среды, которые могут быть активизированы для высвобождения лекарственного средства локально изменением условий окружающей среды (например, рН в случае носителей, чувствительных к рН, или применением местного тепла в случае носителей, чувствительных к температуре). Другие способы для локализованной доставки необязательно включают в себя чувствительные к рН или температуре носители и носители, которые могут быть активированы высвобождать лекарственное средство способом, обусловленным состояниями, отличными от температурной чувствительности или чувствительности к рН, включая, но не ограничиваясь наличием газообразного ядра и/или слоев, чувствительных к применению внешней ультразвуковой частоты/волны и напряжения.
CEST МРТ
Настоящее изобретение относится к усилению контрастности CEST МРТ. Данный способ служит для получения контрастного изображения, используя химический обменный переносчик насыщения (CEST), магнитно предварительно насыщенные протоны для всей массы молекул воды, определяемой МРТ.
CEST в сочетании с парамагнитным химическим сдвигающим реактивом (параCEST) представляет собой способ, в котором намагничивание пула парамагнитно смещенных протонов CEST контрастного вещества избирательно насыщают применением радиочастотного (РЧ) излучения. Перенос указанного насыщения к массе молекул воды протонным обменом приводит к уменьшению количества возбудимых протонов воды в окружающей среде CEST контрастного вещества. Следовательно, получают уменьшение интенсивности сигнала всей массы воды, что может быть использовано для создания (отрицательного) контрастного усиления в МРТ изображениях.
Подход к получению высокой эффективности CEST основан на использовании большого числа молекул воды раствора, содержащего парамагнитный сдвигающий реактив (например, Na[Tm(dotma)(H2O)]), в котором «H4dotma» означает α,α′,α″,α′″-тетраметил-1,4,7,19-тетрауксусную кислоту и dotma представляет соответствующую четвертичную депротонированную тетраанионную форму лиганда, для того, чтобы предоставить пул протонов, которые химически смещены и которые, следовательно, могут быть избирательно насыщены РЧ импульсом. Если указанная система инкапсулирована в носителе, в данном описании полимерсоме, магнитное насыщение можно перенести ко всей массе молекул воды снаружи носителей, которые не являются химически смещенными. Количество магнитного переноса, а значит степень контрастного усиления, определяется скоростью диффузии воды через оболочку носителя (т.е. скорость обмена воды), так же как и количеством воды в носителе.
Оптимальная скорость обмена воды напрямую коррелирует с разницей химического сдвига между пулом протонов внутри носителя и массой воды снаружи носителя. Парамагнитный сдвиг, который вызван на молекулах воды внутри полимерсом, состоит из двух основных составляющих: химический сдвиг, вызванный непосредственным биполярным взаимодействием между молекулами воды и сдвигающим реактивом (δдип), и химический сдвиг, вызванный эффектом магнитной чувствительности (δbms). В целом парамагнитный сдвиг представляет собой сумму этих двух факторов:
δ=δдип+δbms (1)
δbms представляет собой ноль для сферических частиц, но может быть значительным для анизотропных частиц. Несферические частицы испытывают напряжение магнитного поля, которое вызывает их выстраивание по линиям магнитного поля. В случае липосом, продемонстрировали, что в целом парамагнитный сдвиг может дополнительно быть увеличен, если липосомы переносят парамагнитные молекулы, связанные с фосфолипидной мембраной.
Ссылка на CEST, используя несферические липосомы, представляет собой Terreno, Е. et al. Angew Chem. Int. Ed. 46, 966-968 (2007).
Полимерсомы
Термин «полимерсомы», использованный в данном описании, в общем случае означает нанопузырьки или микропузырьки, содержащие бислой амфифильного полимера, который окружает полость. Указанные пузырьки предпочтительно состоят из амфифильных блок-сополимеров. Данные искусственные амфифильные вещества имеют амфифильность, схожую с амфифильностью липидов. В силу своей амфифильной природы (имеющие более гидрофильную головку и более гидрофобный хвост) блок-сополимеры будут сами по себе формировать головка-к-хвосту и хвост-к-головке двухслойные структуры, похожие на липосомы.
По сравнению с липосомами, полимерсомы имеют большую молекулярную массу, обычно в среднем от 1000 до 100000, предпочтительно от 2500 до 50000 и более предпочтительно от 5000 до 25000.
Термин «более гидрофильный» и «более гидрофобный» относительны. Т.е. оба могут быть или гидрофильным или гидрофобным, поскольку разница в полярности между блоками достаточна для образования вышеуказанных полимерсом. Однако с точки зрения образования полости, в которую легко можно ввести воду, предпочтительно для более гидрофильного конца полимера быть действительно гидрофильным.
Дополнительно, с точки зрения использования в качестве носителя лекарственного средства, желательно, чтобы также гидрофобные лекарственные средства могли быть введены в полимерсомы. Наконец, предпочтительно, чтобы гидрофобный конец полимера являлся действительно гидрофобным.
Амфифильная природа блок-сополимеров предпочтительно реализовывается в образовании блок-сополимера, включающего блок, полученный из более гидрофильных мономерных звеньев (А), и блок, полученный из более гидрофобных звеньев (В), блок-сополимер имеет общую формулу (AnBm), в которой n и m представляют собой целые числа от 5 до 5000, предпочтительно от 10 до 1000, более предпочтительно от 10 до 500. Также понятно, что одно или более дополнительных звеньев или блоков могут быть встроены в, например, звено С с промежуточной гидрофильностью, так что тройной сополимер, имеющий формулу AnCpBm, в котором n и m определены выше и p представляет собой целое число от 5 до 5000, предпочтительно от 10 до 1000, более предпочтительно от 10 до 500. Любые блоки сами могут быть сополимером, т.е. содержать различные мономерные звенья требуемой гидрофильной и, соответственно, гидрофобной природы. Предпочтительно, чтобы блоки сами являлись гомополимерными. Любые блоки, в частности более гидрофильный блок, могут иметь заряд. Количество и тип зарядов могут зависеть от рН окружающей среды. Подходит любое сочетание положительного и/или отрицательного зарядов на каких-либо блоках.
С точки зрения применимости в средствах для медицинской диагностики и лечения, предпочтительно, чтобы полимерные блоки были созданы из фармацевтически приемлемых полимеров. Примеры их представляют собой, например, полимерсомы, раскрытые в патенте США 2005/0048110, и полимерсомы, содержащие термочувствительные блок-сополимеры, раскрытые в международном патенте 2007/075502. Дополнительные ссылки на вещества для полимерсом включают WO 207081991, WO 2006080849, US 20050003016, US 2050019265 и US 6835394.
Возможно, чтобы структура, подобная полимерсоме, могла быть образована на основе блок-сополимера, такая как блок-терполимер, которая, в сущности, имеет свойства образования оболочки, окружающей полость.
В настоящем изобретении применение полимерсом облегчает получение нескольких преимуществ.
В отношении применения CEST МРТ контрастного вещества, полимерная природа оболочки ведет к возможности включать в состав различные требуемые звенья. Следовательно, например, для достижения высокого увеличения контрастности сам полимер можно сделать парамагнитным включением в его состав металлополимерных звеньев, обогащая полимерные звенья металлом или и тем и другим. Указанное относится, например, к обогащению включением лантанидсодержащих липидов в полимерсомные структуры или используя лантанидсодержащие сополимеры. Общими ссылками в отношении металлополимеров являются D. WÖhrle, A.D. Pomogailo «Metal complexes and Metals in Macromolecules» Wiley-VCH: Weinheim, 2003, и R.D. Archer «Inorganic and Organometallic Polymers» Wiley-VCH: New York, 2001. Предпочтительно металлополимер содержит один тип или разные типы парамагнитных ионов металла с высоким магнитным моментом, такие как ионы лантанидов. В частности, приемлемые лантаниды представляют собой, например, гадолиний, тербий, диспрозий, холмий, эрбий, тулий и иттербий. Ссылкой в отношении лантанидсодержащих металлополимеров является M.J. Allen, R.T. Raines, L.L. Kiessling, Journal of the American Chemical Society, 2006, 128, 6534-6535. Ион металла может быть частью полимерного скелета или может быть связан с полимерной цепочкой через линкер, соединяющий полимерную цепочку с лигандом, содержащим металл. Ссылкой в отношении подходящих инкапсулированных лигандов является Р. Caravan, J.J. Ellison, T.J. McMurry, R.B. Lauffer Chemical Reviews, 1999, 99, 2293-2352.
CEST эффект можно регулировать природой блоков сополимера и/или толщиной полимерного слоя, так как указанные параметры влияют на скорость обмена воды через мембрану; например, амфифильная природа полимера может использоваться для влияния на скорость протонного обмена через полимерсому. Указанное, в общем случае, осуществляют изменением соотношения длины более гидрофильного и более гидрофобного блоков.
По сравнению с общепринятыми липосомами, полимерсомы действительно имеют преимущества длительной циркуляции, так как они менее подвержены поглощению макрофагами.
В соответствии с изобретением применение полимерсом в CEST МРТ контрастных веществах дополнительно приводит к преимуществам, которые могут быть точно направлены, если контрастные вещества используют в качестве носителя лекарственного средства. Например, посредством большой изменчивости структуры, полимерсома может включать в состав и лекарственное средство, и парамагнитное вещество в полости полимерсомы (и, следовательно, имеет такое же одинаковое распределение лекарственного средства и парамагнитного вещества) или может включать одно из двух и создавать различное распределение лекарственного средства и вещества, например, если лекарственное средство включено в полость, а парамагнитное вещество включено в полимерную оболочку. Или, например, оно может иметь сочетание лекарственных веществ предоставлением гидрофильного лекарственного средства в полости и гидрофобного лекарственного средства в оболочке.
Полимерсомы являются полупроницаемыми. В общем случае полупроницаемость относится к свойству оболочки быть избирательно проницаемой, иногда также обозначают полупроницаемость или частичной или избирательной проницаемостью. Полупроницаемость выявляет структуру, которая в основном замкнута, в смысле, что она не является полностью разомкнутой оболочкой, и предпочтительно в основном замкнута (в данном случае оболочка охватывает полость), что позволяет некоторым молекулам или ионам проникать через нее диффузией.
Изменчивость полимерсом, т.е., в общем, свобода изменять соответствующее химическое строение сополимерных блоков, может быть использована с выгодой, если полимеры изменяют, так чтобы они были биоразрушаемыми, были чувствительными к условиям окружающей среды или и то и другое. Данное свойство будет объяснено далее ссылкой на отдельные преимущества для применения в качестве носителей лекарственных средств.
Настоящее изобретение разумно сочетает преимущества использования CEST МРТ контрастных веществ в доставке лекарственного средства с желательными свойствами полимерсом.
По сравнению с липосомами, полимерсомы химически более устойчивы, меньше допускают протекание, менее склонны мешать биологическим мембранам и менее динамичны вследствие своей низкой критической агрегационной концентрации. Указанные свойства приводят к меньшей опсонизации и к более длительному времени циркуляции.
Полимерсомы, содержащие гидролизируемые диблок-сополимеры полиэтиленгликольполиактиловой кислоты, используют в качестве системы доставки для доксорубицина, смотрите, например, Ahmed, F.; Discher, D.E. Journal of Controlled Release, 2004, 96 (1), 37-53. Высвобождение доксорубицина из указанных нагруженных полимерсом может быть активировано рН. Смотрите Ahmed, F. Et al., Molecular Pharmaceutics, 2006, 3 (3), 340-350. Устойчивость in vivo полимерсом может регулироваться для специфического применения.
Тем не менее доставка лекарственного средства может быть активирована внешним воздействием, сам по себе процесс доставки лекарственного средства не может быть изображен в способах, применимых до настоящего изобретения, что приводит к недостаточному контролю лечебного вмешательства. Например, полимерсомы, нагруженные флюорофорами, основанными на порфирине, могут быть использованы в качестве NIR-излучающего зонда для оптических изображений in vivo у крыс. Смотрите, Ghoroghchian et al. Proceeding of the National Academy of Sciences of the United States of America, 2005, 102 (8), 2922-2927.
Однако главный недостаток оптического изображения представляет собой ограниченную глубину проникновения света, который на сегодняшний день препятствует применению оптического изображения у человека. Усиление контрастности CEST, используемое в настоящем изобретении, хорошо подходит для проведения у человека in vivo МР визуализации.
Вещества согласно изобретению хорошо подходят для анализа пространственного распределения полимерсом, нагруженных биоактивным соединением, перед высвобождением лекарственного средства. Кроме того, интенсивность CEST MP сигнала соотносится с количеством высвобождаемого лекарственного средства, что обеспечивает количественный контроль доставленной дозы лекарственного средства in vivo. Высвобождение лекарственных средств из полимерсомы в месте заболевания может быть активировано стимулом (например, местным нагреванием, используя РЧ или ультразвук, рН, (ферментативным) гидролизом (биоразрушаемой) полимерной цепочки вследствие включения в ее состав диблок-сополимеров, которые ответственны за биоразрушение).
Другие преимущества изобретения включают в себя то, что усиление контрастности может быть включено и выключено по желанию. Кроме того, CEST эффект может регулироваться свойствами (биоразрушаемых) блоков сополимера и/или толщиной полимерного слоя, так как указанные параметры влияют на скорость обмена воды через мембрану. Химический сдвиг между двумя пулами протонов, т.е. пулом в полимерсоме и в окружающей среде, может быть увеличен вышеуказанным включением в состав полимерного бислоя парамагнитных соединений, например лантанидсодержащих липидов или лантанидсодержащих полимеров. В отличие от липосом, полимерсомы предоставляют дополнительное преимущество тем, что они допускают включение в состав хорошо известных металлополимеров, или обогащенных металлом полимеров, вместо только парамагнитного комплекса, на амфифильную молекулу. Указанное очень выгодно, так как химический сдвиг между захваченной водой и всей массой воды соотносится с количеством парамагнитного соединения.
Все перечисленные различные преимущества, предлагаемые настоящем изобретением, основанным на полимерсомах в качестве CEST контрастных веществ, предоставляют возможности для терапии с визуальным контролем и молекулярной МРТ.
Для дополнительно уровня техники полимерсом и их получения сделана ссылка на Antonietti et al., Adv. Mater. 2003, 15, No.16, и Soo et al. J. Pol. Sci. Part B: Polymer Physics, Vol.42, 923-938 (2004).
Носитель лекарственного средства
Носитель лекарственного средства вводят в организм пациента, подвергаемого МРТ. Введение будет выполнено инъекцией в кровоток или другими способами введения носителя в жидкости организма.
Лекарственное средство представляет собой химическое вещество, используемое в лечении, устранении, предупреждении или диагностике заболевания или расстройства, или используют для улучшения физического или душевного здоровья. Управляемая доставка, предусмотренная настоящим изобретением, будет в основном использоваться для лекарственных средств (т.е. лекарственных средств в узком смысле, предназначенных для лечения или предупреждения заболеваний и расстройств), но также для веществ, вводимых с диагностической целью. Хотя другие биоактивные вещества, т.е. те, которые не являются лечебными или диагностическими, такие как ингредиенты функциональной пищи, не будут, в общем случае, подвергаться управляемой и/или контролируемой доставке, при необходимости описываемая доставка может быть выполнена, используя настоящее изобретение.
Наиболее оптимальное применение настоящего изобретения достигается в случае нацеленных лекарственных средств, т.е. лекарственных средств, которые предназначены для направленной доставки, так как доставка будет наиболее успешной посредством осуществления наблюдения с помощью настоящего изобретения. Указанное относится, например, к лекарственным средствам в лечении опухолей, доставляемым к месту воздействия, лекарственным средствам в лечении или предупреждении сердечно-сосудистых расстройств, таких как атеросклероз коронарных артерий, или антитромботическим средствам (например, для местного растворения кровяных тромбов) или средствам, которым требуется проходить через гематоэнцефалический барьер, таких как нейромодуляторы, что может быть использовано в лечении неврологических состояний, таких как эпилепсия, болезнь Альцгеймера, болезнь Паркинсона или инсульт. Преимущества управляемой и контролируемой направленной доставки лекарственных средств могут быть также использованы для нацеленных диагностических средств. Так же как и в случае лекарственных нацеленных средств, рак представляет собой область, в которой сайт-специфическая доставка может быть важной.
Биоактивные вещества, подходящие для применения в настоящем изобретении, включают биологически активные вещества, включающие лекарственные средства, эндогенные молекулы и фармакологически активные средства, включая антитела; молекулы питательных веществ; диагностические средства; и дополнительные контрастные вещества для получения изображения. Как использовано в настоящем описании, активное вещество включает фармакологически приемлемые соли активных веществ.
Носители лекарственных средств, основанные на полимерсомах, согласно настоящему изобретению могут содержать или гидрофобные или гидрофильные биоактивные вещества. Гидрофильное биоактивное вещество будет инкапсулировано в водный компартмент носителя, или будет связано с более гидрофильной частью оболочки, или его распределение охватывает сочетание указанных частей, в то же время гидрофобные биоактивные вещества будут включены в гидрофобные домены носителя, например в оболочку полимерсомы. Нуклеиновые кислоты, углеводороды и, в общем случае, белки и пептиды являются водорастворимыми и гидрофильными. Например, также предусматриваются биоактивные вещества, которые представляют собой небольшие молекулы, липиды, липополисахариды, полинуклеотиды и антисмысловые нуклеотиды (вещества, применяемые в генной терапии). Указанные биологически активные вещества, которые могут быть включены в состав, следовательно, охватывают непептидные, небелковые лекарственные средства. В рамках настоящего изобретения возможно включить в состав лекарственные средства полимерной природы, но также возможно включить в состав лекарственные средства относительно маленькой молекулярной массы, менее чем 1500 г/моль или даже меньше чем 500 г/моль.
Соответственно соединения, предназначенные для применения в качестве биологически активных веществ в контексте настоящего изобретения, включают любое соединение с лечебным или профилактическим эффектом. Оно может быть соединением, которое влияет или принимает участия в росте тканей, клеточном росте, клеточной дифференцировке, соединением, которое способно осуществлять биологическое воздействие, такое как иммунный ответ, или соединением, которое может играть любую другую роль в одном или более биологических процессах.
Относительно небольшие пептиды могут относиться к ряду аминокислот (например, ди-, три-, тетрапептиды). Пептид с относительно маленьким числом амидных связей, который также может называться олигопептидом (до 50 аминокислот), в то же время пептид с относительно большим числом (более чем 50 аминокислот) могут также называться полипептидом или белком. В добавление к полимеру из аминокислотных остатков, некоторые белки могут дополнительно отличаться так называемой четвертичной структурой, конгломератом ряда полипептидов, которые необязательно связаны амидными связями, но связаны силами, в общем случае, известными специалистам в области техники, как электростатические силы или силы Вандерваала. Термин пептиды, белки или их смеси, использованный в данном описании, включает все вышеуказанные возможности.
Обычно белок и/или пептид выбирают, исходя из его биологической активности. В зависимости от типа выбранного полимера, продукт, полученный в настоящем способе, очень подходит для контролированного высвобождения белков или пептидов. В отдельном варианте осуществления белок или пептид представляют собой фактор роста.
Другие примеры пептидов, или белков, или молекул, содержащих пептиды или белки, которые могут преимущественно содержаться в нагруженном полимере, включают, но не ограничиваются перечисленным, иммунные пептиды и иммунные белки.
В отличие от биоактивных веществ, которые растворимы в воде, другие водорастворимые соединения могут быть включены в состав, такие как антиоксиданты, ионы, хелатирующие вещества, красители, вещества для получения изображения.
Предпочтительными лекарственными средствами являются лекарственные средства, применяемые для лечения рака (например, противоопухолевые) и сердечно-сосудистых заболеваний.
Способы получения липофильных производных лекарственных средств, которые подходят для образования наночастиц или полимерсом, известны в области техники (смотрите, например, патент США 5534499, описывающий ковалентное соединение лекарственных средств к цепи жирной кислоты фосфолипида). Лекарственные средства в настоящем изобретении могут также быть пролекарствами.
Лекарственное средство может быть представлено во внутреннем, наружном или обоих компартментах носителя, например в полости и/или в оболочке полимерсомы. Распределение лекарственного средства представляет собой распределение, независимое от других лекарственных средств, содержащихся в носителе лекарственного средства, таких как парамагнитный химический сдвигающий реактив или парамагнитное вещество. Сочетание лекарственных средств может быть использовано, и любое из указанных средств может быть представлено во внутреннем, наружном или обоих компартментах носителя, например в полости и/или в оболочке полимерсомы.
Носители, чувствительные к условиям окружающей среды
Это относится, например, к полимерсомам, имеющим полимерную оболочку, на целостность которой можно влиять внешними воздействиями, например нагреванием, рН, полимерсомам, содержащим газообразное ядро и/или газообразные слои, полимерсомам, которые чувствительны к внешнему применению ультразвуковых частот/волн и напряжения. Указанные полимерсомы могут быть активированы высвобождать лекарственное средство (высвобождение которого может мониторироваться действием CEST эффекта), когда и где требуется, применением соответствующих условий окружающей среды. Кроме того, указанное может применяться для высвобождения лекарственного или диагностического вещества (и мониторировать высвобождение) на месте в организме, действительно имеющем соответствующие условия. В качестве примера указанного условия сделана ссылка на снижение, в общем случае, рН в опухолевых клетках.
Чувствительность к условиям окружающей среды может также относиться к полимерам, которые являются биоразрушаемыми. Указанное может быть использовано, например, для образования CEST МРТ контрастных веществ, в особенности к носителям лекарственных средств, основанных на них, которые имеют предопределенный период жизни в условиях, обнаруженных в человеческом организме. В конце периода существования они будут разрушаться, и в результате CEST эффект пропадает и не будет проявляться (таким образом, позволяя непрямое определение разрушения носителя лекарственного средства).
Изобретение предпочтительно предоставляет носители, которые термочувствительны. Это означает, что физическое или химическое состояние носителя зависит от его температуры.
Любой термочувствительный носитель, представляющий собой полимерсому, согласно вышеприведенному определению, который может содержать интересующую молекулу и который интактен при температуре тела (т.е. 37°С), но разрушается при любой другой температуре, отличной от температуры тела, которая безразлична для пациента, может быть использован. Носители согласно изобретению включают, но не ограничиваются перечисленным, термочувствительные полимерсомы, в частности термочувствительные нанопузырьки, основанные на полимерах.
Термочувствительные нанопузырьки, в общем случае, имеют диаметр до 100 нм. В контексте настоящего изобретения пузырьки больше чем 100 нм, обычно до 5000 нм, относят к микропузырькам. Слово «пузырек» описывает любой тип микро- и нанопузырьков. Термочувствительные наносферы включают, но не ограничиваются перечисленным, сферы, которые не меньше чем 5 нанометров. Термочувствительные полимерсомы включают полимерсомы, имеющие удлиненный период полужизни, например PEGилированные полимерсомы.
В настоящем описании полупроницаемость оболочки, в общем случае, относится к ее способности позволять МР аналиту проникать через нее диффузией. Однако если сочетание аналита (такого как вода или другие маленькие молекулы, содержащие протоны) и оболочки (такой как амфифильный полимерный бислой) такое, что аналит может проникать через оболочку диффузией, в то же время другие молекулы, такие как вещество химического сдвига или гидрофильное лекарственное средство, не могут проходить мембрану.
Ссылки на чувствительные к условиям окружающей среды носители, имеющие полупроницаемую оболочку, представляют собой патенты США 6726925, США 2006/0057192, США 2007/0077230 А1 и Японии 2006-206794. Дополнительные ссылки представляют собой, в частности, Ahmed, F.; Discher, D. E. Journal of Controlled Release, 2004, 96 (1), 37-53; to Ahmed, F.; Pakunlu, R. I.; Srinivas, G.; Brannan, A.; Bates, F.; Klein, M. L.; Minko, Т.; Discher, D. E. Molecular Pharmaceutics, 2006, 3 (3), 340-350; and to Ghoroghchian, P. P.; Frail, P. R.; Susumu, K.; Blessington, D.; Brannan, A. K.; Bates, F. S.; Chance, В.; Hammer, D. A.; Therien, M. J. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102 (8), 2922-2927. Исходя из описания настоящего изобретения, ссылка на указанные раскрытия даст возможность специалисту в области техники осуществить усиление контрастности CEST, используя полимерсомы, чувствительные к условиям окружающей среды.
Термочувствительные полимерсомы для использования в настоящем изобретении идеально сохраняют свое строение при приблизительно 37°С, т.е. при температуре человеческого тела, но разрушаются при более высокой температуре, предпочтительно только слегка выше температуры человеческого тела и предпочтительно также выше пирексической температуры. Обычно приблизительно 42°С представляют собой оптимальную температуру для индуцированной температурой (локальной) доставки лекарственного средства. Нагревание может быть применено любым физиологически приемлемым образом, предпочтительно используя сфокусированный пучок энергии, способный вызывать точно локализованную гипертермию. Энергия может быть предоставлена, например, микроволнами, ультразвуком, магнитной индукцией, энергией инфракрасного излучения или световой энергией.
Захват лекарственного средства или другого биологически активного вещества в полимерсомах согласно настоящему изобретению может быть также осуществлен любым общепринятым способом в области техники. В получении полимерсомальных композиций согласно настоящему изобретению могут быть использованы стабилизаторы, такие как антиоксиданты и другие добавки, до тех пор, пока они не противоречат цели изобретения. Примеры включают сополимеры N-изопропилакриламида (Bioconjug. Chem. 10: 412-8 (1999)).
Полимерсомы будут в общем случае сферическими. Для применения в настоящем изобретении предпочтительно сделать такие сферические носители несферическими. В случае полимерсом указанное осуществляют, подвергая полимерсомы процессу диализа против гипертонического буферного раствора, следовательно, буферный раствор с более высокой осмолярностью по сравнению с раствором внутри полимерсом. Диализ вызывает результирующую диффузию воды из полимерсом в основную массу раствора. Указанное снижает общий внутренний объем полимерсом. Так как поверхностная площадь полимерсом остается постоянной, уменьшение объема деформирует полимерсомы, и полимерсома принимает несферическую форму, такую как дискоообразная, сигарообразная или любая другая несферическая форма.
Парамагнитный химический сдвигающий реактив
В настоящем изобретении парамагнитный сдвигающий реактив или реактивы могут быть включены каким-либо образом в или на носитель. Предпочтительно иметь сдвигающий реактив в существенном взаимодействии с пулом протонов, включая и реактив и пул в полость носителя.
Парамагнитный сдвигающий реактив или реактивы могут в основном быть любым парамагнитным веществом, подходящим для того, чтобы приводить относительно большое количество молекул воды раствора или дисперсии, в которых он содержится, в пул протонов, которые химически сдвигаются в соответствии с их МР частотой, в отношении окружающих протонов массы молекул воды. В качестве полимерсом, содержащих оболочку, которые в основе допускают обмен протонов непосредственно с окружающей средой, насыщение, вызванное отдельным радиочастотным импульсом, будет перемещаться к окружающей среде нагруженных термочувствительных носителей лекарственных средств. Следовательно, на основании проведения магнитно-резонансной томографии непосредственные окружающие условия термочувствительных носителей лекарственных средств будут демонстрировать уменьшение интенсивности сигнала по сравнению с массой молекул воды других областей и, следовательно, позволять определить непосредственное окружение контрастных веществ, вследствие снижения интенсивности сигнала. Парамагнитный химический сдвигающий реактив содержит парамагнитное соединение, т.е. любое соединение, обладающее парамагнитными свойствами. Предпочтительно парамагнитное соединение содержит ионы парамагнитного металла, например ионы металла, образующие комплекс с хелатными лигандами. Ионы парамагнитных металлов известны специалисту в области техники и не нуждаются в объяснении в настоящем описании. Например, ранние и поздние переходные металлы, однозначно включающие хром, марганец, железо, также включают лантаниды, такие как гадолиний, европий, диспрозий, гольмий, эрбий, тулий, иттербий.
Парамагнитный химический сдвигающий реактив содержит хелатообразующую структуру, способную прочно связывать парамагнитный металл и позволяющую металлу взаимодействовать с водой или с другим подходящим источником протонов. В отношении подходящих хелатообразующих структур сделана ссылка на P. Caravan et al., Chem. Rev., 99, 2293-2352 (1999). Предпочтительно вода по меньшей мере кратковременно координируется к металлу парамагнитного реактива. В отношении механизмов парамагнитного сдвига сделана ссылка на J.F. Peters et al., Prog. Nucl. Magn. Reson. Spectr., 28, 283-350 (1999). В одном варианте осуществления хелатообразующая структура сама также содержит способные к обмену протоны, например гидрокси, аминные или амидные протоны.
Приемлемо, парамагнитный химический сдвигающий реактив содержит ион лантанида, координируемый хелатообразующей структурой, например макроциклическими хелатами лантанидов(III), полученными из 1,4,7,10-тетраазациклододекана-1,4,7,10-тетрауксусной кислоты (H4dota), 1,4,7,10-тетраазациклододекана-α,α′,α″,α′″-тетраметил-1,4,7,10-тетрауксусной кислоты (H4dotma) и относящимися к лигандам, которые позволяют аксиально координировать молекулу воды в парамагнитном реактиве. В этом отношении сделана ссылка на Aime et al., Angew. Chem. Int. Ed., 44, 5513-5515 (2005). Несколько одинаковых или различных хелатообразующих звеньев могут сочетаться в разветвленные или пролимерные структуры, предоставляя разветвленные или полимерные химические сдвигающие реактивы. Общим преимуществом применения разветвленных или полимерных парамагнитных соединений является то, что могут быть достигнуты высокие эффективные концентрации комплекса парамагнитного металла в отсутствие повышения осмолярности раствора, так как это происходит в случае, если используются одноядерные парамагнитные соединения. Здесь сделана ссылка на E. Terreno, A. Barge, L. Beltrami, G. Cravotto, D.D. Castelli, F. Fedeli, B. Jebasingh, S. Aime, Chemical Communications, 2008, 600-602.
Предпочтительно парамагнитные химические сдвигающие реактивы растворимы в воде. Подходящие парамагнитные химические сдвигающие реактивы известны специалисту в области техники. CEST контрастные вещества не требуют какого-либо специфического химического сдвигающего реактива до тех пор, пока сдвигающий реактив и пул протонов имеют достаточное взаимодействие, приводя к существованию пула химически смещенных протонов.
Предпочтительно парамагнитный химический сдвигающий реактив представляет собой комплекс металла, содержащий ион металла и лиганд, который основан на полидентатном хелатообразующем лиганде. Более предпочтительно взаимодействие химического сдвигающего реактива с пулом протонов обеспечивается в форме координации. Следовательно, предпочтителен комплекс металла, имеющий, по меньшей мере, один координационный центр металла, остающийся открытым для координирования, по меньшей мере, одной молекулы воды.
Примерами подходящих химических сдвигающих реактивов являются [Ln(hpdo3a)(H2O)] (1), [Ln(dota)(H2O)]- (2), [Ln(dotma)(H2O)]- (3), [Ln(dotam)(H2O)]3+ (4) и [Ln(dtpa)(H2O)]2- (5), включая их производные и родственные соединения, в которых Ln представляет собой ион лантанида.
Предпочтительные парамагнитные химические сдвигающие реактивы представляют собой комплекс, такой как комплексы в формулах 1-5, приведенные далее:



в которых лантаниды представляют собой Eu3+, Dy3+, Ho3+, Er3+, Tm3+, Yb3+ и предпочтительно представляют собой Tm3+ и Dy3+.
Парамагнитный химический сдвигающий реактив обычно содержится в веществе в количестве от 1 мМ до 2000 мМ, предпочтительно от 10 мМ до 1000 мМ и более предпочтительно от 50 мМ до 200 мМ.
Вышеуказанные содержащие металл соединения могут быть растворены, эмульгированы, суспендированы или могут быть в любой другой форме однородно или неоднородно распределены в полости, т.е. во внутреннем компартменте, полимерсомы. Они могут быть, в качестве альтернативы, связаны с внешним компартментом полимерсомы, по меньшей мере, одной ковалентной или нековалентной связью или представлять собой сочетание вышеперечисленного. Кроме того, такое же или, по меньшей мере, одно отличающееся содержащее металл соединение может быть одновременно представлено в любом из компартментов.
Можно предположить, что парамагнитное вещество и лекарственное средство представляют собой одно и то же, если лекарственное средство само содержит соответствующий металл.
Дополнительные вещества для увеличения контрастности
Контрастные вещества согласно изобретению могут содержать Т1, Т2 или Т2* уменьшающие вещества. В данном отношении сделана ссылка на Aime et al., Journal of American Chemical Society, 2007, 129, 2430-2431. Таким образом реализуется концепция «все в одном» для Т1, Т2 или Т2* и CEST контрастных веществ.
Разница химического сдвига между внутренними протонами и всей массой протонов воды термочувствительных носителей лекарственных средств может быть дополнительно увеличена обеспечением мембраны термочувствительных носителей лекарственных средств дополнительным парамагнитным веществом, которое необязательно представляет собой химический сдвигающий реактив. Таким образом, влияют на ориентацию несферического носителя в магнитном поле и усиливают вышеуказанную магнитную восприимчивость. Дополнительное парамагнитное вещество предпочтительно представляет собой амфифильное соединение, содержащее лантанидный комплекс (на более полярной стороне амфифильного соединения) и имеющее неполярный хвост, который имеет тенденцию предпочтительно интегрировать и соединяться с липидным бислоем на поверхности термочувствительного носителя лекарственного средства, исходя из взаимодействий гидрофобных молекул.
Указанные амфифильные парамагнитные комплексы могут быть, например:





Полимерная природа оболочки полимерсом приводит к возможности сам полимер сделать парамагнитным, включая в его состав металлополимерные звенья, обогащая полимерные звенья металлом, или и тем и другим. Указанное относится, например, к увеличению включая основанные на лантаниде липиды в структуру полимерсомы, или используя основанные на лантаниде сополимеры в качестве обрисованного выше.
Ион лантанида в необязательном парамагнитном веществе, связанном с мембраной, может быть одинаковым или различающимся с лантанидом в полости контрастного вещества.
Как предоставлено по настоящему изобретению, парамагнитный химический сдвигающий реактив может входить в термочувствительные носители лекарственных средств. Таким образом, получается пул протонов воды, которые имеют различный химический сдвиг по сравнению со сдвигом всей массы воды, окружающей носители. Магнитный резонанс таких химически смещенных протонов воды может быть насыщен импульсом РЧ ограниченной широты. Так как молекулы воды внутри контрастного вещества быстро обмениваются с молекулами всей массы воды, окружающей контрастные вещества, указанное насыщение переносится ко всей массе воды.
Следовательно, при применении на практике при локализации CEST контрастного вещества, основанного на термочувствительных носителях лекарственных средств, окружающая вода (т.е. жидкости организма в предпочтительном применении in vivo) будет визуализироваться в виде областей низкой интенсивности в CEST-усиленной МРТ. При CEST-усиленной МРТ имеется в виду общепринятая МРТ, перед намагничиванием способная обмениваться вода резонанса избирательно насыщается. Радиочастотный импульс, используемый для насыщения, обычно имеет ширину полосы от нескольких герц до нескольких сотен герц. Соответствующую частоту импульса обычно изучают на модели или в преклинических CEST-МРТ исследованиях, но она может быть также оптимизирована во время текущего клинического исследования МРТ.
Таким образом, носители согласно настоящему изобретению определяют посредством МРТ в какой-либо временной точке до того, как носитель раскроется. Если они дополнительно содержат Т1 и Т2 контрастные вещества, также можно определить стадию высвобождения лекарственного средства, исходя из раскрытия носителя (CEST увеличение контрастности будет действовать до тех пор, пока оболочка замкнута и обмен насыщенных протонов может осуществляться диффузией), Т1 и Т2 усиление контрастности будет наблюдаться как действие, когда указанные контрастные вещества способны взаимодействовать со всей массой воды (т.е. жидкостью организма, если указанные вещества высвобождаются через разомкнутую оболочку).
CEST контрастные вещества по изобретению могут использоваться различным образом. Их можно применять для получения требуемого уровня контрастности при МРТ в любом водном пространстве. Их основное применение, которое также имеет преимущества использования термочувствительных носителей лекарственных средств, представляет собой получение локальной МРТ контрастности в результате применения in vivo. Указанное может осуществляться введением контрастных веществ, например, инъекцией в кровь или другую жидкость организма живого пациента, предпочтительно человека, и выполнением МРТ организма, целиком или частично, с CEST усиленной контрастностью. Полученная контрастность, усиленная CEST, всей массы молекул воды обеспечивает визуализацию областей, таких как опухоли, в которых нарушено нормальное содержание воды. Также контрастные вещества согласно изобретению, в своей липидной оболочке, могут быть обеспечены специфическими для заболевания молекулярными зондами, например, имеющими соединения, обладающие гидрофобным хвостом, подходящим для проникновения в поверхность носителя (например, в случае фосфолипидной поверхности), в которых другой конец соединения содержит требуемый лиганд (т.е. биохимический лиганд для направленного связывания).
Указанные молекулярные зонды позволяют контрастным веществам предпочтительно локализоваться в требуемых или предполагаемых местах тела, которые затем визуализируют МРТ. Данное свойство увеличивает пригодность носителей лекарственных средств согласно изобретению для локализованной доставки.
CEST контрастные вещества согласно изобретению предпочтительно действуют, исходя из пула протонов в носителе, которые обмениваются с жидкостью снаружи носителя. Данный обмен может быть выполнен переносчиком протонов воды, но также и переносчиком протонов из других молекул, маленьких достаточно, чтобы проходить оболочку полимерсомы.
Таким образом, описанные ранее основанные на химических обменных переносчиках насыщения (CEST) контрастные вещества для магнитно-резонансной томографии (МРТ), содержащие полимерсомы, предоставлены с парамагнитным веществом. Полимерсома предпочтительно содержит полимерную оболочку, заключающую полость, в которой полость содержит пул протонного аналита, и в которой оболочка допускает диффузию протонного аналита. Основанные на полимерсомах CEST МРТ контрастные вещества подходят в качестве носителей лекарственных средств, используемых в направляемом МРТ высвобождении лекарственного средства.
Понятно, что настоящее изобретение не ограничивается вариантами осуществления и формулами, описанными ранее. Также понятно, что в формуле изобретения слово «содержащий» не исключает других элементов и стадий. Когда используют формы слова, относящиеся к существительному единственного числа, они включают и множественное число, если специально не указано иначе.
Изобретение будет проиллюстрировано далее ссылкой на неограничивающий пример и сопровождается неограничивающими фигурами.
ПРИМЕР
Аббревиатуры, применяемые в примере, не использованные на протяжении вышеизложенного описания: PBD представляет собой поли(бутадиен), РЕО представляет собой поли(этиленоксид), HEPES представляет собой 4-(2-гидроксиэтил)-1-пиперазин этансульфоновой кислоты.
Получают полимерные пузырьки со средним диаметром 100-150 нм методикой тонкопленочного гидрирования с последующей экструзией. Коротко, поли(бутадиен(1,2-добавка)-b-этиленоксид) с Mn(г/моль): PBD(2500)-b-PEO(1300), PD=1,04 и fEO=0,34 растворяют в CHCl3. Осторожно удаляют растворитель при пониженном давлении и получают тонкую полимерную пленку. Пленку гидрируют в 20 мМ растворе HEPES, содержащем 65 мМ [Tm(hpdo3a)(H2O)] и 5 мМ карбоксифлюоресцеина. Получают монодисперсное распределение полимерных пузырьков после обработки ультразвуком при температуре 50°С в течение 30 минут, последующих трех циклов заморозки-оттаивания в вакууме, используя жидкий азот при -177°С и водяную баню при 50°С. Затем дисперсию подвергают экструзии несколько раз через поликарбонатные фильтры с диаметром пор 1 мкм, 0,4 мкм, 0,2 мкм и 0,1 мкм. Средний радиус полимерсом измеряют динамическим рассеиванием света. Форму пузырьков блок-сополимера исследуют криотрансмиссионной электронной микроскопией. Полученные полимерсомы подвергают диализу на протяжении ночи при 4°С для удаления карбоксифлюоресцеина и [Tm(hpdo3a)(H2O)], не захваченного после гидрирования липидной пленки. Диализ выполняют против буфера с высокой ионной силой (20 мМ HEPES буфер, содержащий 0,3 М NaCl). CEST эффект полимерсом с [Tm(hpdo3a)(H2O)] внутри исследуют в виде функции сдвига частоты насыщения (фиг.3), в виде функции силы РЧ насыщения (фиг.4), как функцию времени (фиг.5) и как функцию концентрации Triton X-100 (фиг.6). Для указанной цели 5 мм стеклянную ЯМР пробирку наполняют 0,5 мл композиции полимерсом. Все CEST-МР данные записывают при 7 Тесла на спектрометре Bruker A Avance 300 NMR, используя стандартное непрерывное облучение (длительность импульса 2 секунды; постоянная амплитуда) для избирательно предварительно насыщенного обменного протонного резонанса. Обычно 117 отдельных одномерных1Н-МР спектров получают при различных значениях сдвига частоты предварительного насыщения (100 Гц интервалы до 1000 Гц, затем 200 Гц интервалы до 4000 Гц, затем 400 Гц интервалы до 10000 Гц и 600 Гц интервалы до 20200 Гц), основанных на резонансной частоте воды, и хранят в едином 2D NMR наборе данных. Для реконструкции Z-спектра сигнал воды каждого отдельного спектра в 2D наборе данных объединяют и строят график в виде функции сдвига частоты предварительного насыщения. Из Z-спектра определяют CEST эффект, используя уравнения 1 и 2


в которых Ms представляет собой контрастность всей массы воды после насыщения РЧ импульсом, применяемого при определенном сдвиге частоты (например, резонансная частота протонного обмена контрастного вещества). M0 представляет собой контрастность всей массы воды базисного эксперимента, в котором импульс радиочастотного насыщения наносят симметрично на противоположной стороне сигнала массы воды для коррекции неизбирательного насыщения, например прямого насыщения воды. М∞ представляет собой контрастность всей массы воды при бесконечной частоте сдвига (-200 кГц).
ФИГУРЫ
Фиг.1 представляет собой схематическое представление CEST МРТ контрастных веществ, основанных на полимерсомах. Инкапсулирование парамагнитного химического сдвигающего вещества, такого как [Tm(hpdo3a)(H2O)], предоставляет пул протонов, которые химически смещены и которые, следовательно, могут быть избирательно насыщены радиочастотным импульсом (фиг.1а). Магнитное насыщение может быть перенесено ко всей массе молекул воды снаружи полимерсомы, и, следовательно, степень контрастного усиления определяется скоростью диффузии воды через полимерный бислой, а также количеством воды в полости полимерсомы (фиг.1b).
Фиг.2 представляет собой схематическое представление полимерсом для визуально направляемой доставки лекарственного средства. Гидрофильные лекарственные средства и радиоактивное средство инкапсулированы в водный компартмент. Гидрофобные лекарственные средства включены в состав гидрофобного домена полимерного бислоя.
Фиг.3 представляет Z-спектры полимерсом, нагруженных 65 мМ [Tm(hpdo3a)(H2O)] в буферном растворе (20 мМ HEPES, рН 7,4) после применения предварительно насыщающей силы различных уровней при 310 К и 7 Т (слева). CEST эффект напротив уровня силы (справа). Эффект химического обмена воды в полости полимерсомы и всей массы молекул воды может быть получен из расчета (М0-MS)/М∞·100% (уравнение 1), в котором MSпредставляет собой магнитуду сигнала протонов воды после насыщения воды внутри полимерсомы, М0 представляет собой контрастность сигнала протонов воды при контрольном облучении при противоположной частоте сдвига и М∞ представляет собой магнитуду сигнала протонов воды после насыщения при частоте сдвига -200 кГц.
Фиг.4 демонстрирует CEST эффект полимерсом, нагруженных [Tm(hpdo3a)(H2O)] в виде функции уровня мощности при 310 К и 7 Т. Эффект химического обмена между водой в полости полимерсомы и массой молекул воды может быть получен из расчета (М0-MS)/М∞·100% (уравнение 1) и (М0-MS)/М0·100% (уравнение 2), в котором MSпредставляет собой магнитуду сигнала протонов воды после насыщения воды внутри полимерсомы, М0 представляет собой контрастность сигнала протонов всей массы воды при контрольном облучении при противоположной частоте сдвига и М∞ представляет собой магнитуду сигнала протонов воды после насыщения при частоте сдвига -200 кГц. Для сравнения с фиг.3: 44 дБ~9,6Е-6 Т; 48 дБ~6,4Е-6 Т; 52 дБ~1,2Е-6 Т.
Фиг.5 демонстрирует CEST эффект CEST МРТ контрастных веществ, основанных на полимерсомах при 323 К и уровне мощности 44 дБ. CEST эффект (в соответствии с уравнением 1) против частоты сдвига (слева). Максимальный CEST эффект в виде функции времени (слева).
Фиг.6 демонстрирует CEST эффект полимерсом, нагруженных [Tm(hpdo3a)(H2O)] в присутствии Triton X-100 при 323 К. CEST эффект снижает, исходя из более высоких концентраций Triton X-100, выявляя высвобождение [Tm(hpdo3a)(H2O)] из полимерсомы. Кроме того, частота сдвига химически смещенной воды внутри полимерсом уменьшается в виде функции концентрации Triton X-100 (справа).
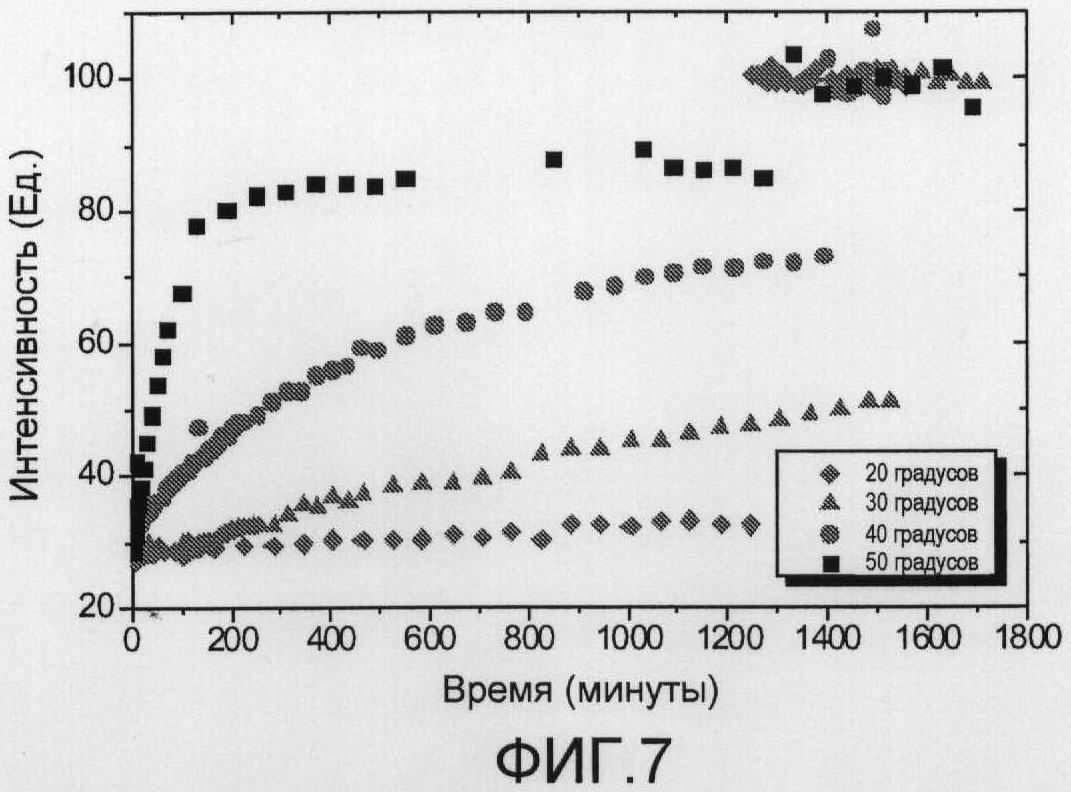
Фиг.7 выявляет нормализованную яркость флюоресценции полимерсом, нагруженных 5 мМ карбоксифлюоресцеина и 65 мМ [Tm(hpdo3a)(H2O)] в буферном растворе (20 мМ HEPES, 0,3 н. NaCl, и рН 7,4) при различных температурах (λex=488 нм и λem=512 нм). При 20°С нормализованная яркость флюоресценции представляет собой постоянную величину на протяжении времени и полученное самозатухание флюоресценции. При добавлении Triton X-100 (после 1240 минут) флюоресцентный образец высвобождается из полимерсомы и растворяется в окружающей среде, и возрастает яркость флюоресценции, следовательно, получают отсутствие самозатухания карбоксифлюоресцеина. При высоких температурах яркость флюоресценции возрастает на протяжении времени, и при 50°С насыщение флюоресцентного сигнала определяют после 6 часов. Хотя сигнал возникает при насыщении при 50°С, добавление Triton X-100 вызывает дополнительное увеличение флюоресценции.
Реферат
Изобретение относится к контрастному веществу для магнитно-резонансной томографии (МРТ), основанному на химическом обменном переносчике насыщения (CEST). Контрастное вещество содержит полимерсому, обеспеченную парамагнитным веществом, и бислой амфифильного блок-сополимера или терполимера, заключающего полость. В указанной полости находится пул протонного аналита, содержащий воду. Парамагнитное вещество представляет собой парамагнитный химический сдвигающий реактив, включающий металлический комплекс, имеющий ион металла и мультидентатный хелатообразующий лиганд, в котором оболочка допускает диффузию протонного аналита. Изобретение также относится к носителю лекарственного средства, содержащему указанное контрастное вещество, который приспособлен для локализованной доставки лекарственного средства. Также заявлен способ для направленной МРТ доставки биоактивного средства пациенту, который включает стадии введения носителя лекарственного средства, выполнение МРТ, используя усиление контрастности CEST, и предоставление возможности носителю лекарственного средства высвободить биоактивное вещество. Изобретение обеспечивает увеличение контрастности, увеличенное время циркуляции и меньшую склонность к поглощению макрофагами. 4 н. и 5 з.п. ф-лы, 7 ил., 1 пр.

Комментарии