Композиции липидных везикул и способы применения - RU2595872C2
Код документа: RU2595872C2
Чертежи










Описание
Родственные заявки
По настоящей заявке в соответствии со статьей 35 U.S.С.§ 119(е) испрашивается приоритет предварительной заявки на выдачу патента США с серийным №61/315485 под названием «Микро- и наночастицы с самособирающимися липидными покрытиями для визуализации поверхности лекарственных средств, таких как вакцинные антигены и адъюванты», поданной 19 марта 2010 г., а также предварительной заявки на выдачу патента США с серийным №61/319709 под названием «Сшитые между бислоями многослойные везикулы», поданной 31 марта 2010 г., каждая из которых включена в настоящий документ полностью посредством ссылки.
Финансируемое из федерального бюджета исследование
Настоящее изобретение создано при государственной поддержке в форме гранта №СА140476 от NIH, а также гранта №W911NF-07-D-0004 от Министерства обороны. Правительству принадлежат определенные права на настоящее изобретение.
Уровень техники
Липосомы широко использовались в качестве носителя для доставки малых молекул; однако, по-прежнему трудно достичь высоких уровней инкапсуляции в липосомах для многих макромолекулярных лекарственных средств, и многие лекарственные составы истекают из липосом слишком быстро, чтобы обеспечить подходящие кинетические характеристики доставки лекарственного средства. Несмотря на то, что при доставке лекарственного средства микро- и наночастицы могут инкапсулировать белки и низколекулярные лекарственные средства, все же, как правило, это дает очень низкую общую массу инкапсулированного лекарственного средства на массу частицы, обычно порядка ~10 мкг лекарственного средства/мг частиц. Кроме того, органические растворители, используемые в синтезе полимерных частиц, и гидрофобная/кислотная среда в этих частицах могут привести к разрушению терапевтических средств (см. Zhu et al. Nat. Biotechnol. 2000 18:52-57).
Сущность изобретения
Настоящее изобретение относится к новым и оригинальным системам доставки лекарственного средства с более высокой загрузочной возможностью, способностью связывать высокие уровни и гидрофобных, и гидрофильных средств одновременно и с более длительными профилями высвобождения. Некоторые аспекты этих систем доставки предусматривают стабилизированные многослойные липидные везикулы, имеющие сшитые липидные бислои (названные в настоящем документе сшитыми между бислоями многослойными везикуламы или ICMV).
Как показано в примерах, везикулы в соответствии с настоящим изобретением обладают неожиданно улучшенной эффективностью инкапсуляции (например, в некоторых случаях, в 100 раз более эффективны, чем простые липосомы), и они способны высвобождать инкапсулированные (или иным образом удерживаемые) средства посредством кинетических характеристик замедленного и длительного высвобождения, даже в присутствии сыворотки крови, благодаря чему они хорошо подходят в качестве носителей для доставки с длительным высвобождением in vivo. Более того, как более подробно описано в настоящем документе, везикулы в соответствии с настоящим изобретением могут быть синтезированы в водных средах, что позволяет избежать жестких условий, которые характерны для различных способов предшествующего уровня техники, предусматривающих применение органических растворителей и/или кислотных сред. В результате такие способы синтеза являются более приемлемыми для ряда средств, в том числе тех, которые, как правило, структурно и/или функционально повреждались с использованием таких способов предшествующего уровня техники. Полученные в результате везикулы, следовательно, не содержат органического растворителя и могут содержать исключительно липиды, в том числе биоразлагаемые липиды, и какое-либо средство, инкапсулированное в них или посредством их.
Настоящее изобретение отчасти основано на этих и других удивительных и неожиданных характеристиках везикул в соответствии с настоящим изобретением, как более подробно описано в настоящем документе. Следовательно, настоящее изобретение относится к таким стабилизированным везикулам, композициям, содержащим такие везикулы, способам получения таких везикул и способам их применения.
Таким образом, в одном аспекте настоящее изобретение относится к многослойной липидной везикуле, имеющей сшивки между липидными бислоями, или к множеству, или к популяции многослойных липидных везикул, имеющих сшивки между липидными бислоями. Множество может составлять без ограничения 1-103, 1-104, 1-105, 1-106, 1-107, 1-108 или 1-109. Ниже описываются различные аспекты везикул, и будет понятно, что эти аспекты одинаково применимы к множеству или популяции везикул, если не указано иное. Будет понятно, что везикулы в соответствии с настоящим изобретением содержат связи между компонентами внутренних смежных (или прилегающих) бислоев, а не просто сшивки между компонентами внешнего (или крайнего) бислоя или поверхности бислоя.
В некоторых вариантах осуществления везикула содержит функционализированный липид. В некоторых вариантах осуществления функционализированный липид представляет собой малеимид-функционализированный липид. Функционализированным липидом может быть без ограничения фосфоэтаноламин. В некоторых вариантах осуществления везикула содержит компонент липидного бислоя, который является Функционализированным, предпочтительно напрямую Функционализированным. В некоторых вариантах осуществления везикула содержит фосфохолин, такой как без ограничения DOPC. В некоторых вариантах осуществления везикула содержит глицерофосфат, такой как без ограничения DOPG. В некоторых вариантах осуществления везикула содержит DOPC, DOPG и функционализированный липид, такой как без ограничения функционализированный фосфоэтаноламин. Функционализированным липидом может быть липид, содержащий малеимид. В некоторых вариантах осуществления везикулы содержат DOPC, DOPG и малеимид-функционализированный липид. Функционализированным липидом может быть малеимид-функционализированный фосфоэтаноламин, такой как без ограничения МРВ. В некоторых вариантах осуществления мольное отношение DOPC:DOPG:функционализированный липид составляет 40:10:50. В некоторых вариантах осуществления везикула может содержать DOPC и МРВ. В некоторых вариантах осуществления везикулы могут содержать DOPC, DOTAP и МРВ. В некоторых вариантах осуществления мольное отношение DOPC:DOTAP:функционализированный липид составляет 40:10:50. В некоторых вариантах осуществления функционализированный липид присутствует в мольном процентном отношении по меньшей мере 25%.
В некоторых вариантах осуществления везикула содержит средство, включающее в себя одно или несколько средств. В настоящем документе одно или несколько средств предполагают одно или несколько средств, которые отличаются друг от друга. В некоторых вариантах осуществления средством является профилактическое средство, терапевтическое средство или диагностическое средство. В некоторых вариантах осуществления средством является антиген. В некоторых вариантах осуществления средством является белковый антиген, в том числе цельный белковый антиген. В некоторых вариантах осуществления средством является адъювант.Адъювантом может быть без ограничения агонист TLR, такой как агонисты TLR4, TLR7, TLR8 и TLR9. В некоторых вариантах осуществления везикулы содержат антиген и по меньшей мере два адъюванта, такие как агонисты TLR4 и TLR7. В некоторых вариантах осуществления средством является белок.
В некоторых вариантах осуществления везикулы содержат свыше 300 мкг средства на мг липида (или частицы) или свыше 400 мкг средства на мг липида (или частицы). В некоторых вариантах осуществления везикулы содержат 300-400 мкг средства на мг липида (или частицы). В некоторых вариантах осуществления везикулы содержат 325 мкг средства на мг липида (или частицы) или 407 мкг средства на мг липида (или частицы). В родственных вариантах осуществления средством может быть белковый антиген.
В некоторых вариантах осуществления средство инкапсулировано в везикулу. В некоторых вариантах осуществления средство присутствует в ядре везикулы. В некоторых вариантах осуществления средство присутствует между липидными бислоями.
В некоторых вариантах осуществления везикулы содержат средство в ядре, а другое средство между липидными бислоями. В некоторых вариантах осуществления средством в ядре может быть антиген, такой как белковый антиген, а средством между липидными бислоями может быть адъювант, такой как без ограничения MPLA. В некоторых вариантах осуществления антиген находится в ядре, а два адъюванта находятся между внутренними липидными бислоями. Двумя адъювантами в некоторых вариантах осуществления являются MPLA и R-848.
В некоторых вариантах осуществления везикулы содержат средство в ядре, а другое средство во внешнем бислое. В некоторых вариантах осуществления средством в ядре может быть антиген, такой как белковый антиген, а средством во внешнем бислое может быть адъювант, такой как без ограничения MPLA. В некоторых вариантах осуществления антиген находится в ядре, а два адъюванта находятся во внешнем бислое. В некоторых вариантах осуществления антиген находится в ядре, а один или несколько адъювантов находятся между внутренними бислоями и/или на внешней поверхности бислоя. Двумя адъювантами в некоторых вариантах осуществления являются MPLA и R-848.
В некоторых вариантах осуществления везикулы конъюгированы с полиэтиленгликолем (PEG). В некоторых вариантах осуществления везикулы могут быть поверхностно конъюгированы с PEG.
В другом аспекте настоящее изобретение относится к композиции, содержащей любую из вышеупомянутых многослойных липидных везикул (или совокупностей везикул) и фармацевтически приемлемый носитель.
В другом аспекте настоящее изобретение относится к композиции, содержащей любую из вышеупомянутых многослойных липидных везикул (или популяций везикул) и вспомогательное вещество, приемлемое для лиофилизации. В некоторых вариантах осуществления вспомогательное вещество, приемлемое для лиофилизации, содержит сахарозу. Везикулы могут быть использованы отдельно или могут быть комбинированы с другими средствами, в том числе с любым из средств, описанных в настоящем документе. В некоторых вариантах осуществления они не будут вводиться вместе с клетками, и они не будут конъюгированными (или физически соединенными иным образом) с клетками, например, перед введением субъекту. Везикулы, однако, могут быть конъюгированы с нацеливающими лигандами для нацеливания их на конкретные клетки или участки в организме.
В другом аспекте настоящее изобретение относится к способу, включающему контактирование липосом, содержащих функционализированный липид, с многовалентным (например, двухвалентным) катионом с образованием слитых липосом, и контактирование слитых липосом со сшивателем с образованием многослойных липидных везикул, имеющих сшивки между липидными бислоями, в том числе любых из вышеупомянутых везикул.
В некоторых вариантах осуществления функционализированным липидом является малеимид-функционализированный липид. В некоторых вариантах осуществления функционализированным липидом является функционализированный фосфоэтаноламин. В некоторых вариантах осуществления функционализированным липидом является малеимид-функционализированный липид. В некоторых вариантах осуществления функционализированным липидом является малеимид-функционализированный фосфоэтаноламин. В некоторых вариантах осуществления липосомы содержат фосфохолин, такой как без ограничения DOPC. В некоторых вариантах осуществления липосомы содержат глицерофосфат, такой как без ограничения DOPG. В некоторых вариантах осуществления липосомы содержат малеимид-функционализированный липид, фосфохолин и глицерофосфат.В некоторых вариантах осуществления липосомы содержат DOPC, DOPG и малеимид-функционализированный липид (такой как МРВ) в мольном отношении 40:10:50. В некоторых вариантах осуществления липосомы содержат DOPC и малеимид-функционализированный липид, такой как МРВ. В некоторых вариантах осуществления липосомы содержат DOPC, DOTAP и малеимид-функционализированный липид (такой как МРВ) необязательно в мольном отношении 40:10:50.
В некоторых вариантах осуществления линкером является проникающий через мембрану линкер. В некоторых вариантах осуществления сшивателем является дитиоловый сшиватель. В некоторых вариантах осуществления сшивателем является дитиотреитол (DTT). В некоторых вариантах осуществления мольное отношение дитиолового сшивателя к малеимид-функционализированному липиду составляет 1:2.
В некоторых вариантах осуществления способ дополнительно включает конъюгирование полиэтиленгликоля (PEG) с поверхностью многослойных липидных везикул, имеющих сшивки между липидными бислоями.
В некоторых вариантах осуществления многовалентными катионами являются двухвалентные катионы, такие как без ограничения Са^ или Mg2^ Они могут быть использованы по отдельности или в комбинации.
В некоторых вариантах осуществления контактирование происходит в водном буфере.
В некоторых вариантах осуществления липосомы содержат средство. В некоторых вариантах осуществления средством является профилактическое средство, терапевтическое средство или диагностическое средство.
В другом аспекте настоящее изобретение относится к способу, включающему контактирование многослойной липидной везикулы, содержащей компонент функционализированного липидного бислоя, такой как функционализированный липид, со сшивателем, с образованием многослойных липидных везикул, имеющих сшивки между липидными бислоями.
В другом аспекте настоящее изобретение относится к способу, включающему введение субъекту многослойной липидной везикулы, имеющей сшитые липидные бислои, которая содержит средство в эффективном количестве. Многослойной липидной везикулой, имеющей сшитые липидные бислои может быть любая из вышеупомянутых многослойных липидных везикул, имеющих сшитые липидные бислои или любая из описанных в настоящем документе.
В некоторых вариантах осуществления многослойная липидная везикула содержит биоразлагаемый липид. В некоторых вариантах осуществления многослойная липидная везикула содержит фосфолипид. В некоторых вариантах осуществления многослойная липидная везикула содержит фосфохолин, глицерофосфат и/или фосфоэтаноламин. В некоторых вариантах осуществления многослойная липидная везикула содержит функционализированный липид. В некоторых вариантах осуществления функционализированным липидом является малеимид-функционализированный липид. В некоторых вариантах осуществления малеимид-функционализированным липидом является малеимид-функционализированный фосфоэтаноламин.
В некоторых вариантах осуществления средством является профилактическое средство. В некоторых вариантах осуществления средством является терапевтическое средство. В некоторых вариантах осуществления средством является антиген. В некоторых вариантах осуществления средством является адъювант.В некоторых вариантах осуществления везикулы содержат два или более средств. В некоторых вариантах осуществления везикулы содержат антиген и адъювант.В некоторых вариантах осуществления везикулы содержат антиген и два адъюванта. В некоторых вариантах осуществления везикулы содержат белковый антиген, а также агонист TLR4 и агонист TLR7. В некоторых вариантах осуществления антиген, такой как белковый антиген, присутствует в ядре везикулы, а адъювант(ы) присутствует(ют) между внутренними бислоями везикулы.
В некоторых вариантах осуществления многослойная липидная везикула конъюгирована с PEG на ее внешней поверхности.
В некоторых вариантах осуществления субъект имеет злокачественную опухоль или подвержен риску развития злокачественной опухоли. В некоторых вариантах осуществления субъект имеет инфекцию или подвержен риску развития инфекции. В некоторых вариантах осуществления субъект страдает аллергией или астмой или подвержен риску развития аллергии или астмы, или испытывает астматический приступ, или подвержен риску испытать астматический приступ.
В некоторых вариантах осуществления эффективным количеством является количество для стимулирования иммунной реакции у субъекта. Иммунной реакцией может быть гуморальная реакция или клеточная реакция, или это может быть комбинированная гуморальная и клеточная реакция. Клеточная реакция может предусматривать стимуляцию CD8 Т-клеток.
В другом аспекте настоящее изобретение относится к способу, включающему стимуляцию иммунной реакции у субъекта, нуждающегося в этом, путем введения многослойных липидных везикул, имеющих сшитые липидные бислои и содержащих антиген, при этом субъекту вводится эффективное количество антигена. Многослойными липидными везикулами, имеющими сшитые липидные бислои могут быть любые из таких вышеупомянутых везикул или любые из описанных в настоящем документе. Везикулы, кроме того, могут содержать один или несколько адъювантов. В некоторых вариантах осуществления везикулы содержат антиген, в том числе белковый антиген, в своих ядрах и адъюванты между своими липидными бислоями. Белковым антигеном может быть цельный белковый антиген. Адъювантами могут быть без ограничения агонисты TLR4, такие как MPLA и агонисты TLR7, такие как R-848. В некоторых вариантах осуществления везикулы содержат 300-400 мкг антигена на мг липида. В некоторых вариантах осуществления везикулы вводятся только один раз (т.е. достаточно примирующей дозы). В некоторых вариантах осуществления везикулы вводятся более чем один раз (например, возбуждающая и бустерная дозы). В некоторых вариантах осуществления антигеном является бактериальный антиген, вирусный антиген, грибковый антиген, паразитарный антиген или микобактериальный антиген. В некоторых вариантах осуществления антигеном является антиген злокачественной опухоли. В некоторых вариантах осуществления иммунной реакцией является синергическая иммунная реакция.
В другом аспекте настоящее изобретение относится к способу, включающему контактирование многослойной липидной везикулы, имеющей сшитые липидные бислои и содержащей средство, с клеткой или клеточной популяцией in vitro. Клеткой или клеточной популяцией могут быть дендритные клетки или другие антиген-презентирующие клетки. Многослойной липидной везикулой, имеющей сшитые липидные бислои, может быть любая из вышеупомянутых многослойных липидных везикул, имеющих сшитые липидные бислои или любая из описанных в настоящем документе.
Следует понимать, что все комбинации вышеупомянутых понятий и дополнительные понятия, более подробно обсуждаемые ниже, (при условии, что такие понятия не являются взаимно несовместимыми) предполагаются как часть объекта настоящего изобретения, раскрытого в настоящем документе. В частности, все комбинации заявленного объекта настоящего изобретения, представленного в конце этого раскрытия, предполагаются как часть объекта настоящего изобретения, раскрытого в настоящем документе. Также следует понимать, что терминология, однозначно используемая в настоящем документе, которая также может быть представлена в любом раскрытии, включенном посредством ссылки, должна соответствовать значению, наиболее подходящему для конкретных понятий, раскрытых в настоящем документе.
Краткое описание графических материалов
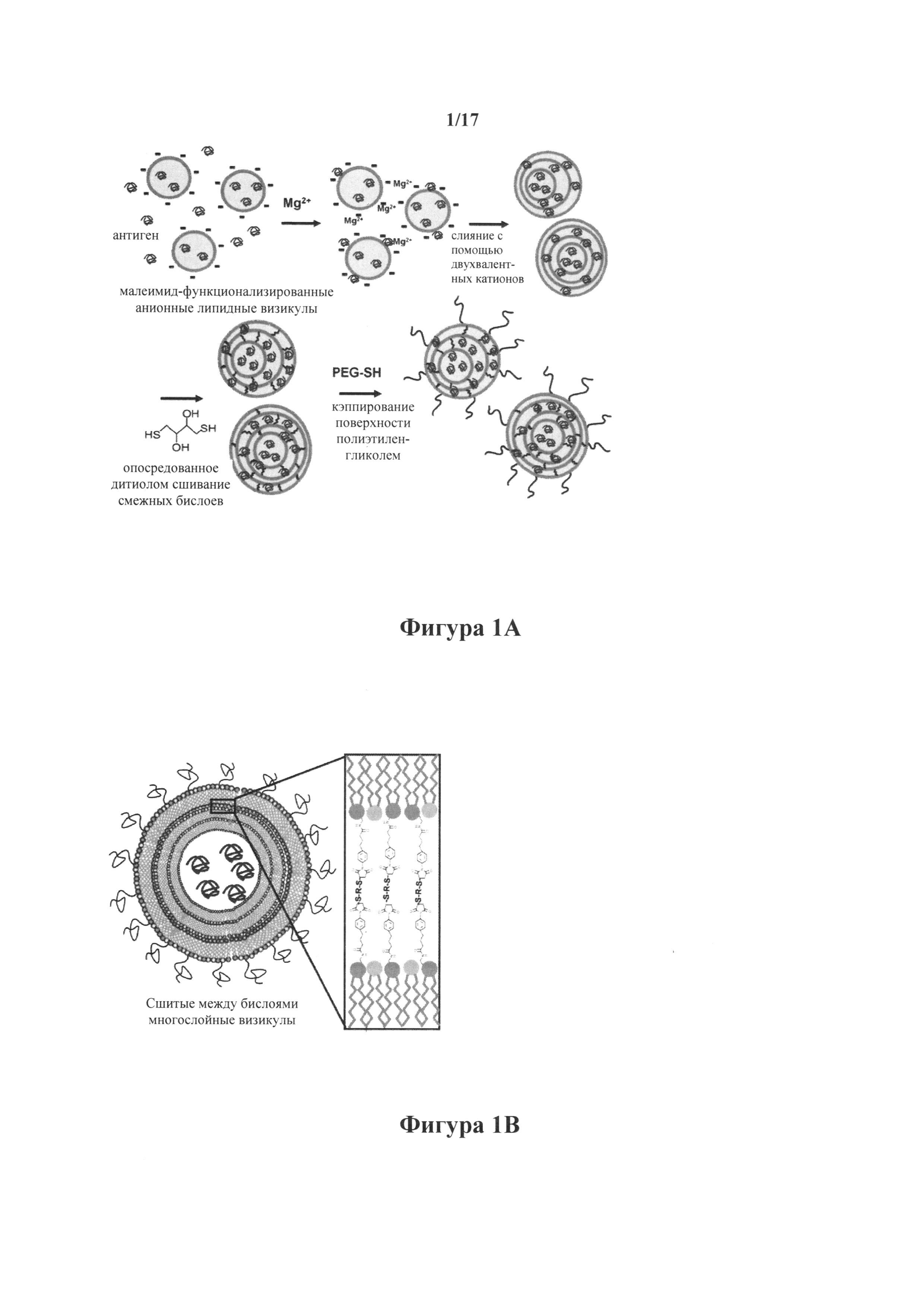
На фиг.1А представлена схема синтеза сшитых между бислоями многослойных везикул (ICMV). Опосредованное двухвалентным катионом слияние приводит к образованию многослойных везикул, в которых смежные бислои были сшиты с DTT. Полученные в результате ICMV были пэгилированы в реакции с PEG-тиолом.
На фиг.1В представлена иллюстрация ICMV, образованных путем конъюгации двух липидных головных групп вместе в многослойные везикулы.
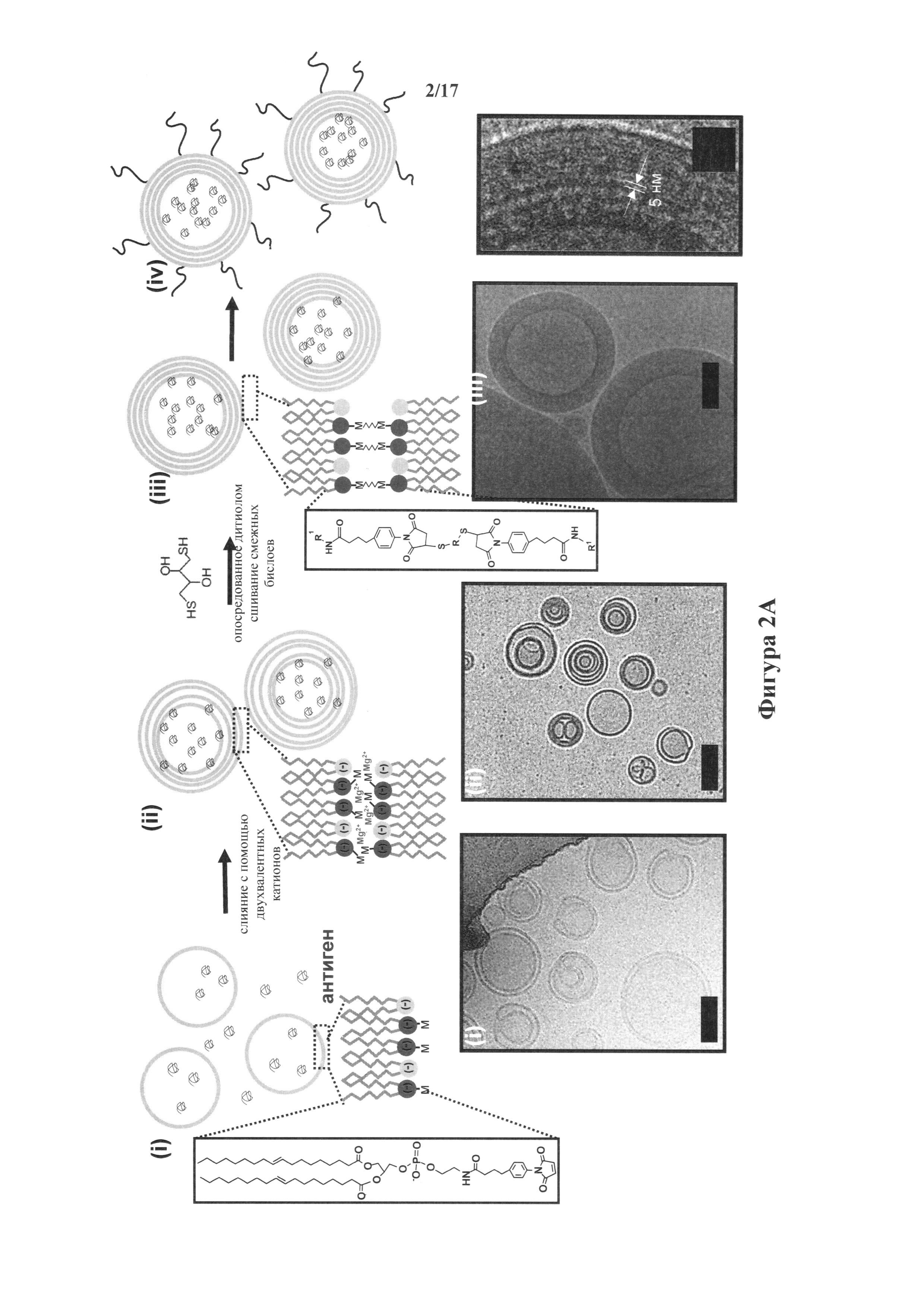
На фиг.2A-D представлен синтез ICMV. (А) Показаны схематическая иллюстрация синтеза ICMV и изображения, полученные криоэлектронным микроскопом: (i) анионные, малеимид-функционализированные липосомы получали из высушенных липидных пленок, (ii) добавляли двухвалентные катионы для индуцирования слияния липосом и образования MLV, (hi) добавляли проникающие через мембрану дитиолы, которые сшивали малеимид-липиды в прилегающих липидных бислоях в стенках везикул, и (iv) полученные в результате липидные частицы пэгилировали с тиол-концевым PEG. Изображения, полученные криоэлектронным микроскопом, из каждого этапа синтеза показывают (i) исходные липосомы, (ii) MLV и (hi) ICMV с толстыми липидными стенками. Масштабные полоски=100 нм. На изображении справа (hi) показано увеличенное изображение стенки ICMV, в которой упакованные бислои различаются как электронноплотные полосы; масштабная полоска=20 нм. (В) Показана гистограмма размера частиц ICMV, измеренных динамическим рассеиванием света. (С, D) Гистограммы свойств ICMV по изображениям, полученным криоэлектронным микроскопом, показывают (С) число липидных бислоев на частицу и (D) отношение радиуса частицы к толщине липидной стенки (п=165 проанализированных частиц).
На фиг.3А-В показаны (А) гистограмма диаметров частиц, измеренных динамическим рассеиванием света; (В) полученное криоэлектронным микроскопом изображение частицы ICMV.
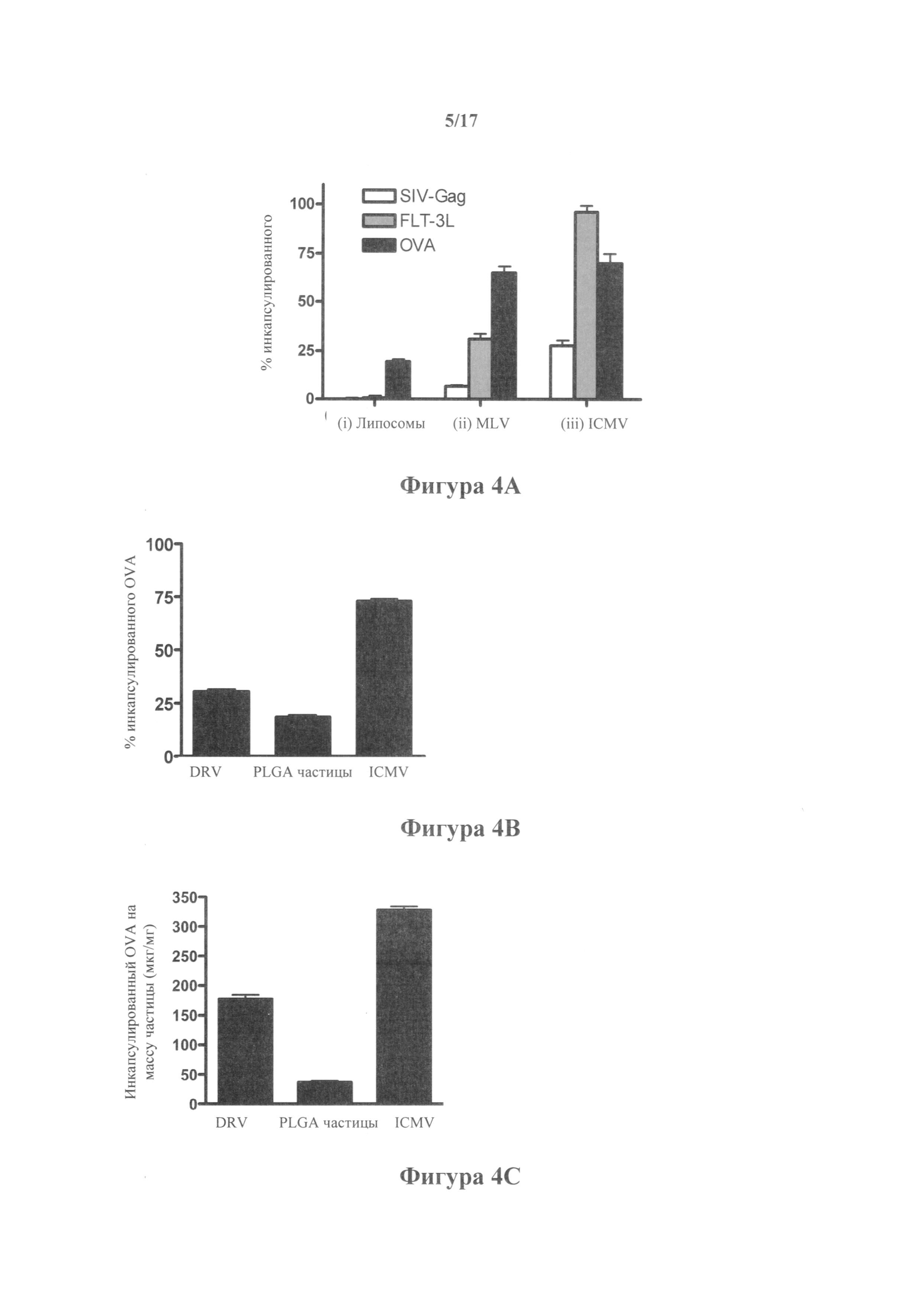
На фиг.4А-Е показана инкапсуляция белка и высвобождение из ICMV. (А) Эффективность инкапсуляции глобулярных белков SIV-gag, FLT-3L или OVA в липидных везикулах, собранных на каждом этапе синтеза ICMV. (В, С) Сравнение эффективности инкапсуляции OVA (В) и общей загрузки белком на массу частицы (С) в ICMV и в полученных методом дегидратации-регидратации везикулах (DRV) или в наночастицах PLGA. (D) Кинетические характеристики высвобождения OVA из простых липосом, MLV или ICMV (все с основной липидной композицией 4:5:1 DOPC:MPB:DOPG), инкубированных в среде RPMI с 10% сывороткой крови при 37°С, измеряемые в течение 30 дней in vitro. Также для сравнения показаны кинетические характеристики высвобождения для липосом, стабилизированных холестерином и PEG-липидом (38:57:5 DOPC:chol:PEG-DOPE). (E) Высвобождение OVA из ICMV измеряли в буферах, имитирующих различные аспекты эндосомальной среды:
восстанавливающий буфер, 100 мМ бета-меркаптоэтанола (бета-МЕ) в PBS; кислотный буфер, 50 мМ цитрата натрия, рН 5,0; содержащий липазу буфер, 500 нг/мл липазы А в PBS. Данные представляют среднее±стандартная ошибка среднего по меньшей мере трех экспериментов с п=3.
На фиг.5А-В представлено сравнение инкапсуляции OVA в традиционных липосомах, покрытых липидом частицах PLGA и ICMV, показывающее (А) фракцию инкапсулированного OVA в частицах и (В) количество инкапсулированного OVA на общую массу частицы.
На фиг.6А-В 6 показан высвобожденный OVA из обработанных ультразвуком липосом, MLV, слитых с помощью Mg+, ICMV, образованных с помощью Mg+и DTT (А) в PBS и (В) в среде RPMI с 10% сывороткой крови.
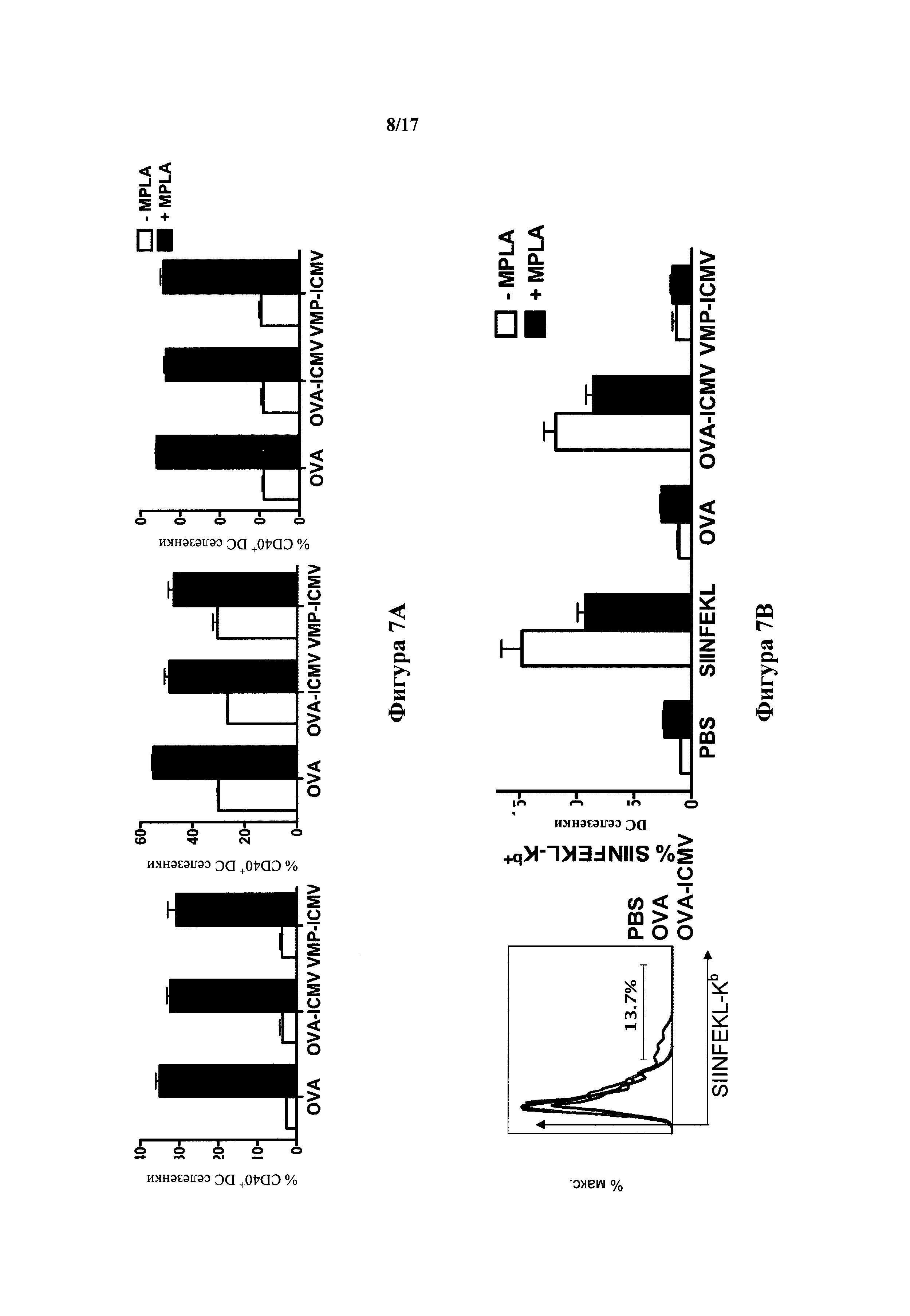
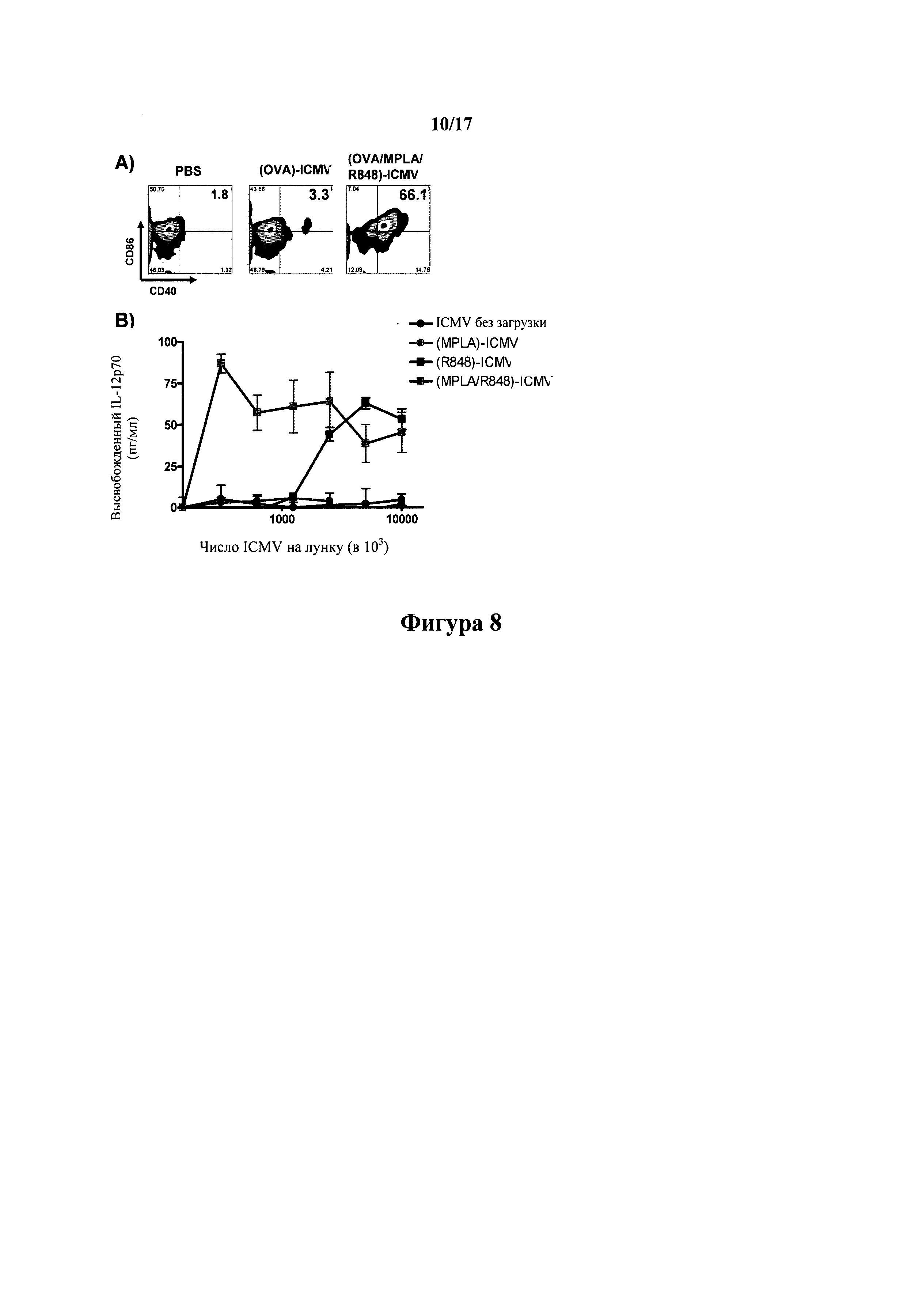
На фиг.7А-С показана in vitro стимуляция иммунных реакций с помощью ICMV, дополненных агонистом TLR MPLA. (А) Анализ проточной цитометрии экспрессии костимулирующих маркеров клеточной поверхности CD40, CD80 и CD86 в селезеночных дендритных клетках (DC) после 18 часов инкубации с 0,7 мкг/мл растворимого OVA, эквивалентными дозами OVA, загруженного в ICMV, или ICMV, загруженными нехарактерным белком (белок трехдневной малярии, VMP), в присутствии 0,1 мкг/мл MPLA или при отсутствии такового. (В) Селезеночные DC инкубировали в течение 18 часов с 10 мкг/мл пептида SIINFEKL (OVA257-264); 5,0 мкг/мл растворимого OVA, эквивалентными дозами OVA, загруженного в ICMV, или загруженными VMP ICMV в присутствии 0,05 мкг/мл MPLA или при отсутствии такового, и степень кросс-презентации OVA оценивали анализом проточной цитометрии клеток, окрашенных 25-D1.16 mAb, который распознает SIINFEKL, образующий комплекс с Н-2Kb. (С) Меченные 5-(6)-карбоксифлуоресцеин-диацетат-сукцинимидиловым сложным диэфиром (CFSE) OVA-специфичные наивные OT-I CD8+ Т-клетки совместно культивировали с сингенными селезеночными DC, активированными 0,7 мкг/мл растворимого OVA, смешанного с 0,1 мкг/мл MPLA, или эквивалентными дозами загруженных OVA ICMV, смешанных с MPLA. Пустые ICMV без антигена или ICMV, загруженные нехарактерным антигеном VMP, включали в качестве отрицательного контроля. Пролиферацию CDS^ Т-клеток оценивали в день 3 с помощью анализа проточной цитометрии раствора CFSE в OT-I CD8+ Т-клетках; показаны гистограммы флуоресценции CFSE. Пороговые значения на каждой гистограмме показывают процентное отношение поделившихся клеток в каждом образце. Данные представляют среднее±стандартная ошибка среднего по меньшей мере трех экспериментов с n=3-4.
На фиг.8А-В показаны (А) созревание DC и (В) активация в ответ на ICMV-включенный с MPLA и/или R-848.
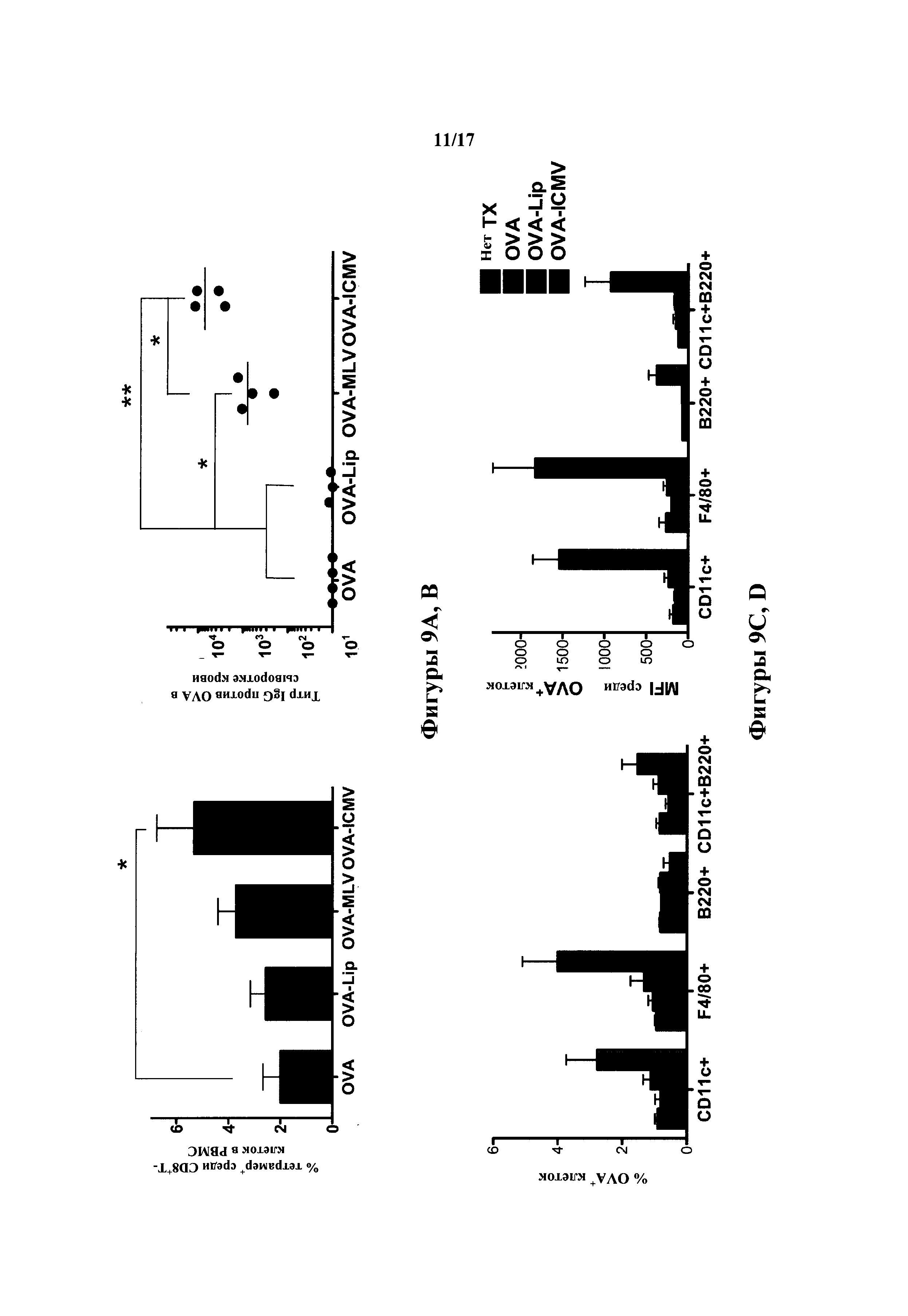
На фиг.9A-F показана иммунизация in vivo с ICMV по сравнению с растворимым антигеном или антигеном, инкапсулированным в несшитые везикулы. (А, В) Мышей С57 В1/6 подкожно (s.c.) иммунизировали однократной инъекцией 10 мкг OVA, доставленного в растворимом, липосомальном, MLV или ICMV составах, каждый из которых смешан с 0,1 мкг MPLA. (А) Процентное отношение антиген-специфичных CD8+Т-клеток определяли с помощью анализа проточной цитометрии мононуклеарных клеток периферической крови (РВМС) через 7 дней после иммунизации с флуоресцентными OVA пептид-МНС тетрамерами. (В) Сыворотку крови от иммунизированных мышей анализировали с помощью ELISA через 21 день после иммунизации на OVA-специфичный IgG. (С, D) Мышам С57В 1/6 инъецировали 10 мкг конъюгированного с флуорофором OVA, смешанного с 0,1 мкг MPLA в качестве растворимого, липосомального или ICMV состава, и в день 2 оценивали клетки дренирующего пахового лимфатического узла (dLN), которые интернализировали OVA. (С) Показаны процентные отношения DC (CD11c+), макрофагов (F4/80+), В-клеток (B220+) и плазмацитоидных DC (CD11c+B220+), положительных по поглощению OVA, и (D) средняя интенсивность флуоресценции (MFI) OVA+ совокупностей. (Е, F) Мышам С57 В1/6 инъецировали 10 мкг OVA, смешанного с 0,1 мкг MPLA в качестве растворимого, липосомального или ICMV состав, и через 2 дня выделенные из дренирующих паховых LN DC анализировали с помощью проточной цитометрии для оценки активации DC и кросс-презентации антигена. (Е) На оверлейных гистограммах показаны костимулирующие маркеры (CD40 и CD86) и экспрессия MHC-II в DC. (F) На левой панели показаны оверлейные гистограммы DC паховых LN, окрашенные на комплексы SIINFEKL-Kb+, а на правой панели показаны средние уровни MFI. Данные представляют среднее±стандартная ошибка среднего 2-3 независимых экспериментов, проведенных с n=3-4. *,р<0,05 и **, р<0,01, анализировали с помощью однофакторного ANOVA, с последующим HSD Тьюки.
На фиг.10А-В показаны (А) OVA-специфичные CD8+Т-клетки в периферической крови через 7 дней после бустерной инъекции, оцененные с помощью анализа проточной цитометрии клеток, окрашенных антителами против CD8 и пептид-МНС тетрамерами, образующими комплекс с производным от OVA пептидом SIINFEKL. (В) Титры антитела против OVA измеряли в день 21 после иммунизации с помощью ELISA.
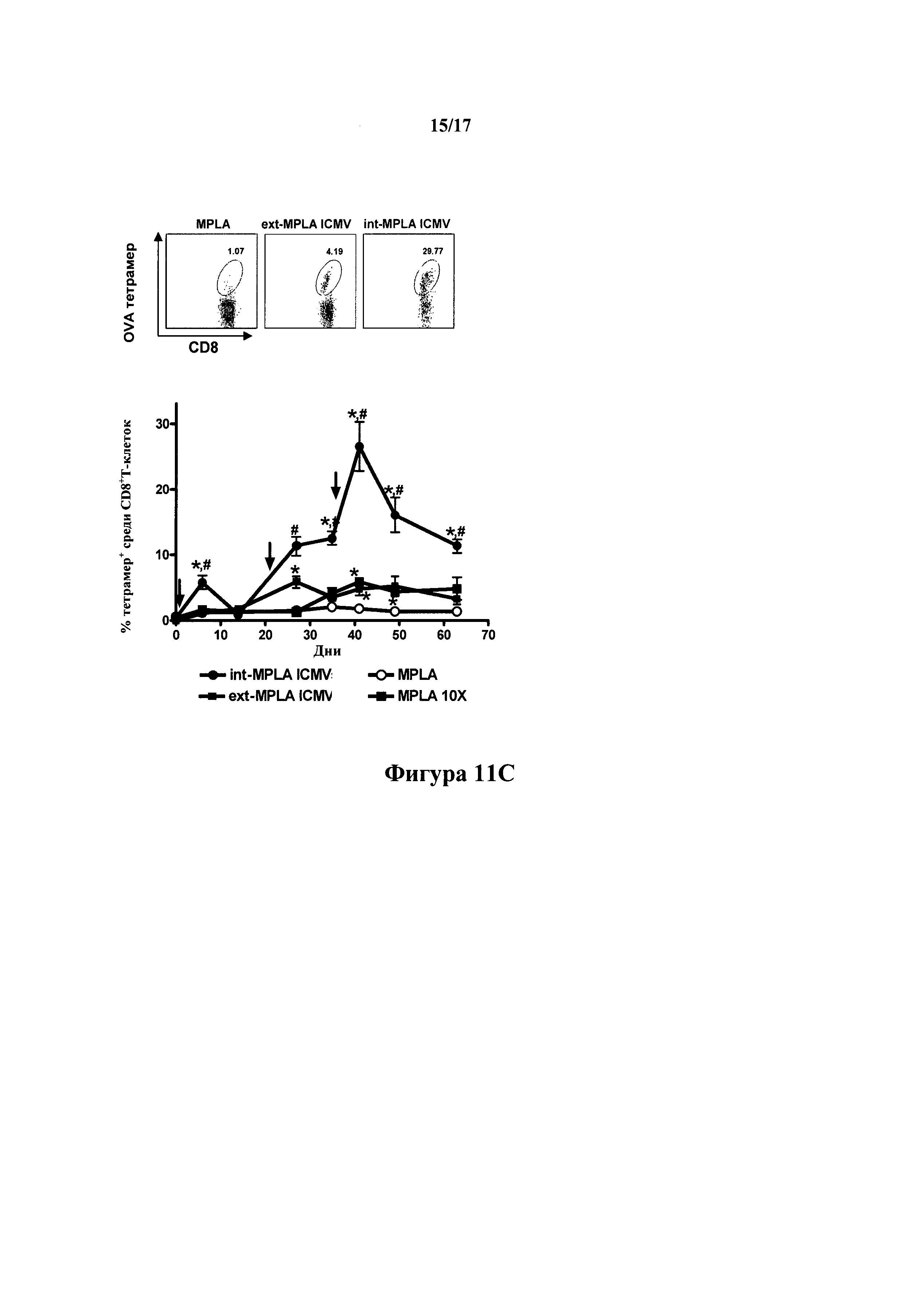
На фиг.11А-Е показано, что ICMV, несущие антиген в водном ядре и введенный в стенки везикулы MPLA, вызывают активное антитело и CD8+Т-клеточные ответы. (А) Схематическая иллюстрация вакцинных групп: растворимый OVA, смешанный с MPLA (MPLA), загруженные OVA ICMV только с MPLA на внешней поверхности (ext-MPLA ICMV), или загруженные OVA ICMV с MPLA через липидные многомолекулярные слои (int-MPLA ICMV). (B-G) Мышей С57В 1/6 иммунизировали в дни 0, 21 и 35 в основание хвоста подкожно 10 мкг OVA и либо 0,1 мкг, либо 1,0 мкг MPLA, составленного либо как MPLA, ext-MPLA ICMV, либо как int-MPLA ICMV. (В) С помощью ELISA анализировали общий OVA-специфичный IgG в сыворотке крови. (С) Частоту встречаемости OVA-специфичных Т-клеток в периферической крови оценивали с течением времени с помощью анализа проточной цитометрии тетрамер+CD8+Т-клеток для вакцинации 10 мкг OVA и 0,1 мкг MPLA. Также для сравнения показан ответ на вакцинации с растворимым OVA+1 мкг MPLA (MPLA 10Х). Показаны типичные диаграммы рассеяния проточной цитометрии от отдельных мышей в день 41 и средние тетрамер^значения от группы мышей с течением времени. (D) Анализировали фенотипы Т-клеток эффекторных/эффекторной памяти/центральной памяти в периферической крови с помощью окрашивания CD44/CD62L в тетрамер4' клетках из периферической крови в день 41. Показаны типичные графики цитометрии от отдельных мышей и среднее процентные отношения tet+CD44+CD62L+клеток среди CD8+ Т-клеток в день 41. (Е) Функциональность антиген-специфичных CD8+ Т-клеток анализировали в день 49 с внутриклеточным IFN-у окрашиванием после повторной стимуляции ex vivo PBMC пептидом OVA in vitro. Показаны типичные гистограммы проточной цитометрии IFN-γ+CD8+ Т-клеток от отдельных мышей и средние результаты группы. Данные представляют среднее±стандартная ошибка среднего двух независимых экспериментов, проведенных с n=3. с, *,р<0,05 по сравнению с растворимым OVA+MPLA и #,р<0,05 по сравнению с ext-MPLA ICMV. (D, Е) * р<0,05 и **, р<0,01, анализировали с помощью двухфакторного ANOVA, с последующим HSD Тьюки.
На фиг.12А-В показаны альтернативные реакции сшивки между бислоями с использованием клик-химии. (А) Липид с алкиновой головной группой синтезировали из DOPE и алкинового предшественника. (В) Липосомы формировали с липидами с алкиновыми концевыми группами и индуцировали образование MLV с помощью Mg2^ Последующая инкубация несущих алкин MLV с диазидом и катализатором, как показано, привела к успешному образованию ICMV с 83% выходом частиц, как измерено после извлечения частицы при условиях центрифугирования с низкой скоростью.
Подробное описание изобретения
Настоящее изобретение относится к стабилизированным многослойным липидным везикулам для применения, среди прочего, в доставке средств. Вакцины 30 предшествующего уровня техники, основанные на рекомбинантных белках, исключают токсичность и антивекторный иммунитет, связанные с векторами (например, вирусными) живой вакцины, но их иммуногенность слабая, особенно для ответов CD8+Т-клеток (CD8T). Для улучшения субъединичных вакцин были разработаны синтетические частицы, несущие антигены и адъювантные молекулы, но по сути с помощью этих материалов не удалось вызвать ответы CD8T, сопоставимые с живыми векторами, на доклинических животных моделях. В отличие от композиций и способов предшествующего уровня техники настоящее изобретение относится к стабилизированным многослойным везикулам, таким как сшитые между бислоями многослойные везикулы (ICMV), образованные путем сшивания головных групп смежных липидных бислоев в многослойных везикулах. Эти везикулы стабильно захватывают, среди прочего, белковые антигены в ядро везикулы, а основанные на липидах иммуностимулирующие молекулы в стенки везикулы при внеклеточных условиях, но проявляют быстрое высвобождение в присутствии эндолизосомных липаз. При использовании для доставки антигена отдельно или в присутствии адъюванта везикулы в соответствии с настоящим изобретением формируют высоко эффективную вакцину (например, вакцину из цельного белка), вызывающую ответы эндогенных Т-клеток и антитела, сопоставимые с самыми эффективными вакцинными векторами.
Везикулы стабилизируются внутренней связью (например, сшиванием) их липидных бислоев. Стабилизированная природа этих везикул позволяет им включать большие количества средств и удерживать такие средства в течение более длительного периода времени по сравнению с простыми липосомами или покрытыми липидом нано- или микрочастицами. Их кинетические характеристики длительного высвобождения, особенно в присутствии сыворотки крови, делают их подходящими для in vivo доставки средств, для которых желательно замедленное, устойчивое и пролонгированное высвобождение, или для которых желательно замедленное высвобождение во внеклеточную среду, но быстрое высвобождение в клетки. Настоящее изобретение предполагает использование таких везикул с рядом разнообразных средств, в том числе профилактических средств, терапевтических средств и/или диагностических средств, как более подробно описано в настоящем документе. Настоящее изобретение, таким образом, относится к композициям, содержащим вышеупомянутые везикулы, к способам их синтеза и к способам их применения.
Стабилизированные многослойные липидные везикулы (MLV)
Настоящее изобретение относится к MLV, которые стабилизированы путем связи смежных (или прилегающих) липидных бислоев друг с другом. В настоящем документе, многослойная везикула представляет собой нано- или микросферу с оболочкой, которая содержит два или более концентрически расположенных липидных бислоев. В настоящем документе, смежные или прилегающие липидные бислои (или поверхности липидных бислоев) означают бислои или поверхности, которые расположены близко друг к другу, но которые в остальном различаются и, как правило, физически разделены. Этот термин обычно не подразумевает взаимосвязь между двумя монослоями одного бислоя.
В настоящем документе термин «связь» означает две структурные единицы, стабильно связанные друг с другом с помощью каких-либо физико-химических средств. Может быть использована любая связь, известная специалистам в данной области, в том числе ковалентная или нековалентная связь, хотя ковалентная связь является предпочтительной. В некоторых важных вариантах осуществления, описанных в настоящем документе, ковалентная связь между смежными (или прилегающими) липидными бислоями в MLV обеспечивается применением сшивателей и функционализированных компонентов липидного бислоя. Настоящее изобретение, однако, предполагает, что связь, в том числе ковалентная связь, может быть осуществлена другими путями. В качестве примера настоящее изобретение предполагает способы, при которых на компонентах поверхностей смежных бислоев располагаются комплементарные реакционно-способные группы, и связь между поверхностями бислоев осуществляется взаимодействием этих групп друг с другом, даже в отсутствии сшивателя. Приемлемые комплементарные реакционно-способные группы известны в предшествующем уровне техники и описаны в настоящем документе.
Внутренняя часть везикулы обычно представляет собой водную среду, и она может содержать средство, такое как без ограничения профилактическое, терапевтическое или диагностическое средство. В некоторых случаях везикулы не имеют твердого ядра, такого как твердое полимерное ядро (например, синтетическое полимерное ядро). Вместо этого, как обсуждалось выше, они могут иметь жидкое ядро, содержащее представляющие интерес средства. В некоторых случаях ядро может содержать мономеры для полимеризации в гидрогелевое ядро. Везикулы также могут быть названы в настоящем документе частицами, в том числе нано- или микрочастицами, хотя будет понятно, что такие нано- или микрочастицы обладают характеристиками стабилизированных MLV и сшитых между бислоями многослойных липидных везикул (ICMV) в соответствии с настоящим изобретением.
Везикулы могут иметь свободный объем в своем ядре, и/или они могут содержать одно или несколько средств в своем ядре и/или между смежными (или прилегающими) липидными бислоями, как показано на фиг.1А, 1В и 2А. Средства, как правило, включаются в липидный раствор во время процесса синтеза и, таким образом, включаются (например, путем инкапсуляции) в везикулы во время синтеза. Липофильные молекулы также могут быть включены непосредственно в липидные бислои при образовании везикул, или молекулы с липофильными хвостами могут быть прикреплены к липидным бислоям при образовании везикулы. Везикулы могут быть получены в отсутствии агрессивных растворителей, таких как органические растворители, и в результате они могут инкапсулировать широкий спектр средств, в том числе тех, которые могли бы быть чувствительными к органическим растворителям и т.п.
Количество средства в везикулах может варьировать и может зависеть от природы средства. Как показано в примерах, в соответствии с настоящим изобретением в везикулы может быть включено 300-400 мкг белкового средства на мг липида. В некоторых вариантах осуществления везикулы могут содержать приблизительно 100 мкг средства или приблизительно 150 мкг средства, или приблизительно 200 мкг средства, или приблизительно 250 мкг средства, или приблизительно 300 мкг средства, или приблизительно 325 мкг средства, или приблизительно 350 мкг средства, или приблизительно 375 мкг средства, или приблизительно 400 мкг средства, или приблизительно 410 мкг средства на мг липида. В некоторых вариантах осуществления средством может быть белок, такой как белковый антиген.
Везикулы в соответствии с настоящим изобретением также могут быть охарактеризованы их профилями удержания. В некоторых вариантах осуществления везикулы высвобождают средство при скорости приблизительно 25% в неделю при помещении в содержащую сыворотку крови среду (например, 10% сыворотки крови) и выдерживании при 37°С. В некоторых вариантах осуществления везикулы высвобождают приблизительно 25% средства за первую неделю и до приблизительно 90% через приблизительно 30 дней при этих условиях. В некоторых вариантах осуществления везикулы удерживают по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90% или по меньшей мере 95% этого средства при хранении в буфере (таком как PBS) при 4°С в течение 30 дней.
Число липидных бислоев в каждой везикуле может варьировать с типичным диапазоном от по меньшей мере 2 до приблизительно 50 или от по меньшей мере 2 до приблизительно 25, или от по меньшей мере 2 до приблизительно 15, или от по меньшей мере 2 до приблизительно 10, или от по меньшей мере 2 до приблизительно 5.
Диаметр везикул может варьировать. В некоторых случаях везикулы будут иметь диаметр, варьирующий от приблизительно 100 до приблизительно 500 нм, в том числе от приблизительно 125 до приблизительно 300 нм, в том числе от приблизительно 150 до приблизительно 300 нм, в том числе от приблизительно 175 до приблизительно 275 нм. В некоторых случаях диаметр варьирует от приблизительно 150 до приблизительно 250 нм. Профили диаметра для ICMV, полученной, как описано в примерах, показаны на фиг.2 В и ЗА. Следует понимать, что в любом препарате везикул предусматривается гетерогенность между везикулами по отношению к диаметру везикул, числу липидных бислоев, количеству загруженного средства и т.п.Такие распределения показаны в примерах.
Используемые в настоящем документе везикулы в соответствии с настоящим изобретением также могут быть названы липосомами (например, стабилизированными многослойными липосомами или, как обсуждается ниже, сшитыми между бислоями многослойными липосомами). Следовательно, применение термина «везикулы» не предназначено для указания источника или происхождения везикул. Везикулами в соответствии с настоящим изобретением являются синтетические везикулы (т.е. они получены in vitro), как будет более подробно обсуждаться ниже.
Везикулы могут быть выделенными, что подразумевает их физическое отделение полностью или частично от среды, в которой они синтезированы. В качестве примера, содержащие средство (т.е. их «переносимый груз» или «полезный груз») везикулы могут быть отделены целиком или частично от везикул без средства (т.е. от пустых везикул) и тогда могут называться «выделенными везикулами». Отделение может происходить на основе веса (или массы), плотности (в том числе плавучей плотности), размера, цвета и т.п.(например, если переносимый груз везикулы выявляется по излучению им энергии). Как описано в примерах, для отделения везикул в соответствии с настоящим изобретением от простых липосом или MLV идентичной липидной композиции, которые не имеют сшитых бислоев, может быть использовано центрифугирование. Центрифугирование при приблизительно 14000 g в течение приблизительно 4 минут является достаточным для отделения везикул в соответствии с настоящим изобретением, которые представляют собой пеллеты, от других типов частиц.
Сшитые между бислоями многослойные липидные везикулы
Примером стабилизированной MLV в соответствии с настоящим изобретением являются сшитые между бислоями многослойные (липидные) везикулы (ICMV). Подобно описанной выше стабилизированной MLV ICMV являются нано- или микросферами с оболочкой, которая содержит два или более концентрически расположенных липидных бислоя, которые конъюгированы друг с другом, как описано в настоящем документе. Число липидных бислоев в стабилизированных многослойных везикулах, в том числе в ICMV, может варьировать от приблизительно 2 до 30, но чаще находится в диапазоне от 2 до 15. Следовательно, в различных вариантах осуществления число слоев может составлять 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более. Распределение численности бислоев, полученных в результате одного типичного синтеза ICMV, показано на фиг.2С.Бислои, как правило, состоят из липидов, содержащих гидрофильные головные группы и гидрофобные хвосты, которые упорядочены подобно клеточной мембране (т.е. с гидрофильными головными группами, как правило, выставленными в водную среду, и гидрофобными хвостами, погруженными в бислой).
ICMV стабилизированы путем сшивки между их липидными бислоями, и поэтому их называют «сшитыми между бислоями» MLV. В настоящем документе это означает, что по меньшей мере два липидных бислоя в оболочке везикулы сшиты друг с другом. Сшитые бислой, как правило, являются прилегающими или смежными по отношению друг к другу. Большинство или все из липидных бислоев в оболочке могут быть сшиты с прилегающим к ним липидным бислоем в оболочке. Между липидными бислоями может существовать одна или несколько сшивок. Как правило, между липидными бислоями существует несколько сшивок. Размещение и расположение таких сшивок могут быть случайными или неслучайными. Степень сшивок (и, таким образом, обеспеченная в результате стабильность везикул) будет зависеть от пропорции функционализированных липидов (или других компонентов липидного бислоя), используемых для получения везикул, а также от условий сшивания (в том числе, например, от времени инкубации везикул со сшивателем). Следует понимать, что чем выше пропорция функционализированных липидов (или других компонентов липидного бислоя) в везикулах, тем больше сшивок будет образовываться при равенстве всех остальных факторов и параметров. Подобным образом, чем более благоприятны условия для сшивания, тем более высокая степень сшивания будет достигаться.
Способ синтеза
Типичным способом синтеза является следующий. Липиды и необязательно другие компоненты бислоя объединяют с образованием гомогенной смеси. Это может происходить посредством этапа сушки, при котором липиды высушивают с образованием липидный пленки. Затем липиды объединяют (например, регидратируют) с водным растворителем. Водный растворитель может характеризоваться рН в диапазоне от приблизительно 6 до приблизительно 8, в том числе рН приблизительно 7. Используют буферы, совместимые со слиянием везикул, как правило, с низкими концентрациями соли. Используемый в примерах растворитель представляет собой 10 мМ бис-трис пропанового (ВТР) буфера, рН 7,0. Природа буфера может влиять на длительность инкубации, как показано в таблице 1А. Например, с буфером, таким как PBS, может потребоваться более длительная инкубация по сравнению с буфером, таким как ВТР, при равенстве всех остальных факторов. Если буфером является PBS, тогда время инкубации может составлять приблизительно 6-24 часа или 8-16 часов, или 10-12 часов. Если буфером является ВТР, тогда время инкубации может быть короче, например, 1-4 часа или 1-2 часа. Следовательно, можно использовать разнообразные водные буферы при условии, что также обеспечивается достаточное время инкубации. Этот этап также может включать присутствие средства(средств), включаемого(ых) в везикулы. Полученные в результате липосомы затем инкубируют с одним или несколькими двухвалентными катионами для слияния их в многослойные везикулы. Приемлемые двухвалентные катионы включают Mg2+, Ca2+, Ва2+ или Sr2+. Многовалентные или полимерные катионы также можно использовать для слияния везикул. Слияние везикул также может быть достигнуто путем смешивания катионных везикул с двухвалентными или с более высокой валентностью анионами; примером может служить слияние катионных липосом с ДНК олигонуклеотидами или ДНК плазмидами. Это может быть осуществлено при взбалтывании, таком как обработка ультразвуком, встряхивание и т.п. Если липосомы были получены в присутствии средства, MLV будут содержать средство в своем ядре и/или между концентрически расположенными липидными бислоями. Настоящее изобретение предполагает слияние липосом, несущих различные средства, с образованием MLV, которые содержат такие средства.
Затем полученные в результате MLV инкубируют со сшивателем, а предпочтительно с проникающим через мембрану сшивателем. Как указано в настоящем документе, природа сшивателя будет варьировать в зависимости от природы реакционно-способных групп, связанных вместе. Как показано в примерах, содержащий дитиол сшиватель, такой как DTT или (1,4-ди-[3'-(2'-пиридилдитио)-пропионамидо]бутан), может быть использован для сшивки MLV, состоящих из малеимид-функционализированных липидов (или других компонентов бислоя из функционализированного липида), или можно использовать диазидные сшиватели для сшивки липидов с алкиновыми головными группами с помощью клик-химии, как показано на фиг.12. Все эти различные способы инкубации осуществляют в водных условиях при рН в диапазоне от приблизительно 6 до приблизительно 8 или от приблизительно 6,5 до приблизительно 7,5, или при приблизительно 7. Этап сшивания может быть выполнен при комнатной температуре (например, 20-25°С) или при повышенной температуре, в том числе, например, до или выше 37°С.
Полученные в результате сшитые везикулы затем могут быть собраны (например, с помощью центрифугирования или других средств пеллетирования), промыты, а затем пэгилированы на их наружной или внешней поверхности (например, как используется в настоящем документе, везикулы могут называться «поверхностно пэгилированными» или «поверхностно конъюгированными» с PEG) с помощью инкубации с тиол-PEG. PEG может быть любого размера, в том числе без ограничения 0,1-10 кДа, 0.5-5 кДа или 1-3 кДа. В примерах используется 2 кДа PEG, функционализированный с тиолом. Период инкубации может варьировать от приблизительно 10 минут до 2 часов, хотя он может быть короче или длиннее в зависимости от других условий, таких как температура, концентрация и т.п. Этап пэгилирования может быть выполнен при комнатной температуре (например, 20-25°С) или при повышенной температуре, в том числе, например, до или выше 37°С. В типичных способах синтеза примеров используется 30-минутный период инкубации. Затем везикулы могут быть собраны (например, центрифугированием или другими средствами пеллетирования) и промыты водой или другим водным буфером.
Везикулы можно хранить при 4°С в буферном растворе, таком как без ограничения PBS, или они могут быть лиофилизированы в присутствии приемлемых криоконсервантов, а затем их можно хранить при -20°С. Приемлемые криоконсерванты включают содержащие сахарозу (например, 1-5% сахарозы и предпочтительно приблизительно 3% раствор сахарозы).
Сшивание также может быть осуществлено с помощью соединения реакционно-способной группы в одном бислое с комплементарной реакционно-способной группой в смежном бислое. Например, слитые везикулы, содержащие головные группы функционализированного сукцинимидиловым сложным эфиром липида (А) и содержащие первичный амин (В) головные группы, могут быть получены сшиванием с помощью реакции in situ между А и В липидами смежных бислоев. Подобным образом может быть использован ряд других комплементарных функционализированных липидов, известных специалистам в данной области.
Мольное отношение функционализированного липида (или другого функционализированного компонента липидного бислоя) к сшивателю может варьировать в зависимости от условий. В некоторых случаях оно может варьировать от приблизительно 1 до приблизительно 5. В некоторых вариантах осуществления достаточным является мольное отношение 2 (т.е. мольное отношение функционализированного липида (или компонента) к сшивателю составляет 2:1). В примерах описывается способ синтеза, при котором для сшивки липидных бислоев везикул используется мольное отношение малеимид-функционализированного липида к DTT 2:1. Время инкубации может варьировать от 1 часа до 24 часов, от 2 до 18 часов, от 2 до 12 часов или от 2 до 6 часов. В одних случаях оно может составлять приблизительно 2 часа. В других случаях инкубацию можно осуществлять в течение ночи (например, приблизительно 12 часов).
Мольный % функционализированного липида в везикулах может варьировать от 1% до 100% или от приблизительно 10% до приблизительно 60% в одних случаях, или от приблизительно 25% до приблизительно 55% в других случаях. В некоторых случаях мольный % функционализированного липида в везикулах, как правило, составляет по меньшей мере 10%, предпочтительно по меньшей мере 15%, более предпочтительно по меньшей мере 20% и еще более предпочтительно по меньшей мере 25%. В таблицах 1А и 1В показано, что в отсутствии функционализированного липида, везикулы не образуются.
Наоборот, нефункционализированные липиды могут присутствовать в мольном % от приблизительно 0% до 99%. Более типично нефункционализированные липиды могут присутствовать в мольном % от приблизительно 40% до 75% или от 40% до 60%.
В одном важном варианте осуществления везикулы синтезированы с использованием DOPC, DOPG и малеимид-функционализированного DSPE. Отношение этих липидов друг к другу может варьировать. В таблицах 1А и 1 В показаны эффекты варьирования отношения ООРС:ООРО:малеимид-функционализированный липид на выход везикул. Мольный % DOPC может варьировать от 1 до 50%, мольный % DOPG может варьировать от 1 до 50%, а мольный % малеимид-функционализированного липида может варьировать от 1 до 80%. В некоторых вариантах осуществления в соответствии с настоящим изобретением представлены везикулы с отношением DOPC:DOPG:малеимид-функционализированный липид 40:10:50. В некоторых вариантах осуществления представлены везикулы с отношением DOPC:DOPG:малеимид-функционализированный липид 60:15:25. В некоторых вариантах осуществления представлены везикулы, состоящие из DOPG и малеимид-функционализированного липида.
Липиды
Везикулы состоят из одного или нескольких липидов. Тип, число и отношение липидов может варьировать с условием, что совместно они образуют сферические бислои (т.е. везикулы). Липиды могут быть выделены из источника природного происхождения, или они могут быть синтезированы, независимо от какого-либо источника природного происхождения.
По меньшей мере один (или несколько) из липидов является/являются амфипатическим липидом, определенным как содержащий гидрофильную и гидрофобную части (как правило, гидрофильную головную группу и гидрофобный хвост). Гидрофобная часть, как правило, ориентирована в гидрофобную фазу (например, в бислои), тогда как гидрофильная часть, как правило, ориентирована по направлению к водной фазе (например, за пределы бислоя и, возможно, между поверхностями смежных прилегающих бислоев). Гидрофильная часть может содержать полярные или заряженные группы, такие как углеводные, фосфатную, карбоксильную, сульфатную, амино, сульфгидрильную, нитро, гидрокси и другие подобные группы. Гидрофобная часть может содержать неполярные группы, которые содержат без ограничения с длинной цепью насыщенные и ненасыщенные алифатические углеводородные группы и группы, замещенные одной или несколькими ароматическими, циклоалифатическими или гетероциклическими группами. Примеры амфипатических соединений включают в себя без ограничения фосфолипиды, аминолипиды и сфинголипиды.
Как правило, липидами являются фосфолипиды. Фосфолипиды включают в себя без ограничения фосфатидилхолин, фосфатидилэтаноламин, фосфатидилглицерин, фосфатидилинозитол, фосфатидилсерин и т.п. Будет понятно, что могут быть использованы другие компоненты липидной мембраны, такие как холестерин, сфингомиелин, кардиолипин и т.п.
Липидами могут быть анионные и нейтральные (в том числе цвиттер-ионные и полярные) липиды, в том числе анионные и нейтральные фосфолипиды. Нейтральные липиды существуют в незаряженной форме или в форме нейтрального цвиттер-иона при выбранном рН. При физиологическом рН такие липиды включают в себя, например, диолеоилфосфатидилглицерин (DOPG), диацилфосфатидилхолин, диацилфосфатидилэтаноламин, керамид, сфингомиелин, цефалин, холестерин, цереброзиды и диацилглицерины. Примеры цвиттер-ионных липидов включают в себя без ограничения диолеоилфосфатидилхолин (DOPC), димиристоилфосфатидилхолин (DMPC) и диолеоилфосфатидилсерин (DOPS). Анионным липидом является липид, который отрицательно заряжен при физиологическом рН. Такие липиды включают в себя без ограничения фосфатидилглицерин, кардиолипин, диацилфосфатидилсерин, диацилфосфатидную кислоту, N-додеканоилфосфатидилэтаноламины, N-сукцинилфосфатидилэтаноламины, N-глутарилфосфатидилэтаноламины, лизилфосфатидилглицерины, пальмитоилолеоилфосфатидилглицерин (POPG) и другие анионные модифицирующие группы, присоединенные к нейтральным липидам.
Совместно анионные и нейтральные липиды названы в настоящем документе некатионными липидами. Такие липиды могут содержать без ограничения фосфор. Примеры некатионных липидов включают в себя лецитин, лизолецитин, фосфатидилэтаноламин, лизофосфатидилэтаноламин, диолеоилфосфатидилэтаноламин (DOPE), дипальмитоилфосфатидилэтаноламин (DPPE), димиристоилфосфоэтаноламин (DMPE), дистеароилфосфатидилэтаноламин (DSPE), пальмитоилолеоилфосфатидилэтаноламин (POPE), пальмитоилолеоилфосфатидилхолин (РОРС), яичный фосфатидилхолин (ЕРС), дистеароилфосфатидилхолин (DSPC), диолеоилфосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), диолеоилфосфатидилглицерин (DOPG), дипальмитоилфосфатидилглицерин (DPPG), пальмитоилолеоилфосфатидилглицерин (POPG), 16-O-монометил РЕ, 16-O-диметил РЕ, 18-1-транс РЕ, пальмитоилолеоилфосфатидилэтаноламин (POPE), 1-стеароил-2-олеоил-фосфатидилэтаноламин (SOPE), фосфатидилсерин, фосфатидилинозитол, сфингомиелин, цефалин, кардиолипин, фосфатидную кислоту, цереброзиды, дицетилфосфат и холестерин.
Дополнительные несодержащие фосфор липиды включают стеариламин, додециламин, гексадециламин, ацетилпальмитат, глицеринрицинолеат, гексадецилстеарат, изопропилмиристат, амфотерные акриловые полимеры, триэтаноламин-лаурилсульфат, алкил-арилсульфат полиэтоксилированные жирнокислотные амиды, диоктадецилдиметиламмония бромид и т.п., диацилфосфатидилхолин, диацилфосфатидилэтаноламин, керамид, сфингомиелин, цефалин и цереброзиды. В некоторых случаях могут быть использованы липиды, такие как лизофосфатидилхолин и лизофосфатидилэтаноламин. Некатионные липиды также включают в себя основанные на полиэтиленгликоле полимеры, такие как PEG 2000, PEG 5000 и полиэтиленгликоль, конъюгированный с фосфолипидами или с керамидами (названный PEG-Cer).
В некоторых случаях могут быть использованы модифицированные формы липидов, в том числе формы, модифицированные выявляемыми метками, такими как флуорофоры. В некоторых случаях липидом является липидный аналог, который испускает сигнал (например, флуоресцентный сигнал). Примеры включают в себя без ограничения 1,1'-диоктадецил-3,3,3',3'-тетраметилиндотрикарбоцианин йодид (DiR) и 1,1'-диоктадецил-3,3,3',3'-тетраметилиндодикарбоцианин (DiD).
Предпочтительно липиды являются биоразлагаемыми для обеспечения высвобождения инкапсулированного средства in vivo и/или in vitro. Биоразлагаемые липиды включают в себя без ограничения 1,2-диолеоил-sn-глицеро-3-фосфохолин (диолеоил-фосфохолин, DOPC), анионный 1,2-ди-(9 г-октадеценоил)-5n-глицеро-3-фосфо-(1'-rac-глицерин) (диолеоил-глицерофосфат, DOPG) и 1,2-дистеароил-5n-глицеро-3-фосфоэтаноламин (дистеароил-фосфоэтаноламин, DSPE). Также могут быть включены нелипидные мембранные компоненты, такие как холестерин.
Функционализированные липиды или компоненты бислоя
По меньшей мере один компонент липидного бислоя должен быть функционализированным (или реакционно-способным). В настоящем документе функционализированным компонентом является компонент, содержащий реакционно-способную группу, которая может быть использована для сшивки смежных бислоев многослойной везикулы. Компонент бислоя может быть модифицированным с содержанием реакционно-способной группы.
Один или несколько использованных в синтезе везикул липидов могут быть функционализированными липидами. В настоящем документе, функционализированным липидом является липид, имеющий реакционно-способную группу, которая может быть использована для сшивки смежных бислоев многослойной везикулы. В некоторых вариантах осуществления реакционно-способной группой является группа, которая будет реагировать со сшивателем (или другим компонентом) с образованием сшивок между такими функционализированными липидами (и, таким образом, между липидными бислоями в везикуле). Реакционно-способная группа может быть расположена где угодно в липиде, что позволяет ей взаимодействовать со сшивателем и быть сшитой с другим липидом в смежном прилегающем бислое. В некоторых вариантах осуществления она может находится в головной группе липида, в том числе, например, фосфолипида. Примером реакционно-способной группы является малеимидная группа. Малеимидные группы могут быть сшитыми друг с другом в присутствии дитиоловых сшивателей, таких как без ограничения дитиотреитол (DTT). Пример функционализированного липида является 1,2-диолеоил-уи-глицеро-3-фосфоэтаноламин-N-[4-(п-малеимидофенил)бутирамид, названный в настоящем документе МРВ. В примерах продемонстрировано применение такого функционализированного липида в синтезе везикул в соответствии с настоящим изобретением. Другим примером функционализированного липида является 1,2-дистеароил-зп-глицеро-3-фосфоэтаноламин-М-[малеимид(полиэтиленгликоль)2000]
(также названный малеимид-PEG 2k-PE). Другим примером функционализированного липида является диолеоил-фосфатидилэтаноламин-4-(М-малеимидометил)-циклогексан-1 -карбоксилат (DOPE-mal).
Будет понятно, что настоящее изобретение предполагает применение других функционализированных липидов, других функционализированных липидных компонентов бислоя, других реакционно-способных групп и других сшивателей. В дополнение к малеимидным группам другие примеры реакционно-способных групп включают без ограничения другие тиоловые реакционно-способные группы, аминогруппы, такие как первичные и вторичные амины, карбоксильные группы, гидроксильные группы, альдегидные группы, алкиновые группы, азидные группы, карбонилы, галогенацетильные (например, йодацетильные) группы, имидоэфирные группы, N-гидроксисукцинимидные сложные эфиры, сульфгидрильные группы, пиридилдисульфидные группы и т.п.
Функционализированные и нефункционализированные липиды доступны из ряда коммерческих источников, в том числе Avanti Polar Lipids (Alabaster, Alabama).
Будет понятно, что настоящее изобретение предполагает различные пути для связывания смежных бислоев в многослойных везикулах друг с другом. В некоторых случаях сшиватели используются для осуществления связи между смежными бислоями. Настоящее изобретение, однако, этим не ограничивается.
В качестве примера, везикулы могут быть образованы с использованием клик-химии. В типичном способе синтеза применяются алкин-модифицированные липиды и алкин-азидная химия, как изложено ниже. Алкин-модифицированные липиды получали смешиванием липидов, таких как 1,2-диолеоил-уи-глицеро-3-фосфоэтаноламин (DOPE, 744 мг, 1 ммоль), с N-гидроксисукцинимидным сложным эфиром пропиоловой кислоты (167 мг, 1 ммоль) и Et3N (202 мг, 2 ммоль) в 5 мл CDCl3. Реакцию контролировали с помощью ЯМР. Через 3 часа при комнатной температуре реакцию завершали. Затем органический раствор промывали 5 мл 5% Na2CO4, 1% HCl и солевым раствором, сушили под Na2SO4, выпаривали и взвешивали алкин-модифицированный DOPE. Получали 1,26 мкмоль липидной пленки с DOPC и алкин-DOPE в мольном отношении 1:1, гидратировали, обрабатывали ультразвуком и индуцировали слияние с 10 мМ Mg2+, как описано ранее. MLV с алкин-функционализированными липидами инкубировали с 2,5 мМ CuSO4, медной проволокой и 1,5 мМ 1,14-диазидо-3,6,9,12-тетралксатетрадекана в течение 24 часов при комнатной температуре. Выход частиц измеряли после 3Х промываний с центрифугированием.
Сшиватели
Сшивателем может быть гомобифункциональный сшиватель или гетеробифункциональный сшиватель в зависимости от природы реакционно-способных 30 групп в липидных бислоях, которые подлежат связыванию друг с другом. Термины «сшиватель» и «сшивающее средство» используются взаимозаменяемо в настоящем документе. Гомобифункциональные сшиватели имеют две идентичные реакционно-способные группы. Гетеробифункциональные сшиватели имеют две различные реакционно-способные группы.
В одном случае смежные бислои сшиты друг с другом с использованием одного и того же функционализированного липида (или другого компонента бислоя) и сшивателя (такого как гомобифункциональный сшиватель). В другом случае смежные бислои сшиты друг с другом с использованием различных функционализированных липидов (или других компонентов бислоев) и сшивателя (такого как гетеробифункциональный сшиватель).
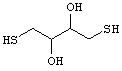
Различные типы коммерчески доступных сшивателей являются реакционно-способными с одной или несколькими из следующих групп: малеимидов, первичных аминов, вторичных аминов, сульфгидрилов, карбоксилов, карбонилов и углеводов. Примерами амин-специфичных сшивателей являются бис(сульфосукцинимидил)суберат, бис[2-(сукцинимидооксикарбонилокси)этил]сульфон, дисукцинимидилсуберат, дисукцинимидилтартрат, диметил адипимат.2 НС1, диметилпимелимидат.2 НС1, диметилсуберимидат.2 НС1 и этилен гликоль-бис-[сукцинимидил-[сукцинат]]. Сшиватели, реакционно-способные с сульфгидрильными группами, включают в себя бисмалеимидогексан, 1,4-ди-[3'-(2'-пиридилдитио)-пропионамидо)]бутан, 1-[п-азидосалициламидо]-4-[йодоацетамидо] бутан и N-[4-(п-азидосалициламидо)бутил]-3'-[2'-пиридилдитио]пропионамид. Сшиватели, предпочтительно реакционно-способные с углеводами, включают в себя азидобензоилгидразин. Сшиватели, предпочтительно реакционно-способные с карбоксильными группами, включают в себя 4-[п-азидосалициламидо]бутиламин. Дитиоловые сшиватели, такие как дитиолтиэтол (DTT), 1,4-ди-[3'-(2'-пиридилдитио)-пропионамидо]бутан (DPDPB), а в некоторых случаях содержащие тиол полимеры, такие как (PEG)-SH2, могут быть использованы для сшивки малеимид-реакционно-способных групп.Структура DTT представляет собой
Структура DPDPB представляет собой

Сшиватели, реакционно-способные с алкиновыми группами, включают в себя диазиды, такие как 1,14-диазидо-3,6,9,12-тетралксатетрадекан, и другие группы, совместимые с клик-химией.
Гетеробифункциональные сшиватели, которые реагируют с аминами и сульфгидрилами, включают в себя N-сукцинимидил-3-[2-пиридилдитио]пропионат, сукцинимидил[4-йодацетил]аминобензоат, сукцинимидил-4-[N-малеимидометил]циклогексан-1-карбоксилат, м-малеимидобензоил-N-гидроксисукцинимидовый сложный эфир, сульфосукцинимидил-6-[3-[2-пиридилдитио]пропионамидо]гексаноат и сульфосукцинимидил-4-[N-малеимидометил] циклогексан-1-карбоксилат. Гетеробифункциональные сшиватели, которые реагируют с карбоксильными и аминными группами, включают в себя 1-этил-3-[3-диметиламинопропил]-карбодиимида гидрохлорид. Гетеробифункциональные сшиватели, которые реагируют с углеводами и сульфгидрилами включают в себя 4-[N-малеимидометил]-циклогексан-1-карбоксилгидразид.2 HCl, 4-(4-N-малеимидофенил)-масляной кислоты гидразид.2 HCl и 3-[2-пиридилдитио]пропионилгидразид. Другими сшивателями являются бис-[(3-4-азидосалициламидо)этил]дисульфид и глутаральдегид.
Также сшиватели предпочтительно являются проникающими через мембрану (или растворимыми в липидах) так, что они могут диффундировать через один или несколько бислоев MLV для осуществления сшивания между различными смежными слоями. Любая слабополярная/незаряженная бифункциональная или гетеробифункциональная малая молекула может быть эффективным проникающим через мембрану сшивателем, особенно если такая молекула содержит реакционно-способную группу, такую как без ограничения малеимиды, сукцинимидиловые сложные эфиры, азиды, тиолы и т.п. Примеры проникающих через мембрану сшивателей включают в себя без ограничения DTT и 1,4-ди-[3'-(2'-пиридилдитио)-пропионамидо] бутан (DPDPB).
Пэгилирование
ICMV могут быть дополнительно модифицированы. Как описано в примерах, ICMV могут быть конъюгированы с полиэтиленгликолем (PEG) на своей поверхности. Пэгилирование используется клинически для увеличения периода полувыведения различных средств, в том числе липосом STEALTH. Пэгилирование может быть осуществлено путем взаимодействия функционализированных липидов на поверхности стабилизированных MLV с комплементарным функционализированным PEG. Липиды предпочтительно не конъюгированы с PEG до синтеза ICMV, и скорее PEG конъюгирован с внешней поверхностью ICMV после синтеза, или PEG-липидные конъюгаты вводятся во внешний мембранный слой частиц процессами «post-insertion».
Реакционно-способные группы, которые будут использоваться для пэгилирования ICMV, могут быть такими же, как использованные для сшивки бислоев, в этом случае никаких дополнительных функционализированных липидов (или других функционализированных компонентов) не требуется. В качестве примера, если ICMV содержат малеимид-функционализированные липиды, то функционализированным PEG может быть тиол-PEG. Альтернативно, реакционно-способные группы, использованные для стабилизации везикул, могут отличаться от тех, что использованы для конъюгирования PEG с внешней поверхностью. Специалисту в данной области будет понятно, что могут быть использованы другие модифицированные варианты PEG в зависимости от природы реакционно-способной группы в функционализированном липиде (или компоненте) в липидном бислое везикул. Приемлемые реакционно-способные группы включают в себя без ограничения аминогруппы, такие как первичные и вторичные амины, карбоксильные группы, сульфгидрильные группы, гидроксильные группы, альдегидные группы, азидные группы, карбонилы, малеимидные группы, галогенацетильные (например, йодацетильные) группы, имидоэфирные группы, N-гидроксисукцинимидные сложные эфиры и пиридилдисульфидные группы.
В таблице 2 проиллюстрировано влияние пэгилирования на диаметр ICMV непосредственно после синтеза и через 7 дней в PBS. Непосредственно после синтеза пэгилированные ICMV имеют немного больший диаметр, чем непэгилированные ICMV (например, 272+/-39 нм для пэгилированных ICMV по сравнению с 234+/-45 нм для непэгилированных в одном эксперименте).
С полученными в результате стабилизированными везикулами могут быть выполнены различные тесты для определения, среди прочего, размера и заряда поверхности (например, с помощью динамического рассеивания света), фракции липидов на их внешней поверхности (например, с помощью анализа ламеллярности), количества средства, включенного в них или посредством их (например, с помощью FACS) и т.п.Другие тесты, которые могут быть выполнены на везикулах, включают в себя конфокальную микроскопию и туннелирующую электронную криомикроскопию (ТЕМ).
В следующих таблицах представлены результаты различных тестов, выполненных на стабилизированных везикулах.
Таблица 1А. Выход ICMV при варьирующих условиях синтеза
а Гидратировали с 10 мМ бис-трис пропана при рН 7,0;b при 10 мМ, если не указано иное;с при 1,5 мМ, если не указано иное;
d процентное отношение липидной массы, полученной после синтеза и центрифугирования при 14000×g в течение 4 минут;
е 1,4-ди-[3'-(2'пиридилдитио)-пропионамидо]бутан (MW 482);fW 2000.
а Измеряли с помощью динамического рассеивания света (DLS);
b фракция липида, расположенная на внешней поверхности везикул,
уменьшилась после сшивания между бислоями, как измеряли с помощью анализа ламеллярности (см. Lutsiak et al. Pharm Res 19, 1480-1487 (2002));
* все значения представляют собой среднее ±SD.
Таблица 2. Характеристика везикул на каждом этапе процесса синтеза Средства
Настоящее изобретение предполагает доставку, в том числе в некоторых случаях пролонгированную (длительную) доставку, средств в участки, ткани или клетки in vivo или in vitro с использованием стабилизированных липидных везикул, в том числе ICMV, в соответствии с настоящим изобретением. В настоящем документе, средством является любой атом или молекула, или соединение, которые могут быть использованы для обеспечения пользы субъекту (в том числе без ограничения профилактической или терапевтической пользы), или которые могут быть использованы для диагностики и/или выявления (например, получения изображения) in vivo, или которые используются в применениях in vitro.
Любое средство может быть доставлено с использованием композиций (например, стабилизированных MLV, таких как ICMV, и их композиций, в том числе их фармацевтических композиций) и способов в соответствии с настоящим изобретением при условии, что оно может быть инкапсулировано в MLV (в том числе посредством их) или иным образом переноситься стабилизированными MLV, такими как ICMV, представленные в настоящем документе. Например, средство должно быть способно выдержать синтез и необязательно процесс хранения для таких везикул. Везикулы могут синтезироваться и храниться, например, в лиофилизированной форме, предпочтительно со вспомогательным веществом на основе сахарозы. Средства, если включаются в везикулы во время синтеза, должны быть стабильными во время таких процедур хранения и с течением времени.
Средством может быть без ограничения белок, полипептид, пептид, нуклеиновая кислота, лекарственное средство (например, химическое, либо органическое, либо неорганическое) в виде малой молекулы, подобная вирусу частица, стероид, протеогликан, липид, углевод, а также их аналоги, производные, смеси, слияния, комбинации или конъюгаты. Средством может быть пролекарство, которое метаболизируется и, таким образом, превращается in vivo в его активную (и/или стабильную) форму.
Средства могут быть природного происхождения или неприродного происхождения. Средства природного происхождения включают в себя те, которые могут быть синтезированы субъектами, которым вводятся везикула. Средства неприродного происхождения являются те, которые обычно не существуют в природе, либо продуцируются растением, животным, микроорганизмом, либо другим живым организмом.
Одним классом средств являются средства на основе пептида, такие как (одно-или многоцепочечные) белки и пептиды. Примеры включают антитела, одноцепочечные антитела, фрагменты антител, ферменты, кофакторы, рецепторы, лиганды, факторы транскрипции и другие регуляторные факторы, некоторые антигены (как обсуждается ниже), цитокины, хемокины и т.п.Эти средства на основе пептида могут иметь или могут не иметь природное происхождение, но они могут быть синтезированы у субъекта, например, посредством применения созданных генно-инженерным методом клеток.
Другой класс средств, которые могут быть доставлены с использованием везикул в соответствии с настоящим изобретением, включает такие средства, которые не являются основанными на пептиде. Примеры включают химические соединения неприродного происхождения или химические соединения, которые не синтезируются в природе клетками млекопитающих (а особенно человека).
Ряд средств, которые в настоящее время используются для терапевтических или диагностических целей, может быть доставлен в соответствии с настоящим изобретением, и он включает без ограничения средства для получения изображения (визуализирующие средства), иммуномодулирующие средства, такие как иммуностимулирующие средства и иммуноингибирующие средства, антигены, адъюванты, цитокины, хемокины, средства против злокачественной опухоли, противоинфекционные средства, нуклеиновые кислоты, антитела или их фрагменты, слитые белки, такие как слитые белки цитокин-антитело, Fc-слитые белки и т.п.
Визуализирующие средства. В настоящем документе, визуализирующим средством является средство, которое испускает сигнал непосредственно или косвенно, что тем самьм позволяет его выявление in vivo. Визуализирующие средства, такие как контрастные средства и радиоактивные средства, могут быть выявлены с использованием медицинских методик получения изображения, таких как ядерные медицинские сканирования и получение изображения с помощью магнитного резонанса (MRI). Визуализирующие средства для получения изображения с помощью магнитного резонанса (MRI) включают Gd(DOTA), оксид железа или наночастицы золота; средства для получения изображения для ядерной медицины включают ^Tl, гамма-активный радионуклид 99 mTc; средства для получения изображения для позитронно-эмисионной томографии (PET) включают позитронно-активные изотопы, (18)Р-фтордезоксиглюкозу ((18)FDG), (18)Р-фторид, медь-64, гадоамид и радиоизотопы Pb(II), такие как 203 Pb, и 11 In; средства для получения изображения для флуоресцентного получения изображения in vivo, такие как флуоресцентные красители или конъюгированные с красителем наночастицы. В других вариантах осуществления средство, подлежащее доставке, является конъюгированным или слитым, или смешанным, или комбинированным со средством для получения изображения.
Иммуностимулирующие средства. В настоящем документе, иммуностимулирующим средством является средство, которое стимулирует иммунную реакцию (в том числе усиливая предварительно существующую иммунную реакцию) у субъекта, которому оно вводится, либо отдельно, либо в комбинации с другим средством. Примеры включают антигены, адъюванты (например, лиганды TLR, такие как имиквимод и резиквимод, имидазохинолины, нуклеиновые кислоты, содержащие неметилированный CpG динуклеотид, монофосфориллипид A (MPLA) или другие липополисахаридные производные, однонитевую или двухнитевую РНК, флагеллин, мурамилдипептид), цитокины, в том числе интерлейкины (например, IL-2, IL-7, IL-15 (или суперагонист/мутантные формы этих цитокинов), IL-12, IFN-гамма, IFN-альфа, GM-CSF, FLT3-лиганд и т.п.), иммуностимулирующие антитела (например, против CTLA-4, против CD28, против CD3 или одна цепочка/фрагменты антитела этих молекул) и т.п.
Антигены. Антигеном может быть без ограничения антиген злокачественной опухоли, свой или аутоиммунный антиген, микробный антиген, аллерген или антиген окружающей среды. Антигеном может быть без ограничения пептид, липид или углевод природного происхождения.
Антигены злокачественной опухоли. Антигеном злокачественной опухоли является антиген, который экспрессируется предпочтительно клетками злокачественной опухоли (т.е. он экспрессируется при более высоких уровнях в клетках злокачественной опухоли, чем в клетках, не являющихся клетками злокачественной опухоли), а в некоторых случаях он экспрессируется исключительно клетками злокачественной опухоли. Антиген злокачественной опухоли может экспрессироваться в клетке злокачественной опухоли или на поверхности клетки злокачественной опухоли. Антигеном злокачественной опухоли может быть MART-1/Melan-A, gp100, связывающий аденозиндеаминазу белок (ADAbp), FAP, циклофилин b, колоректальный связанный антиген (CRC)-C017-1A/GA733, эмбриокарциномный антиген (СЕА), CAP-1, CAP-2, etv6, AML1, специфичный для предстательной железы антиген (PSA), PSA-1, PSA-2, PSA-3, специфичный для предстательной железы мембранный антиген (PSMA), Т-клеточный рецептор/СВ3-зета цепь и CD20. Антиген злокачественной опухоли может быть выбран из группы, состоящей из MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4. MAGE-A5, MAGE-A6, MAGE-A7, MAGE-A8, MAGE-A9, MAGE-AlO, MAGE-АН, MAGE-A12, MAGE-Xp2 (MAGE-B2), MAGE-ХрЗ (MAGE-B3), MAGE-Xp4 (MAGE-B4), MAGE-C1, MAGE-C2, MAGE-C3, MAGE-C4, MAGE-C5. Антиген злокачественной опухоли может быть выбран из группы, состоящей из GAGE-1, GAGE-2, GAGE-3, GAGE-4, GAGE-5, GAGE-6, GAGE-7, GAGE-8, GAGE-9. Антиген злокачественной опухоли может быть выбран из группы, состоящей из BAGE, RAGE, LAGE-1, NAG, GnT-V, MUM-1, CDK4, тирозиназы, р53, семейства MUC, HER2/neu, p21ras, RCAS1, α-фетопротеина, β-кадгерина, α-катенина, β-катенина, γ-атенина, pl20ctn, gp100Pmel117, PRAME, NY-ESO-1, cdc27, белка аденоматозного полипоза (АРС), фодрина, коннексина-37, Ig-идиотипа, р15, gp75, GM2 ганглиозида, GD2 ганглиозида, белков вируса папилломы человека, семейства Smad опухолевых антигенов, Imp-1, PI А, EBV-кодированного ядерного антигена (EBNA)-l, гликогенфосфорилазы мозга, SSX-1, SSX-2 (HOM-MEL-40), SSX-1, SSX-4, SSX-5, SCP-1 и СТ-7, CD20 и с-erbB-2.
Микробные антигены. Микробными антигенами являются антигены, происходящие от видов микробов, таких как без ограничения виды бактерий, вирусов, грибов, паразитов и микобактерий. Как таковые, микробные антигены включают бактериальные антигены, вирусные антигены, грибные антигены, паразитные антигены и микобактериальные антигены. В настоящем документе представлены примеры видов бактерий, вирусов, грибов, паразитов и микобактерий. Микробным антигеном может быть часть микроба, или это может быть целый микроб.
Аллергены. Аллергеном является средство, которое может индуцировать аллергическую или астматическую реакцию у субъекта. Аллергены включают без ограничения пыльцу, яды насекомых, перхоть животных, споры грибов и лекарственные средства (например, пенициллин). Примеры природных, животных и растительных аллергенов включают без ограничения белки, специфичные к следующим родам: Canine (Canis familiaris); Dermatophagoides (например, Dermatophagoides farinae); Felis (Felis domesticus); Ambrosia (Ambrosia artemiisfolia; Lolium (например, Lolium perenne или Lolium multiflorum'); Cryptomeria (Cryptomeria japonica); Alternaria {Alternaria alternata); Alder; Ainus (Ainus gultinoasa); Betula (Betula verrucosd); Quercus (Quercus alba); Olea (Olea europa); Artemisia {Artemisia vulgaris); Plantago (например, Plantago lanceolata); Parietaria (например, Parietaria officinalis или Parietaria judaica); Blattella (например, Blattella germanica); Apis (например. Apis multiflorum'); Cupressus (например, Cupressus sempervirens, Cupressus arizonica и Cupressus macrocarpa); Juniperus (например, Juniperus sabinoides, Juniperus virginiana, Juniperus communis и Juniperus ashei); Thuya (например, Thuya orientalis); Chamaecyparis (например, Chamaecyparis obtusa); Periplaneta (например, Periplaneta americana); Agropyron (например, Agropyron repens); Secale (например, Secale cereale); Triticum (например, Triticum aestivum); Dactylis (например, Dactylis glomerata); Festuca (например, Festuca elatior); Poa (например, Роа pratensis или Роа compressa); Avena (например, Avena sativa); Holcus (например, Holcus lanatus); Anthoxanthum (например, Anthoxanthum odoratum); Arrhenatherum (например, Arrhenatherum elatius); Agrostis (например, Agrostis alba); Phleum (например, Phleum pratense); Phalaris (например, Phalaris arundinacea); Paspalum (например, Paspalum notatum); Sorghum (например, Sorghum halepensis) и Bromus (например, Bromus inermis).
Адъюванты. Адъювантом могут быть без ограничения квасцы (например, гидроксид алюминия, фосфат алюминия); сапонины, очищенные от коры дерева Q. Saponaria, такие как QS21 (гликолипид, который элюируется в 21-ом пике при фракционировании HPLC; Virus Research Institute, USA); поли[ди(карбоксилатофенокси)фосфазен (полимер РСРР; Virus Research Institute, USA), лиганд Flt3, фактор элонгации Leishmania (очищенный белок Leishmania; Corixa Corporation, Seattle, Wash.), ISCOMS (иммуностимулирующие комплексы, которые содержат смешанные сапонины, липиды и образуют частицы размером с вирус с порами, которые могут захватить антиген; CSL, Melbourne, Australia), Pam3Cys, SB-AS4 (адъювантная система SmithKline Beecham #4, которая содержит квасцы и MPL; SBB, Belgium), неионные блок-сополимеры, которые образуют мицеллы, такие как CRL 1005 (они содержат линейную цепочку гидрофобного полиоксипропилена, фланкированного цепочками полиоксиэтилена, Vaxcel, Inc., Norcross, Ga.), и Montanide IMS (например, IMS 1312, наночастицы на водной основе, комбинированные с растворимым иммуностимулятором, Seppic).
Адъювантами могут быть лиганды TLR. Адъюванты, которые действуют через TLR3, включают без ограничения двухнитевую РНК. Адъюванты, которые действуют через TLR4, включают без ограничения производные липополисахаридов, таких как монофосфориллипид A (MPLA; Ribi ImmunoChem Research, Inc., Hamilton, Mont.), мурамилдипептид (MDP; Ribi) и треонил-мурамилдипептид (t-MDP; Ribi); ОМ-174 (родственный липиду А глюкозаминовый дисахарид; ОМ Pharma SA, Meyrin, Switzerland). Адъюванты, которые действуют через TLR5, включают без ограничения флагеллин. Адъюванты, которые действуют через TLR7 и/или TLR8, включают однонитевую РНК, олигорибонуклеотиды (ORN), синтетические низкомолекулярные соединения, такие как имидазохинолинамины (например, имиквимод (R-837), резиквимод (R-848)). Адъюванты, действующие через TLR9, включают ДНК вирусного или бактериального происхождения, или синтетические олигодезоксинуклеотиды (ODN), такие как ODN CpG. Другим классом адъювантов являются содержащие фосфоротиоат молекулы, такие как фосфоротиоатные нуклеотидные аналоги и нуклеиновые кислоты, содержащие связи фосфоротиоатного скелета.
Иммуноингибирующие средства. В настоящем документе, иммуноингибирующим средством является средство, которое ингибирует иммунную реакцию у субъекта, которому вводится, либо отдельно, либо в комбинации с другим средством. Примеры включают стероиды, ретиноевую кислоту, дексаметазон, циклофосфаамид, антитело против CD3 или фрагмент антитела и другие иммуносупрессанты.
Средства против злокачественной опухоли. В настоящем документе, средством против злокачественной опухоли является средство, которое по меньшей мере частично ингибирует развитие или прогрессирование злокачественной опухоли, включая ингибирование полностью или частично симптомов, связанных со злокачественной опухолью, даже если только на короткое время. Несколько средств против злокачественной опухоли могут быть классифицированы как повреждающие ДНК средства и те, что включают ингибиторы топоизомеразы (например, этопозид, рамптотецин, топотекан, тенипозид, митоксантрон), алкилирующие ДНК средства (например, цисплатин, мехлоретамин, циклофосфамид, ифосфамид, мелфалан, хорамбуцил, бусульфан, тиотепа, кармустин, ломустин, карбоплатин, дакарбазин, прокарбазин), средства, индуцирующие разрыв нити ДНК (например, блеомицин, доксорубицин, даунорубицин, идарубицин, митомицин С), средства против микротрубочек (например, винкристин, винбластин), противометаболические средства (например, цитарабин, метотрексат, гидроксимочевина, 5-фторурацил, флоксуридин, 6-тиогуанин, 6-меркаптопурин, флударабин, пентостатин, хлордезоксиаденозин), антрациклины, алкалоиды барвинка или эпиподофиллотоксины.
Примеры средств против злокачественной опухоли включают без ограничения ацивицин; акларубицин; акодазола гидрохлорид; акронин; адозелезин; альдеслейкин; альтретамин; амбомицин; аметантрон ацетат; аминоглютетимид; амсакрин; анастрозол; антрамицин; аспарагиназа; асперлин; азацитидин; азетепа; азотомицин; батимастат; бензодепа; бикалутамид; бисантрена гидрохлорид; биснафид димезилат, бизелесин, блеомицин сульфат; бортезомиб (Velcade); брехинар натрий; бропиримин; бусульфан; кактиномицин; калустерон; карацемид; карбетимер; карбоплатин (содержащий платину режим); кармустин; карубицина гидрохлорид; карзелесин; цедефингол; хлорамбуцил; циролемицин; цисплатин (содержащий платину режим); кладрибин; криснатол мезилат; циклофосфамид; цитарабин; дакарбазин; дактиномицин; даунорубицин; децитабин; дексормаплатин; дезагуанин; диазихон; доцетаксел (Taxotere); доксорубицин; дролоксифен; дромостанолон; дуазомицин; эдатрексат; эфлорнитин; элзамитруцин; энлоплатин; энпромат; эпипропидин; эпирубицин; эрбулозол; эрлотиниб (Tarceva); эсорубицин; эстрамустин; этанидазол; этопозид; этоприн; фадрозол; фазарабин; фенретинид; флоксуридин; флударабин; 5-фторурацил; флуроцитабин; фосхидон; фостриецин; гефитиниб (Iressa); гемцитабин; гидроксимочевина; идарубицин; ифосфамид; илмофосин; иматиниб мезилат (Gleevac); интерферон альфа-2а; интерферон альфа-2b; интерферон альфа-nl; интерферон альфа-пЗ; интерферон бета-Ia; интерферон гамма-Ib; ипроплатин; иринотекан; ланреотид; леналидомид (Revlimid, Revimid); летрозол; леупролид; лиарозола; лометрексол; ломустин; лосоксантрон; масопроцол; маитанзин; мехлортамин; мегестрол; меленгестрол; мелфалан; меногарил; меркаптопурин; метотрексат; метоприн; метуредепа; митиндомид; митокарцин; митокромин; митогиллин; митомалцин; митомицин; митоспер; митотан; митоксантрон; микофеноловую кислоту; нокодазол; ногаламицин; ормаплатин; оксисуран; паклитаксел; пемтрексед (Alimta), пегаспаргаз; пелиомицин; пентамустин; пентомон; пепломицина сульфат; перфосфамид; пипоброман; пипосулфан; пипосульфан; пиритрексим изетионат; пироксантрон; плицамицин; пломестан; порфимер; порфиромицин; преднимустин; прокарбазин; пуромицин; пуромицин; пиразофурин; рибоприн; роглетимид; сафингол; сафингол; семустин; симтразен; ситоглузид; спарфосат; спарсомицин; спирогерманий; спиромустин; спироплатин; стрептонигрин; стрептозоцин; сулофенур; тализомицин; тамсулозин; таксол; таксотер; текогалан; тегафур; телоксантрон; темопорфин; темозоломид (Temodar); тенипозид; тероксирон; тестолактон; талидомид (Thalomid) и их производные; тиамиприн; тиогуанин; тиотепа; тиазофурин; тирапазамин; топотекан; торемифен; трестолон; трицирибин; триметрексат; трипторелин; тубулозол; урацил иприт; уредепа; вапреотид; вертепорфин; винбластин; винкристин; виндесин; виндесин; винпидин; винглицинат; винлеуросин; винорелбин; винросидин; винзолидин; ворозол; зениплатин; зиностатин; зорубицин.
Средством против злокачественной опухоли может быть ингибитор фермента, в том числе без ограничения ингибитор тирозинкиназы, ингибитор CDK, ингибитор МАР-киназы или ингибитор EGFR. Ингибитором тирозинкиназы может быть без ограничения генистеин (4',5,7-тригидроксиизофлавон), тирфостин 25 (3,4,5-тригидроксифенил), метилен-пропандинитрил, гербимицин А, даидзеин (4',7-дигидроксиизофлавон), AG-126, транс-1 -(3 '-карбокси-4'-гидроксифенил)-2-(2",5"-дигидрокси-фенил)этан или HDBA (2-гидрокси-5-(2,5-дигидроксибензиламино)-2-гидроксибензойная кислота. Ингибитором CDK может быть без ограничения р21, р27, р57, р15, р16, р18 или р19. Ингибитором МАР-киназы может быть без ограничения KY12420 (C23H24O8), CNI-1493, PD98059 или 4-(4-фторфенил)-2-(4-метилсульфинил-фенил)-5-(4-пиридил)-1Н-имидазол. Ингибитором EGFR может быть без ограничения эрлотиниб (Tarceva), гефитиниб (Iressa), WHI-P97 (производное хиназолина), LFM-A12 (аналог лефлуномидного метаболита), ABX-EGF, лапатиниб, канертиниб, ZD-6474 (Zactima), AEE788 и AG1458.
Средством против злокачественной опухоли может быть ингибитор VEGF, в том числе без ограничения бевацизумаб (Avastin), ранибизумаб (Lucentis), пегаптаниб (Macugen), сорафениб, сунитиниб (Sutent), ваталаниб, ZD-6474 (Zactima), анекортав (Retaane), скваламина лактат и семафорин.
Средством против злокачественной опухоли может быть антитело или фрагмент антитела, в том числе без ограничения антитело или фрагмент антитела, в том числе без ограничения бевацизумаб (Avastin), трастузумаб (Herceptin), алемтузумаб (Campath, назначаемый при В-клеточном хроническом лимфоцитарном лейкозе), гемтузумаб (Mylotarg, hP67.6, атитело против-СОЗЗ, назначаемый при лейкозе, таком как острый миелоидный лейкоз), ритуксимаб (Rituxan), тоситумомаб (Веххаг, антитело против CD20, назначаемый при В-клеточном злокачественном новообразовании), MDX-210 (биспецифичное антитело, которое одновременно связывается с онкогенным белковым продуктом HER-2/neu и Fc-рецепторами I типа для иммуноглобулина G (IgG) (Fc-гамма RI)), ореговомаб (Ovarex, назначаемый при злокачественной опухоли яичника), эдреколомаб (Рапогех), дактизумаб (Zenapax), паливизумаб (Synagis, назначаемый при респираторных состояниях, таких как RSV инфекция), ибритумомаб тиуксетан (Zevalin, назначаемый при неходжкинской лимфоме), цетуксимаб (Erbitux), MDX-447, MDX-22, MDX-220 (антитело против TAG-72), IOR-C5, IOR-T6 (антитело против CD1), IOR EGF/R3, целоговаб (Oncoscint OV103), эпратузумаб (Lymphocide), пемтумомаб (Theragyn) и глиомаб-Н (назначаемый при злокачественной опухоли мозга, меланоме).
Средства для дифференцировки кроветворных клеток. Средством может быть средство, которое стимулирует дифференцировку кроветворных клеток-предшественников по отношению к одной или нескольким линиям. Примеры включают без ограничения IL-3, G-CSF, GM-CSF, M-CSF, тромбопоэтин, эритропоэтин, Wnt5A, WntllAHT.n.
Средства для самовосстановления кроветворных клеток. Средством может быть, средство которое стимулирует самовосстановление кроветворных клеток-предшественников. Примеры включают без ограничения набор лигандов, ингибиторы GSK-3-бета, Wnt5A вместе с SLF, активаторы Notchi, ингибиторы Lnk, простагландин Е2 (PGE2) и средства, которые стимулируют путь PGE2, в том числе PGE2, PGI2, линолевую кислоту, 13(s)-HODE, LY 171883, медовую кислоту, эйкозатриеновую кислоту, эпоксиэйкозатриеновую кислоту, ONO-259, Сау1039, агонист рецептора PGE2, 16,16-диметил PGE2, 19(К)-гидрокси PGE2, 16,16-диметил PGE2 п-(п-ацетамидобензамидо)фениловый сложный эфир, 11-дезокси-1б,16-диметил-РСЕ2, 9- дезокси-9-метилен-16,16-диметил-РОЕ2, 9-дезокси-9-метилен-РОЕ2, бутапрост, сульпростон, сериноламид-РОЕ2, метиловый сложный эфир PGE2, 16-фенилтетранор-PGE2, 15(8)-15-метил-РОЕ2, 15(К)-15-метил-РОЕ2, BIO, 8-бром-сАМР, форсколин, Bapta-AM, фендилин, никардипин, нифедипин, пимозид, строфантидин, ланатозид, L-Arg, нитропруссид натрия, ванадат натрия, брадикинин, мебеверин, флурандренолид, атенолол, пиндолол, габоксадол, кинуреновую кислоту, гидралазин, тиабендазол, бикукуллин, везамикол, перувозид, имипрамин, хлорпропамид, 1,5-пентаметилентетразол, 4-аминопиридин, диазоксид, бенфотиамин, 12-метоксидодеценовую кислоту, N-$opMHn-Met-Leu-Phe, галламин, IAA 94, хлортрианизен, их производные и т.п.
Противоинфекционные средства. Средством может быть противоинфекционное средство, в том числе без ограничения противобактериальное средство, противовирусное средство, противопаразитарное средство, противогрибковое средство и противомикобактериальное средство.
Противобактериальными средствами могут быть без ограничения (3-лактамные антибиотики, пенициллины (такие как природные пенициллины, аминопенициллины, устойчивые к пенициллиназе пенициллины, карбоксипенициллины, уреидопенициллины), цефалоспорины (цефалоспорины первого поколения, второго поколения и третьего поколения), другие р-лактамы (такие как имипенем, монобактамы), ингибиторы р-лактамазы, ванкомицин, аминогликозиды и спектиномицин, тетрациклины, хлорамфеникол, эритромицин, линкомицин, клиндамицин, рифампин, метронидазол, полимиксины, сульфонамиды и триметоприм или хинолины.
Другими Противобактериальными средствами могут быть без ограничения ацедапсон; ацетосульфон натрия; аламецин; алексидин; амдиноциллин; амдиноциллин пивоксил; амициклин; амифлоксацин; амифлоксацина мезилат; амикацин; амикацина сульфат; аминосалициловая кислота; аминосалицилат натрия; амоксициллин; амфомицин; ампициллин; ампициллин натрия; апалциллин натрия; апрамицин; аспартоцин; астромицина сульфат; авиламицин; авопакрин; азитромицин; азлоциллин; азлоциллин натрия; бакампициллина гидрохлорид; бацитрацин; бацитрацина метилендисалицилат; бацитрацин цинка; бамбермицины; бензоилпас кальция; беритромицин; бетамицина сульфат; биапенем; бинирамицин; бифенамина гидрохлорид; биспиритиона магсульфекс; бутикацин; бутирозина сульфат; капреомицина сульфат; карбадокс; карбенициллин динатрия; карбенициллин инданил натрия; карбенициллин фенил натрия; карбенициллин калия; карумонам натрия; цефаклор; цефадроксил; цефамандол; цефамандола нафат; цефамандол натрия; цефапарол; цефатризин; цефазафлур натрия; цефазолин; цефазолин натрия; цефбуперазон; цефдинир; цефепим; цефепима гидрохлорид; цефетикол; цефиксим; цефменоксима гидрохлорид; цефметазол; цефметазол натрия; цефоницид мононатрия; цефоницид натрия; цефоперазон натрия; цефоранид; цефотаксим натрия; цефотетан; цефотетан динатрия; цефотиама гидрохлорид; цефокситин; цефокситин натрия; цефпимизол; цефпимизол натрия; цефпирамид; цефпирамид натрия; цефпирома сульфат; цефподоксим проксетил; цефпрозил; цефпроксадин; цефсулодин натрия; цефтазидим; цефтибутен; цефтизоксим натрия; цефтриаксон натрия; цефуроксим; цефуроксима аксетил; цефуроксим пивоксетил; цефуроксим натрия; цефацетрил натрия; цефалексин; цефалексина гидрохлорид; цефалоглицин; цефалоридин; цефалотин натрия; цефапирин натрия; цефрадин; цетоциклина гидрохлорид; цетофеникол; хлорамфеникол; хлорамфеникола пальмитат; комплекс хлорамфеникола пантотената; хлорамфеникола натрия сукцинат; хлоргексидина фосфанилат; хлорксиленол; хлортетрациклина бисульфат; хлортетрациклина гидрохлорид; циноксацин; ципрофлоксацин; ципрофлоксацина гидрохлорид; циролемицин; кларитромицин; клинафлоксацина гидрохлорид; клиндамицин; клиндамицина гидрохлорид; клиндамицина пальмитата гидрохлорид; клиндамицина фосфат; клофазимин; клоксациллина бензатин; клоксациллин натрия; клоксиквин; колистиметат натрия; колистина сульфат; коумермицин; коумермицин натрия; циклациллин; циклосерин; далфопристин; дапсон; даптомицин; демеклоциклин; демеклоциклина гидрохлорид; демециклин; денофунгин; диаверидин; диклоксациллин; диклоксациллин натрия; дигидрострептомицина сульфат; дипиритион; диритромицин; доксициклин; доксициклин кальция; доксициклин фосфатекс; доксициклина гиклат; дроксацин натрия; эноксацин; эпициллин; эпитетрациклина гидрохлорид; эритромицин; эритромицина ацистрат; эритромицина эстолат; эритромицина этилсукцинат; эритромицина глюцептат; эритромицина лактобионат; эритромицина пропионат; эритромицина стеарат; этамбутола гидрохлорид; этионамид; флероксацин; флоксациллин; флудаланин; флумеквин; фосфомицин; фосфомицина трометамин; фумоксициллин; фуразолия хлорид; фуразолия тартрат; фузидат натрия; фузидовая кислота; гентамицина сульфат; глоксимонам; грамицидин; галопрогин; гетациллин; гетациллин калия; гекседин; ибафлоксацин; имипенем; изоконазол; изепамицин; изониазид; джозамицин; канамицина сульфат; китазамицин; левофуралтадон; левопропилциллин калия; лекситромицин; линкомицин; левопропилциллина гидрохлорид; ломефлоксацин; ломефлоксацина гидрохлорид; ломефлоксацина мезилат; лоракарбеф; мафенид; меклоциклин; меклоциклина сульфосалицилат; мегаломицина калия фосфат; меквидокс; меропенем; метациклин; метациклина гидрохлорид; метенамин; метенамина гиппурат; метенамина манделат; метициллин натрия; метиоприм; метронидазола гидрохлорид; метронидазола фосфат; мезлоциллин; мезлоциллин натрия; миноциклин; миноциклина гидрохлорид; миринкамицина гидрохлорид; монензин; монензин натрия; нафциллин натрия; налидиксат натрия; налидиксовая кислота; натамицин; небрамицин; неомицина пальмитат; неомицина сульфат; неомицина ундециленат; нетилмицина сульфат; нейтрамицин; нифурадин; нифуралдезон; нифурател; нифуратрон; нифурдазил; нифуримид; нифурпиринол; нифурхиназол; нифуртиазол; нитроциклин; нитрофурантоин; нитромид; норфлоксацин; новобиоцин натрия; офлоксацин; орметоприм; оксациллин натрия; оксимонам; оксимонам натрия; оксолиновая кислота; окситетрациклин; окситетрациклин кальция; окситетрациклина гидрохлорид; палдимицин; парахлорфенол; пауломицин; пефлоксацин; пефлоксацина мезилат; пенамециллин; пенициллин G бензатин; пенициллин G калия; пенициллин G прокаин; пенициллин G натрия; пенициллин V; пенициллин V бензатин; пенициллин V гидрабамин; пенициллин V калия; пентизидон натрия; фениламиносалицилат; пиперациллин натрия; пирбенициллин натрия; пиридициллин натрия; пирлимицина гидрохлорид; пивампициллина гидрохлорид; пивампициллина памоат; пивампициллина пробенат; полимиксина В сульфат; порфиромицин; пропикаин; пиразинамид; пиритион цинк; хиндекамина ацетат; хинупристин; рацефеникол; рамопланин; ранимицин; реломицин; репромицин; рифабутин; рифаметан; рифамексил; рифамид; рифампин; рифапентин; рифаксимин; ролитетрациклин; ролитетрациклина нитрат; розарамицин; розарамицина бутират; розарамицина пропионат; розарамицина натрия фосфат; розарамицина стеарат; розоксацин; роксарзон; рокситромицин; санциклин; санфетринем натрия; сармоксициллин; сарпициллин; скопафунгин; сизомицин; сизомицина сульфат; спарфлоксацин; спектиномицина гидрохлорид; спирамицин; сталлимицина гидрохлорид; стеффимицин; стрептомицина сульфат; стрептоникозид; сульфабенз; сульфабензамид; сульфацетамид; сульфацетамид натрия; сульфацитин; сульфадиазин; сульфадиазин натрия; сульфадоксин; сульфален; сульфамеразин; сульфаметер; сульфаметазин; сульфаметизол; сульфаметоксазол; сульфамонометоксин; сульфамоксол; сульфанилат цинка; сульфанитрин; сульфасалазин; сульфазомизол; сульфатиазол; сульфазамет; сульфизоксазол; сульфизоксазола ацетил; сульфизоксазола диоламин; сульфомиксин; сулопенем; султамициллин; санциллин натрия; талампициллина гидрохлорид; теикопалнин; темафлоксацина гидрохлорид; темоциллин; тетрациклин; тетрациклина гидрохлорид; комплекс тетрациклина фосфата; тетроксоприм; тиамфеникол; тифенциллин калия; тикарциллин крезил натрия; тикарциллин динатрия; тикарциллин мононатрия; тиклатон; тиодония хлорид; тобрамицин; тобрамицина сульфат; тосуфлоксацин; триметоприм; триметоприма сульфат; трисульфапиримидины; тролеандомицин; троспектомицина сульфат; тиротрицин; ванкомицин; ванкомицина гидрохлорид; вирджиниамицин или зорбамицин.
Противомикобактериальными средствами могут быть без ограничения миамбутол (этамбутола гидрохлорид), дарсон (4,4'-диаминодифенилсульфон), гранулы пазера (гранулы аминосалициловой кислоты), прифтин (рифапентин), пиразинамид, изониазид, рифадин (рифампин), рифадин IV, рифамат (рифампин и изониазид), рифатер (рифампин, изониазид и пиразинамид), стрептомицина сульфат или трекатор-SC (этионамид).
Противовирусными средствами могут быть без ограничения амантидин и римантадин, рибиварин, ацикловир, видарабин, трифтортимидин, ганцикловир, зидовудин, ретиновир и интерфероны.
Кроме того, противовирусные средства без ограничения включают ацеманнан; ацикловир; ацикловир натрия; адефовир; аловудин; алвирсепт судотокс; амантадина гидрохлорид; аранотин; арилдон; атевирдина мезилат; авридин; цидофовир; ципамфиллин; цитарабина гидрохлорид; делавирдина мезилат; десцикловир; диданозин; дизоксарил; эдоксудин; энвираден; энвироксим; фамцикловир; фамотина гидрохлорид; фиацитабин; фиалуридин; фозарилат; фоскарнет натрия; фосфонет натрия; ганцикловир; ганцикловир натрия; идоксуридин; кетоксал; ламивудин; лобукавир; мемотина гидрохлорид; метисазон; невирапин; пенцикловир; пиродавир; рибавирин; римантадина гидрохлорид; саквинавира мезилат; сомантадина гидрохлорид; соривудин; статолон; ставудин; тилорона гидрохлорид; трифлуридин; валацикловира гидрохлорид; видарабин; видарабина фосфат; видарабина натрия фосфат; вироксим; залцитабин; зидовудин; зинвироксим или ингибиторы интегразы.
Противогрибковыми средствами могут быть без ограничения имидазолы и триазолы, полиен-макролидные антибиотики, гризеофульвин, амфотерин В и флуцитозин. Противопаразитарные сресдтва включают в себя тяжелые металлы, противомалярийные хинолины, антагонисты фолата, нитроимидазолы, бензимидазолы, авермектины, праксиквантел, ингибиторы орнитиндекарбоксилазы, фенолы (например, битионол, никлозамид); синтетический алкалоид (например, дегидроэметин); пиперазины (например, диэтилкарбамазин); ацетанилид (например, дилоксанида фуроат); галогенированные хинолины (например, йодохинол (дийодогидроксихин)); нитрофураны (например, нифуртимокс); диамидины (например, пентамидин); тетрагидропиримидин (например, пирантела памоат) или сульфатированный нафтиламин (например, сурамин).
Другими противоинфекционными средствами могут быть без ограничения дифлоксацина гидрохлорид; лаурил изохинолиния бромид; моксалактам динатрия; орнидазол; пентизомицин; сарафлоксацина гидрохлорид; ингибиторы протеазы ВИЧ и других ретровирусов; ингибиторы интегразы ВИЧ и других ретровирусов; цефаклор (Ceclor); ацикловир (Zovirax); норфлоксацин (Noroxin); йефокситин (Mefoxin); цефуроксима аксетил (Ceftin); ципрофлоксацин (Cipro); аминакрина гидрохлорид; бензетония хлорид; битионолат натрия; бромхлоренон; карбамида пероксид; цеталкония хлорид; цетилпиридиния хлорид; хлоргексидина гидрохлорид; клиохинол; домифена бромид; фентиклор; флудазония хлорид; фуксин основный; фуразолидон; генцианвиолет; халхинолы; гексахлорофен; перекись водорода; ихтаммол; имидецил йод; йод; изопропиловый спирт; мафенида ацетат; мералеин натрия; меркуфенола хлорид; аммонизированная ртуть; метилбензетония хлорид; нитрофуразон; нитромерзол; октенидина гидрохлорид; оксихлорозен; оксихлорозен натрия; содержащий камфару парахлорофенол; перманганат калия; повидон-йод; сепазония хлорид; нитрат серебра; сульфадиазин серебра; симклозен; тимерфонат натрия; тимерозал или троклозен калия.
Средства на основе нуклеиновых кислот.Нуклеиновые кислоты, которые могут быть доставлены субъекту в соответствии с настоящим изобретением, включают ДНК природного или неприродного происхождения (в том числе кДНК, геномную ДНК, ядерную ДНК, митохондриальную ДНК), РНК (в том числе мРНК, рРНК, тРНК), олигонуклеотиды, молекулу, образующую тройную спираль, иммуностимулирующие нуклеиновые кислоты, такие как описанные в патенте США №6194388 (раскрытие которого, относящиеся к иммуностимулирующим нуклеиновым кислотам, содержащим CpG, включены в настоящий документ посредством ссылки), малую интерферирующую РНК (siRNA) или микроРНК (miRNA), используемую для модуляции экспрессии генов, антисмысловые олигонуклеотиды, использемые для модуляции экспрессии генов, аптамеры, рибозимы, ген или фрагмент гена, регуляторную последовательность, в том числе их аналоги, производные и комбинации. Эти нуклеиновые кислоты могут быть введены в чистом виде или в комплексе с другим компонентом, например, для облегчения их связывания и/или поглощения мишеневыми тканями и/или клетками.
Противовоспалительные средства. Противовоспалительными средствами являются средства, которые снижают или устраняют воспаление. Они включают алклофенак; алклометазона дипропионат; аглестона ацетонид; альфа-амилазу; амцинафал; амцинафид; амфенак натрия; амиприлозы гидрохлорид; анакинру; аниролак; анитразафен; апазон; балзалазид динатрия; бендазак; беноксапрофен; бензидамина гидрохлорид; бромелайны; броперамол; будезонид; карпрофен; циклопрофен; цинтазон; клипрофен; клобетазола пропионат; клобетазона бутират; клопирак; клотиказона пропионат; корметазона ацетат; кортодоксон; дефлазакорт; дезонид; дезокиметазон; дексаметазона дипропионат; диклофенак калия; диклофенак натрия; дифлоразона диацетат; дифлумидон натрия; дифлунизал; дифлупреднат; дифталон; диметилсульфоксид; дроцинонид; эндризон; энлимомаб; эноликам натрия; эпиризол; этодолак; этофенамат; фелбинак; фенамол; фенбуфен; фенклофенак; фенклорак; фендозал; фенпипалон; фентиазак; флазалон; флуазакорт; флуфенамовую кислоту; флумизол; флунизолида ацетат; флуниксин; флуниксин меглумин; флуокортин бутил; флуорометалона ацетат; флуквазон; флурбипрофен; флуретофен; флутиказона пропионат; фурапрофен; фуробуфен; галцинонид; галобетазола пропионат; галопредона ацетат; ибуфенак; ибупрофен; ибупрофен алюминия; ибупрофен пиконол; илонидап; индометацин; индометацин натрия; индопрофен; индоксол; интразол; изофлупредона ацетат; изоксепак; изоксикам; кетопрофен; лофемизола гидрохлорид; лорноксикам; лотепреднола этабонат; меклофенамат натрия; меклофенамовую кислоту; меклоризона дибутират; мефенамовую кислоту; месаламин; месеклазон; метилпреднизолона сулептанат; морнифлумат; набуметон; напроксен; напроксен натрия; напроксол; нимазон; олсалазин натрия; орготеин; орпаноксин; оксапрозин; оксифенбутазон; паранилина гидрохлорид; пентозана полисульфат натрия; фенбутазон натрия глицерат; пирфенидон; пироксикам; пироксикама циннамат; пироксикама оламин; пирпрофен; предназат; прифелон; продоловую кислоту; проквазон; проксазол; проксазола цитрат; римексолон; ромазарит; салколекс; салнацедин; салсалат; салицилаты; сангвинария хлорид; секлазон; серметацин; судоксикам; сулиндак; супрофен; талметацин; талнифлумат; талосалат; тебуфелон; тенидап; тенидап натрия; теноксикам; тезикам; тезимид; тетридамин; тиопинак; тиксокортола пивалат; толметин; толметин натрия; триклонид; трифлумидат; зилометацин; глюкокортикоиды; зомепирак натрия. Одним предпочтительным противовоспалительным средством является аспирин.
Другие средства. Средствами могут быть без ограничения адренергическое средство; адренокортикальный стероид; адренокортикальный супрессант; спиртовой замедлитель; антагонист альдостерона; детоксикант аммиака; аминокислота; средство для амиотрофического латерального склероза; анаболик; аналептик; анальгетик; андроген; анестетик; аноректик; средство, понижающее аппетит; активатор передней доли гипофиза; супрессант передней доли гипофиза; противоглистное средство; средство против угревой сыпи; противоадренергическое средство; противоаллергическое средство; противоамебное средство; противоандрогенное средство; средство против анемии; противоангинальное средство; средство против тревожности; противоартритное средство; противоастматическое средство, в том числе β-адренергические агонисты, метилксантины, средства, стабилизирующие тучные клетки, антихолиннергические средства, адренокортикальные стероиды, такие как глюкокортикоиды; противоатеросклеротическое средство; средство против камней в желчном пузыре; холелитолитическое средство; антихолинергическое средство; антикоагулянт; противококцидное средство; противосудорожное средство; антидепрессант; противодиабетическое средство; противодиарейное средство; антидиуретик; антидот; противодискинетическое средство; противорвотное средство; противоэпилептическое средство; противоэстрогенное средство; антифибринолитик; противоглаукомное средство; кровоостанавливающее средство; гемореологическое средство; антигистамин; антигиперлипидемическое средство; антигиперлипопротеинемическое средство; противогипертоническое средство; противогипотензивное средство; противоинфекционное средство; противовоспалительное средство; антикератинизирующее средство; средство против мигрени; антимитотическое средство; противогрибковое средство; средство против тошноты; антинейтропеническое средство; антиобсессивное средство; антиоксидант; антипаркинсоническое средство; противоперистальтическое средство; противопневмоцистное средство; средство против гипертрофии предстательной железы; антипротозойное средство; противозудное средство; противопсориазное средство; антипсихотическое средство; противоревматическое средство; антишистосомозное средство; противосеборейное средство; антисекреторное средство; противосудорожное средство; антитромботическое средство; противокашлевое средство; противоязвенное средство; противоуролитическое средство; супрессант аппетита; регулятор глюкозы в крови; ингибитор резорбции кости; бронхолитическое средство; ингибитор карбоангидразы; кардиодепрессант; кардиозащитное средство; кардиотоническое средство; сердечно-сосудистое средство; средство против ишемии головного мозга; желчегонное средство; холинэргическое средство; холинэргический агонист; дезактиватор холинэстеразы; кокцидиостатическое средство; стимулятор когнитивных функций; корректор нарушений когнитивных функций; средство против конъюнктивита; контрастирующее средство; депрессант; диагностическое вспомогательное средство; диуретик; допаминергическое средство; эктопаразитицид; рвотное средство; ингибитор фермента; эстроген; агонист эстрогенового рецептора; фибринолитическое средство; флуоресцентное средство; поглотитель радикалов свободного кислорода; супрессант желудочной кислоты; эффектор двигательной активности желудочно-кишечного тракта; гериатрическое средство; глюкокортикоид; лекарственное вещество, стимулирующее половую железу; стимулятор роста волос; гемостатическое средство; травяное активное средство; антагонисты гистаминовых Н2-рецепторов; гормон; гипохолестеринемическое средство; гипогликемическое средство; гиполипидемическое средство; гипотензивное средство; ингибитор HMGCoA-редуктазы; средство для лечения полового бессилия; средство против воспалительного заболевания кишечника; кератолитическое средство; агонист LHRH; средство против нарушений печени; лютеолизин; средство для улучшения памяти; усилитель психической деятельности; минерал; регулятор настроения; муколитик; средство для защиты слизистой; средство против рассеянного склероза; средство, расширяющее зрачок; средство против заложенности носа; нейролептик; средство нейромышечного блокирования; нейропротекторное средство; антагонист NMDA; производное негормонального стерола; питательное вещество; средство, стимулирующее родовую деятельность; средство против болезни Паджета; активатор плазминогена; антагонист фактора активации тромбоцита; ингибитор агрегации тромбоцитов; средства, применяемые после удара и после травмы головы; прогестин; простагландин; ингибитор роста предстательной железы; протиротропин; психотропное средство; радиоактивное средство; релаксант; средство против ринита; противочесоточное средство; склерозирующее средство; седативное средство; седативно-снотворное средство; селективный антагонист аденозина А1; отшелушивающие средства; антагонист серотонина; ингибитор серотонина; антагонист серотонинового рецептора; стероид; стимулятор; супрессант; гормон щитовидной железы; ингибитор гормона щитовидной железы; миметик гормона щитовидной железы; транквилизатор; средство против нестабильной стенокардии; средство, способствующее выведению мочевой кислоты; сосудосуживающее средство; сосудорасширяющее средство; ранозаживляющее; средство для лечения ран или ингибитор ксантиноксидазы.
Субъекты
Настоящее изобретение может быть осуществлено фактически с субъектом любого типа, который может получить пользу от доставки средств, как это предусмотрено в настоящем документе. В некоторых вариантах осуществления в соответствии с настоящим изобретением предпочтительными субъектами являются люди. Субъектами также могут быть животные, такие как домашние животные (например, собаки, кошки, кролики, хорьки и т.п.), домашний скот или сельскохозяйственные животные (например, коровы, свиньи, овцы, куры и другая домашняя птица), лошади, такие как чистокровные лошади, лабораторные животные (например, мыши, крысы, кролики и подобные) и т.п. Субъектами также могут быть рыбы и другие виды водных животных.
Субъектами, которым доставляются средства, могут быть нормальные субъекты. Альтернативно они могут иметь состояние или могут быть подвержены риску развития состояния, которое может диагностироваться, или на которое может успешно повлиять доставка одного или нескольких конкретных средств.
Такие состояния включают злокачественную опухоль (например, солидные злокачественные опухоли или несолидную злокачественную опухоль, такую как лейкоз), инфекции (в том числе инфекции, локализованные на конкретных участках или в тканях организма), аутоиммунные нарушения, аллергии или аллергические состояния, астму, отторжение трансплантата и т.п.
Тесты для диагностики различных состояний, охватываемых настоящим изобретением, известны в предшествующем уровне техники и будут знакомы практикующему врачу. Такие лабораторные тесты включают без ограничения анализы с использованием микроскопии, тесты с использованием культивирования (такие как культуры), и тесты по выявлению нуклеиновых кислот. Они включают влажные препараты, микроскопию с усилением окрашиванием, иммунную микроскопию (например, FISH), микроскопию гибридизации, агглютинацию частиц, связывающие фермент иммуносорбентные анализы, скрининг-тесты мочи, гибридизацию ДНК-зонда, серологические тесты и т.п.Как правило, терапевт также учитывает полную историю болезни и проводит полный медицинский осмотр в дополнение к проведению перечисленных выше лабораторных тестов.
Субъектом со злокачественной опухолью является субъект, у которого имеются выявляемые клетки злокачественной опухоли. Субъектом, подверженным риску развития злокачественной опухоли, является субъект, который характеризуется превышающей норму вероятностью развития злокачественной опухоли. Такими субъектами являются, например, субъекты, имеющие генетическое отклонение, которое, как было продемонстрировано, связано с более высокой вероятностью развития злокачественной опухоли, субъекты, имеющие семейную предрасположенность к злокачественной опухоли, субъекты, подвергшиеся воздействию средств, вызывающих злокачественную опухоль (т.е. карциногенов), таких как табак, асбест или другие химические токсины, и субъекты, ранее получавшие лечение по поводу злокачественной опухоли и в очевидной ремиссии.
Субъектами, имеющими инфекцию, являются те, у которых проявляются ее симптомы, в том числе без ограничения лихорадка, озноб, миалгия, фотофобия, фарингит, острая лимфаденопатия, спленомегалия, желудочно-кишечное расстройство, лейкоцитоз или лейкопения, и/или те, у которых могут быть выявлены инфицирующие патогены или продукты их жизнедеятельности.
Субъектом, подверженным риску развития инфекции, является субъект, который подвержен риску воздействия инфицирующего патогена. Такими субъектами являются те, которые живут в зоне существования таких патогенов, и где такие инфекции являются распространенными. Такими субъектами также являются те, которые занимаются опасными видами деятельности, такими как обмен иглами, вступающие в незащищенный половой контакт, периодически контактируют с инфекционными образцами субъектов (например, медицинские сотрудники), люди, перенесшие хирургическое вмешательство, в том числе без ограничения абдоминальную операцию, и т.п.
Субъект может иметь или может быть подвержен риску развития инфекции, такой как бактериальная инфекция, вирусная инфекция, грибковая инфекция, паразитарная инфекция или микобактериальная инфекция. В таких вариантах осуществления везикулы могут содержать противомикробное средство, такое как противобактериальное средство, противовирусное средство, противогрибковое средство, противопаразитарное средство или противомикобактериальное средство, и клеточные носители (например, Т-клетки) могут быть созданы генно-инженерным методом для получения другого средства, подходящего для стимуляции иммунной реакции против инфекции или для потенциального лечения инфекции.
Злокачественная опухоль
Настоящее изобретение предусматривает введение средств субъектам, имеющим злокачественную опухоль или подверженным риску развития злокачественной опухоли, в том числе, например, солидной злокачественной опухоли, с использованием везикул в соответствии с настоящим изобретением. Средствами могут быть противораковые средства, в том числе химиотерапевтические средства, терапевтические средства на основе антител, терапевтические средства на основе гормонов и ингибирующие ферменты средства, и/или они могут быть иммуностимулирующими средствами, такими как антигены (например, антигены злокачественной опухоли) и/или адъюванты, и/или они могут быть диагностическими средствами (например, визуализирующими средствами) или любыми другими средствами, описанными в настоящем документе. Настоящее изобретение предусматривает, что везикулы в соответствии с настоящим изобретением способны доставлять большие количества этих средств по отдельности или в комбинации, этим субъектам и/или обеспечивать пролонгированное воздействие на субъекта этих средств благодаря замедленному равномерному профилю высвобождения.
Злокачественной опухолью может быть карцинома, саркома или меланома. Карциномы включают без ограничения базально-клеточную карциному, злокачественную опухоль желчных протоков, злокачественную опухоль мочевого пузыря, злокачественную опухоль молочной железы, злокачественную опухоль шейки матки, хориокарциному, злокачественную опухоль ЦНС, злокачественную опухоль ободочной кишки и прямой кишки, злокачественную опухоль почек или клеток почечного эпителия, злокачественную опухоль гортани, злокачественную опухоль печени, мелкоклеточный рак легкого, немелкоклеточный рак легкого (NSCLC, в том числе аденокарциному, гигантоклеточную (или овсяно-клеточную) карциному и плоскоклеточную карциному), злокачественную опухоль ротовой полости, злокачественная опухоль яичника, злокачественную опухоль поджелудочной железы, злокачественную опухоль предстательной железы, злокачественную опухоль кожи (в том числе базально-клеточный рак и плоско-клеточный рак), злокачественную опухоль желудка, злокачественную опухоль яичек, злокачественную опухоль щитовидной железы, злокачественную опухоль матки, злокачественную опухоль прямой кишки, злокачественную опухоль дыхательной системы и злокачественную опухоль мочевыделительной системы.
Саркомы представляют собой редкие мезенхемальные новообразования, которые возникают в кости (остеосаркомы) и мягких тканях (фибросаркомы). Саркомы включают без ограничения липосаркомы (в том числе слизеподобные липосаркомы и плеоморфные липосаркомы), лейомиосаркомы, рабдомиосаркомы, злокачественные опухоли оболочек периферических нервов (также называемые злокачественными шванномами, нейрофибросаркомами или нейрогенными саркомами), опухоли Юинга (в том числе саркому кости Юинга, внескелетную (т.е. не костную) саркому Юинга и примитивную нейроэктодермальную опухоль), синовиальную саркому, ангиосаркомы, гемангиосаркомы, лимфангиосаркомы, саркому Калоши, гемангиоэндотелиому, десмоидную опухоль (также называемую агрессивным фиброматозом), выбухающую дерматофибросаркому (DFSP), злокачественную фиброзную гистиоцитому (DFSP), гемангиоперицитому, злокачественную мезенхимому, альвеолярную саркому мягких тканей, эпителиоидную саркому, светлоклеточную саркому, десмопластическую мелкоклеточную опухоль, желудочно-кишечную стромальную опухоль (GIST) (также известную как желудочно-кишечная стромальная саркома) и хондросаркому.
Меланомы представляют собой опухоли, возникающие из меланоцитарной системы кожи и других органов. Примеры меланомы включают без ограничения ограниченный предраковый меланоз, поверхностную генерализованную меланому, узелковую меланому и акральную лентигинозную меланому.
Злокачественная опухоль может быть солидной лимфомой. Примеры включают лимфому Ходжкина, неходжскинскую лимфому и В-клеточную лимфому.
Злокачественной опухолью может быть без ограничения злокачественная опухоль костной ткани, злокачественная опухоль головного мозга, злокачественная опухоль молочной железы, колоректальная злокачественная опухоль, злокачественная опухоль соединительной ткани, злокачественная опухоль пищеварительной системы, злокачественная опухоль эндометрия, злокачественная опухоль пищевода, злокачественная опухоль органов зрения, злокачественная опухоль головы и шеи, злокачественная опухоль желудка, интраэпителиальное новообразование, меланома, нейробластома, неходскинская лимфома, немелкоклеточный рак легкого, злокачественная опухоль предстательной железы, ретинобластома или рабдомиосаркома.
Инфекция
Настоящее изобретение предусматривает введение средств субъектам, имеющим инфекцию или подверженным риску развития инфекции, такой как бактериальная инфекция, вирусная инфекция, грибковая инфекция, паразитарная инфекция или микобактериальная инфекция, с использованием везикул в соответствии с настоящим изобретением. Средствами могут быть противоинфекционные средства, в том числе противобактериальные средства, противовирусные средства, противогрибковые средства, противопаразитарные средства и противомикобактериальные средства), иммуностимулирующие средства, такие как антигены (например, микробные антигены такие, как как бактериальные антигены, вирусные антигены, грибковые антигены, паразитические антигены и микокбактериальные антигены), и/или адъюванты, диагностические средства (например, визуализирующие средства) или любые другие средства, описанные в настоящем документе. Настоящее изобретение предусматривает, что везикулы в соответствии с настоящим изобретением способны доставлять большие количества этих средств по отдельности или в комбинации таким субъектам и/или обеспечивать пролонгированное воздействие на субъекта этих средств, благодаря замедленному равномерному профилю высвобождения.
Бактериальная инфекция может быть без ограничения инфекцией Е. coli, стафилококковой инфекцией, стрептококковой инфекцией, инфекцией Pseudomonas, инфекцией Clostridium difficile, инфекцией Legionella, пневмококковой инфекцией, инфекцией Haemophilus, инфекцией Klebsiella, инфекцией Enterobacter, инфекцией Citrobacter, инфекцией Neisseria, инфекцией Shigella, сальмонеллезной инфекцией, инфекцией Listeria, инфекцией Pasteurella, инфекцией Streptobacillus, инфекцией Spirillum, инфекцией Treponema, инфекцией Actinomyces, инфекцией Borrelia, инфекцией Corynebacterium, инфекцией Nocardia, инфекцией Gardnerella, инфекцией Campylobacter, инфекцией Spirochaeta, инфекцией Proteus, инфекцией Bacteriodes, инфекцией Н. pylori или сибиреязвенной инфекцией.
Микобактериальная инфекция может быть без ограничения туберкулезом или проказой, вызванными видами М. tuberculosis и М. leprae, соответственно.
Вирусная инфекция может быть без ограничения инфекцией Herpes simplex virus 1, инфекцией Herpes simplex virus 2, цитомегаловирусной инфекцией, инфекцией вируса гепатита А, инфекцией вируса гепатита В, инфекцией вируса гепатита С, инфекцией вируса папилломы человека, инфекцией вируса Эпштейна-Барра, ротавирусной инфекцией, аденовирусной инфекцией, инфекцией вируса гриппа, инфекцией вируса гриппа А, инфекцией H1N1 (свиного гриппа), инфекцией респираторно-синцитиального вируса, инфекцией вируса ветряной оспы, инфекцией черной оспы, инфекцией обезьяньей оспы, инфекцией SARS или инфекцией птичьего гриппа.
Грибковая инфекция может быть без ограничения кандидозом, стригущим лишаем, гистоплазмозом, бластомикозом, паракокцидиоидомикозом, криптококкозом, аспергиллезом, хромомикозом, мицетомами, псевдоаллешериозом или разноцветным лишаем.
Паразитарная инфекция может быть без ограничения амебиазом, инфекцией Trypanosoma cruzi, фасциолезом, лейшманиозом, инфекциями Plasmodium, онхоцеркозом, парагонимозом, инфекцией Trypanosoma brucei, инфекцией Pneumocystis, инфекцией Trichomonas vaginalis, инфекцией Taenia, инфекцией Hymenolepsis, эхинококковыми инфекциями, шистосомозом, нейроцистицеркозом, инфекцией Necator americanus или инфекцией Trichuris trichuria.
Аллергия и астма
Настоящее изобретение предусматривает введение средств субъектам, страдающим аллергией или астмой или подверженным риску развития аллергии или астмы. Средствами могут быть аллергены, иммуностимулирующие средства, в том числе средства, которые стимулируют ответ ТЫ, иммуноингибирующие или иммуноподавляющие средства, в том числе средства, которые ингибируют ответ Th2, противовосалительные средства, антагонисты лейкотриенов, мутеины IL-4, растворимые рецепторы IL-4, антитела против IL-4, антагонисты IL-4, антитела против IL-5, белки слияния рецептора Fc с растворимым IL-13, антитела против IL-9, антагонисты CCR3, антагонисты CCR5, ингибиторы VLA-4 и другие даунрегуляторы IgE, такие как без ограничения антитела против IgE, цитокины, такие как Thi, цитокины, такие как IL-12 и гамма-интерферон, стероиды, в том числе кортикостероиды, такие как преднизолон, и/или они могут быть диагностическими средствами (например, визуализирующими средствами) или любыми другими средствами, описанными в настоящем документе. Настоящее изобретение предусматривает, что везикулы в соответствии с настоящим изобретением способны доставлять большие количества таких средств по отдельности или в комбинации субъектам и/или обеспечивать пролонгированное воздействие на субъекта таких средств благодаря замедленному равномерному профилю высвобождения.
Аллергия представляет собой приобретенную гиперчувствительность к аллергену. Аллергические состояния включают без ограничения экзему, аллергический ринит или острый ринит, сенную лихорадку, бронхиальную астму, крапивную лихорадку (крапивницу) и аллергии на продукты питания, а также другие атопические состояния. Аллергии обычно вызываются образованием антител IgE против безвредных аллергенов. Астма представляет собой расстройство дыхательной системы, характеризующееся воспалением, сужением дыхательных путей и повышенной реактивностью дыхательных путей к вдыхаемым агентам. Астма часто, хотя не исключительно, ассоциируется с атопическими или аллергическими симптомами.
Аутоиммунное заболевание
Настоящее изобретение предусматривает введение средств субъектам, страдающим аутоиммунным заболеванием или расстройством или подверженным риску развития аутоиммунного заболевания или расстройства. Средствами могут быть иммуноингибирующие или иммуноподавляюще средства, в том числе те, которые ингибируют ответ Thi, иммуностимулирующие средства, которые стимулируют ответ Th2, цитокины, такие как IL-4, IL-5 и IL-10, противовоспалительные средства, и/или они могут быть диагностическими средствами (например, визуализирующими средствами) или любыми другими средствами, описанными в настоящем документе. Настоящее изобретение предусматривает, что везикулы в соответствии с настоящим изобретением способны доставлять большие количества таких средств по отдельности или в комбинации таким субъектам, и/или обеспечивать пролонгированное воздействие на субъекта таких средств благодаря замедленному равномерному профилю высвобождения.
Аутоиммунные заболевания представляют собой класс заболеваний, при которых собственные антитела субъекта реагируют с тканями хозяина, или при которых иммунные эффекторные Т-клетки являются аутореактивными по отношению к эндогенным аутопептидам и вызывают разрушение тканей. Таким образом, нарастает иммунная реакция против собственных антигенов субъекта, называемых аутоантигенами. Аутоиммунные заболевания обычно считаются находящимися под влиянием ТЫ. В результате индукция иммунной реакции Th2 или Тп2-подобных цитокинов может оказывать благотворный эффект.
Аутоиммунные заболевания включают без ограничения ревматоидный артрит, болезнь Крона, рассеянный склероз, системную красную волчанку (SLE), аутоимуунный энцефаломиелит, миастению гравис (MG), тиреоидит Хашимото, синдром Гудпасчера, пемфигус (например, обыкновенную пузырчатку), болезнь Грейва, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопеническую пурпуру, склеродермию с антителами против коллагена, смешанное поражение соединительной ткани, полиомиозит, пернициозную анемию, идиопатическую болезнь Аддисона, связанное с аутоиммунными реакциями бесплодие, гломерулонефрит (например, серповидный гломерулонефрит, пролиферативный гломерулонефрит), буллезный пемфигоид, синдром Шегрена, резистентность к инсулину и аутоиммунный сахарный диабет.
Трансплантационная терапия
Настоящее изобретение предусматривает введение средств субъектам, подвергающимся трансплантации клеток или органов. Средства могут быть иммуноингибирующими или иммуноподавляющими средствами, противовоспалительными средствами, и/или они могут быть диагностическими средствами (например, визуализирующими средствами) или любыми другими средствами, описанными в настоящем документе. Настоящее изобретение предусматривает, что везикулы в соответствии с настоящим изобретением способны доставлять большие количества таких средств по отдельности или в комбинации таким субъектам и/или обеспечивать пролонгированное воздействие на субъекта такими средствами, благодаря замедленному равномерному профилю высвобождения.
Композиции и способы, представленные в настоящем документе, могут также использоваться для модулирования иммунных реакций после трансплантационной терапии. Успешность трансплантации часто ограничивается отторжением трансплантированной ткани иммунной системой организма. В результате реципиенты трансплантата обычно получают иммуноподавляющие препараты на протяжении длительных периодов времени с целью обеспечения приживаемости трансплантированной ткани. Настоящее изобретение предусматривает доставку иммуномодуляторов, в частности, иммуноингибирующих средств, к участку трансплантации с целью минимизации реакции отторжения трансплантата. Таким образом, настоящее изобретение предусматривает введение субъектам, которые будут подвергаться, подвергаются или подвергались трансплантации.
Вышеупомянутые перечни подразумеваются не исчерпывающими, а скорее иллюстративными. Специалисты в данной области определят другие примеры для каждого типа состояний, которые поддаются предотвращению и лечению с использованием способов в соответствии с настоящим изобретением.
Эффективные количества, режимы, составы
Средства вводятся в форме стабилизированных MLV и в эффективных количествах. Эффективное количество представляет собой дозу средства, достаточную для обеспечения клинически желаемого результата. Эффективное количество будет варьировать в зависимости от желаемого исхода, конкретного состояния, подлежащего лечению или предотвращению, возраста и физического состояния субъекта, подлежащего лечению, тяжести состояния, длительности лечения, природы сопутствующей или комбинированной терапии (если таковая имеет место), конкретного способа введения и подобных факторов, находящихся в сфере компетенции лечащего врача. В целом, предпочтительно использовать максимальную дозу, т.е. самую высокую безопасную дозу в соответствии с результатами тщательной медицинской оценки.
Например, если у субъекта есть опухоль, эффективным количеством может быть количество, которое сокращает объем опухоли или нагрузку (что определяется, например, визуализацией опухоли). Эффективные количества могут также оцениваться по присутствию и/или частоте встречаемости клеток злокачественной опухоли в крови или других жидкостях или тканях организма (например, при биопсии). Если опухоль влияет на нормальное функционирование ткани или органа, эффективное количество может оцениваться посредством измерения нормального функционирования ткани или органа.
В некоторых случаях эффективным количеством является количество, необходимое для уменьшения или устранения одного или нескольких, предпочтительно всех симптомов. Например, если субъект страдает аллергией или испытывает астматический приступ, эффективным количеством средства может быть количество, которое уменьшает или устраняет симптомы, ассоциированные с аллергией или астматическим приступом. Они могут включать чихание, крапивницу, заложенность носа и затрудненное дыхание. Аналогично, для субъекта с инфекцией эффективным количеством средства может быть количество, которое уменьшает или устраняет симптомы, ассоциированные с инфекцией. Они могут включать лихорадку и недомогание. Если средство является диагностическим средством, то эффективным количеством может быть количество, которое обеспечивает визуализацию области организма или клеток, представляющих интерес. Если средство является антигеном, то эффективным количеством может быть количество, которое запускает иммунную реакцию против антигена и предпочтительно относится к кратковременной и даже более предпочтительно к долговременной защите от патогена, от которого происходит антиген. Будет понятно, что в некоторых случаях настоящее изобретение предусматривает однократное введение средства, а в некоторых случаях настоящее изобретение предусматривает многократные введения средства. В качестве примера, антиген может вводиться в первичной дозе и в бустерной дозе, хотя в некоторых случаях настоящее изобретение обеспечивает достаточную доставку антигена и необязательно адъюванта, поэтому в бустерной дозе нет необходимости.
Настоящее изобретение относится к фармацевтическим композициям. Фармацевтические композиции представляют собой стерильные композиции, которые содержат везикулы в соответствии с настоящим изобретением и предпочтительно средство(а), предпочтительно в фармацевтически приемлемом носителе. Термин «фармацевтически приемлемый носитель» означает один или несколько совместимых твердых или жидких наполнителей, растворителей или инкапсулирующих веществ, которые являются приемлемыми для введения человеку или другому субъекту, преду сматриваемым в соответствии с настоящим изобретением.
Термин «носитель» обозначает органический или неорганический ингредиент, природный или синтетический, с которым комбинируются везикулы и предпочтительно средство(а) для облегчения введения. Компоненты фармацевтических композиций смешиваются таким способом, который предотвращает взаимодействия, которые могли бы существенно нарушить их желаемую фармацевтическую эффективность.
Приемлемые буферные средства включают уксусную кислоту и соль (1-2% масса/объем); лимонную кислоту и соль (1-3% масса/объем); борную кислоту и соль (0,5-2,5% масса/объем); а также фосфорную кислоту и соль (0,8-2% масса/объем). Приемлемые консерванты включают бензалкония хлорид (0,003-0,03% масса/объем); хлорбутанол (0,3-0,9% масса/объем) и парабены (0,01-0,25% масса/объем).
Если в настоящем документе не указано иное, доступны разнообразные способы введения. Конкретный выбранный способ будет зависеть, конечно, от выбранного конкретного активного средства, конкретного состояния, подлежащего лечению, и дозировки, необходимой для терапевтической эффективности. В общем случае представленные способы могут осуществляться с использованием любого способа введения, который является клинически приемлемым, что означает любой способ, который обеспечивает эффективные уровни желаемого ответа не вызывая при этом клинически неприемлемых неблагоприятных эффектов. Одним из способов введения является парентеральный путь. Термин «парентеральный» включает подкожные инъекции, методы внутривенной, внутримышечной, внутрибрюшинные, внутристернальной инъекции или инфузии. Другие способы введения включают пероральный, слизистый, ректальный, вагинальный, подъязычный, интраназальный, внутритрахеальный, ингаляцией, глазной, трансдермальный и т.п.
Для перорального введения соединения могут быть легко составлены путем комбинирования везикул с фармацевтически приемлемыми носителями, хорошо известными в предшествующем уровне техники. Такие носители дают возможность составлять такие формы, как таблетки, пилюли, драже, капсулы, жидкости, гели, сиропы, взвеси, пленки, суспензии и т.п.для перорального приема субъектом, получающим лечение. Приемлемыми вспомогательными веществами являются, в частности, наполнители, такие как сахара, в том числе лактоза, сахароза, маннит или сорбит; препараты целлюлозы, такие как, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантова камедь, метилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза не указано иное и/или поливинилпирролидон (PVP). Необязательно пероральные составы могут быть составлены на солевом растворе или буферах для нейтрализации внутренних кислых условий или могут быть вводиться без каких-либо носителей.
Фармацевтические препараты, которые могут быть использованы перорально, включают в себя твердые капсулы, изготовленные из желатина, а также мягкие, запаянные капсулы, изготовленные из желатина и пластификатора, такого как глицерин или сорбит.Твердые капсулы могут содержать везикулы, суспендированные в приемлемых жидкостях, таких как водные растворы, забуференные растворы, жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут добавляться стабилизаторы. Все составы для перорального введения должны находиться в приемлемых дозировках для такого введения.
Для трансбуккального введения композиции могут иметь форму таблеток или леденцов, составленных общепринятым способом.
Для введения путем ингаляции композиции могут традиционно доставляться в форме распыляемых аэрозолей из баллонов, находящихся под давлением, или небулайзера с применением приемлемого пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, двуокиси углерода или другого приемлемого газа. В случае аэрозоля под давлением единицу дозирования можно определять с помощью клапана для доставки отмеренного количества.
Если желательно доставлять композиции в соответствии с настоящим изобретением систематически, они могут быть составлены для парентерального введения путем инъекции, например, болюсных инъекций или непрерывной инфузии. Составы для инъекций могут быть представлены в единичной дозированной форме, например, в ампулах или контейнерах с несколькими дозами. Фармацевтические парентеральные составы включают водные растворы ингредиентов. Водные суспензии для инъекции могут содержать вещества, которые повышают вязкость суспензии, такие, как карбоксиметилцеллюлоза натрия, сорбит или декстран. В качестве альтернативы, суспензии везикул могут быть получены в виде суспензий на основе масла. Приемлемые липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды.
В качестве альтернативы, везикулы могут быть в форме порошка или в лиофилизированной форме для восстановления перед применением с приемлемым носителем, например, стерильной, свободной от пирогенов воды.
Композиции также могут быть составлены в виде ректальных или вагинальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие общепринятые основы для суппозиториев, такие как масло какао или другие глицериды.
Применение in vitro
Кроме того, настоящее изобретение предусматривает применения in vitro, такие как культивирование клеток и тканевая инженерия, которые требуют, или для которых более удобен постоянный источник одного или нескольких средств, таких как без ограничения факторы роста клеток и т.п.
Наборы
Кроме того, настоящее изобретение предусматривает наборы, содержащие везикулы в соответствии с настоящим изобретением. Везикулы могут содержать одно или несколько представляющих интерес средств. Кроме того, наборы могут содержать одно или несколько представляющих интерес средств, включенных в везикулы. Эти наборы также могут включать письменные материалы, такие как инструкции по применению везикул. Везикулы могут быть приготовлены в буфере или в лиофилизированной форме, предпочтительно со вспомогательным веществом, содержащим сахарозу.
Настоящее изобретение также предусматривает наборы, содержащие различные субстраты, реагенты и катализаторы, необходимые для синтеза везикул в соответствии с настоящим изобретением. Такие наборы могут включать, например, липиды, такие как те, что описаны в настоящем документе, функционализированные компоненты липидного бислоя, такие как функционализированные липиды, один или несколько сшивателей, таких как проникающие через мембрану сшиватели, многовалентные катионы, такие как двухвалентные катионы и т.п.Эти наборы также могут включать письменные материалы, такие как инструкции для синтеза везикул. Наборы также могут включать в себя представляющие интерес средства.
Далее настоящее изобретение иллюстрируется следующими примерами, которые никоим образом не должны быть истолкованы как ограничивающие. Полное содержание всех ссылок (в том числе литературных ссылок, выданных патентов, опубликованных патентных заявок и находящихся на одновременном рассмотрении заявок), процитированных в настоящей заявке, тем самым однозначно включено посредством ссылки.
ПРИМЕРЫ
Пример 1
Для преодоления ограничений способов предшествующего уровня техники авторы настоящего изобретения предусмотрели синтез липидных частиц, стабилизированных образованием сшивок, соединяющих головные группы смежных липидных слоев в многослойных везикулах (MLV). Известно, что двухвалентные катионы индуцируют слияние липосом в MLV (см. Duzgunes et al., J Membrane Biol. 1981;59:115-125). Авторы настоящего изобретения модифицировали этот процесс посредством ввода малеимид-функционализированных липидов (например, МРВ) в везикулы и сшивания слоев МРВ с использованием дитиоловых сшивателей (например, в схемах синтеза, показанных на фиг.1А). Полученные в результате сшитые между бислоями многослойные липидные везикулы (ICMV) обладали привлекательными характеристиками, такими как значительно повышенные эффективность инкапсуляции белка (100-кратная по сравнению с простыми липосомами, фиг.5), нагрузка белком на массу частиц (20-кратная по сравнению с простыми липосомами, фиг.5) и длительное удержание захваченных грузов в присутствии сыворотки крови с кинетическими характеристиками замедленного длительного высвобождения (фиг.6). Синтез проводили полностью в водных буферах, безвредных для захвата хрупких белковых грузов, и получали частицы, состоящие только из биоразлагаемых липидов. В качестве экспериментальной модели для биомедицинских применений этого нового класса частиц исследовали ICMV в качестве носителя для доставки антигенов и адъювантов. В частности, использовали яичный альбумин (OVA) в качестве модельного антигена и тестировали совместную доставку агонистов toll-подобных рецепторов (TLRa) in vivo для применения вакцин.
Материалы и методы
Липиды (DOPC:DOPG: малеимид-функционализированные липиды в мольном отношении 40:10:50) высушивали с образованием липидных пленок и регидратировали в 10 мМ бис-трис пропана (ВТР) при рН 7,0 в течение 1 часа в присутствии молекул груза. Как показано на фиг.1А, полученные в результате липосомы обрабатывали ультразвуком и подвергали слиянию посредством добавления двухвалентных катионов, таких как Mg2+ и Са2+ Полученные в результате MLV инкубировали с DTT (отношении малеимид:DTT составляет 2:1) для конъюгации расположенных рядом слоев малеимид-функционализированных липидов и образования сшитых ICMV. Полученные в результате структуры центрифугировали, промывали, а затем пэгилировали путем инкубации с 2 кДа PEG-тиолом в течение 30 минут. Конечные продукты центрифугировали и трехкратно промывали деионизированной водой. Размер частиц и поверхностный заряд определяли методом динамического светорассеивания (DLS) с использованием анализатора размера частиц 90Plus (Brookhaven Instruments). Частицы анализировали конфокальной микроскопией и крио-ТЕМ. Для количественной оценки фракции липидов, экспонированных на внешней поверхности частиц, выполняли анализ ламеллярности, как описано ранее (см. Girard et al., Biophysical journal 2004;87:419-429). Для исследований инкапсуляции использовали яичный альбумин (OVA), модифицированный с помощью Alexa-Fluor 555, для измерения количества, инкапсулированного в пэгилированных липосомах, покрытых липидом частицах PLGA (как ранее описано Bershteyn et al., Soft Matter 2008;4:1787-1791) и в ICMV. В некоторых анализах использовали SIV-Gag и лиганд FLT-3, модифицированные с помощью Alexa-Fluor 555. Высвобождение OVA из таких частиц выполняли с использованием диализных мембран с отсекаемой молекулярной массой 100 кДа.
Для исследований активации дендритных клеток (DK) in vitro извлеченные из костного мозга или селезенки DK инкубировали с ICMV, инкапсулирующими OVA в комбинации с монофосфориллипидом A (MPLA) и агонистами R-848, TLR4 и TLR7, соответственно. Клетки окрашивали и анализировали с помощью проточной цитометрии для изучения степени активации DK и интернализации частиц. Культуральные среды анализировали на предмет экспрессии IL12p70 с помощью ELISA (R&D Systems). Для анализа in vivo функции ICMV в качестве носителей вакцины группы мышей С57В 1/6 иммунизировали подкожно в бок 70 мкг OVA, доставленного либо болюсной инъекцией, либо в ICMV (с агонистами TLR или без таковых) и повторно стимулировали через 21 день. Частоту встречаемости OVA-специфичных Т-клеток и Т-клеток, продуцирующих в результате иммунизации гамма-интерферон, определяли с помощью анализа проточной цитометрии мононуклеарных клеток периферической крови. Титры антител против OVA определяли анализом ELISA сыворотки крови иммунизированных мышей. Животных содержали в соответствии с директивами NIH, федеральными и местными директивами.
Результаты и обсуждение
Традиционный протокол для получения MLV модифицировали с целью синтеза стабильных ICMV (фиг.1А). Во-первых, липосомы, содержащие до 50 мол. % МРВ, получали посредством регидратации липидных пленок с помощью обработки ультразвуком в присутствии груза в виде раствора белка или лекарственного средства. Слияние полученных в результате липосом индуцировали добавлением двухвалентных катионов с образованием MLV, как сообщалось ранее (см. Duzgunes et al., J Membrane Biol. 1981;59:115-125). Затем вводили DTT в качестве проникающего через мембрану реагента с образованием ковалентных сшивок между головными группами малеимидов из находящихся рядом в MLV липидных мембран (фиг.1В). Как показано в таблицах 1А и 1В, и двухвалентный катион и DTT были необходимы с образованием стабильных ICMV со значимым выходом более 40%; MLV, образованные либо с Mg+, либо с DTT по отдельности, не давали значимого количества липидных частиц при центрифугировании на 10000 g. Присутствие 20 мМ хлорида натрия нарушали образование частиц, поскольку известно, что одновалентные катионы ингибируют слияние везикул, опосредованное двухвалентными катионами (см. Duzgunes et al., J Membrane Biol. 1981;59:115-125). Для того, чтобы достичь значимого выхода частиц, необходимо по меньшей мере 25 мол. % или более МРВ, и впоследствии выбирали для работы с липидными композициями мольное отношение DOPC:DOPG:MPB 40:10:50.
Полученные в результате ICMV имели типичный средний диаметр 250±40 нм с индексами полидисперсности ~0,08 (фиг.3А). Полученные методом криоэлектронной микроскопии изображения частиц показывали многослойные структуры, состоящие из электронно плотных полос, более толстых, чем единичные липидные бислои, что свидетельствует о множественных слоях липидов, конъюгированных сквозь липидные мембраны (фиг.3В). Фракцию липидов, экспонированных на внешней поверхности частиц, измеряли с помощью анализа ламеллярности. Обработанные ультразвуком липосомы содержали 37±2,3% липидов на внешней поверхности, тогда как это значение снижалось до 19±1,0% для ICMV, образованных после модификации липосом Mg+ и DTT, что указывало на их многослойные структуры. ICMV пэгилировали осуществлением взаимодействия расположенного на поверхности МРВ с PEG-тиолом (молекулярная масса 2 кДа). Пэгилирвание увеличивало диаметр ICMV до 272±40 нм, и частицы, хранившиеся в PBS в течение 7 суток, сохраняли свои первоначальные размеры (таблица 2, некоторые данные не показаны). ICMV подвергали лиофилизации с 3% сахарозой, добавляемой в качестве вспомогательного вещества, поскольку частицы, ресуспендированные в буферном растворе после лиофилизации, в целом сохраняют свои морфологические характеристики и размеры (таблица 2).
Липосомы и частицы PLGA широко используются как носители для доставки белков; поэтому сравнивали инкапсуляцию белка в этих носителях с инкапсуляцией в ICMV. Как показано на фиг.5, ICMV демонстрировали эффективность инкапсуляции OVA, превосходящую по характеристикам традиционные пэгилированные стелс-липосомы и покрытые липидом частицы PLGA (108- и 4-кратное возрастание, соответственно). Аналогично, в ICMV повышалось количество инкапсулированного OVA на общую массу частицы в 21 и 10 раз, соответственно. Затем исследовали количество различных белков, инкапсулированных в ICMV в ходе их синтеза (фиг.4А). Количество инкапсулированных SIV-gag, FLT-3 лиганда и OVA постепенно повышалось в ряду от обработанных ультразвуком липосом, MLV, образованных в результате Mg2+ опосредованного слияния, до ICMV, образованных с помощью Mg2+ и DTT. В частности, более 70% от изначально загруженного OVA инкапсулировалось в ICMV со значением 407,5±18,7 мкг OVA на мг липидов. При использовании OVA в качестве модельного белка высвобождение груза из этих везикул было сопоставимо (фиг.6). Из ICMV OVA высвобождался медленно и непрерывно, тогда как из липосом и MLV OVA высвобождался взрывообразно в среды с сывороткой крови.
С использованием OVA в качестве модельного антигена вакцины изучили ICMV как основу для доставки вакцины. ICMV нагружали OVA и агонистами toll-подобных рецепторов, MPLA (лиганд TLR4) и/или резиквимодом (лиганд TLR7/8). Дендритные клетки (DC), проинкубированные с нагруженными OVA ICMV, in vitro активно поглощали частицы путем эндоцитоза. ICMV, нагруженные только OVA, не активировали DC in vitro, а частицы, несущие агонисты TLR, запускали активацию костимулирующих молекул (например, CD40, CD80, CD86 и МНС II) и секрецию IL-12р70 в DC in vitro; частицы, несущие агонисты и TLR4, и TLR7 способствовали синергической активации DC (фиг.8).
С целью тестирования эффективности частиц на предмет совместной доставки TLRa в комбинации с OVA для вакцинации in vivo мышей С57 В1/6 иммунизировали нагруженными OVA ICMV и сравнивали с эквивалентными дозами растворимого OVA. Интересно, что по сравнению с болюсной инъекцией OVA нагруженные OVA ICMV усиливали экспансию антиген-специфичных CD8+Т-клеток в 17 раз, содержание которых достигало -7% среди всех CD8+ Т-клеток после повторной иммунизации (фиг.10). Такие нагруженные OVA частицы также приводят к самой высокой частоте встречаемости функционально-компетентных продуцирующих гамма-интерферон (IFN-gamma) OVA-специфичных Т-клеток. Примечательно, однако, что гуморальный ответы антител против OVA требуют присутствия TLRa для достижения максимальных титров, и нагруженные OVA ICMV с коинкапсулированными агонистами TLR4 и TLR7 вызывают накопление титров антител против OVA, приблизительно в 10 раз выше, чем при таких же дозах растворимых OVA/TLRa (фиг.10 В).
Для того, чтобы понять иммунные реакции, которые ICMV могут вызывать против антигенов клинически значимых патогенов, тестировали иммунизацию антигеном из инфекционного агента. Для иммунизации мышей использовали различные дозы ICMV, несущих инкапсулированный антиген, а также имеющих MPLA, включенный в их бислои. После режима первичной и бустерной иммунизации против антигена вырабатывались высокие титры антител, определяемые в сыворотке крови с 34-го дня, тогда как эквивалентные дозы растворимых антигена и MPLA вызывали гораздо более низкие титры (данные не показаны). Эти результаты свидетельствуют о том, что ICMV являются эффективным носителем для доставки антигенов при иммунизации.
В этом исследовании разработали новые многослойные липидные частицы, которые обладают привлекательными характеристиками: инкапсуляция белка в ICMV намного больше без применения органических растворителей. Эти частицы демонстрируют коллоидную стабильность, и частицы на основе липидов являются полностью биоразлагаемыми. Продемонстрировали универсальность ICMV в качестве основы для доставки вакцин. Эти исследования свидетельствуют о том, что ICMV могут широко применяться in vivo для доставки лекарственных средств.
Пример 2
Следующий пример представляет собой более полное описание и сообщение о некоторых экспериментах и результатах, описанных в примере 1.
Лицензированные на настоящее время адъюванты вакцин (например, гидроксид алюминия и эмульсия MF59 типа «масло в воде») способствуют иммунитету, вызывая прежде всего гуморальные иммунные реакции, без стимуляции клеточного иммунитета1,2. Поскольку для вакцин против злокачественных опухолей или внутриклеточных патогенов, таких как ВИЧ, малярия и гепатит С, может потребоваться мощный ответ CD8+ Т-клеток (CD8T), большой интерес представляют технологии усиления согласованных гуморальной и клеточной иммунных реакций3,4. В связи с этим были разработаны векторы рекомбинантных живых вакцин, такие как нереплицирующиеся рекомбинантные вирусы", которые могут индуцировать и сильный ответ антител, и массовую экспансию функциональных антиген-специфичных CD8+ Т-клеток на моделях мышей. Однако опасения, связанные с безопасностью, с живыми векторами и иммунным ответом на векторы могут осложнить создание вакцин на основе живых векторов. Уже имеющиеся вектор-специфичные иммунные реакции снижали иммуногенность основанных на живых векторах вакцин в клинических испытаниях8, и иммунная реакция, развившаяся по отношению к живым векторам после первичной иммунизации, может сделать повторные иммунизации с использованием того же самого вектора проблематичными7.
Напротив, неживые синтетические вакцины, доставляющие определенные антигены, могут быть рационально сконструированы, чтобы избежать иммунитета против вектора9. Такие «субъединичные» вакцины состоят из одного или нескольких выбранных рекомбинантных белков или полисахаридов, в норме присутствующих в структуре мишеневого патогена. Однако субъединичные вакцины вызывают слабый ответ со стороны CD8T или не вызывают ответа совсем вследствие низкой эффективности кросс-презентации (поглощения и процессинга внеклеточного антигена иммунными клетками для презентации на молекулах МНС класса I наивным CD8+Т-клеткам)10. Для обеспечения кросс-презентации использовали синтетические частицы, нагруженные белковыми антигенами и определенными иммуностимулирующими молекулами11-17, которые упрощенным образом имитировали сигналы, подаваемые иммунной системе во время инфекции патогенами. Липосомы благодаря их низкой токсичности и иммуногенности, опыту их безопасного применения в клинической практике, легкости изготовления и доказанной технологичности в коммерческих масштабах являются особенно привлекательным материалом для этого применения18'19. Липидные везикулы в форме однослойных, многослойных или полимеризованных везикул с некоторым успехом протестировали в качестве материалов для доставки вакцин19-23. Антигены, захваченные в липидные везикулы, перекрестно презентировались in vivo19,24,25, и показали, что липосомальные белковые вакцины вызывают защитные опосредованные Т-клетками противомикробные и противоопухолевые иммунные реакции на моделях мелких животных23,26,27. Однако в настоящее время считается, что для болезней, таких как HIV и злокачественная опухоль, необходим чрезвычайно мощный ответ Т-клеток (согласованный с гуморальным иммунитетом) для контроля вирусов/опухолей, и, следовательно, поиск более мощных Т-клеточных вакцин продолжается3,4.
Потенциальным фактором, влияющим на активность липидных везикул при доставке вакцин, является их ограниченная стабильность в присутствии компонентов сыворотки крови. Для липосомальных грузов, которые могут обрабатываться при высоких температурах или загружаться путем диффузии через заранее образованные мембраны везикул, повышенная стабильность везикул может быть достигнута путем использования липидов с высокой Тп, особенно при комбинации с холестерином и/или пэгилированием28. Одно- и многослойные везикулы также стабилизировали посредством полимеризации химически активных головных групп на поверхности бислоев29, полимеризации химически активных групп в фосфолипидных ацильных хвостах20,29 или полимеризации гидрофобных мономеров, адсорбированных на гидрофобных внутренних поверхностях мембран30. Для каждого из этих подходов общим является концепция полимеризации компонентов в плоскости бислоя. Однако поиск методов полимеризации, которые можно проводить в мягких условиях не повреждающих антигены вакцин, является сложной задачей20.
В настоящем документе описывается новый класс липидных носителей лекарственных средств, сшитые между бислоями многослойные везикулы (ICMV), образованные посредством стабилизации многослойных везикул короткими ковалентными сшивками, связывающими головные группы липидов на соседних поверхностях смежных плотно упакованных бислоев в стенках везикул. ICMV инкапсулировали и стабильно удерживали высокие уровни белков, высвобождая захваченный груз очень медленно при воздействии сыворотки крови (на протяжении 30 дней) по сравнению с простыми липосомами или многослойными везикулами (MLV) с такой же липидной композицией. Однако такие везикулы быстро разрушались в присутствии липаз, в норме обнаруживаемых с высоким содержанием во внутриклеточных компартментах31. С использованием новой структуры везикул для совместного захвата высоких количеств модельного белкового антигена (яичного альбумина, OVA) и подобного липиду иммуностимулирующего лиганда (монофосфориллипида A, MPLA) выполняли исследования иммунизации на мышах и обнаружили, что ICMV вызывали накопление высоких титров антител в -1000 раз больших, чем при использовании простых липосом, и в -10 раз больших, чем при использовании MLV с идентичными липидными композициями. В отличие от живых векторов, которые часто эффективны только при однократной инъекции, вводимой наивному в отношении вектора индивидууму7, эти синтетические везикулы запускали стабильно возрастающие гуморальный и CD8+ Т-клеточный ответ после повторных введений, при этом антиген-специфичные Т-клетки увеличивались в количестве, достигая пика почти 30% от общего количества CD8+Т-клеток в крови после первичной и двух бустерных иммунизации. Таким образом, эти новые материалы могут привести к созданию субъединичных вакцин, которые будут одновременно безопасными и высоко эффективными в отношении возбуждения и гуморального и клеточного иммунитета.
Материалы и методы
Синтез ICMV. 1,26 мкмоль липидов в хлороформе (типичная липидная композиция: DOPC (1,2-диолеоил-sn-глицеро-3-фосфохолин):BOPG0 (1,2-ди-(9Z-октадеценоил)-sn-глицеро-3-фосфо-(1'-rac-глицерол)):МРВ (1,2-диолеоил-8п-глицеро-3-фосфоэтаноламин-Н-[4-(р-малеимидофенил)бутирамид) с мольным отношением=4:1:5, все липиды производства Avanti Polar Lipids, Alabaster, AL, распределяли по стеклянным сосудам и выпаривали органические растворители под вакуумом в течение ночи для получения высушенных липидных пленок. Липидные пленки регидратировали в 10 мМ бис-трис пропана (ВТР) при рН 7,0 с загрузочными белками в течение 1 часа при жестком встряхивании каждые 10 минут, затем обрабатывали чередующимися циклами ультразвука мощностью по 6 ватт и 3 ватт с 30-секундными интервалами в течение 5 минут на льду (соникатором Misonix Microson XL с наконечником зонда, Farmingdale, NY). Липосомы, образованные на этом первом этапе, подвергали слиянию добавлением двухвалентных катионов, таких как Mg2+ и Са2+, при конечной концентрации 10 мМ. Полученные в результате MLV инкубировали с 1,5 мМ DTT (мольное отношение малеимид:ВТТ 2:1) в течение 1 часа при 37°С для конъюгации находящихся друг напротив друга бислоев малеимид-функционализированных липидов и образования сшитых ICMV; полученные в результате везикулы извлекали центрифугированием при 14000 g в течение 4 минут и дважды промывали деионизированной водой. Для пэгилирования частицы инкубировали с 2 кДа PEG-тиолом (Laysan Bio, Arab, AL) в 1,5-кратном мольном избытке PEG-SH к малеимидным группам в течение 1 часа при 37°С. Полученные в результате частицы центрифугировали и промывали трижды деионизированной водой. Конечные продукты либо хранили в PBS при 4°С, либо лиофилизировали в присутствии 3% сахарозы в качестве криопротектора и хранили при -20°С. Для некоторых анализов простые липосомы или слитые с помощью Mg MLV собирали до сшивания ультрацентрифугированием при 115000 g с использованием ультрацентифуги Optima (Beckman Coulter) в течение 6 часов.
Загрузка белком in vitro и высвобождение лекарственного препарата. Для исследований инкапсуляции яичный альбумин (OVA, Worthington, Lakewood, NJ), SIV-gag (Advanced Bioscience Laboratories, Kensington, MD), и FLT-3L (Peprotech, Rocky Hill, NJ) метили с Alexa-Fluor 555 (Invitrogen, Carlsbad, CA) для непосредственного флуориметрического определения количества захваченного белка. OVA также инкапсулировали в DRV и в PLGA наночастицах, как описано ранее43144. В некоторых экспериментах ICMV нагружали рекомбинантным белком трехдневной малярии (VMP) в качестве контроля с применением нерелевантного антигена49 (предоставлен Dr. Anjali Yadava, Walter Reed Army Institute of Research). Кэппированный тиолом OVA получали путем инкубации 1 мг OVA с 1,5 мМ ТСЕР в течение 1 часа при комнатной температуре, после чего следовали инкубация с 1,5 мМ этилмалеимида (Pierce, Rockford, IL) при 37°С в течение 1 часа. По результатам анализа методом Эллмана степень тиоловой защиты составляла >95%50. Высвобождение OVA, меченного с помощью Alexa-Fluor 555 из липидных везикул определяли количественно в среде RPMI, дополненной 10% фетальной телячьей сывороткой, при 37°С с использованием диализных мембран с отсекаемой молекулярной массой 100 кДа. Через равные интервалы высвобождающуюся среду удаляли для количественной оценки флуоресценции и заменяли ее равным объемом свежей среды для продолжения мониторинга высвобождения лекарственного средства. Остаточный OVA, оставшийся в конце эксперимента, определяли с помощью экстракции липидов везикул с обработкой 1% Тритоном Х-100 и измерения высвободившегося белка методом флуоресцентной спектрофотометрии. Анализ высвобождения OVA также выполняли в забуференном солевом растворе Хэнкса, дополненном 500 нг/мл фосфолипазы А (Sigma, St. Louis, МО). Для исследования стабильности инкапсулированных молекул груза моноклональные IgG крысы, инкапсулированные ICMV, извлекали с помощью обработки 1% Тритоном Х-100 и анализировали методом SDS-PAGE при невосстанавливающих условиях с окрашиванием серебром (Pierce).
Исследование вакцинации с ICMV. Группы мышей С57 В1/6 (Jackson Laboratories) иммунизировали подкожно у основания хвоста указанными дозами OVA (с агонистом TLR MPLA или без такового). Частоту встречаемости OVA-специфичных CD8+Т-клеток и их фенотипы, вызванные иммунизацией, определяли с помощью анализа проточной цитометрии РВМС в выбранных временных точках после окрашивания DAPI (для распознавания живых и мертвых клеток) и антителами против CDS-альфа, антителами против CD44, антителами против CD62L и пептидом SIINFERL/Н-2Kb-тетрамерами МНС (Becton Dickinson). Для оценки функциональности примированных CD8 Т-клеток РВМС стимулировали ex vivo 1 мкМ OVA-пептида SIINFEKL в течение 6 часов с GolgiPlug (Becton Dickinson), фиксировали, пермеабилизировали, окрашивали антителами против IFN-гамма и CDS-альфа и анализировали с помощью проточной цитометрии. Титры IgG против OVA, определяемые как разведение сыворотки, при котором показания OD на 450 нм составляли 0,5, определяли анализом ELISA сыворотки крови иммунизированных мышей. О животных заботяться в соответствии с директивами Животных содержали в соответствии с директивами NIH, федеральными и местными директивами.
Статистический анализ. Статистический анализ выполняли с использованием Jmp 5.1 (SAS Institute Inc., Сагу, NC). Массивы данных анализировали с использованием одно- или двухфакторного дисперсионного анализа (ANOVA), за которым следовал критерий HSD Тьюки для множественных сравнений. Значения р, менее чем 0,05, расценивали как статистически значимые. Все значения представлены как среднее±стандартная ошибка среднего.
Результаты
Вводили ковалентные сшивки в заренее образованные MLV между функционализированными головными группами липидов смежных прилегающих бислоев с образованием ICMV (фиг.2А). В ходе типичного синтеза высушенные фосфолипидные пленки, содержащие DOPC, анионный DOPG и анионный липид МРВ 30 с малеимидом в качестве головной группы в мольном отношении 4:1:5, гидратировали и обрабатывали ультразвуком с образованием простых липосом (этап (i)). К липосомам добавляли двухвалентные катионы (например, Mg2+) для того, чтобы индуцировать слияние везикул и образование MLV, как сообщалось ранее32 (этап (ii)). Для введения сшивок между смежными бислоями в MLV в суспензию везикул затем добавляли дитиотреитол (DTT), который действует как проникающий через мембрану сшиватель, образуя ковалентные связи между малеимидными головными группами прилегающих мембран, сближенных катионными солевыми мостиками, образованными между слоями везикулы (этап (iii)). Пэгилирование является хорошо известной стратегией повышения стабильности липидных везикул в сыворотке крови и увеличения времени полужизни их в кровотоке18. Таким образом, на последнем этапе везикулы промывали, а остаточные малеимидные группы, экспонированные на внешней поверхности частиц, кэппировали PEG с тиоловыми концевьми группами (этап (iv)).
Диаметр/полидисперсность частиц будет определять тип клеток, способных к интернализиции этих частиц33, тогда как предполагается, что число бислоев, составляющих стенки везикулы, будет влиять на стабильность везикул и их способность удерживать/медленно высвобождать грузы в присутствии сыворотки крови. Для оценки этих свойств и лучшего понимания процесса образования ICMV характеризовали продукты на каждом этапе синтеза. Первоначальные липосомы, образованные сонификацией (этап (i)) имели гидродинамические диаметры -190 нм, после Mg2+-опосредованного слияния везикул (этап (ii)) и последующего «скрепления» бислоев DTT размер несколько возрастал до -240 нм (этап (iii), таблица 2). Полученные в результате ICMV показывали мономодальное, относительно узкое распределение размеров (сравнимое с препаратами обычных липидных везикул или полимерных наночастиц '), и, исходя из данных динамического светорассеяния (DLS) или криоэлектронной микроскопии, не выявлялись доказательства сильной агрегации частиц во время этапа сшивания (фиг.2А, В и таблица 2). Добавление PEG с тиоловыми концевыми группами к обработанным DTT везикулам блокировало оставшиеся определяемые малеимидные группы на поверхностях MLV и вводило цепи PEG на ~2 мол. % экспонированных на поверхности липидов ICMV без значительного изменения диаметра частиц (таблица 2, данные не показаны). Пэгилированные ICMV, хранившиеся при 4°С или 37°С в PBS, оставались стабильными на протяжении 7 дней, и их можно было подвергать лиофилизации с добавлением 3% сахарозы в качестве вспомогательного вещества34, что подчеркивает их совместимость с условиями длительного хранения (таблица 2, данные не показаны). Получали изображения первоначальных липосом, слитых с помощью Mg2+ MLV и окончательных ICMV с помощью криоэлектронной микроскопии (фиг.2А) и выясняли, что сшивание DTT приводит к образованию везикул толстыми многослойными стенками, составленными из плотно упакованных бислоев, полученных как полосы электронной плотности ~4- 5 нм. Среднее число бислоев на частицу составляло 4,4 (межквартильный размах [IQR], 3,3-6,9), а отношение среднего радиуса частиц к толщине липидной стенки составляет 3,8 (IQR, 2,4-6,8) (фиг.2С, D). Интересно, что большинство ICMV имели стенки везикулы, состоящие из концентрических бислоев, хотя также можно было обнаружить несколько примеров ICMV с дефектами поверхности в виде незавершенных внешних липидных слоев (данные не показаны). С повышенной ламеллярностью везикул после опосредованного катионами слияния и сшивания DTT, наблюдаемой с помощью электронной микроскопии, согласуется фракция липидов, экспонированных на внешних поверхностях везикул уменьшалась на этапах синтеза (ii) и (iii), как измерено с помощью анализа ламеллярности по объемному тушению флуоресценции (таблица 2). Химическое доказательство сшивания между малеимид-липидами после обработки DTT получали с помощью тонкослойной хроматографии и измерений MALDI-TOF в ICMV (данные не показаны). Важно то, что и размер частиц и распределения индивидуальной ламеллярности были мономодальными с менее чем 3% контаминирующих однослойных везикул, и отсутствовали крупные агрегаты, которые могли бы исказить функциональные свойства (например, высвобождение белка) частиц. ICMV имеют такие размеры, что должны активно поглощаться моноцитами и дендритными клетками36, а структура сшитых многослойных стенок будет стабилизировать захват белка по сравнению с традиционными однослойными или многослойными липосомами.
Анализ условий, необходимых для образования стабильных везикул, обеспечил глубокое понимание механизмов образования ICMV. После сшивания между бислоями ICMV могут быть собраны центрифугированием при 14000 g в течение 4 минут («низкоскоростные условия»), в то время как простые липосомы или MLV идентичной липидной композиции для осаждения требуют ультрацентрифугирования. С использованием массы частиц, собранной низкоскоростным центрифугированием, как суррогатную меру выхода сшитых везикул, обнаружили, что для образования ICMV необходимы и опосредованное двухвалентными катионами слияние (фиг.2А этап (ii), или Mg2+ или Са2+) и обработка DTT (этап (iii)) (таблицы 1А, В). Везикулы-предшественники, обработанные либо Mg2+, либо DTT по отдельности, даже при 10-кратном мольном избытке по отношению к малеимидным группам не давали значимых выходов частиц (таблицы 1А, В). Кроме того, для образования ICMV требовалось по меньшей мере 25 мол. % МРВ (Таблицы 1А, В); высокий уровень реакционно-способных головных групп, необходимый для значительного выхода ICMV, может отражать конкуренцию между внутренней частью бислоя (между головными группами одного и того же бислоя) и межбислойным образованием сшивок. DTT может быть замещен DPDPB, другим проникающим через мембрану дитиолом, но не 2 кДа PEG-дитиолом, при используемых условиях (таблицы 1А, В). ICMV также могут быть образованы с использованием только липидов DOPC и МРВ, или с использованием катионного DOTAP всесто DOPG (данные не показаны). В качестве альтернативного способа образования ICMV малеимид-дитиоловое сшивание можно заменить биоортогональной клик-химией с использованием для образования везикул липидов с конечными алькильными группами и диазидов для сшивания37,38 (фиг.12, данные не показаны). Таким образом, межбислойное сшивание с образованием стабилизированных везикул является общей стратегией, которая может быть адаптирована к другим липидам/сшивателям. Основываясь на высоком выходе синтеза и коллоидной стабильности решили сосредоточиться на пэгилированных ICMV с липидной композицией DOPC:DOPG:MPB в мольном отношении 4:1:5 для дальнейшего тестирования их как носителей для доставки белка/вакцины.
Для тестирования пригодности ICMV для доставки белка изучали захват нескольких глобулярных белков: SIV-gag, антигена вакцины HIV; FLT-3L, терапевтического цитокина и яичного альбумирна (OVA), модельного антигена вакцин. Инкапсуляцию белка достигали путем регидратации высушенных липидов растворами белка на этапе (i) синтеза (фиг.2А). Количество инкапсулированного белка возрастало на каждом этапе получения ICMV (фиг.4А), что может отражать дополнительный захват белка, происходящий при слиянии везикул на обоих этапах (и) и (in). Захват белка в ICMV не был опосредован конъюгацией тиолов в загруженных белках с малеимид-функционализированными липидными везикулами, поскольку OVA, предварительно восстановленный ТСЕР и обработанный этилмалеимидом для блокирования всех тиоловых групп белка, инкапсулировали в ICMV на уровнях подобных немодифицированному белку (76,1±6,3% по сравнению с 83,3±8,4% для OVA с кэппированными тиолами и немодифицированного OVA; p=0,17). Также подтвердили тот факт, что дисульфидные связи в модельных белковых грузах не восстанавливались сшивателем DTT в процессе образования везикул и что инкапсуляция в ICMV не вызывала агрегацию белка (данные не показаны). Для непосредственного сравнения эффективности и количества загружаемого белка, достигаемых с ICMV, с двумя наиболее распространенными типами носителей для доставки лекарственных средств39-41 сравнили инкапсуляцию OVA в липосомах, наночастицах PLGA и ICMV. С использованием модельной стабильной композиции липидов, состоящей из фосфохолина, PEG-липида и холестерина42, образовывали DRV, поскольку они являются одним из самых эффективных подходов захвата водных растворов для липосом43, и получали нагруженные OVA частицы PLGA с использованием процесса выпаривания растворителя из двойной эмульсии44. ICMV демонстрировали лучшую эффективность инкапсуляции (-75%) по сравнению с DRV или с частицами PLGA (2- и 4-кратное возрастание, соответственно; фиг.4 В), а количество OVA, инкапсулированного на общую массу частицы (~325 мкг OVA на мг частиц) в ICMV возрастало в 1,8-и 9-раз по сравнению с DRV и частицами PLGA, соответственно (фиг.4С). Таким образом, ICMV являются эффективными для инкапсуляции ряда глобулярных белков, и по меньшей мере в отношении модельного антигена OVA ICMV захватывают белок более эффективно, чем широко известные альтернативные носители белка.
Затем определяли, позволяет ли межбислойное сшивание липидным везикулам сохранять биоразлагаемость при увеличении способности удерживать белок в присутствии сыворотки крови. OVA загружали в пэгилированные липосомы, слитые при помощи Mg2+ MLV или ICMV с одинаковой липидной композицией и количественно оценивали кинетические характеристики высвобождения белка при 37°С в среде, содержащей 10% фетальной телячьей сыворотки. Однослойные липосомы быстро высвобождали весь груз захваченного OVA в течение ~2 дней, тогда как многослойные слитые посредством Mg MLV высвобождали ~50% своего захваченного груза за тот же самый период времени (фиг.4D). Однако ICMV показали значительно возросшую способность удерживать белок, высвобождая только ~25% своего груза через одну неделю и -90% через 30 дней (фиг.4D). Примечательно, что ICMV также высвобождали белок значительно медленнее, чем однослойные липосомы, стабилизированные включением холестерина (фиг.4D). Сшитые везикулы также удерживали ~95% своего захваченного белка при хранении в PBS при 4°С на протяжении 30 дней (фиг.4Е). Также исследовали высвобождение белка из ICMV в условиях, моделирующих внутриклеточные компартменты: везикулы, инкубируемые в восстанавливающих или кислотных условиях в течение 1 дня при 37°С, сохраняли>95% удерживаемого OVA, в то время как инкубация с фосфолипазой А приводила к высвобождению >90% OVA и быстрому разрушению везикул (фиг.4Е). Таким образом, ICMV обладают повышенной стабильностью в присутствии сыворотки крови по сравнению с традиционными липосомальными составами, но быстро разрушаются в присутствии ферментов, которые присутствуют во внутриклеточных эндолизосомальных компартментах31, обеспечивая тем самым механизм запуска внутриклеточного высвобождения груза после интернализации клетками. Хотя нельзя исключить возможность некоторого разрушения белков в везикулах при введении in vivo до интернализации клетками, критическое поглощение и процессинг антигена при доставке вакцины будет происходить в первые несколько дней после иммунизации45, когда такой процесс разрушения должен быть минимальным.
Выдвинули гипотезу о том, что уникальная структура ICMV с эффективным удержанием инкапсулированных белковых антигенов во внеклеточной среде и быстрым высвобождением в эндосомах/лизосомах будет обеспечивать усиленные ответы на вакцину. Для создания вакцинных ICMV получали везикулы, несущие модельный антиген OVA (OVA-ICMV) и смешивали эти везикулы с молекулярным адъювантом монофосфориллипидом A (MPLA). MPLA является одобренным FDA агонистом для toll-подобного рецептора (TLR) 4, экспрессируемого дендритными клетками, В-клетками и клетками системы врожденного иммунитета, который мощно усиливает ответы на вакцину1'46. Нагруженные антигеном ICMV, смешанные с MPLA, способствуют активации совместно стимулирующих молекул в дендритных клетках (ДК) селезенки и костного мозга in vitro по сравнению с DC, активированными ICMV без MPLA (фиг.7А, данные не показаны). DC, активированные ICMV, перекрестно презентировали пептиды, образующиеся из OVA, с намного более высокой эффективностью по сравнению с DC, активированными растворимым OVA (с добавленными MPLA или без таковых), что было показано с помощью окрашивания DC 25-D1.16 mAb, который распознает пептид SIINFEKL (OVA257-264) в комплексе с молекулами МНС класса I H-2K1' (р<0,001, по сравнению с растворимым OVA или с ICMV, нагруженными нерелевантным антигеном [белком трехдневной малярии, VMP], фиг.7 В). DC селезенки, инкубируемые с OVA-ICMV+MPLA, запускали активную пролиферацию OVA-специфичных наивных ОТ-1 CD8+Т-клеток in vitro, как оценено с помощью анализа разведения с карбоксифлуоресцеин сукцинимидиловьм эфиром (CFSE). Наоборот, когда DC активировали эквивалентными дозами растворимых OVA и MPLA, пустыми ICMV или VMP-ICMV, наблюдается слабый ответ Т-клеток, что указывает на специфичность ответов Т-клеток, вызванных ICMV (фиг.7С). Эти результаты свидетельствуют о том, что добавление MPLA дает возможность эквивалентной активации DC с помощью ICMV или растворимым OVA, но ICMV запускают усиленную кросс-презентацию антигена, как и ожидалось при доставке корпускулярного антигена.
Для определения влияние структуры везикул иммунную реакцию in vivo вакцинировали мышей С57 В1/6 эквивалентными дозами OVA, MPLA и липидов (Юмкг, 0,1 мкг и 142 мкг, соответственно) в форме пэгилированных однослойных липосом, MLV или ICMV. Через семь дней после иммунизации оценивали силу ответа эндогенных CD8+Т-клеток, анализируя частоту встречаемости пептида OVA-тетрамера+ МНС (антиген-специфичных) CD8+ Т-клеток среди мононуклеарных клеток периферической крови (PBMS) методом проточной цитометрии и обнаружили тенденцию к возрастанию Т-клеточных ответов в ряду растворимый OVA<липосомы<слитые посредством Mg2+ MLV
Многослойная структура ICMV обеспечивает возможность распределять не только белковый антиген (в водном ядре), но и липофильные молекулы (в стенках везикул). Таким образом, тестировали, будет ли внедренный в стенки ICMV MPLA оказывать влияние на иммунную реакцию in vivo, обеспечивая лучшее удержание MPLA наряду с антигеном в везикулах. Агонист TLR включали в слои везикул совместным растворением MPLA с другими липидами на первом этапе синтеза (ICMV с внутренним MPLA) и сравнивали эти везикулы с ICMV, несущими то же самое количество MPLA, включенного только на поверхности везикул посредством подхода «post-insertion» (ICMV с внешним MPLA, фиг.11А, данные не показаны). Мышей иммунизировали подкожно OVA (10 мкг) и MPLA (0,1 мкг или 1,0 мкг) в ICMV или в растворимой форме, и проводят бустерную иммунизацию на 21-й и 35-й дни теми же самыми составами. Как показано на фиг.11 В, иммунизации с использованием низкой дозы MPLA приводила к едва определяемому ответу антител против растворимого OVA, даже после двух повторных иммунизации, тогда как ICMV и с внутренним MPLA, и с внешним MPLA вызывали накопление высоких титров IgG против OVA в сыворотке крови к 56-му дню. Ответ IgG на растворимый OVA можно получить с использованием 10-кратного количества MPLA, но ICMV с внутренним MPLA в количестве 1,0 мкг вызывали более высокие титры, чем растворимый белок (в ~13 раз выше на 56-й день). С другой стороны, не наблюдали какого-либо значимого уровня антител против липидных компонентов ICMV на протяжении всего периода исследований иммунизации (данные не показаны).
Встраивание MPLA в множественные слои ICMV оказывало более сильное воздействие на ответ CD8+ Т-клеток при вакцинации. Растворимый OVA, смешанный с 0,1 мкг MPLA, вызывал едва заметную экспансию антиген-специфичных Т-клеток, что было оценено по окрашиванию тетрамера на РВМС; доставка с использованием ICMV с внешним MPLA приводила к 2,5-кратному увеличению популяции тетрамер+ Т-клеток к 41-му дню (фиг.11С, р<0,05). Добавление в 10 раз большего количества MPLA позволяло иммунизациям растворимым OVA достигать Т-клеточных ответов, эквивалентных ответам после повторной иммунизации при применении ICMV с внешним MPLA. Наоборот, иммунизация ICMV с внутренним MPLA вызывало гораздо более сильные ответы CD8+ Т-клеток, которые продолжали нарастать после каждой повторной иммунизации, достигая пикового значения численности тетрамер+Т-клеток 28% в популяции CD8+ Т- клеток к 41-му дню (в 5 раз больше, чем при использовании ICMV с внешним MPLA (р<0,05), и в 14 раз больше, чем при использовании растворимого OVA+MPLA (р<0,01) фиг.11C). Примечательно то, ICMV с внутренним MPLA в целом вызывали к значительно более высокую частоту встречаемости тетрамер+CD44+CD62L+клеток (р<0,01, фиг.11D), фенотипа Т-клеток центральной памяти, отвечающих, как известно, за долговременную защиту от патогенов и опухолей48. Антиген-специфичные Т-клетки, появившиеся в результате введения ICMV с внутренним MPLA, сохраняются даже месяц спустя после последней повторноц иммунизации, при этом количество тетрамер+ Т-клеток среди CD8+ Т-клеток составляло -11% (в 3 раза и 8 раз больше, чем при применении ICMV с внешним MPLA и растворимого OVA+MPLA, соответственно, p<0,05 для обоих, фиг.11 С). Для тестирования функциональности Т-клеток, увеличившихся в численности вследствие иммунизацией, оценивали способность CD8+Т-клеток из периферической крови продуцировать интерферон-γ (IFN-γ) после повторной стимуляции ex vivo на 49-й день. У мышей, иммунизированных ICMV с внутренним MPLA, наблюдали гораздо более высокие содержания IFN-γ-компетентных Т-клеток, чем у мышей, получавших иммунизации ICMV с внешним MPLA или растворимый OVA (р<0,05, фиг.11Е). Насколько известно, с точки зрения степени экспансии антиген-специфичных Т-клеток, сохранения клеток памяти, и способности продуцировать IFN-γ, это один из самых сильных эндогенных Т-клеточных ответов, когда-либо зарегистрированных для белковых вакцин, и он сравним с реакциями на сильные живые векторы, такие как рекомбинантные вирусы5,6. Примечательно то, что это достигается путем «гомологичной» бустерной иммунизации, повторной иммунизации теми же самыми составами частицами, стратегия, которая не может быть использована со множеством живых векторов вследствие иммунных реакций, развивающихся против самого вектора доставки на основе патогена7.
Эти исследования демонстрируют синтез нового класса реагентов в форме субмикронных частиц на основе сшитых многослойных липидных везикул, которые сочетают ряд привлекательных свойств для биомедицинских применений; синтез частиц не требует экспозиции белковых грузов в органических растворителях, липидная основа частиц делает их по своей природе биоразлагаемыми до метаболизируемых побочных продуктов, фосфолипидная оболочка дает возможность блочного захвата и липофильных и гидрофильных грузов, белки инкапсулируются с очень высокими содержаниями на массу частиц, и высвобождение белка из частиц может поддерживаться на протяжении длительных периодов времени. Эти результаты свидетельствуют о том, что ICMV могут быть очень эффективным носителем для доставки биомакромолекул, и в частности, для вакцинных применений. Способность достигать такого мощного комбинированного Т-клеточного ответа и ответа антител с использованием вакцин на основе синтетических частиц может открыть новые возможности для вакцинации в ситуациях с инфекционными заболеваниями и злокачественной опухолью.
Ссылки
1. Guy, В. The perfect mix: recent progress in adjuvant research. Nat Rev Microbiol 5, 505-517 (2007).
2. Perrie, Y., Mohammed, A.R., Kirby, D.J., McNeil, S.E. & Bramwell, V.W. Vaccine adjuvant systems: enhancing the efficacy of sub-unit protein antigens. Int J Pharm 364,272-280 (2008).
3. Reed, S.G., Bertholet, S., Coler, R.N. & Friede, M. New horizons in adjuvants for vaccine development. Trends Immunol 30, 23-32 (2009).
4. Walker, B.D. & Burton, D.R. Toward an AIDS vaccine. Science 320, 760-764 (2008).
5. Haglund, K., et ей. Robust recall and long-term memory T-cell responses induced by prime-boost regimens with heterologous live viral vectors expressing human immunodeficiency virus type 1 Gag and Env proteins. J Virol 76, 7506-7517 (2002).
6. Flatz, L., et al. Development of replication-defective lymphocytic choriomeningitis virus vectors for the induction of potent CD8+Т cell immunity. Nat Med 16, 339-345 (2010).
7. Brave, A., Ljungberg, К., Wahren, В. & Liu, M.A. Vaccine delivery methods using viral vectors. Mol Pharm 4, 18-32 (2007).
8. Priddy, F.H., et al. Safety and immunogenicity of a replication-incompetent adenovirus type 5 HIV-1 clade В gag/pol/nef vaccine in healthy adults, din Infect Dis 46, 1769-1781 (2008).
9. Hubbell, J.A., Thomas, S.N. & Swartz, M.A. Materials engineering for immunomodulation. Nature 462,449-460 (2009).
10. Heath, W.R. & Carbone, F.R. Cross-presentation in viral immunity and self-tolerance. Nat Rev Immunol 1, 126-134 (2001).
11. Kwon, Y.J., James, E., Shastri, N. & Frechet, J.M. In vivo targeting of dendritic cells for activation of cellular immunity using vaccine carriers based on pH-responsive microparticles. Proc Nati Acad Sci USA 102,18264-18268 (2005).
12. Hamdy, S., et al. Enhanced antigen-specific primary CD4+and CD8+responses by codelivery of ovalbumin and toll-like receptor ligand monophosphoryl lipid A in poly(D,L-lactic-co-glycolic acid) nanoparticles. JBiomed Mater Res A 81, 652-662 (2007).
13. Heit, A., Schmitz, F., Haas, Т., Busch, D.H. & Wagner, H. Antigen co-encapsulated with adjuvants efficiently drive protective Т cell immunity. Eur J Immunol 37, 2063-2074 (2007).
14. Schlosser, E., et al. TLR ligands and antigen need to be coencapsulated into the same biodegradable microsphere for the generation of potent cytotoxic Т lymphocyte responses. Vaccine 26, 1626-1637(2008).
15. Heffeman, M.J., Kasturi, S.P., Yang, S.C., Pulendran, B. & Murthy, N. The stimulation of CD8+Т cells by dendritic cells pulsed with polyketal microparticles containing ion-paired protein antigen and poly(inosinic acid)-poly(cytidylic acid). Biomaterials 30, 910-918(2009).
16. Demento, S.L., et al. Inflammasome-activating nanoparticles as modular systems for optimizing vaccine efficacy. Vaccine 27, 3013-3021 (2009).
17. Reddy, S.T., et al. Exploiting lymphatic transport and complement activation in nanoparticle vaccines. Nat Biotechnol 25, 1159-1164 (2007).
18. Torchilin, V.P. Recent advances with liposomes as pharmaceutical carriers. Nat Rev Drug Discov 4, 145-160 (2005).
19. Gregoriadis, G., Gursel, I., Gursel, M. & McCormack, B. Liposomes as immunological adjuvants and vaccine carriers. Journal of Controlled Release 41, 49-56 (1996).
20. Jeong, J.M., Chung, Y.C. & Hwang, J.H. Enhanced adjuvantic property of polymerized liposome as compared to a phospholipid liposome. J Biotechnol 94, 255-263 (2002).
21. Vangala, A., et al. Comparison of vesicle based antigen delivery systems for delivery of hepatitis В surface antigen. J Control Release 119,102-110 (2007).
22. Steers, N.J., Peachman, K.K., McClain, S., Alving, C.R. & Rao, M. Liposome-encapsulated HIV-1 Gag p24 containing lipid A induces effector CD4+T-cells, memory CD8+T-cells, and pro-inflammatory cytokines. Vaccine 27, 6939-6949 (2009).
23. Bhowmick, S., Mazumdar, Т., Sinha, R. & Ali, N. Comparison of liposome based antigen delivery systems for protection against Leishmania donovani. J Control Release 141,199-207 (2010).
24. Reddy, R., Zhou, F., Nair, S., Huang, L. & Rouse, B.T. In vivo cytotoxic Т lymphocyte induction with soluble proteins administered in liposomes. JImmunol 148, 1585-1589 (1992).
25. Collins, D.S., Findlay, К. & Harding, C.V. Processing of exogenous liposome-encapsulated antigens in vivo generates class I MHC-restricted Т cell responses. J Immunol 148, 3336-3341 (1992).
26. Wakita, D., et al. An indispensable role of type-1 IFNs for inducing CTL-mediated complete eradication of established tumor tissue by CpG-liposome co-encapsulated with model tumor antigen. Int Immunol 18,425-434 (2006).
27. Popescu, M.C., et al. A novel proteoliposomal vaccine elicits potent antitumor immunity in mice. Blood 109, 5407-5410 (2007).
28. Alien, T.M., Mumbengegwi, D.R. & Charrois, G.J. Anti-CD 19-targeted liposomal doxorubicin improves the therapeutic efficacy in murine B-cell lymphoma and ameliorates the toxicity of liposomes with varying drug release rates, din Cancer Res 11, 3567-3573 (2005).
29. Cashion, M.P. & Long, Т.Е. Biomimetic Design and Performance of Polymerizable Lipids. Accounts of Chemical Research 42, 1016-1025 (2009).
30. Hotz, J. & Meier, W. Vesicle-templated polymer hollow spheres. Langmuir 14, 1031-1036(1998).
31. Mahadevan, S. & Tappel, A.L. Lysosomal lipases of rat liver and kidney. J Biol Chem 243, 2849-2854 (1968).
32. Papahadjopoulos, D., Nir, S. & Duzgunes, N. Molecular mechanisms of calcium-induced membrane fusion. JBioenerg Biomembr 22, 157-179 (1990).
33. Zauner, W., Farrow, N.A. & Haines, A.M. In vitro uptake of polystyrene microspheres: effect of particle size, cell line and cell density. J Control Release 71, 39-51 (2001).
34. Mohammed, A.R., Bramwell, V.W., Coombes, A.G. & Perrie, Y. Lyophilisation and sterilisation of liposomal vaccines to produce stable and sterile products. Methods 40, 30-38 (2006).
35. Girard, P., et al. A new method for the reconstitution of membrane proteins into giant unilamellar vesicles. Biophys JH7, 419-429 (2004).
36. Lutsiak, M.E., Robinson, D.R., Coester, C., Kwon, G.S. & Samuel, J. Analysis of poly(D,L-lactic-co-glycolic acid) nanosphere uptake by human dendritic cells and macrophages in vitro. Pharm Res 19,1480-1487 (2002).
37. Huisgen, R. Cycloadditions - definition classification and characterization. Ange-wandte Chemie-International Edition 7, 321-& (1968).
38. Wang, Q., et al. Bioconjugation by copper(I)-catalyzed azide-alkyne [3+2] cycloaddition. J Am Chem Soc 125, 3192-3193 (2003).
39. Alien, T.M. & Cullis, P.R. Drug delivery systems: entering the mainstream. Science 303,1818-1822 (2004).
40. Mundargi, R.C., Babu, V.R., Rangaswamy, V., Patel, P. & Aminabhavi, T.M. Nano/micro technologies for delivering macromolecular therapeutics using poly(D,L-lactide-co-glycolide) and its derivatives. J Control Release 125, 193-209 (2008).
41. Vasir, J.K. & Labhasetwar, V. Biodegradable nanoparticles for cytosolic delivery of therapeutics. Adv Drug Deliv Rev 59, 718-728 (2007).
42. Gabizon, A., et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethylene-glycol coated liposomes. Cancer Res 54, 987-992 (1994).
43. Kirby, С.& Gregoriadis, G. Dehydration-rehydration vesicles - a simple method for high-yield drug entrapment in liposomes. Bio-Technology 2, 979-984 (1984).
44. Bershteyn, A., et al. Polymer-supported lipid shells, onions, and flowers. Soft Matter 4, 1787-1791(2008).
45. McKee, A.S., Munks, M.W. & Marrack, P. How do adjuvants work? Important considerations for new generation adjuvants. Immunity 27, 687-690 (2007).
46. Mata-Haro, V., et al. The vaccine adjuvant monophosphoryl lipid A as a TRIF-biased agonist ofTLR4. Science 316, 1628-1632 (2007).
47. Porgador, A., Yewdell, J.W„ Deng, Y., Bermink, J.R. & Germain, R.N. Localization, quantitation, and in situ detection of specific peptide-MHC class I complexes using a monoclonal antibody. Immunity 6, 715-726 (1997).
48. Sallusto, F., Geginat, J. & Lanzavecchia, A. Central memory and effector memory Т cell subsets: function, generation, and maintenance. Annu Rev Immunol 22, 745-763 (2004).
49. Yadava, A., et al. A novel chimeric Plasmodium vivax circumsporozoite protein induces biologically functional antibodies that recognize both VK210 and VK247 sporozoites. Infect Immun 75,1177-1185 (2007).
50. Ellman, G.L. Tissue sulfhydryl groups. Arch Biochem Biophys 82, 70-77 (1959).
Эквиваленты
В то время как в настоящем документе описаны и проиллюстрированы некоторые варианты осуществления в соответствии с настоящим изобретением, специалисту в данной области будет легко представить ряд других средств и/или структур для осуществления функции и/или для получения результатов и/или одного или нескольких из преимуществ, описанных в настоящем документе, и каждый из таких вариантов и/или модификаций, как считается, попадает в объем описанных в настоящем документе вариантов осуществления в соответствии с настоящим изобретением. Более широко, специалистам в данной области будет легко понять, что все параметры, размеры, материалы и конфигурации, описанные в настоящем документе, как подразумевается, являются типичными, и что фактические параметры, размеры, материалы и/или конфигурации будут зависеть от конкретного применения или применений, для которых используются методики в соответствии с настоящим изобретением. Специалистам в данной области будет понятно, или они в состоянии будут убедиться, что можно использовать не более чем рутинный эксперимент и множество эквивалентов для описанных в настоящем документе конкретных вариантов осуществления в соответствии с настоящим изобретением. Таким образом, следует понимать, что вышеупомянутые варианты осуществления представлены исключительно в качестве примера, и что в объем приложенной формулы изобретения и ее эквивалентов попадают варианты осуществления в соответствии с настоящим изобретением, выполненные иным образом, отличным от того, что конкретно описан и заявлен. Варианты осуществления настоящего раскрытия направлены на каждый отдельный признак, систему, изделие, материал, набор и/или способ, описанные в настоящем документе. Кроме того, какая-либо комбинация двух или более таких признаков, систем, изделий, материалов, наборов и/или способов, если такие признаки, системы, изделия, материалы, наборы и/или способы не являются взаимоисключающими, включена в объем раскрытия настоящего изобретения.
Все определения, описанные и использованные в настоящем документе, следует понимать как контроль над справочными определениями, определениями в документах, включенных посредством ссылки, и/или общепринятыми значениями определяемых терминов.
Все ссылки, патенты и патентные заявки, раскрытые в настоящем документе, включены посредством ссылки по отношению к предмету, для которого каждая из них цитируется, и которая в некоторых случаях может включать весь документ.
Используемые в настоящем документе в описании и в формуле изобретения термины в единственном числе, если четко не указано обратное, следует понимать как «по меньшей мере один».
Используемую в настоящем документе в описании и в формуле изобретения фразу «и/или» следует понимать как «любой из двух или оба вместе» элемента, таким образом объединенных, т.е. элементы, которые вместе присутствуют в одних случаях и отдельно присутсвуют в других случаях. Несколько элементов, перечисленных с «и/или» следует толковать таким же образом, т.е. «один или несколько» элементов, таким образом объединенных. Необязательно могут присутствовать другие элементы, отличные от элементов, конкретно определенных с помощью условия «и/или», будь то связанные или не связанные с конкретно определенными элементами. Таким образом, в качестве неограничивающего примера ссылка на «А и/или В» при использовании в сочетании с неограничивающим выражением, таким как «содержащий», в одном варианте осуществления может относиться только к А (необязательно включая элементы, отличные от В); в другом варианте осуществления только к В (необязательно включая элементы, отличные от А); в следующем варианте осуществления и к А, и к В (необязательно включая другие элементы) и т.п.
Используемый в настоящем документе в описании и в формуле изобретения термин «или» следует понимать в том же значении, как «и/или», что определено выше. Например, при отделении пунктов в перечне «или» или «и/или» следует понимать как включающие, т.е. включение по меньшей мере одного, но также в том числе и более чем одного числа или перечня элементов и необязательно дополнительных неперечисленных пунктов. Только выражения, четко указывающие обратное, такие как «только один из» или «ровно один из», или используемое в формуле изобретения «состоящий из» будут означать включение ровно одного элемента из числа или перечня элементов. В целом, используемый в настоящем документе термин «или» следует понимать только как указание исключающих альтернатив (т.е. «один или другой, но не оба»), если он предшествовал терминам исключительности, таким как «либо», «один из», «только один из» или «ровно один из». Выражение «состоящий в основном из» при использовании в формуле изобретения должно характеризоваться обычным значением, используемым в области патентного права.
Используемую в настоящем документе в описании и в формуле изобретения фразу «по меньшей мере один» в отношении перечня одного или нескольких элементов следует понимать как означающую по меньшей мере один элемент, выбранный из какого-либо одного или нескольких элементов в перечне элементов, но не обязательно включение по меньшей мере одного из каждого и всякого элемента, конкретно указанных в перечне элементов, и не исключение каких-либо комбинаций элементов в перечне элементов. Это определение также предусматривает, что необязательно могут присутствовать элементы, отличные от элементов, конкретно указанных в перечне элементов, к которому относится фраза «по меньшей мере один», будь то связанные или не связанные с конкретно определенными элементами. Таким образом, в качестве неограничивающего примера «по меньшей мере один из А и В» (или эквивалентного «по меньшей мере один из А или В», или эквивалентного «по меньшей мере один из А и/или В») может означать в одном варианте осуществления по меньшей мере один, необязательно в том числе более чем один А с отсутствием В (и необязательно в том числе элементы, отличные от В); в другом варианте осуществления по меньшей мере один, необязательно в том числе более чем один В с отсутствием А (и необязательно в том числе элементы, отличные от А); в следующем варианте осуществления по меньшей мере один, необязательно в том числе более чем один А и по меньшей мере один, необязательно в том числе более чем один В (и необязательно в том числе другие элементы) и т.п.
Также следует понимать, что если четко не указано обратное, в любые способы, заявленные в настоящем документе, которые предусматривают более чем одну стадию или действие, порядок стадий или действий способа не обязательно ограничивается порядком, в котором стадии или действия способа упомянуты.
В формуле изобретения, а также в вышеприведенном описании все переходные фразы, такие как «содержащий», «включающий в себя», «несущий», «имеющий», «заключающий», «вовлекающий», «содержащий в себе», «состоящий из» и т.п., следует понимать как открытые, т.е. означающие включение в себя без ограничения. Только переходные фразы «состоящий из» и «состоящий в основном из» должны быть закрытыми или на половину закрытыми переходными фразами, соответственно, согласно указаниям в United States Patent Office Manual of Patent Examining Procedures, Section 2111.03.
Реферат
Группа изобретений относится к области медицины, а именно к многослойной липидной везикуле для доставки терапевтического, профилактического или диагностического средства, имеющей ковалентные сшивки между липидными бислоями, при этом по меньшей мере два липидных бислоя в многослойной липидной везикуле являются ковалентно сшитыми друг с другом, а также к способам ее получения, к способам доставки терапевтического, профилактического или диагностического средства и к фармацевтическим композициям, содержащим такую многослойную липидную везикулу. Группа изобретений обеспечивает повышение эффективности инкапсуляции и стабильности многослойных липидных везикул. 10 н. и 83 з.п. ф-лы, 29 ил.,3 табл., 2 пр.
Формула
контактирование липосом, содержащих функционализированный липид, с двухвалентным катионом с образованием слитых липосом и
контактирование слитых липосом со сшивателем.
многослойную липидную везикулу, имеющую ковалентные сшивки между липидными бислоями, причем по меньшей мере два липидных бислоя в многослойной липидной везикуле являются ковалентно сшитыми друг с другом; и
терапевтическое средство, профилактическое средство или диагностическое средство.
многослойной липидной везикулы, имеющей ковалентные сшивки между липидными бислоями, причем по меньшей мере два липидных бислоя в многослойной липидной везикуле являются ковалентно сшитыми друг с другом; и
иммуномодулирующего средства.

Комментарии