Фармацевтическая композиция, содержащая сополимер нуклеиновой кислоты - RU2143903C1
Код документа: RU2143903C1
Чертежи



Описание
Изобретение относится к фармацевтической композиции, содержащей липидный элемент и сополимер одноцепочечной нуклеиновой кислоты.
Используемый в настоящем описании термин "липидный элемент" означает систему, содержащую натуральный или синтетический липид в качестве ее компонента и обладающую способностью стимулировать внутриклеточное поглощение физиологически активного вещества.
Комплекс "нуклеиновокислотный полимер - нуклеиновокислотный полимер", такой как "полиинозиновая кислота - полицитидиловая кислота", т.е. сополимер одноцепочечной нуклеиновой кислоты, такой как поли(адениловая кислота-уридиловая кислота), к сожалению не обладает интерферониндуцирующей активностью, и введенный отдельно он не оказывает противоопухолевого действия.
Тем не менее известно, что некоторые виды положительно заряженных липидных систем (например, катионные липосомы) являются средством доставки генов в клетки (см. например, JP-A-4108391, WO 91/17424). Известно также, что введение нуклеиновой кислоты определенного типа, например двухцепочечной РНК, совместно с липидной системой, такой как катионные липосомы, способствует потенцированию действия индуктора интерферона (патент США N 5049386). В этой связи было высказано предположение, что поскольку нуклеиновые кислоты или, например, гены заряжены отрицательно, то они могут образовывать комплексы с катионными липосомами, и эти комплексы, связываясь с клеточными мембранами, обеспечивают доставку нуклеиновых кислот или генов и т.п. вовнутрь клетки.
Однако при этом остается выяснить, можно ли использовать указанную липидную систему применительно к сополимеру одноцепочечной нуклеиновой кислоты в целях индуцирования активности индуктора интерферона или противоопухолевого действия.
Целью настоящего изобретения является осуществление эффективного использования сополимера одноцепочечной нуклеиновой кислоты и получение фармацевтической композиции, обладающей противоопухолевой активностью.
В ходе тщательных исследований авторами настоящего изобретения было установлено, что использование липидной системы совместно с сополимерами одноцепочечных нуклеиновых кислот, такими как поли(адениловая кислота-уридиловая кислота), приводит к повышению активности индуктора интерферона; и этот факт был положен в основу настоящего изобретения.
В качестве липидной системы могут быть использованы липофектин (Lipofectin) (товарный знак продукта, выпускаемого Bethesda Research Laboratories Life Technologies Inc.) и генетрансфер (Genetransfer) (товарный знак продукта, выпускаемого Wako Pure Chemical Industries), которые являются известными соединениями, а также смесь соединения, имеющего формулу I, и фосфолипида.

где R1 и R2 являются различными и каждый из них представляет собой OY или -A-(CH2)n-E, где n является целым числом от 0 до 4, а E представляет собой пирролидинопиперидино-, замещенную или незамещенную пиперазино, морфолино-, замещенную или незамещенную гуанидиногруппу, либо

(R3 и R4 могут быть одинаковыми или различными и каждый из них представляет собой водород, низший(C1-C4)алкил, гидрокси-низший(C1-C4)алкил или моно- или ди-(низший)алкиламино(C2-C8)алкил).
A
представляет собой (1), (2), (3), (4), (5), (6) и (7), а именно



R и Y могут быть одинаковыми или различными и каждый из них представляет собой насыщенную или ненасыщенную алифатическую углеводородную группу из 10-30 атомов углерода, или насыщенный или ненасыщенный остаток жирной кислоты из 10-30 атомов углерода.
Замещенный пиперазиногруппами для E являются 4-метилпиперазино-, 4-этилпиперазино-, 4-H-пропилпиперазино-, 4-изопропилпиперазино-, 4-н-бутилпиперазино-, 4-изобутилпиперазино-, 4-(2-гидроксиэтил)пиперазино-, 4-(2-гидроксипропил)пиперазино- и 4-(3-гидроксипропил)пиперазиногруппы и т.п.
Замещенными гуанидиногруппами для E являются метилгуанидино-, этилгуанидино-, н-пропилгуанидино-, N,N-диметилгуанидино-, N,N-диэтилгуанидино-, N, N-ди-н-пропилгуанидино-, N, N'-диметилгуанидино-, N,N'-диэтилгуанидино-, N, N'-ди-н-пропилгуанидино-, N, N, N'-триметилгуанидино-, N,N,N'-триэтилгуанидино-, N,N,N'-три-н-пропилгуанидино-, N,N,N,N'-тетраметилгуанидино-, N,N,N, N'-тетраэтилгуанидино- и N,N,N, N'-тетра-н-пропилгуанидиногруппы и др.
Низший алкил для R3 и R4 представляет метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, третбутил и т.п.
Гидрокси(низший)алкил для R3 и R4 представляет собой гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1-гидроксипропил, 2-гидроксипропил, 3-гидроксипропил и др.
Моно- и ди-(низший)алкиламиноалкил для R3 и R4 представляет собой метиламинометил, диметиламинометил, 2-(метиламино)этил, 2-диметиламиноэтил, 3-(метиламино)пропил, 3-диметиламинопропил, этиламинометил, диэтиламинометил, 2-(этиламино)этил, 2-диэтиламиноэтил, 3-(этиламино)пропил, 3-диэтиламинопропил, н-пропиламинометил, ди-н-пропиламинометил, 2-(н-пропиламино)этил, 2-(ди-н-пропиламино)этил, 3-(н-пропиламино)пропил, 3-(ди-н-пропиламино)пропил и т.п.
Кроме того, в формуле (I) R и Y могут быть одинаковыми или различными и каждый из них представляет собой насыщенную или ненасыщенную алифатическую углеводородную группу, имеющую 10-30 атомов углерода, либо насыщенный или ненасыщенный остаток жирной кислоты, имеющий 10-30 атомов углерода. Однако предпочтительно, если R и Y являются одинаковыми и представляют собой ненасыщенный алифатический углеводородный остаток или ненасыщенный остаток жирной кислоты, имеющий 12-20 атомов углерода. Особенно предпочтительно, если оба R и Y представляют собой, например, олеил или олеоил.
A является предпочтительно карбаматной связью или сложноэфирной связью.
В качестве
типичных конкретных примеров могут служить следующие соединения:
3-O-(2-диметиламиноэтил) карбамоил-1,2-O- дилаурилглицерин,
3-O-(2-диметиламиноэтил)
карбамоил-1,
2-O- димиристилглицерин,
3-O-(2-диметиламиноэтил) карбамоил-1,2 -O-дипальмитилглицерин,
3-O-(2-диметиламиноэтил) карбамоил-1,2-O- диолеилглицерин,
3-O-(2-диметиламиноэтил)
карбамоил-1,2-O- дилинолеилглицерин,
3-O-(2-диметиламиноэтил)карбамоил -2-O-лаурил-1-O- миристилглицерин,
3-O-(2-диметиламиноэтил) карбамоил-1-O-олеил
-2-O- пальмитилглицерин,
3-O-(2-диметиламиноэтил) карбамоил-1-O- линолеил-2-O- олеилглицерин,
3-O-(диметиламинометил) карбамоил-1,2-O- диолеилглицерин,
3-O-(3-диметиламинопропил) карбамоил-1,
2-O- диолеилглицерин,
3-O-(4-диметиламинобутил) карбамоил-1,2-O- диолеилглицерин,
3-O-(2-диэтиламиноэтил) карбамоил-1,2-O- диолеилглицерин,
3-O-(3-диэтиламинопропил)
карбамоил-1,2-O- диолеилглицерин,
3-O-(2-ди-н-пропиламиноэтил) карбамоил-1,2-O- диолеилглицерин,
3-O-(2-диизопропиламиноэтил) карбамоил-1,
2-O- диолеилглицерин,
3-O-(2-ди-н-бутиламиноэтил) карбамоил-1,2-O- диолеилглицерин,
3-O-(2-диизобутиламиноэтил) карбамоил-1,2-O- диолеилглицерин,
3-O-(2-ди-втор-бутиламиноэтил) карбамоил-1,
2-O- диолеилглицерин,
3-O-[2-(N-этил-N- метиламино)этил] карбамоил-1,2-O- диолеилглицерин,
3-O-(2-метиламиноэтил) карбамоил-1,
2-O- диолеилглицерин,
3-O-(2-этиламиноэтил)
карбамоил-1,2-O- диолеилглицерин,
3-O-(2-н-пропиламиноэтил) карбамоил-1,2-O- диолеилглицерин,
3-O-(2-н-бутиламиноэтил)
карбамоил-1,2-O- диолеилглицерин,
3-O-(2-аминоэтил)
карбамоил-1,2-O- диолеилглицерин,
3-O-[2-(N-метил-N- (2-гидроксиэтил)амино] карбамоил-1,2-O- диолеилглицерин,
3-O-[2-(N-этил-N- (2-гидроксиэтил)амино) этил]карбамоил-1,
2-O- диолеилглицерин,
3-O-[2-(N,N-ди- (2-гидроксиэтил)амино) этил]карбамоил-1,2-O- диолеилглицерин,
3-O-[2-(N-(2-диэтиламино) этил-N-метиламино) этил]карбамоил-1,2-O- диолеилглицерин,
3-O-[2-(4-метилпиперазино) этил]карбамоил -1,2-O- диолеилглицерин,
3-O-(2-морфолиноэтил)
карбамоил-1,2-O- диолеилглицерин,
3-O-(2-пиперидиноэтил) карбамоил-1,
2-O- диолеилглицерин,
3-O-(2-пирролидиноэтил) карбамоил-1,2-O- диолеилглицерин,
3-O-(2-диэтиламиноэтил)
тиокарбамоил-1,2-O- диолеилглицерин,
3-O-(2-диметиламиноэтил)
тиокарбамоил-1,2-O- диолеилглицерин,
3-O-[2-(N, N-ди- (2-гидроксиэтил)амино) этил]тиокарбамоил-1,2-O- диолеилглицерин,
3-O-(2-пирролидиноэтил) тиокарбамоил-1,2-O- диолеилглицерин,
3-O-(2-диметиламиноэтил) сульфамоил-1,2-O- диолеилглицерин,
3-O-(2-диэтиламиноэтил) сульфамоил-1,
2-O- диолеилглицерин,
3-O-[2-N, N-ди (2-гидроксиэтил)амино)этил] сульфамоил-1,
2-O- диолеилглицерин,
3-O-(2-пирролидиноэтил) сульфамоил-1,2-O- диолеилглицерин,
3-O-(N,
N- диметиламиноацетил)-1,2-O- диолеилглицерин,
3-O-(4-диметиламинобутаноил) -1,
2-O-дилаурилглицерин,
3-O-(4-диметиламинобутаноил) -1,2-O-дипальмитилглицерин,
3-O-(4-диметиламинобутаноил) -1,2-O-диолеилглицерин,
3-O-(4-диэтиламинобутаноил) -1,
2-O-диолеилглицерин,
3-O-(4-диметиламинобутаноил) -1,2-O-дилинолеилглицерин,
3-O-(4-диметиламинобутаноил) -1-O-олеил-2-O- пальмитилглицерин,
3-O-(4-диметиламинобутаноил)
-1-O-линолеил-2-O- олеилглицерин,
3-O-(3-диметиламинопропионил) -1,2-O- диолеилглицерин,
3-O-(5-диметиламинопентаноил) -1,2-O- диолеилглицерин,
3-O-(4-ди-н-пропиламинобутаноил) -1,2-O- диолеилглицерин,
3-O-(4-диизопропиламинобутаноил) -1,2-O- диолеилглицерин,
3-O-[4- (N-этил-N-метиламино) бутаноил]-1,2-O- диолеилглицерин,
3-O-(4- этиламинобутаноил)-1,2-O- диолеилглицерин,
3-O-[4-(N- метил-N-(2-гидроксиэтил) амино)бутаноил] -1,
2-O- диолеилглицерин,
3-O-[4-(N, N- ди-(2-гидроксиэтил)
амино)бутаноил] -1,2-O- диолеилглицерин,
3-O-[4-(N-(2- диэтиламино)этил-N- метиламино)бутаноил]-1,2-O- диолеилглицерин,
3-O-[4- (4-метилпиперазино) бутаноил]-1,2-O-диолеилглицерин,
3-O-(4-морфолинобутаноил) -1,2-O- диолеилглицерин,
3-O-(4-пирролидинобутаноил) -1,2-O- диолеилглицерин,
3-O-(4-пиперидинобутаноил) -1,2-O- диолеилглицерин,
O-(2-диэтиламиноэтил) -O-(2,3-диолеилоксипропил) метилфосфонат,
O-(2-диметиламиноэтил) -O'-(2,3-диолеилоксипропил) метилфосфонат,
O-[2-(N, N-ди- (2-гидроксиэтил) амино)этил] -O'-(2,
3- диолеилоксипропил) метилфосфонат,
O-(2-пирролидиноэтил) -O'-(2,3-диолеилоксипропил) метилфосфонат,
3-O-(2-диметиламиноэтил) карбамоил-1,2-O-дилаурилглицерин,
3-O-(2-диметиламиноэтил) карбамоил-1,2-O-димиристоилглицерин,
3-O-(2-диметиламиноэтил) карбамоил- 1,
2-O-дипальмитоилглицерин,
3-O-(2-диметиламиноэтил) карбамоил-1,
2-O- диолеилглицерин,
3-O-(2-диметиламиноэтил) карбамоил-1,2-O- дилиноленилглицерин,
3-O-(2-диметиламиноэтил)
карбамоил-1-O-олеоил -2-O- пальмитоилглицерин,
3-O-(2-диметиламиноэтил) карбамоил-1-O-линоленил-2-O- олеоилглицерин,
3-O-(3-диметиламинопропил) карбамоил-1,2-O-диолеилглицерин,
3-O-(2-диэтиламиноэтил) карбамоил-1,
2-O-диолеоилглицерин,
3-O-(2-ди-н-пропиламиноэтил) карбамоил-1,2-O-диолеилглицерин,
3-O-(2-диизопропиламиноэтил) карбамоил-1,
2-O-диолеоилглицерин,
3-O-[2-(N-этил-N- метиламино)этил] карбамоил-1,2-O-диолеоилглицерин,
3-O-(2-этиламиноэтил) карбамоил-1,2-O- диолеоилглицерин,
3-O-[2-(N-метил- N-(2-гидроксиэтил) амино)этил]
карбамоил-1,2-O- диолеоилглицерин,
3-O-[2-(N, N-ди- (2-гидроксиэтил) амино)этил] карбамоил-1,2-O-диолеоилглицерин,
3-O-[2-(N- (2-диэтиламино)этил-N- метиламино)этил] карбамоил-1,
2-O- диолеоилглицерин,
3-O-(2-пиперидиноэтил) карбамоил-1,2-O-диолеоилглицерин,
3-O-(2-пирролидиноэтил) карбамоил-1,
2-O-диолеоилглицерин,
3-O-(2-аминоэтил)карбамоил -1,
2-O-диолеоилглицерин,
3-O-(2-диэтиламиноэтил) тиокарбамоил-1,2-O- диолеоилглицерин,
3-O-(2-диметиламиноэтил)
тиокарбамоил-1,2-O- диолеоилглицерин,
3-O-[2-(N,
N-ди- (2-гидроксиэтил)амино) этил] тиокарбамоил-1,2-O- диолеоилглицерин,
3-O-(2-пирролидиноэтил) тиокарбамоил- 1,
2-O- диолеоилглицерин,
3-O-(2-диэтиламиноэтил) сульфамоил-1,
2-O- диолеоилглицерин,
3-O-(2-диметиламиноэтил) сульфамоил-1,2-O- диолеоилглицерин,
3-O-[2-N,
N-ди- (2-гидроксиэтил)амино) этил] сульфамоил-1,2-O- диолеоилглицерин,
3-O-(2-пирролидиноэтил) сульфамоил-1,2-O- диолеоилглицерин,
3-O-(4-диметиламинобутаноил) -1,
2-O- дилауроилглицерин,
3-O-(4-диметиламинобутаноил) -1,2-O- димиристоилглицерин,
3-O-(4-диметиламинобутаноил) -1,2-O-дипальмитоилглицерин,
3-O-(4-диметиламинобутаноил) -1,
2-O-диолеоилглицерин,
3-O-(4-диметиламинобутаноил) -1,2-O-дилиноленилглицерин,
3-O-(4-диметиламинобутаноил) -1-O-олеоил-2-O-пальмитоилглицерин,
3-O-(4-диметиламинобутаноил)
-1-O-линоленил-2-O-олеоилглицерин,
3-O-(3-диметиламинопропионил) -1,2-O-диолеоилглицерин,
3-O-(5-диметиламинопентаноил) -1,2-O-диолеоилглицерин,
3-O-(4-диэтиламинобутаноил)
-1,2-O-диолеоилглицерин,
3-O-(4-ди-н-пропиламинобутаноил) -1,2-O-диолеоилглицерин,
3-O-(4-диизопропиламинобутаноил)-1,2-O-диолеоилглицерин,
3-O-[4-(N-этил-N-метиламино)бутаноил] -1,2-O-диолеоилглицерин,
3-O-(4-этиламинобутаноил) -1,2-O-диолеоилглицерин,
3-O-[4-(N-метил-N- (2-гидроксиэтил)амино) бутаноил] -1,
2-O- диолеоилглицерин,
3-O-[4-(N, N-ди- (2-гидроксиэтил)амино) бутаноил]-1,2-O- диолеоилглицерин,
3-O-[4-(N-(2-диэтиламино) этил] -N-метиламино) бутаноил] -1,2-O- диолеоилглицерин,
3-O-(4-пирролидинобутаноил] -1,2-O- диолеоилглицерин,
O-(2-диэтиламиноэтил) -O'-(2,
3-диолеоилоксипропил) метилфосфонат,
O-(2-диметиламиноэтил) -O'-(2,3-диолеоилоксипропил)
метилфосфонат,
O-[2-(N, N-ди- (2-гидроксиэтил) амино)этил] -O'- (2,
3-диолеоилоксипропил)метилфосфонат,
O-(2-пирролидиноэтил-O'- (2,3-диолеоилоксипропил) метилфосфонат,
2-O-(2-диметиламиноэтил) карбамоил-1,3-O- дилаурилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1,3-O-димиристилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1,3-O-дипальмитилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1,3-O-дилинолеилглицерин,
2-O-(2-диметиламиноэтил)
карбамоил-1-O-лаурил-3-O- миристилглицерин,
2-O-(2-диметиламиноэтил)
карбамоил-1-O-олеил-3-O- пальмитилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1-O-линолеил-3-O- олеилглицерин,
2-O-(3-диметиламинопропил) карбамоил-1,3-O-диолеилглицерин,
2-O-(4-диметиламинобутил) карбамоил-1,3-O-диолеилглицерин,
2-O-(2-диэтиламиноэтил) карбамоил-1,
3-O-диолеилглицерин,
2-O-(2-ди-н-пропиламиноэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-(2-диизопропиламиноэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-(2-ди-н-бутиламиноэтил)
карбамоил-1,3-O-диолеилглицерин,
2-O-(2-диизобутиламиноэтил) карбамоил-1,
3-O-диолеилглицерин,
2-O-(2-ди- втор-бутиламиноэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-[2-(N-этил-N- метил)аминоэтил] карбамоил-1,3-O-диолеилглицерин,
2-O-(2-метиламиноэтил) карбамоил-1,3 -O-диолеилглицерин,
2-O-(2-этиламиноэтил) карбамоил-1,3-O- диолеилглицерин,
2-O-(2-н-пропиламиноэтил) карбамоил-1,3-O- диолеилглицерин,
2-O-(2-бутиламиноэтил) карбамоил-1,3-O- диолеилглицерин,
2-O-(2-аминоэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-[2-(N-метил-N- (2-гидроксиэтил)амино) этил] карбамоил-1,
3-O-диолеилглицерин,
2-O-[2-(N-этил-N- (2-гидроксиэтил) амино)этил] карбамоил-1,3-O-диолеилглицерин,
2-O-[2-(N,
N-ди-(2- гидроксиэтил)амино)этил] карбамоил-1,3-O-диолеилглицерин,
2-O-[2-(N-(2-диэтиламино) этил-N-метиламино)этил] карбамоил-1,3-O-диолеилглицерин,
2-O-[2-(4-метилпиперазино)этил]
карбамоил-1,3-O-диолеилглицерин,
2-O-(2-морфолиноэтил)карбамоил -1,3-O-диолеилглицерин,
2-O-(2-пиперидиноэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-(2-пирролидиноэтил)
карбамоил-1,3-O-диолеилглицерин,
2-O-(2-диметиламиноэтил) тиокарбамоил-1,3-O-диолеилглицерин,
2-O-(2-диэтиламиноэтил) тиокарбамоил-1,3-O-диолеилглицерин,
2-O-[2-(N,
N-ди- (2-гидроксиэтил)амино) этил]тиокарбамоил-1,
3-O- диолеилглицерин,
2-O-(2- пирролидиноэтил)тиокарбамоил -1,3-O- диолеилглицерин,
2-O-(2- диметиламиноэтил)сульфамоил -1,
3-O- диолеилглицерин,
2-O-(2- диэтиламиноэтил)сульфамоил -1,3-O- диолеилглицерин,
2-O-[2-N, N-ди- (2-гидроксиэтил)амино) этил]сульфамоил-1,3-O- диолеилглицерин,
2-O-(2-пирролидиноэтил) сульфамоил-1,
3-O-диолеилглицерин,
2-O-(4-диметиламинобутаноил) -1,3-O-дилауроилглицерин,
2-O-(4-диэтиламинобутаноил) -1,3-O-дипальмитилглицерин,
2-O-(4-диметиламинобутаноил) -1,
3-O-дилинолеилглицерин,
2-O-(4-диметиламинобутаноил) -1-O-олеил-3-O-пальмитилглицерин,
2-O-(4-диметиламинобутаноил) -1-O-линолеил-3-O-олеилглицерин,
2-O-(3-диметиламинопропионил) -1,3-O-диолеилглицерин,
2-O-(5-диметиламинопентаноил) -1,3-O-диолеилглицерин,
2-O-(4-ди-н-пропиламинобутаноил) -1,3-O-диолеилглицерин,
2-O-(4-диизопропиламинобутаноил) -1,3-O-диолеилглицерин,
2-O-[4-(N-этил -N-метил)аминобутаноил] -1,3-O- диолеилглицерин,
2-O-(4-этиламинобутаноил) -1,3-O-диолеилглицерин,
2-O-[4-(N-метил-N- (2-гидроксиэтил)амино) бутаноил]-1,3-O- диолеилглицерин,
2-O-[4-(N,N-ди- (2-гидроксиэтил)амино) бутаноил]-1,3-O- диолеилглицерин,
2-O-[4-(N- (2-диэтиламино)этил)
-N-метиламино)бутаноил]-1,3-O- диолеилглицерин,
2-O-[4-(4-метилпиперазино) бутаноил]-1,3-O- диолеоилглицерин,
2-O-(4-морфолинобутаноил) -1,
3-O-диолеилглицерин,
2-O-(4-пирролидинобутаноил) -1,3-O-диолеилглицерин,
2-O-(4-пиперидинобутаноил) -1,3-O-диолеилглицерин,
O-(2-диэтиламиноэтил)-O'- (1,
3-диолеилоксипропил)метилфосфонат,
O-(2-диметиламиноэтил)-O'- (1,3-диолеилоксипропан-2-ил) метилфосфонат,
O-[2-(N, N-ди- (2-гидроксиэтил)амино)этил]-O'- (1,
3-диолеилоксипропан-2-ил)метилфосфонат,
O-(2-пирролидиноэтил)-O'-(1,3- диолеилоксипропан-2-ил) метилфосфонат,
2-O-(2-диметиламиноэтил) карбамоил-1,3-O-дилаурилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1,
3-O-димиристоилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1,3-O-дипальмитоилглицерин,
2-O-(2-диэтиламиноэтил) карбамоил-1,
3-O-дипальмитоилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1,3-O-дилиноленилглицерин,
2-O-(2-диметиламиноэтил)
карбамоил-1-O-олеоил-3-O- пальмитоилглицерин,
2-O-(2-диметиламиноэтил) карбамоил-1-O-линолеил-3-O- оленилглицерин,
2-O-(диметиламинометил) карбамоил-1,3-O-диолеилглицерин,
2-O-(3-диметиламинопропил) карбамоил-1,3-O-диолеилглицерин,
2-O-(2-диэтиламиноэтил) карбамоил-1,3-O- диолеилглицерин,
2-O-(2-ди-н-пропиламиноэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-(2-диизопропиламиноэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-[2-(N-этил- N-метиламино)этил] карбамоил-1,3-O-диолеилглицерин,
2-O-[2-(N-метил -N-н-бутиламино)этил]
карбамоил-1,3-O- диолеилглицерин,
2-O-(2-этиламиноэтил) карбамоил-1,3-O-диолеилглицерин,
2-O-[2-(N, N-ди- (2-гидроксиэтил)амино) этил]карбамоил-1,3-O- диолеилглицерин,
2-O-[2-(N-метил-N- (2-гидроксиэтил)амино) этил]карбамоил-1,3-O- диолеилглицерин,
2-O-[2-(N-этил-N- (2-гидроксиэтил)амино) этил]карбамоил-1,3-O- диолеоилглицерин,
2-O-[2-(N-(2-диэтиламино) этил-N-метиламино)этил] карбамоил-1,3-O- диолеоилглицерин,
2-O-[2-(N, N, N', N'-тетраметилгуанидино) этил)карбамоил-1,3-O- диолеоилглицерин,
2-O-(2-морфолиноэтил) карбамоил-1,3-O-диолеоилглицерин,
2-O-(2-пиперидиноэтил) карбамоил-1,3-O-диолеоилглицерин,
2-O-(2-пирролидиноэтил) карбамоил-1,3-O-диолеоилглицерин,
2-O-[2-(4-этилпиперазино) этил]карбамоил-1,3-O-диолеоилглицерин,
2-O-[2-(4-(2-гидроксиэтил) пиперазино)этил] карбамоил-1,3-O- диолеоилглицерин,
2-O-(2-диэтиламиноэтил)
тиокарбамоил-1,
3-O-диолеоилглицерин,
2-O-(2-диметиламиноэтил) тиокарбамоил-1,3-O-диолеоилглицерин,
2-O-[2-(N, N-ди- (2-гидроксиэтил)амино) этил] тиокарбамоил- 1,3-O-диолеоилглицерин,
2-O-(2-пирролидиноэтил) тиокарбамоил-1,3-O-диолеоилглицерин,
2-O-(2-диэтиламиноэтил) сульфамоил-1,3-O-диолеоилглицерин,
2-O-(2-диметиламиноэтил) сульфамоил-1,
3-O-диолеоилглицерин,
2-O-[2-(N, N-ди- (2-гидроксиэтил)аминоэтил] сульфамоил-1,3-O- диолеоилглицерин,
2-O-(2-пирролидиноэтил) сульфамоил-1,3-O-диолеоилглицерин,
2-O-(3-диэтиламинопропионил) -1,
3-O-диолеоилглицерин,
2-O-(4-диметиламинобутаноил) -1,3-O-дилауроилглицерин,
2-O-(4-диметиламинобутаноил) -1,3-O-димиристоилглицерин,
2-O-(4-диметиламинобутаноил) -1,
3-O-дипальмитоилглицерин,
2-O-(4-диметиламинобутаноил) -1,3-O-диолеоилглицерин,
2-O-(4-диметиламинобутаноил) -1,3-O-дилиноленилглицерин,
2-O-(4-диметиламинобутаноил)
-1-O-олеоил-3-O- пальмитоилглицерин,
2-O-(4-диметиламинобутаноил) -1-O-линоленил-3-O- олеоилглицерин,
2-O-(3-диметиламинопропионил) -1,
3-O-диолеоилглицерин,
2-O-(5-диметиламинопентаноил) -1,3-O-диолеоилглицерин,
2-O-(4-диэтиламинобутаноил) -1,3-O-диолеоилглицерин,
2-O-(4-ди-н-пропиламинобутаноил) -1,
3-диолеоилглицерин,
2-O-(4-диизопропиламинобутаноил) -1,3-диолеоилглицерин,
2-O-[4-(N-этил-N-метиламино) бутаноил]-1,3-O-диолеоилглицерин,
2-O-[4-(этил)аминобутаноил] -1,
3-O-диолеоилглицерин,
2-O-[4-(N-метил-N- (2-гидроксиэтил)амино) бутаноил]-1,3-O- диолеоилглицерин,
2-O-[4-(N, N-ди- (2-гидроксиэтил)амино) бутаноил]-1,3-O- диолеоилглицерин,
2-O-[4-(N- (2-диэтиламино)этил-N-метиламино) бутаноил]-1,3-O- диолеоилглицерин,
2-O-(4-пирролидинобутаноил) -1,3-O-диолеоилглицерин,
O-(2-диметиламиноэтил) -O'-(1,
3-диолеоилоксипропан-2-ил) метилфосфонат,
O-(2-аминоэтил)-O'- (1,3-диолеоилоксипропан-2-ил) метилфосфонат,
O-(2-диэтиламиноэтил)-O'- (1,3-диолеоилоксипропан-2-ил) метилфосфонат,
2-диметиламиноэтил N-(2,3- дилауроилоксипропил)карбамат,
2-диметиламиноэтил N-(2,3- димиристилоксипропил)карбамат,
2-диметиламиноэтил N- (2,3-диолеилоксипропил)карбамат,
2-диметиламиноэтил N- (2,3-дилинолеилоксипропил)карбамат,
2-диметиламиноэтил N-(2-лаурилокси-3-линолеилоксипропил) карбамат,
2-диметиламиноэтил
N-(3-миристилокси- 2-олеилоксипропил) карбамат,
3-диметиламинопропил N-(2,3-диолеилоксипропил)карбамат,
4-диметиламинобутил N-(2,3-диолеилоксипропил)карбамат,
2-диэтиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-ди-н-пропиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-ди-н-бутиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-этилметиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-(N-этил-N-метиламино)этил N-(2,3-диолеилоксипропил)карбамат,
2-этиламинобутил N-(2,3-диолеилоксипропил)карбамат,
2-н-пропиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-N-метил-N-(2-гидроксиэтил) амино]этил N-(2,3-диолеилоксипропил)карбамат,
2-N-этил-N-(2-гидроксиэтил) амино]этил N-(2,
3-диолеилоксипропил)карбамат,
2-N,N-ди-(2-гидроксиэтил) амино]этил N-(2,3-диолеилоксипропил)карбамат,
2-N-(2-диэтиламино)этил-N- метиламино] этил N-(2,3-диолеилоксипропил)карбамат,
2-(4-метилпиперидино) этил N-(2,3-диолеилоксипропил)карбамат,
2-морфолиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-пиперидиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-пирролидиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-диметиламиноэтил N-(2,3-диолеилоксипропил)тиокарбамат,
2-диэтиламиноэтил N-(2,3-диолеилоксипропил)тиокарбамат,
2-N,
N-ди-(2-гидроксиэтил)амино]этил N-(2,3-диолеилоксипропил)тиокарбамат,
2-пирролидиноэтил N-(2,3-диолеилоксипропил)тиокарбамат,
2-диметиламиноэтил N-(2,
3-диолеилоксипропил)сульфамат,
2-диэтиламиноэтил N-(2,3-диолеилоксипропил)сульфамат,
2-N,N-ди(2-гидроксиэтил) амино]этил N-(2,3-диолеилоксипропил)сульфамат,
2-пирролидиноэтил N-(2,
3-диолеилоксипропил)сульфамат,
N-(2,3-диолеилокси) пропил-4-диметиламинобутиламид,
N-(2,3-диолеилокси) пропил-4-диэтиламинобутиламид,
N-(2,
3-диолеилокси) пропил-4-N,
N-ди-(2-гидроксиэтил)аминобутиламид,
N-(2,3-диолеилокси) пропил-4-пирролидинобутиламид,
2-диметиламиноэтил N-(2,3-дилауроилоксипропил)карбамат,
2-диметиламиноэтил N-(2,
3-димиристоилоксипропил)карбамат,
2-диметиламиноэтил N-(2,3-дипальмитоилоксипропил)карбамат,
2-диметиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-диметиламиноэтил N-(2,
3-дилиноленилоксипропил)карбамат,
2-диметиламиноэтил N-(2-олеилокси-3-пальмитоилоксипропил) карбамат,
2-диметиламиноэтил
N-(2-линоленилокси-3-олеилоксипропил) карбамат,
2-диэтиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-диметиламинопропил N-(2,3-диолеилоксипропил)карбамат,
2-диизопропиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-ди-н-пропиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-(N-этил-N-метиламино)этил N-(2,3-диолеилоксипропил)карбамат,
2-этиламиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-N-метил-N- (2-гидроксиэтил)амино]этил N-(2,3-диолеилоксипропил)карбамат,
2-N,N-ди-(2-гидроксиэтил) амино]этил N-(2,
3-диолеилоксипропил)карбамат,
2-N-(2-диэтиламино)этил-N- метиламино] этил N-(2,3-диолеилоксипропил)карбамат,
2-пиперидиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-пирролидиноэтил N-(2,3-диолеилоксипропил)карбамат,
2-аминоэтил N-(2,3-диолеилоксипропил)карбамат,
2-диметиламиноэтил N-(2,3-диолеилоксипропил)тиокарбамат,
2-диэтиламиноэтил N-(2,3-диолеилоксипропил)тиокарбамат,
2-N,
N-ди-(2-гидроксиэтил) аминоэтил N-(2,3-диолеилоксипропил)тиокарбамат,
2-пирролидиноэтил N-(2,
3-диолеилоксипропил)тиокарбамат,
2-диметиламиноэтил N-(2,3-диолеилоксипропил)сульфамат,
2-диэтиламиноэтил N-(2,3-диолеилоксипропил)сульфамат,
2-N,N-ди-(2-гидроксиэтил)
аминоэтил N-(2,3-диолеилоксипропил)сульфамат,
2-пирролидиноэтил N-(2,
3-диолеилоксипропил)сульфамат,
N-(2,3-диолеилокси)пропил -4-диметиламинобутиламид,
N-(2,
3-диолеилокси)пропил -4-диэтиламинобутиламид,
N-(2,3-диолеилокси)пропил -4-N,
N-ди-(2-гидроксиэтил) аминобутиламид,
N-(2,3-диолеилокси)пропил -4-пирролидинобутиламид,
2-диметиламиноэтил N-(1,3-дилаурилоксипропил-2-ил)карбамат,
2-диметиламиноэтил N-(1,
3-димиристилоксипропан-2-ил)карбамат,
2-диметиламиноэтил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-диметиламиноэтил N-(1,3-дилинолеилоксипропан-2-ил)карбамат,
2-диметиламиноэтил N-(1-лаурилокси-3-линолеилоксипропан-2-ил) карбамат,
2-диметиламиноэтил
N-(1-миристилокси-3-олеилоксипропан-2-ил) карбамат,
2-диметиламиноэтил
N-(1-олеилокси-3-пальмитилоксипропан-2-ил) карбамат,
3-диметиламинопропил N-(1,
3-диолеилоксипропан-2-ил)карбамат,
4-диметиламинобутил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-диэтиламиноэтил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-ди-н-пропиламиноэтил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-ди-н-бутиламиноэтил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-(N-этил-N-метиламино)этил N-(1,
3-диолеилоксипропан-2-ил)карбамат,
2-метиламиноэтил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-этиламинобутил N-(1,
3-диолеилоксипропан-2-ил)карбамат,
2-н-пропиламиноэтил
N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-н-бутиламино N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-N-метил-N-(2-гидроксиэтил) амино] этил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-[N-этил-N-(2-гидроксиэтил) амино] этил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-N,
N-ди-(2-гидроксиэтил) амино] этил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-[N-(2-диэтиламино)этил -N-метиламино] этил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-(4-метилперидино)этил
N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-пиперидиноэтил N-(1,
3-диолеилоксипропан-2-ил)карбамат,
2-пирролидиноэтил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-диметиламиноэтил
N-(1,3-диолеилоксипропан-2-ил)тиокарбамат,
2-диэтиламиноэтил
N-(1,3-диолеилоксипропан-2-ил)тиокарбамат,
2-[N, N-ди-(2-гидроксиэтил) амино] этил N-(1,
3-диолеилоксипропан-2-ил)тиокарбамат,
2-пирролидиноэтил N-(1,
3-диолеилоксипропан-2-ил)тиокарбамат,
2-диметиламиноэтил N-(1,3-диолеилоксипропан-2-ил)сульфамат,
2-диэтиламиноэтил
N-(1,3-диолеилоксипропан-2-ил)сульфамат,
2-[N,
N-ди-(2-гидроксиэтил) амино] этил N-(1,3-диолеилоксипропан-2-ил)сульфамат,
2-пирролидиноэтил N-(1,
3-диолеилоксипропан-2-ил)сульфамат,
N-(4-диметиламинобутаноил) -1,
3-диолеилокси-1-аминопропан,
N-(4-диэтиламинобутаноил) -1,3-диолеилокси-1-аминопропан,
N-[4-(N,
N-ди-(2-гидроксиэтил) амино)бутаноил] - 1,3-диолеилокси-1-амино-пропан,
N-4-пирролидинобутаноил-1,3- диолеилокси-1-амино-пропан,
2-диметиламиноэтил N-(1,
3-дилауроилоксипропан-2-ил)карбамат,
2-диметиламиноэтил N-(1,3-димиристоилоксипропан-2-ил)карбамат,
2-диметиламиноэтил N-(1,3-дипальмитоилоксипропан-2-ил)карбамат,
2-диметиламиноэтил N-(1,3-диолеилоксипропан-2-ил)карбамат,
2-диметиламиноэтил N-(1,
3-дилиноленилоксипропан-2-ил)карбамат,
2-диметиламиноэтил
N-(1-олеилокси-3-пальмитоилоксипропан-2-ил) карбамат,
2-диметиламиноэтил N-(1-линоленилокси-3-олеоилоксипропан-2-ил)
карбамат,
2-диэтиламиноэтил N-(1,
3-диолеоилоксипропан-2-ил)карбамат,
3-диметиламинопропил N-(1,3-диолеоилоксипропан-2-ил)карбамат,
2-диизопропиламиноэтил N-(1,
3-диолеоилоксипропан-2-ил)карбамат,
2-ди-н-пропиламиноэтил N-(1,3-диолеоилоксипропан-2-ил)карбамат,
2-(N-этил-N-метиламино)этил N-(1,3-диолеоилоксипропан-2-ил)карбамат,
2-этиламиноэтил N-(1,
3-диолеоилоксипропан-2-ил)карбамат,
2-[N-метил-N-(2-гидроксиэтил) амино] этил N-(1,3-диолеоилоксипропан-2-ил)карбамат,
2-[N, N-ди-(2-гидроксиэтил) амино] этил
N-(1,
3-диолеоилоксипропан-2-)карбамат,
2-N-(2-диэтиламино) этил-N-метиламино] этил N-(1,3-диолеоилоксипропан-2-ил)карбамат,
2-пиперидиноэтил N-(1,3-диолеоилоксипропан-2-ил)карбамат,
2-пирролидиноэтил N-(1,3-диолеоилоксипропан-2-ил)карбамат,
2-аминоэтил N-(1,3-диолеоилоксипропан-2-ил)карбамат,
2-диметиламиноэтил N-(1,
3-диолеоилоксипропан-2-ил)тиокарбамат,
2-диэтиламиноэтил N-(1,3-диолеоилоксипропан-2-ил)тиокарбамат,
2-[N, N-ди-(2-гидроксиэтил) амино] этил N-(1,
3-диолеоилоксипропан-2-ил)тиокарбамат,
2-пирролидиноэтил N-(1,
3-диолеоилоксипропан-2-ил)тиокарбамат,
2-диметиламиноэтил N-(1,3-диолеоилоксипропан-2-ил)сульфамат,
2-диэтиламиноэтил N-(1,3-диолеоилоксипропан-2-ил)сульфамат,
2-N,
N-ди-(2-гидроксиэтил) амино] этил N-(1,3-диолеоилоксипропан-2-ил)сульфамат,
2-пирролидиноэтил N-(1,
3-диолеоилоксипропан-2-ил)сульфамат,
N-(2,3-диолеоилокси)
пропил-4-диметиламинобутиламид,
N-(2,3-диолеоилокси) пропил-4-диэтиламинобутиламид,
N-(2,3-диолеоилокси)
пропил-4-N,N-ди-(2-гидроксиэтил) аминобутиламид,
N-(2,
3-диолеоилокси) пропил-4-пирролидинобутиламид.
Из соединений общей формулы I предпочтительными являются:
3-O-(4-диметиламинобутаноил)-1,2-O-диолеилглицерин,
3-O-(2-диметиламиноэтил)карбамоил-1,2-O-диолеилглицерин,
3-O-(2-диэтиламиноэтил)карбамоил-1,2-O-диолеилглицерин,
2-O-(2-диэтиламиноэтил)карбамоил-1,3-O-диолеилглицерин и др.
Наиболее предпочтительным является 3-O-(2-диэтиламиноэтил)карбамоил-1,2-O-диолеилглицерин.
Соединение (I) может быть получено способами, описанными ниже, или другими способами.
(1) Вариант, когда R представляет собой OY, а A представляет собой -O-C(=O)-NH-:

(где B обычно является имидазолилом, галогеном или фенокси. Галогеном может быть, например, хлор, бром или иод. R, Y, E и n имеют значения, определенные выше).
Как показано схематически выше, соединение (I) может быть синтезировано с помощью реакции соединения (II) с соединением (III).
Эта реакция между (II) и (III) может быть осуществлена с использованием 1-3 эквивалентов (III) на один эквивалент (II) в присутствии растворителя при 0o-150oC в течение 1-20 часов. В качестве реакционного растворителя может быть использован диметилформамид, пиридин, толуол, бензол, эфир, диоксан, тетрагидрофуран, хлороформ и т. п. Для ускорения реакции может быть добавлено основание, такое как триэтиламин. Кроме того, соединение (III) может быть сначала превращено в металлическую соль с использованием гидрида натрия, н-бутиллития или т. п. в вышеуказанном растворителе, а затем подвергнуто реакции с соединением (II).
(2) Вариант, когда R1 представляет собой OY, а A представляет -H-C(= O)-O-:

(где B, R, Y, E и n имеют значения, определенные выше).
Соединение (I) может быть синтезировано с помощью реакции соединения (IV) с соединением (V) в соответствии с вышеуказанной реакционной схемой и с использованием реакционных условий, аналогичных условиям, упомянутым в п. (1).
(3) Вариант, когда R1 представляет собой OY, а A
представляет собой -NH-C(=O)-O-:

(где R, Y, E и n имеют значения, определенные выше).
Соединение (I) может быть синтезировано с помощью реакции соединения (VI) с соединением (III'), как схематически показано выше; при этом условия реакции аналогичны реакционным условиям, указанным в (I).
(4) Вариант, когда R1 представляет собой OY, а A
представляет собой -O-C(=O)-NH-:

(где R, Y, E и n имеют значения, определенные выше).
Соединение (I) может быть синтезировано с помощью реакции соединения (IV') с соединением (VII), как схематически показано выше, с использованием реакционных условий, аналогичных условиям, указанным в (1).
(5) Вариант, когда R1 представляет собой OY, а R2 представляет собой -A-(CH2)n-E:

(где A, E и n имеют значения, определенные выше).
Соединение (I) может быть синтезировано путем трансформации гидроксильных групп вышеуказанного соединения в замещающие группы R и Y посредством реакции этого соединения с соответствующими ацилирующими агентами (например такими, как ангидриды или хлорангидриды жирных кислот). В этом варианте синтеза предпочтительно, чтобы R и Y являются остатками жирной кислоты.
Синтез исходных соединений (IV), (IV'), (V), (VI), (VII) и (VIII).
(1) Синтез исходного соединения (IV'):
Исходное соединение (IV) может быть
синтезировано в соответствии с нижеследующей реакционной схемой:

(где Tr представляет собой тритил, Ts представляет собой тозил; R и Y имеют значения, определенные выше).
(2) Синтез
исходного соединения (IV):
Исходное соединение (IV) может быть синтезировано в
соответствии с нижеследующей типичной процедурой.
Соединение (IV) может быть получено с использованием исходного соединения (IV) в соответствии со стандартной процедурой, например, путем азидирования с последующей реакцией восстановления.
(3) Синтез исходного соединения
(V):
Исходное соединение (V), в котором B является имидазолом, может быть
синтезировано, например, посредством реакции соединения (III') с N,N'-карбонилдиимидазолом в пиридине,
осуществляемой при комнатной температуре.
(4) Синтез исходного соединения
(VI):
Исходное соединение (VI) может быть синтезировано посредством реакции соединения (IV) с
дифосгеном.
(5) Синтез исходного соединения (VII):
Исходное соединение
(VII) может быть легко получено, в основном, посредством реакции соединения (III) с дифосгеном, либо
посредством реакции соединения формулы HOOC-(CH2)n-E (где n и E имеют
значения, определенные выше) с дифенилфосфорилазидом (DPPA) в присутствии третичного амина, такого как
пиридин, и при температуре 0o-150oC.
(6) Синтез исходного
соединения (VIII):
1. Соединение (VIII), в котором A представляет собой -O-C(=O)-NH-, может
быть синтезировано, в основном, в соответствии с нижеследующей реакционной схемой

(где Im представляет собой имидазолил).
2. Соединение (VIII), в котором A представляет собой -NH-C(=O)-O-, может быть синтезировано, в основном, в соответствии с нижеследующей реакционной схемой.
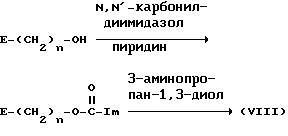
(где Im представляет собой имидазолил; а E и n имеют значения, определенные выше).
3. Соединение (VIII), в котором A представляет собой
-O-C(=O)-, может быть синтезировано, в основном, в соответствии с нижеследующей реакционной схемой:
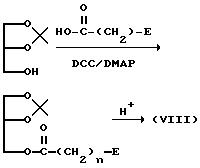
(где DCC означает дициклогексилкарбодиимид и DMAP означает 4-N,N-диметиламинопиридин; а E и n имеют значения, определенные выше).
4. Соединение (VIII), в котором A представляет
собой -O-C(=S)-NH, может быть синтезировано, в основном, в соответствии с нижеследующей реакционной
схемой:

(где Im представляет собой имидазолил).
5. Соединение (VIII), в
котором A представляет собой -NH-C(=O)-, может быть синтезировано, в основном, в соответствии с
нижеследующей реакционной схемой:

(где DCC означает дициклогексилкарбодиимид; а E и n имеют значения, определенные выше).
6. Соединение (VIII), в котором A представляет собой
-OSO2-NH-, может быть синтезировано в соответствии с нижеследующей реакционной схемой:

(где E и n имеют значения, определенные выше).
7. Соединение (VIII), в котором A
представляет собой -O-P(=O)(CH3)-O-, может быть синтезировано, в основном, в
соответствии с нижеследующей реакционной схемой:

(где BT означает 1-бензотриазолил).
Фосфолипидом, используемым в комбинации с соединением (I), может быть, например, фосфатидилэтаноламин или фосфатидилхолин.
Подходящее соотношение соединения (I) и фосфолипида обычно составляет 0,1: 9,9 - 9,9:0,1 (молярное отношение "соединение (I):фосфолипид"), предпочтительно 1: 9 - 9:1 (молярное отношение "соединение (I):фосфолипид"), а более предпочтительно 1:3 - 3:1 (молярное отношение "соединение (I):фосфолипид").
В фармацевтической композиции настоящего изобретения (называемой далее композицией настоящего изобретения) в качестве липидной системы может быть использована липидная суспензия, липосома или другие формы.
Указанная липидная система, состоящая из соединения (I) и фосфолипида, может быть легко получена путем простого смешивания соединения (I) с фосфолипидом в присутствии воды. Эта система может быть также получена способом, заключающимся в том, что соединение (I) и фосфолипид растворяют в хлороформе, после чего хлороформ полностью удаляют в условиях продувания газообразным азотом, полученную смесь тщательно размешивают с добавлением воды и в течение нескольких минут обрабатывают ультразвуком.
В качестве сополимера одноцепочечных нуклеиновых кислот могут быть использованы поли(адениловая кислота-уридиловая кислота, поли(инозиновая кислота-уридиловая кислота) или другие сополимеры. Последовательность двух структурных оснований может быть регулярной или нерегулярной. Термин "регулярная" относится к последовательности, в которой два структурных основания расположены поочередно друг за другом, или в блок-последовательности, в которой за определенным числом звеньев одного основания следует определенное число звеньев другого основания. При этом предпочтительным является сополимер одноцепочечных нуклеиновых кислот, в котором два структурных основания расположены поочередно друг за другом. Еще более предпочтительным является сополимер адениловой кислоты и уридиловой кислоты, имеющий указанную чередующуюся структуру. Число оснований, которое может быть практически использовано в конкретном одноцепочечном нуклеиновокислотном сополимере настоящего изобретения, не играет решающей роли, но в основном оно составляет порядка от 10 до 5000.
Одноцепочечный нуклеиновокислотный сополимер настоящего изобретения может быть подвергнут коалесценции с образованием двухцепочечной формы. Более того, указанный сополимер может быть подвергнут частичной коалесценции с образованием локального двухцепочечного участка.
Отношение липидного компонента к одноцепочечному нуклеиновокислотному сополимеру составляет предпочтительно от 1:0,1 до 1:10 (массовое отношение "липидный компонент:одноцепочечный нуклеиновокислотный сополимер").
Композиция настоящего изобретения может быть получена путем добавления одноцепочечного нуклеиновокислотного сополимера к липидной системе с последующим размешиванием полученной смеси с использованием соответствующих средств. Указанная композиция может быть также изготовлена путем добавления одноцепочечного нуклеиновокислотного сополимера в процессе получения липидной системы.
Композиция настоящего изобретения может быть введена животному или человеку внутривенно, внутриартериально, перорально, ректально либо путем местного (например, чрезкожного) или внутритканевого введения, предпочтительно в виде разовых лекарственных форм. При этом предпочтительным является внутривенное, внутриартериальное и местное введение. Само собой разумеется, что лекарственная форма вводимой композиции должна соответствовать выбранному способу введения; например, такой лекарственной формой могут быть препараты для инъекций, препараты для перорального введения, аэрозольные препараты для ингаляций, глазные капли, мази, суппозитории и т.п.
Дозу композиции настоящего изобретения предпочтительно определяют исходя из типа активного ингредиента конкретно вводимой лекарственной формы, данных пациента, например его возраста и веса тела, способа введения, природы и тяжести заболевания и т.п., однако в основном доза указанной композиции для взрослых составляет от 0,1 мг до 10 г, а предпочтительно от 1 мг до 500 мг в день на человека, исходя из активного ингредиента. В некоторых случаях могут оказаться достаточными более низкие дозы, а в других случаях необходимы более высокие дозы. Указанные дозы могут быть введены в виде разделенных нескольких доз, либо они могут быть введены с интервалами в несколько дней.
Описание предпочтительных вариантов осуществления настоящего изобретения.
Ниже представлены примеры, более подробно иллюстрирующие настоящее изобретение.
Сравнительный пример 1: Синтез 1,2-O-диолеилглицерина.
(1) В 50 мл пиридина растворяли 4, 6 г (50 мМ) глицерина, а затем добавляли 13,9 г (50 мМ) тритилхлорида, после чего полученную смесь размешивали в течение ночи при комнатной температуре. Затем реакционную смесь концентрировали при пониженном давлении, а остаток разводили водой и экстрагировали эфиром. Органический слой промывали водой, осушали сульфатом магния и концентрировали. Остаток очищали с помощью колоночной хроматографии (силикагель/хлороформ-метанол) и получали 9,5 г (59%) 1-O-тритилглицерина.
(2) В 120 мл ксилола растворяли 3,22 г (10 мМ) 1-O-тритилглицерина, а затем добавляли 3,36 г (30 мМ) т-бутоксикалия в атмосфере аргона. После перемешивания в течение 5 минут к раствору по капле добавляли 30 мл раствора 12,8 г (30 мМ) олеил-пара-толуолсульфоната в ксилоле и полученную смесь перемешивали при пониженном давлении (20-30 мм рт.ст.) при комнатной температуре в течение 30 минут, а затем при температуре 50oC в течение часа. Реакционную смесь выливали в ледяную воду и экстрагировали эфиром, а затем полученный экстракт промывали водой, осушали и концентрировали. Осадок очищали с помощью колоночной хроматографии на силикагеле (элюент: н-гексан/этилацетат) и получали 6,10 г (73%) 1,2-O-диолеил-3-O-тритилглицерина.
(3) 1,2-O-Диолеил-3-O-тритилглицерин (6,10 г, 7,3 мМ) подвергали реакции с 50 мл (об/об) смеси 5% трифторуксусной кислоты и метиленхлорида при комнатной температуре в течение часа. Органический слой промывали насыщенным водным раствором бикарбоната натрия и водой, после чего осушали и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: хлороформ) и получали 3,75 г (87%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц, CH3 • 2), 1,14 - 1,44 (44H, м, CH2 • 22), 1,48 - 1,68 (4H, м, OCH2CH2 • 2), 1,90 - 2,10 (8H, м, CH= CHCH2 • 4), 3,38 - 3,78 (9H, м, OCH2 • 4 и OCH), 5,26 - 5,45 (4H, м, CH= CH • 2).
MC (FAB): 593 (M + H)+.
Сравнительный пример 2: Синтез 2, 3-диолеилоксипропиламина.
(1) К смеси, состоящей из 1,00 г (1,7 мМ) 1,2-O-диолеилглицерина, 0,83 г (17 мМ) азида лития, 0,89 г (3,4 мМ) трифенилфосфина и 1,13 г (3,4 мМ) тетрабромметана, добавляли 10 мл N,N-диметилформамида в болюсе и полученную смесь перемешивали при комнатной температуре в течение 3 часов. После завершения реакции, растворитель отгоняли, а образовавшийся остаток разводили водой и экстрагировали эфиром. Эфирный слой промывали водой, осушали и концентрировали, а затем остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: н-гексан/этилацетат), в результате чего получали 1,03 г (100%) 2,3-диолеилоксипропилазида в виде маслообразного вещества.
ИК (чистый, см-1): 2920, 2850, 2100.
(2) В 30 мл тетрагидрофурана суспендировали 75 мг (2 мМ) алюмогидрида лития. К полученной суспензии, охлаждая льдом, по капле добавляли 1,03 г (1,7 мМ) 2,3-диолеилоксипропилазида и смесь перемешивали в течение 30 минут. После этого полученную смесь перемешивали при комнатной температуре в течение 3 часов. После завершения реакции, реакционную смесь выливали в ледяную воду и экстрагировали эфиром. Экстракт промывали водой, осушали и концентрировали. Остаток подвергали хроматографии на колонке с силикагелем (элюент: метиленхлорид/метанол) и получали 0,98 г (98%) целевого соединения в виде бесцветного маслообразного вещества.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц, CH3 • 2), 1,17 - 1,45 (44H, м, CH2 • 22), 1,48 - 1,70 (4H, м,

MC (FAB): 592 (M + H)+.
Сравнительный пример 3: Синтез 1,3-O-диолеилглицерина.
(1) В пиридине растворяли 1,00 г (11 мМ) глицерина и 2,96 г (43 мМ) имидазола и полученный раствор подвергали азеотропной дистилляции. Образовавшийся остаток растворяли в 15 мл N,N-диметилформамида. К этому раствору, охлаждая льдом, добавляли 3,60 г (24 мМ) трибутилдиметилсилилхлорида и полученную смесь перемешивали при комнатной температуре в течение 5 часов. После завершения реакции растворитель отгоняли, а остаток разводили метиленхлоридом и промывали насыщенным водным раствором бикарбоната натрия. Эту смесь осушали и концентрировали, в результате чего получали 3,45 г (99%) 1,3-O-ди-(трет-бутилдиметилсилил)глицерина.
(2) В диоксане растворяли 3,45 г (11 мМ) 1, 3-O-ди-(трет-бутилдиметилсилил)глицерина, а затем к полученному раствору добавляли 3,03 г (12 мМ) п-толуолсульфоната пиридина. К этой суспензии, охлаждая льдом, постепенно добавляли 16,5 мл (22 мМ) дигидрофурана и полученную смесь перемешивали в течение часа. После нагревания до комнатной температуры смесь оставляли для реакции на ночь. После завершения реакции растворитель отгоняли, а остаток обрабатывали метиленхлоридом и насыщенным водным раствором бикарбоната натрия. Метиленхлоридный слой промывали водой, осушали и концентрировали, в результате чего получали 4,25 г (100%) 1, 3-O-ди-(трет-бутилдиметилсилил)-2-O-тетрагидрофуранглицерина.
(3) К раствору 4,25 г (11 мМ) 1,3-O-ди-(трет-бутилдиметилсилил)-2-O-тетрагидрофуранилглицерина в 30 мл тетрагидрофурана по капле добавляли 30 мл фторида тетра-н-бутиламмония (1 М/л в ТГФ) и полученную смесь перемешивали при комнатной температуре в течение 2 часов. Затем реакционную смесь концентрировали, а остаток подвергали колоночной хроматографии на силикагеле (элюент: метиленхлорид/метанол), в результате чего получали 1,70 г (96%) 2-O-тетрагидрофуранилглицерина.
(4) В 30 мл ксилола растворяли 854 мг (5,3 мМ) 2-O-тетагидрофуранилглицерина. К полученному раствору добавляли 1,78 г (15,9 мМ) т-бутоксикалия в атмосфере аргона и полученную смесь перемешивали в течение 5 минут. После добавления по капле 10-миллилитрового раствора 6,71 г (15,9 мМ) олеил-п-толуолсульфоната в ксилоле, смесь перемешивали при пониженном давлении (20-30 мм рт. ст. ) при комнатной температуре в течение 30 минут, а затем при температуре 50oC в течение 1 часа. Реакционную смесь выливали в смесь льда/воды и полученный экстракт промывали водой, осушали и концентрировали. Образовавшийся остаток очищали с помощью колоночной хроматографии на силикагеле, используя в качестве элюента хлороформ, и получали 628 мг (18%) 1,3-O-диолеил-2-O-тетрагидрофуранилглицерина в виде желтого маслообразного вещества.
(5) В 30 мл тетрагидрофурана растворяли 628 мг (0,95 мМ) 1,3-O-диолеил-2-O-тетрагидрофуранилглицерина, а затем добавляли 5 мл разбавленной 10% соляной кислоты и полученную смесь перемешивали в течение ночи. Затем реакционную смесь разводили водой, нейтрализовали насыщенным водным раствором бикарбоната натрия и экстрагировали эфиром. Экстракт осушали, концентрировали и образовавшийся остаток подвергали колоночной хроматографии (силикагель; элюент: н-гексан/этилацетат), в результате чего получали 321 мг (57%) целевого соединения в виде бесцветного маслообразного вещества.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц, CH3 • 2), 1,14 - 1,26 (44H, м, CH2 • 22), 1, 49 - 1,68 (4H, м, OCH2CH2 • 2), 1,98 - 2,13 (8H, м, CH=CHCH2 • 4), 3,37 - 3,56 (8H, м, OCH2 • 4), 3,95 (1H, шир.с., OC

MC (FAB): 593 (M+H)+.
Сравнительный пример 4: Синтез 1,3-диолеилокси-2-пропиламина.
(1) В 5 мл пиридина растворяли 150 мг (0,25 мМ) 1,3-O-диолеилглицерина, а затем добавляли 77 мг (0,40 мМ) паратолуосульфонилхлорида и полученную смесь нагревали при температуре 60oC и перемешивали в течение 2 дней. После завершения реакции растворитель отгоняли, а остаток разводили водой и экстрагировали эфиром. Экстракт осушали и концентрировали, в результате чего получали 150 мг (80%) 1,3-O-диолеил-2-O-(п-толуолсульфонил)глицерина в виде желтого маслообразного вещества.
(2) Смесь, состоящую из 150 мг (80%) вышеописанного 1,3-O-диолеил-2-O-(п-толуолсульфонил)глицерина, 30 мг (0,6 мМ) азида лития и 5 мл N,N-диметилформамида, перемешивали в течение 2 часов при 100oC. После охлаждения растворитель отгоняли, а остаток разводили водой и экстрагировали эфиром. Экстракт промывали водой, осушали и концентрировали, в результате чего получали 125 мг (99%) 1, 3-диолеилокси-2-пропилазида в виде светло-коричневого маслообразного вещества.
(3) В 3 мл тетрагидрофурана суспендировали 8 мг (0,2 мМ) алюмогидрида лития. К полученной суспензии, охлаждая льдом, по капле добавляли 125 мг (0,2 мМ) 1,3-диолеилокси-2-пропилазида и эту смесь перемешивали в течение 2 часов при температуре 0oC. Затем реакционную смесь выливали в смесь льда/воды и экстрагировали эфиром. Полученный экстракт промывали водой, осушали и концентрировали. Остаток подвергали колоночной хроматографии (силикагель; элюент: метиленхлорид/метанол) и получали 104 мг (89%) целевого соединения в виде бесцветного маслообразного вещества.
Сравнительный пример 5: Синтез 1,2-O-диолеилглицерина.
(1) В пиридине растворяли 1 г (0,011 М) глицерина, а затем осуществляли азеотропную дистилляцию. Остаток растворяли в 30 мл пиридина, после чего, охлаждая льдом, добавляли 4,05 г (0,012 М) диметокситритилхлорида. Полученную смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции к смеси добавляли 5 мл метанола. Полученную смесь перемешивали в течение 30 минут, а затем растворитель отгоняли. К остатку добавляли метиленхлорид и эту смесь промывали насыщенным водным раствором бикарбоната натрия, а затем осушали и концентрировали. Остаток подвергали колоночной хроматографии (силикагель; элюент: метиленхлорид/ метанол) и получали 2,58 г (60,2%) 1-O-диметокситритилглицерина.
(2) 290 мг (0,735 мМ) полученного 1-O-диметокситритилглицерина подвергали азеотропной дистилляции с использованием пиридина, а затем остаток растворяли в 5 мл пиридина. К полученному раствору, охлаждая льдом, добавляли 669 мг (2,223 мМ) олеилхлорида и реакцию осуществляли при температуре 50oC в течение 6 часов. После завершения реакции растворитель отгоняли при пониженном давлении. Остаток разводили метиленхлоридом, промывали насыщенным водным раствором бикарбоната натрия, осушали и концентрировали. После этого остаток подвергали колоночной хроматографии (силикагель; элюент: н-гексан/метиленхлорид), в результате чего получали 519 мг (76,5%) 1-O-диметокситритил-2,3-O-диолеилглицерина.
1H-ЯМР (60 МГц, CDCl3) δ: 0,88 (6H, м), 1,27 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 3,10 - 3, 30 (2H, м), 3,79 (6H, с), 4,20 - 4,40 (2H, м), 5,10 - 5,50 (5H, м), 6,70 - 7,40 (13H, м).
(3) 1-O-Диметокситритил-2,3-O-диолеилглицерин (218 мг, 0,236 мМ) растворяли в 10-миллилитровой смеси 5% муравьиной кислоты и метиленхлорида, а затем реакцию проводили в течение 10 минут. Реакционную смесь нейтрализовали насыщенным водным раствором бикарбоната натрия, после чего органический слой промывали насыщенным водным раствором бикарбоната натрия, осушали и концентрировали. Остаток подвергали колоночной хроматографии (силикагель; элюент: н-гексан/метиленхлорид/метанол) и получали 100 мг (68,0%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,28 - 2,40 (4H, м), 3,72 (2H, д, J = 6 Гц), 4,10 - 4,40 (2H, м), 5,00 - 5,12 (1H, м), 5,30 - 5,40 (4H, м).
МС (FAB): 621 (M + H)+.
Сравнительный пример 6: Синтез 1,3-O-диолеилглицерина.
(1) В 60 мл пиридина растворяли 2,75 г (0,013 М) 2-O-(т-бутилдиметилсилил)глицерина, а затем, охлаждая льдом, добавляли 8,82 г (0,028 М) олеилхлорида. Реакцию осуществляли при температуре 50oC в течение 15 часов. После завершения реакции растворитель отгоняли и остаток разводили метиленхлоридом, промывали насыщенным водным раствором бикарбоната натрия, а затем осушали и концентрировали. В результате этой процедуры получали 1,3-O-диолеил-2-O-(т-бутилдиметилсилил)глицерина.
(2) К 1,3-O-диолеил-2-O-(т-бутилдиметилсилил)глицерину добавляли 266 мл 0,1 М тетра-н-бутиламмония/тетрагидрофурана и реакцию осуществляли при комнатной температуре в течение 30 минут. После завершения реакции растворитель отгоняли при пониженном давлении, а остаток разводили метиленхлоридом, после чего промывали водой, осушали и концентрировали. Затем образовавшийся остаток подвергали колоночной хроматографии (силикагель; элюент: этилацетат/н-гексан) и получали 3,97 г (48,0%) целевого соединения, а именно 2-O-бутилдиметилсилилглицерина.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,34 (4H, т, J = 8 Гц), 4,10 - 4,22 (5H, м), 5,30 - 5,40 (4H, м).
МС (FAB): 621 (M + H)+.
Сравнительный пример 7: Синтез 1,3-O-диолеил-2-O-(2-бромоэтил)карбамоилглицерина.
В пиридине растворяли 230 мг (0,37 мМ) 1, 3-O-диолеоилглицерина и полученный раствор подвергали азеотропной дистилляции. Остаток растворяли в 5 мл пиридина и после добавления 120 мг (0,740 мМ) N,N'-карбонилдиимидазола, смесь перемешивали в течение 3 часов при комнатной температуре. Растворитель отгоняли при пониженном давлении, а остаток растворяли в метиленхлориде, промывали смесью 5% бифосфата натрия/водой, осушали и концентрировали. Затем остаток растворяли в 10 мл N,N-диметилиформамида и после добавления 45 мг (0,737 мМ) 2-аминоэтанола, смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции растворитель отгоняли. Образовавшийся остаток растворяли в метиленхлориде, промывали 5% бифосфатом натрия, осушали и концентрировали. После концентрирования остаток подвергали колоночной хроматографии на силикагеле (элюент; метиленхлорид/метанол), в результате чего получали 204 мг (79,5%) 1,3-O-диолеоил-2-O-(2-гидроксиэтил)карбамоилглицерина.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,80 (4H, м), 1,90 - 2,10 (8H, м), 2,34 (4H, т, J = 8 Гц), 3,28 - 3,40 (2H, м), 3,64 - 3,80 (2H, м), 4,20 - 4,40 (4H, м), 5,06 - 5,20 (2H, м), 5,30 - 5,50 (4H, м).
МС (FAB): 690 (M + OH)+.
(2) К смеси, состоящей из 160 мг (0,226 мМ) 1, 3-O-диолеоил-2-O-(2-гидроксиэтил)карбамоилглицерина, 150 мг (0,452 мМ) тетрахлорметана и 120 мг (0,458 мМ) трифенилфосфина, добавляли 10 мл N,N-диметилформамида в болюсе и эту смесь перемешивали при комнатной температуре в течение 2 часов. После завершения реакции растворитель отгоняли, а остаток растворяли в метиленхлориде, промывали водой, осушали и концентрировали. Затем остаток подвергали колоночной хроматографии (силикагель; элюент: этилацетат/н-гексан), в результате чего получали (52,2%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0, 86 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,31 (4H, т, J = 8 Гц), 3,40 - 3,52 (2H, м), 3,52 - 3,70 (2H, м), 4,20 - 4,44 (4H, м), 5,06 - 5,20 (2H, м), 5,25 - 5,40 (4H, м).
МС (FAB): 770 (M + H)+.
Пример для синтеза-1: Синтез 3-O-(2-диметиламиноэтил)карбамоил- 1,2-O-диолеилглицерина.
К 25-миллилитровому раствору 2,00 г (3,4 мМ) 1,2-O-диолеилглицерина в пиридине добавляли 0,66 г (4,1 мМ) N, N-карбонилдиимидазола и эту смесь перемешивали 5 часов при комнатной температуре. После отгонки растворителя при пониженном давлении, остаток растворяли в метиленхлориде, промывали 5% бифосфатом натрия/водой, осушали и концентрировали. Остаток растворяли в 20 мл N, N-диметилформамида и после добавления 595 мг (6,8 мМ) N,N-диметилэтилендиамина смесь перемешивали в течение ночи. После завершения реакции растворитель отгоняли, а остаток разводили водой и экстрагировали метиленхлоридом. Полученный экстракт промывали водой, осушали и концентрировали. Остаток подвергали колоночной хроматографии (силикагель; элюент: хлороформ/метанол) и получали 2,18 г (91%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 7 Гц, CH3 • 2), 1,16 - 1,44 (44H, м, CH3 • 22), 1,47 - 1,68 (4H, м, OCH2CH2 • 2), 1,84 - 2,12 (8H, м,


MC (FAB): 707 (M + H)+.
Пример синтеза-2: Синтез 3-O-(2-метиламиноэтил)-карбамоил-1,2-O- диолеилглицерина.
Целевое соединение получали способом, описанным в примере синтеза-1, за исключением того, что вместо N,N-диметилэтилендиамина использовали N-метиленэтилендиамин.
1 H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир.с.), 1,50 - 1, 60 (4H, м), 1,90 - 2,10 (8H, м), 2,43 (3H, с), 2,71 (2H, т, J = 6 Гц), 3,28 (2H, кв. , J = 6 Гц), 3,40 - 3,70 (7H, м), 4,05 - 4,26 (2H, м), 5,14 (1H, шир.с.), 5,30 - 5,44 (4H, м).
MC (FAB): 693 (M + H)+.
Пример синтеза-3: Синтез 3-O-(2-аминоэтил)карбамоил-1, 2-O- диолеилглицерина.
Это соединение синтезировали способом, описанным в примере синтеза-1, за исключением того, что вместо N,N-диметилэтилендиамина использовали N-тритилэтилендиамин, а обработку проводили с использованием смеси 5% трихлоруксусной кислоты/метиленхлорида, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир.с.), 1,50 - 1,60 (4H, м), 1,90 - 2,10 (8H, м), 3,10 - 3,20 (2H, м), 3,40 - 3,70 (9H, м), 4,04 - 4,26 (2H, м), 5,30 - 5,45 (4H, м), 6,20 (1H, шир.с.).
MC (FAB): 679 (M + H)+.
Пример синтеза-4: Синтез 3-O-(2-диэтиламиноэтил) карбамоил-1-2-O-диолеилглицерина.
Повторяли процедуру, описанную в примере синтеза-1, за исключением того, что вместо N,N-диметилэтилендиамина использовали N,N-диэтилендиамин, в результате чего получали целевое соединение.
1 H-ЯМР (200 МГц, CDCl3) δ: 0,87 (6H, т, J = 6 Гц), 1,01 (6H, т, J = 6 Гц), 1,27 (44H, шир.с.), 1,46 - 1,62 (4H, м), 1,90 - 2,10 (8H, м), 2,48 - 2,62 (6H, м), 3,18 - 3,30 (2H, м), 3,38 - 3,66 (7H, м), 4,04 - 4,24 (2H, м), 5,24 - 5,44 (5H, м).
MC (FAB): 735 (M + H)+.
Пример синтеза-5: Синтез 3-O-(4-диметиламинобутил) карбамоил-1, 2-O-диолеилглицерина.
Повторяли процедуру, описанную в примере синтеза-1, за исключением того, что вместо N,N-диметилэтилендиамина использовали 4-диметиламинобутиламин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3 ) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир.с.), 1,46 - 1,70 (8H, м), 1,90 - 2,10 (8H, м), 2,39 (6H, с), 2,44 - 2,56 (2H, м), 3,10 - 3,24 (2H, м), 3,36 - 3,70 (7H, м), 4,00 - 4,24 (2H, м), 5, 18 - 5,42 (5H, м).
MC (FAB): 736 (M + H)+.
Пример синтеза-6: Синтез 3-O-(2-диметиламиноэтил) тиокарбамоил-1,2-O-диолеилглицерина.
Повторяли процедуру, описанную в примере синтеза-1, за исключением того, что вместо N,N'-карбонилдиимидазола использовали N,N'-тиокрабонилдиимидазол, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир.с.), 1,50 - 1,60 (4H, м), 1,90 - 2,10 (8H, м), 2,21 (6H, д, J = 4 Гц), 2,36 - 2,54 (2H, м), 3,30 - 3,80 (9H, м), 4,40 - 4,70 (2H, м), 5,26 - 5,45 (4H, м).
MC (FAB): 723 (M + H)+.
Пример синтеза-7: Синтез 3-O-(4-диметиламинобутаноил) -1, 2-O-диолеилглицерина.
В 6 мл метиленхлорида/N,N-диметилформамида (1:2) растворяли 120 мг (0, 20 мМ) 1,2-O-диолеилглицерина, а затем добавляли 168 мг (1 мМ) гидрохлорида 4-диметиламиномасляной кислоты. К полученной смеси добавляли 206 мг (1 мМ) N, N'-дициклогексилкарбодиимида (DCC) и 25 мг (0, 2 мМ) 4-диметиламинопиридина, после чего реакцию осуществляли при комнатной температуре в течение ночи. Осажденный побочный продукт, представляющий собой мочевину, отфильтровывали с помощью фильтра Шотта, а затем фильтрат концентрировали досуха при пониженном давлении и обрабатывали смесью метиленхлорида и насыщенного водного раствора бикарбоната натрия. После разделения фаз метиленхлоридный слой осушали сульфатом натрия, а растворитель отгоняли при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (элюент: метиленхлорид/метанол) и получали 123 мг (87%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,20 - 1,40 (44H, м), 1,45 - 1,60 (4H, м), 1,70 - 1,90 (2H, м), 1,90 - 2,10 (8H, м), 2,22 (6H, с), 2,30 (2H, т, J = 8 Гц), 2,36 (2H, т, J = 8 Гц), 3,38 - 3, 85 (7H, м), 4,04 - 4,30 (2H, м), 5,30 - 5,45 (4H, м).
MC (FAB): 706 (M + H)+.
Пример синтеза-8: Синтез 3-O-(N,N-диметиламиноацетил)- -1, 2-O-диолеилглицерина.
В смесь, состоящую из 22 мл N,N-диметилформамида и 11 мл метиленхлорида, суспендировали 572 мг (5,547 мМ) N,N-диметилглицина, а затем добавляли 1736 мг (8,414 мМ) N,N'-дициклогексилкарбодиимида (DCC) и полученную смесь перемешивали при комнатной температуре в течение ночи. После отгонки растворителя при пониженном давлении остаток растворяли в 12 мл пиридина, содержащего 327 мг (0,551 мМ) растворенного 1,2-O-диолеилглицерина. К полученному раствору добавляли 80 мг (0,388 мМ) N, N'-дициклогексилкарбодиимида (DCC) и реакцию осуществляли при 50oC в течение ночи. После завершения реакции растворитель отгоняли, а образовавшийся остаток растворяли в метиленхлориде, промывали насыщенным водным раствором бикарбоната натрия, осушали и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/н-гексан) и получали 251 мг (67,2%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,36 (6H, с), 3,23 (2H, с), 3,40 - 3,70 (7H, м), 4,00 - 4,20 (2H, м), 5,20 - 5, 40 (4H, м).
MC (FAB): 678 (M + H)+.
Пример синтеза-9: Синтез 3-O-(4-диэтиламинобутаноил)- 1,2-O-диолеилглицерина.
(1) В 5 мл безводного пиридина растворяли 300 мг (0,51 мМ) 1,2-O-диолеилглицерина, а затем к полученному раствору, охлаждая льдом, добавляли 188 мг (1,01 мМ) 4-бромобутилхлорида. После нагревания смеси до комнатной температуры реакцию осуществляли в течение часа при температуре 50oC. Затем растворитель отгоняли, а образовавшийся остаток обрабатывали смесью метиленхлорида и насыщенного водного раствора бикарбоната натрия. После разделения фаз и осушки сульфатом натрия растворитель отгоняли при пониженном давлении. Полученный таким образом остаток подвергали колоночной хроматографии на силикагеле (элюент: метиленхлорид/метанол) и получали 159 мг (42%) бромового соединения.
1 H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,27 (44H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,20 (10H, м), 2,53 (2H, т, J = 8 Гц), 3,40 - 3,70 (9H, м), 4,05 - 4,30 (2H, м), 5, 25 - 5,45 (4H, м).
(2) В 6 мл N, N-диметилформамида/изопропилового спирта/хлороформа (1:1:1) растворяли 130 мг (0,18 мМ) полученного выше бромового соединения, а затем к полученному раствору добавляли 1 мл диэтиламина и 70 мг (0,54 мМ) N,N-диизопропилэтиламина. После этого смесь подвергали реакции при температуре 60oC в течение 20 часов, а затем при температуре 80oC в течение 6 часов. Растворитель отгоняли при пониженном давлении, а образовавшийся остаток обрабатывали метиленхлоридом/водой. Метиленхлоридный слой осушали сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток подвергали колоночной хроматографии (силикагель; элюент: метиленхлорид/метанол) и получали 63 мг (50%) целевого соединения.
1 H-ЯМР (200 МГц, CDCl3) δ: 0, 88 (6H, т, J = 6 Гц), 1,04 (6H, т, J = 6 Гц), 1,27 (44H, шир.с.), 1,50 - 1,70 (4H, м), 1,80 (2H, м), 1,90 - 2,10 (8H, м), 2,37 (2H, т, J = 6 Гц), 2,44 - 2, 70 (6H, м), 3,40 - 3,70 (7H, м), 4,05 - 4,30 (2H, м), 5,30 - 5,45 (4H, м).
MC (FAB): 734 (M + H)+.
Пример синтеза-10: Синтез N-(2, 3-диолеилокси)-пропил-4- диметиламинобутиламида.
В 3 мл безводного N, N-диметилформамида растворяли 100 мг (0,17 мМ) 2,3-диолеилоксипропиламина. К полученному раствору добавляли 71 мг (0,42 мМ) гидрохлорида 4-диметиламиномасляной кислоты, 105 мг (0,51 мМ) N,N'-дициклогексилкарбодиимида (DCC) и 4,1 мг (0,034 мМ) 4-диметиламинопиридина, а затем реакцию осуществляли при комнатной температуре в течение ночи. Реакционную смесь обрабатывали тем же способом, что и в примере синтеза-6, в результате чего получали 115 мг (96%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,20 - 1,40 (44H, м), 1,50 - 1,60 (4H, м), 1,70 - 1,90 (2H, м), 1,90 - 2,10 (8H, м), 2,23 (6H, с), 2,24 (2H, т, J = 8 Гц), 2,34 (2H, т, J = 8 Гц), 3,20 - 3,60 (9H, м), 5,30 - 5,42 (4H, м).
MC (FAB): 705 (M + H)+.
Пример синтеза-11: Синтез 3-O-(2-диметиламиноэтил)сульфамоил- 1, 2-O-диолеилглицерина.
В 4 мл метиленхлорида/пиридина (2:1) растворяли 150 мг (0,25 мМ) 1,2-O-диолеилглицерина. Затем к полученному раствору добавляли 1-миллилитровый раствор 150 мг (0, 75 мМ) (2-диметиламиноэтил)сульфамоилхлорида в метиленхлориде и реакцию проводили при температуре 50oC в течение 2 часов. После завершения реакции растворитель отгоняли при пониженном давлении, а остаток обрабатывали смесью метиленхлорида/насыщенного водного раствора бикарбоната натрия. Метиленхлоридный слой осушали сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии (силикагель; элюент: метиленхлорид/метанол) и получали 34 мг (18%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,20 - 1,40 (44H, м), 1,45 - 1,65 (4H, м), 1,90 - 2,10 (8H, м), 2,24 (6H, с), 2,48 (2H, т, J = 6 Гц), 3,18 (2H, т, J = 6 Гц), 3,40 - 3,60 (6H, м), 3,60 - 3,75 (1H, м), 4,08 - 4,30 (2H, м), 5,30 - 5,40 (4H, м).
MC (FAB): 743 (M + H)+.
Пример синтеза-12: Синтез 2-диметиламиноэтил N-(2,3-диолеилоксипропил)карбамата.
В 2 мл пиридина растворяли 45 мг (0,5 мМ) 2-диметиламиноэтанола, а затем добавляли 97 мг (0,6 мМ) N,N'-карбонилдиимидазола и полученную смесь перемешивали в течение 4 часов. К этому раствору добавляли 355 мг (0,6 мМ) 2, 3-диолеилоксипропиламина и смесь перемешивали в течение 24 часов. После завершения реакции растворитель отгоняли, а остаток растворяли в метиленхлориде, промывали насыщенным водным раствором бикарбоната натрия, осушали и концентрировали. Полученный остаток очищали с помощью колоночной хроматографии (силикагель; элюент: метиленхлорид/метанол) и получали 383 г (100%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,87 (6H, т, J = 6 Гц, CH3 • 2), 1,12 - 1,44 (44H, м, CH2 • 22), 1,46 - 1,64 (4H, м, OCH2CH2 • 2), 1,88 - 2,12 (8H, м,


MC (FAB): 707 (M + H)+.
Пример синтеза-13: Синтез 2-O-(2-диметиламинометил)карбамоил-1,3-O-диолеилглицерина.
К 2-миллилитровому раствору 1,3-O-диолеилглицирина (150 мг, 0,253 мМ) в пиридине добавляли 82 мг (0,51 мМ) N,N'-карбодиимидазола и полученную смесь перемешивали при комнатной температуре в течение 5 часов. После отгонки растворителя при пониженном давлении остаток растворяли в метиленхлориде, промывали 5% бифосфатом натрия/водой, осушали и концентрировали. Затем остаток растворяли в 1,6 мл N,N-диметилформамида и перемешивали вместе с 45 мг (0,51 мМ) N,N-диметиленэтилдиамина в течение ночи. После завершения реакции растворитель отфильтровывали, а остаток разводили водой и экстрагировали метиленхлоридом. Полученный экстракт промывали водой, осушали и концентрировали. Остаток подвергали колоночной хроматографии на силикагеле (элюент: хлороформ/метанол) и получали 179 мг (100%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0, 88 (6H, т, J = 6 Гц), 1,28 (44H, шир.с.), 1,50 - 1,65 (4H, м), 1,90 - 2,10 (8H, м), 2,20 (6H, с), 2,39 (2H, т, J = 6 Гц), 3,20 - 3,30 (2H, м), 3,34 - 3,55 (4H, м), 3,55 - 3,70 (4H, д, J = 4 Гц), 4,99 (1H, т, J = 4 Гц), 5,25 - 5,46 (5H, м).
MC (FAB): 707 (M + H)+.
Пример синтеза-14: Синтез 2-диметиламиноэтил N-(1,3-диолеилоксипропан-2-ил)карбамата.
Повторяли процедуру, описанную в примере синтеза-12, за исключением того, что использовали 1,3-диолеилокси-2-пропиламин, в результате чего получали целевое соединение.
1 H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир.с.), 1,50 - 1,60 (4H, м), 1,90 - 2,10 (8H, м), 2,28 (6H, с), 2,54 (2H, т, J = 6 Гц), 3,40 - 3,55 (8H, м), 3,80 - 3,90 (1H, м), 4,15 (2H, т, J = 6 Гц), 5,10 - 5,20 (1H, м), 5,20 - 5,45 (4H, м).
MC (FAB): 707 (M + H)+.
Пример синтеза-15: Синтез 3-O-(2-диметиламиноэтил) карбамоил-1,2-O-диолеилглицерина.
Повторяли процедуру, описанную в примере синтеза-1, за исключением того, что использовали 1,2-O-диолеоилглицерин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,22 (6H, с), 2,24 - 2,40 (4H, м), 2,41 (2H, т, J = 6 Гц), 3,20 - 3,30 (2H, м), 4,10 - 4,15 (4H, м), 5,20 - 5,30 (2H, м), 5,30 - 5,45 (4H, м).
MC (FAB): 735 (M + H)+ .
Пример синтеза-16: Синтез 2-O-(2-диметиламиноэтил) карбамоил-1,2-O-диолеилглицерина.
Повторяли процедуру, описанную в примере синтеза-13, за исключением того, что использовали 1,3-O-диолеоилглицерин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,26 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,22 (6H, с), 2,32 (4H, т, J = 8 Гц), 2,42 (2H, т, J = 6 Гц), 3,20 - 3,30 (2H, м), 4,12 - 4,25 (4H, м), 5,15 (1H, т, J = 6 Гц), 5,20 - 5,45 (5H, м).
MC (FAB): 735 (M + H)+.
Пример синтеза-17: Синтез 2-диметиламиноэтил N-(2,3-диолеилоксипропил)-карбамата.
В 30 мл безводного пиридина растворяли 500 мг (5,61 мМ) 2-диметиламиноэтанола, а затем добавляли 1,91 г (11,8 мМ) N,N'-карбонилдиимидазола, после чего реакцию осуществляли при комнатной температуре в течение 5 часов. К этой реакционной смеси добавляли 197 мг (2,16 мМ) 3-амино-1,2-пропандиола и реакцию осуществляли при комнатной температуре в течение ночи. После отгонки пиридина при пониженном давлении полученный неочищенный карбамат повторно растворяли в безводном пиридине. Затем к раствору, охлаждая льдом, добавляли 5,22 г (17,4 мМ) олеоилхлорида и реакцию проводили при температуре 50oC в течение 14 часов. После отгонки пиридина при пониженном давлении остаток растворяли в метиленхлориде и промывали насыщенным водным раствором бикарбоната натрия. Метиленхлоридный слой осушали сульфатом натрия на силикагеле (элюент: метиленхлорид/метанол) и получали 250 мг (16%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,25 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,28 (6H, с), 2,30 (4H, т, J = 8 Гц), 2,57 (2H, т, J = 6 Гц), 3,30 - 3,50 (2H, м), 4,06 - 4,30 (4H, м), 5,04 - 5,15 (2H, м), 5,25 - 5,40 (4H, м).
MC (FAB): 735 (M + H)+.
Пример синтеза-18: Синтез 2-диметиламиноэтил N-(1,3-диолеоилоксипропан-2-ил)карбамата.
Повторяли процедуру, описанную в примере синтеза-17, за исключением того, что вместо 3-амино-1,2-пропандиола использовали 2-амино-1,3-пропандиол, в результате чего получали 372 мг (2,2 мМ) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,87 (6H, т, J = 7 Гц), 1,20 - 1,40 (40H, м), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,30 (6H, с), 2,32 (4H, т, J = 8 Гц), 2,59 (2H, т, J = 6 Гц), 4,00 - 4,25 (7H, м), 5, 10 - 5,20 (1H, м), 5,30 - 5,45 (4H, м).
MC (FAB): 735 (M + H)+.
Пример синтеза-19: Синтез 2-O-(2-пиперидиноэтил)- карбамоил-1,3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-13, за исключением того, что использовали 1,3-O-диолеилглицерин и 1-(2-аминоэтил)пиперидин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,44 - 1, 54 (2H, м), 1,54 - 1,76 (8H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,39 - 2,56 (6H, м), 3,20 - 3,40 (2H, м), 4,12 - 4,40 (4H, м), 5,08 - 5,24 (1H, м), 5,24 - 5,52 (5H, м).
MC (FAB): 773 (M + H)+.
Пример синтеза-20: Синтез 2-O-(2-диэтиламиноэтил)-карбамоил- 1,3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-13, за исключением того, что использовали 1, 3-O-диолеилглицерин и N,N-диэтилэтилендиамин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,02 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,44 - 2,66 (6H, м), 3,16 - 3,32 (2H, м), 4,22 - 4,38 (4H, м), 5,08 - 5,22 (1H, м), 5,26 - 5,52 (5H, м).
MC (FAB): 763 (M + H)+.
Пример синтеза-21: Синтез 2-O-(2-диизопропиламиноэтил) карбамоил-1, 3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-13, за исключением того, что использовали 1,3-O-диолеоилглицерин и N,N-диизопропилэтилендиамин, в результате чего получали целевое соединение.
1 H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,00 (12H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1, 94 - 2,10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,48 - 2,68 (2H, м), 2,88 - 3,20 (4H, м), 4,10 - 4,32 (4H, м), 5,06 - 5,28 (2H, м), 5,30 - 5,42 (5H, м).
MC (FAB): 791 (M + H)+ .
Пример синтеза-22: Синтез 2-O-(2-пирролидиноэтил)- карбамоил-1,3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-13, за исключением того, что использовали 1,3-O-диолеоилглицерин и 1-(2-аминоэтил)пирролидин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50 - 1, 70 (4H, м), 1,74 - 1,88 (4H, м), 1,90 - 2,10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,44 - 2,70 (6H, м), 3,20 - 3,40 (2H, м), 4,20 - 4,42 (4H, м), 5,08 - 5,22 (1H, м), 5,24 - 5,46 (5H, м).
MC (FAB): 761 (M + H)+.
Пример синтеза-23: Синтез 2-O-(2-морфолиноэтил) карбамоил-1,3-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-13, за исключением того, что использовали 1,3-O-диолеоилглицерин и 4-(2-аминоэтил)морфолин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,31 (4H, т, J = 8 Гц), 2,40 - 2,54 (6H, м), 3,20 - 3,40 (2H, м), 3,70 (4H, т, J = 6 Гц), 4,12 - 4,38 (4H, м), 5,08 - 5,20 (2H, м), 5,20 - 5,46 (4H, м).
MC (FAB): 777 (M + H)+.
Пример синтеза-24: Синтез 2-O-(3-диэтиламинопропил)- карбамоил-1, 3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-13, за исключением того, что использовали 1,3-O-диолеоилглицерин и 3-диэтиламинопропиламин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,03 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2, 10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,46 - 2,58 (6H, м), 3,20 - 3,32 (2H, м), 4,10 - 4,34 (4H, м), 5,10 - 5,20 (1H, м), 5,30 - 5,42 (4H, м), 6,18 - 6,30 (1H, шир.с.).
MC (FAB): 777 (M + H)+.
Пример синтеза-25: Синтез 2-O-2-N-метил-N-(2-гидроксиэтил) амино)этил карбамоил-1,3-O-диолеоилглицерина.
В 10 мл хлороформа растворяли 173 мг (0,224 мМ) 1,3-O-ди-олеоил-2-O-(2-бромэтил)карбамоилглицерина, а затем добавляли 543 мг (7,228 мМ) 2-(метиламино)этанола и 27 мг (0,209 мМ) диизопропилэтиламина и полученную смесь нагревали с обратным холодильником при температуре 80oC в течение ночи. Затем реакционную смесь промывали смесью, состоящей из 5% бифосфата натрия и воды, после чего осушали и концентрировали. Остаток хроматографировали на колонке с силикагелем (элюент: метиленхлорид/метанол) и получали 128 мг (74,3%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,86 (6H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,26 - 2,38 (7H, м), 2,50 - 2,70 (4H, м), 3,20 - 3,40 (2H, м), 3,61 (4H, т, J = 6 Гц), 4,20 - 4,44 (4H, м), 5,06 - 5,20 (2H, м), 5,30 - 5,45 (4H, м).
MC (FAB): 765 (M + H)+.
Пример синтеза-26: Синтез 2-O-[2-(N-этил-N-(2-гидроксиэтил) амино)этил] карбамоил-1, 3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-25, за исключением того, что использовали 2-(этиламино)этанол, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,03 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,54 - 2,68 (6H, м), 3,20 - 3,30 (2H, м), 3,56 (2H, т, J = 6 Гц), 4,12 - 4,34 (4H, м), 5,06 - 5,20 (2H, м), 5,30 - 5,44 (4H, м).
MC (FAB): 779 (M + H)+ .
Пример синтеза-27: Синтез 2-O-[2-(N,N-ди-(2-гидроксиэтил)амино) этил] карбамоил-1,3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-25, за исключением того, что использовали диэтаноламин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,60 - 2,70 (6H, м), 3,20 - 3,30 (2H, м), 3,60 (4H, т, J = 6 Гц), 4,12 - 4,40 (4H, м), 5,08 - 5,20 (1H, м), 5,30 - 5,42 (4H, м), 5,60 - 5,70 (1H, шир.с.).
MC (FAB): 795 (M + H)+.
Пример синтеза-28: Синтез 2-O-[2-(N-метил-N-н-бутиламино)этил] карбамоил-1, 3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-25, за исключением того, что использовали N-метилбутиламин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,82 - 0,96 (9H, м), 1,10 - 1,50 (42H, м), 1,50 - 1,75 (6H, м), 1,90 - 2,10 (8H, м), 2,19 (3H, с), 2,26 - 2,40 (6H, м), 2,46 (2H, м), 3,20 - 3,30 (2H, м), 4,10 - 4,30 (4H, м), 5,08 - 5,20 (1H, м), 5,25 - 5,40 (4H, м).
MC (FAB): 777 (M + H)+.
Пример синтеза-29: Синтез 2-O-[2-(4-гидроксиэтил)пиперазино) этил]карбамоил-1,3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-25, за исключением того, что использовали 1-(2-гидроксиэтил)-пиперазин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (3H, т, J = 6 Гц), 1, 28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,40 - 2,60 (12H, м), 3,18 - 3,32 (2H, м), 3,62 (2H, т, J = 6 Гц), 4,12 - 4,32 (4H, м), 5,08 - 5,24 (2H, м), 5,30 - 5,40 (4H, м).
MC (FAB): 820 (M + H)+.
Пример синтеза-30: Синтез 2-O-[2-(N,N,N',N'-тетраметилгуанидино) этил] карбамоил-1,3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-25, за исключением того, что использовали N,N,N',N'-тетраметилгуанидин, в результате получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (3H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,96 (3H, с), 3,10 (3H, с), 3,53 - 3, 40 (2H, м), 3,60 - 3,70 (2H, м), 4,04 - 4,34 (4H, м), 4,98 - 5,08 (12H, м), 5,30 - 5,40 (4H, м), 6,30 - 6,40 (1H, м).
MC (FAB): 805 (M + H)+.
Пример синтеза-31: Синтез 2-O-[2-(N-2-диэтиламино)этил-N- метиламино)этил]карбамоил-1,3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-25, за исключением того, что использовали N, N-диэтил-N-метилэтилендиамин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,04 (6H, т, J - 6 Гц), 1, 26 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,26 - 2,36 (7H, м), 2,44 - 2,64 (10H, м), 3,15 - 3,25 (2H, м), 4,16 - 4,26 (4H, м), 5,08 - 5,18 (1H, м), 5,30 - 5,40 (4H, м), 6,46 - 6,60 (1H, шир.с.).
MC (FAB): 820 (M + H)+.
Пример синтеза-32: Синтез 2-O-[2-(4-этилпиперазино)этил] карбамоил-1,3-O-диолеоилглицерина.
Повторяли процедуру, описанную в примере синтеза-25, за исключением того, что использовали 1-этилпиперазин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,10 (3H, т, J = 6 Гц), 1,26 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,38 - 2,60 (12H, м), 3,22 - 3,34 (2H, м), 4,12 - 4,34 (4H, м), 5,10 - 5,30 (2H, м), 5,30 - 5,42 (4H, м).
MC (FAB): 802 (M + H)+.
Пример синтеза-33: Синтез 2-O-[2-(N-этил-N-метиламино) этил]карбамоил-1,3-O-диолеоилглицерина.
В 3 мл хлороформа растворяли 131 мг (0,170 мМ) 1,3-O-диолеоил-2-O-(2-бромоэтил)карбамоилглицерина, а затем к полученному раствору добавляли 470 мг (7,951 мМ) N-этиламинина, после чего реакцию осуществляли в герметично закрытом реакционном сосуде при 80oC в течение ночи. Эту реакционную смесь промывали 5% бифосфатом натрия/водой, осушали и концентрировали. Остаток подвергали колоночной хроматографии на силикагеле, элюируя смесью метиленхлорида/метанола, в результате чего получали 104 мг (81,5%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,04 (3H, т, J = 6 Гц), 1,26 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2, 10 (8H, м), 2,20 (3H, с), 2,32 (4H, т, J = 8 Гц), 2,38 - 2,52 (4H, м), 3,20 - 3,30 (2H, м), 4,12 - 4,32 (4H, м), 5,10 - 5,20 (1H, м), 5,25 - 5,42 (4H, м).
MC (FAB): 749 (M + H)+.
Пример синтеза-34: Синтез 2-O-(2-диэтиламиноэтил)-карбамоил- 1,3-O-дипальмитоилглицерина.
Повторяли процедуру, описанную в примере синтеза-13, за исключением того, что использовали 1, 3-O-дипальмитоилглицерин и N,N-диэтилэтилендиамин, в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,87 (6H, т, J = 6 Гц), 1,00 (6H, т, J = 6 Гц), 1,25 (48H, шир.с.), 1,50 - 1,70 (4H, м), 2,30 (4H, т, J = 8 Гц), 2,46 - 2,60 (6H, м), 3,10 - 3,30 (2H, м), 4,12 - 4,32 (4H, м), 5,10 - 5,20 (1H, м), 5,20 - 5,35 (1H, м).
MC (FAB): 711 (M + H)+.
Пример синтеза-35: Синтез 2-диэтиламиноэтил N-(1,3-диолеилоксипропан-2-ил)карбамата.
В метиленхлориде растворяли 470 мг (4 мМ) 2-диэтиламиноэтанола. После добавления 633 мг (8 мМ) пиридина к полученной смеси, охлаждая льдом, добавляли 690 мг (4,4 мМ) фенилхлороформата, после чего реакцию осуществляли в течение 2 часов при комнатной температуре. После завершения реакции растворитель отгоняли, а образовавшийся остаток переносили в этилацетатный раствор 1% водного бикарбоната натрия. Этилацетатный слой отделяли, осушали сульфатом натрия и концентрировали при пониженном давлении с получением 705 мг (74%) неочищенного карбонатного соединения. Этот неочищенный карбонат растворяли в безводном пиридине, а затем добавляли 134 мг (1,47 мМ) 2-амино-1,3-пропандиола и реакцию проводили при температуре 80oC в течение ночи. Затем к реакционной смеси добавляли 973 мг (3,2 мМ) олеоилхлорида, после чего реакцию проводили при комнатной температуре в течение 24 часов. После завершения реакции растворитель отгоняли при пониженном давлении, а образовавшийся остаток переносили в смесь метиленхлорида и насыщенного водного раствора бикарбоната натрия и осушали сульфатом натрия. Растворитель удаляли при пониженном давлении, а остаток подвергали колоночной хроматографии на силикагеле (элюент: метиленхлорид/метанол), в результате чего получали 250 мг (22%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,87 (6H, т, J = 6 Гц), 1,04 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,50 - 2,70 (6H, м), 4,00 - 4,30 (7H, м), 5,05 - 5,20 (1H, м), 5,25 - 5,45 (4H, м).
MC (FAB): 763 (M + H)+.
Пример синтеза-36: Синтез 2-O-(3-диэтиламинопропионил)- 1,3-диолеоилглицерина.
В смеси, состоящей из 3 мл N,N-диметилформамида и 6 мл метиленхлорида, растворяли 172 мг (0,277 мМ) 1,3-диолеоилглицерина, а затем добавляли 101 мг (0,556 мМ) гидрохлорида N,N-диэтил-β-аланина, 114 мг (0,553 мМ) N,N-дициклогексилкарбодиимида и 7 мг (0,057 мМ) 4-диметиламинопиридина, после чего полученную смесь перемешивали в течение ночи. Затем реакционную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Остаток растворяли в метиленхлориде и промывали водой. Промытый раствор осушали и концентрировали. Остаток подвергали колоночной хроматографии на силикагеле (элюент: метиленхлорид/метанол) и получали 129 мг (62%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,20 - 1,40 (46H, м), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,76 - 2,84 (6H, м), 3,04 - 3,14 (2H, м), 4,08 - 4,42 (4H, м), 5,18 - 5,30 (1H, м), 5,30 - 5,44 (4H, м).
MC (FAB): 748 (M + H)+.
Пример синтеза-37: Синтез O-(2-диметиламиноэтил)- O'- (1,3-диолеоилоксипропил)метилфосфоната.
К 310 мг (0,50 мМ) 1,3-диолеоилглицерина, осушенного путем азеотропной дистилляции с использованием пиридина, добавляли 9,1 мл (1 мМ) 0,11 М раствора метил бис-O,O-(1-бензотриазолил)фосфоната в диоксане, после чего реакцию проводили при комнатной температуре в течение 3 часов. К этой реакционной смеси добавляли 446 мг (5 мМ) 2-диметиламиноэтанола и 411 мг (5 мМ) 1-метилимидазола, после чего реакцию проводили в течение ночи при комнатной температуре. Затем реакционную смесь обрабатывали смесью метиленхлорида и 5% раствора бифосфата натрия. Метиленхлоридный слой осушали сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (элюент: метиленхлорид/метанол) и получали 272 мг (59%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,86 (6H, т, J = 6 Гц), 1,25 (40H, шир.с.), 1,54 (3H, д, J = 20 Гц), 1,50 - 1,70 (4H, м), 2,32 (4H, т, J = 8 Гц), 2,35 (6H, с), 2,68 (2H, т, J = 6 Гц), 4,05 - 4,25 (4H, м), 4,25 - 4,35 (2H, м), 4,70 - 4,90 (1H, м), 5,25 - 5,40 (4H, м).
MC (FAB): 770 (M + H)+.
Пример синтеза-38: Синтез O-(2-аминоэтил)-O'- (1, 3-диолеилоксипропил)метилфосфоната.
Повторяли процедуру, описанную в примере синтеза-37, за исключением того, что вместо 2-диметиламиноэтанола использовали т-бутил N-(2-гидроксиэтил)карбамат, и полученное соединение обрабатывали трифторуксусной кислотой/метиленхлоридом (1:2), в результате чего получали целевое соединение.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 2,25 (40H, шир.с.), 1,50 - 1,90 (7H, м), 1,90 - 2,10 (8H, м), 2,34 (4H, т, J = 8 Гц), 3,30 - 3,40 (2H, с), 4,10 - 4,50 (6H, м), 4,75 - 4,90 (1H, м), 5,30 - 5,40 (4H, м).
MC (FAB): 742 (M + H)+.
Пример синтеза-39: Синтез O-(2-диэтиламиноэтил)-O'- (1,3-диолеоилоксипропил)метилфосфоната.
Повторяли процедуру, описанную в примере синтеза-37, за исключением того, что использовали 2-диэтиламиноэтанол, в результате чего получали 166 мг (70,7%) целевого соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,87 (6H, т, J = 6 Гц), 1, 01 (6H, т, J = 6 Гц), 1,26 (40H, шир.с.), 1,48 - 1,70 (7H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,57 (4H, кв., J = 6 Гц), 2,80 (2H, т, J = 6 Гц), 3,90 - 4,40 (6H, м), 4,70 - 4,90 (1H, м), 5,30 - 5,42 (4H, м).
MC (FAB): 798 (M + H)+.
Пример получения 1.
В сосуде, содержащем 200 мкл хлороформа, растворяли 5 мг соединения, полученного в примере синтеза-4, и 5 мг фосфатидилэтаноламина яичного желтка. Затем газообразный азот продували через раствор для удаления хлороформа, после чего на внутренней стенке сосуда оставалась тонкая пленка. Содержимое сосуда оставляли на ночь при пониженном давлении и после добавления 2 мл стерильной дистиллированной воды перемешивали в вихревом смесителе для отслаивания тонкой пленки. После продувки газообразным азотом сосуд герметично закрывали и оставляли на 3 часа при температуре 4oC. Затем с использованием ультразвукового аппарата осуществляли ультразвуковую обработку в течение 10 минут и получали липидную систему.
Пример получения 2.
С использованием соединения, полученного в примере синтеза-1, липидную систему продуцировали в соответствии с описанием, приведенным в примере получения 1.
Пример получения 3.
С использованием соединения, полученного в примере синтеза-7, продуцировали липидную систему в соответствии с описанием, приведенным в примере получения 1.
Пример получения 4.
В сосуде, содержащем 200 мкл хлороформа, растворяли 5 мг соединения, полученного в примере синтеза-20, и 5 мг фосфатидилэтаноламина яичного желтка. Затем газообразный азот продували через раствор для удаления хлороформа, после чего на внутренней стенке сосуда оставалась тонкая пленка. Содержимое сосуда оставляли на ночь при пониженном давлении и после добавления 2 мл стерильной дистиллированной воды перемешивали в вихревом смесителе для отслаивания тонкой пленки. Сосуд продували газообразным азотом, герметично закрывали и оставляли на 3 часа при температуре 4oC. Затем с использованием ультразвукового аппарата осуществляли ультразвуковую обработку в течение 10 минут, в результате чего получали липидную систему.
Пример получения 5.
С использованием соединения, полученного в примере синтеза-1, липидную систему продуцировали в соответствии с описанием, приведенным в примере получения 4.
Пример получения 6.
С использованием соединения, полученного в примере синтеза-4, липидную систему продуцировали в соответствии с описанием, приведенным в примере получения 4.
Пример получения 7.
С использованием соединения, полученного в примере синтеза-7, липидную систему продуцировали в соответствии с описанием, приведенным в примере получения 4.
Пример 1. Композиция инъецируемая, содержащая чередующийся сополимер адениловой кислоты и уридиловой кислоты.
К 60 мкл липидной системы, продуцированной в соответствии с описанием, приведенным в примере получения 4, добавляли 0,9 мл физиологического раствора, а затем добавляли 0,1 мл 100 мкг/мл физиологического раствора чередующегося сополимера адениловой кислоты и уридиловой кислоты [Поли(rA-rU)'Поли(rA-rU), S20, W = 4,70, изготовленного Pharmacia]; и смесь перемешивали, в результате чего получали инъецируемую композицию. Подобные инъецируемые композиции были получены с использованием липидных систем, продуцированных в соответствии с описанием, приведенным в примерах получения 1-3 и 5-7.
Пример 2. Инъецируемая композиция, содержащая чередующийся сополимер адениловой кислоты и уридиловой кислоты.
К 300 мкл Липофектина (торговая марка, Bethesda Laboratories) добавляли 0,9 мл физиологического раствора, а затем добавляли 0,1 мл 100 мкг/мл физиологического раствора чередующегося полимера и смесь перемешивали, в результате чего получали инъецируемую композицию.
Пример теста 1: Действие, ингибирующее рост клеток Helas 3 (in vitro).
96-луночный планшет засевали клетками Helas 3 при плотности клеток, составляющей 104 клеток/лунку (90 мкл). На следующий день в каждую лунку добавляли 10 мкл 30 мкг/мл липидной системы, содержащих различные концентрации чередующегося сополимера адениловой кислоты и уридиловой кислоты. Что касается композиции, содержащей Genetransfer (торговая марка, Wako Pure Chemical Industries), что в каждый сосуд с Genetransfer добавляли 1 мл 10 мМ фосфатного буфера (дополненного 0,9% хлоридом натрия), содержащего 20 мкг растворенного сополимера адениловой кислоты и уридиловой кислоты, и эту смесь разбавляли для предварительного определения концентраций чередующегося сополимера адениловой кислоты и уридиловой кислоты. Планшет инкубировали через 72 часа после добавления, а затем добавляли 10 мкл/лунку 5 мг/мл-раствор MTT (3-(4,5-диметилтиазол-2-ил)-2, 5-дифенилтетразол)-бромида. Через 2-4 часа реакцию прекращали путем добавления смеси изопропилового спирта/0,04 н. соляной кислоты. После перемешивания содержимого каждой лунки оптическую плотность при 540 нм измеряли с помощью (планшет)-ридера (изготовленного Corona) и оценивали процент ингибирования роста клеток Helas 3. Эту оценку проводили в соответствии с уравнением, представленным ниже. В качестве контроля принимали степень ингибирования клеточного роста одноцепочечного нуклеиновокислотного сополимера в присутствии липидного компонента.

Полученные результаты представлены в таблице 1.
Как видно из таблицы 1, совместное использование липидной системы и одноцепочечного нуклеиновокислотного сополимера [чередующийся сополимер адениловой кислоты и уридиловой кислоты], которые сами по себе не обладают ингибирующей активностью, приводит к ингибированию клеточного роста.
Пример теста 2: Индуцирование β-интерферона из клеток Helas 3.
В 96-луночный планшет засевали клетки Helas 3 (90 мкл) при клеточной плотности 104 клеток/лунку и на следующий день в каждую лунку добавляли 10 мкл 30 мкг/мл липидного компонента, содержащие различную концентрацию чередующегося сополимера адениловой кислоты и уридиловой кислоты. Планшет инкубировали в течение 24 часов после добавления и с использованием набора для ELISA-анализа (набор для анализа β-интерферона, изготовленный фирмой Toray Industries, Inc.) определяли интерферон в клеточной культуре. Полученные результаты представлены в таблице 2.
Реферат
Изобретение относится к области медицины и касается фармацевтической композиции, обладающей противоопухолевой активностью и являющейся индуктором интерферона, включающей липидный элемент, такой как Липофектин (торговая марка), 3-O-(4-диметиламинобутано)1,2 -O-диолеилглицерин, 3-O-(2-диметиламиноэтил)-карбамоил- 1,2-O-диолеилглицерин, 3-O-(2-диэтиламиноэтил)карбамоил- 1,2-O-диолеилглицерин или 2-O-(2-диэтиламиноэтил)карбамоил- 1,3-O-диолеоилглицерин, а также сополимер адениловой и уридиловой кислот. Композиция обладает повышенной активностью за счет совместного использования липидной системы и сополимеров одноцепочечных нуклеиновых кислот. 3 с. и 2 з.п.ф-лы, 2 табл.
Формула

где R1 и R2 различные и каждый из них представляет собой OY или -A-(CH2)n-E, где n является целым числом от 0 до 4, а E - пирролидино-, пиперидино-, замещенную или незамещенную пиперазино-, морфолино-, замещенную или незамещенную гуанидиногруппу либо

где R3 и R4, одинаковые или различные, каждый из них водород, низший (C1-C4)алкил, гидроксинизший (C1-C4)алкил или моно- или ди-(низший)алкил аминоалкил (C2-C8);
A представляет собой



где R и Y, одинаковые или различные, каждый из них представляет собой насыщенную или ненасыщенную алифатическую углеводородную группу из 10 - 30 атомов углерода или насыщенный или ненасыщенный остаток жирной кислоты, состоящий из 10 - 30 атомов углерода.

где R11 и R21, одинаковые или различные, и каждый из них представляет собой олеил или олеоил;
D - -CH2- или -NH-;
R30 и R40, одинаковые или различные, и каждый из них - метил или этил.

Комментарии