Производные глицерина, средство для доставки физиологически активного вещества и фармацевтическая композиция - RU2123492C1
Код документа: RU2123492C1
Чертежи

Описание
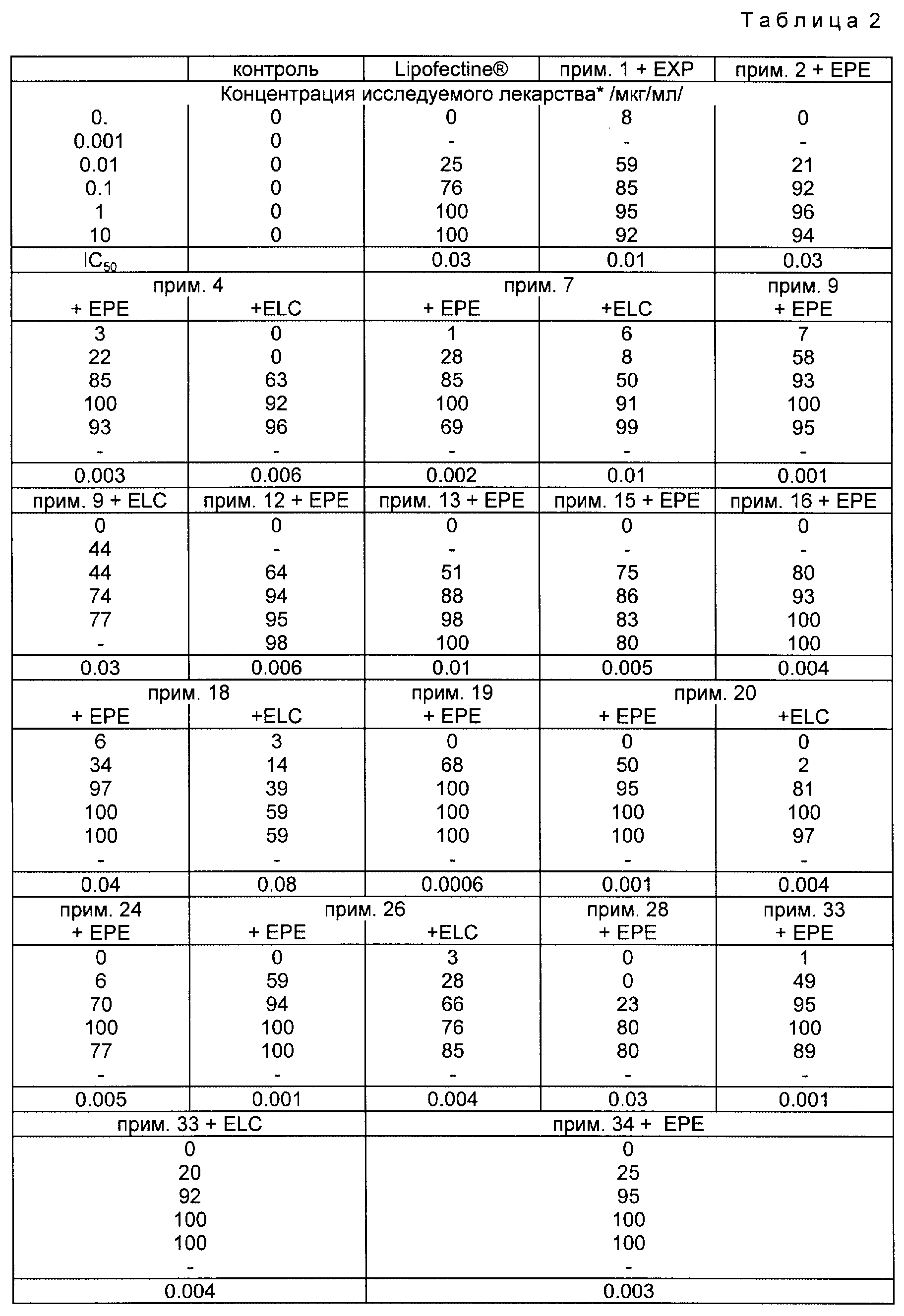
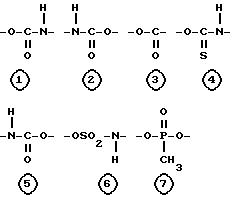
Настоящее изобретение относится к соединениям следующей общей формулы I
где
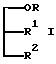
R1 и R2 не одинаковы и каждый представляет OY или -A-(CH2)n-E;
n представляет целое число от 0 до 4;
E представляет пирролидино, пиперидино, замещенный или незамещенный пиперазино, морфолино, замещенный или незамещенный гуанидино,
или
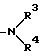
где
R3 и R4 - одинаковы или различны и каждый представляет водород, низший C1-C4-алкил, гидрокси-низший C1-C4-алкил, или моно- или ди(низший)алкиламино-алкил C2-C8.
A представляет собой следующие формулы
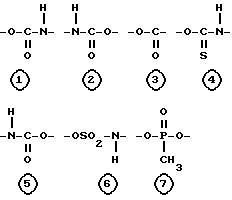
R и Y одинаковы или различны, и каждый представляет насыщенную или ненасыщенную алифатическую углеводородную группу из 10-30 атомов углерода, или насыщенный или ненасыщенный остаток жирной кислоты из 10-30 атомов углерода.
(Однако при этом исключаются соединения, в которых A представляет


Соединения настоящего изобретения (здесь и далее именуемые как соединения изобретения) имеют широкое применение в качестве компонента DDS (drug delivery System - система доставки лекарств) средства. Термин "средство" обозначает материал, функция которого состоит в транспортировке физиологически активного вещества, то есть носитель.
Известно, что средство, содержащее определенный положительно заряженный липид (например, катионная липосома) можно использовать для переноса генов в клетки (например, JP-A-4108391, W 091/17424). Известно также, что когда нуклеиновая кислота, как двухнитевая РНК вводится вместе с таким средством, как катионная липосома, происходит потенциирование индуктора интерферона (патент США 5049386). Обычно предполагают, что так как нуклеиновая кислота, например, гена, имеет отрицательный заряд, она образует комплекс с катионной липосомой, и комплекс сливается с клеточной мембраной и нуклеиновая кислота или ген, или что-либо подобное, находит свой путь в клетку.
Указанная катионная липосома, Lipofectin (торговая марка, Bethesda Research Laboratories Life Technologies Inc.), содержащая N-[1-/2,3-диолеилокси/пропил] -N, N,N-триметиламмонийхлорид (здесь и далее ДОТМА) и диолеилфосфатидилэтаноламин в соотношении 1:1 хорошо известны.
Однако так как ДОТМА как компонент Lipofectin является соединением четвертичного аммония, и, поэтому обладает высокой гемолитической токсичностью, он не годится для фармацевтического использования.
Была предпринята попытка повысить эффективность липосомы за счет замены ДОТМА в Lipofectin производным холестерина (Third International Symposium on Catalytic RNAs and Targeted Gene Therapy for the Theatment of HIV Infection, December 6-11, 1992).
Целью настоящего изобретения является создание липидного средства, которое функционально эквивалентно катионной липосоме и при этом менее токсично, а липид является компонентом средства.
В процессе интенсивных исследований авторы настоящего изобретения обнаружили, что вышеуказанную проблему можно решить, используя соединение настоящего изобретения вместо ДОТМА в Lipofectin, и осуществили настоящее изобретение.
Одна из существенных отличительных особенностей настоящего изобретения состоит в структуре соединения общей формулы (I). Соединение настоящего изобретения является новым соединением, которое не описано в литературе.
Соединение настоящего изобретения структурно характеризуется тем, что глицерин является основным скелетом, одна из трех гидроксильных групп глицерина замещена группой формулы -A-(CH2)n-E, где A, n и E имеют указанные ранее значения. Другой отличительной особенностью настоящего изобретения является то, что A в вышеуказанной формуле -A-(CH2)n-E имеет следующие значения:
Среди конкретных соединений настоящего изобретения ни одно из них не имеет амина в группе заместителя E в форме четвертичного аммония. В JP-A-4108391 указано, что липид, содержащий группу четвертичного аммония, подходит в качестве липидного составляющего липосомы или средства, но такие соединения не пригодны для целей настоящего изобретения.
Замещенные пиперидино для E включают 4-метилпиперазино, 4-этилпиперазино, 4-н-пропилпиперазино, 4-изопропилпиперазино, 4-н-бутилпиперазино, 4-изобутилпиперазино, 4-(2-гидроксиэтил)-пиперазино, 4-(2-гидроксипропил)пиперазино и 4-(3-гидроксипропил)пиперазино наряду с другими.
Замещенный гуанидино для E включает метилгуанидино, этилгуанидино, н-пропилгуанидино, N, N-диметилгуанидино, N,N-диэтилгуанидино, N, N-ди-н-пропилгуанидино, N,N'-диметилгуанидино, N,N'-диэтилгуанидино, N,N'-ди-н-пропилгуанидино, N, N,N'-триметилгуанидино, N,N,N'-триэтилгуанидино, N,N,N'-три-н-пропилгуанидино, N, N, N', N'-тетраметилгуанидино, N,N,N',N'-тетраэтилгуанидино и N,N,N',N'-тетра-н-пропилгуанидино наряду с другими.
Низший алкил для R3, R4 включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор.-бутил и трет-бутил наряду с другими.
Гидрокси/низший/алкил для R3, R4 включает гидроксиметил, 1-гидроксиэтил, 2-гидроксиэтил, 1-гидроксипропил, 2-гидроксипропил и 3-гидроксипропил наряду с другими.
Моно- или ди-(низший)алкиламиноалкил для R3, R4 включает метиламинометил, диметиламинометил, 2-(метиламино)этил, 2-диметиламиноэтил, 3-(метиламино)пропил, 3-диметиламинопропил, этиламинометил, диэтиламинометил, 2-(этиламино)этил, 2-диэтиламиноэтил, 3-(этиламино)пропил, 3-диэтиламинопропил, н-пропиламинометил, ди-н-пропиламинометил, 2-(н-пропиламино)-этил, 2-(ди-н-пропиламино)этил, 3-(н-пропиламино)пропил, и 3-(ди-н-пропиламино)пропил наряду с другими.
Что касается дальнейших отличий общей формулы (I), то R и Y одинаковы или различны, и каждый представляет насыщенную или ненасыщенную алифатическую углеводородную группу, содержащую от 10 до 30 атомов углерода, или остаток насыщенной или ненасыщенной жирной кислоты, содержащий от 10 до 30 атомов углерода, как было указано ранее.
Однако предпочтителен случай, когда R и Y одинаковы, и каждый представляет ненасыщенный алифатический углеводород или остаток ненасыщенной жирной кислоты, содержащие от 12 до 20 атомов углерода. Наиболее предпочтителен случай, когда оба, R и Y, представляют олеил или олеоил, например.
Предпочтительно, чтобы A представлял карбаматную или сложноэфирную связь.
Соединения настоящего изобретения нетоксичны или очень малотоксичны.
Соединение общей формулы (I) по способу настоящего изобретения можно получить, наряду с другими, следующими способами:
(1) Если R1 представляет
OY, а A представляет -O-C(=O)-NH-,
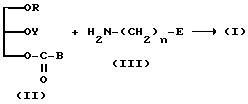
(где B обычно представляет имидазолил, галоид или фенокси. Галоид может быть, например, хлором, бромом или иодом. R, Y, E и n имеют указанные ранее значения).
Как представлено ранее на схеме, соединение настоящего изобретения (I) можно получить, осуществляя взаимодействие (II) с (III).
Эту реакцию (II) и (III) можно проводить, используя 1-3 эквивалента (III) на эквивалент (II) в присутствии растворителя при 0 - 150oC в течение 1-20 ч. В качестве растворителя в реакции можно использовать диметилформамид, пиридин, толуол, бензол, эфир, диоксан, тетрагидрофуран, хлороформ и т. д. Для ускорения реакции можно добавлять такое основание, как триэтиламин. Более того, можно вначале превратить (III) в соль металла, используя гидрид натрия, н-бутиллитий и т.п., в вышеуказанном растворителе, а затем подвергнуть ее взаимодействию с (II).
(2) Если R1 представляет OY, а A представляет -NH-C/=O/-O-,
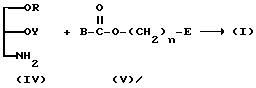
(где
B, R, Y, E и n имеют указанные ранее значения).
Соединение (I) настоящего изобретения можно получить, подвергая взаимодействию (IV) с (V) в соответствии с приведенной выше схемой, используя условия реакции, аналогичные указанным в пункте (I).
(3) Если R1 представляет OY, а A представляет -NH-C(=O)-O,
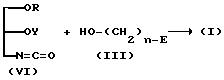
(где
R, Y, E и n имеют указанные ранее значения).
Соединение (I) настоящего изобретения можно получить при взаимодействии (VI) с (III) как показано на схеме ранее, используя условия реакции, аналогичные тем, которые указаны в пункте (1).
(4) Если
R1 представляет OY, а A представляет -O-C(=O)-NH-
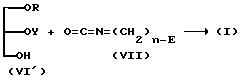
(где
R, Y, E и n имеют указанные ранее значения).
Соединение (I) настоящего изобретения можно получить, осуществляя взаимодействие (IV) с (VII), как представлено выше на схеме, используя условия реакции, аналогичные условиям, указанным в пункте (1).
(5) Если R1 представляет OY, а R2 представляет -A-(CH2)n-E
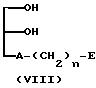
(где
A, E и n имеют указанные ранее значения).
Соединение (I) настоящего изобретения можно получить, превращая гидроксильные группы вышеуказанного соединения в группы заместителей R и Y за счет реакции с подходящими ацилирующими агентами (например, ангидридами или хлорангидридами жирных кислот). Этот способ получения предпочтителен, если R и Y представляют остатки жирных кислот.
(Получение исходных соединений (IV), (IV'), (V), (VI), (VII) и (VIII))
(1) Получение исходного
соединения (IV')
Исходное соединение (IV') можно получить обычно в соответствии со следующей схемой реакции:
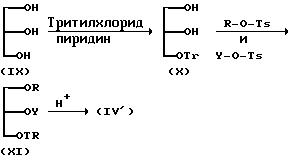
(где
Tr представляет тритил, Ts представляет тозил; R и Y имеют указанные ранее значения).
(2) Получение исходного соединения (IV)
Исходное соединение (IV) можно получить обычно следующим образом, который приведен в качестве примера.
Исходя из соединения (IV') можно получить соединение (IV) обычным способом, например азидированием, с последующим восстановлением.
(3) Получение исходного соединения (V)
Исходное соединение (V), в котором B представляет, например, имидазолил, можно
получить, подвергая взаимодействию соединение (III') с N,N'-карбонилдиимидазолом в пиридине при комнатной температуре.
(4) Получение исходного соединения (VI)
Исходное
соединение (VI) можно получить при взаимодействии соединения (IV) с дифосгеном.
(5) Получение исходного соединения (VII)
Исходное соединение (VII) можно легко получить обычной
реакцией соединения (III) с дифосгеном, либо при взаимодействии соединения формулы HOOC-(CH2)n-E (где n и E имеют указанные ранее значения) с DPPA (дифенилфосфорилазидом) в
присутствии такого третичного амина, как триэтиламин, при температуре от 0 до 150oC, и кроме того, в присутствии такого третичного амина как пиридин, при температуре от 0 до 150o
C.
(6) Получение исходного соединения (VIII)

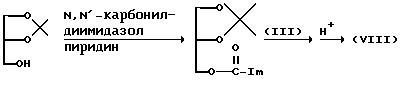
(где
Im представляет имидазолил).
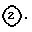

где
Im представляет имидазолил; E и n имеют указанные ранее значения).

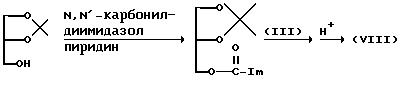
Соединение (VIII), где A представляет -O-C(=O)-, можно получить в соответствии со следующей схемой реакции:
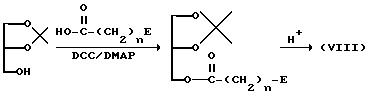
где
DCC представляет дициклогексилкарбодиимид, а DMAP представляет 4-N,N-диметиламинопиридин; E и n имеют указанные ранее значения).
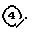
где
Im представляет имидазолил).

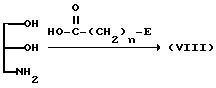
где
DCC представляет дициклогексилкарбодиимид; E и n имеют указанные ранее значения).

Соединение (VIII), где A представляет -OSO2-NH-, можно получить в соответствии со следующей схемой реакции:

где
E и n имеют указанные ранее значения).

Соединение (VIII), где A представляет -O-P(=O)(-CH3)-O-, можно получить в соответствии со следующей схемой реакции:
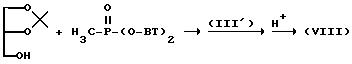
где
BT представляет 1-бензотриазолил.
Далее приводится частичный список соединений настоящего изобретения.
3-O-/2-диметиламиноэтил/карбамоил-1,2-O-дилаурилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1,2-O-димиристилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1,2-O-дипальмитилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1,2-O-дилинолеилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-2-O-лаурил-1-O- миристилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1-O-олеил-2-O- пальмитилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1-O-линолеил-2-O- олеилглицерин,
3-O-/диметиламинометил/карбамоил-1,2-O-диолеилглицерин,
3-O-/3-диметиламинопропил/карбамоил-1,2-O-диолеилглицерин,
3-O-/4-диметиламинобутил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-диэтиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-диэтиламинопропил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-ди-н-пропиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-диизопропиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-ди-н-бутиламиноэтил/карбамоил-1,
2-O-диолеилглицерин,
3-O-/2-диизобутиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-ди-втор.-бутиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-/N-этил-N-метиламино/этил/карбамоил-1,2-O- диолеилглицерин,
3-O-/2-метиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-этиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-н-пропиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-н-бутиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-аминоэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-/N-метил-N-/2-гидроксиэтил/амино/этил/карбамоил-1,2-O- диолеилглицерин,
3-O-/2-/N-этил-N-/2-гидроксиэтил/амино/этил/карбамоил-1,2-O- диолеилглицерин,
3-O-/2-/N,
N-ди-/2-гидроксиэтил/амино/этил/карбамоил-1,2-O- диолеилглицерин,
3-O-/2-/N-/2-диэтиламино/этил-N-метиламино/этил/карбамоил-1,2-O- диолеилглицерин,
3-O-/2-/4-метилпиперазино/этил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-морфолиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-пиперидиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-пирролидиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-диэтиламиноэтил/тиокарбамоил-1,2-O-диолеилглицерин,
3-O-/2-диметиламиноэтил/тиокарбамоил-1,2-0-диолеилглицерин,
3-O-/2-/N, N-ди-/2-гидроксиэтил/амино/этил/тиокарбамоил- 1,2-0-диолеилглицерин,
3-O-/2-пирролидиноэтил/тиокарбамоил-1,2-O-диолеилглицерин,
3-O-/2-диметиламиноэтил/сульфамоил-1,
2-O-диолеилглицерин,
3-O-/2-диэтиламиноэтил/сульфамоил-1,2-O-диолеилглицерин,
3-O-/2-N, N-ди-/2-гидроксиэтил/амино/этил/сульфамоил- 1,2-O-диолеилглицерин,
3-O-/2-пирролидиноэтил/сульфамоил-1,2-O-диолеилглицерин,
3-O-/N,N-диметиламиноацетил/-1,2-O-диолеилглицерин,
3-O-/4-диметиламинобутаноил/-1,2-O-дилаурилглицерин,
3-O-/4-диэтиламинобутаноил/-1,2-O-дипальмитилглицерин,
3-O-/4-диметиламинобутаноил/-1,2-O-диолеилглицерин,
3-O-/4-диэтиламинобутаноил/-1,2-O-диолеилглицерин,
3-O-/4-диметиламинобутаноил/-1,2-O-дилинолеилглицерин,
3-O-/4-диметиламинобутаноил/-1-O-олеил-2-O-пальмитилглицерин,
3-O-/4-диметиламинобутаноил/-1-O-линолеил-2-O-олеилглицерин,
3-O-/3-диметиламинопропионил/-1,2-O-диолеилглицерин,
3-O-/5-диметиламинопентаноил/-1,2-O-диолеилглицерин,
3-O-/4-ди-н-пропиламинобутаноил/-1,2-O-диолеилглицерин,
3-O-/4-диизопропиламинобутаноил/-1,2-O-диолеилглицерин,
3-O-/4-/N-этил-N-метиламино/бутаноил/-1,2-O-диолеилглицерин,
3-O-/4-этиламинобутаноил/-1,2-O-диолеилглицерин,
3-O-/4-/N-метил-N-/2-гидроксиэтил/амино/бутаноил/-1,2-O- диолеилглицерин,
3-O-/4-/N,N-ди-/2-гидроксиэтил/амино/бутаноил/-1,2-O- диолеилглицерин,
3-O-/4-/N-/2-диэтиламино/этил-N-метиламино/бутаноил/-1,2-O- диолеилглицерин,
3-O-/4-/4-метилпиперазино/бутаноил/-1,2-O-диолеилглицерин,
3-O-/4-морфолинобутаноил/-1,
2-O-диолеилглицерин,
3-O-/4-пирролидинобутаноил/-1,2-O-диолеилглицерин,
3-O-/4-пиперидинобутаноил/-1,2-O-диолеилглицерин,
O-/2-диэтиламиноэтил/-O'-/2,
3-диолеилоксипропил/метилфосфонат,
O-/2-диметиламиноэтил/-O'-/2,3-диолеилоксипропил/метилфосфонат,
O-/2-/N, N-ди/2-гидроксиэтил/амино/этил/-O'-/2,3- диолеилоксипропил/метилфосфонат,
O-/2-пирролидиноэтил/-O'-/2,3-диолеилоксипропил/метилфосфонат,
3-O-/2-диметиламиноэтил/карбамоил-1,2-O -дилауроилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1,
2-O-димиристоилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1,2-O-дипальмитоилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1,2-O-диолеоилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1,2-O-дилиноленилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1-O-олеоил-2-O- пальмитоилглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1-O-линоленил-2-O- олеоилглицерин,
3-O-/3-диметиламинопропил/карбамоил-1,2-O-диолеоилглицерин,
3-O-/2-диэтиламиноэтил/карбамоил-1,
2-O-диолеоилглицерин,
3-O-/2-ди-н-пропиламиноэтил/карбамоил-1,2-O-диолеоилглицерин,
3-O-/2-диизопропиламиноэтил/карбамоил-1,2-O-диолеоилглицерин,
3-O/2-/N-этил-N-метиламино/этил/карбамоил-1,2-O- диолеоилглицерин,
3-O-/2-этиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-/N-метил-N-/2-гидроксиэтил/амино/этил/карбамоил-1,
2-O- диолеоилглицерин,
3-O-/2-/N, N-ди-/2-гидроксиэтил/амино/этил/карбамоил-1,2-O- диолеоилглицерин,
3-O-/2-/N-/2-диэтиламино/этил-N-метиламино/этил/карбамоил-1,2-O- диолеоилглицерин,
3-O-/2-пиперидиноэтил/карбамоил-1,2-O -диолеоилглицерин,
3-O-/2-пирролидиноэтил/карбамоил-1,2-O-диолеоилглицерин,
3-O-/2-аминоэтил/карбамоил-1,2-O-диолеоилглицерин,
3-O-/2-диэтиламиноэтил/тиокарбамоил-1,2-O-диолеоилглицерин,
3-O-/2-диметиламиноэтил/тиокарбамоил-1,2-O-диолеоилглицерин,
3-O-/2-/-N, N-ди-/2-гидроксиэтил/амино/этил/тиокарбамоил- 1,
2-O-диолеоилглицерин,
3-O-/2-пирролидиноэтил/триокарбамоил-1,2-O- диолеоилглицерин,
3-O-/2-диэтиламиноэтил/сульфамоил-1,2-O-диолеоилглицерин,
3-O-/2-диметиламиноэтил/сульфамоил-1,2-O-диолеоилглицерин,
3-O-/2-N, N-ди-/2-гидроксиэтил/амино/этил/сульфамоил-1,2-O- диолеоилглицерин,
3-O-/2-пирролидиноэтил/сульфамоил-1,
2-O-диолеоилглицерин,
3-O-/4-диметиламинобутаноил/-1,2-O-дилауроилглицерин,
3-O-/4-диметиламинобутаноил/-1,2-O-димиристоилглицерин,
3-O-/4-диметиламинобутаноил/-1,
2-O-дипальмитоилглицерин,
3-O-/4-диметиламинобутаноил/-1,2-O-диолеоилглицерин,
3-O-/4-диметиламинобутаноил/-1,2-O-дилиноленилглицерин,
3-O-/4-диметиламинобутаноил/-1-O-олеоил-2-O-пальмитоилглицерин,
3-O-/4-диметиламинобутаноил/-1-O-линоленил-2-O-олеоилглицерин,
3-O-/3-диметиламинопропионил/-1,2-O-диолеоилглицерин,
3-O-/5-диметиламинопентаноил/-1,2-O-диолеоилглицерин,
3-O-/4-диэтиламинобутаноил/-1,2-O-диолеоилглицерин,
3-O-/4-ди-н-пропиламинобутаноил/-1,2-O-диолеоилглицерин,
3-O-/4-диизопропиламинобутаноил/-1,2-O-диолеоилглицерин,
3-O-/4-/N-этил-N-метиламино/бутаноил/-1,2-O-диолеоилглицерин,
3-O-/4-этиламинобутаноил/-1,2-O-диолеоилглицерин,
3-O-/4-/N-метил-N-/2-/гидроксиэтил/амино/бутаноил/- 1,2-O-диолеоилглицерин,
3-O-/4-/N,N-ди-/2-гидроксиэтил/амино/бутаноил/1,2-O- диолеоилглицерин,
3-O-/4-/N-/2-диэтиламино/этил-N-метиламино/бутаноил/- 1,2-O-диолеоилглицерин,
3-O-/4-пирролидинобутаноил/-1,2-диолеоилглицерин,
O-/2-диэтиламиноэтил/-O'-/2,
3-диолеоилоксипропил/-метилфосфонат,
O-/2-диметиламиноэтил/-O'-/2,3-диолеоилоксипропил/- метилфосфонат
O-/2-/N, N-ди-/2-гидроксиэтил/амино/этил/-O'-/2,
3- диолеоилоксипропил/метилфосфонат,
O-/2-пирролидиноэтил/-O'-/2,3-диолеоилоксипропил/метилфосфонат,
2-O-/2-диметиламиноэтил/карбамоил-1,3-O-дилаурилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1,3-O-димиристилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1,3-O-дипальмитилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1,3-O-дилинолеилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1-O-лаурил-3-O- миристилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1-O-олеил-3-O- пальмитилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1-O-линолеил-3-O- олеилглицерин
2-O-/3-диметиламинопропил/карбамоил-1,
3-O-диолеилглицерин,
2-O-/4-диметиламинобутил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-диэтиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-ди-н-пропиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-диизопропиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-ди-н-бутиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-диизобутиламиноэтил/-карбамоил-1,3-диолеилглицерин,
2-O-/2-ди-втор.-бутиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-/N-этил-N-метил/аминоэтил/карбамоил-1,
3-O- диолеилглицерин
2-O-/2-метиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-этиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-н-пропиламиноэтил/карбамоил-1,
3-O-диолеилглицерин,
2-O-/2-бутиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-аминоэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-/N-метил-N-/2-гидроксиэтил/амино/этил/карбамоил- 1,3-O-диолеилглицерин,
2-O-/2-/N-этил-N-/2-гидроксиэтил/амино/этил/карбамоил- 1,3-O-диолеилглицерин,
2-O-/2-/N,
N-ди-/2-гидроксиэтил/амино/этил/карбамоил-1,3- O-диолеилглицерин,
2-O-/2-/N-/2-диэтиламино/этил-N-метиламино/этил/карбамоил-1,3- O-диолеилглицерин,
2-O-/2-/4-метилпиперазино/этил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-морфолиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-пиперидиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-пирролидиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-диметиламиноэтил/тиокарбамоил-1,3-O-диолеилглицерин,
2-O-/2-диэтиламиноэтил/тиокарбамоил-1,3-O-диолеилглицерин,
2-O-/2-/N, N-ди-/2-гидроксиэтил/амино/этил/тиокарбамоил- 1,3-O-диолеилглицерин,
2-O-/2-пирролидиноэтил/тиокарбамоил-1,3-O-диолеилглицерин,
2-O-/2-диметиламиноэтил/сульфамоил-1,
3-O-диолеилглицерин,
2-O-/2-диэтиламиноэтил/сульфамоил-1,3-O-диолеилглицерин,
2-O-/2-/N, N-ди-/2-гидроксиэтил/амино/этил/сульфамоил- 1,3-O-диолеилглицерин,
2-O-/2-пирролидиноэтил/сульфамоил-1,3-O-диолеилглицерин,
2-O-/4-диметиламинобутаноил/-1,3-O-дилаурилглицерин,
2-O-/4-диэтиламинобутаноил/-1,3-O-дипальмитилглицерин,
2-O-/4-диметиламинобутаноил/-1,3-O-дилинолеилглицерин,
2-O-/4-диметиламинобутаноил/-1-O-олеил-3-O-пальмитилглицерин,
2-O-/4-диметиламинобутаноил/-1-O-линолеил-3-O-олеилглицерин,
2-O-/3-диметиламинобутаноил/-1,3-O-диолеилглицерин,
2-O-/5-диметиламинопентаноил/-1,3-O-диолеилглицерин,
2-O-/4-ди-н-пропиламинобутаноил/-1,3-O-диолеилглицерин,
2-O-/4-диизопропиламинобутаноил/-1,3-O-диолеилглицерин,
2-O-/4-/N-этил-N-метил/аминобутаноил/-1,3-O-диолеилглицерин,
2-O-/4-этиламинобутаноил/-1,3-O-диолеилглицерин,
2-O-/4-/N-метил-N-/2-гидроксиэтил/амино/бутаноил/-1,3-O-диолеилглицерин,
2-O-/4-/N,N-ди-/2-гидроксиэтил/амино-бутаноил/-1,3-O-диолеилглицерин,
2-O-/4-/N-/2-диэтиламино/этил-N-метиламино/бутаноил/- 1,3-O-диолеилглицерин,
2-O-/4-/4-метилпиперазино/бутаноил/-1,3-O-диолеилглицерин,
2-O-/4-морфолинобутаноил/-1,
3-O-диолеилглицерин,
2-O-/4-пирролидинобутаноил/-1,3-O-диолеилглицерин,
2-O-/4-пиперидинобутаноил/-1,3-O-диолеилглицерин,
O-/2-диэтиламиноэтил/-O'-/1-3-диолеилоксипропил/метилфосфонат,
O-/2-диметиламиноэтил/-O'-/1-3-диолеилоксипропан-2-ил/метилфосфонат,
O-/2-/N,
N-ди-/2-гидроксиэтил/амино/этил/-O'-/1-3- диолеилоксипропан-2-ил/метилфосфонат,
O-/2-пирролидиноэтил/-O'-/1-3-диолеилоксипропан-2-ил/метилфосфонат,
2-O-/2-диметиламиноэтил/карбамоил-1,3-O-дилауроилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1,3-O-димиристоилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1,3-O-дипальмитоилглицерин,
2-O-/2-диэтиламиноэтил/карбамоил-1,3-O-дипальмитоилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1,3-O-диолеилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1,
3-O-дилиноленилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1-O-олеоил-3-O-пальмитоилглицерин,
2-O-/2-диметиламиноэтил/карбамоил-1-O-линоленил-3-O-олеоилглицерин,
2-O-/диметиламинометил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/3-диметиламинопропил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-диэтиламиноэтил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-ди-н-пропиламиноэтил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-диизопропиламиноэтил/карбамоил-1,3-диолеоилглицерин,
2-O-/2-/N-этил-N-метиламино/этил/карбамоил-1,
3-O-диолеоилглицерин,
2-O-/2-/N-метил-N-н-бутиламино/этил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-этиламиноэтил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-/N,
N-ди-/2-гидроксиэтил/амино/этил/карбамоил-1,3-O- диолеоилглицерин,
2-O-/2-/N-метил-N-/2-гидроксиэтил/амино/этил/карбамоил-1,3-O- диолеоилглицерин,
2-O-/2-/N-этил-N-/2-гидроксиэтил/амино/этил/карбамоил-1,3-O- диолеоилглицерин,
2-O-/2-/N-/2-диэтиламино/этил-N-метиламино/этил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-/N, N, N',
N'-тетраметилгуанидино/этил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-морфолиноэтил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-пиперидиноэтил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-пирролидиноэтил/карбамоил-1,3-O-диолеоилглицерин,
2-O-/2-/4-этилпиперазино/этил/-карбамоил-1,3-диолеоилглицерин,
2-O-/2-/4-/2-гидроксиэтил/пиперазино/этил/-карбамоил-1,
3-O- диолеоилглицерин,
2-O-/2-диэтиламиноэтил/тиокарбамоил-1,3-O-диолеоилглицерин,
2-O-/2-диметиламиноэтил/тиокарбамоил-1,3-O-диолеоилглицерин,
2-O-/2-/N,
N-ди-/2-гидроксиэтил/амино/этил/тиокарбамоил-1,3-O- диолеоилглицерин,
2-O-/2-пирролидиноэтил/тиокарбамоил-1,3-O-диолеоилглицерин,
2-O-/2-диэтиламиноэтил/сульфамоил-1,
3-O-диолеоилглицерин,
2-O-/2-диметиламиноэтил/сульфамоил-1,3-O-диолеоилглицерин,
2-O-/2-N,N-ди-/2-гидроксиэтил/аминоэтил/сульфамоил-1,3-O- диолеоилглицерин,
2-O-/пирролидиноэтил/сульфамоил-1,3-O-диолеоилглицерин,
2-O-/3-диэтиламинопропионил/-1,3-O-диолеоилглицерин,
2-O-/4-диметиламинобутаноил/-1,3-O-дилауроилглицерин,
2-O-/4-диметиламинобутаноил/-1,3-O-димиристоилглицерин,
2-O-/4-диметиламинобутаноил/-1,3-O-дипальмитоилглицерин,
2-O-/4-диметиламинобутаноил/-1,3-O-диолеоилглицерин,
2-O-/4-диметиламинобутаноил/-1,3-O-дилиноленилглицерин,
2-O-/4-диметиламинобутаноил/-1-O-олеоил-3-O-пальмитоилглицерин,
2-O-/4-диметиламинобутаноил/-1-O-линоленил-3-O-олеоил-глицерин,
2-O-/3-диметиламинопропионил/-1,3-O-диолеоилглицерин,
2-O-/5-диметиламинопентаноил/-1,3-O-диолеоилглицерин,
2-O-/4-диэтиламинобутаноил/-1,3-O-диолеоилглицерин,
2-O-/4-ди-н-пропиламинобутаноил/-1,3-O-диолеоилглицерин,
2-O-/4-диизопропиламинобутаноил/-1,3-O-диолеоилглицерин,
2-O-/4-/N-этил-N-метиламино/бутаноил/-1,3-O-диолеоилглицерин,
2-O-/4-/этил/аминобутаноил/-1,3-O-диолеоилглицерин,
2-O-/4-/N-метил-N-/2-гидроксиэтил/амино/бутаноил/-1,3-O- диолеоилглицерин,
2-O-/4-/N,N-ди-/2-гидроксиэтил/амино/бутаноил/-1,
3-O- диолеоилглицерин,
2-O-/4-/N-/2-диэтиламино/этил-N-метиламино/бутаноил/- диолеоилглицерин 1,3-O-диолеоилглицерин,
2-O-/4-пирролидинобутаноил/-1,3-O-диолеилглицерин,
O-/2-диметиламиноэтил/-O'-/1,3-диолеоилоксипропан-2-ил/-метилфосфонат,
O-/2-аминоэтил/-O'-/1,3-диолеоилоксипропан-2-ил/метилфосфонат,
O-/2-диэтиламиноэтил/-O'-/1,
3-диолеоилоксипропан-2-ил/-метилфосфонат,
2-диметиламиноэтил-N-/2,3-дилаурилоксипропил/карбамат,
2-диметиламиноэтил-N-/2,3-димиристилоксипропил/карбамат,
2-диметиламиноэтил-N-/2,3-диолеоилоксипропил/карбамат,
2-диметиламиноэтил-N-/2,3-дилинолеилоксипропил/карбамат,
2-диметиламиноэтил-N-/2-лаурилокси-3-линолеилоксипропил/карбамат,
2-диметиламиноэтил-N-/3-миристилокси-2-олеилоксипропил/карбамат,
3-диметиламинопропил-N-/2,3-диолеилоксипропил/карбамат,
4-диметиламинобутил-N-/2,3-диолеилоксипропил/карбамат,
2-диэтиламиноэтил-N-/2,3-диолеилоксипропил/карбамат,
2-ди-н-пропиламиноэтил-N-/2,3-диолеилоксипропил/карбамат,
2-ди-н-бутиламиноэтил-N-/2,3-диолеилоксипропил/карбамат,
2-этилметиламиноэтил-N-/2,3-диолеилоксипропил/карбамат,
2-/N-этил-N-метиламино/этил-N-/2,3-диолеилоксипропил/карбамат,
2-этиламинобутил-N-/2,3-диолеилоксипропил/карбамат,
2-н-пропиламиноэтил-N-/2,3-диолеилоксипропил/карбамат,
2-/N-метил-N-/2-гидроксиэтил/амино/этил-N-/2,3-диолеилоксипропил/ карбамат,
2-/N-этил-N-/2-гидроксиэтил/амино/этил-N-/2,
3-диолеилоксипропил/ карбамат,
2-/N,N-ди-/2-гидроксиэтил/амино/этил-N-/2,3-диолеилоксипропил/ карбамат,
2-/N-/2-диэтиламино/-этил-N-метиламино/-этил-N-/2,
3-диолеилоксипропил/ карбамат,
2-/4-метилпиперидино/этил-N-/2,3-диолеилоксипропил/карбамат,
2-морфолиноэтил-N-/2,3-диолеилоксипропил/карбамат,
2-пиперидиноэтил-N-/2,
3-диолеилоксипропил/карбамат,
2-пирролидиноэтил-N-/2,3-диолеилоксипропил/карбамат,
2-диметиламиноэтил-N-/2,3-диолеилоксипропил/тиокарбамат,
2-диэтиламиноэтил-N-/2,
3-диолеилоксипропил/тиокарбамат,
2-/N, N-ди-/2-гидроксиэтил/амино/этил-N-/2,3-диолеилоксипропил/ тиокарбамат,
2-пирролидиноэтил-N-/2,3-диолеилоксипропил/тиокарбамат,
2-диметиламиноэтил-N-/2,3-диолеилоксипропил/сульфамат,
2-диэтиламиноэтил-N-/2,3-диолеилоксипропил/сульфамат,
2-/N,N-ди-/2-гидроксиэтил/амино/этил-N-/2,3-диолеилоксипропил/сульфамат,
2-пирролидиноэтил-N-/2,3-диолеилоксипропил/сульфамат,
N-/2,3-диолеилокси/пропил-4-диметиламинобутиламид,
N-/2,3-диолеилокси/пропил-4-диэтиламинобутиламид,
N-/2,
3-диолеилокси/пропил-4-/N,N,-ди-/2-гидроксиэтил/- амино/бутиламид,
N-/2,3-диолеилокси/пропил-4-пирролидинобутиламид,
2-диметиламиноэтил-N-/2,3-дилауроилоксипропил/карбамат,
2-диметиламиноэтил-N-/2,3-димиристоилоксипропил/карбамат,
2-диметиламиноэтил-N-/2,3-дипальмитоилоксипропил/карбамат,
2-диметиламиноэтил-N-/2,3-диолеоилоксипропил/карбамат,
2-диметиламиноэтил-N-/2,3-дилиноленилоксипропил/карбамат,
2-диметиламиноэтил-N-/2-олеоилокси-3-пальмитоилоксипропил/ карбамат,
2-диметиламиноэтил-N-/2-линоленилокси-3-олеоилоксипропил/ карбамат,
2-диэтиламиноэтил-N-/2,3-диолеоилоксипропил/карбамат,
3-диметиламинопропил-N-/2,3-диолеоилоксипропил/карбамат,
2-диизопропиламиноэтил-N-/2,3-деиолеоилоксипропил/карбамат,
2-ди-н-пропиламиноэтил-N-/2,3-диолеоилоксипропил/карбамат,
2-/N-этил-N-метиламино/этил-N-/2,
3-диолеоилоксипропил/карбамат,
2-этиламиноэтил-N-/2,3-диолеоилоксипропил/карбамат,
2-/-N-метил-N-/2-гидроксиэтил/амино/этил-N-/2,3-диолеоилоксипропил/ карбамат,
2-/N,
N-ди/2-гидроксиэтил/амино/этил-N-/2,3-диолеоилоксипропил/ карбамат,
2-/N-/2-диэтиламино/этил-N-метиламино-этил-N-/2,3- диолеоилоксипропил/карбамат,
2-пиперидиноэтил-N-/2,
3-диолеоилоксипропил/карбамат,
2-пирролидиноэтил-N-/2,3-диолеоилоксипропил/карбамат,
2-аминоэтил-N-/2,3-диолеоилоксипропил/карбамат,
2-диметиламиноэтил-N-/2,
3-диолеоилоксипропил/тиокарбамат,
2-диэтиламиноэтил-N-/2,3-диолеоилоксипропил/тиокарбамат,
2-/N, N-ди/2-гидроксиэтил/аминоэтил-N-/2,3-диолеоилоксипропил/ тиокарбамат,
2-пирролидиноэтил-N-/2,3-диолеоилоксипропил/тиокарбамат,
2-диметиламиноэтил-N-/2,3-диолеоилоксипропил/сульфамат,
2-диэтиламиноэтил-N-/2,3-диолеоилоксипропил/сульфамат,
2-/N,
N-ди/2-гидроксиэтил/аминоэтил-N-/2,3-диолеоилоксипропил/ сульфамат,
2-пирролидиноэтил-N-/2,3-диолеоилоксипропил/сульфамат,
N-/2,3-диолеоилокси/пропил-4-диметиламинобутиламид,
N-/2,3-диолеоилокси/пропил-4-диэтиламинобутиламид,
N-/2,3-диолеоилокси/пропил-4-/N,N-ди-/2-гидроксиэтил/-амино/ бутиламид,
N-/2,3-диолеоилокси/пропил-4-пирролидинобутиламид,
2-диметиламиноэтил-N-/1,3-дилаурилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1,3-димиристилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1,3-дилинолеилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1-лаурилокси-3-линолеилоксипропан-2- ил/карбамат,
2-диметиламиноэтил-N-/1-миристилокси-3-олеилоксипропан-2- ил/карбамат,
2-диметиламиноэтил-N-/1-олеилокси-3-пальмитилоксипропан-2- ил/карбамат,
3-диметиламинопропил-N-/1,
3-диолеилоксипропан-2-ил/карбамат,
4-диметиламинобутил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-диэтиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-ди-н-пропиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-ди-н-бутиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-/N-этил-N-метиламино/этил-N-/1,
3-диолеилоксипропан-2-ил/ карбамат,
2-метиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-этиламинобутил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-н-пропиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-н-бутиламино-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-N-метил-N-/2-гидроксиэтил/амино/этил-N-/1,3-диолеилоксипропан
-2-ил/карбамат,
2-N-этил-N-/2-гидроксиэтил/амино/этил-N-/1,3-диолеилоксипропан -2-ил/карбамат,
2-/N, N-ди-/2-гидроксиэтил/амино/этил-N-/1,3-диолеилоксипропан -2- ил/карбамат,
2-/N-/2-диэтиламино/этил-N-метиламино/этил-N-/1,3- диолеилоксипропан-2-ил/ карбамат,
2-/4-метилпиперидино/этил-N-/1,3-диолеилоксипропан-2-ил/- карбамат,
2-пиперидиноэтил-N-/1,
3-диолеилоксипропан-2-ил/карбамат,
2-пирролидиноэтил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/тиокарбамат,
2-диэтиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/тиокарбамат,
2-/N,N-ди-/2-гидроксиэтил/амино/этил-N-/1,3-диолеилоксипропан-2-ил/ тиокарбамат,
2-пирролидиноэтил-N-/1,
3-диолеилоксипропан-2-ил/тиокарбамат,
2-диметиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/сульфамат,
2-диэтиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/сульфамат,
2-/N,
N-ди-/2-гидроксиэтил, амино/этил-N-/1,3-диолеилоксипропан- 2-ил/сульфамат,
2-пирролидиноэтил-N-/1,3-диолеилоксипропан-2-ил/сульфамат,
N-/4-диметиламинобутаноил/-1,
3-диолеилокси-1-амино-пропан,
N-/4-диметиламинобутаноил/-1,3-диолеилокси-1-амино-пропан,
N-/4-/N, N-ди-/2-гидроксиэтил/амино/бутаноил/-1,3- диолеилокси-1-амино-пропан,
N-4-пирролидинобутаноил-1,3-диолеилокси-1-амино-пропан,
2-диэтиламиноэтил-N-/1,3-дилауроилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1,3-димиристоилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1,3-дипальмитоилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1,
3-дилиноленилоксипропан-2-ил/ карбамат,
2-диметиламиноэтил-N-/1-олеоилокси-3-пальмитоилоксипропан- 2-ил/карбамат,
2-диметиламиноэтил-N-/1-линоленилокси-3-олеоилоксипропан- 2-ил/карбамат,
2-диэтиламиноэтил-N-/1,3-диолеоилоксипропан-2-ил/карбамат,
3-диметиламинопропил-N-/1,
3-диолеоилоксипропан-2-ил/карбамат,
2-диизопропиламиноэтил-N-/1,3-диолеоилоксипропан-2-ил/- карбамат,
2-ди-н-пропиламиноэтил-N-/1,3-диолеоилоксипропан-2-ил/карбамат,
2-/N-этил-N-метиламино/этил-N-/1,3-диолеоилоксипропан- 2-ил/карбамат,
2-этиламиноэтил-N-/1,3-диолеоилоксипропан-2-ил/карбамат,
2-/N-метил-N-/-2-гидроксиэтил/амино/этил-N-/1,
3- диолеоилоксипропан-2-ил/карбамат,
2-/N, N-ди-/2-гидроксиэтил/амино/этил-N-/1,3-диолеоилоксипропан- 2-ил/карбамат,
2-/N-/2-диэтиламино/этил-N-метиламино/этил-N-/1,
3- диолеоилоксипропан-2-ил/карбамат,
2-пиперидиноэтил-N-/1,3-диолеоилоксипропан-2-ил/карбамат,
2-пирролидиноэтил-N-/1,3-диолеоилоксипропан-2-ил/карбамат,
2-аминоэтил-N-/1,
3-диолеоилоксипропан-2-ил/карбамат,
2-диметиламиноэтил-N-/1,3-диолеоилоксипропан-2-ил/ тиокарбамат,
2-диэтиламиноэтил-N-/1,3-диолеоилоксипропан-2-ил/ тиокарбамат,
2-/N,
N-ди-/2-гидроксиэтил/амино/этил-N-/1,3-диолеоилокси- пропан-2-ил/тиокарбамат,
2-пирролидиноэтил-N-/1,3-диолеоилоксипропан-2-ил/ тиокарбамат,
2-диметиламиноэтил-N-/1,
3-диолеоилоксипропан-2-ил/сульфамат,
2-диэтиламиноэтил-N-/1,3-диолеоилоксипропан-2-ил/сульфамат,
2-/N, N-ди-/2-гидроксиэтил/амино/этил-N-/1,3-диолеоилоксипропан- 2-ил/сульфамат,
2-пирролидиноэтил-N-/1,3-диолеоилоксипропан-2-ил/сульфамат,
N-/2,3-диолеоилокси/пропил-4-диметиламинобутиламид,
N-/2,3-диолеоилокси/пропил-4-диэтиламинобутиламид,
N-/2,
3-диолеоилоксид/пропил-4-/N,N-ди-/2-гидроксиэтил/- амино/-бутиламид/
N-/2,3-диолеоилокси/пропил-4-пирролидинобутиламид.
Среди соединений настоящего изобратения
предпочтительными являются:
3-O-/4-диметиламинобутаноил/-1,2-O-диолеоилоглицерин,
3-O-/2-диметиламиноэтил/карбамоил-1,2-O-диолеилглицерин,
3-O-/2-диэтиламиноэтил/карбамоил-1,
2-O-диолеилглицерин,
2-O-/2-диэтиламиноэтил/карбамоил-1,3-O-диолеоилглицерин и т.д.
Наиболее предпочтителен 3-O-/2-диэтиламиноэтил/карбамоил- 1,2-O-диолеоилглицерин.
Другим еще одним объектом изобретения является средство, содержащее соединения (I) настоящего изобретения и фосфолипид, и имеющее функцию DDS.
Липидсодержащее средство, обладающее функцией DDS, липосомы и жировые эмульсии известны. Средство же, обладающее функцией DDS по способу настоящего изобретения (здесь и далее именуемое как средство настоящего изобретения), принадлежит к категории таких средств.
Средство настоящего изобретения может иметь различные формы, такие как липидная суспензия, липосома и т.д., только если оно обладает способностью транспортировать физиологически активное вещество в клетку.
Фосфолипид, как компонент средства настоящего изобретения, может, например, быть фосфатидилэтаноламином или фосфатидилхолином.
Отношение соединения настоящего изобретения к фосфолипиду в средстве настоящего изобретения составляет примерно 0,1:9,9-9,9-0,1 (соединение настоящего изобретения: фосфолипид (молярное соотношение), предпочтительно 1:9 - (9: 1) (соединение настоящего изобретения: фосфолипид/молярное соотношение)), а наиболее предпочтительно: 1:3 - 3:1 (соединение настоящего изобретения: фосфолипид (молярное соотношение)).
Средство настоящего изобретения можно получить, например, следующим способом.
Средство настоящего изобретения можно получить, просто смешивая соединение настоящего изобретения с фосфолипидом в присутствии воды. Его можно получить способом, который включает растворение соединения настоящего изобретения и фосфолипида в хлороформе, тщательное удаление хлороформа в атмосфере газообразного азота, перемешивание смеси с добавлением воды и обработку ультразвуковом в течение нескольких минут.
Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая средство настоящего изобретения и физиологически активное вещество.
Как было указано ранее, даже если вещество демонстрирует высокую внеклеточную физиологическую активность, нельзя ожидать полностью такой же активности, если его способность проникать в клетку низка, что требует увеличения дозы. При современном состоянии знаний по этой причине многие из потенциально пригодных лекарств нельзя использовать в клиниках. Это не только большая потеря для промышленности, но, к сожалению, и потеря с точки зрения сохранения здоровья нации.
Однако, если их вводить вместе со средством настоящего изобретения, даже физиологически активные вещества со слабой способностью проникать в клетки могут проникать в клетки с заметной легкостью, и демонстрировать свою активность достаточно эффективно. Это означает возможность вернуться к использованию полезных лекарств, которые до сих пор оставались неразбавленными.
Поэтому фармацевтические композиции, полученные по способу настоящего изобретения (здесь и далее именуемые композициями настоящего изобретения) могут быть широко использованы как в промышленности, так и в плане сохранения здоровья нации.
Средство настоящего изобретения можно применять с физиологически активными веществами, которые эффективны с точки зрения проникновения внутрь клеток. Даже если физиологически активное вещество с хорошей внутриклеточной проникаемостью вводят вместе со средством настоящего изобретения, реализуется дальнейшее повышение проникновения в клетку и, следовательно, его дозу можно снизить, и устранить, тем самым, риск возникновения побочных эффектов.
Физиологически активные вещества, которые можно использовать со средством настоящего изобретения, включают водорастворимые анионные соединения, противоопухолевые агенты, противовирусные агенты и антибиотики, наряду с другими. Более конкретно, это могут быть такие соединения нуклеиновых кислот, как двухнитевые РНК и двухнитевые или трехнитевые антисмысловые нуклеиновые кислоты, такие кислотные сахариды, как гепаринсульфат и декстрансульфат, цитокинины, такие вторичные мессенджеры как циклические AMP, ATP и IP3, пенициллины и цефалоспорины, такие витамины, как витамин C и ретинолы, другие известные содержащие кислотные группы лекарства, интерфероны (α,β,γ), , интерлейкины (IL-1, IL-2), колонии-стимулирующие факторы (CSF), фактор некроза опухоли (TSF), левамизол, бестатин, ретиноевая кислота, 5-фтороурацил (5-FU), цитозинарабинозид (Ara-C), аденинарабинозид (Ara-A), цисплатин (CDDP), циклофосфамид и азидотимидин (AZT), наряду с другими.
Двухнитевые РНК включают (но не ограничиваются ими) следующие соединения:
(1) Комплексы гомополимер-гомополимер
1. Основно-модифицированные
Полиинозиновая кислота
- полицитидиловая кислота
Полиинозиновая кислота-поли/5-бромцитидиловая кислота).
Полиинозиновая кислота-поли/2-тиоцитидиловая кислота/.
Поли/7-деазаинозиновая кислота/-полицитидиловая кислота.
Поли/7-деазаинозиновая кислота-поли/5-бромцитидиловая кислота).
2. Рибозо-модифицированные
Поли/2'-азидоинозиновая
кислота-полицитидиловая кислота
3. Фосфат-модифицированные
Полиинозиновая кислота-поли/цитидин-5'-тиофосфат/.
Комплексы гомополимер-сополимер
Полиинозиновая
кислота-поли(цитидиловая кислота-уридиловая кислота).
Полиинозиновая кислота-поли(цитидиловая кислота-4-тиоуридиловая кислота).
(3) Комплексы синтетическая нуклеиновая
кислота-поликатион
Полиинозиновая кислота-полицитидиловая кислота-поли-L-лизин.
(4) Остальные
Полиинозиновая кислота-поли(1-винилцитидиловая кислота).
Антисмысловые нуклеиновые кислоты включают (но этим не ограничиваются) природные нуклеиновые кислоты и их производные такие, как нуклеиновые кислоты, содержащие метилфосфонатную фосфоротиоатную или фосфородитиоатную группу в качестве внутренней связи, и их производные.
Весовое соотношение средства настоящего изобретения и физиологически активного вещества составляет предпочтительно 1:0,1 - 1:10 (средство изобретения: физиологически активное вещество).
Композицию настоящего изобретения можно получить, добавляя физиологически активное вещество к средству настоящего изобретения и перемешивая полученную смесь подходящим способом. Композицию можно также получить, добавляя физиологически активное вещество в процессе получения средства настоящего изобретения.
Композицию настоящего изобретения, предпочтительно, вводят в единичной дозированной форме, и ее можно применять для животных, включая человека, за счет внутривенного, внутриартериального, перорального, внутритканевого, локального (например, трансдермально) или ректального способа введения. Наиболее предпочтительны внутривенное, внутриартериальное и локальное введение. Естественно, что композиция вводят в дозовых формах, подходящих для соответствующего способа введения, например, в виде инъекций, глазных капель, мазей, суппозиториев и т.д.
Хотя дозы композиций настоящего изобретения как лекарства, предпочтительно, определяют с учетом типа активного ингредиента, дозовой формы, таких особенностей пациента, как возраст и вес, способа введения, природы и серьезности заболевания и т.д., обычная доза для взрослых составляет 0,1 мг - 10 г /день/ человек, предпочтительно 1 мг - 500 мг /день/ человек в расчете на активный ингредиент. В некоторых случаях могут оказаться достаточными более низкие дозы, тогда как в других случаях необходимы более высокие дозы. Эти дозы можно вводить в виде нескольких разделенных доз или с интервалами в несколько дней.
Нижеследующие примеры предназначены для более длительного раскрытия изобретения.
Сравнительный пример 1.
Получение 1,
2-O-диолеилглицерина
(1) В 50 мл пиридина растворяют 4,6 г (50 ммоль) глицерина с последующим добавлением 13,9 г (50 ммоль) тритилхлорида, и полученную смесь перемешивают при комнатной
температуре в течение ночи. Затем реакционную смесь концентрируют при пониженном давлении, а остаток разбавляют водой и экстрагируют эфиром. Органический слой промывают водой, сушат над сульфатом
магния и концентрируют. Остаток очищают с помощью хроматографической колонки (силикагель/хлороформ-метанол) до получения 9,5 г (59%) 1-O-тритилглицерина.
(2) В 120 мл ксилола растворяют 3,22 г (10 ммоль) 1-O-тритилглицерина, затем добавляют 3,36 г (30 ммоль) трет-бутоксикалия в атмосфере аргона. После 5 мин перемешивания прикапывают 30 мл раствора 12,8 г (30 ммоль) олеилпаратолуолсульфоната в кислоте, и полученную смесь перемешивают при пониженном давлении (20-30 мм рт. ст.) при комнатной температуре в течение 30 мин, а затем при 50oC в течение 1 ч. Затем реакционную смесь выливают в смесь льда и воды, экстрагируют эфиром и полученный экстракт промывают водой, сушат и концентрируют. Остаток очищают на хроматографической колонке (силикагель/н-гексан-этилацетат) до получения 6,10 г (73%) 1,2-O-диолеил-3-O-тритилглицерина.
(2) 1,2-O-диолеил-3-O-тритилглицерин (6,10 г, 7,3 ммоль) подвергают взаимодействию с 5% трихлоруксусной кислотой/метиленхлоридом (50 мл/вес/объем/ при комнатной температуре в течение 1 ч. Затем органический слой промывают насыщенным водным раствором бикарбоната натрия и водой, сушат и концентрируют. Остаток очищают на хроматографической колонке (силикагель/хлороформ) до получения 3,75 г (87%) указанного в заглавии соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц, CH3х2), 1,14-1,44 (44H, м, CH3х2), 1,48-1,68 (4H, м, OCH2CH2х2), 1,90-2,10 (8H, м, CH= CHCH2х4), 3,38-3, 78 (9H, м, OCH2х4 и OCH), 5,26-5,45 (4H, м, CH=CHх2).
Масс-спектр с бомбардировкой быстрыми электронами: 593(M+H)+.
Сравнительный пример 2:
Получение 2,3-диолеилоксипропиламина
(1) К смеси 1,00 г (1,7 ммоль) 1,2-O-диолеилглицерина, 0,83 г (17 ммоль) азида лития, 0,89 г (3,4 ммоль) трифенилфосфина и 1,13 г (3,4 ммоль)
четырехбромистого углерода добавляют 10 мл N,N-диметилформамида в шарике, и полученную смесь перемешивают при комнатной температуре в течение 3 ч. После завершения реакции растворитель отгоняют, а
остаток разбавляют водой и экстрагируют эфиром. Эфирный слой промывают водой, сушат и концентрируют, а полученный остаток очищают на хроматографической колонке (силикагель/н-гексан-этилацетат) до
получения 1,03 г (100%) 2,3-диолеилоксипропилазида в виде масла.
ИК (чистый) см-1: 2920, 2850, 2100.
(2) В 30 мл тетрагидрофурана суспендируют 75 мл (2 ммоль) литийалюминийгидрида. Поддерживая эту суспензию при охлаждении льдом, прикапывают 1,03 г (1,7 ммоль) 2,3-диолеилоксипропилазида, и полученную смесь перемешивают в течение 30 мин. Затем полученную смесь перемешивают при комнатной температуре еще 2 ч. После завершения реакции реакционную смесь выливают в ледяную воду и экстрагируют эфиром, а полученный экстракт промывают водой, сушат и концентрируют. Остаток обрабатывают на хроматографической колонке (силикагель/метиленхлорид-метанол) до получения 0,98 г (98%) указанного в заглавии соединения в виде бесцветного масла.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88/6H, т, J = 6 Гц, CH3х2), 1,17-1,45 (44H, м, CH2х22), 1,48-1,70 (4H, м, OCH2CHх2), 1,90-2,14 (8H,
м, CH=CHCH2х4), 2,64-2,91 (2H, м, NCH2), 3,30-3,78 (9H, м, OCH2х3 и OCH), 5,25-5,46 (4H, м, CH=CHх2)
Масс-спектр с бомбардировкой быстрыми электронами: 592
(M+H)+.
Сравнительный пример 3:
Получение 1,3-O-диолеилглицерина
(1) В пиридине растворяют 1,00 г (11 молей) глицерина и 2,96 г /43 ммоль имидазола, и
осуществляют азеотропную перегонку. Полученный остаток растворяют в 15 мл N, N-диметилформамида. К этому раствору при охлаждении льдом добавляют 3,60 г (24 ммоль) трибутилдиметилсилилхлорида, и
полученную смесь перемешивают при комнатной температуре в течение 5 ч. После завершения реакции растворитель отгоняют, а остаток разбавляют метиленхлоридом и промывают насыщенным водным раствором
бикарбоната натрия. Его сушат и концентрируют до получения 3,45 г (99%) 1,3-O-ди/трет-бутилдиметилсилил/глицерина.
(2) В диоксане растворяют 3,45 г (11 ммоль) 1, 3-O-ди/трет-бутилдиметилсилил/глицерина с последующим добавлением 3,03 г /12 ммоль пиридиний-пара-толуолсульфоната. К этой суспензии добавляют 16,5 мл (22 ммоль) дигидрофурана, постепенно при охлаждении льдом, и полученную смесь перемешивают в течение 1 ч. После нагревания до комнатной температуры смесь оставляют реагировать в течение ночи. После завершения реакции растворитель отгоняют, а остаток обрабатывают метиленхлоридом и насыщенным водным раствором бикарбоната натрия. Метиленхлоридный слой промывают водой, сушат и концентрируют до получения 4,25 г (100%) 1, 3-O-ди/трет-бутилдиметилсилил/2-O-тетрагидрофуранилглицерина.
(3) К раствору 4,25 г (11 ммоль) 1,3-O-ди/трет-бутил-диметилсилил/2-O-тетрагидрофуранилглицерина в 30 мл тетрагидрофурана добавляют 30 мл тетра-н-бутиламмонийфторида (1 моль/л в ТГФ) по каплям, и полученную смесь перемешивают при комнатной температуре в течение 2 ч. Затем реакционную смесь концентрируют, а остаток обрабатывают на хроматографический колонке /силикагель/метиленхлорид-метанол/ до получения 1,70 г (96%) 2-O-тетрагидрофуранилглицерина.
(4) В 30 мл ксилола растворяют 854 мг (5,3 ммоль) 2-O-тетрагидрофуранилглицерина. К этому добавляют 1,78 г (15,9 ммоль) трет-бутоксикалия в атмосфере аргона, и полученную смесь перемешивают 5 мин. Затем прикапывают 10 мл раствора 6,71 г (15,9 ммоль) олеилпара-толуолсульфоната в ксилоле, и полученную смесь перемешивают при пониженном давлении (20-30 мм рт.ст.) при комнатной температуре в течение 30 мин, и еще 1 ч при 50oC. Реакционную смесь выливают в смесь льда и воды, экстрагируют эфиром, и полученный экстракт промывают водой, сушат и концентрируют. Остаток очищают на хроматографической колонке (силикагель/хлороформ) до получения 628 мг (18%) 1,3-O-диолеил-2-O-тетрагидрофуранилглицерина в виде масла желтого цвета.
(5) В 30 мл тетрагидрофурана растворяют 628 мг (0,95 ммоль) 1, 3-O-диолеил-2-O-тетрагидрофуранилглицерина, а затем добавляют 5 мл разбавленной (10%) соляной кислоты, и полученную смесь перемешивают в течение ночи. Затем реакционную смесь разбавляют водой, нейтрализуют насыщенным водным раствором бикарбоната натрия и экстрагируют эфиром. Полученный экстракт сушат и концентрируют, а остаток обрабатывают на хроматографической колонке (силикагель/н-гексан-этилацетат) до получения 321 мл (57%) указанного в заглавии соединения в виде бесцветного масла.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88/6H, т, J = 6 Гц, CH3х2), 1,14-1,26 (44H, м, CH2х22), 1,49-1,68 (4H, м, OCH2CH2х2), 1,98-2,13 (8H, м, CH=CHCH2х>4), 3,37-3,56 (8H, м, OCH2х4), 3,95 (1H, шир. с., OC H), 5,27-5,46 (4H, м, CH= CHх2).
Масс-спектр с бомбардировкой быстрыми электронами 593 (M+H)+.
Сравнительный пример 4:
Получение 1,3-диолеилокси-2-пропиламина
(1) В 5 мл пиридина растворяют 150 мг (0,25 ммоль) 1,3-O-диолеилглицерина с последующим добавлением 77 мг (0,40 ммоль)
пара-толуолсульфонилхлорида, и полученную смесь нагревают при 60oC, и перемешивают в течение 2 дней. После завершения реакции растворитель отгоняют, а остаток разбавляют водой и
экстрагируют эфиром. Полученный экстракт сушат и концентрируют до получения 150 мг (80%) 1,3-O-диолеил-2-O-(пара-толуолсульфонил)глицерина в виде масла желтого цвета.
(2) Смесь 150 мг (80%) полученного 1,3-O-диолеил-2-O-(пара-толуолсульфонил)глицерина, 30 мг (0,6 ммоль) азида лития и 5 мл N,N-диметилформамида перемешивают при 100oC в течение 2 ч. После охлаждения растворитель отгоняют, а остаток разбавляют водой и экстрагируют эфиром. Полученный экстракт промывают водой и концентрируют до получения 125 мг (99%) 1,3-диолеил-окси-2-пропилазида в виде масла светло-коричневого цвета.
(3) В 3 мл тетрагидрофурана суспендируют 8 мг (0,2 ммоль) литийалюминийгидрида. При охлаждении этой суспензии льдом к ней прикапывают 125 мг (0,2 ммоль) 1, 3-диолеилокси-2-пропилазида, и полученную смесь перемешивают при 0oC в течение 2 ч. Затем реакционную смесь выливают в смесь льда и воды и экстрагируют эфиром. Полученный экстракт промывают водой, сушат и концентрируют. Остаток обрабатывают на хроматографической колонке (силикагель/метиленхлорид-метанол) до получения 104 мг (89%) указанного в заглавии соединения в виде бесцветного масла.
Сравнительный пример 5:
Получение 1,2-O-диолеоилглицерина
(1) В пиридине растворяют 1 г (0,011 молей) глицерина и осуществляют азеотропную перегонку. Остаток
растворяют в 30 мл пиридина, затем добавляют 4,05 г (0,012 молей) диметокситритилхлорида при охлаждении льдом. Затем полученную смесь перемешивают в течение ночи при комнатной температуре. После
завершения реакции добавляют 5 мл метанола, и полученную смесь перемешивают в течение 30 мин, к концу этого времени растворитель отгоняют. К остатку добавляют метиленхлорид, и полученную смесь
промывают насыщенным водным раствором бикарбоната натрия, сушат и концентрируют. Остаток обрабатывают на хроматографической колонке (силикагель/метиленхлорид-метанол, 0,1% пиридин) до получения 2,58 г
(60,2%) 1-O-диметокситритилглицерина.
(2) Полученный таким образом 1-O-диметокситритилглицерин, 290 мг (0,735 ммоль) азеотропно перегоняют с пиридином, и остаток растворяют в 5 мл пиридина. Затем при охлаждении льдом добавляют 669 мг (2,223 ммоль) олеоилхлорида, и реакцию ведут при 50oC в течение 6 ч. После завершения реакции растворитель отгоняют при пониженном давлении, а остаток разбавляют метиленхлоридом, промывают насыщенным водным раствором бикарбоната натрия, сушат и концентрируют. Остаток обрабатывают на хроматографической колонке (силикагель/н-гексан-метиленхлорид/ до получения 519 мг (76,5%) 1-O-диметокситритил-2,3-O-диолеилглицерина.
1H-ЯМР (60 МГц, CDCl3) δ: 0,88 (6H, м), 1,27 (40H, шир.с.), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 3,10-3,30 (2H, м), 3,79 (6H, с), 4,20-4,20 (2H, м), 5,10-5,50 (5H, м), 6,70-7,40 (13H, м).
(3) Полученный 1-O-диметокситритил-2, 3-O-диолеилглицерин, 218 мг (0,236 ммоль) растворяют в 10 мл 5% муравьиной кислоте-метиленхлориде, и реакцию ведут в течение 10 мин. Реакционную смесь затем нейтрализуют насыщенным водным раствором бикарбоната натрия, и органический слой промывают далее насыщенным водным раствором бикарбоната натрия, сушат и концентрируют. Остаток обрабатывают на хроматографической колонке (силикагель/н-гексан-метиленхлорид-метанол) до получения 100 мг (68,0%) указанного в заглавии соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т), J = 6,0 Гц), 1,28 (40H, шир.с. ), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,28-2,40 (2H, м), 3,72 (2H, д, J = 6 Гц), 4,10-4,40 (2H, м), 5,00-5,12 (1H, м), 5,30-5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 621 (M+H)+.
Сравнительный пример 6:
Получение 1,3-O-диолеоилглицерина
(1) В 60 мл пиридина растворяют 2,75 г (0,013
моля) 2-O-/третбутилдиметилсилил/глицерина, затем добавляют 8,82 г (0,028 моля) олеоилхлорида при охлаждении льдом. Реакцию ведут при 50oC в течение 15 ч. После завершения реакции
растворитель отгоняют, а остаток разбавляют метиленхлоридом, промывают насыщенным водным раствором бикарбоната натрия, сушат и концентрируют. В результате получают 1,
3-O-диолеоил-2-O-/трет-бутилдиметилсилил/глицерин.
(2) К 1,3-O-диолеоил-2-O-(трет-бутилдиметилсилил/глицерину добавляют 266 мл 0,1M тетра-н-бутиламмонийфторид-тетрагидрофурана, и реакцию ведут при комнатной температуре в течение 30 мин. После завершения реакции растворитель отгоняют при пониженном давлении, а остаток разбавляют метиленхлоридом, промывают водой, сушат и концентрируют. Остаток обрабатывают на хроматографической колонке (силикагель/этилацетат-н-гексан) до получения 3,97 г (48,0% в расчете на 2-O-трет-бутилдиметилсилилглицерин) указанного в заглавии соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40 H, шир. с.), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,34 (4H, т, J = 8 Гц), 4,10-4, 22 (5H, м), 5,30-5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 621 (M+H)+.
Сравнительный пример 7:
Получение 1,
3-O-диолеоил-2-O-/2-бромэтил/карбамоилглицерина
(1) В пиридине растворяют 230 мг (0,37 ммоль) 1,3-O-диолеоилглицерина, и полученный раствор азеотропно перегоняют. Остаток растворяют в 5 мл
пиридина и после добавления 120 мг (0,740 ммоль) N,N'-карбонилдиимидазола полученную смесь перемешивают при комнатной температуре в течение 3 ч. Затем растворитель отгоняют при пониженном давлении, а
остаток растворяют в метиленхлориде, промывают 5% первичного кислого фосфата натрия в воде, сушат и концентрируют. Остаток растворяют в 10 мл N,N'-диметилформамида и после добавления 45 мг (0,737
ммоль) 2-аминоэтанола полученную смесь перемешивают при комнатной температуре в течение ночи. После завершения реакции растворитель отгоняют, а остаток растворяют в метиленхлориде, промывают 5%
раствором первичного кислого фосфата натрия в воде, сушат и концентрируют. Остаток обрабатывают хроматографически (силикагель/метиленхлорид-метанол) до получения 204 мг (79,5%) 1,
3-O-диолеоил-2-O-(2-гидроксиэтил)-карбамоилглицерина.
1H-ЯМР (200 МГц, CDCL3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир. с.), 1,50-1,80 (4H, м), 1,90-2,10 (8H, м), 2,34 (4H, т, J = 8 Гц), 3,28-3,40 (2H, м), 3,64-3,80 (2H, м), 4,20-4,40 (4H, м), 5,06-5,20 (2H, м), 5,30-5,50 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 690
(M-OH)+
(2) К смеси 160 мг (0,226 ммоль) 1,3-O-диолеоил-2-О-(2-гидроксиэтил)карбамоилглицерина, 150 мл (0,452 ммоль) четыреххлористого углерода и 120 мг (0,458 ммоль)
трифенилфосфина добавляют 10 мл N,N-диметилформамида в шарике, и полученную смесь перемешивают при комнатной температуре в течение 2 ч. После завершения реакции растворитель отгоняют, а остаток
растворяют в метиленхлориде, промывают водой, сушат и концентрируют. Полученный остаток обрабатывают на хроматографической колонке (силикагель/этилацетат-н-гексан) до получения 91 мг (52,2%)
указанного в заглавии соединения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,86 (6H, т, J = 6 Гц), 1,28 (40H, шир. с), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,31 (4H, т, J = 8 Гц), 3,40-3,52 (2H, м), 3,51-3,70 (2H, м), 4,20-4,44 (4H, м), 5,06-5,20 (2H, м), 5,25-5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 770 M+H.
Пример 1
Получение 3-O-/2-диметиламиноэтил/карбамоил-1,2-O-диолеилглицерин
К 25 мл раствора 2,00 г (3,4 ммоль) 1,2-O-диолеилглицерина в пиридине добавляют 0,66 г (4,1 ммоль) N,
N'-карбонилдиимидазола, и полученную смесь перемешивают при комнатной температуре в течение 5 ч. Затем растворитель отгоняют при пониженном давлении, а остаток растворяют в метиленхлориде, промывают
5% раствором первичного кислого фосфата натрия в воде, сушат и концентрируют. Остаток растворяют в 20 мл N,N-диметилформамида и после добавления 595 мг (6,8 ммоль) N,N-диметилэтилендиамина полученную
смесь перемешивают в течение ночи. После завершения реакции растворитель отгоняют, а остаток разбавляют водой и экстрагируют метиленхлоридом. Полученный экстракт промывают водой, сушат и концентрируют,
а остаток обрабатывают на хроматографической колонке (силикагель/хлороформ-метанол/ до получения 2,18 г (91%) указанного в заглавии соединения настоящего изобретения.
1 H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 7 Гц, CH3х2), 1,16-1,44 (44H, м, CH2х22), 1,7-1,68 (4H, м, OCH2CH2х2), 1,84-2,12 (8H, м, CH= CHCH2х4), 2,20 (6H, с, N(CH3)2), 2,39 (2H, т, J = 6 Гц/ NCH2), 3,18-3,31 (2H, м, CONHCH2), 3,36-3,64 (7H, м, OCH2х3 и OCH), 4,03-4,26 (2H, м, CH2OCO), 5,22 (1H, шир.с, NHCO), 5,28-5,43 (4H, м, CH=CHх2).
Масс-спектр с бомбардировкой быстрыми электронами: 707 (M+H)+.
Пример 2
Получение 3-O-(2-метиламиноэтил)карбамоил-1,2-O-диолеилглицерина
Указанное в заглавии соединение получают по способу примера 1 за исключением того, что N-метилэтилендиамин используют
вместо N,N-диметилэтилендиамина.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир. с), 1,50-1,60 (4H, м), 1,90-2,10 (8H, м), 2,43 (3H, с), 2,71 (2H, т, J = 6 Гц), 3,28 (2H, кв, J = 6 Гц); 3,40-3,70 (7H, м), 4,05-4,26 (2H, м), 5,14 (1H, шир. с), 5,30-5,44 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами 693 (M+H)+.
Пример 3
Получение 3-O-/2-аминоэтил/карбамоил-1,2-O-диолеилглицерина
Это соединение получают, используя N-тритилэтилендиамин вместо N,
N-диметилэтилендиамина, во всем остальном по способу примера 1, его обрабатывают 5% трихлоруксусной кислотой - метиленхлоридом и очищают тем же способом до получения указанного в заглавии
соединения.
1H ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир. с), 1,50-1,60 (4H, м), 1,90-2,10 (8H, м), 3,10-3,20 (2H, м), 3,40-3,70 (9H,
м), 4,04-4,26 (2H, м), 5,30-5,45 (4H, м), 6,20 (1H, шир. с),
Масс-спектр с бомбардировкой быстрыми электронами 679 (M+H)+
Пример 4
Получение
3-O-/2-диэтиламиноэтил/карбамоил-1,2-O-диолеилглицерина
Используя N,N-диэтилендиамин вместо N,N-диметилэтилендиамина, по способу примера 1 во всем остальном, получают указанное в заглавии
соединение настоящего изобретения.
1H ЯМР (200 МГц, CDCl3) δ: 0,87 (6H, т, J = 6 Гц), 1,01 (6H, т, J = 6 Гц), 1,27 (44H, шир. с), 1,46-1,62 (4H, м), 1,90-2, 10 (8H, м), 2,48-2,62 (6H, м), 3,18-3,30 (2H, м), 3,38-3,66 (7H, м), 4,04-4,24 (2H, м), 5,24-5,44 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 735 (M+H)+.
Пример 5
Получение 3-O-/4-диметиламинобутил/карбамоил-1,2-O-диолеилглицерина
Используя 4-диметиламинобутиламин вместо N, N-диметилэтилендиамина, в остальном по способу
примера 1, получают указанное в заглавии соединение изобретения.
1H ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир. с), 1,46-1,70 (8H, м), 1,90-2,10 (8H, м), 2,39 (6H, с), 2,44-2,56 (2H, м), 3,10-3,24 (2H, м), 3,36-3,70 (7H, м), 4,00-4,24 (2H, м), 5,18-5,42 (5H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 736 (M+H)+.
Пример 6
Получение 3-O-/2-диметиламиноэтил/тиокарбамоил-1,2-O-диолеилглицерина
Используя N, N-тиокарбонилдиимидазол вместо N,
N-карбонил-диимидазола, в остальном по способу примера 1, получают указанное в заглавии соединение настоящего изобретения.
1H ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир. с), 1,50-1,60 (4H, м), 1,90-2,10 (8H, м), 2,21 (6H, д, J = 4 Гц), 2,36-2,54 (2H, м), 3,30-3,80 (9H, м), 4,40-4,70 (2H, м), 5,26-5,45 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 723 (M+H)+.
Пример 7
Получение 3-O-/4-диметиламинобутаноил/-1,2-O-диолеилглицерина
В 6 мл
метиленхлорида-N,N-диметилформамида (1:2) растворяют 120 мг (0,20 ммоль) 1,2-O-диолеилглицерина, затем добавляют 168 мг (1 ммоль) 4-диметиламиномасляной кислоты гидрохлорида. Затем добавляют 206 мг (1
ммоль) N, N'-дициклогексилкарбодиимида (DCC) и 25 мг (0,2 ммоль) 4-метиламинопиридина, и реакцию ведут при комнатной температуре в течение ночи. Осаждающийся побочный продукт-мочевину отфильтровывают,
используя стеклянный фильтр, а полученный фильтрат концентрируют досуха при пониженном давлении, и обрабатывают метиленхлоридом-насыщенным водным раствором бикарбоната натрия. После разделения фаз
метиленхлоридный слой сушат над сульфатом натрия, а растворитель отгоняют при пониженном давлении. Остаток обрабатывают на хроматографической колонке с силикагелем, элюируя метиленхлоридом-метанолом,
до получения 123 мг (87%) указанного в заглавии соединения настоящего изобретения.
1H ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,20-1,40 (44H, м), 1, 45-1,60 (4H, м), 1,70-1,90 (2H, м), 1,90-2,10 (8H, м), 2,22 (6H, с), 2,30 (2H, т, J = 8 Гц), 2,36 (2H, т, J = 8 Гц), 3,38-3,85 (7H, м), 4,04-4,30 (2H, м), 5,30-5,45 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 706 (M+H)+.
Пример 8
Получение 3-O-/N,N-диметиламиноацетил/-1,2-O-диолеилглицерина
В смеси
растворителей из 22 мл N,N-диметилформамида и 11 мл метиленхлорида суспендируют 572 мг (5,547 ммоль) N,N-диметилглицина, затем добавляют 1736 мг (8,414 ммоль) N,N-дициклогексилкарбодиимида, и
полученную смесь перемешивают при комнатной температуре в течение ночи. Затем растворитель отгоняют при пониженном давлении, а остаток растворяют в 12 мл пиридина, содержащего 327 мг (0,551 ммоль)
растворенного 1,2-O-диолеилглицерина. Затем добавляют 80 мг (0,388 ммоль) N,N'-дициклогексилкарбодиимида (DCC), и реакцию ведут при 50oC в течение ночи. После завершения реакции
растворитель отгоняют, а остаток растворяют в метиленхлориде, промывают насыщенным водным раствором бикарбоната натрия, сушат и концентрируют. Остаток обрабатывают на хроматографической колонке
(силикагель/этилацетат-н-гексан) до получения 251 мг (67,2%) указанного в заглавии соединения настоящего изобретения.
1H ЯМР (400 , CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир. с), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,36 (6H, с), 3,23 (2H, с), 3,40-3,70 (7H, м), 4,00-4,20 (2H, м), 5,20-5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 678 (M+H)+.
Пример 9
Получение 3-O-/4-диметиламинобутаноил/-1,2-O-диолеилглицерина
(1) В 5 мл безводного пиридина растворяют 300 мг
(0,51 ммоль 1,2-O-диолеилглицерина, затем добавляют 188 мг (1,91 ммоль) 4-бромбутилхлорида при охлаждении льдом. После того, как температуре дают возможность вернуться до комнатной, реакцию ведут при
50oC в течение 1 ч. Затем растворитель отгоняют, а остаток обрабатывают метиленхлоридом-насыщенным раствором бикарбоната натрия. После разделения фаз и сушки над сульфатом натрия,
растворитель отгоняют при пониженном давлении. Полученный таким образом остаток обрабатывают на хроматографической колонке с силикагелем, элюируя метиленхлоридом-метанолом, до получения 159 мг (42%)
бром-соединения.
1H ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,27 (44H, шир. с), 1,50-1,70 (4H, м), 1,90-2,20 (10H, м), 2,53 (2H, т, J = 8 Гц), 3, 40-3,70 (9H, м), 4,05-4,30 (2H, м), 5,25-5,45 (4H, м).
(2) В 6 мл N,N-диметилформамида-изопропилового спирта-хлороформа (1:1:1) растворяют 130 мг (0,18 ммоль) вышеуказанного бромсоединения, а затем добавляют 1 мл диэтиламина и 70 мг (0,54 ммоль) N,N-диизопропилэтиламина. Полученную смесь оставляют реагировать при 60oC в течение 20 ч, а затем при 80oC еще в течение 6 ч. Растворитель отгоняют при пониженном давлении, а остаток обрабатывают метиленхлоридом-водой. Метиленхлоридный слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток обрабатывают хроматографически (силикагель/метиленхлорид/метанол) до получения 63 мг (50%) указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,04 (6H, т, J= 6 Гц), 1,27 (44H, шир.с.), 1,50-1,70 (4H, м), 1,80 (2H, м), 1,90-2,10 (8H, м), 2,37 (2H, т, J = 6 Гц), 2,44-2,70 (6H, м), 3,40-3,70 (7H, м), 4,05-4,30 (2H, м), 5,30-5,45 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 734 (M+H)+.
Пример 10
Получение N-(2,
3-диолеилокси)пропил-4-диметиламинобутиламида
В 3 мл безводного N,N-диметилформамида растворяют 100 мг (0,17 ммоль) 2,3-диолеилоксипропиламина. К этому раствору добавляют 71 мг (0,42 ммоль)
4-диметиламиномасляной кислоты гидрохлорида, 105 мг (0,51 ммоль) N,N'-дициклогексилкарбодиимида (DCC) и 4,1 мг (0,034 ммоль) 4-диметиламинопиридина, и реакцию ведут при комнатной температуре в течение
ночи. Затем реакционную смесь обрабатывают по способу примера 6 до получения 115 мг (96%) указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6,0 Гц), 1,20-1,40 (44H, м), 1,50-1,60 (4H, м), 1,70-1,90 (2H, м), м), 1,90-2,10 (8H, м), 2,23 (6H, с), 2,24 (2H, т, J = 8 Гц), 2,34 (2H, т, J = 8 Гц), 3,20-3,60 (9H, м), 5,30-5,42 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 705 (M+H)+.
Пример 11
Получение
3-O-/2-диметиламиноэтил/сульфамоил-1,2-O- диолеилглицерина
В 4 мл метиленхлорида-пиридина (2: 1) растворяют 150 мг (0,25 ммоль) 1,2-O-диолеилглицерина. Затем добавляют 1 мл раствора 150 мг (0,
75 ммоль) (2-диметиламиноэтил)-сульфамоилхлорида в метиленхлориде, и реакцию ведут при комнатной температуре в течение 2 ч. После завершения реакции растворитель отгоняют при пониженном давлении, а
остаток обрабатывают метилен-хлоридом - насыщенным водным раствором бикарбоната натрия. Слой метиленхлорида сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток обрабатывают на
хроматографической колонке (силикагель/метиленхлорид-метанол) до получения 34 мг/18%/ указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,20-1,40 (44H, м), 1,45-1,65 (4H, м), 1,90-2,10 (8H, м), 2,24 (6H, с), 2,48 (2H, т, J = 6 Гц), 3,18 (2H, т, J = 6 Гц), 3,40-3,60 (6H, м), 3,60-3,75 (1H, м), 4,08-4,30 (2H, м), 5,30-5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 743 (M+H)+.
Пример 12
Получение 2-диметиламиноэтил-N-/2,
3-диолеилоксипропил/-карбамата
В 2 мл пиридина растворяют 45 мг (0,5 ммоль) 2-диметиламиноэтанола, а затем добавляют 97 мг (0,6 ммоль) N,N-карбонилдиимидазола, и полученную смесь перемешивают
в течение 4 ч. К этому раствору добавляют 355 мг (0,6 ммоль) 2,3-диолеилоксипропиламина по каплям, и полученную смесь перемешивают в течение 24 ч. После завершения реакции растворитель отгоняют, а
остаток растворяют в метиленхлориде, промывают насыщенным водным раствором бикарбоната натрия, сушат и концентрируют. Остаток очищают на хроматографической колонке (силикагель/метиленхлорид-метанол)
до получения 383 мг (100%) указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (МГц, CDCl3) δ: 0,87 (6H, т, J = 6 Гц, CH3х2), 1,12-1, 44 (44H, м, CH2х22), 1,46-1,64 (4H, м, OCH2CH2х2), 1,88-2,12 (8H, м, CH=CHCH2х4), 2,37 (6H, с, N(CH3)2), 2,54 (2H, т, J = 6 Гц, NCH2), 3,32-3,64 (9H, м, OCH2х3, OCH и NHCH2), 4,16 (2H, т, J = 6 Гц, COOCH2), 5,17 (1H, шир.с, NHCO), 5,26-5,46 (4H, м, CH=CHх2).
Масс-спектр с бомбардировкой быстрыми электронами: 707 (M+H)+.
Пример 13
Получение 1-O-/2-диметиламиноэтил/карбамоил-1,3-диолеилглицерина
К 2 мл раствора
150 мг (0,253 ммоль) 1,3-O-диолеилглицерина в пиридине добавляют 82 мг (0,51 ммоль) N,N'-карбонилдиимидазола, и полученную смесь перемешивают при комнатной температуре в течение 5 ч. Растворитель
отгоняют при пониженном давлении, а остаток растворяют в метиленхлориде, промывают 5% раствором первичного кислого фосфата натрия в воде, сушат и концентрируют. Остаток растворяют в 1,6 мл N,
N-диметилформамида и перемешивают вместе с 45 мг (0,51 ммоль) N,N-диметилэтилендиамина в течение ночи. После завершения реакции растворитель отгоняют, а остаток разбавляют водой и экстрагируют
метиленхлоридом. Полученный экстракт промывают водой, сушат и концентрируют. Остаток обрабатывают на хроматографической колонке (силикагель/хлороформ-метанол/до получения 179 (100%) указанного в
заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир.с.), 1,50-1,65 (4H, м), 1,90-2,10 (8H, м), 2, 20 (6H, с), 2,39 (2H, т, J = 6 Гц), 3,20-3,30 (2H, м), 3,34-3,55 (4H, м), 3,55-3,70 (4H, д, J = 4 Гц), 4,99 (1H, т, J = 4 Гц), 5,25-5,46 (5H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 707 (M+H)+.
Пример 14
Получение 2-диметиламиноэтил-N-/1,3-диолеилоксипропан-2-ил/ карбамата
Используя 1,3-диолеилокси-2-пропиламин, во всем
остальном по способу примера 12, получают указанное в заглавии соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (44H, шир.с.), 1,50-1,60 (4H, м), 1,90-2,10 (8H, м), 2,28 (6H, с), 2,54 (2H, т, J = 6 Гц), 3,40-3,55 (8H, м), 3,80-3,90 (1H, м), 4,15 (2H, т, J = 6 Гц), 5,10-5,20 (1H, м), 5,20-5,45 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 707 (M+H)+.
Пример 15
Получение 3-O-(2-диметиламиноэтил)карбамоил-1,2-O-диолеоилглицерина
Используя 1,2-O-диолеилглицерин, во всем остальном повторяют методику примера 1, получают указанное в заглавии соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,22 (6H, с), 2,24-2,40 (4H, м), 2,41 (2H, т, J = 6 Гц), 3,20-3,30 (2H, м), 4,10-4,15 (4H, м), 5, 20-5,30 (2H, м), 5,30-5,45 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 735 (M+H)+.
Пример 16
Получение
2-O-(2-диметиламиноэтил)карбамоил-1,3-O- диолеоилглицерина
Используя 1,3-диолеоилглицерин, во всем остальном по способу примера 13, получают указанное в заглавии соединение настоящего
изобретения.
1H ЯМР (200 МГц, CDCl3) δ: : 0,88 (6H, т, J = 6 Гц), 1,26 (40H, шир. с. ), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,22 (6H, с), 2,32 (4H, т, J
= 8 Гц), 2,42 (2H, т, J = 6 Гц), 3,20-3,30 (2H, м), 4,12-4,25 (4H, м), 5,15 (1H, т, J = 6 Гц), 5,20-5,45 (5H, м)
Масс-спектр с бомбардировкой быстрыми электронами: 735 (M+H)+
Пример 17
Получение 2-диметиламиноэтил-N-(2,3-диолеоилоксипропил)- карбамата
В 30 мл безводного пиридина растворяют 500 мг (5,61 ммоль) 2-диметиламиноэтанола, затем добавляют 1,
91 г (11,8 ммоль) N,N'-карбонилдиимидазола, и реакцию ведут при комнатной температуре в течение 5 ч. К этой реакционной смеси добавляют 197 мг (2,16 ммоль) 3-амино-1,2-пропандиола, и реакцию ведут при
комнатной температуре в течение ночи. Затем пиридин отгоняют при пониженном давлении, а оставшийся неочищенный карбамат снова растворяют в пиридине. Затем при охлаждении льдом, добавляют 5,22 г (17,4
ммоль) олеоилхлорида, и реакцию ведут при 50oC в течение 14 ч. Затем пиридин отгоняют при пониженном давлении, а остаток растворяют в метиленхлориде и промывают насыщенным водным раствором
бикарбоната натрия. Слой метиленхлорида сушат над сульфатом натрия и концентрируют. Остаток очищают на хроматографической колонке (силикагель)метиленхлорид-метанол/ до получения 250 мг
/16%/ указанного в заглавии соединения настоящего изобретения.
1H ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц) 1,25 (40H, шир.с.), 1,50-1,70 (4H, м), 1, 90-2,10 (4H, м), 2,28 (6H, с), 2,30 (4H, т, J = 8 Гц), 2,57 (2H, т, J = 6 Гц), 3,30-3,50 (2H, м), 4,06-4,30 (4H, м), 5,04-5,15 (2H, м), 5,25-5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 735 (M+H)+.
Пример 18
Получение 2-диметиламиноэтил-N-/1,3-диолеоилоксипропан-2-ил/ карбамата
Используя 2-амино-1,3-пропандиол вместо
3-амино-1,2-пропандиола, в остальном по способу 17, получают 372 мг (2,2 ммоль) указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,87 (6H, т, J = 7 Гц), 1,20-1,40 (40H, м), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,30 (6H, с), 2,32 (4H, т, J = 8 Гц), 2,59 (2H, т, J = 6 Гц), 4,00-4,25 (7H, м), 5,10-5,20 (1H, м), 5,30-5, 45 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 735 (M+H)+
Пример 19
Получение 2-O-/2-пиперидиноэтил/карбамоил-1,3-O- диолеоилглицерина
Используя 1,3-O-диолеоилглицерин и 1-/2-аминоэтил/пиперидин, во всем остальном по способу примера 13 ,получают указанное в заглавии соединение настоящего изобретения.
1 H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,44-1,54 (2H, м), 1,54-1,76 (8H, м), 1,90-2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,39-2,56 (6H, м), 3,20-3,40 (2H, м), 4,12-4,40 (4H, м), 5,08-5,24 (1H, м), 5,24-5,52 (5H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 773 (M+H)+.
Пример 20
Получение 2-O-|2-диэтиламиноэтил/карбамоил-1,3-O- диолеоилглицерина
Используя 1,3-O-диолеоилглицерин и N,N-диэтилэтилендиамин, в остальном по способу примера 13, получают указанное в заглавии
соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,02 (6H, т, J = 6 Гц), 1,28 (40H, шир.с), 1,50-1,70 (4H, м), 1,90-2, 10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,44-2,66 (6H, м), 3,16-3,32 (2H, м), 4,22-4,38 (4H, м), 5,08-5,22 (1H, м), 5,26-5,52 (5H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 763 (M+H)+.
Пример 21
Получение 2-O-/2-диизопропиламиноэтил/карбамоил-1,3-O- диолеоилглицерина
Используя 1,3-O-диолеоилглицерин и N,
N-диизопропилэтилендиамин, в остальном по способу примера 13 получают указанное в заглавии соединение настоящего изобретения.
1H ЯМР (200 МГц, CDCl3) δ:/ 0,88 (6H, т, J = 6 Гц), 1,00 (12H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,48-2,64 (2H, м), 2,88-3,20 (4H, м), 4,10-4,32 (4H, м), 5,06-5,28 (2H, м), 5,30-5,42 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 791 (M+H)+.
Пример 22
Получение 2-O-/-2-пирролидиноэтил/карбамоил-1,
3-O- диолеоилглицерина
Используя 1,3-O-диолеоилглицерин и 1-/2-аминоэтил/пирролидин, в остальном по способу примера 13, получают указанное в заглавии соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3), δ: 0,88 (6H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50-1,70 (4H, м), 1,74-1,88 (4H, м), 1,90-2,10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,44-2, 70 (6H, м), 3,20-3,40 (2H, м), 4,20-4,42 (4H, м), 5,08-5,22 (1H, м), 5,24-5,46 (5H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 671 (M+H)+.
Пример 23
Получение 2-O-/2-морфолиноэтил/карбамоил-1,3-O-диолеоилглицерина
Используя 1,3-диолеоилглицерин и 4-/2-аминоэтил/морфолин, в остальном по способу примера 13, получают
указанное в заглавии соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: : 0,88 (6H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,31 (4H, т, J = 8 Гц), 2,40 - 2,54 (6H, м), 3,20 - 3,40 (2H, м), 3,70 (4H, т, J = 6 Гц), 4,12 - 4,38 (4H, м), 5,08 - 5,20 (2H, м), 5,20 - 5,46 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 777 (M+H)+.
Пример 24
Получение 2-O-/3-диэтиламинопропил/карбамоил-1,3-O-диолеоилглицерина
Используя 1,
3-O-диолеоилглицерин и 3-диэтиламинопропиламин, в остальном по способу примера 13 ,получают указанное в заглавии соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: : 0,88 (6H, т, J = 6 Гц), 1,03 (6 Гц, т, 6H), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,46 - 2,58 (6H, м), 3,20 - 3,32 (2H, м), 4,10 - 4,34 (4H, м), 5,10 - 5,20 (1H, м), 5,30 - 5,42 (4H, м), 6,18 - 6,30 (1H, шир.с.).
Масс-спектр с бомбардировкой быстрыми электронами: 777 (M+H)+.
Пример
25
Получение 2-O-/2-/N--метил-N-/2-гидроксиэтил/амино/этил-карбамоил -1,3-диолеоилглицерина
В 10 мл хлороформа растворяют 173 мг (0,224 ммоль) 1,
3-O- диолеоил-2-O-/2-бромэтил/карбамоилглицерина, затем добавляют 543 мг (7,228 ммоль) 2-/метиламино/этанола и 27 мг /0,209 ммоль/ диизопропилэтаноламина, и полученную смесь кипятят с обратным
холодильником при 80oC в течение ночи. Затем реакционную смесь промывают 5% первичным кислым фосфатом натрия-водой, сушат и концентрируют. Остаток обрабатывают на хроматографической колонке
(силикагель/метиленхлорид-метанол) до получения 128 мг (74,3%) указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,86 (6H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,26 - 2,38 (7H, м), 2,50 - 2,70 (4H, м), 3,20 - 3,40 (2H, м), 3,61 (4H, т, J = 6 Гц), 4,20 - 4,44 (4H, м), 5,06 - 5,20 (2H, м), 5,30 - 5,45 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 765 (M+H)+.
Пример 26
Получение
2-O-/2-N-этил-N-/2-гидроксиэтил/амино/этил-карбамоил -1,3-O-диолеоилглицерина
Используя 2-(этиламино)этанол, в остальном по способу примера 25, получают указанное в заглавии соединение
настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6,0 Гц), 1,03 (3H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,54 - 2,68 (6H, м), 3,20 - 3,30 (2H, м), 3,56 (2H, т, J = 6 Гц), 4,12 - 4,34 (4H, м), 5,06 - 5,20 (2H, м), 5,30 - 5,44 (4H, м).
Масс-спектр с бомбардировкой быстрыми электродами: 779 (M+H)+.
Пример 27
Получение 2-O-/2-/-N,N-ди-/2-гидроксиэтил/амино/этил/карбамоил- 1,3-O-диолеоилглицерина
Используя диэтиламин, в остальном по способу примера 25, получают указанное в заглавии соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м) 2,32 (4H, т, J = 8 Гц), 2,60 - 2,70 (6H, м), 3,20 - 3,30 (2H, м), 3,60 (4H, т, J = 6 Гц), 4,12 - 4,40 (4H, м), 5,08 - 5, 20 (1H, м), 5,30 - 5,42 (4H, м), 5,60 - 5,70 (1H, шир.с.).
Масс-спектр с бомбардировкой быстрыми электронами: 795 (M+H)+.
Пример 28
Получение
2-O-/2-/-N-метил-N-н-бутиламино/этил/карбамоил-1,3- диолеоилглицерина
Используя N-метилбутиламин, в остальном по способу примера 25, получают указанное в заглавии соединение настоящего
изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,82 - 0,96 (9H, м), 1,10 - 1,50 (42H, м), 1,50 - 1,75 (6H, м), 1,90 - 2,10 (8H, м), 2,19 (3H, с), 2,26 - 2,40 (6H, м), 2,46 (2H, м), 3,20 - 3,30 (2H, м), 4,10 - 4,30 (4H, м), 5,08 - 5,20 (1H, м), 5,25 - 5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 777 (M+H)+.
Пример 29
Получение 2-O-/2-/4-/2-гидроксиэтил/пиперазино/этил/карбамоил- 1,3-O-диолеоилглицерина
Используя 1-/2-гидроксиэтил/пиперазин, в остальном по способу примера 25,
получают указанное в заглавии соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (3H, т, J = 6 Гц), 1,28 (40H, шир.с.), 1,50 - 1,70 (4H, м), 1,90 - 2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,40 - 2,60 (12H, м), 3,18 - 3,32 (2H, м), 3,62 (2H, т, J = 6 Гц), 4,12 - 4,32 (4H, м), 5,08 - 5,24 (2H, м), 5,30 - 5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 820 (M+H)+.
Пример 30
Получение 1-O-/2-/N, N, N', N'-тетраметилгуанидино/этил/карбамоил-1,
3-O-диолеоилглицерин
Используя N, N, N', N'-тетраметилгуанидин, в остальном по способу примера 25, получают указанное в заглавии соединение настоящего изобретения.
1 H-ЯМР (200 МГц, CDCl3) δ: 0,88 (3H, т, J = 6 Гц), 1,27 (40H, шир.с.), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,96 (3H, с), 3,10 (3H, с), 3,35-3,40 (2H, м), 3, 60-3,70 (2H, м), 4,04-4,34 (4H, м), 4,98-5,08 (1H, м), 5,30-5,40 (4H, м), 6,30-6,40 (1H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 805 (M+H)+.
Пример 31
Получение 2--O-/2-/N-/2-диэтиламино/этил-N-метиламино/этилкарбамоил-1,3-O- диолеоилглицерина
Используя N, N-диэтил-N'-метилэтилендиамин, в остальном по способу примера 25,
получают указанное в заглавии соединение настоящего изобретения.
1H ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,04 (6H, т, J = Гц), 126 (40H, шир.с.), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,26-2,36 (7H, м), 2,44-2,64 (10H, м), 3,15-3,25 (2H, м), 4,16-4,26 (4H, м), 5,08-5,18 (1H, м), 5,30-5,40 (4H, м), 6,46-6,60 (1H, шир.с.).
Масс-спектр с бомбардировкой быстрыми электронами: 820 (M+H)+.
Пример 32
Получение 2-O-/2-/4-этилпиперазино/этил/карбамоил-1,3-диолеоилглицерина
Используя
1-этилпиперазил, в остальном по способу 25, получают указанное в заглавии соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6
Гц), 1,10 (3H, т, J = 6 Гц), 1,26 (40H, шир.с), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,38-2,60 (12H, м), 3,22-3,34 (2H, м), 4,12-4,34 (4H, м), 5,10-5,30 (2H, м), 5,30-5,42 (4H,
м)
Масс-спектр с бомбардировкой быстрыми электронами: 802 (M+H)+.
Пример 33
Получение 2-О-/2-/N-этил-N-метиламино/этил/карбамоил-1,
3-О-диолеоилглицерина
В 3 мл хлороформа растворяют 131 мг (0,170 ммоль) 1.3-0-диолеоил-2-О-/2-бромэтил/карбамоилглицерина, а затем добавляют 470 мг (7,951 ммоль) N-этилметиламина, и реакцию
ведут в запаянной ампуле при 80oC в течение ночи. Реакционную смесь промывают 5% раствором первичного кислого фосфата натрия в воде, сушат и концентрируют. Остаток обрабатывают на
хроматографической колонке (силикагель/метиленхлорид-метанол) до получения 104 мг (81,5%) указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 1,04 (3H, т, J = 6 Гц), 1,26 (40H, шир.с.), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,20 (3H, с), 2,32 (4H, т, J = 8 Гц), и 2,38-2,52 (4H, м), 3,20-3,30 (2H,
м), 4,12-4,32 (4H, м), 5,10-5,20 (1H, м), 5,25-5,42 (5H, м)
Масс-спектр с бомбардировкой быстрыми электронами: 749 (M+H)+.
Пример 34
Получение
2-О/2-диэтиламиноэтил/карбамоил-1,3-О-дипальмитлилглицерина
Используя 1,3-О-дипальмитоилглицерин и N, N-диэтилэтилендиамин, в остальном по
способу примера 13 получают указанное в заглавии
соединение настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3, δ: 0,87 (6H, т, J = 6 Гц), 1,00 (6H, т, J = 6 Гц), 1,25 (48H, шир.с.), 1,50-1,70 (4H, м), 2,30
(4H, т, J = 8 Гц), 2,46-2,60 (6H, м), 3,10-3,30 (2H, м), 4,12-4,32 (4H, м), 5,10-5,20 (1H, м), 5,20-5,35 (1H, м)
Масс-спектр с бомбардировкой быстрыми электронами: 711 (M+H)+.
Пример 35
Получение 2-диэтиламиноэтил-N-/1,3-диолеоилоксипропан-2-ил/-карбамата
В метиленхлориде растворяют 470 мг (4 ммоль) 2-диэтиламиноэтанола. После добавления 633
мг (8 ммоль) пиридина, 690 мг (4,4 ммоль) фенилхлорформата добавляют далее при охлаждении льдом и реакцию ведут при комнатной температуре в течение 2 ч. После завершения реакции растворитель отгоняют,
а остаток переносят в этилацетат-1% водный раствор бикарбоната натрия. Этилацетатный слой выделяют, сушат над сульфатом натрия и концентрируют при пониженном давлении до получения 705 мг (74%)
неочищенного карбонатного соединения. Этот неочищенный карбонат растворяют в безводном пиридине, затем добавляют 134 мг (1,47 ммоль) 2-амино-1.3-пропандиола и реакцию ведут при 80oC в
течение ночи. Затем добавляют 972 мг (3,2 ммоль) олеоилхлорида, и реакцию ведут еще 24 ч при комнатной температуре. После завершения реакции растворитель отгоняют, при пониженном давлении, а остаток
переносят в метиленхлорид-насыщенный водный раствор бикарбоната натрия и сушат над сульфатом натрия. Затем растворитель удаляют при пониженном давлении, а остаток обрабатывают на хроматографической
колонке (силикагель/метиленхлорид-метанол) до получения 250 мг (22%) указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0, 87 (6H, т, J = 6 Гц), 1,04 (6H, т, J = 6 Гц), 1,28 (40 H, шир.с.), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,30 (4H, т, J = 8 Гц), 2,50-2,70 (6H, м), 4,00-4,30 (7H, м), 5,05-5,20 (1H, м), 5,25-5,45 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 763 (M+H)+.
Пример 36
Получение 2-О-/3-диэтиламинопропионил/-1,3-О-диолеоглицерина
В смеси растворителей из 3 мг N,N-диметилформамида и 6 мл метиленхлорида растворяют 172 мг (0,277 ммоль) 1,3-диолеоилглицерина, а затем добавляют 101 мг (0,556 ммоль) N,N-диэтил β аланина (в
виде гидрохлорида), 114 мг (0,553 ммоль) N, N-дициклогексилкарбодиимида и 7 мг (0,057 ммоль) 4-диметиламинопиридина, и полученную смесь перемешивают в течение ночи. Затем реакционную смесь фильтруют,
а полученный фильтрат концентрируют при пониженном давлении. Остаток растворяют в метиленхлориде и промывают водой. Промытый раствор сушат и концентрируют, а остаток обрабатывают на хроматографической
колонке (силикагель/метиленхлорид-метанол) до получения 129 мг (62%) указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0, 88 (6H, т, J = 6 Гц), 1,20-1,40 (46H, м), 1,50-1,70 (4H, м), 1,90-2,10 (8H, м), 2,32 (4H, т, J = 6 Гц), 2,76-2,84 (6H, м), 3,04-3,14 (2H, м), 4,08-4,42 (4H, м), 5,18-5,30 (1H, м), 5,30-5,44 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 707 (M+H)+.
Пример 37
Получение O-/2-диметиламиноэтил/-O-(1,
3-диолеоилглицерина/- метилфосфоната
К 310 мг (0,50 ммоль) 1,3-диолеилглицерина, высушенного за счет азеотропной перегонки с пиридином, добавляют 9,1 мл (1 ммоль) 0,11 М метил-бис-O,
O-(1-бензотриазолил)фосфоната-диоксана, и реакцию ведут при комнатной температуре в течение 3 ч. К этой реакции смеси добавляют 446 мг (5 ммоль)2-диметиламиноэтанола и 411 мг /5
ммоль/ 1-метил-имидазола, и реакцию ведут далее при комнатной температуре в течение ночи. Затем реакционную смесь обрабатывают метиленхлоридом-5% раствором первичного кислого фосфата натрия, и
метиленхлоридный слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток обрабатывают на хроматографической колонке (силикагель/метиленхлорид-метанол) до получения 272 (59%)
указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,86 (6H, т, J = 6 Гц), 1,25 (40H, шир.с.), 1,54 (3H, д, J = 20 Гц), 1, 50-1,70 (4H, м), 2,32 (4H, т, J = 8 Гц), 2,35 (6H, с), 2,68 (2H, т, J = 6 Гц), 4,05-4,25 (4H м), 4,25-4,35 (2H, м), 4,70-4,90 (1H, м), 5,25-5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 770 (M+H)+.
Пример 38
Получение O-/2-аминоэтил/-O-(1,3-диолеоилоксипропил/- метилфосфоната
Используют
трет-бутил-N-/2-гидроксиэтил/карбамат вместо 2-диметиламиноэтанола, в остальном по способу примера 37 получают соединение, которое обрабатывают трифторуксусной кислотой (метиленхлоридом) (1:2) до
получения указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,88 (6H, т, J = 6 Гц), 2,25 (40H, шир.с.), 1,50-1,90 (7H, м), 1,90-2,10 (8H, м), 2,34 (4H, т, J = 8 Гц), 3,30-3,40 (2H, с), 4,10-4,50 (6H м), 4,75-4,90 (1H, м), 5,30-5,40 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 770 (M+H)+.
Пример 39
Получение O-/2-диэтиламиноэтил/-O-/1,3-диолеоилоксипропил/- метилфосфоната
Используют 2-диэтиламиноэтанол, по способу примера 37 получают 166 мг
(70,7%) указанного в заглавии соединения настоящего изобретения.
1H-ЯМР (200 МГц, CDCl3) δ: 0,87 (6H, т, J = 6 Гц), 1,01 (6H, т, J = 6 Гц), 1,26 (40H, шир.с.), 1,48-1,70 (7H, м), 1,90-2,10 (8H, м), 2,32 (4H, т, J = 8 Гц), 2,57 (4H, кв., J = 6 Гц), 2,80 (2H, т, J = 6 Гц), 3,90-4,40 (6H, м), 4,70-4,90 (1H, м), 5,30-5,42 (4H, м).
Масс-спектр с бомбардировкой быстрыми электронами: 798 (M+H)+.
Пример 40
В 200 мкл хлороформа в ампуле растворяют 5 мл соединения настоящего изобретения по примеру
4 и 5 мг фосфатидилэтаноламина яичного желтка. Затем газообразный азот продувают над раствором для удаления хлороформа, в результате чего остается тонкая пленка на внутренних стенках ампулы. Затем
ампулу оставляют на ночь при пониженном давлении и после добавления 2 мл стерильной дистиллированной воды перемешивают в вихревом смесителе для отслаивания пленки. После продувания газообразным азотом
ампулу герметически закрывают и оставляют выстаиваться при 4oC в течение 3 ч. Затем в течение 10 мин проводят обработку ультразвуком с помощью дезинтегратора до получения липидного средства
настоящего изобретения. Соотношение соединения к фосфолипиду составляет 1:1.
Пример 41
Используя соединение настоящего изобретения по примеру 7, получают липидное средство
настоящего изобретения по способу примера 40. Соотношение соединения к фосфолипиду составляет 1,03:1.
Пример 42
Используя соединение настоящего изобретения по примеру 20,
получают липидное средство настоящего изобретения по способу примера 40. Соотношение соединения к фосфолипиду составляет 0,96:1.
Пример 43
Используя фосфатидилхолин яичного
желтка вместо фосфатидилэтаноламина яичного желтка, получают средство настоящего изобретения по примеру 20, получают липидное средство настоящего изобретения по способу примера 40. Соотношение
соединения к фосфолипиду составляет 1,05:1.
Пример 44
Используя соединение настоящего изобретения по примеру 7, получают липидное средство настоящего изобретения во всем
остальном по способу примера 43. Соотношение соединения к фосфолипиду составляет 1,10:1.
Пример 45
Используя соединение изобретения по примеру 20, во всем остальном по
способу примера 43, получают липидное средство настоящего изобретения. Соотношение соединения к фосфолипиду составляет 1,10:1.
Пример 46
Композиция для инъекций
К 60
мкл средства настоящего изобретения по примеру 40 добавляют 0,9 мл физиологического солевого раствора. К этой смеси добавляют 0,1 мл 100 мкг/мл солевого раствора ошибочно спаренной двухнитевой РНК
(Двухнитевая РНК, состоящая из сополимера полиинозиновой кислоты и цитидиловой кислоты, содержащего одно звено 4-тиоуридиловой кислоты, замещенной на 20 звеньев цитидиловой кислоты, при полном
распределении молекул по размерам, контролируемым в пределах около 50-10000 оснований) (здесь и далее именуемая как исследуемое лекарство), и полученную смесь перемешивают до получения композиции для
инъекций.
Пример 47
Композиция для инъекций
Используя средства настоящего изобретения, полученные по способу примеров 41-45, во всем остальном по способу примера 46
получают композиции для инъекций.
Пример 48
Композиция для инъекций
Используя 10 мМ фосфатного буфера вместо физиологического раствора, во всем остальном по способу
примера 46 получают композицию для инъекций.
Тестовый пример 1
Гемолитическое действие
К 0,9 мл суспензии эритроцитов крысы, промытой изотоническим раствором,
добавляют 0,1 мл водной суспензии соединения настоящего изобретения, и полученную смесь инкубируют при 37oC при перемешивании в течение 45 мин. Полученную смесь центруфигируют со скоростью
3000 об/мин в течение 2 мин, и определяют поглощение надосадочной жидкости на 540 нм. Если принять поглощение образца, полученного при добавлении 0,1 мл изотонического раствора за 0% (гемолиза нет) и
абсорбцию образца, полученного добавлением 0,1 мл 0,1% Тритона X-100, за за 100% (полный гемолиз), тогда степень гемолиза для средства настоящего изобретения можно рассчитать. Полученные результаты
приведены в табл. 1. Суспензию эритроцитов приготавливают таким образом, чтобы поглощение на 540 нм после полного гемолиза составило бы 1,2.
Из данных табл. 1 видно, что по сравнению с коммерческим липидным средством, гемодитическое действие средства настоящего изобретения, которое вызывает гемолиз 30% эритроцитов, составляет приблизительно 1/10.
Именно поэтому предполагают, что средство настоящего изобретения обладает очень низкой токсичностью.
Тестовый пример 2
Способность ингибировать рост клеток Hela S3 (in vitro)
Плато
с 96 ячейками засевают клетками Hela S3 с плотностью 104 клеток/ячейку (90 мкл). На следующий день добавляют 10 мкг/ячейку Lipofectin (торговая марка) или средство настоящего изобретения,
причем концентрация липида у каждого составляет 30 мкг/мл, а концентрации исследуемого лекарства различны. Плато инкубируют в течение 72 ч после добавления, а затем добавляют по 10 мкл/ячейку 5 мг/мл
раствора МТТ/3-/4,5-диметилтиазол-2-ил/-2,5-дифенилтетразолийбромида. Через 2-4 ч реакцию останавливают, добавляя изопропиловый спирт /0,04 н. соляную кислоту. После получения суспендирования каждой
ячейки определяют поглощение на 540 нм с помощью считывающего устройства (производится Corona) и рассчитывают степень ингибирования роста клеток HeLa S3 (%). Расчет приводят на основании приводимой
далее формулы. В качестве контроля используют степень ингибирования роста клеток исследуемым лекарством как в отсутствие Lipofectin, так и в отсутствие средства настоящего изобретения.

Полученные результаты приведены в табл. 2
Примечания к табл. 2:
Exp = пример
Тестируемое лекарство представляет собой вещество: полиинозиновая кислота - поли(цитидиловая кислота-4-тиоуридиловая кислота).
Значения в таблице представляют степень ингибирования (%).
EPE = фосфатидилэтаноламин яичного желтка
ELC = фосфатидилхолин яичного желтка.
Из данных табл. 2 видно, что эффект ингибирования роста, достигаемый за счет средства настоящего изобретения, является 1-3 ~ 20-кратным по сравнению с эффектом, достигаемым с обычным липидным средством Липофектином (Lipofectin - торговая марка).
Однако было приготовлено липидное средство, содержащее 3β-/N-/-N',N'-диметиламиноэтан/-карбамоил/холестерин (DC-chol) и фосфатидилэтаноламин яичного желтка (1:1), способом, описанным в литературе (Biochemical and Biophysical Research Communication, 280-285, Vol. 179, N 1 (1991) и приведено сравнение со средством настоящего изобретения (примеры 40 и 43) по активности ингибирования роста клеток Hela S3. Было обнаружено, что если используют 0,1 мкг/мл исследуемого средства при концентрации липида 30 мкг/мл, средство настоящего изобретения оказывается примерно в 6 раз более эффективным нежели DC-chol липидное средство с точки зрения активности ингибирования роста клеток.
Реферат
Целью изобретения является создание липидного средства, функционально эквивалентного, так называемой, катионной липосоме, менее токсичного и содержащего липид или его аналог в качестве компонента этого средства. Соединения изобретения относятся к соединениям общей формулы I, где R1 и R2 неодинаковы и каждый представляет группу -0-Y или группу - А-(СН2)n-Е, где n-целое число от 2 до 4, E представляет пирролидино, пиперидино, морфолино и др. или Е представляет группу
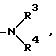
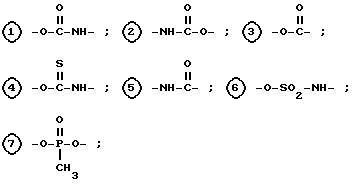
R и Y - одинаковы и каждый представляет олеил, или олеоил, или пальмитоил при условии, что когда n = 1, то А не может быть группой


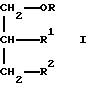
Формула
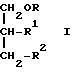
R1 и R2 - неодинаковы и каждый представляет группу -O-Y или группу -A-(CH2)n-E, где n - целое число от 1 до 4, E представляет пирролидино, пиперидно, морфолино, пиперазиногруппу, замещенную гидроксинизшим C1-C4 -алкилом, гуанидиногруппу, замещенную низшим алкилом, или E представляет группу
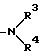
где R3 и R4 - одинаковые или различные и каждый представляет атом водорода, низший-C1-C4-алкил, гидроксинизший-C1-C4-алкил,
A представляет группу формулы
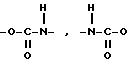
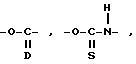
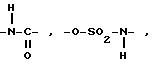
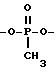
R и Y - одинаковые и каждый представляет олеил, или олеоил, или пальмитолил при условии, что когда n = 1, то A не может быть группой 3 или 5.
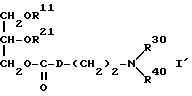
где R11 и R21 - одинаковые и каждый представляет олеил или олеоил;
D представляет -CH2- или -NH-;
R30 и R40 - одинаковые и каждый представляет метил или этил.

Комментарии