Невирусный вектор для введения нуклеиновой кислоты и способ его получения, конденсированный комплекс полипептид/нуклеиновая кислота и способ встраивания представляющей интерес нуклеиновой кислоты в эукариотическую клетку - RU2267536C2
Код документа: RU2267536C2
Чертежи



















Описание
Область техники изобретения
Настоящее изобретение относится к комплексам типа катионный липид/протеин/нуклеиновая кислота, которые содержат вирусные упаковывающие протеины, и к их применению для эффективного введения нуклеиновых кислот в клетки, такие как нервные клетки.
Предпосылки создания изобретения
Создание включающих катионные липиды синтетических липосом, с помощью которых можно трансфектировать клетки, позволило осуществлять эффективный перенос генов без использования вирусов. Однако лишь незначительное количество таких комплексов было исследовано в отношении их способности осуществлять эффективный перенос ДНК в клетки ЦНС и экспрессию трансгена. Возможность эффективно и безопасно осуществлять трансфекцию нервных клеток может представлять собой очень важный инструмент для исследования нервных функций и может служить предпосылкой для создания новых методов лечения неврологических нарушений.
К сожалению, развитие генной терапии применительно к ЦНС сдерживается из-за отсутствия эффективных средств трансдукции постмитотических нейронов. В большинстве исследований для введения генов использовали вирусные векторы. Однако при использовании многих вирусных векторов возникают проблемы, связанные с иммунитетом и цитотоксичностью, и их трудно решать специалистам, которые не являются вирусологами [1-3]. В настоящее время применение невирусных векторов дает возможность создать альтернативный метод трансдукции клеток. Наиболее перспективным направлением в области переноса генов с помощью невирусных векторов явилось создание синтетических липосом, содержащих катионные липиды (цитофектины), которые обладают способностью трансфектировать клетки. Такие катионные липосомы относительно легко использовать, они имеют широкую область применения и не обладают цитотоксическим действием [4].
В настоящее время постоянно ведутся работы по созданию новых композиций на основе катионных липосом [5]. Однако лишь незначительное количество таких комплексов было исследовано в отношении их способности осуществлять эффективную трансдукцию клеток ЦНС. Действие катионных липосом основано на электростатическом взаимодействии с несущей отрицательный заряд ДНК и затем с клеточными мембранами при их проникновении через клеточную мембрану в результате медленного процесса эндоцитоза [6, 10, 11]. Их часто создают с использованием нейтрального липида диолеил-L-α-фосфатидилэтаноламина (ДОФЭ), который обладает очень высокой эффективностью в отношении забуферивания и разрушения эндосом [8, 12]. В перинуклеарном пространстве трансфектированный генетический материал высвобождается из липосомного комплекса, транспортируется в ядро и там происходит его экспрессия. В настоящее время успешную трансфекцию клеток ЦНС можно обеспечивать только с помощью липосом, созданных на основе хлорида N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (ДОТМА) и ДОФЭ [13-16]. Для генной терапии требуется разработка липосомных комплексов, позволяющих осуществлять высокоэффективную трансфекцию клеток ЦНС.
Основным препятствием при переносе генов, опосредуемом невирусными векторами, является образование больших агрегированных молекул в процессе формирования комплексов липосома: ДНК [5]. Возможно, что такие большие агрегаты могут снижать эффективность трансфекции в результате ограничения эндоцитоза комплексов. Один из путей преодоления этого заключается в уменьшении размера молекул ДНК путем конденсации ДНК перед формированием комплекса. Предварительная конденсация ДНК приводит к уменьшению размеров комплексов и повышает эффективность трансфекции [17-23]. Были выявлены различные поликатионы, обладающие эффективностью в отношении улучшения опосредуемой липосомами трансфекции. Установлено, что среди них поли-L-лизин и протамин обладают наибольшей эффективностью для большинства линий клеток, не относящихся к нервным клеткам, которая превышает более чем в 30 раз эффективность, характерную для комплексов, получаемых без предварительной конденсации [17, 21].
Для усиления трансфекции с помощью липосом наиболее предпочтительно использовать сульфат протамина. Протамин представляет собой образующийся в естественных условиях поликатион, который присутствует в головке сперматозоида. Функция протамина состоит в том, что он способствует конденсации ДНК в сперме и облегчает ее перенос в ядро яйцеклетки. Тот факт, что протамин обладает способностью осуществлять направленный перенос в ядро, делает его очень привлекательным агентом для переноса генов. Так, в отличие от синтетического поли-L-лизина, который имеет большую молекулярную массу (18000-19200 Да), встречающиеся в естественных условиях молекулы протамина отличаются меньшим и более однородным размером (4000-4250 Да). Такие характеристики свидетельствуют о том, что в данном случае имеется меньшая вероятность возникновения иммуногенных реакций в ткани-мишени и легче контролировать процесс конденсации. Для усиления опосредуемого катионными липосомами переноса ДНК применяли также другие встречающиеся в естественных условиях протеины, обладающие способностью конденсировать ДНК. Fritz с соавторами [22] продемонстрировали, что можно достичь почти 30-кратного увеличения липофекции за счет использования рекомбинантного протеина человеческого гистона Н1, содержащего сигнал ядерной локализации (nls-Hl). Было установлено также, что обладающий высокой подвижностью негистонный хромосомный протеин группы 1, 2 позволяет усиливать липофекцию, и его применяют в стандартном методе с использованием HVJ-липосом [20, 24].
Краткое изложение сущности изобретения
При создании изобретения были проведены исследования вирусных протеинов, связанных с ДНК, в отношении их способности усиливать опосредуемый липосомами перенос генов. В частности, проводили сравнение кодируемого вирусом синтетического пептида Mu1 и рекомбинантного протеина Vp1 аденовируса и вируса полиомы соответственно. Mu1 может играть роль в конденсации аденовирусной хромосомы, в то время как Vp1 является только структурным протеином вируса полиомы, обладающим ДНК-связывающей активностью [25-27]. Vp1 в отличие от Mu1 содержит встроенный классический сигнал ядерной локализации (NLS), аналогичный сигналу, обнаруженному в HMG-1,2 и nls-Hl [26]. Было установлено, что Mu1 в отличие от Vp1 существенно усиливает опосредуемый катионными липосомами перенос генов в клетки, выделенные из нервной системы и почки. Было также установлено, что опосредуемое Mu1 усиление проявлялось в большей степени в дифференцирующихся клетках, что свидетельствует о возможной применимости данного подхода для нервных клеток in vivo.
Полученные результаты можно использовать в экспериментальных и терапевтических целях для опосредуемого липосомами введения ДНК в клетки ЦНС.
Таким образом, объектом настоящего изобретения является невирусный вектор для введения нуклеиновой кислоты, содержащий конденсированный комплекс полипептид/нуклеиновая кислота и катионный липид, где комплекс включает
(а) представляющую интерес нуклеотидную последовательность (NOI);
(б) один или несколько вирусных упаковывающих нуклеиновую кислоту полипептидов или их производных, где полипептиды или их производные (I) обладают способностью связываться с NOI; и (II) обладают способностью конденсировать NOI; и где NOI является гетерологичной по отношению к полипептиду.
Предпочтительно по меньшей мере один полипептид представляет собой аденовирусный упаковывающий нуклеиновую кислоту полипептид или его производное. Более предпочтительно аденовирусный полипептид представляет собой Mu1, pV или pVII или его производное.
Понятие «гетерологичный по отношению к полипептиду» означает, что в этом случае отсутствуют вирусные NOI, которые встречаются в естественных условиях в комбинации с вирусным упаковывающим полипептидом.
В предпочтительном варианте вектор дополнительно включает полипептид, содержащий последовательность ядерной локализации (NLS). Более предпочтительно полипептид, содержащий последовательность ядерной локализации (NLS), представляет собой аденовирусный pV или его производное.
Объектом настоящего изобретения является также конденсированный комплекс полипептид/нуклеиновая кислота, включающий катионный липид, полипептидный компонент и компонент, представляющий собой нуклеиновую кислоту, предназначенный для введения компонента, представляющего собой нуклеиновую кислоту, в ядро эукариотической клетки, где
(I) компонент, представляющий собой полипептид, является вирусным упаковывающим нуклеиновую кислоту полипептидом или его производным;
(II) компонент, представляющий собой полипептид или его производное, обладает способностью связываться с NOI;
(III) компонент, представляющий собой полипептид или его производное, обладает способностью конденсировать NOI; и где нуклеиновая кислота является гетерологичной по отношению к полипептиду.
Предпочтительно по меньшей мере один полипептид представляет собой аденовирусный упаковывающий нуклеиновую кислоту полипептид или его производное. Более предпочтительно аденовирусный полипептид представляет собой Mu1, pV или pVII или его производное.
В предпочтительном варианте осуществления комплекс также содержит последовательность ядерной локализации (NLS). Более предпочтительно полипептид, содержащий последовательность ядерной локализации (NLS), представляет собой аденовирусный pV или его производное.
Настоящее изобретение относится также к способу получения невирусного вектора, предназначенного для введения нуклеиновой кислоты, содержащего конденсированный комплекс полипептид/нуклеиновая кислота и катионный липид, который заключается в том, что
(а) представляющую интерес нуклеотидную последовательность (NOI) приводят в контакт с вирусным упаковывающим нуклеиновую кислоту полипептидом, или его производным, где компонент, представляющий собой полипептид или его производное, (I) обладает способностью связываться с NOI; (II) обладает способностью конденсировать NOI; и где NOI является гетерологичной по отношению к полипептиду;
(б) образовавшийся в результате комплекс нуклеиновая кислота/полипептид приводят в контакт с катионным липидом.
Настоящее изобретение относится также к способу встраивания представляющей интерес нуклеотидной последовательности (NOI) в эукариотическую клетку, заключающемуся в том, что клетку приводят в контакт с комплексом по изобретению, который содержит NOI. Предпочтительно клетка представляет собой нервную, раковую или эпителиальную клетку.
В альтернативном варианте вместо или в дополнение к вирусному упаковывающему нуклеиновую кислоту полипептиду можно использовать вирусный полипептид, осуществляющий ядерную локализацию/введение нуклеиновой кислоты. В действительности некоторые вирусные полипептиды обладают обеими этими функциями.
Подробное описание изобретения
Хотя в целом упомянутые в настоящем описании методы являются хорошо известными в данной области, следует специально сослаться на такие руководства, как Sambrook и др., Molecular Cloning, A Laboratory Manual (1989) и Ausubel и др., Short Protocols in Molecular Biology (1999), 4-е изд., John Wiley & Sons, Inc.
А. Полипептидные компоненты
1. Вирусные упаковывающие нуклеиновую кислоту полипептиды
Понятие «вирусный упаковывающий нуклеиновую кислоту полипептид» обычно включает полипептиды, кодируемые вирусными геномами, которые присутствуют в естественных условиях в вирусных частицах, функция которых заключается в упаковке, в частности в конденсации, и введении в ядро нуклеиновых кислот, образующих вирусный геном вириона. Под это понятие также подпадают описанные ниже их гомологи и производные, а также фрагменты.
Примерами вирусных упаковывающих нуклеиновую кислоту полипептидов являются вирусные коровьи протеины, такие как коровий антиген вируса гепатита В и аденовирусные коровьи протеины, Mu1, pV и pVII, а также эквивалентные им протеины других аденовирусов, таких как Mastadenoviruses (аденовирусы млекопитающих) и Aviadenoviruses (аденовирусы птиц). Наиболее предпочтительным для применения согласно настоящему изобретению вирусным упаковывающим нуклеиновую кислоту полипептидом является полипептид Mu1, последовательность которого приведена ниже (SEQ ID NO: 1).
NH2 -Met-Arg-Arg-Ala-His-His-Arg-Arg-Arg-Arg-Ala-Ser-His-Arg-Arg-Met-Arg-Gly-Gly-OH (SEQ ID NO: 1).
Вирусные упаковывающие нуклеиновую кислоту полипептиды, которые можно применять согласно настоящему изобретению, обладают способностью связываться с нуклеиновыми кислотами, как правило, неспецифическим образом, предпочтительно вызывая при этом конденсацию нуклеиновой кислоты. Для обеспечения оптимальной эффективности введения в клетку-мишень в целом предпочтительно, чтобы длина конденсированной NOI была равна или не превышала 200 нм, например составляла от 50 до 200 нм.
Способность вирусных полипептидов связываться с нуклеиновыми кислотами можно оценивать в опытах in vitro с помощью таких методов, как гель-электрофорез, в том числе с помощью анализа на замедление подвижности в геле (см. раздел «Материалы и методы» и раздел «Результаты») и электрофоретического анализа изменения подвижности полос в геле, анализа, основанного на выделении с помощью бромида этидия, и аффинной хроматографии (например, с использованием одноцепочечной или двухцепочечной ДНК-целлюлозы).
Способность вирусных полипептидов конденсировать нуклеиновые кислоты можно оценивать, например, с помощью спектроскопии на основе метода циркулярного дихроизма (ЦД) (см., например, у Sato и Hosokawa, J. Biol. Chem., 95: 1031-1039, 1984).
Как правило, при физиологических значениях рН (например, рН 7,4) вирусные полипептиды, или их гомологи, или производные содержат большое количество положительно заряженных аминокислотных остатков. Предпочтительно чистый суммарный заряд вирусного полипептида при физиологическом значении рН является положительным. В частности, предпочтительно, чтобы соотношение заряд: количество аминокислотных остатков составляло по меньшей мере +0,3, предпочтительно по меньшей мере +0,4, +0,5 или +0,6.
Предпочтительно, чтобы вирусные полипептиды, или их гомологи, или производные содержали остатки аргинина, а не остатки лизина, или их смесь. Наиболее предпочтительно, чтобы вирусные полипептиды, или их гомологи, или производные содержали также один или несколько остатков гистидина, предпочтительно два или более остатков гистидина. Кроме того, вирусные полипептиды, или их гомологи, или производные, как правило, должны содержать большое количество обладающих высокой гидрофобностью остатков аминокислот, таких как аланин, например два или более гидрофобных остатков.
Следует понимать, что аминокислотные последовательности, которые можно применять согласно изобретению, не ограничены встречающимися в естественных условиях вирусными упаковывающими нуклеиновую кислоту полипептидами, а также включают гомологичные последовательности, полученные из любого источника, например родственные вирусные/бактериальные протеины, клеточные гомологи и синтетические пептиды, а также их варианты и производные, такие как фрагменты.
В контексте настоящего описания гомологичная последовательность обозначает последовательность, содержащую аминокислотную последовательность, которая по меньшей мере на 60, 70, 80 или 90%, предпочтительно по меньшей мере на 95 или 98%, идентична по меньшей мере 10, предпочтительно по меньшей мере 20, 30, 40 или 50 аминокислотам вирусного коровьего полипептида, например последовательность Mu1, представленную в виде SEQ ID NO: 1. Гомологию следует оценивать прежде всего для тех областей, которые как известно являются важными для связывания нуклеиновой кислоты, а не для имеющих решающего значения соседних областей. Хотя гомологию можно оценивать также с точки зрения подобия (т.е. количества аминокислотных остатков, обладающих сходными химическими свойствами/функциями), в контексте настоящего описания предпочтительно гомологию оценивать с точки зрения идентичности последовательностей.
Оценку гомологии можно проводить визуально или, что является более удобным, с помощью уже применяемых программ сравнения последовательностей. Такие доступные на коммерческой основе компьютерные программы позволяют рассчитывать процент гомологии двух или нескольких последовательностей.
Процент гомологии можно рассчитывать для непрерывных последовательностей, т.е. когда одну последовательность сравнивают с другой последовательностью и каждую аминокислоту в одной последовательности непосредственно сопоставляют с соответствующей аминокислотой в другой последовательности, каждый раз один остаток с другим остатком. Эта процедура называется «сравнением последовательностей без учета брешей». Как правило, такие сравнения без учета брешей осуществляют только для относительно небольшого количества остатков (например, для менее чем 50 смежных аминокислот).
Хотя данный метод является очень простым и непротиворечивым, он оказывается непригодным, например, при анализе пар последовательностей, идентичных за исключением одной вставки или делеции, он приводит к исключению из рассмотрения следующих за ними аминокислотных остатков и к значительному уменьшению % гомологии при осуществлении глобального сравнения последовательностей. Вследствие этого большинство методов сравнения последовательностей созданы для того, чтобы иметь возможность осуществления оптимального сравнения, учитывающего возможные вставки и делеции, при котором не происходит чрезмерного уменьшения общей оценки степени гомологии. Это достигается путем введения «брешей» при сравнении последовательностей с целью максимизации локальной гомологии.
Однако поскольку при использовании этих более сложных методов для каждой бреши, которая встречается при проведении сравнения, приписывается «штраф за брешь», то существует возможность, что для одного и того же количества идентичных аминокислот данный метод сравнения последовательностей в случае минимального количества брешей, что соответствует более высокому сходству двух сравниваемых последовательностей, они дают более высокую оценку, чем для последовательностей с большим количеством брешей. Для того чтобы сохранить относительно высокую цену за наличие бреши и более низкий штраф за каждый последующий остаток в бреши, как правило, применяют «цену за аффинную брешь». Такой метод представляет собой наиболее часто применяемую систему оценки с использованием брешей. Естественно, что высокие штрафы за брешь позволяют производить более оптимальные оценки последовательностей, имеющих небольшое количество брешей. Для большинства программ сравнения последовательностей имеется возможность корректировки штрафов за брешь. Однако при использовании такого программного обеспечения для сравнения последовательностей предпочтительно применять параметры, задаваемые по умолчанию. Например, при использовании пакета программ GCG Winsconsin Bestfit (см. ниже) задаваемый по умолчанию штраф за брешь в аминокислотной последовательности составляет -12, а за каждое удлинение бреши составляет -4.
Таким образом, вычисление процента гомологии прежде всего требует проведения оптимального сравнения последовательностей с учетом штрафов за брешь. Для осуществления такого сравнения можно использовать компьютерную программу GCG Winsconsin Bestfit (University of Wisconsin, США; Devereux и др., Nucleic Acids Research, 12: 387, 1984). Примеры других программ, которые позволяют обеспечивать сравнения последовательностей, включают (но не ограничиваясь ими) пакет программ BLAST (см. Ausubel и др., 1999, цит. выше, глава 18), FASTA (Altschul и др., J. Mol. BioL, 403-410, 1990) и набор для сравнения последовательностей GENEWORKS. Программы BLAST и FASTA можно использовать для исследования как в режиме off-line, так и on-line (см. Ausubel и др., 1999, цит. выше, стр. с. 7-58 до 7-60). Однако предпочтительно использовать программу GCG Bestfit.
Хотя конечный процент гомологии можно оценивать с точки зрения идентичности, сам процесс сравнения последовательностей обычно не основан на сравнении пар по принципу «да-нет». Вместо этого применяют матрицу относительных баллов сходства, согласно которой при каждом сравнении пар на основе химического сходства или эволюционного расстояния получают определенный балл. Примером такой обычно используемой матрицы является матрица BLOSUM62 - задаваемая по умолчанию матрица для пакета программ BLAST. В программах GSG Wisconsin, как правило, используют либо известные задаваемые по умолчанию значения, либо пригодную для конкретного случая таблицу сравнительных символов (более подробно см. руководство для пользователя). Для пакета программ GCG предпочтительно применять известные задаваемые по умолчанию значения, а в случае использования другого программного обеспечения следует применять задаваемую по умолчанию матрицу, такую как BLOSUM62.
После того как с помощью программного обеспечения осуществлено оптимальное сравнение последовательностей, можно рассчитывать % гомологии, предпочтительно % идентичности последовательностей. Обычно это осуществляют с помощью программного обеспечения в качестве определенного этапа сравнения последовательностей и выдают в виде численного результата.
Понятие «производное» применительно к аминокислотным последовательностям по настоящему изобретению относится к любому замещению, изменению, модификации, замене, делеции или добавлению одной (или нескольких) аминокислот в последовательности, которые позволяют получать конечную аминокислотную последовательность, обладающую активностью в отношении связывания с нуклеиновыми кислотами и их конденсации, предпочтительно обладающую по меньшей мере такой же активностью, что и немодифицированные полипептиды.
Для применения согласно настоящему изобретению можно модифицировать вирусные полипептиды. Обычно осуществляют такие модификации, которые сохраняют способность последовательности связываться с нуклеиновой кислотой и конденсировать ее. Количество аминокислотных замен может составлять, например, от 1, 2 или 3 до 10, 20 или 30 при условии, что модифицированная последовательность сохраняет способность связываться с нуклеиновой кислотой и конденсировать ее. Аминокислотные замены можно производить с использованием не встречающихся в естественных условиях аналогов, например, с целью увеличения времени полужизни в плазме вводимого с терапевтической целью полипептида.
В частности, может оказаться целесообразным осуществлять аминокислотные замены для того, чтобы увеличивать при физиологическом значении рН чистый положительный заряд встречающегося в естественных условиях вирусного упаковывающего полипептида. Положительно заряженные аминокислоты включают аргинин, лизин и гистидин. Аргинин обладает наибольшим зарядом среди встречающихся в естественных условиях аминокислот и поэтому является наиболее предпочтительным.
Консервативные замены можно осуществлять, например, согласно приведенной выше таблице. Аминокислоты, указанные в одном и том же блоке во втором столбце и предпочтительно в одной и той же строке в третьем столбце, можно заменять друг на друга.
Полипептиды, предназначенные для применения согласно изобретению, можно получать рекомбинантными методами, например, как описано ниже. Однако их можно также получать синтетическим путем с помощью хорошо известных специалистам в данной области методов, таких как метод твердофазного синтеза. Полипептиды, предназначенные для применения согласно изобретению, можно создавать также в виде слитых протеинов, например, для целей экстракции и очистки. Примерами компонентов слитых протеинов являются глутатион-S-трансфераза (GST), 6×His, GAL4 (ДНК-связывающие и/или активирующие транскрипцию домены) и β-галактозидаза. Может оказаться целесообразным встраивать сайт протеолитического расщепления между компонентом, представляющим собой слитый протеин, и последовательностью представляющего интерес протеина для того, чтобы иметь возможность удалять последовательности слитого протеина. Предпочтительно компонент, представляющий собой слитый протеин, не снижает биологическую активность протеина, имеющего представляющую интерес последовательность.
Полипептиды, предназначенные для применения согласно изобретению, могут находиться в практически выделенной форме. Это означает, что полипептиды можно смешивать с носителями или разбавителями, которые не оказывают влияния на целевую функцию полипептидов, и поэтому последние можно рассматривать как практически выделенные. Полипептиды могут находиться также в практически очищенной форме, где как правило более 90%, например 95, 98 или 99%, протеина в композиции содержит полипептиды, предназначенные для применения согласно изобретению.
2. Полипептиды. содержащие последовательности ядерной локализации
В предпочтительном варианте осуществления вектор для введения/комплекс по изобретению дополнительно включает полипептид, содержащий последовательность ядерной локализации (NLS). В целом NLS хорошо известны в данной области (см., например, Dingwall и Laskey, Trends. Biochem. Sci, 16: 478-481, 1991). Однако наиболее предпочтительно использовать NLS аденовирусного коровьего протеина pV. NLS протеина pV представляет собой последовательность RPRRRATTRRRTTTGTRRRRRRR (SEQ ID NO: 2), которая соответствует аминокислотам 315-337 (D. Mattews, не опубликовано). Еще одна NLS расположена на N-конце (KPRKLKRVKKKKK - SEQ ID NO: 3), хотя предпочтительно, чтобы NLS была расположена на С-конце.
NLS может присутствовать на полипептидной молекуле, отличной от в упаковывающего полипептида, или в виде части одной и той же цепи такого полипептида, например, в составе слитого протеина.
Б. Представляющие интерес нуклеотидные последовательности
Представляющие интерес нуклеотидные последовательности (NOI), которые требуется вводить в клетки с помощью предназначенного для введения вектора или комплекса по изобретению, могут содержать ДНК или РНК. Они могут быть одноцепочечными или двухцепочечными. Они могут также представлять собой полинуклеотиды, содержащие полученные синтетическим путем или модифицированные нуклеотиды. В данной области известно большое количество различных типов модификаций олигонуклеотидов. Они включают использование метилфосфонатных и фосфортиоатных каркасов, введение акридиновых или полилизиновых цепей на 3'- и/или 5'-концы молекулы. Следует понимать, что для целей настоящего изобретения указанные в настоящем описании полинуклеотиды можно модифицировать любым известным в данной области методом. Такие модификации можно осуществлять для того, чтобы повышать активность in vivo или продолжительность жизненного цикла NOI.
Как правило, NOI содержат гетерологичный ген. Понятие «гетерологичный ген» относится к любому гену. Гетерологичный ген может представлять собой любой аллельный вариант гена дикого типа или может представлять собой мутантный ген. Понятие «ген» относится к нуклеотидным последовательностям, которые обладают по меньшей мере способностью к транскрипции. Таким образом, указанное понятие включает последовательности, кодирующие мРНК, тРНК и пРНК, а также антисмысловые конструкции. Нуклеиновые кислоты могут представлять собой, например, рибонуклеиновую кислоту (РНК), или дезоксирибонуклеиновую кислоту (ДНК), или их аналоги. Последовательности, кодирующие мРНК, могут необязательно содержать некоторые или все 5'- или 3'-транскрибируемые, но нетранслируемые фланкирующие последовательности, естественным или иным образом связанные с транслируемой кодирующей последовательностью. Они могут необязательно дополнительно содержать связанные с транскрипцией последовательности, как правило связанные с транскрибируемыми последовательностями, например сигналы терминации транскрипции, сайты полиаденилирования и расположенные по ходу транкрипции энхансерные элементы.
Транскрибируемая последовательность гетерологичного гена предпочтительно функционально связывают с контролирующей последовательностью, что позволяет осуществлять экспрессию гетерологичного гена в клетках млекопитающих, предпочтительно в нервных клетках, таких как клетки центральной и периферической нервной системы, раковые или эпителиальные клетки.
Понятие «функционально связанный» относится к такому расположению рассматриваемых компонентов, которое позволяет им осуществлять свои функции требуемым образом. Контролирующую последовательность, «функционально связанную» с кодирующей последовательностью, встраивают путем лигирования таким образом, чтобы экспрессия кодирующей последовательности происходила в условиях, которые являются приемлемыми для контролирующей последовательности.
Контролирующая последовательность содержит промотор, обеспечивающий экспрессию гетерологичного гена, и сигнал терминации транскрипции. Промотор выбирают из числа промоторов, которые могут функционировать в клетках млекопитающих, предпочтительно в клетках человека. Промотор можно получать из промоторных последовательностей эукариотических генов. Например, он может представлять собой промотор, полученный из генома клетки, в которой может осуществляться экспрессия гетерологичного гена, предпочтительно клетки центральной или периферической нервной системы млекопитающего. Промоторы из эукариотических клеток могут представлять собой промоторы, которые осуществляют свою функцию независимо от типа ткани (такие как промоторы β-актина, тубулина), или в альтернативном варианте тканеспецифическим образом (такие как промоторы генов пируваткиназы). Они могут представлять собой также промоторы, реагирующие на определенные стимулы, например промоторы, связывающиеся с рецепторами стероидных гормонов. Можно использовать также вирусные промоторы, например промотор длинного концевого повтора (LTR) вируса мышиного лейкоза Молони (MMLV), или промоторы генов вируса герпеса.
Может оказаться предпочтительным использовать также такие индуцибельные промоторы, которые позволяют регулировать уровни экспрессии гетерологичного гена в течение жизненного цикла клетки. Индуцибельность означает, что можно регулировать контролируемые промотором уровни экспрессии.
Кроме того, любой из этих промоторов можно модифицировать путем введения дополнительных регуляторных последовательностей, например энхансерных последовательностей. Можно использовать также химерные промоторы, содержащие элементы последовательностей из двух или большего количества различных указанных выше промоторов. Кроме того, может оказаться целесообразным использовать области контроля локуса (LCR).
Гетерологичный ген, как правило, кодирует полипептид, предназначенный для терапевтических целей. NOI-последовательности по настоящему изобретению включают (но не ограничиваясь ими) следующие последовательности, которые можно применять для терапевтических и/или диагностических целей: последовательности, кодирующие цитокины, хемокины, гормоны, антитела, сконструированные иммуноглобулинподобные молекулы, одноцепочечное антитело, слитые протеины, ферменты, молекулы для иммунной костимуляции, иммуномодуляторные молекулы, антисмысловую РНК, трансдоминантный отрицательный мутант протеина-мишени, токсин, условный токсин, антиген, протеин - супрессор опухоли и факторы роста, мембранные протеины, вазоактивные протеины и пептиды, антивирусные протеины и рибозимы и их производные (такие, которые содержат связанную репортерную группу).
Примерами полипептидов, которые можно применять для терапевтических целей, являются нейротрофные факторы, такие как фактор роста нервной ткани (NGF), цилиарный нейротрофический фактор (CNTF), нейротрофический фактор головного мозга (BNTF) и нейтрофины (такие как NT-3, NT-4/5), которые потенциально можно применять в качестве терапевтических агентов для лечения неврологических заболеваний, таких как болезнь Паркинсона.
NOI, которые можно применять согласно настоящему изобретению для лечения или профилактики рака, включают NOI, кодирующие протеины, которые разрушают клетку-мишень (например, рибосомный токсин), действуют в качестве супрессоров опухоли (таких как р53 дикого типа); активаторов противоопухолевых иммунных механизмов (таких как цитокины, молекулы для иммунной костимуляции и иммуноглобулины); ингибиторы ангиогенеза; или протеины, которые усиливают чувствительность к лекарственным средствам (такие как ферменты, активирующие пролекарства); косвенным образом стимулируют разрушение клетки-мишени природными эффекторными клетками (например, сильный антиген, стимулирующий иммунную систему или превращающий субстанцию-предшественник в токсичную субстанцию, которая разрушает клетку-мишень (например, фермент, активирующий пролекарство)). Кодируемые протеины могут также разрушать присутствующие опухолевые клетки (например, с помощью секретируемого обладающего противоопухолевой активностью слитого протеина: антитело-рибосомный токсин), стимулировать косвенным образом разрушение присутствующих опухолевых клеток (например, цитокинами, стимулируя иммунную систему, или прокоагулянтными протеинами, вызывая местную закупорку сосудов) или превращать субстанцию-предшественник в токсичную субстанцию, которая разрушает присутствующие опухолевые клетки (например, фермент, активирующий пролекарство, превращая его в обладающее способностью к диффузии лекарственное средство).
Можно применять NOI, кодирующие антисмысловые транскрипты или рибозимы, которые оказывают воздействие на экспрессию клеточных или патогенных генов, например на экспрессию клеточных генов, обусловливающих персистентность к опухоли (например, в отношении аберрантных myc-транскриптов при лимфоме Беркитта или в отношении bcr-abl-транскриптов при хроническом миелоидном лейкозе). Можно применять также комбинации таких NOI.
Вместо этого или наряду с этим NOI или несколько NOI, если они избирательно экспрессируются в тканях-мишенях, можно использовать для кодирования фермента или ферментов, активирующего(их) пролекарство, которое не оказывает выраженного действия или не оказывает вредного действия до тех пор, пока индивидуума не обрабатывают одним или несколькими пролекарствами, на которые воздействуют фермент или ферменты. В присутствии активной NOI обработка индивидуума соответствующим пролекарством приводит к более значительному снижению роста опухоли или повышает выживаемость.
Для лечения рака фермент, активирующий пролекарство, можно вводить в область опухоли. В каждом случае для лечения пациента применяют необходимое пролекарство в сочетании с соответствующим активирующим пролекарство ферментом. Соответствующее пролекарство вводят в сочетании с вектором. Примерами пролекарств являются этопозидфосфат (в сочетании с щелочной фосфатазой); 5-флуорцитозин (в сочетании с цитозиндеаминазой); доксорубицин-N-пара-гидроксифеноксиацетамид (в сочетании с пенициллин-V-амидазой); пара-N-бис(2-хлорэтил)аминобензоилглутамат (в сочетании с карбоксипептидазой G2); цефалоспориновые азотные горчичные карбаматы (в сочетании с β-лактамазой); SR4233 (в сочетании с редуктазой Р450); ганцикловир (в сочетании с тимидинкиназой HSV); пролекарства на основе горчицы, содержащие нитроредуктазу и циклофосфамид (в сочетании с Р450).
Примерами ферментов, активирующих пролекарство, которые можно применять согласно изобретению, являются тимидинфосфорилаза, активирующая 5-флуорурациловые пролекарства капсетабин и фуртулон; тимидинкиназа вируса герпеса простого, активирующая ганцикловир; цитохром Р450, активирующий такое пролекарство, как циклофосфамид, с образованием агента, повреждающего ДНК; и цитозиндеаминаза, активирующая 5-флуорцитозин. Предпочтительно используют фермент, вырабатываемый в организме человека.
NOI могут также кодировать коровьи полипептиды, применяемые в качестве вакцин. Предпочтительно такие антигенные полипептиды получают из патогенных организмов, например из бактерий или вирусов. Примерами таких антигенных полипептидов являются антигены вируса гепатита С, поверхностные или ядерные антигены вируса гепатита В, антигены ВИЧ, токсин коклюша, токсин холеры или токсин дифтерии.
NOI могут включать также маркерные гены (например, кодирующие β-галактозидазу или зеленый флуоресцентный протеин) или гены, продукты которых регулируют экспрессию других генов (например, факторы, регулирующие транскрипцию).
В том случае, если заболевание вызывается дефектным геном, например, в случае кистозного фиброза, можно вводить NOI, кодирующие полный функционально активный аллель гена. В настоящее время выявлена причина различных генетических нарушений на молекулярном уровне и клонированы функциональные последовательности дикого типа. Для замены дефектного гена путем гомологичной рекомбинации может оказаться целесообразным включать в NOI фланкирующие последовательности для генов, применяемых для терапевтических целей, которые являются гомологичными соответствующим фланкирующим последовательностям генома.
Для осуществления генной терапии, а также для других целей может требоваться введение нескольких генов. При лечении различных состояний может оказаться предпочтительной экспрессия нескольких генов. Поскольку нет ограничений на размер NOI, которую можно встраивать в осуществляющий введение вектор или комплекс по изобретению, то может оказаться возможным осуществлять направленный перенос в клетки одновременно нескольких генов.
В. Катионные липиды
В данной области известно большое количество катионных липидов (см., например, заявку WO 95/02698, содержание которой включено в настоящее описание в качестве ссылки), некоторые из которых приведены ниже. Примеры структур катионных липидов, которые можно применять согласно настоящему изобретению, приведены в таблице 1 WO 95/02698. В целом в композициях и способах по изобретению можно применять любые катионные липиды как одновалентные, так и поливалентные. Как правило, предпочтительными являются поливалентные катионные липиды. Катионные липиды содержат насыщенную и ненасыщенную алкильную группу и алициклические простые и сложные эфиры аминов, амидов или их производных. Алкильные или алкеновые группы катионных липидов, имеющие прямую или разветвленную цепь, могут содержать от 1 до приблизительно 25 атомов углерода. Предпочтительными являются алкильные или алкеновые группы с прямой или разветвленной цепью, содержащие шесть или более атомов углерода. Алициклические группы могут содержать приблизительно 6-30 атомов углерода. Предпочтительно алициклические группы содержат холестерин или другие стероидные группы. Катионные липиды можно получать с использованием различных противоионов (анионов), включающих среди прочего хлорид, бромид, йодид, фторид, ацетат, трифторацетат, сульфат, нитрит и нитрат.
Широко известным катионным липидом является хлорид N-[1-(2,3-диолеилокси)пропил]-N,N, N-триметиламмоия(ДОТМА).
ДОТМА и аналогичный сложный диэфир ДОТАП (1,2-бис(олеилокси)-3-(триметиламмоний)пропан) имеются в продаже. Другие катионные липиды, имеющие сходную с ДОТАП структуру, описаны в патенте США 4897355, включенном в настоящее описание в качестве ссылки.
Другие группы катионных липидов. родственные ДОТМА и ДОТАП, которые можно применять согласно изобретению, обычно называют простыми DORI-эфирами или сложными DORI-эфирами. DORI-липиды отличаются от ДОТМА и ДОТАП тем, что в них одна из метильных групп в группе триметиламмония замещена гидроксиэтильной группой. Олеиловые группы DORI-липидов можно замещать другими алкильными или алкеновыми группами, такими как пальмитоиольная или стеароильная группы. Гидроксильную группу липидов DORI-типа можно использовать в качестве сайта для последующей функционализации, например для этерификации с образованием аминов, таких как карбоксиспермин.
Другие катионные липиды, которые можно применять в предназначенных для введения векторах или комплексах по настоящему изобретению, включают липиды, описанные в WO 91/15501 в качестве векторов, пригодных для трансфекции клеток.
Согласно настоящему изобретению можно применять также катионные стерольные производные, например 3β-[N-(N',N'-диметиламиноэтан)карбамоил]холестерин (DC-Chol), в котором холестерин связан с триалкиламмонийной группой. Имеются данные о том, что DC-Chol обеспечивает для одних и тех же линий клеток более эффективную трансфекцию и меньшую токсичность, чем липосомы, содержащие ДОТМА. Можно также применять полиаминовые производные DC-Chol, такие как описанные в WO 97/45442.
В предназначенных для введения векторах или комплексах по изобретению можно применять также поликатионные липиды, содержащие карбоксиспермин. В ЕР-А-304111 описан карбоксиспермин, содержащий катионные липиды, в том числе 5-карбоксиспермилглициндиоктадециламид (ДОГС) и дипальмитоилфосфатидилэтаноламин-5-карбоксиспермиламид (ДПФЭС). Другие катионные липиды можно получать путем замещения октадецильных и пальмитоильных групп ДОГС и ДПФЭС соответственно другими алкильными или алкеновыми группами.
В предназначенных для введения векторах или комплексах по изобретению катионные липиды необязательно можно объединять с некатионными вспомогательными липидами, предпочтительно нейтральными липидами, с образованием липосом или липидных агрегатов. Нейтральные липиды, которые можно применять согласно настоящему изобретению, включают среди прочего
лецитины; фосфатидилэтаноламины, такие как ДОФЭ (диолеилфосфатидилэтаноламин), ПОФЭ (пальмитоилолеилфосфатидилэтаноламин) и ДСФЭ (дистеароилфосфатидилэтаноламин); фосфатидилхолин; фосфатидилхолины, такие как ДОФХ (диолеилфосфатидилхолин), ДПФХ (дипальмитоилфосфатидилхолин), ПОФХ (пальмитоилолеилфосфатидилхолин) и ДСФХ (дистеароилфосфатидилхолин); фосфатидилглицерин; фосфатидилглицерины, такие как ДОФГ (диолеилфосфатидилглицерин), ДПФГ (дипальмитоилфосфатидилглицерин) и ДСФГ (дистеароилфосфатидилглицерин); фосфатидилсерины, такие как диолеоил- или дипальмитоилфосфатидилсерин; дифосфатидилглицерины; эфиры жирных кислот; сложные эфиры глицерина; сфинголипиды; кардолипин; цереброзиды и церамиды; и их смеси. Нейтральные липиды включают также холестерин и другие 3DОН-стеролы.
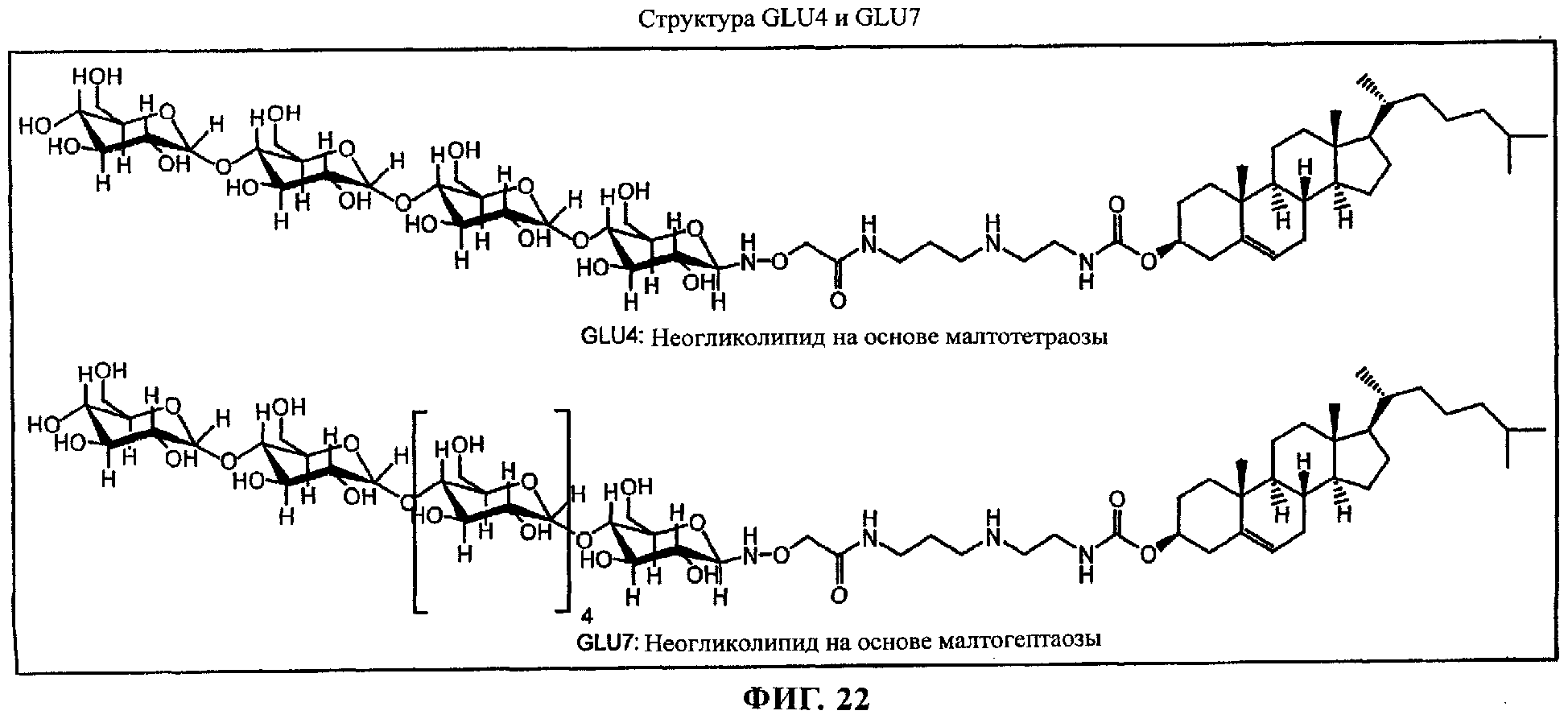
Кроме того, в предназначенные для введения вектор или комплексы по изобретению необязательно можно включать одно или несколько амфифильных соединений для модификации их поверхностных свойств. Амфифильные соединения, которые можно применять согласно настоящему изобретению, включают среди прочего неогликолипиды, такие как GLU4 и GLU7, приведенные на фиг 22, полиэтиленгликольные липиды, такие как N-(ω-метокси(полиоксиэтилен)оксикарбонил)фосфатидилэтаноламин, N-монометокси(полиоксиэтилен)сукцинилфосфатидилэтаноламин и простой эфир полиоксиэтилена и холестерина; неионогенные поверхностно-активные вещества, такие как алкилгликозиды, алкилметилглюкамиды, сложные эфиры сахарозы, простые алкиловые эфиры полиглицерина, простые алкиловые эфиры полиоксиэтилена и простые алкиловые эфиры сорбитана и оксиэтилена и стероидные простые эфиры оксиэтилена; блок-сополимеры, такие как блок-сополимеры полиоксиэтилена и полиоксипропилена.
Согласно одному из вариантов осуществления катионный липид по настоящему изобретению модифицируют с помощью фрагмента сахара или фрагмента полиэтиленгликоля (ПЭГ). Еще одним объектом изобретения является комплекс по изобретению, дополнительно содержащий соединение, обладающее способностью функционировать в качестве катионного липида, причем соединение содержит холестериновую группу, присоединенную с помощью аминогруппы, фрагмента сахара или полиэтиленгликолевого фрагмента. Как это продемонстрировано в примерах, при создании изобретения было установлено, что наиболее предпочтительно применять катионные липиды, модифицированные с использованием сахара/ПЭГ. Таким образом, еще одним объектом настоящего изобретения является соединение, обладающее способностью функционировать в качестве катионного липида, где соединение содержит холестериновую группу, присоединенную с помощью аминогруппы, фрагмента сахара или полиэтиленгликолевого фрагмента. Предпочтительно соединение содержит 1-7 остатков сахара или остатков полиэтиленгликоля. Соединение может содержать смесь остатков сахара и остатков полиэтиленгликоля. Предпочтительно фрагмент сахара представляет собой глюкозу, или D-глюкозу, или является ее производным.
Г. Комплексы катионный липид/NOI/упаковывающий полипептид
Предназначенный для введения вектор/комплекс по настоящему изобретению, как правило, получают, осуществляя сначала контакт упаковывающего полипептида с NOI в стерильной пробирке в течение приблизительно 10 мин при комнатной температуре, в результате чего образуется конденсированный комплекс полипептид/NOI. Стандартный метод состоит в том, что в пробирке наносят параллельно друг другу пятна нуклеиновой кислоты и протеина, которые не контактируют друг с другом, и затем инициируют смешение путем добавления нескольких сотен микролитров жидкого носителя, такого как фармацевтически приемлемый носитель, эксципиент или разбавитель.
Еще одним предпочтительным способом получения, предназначенным для введения вектора/комплекса по настоящему изобретению, является приведение упаковывающего полипептида в контакт с NOI путем непрерывного вращения.
Как правило, используют соотношение NOI и полипептида, составляющее по меньшей мере 1:1, предпочтительно от 1:1 до 2:1, более предпочтительно от 1,4:1 до 1, 9:1, наиболее предпочтительно от 1,5:1 до 1,8:1. При создании изобретения было установлено, что наиболее эффективно использовать соотношение NOI и полипептида, составляющее приблизительно 1:0, 6(˜1,7:1). В некоторых вариантах осуществления изобретения обычно используется соотношение полипептида к NOI от 0,2 до 1,5, предпочтительно от 0,3 до 1,2 (мас./мас.), более предпочтительно от 0, 2 до 0,7. В других вариантах осуществления соотношение полипептида и NOI обычно составляет по меньшей мере 10:1 или по меньшей мере 20:1 (мас./мас.). Однако оптимальное соотношение может зависеть от соотношения заряд:количество аминокислоты в упаковывающем полипептиде. Как правило чем ниже соотношение заряд:количество аминокислот, тем более высокое соотношение полипептид:NOI следует использовать.
Затем в комплекс добавляют катионные липиды. Согласно одному из вариантов осуществления катионные липиды могут представлять собой часть заранее сформированных липосом, включающую два или несколько липидных компонента, таких как DC-Chol и ДОФЭ. Катионные липиды обычно инкубируют с комплексом полипептид/NOI в течение приблизительно 20 мин при комнатной температуре. Еще один и предпочтительный метод добавления катионных липидов представляет собой добавление в виде суспензии катионных липосом. Такой конечный комплекс с добавлением 10% сахарозы (мас./мас.) можно хранить до применения при температуре приблизительно -80°С.
Соотношение количества липосом и NOI обычно составляет приблизительно от 3:1 до 20:1, предпочтительно от 6:1 до 15:1, более предпочтительно от 8:1 до 14:1. При создании изобретения было установлено, что наиболее предпочтительное соотношение количества липосом и NOI составляет 12:1. В других вариантах осуществления соотношение количества липосом и NOI обычно составляет приблизительно от 2:1 до 10:1 или от 3:1 до 6:1. Если катионные липиды применяют в сочетании с нейтральными липидами, то соотношение как правило составляет приблизительно 1:1.
В наиболее предпочтительном варианте соотношение количеств липосомы:NOI:полипептид составляет 3-20:1:0,5-1, предпочтительно 8-14:1:0,5-0,7, более предпочтительно ˜12:1:˜6.
После этого предназначенный для введения вектор/комплекс готов к применению. Хотя предпочтительно смешивать различные компоненты в указанном выше порядке, можно объединять компоненты в произвольном порядке. Если необходимо добавлять другие полипептидные компоненты, то их можно добавлять на любой стадии, однако предпочтительно добавлять в сочетании с упаковывающим полипептидом.
Может оказаться целесообразным включать в состав векторов/комплексов другие компоненты, например лиганды, которые осуществляют связывание с рецепторами на поверхности клеток, для того, чтобы придать векторам/комплексам определенную степень избирательности в отношении типа клеток. Лиганды включают пептиды, гликопротеины, олигосахариды, лектины и антитела и их фрагменты.
Д. Введение
Для получения фармацевтической композиции (которую можно применять для человека или животного) предназначенный для введения вектор/комплекс по изобретению предпочтительно объединяют с фармацевтически приемлемым носителем или разбавителем. Пригодные носители и разбавители включают изотонические соляные растворы, например забуференный фосфатом соляной раствор. Композицию по изобретению можно вводить непосредственно путем инъекции. Композицию можно приготавливать в форме, пригодной для парентерального, внутримышечного, внутривенного, подкожного, интраокулярного или трансдермального введения или введения путем ингаляции. Как правило, каждую NOI можно вводить в дозе, составляющей от 10 нг до 10 мкг/кг веса тела, предпочтительно от 0,1 до 10 мкг/кг, более предпочтительно от 0,1 до 1 мкг/кг веса тела.
В альтернативном варианте трансфекцию клеток пациента можно осуществлять ex vivo путем выделения ткани пациента, осуществления ее трансфекции с использованием предназначенного для введения вектора/комплекса по изобретению, и последующей повторной имплантации трансфектированной ткани.
Описанные пути введения и дозы приведены только в качестве примера, поскольку специалист в данной области может легко определять оптимальный путь введения и дозы для конкретного пациента и состояния.
Е. Применение
Предназначенные для введения векторы/комплексы по настоящему изобретению можно применять для осуществления эффективной трансфекции NOI эукариотических клеток, в частности клеток млекопитающих. Было установлено, что предназначенные для введения векторы/комплексы более эффективны по сравнению с существующими композициями для трансфекции нервных клеток. Их можно применять конкретно для (I) научных исследований, в которых используются нервные клетки, и (II) в клинической практике, когда необходимо осуществлять введение NOI в клетки центральной или периферической нервной системы человека или животного. Более конкретно предназначенные для введения векторы/комплексы по настоящему изобретению могут найти применение в областях, связанных с введением NOI, таких как генная терапия, введение ДНК-вакцины и исследования, связанные с трансфекцией in vitro.
Примерами заболеваний, которые можно лечить с использованием комплексов/векторов по изобретению, являются заболевания периферической или центральной нервной системы, такие как нейродегенеративные заболевания и нарушения нервной ткани в результате повреждения/травмы (в том числе вследствие «ударов»). Нейродегенеративные заболевания включают, в частности, прогрессирующую мышечную атрофию, некоторые врожденные заболевания, такие как семейная вегетативная дисфункция и спинальная мышечная атрофия детей раннего возраста, а также наступающие в позднем возрасте нейродегенеративные заболевания, такие как болезни Паркинсона и Альцгеймера.
Предназначенные для введения векторы/комплексы по изобретению можно использовать также для введения в терапевтических целях генов пациенту, страдающему злокачественным заболеванием. Примерами злокачественных заболеваний, которые можно лечить таким образом, являются рак молочной железы, шейки матки, ободочной кишки, прямой кишки, эндометрия, почки, легкого, яичника, поджелудочной железы, предстательной железы, кожи, желудка, мочевого пузыря, ЦНС, пищевода, головы или шеи, печени, яичек, тимуса или щитовидной железы. Объектом лечения могут являться также злокачественные заболевания кровяных клеток, клеток костного мозга, В-лимфоцитов, Т-лимфоцитов, предшественников лимфоцитов или предшественников миелоидных клеток.
Опухоль может представлять собой твердую опухоль или нетвердую опухоль, и она может являться основной опухолью или диссеминированной метастатической (вторичной) опухолью. Нетвердые опухоли включают миелому; лейкоз (острый или хронический, лимфозный или миеломный), такой как острый миелобластный, острый промиелозный, острый миеломоноцитарный, острый моноцитарный лейкоз, эритролейкоз; и лимфомы, такие как лимфома Ходжкина, неходжкинская лимфома и лимфома Беркитта. Твердые опухоли включают карциному, карциному ободочной кишки, мелкоклеточную карциному легкого, немелкоклеточную карциному легкого, аденокарциному, меланому, базально-клеточную или плоскоклеточную карциному, мезотелиому, нейробластому, глиому, астроцитому, медуллобластому, ретинобластому, саркому, остеосаркому, рабдомиосаркому, фибросаркому, остеогенную саркому, гепатому и семиному.
К другим представляющим интерес заболеваниям относятся заболевания, вызываемые мутациями (врожденными или соматическими) нормальных клеточных генов, такие как кистозный фиброз, талассемии и т.п.
Другие представляющие интерес области применения включают лечение связанных с иммунной системой нарушений, таких как отторжение трансплантата органа и аутоиммунные заболевания. Спектр аутоиммунных заболеваний охватывает как специфические для органа заболевания (такие как тиреоидит, инсулит, рассеянный склероз, иридоциклит, увеит, орхит, гепатит, болезнь Аддисона, тяжелая псевдопаралитическая миастения), так и системные болезни, такие как ревматоидный артрит и другие ревматические заболевания, или системная красная волчанка. К другим нарушениям относятся иммунная гиперреактивность, например аллергические реакции, в частности, связанные с производством гистамина, и астма.
Ниже изобретение более подробно пояснено с помощью примеров, которые приведены только с целью иллюстрации и не служат для ограничения объема изобретения.
Описание чертежей
На фиг.1 приведено изображение пластины;
на фиг.2 приведен график;
на фиг.3 приведено изображение пластины;
на фиг.4 приведен график;
на фиг.5 приведен график;
на фиг.6 приведен график;
на фиг.7 приведен график;
на фиг.8 приведен график;
на фиг.9 приведены структуры;
на фиг.10 приведен график;
на фиг.11 приведен график;
на фиг.12 приведен график;
на фиг.13 приведен график;
на фиг.14 приведен график;
на фиг.15 приведен график;
на фиг.16 приведено изображение пластины;
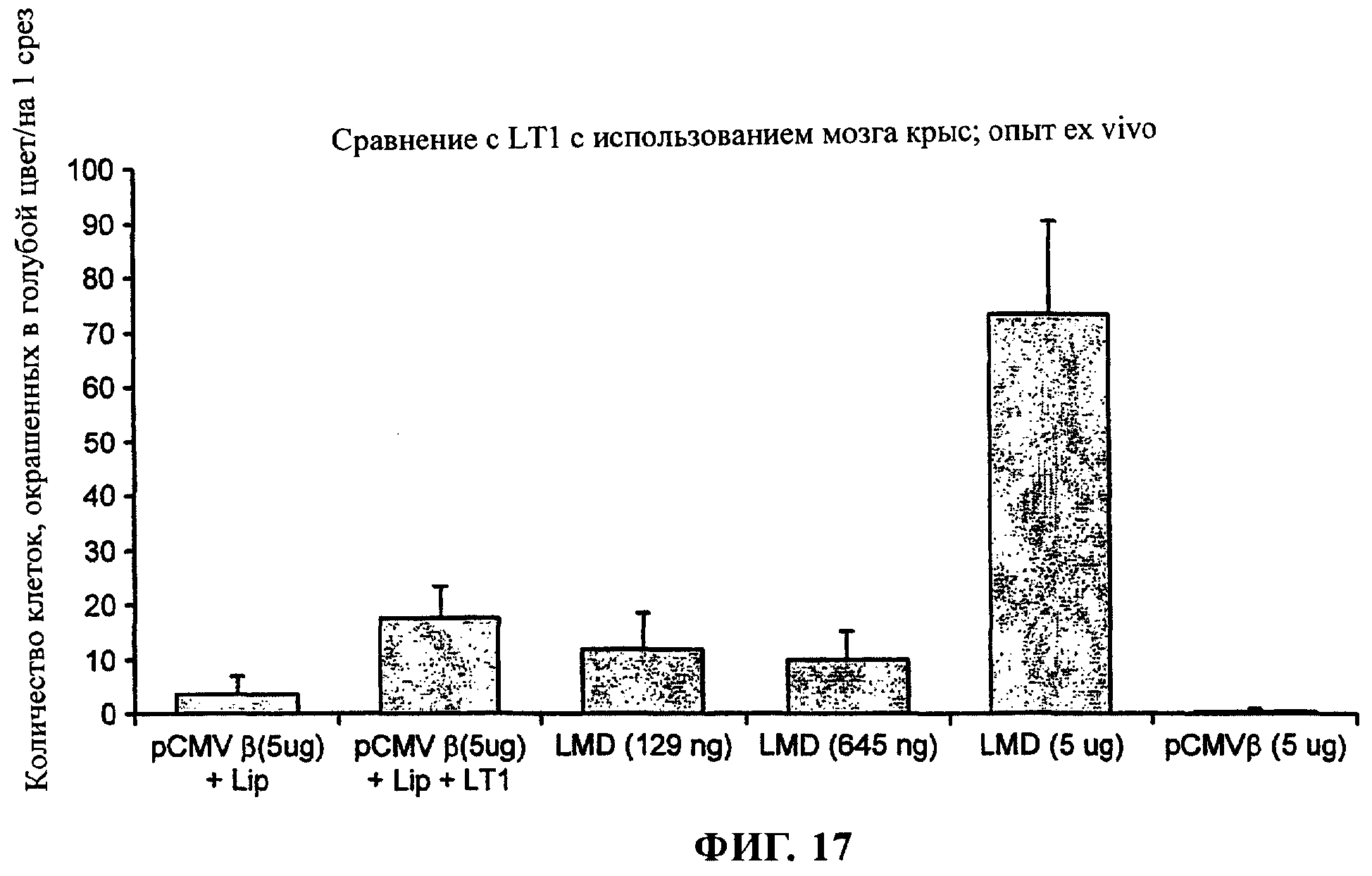
на фиг.17 приведен график;
на фиг.18 приведен график;
на фиг.19 приведена структура;
на фиг.20 приведена реакционная схема;
на фиг.21 приведена реакционная схема;
на фиг.22 приведена структура;
на фиг.23 представлен принцип включения мицелл;
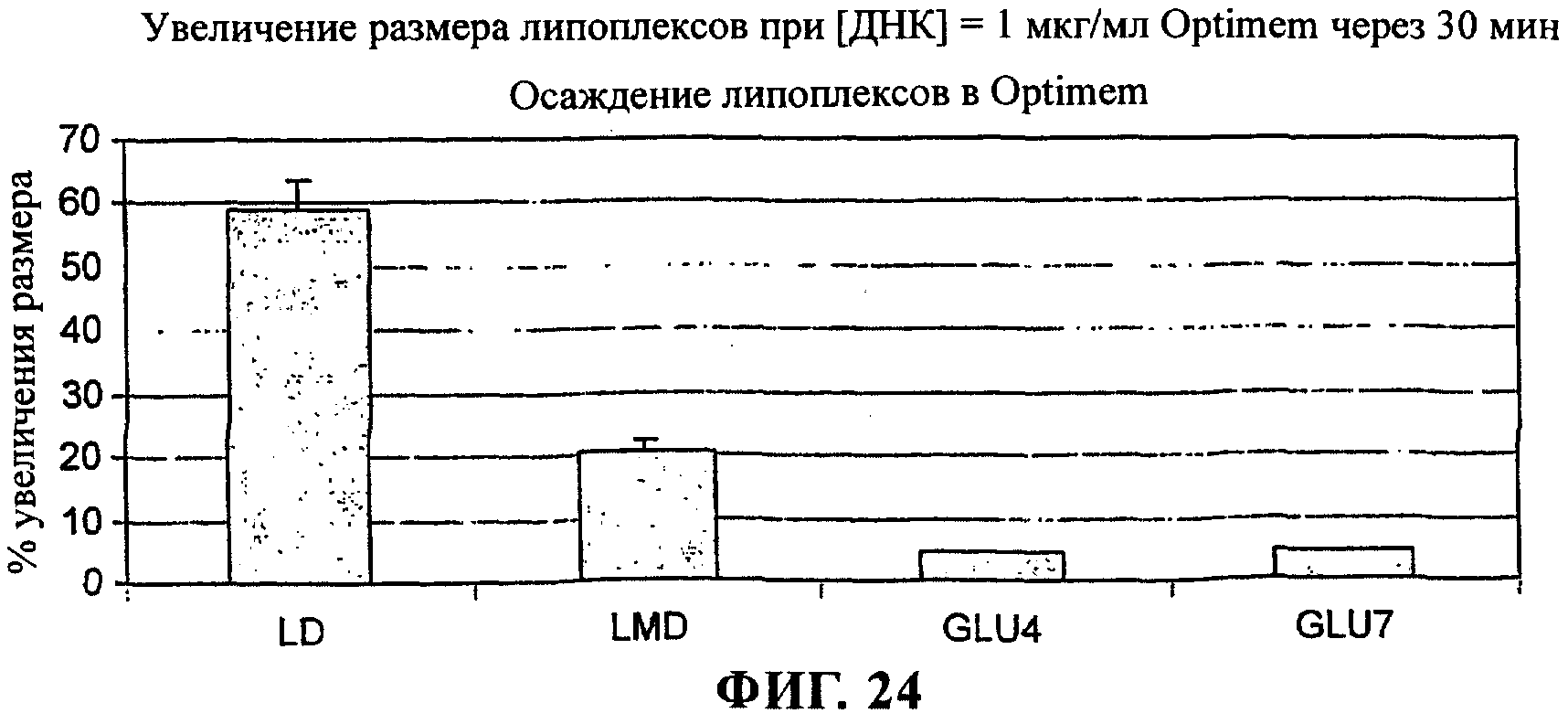
на фиг.24 приведен график;
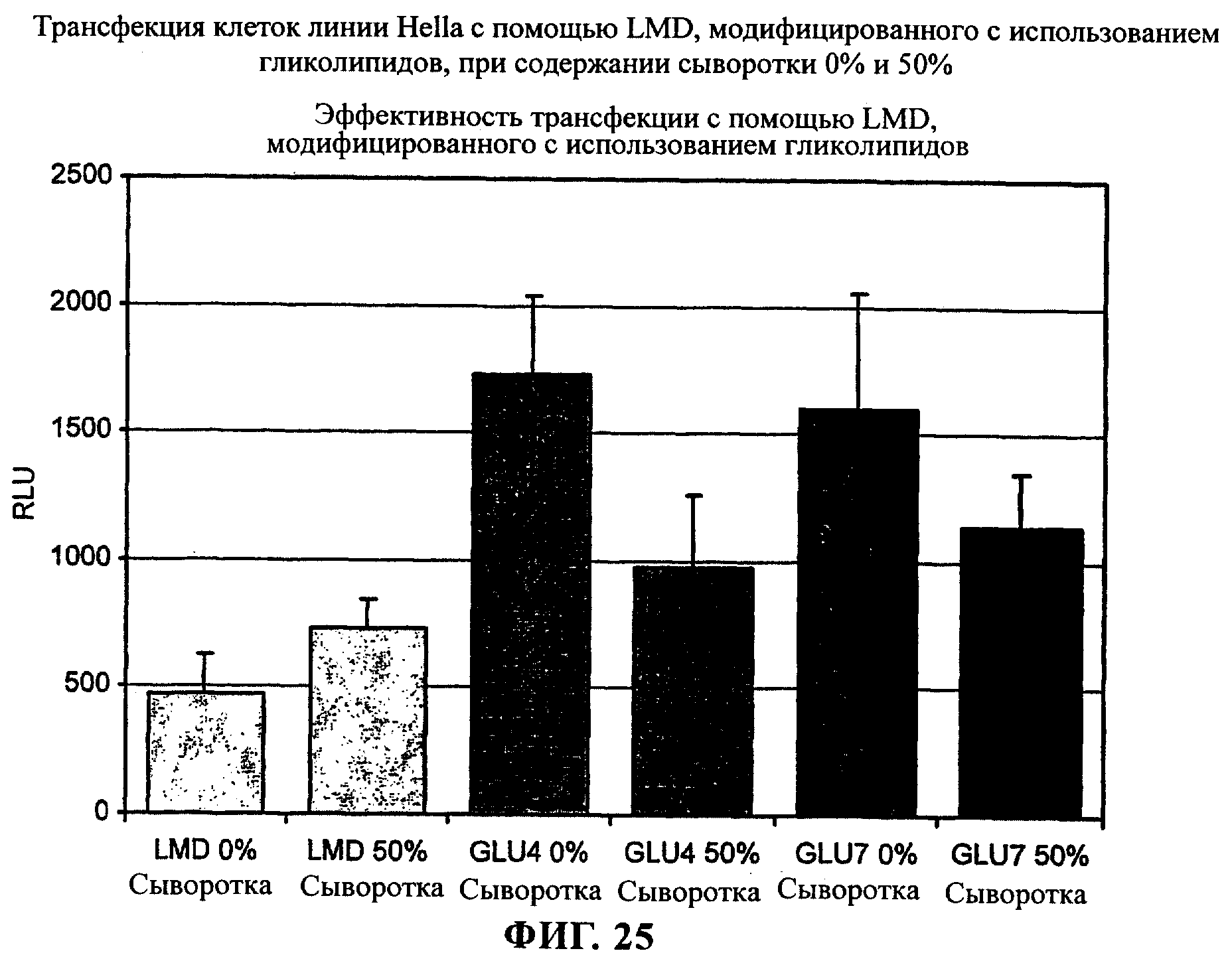
на фиг.25 приведен график.
Подробное описание чертежей 1-6
Фиг.1 - Аденовирусный коровий протеин Mu1 обладает большей эффективностью в отношении связывания с плазмидной ДНК (пДНК). чем коровий протеин Vp1 вируса полиомы.
A) Присутствие БСА (бычий сывороточный альбумин) не оказывало влияния на электрофоретическую подвижность пДНК. Один микрограмм pCMVβ инкубировали с 0 мкг (полоса 2), 5 мкг (полоса 3), 10 мкг (полоса 4), 15 мкг (полоса 5), 20 мкг (полоса 6), 25 мкг (полоса 7) и 30 мкг (полоса 8) БСА в течение 10 мин при комнатной температуре в 1×HBS. Затем образцы анализировали в 1%-ном агарозном геле в отношении изменения подвижности. Не было выявлено никаких изменений электрофоретической подвижности при добавлении БСА.
Б) В отличие от БСА пептид Mu1 оказывал сильное влияние на подвижность пДНК. Аналогично методу, описанному в разделе A, pCMVβ (1 мкг) инкубировали с 0,25 мкг (полоса 2), 0,5 мкг (полоса 3), 1 мкг (полоса 4), 2 мкг (полоса 5), 4 мкг (полоса 6), 6 мкг (полоса 7) и 0 мкг (полоса 8) рекомбинантного пептида. Хотя при соотношении количества протеина и пДНК, равном 0,25 (мас./мас.) (полоса 2), подвижность релаксированной формы pCMVβ не изменялась (верхняя полоса), наблюдалась небольшое замедление подвижности суперспиральной пДНК (нижняя полоса). Однако при соотношениях указанных количеств, равных или превышающих 0,5 (мас./мас.), миграция обеих форм пДНК существенно замедляется.
B) Протеин Vp1 вируса полиомы обладал намного меньшей эффективностью в отношении снижения подвижности пДНК. PCMVβ (1 мкг) инкубировали с 2 мкг (полоса 2), 4 мкг (полоса 3), 6 мкг (полоса 4), 8 мкг (полоса 5), 16 мкг (полоса 6), 32 мкг (полоса 7) и 0 мкг (полоса 8) Vp1. Только при соотношениях протеин: пДНК (мас./мас.), равных или превышающих 6, наблюдалось существенное замедление подвижности суперспиральной рДНК (полоса 6, нижняя зона). Равным образом, до тех пор, пока указанное соотношение не достигало 32 (мас./мас.), не наблюдалось влияния не миграцию релаксированной формы рДНК (полоса 7, верхняя зона). Для всех описанных гель-электрофоретических опытов полоса 1 соответствовала ДНК-маркеру длиной 1 т.п.н (фирма BRL).
Фиг.2 - β-Галактозидазная активность в клетках линии ND7, трансфектированных комплексами пДНК-Mu1-катионная липосома
Клетки линии ND7 высевали с плотностью 5×104 клеток/лунку в 24-луночные культуральные планшеты за 24 ч до осуществления трансфекции.
Непосредственно перед трансфекцией клетки промывали бессывороточной средой. Комплексы получали путем совместной инкубации pCMVβ и Mu1 и последующего добавления катионной липомы DC-Chol/ДОФЭ. Для каждого варианта 1 мкг pCMVβ объединяли с 0,6, 6, 12 и 21 мкг пептида Mu1. После этого каждую из указанных комбинаций объединяли с 3, 4 и 6 мкг DC-Chol/ДОФЭ. Клетки линии ND7 приводили в контакт с предназначенными для трансфекции комплексами в течение 2 ч, после чего выдерживали при 37°С в атмосфере, содержащей 5% CO2, еще в течение 24 ч, после чего их собирали и обрабатывали для анализа β-галактозидазной активности. Приведенные данные представляют собой средние значения ± С.К.О., n=3.
Фиг.3 - Mu1 увеличивает опосредуемую катионными липосомами эффективность трансфекции линии нервных клеток ND7.
Нейроны линии ND7 высевали в 24-луночные культуральные планшеты с плотностью 4×104 клеток/лунку и выращивали в течение 24 ч. Затем недифференцированные нейроны линии ND7 трансфектировали либо только pCMVβ (А), либо pCMVβ, объединенной в комплекс с DC-Chol/ДОФЭ (1/3, мас./мас.) (Б), либо pCMVβ, объединенной в комплекс с Mu1 и DC-Chol/ДОФЭ (1/12/6) (В). Через 48 ч клетки фиксировали и обрабатывали для осуществления обнаружения X-Gal гистохимическим методом. Как видно на панели В, включение Mu1 в комплекс в оптимальном соотношении приводило к существенному увеличению количества X-Gal-позитивных клеток (окрашены в синий цвет).
Фиг.4 - Mu1 обладает большей эффективностью в отношении усиления опосредуемой катионными липосомами трансфекции клеток линии ND7, чем Vp1.
ДНК плазмиды pCMVβ объединяли в комплекс с различными количествами поликатионного пептида и затем смешивали с катионными липосомами в соотношении 1:3 (pCMVβ:липосомы; мас./мас.). После быстрой промывки бессывороточными средами клетки линии ND7 приводили в контакт с комплексами липосома-поликатион-липосома в течение 2 ч и затем снова помещали в бессывороточные среды. Через 24 ч клетки собирали и обрабатывали для выявления β-галактозидазной активности. Каждый вариант условий воспроизводили в трех повторностях и каждый эксперимент повторяли три раза. Данные представляют собой средние значения ± С.К.О.
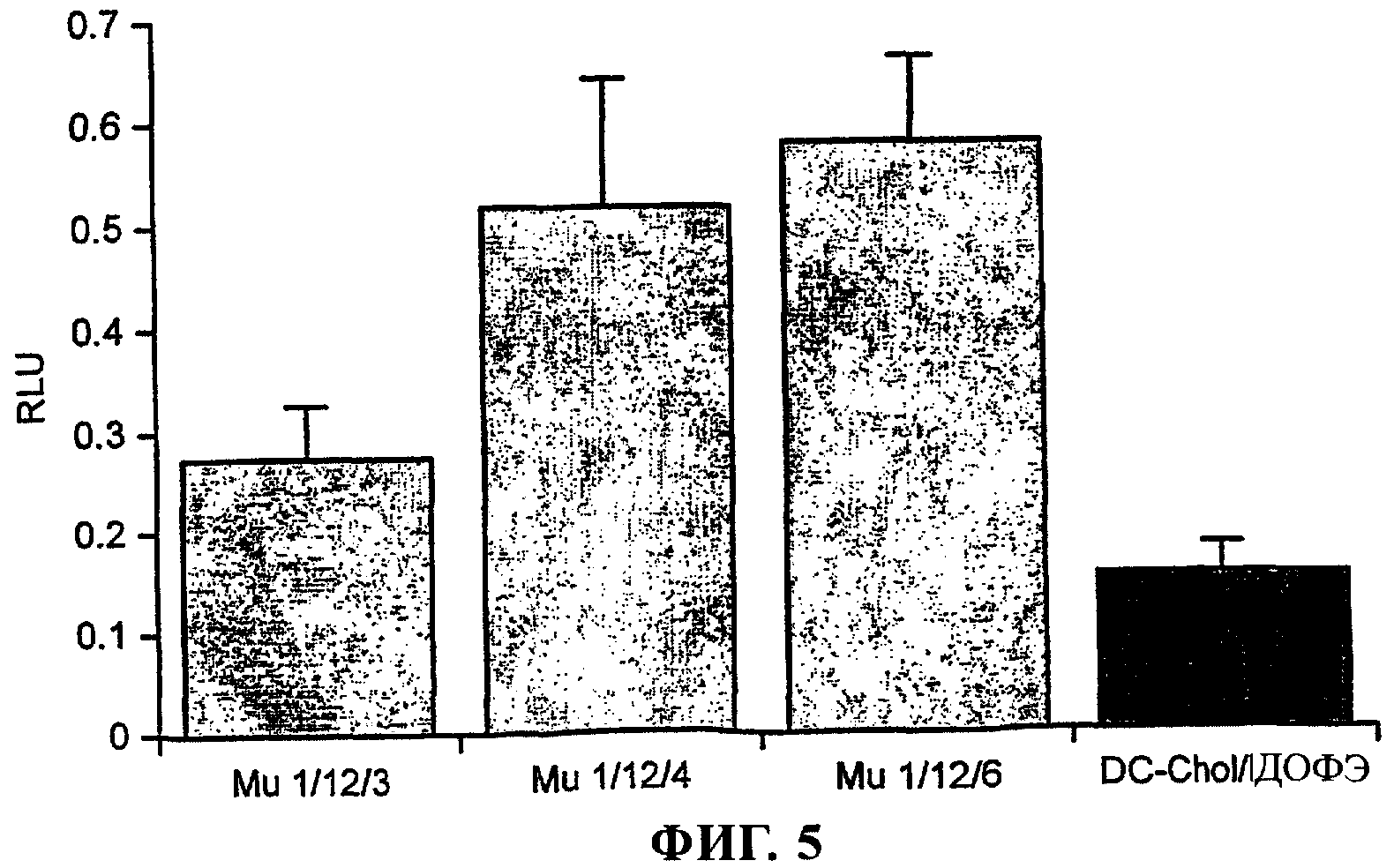
Фиг.5 - Mu1 усиливает опосредуемую DC-Chol/ДОФЭ трансфекцию клеток линии COS-7
Клетки COS высевали с плотностью, обеспечивающей 60-80%-ную конфлюэнтность, в 24-луночные культуральные планшеты за 24 ч до осуществления трансфекции. Непосредственно перед трансфекцией клетки промывали бессывороточной средой. Путем инкубации pCMVβ совместно с Mu1 и последующего добавления катионной липосомы DC-Chol/ДОФЭ получали комплексы, позволяющие осуществлять трансфекцию клеток. Для каждого варианта 1 мкг pCMVβ объединяли в комплекс с 12 мкг пептида Mu1, который, как было установлено, является оптимальным для клеток линии ND7. После этого комплексы pCMVβ :Mu1 смешивали с 3, 4 и 6 мкг DC-Chol/ДОФЭ. Клетки COS приводили в контакт с предназначенными для трансфекции комплексами в течение 2 ч, после чего выдерживали при 37°С в атмосфере, содержащей 5% СО2, еще в течение 24 ч, после чего их собирали и обрабатывали для проведения анализа β-галактозидазной активности. Приведенные данные представляют собой средние значения ± С.К.О., n=3.
Фиг.6 - Эффективность трансфекции дифференцированных клеток линии ND7 с помощью комплексов pCMVβ-Mu1-катионная липосома
Клетки линии ND7 высевали в 24-луночные культуральные планшеты с плотностью 4×104 клеток/лунку в нормальную среду для роста (содержащую сыворотку). Через 24 ч среду заменяли средой для дифференцировки и клетки выращивали еще в течение 24 ч. Использовали три различные среды для дифференцировки: бессывороточную среду (-сыворотка), нормальную среду для роста, дополненную 1 мМ цАМФ (среда цАМФ), или среду, содержащую пониженное количество сыворотки (0,5%), дополненную 1 мМ цАМФ и 50 нг/мл фактора роста нервной ткани (NGF). Затем клетки трансфектировали pCMVβ, объединенной в комплекс либо только с DC-Chol/ДОФЭ, либо с Mu1 и DC-Chol/ДОФЭ. Спустя 48 ч клетки фиксировали и обрабатывали для гистохимического анализа с целью выявления X-Gal и оценивали процент позитивных клеток. Во всех случаях присутствие Mu1 приводило к увеличению количества позитивных клеток.
Представляет интерес тот факт, что количество трансфектированных клеток как в присутствии Mu1, так и без него, оказывалось большим в том случае, если клетки выращивали в присутствии цАМФ.
Примеры
Материалы и методы
Синтез пептидов
Пептиды Vp1 и Mu1 синтезировали с помощью твердофазного синтезатора пептидов типа Shimadzu PSSM-8 с использованием 5-кратного избытка L-аминокислот, имеющих защитные группы Fmoc ((9-фторенил)метоксикарбонил) (фирма Novabiochem), и реагентов FastMoc™ (гексафторфосфат/гидроксибензотриазол 2-(1Н-бензотриазол-1-ил)-1,1,3,3-тетраметилурония (ГБТУ/ГОБТ) (фирма Advanced Chemical Europe) в качестве агента для осуществления амидного сочетания. После отщепления от смолы и удаления защитных групп осуществляли обессоливание путем гель-фильтрации с использованием колонки типа Р2 Biogel (2×28 см; фирма Biorad), присоединенной к системе для жидкостной экспресс-хроматографии белков (FPLC) (фирма Amersham Pharmacia Biotech, Великобритания), с использованием в качестве элюента 0,1%-ного водного раствора ТФК (трифторуксусная кислота) при скорости потока 0,5-0,75 мл/мин. Окончательную очистку с помощью препаративной хроматографии с обращенной фазой осуществляли на колонке типа Vydac (С 18, 5 мкм, 2×25 см; фирма Hichrom), присоединенной к системе для ЖХВР типа Gilson (фирма Anachem). Пептиды элюировали при скорости потока 5 мл/мин с использованием линейного градиента ацетонитрила в 0, 1%-ном водном растворе ТФК и наблюдение за процессом элюирования осуществляли при длине волны 220-230 нм.
Пептид Vp1 получали с использованием суперкислотной лабильной смолы, предварительно загруженной L-Pro-2-хлортритилом (фирма Novabiochem) (100 мг, 1,05 ммоля/г, 0,1 ммоля). Для того чтобы включить все аминокислотные остатки от шестого (Lys) до N-концевого остатка, использовали более продолжительные промежутки времени для осуществления реакции сочетания. После автоматического удаления N-концевой защитной группы Fmoc с помощью пиперидина (20 об.%) в диметилформамиде смолу выделяли, промывали диметилформамидом (10 мл) и метанолом (15 мл), после чего сушили в вакууме. Неочищенный пептид отщепляли от смолы с использованием охлажденной на льду ТФК (8 мл), содержащей фенол (7% мас./об.), этандитиол (2 об.%), тиоанизол (4 об.%) и воду (4 об.%) (обозначена как смесь А), и затем осаждали с помощью охлажденного на льду метил-трет-бутилового эфира (МТБЭ) (30 мл). Затем образовавшиеся пеллеты обессоливали и неочищенную пептидную смесь очищали с помощью ЖХВР с обращенной фазой. После элюирования фракции, содержащие целевой пептид (элюирование осуществляли с использованием ацетонитрила 68,5 об.%), объединяли и лиофилизировали, получая пептид в виде порошка белого цвета. Общий выход: 32 мг (15 мкмолей, 15%); МС (MALDI-TOF) C85 H151N26O26S3: [M+H]+, рассчитано 2049,5, обнаружено 2050,2. Последовательность проверяли путем анализа состава аминокислот и анализа последовательности. По данным анализа с использованием ЖХВР гомогенность составляла >95%.
Пептид Mu1 получали с использованием смолы Gly-Wang (фирма Novabiochem) (40 мг, 0,67 ммоля/г, 0,03 ммоля). В этом процессе использовали обычные промежутки времени для осуществления реакции сочетания. После автоматического удаления согласно описанному выше методу N-концевой защитной группы Fmoc смолу выделяли, промывали дихлорметаном (20 мл) и метанолом (20 мл), после чего смолу сушили в вакууме. Неочищенный пептид отщепляли от смолы с использованием смеси А (8 мл) и осаждали с помощью МТБЭ (30 мл), полностью следуя описанному выше процессу. В завершение неочищенную пептидную смесь обессоливали и очищали с помощью ЖХВР с обращенной фазой. После элюирования фракции, содержащие целевой пептид (элюирование осуществляли с использованием ацетонитрила, 17,2%), объединяли и лиофилизировали, получая пептид в виде порошка белого цвета. Общий выход: 65 мг (26 мкмолей, 80%); МС (ES) C95H170N52O21S2: [M+H]+, рассчитано 2440,7, обнаружено 2440,6. По данным анализа с использованием ЖХВР гомогенность составляла >95%.
Анализ связывания ДНК
Очищенные пептиды восстанавливали в стерильной дистиллированной Н2O до концентрации 3 мг/мл. Пептид и пДНК объединяли в комплекс в 20 мкл забуференного HEPES физиологического раствора (137 мМ NaCl, 5 мМ KCl, 0,75 мМ Na2HPO4, 19 мМ HEPES, рН 7,4) в течение 20 мин при комнатной температуре. Затем комплексы пептид:пДНК анализировали с помощью электрофореза на агарозном геле (1%). Контрольные инкубации для оценки обычных макромолекулярных взаимодействий пДНК осуществляли с использованием различных количеств бычьего сывороточного альбумина, имеющего достаточную для применения в области молекулярной биологии чистоту (фирма Sigma).
Клеточные культуры
ND7 представляет собой хорошо изученную линию клеток, полученную путем слияния клеток нейробластомы (N18Tg2) с сенсорными нейронами новорожденных крыс [28]. Линию клеток поддерживали в нормальной среде для роста (NGM) (среда Лейбовица L-15 (фирма BRL), дополненная 10% фетальной бычьей сыворотки (фирма BRL), 4 г/л глюкозы, 4 г/л бикарбоната натрия (фирма BRL), 100 мед/мл пенициллина/стрептомицина (фирма BRL)) при 37°С в атмосфере, содержащей 5% CO2. Клетки высевали в 24-луночные планшеты (фирма Costar) с такой плотностью, которая обеспечивала через 24 ч 70%-ную конфлюентность.
Дифференцировку клеток линии ND7 осуществляли с помощью трех описанных ранее методов [28, 29]. Клетки линии ND7 высевали в NGM с плотностью 4×104 клеток на лунку в 24-луночные культуральные планшеты (фирма Nunc). Через 24 ч среду заменяли либо а) NGM, дополненной 1 мМ циклическим аденозин-3':5'монофосфатом (цАМФ; фирма Sigma), либо б) бессывороточной средой для дифференцировки (50% среды Хама F12, 50% DMEM, 5 мкг/мл трансферрина, 250 нг/мл инсулина, 0,3 мкМ селенит натрия) или в) средой для фактора роста нервной ткани (NGF) с низким содержанием (среда L-15, дополненная 2 мМ глутамином, 4 г/л глюкозы, 4 г/л бикарбоната натрия, 10 ед./мл пенициллина, 10 г/мл стрептомицина, 0,5% ФТС, 1 мМ цАМФ, 50 нг/мл NGF (фирма Alomone Labs)). Дифференцированные клетки линии ND7 перед осуществлением трансфекции выращивали в соответствующей среде в течение 24 ч при 37°С в атмосфере, содержащей 5% СО2.
Клетки линии COS-7 (полученные из почки зеленой мартышки) выращивали в среде RPMI 1640 (фирма BRL), дополненной 10% фетальной бычьей сыворотки (фирма BRL) и 100 ед./мл пенициллина/стрептомицина (фирма BRL).
Плазмидные конструкции
Все трансфекции осуществляли с использованием репортерной плазмиды pCMVβ (фирма Clontech, Пало Альта, штат Калифорния), которая содержит полноразмерную последовательность β-галактозидазы Е.coli, расположенную по ходу транскрипции относительно непосредственного раннего промотора/энхансера человеческого цитомегаловируса (фирма Clontech). Линии плазмидной ДНК получали с помощью стандартного метода молекулярного клонирования и очищали с использованием не содержащей эндотоксин системы очистки плазмид фирмы Qiagen (фирма Qiagen, Доркинг, Великобритания).
Липосомы
Липосомы DC-Chol/ДОФЭ получали согласно описанному выше методу [30, 31]. В целом метод состоял в том, что к продистиллированному перед опытом СН2Cl2 (5 мл) добавляли в атмосфере азота 6 мкмолей DC-Chol и 4 мл ДОФЭ (в виде раствора с концентрацией 10 мг/мл в CH2Cl2). К смеси добавляли 5 мл 20 мМ Hepes (pH 7,8) и ее облучали ультразвуком в течение 3 мин. Органические растворители удаляли при пониженном давлении и образовавшуюся суспензию липосом облучали ультразвуком еще в течение 3 мин. Липосомные препараты хранили при 4°С.
Протокол трансфекции
Поскольку в первых экспериментах было установлено, что присутствие фетальной бычьей сыворотки ингибирует трансфекцию клеток линии ND7, то для всех вариантов трансфекции использовали бессывороточную среду для дифференцировки. На дно стерильного контейнера типа Bijou (фирма Bibby Sterlin Ltd., Стаффордшир, Великобритания) помещали различные количества ДНК и липосом так, чтобы они не находились в контакте друг с другом. ДНК и липосомы объединяли путем добавления 400 мкл бессывороточной среды для дифференцировки и осторожного встряхивания. Смесь ДНК:липосомы инкубировали при комнатной температуре в течение 20-30 мин перед ее добавлением к клеткам. Затем смесь ДНК:липосомы добавляли к клеткам и инкубировали при 37°С в атмосфере, содержащей 5% СО2, в течение 2 ч, после чего эту среду заменяли свежей полной средой. По истечении 24-48 ч клетки фиксировали и обрабатывали для гистохимического анализа с использованием X-gal согласно методу, описанному в [31], или их собирали для анализа β -галактозидазной активности (фирма Promega Corp.).
Подсчет клеток осуществляли при 40-кратном увеличении с использованием инвертированного микроскопа типа Nikon Diapot. Каждый вариант трансфекции повторяли по меньшей мере трижды и для каждой лунки выполняли по меньшей мере три независимых подсчета.
Содержащие тестируемые полипептиды комплексы для трансфекции создавали следующим образом. На дно стерильных полистироловых контейнеров размещали различные количества пептида таким образом, чтобы они находились рядом, но не контактировали с 1 мкг pCMVβ, после чего осуществляли смешение путем добавления 400 мкл бессывороточной среды NGM. Комплексы инкубировали при комнатной температуре в течение 10 мин, после чего добавляли DC-Chol/ДОФЭ. Комплекс пДНК/пептид/липосома дополнительно инкубировали при комнатной температуре в течение 20 мин и затем добавляли к клеткам, как описано выше.
Пример 1 - Анализ связывания ДНК
Mu1 представляет собой поликатионный пептид, содержащий 19 аминокислот, связанных с коровьим комплексом аденовируса (таблица 1) [27, 32]. При создании изобретения было проведено сравнение ДНК-связывающей активности Mu1 и основного капсидного протеина Vp1 вируса полиомы мыши, которое осуществляли с использованием взаимодействия с плазмидной ДНК с помощью анализа замедления подвижности в геле. Vp1 представляет собой пептид, состоящий из 19 аминокислот, который содержит сигнал ядерной локализации [26] и содержит меньше аминокислот, которые имеют положительный заряд, по сравнению с аминокислотами Mu1. Поэтому предполагалось, что он обладает меньшей ДНК-связывающей активностью.
Последовательность NLS в Vp1 подчеркнута.
Различные количества очищенного пептида инкубировали при комнатной температуре в HBS в течение приблизительно 10 мин и затем подвергали анализу с помощью гель-электрофореза на агарозе. В отсутствии пептида подвижности суперспиральной и релаксированной кольцевых плазмидных ДНК (пДНК) оказались ожидаемыми (фиг.1, полоса 8).
Начиная с соотношения ДНК:полипептид Mu1, равного 1:0,25 (мас./мас.) миграция плазмидной ДНК замедлялась (фиг.1). При соотношениях 1:0,25 (мас./мас.) влияние на подвижность было слабым, однако при соотношении, равном 1:0,5 (мас./мас.), подвижность плазмидной ДНК существенно замедлялась и лишь очень небольшое количество было способно мигрировать из лунок. При соотношениях 2:1 и выше пДНК не обладала способностью мигрировать в агарозный гель и способность бромида этидия проникать в плазмиду снижалась. В отличие от Mu1 для Vp1 не было обнаружено влияния на электрофоретическую подвижность плазмидной ДНК при соотношениях пДНК:протеин вплоть до 1,8 (мас.%) (фиг.1). Добавление 8 мкг Vp1 к 1 мкг плазмидной ДНК приводило к расширению зоны, соответствующей суперспиральной пДНК. Однако для полосы, соответствующей релаксированной пДНК, влияние Vp1 не проявлялось вплоть до соотношения пДНК:протеин, равного 1:32 (мас./мас.). При таком соотношении наблюдалось существенное замедление полос, соответствующих как суперспиральной, так и релаксированной пДНК, и было установлено, что некоторое количество ДНК оставалось в лунке. При инкубации пДНК с БСА не было обнаружено влияния на электрофоретическую подвижность при соотношениях пДНК:протеин вплоть до 1:30 (мас./мас.) (фиг.1).
Пример 2 - Трансфекция недифференцированных клеток линии ND7
При создании изобретения с помощью анализа, основанного на использовании репортерного гена β-галактозидазы, были проведены исследования способности Mu1 и Vp1 усиливать трансфекцию линии нервных клеток катионными липосомами. Клетки линии ND7 трансфектировали pCMVβ, объединенной в комплекс с различными количествами пептида и DC-Chol/ДОФЭ. Ранее было установлено, что катионная липосома DC-Chol/ДОФЭ обладает способностью осуществлять эффективную трансфекцию клеток линии ND7, происходящих из нервных клеток [31]. При создании изобретения в этом исследовании было установлено, что оптимальная эффективность (>40%) для этой линии клеток, происходящих из нервных клеток, достигается при использовании 1 мкг плазмидной ДНК, объединенной в комплекс с 3 мкг DC-Chol/ДОФЭ [31]. При изучении временной зависимости было установлено, что максимальные уровни экспрессии трансгена достигались через 48-60 ч после трансфекции. Таким образом, для того чтобы увеличить до максимума вероятность обнаружения усиления трансфекции, во всех исследованиях, проведенных при создании изобретения, анализы проводили через 12-20 ч после осуществления трансфекции, т.е. в то время, когда уровни экспрессии репортерного гена были пониженными. Ранее было установлено, что для трансфекции клеток линии ND7 оптимальное соотношение пДНК:липосома составляет 1:3 (мас./мас.). Поэтому сравнение влияния различных количеств пептида на трансфекицю проводили при соотношениях пДНК: DC-Chol/ДОФЭ, составляющих 1:3, 1:4 и 1:6. Результаты анализа замедления подвижности в геле позволили предположит, что для того чтобы происходило связывание всей плазмидной ДНК, достаточно, чтобы соотношение пДНК:Мu1 составляло приблизительно 1:0,5 (мас./мас.) (фиг.1). Однако в первых экспериментах с использованием этого соотношения и липосом не было выявлено влияния на эффективность трансфекции (данные не приведены). Причина заключалась в том, что объемы, использовавшиеся для получения комплексов для трансфекции, были намного больше тех, которые используются при осуществлении анализа замедления подвижности в геле (400 мкл по сравнению с 20 мкл). Поэтому были проведены исследования с использованием больших количеств Mu1, которые позволяли получать концентрацию в растворе, аналогичную той, которая использовалась в анализе замедления подвижности в геле. Была произведена сравнительная оценка влияния присутствия 0,6, 6, 12 и 21 мкг пептида Mu1 на опосредуемую DC-Chol/ДОФЭ трансфекцию. Было установлено, что Mu1 обладал способностью усиливать эффективность опосредуемой катионной липосомой трансфекции более чем в 4 раза. Наибольшее усиление трансфекции наблюдалось при использовании относительного соотношения pCMVβ/Mu1/(DC-Chol/ДОФЭ) (мас./мас./мас.), составляющего 1/12/6. Такая комбинация приводила к усилению трансфекции в 11 раз по сравнению с трансфекцией при использовании только ДНК (фиг.2).
Анализ на основе применения репортерного гена β-галактозидазы позволял оценивать общий уровень продуцированной β -галактозидазы, однако он не давал информации о количестве трансфектированных клеток. Вследствие этого при создании изобретения также проводили опыты, позволяющие осуществлять подсчет количества трансфектированных клеток линии ND7. Клетки высевали с плотностью 4×104 в 24-луночные планшеты для культур клеток. Через 24 ч клетки быстро промывали бессывороточной средой и трансфектировали pCMVβ, объединенной в комплекс с DC-Chol/ДОФЭ и пептидом Mu1. При этом использовали соотношения pCMVβ:Mu1:DC-Сhо1/ДОФЭ, которое было выявлено в качестве оптимального в анализе с использованием репортерного гена, а именно 1:12:6. При использовании такого соотношения было выявлено 6-кратное увеличение количества позитивных в отношении β-галактозидазы клеток (фиг.3 и 6). Не было обнаружено заметного уменьшения количества клеток при использовании комплекса с Mu1 во всех исследованных концентрациях. Аналогично этому концентрация протеина в клеточных лизатах, применяемых в анализе с использованием репортерного гена β-галактозидазы, не изменялись существенно по сравнению с нетрансфектированными клетками (данные не приведены).
В отличие от этого при использовании Vp1 не было выявлено никакого усиления эффективности трансфекции (фиг.4). Не было выявлено никакого усиления эффективности трансфекции при использовании pCMVβ в комплексе только с одним Mu1 по сравнению с использованием «оголенной» ДНК.
Для того чтобы установить, можно ли достичь усиления трансфекции в других типах клеток, были проведены аналогичные анализы с использованием клеток линии COS-7. Присутствие Mu1 также усиливало опосредуемую липосомой трансфекцию клеток линии COS-7 (фиг.5). Было установлено, что соотношение пДНК:Mu1:липосома, являющееся оптимальным для клеток линии ND7, также является оптимальным и для клеток линии COS-7. Была выявлена аналогичная степень усиления трансфекции (в 3,7 раза) по сравнению с трансфекцией, осуществляемой при использовании только катионной липосомы.
Пример 3 - Трансфекция дифференцированных клеток линии ND7
При создании изобретения были проведены также исследования способности Mu1 усиливать опосредуемую катионной липосомой трансфекцию дифференцированных клеток линии ND7. Клетки линии ND7 получали путем слияния первичных нейронов спинномозгового узла (DRG) крыс и клеток мышиной нейробластомы линии N18Tg2 [28]. Клетки линии ND7 можно подвергать дифференцировке различными методами, например путем удаления сыворотки, введения цАМФ или подвергая их воздействию среды с пониженным содержанием сыворотки с добавлением цАМФ и фактора роста нервной ткани. Дифференцировка клеток линии ND7 приводит к появлению свойств клеток, связанных с их родительскими ноцицептивными сенсорными нейронами, включающими уменьшение деления клеток и начало роста аксонов нервной клетки. Клетки линии ND7 высевали в 24-луночные культуральные планшеты и через 24 ч инициировали дифференцировку. Через 15-20 ч после начала дифференцировки их подвергали трансфекции согласно описанному выше методу. Через 15-20 ч после осуществления трансфекции клетки фиксировали и обрабатывали для гистохимического анализа с использованием X-gal. В соответствии с полученными ранее данными эффективность трансфекции в значительной степени варьировалась между тремя группами дифференцированных клеток. Для клеток линии ND7, которые дифференцировались в результате удаления сыворотки, были выявлены наиболее низкие уровни трансфекции (1,3%), в то время как для группы, подвергнутой воздействию цАМФ, наблюдались максимальные уровни (8%) для группы, обработанной средой с низким содержанием сыворотки/цАМФ/NGF, были выявлены промежуточные уровни (4,7%) (фиг.5). Однако во всех трех случаях введение полипептида Mu1 в комплекс для трансфекции приводило у усилению трансдукции дифференцированных клеток линии ND7. Эффективность трансфекции клеток линии ND7, дифференцированных под действием либо только цАМФ, либо под действием среды с низким содержанием сыворотки/цАМФ/NGF, повышалась более чем в 6 раз (фиг.5). Однако наибольшее усиление эффективности трансфекции наблюдалось для группы, подвергавшейся дифференцировки в результате удаления сыворотки. В данном случае наблюдалось более чем 10-кратное усиление.
Комплексы, содержащие пептид Mu1 и ДНК
Как продемонстрировано в примере 1 с помощью гель-электрофореза (анализ связывания ДНК), при соотношении Mu1:ДНК, превышающем 0,5:1,0 (мас./мас.), подвижность плазмидной ДНК существенно замедлялась и лишь небольшое количество ДНК мигрировало из лунки. Это свидетельствует о том, что пептид Mu1 сильно взаимодействует с ДНК и может приводить к нейтрализации и конденсации нуклеиновых кислот с образованием небольших частиц, которые можно применять для введения генов. Была проведена оценка размеров частиц Mu1:ДНК (МД) в диапазоне соотношений Mu1:ДНК, указанных на фиг.7.
Частицы МД получали путем смешения. В целом метод состоял в том, что соответствующие аликвоты пептида Mu1 в деионизированной воде добавляли к плазмидной ДНК (pCMVβ) (в конечной концентрации 220 мкг/мл) в 20 мМ буфере Hepes, pH 7,0. После тщательного перемешивания каждую смесь инкубировали в течение 10 мин при 20°С. Сразу после инкубации каждую смесь разбавляли буфером Hepes (конечная концентрация ДНК 24 мкг/мл) и проводили анализ размеров частиц методом фотонно-корреляционной спектроскопии (анализатор типа N4 plus, фирма Coultier). Все измерения проводили при 20°С, данные получали при угле, равном 90°. Для вычисления среднего размера частиц и стандартного отклонения (С.О.) применяли унимодальный анализ.
Представляет интерес тот факт, что хотя Mu1 обладал способностью связывать ДНК и образовывать комплексы во всем исследованном диапазоне, размер частиц существенно варьировался в зависимости от соотношения Mu1:ДНК. Стабильные малые частицы размером порядка нанометра образовывались в диапазоне соотношений Mu1:ДНК от 0,3 до 1,2 (диапазон L) и величинах этого соотношения, превышающих 5 (диапазон Н). При промежуточных величинах этого соотношения происходила выраженная агрегация, при этом размер частиц комплекса возрастал в течение периода инкубации, достигая более чем 2 мкм (фиг.7).
Пример 4 - Получение LMD в диапазоне L
При создании изобретения было проведено исследование того, могут ли комплексы липосома-Mu1-ДНК, характеризующиеся низким соотношением MD:ДНК, образовывать стабильные частицы с размером порядка нанометра и могут ли образующие комплекс частицы обладать высокой эффективностью в отношении трансфекции.
Получение липосом: DC-Chol (30 мкмолей) и ДОФЭ (20 мкмолей) объединяли в дихлорметане. Органический растворитель удаляли при пониженном давлении с помощью роторного испарителя и остаток сушили в вакууме в течение 3 ч. После этого к липидной пленке при смешении путем вращения добавляли 4 мМ буфер Hepes, pH 7,0 (3 мл). После кратковременного облучения ультразвуком (2-3 мин) образовавшуюся суспензию катионных липосом трижды экструдировали с помощью экструдера (фирма Lipex Biomembranes) через два наложенных друг на друга поликарбонатных фильтра (типа Millipore 0,2 мкм), а затем десять раз через два наложенных друг на друга поликарбонатных фильтра (типа Millipore 0,1 мкм), в результате чего образовывались липосомы малого размера (средний диаметр 109 нм по данным PCS) (приблизительно 8-10 мг/мл, что определялось разбросом при использовании данного метода получения).
Получение комплексов липосома:Mu1:ДНК (LMD): Пептид Mu1 (0,12 мг в деионизированной воде, концентрация пептида 3,5 мг/мл) добавляли при непрерывном перемешивании к раствору плазмидной ДНК (pCFl-CAT) (0,2 мг, типичная концентрация плазмиды 1,0 мг/мл) в 4 мМ буфере Hepes. Затем вносили суспензию катионных липосом (общее содержание липидов 2,4 мг, 4 мкмоля), в результате чего происходило образование частиц малого размера, характеризующихся узким диапазоном распределения (168± 58 нм) по данным анализа с помощью PCS. Полученный комплекс LMD (конечная концентрация ДНК 0,14 мг/мл) с добавлением 10% сахарозы (%мас./об.) хранили до применения при -80°С. В течение месяца не было обнаружено изменения размеров частиц.
Комплексы липосома:ДНК (LD) (липокомплексы) для контрольных экспериментов получали с использованием соотношения липосома:ДНК, составляющего 3:1 (мас./мас.), характерного для оптимальной композиции для трансфекции клеток линии ND7.
Трансфекция клеток линии ND7: Клетки линии ND7 высевали в нормальную среду для роста (NGM) (содержащую 10% сыворотки) с плотностью приблизительно 4×104 клеток/лунку в 24-луночные культуральные планшеты. Через 24 ч клетки быстро промывали средой NGM (бессывороточной) и затем обрабатывали в течение указанных промежутков времени растворами, которые содержали комплексы LMD или LD, предварительно разбавленными NMG (бессывороточной) (во всех случаях конечная концентрация ДНК составляла 3,2 мкг/мл). Затем клетки снова промывали и инкубировали в течение еще 48 ч, после чего их собирали. Уровни трансфекции оценивали с помощью ферментного анализа на основе хлорамфениколтрансферазы (CAT) с использованием в качестве субстрата14С-САМ (фирма Promega). Активность трансфекции выражали в виде процента (%) превращения ферментом внесенного14С-САМ.
При использовании опосредуемой LMD трансфекции была выявлена намного большая экспрессия репортерного гена, чем при опосредуемой LD трансфекции. Так, опосредуемая LMD трансфекция вызывала через 10 мин после осуществления трансфекции в 16 раз более высокую ферментативную активность CAT, а через 60 мин после осуществления трансфекции - в 6 раз более высокую активность по сравнению с опосредуемой LD трансфекцией (фиг.8). При использовании LMD значительные уровни трансфекции были выявлены даже в том случае, если продолжительность трансфекции была менее 10 мин. Эти данные служат иллюстрацией того, насколько быстро LMD-частицы способны проникать в клетки.
Пример 5 - Варианты катионного липида (цитофектина)
При создании изобретения было проведено изучение возможности улучшения характеристик комплексов LMD путем встраивания поликатионных холистериновых липидов (WO 97/45442). Вместо DC-Chol для получения катионных липосом использовали CDAN (D198), ACHx (CJE52) и СТАР (В232) (фиг.9). Каждая система катионных липосом содержала 60 мол.% катионного липида и 40 мол.% ДОФЭ, и их получали согласно методу, описанному в примере 4. Получали и сравнивали следующие различные системы комплекса на основе LMD: LMD (DC-Chol), LMD (В 198), LMD (CJE52) и LMD (В232). Все системы LMD получали согласно описанному выше методу с использованием катионных липосом (общее содержание липидов 20 мкмолей) и 0,6 мг пептида Mu1 на 1,0 мг ДНК (pCMVβ). Было установлено, что частицы имеют диаметр менее 200 нм.
Для контрольных экспериментов получали смеси комплексов липосома:ДНК (LD) (липоплексы) с соотношением липосома:ДНК, составляющим 3:1 (мас./мас.), которое является оптимальным для композиции для трансфекции клеток линии ND7.
Трансфекция клеток линии ND7: Клетки линии ND7 высевали в среду NGM (содержащую 10% сыворотки) с плотностью приблизительно 4×104 клеток на лунку в 24-луночный культуральный планшет. Через 24 ч клетки быстро промывали NGM (бессывороточной) и затем в течение 1ч обрабатывали растворами, содержащими комплексы LMD или LD, предварительно разбавленными NMG (бессывороточной) (во всех случаях конечная концентрация ДНК составляла 2,5 мкг/мл). Затем клетки снова промывали и инкубировали еще в течение 48 ч для обработки с целью окрашивания с помощью X-gal для гистохимического анализа. Количество клеток, окрашенных в голубой цвет, подсчитывали с помощью инвертированного микроскопа.
Во всех случаях композиции, содержащие LMD, обладали большей эффектитвностью, чем соответствующие LD-системы, полученные с использованием тех же самых поликатионных холестериновых липидов (фиг.10). Уровни эффективности трансфекции располагались следующим образом: LMD (B198)>LMD (DC-Chol)>LMD (CJE52)≫LMD (B232). Такое же расположение, а именно B198>DC-Chol>B232, наблюдалось при использовании соответствующих систем на основе LD.
Пример 6 - Количество пептида Mu1 в диапазоне L
При создании изобретения проводилось исследование влияния соотношения Mu1:ДНК (в диапазоне L, указанном на фиг.7) на эффективность трансфекции.
Катионные липосомы, содержащие катионный липид В 198 и ДОФЭ (3:2 мас./мас.), получали тем же методом, который описан в примере 4. Приготавливали серии смесей MD-комплекса (соотношение Mu1:ДНК варьировалось от 0,3 до 1,2) и их объединяли в комплекс с катионными липосомами. Полученные LMD-системы характеризовались соотношениями липосома:Mu1:ДНК(pCMVβ), составлявшими 12:0,3:1, 12:0,6:0,6, 12:0,9:1 и 12:1,2:1 (мас./мас./мас.) соответственно. Измеренные размеры LMD-частиц составляли приблизительно 150 нм.
Эффективность трансфекции оценивали в опытах in vitro с использованием клеток линии Panc-1 (линия клеток рака поджелудочной железы человека).
Клетки высевали с плотностью приблизительно 5×104 клеток/лунку в 24-луночный культуральный планшет в среду RPMI, дополненную 10% ФТС, и выращивали в течение 24 ч в атмосфере, содержащей 5% CO2, при 37°С. Клетки быстро промывали средой RPMI и затем в течение 30 мин обрабатывали растворами LMD-комплексов, предварительно разбавленных RPMI (во всех случаях конечная концентрация ДНК составляла 5,0 мкг/мл). После этого клетки снова промывали и инкубировали еще в течение 48 ч в среде RPMI, дополненной 10% ФТС, после чего их собирали и подвергали анализу в отношении β -галактозидазной активности с использованием стандартного набора для анализа (фирма Promega).
Как показано на фиг.11, оптимальное для трансфекции клеток линии Panc-1 соотношение липосома:Mu1:ДНК составляло 12:0,6:0,6. В других вариантах с использованием этих LMD-комплексов с низким содержание Mu1 также были получены очень высокие значения эффективности трансфекции.
Пример 7 - Количество и состав липидов
Для того чтобы исследовать, как влияет изменение соотношения количеств катионных липидов и ДОФЭ, а также соотношение количеств всех липидов к Mu1 и ДНК, получали серии LMD-систем с использованием В 198 в качестве предпочтительного катионного липида. Получали катионные липосомы, содержащие 60 мол.% В 198 и 40 мол.% ДОФЭ (3:2 мол./мол.), 50 мол.% В 198 и 50 мол.% ДОФЭ (1:1 мол./мол.) и 33 мол.% В 198 и 67 мол.% ДОФЭ (1:2 мол./мол.), и объединяли их согласно методу, описанному в примере 4, со стандартной смесью MD-комплекса (Mu1:ДНК 0,6:1 мас./мас.) в соотношениях, указанных на фиг.12.
Для контрольных экспериментов получали смеси (липоплексы), содержащие комплекс липосома:ДНК (LD) с соотношением липосома:ДНК, составляющим 3:1 (мас./мас.). Было установлено, что все LMD-системы имели больший средний размер в том случае, когда в состав MD-комплексов вводили меньшие количества катионных липосом. Однако размер LMD-частиц, содержащих более 12 мкмолей липидов/мг ДНК, оставался менее 200 мкм, в то время как размер частиц, содержащих от 12 до 6 мкмолей липидов/мг ДНК, превышал это значение. В процессе получения LMD-систем, содержащих 6 мкмолей липидов/мг ДНК, иногда наблюдалась агрегация.
С использованием клеток линии Panc-1 оценивали эффективность трансфекции (фиг.12). Клетки высевали с плотностью приблизительно 5×104 клеток/лунку в 24-луночный планшет в среду DMEM, дополненную 10% ФТС, и выращивали в течение 24 ч в атмосфере, содержащей 5% CO2, при 37°С. Клетки промывали в течение небольшого периода времени средой DMEM и затем обрабатывали в течение 2 ч растворами, содержащими LMD- или LD-комплексы, предварительно разбавленные DMEM (во всех случаях конечная концентрация ДНК составляла 5,0 мкг/мл). Затем клетки снова промывали и инкубировали еще в течение 48 ч в среде DMEM, дополненной 10% ФТС, после чего собирали и подвергали анализу в отношении β-галактозидазной активности с использованием стандартного набора для анализа (фирма Promega).
Максимальная эффективность трансфекции не существенно отличалась от той, которая наблюдалась для трех исследованных композиций с различными соотношениями катионный липид:ДОФЭ. В случае LMD-систем, полученных с использованием В198:ДОФЭ (1:2 мол./мол.), максимальный уровень трансфекции наблюдали при соотношении липосома:ДНК, составляющем приблизительно 12,5 мкмоля липида/мг ДНК. Эффективности трансфекции для LMD-систем, полученных с использованием катионных липосом, имеющих соотношение В198:ДОФЭ 3:2 ммол./ммол. и В198:ДОФЭ 2:2 ммол./ммол., выходили на постоянный уровень при соотношениях липосома:ДНК, превышающих 12,5 мкмолей липида/мг ДНК. Для всех проанализированных LMD-систем обнаружена тенденция к меньшей эффективности трансфекции при низких соотношениях липосома:ДНК (фиг.12). Это свидетельствует о том, что для LMD-композиций, содержащих небольшие количества пептида Mu1, должны требоваться большие количества катионных липосом по сравнению с композициями, полученными с использованием больших количеств пептида Mu1, для того чтобы соответствующие LMD-системы проявляли свою максимальную активность в отношении трансфекции.
Пример 8 - Сравнение пептида Mu1 и протамина
Протамин представляет собой встречающийся в естественных условиях катионный пептид, присутствующий в большом количестве в сперме рыб, который обладает сильной способностью нейтрализовать и конденсировать ДНК. Проводили сравнение активности протамина в отношении трансфекции и пептида Mu1. Пептид Mu1 или сульфат протамина (фирма Sigma, степень чистоты X, получен из лосося) объединяли в комплекс с ДНК (pCMVβ) и затем с катионными липосомами (В198:ДОФЭ в соотношении 3:2), получая соотношение липосома:пептид:ДНК 12:0,6:1 (мас./мас.).
Активность в отношении трансфекции исследовали с использованием клеток линии Swiss 2T3. Клетки высевали с плотностью приблизительно 2×104 клеток/лунку в 24-луночные культуральные планшеты в среду DMEM, дополненную 10% ФТС, и выращивали в течение 48 ч до конфлюентности в атмосфере, содержащей 5% СО2, при 37°С. Клетки быстро промывали средой DMEM и затем обрабатывали в течение 1 или 2 ч растворами, содержащими LMD- или LD-комплексы, предварительно разбавленными DMEM (во всех случаях конечная концентрация ДНК составляла 5,0 мкг/мл). После этого клетки снова промывали и инкубировали еще в течение 48 ч в среде DMEM, дополненной 10% ФТС, после чего собирали. Уровень β-галактозидазной активности определяли с помощью стандартного набора для анализа (фирма Promega).
Как показано на фиг.13, комплексы, содержащие Mu1, обладали большей эффективностью в отношении трансфекции таких конфлюентных клеток, чем комплексы, содержащие протамин.
Пример 9 - Другие катионные пептиды
Для исследования влияния различных других катионных пептидов на эффективность трансфекции получали серии комплексов липосома: катионный пептид:ДНК и исследовали in vitro их относительные способности осуществлять трансфекцию. В качестве пептидов использовали гидрохлорид полилизина (средняя молекулярная масса 3970, фирма Sigma), гидрохлорид полиаргинина (средняя молекулярная масса 1180, фирма Sigma), пептид, полученный из протеина V, pV (p5, последовательность приведена ниже), пептид, являющийся аналогом Mu1 (V, последовательность приведена ниже) и сам пептид Mu1. Пептид p5 и пептид V синтезировали с использованием того же метода твердофазного синтеза пептидов, который применяли для получения пептида Mu1.
Каждый пептид объединяли с катионной липосомой (DC-Chol:ДОФЭ, 3:2 ммоль/ммоль) и ДНК (pCMVβ) в соотношении липосома: пептид:ДНК, составляющем 12:0,6:1 (мас./мас./мас.) согласно описанному в примере 4 методу. Активности в отношении трансфекции исследовали с использованием клеток линии HeLa (человеческие эпителиальные клетки). Клетки высевали с плотностью приблизительно 5×104 клеток/лунку в 24-луночный культуральный планшет в среду DMEM, дополненную 10% ФТС, и выращивали в течение 24 ч в атмосфере, содержащей 5% СО2, при 37°С. Клетки быстро промывали средой DMEM и затем обрабатывали в течение 30 мин растворами, содержащими LMD-или LD-комплексы, предварительно разбавленные средой OPTIMEM (фирма Gibco) (во всех случаях конечная концентрация ДНК составляла 1,0 мкг/мл). Затем клетки снова промывали и инкубировали еще в течение 48 ч в среде DMEM, дополненной 10% ФТС, после чего их собирали. Уровень ферментативной активности β-галактозидазы определяли с использованием стандартного набора для анализа (набор для измерения хемилюминисценции, фирма Roche).
Как показано на фиг.14, катионные пептиды, полученные из аденовируса (Mu1 и р5), и аналог Mu1 (V) обладали очень высокой активностью в отношении трансфекции по сравнению с комплексами, полученными с использованием синтетических катионных полипептидов, полилизина и полиаргинина.
Аминокислотные последовательности р5, V и Mu1:
р5: RPRRRATTRRRTTTGTRRRRRRR
V: VRRVHHRRRRVSHRRVRGG
Мu1: MRRAHHRRRRASHRRMRGG
Пример 10 - Сравнение с комплексом Transfast с использованием линии клеток Panc-1
LMD и LD получали согласно методу, описанному в примере 4, за исключением того, что не использовали pCMVβ. Комплекс Transfast (фирма Promega) получали согласно протоколу производителя.
Активности в отношении трансфекции оценивали в опытах in vitro с использованием клеток линии Panc-1. Клетки высевали с плотностью приблизительно 5×104 клеток/лунку в 24-луночный культуральный планшет в среду RPMI, дополненную 10% ФТС, и выращивали в течение 24 ч в атмосфере, содержащей 5% CO2, при 37°С. Клетки быстро промывали средой RPMI и затем обрабатывали в течение указанных периодов времени растворами, содержащими LMD- и LD-комплексы, предварительно разбавленные средой RPMI (во всех случаях концентрация ДНК составляла 5,0 мкг/мл). После этого клетки снова промывали и инкубировали еще в течение 48 ч в среде RPMI, дополненной 10% ФТС, после чего собирали. Уровень ферментативной активности β-галактозидазы определяли с использованием стандартного набора для анализа (фирма Promega). Трансфекцию с использованием комплекса Transfast:ДНК осуществляли в течение 1 ч в бессывороточной среде (оптимальные условия).
Как продемонстрировано на фиг.15, LMD обладал более высокой активностью в отношении трансфекции, чем комплекс Transfast:ДНК и LD. Эти результаты находятся в полном соответствии с результатами, полученными с использованием клеток линии ND-7.
Пример 11 - Сравнение с липофектамином при использовании человеческих бронхиальных клеток
Активность LMD-комплексов в отношении трансфекции сравнивали с активностью липофектамина (фирма Gibco) в комплексе с ДНК с использованием клеток НВЕ (эпителиальные клетки бронхов человека).
Клетки высевали в 12-луночный культуральный планшет в среду DMEM, дополненную 10% ФТС, и выращивали в течение 24 ч в атмосфере, содержащей 5% СО2, при 37°С. Клетки быстро промывали средой DMEM и затем обрабатывали в течение указанных промежутков времени растворами, содержащими либо LMD-комплекс (полученный согласно методу, описанному в примере 4), либо LD-комплекс (полученный с использованием соотношения липофектамин:ДНК, равного 12:1 (мас./мас.)), предварительно разбавленные средой OPTIMEM (фирма Gibco) (во всех случаях конечная концентрация составляла 5,0 мкг/мл) (фиг.16). После этого клетки снова промывали и инкубировали еще в течение 48 ч в среде DMEM, дополненной 10% ФТС, после чего подвергали обработке для окрашивания для проведения гистохимического анализа с использованием X-gal.
Было установлено, что LMD обладал более высокой активностью в отношении трансфекции, чем липофектамин (фиг.16), и более быстро поглощался клетками линии НВЕ. Аналогичные результаты были получены для клеток линий ND7 и Panc-1.
Пример 12 - Сравнение с LT1 с использованием головного мозга крыс: эксперимент ex vivo
При создании изобретения были проведены исследования активности в отношении трансфекции на органотипических культурах клеток из головного мозга крыс с использованием репортерной ДНК (pCMVβ) с целью имитации условий, существующих in vivo. Срезы головного мозга помещали на прозрачные пористые мембраны и принимали меры для того, чтобы сохранить в максимальной степени присущую этой ткани связность и цитоархитектуру.
LMD и LD получали согласно описанному в примере 4 методу. LT1 представляет собой полиаминный реагент для трансфекции, который производится фирмой PanVera Co. Получали комплекс, содержащий катионные липосомы (DC-Chol/ДОФЭ, 3:2 ммол./мол.), LT-1 и плазмиду pCMVβ в соотношении 3:3,2:1 (мас./мас./мас.). Срезы головного мозга обрабатывали в течение 2 ч растворами, содержащими LMD, LD или комплекс липосомы: LT1: ДНК (Murray и др.. Gene Ther., 6, 190-197, 1999). Во всех случаях в ходе эксперимента не было выявлено морфологических изменений в срезах. После завершения трансфекции и инкубации в течение 48 ч клетки собирали, окрашивали с помощью X-gal и подсчитывали количество клеток голубого цвета в срезе (фиг.17).
При использовании ДНК в дозе 5,0 мкг (объем культуры 2 мл) в присутствии LMD после окрашивания с использованием X-gal было выявлено существенно большее количество окрашенных в голубой цвет клеток, чем в присутствии LD или LT1-комплекса. При использовании в количестве, составляющем всего 129 нг, LMD обладал значительной активностью в отношении трансфекции, которая все еще превышала активность LD (DC-Chol/ДОФЭ в комплексе с ДНК, соотношение 3:1 (мас./мас.) (доза ДНК 5,0 мкг). Было выявлено, что экспрессия репортерного гена в присутствии была намного большей, чем в случае трансфекции, опосредуемой комплексами LD или липосома:LТ1:ДНК. Так, при использовании сопоставимых доз эффективность опосредуемой LMD трансфекции превышала в 19 раз эффективность трансфекции, опосредуемой LD, и в 4 раза превышала эффективность трансфекции, опосредуемой комплексом липосома:LТ1:ДНК.
Пример 13 - Сравнение с катионными липосомами GL-67: эксперимент in vivo с использованием легкого мыши
Активность LMD (полученного согласно методу, описанному в примере 4, с использованием катионных липосом на основе DC-Chol/ДОФЭ [3:2, мол./мол.] и плазмиды pCFl-САТ) в отношении трансфекции оценивали в опытах in vivo с использованием легкого мыши путем сравнения с активностью в отношении трансфекции катионных липосом GL-67:ДОФЭ:ВМРЕ-ПЭГ5000 (1:2:0,05 мол./мол./мол.), объединенных в комплекс с плазмидой pCFl-CAT (LD) (соотношение липосома:ДНК 5,4:1 мас./мас.), которые использовали для повышения действия при проведении клинических исследований на легком (Alton и др.. Lancet, 353, 947-954, 1999).
LMD (конечная концентрация ДНК 0,14 мг/мл; объем 100 мкл; доза ДНК 14 мкг) вводили в виде капель в легкие мышей линии Balb/c. GL-67:ДОФЭ:DMPE-ПЭГ5000 (1:2:0,05 мол./мол./мол.), объединяли в комплекс с плазмидой pCF1-CAT (конечная концентрация ДНК 0,8 мг/мл; объем 100 мкл; доза ДНК 80 мкг) и этот LD-комплекс вводили аналогичным образом в виде капель в легкие мышей линии Balb/c. Через 48 ч легкие гомогенизировали и проводили анализ в отношении активности CAT. «Усы» представляют собой С.К.О.
Полученные результаты (фиг.18) свидетельствуют о том, что система LMD и система GL-67, содержащая LD, обеспечивали практически эквивалентные уровни трансфекции in vivo, хотя с помощью системы LMD вводили в пять раз более низкую дозу ДНК.
Пример 14 - Системы LMD, модифицированные с использованием сахара
Для применений in vivo необходимо минимизировать неспецифические взаимодействия LMD с биологической окружающей средой. Например, при внутривенном введении существенными помехами являются нежелательные взаимодействия с компонентами крови (солями, протеинами и т.д.) и клетками, не являющимися мишенями. Так, одним из первых этапов существующего в естественных условиях процесса удаления чужеродных частиц с помощью врожденной иммунной системы является опсонизация чужеродных частиц протеинами плазмы. Для того чтобы уменьшить связывание протеинов и индуцируемую присутствием солей агрегацию, с LMD можно связать встречающиеся в естественных условиях полисахариды. Такие модификации LMD, осуществляемые с использованием углеводов, можно успешно применять для осуществления направленного переноса LMD к углеводным рецепторам.
Для достижения требуемого действия были сконструированы неогликолипиды, представленные на фиг.19. Основой этих соединений являются три различных домена.
ACHx (CJE 52): Этот липид (фиг.9) был выбран в качестве общего липидного каркаса для рассматриваемых неогликолипидов. Алифатическая кольцевая холестериновая система представляет собой обладающую выраженной гидрофобностью область, находящуюся внутри липидной оболочки LMD и LD частиц, которая действует в качестве неогликолипидного якоря.
Углеводный мотив: Выбор олигосахаридов был ограничен вследствие сложности любого химического метода, в котором используются модификации углеводов. При создании изобретения для доказательства принципиальной возможности применения углеводов использовали поступающие в продажу углеводы с длинной цепью, такие как мальтотетраоза и мальтогептаоза.
Линкер: Применение хемоселективной связи оказалось эффективным и удобным, и это при создании изобретения позволило синтезировать большое разнообразие неогликолипидов. Такой хемоселективный метод основан на превращении CJE52 в гидроксиламинолипид, который способен непосредственно связываться с незащищенными углеводами. Схема синтеза типичного комплекса гидроксиламино-СJЕ52 представлен на фиг.20 (схема 1), при этом реакция сочетания углеводного фрагмента с линкером основана на гликозилировании О-замещенного гидроксиламина (принцип взаимодействия с глюкозой проиллюстрирован на фиг.21 (схема 2)). С использованием этой стратегии осуществляли реакцию сочетания с мальтотетраозой и мальтогептаозой, получая соединения GLU4 и GLU7 (структуры приведены на фиг.22).
Модификации LMD с помощью гликозилирования основаны на природной способности неогликолипидных мицелл подвергаться диссоциации, после чего свободные липиды встраиваются в мембраны LMD. Сначала приготавливали LMD с использованием катионных липосом DC-Chol:ДОФЭ, пептида Mu1 и плазмиды pCMVβ согласно методу, описанному в примере 4. Затем к смесям, содержащим LM, добавляли суспензию неогликолипидных мицелл в буфере Hepes, pH 7,0, и инкубировали в течение 30 мин при 20°С, после чего помещали на хранение при -80°С (фиг.23).
Стабилизация LMD с помощью неогликолипидов: Стабилизирующее действие на LMD, модифицированный с помощью неогликолипида, оценивали при введении в LMD 7,5 мол.% GLU4 или GLU7. Известно, что липидный слой LD-систем подвергается агрегации после воздействия солей. Поэтому были произведены оценки размеров частиц LD (конечная концентрация ДНК 1 мкг/мл) после выдерживания в течение 30 мин при 37°С в среде OPTIMEM, которые проводили методом фотонно-корреляционной спектроскопии (устройство типа N4 plus, фирма Coultier). Для оценки среднего размера частиц применяли метод унимодального анализа. Увеличение среднего размера LD-частиц в процентах представлено на фиг.24. Такую же процедуру осуществляли для основной LMD-системы, LMD (GLU4) и LMD (GLU7) (конечные концентрации ДНК 1 мкг/мл).
Результаты свидетельствуют о том, что LMD является более стабильным в растворе, чем LD, однако они также показывают, что присутствие GLU4 и GLU7 оказывает повышенное антиагрегирующее стабилизирующее действие на LMD-частицы при 7,5 мол.%.
Эффективность трансфекции in vitro: Активность в отношении трансфекции определяли с использованием клеток линии HeLa, которые высевали с плотностью 5×10 клеток/лунку в 24-луночные культуральные планшеты и выращивали до достижения 70%-ной конфлюэнтности в среде DMEM, дополненной ФТС, при 37°С в атмосфере, содержащей 5% СО2. Клетки промывали ЗФР и затем в течение 30 мин обрабатывали растворами, содержащими LMD-комплексы, предварительно разбавленными средой DMEM, содержащей ФТС в указанной концентрации (%) (во всех случаях конечная концентрация ДНК составляла 5,0 мкг/мл). После этого клетки еще раз промывали и затем инкубировали еще в течение 48 ч в нормальной среде (NGM), после чего собирали. Уровень экспрессии β-галактозидазы определяли с помощью стандартного набора для анализа (набор для хемилюминисцентного анализа, фирма Roche).
Результаты свидетельствуют о увеличении эффективности трансфекции в случае модификации с использованием сахара как в условиях, когда среда содержала 0%, так и в условиях, когда среда содержала 50% сыворотки (фиг.25).
Обсуждение результатов
Ранее было установлено, что липосомы DC-Chol/ДОФЭ обладают эффективностью в отношении трансфекции клеток линии ND7, полученной из нервных клеток [31]. Известно, что DC-Chol успешно применяли для различных тканей, отличных от тканей ЦНС, и проводили клинические исследования возможности применения для генной терапии кистозного фиброза [33, 34]. Было установлено также, что липосомы, содержащие DC-Chol, не обладали побочными цитотоксическими действиями [35, 36]. Вследствие этого была поставлена задача разработать композиции этих липосом, обладающие улучшенными характеристиками, которые можно применять для нервных клеток.
Настоящее изобретение касается применения кодируемого вирусом протеина для трансфекции клеток. Было установлено, что Mu1 при его применении в комбинации с катионной липосомой DC-Chol/ДОФЭ обладает способностью существенно усиливать трансфекцию клеток. Наиболее вероятно, что это обусловливается тем, что Mu1 обладает способностью конденсировать пДНК, и указанное действие можно оптимизировать путем изменения соотношений полипептида, пДНК и катионной липосомы. Важно, что усиление эффективности трансфекции является более выраженным в случае дифференцированных клеток. Как указывалось выше, клетки линии ND7 были получены из первичных DRG. При дифференцировке клеток линии ND7 возникает фенотип, аналогичный фенотипу родительских периферических чувствительных нейронов, включающий индукцию роста аксона нервной клетки, уменьшение общей пролиферации и уменьшение способности к трансфекции [28, 37]. Усиление эффективности трансфекции дифференцированных клеток линии ND7 может отражать повышенную способность стимулировать трансфекцию первичных нейронов in vivo.
Успех применения невирусных носителей, обеспечивающих введение генов, в качестве реальной альтернативы для систем, основанных на использовании вирусных векторов, зависит от создания комплексов, обладающих более высокой и более длительной эффективностью в отношении трансфекции. С того времени, когда впервые было установлено, что катионные липосомы можно применять в качестве носителей для переноса генетического материала в клетки, были предприняты значительные усилия с целью создания композиций на основе катионных липосом, обладающих улучшенными характеристиками [5, 7]. Большинство подходов к улучшению характеристик катионных липосом базировались на структурных модификациях самой молекулы [30]. Были разработаны новые композиции, характеризующиеся повышенной эффективностью трансфекции [30]. Однако для различных типов клеток эффективность трансфекции, осуществляемой с использованием катионных липосом, является разной. Например, при создании изобретения было установлено, что полипептид Mu1 усиливает опосредуемую катионными липосомами трансфекцию в большей степени, чем Vp1. Это может быть обусловлено тем, что Mu1 имеет большее соотношение заряд/масса. В то время, как оба пептида имеют приблизительно одинаковую молекулярную массу, общее соотношение заряда и массы для Mu1 более чем в два раза превышает соответствующее значение для Vp1 (таблица 1). В соответствии с этим Mu1 обладал способностью замедлять электрофоретическую подвижность плазмидной ДНК в 60 раз более низкой концентрации, что свидетельствует о том, насколько сильно Mu1 способен связываться с ДНК. Хотя в том случае, когда 0,25 мкг Mu1 объединяли в комплекс с 1 мкг pCMVβ, было обнаружено небольшое изменение подвижности пДНК, после добавления 0,5 мкг Mu1 почти все плазмиды оставались вблизи лунки, в которую они были загружены (фиг.1). Соотношение Mu1 и pCMVβ, составляющее 0,5/1,0 (мас./мас.), соответствует молярному соотношению 1000/1. Каждая молекула Mu1 содержит 12 остатков, которые потенциально могут нести положительный заряд. Теоретическое соотношение зарядов Mu1 и pCMVβ должно составлять 1,6 (12000 катионов Mu1 по отношению к 7500 анионам pCMVβ). Такое соотношение должно полностью нейтрализовать отрицательные заряды pCMVβ и тем самым полностью исключить его миграцию, как это видно из представленных результатов.
Прямое сравнение количества Mu1, которое существенно замедляет миграцию плазмидной ДНК, и количества, которое оптимальным образом усиливает трансфекцию, не проводилось, поскольку использовались различные методы получения. Предназначенные для трансфекции комплексы пептид-пДНК-липосома получали в более крупных объемах (см. раздел Материалы и методы). Хотя для достижения оптимального усиления эффективности трансфекции требовалось в 24 раза большее количество Mu1 (12 мкг/1 мкг pCMVβ), чем для замедления миграции в агарозном геле, концентрация в растворе была аналогичной (25 нг/мл для замедления миграции пДНК; 30 нг/мл для оптимальной трансфекции). Присутствие Mu1 приводило также к изменению взаимодействия катионных липосом и пДНК. Оптимальное соотношение DC-Chol/ДОФЭ и pCMVβ в присутствии Mu1 составляло 6/1, что в два раза превышало оптимальное соотношение, установленное ранее для нервных клеток [31, 38]. С теоретической точки зрения используемое количество Mu1 должно полностью нейтрализовать положительные заряды, имеющиеся на pCMVβ, которые могли препятствовать дальнейшему образованию комплексов с DC-Chol/ДОФЭ. Очевидно, что это не имело места, поскольку оказалось возможным получить намного более высокие эффективности трансфекции. Вероятно, это обусловлено тем, что при использовании указанного в рассматриваемых исследованиях буфера не все возможные заряженные аминокислоты были депротонированы. Неизвестно, почему для усиления трансфекции требуется большее количество катионных липосом, поэтому в настоящее время проводятся исследования для разрешения данного вопроса.
Наконец, следует сделать замечания, касающиеся сигнала ядерной локализации, содержащегося в Vp1. Последние данные, полученные при создании изобретения (данные не опубликованы), а также приведенные в других работах [10, 11, 39, 40], позволяют предположить, что при липофекции транспорт трансфектированного продукта в ядро может оказаться неэффективным. Вследствие этого для усиления поглощения трансфектированной ДНК ядром были предприняты попытки осуществить предварительную конденсацию ДНК с помощью поликатионов, содержащих последовательности пептидов, для которых известно, что они обладают способностью осуществлять ядерную локализацию [17, 20, 22]. Однако при создании изобретения было установлено, что с точки зрения повышения эффективности трансфекции более эффективная способность Mu1 конденсировать ДНК значительно перевешивает способность Vp1 осуществлять ядерную локализацию. Аналогично этому Fritz с соавторами [22] не выявили различия в эффективностях трансфекции, осуществляемых с использованием рекомбинантного человеческого гистона (HI) и модифицированной версии, содержащей большую последовательность ядерной локализации Т антигена SV40. Результаты других исследований позволяют предположить, что наличие NLS может улучшать накопление трансфектированной пДНК в ядре, хотя это осуществляется специфическими внутриклеточными путями [41, 42].
Все публикации, упомянутые в настоящем описании, включены в него в качестве ссылки. Для специалиста в данной области должно быть очевидно, что могут быть сделаны различные модификации и вариации описанных методов и систем без отклонения от объема и сущности изобретения. Хотя изобретение было описано со ссылкой на конкретные предпочтительные варианты осуществления, следует понимать, что заявленное изобретение не ограничено этими конкретными вариантами осуществления. В объеме приведенной ниже формулы изобретения могут быть сделаны различные модификации описанных вариантов осуществления изобретения, которые являются очевидными для специалистов в области молекулярной биологии и родственных областях.
Список литературы
1. Wood M.J.A. и др. Inflammatory effects of gene-transfer into CNS with defrctive HSV-1 vectors. Gene Ther., 1: 283-291, 1994.
2. Byrnes A.P. и др. Adenovirus gene-transfer causes inflammation in the brain, Neuroscience, 66: 1015-1024, 1995.
3. Naldini L., и др. In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector [см. комментарии]. Science, 272: 263-267, 1996.
4. Miller A.D. Cationic liposomes for gene delivery, Angewandte Chemie-International Edition, 37: 1769-1785, 1998.
5. Lee R.J., Huang L. Lipidic vector systems for gene transfer. Critical Reviews in Theraupetic Drug Carrier Systems, 14: 173-206, 1997.
6. Gao X., Huang L. Cationic liposome-mediated gene-transfer, Gene Ther., 2: 710-722, 1995.
7. Felgner P.L. и др., Lipofection - a Highly Efficient, Lipid-mediated DNA-Transfection Procedure, Proceedings of the National Academy of Science of the United States of America, 84: 7413-7417, 1987.
8. Farhood H., Serbina N., Huang L. The role of dioleyl phosphatidilethanolamine in cationic liposome mediated gene transfer, Biochim. Biophys. Acta, 1235: 289-295, 1995.
9. Caplen N.J. и др. In-vivo liposome-mediated DNA transfection of epithelial-cell lines using cationic liposome DC-Chol/DOPE, Gene Ther., 2: 603-613, 1995.
10. Labat-Moleur F. и др. An electron microscopy study into the mechanism of gene transfer with lipopolyamines, Gene Ther., 3: 1010-1017, 1996.
11. Zabner J. и др. Cellular and molecular barriers to gene transfer by a cationic lipid, J. Biol. Chem., 270: 18997-19007, 1995.
12. Felgner P.L. и др. Enhanced Gene Delivery and Mechanism Studies With a Novel Series of Cationic Lipid Formulations, J. Biol. Chem., 269: 2550-2561, 1994.
13. Sahenk Z. и др. Gene Delivery to Spinal Motor Neurons, Brain Res., 606: 126-129, 1993.
14. Iwamoto Y. и др. Liposome-Mediated Bdnf Cdna Transfer In Intact and Injured Rat-Brain, Neuroreport, 7: 609-612, 1996.
15. Roessler B.J., Davidson B.L., Direct plasmid-mediated transfection of adult murine brain-cells in vivo using cationic liposomes, Neurosci. Lett., 167: 5-10, 1994.
16. Zhou X, Huang L. DNA transfection mediated by cationic liposomes containing lipopolylysine: characterization and mechanism of action, Biochim. Biophys. Acta, 1189: 195-203, 1994.
17. Sorgi F.L., Bhattacharya S., Huang L. Protamine sulfate enhances lipid-mediated gene transfer. Gene Ther., 4: 961-968, 1997.
18. Li S., Huang L. Protamine sulfate provides enhanced and reproducible intravenous gene transfer by cationic liposome/DNA complex. Journal of Liposome Research. 7: 207-219, 1997.
19. Vitiello L. и др. Condensation of plasmid DNA with polylysine improves liposome-mediated gene transfer into established and primary muscle cells. Gene Ther., 3: 396-404, 1996.
20. Namiki Y., Takahashi Т., Ohno Т. Gene transduction for disseminated intraperitoneal tumor using cationic liposomes containing non-histone chromatin proteins: cationic liposomal gene therapy of carcinomatosa. Gene Ther., 5: 240-246, 1998.
21. Gao X., Huang L. Potentiation of cationic liposome-mediated gene delivery by polycations., Biochem., 35: 9286-9286, 1996.
22. Fritz J.D. и др. Gene transfer into mammalian cells using histone-condensed plasmid DNA, Hum. Gene Ther., 7: 1395-1404, 1996.
23. Hagstrom J.E. и др. Complexes of non-cationic liposomes and histone HI mediate efficient transfection of DNA without encapsulation, Biochim. Biophys. Acta, 1284: 47-55, 1996.
24. Isaka Y. и др. The HVJ liposome method, Exp.-Nephrol, 6: 144-147, 1998.
25. Gillock E.Т. и др. Polyomavirus major capsid protein VP1 is capable of packing cellular DNA when expressed in the baculovirus system, J-Virol, 71: 2857-2865, issn: 0022-2538x, 1997.
26. Chang D., Cai X., Consigli R.A. Characterization of the DNA binding properties of polyomavirus capsid proteins, Journal of Virology, 67: 6327-6331, 1993.
27. Anderson C.W., Young M.E., Flint S.J. Characterization of the adenovirus 2 virion protein, mu, Virology, 172: 506-512, 1989.
28. Wood J.N. и др. Novel Cell-Lines Display Properties of Nonciceptive Sensory Neurons, Proceedings of the Royal Society of London Series B-Biological Sciences, 241: 187-194, 1990.
29. Budhrammahadeo V., Lillycrop K.A. The Levels of the Antagonistic Pou Family Transcription Factors Brn-3a and Brn-3b in Neuronal Cells Are Regulated in Opposite Directions By Serum Growth-Factors, Neurosci. Lett., 185: 48-51, 1995.
30. Cooper R.G. и др. Polyamine analogues of 3-beta-[N-(N',N'-dimethylaminomethan)carbamoil] cholesterol (DC-Chol) as agents for gene delivery, Chemistry-a European Journal, 4: 137-151, 1998.
31. McQuillin А. и др. Optimization of liposome mediated transfection of neuronal cell line, Neuroreport, 8: 1481-1484, 1997.
32. Hosokawa K., Sung M.T. Isolation and characterization of an extremely basic protein from adenovirus type 5, Journal of Virology, 17: 924-934, 1976.
33. Caplen N.J. и др. Liposome-Mediated Cftr Gene-Transfer to the Nasal Epithelium of patients With Cystic-Fibrosis, Nature Med., 1: 39-46, 1995.
34. Nabel G., Chang A., Nabel E. Clinical Protocol: Immunotherapy of malignancy by in vivo gene transfer into tumors, Hum. Gene Ther., 3: 399-4100, 1992.
35. Nabel G. и др. Direct gene-transfer with DNA liposome complexes in melanoma-expression, biological activity, and of toxicity in humans, Proc. Natl. Acad. Sci. USA, 90: 11307-11311, 1993.
36. Stewart M.J. и др. Gene-transfer in vivo with DNA liposome complexes - safety and acute toxicity in mice, Hum. Gene Ther. 3: 267-275, 1992.
37. Murray K.D. и др. DC-Chol/DOPE mediated transfections in differentiated sensory neurons. In preparations, 1999.
38. Murray K.D. и др., Cationic liposome-mediated transfection in organotipic explant cultures. Gene Ther., 6: 190-197, 1999.
39. Thierry A.R. и др. Characterization of liposome-mediated gene delivery: Expression, stability and pharmacokinetics of plasmid DNA, Gene Ther., 4: 226-237, 1997.
40. Coonrod A., Li F.Q., Horwitz M. On the mechanism of DNA transfection: efficient gene transfer without viruses, Gene Ther., 4: 1313-1321, 1997.
41. Sebestyen M.G. и др. DNA vector chemistry: the covalent attachment of signal peptides to plasmid DNA, Nat. Biotechnol., 16: 80-85, 1998.
42. Hagstrom J.B. и др. Nuclear import of DNA in digitonin-permeabilized cells, J. Cell Sci., 110(Pt 18): 2323-2331, 1997.

Реферат
Изобретение относится к комплексам типа катионный липид/протеин/нуклеиновая кислота. Предложен невирусный вектор, содержащий конденсированный комплекс полипептид/нуклеиновая кислота и катионный липид. Комплекс представляет собой необходимую нуклеотидную последовательность и один или несколько вирусных упаковывающих нуклеиновую кислоту полипептидов или их производных. Предложен также сам комплекс полипептид/нуклеиновая кислота, способ получения невирусного вектора и способ встраивания представляющей интерес нуклеиновой кислоты в эукариотическую клетку. Изобретение позволяет повысить эффективность введения нуклеиновых кислот в клетки. Изобретение может быть использовано в генетической инженерии. 4 н. и 10 з.п. ф-лы, 25 ил., 1 табл.


Комментарии