Клеточная линия иммортализованных кератиноцитов и меланоцитов (варианты), способ иммортализации клеток кожи человека для получения иммортализованных кератиноцитов, способ иммортализации клеток кожи человека для получения иммортализованных меланоцитов, бе - RU2215030C2
Код документа: RU2215030C2
Чертежи









Описание
Изобретение относится к улучшенным непрерывным (иммортализованным) клеточным линиям, полученным из нормальных тканей кожи человека, в частности линиям кератиноцитов и меланоцитов, которые сохраняют способность экспрессировать протеины дифференциации, характерные для дифференциированных меланоцитов или кератиноцитов, даже в случае большого числа пассажей. Настоящее изобретение относится также к новой, не содержащей сыворотки среде, которая не требует использования фидерных клеток.
Предпосылки
изобретения
Ранее уже было описано получение иммортализованных клеточных линий, полученных из тканей кожи человека. Обычно такие способы включают трансфекцию или трансформацию клеток кожи
человека, например кератиноцитов и меланоцитов, культивируемых in vitro агентами, которые обеспечивают иммортализацию.
Иммортализация относится к получению клеток, которые способны к культивированию в течение длительного промежутка времени in vitro, в идеале неопределенно долго. Такие клетки также называют непрерывными клеточными линиями. В противоположность неиммортализованным, клетки могут расти в течение конечного числа делений in vitro. Существенная необходимость в иммортализованных клетках объясняется тем, что они обеспечивают стабильный, потенциально неограниченный запас клеток, обладающих определенными характеристикам. Обычные агенты для получения иммортализованных клеточных линий и иммортализованных клеточных линий кожи человека, в частности, включают, например, вирусы, рекомбинантные вирусы и плазмиды, которые содержат ДНК последовательности, которые обеспечивают иммортализацию.
Вероятно, наиболее обычный способ получения иммортализованных клеточных линий человека включает использование S40 последовательностей, и, более конкретно, SV40 крупной Т антигенной ДНК в качестве иммортализующего агента. Так, например, Steiberg et al., J.Cell, Phys., 123:117-125 (1985); Reddel et al. , патент США 4885238, выданный 5 декабря 1989 г; Major, патент США 4707448, выданный 17 ноября 1987 г; Stoner et al., Cancer Res., 51:365-371 (1991); Chopra et al., In Vitro Cell Dev.Biol., 30A: 539-546 (1994); Chopra et al. , Jn Vitro Cell Dev.Biol., 27A:763-765 (1991); Christian et al., Cancer Res., 47:6066-6073 (1987); Rhim et al.. Science 227:1250-1252 (1985), и Grubman et al. , Gastrointest. Liver Physiol., 29:G1060-G1070 (1994), предлагают использование SV40 векторов и SV40 крупной Т антигенной последовательности, содержащей векторы, для получения иммортализованных клеточных линий человека. Введение таких последовательностей обычно осуществляют с помощью инфицирования, используя SV40 вирус или гибридный аденовирус-12 SV40 гибридный вирус, или за счет трансфекции клеток с рекомбинантной плазмидой, содержащей длинный терминальный репит (повтор) вируса саркомы Rous и Ori-SV40 ранний участок за счет совместного осаждения фосфатом стронция (см. Brash et al., Mol. Cell Biol., 7:2031-2034 (1987).
Другим известным способом для получения иммортализованных клеточных линий, в частности иммортализованных кератиноцитов человека, является способ, который включают трансфекцию или инфицирование клеток ДНК последовательностями вируса папилломы человека. Так, например, в патенте США 5376542, выданном 27 декабря 1994 г, описывается иммортализация эпителиальных клеток человека за счет выделенных HPV-16, 18, 31, 33 или 35 Е6 и Е7 генов, или одного только Е7 гена, для получения неонкогенных иммортализованных клеточных линий. Кроме того, Barbosa et al., Oncogene, 4:1529-1532 (1989), и Hunger et al., J.Virol., 63(10):4417-4421 (1989), описывают использование HPV-16 и HPV-18 Е6 и Е7 генов для получения иммортализованных кератиноцитов человека.
Однако, хотя ряд исследовательских групп сообщали о иммортализованных клеточных линиях кератиноцитов и их использовании в In vitro анализах, полученные ранее иммортализованные клеточные линии кератиноцитов и меланоцитов обычно обладали одним или более свойств, которые делали их использование невыгодным. Так, например, иммортализованные кератиноциты, о которых сообщалось ранее, обладают одной или более из следующих характристик: i) снижение или потеря экспрессии диференцирующих маркеров, например протеинов, которые экспрессируются нормальными диференцированными кератиноцитами, и (ii) изменение характеристик роста в тканевой культуре.
Так, например, Jetten et al., J.Invest.Dermatol., 92:203-209 (1989), сообщают о SV40 иммортализованных кератиноцитах, полученных после большого числа пассажей (число пассажей больше 12) с использованием вектора NHEK-SV40-T8-1, которые оказались неспособными к дифференциации. Аналогично Bernard et al., Cancer Res., 45:1707-1716 (1985), сообщают о выделении иммортализованной клеточной линии кератиноцитов, названной как SVK14, которая, как сообщается, почти полностью неспособна к дифференциации. Кроме того, эта клеточная линия не экспрессирует кератины К1/10 ( более 53 кД) и 50 кД кератин (кератин К14), протеины, которые обычно экспрессируются дифференцированными кератиноцитами.
Кроме того, Steinberg et al., J.Cell Physiol., 123:117-125 (1985), сообщает о SV40 трансформированных кератиноцитах, которые постепенно теряют способность экспрессировать кератины, которые характерны для нормального кератинового цитоскелета. Такая потеря нормальной экспрессии кератинов происходит после примерно 10-15 пассажей. Далее, Hronis et al., Cancer Res., 44: 5797-5804 (1984), описывают SV40 ДНК иммортализованные кератиноциты, которые потеряли способность продуцировать К5, К6, К14/15, К16 и К17 кератины и инволюкрин, протеины, которые характерны для нормальных дифференцированных кератиноцитов. Далее, Morris et al., Proc.Natl.Acad. Sci, USA, 82:8498-8502 (1985), описывают SV40 иммортализованные кератиноциты, которые при большом числе пассажей (более 14 пассажей) демонстрируют сильно пониженную экспрессию кератинов класса II и класса I. Так, например, эти кератиноциты почти не экспрессируют K13(Id).
Кроме того, Banks-Schlegel et al., J.Cell Biol., 96: 330-337 (1983), раскрывают SV40 иммортализованные кератиноциты, которые демонстрируют измененные характеристики роста в тканевой культуре. Так, например, в отличие от нормальных кератиноцитов эти иммортализованные клетки требуют для роста 3Т3 фидерный слой.
Описанные ранее способы получения иммортализованных человеческих кератиноцитов и меланоцитов обычно использовали методику фидерных клеток (когда фибробласты обычно функционируют в качестве "фидерных" клеток) и обычно вели культуру клеток в содержащей сыворотку среде. Так, например, Sexton et al., "Stable transfection of human keratinocytes: HPV immortalization", Keratinocyte Methods, eds., Leigh I.M. et al., University Press, 179-180 (1994); Garlick et al., "Retroviral Vectors", Keratinocyte methods, eds. Leigh I.M. et al. , Cambridge University Press, 181-183 (1994), описывают использование среды, содержащей фетальную телячью сыворотку и фидерные клетки, при выделении и продуцировании иммортализованных кератиноцитов.
Использование не содержащей сыворотки среды при выделении и продуцировании иммортализованных эпителиальных клеток было раскрыто ранее. Так, например, Barbosa et al., Oncogene, 4:1529-1532 (1989), описывает начальное культивирование человеческих кератиноцитов, трансфектированных за счет электропорации или липофекции, в не содержащей сыворотку среде с низким содержанием кальция до конфлюэнтности.
Однако вне зависимости от того, что сообщалось ранее, все еще остается существенная необходимость в иммортализованных человеческих кератиноцитах и меланоцитах, которые обладали бы улучшенными характеристиками, в частности, которые сохраняли бы потенциал дифференциации нормальных кератиноцитов и меланоцитов и которые экспрессировали бы протеины дифференциации, характерные для дифференцированных меланоцитов и кератиноцитов, даже после большого числа пассажей. Такие клетки были бы очень выгодны во многих применениях, особенно в анализах, которые требуют дифференцированных клеток кожи. Кроме того, существует необходимость в усовершенствованной культуральной среде, способной поддерживать первичные и иммортализованные кератиноциты и меланоциты, а также в усовершенствованных способах культивирования, в которых не требовалось бы применения фидерных клеток.
Цели
изобретения
Целью настоящего изобретения является получение усовершенствованных непрерывных (иммортализованных) клеточных линий, полученных из нормальной ткани кожи человека, особенно
иммортализованных клеточных линий кератиноцитов и/или меланоцитов, полученных из нормальной ткани кожи человека, которые сохраняли бы способность дифференцировать и экспрессировать протеины
дифференциации даже после большого числа пассажей. Более конкретно, целью настоящего изобретения является получение иммортализованных кератиноцитов, которые сохраняли бы способность экспрессировать
кератины, цитохромы, а также другие протеины дифференциации, например инволюкрин, филаггрин и лорикрин, которые либо слабо экспрессируются, либо не экспрессируются вовсе обычными иммортализованными
клеточными линиями кератиноцитов. Следующей целью изобретения является получение иммортализованных кератиноцитов и меланоцитов, которые экспрессируют ферменты, которые обычно экспрессируют
дифференцированные кератиноциты и меланоциты, особенно такие ферменты фазы II, как глутатион-S-трансфераза, а также ферменты и/или протеины, которые участвуют в клеточном окислении и воспалительных
реакциях.
Еще одной целью изобретения является создание новой, не содержащей сыворотки среды для культивирования, продуцирования и поддержания нормальных или непрерывных кератиноцитов и/или меланоцитов в тканевой культуре. Эта новая, не содержащая сыворотки среда может также использоваться для выделения, стабилизации и иммортализации клеток кожи человека для получения непрерывных линий меланоцитов и кератиноцитов по способу настоящего изобретения. Таким образом, конкретной целью настоящего изобретения является создание полностью определенной культуральной среды (без неизвестных или плохо определенных дополнений) для культивирования кератиноцитов без фидерных клеток, содержащих эпинефрин, который, как неожиданно было обнаружено, является сильным потенциатором роста нормальных кератиноцитов в не содержащей сыворотки среде.
Другой целью настоящего изобретения является создание нового способа для выделения, установления и иммортализации клеток кожи человека для получения непрерывных клеточных линий меланоцитов и кератиноцитов, полученных из нормальной ткани кожи человека, причем в указанном способе используют не содержащую сыворотки среду по способу настоящего изобретения и дополнительный "коктейль", содержащий фибронектин, BSA и коллаген типа I без "фидерных клеток" (например, фибробластов).
Еще одной целью изобретения является создание первичных кератиноцитов или меланоцитов, полученных в условиях без сыворотки, без использования каких-либо фидерных клеток, причем указанные первичные кератиноциты и меланоциты используют в качестве кожных трансплантатов и в ex vivo генетической терапии.
Еще одной целью изобретения является создание способов использования таких новых и улучшенных непрерывных клеточных линий кератиноцитов и меланоцитов, например, для анализов, иммунологических, фармакологических, фото- и хемотоксикологических кожных реакций и для экспрессии гетерологичных генов.
Краткое описание чертежей
На фиг.1 сравнивается рост (в единицах числа клеток) неиммортализованных DKO-NR кератиноцитов в трех различных средах, т.е. NR-3, дополненной эпинефрином,
модифицированной MCDB 153 и MCDB 153 после 6 дней.
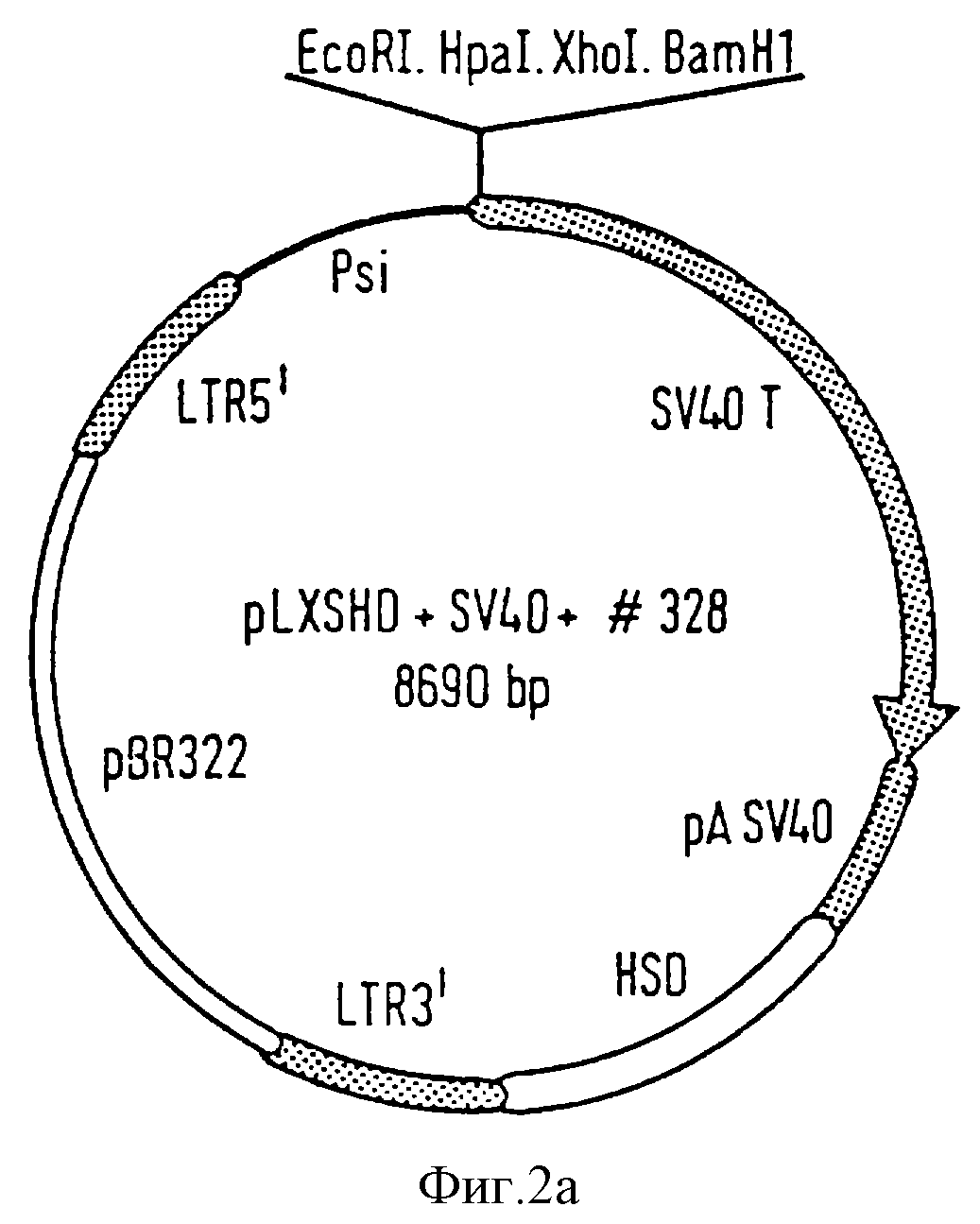
Фиг. 2а представляет SV40 ретровирусную конструкцию pLXSHD+SV40( 328), предпочтительно используемую для иммортализации рассматриваемых меланоцитов и/или кератиноцитов.
Фиг.2b представляет HPV16 ретровирусную конструкцию PLXSHD+E6/E7.
Подробное описание изобретения
В настоящем
изобретении предложены непрерывные (иммортализованные) клеточные линии, полученные из нормальных тканей человеческой кожи, т.е. иммортализованные кератиноциты и меланоцитцы, которые сохраняют
способность к дифференциации и которые сохраняют способность экспрессировать протеины дифференциации, которые экспрессируются нормальными кератиноцитами или меланоцитами, даже при большом числе
пассажей. Под большим числом пассажей подразумевают, по крайней мере, 10 пассажей в культуре, предпочтительно 20-30 пассажей, более предпочтительно, по крайней мере, 50 пассажей и, в идеале,
неопределенное число пассажей. Так, например, иммортализованные кератиноциты, продуцируемые по способу настоящего изобретения, экспрессируют протеины дифференциации кератин К1/10, кератин К14,
инволукрин, филаггрин и лорикрин даже после большого числа пассажей в тканевой культуре. Это происходит в противоположность иммортализованным кератиноцитам, о которых сообщалось ранее, которые либо не
экспрессировали такие протеины дифференциации, либо слабо экспрессировали эти протеины дифференциации.
Далее, в настоящем изобретении предложены первичные кератиноциты и меланоциты, полученные в условиях без сыворотки и без фидерных клеток, которые сохраняют способность дифференцировать и экспрессировать протеины, характерные для дифференцированных меланоцитов и кератиноцитов.
Рассматриваемые иммортализованные кератиноциты имеют профиль цитохрома р450 (CYP450), который аналогичен, если не идентичен, профилю нормальных кератиноцитов. Так, например, рассматриваемые клетки экспрессируют CYP450 3А5, но не CYP450 3А4. Кроме того, рассматриваемые иммортализованные кератиноциты экспрессируют ферменты фазы II, например глутатион-3-трансферазу (GST), и более конкретно, GSTα, GSTμ и GSTπ, сравнимо с нормальными неиммортализованными кератиноцитами.
Далее, рассматриваемые иммортализованные кератиноциты экспрессируют протины и энзимы, участвующие в клеточном окислении и воспалительных реакциях, например супероксиддисмутазу (SOD), и коллагеназу типа I и опухолевый некротический фактор α (TNFα) после обработки сложными эфирами форбола, аналогично или идентично нормальным дифференцированным кератиноцитам. Учитывая эти характеристики, эти клеточные линии обеспечивают высоко стабильный, воспроизводимый источник клеток для исследования иммунологических, фармакологических, воспалительных, фото- и хемотоксилогических кожных реакций.
Далее, рассматриваемые иммортализованные меланоциты экспрессируют эндогенно протеины, ассоциированные с меланином (см. примеры 14-15 далее).
Кроме того, рассматриваемые иммортализованные клеточные линии кератиноцитов и клеточные линии меланоцитов при культивировании в органотипической культуре образуют сильно расслоенный и поляризованный эпителий, содержащий роговичные поверхностные слои (stratum corneum). Только этого удалось достичь ранее в обычных культуральных условиях, т.е. в среде, содержащей сыворотку, с использованием фидерного слоя (см., например, Lechner et al., Virology, 185:536-571, 1991).
Далее, рассматриваемые иммортализованные кератиноциты и меланоциты получают из нормальной кожи в условиях без сыворотки и без использования каких-либо фидерных клеток. Обычно
рассматриваемые иммортализованные кератиноциты и меланоциты получают, используя следующие стадии:
(i) получение образца ткани кожи человека;
(ii) подготовка указанного образца кожи
для культивирования in vitro;
(iii) получение кератиноцитов и/или меланоцитов из указанного подготовленного образца ткани и посев указанных кератиноцитов и/или меланоцитов в не содержащую
сыворотки среду для выращивания, предпочтительно либо в среду NR-3, либо NR-4 (для меланоцитов) (описано ранее) на культуральные пластинки с покрытием, которое облегчает прикрепление и рост клеток,
причем указанное покрытие содержит фибронектин, коллаген типа 1 и BSA;
(iv) при необходимости, изменение среды для оптимизации конфлюэнтного роста культивируемых клеток при непрерывном
поддержании покрытия на культуральных пластинах;
(v) перенос кератиноцитов или меланоцитов в селекционную среду, предпочтительно не содержащую сыворотки среду, на аналогичным образом
предварительно покрытые культуральные пластины;
(vi) инфицирование кератиноцитов или меланоцитов ретровирусной конструкцией, предпочтительно конструкцией на основе SV40 или вируса папилломы
16, например SV40 плазмида pLXSHD+SV40( 328), которая содержит крупный Т антиген (Т Aq) вируса Simian 40, или плазмида pLXSHD+E6/E7, которая содержит Е6/Е7 ген вируса 16 папилломы (HPV16) (см. далее);
(vii) перенос полученных иммортализованных кератиноцитов или меланоцитов на пролиферационную среду, пригодную для пролиферации иммортализованных кератиноцитов или меланоцитов на аналогичным
образом предварительно покрытые культуральные пластины, предпочтительно NR-2 или NR-3 среду (описана далее) и меланоцитную среду М2 (источник M.Olsson Inst. of Dermatology, Uppsala, Sweden), и
(viii) перенос полученных пролиферированных кератиноцитов на дифференцирующую среду, предпочтительно NR-2 (описана далее), или модифицированную MCDB 153 среду (описана далее), которая содержит
высокую концентрацию кальция, предпочтительно 1,5 мМ, на аналогичным образом предварительно покрытые культуральные диски (Boyce et al. , J.Tissue Cult. Meth., 9:83-93, 1985; Pittlekow et al.,
J.Invest.Dermatol., 86:410-417, 1986).
Более конкретно, стадия (i) обычно включает получение образцов ткани кожи человека от людей-доноров, например тех, которые получены при хирургических операциях или в педиатрии. Иммортализация одного образца клеток кожи, т.е. автологичного образца клеток кожи, позволяет получить иммортализованные клеточные линии кератиноцитов и меланоцитов, которые демонстрируют определенные характеристики, например конкретный рецепторный профиль, который является характеристикой конкретного донора.
Затем образец кожи подготавливают на стадии (ii) так, чтобы он был пригоден для культивирования in vitro. Это осуществляют, предпочтительно вначале промывая образец кожи, например используя ту же среду, которую использовали для культивирования. Предпочтительно осуществлять это в NR-2 среде, не содержащей сыворотки среде, точный состав которой раскрыт далее, которая, как было обнаружено, удобна для культивирования кератиноцитов и меланоцитов. После промывки образец кожи сбривают, например, с помощью dermatome, а затем иссекают на мелкие кусочки.
Затем полученные срезы кожи предпочтительно разделяют на дермальные и эпидермальные. Это можно осуществить с помощью физических и/или ферментативных способов. Так, например, это можно осуществить за счет триптинизации, например, подвергая флотации "листочки" кожи в растворе трипсина (например, около 0,5%), содержащем ЕДТА (например, около 0,1%) в течение достаточного промежутка времени для того, чтобы осуществить разделение клеток, например около 30-60 минут при 37oС или в течение ночи при 4oС.
Дермис выделяют (для выделения фибробластов см. пример 2) и затем эпидермис помещают в суспензионную среду. Предпочтительно, чтобы суспензионная среда содержала раствор, ингибирующий трипсин сои (SBTI), и чтобы он контактировал с клетками в течение достаточного промежутка времени, обычно около 5 минут, для инактивации трипсина и обеспечения выделения клеток. Затем тканевую культуральную среду добавляют, предпочтительно не содержащую сыворотки NR-2 среду (описана далее), и фильтр (например, 100 мм фильтр) для получения нужных клеток, например кератиноцитов и/или меланоцитов.
Полученную первичную культуру кератиноцит/меланоцитов, полученную на стадии (ii), высевают затем на не содержащую сыворотки среду, предпочтительно NR-3 среду (подробно описанную далее), при подходящей концентрации клеток, предпочтительно около 1,2х104 клет./см2, на предварительно покрытые культуральные пластины. Однако эту концентрацию клеток можно менять в широких пределах. Культуральные пластины предпочтительно постоянно покрыты составом, который, как было неожиданно обнаружено, улучшает как прикрепление, так и рост кератиноцитов и меланоцитов, особенно в растворе фибронектина BSA и коллагена типа 1. Такой состав для покрытия клеток был описан ранее для использования с бронхиальными клетками (Lechner et al., J.Tissue Cult.Meth., 9:43-48 (1985) (включено сюда для ссылки).
На стадии (iv) культуральную среду заменяют так часто, как это необходимо для оптимизации роста клеток. Предпочтительно заменять среду примерно каждый второй день. Однако это может зависеть от конкретного образца кожи. После достижения почти полной конфлюэнтности, например конфлюэнтности около 90%, что обычно происходит после примерно 10-14 дней, кератиноциты и меланоциты затем разделяют. Это можно осуществить любыми способами, которые могут обеспечить соответствующее разделение клеток, не оказывая при этом вредного воздействия на меланоциты и/или кератиноциты. Так, например, это можно осуществить с помощью дифференциальной трипсинизации. Предпочтительно меланоциты или кераноциты обрабатывать раствором трипсин/ЕДТА, а затем переносить на селекционную среду. В случае кератиноцитов клетки предпочтительно обрабатывать около 5-10 минут раствором трипсин/ЕДТА (0,025%/0,01%), а затем на стадии (v) высевать в NR-3 среду на пластины с предварительным покрытием. Важно отметить, что NR-3 среда промотирует рост кератиноцитов, в противоположность меланоцитам. В случае меланоцитов клетки предпочтительно обрабатывать в течение около 2-4 минут раствором трипсин/ЕДТА. (О,025%/0,01%), а затем высевать на стадии (v) на NR-4 среду на аналогичные культуральные пластины с предварительным покрытием. Важно отметить, что NR-4 среда специфически ингибирует рост кератиноцитов.
Эти клетки затем обрабатывают иммортализующим агентом. В другом варианте клетки можно заморозить до осуществления иммортализации, например в жидком азоте. Инфицирование и иммортализацию предпочтительно осуществляют, используя SV40 конструкцию, определяемую как pLXSHD+SV40 ( 328), которая представлена на фиг. 2а и которая была описана Stockshlaeder et al., (GeneBank, регистрационный М64753; Stockslaeder et al. , Human Gen.Therapy, 2, 33-39,1991), или HPV16 конструкцию, определенную как pLXSHD+E6/E7, которая представлена на фиг. 2b. Конструкция pLXSHD+SV40 ( 328) содержит SV40 Т-Аg последовательность, 5' и 3' LTR последовательности SV40, рВР322 последовательности, которые обеспечивают репликацию в Е.соli множественного сайта клонирования, и последовательность полиаденилирования SV40, наряду с другими последовательностями. Конструкция pLXSHD+E6/E7 содержит вместо Т-Аg фрагмент NcoI/CfoI гена Е6/Е7 вируса 16 папилломы человека. Способ конструирования Е6/Е7 плазмиды основан на работе Durst et al. (Durst et al., 1987, Oncogene, 1: 251-256). После имморталиэации, при необходимости, осуществляют несколько пассажей клеток по время культивирования и затем полученные иммортализованные клетки переносят на пролиферационную среду стадии (vii). В случае кератиноцитов этот перенос предпочтительно осуществляют на пассаже 2.
На стадии (viii) иммортализованные клетки размножают в пролиферационной среде для иммортализованных кератиноцитов или меланоцитов, которая содержит NR-2 или NR-3 и М2-среду для меланоцитов (описана далее). Иммортализованные клетки снова культивируют на постоянно предварительно покрытых культуральных пластинах, причем это покрытие снова включает раствор фибронектина, BSA и коллагена типа 1.
После того, как клетки размножены в пролиферационной среде, их переносят на стадии (viii) в среду, которая обеспечивает дифференцирование нормальных и иммортализованных кератиноцитов. Предпочтительно, чтобы эта среда содержала NR-2 или модифицированную MCDB 153 среду с высоким содержанием кальция, предпочтительно около 1,5 мМ кальция, причем снова культивирование осуществляют на культуральных пластинах, постоянно покрытых раствором фибронектина, BSA и коллагеном типа 1.
Как было указано ранее, неожиданно было обнаружено, что иммортализованные клеточные линии кератиноцитов и меланоцитов, полученные таким образом, сохраняют способность к дифференциации и к экспрессии протеинов дифференциации, которые характерны для нормальных дифференцированных кератиноцитов и меланоцитов, даже при большом числе пассажей в тканевой культуре, т.е. после, по крайней мере, 10 пассажей. Так, например, расматриваемые иммортализованные кератиноциты экспрессируют кетатины, а также другие протеины, например инволюкрин, филаггрин и лорикрин, после большого числа пассажей, которые либо вовсе не экспрессировались, либо мало экспрессировались иммортализованными кератиноцитами SV40, о которых сообщалось ранее.
Более конкретно, некоторые иммортализованные клеточные линии кератиноцитов, полученные по способу настоящего изобретения, DK2-NR, DK3-NR и FK2-NR (см. таблицы 7 и 8 далее), экспрессируют протеины дифференциации К1/10, кератин К14, инволюкрин, филаггрин и лорикрин, даже после большого числа пассажей (более 30 пассажей). Кроме того, иммортализованные кератиноциты, полученные по способу настоящего изобретения, имеют CYP450 профиль, который аналогичен, если не идентичен, профилю нормальных кератиноцитов человека. Так, например, рассматриваемые иммортализованные кератиноциты экспрессируют CYP450 1А1, 2С, 2Е1 и 3А5, но не экспрессируют CYP450 1А2, 2А6, 2В6 и 2D6, которые характерны для профиля цитохрома 450 нормальных кератиноцитов. Впервые удалось продемонстрировать, что нормальные и иммортализованные кератиноциты человека экспрессируют CYP450 3А5, а не CYP450 3А4.
Далее, рассматриваемые иммортализованные клеточные линии кератиноцитов экспрессируют ферменты фазы-II, например глутатион-3-трансферазы (GST), сравнимо с нормальными дифференцированными кератиноцитами. Более конкретно, рассматриваемые клеточные линии кератиноцитов экспрессируют GSTα, GSTμ и GSTπ сравнимо с нормальными кератиноцитами.
Далее, рассматриваемые иммортализованные кератиноциты экспрессируют ферменты и другие протеины, которые участвуют в клеточном окислении и воспалительных реакциях сравнимо с нормальными кератиноцитами. Так, например, иммортализованные кератиноциты, полученные по способу настоящего изобретения, экспрессируют супероксиддисмутазу (SOD). Также, в ответ на сложные эфиры форбола иммортализованные кератиноциты, полученные по способу настоящего изобретения, экспрессируют коллагеназу типа 1 (медиатор воспалений) и TNF-α (альфа-фактор некроза опухоли).
Рассматриваемые меланоциты обладают способностью экспрессировать протеины, связанные с меланином, и виментин.
Более того, рассматриваемые иммортализованные клеточные линии при выращивании в органотипической культуре образуют сильно расслоенный и поляризованный эпителий с ороговевшими поверхностными слоями (stratum corneum) даже при большом числе пассажей (более 20 пассажей). Ранее об этом сообщалось только один раз для иммортализованных клеточных линий кератиноцитов, установленных в обычных условиях культивирования, т.е. в среде, содержащей сыворотку, и с использованием фидерного слоя.
Рассматриваемые иммортализованные клеточные линии получают в условиях полного отсутствия сыворотки и без использования какого-либо фидерного слоя во время культивирования.
Более того, как будет подробно раскрыто далее, неожиданно было обнаружено, что эпинефрин является сильным фактором роста для нормальных кератиноцитов, если его используют в среде, не содержащей сыворотки. Более конкретно, NR-3 среда, описанная далее, содержит эпинефрин, который, как было обнаружено, усиливает рост нормальных кератиноцитов (см. фиг.1). Это весьма удивительно, учитывая тот факт, что эпинефрин, как сообщалось ранее, ингибирует рост кератиноцитов (Halprin, J.Invest.Dermatol., 81:553-557 (1983)) или оказывает умеренное действие на рост клеток кератиноцитов (Koizumi et al., J.Invest.Dermatol., 96:234-237, 1991).
Кроме того, неожиданно было обнаружено, что постоянное покрытие культуральных чашек или пластин, используемое для культивирования первичных и иммортализованных кератиноцитов и/или меланоцитов, в частности покрытием или "коктейлем", содержащим фибронектин, BSA и коллаген типа 1, улучшает как прикрепление кератиноцитов и меланоцитов к культуральным пластинам или чашкам, так и усиливает рост клеток. Использование такого кроющего материала ранее не было описано для использования с иммортализованными кератиноцитами и/или меланоцитами.
Как обсуждалось, настоящее изобретение далее специфически предлагает новую, не содержащую сыворотки, среду, называемую NR-3 средой. Эта среда позволяет культивировать и выделять нормальные кератиноциты и/или меланоциты из кожи человека в условиях без сыворотки и без использования фидерного слоя. Как было обнаружено, эта среда усиливает рост нормальных кератиноцитов и позволяет устанавливать (получать) культуры нормальных кератиноцитов без какого-либо контакта с сывороткой или фидерными клетками.
Точный состав среды NR-3 представлен на стр.52. Эта среда содержит различные аминокислоты, неорганические соли в виде следовых элементов, витамины, факторы роста и другие составляющие. Так, например, эта среда содержит в качестве факторов роста эпидермальный фактор роста (EGF рекомбинант), инсулин, гидрокортизон, трансферрин (человеческий), бычий гипофизный экстракт и эпинефрин. Как отмечалось, неожиданно было обнаружено, что эпинефрин усиливает рост первичных кератиноцитов в тканевой культуре.
В качестве аминокислот эта среда содержит L-аланин, L-аргинин-HCl, L-аспарагин-Н2О, L-аспарагиновую кислоту, L-цистеин-НСl-Н2О, L-глутаминовую кислоту, глутамин, глицин, L-гистидин-НС1-Н2О, L-изолейцин, L-лейцин, L-лизин-НСl, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин.
Содержащиеся в среде неорганические соли включают аммонийметаванадат, аммониймолибдат, кальцийхлорид, сульфат меди (2), сульфат железа(2), магнийхлорид, хлорид марганца, сульфат никеля, хлорид калия, ацетат натрия, бикарбонат натрия, натрийхлорид, двухосновной натрийфосфат, пируват натрия, селенит натрия, силикат натрия, хлорид олова и сульфат цинка.
Содержащиеся в среде NR-3 витамины включают d-биотин, d-кальцийпантотенат, холинхлорид, цианкокальбумин, фолевую кислоту, i-инозитол, никотинамид, пиридоксин и рибофлавин.
Далее среда содержит аденин, этаноламин, фосфоэтаноламин, фенол красный Na, путресцин 2НСl, тиамин НСl, тиоктовую кислоту, тимидин, глюкозу, HEPES и антибиотики (фунгизон, пенициллин и стрептомицин).
Предпочтительный состав NR-3 среды представлен на стр. 52. Однако ожидается, что концентрация заместителей, содержащихся в NR-3 среде, может меняться в широких пределах. Более конкретно, ожидается, что количества различных заместителей могут меняться от ±50 до ±0,1%, более предпочтительно от ±10 до ±0,1% от концентраций, представленных на стр.52. Более того, ожидается, что одна или более из указанных составляющих может быть исключена, а другие составляющие могут быть добавлены при условии, что такие замены составляющих не будут оказывать вредного воздействия на выделение и стабилизацию первичных клеточных культур кератиноцитов или меланоцитов и иммортализованных клеточных линий. Это может определить специалист с помощью анализа проб и ошибок.
Как указывалось, существенным составляющим среды NR-3, не содержащей сывортки, является эпинефрин. Было обнаружено, что эпинефрин является очень сильным промотором роста первичных кератиноцитов человека.
Причина, по которой эпинефрин усиливает пролиферацию кератиноцитов, неясна. Сообщалось, что кератиноциты человека экспрессируют ферменты для синтеза эпинефрина, а также экспрессируют с высокой плотностью бета-2-адренорецепторы (Schallreuther et al., "Production of catecholamines in the human epidermis", Biochem. and Biophys. Res. Commun., 189:72-78 (1992)). Эти ферменты вовлечены в схему биосинтеза катехоламина, в частности фенилэтаноламин-N-метилтрансферазы и биоптеринзависимой тирозингидроксилазы. Напротив, такую ферментативную активность нельзя определить у меланоцитов и фибробластов. Соответственно ферментативная активность и/или экспрессия рецепторов может объяснить способность эпинефрина модулировать пролиферацию кератиноцитов.
Авторы изобретения предполагают, что NR-3 среда усиливает выделение и стабилизацию первичных клеточных культур и клеточных линий, так как она подавляет дифференциацию клеток, что ведет к обогащению клеток, что поддерживает их способность дифференцировать и экспрессировать протеины и ферменты, экспрессируемые нормальными дифференцированными кератиноцитами и меланоцитами.
Более конкретно, считают, что рост кератиноцитов или меланоцитов в среде, содержащей сыворотку, способствует дифференциации на первом пассаже. Однако это невыгодно (во время начального периода культивирования), так как дифференцированные клетки растут слабо. Это, в свою очередь, приводит к избыточному росту и селекции пролиферативных кожных клеток, которые обладают лишь слабой способностью к дифференциации. Соответственно число клеток, которые обладают высокой способностью к дифференциации, уменьшено, если сыворотку добавляют к среде до иммортализации.
Напротив, в настоящем изобретении кератиноциты и меланоциты культивируют в не содержащей сыворотки среде и в условиях, которые ингибируют дифференциацию меланоцитов и кератиноцитов. В настоящем изобретении не содержащую сыворотки среду предпочтительно используют на протяжении всего периода культивирования, как до, так и во время иммортализации, а также в процессе пролиферации и дифференциации.
Как было отмечено, рассматриваемая NR-3, не содержащая сыворотки среда, ингибирует дифференциацию кератиноцитов, и, таким образом, обеспечивает выделение первичных клеточных культур кератиноцитов и полученных из них иммортализованных клеточных линий. Более того, эта не содержащая сыворотки среда содержит низкие концентрации кальция, что ингибирует селективно рост совместно выделенных фибробластов. Это приводит к высоко селективной ростовой среде, что благоприятствует получению культур, которые преимущественно содержат меланоциты и кератиноциты. Соответственно рассматриваемая NR-3 среда выгодна благодаря тому, что она ингибирует дифференциацию кератиноцитов и также ингибирует рост фибробластов.
Как обсуждалось ранее, клеточную суспензию, полученную из одного образца кожи, который содержит диссоциированные меланоциты, кератиноциты и фибробласты, предпочтительно культивируют в рассматриваемой NR-3 среде. Это осуществляют, высевая такие клетки на культуральные чашки, которые постоянно покрыты составом, который облегчает их прикрепление. Предпочтительно, чтобы такое покрытие содержало смесь фибронектина, альбумина бычьей сыворотки и коллаген типа 1. Такое прокрытие, или "коктейль" покрытия, ранее было описано для бронхиальных клеток (Lechner et al., J.Tiss.Cult.Meth., 9:43-48 (1985)). Авторы настоящего изобретения обнаружили, что такой коктейль также усиливает прикрепление кератиноцитов и меланоцитов к пластиковым культуральным чашкам. Более того, неожиданно было обнаружено, что указанное постоянное покрытие культуральных пластин, которые используют для культивирования первичных и иммортализованных кератиноцитов, еще усиливает рост клеток. Такое постоянное покрытие культуральных пластин ранее не было описано для иммортализованных кератиноцитов или меланоцитов.
Во время культивирования первичные клеточные культуры предпочтительно разделяют, когда они достигают, или практически достигают, конфлюэнтности, а затем размножают на других культуральных чашках с покрытием. Обычно клеточные культуры делят примерно каждые 10-14 дней.
После того как было осуществлено культивирование первичных меланоцитов и/или кератиноцитов и их число увеличено до нужного количества в NR-3 среде, не содержащей сыворотки, с использованием описанных культуральных чашек с нанесенным покрытием, их подвергают иммортализации. Предпочтительно, чтобы меланоциты и кератиноциты, которые демонстрируют наилучший рост, были иммортализованы. Однако в другом варианте размноженные первичные меланоциты или кератиноциты можно использовать до иммортализации, например в анализах, при трансплантации кожи или в генной терапии.
Иммортализацию как меланоцитов, так и кератиноцитов можно осуществить с помощью вектора, который обеспечивает экспрессию SV40 Т-антигена или экспрессию Е6/Е7 гена вируса 16 папилломы человека (HPV16). Предпочтительно осуществлять иммортализацию за счет инфицирования меланоцитов или кератиноцитов ретровирусной конструкцией, которая обеспечивает экспрессию SV40 Т-антигена или Е6/Е7 гена HPV16. Клеточное Т-Аg инфицирование основано на протоколе Pfeifer et al., Meth.Cell Sci., 17:83-89, 1995 (за исключением того, что вирус получают из упакованной клеточной линии, присланной в DMEM, 10% фетальной телячьей сыворотке). Во время инфицирования используют содержащую сыворотку среду. Однако для меланоцитов и кератиноцитов предпочтительна не содержащая сыворотки среда, например предпочтительна РС-1 среда, раскрытая в статье Pfeifer et al., Meth.Cell.Sci., 14, 83-89 (1995), которая включена сюда в качестве ссылки. Более предпочтительно осуществлять иммортализацию, используя ретровирусную конструкцию, называемую pLXSHD+SV40 ( 328), представленную на фиг.2а и основанную на конструкции Pfeifer et al. and Stockshlaeder et al. (СепеВаnк, регистрационный M64753), или называемую pLXSHD+E6/E7, представленную на фиг.2b и основанную на конструкции Durst et al., 1987, Oncogene 1, 251-256.
После иммортализации иммортализованные клеточные линии переносят на пролиферационную среду, предпочтительно NR-2 или NR-3, или М2 (для меланоцитов), используя культуральные чашки с предварительно нанесенным покрытием. После того как клетки пролиферируют до нужного количества клеток, их переносят на дифференцирующую среду, подходящую для культивирования нормальных и иммортализованных кератиноцитов. Предпочтительно, чтобы она включала NR-2 или модифицированную MCDB 153 с высоким содержанием кальция (1,5 мМ) или М2 (для меланоцитов), используя культуральные пластины с предварительно нанесенным покрытием (то же самое BSA, коллаген типа 1, фибронектиновое покрытие).
Как было указано ранее, дифференцированные иммортализованные клеточные линии кератиноцитов и меланоцитов, полученные по способу настоящего изобретения, демонстрируют улучшенные свойства, которые делают эти клеточные линии хорошо приспособленными для использования в анализах, в которых нужны дифференцированные клетки кожи человека. В частности, эти клеточные линии, как было обнаружено, экспрессируют протеины, характерные для нормальных дифференцированных меланоцитов и кератиноцитов даже после большого числа пассажей.
Так, например, если иммортализованные кератиноциты, полученные по способу настоящего изобретения, анализируют с помощью Вестерн-блоттинга и RT-PCR, они обладают цитохромным p450 (CYP450) профилем, аналогичным, если не идентичным, нормальным кератиноцитам. Более конкретно, иммортализованные кератиноциты, полученные по способу настоящего изобретения, экспрессируют CYP450 1А1, 2С, 2Е1, 3А5 и не экспрессируют CYP450 1А2, 2А6, 2В6 и 2D6. Такой CYP450 профиль соответствует профилю нормальных кератиноцитов. Такая схема метаболизма ранее не была описана для иммортализованных кератиноцитов. Действительно, впервые появилась возможность продемонстрировать то, что нормальные и иммортализованные кератиноциты экспрессируют CYP450 3А5, но не CYP450 3А4. Далее, иммортализованные кератиноциты, полученные по способу настоящего изобретения, при анализе с помощью антител, специфических для маркеров дифференциации, как было обнаружено, экспрессируют другие протеины дифференциации даже после большого числа пассажей. Более конкретно, рассматриваемые клеточные линии экспрессируют протеины дифференциации К1/10, кератин К14, инволюкрин, филаггрин и лорикрин даже после большого числа пассажей, например после 10 пассажей и после существенно большего числа пассажей.
Рассматриваемые иммортализованные кератиноциты и меланоциты также захватывают экзогенные незаменимые жирные кислоты (EFA) и демонстрируют десатурацию и удлинение цепи EFA значительно, соответствующие нормальным меланоцитам и кератиноцитам.
Далее, как описано более подробно далее, рассматриваемые иммортализованные кератиноциты экспрессируют TNFα и медиатор воспалений коллагеназу типа 1 при обработке сложными эфирами форбола сравнимо с нормальными кератиноцитами. Далее, рассматриваемые иммортализованные кератиноциты экспрессируют супероксиддисмутазу, фермент, который участвует в клеточном окислении аналогично нормальным диференцированным кератиноцитам.
Далее, иммортализованные меланоциты, полученные по способу настоящего изобретения, обработанные индукторами меланогенеза (например, теофиллином и тирозином) и ингибиторами меланогенеза (коджиевой (kojic) кислотой), реагируют аналогично реакциям нормальных меланоцитов.
Учитывая эти свойства, расматриваемые иммортализованные кератиноциты и меланоциты, хорошо приспособлены для иммунологических, фармакологических, фото- и хемотоксикологических исследований кожных реакций.
Так, например, рассматриваемые
иммортализованные клеточные линии кератиноцитов и меланоцитов и первичные меланоциты и кератиноциты можно использовать в анализах, которые требуют дифференцированных клеток кожи, например при
исследовании барьерных функций (корнификация) восстановленной кожи, при исследованиях метаболизма дифференцированных кератиноцитов (метаболизм жирных кислот, метаболизм антиоксидантов), при
исследованиях, касающихся влияния ультрафиолетовой радиации на клетки кожи, при исследованиях, касающихся воздействий
потенциальных кожных ирритантов (веществ, вызывающих раздражение кожи) и
сенсибилизаторов на клетки кожи, при исследованиях, в которых измеряют воздействие соединений на продуцирование меланина, при исследованиях метаболизма липидов, поверхностной обработки ксенобиотиками
(например, косметическими маслами, при скринировании для выявления предполагаемых защитных соединений, например фотопротекторов), при исследовании воспалений и раздражений кожи, и т.д.
Далее, иммортализованные клеточные линии кератиноцитов и меланоцитов и первичные меланоциты и кератиноциты, полученные по способу настоящего изобретения, можно использовать для скринирования потенциальных противораковых агентов и соединений, полезных при лечении кожных заболеваний. Такие исследования обычно включают экспонирование клеточной линии или первичных клеток таким соединениям в течение определенного промежутка времени и определение того, вызывают ли они какие-либо вредные воздействия, например генотоксичность, образование ДНК аддукта, мутагенность, трансформацию клеток или цитотоксичность.
Далее, рассматриваемые клеточные линии меланоцитов и кератиноцитов можно использовать для экспрессии рекомбинантных протеинов, например человеческих протеинов и полипептидов, а также для получения РНК и ДНК.
Далее, рассматриваемые иммортализованные клеточные линии обладают потенциальной способностью для ex vivo генетической терапии. Рассматриваемые клеточные линии должны предоставлять полезный инструмент для генетического мечения и разработки генетически сконструированных клеток, которые экспрессируют нужные генные продукты, например, для терапевтических применений или для исследования токсичности/мутагенности клеток. Более того, учитывая тот факт, что рассматриваемые клеточные линии близко имитируют клетки нормальной кожи, они должны хорошо подходить для анализов биочувствительности.
Далее, первичные кератиноциты и меланоциты, полученные по способу настоящего изобретения, с учетом того, что их получают в условиях отсутствия сыворотки, могут быть использованы в генной терапии. Существенно то, что, так как эти клетки не экспонировались сыворотке, например бычьей сыворотке или сыворотке какого-либо другого животного (за исключением времени вирусного инфицирования и хранения в жидком азоте), они должны быть менее подвержены потенциальным загрязнениям в виде вирусов или других патогенных агентов. Поэтому их использование должно свести к минимуму риск передачи этими клетками патогенных или инфекционных факторов в процессе генной терапии. Такая ex vivo генная терапия перспективна при лечении таких заболеваний, как эпидермолиз буллоза (нарушение, связанное с мутацией кератина), витилиго (нарушение, включающее гены синтеза меланина), карциномы и меланомы, аллергические нарушения и нарушения, связанные с воспалениями. Что касается терапевтического лечения, то единственным потенциальным источником загрязнений является бычий гипофизный экстракт, бычий инсулин, бычий коллаген, альбумин бычьей сыворотки или человеческие фибронектин и трансферин.
Кроме того, рассматриваемые иммортализованные клеточные линии меланоцитов и кератиноцитов и первичные меланоциты и кератиноциты используют в анализах ДНК мутагенеза, в анализах скринирования для кожного мутагена, в анализах для идентификации агентов, повреждающих хромосомы, в исследованиях превращений злокачественных опухолей, в исследованиях биохимии клеток (например, в анализах активации CYP450), при скринировании для выявления соединений и композиций, например "коктейлей" незаменимых жирных кислот, которые участвуют в воспалительных и аллергических реакциях, в анализах активации коллагеназы (связанных с воспалениями), включая TNFα, детектирование интерлейкина.
Существенным потенциальным применением первичных кератиноцитов или меланоцитов, полученных по способу настоящего изобретения, учитывая их доступность и способ получения, является их использование для кожной трансплантации. Так как эти первичные кератиноциты и меланоциты получают в условиях отсутствия сыворотки, они представляют минимальный риск быть зараженными патогенами (например, вирусами) и инфекционными агентами. Более того, так как рассматриваемые меланоциты и кератиноциты могут быть получены от автологусного хозяина, т.е. пациента с обширным ранением, это должно свести к минимуму или исключить риск отторжения трансплантата, или риск возникновения другой вредной иммунологической реакции, а также свести к минимуму риск инфицирования.
Примерами специфических иммортализованных клеточных линий кератиноцитов, полученных по способу настоящего изобретения, являются FK2-NR, DK2-NR и DK3-NR, которые были депонированы 5 октября 1995 г. в DSM-Deutsche Sammlung von Mikroorganismen und ZeIlKulturen GmbH, по адресу Mascheroder Weg в D-38124 Branschweig Germany, и которым были присвоены регистрационные номера DSM ACC2240, DSM ACC2238 и DSM АСС2239 соответственно. Кроме того, экземпляры специфических иммортализованных линий меланоцитов человека, полученных по способу настоящего изобретения, представляют DM2-NR, которая депонирована 11 декабря 1996 г. в Pasteur Institut no адресу 25 rue de Docteur Roux 75724 Paris France под регистрационным номером CNCM I-1796. Эти депозиты сделаны в соответствии с Будапештским соглашением. Все ограничения относительно доступности этих клеточных линий будут немедленно сняты после получения патента на эту заявку или на другую заявку с более ранним приоритетом по отношению к рассматриваемой.
Другие особенности настоящего изобретения станут очевидны в процессе рассмотрения предпочтительных вариантов, которые приведены только с целью иллюстрации изобретения и не должны его ограничивать.
ПРИМЕР 1. Характеристика стабилизированных клеток кожи.
В таблице 1 перечислены все образцы кожи, которые были обработаны в отношении вирусной инфекции. Выделенные кератиноциты, которые продемонстрировали наилучший рост клеток, были использованы для иммортализации.
Фибробласты человека выделяют из образцов кожи FKO-NR, GKO-NR, DKO-NR. После разделения дермальной и эпидермальной частей дермис нарезают на маленькие кусочки размером 0,2х0,2 мм и фиксируют на 6 см культуральной пластине с сывороткой. Через 2-4 часа добавляют минимальную поддерживающую среду Дульбекко (DMEM, 10% FCS ).
Эту эксплантатную среду инкубируют до тех пор, пока разрастание фибробластов не становится заметным. Конфлюэнтные фибробластные культуры разделяют и размножают для получения замороженных запасов.
ПРИМЕР 2.
1) Характеристика роста кератиноцитов в среде без сыворотки
Культуры первичных клеток культивируют в модифицированной MCDB 153 (Boyce et al., J.Tissue Cult. Meth., 9:83-93 (1985); и Pittlekow et al., J. Invest.Dermatol., 86:410-417, 1986) и NR-3 среде.
Наилучший рост клеток наблюдается в NR-3 среде (фиг.1). Улучшенный рост клеток наблюдается также в полностью определенной NR-3 среде (NR-3 без бычьего гипофизного экстракта, ВРЕ) по сравнению с
модифицированной MCDB 153 без ВРЕ.
На фиг. 1 представлено сравнение роста клеток в NR-3 и дополненной эпинефрином модифицированной MCDB 153 (среда для выращивания кератиноцитов) через 6 дней. Модифицированная MCDB 153 среда относится к модифицированной MCDB 153. Кератиноциты собирают в трипсин/ЕДТА (0,05%/0,01%) и подсчет ведут с помощью гемоцитометра. Полученные результаты, представленные на фиг.3, являются средними значениями из трех повторов.
2) Влияние покрытия на прикрепление клеток и рост клеток
Было обнаружено, что нанесение покрытия на
культуральные пластины улучшает прикрепление клеток и рост клеток нормальных кератиноцитов. В частности, представленные в таблице 2 результаты, сравнивают рост кератиноцитов в культуральных пластинах
с нанесенным покрытием или без него. На пластины 3,5 см, содержащие NR-3 среду, высевают 100000 кератиноцитов.
ПРИМЕР 3.
1) Иммортализация кератиноцитов
Суспензию клеток, полученную из образцов кожи, описанных в примере 1, которая содержит диссоциированные меланоциты, кератиноциты и фибробласты, культивируют в рассматриваемой NR-3 среде. Это
осуществляют, высевая такие клетки на культуральные чашки, которые постоянно покрыты "коктейлем"-покрытием, описанным ранее для бронхиальных клеток (Lechner et al., J.Tiss. Cult. Meth. , 9:43-48
(1985). Во время культивирования первичных клеточных культур, когда они достигают или практически достигают конфлюэнтности, клетки обрабатывают в течение 4 минут трипсин/ЕДТА (0,025%/0,01%). Во время
этой обработки меланоциты отделяются от культуры кератиноцитов и их собирают отдельно. Таким образом, первичные меланоциты и кератиноциты разделяют на этой стадии. После того, как первичные
кератиноциты были культивированы и размножены до нужного числа клеток в NR-3 среде, не содержащей сыворотки, с использованием описанных культуральных чашек с покрытием (промотирует рост кератиноцитов
против меланоцитов), их подвергают иммортализации. Иммортализацию кератиноцитов осуществляют с помощью ретровирусной конструкции pLXSHD+SV40 ( 328), которая обеспечивает экспрессию SV40 Т-антигена
(см. Pfeifer et al. , Meth.Cell Sci., 17:83-89, 1995; за исключением того, что вирус получают из упакованной клеточной линии, поставляемой в DMEM, 10% фетальная сыворотка теленка). Во время
инфицирования используют PC-1 среду, не содержащую сыворотки, описанную в статье Pfeifer et al., Meth.Cell Sci., 14, 83-89 (1995). После иммортализации иммортализованные клеточные линии переносят на
NR-2 или NR-3 пролиферационную среду, используя культуральные чашки с предварительно нанесенным покрытием. После пролиферации клеток до нужного числа клеток их переносят на дифференцирующую среду,
пригодную для культивирования нормальных и иммортализованных кератиноцитов.
2) Клеточная пролиферация иммортализованных кератиноцитов при большом числе пассажей
Иммортализованные кератиноциты, как было показано, демонстрируют улучшенный рост клеток при большом числе пассажей. Это представлено далее в таблице 3. Это демонстрируется с помощью оценки времени
удвоения популяции (PDT: время, необходимое для одного удвоения популяции во время логарифмической фазы роста). Метод: кератиноциты собирают в трипсин/ЕДТА (0,05%/ 0,01%) и подсчитывают, используя
гемоцитометр. Представленные результаты представляют среднее значение из трех повторов.
3) СYР450-экспрессия в иммортализованных линиях кератиноцитов человека
CYP4501A1, 1А2,
3А5, 2Е1, 2В6, 2А6 и 2D6 экспрессию анализируют в клеточных линиях нормальных и иммортализованных кератиноцитах кожи с помощью Вестерн-блоттинга (протеин-экспрессия) и RT-PCR (мРНК-экспрессия, см.
таблицу 4). Экспрессированный CYP450 в иммортализованных кератиноцитах аналогичен нормальным кератиноцитам. Скорость экспрессии слегка понижена. Однако DК2-NR-линия демонстрирует почти нормальную
скорость экспрессии CYP450. Способ: RT-PCR (обратная транскриптаза-полимеразная цепная реакция) со специфическим праймером для CYP450 (Mace et al., готовится к печати).
4) Реакция на
СYР450-индуктор
Клеточные линии реагируют на СYР450-индуктор бенз(а)пирен подобно неиммортализованным клеткам даже при большом числе пассажей (см. таблицу 5). Такое индуцирование не было
описано для Т-Аg иммортализованных кератиноцитов.
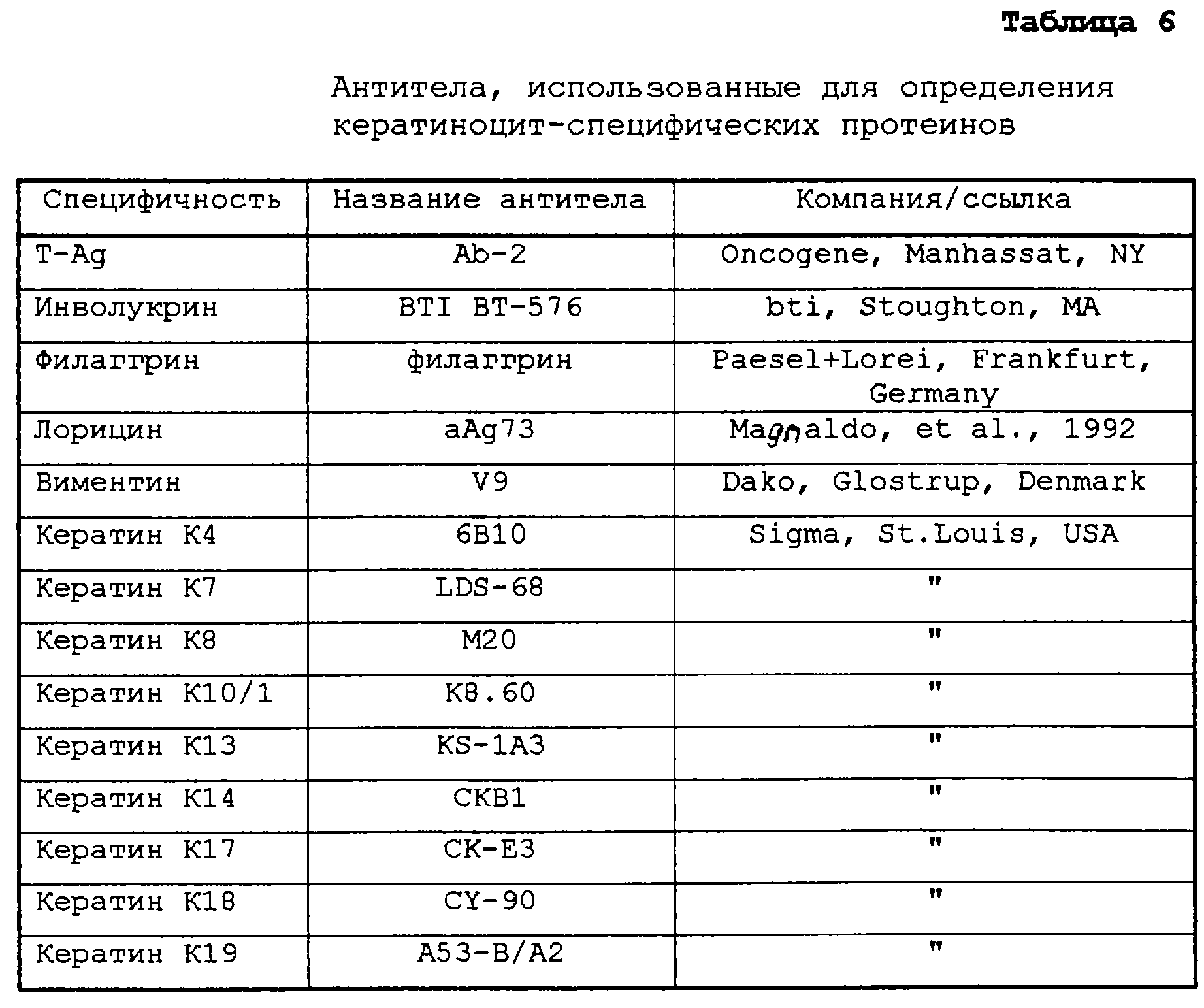
5) Диференциация клеток
Маркеры дифференциации анализируют, используя специфические антитела. Использованные специфические
антитела представлены в таблице 6. Наивысшую дифференцирующую способность можно продемонстрировать в DK2-NR и DK1-NR клонах (таблицы 7 и 8).
6) Экспрессия глутатион-3-трансферазы
Фермент II фазы глутатион-3-трансферазы (GST) анализируют с помощью Норзерн-блоттинга и Вестерн-блоттинга. Все линии кератиноцитов экспрессируют сильно мРНК для GSTπ, но не GSTα и
не GSTμ (таблица 9, способ: Норзерн-блоттинг). Профиль экспрессии протеина GSTα, GSTμ и GSTπ в клеточных линиях аналогичен профилю для нормальных кератиноцитов.
7) Метаболизм незаменимых жирных кислот (ЕРА)
Для анализа и сравнения десатурации и удлинения добавленных EFA к кератиноцитам, иммортализованные (DK1-NR, FK2-NR) и нормальные
кератиноциты обрабатывают линолевой кислотой (LA, 15 мкМ) и α-линоленовой кислотой (LN, 15 мкМ). Для этих экспериментов используют EFA-дефицитную NR-2 (Biofluids Inc. ). Клеточные культуры
обрабатывают после достижения конфлюэнтности и сдвигая NR-2 высоким содержанием кальция (1,5 мМ). Клетки обрабатывают в течение 4 дней EFA (обновляя после 2 дней).
EFA анализ осуществляют с помощью экстракции и выделения фосфолипидов с помощью ТСХ (тонкослойная хроматография) и количественно определяют метиловые сложные эфиры жирных кислот с помощью GLC (газо-жидкостная хроматография). Образование десатурации и удлинения продуктов LA (20:4н-6 и 22:4н-6) и LN (20:5н-3, 22:5н-3 и 22:6н-3) можно продемонстрировать. Такой профиль метаболизма соответствует профилю, наблюдаемому для нормальных кератиноцитов.
8) Кариотипирование
Все клеточные линии были гиподиплоидными с количеством большинства хромосом в диплоидном интервале (за
исключением DK2-NR с количеством хромосом в гипотетраплоидном интервале). Клетки, отличающиеся от клеток анализированных клеточных линий, в культурах не определялись. Этот результат подтверждает
чистоту клеточных линий и отсутствие клеточных загрязнений из других источников.
9) Характеристика in vivo
Онкогенность иммортализованных кератиноцитов определяют, осуществляя
подкожные инъекции (1-2 мио кератиноцитов) голым мышам. Тестированные кератиноцитные линии DK2-NR, DK3-NR, FK2-NR оказались неонкогенными для голых мышей (4 месяца инкубационный период), DK3-NR,
однако, оказалась слабо онкогенной для 6 животных из 10 после 5 месяцев инкубационного периода.
10) Реакция на раздражение кожи
Индуцирование "стрессового гена" TNFα
(альфа-фактор некроза опухоли) после обработки кожным ирритантом РМА (форбол-12-миристат-13-ацетат), SDS (додецилсульфат натрия), DMSO (диметилсульфоксид), IL-1 β (интерлейкин 1β) и UV-B
(ультрафиолет В) анализируют с помощью Норзерн-блоттинга и биологических анализов (см. таблицу 10). Кератиноцитные линии реагируют на РМА и UV-B и экспрессируют TNFα, даже при большом числе
пассажей.
После обработки иммортализованных кератиноцитов сложными эфирами форбола (РМА) наблюдается повышение экспрессии коллагеназы (типа I).
11) Органотипические
культуры
Проводили также культивирование кератиноцитов человека в органотипических условиях (кератиноциты выращивали с доступом воздуха на коллагеновом геле с фидерными клетками). Все
кератиноцитные линии демонстрируют гиперпролиферативную морфологию по сравнению с нормальными кератиноцитами. Эти исследования были проведены в культуральной среде без сыворотки. Гиперпролиферативный
рост клеток снижается в условиях без присутствия сыворотки (NR-2 с высоким содержанием кальция (1,5 мМ) на культуральных чашках с пластиковыми вставками без коллагенового геля и фидерных клеток).
ПРИМЕР 4.
1) Иммортализация меланоцитов
Клеточную суспензию, полученную из образца кожи DKO-NR, описанного в примере 1, которая содержит диссоциированные
меланоциты, кератиноциты и фибробласты, культивируют в рассматриваемой NR-3 среде. Это осуществляют, высевая такие клетки на культуральные чашки, которые постоянно покрыты "коктейлем", описанным ранее
для бронхиальных клеток (Lechner et al., J. Tiss. Cult.Meth., 9:43-48(1985)). Во время культивирования первичных клеточных культур, когда они достигают или практически достигают конфлюэнтности, клетки
обрабатывают в течение 4 минут трипсин/ЕДТА (0,025%/0,01%). Во время такой обработки меланоциты отделяются из культуры кератиноцитов и их собирают отдельно. Первичные меланоциты и кератиноциты, таким
образом, разделяют на этой стадии. Затем собранные первичные меланоциты высевают в NR-4, не содержащую сыворотки среду, которая специфически ингибирует рост кератиноцитов. После культивирования
первичных меланоцитов и их размножения до нужного числа клеток в NR-4, не содержащей сыворотки среде, с использованием описанного покрытия культуры их подвергают иммортализации. Иммортализацию
меланоцитов осуществляют с помощью ретровирусной конструкции pLXSHD+SV40( 328), которая обеспечивает экспрессию SV40 Т-антигена (см. Pfeifer et al., Meth. Cell Sci. , 17:83-89, 1995; за исключением
того, что вирус получают из упакованной клеточной линии, поставляемой в DMEM, 10% фетальной сыворотки теленка). Во время инфицирования используют РС-1, не содержащую сыворотки среду, описанную в
статье Pfeifer et al., Meth.Cell Sci., 14, 88-89 (1995). После иммортализации иммортализованные клеточные линии переносят на М2 пролиферационную и дифференцирующую среду DMEM/F12 среда, Biofluids, 148;
можно также купить у M.Olssen, Uppsala, Sweden).
2) Харатеристика Т-Аg экспрессирующих меланоцитов человека
Экспрессию связанных с меланином протеинов иммортализованных
меланоцитов, полученных по способу настоящего изобретения (особенно DM2-NR), сравнивают с нормальными меланоцитами. Продемонстрировано, что иммортализованные клетки экспрессируют связанные с меланином
протеины, связанный с меланомой антиген (МАА) и НМВ45, аналогично с нормальными клетками, хотя и с меньшим уровнем экспрессии.
3) Индуцирование синтеза меланина
Меланогенез
Т-Аg экспрессирующих меланоцитных клеточных линий (особенно линии DM2-NR) сравнивают с нормальными меланоцитами. Меланоциты обрабатывают индукторами меланогенеза - тирозином и теофиллином, и
ингибитором меланогенеза - коджиевой кислотой. Меланоцитные линии (особенно DM2-NR) реагируют на модулятор меланогенеза сравнимо с нормальными клетками. Показано также, что индуцирование/ингибирование
меланогенеза происходит дозо-зависимым образом.
ПРИМЕР 5.
Штамм DKO-NR, описанный в примере 1, подвергают иммортализации, как указано ранее, используя ретровирусную конструкцию pLXSHD+E6/E7 на основе HPV16, которая представлена на фиг.2b. Отбирают несколько непрерывных линий кератиноцитов. Результаты анализа этих линий с точки зрения продуктов дифференциации (цитокератинов, GST, TNFα, инволукрина, филаггрина, лорикрина, виментина) аналогичны результатам, полученным для линий DK2-NR и DK3-NR.
ПРИМЕР 6.
Далее приводится сравнение состава новой NR-3 среды настоящего изобретения и некоторых других, не содержащих сыворотки сред настоящего изобретения, т.е. NR-1, NR-2 и NR-4.
1) Состав среды
NR-1 (см. далее)
Аминокислоты - NR-1 (мг/литр)
L-аланин - 9,0000
L-аргинин, НС1 - 316,0000
Аспарагин, Н2О - 15,0000
L-аспарагиновая кислота - 4,
0000
L-цистеин, НС1, Н2О - 42,0000
L-глутаминовая кислота - 14,8000
Глутамин - 877,0000
Глицин - 7,6000
L-гистидин, НС1, Н2О - 50,
4000
L-изолейцин - 98,4000
L-лейцин - 131,2000
L-лизин, НС1 - 36,6000
L-метионин - 13,4000
L-фенилаланин - 14,9000
L-пролин - 34,6000
L-серин -
126,2000
L-треонин - 23,8000
L-триптофан - 9,2000
L-тирозин - 13,6000
L-валин - 70,2000
Неорганические соли
Метаванадат аммония
(NH4VO3) - 0,0006
Молибдат аммония [(NH4)6Mo7О24x4H2О] - 0,0010
Хлорид кальция [СаС12х2Н2О] - 16,2000
Сульфат меди (2) [CuSO4x5H2O] - 0,0025
Сульфат железа (2) [FeSО4x7H2О] - 1,4000
Хлорид марганца [MnCl2xH2O] - 0,0002
Хлорид магния [МgС12х6Н2О] - 122,0000
Сульфат никеля [NiSO4x6H2О] - 0,0003
Хлорид калия [КС1]
- 112,0000
Ацетет натрия - 301,5000
Бикарбонат натрия [NаНСО3] - 1088, 0000
Хлорид натрия [NaCI] - 5200, 0000
Двухосновный фосфат натрия [Na2
HP04x7H2O] - 536,0000
Пируват натрия - 55,5000
Селенит натрия [Nа2SеО3] - 0,0050
Силикат натрия [Nа2SiO3
x9Н2О] - 0,1420
Хлорид олова [SnCl2x2H2O] - 0,0001
Сульфат цинка [ZnS04x7H2O] - 0,5100
Витамины
d-биотин - 0,
0200
d-кальцийпантотенат - 0,2600
Холинхлорид - 28,0000
Цианокобаламин (В12) - 0,4100
Фолиевая кислота - 0,7900
i-инозитол - 18,0000
Никотинамид
(В3) - 0,0400
Пиридоксин (В6хН2О) - 0,0600
Рибофлавин (В2) - 0,0400
Остальное
Аденин - 27,3000
Эпидермальный фактор роста (EGF, человеческий,
рекомб.) - 0,0010
Этаноламин - 0,0310
Глюкоза - 1080, 0000
HEPES - 6000, 0000
Гидрокортизон - 0,5000
Инсулин (бычий) - 5,0000
Фенол красный - 1,
2000
Фосфоэтаноламин - 0,0710
Путресцин, 2НС1 - 0,1600
Тиамин, НС1 - 0,3400
Тиоктовая кислота - 0,2100
Тимидин - 0,7300
Трансферрин (человека)
- 10,0000
Осмолярность - 280-285 мОсм/кг
2) Состав среды NR-2; тот же, что и NR-1, но дополнен экстрактом бычьего гипофиза (Biofluid Inc.) при 35 мг/л и содержит антибиотики (Gibco
BRL, Life Technologies Inc. ) фунгиэон (0,25 мг/л), пенициллин (10000 ед) и стрептомицин (10 мг/л).
3) Состав среды NR-3: тот же, что и у среды NR-2, но дополнен эпинефрином (Biofluid Inc.) 250 мкг/л.
4) Состав среды NR-4: тот же, что и у среды NR-2, но дополнен βFGF (3 мкг/л) (основной фактор роста фибробластов, полученный от Sigma Inc.) и
форбол-12-миристат-13-ацетатом (10 мкг/л (РМА)(C.C.R. Inc.)
Хотя настоящее изобретение описано с существенными деталями в отношении некоторых предпочтительных вариантов, другие варианты в
объеме настоящего изобретения также возможны. Соответственно ни раскрытие изобретения, ни приводимая далее формула изобретения, не должны быть ограничены прилагаемыми предпочтительными вариантами.
Реферат
Изобретение относится к биотехнологии и может быть использовано для получения иммортализованных клеток кожи человека. Клеточную линию иммортализованных кератиноцитов человека DK2-NR, DK3-NR, FK2-NR и иммортализованных меланоцитов DM2-NR получают путем посева клеток кожи на бессывороточную среду NR-2, затем кератиноциты переносят на селекционную среду NR-3, а меланоциты - на NR-4 среду. Кератиноциты и меланоциты инфицируют ретровирусной конструкцией, после чего иммортализованные кератиноциты выращивают в пролиферативной среде NR-2 и дифференцируют в среде, содержащей 1,5 мМ кальция, иммортализованные меланоциты пролифирируют на среде М2. Иммортализованные кератиноциты и меланоциты используют для анализа кожных реакций. 9 с. и 3 з. п.ф-лы, 3 ил., 10 табл.

Формула
Аминокислоты
L-аланин - 9,0000
L-аргинин, НС1 - 316, 0000
Аспарагин, Н2О - 15,0000
L-аспарагиновая кислота - 4,0000
L-цистеин, НСl, H2O - 42,0000
L-глутаминовая кислота - 14,8000
Глутамин - 877,0000
Глицин - 7,6000
L-гистидин, НС1, Н2О - 50,4000
L-изолейцин - 98,4000
L-лейцин - 131,2000
L-лизин, НС1 - 36,6000
L-метионин - 13,4000
L-фенилаланин - 14,9000
L-пролин - 34,6000
L-серин - 126,2000
L-треонин - 23,8000
L-триптофан - 9,2000
L-тирозин - 13,6000
L-валин - 70,2000
Неорганические соли
Метаванадат аммония (NH4VO3) - 0,0006
Молибдат аммония [(NH4)6Мо7O24•4Н2О] - 0,0010
Хлорид кальция [CaCl2•2H2О] - 16,2000
Сульфат меди (2) [CuSO4•5H2O] - 0,0025
Сульфат железа (2) [FeSO4•7H2O] - 1,4000
Хлорид марганца [МnСl2•4Н2О] - 0,0002
Хлорид магния [MgCl2 • 6H2O] - 122,0000
Сульфат никеля [NiSO4•6H2O] - 0,0003
Хлорид калия [КС1] - 112,0000
Ацетат натрия - 301,5000
Бикарбонат натрия [NаНСО3] - 1088, 0000
Хлорид натрия [NaCl] - 5200, 0000
Двухосновный фосфат натрия [Nа2НРО4•7H2O] - 536,0000
Пируват натрия - 55,5000
Селенит натрия [NaSeO3] - 0,0050
Силикат натрия [NaSiO3•9H2O] - 0,1420
Хлорид олова [SnCl2• 2H2O] - 0,0001
Сульфат цинка [ZnSO4•7H2O] - 0,5100
Витамины
d-биотин - 0,0200
d-кальцийпантотенат - 0,2600
Холинхлорид - 28,0000
Цианокобаламин (В12) - 0,4100
Фолиевая кислота - 0,7900
i-инозитол - 18,0000
Никотинамид (В3) - 0,0400
Пиридоксин (В6•H2O) - 0,0600
Рибофлавин (В2) - 0,0400
Остальное
Аденин - 27,3000
Эпидермальный фактор роста (EGF, человеческий, рекомб. ) - 0,0010
Этаноламин - 0, 0310
Глюкоза - 1080, 0000
HEPES - 6000, 0000
Гидрокортизон - 0,5000
Инсулин (бычий) - 5,0000
Фенол красный - 1,2000
Фосфоэтаноламин - 0,0710
Путресцин 2НСl - 0,1600
Тиамин НСl - 0,3400
Тиоктовая кислота - 0,2100
Тимидин - 0,7300
Трансферрин (человека) - 10,0000
Экстракт бычьего гипофиза - 35,0000
Фунгизон - 0,2500
Пенициллин - 10000,0000 ед
Стрептомицин - 10,0000
Осмолярность - 280-285 мOсм/кг
причем один или более из указанных компонентов может быть исключен, и количество ингредиентов заместителей может меняться от указанных выше значений в интервале от ±50 до ±0,1, предпочтительно от ±10 до 0,1%; и эпинефрин в концентрации, достаточной для усиления роста кератиноцитов, предпочтительно, около, 250 мкг/л среды.
Аминокислоты
L-аланин - 9,0000
L-аргинин, НС1 - 316,0000
Аспарагин, H2O - 15,0000
L-аспарагиновая кислота - 4,0000
L-цистеин, НСl, Н2О - 42,0000
L-глутаминовая кислота - 14,8000
Глутамин - 877, 0000
Глицин - 7,6000
L-гистидин, НСl, H2O - 50,4000
L-изолейцин - 98,4000
L-лейцин - 131,2000
L-лизин, НС1 - 36,6000
L-метионин - 13, 4000
L-фенилаланин - 14,9000
L-пролин - 34,6000
L-серин - 126,2000
L-треонин - 23,8000
L-триптофан - 9,2000
L-тирозин - 13,6000
L-валин - 70,2000
Неорганические соли
Метаванадат аммония (NН4VО3) - 0,0006
Молибдат аммония [(NH4)6Мо7O24• 4Н2О] - 0,0010
Хлорид кальция [СаСl2•2H2O] - 16,2000
Сульфат меди (2) [CuSO4•5H2O] - 0,0025
Сульфат железа (2) [FeSO4•7H2O] - 1,4000
Хлорид марганца [МnСl2•4H2O] - 0,0002
Хлорид магния [MgCl2•6H2 O] - 122,0000
Сульфат никеля [NiSO4•6H2O] - 0,0003
Хлорид калия [КСl] - 112,0000
Ацетат натрия - 301,5000
Бикарбонат натрия [NаНСО3] - 1088,0000
Хлорид натрия [NaCl] - 5200,0000
Двухосновный фосфат натрия [Na2HPO4•7H2O] - 536,0000
Пируват натрия - 55, 5000
Селенит натрия [NaSeO3] - 0,0050
Силикат натрия [NaSiO3•9H2O] - 0,1420
Хлорид олова [SnCl2•2H2O] - 0,0001
Сульфат цинка [ZnSO4•7H2O] - 0,5100
Витамины
d-биотин - 0,0200
d-кальцийпантотенат - 0,2600
Холинхлорид - 28,0000
Цианокобаламин (В12) - 0,4100
Фолиевая кислота - 0,7900
i-инозитол - 18,0000
Никотинамид (В3) - 0,0400
Пиридоксин (В6•H2O) - 0,0600
Рибофлавин (В2) - 0,0400
Остальное
Аденин - 27,3000
Эпидермальный фактор роста (EGF, человеческий, рекомб. ) - 0,0010
Этаноламин - 0,0310
Глюкоза - 1080, 0000
HEPES - 6000,0000
Гидрокортизон - 0,5000
Инсулин (бычий) - 5,0000
Фенол красный - 1,2000
Фосфоэтаноламин - 0,0710
Путресцин 2НСl - 0,1600
Тиамин НСl - 0,3400
Тиоктовая кислота - 0,2100
Тимидин - 0,7300
Трансферрин (человека) - 10,0000
Экстракт бычьего гипофиза - 35,0000
Фунгизон - 0, 2500
Пенициллин - 10000,0000 ед
Стрептомицин - 10,0000
Осмолярность - 280-285 мОсм/кг
9. Бессывороточная среда по п. 8, отличающаяся тем, что дополнительно содержит эпинефрин в концентрации 250 мкг/л среды (среда NR-3).

Комментарии