Способы и композиции для терапевтических агентов - RU2698906C2
Код документа: RU2698906C2
Чертежи


Описание
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
0001 Настоящая заявка запрашивает приоритет согласно предварительной заявке на изобретение США №61/591837, дата подачи заявки 27 января 2012, содержание которой включено в данную заявку во всей полноте посредством ссылки.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
0002 Большинство вакцин, включая вакцины на основе ослабленных вирусов, со временем теряют активность, и скорость потери активности зависит от температуры. Поэтому были организованы системы холодовых цепей для обеспечения надежности и уверенности, что активность вакцин сохраняется при хранении их в охлажденном состоянии (в большинстве случаев при 2-8°C), до момента использования. Организация холодовой цепи для хранения и распространения вакцин требует значительных усилий, а поддерживать ее в рабочем состоянии сложно. Также очевидно, что, несмотря на самые значительные усилия, холодовые цепи не всегда функционируют, как предполагалось по многим причинам, таким как неправильное обслуживание холодильного оборудования или применение оборудования, исчерпавшего эксплуатационные ресурсы, отключения электропитания, приводящее к отказу оборудования, недостаточное соответствие требованиям процедур холодовой цепи и неадекватный мониторинг. В результате вакцины в холодовой цепи часто подвержены отклонениям температуры (т.е. температура выходит за пределы заданного диапазона).
0003 Другие лекарственные средства, например определенные лекарственные белки, также теряют активность при высокой температуре. Поэтому в данной отрасли техники остается актуальная необходимость в улучшенных композициях и способах, которые обеспечили бы стабильность лекарственных средств и позволили бы лекарственным средствам сохранять их активность при выдерживании при высоких температурах.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
0004 Согласно настоящему изобретению предложены, наряду с прочим, композиции, которые включают лекарственные средства (например, живые ослабленные вирусные антигены, лекарственные белки и т.д.) и липидный компонент. Указанный липидный компонент может включать или состоять из различных видов липидов или липидов, описание которых приведено в тексте данного документа. Согласно некоторым вариантам реализации настоящего изобретения указанные лекарственные средства термолабильны.
0005 Отличительной особенностью настоящего изобретения является то, что указанный липидный компонент состоит из одного или большего числа неионогенных поверхностно-активных веществ (ПАВ). Согласно некоторым вариантам реализации настоящего изобретения в данных композициях состоит из одного неионногеного ПАВ (например, 1-монопальмитоилглицерина (MPG)).
0006 Другой отличительной особенностью настоящего изобретения является то, что указанный липидный компонент состоит из одного или большего числа неионогенных ПАВ (например, MPG) и одного стероида (например, холестерина).
0007 Еще одной отличительной особенностью настоящего изобретения является то, что указанный липидный компонент включает один или большее число липидов, которые комбинируют для формирования везикул (т.е. "везикулярных композиций"). Согласно некоторым вариантам реализации настоящего изобретения липиды комбинируют для формирования везикул в отсутствии лекарственного средства, а затем смешивают с лекарственным средством (т.е. указанные композиции включают "предварительно сформированные везикулы"). В некоторых из указанных вариантов реализации липиды включают неионогенное ПАВ, стероид и ионогенное амфифильное вещество. Везикулярные композиции, полученные в соответствии с указанными вариантами реализации, могут включать любое ионогенное амфифильное вещество, включая любое из использованных в качестве примера ионогенных амфифильных веществ, описание которых приведено в тексте настоящего документа. Согласно некоторым вариантам реализации липиды комбинировали для формирования везикул в присутствии лекарственного средства. Везикулярные композиции, полученные в соответствии с указанными вариантами реализации, могут включать любой из использованных в качестве примера фосфоглицеридов, описание которых приведено в тексте настоящего документа, в качестве неионогенного ПАВ (например, MPG), один стероид (например, холестерин) и одно ионогенное амфифильное вещество (например, дицетилфосфат (DCP) или дифосфатидилглицерин (DPPG)). Согласно некоторым вариантам реализации липидный компонент в указанных везикулярных композициях состоит из одного неионогенного ПАВ (например, MPG), одного стероида (например, холестерина) и одного ионогенного амфифильного вещества (например, дифосфатидилглицерин), и указанные везикулы представляют собой предварительно сформированные везикулы или везикулы, сформированные в присутствии лекарственного средства.
0008 Согласно настоящему изобретению также предложены способы получения композиций, включая вышеуказанные композиции, (например, среди прочих, способами плавления и способами инжекционного распыления).
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
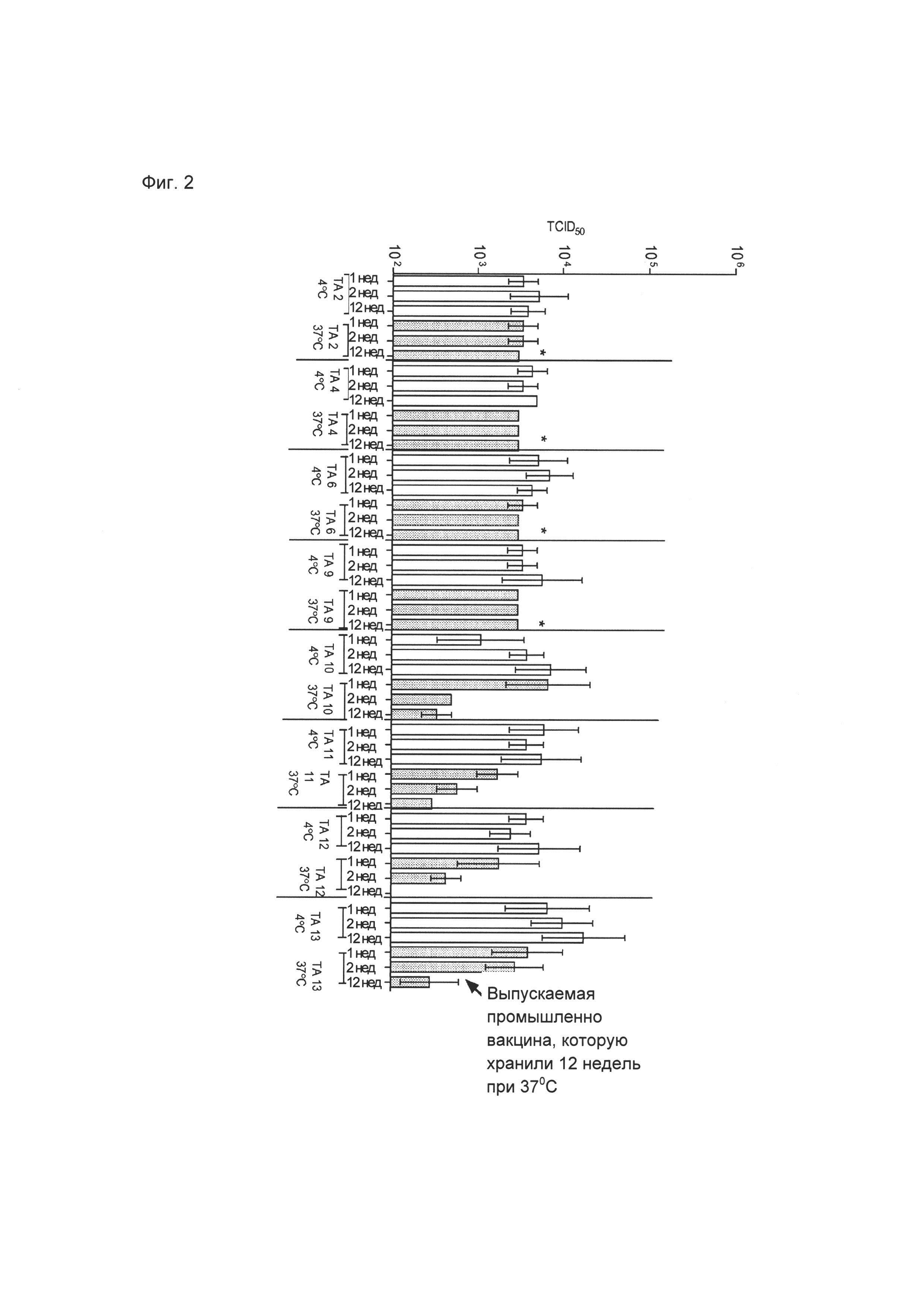
0009 На Фиг. 1 показаны результаты использованного в качестве примера теста активности кори (TCID50), который проводили, используя различные модифицированные вакцины М-M-R-II® (приготовленные с 25 мг/мл липида), которые хранили при температуре приблизительно 4°C и приблизительно 37°C в течение 1, 2 и 12 недель. ТА - Объект тестирования.
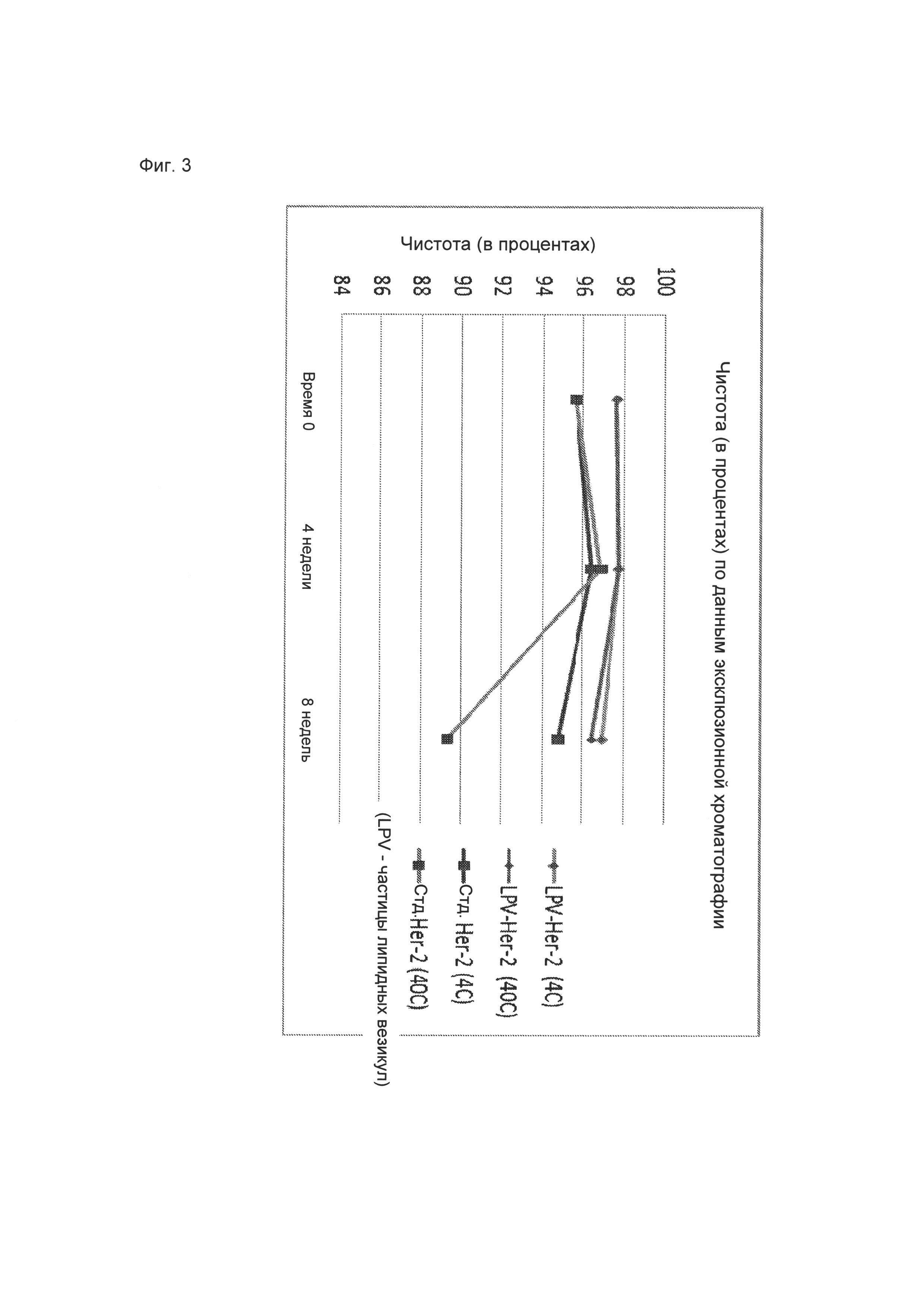
00010 На Фиг. 2 показаны результаты использованного в качестве примера теста активности кори (TCID50), который проводили, используя различные модифицированные вакцины М-M-R-II® (приготовленные с 12,5 мг/мл липида), которые хранили при температуре приблизительно 4°C и приблизительно 37°C в течение 1, 2 и 12 недель.
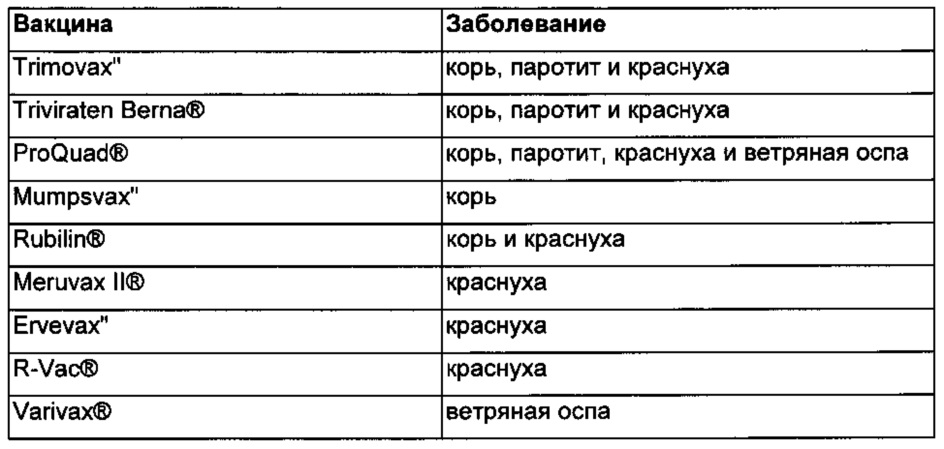
00011 На Фиг. 3 приведены в процентах результаты определения степени чистоты по данным эксклюзионной хроматографии модифицированного трастузумаба (trastuzumab), использованного в качестве примера лекарственного белка (приготовлен с 12,5 мг/мл липида), который хранили при температуре приблизительно 4°C и приблизительно 40°C в течение 4-8 недель.
00012 На Фиг. 4 приведены результаты активности, полученные в тесте антипролиферативной биологической активности ВТ-474, который проводили, используя модифицированный трастузумаб, использованный в качестве примера лекарственного белка (приготовлен с 12,5 мг/мл липида), который хранили при температуре приблизительно 4°C и приблизительно 40°C в течение 4-8 недель.
ОПРЕДЕЛЕНИЯ
00013 На протяжении всего текста описания настоящего изобретения, используются несколько терминов, которые определены в следующих пунктах.
00014 Термин "антиген" или "вирусный антиген" обозначает молекулярную субстанцию, содержащую один или более эпитопов, которые могут быть распознаны антителом. Согласно некоторым вариантам реализации антиген может быть вирусом. Термин "антиген" включает наряду с прочим ослабленные или инактивированные вирусы. Согласно некоторым вариантам реализации антиген может быть "иммуногеном".
00015 Термин "иммунный ответ" обозначает ответ, вызванный у животного. Иммунный ответ может обозначать клеточный иммунитет, гуморальный иммунитет или может относиться к обоим звеньям. Иммунный ответ также может быть ограничен частью иммунной системы. Например, согласно некоторым вариантам реализации имуногенная композиция может индуцировать, повышенный ответ гамма-интерферона (IFN-y). Согласно некоторым вариантам реализации иммуногенная композиция может индуцировать ответ секреторного иммуноглобулина A (IgA) (например, измеренного в назальных и/или ректальных смывах). Согласно некоторым вариантам реализации иммуногенная композиция может индуцировать системный IgG ответ (например, измеренный в сыворотке).
00016 Термин "иммуногенный" значит способный к индукции иммунного ответа у животного-хозяина против внешних факторов (например, вирусного антигена). Согласно некоторым вариантам реализации данный иммунный ответ формирует основу защитного иммунитета, вызванного вакциной против определенного инфекционного организма (например, вируса).
00017 Термин "терапевтически эффективное количество" обозначает количество достаточное для того, чтобы был очевиден значимый полезный результат у курируемого субъекта. Терапевтически эффективное количество композиции может различаться в зависимости от таких факторов, как желаемая целевая биологическая конечная точка, природа композиции, путь введения, состояние здоровья, морфометрические показатели и/или возраст курируемого субъекта и т.д.
00018 Термин "лечить" (или "лечение", "пролеченный" и т.д.) обозначает введение субъекту, страдающему заболеванием, имеющему симптом заболевания или предрасположенность к заболеванию, композиции с целью облегчить, изменить, улучшить или повлиять на заболевание. Согласно некоторым вариантам реализации термин "лечение" обозначает вакцинацию субъекта.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Композиции
00019 Согласно настоящему изобретению предложены, наряду с прочим, композиции, которые включают лекарственное средство и липидный компонент. Термин "липидный компонент" включает все липиды, представленные в указанной композиции. Указанный липидный компонент может включать или состоять из липида или липидов различных видов, соответственно описанию, приведенному в тексте данного документа.
Липидный компонент
00020 Согласно одной из отличительных особенностей настоящего изобретения указанный липидный компонент состоит из одного или большего количества неионогенных ПАВ. Согласно некоторым вариантам реализации липидный компонент состоит из одного неионогенного ПАВ. Не являясь ограничивающими, примеры подходящих неионогенных ПАВ включают ПАВ со сложноэфирными связями, основанные на глицерине. Такие эфиры глицерина могут включать одну или две высших алифатических кислотных группы, например, содержащие, по меньшей мере, десять атомов углерода в каждой кислотной группе. Неионогенные ПАВ, основанные на таких эфирах глицерина могут включать более чем одно глицериновое звено, например, до 5 глицериновых звеньев. Могут быть использованы моноэфиры глицерина, например, содержащие С12-С20 алканоильную или алкеноильную группу, например, капроил, лауроил, миристоил, польмитоил, олеоил или стеароил. Используемое в качестве примера неионогенное ПАВ представляет собой 1-монопальмитоилглицерин (MPG). ПАВ со сложноэфирной связью также могут быть использованы в качестве неионогенных ПАВ. Например, подходящими являются ПАВ со сложноэфирной связью, основанные на глицерине или гликоле, имеющем до 4 атомов углерода, таком как этиленгликоль. Неионогенные ПАВ, основанные на таких гликолях могут включать более одного гликольного звена, например, до 5 гликольных звеньев (например, дигликольцетиловый эфир и/или полиоксиэтилен-3-лауриловый эфир). Могут быть использованы моноэфиры гликоля или глицерина, например, содержащие С12-С20 алканоильную или алкеноильную группу, например, каприл, лаурил, миристил, польмитил, олеил или стеарил. Могут быть использованы продукты конденсации этиленоксида, раскрытые в РСТ Publication №. WO 88/06882 (например, ПАВ на основе высших алифатических эфиров и аминов полиоксиэтилена). Используемые в качестве примера ПАВ со сложноэфирными связями, включают 1-цетилглицериновый сложный эфир и дигликольцетиловый сложный эфир.
00021 Согласно другой отличительной особенности настоящего изобретения указанный липидный компонент состоит из одного или большего количества неионогенных ПАВ и одного или большего количества стероидов (например, стеролов, таких как холестерин). Согласно некоторым вариантам реализации указанный липидный компонент состоит из одного неионогенного ПАВ (например, MPG) и одного стероида (например, холестерина). Согласно некоторым вариантам реализации неионогенные ПАВ и стероиды представлены в композиции в молярном соотношении приблизительно от 6:4 до 4:4, например, 5:4.
00022 Еще одной отличительной особенностью настоящего изобретения является то, что указанный липидный компонент включает один или большее количество липидов, которые комбинируют для формирования везикул (т.е. "везикулярных композиций").
00023 Согласно некоторым вариантам реализации настоящего изобретения липиды комбинируют для формирования везикул в отсутствии лекарственного средства, а затем смешивают с лекарственным средством (т.е. указанные композиции включают "предварительно сформированные везикулы"). В некоторых из указанных вариантов реализации липиды включают неионогенное ПАВ, стероид и ионогенное амфифильное вещество. Везикулярные композиции, полученные в соответствии с указанными вариантами реализации, могут включать любое ионогенное амфифильное вещество, включая любое из используемых в качестве примера ионогенных амфифильных веществ, описание которых приведено в тексте настоящего документа.
00024 Согласно некоторым вариантам реализации липиды комбинируют для формирования везикул в присутствии лекарственного средства. Везикулярные композиции, полученные в соответствии с указанными вариантами реализации, могут включать любой из используемых в качестве примера фосфоглицеридов, описание которых приведено ниже в тексте настоящего документа, в качестве ионогенного амфифильного вещества.
00025 Используемые в качестве примера ионогенные амфифильные вещества могут включать, но не ограничены только перечисленным, кислотные соединения, такие как высшие алкановые и алкеновые кислоты (например, пальмитиновую кислоту, олеиновую кислоту) или другие соединения, содержащими кислотные группы, включая фосфаты, такие как диалкилфосфаты (например, дицетилфосфат или DCP, или фосфатидную кислоту или фосфатидилсерин) и сульфатные моноэфиры, такие как высшие алкилсульфаты (например, цетилсульфат), все указанные вещества могут быть использованы с данной целью.
00026 Как указано выше, согласно некоторым вариантам реализации фосфоглицерид (также известный как глицерофосфолипид) может быть использован в качестве ионогенного амфифильного вещества. Фосфоглицериды могут представлять собой плазмалогены, фосфатидаты (такие как фосфатидилэтаноламины, фосфатидилхолины), фосфатидилхолины или аналогичные соединения. Используемые в качестве примера фосфоглицериды включают, но не ограничены толко перечисленным, дифосфатидилглицерин (DPPG); 1,2-дипальмитоил-sn-глицеро-3-фосфо-L-серин (DPPS); 1,2-дистеароил-sn-глицеро-3-фосфатидилхолин (DSPC); 1,2-,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE); дипальмитоил фосфатидилхолин (DPPC) и их производные.
00027 Согласно некоторым вариантам реализации липидный компонент в указанных везикулярных композициях состоит из одного неионогенного ПАВ (например, MPG), одного стероида (например, холестерина) и одного ионогенного амфифильного вещества (например, DCP) и указанные везикулы представляют собой предварительно сформированные везикулы. Согласно некоторым вариантам реализации липидный компонент в указанных везикулярных композициях состоит из одного неионогенного ПАВ (например, MPG), одного стероида (например, холестерина) и фосфоглицерида, в качестве ионогенного амфифильного вещества (например, DPPG) и указанные везикулы представляют собой предварительно сформированные везикулы или везикулы, сформированные в присутствии лекарственного средства.
00028 Согласно некоторым вариантам реализации указанное неионогенное ПАВ и стероид представлены в указанных везикулярных композициях в молярном соотношении в пределах приблизительно от 6:4 до 4:4, например, приблизительно 5:4. Согласно некоторым вариантам реализации неионогенное ПАВ и ионогенное амфифильное вещество представлены в указанных везикулярных композициях в молярном соотношении в пределах приблизительно от 6:1 до 4:1; например, приблизительно 5:1. Согласно некоторым вариантам реализации указанный стероид и ионогенное амфифильное вещество представлены в указанных везикулярных композициях в молярном соотношении в пределах приблизительно от 5:1 до 3:1; например, приблизительно 4:1.
00029 Согласно определенным вариантам реализации концентрация липида составляет, по меньшей мере, приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90 или 95 мг/мл. Согласно определенным вариантам реализации концентрация липида находится в пределах приблизительно 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 25 мг/мл. Согласно определенным вариантам реализации концентрация липида находится в пределах приблизительно 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и до 30 мг/мл. Согласно определенным вариантам реализации концентрация липида находится в пределах приблизительно 5-50 мг/мл, приблизительно 5-25 мг/мл, приблизительно 10-50 мг/мл, приблизительно 10-30 мг/мл или приблизительно 10-50 мг/мл.
00030 Согласно определенным вариантам реализации композиции, описание которых приведено в тексте данного документа, не содержат молекул, облегчающих транспорт молекул, которые усиливают транспорт липидоподобных молекул через слизистые оболочки. Согласно некоторым вариантам реализации указанные композиции не содержат "желчную кислоту", такую как гликохолевую и таурохолевую кислоту, производные, включая дезоксихолевую и урсодезоксихолевую кислоту, и соли каждой из указанных кислот. Согласно некоторым вариантам реализации указанные композиции не содержат ацилоксилированные аминокислоты, такие как ацилкарнитины и их соли и пальмитоилкарнитины.
Лекарственные средства
00031 Описание настоящего изобретения включает использование различных видов лекарственных средств. Согласно некоторым вариантам реализации указанные лекарственные средства термолабильны. Как это использовано в тексте данного документа, термин "термолабильное лекарственное средство" обозначает лекарственное средство, которое теряет активность, когда подвергается воздействию определенной повышенной температуры. Согласно некоторым вариантам реализации воздействие повышенной температуры на термолабильное лекарственное средство приводит к потере более 20% активности антигена (например, более 30%, более 40%, более 50% или еще больше) по данным, измеренным в тесте активности (например, основанном на значениях IC50 or ЕС50), по сравнению с интактным средством. Согласно некоторым вариантам реализации хранение термолабильного лекарственного средства при одной из указанных температур более 3 минут (например, 5 минут, 10 минут, 15 минут или более) приводят к потере более 20% активности (например, более 30%, более 40%, более 50% или еще больше) по данным, измеренным в тесте активности (например, основанном на значениях IC50 или ЕС50), по сравнению с интактным лекарственным средством. Тем не менее, следует учитывать, что способы и композиции согласно настоящему изобретению не ограничены лишь термолабильными лекарственными средствами и, что согласно некоторым вариантам реализации способы или композиции могут также относиться к стабильным лекарственным средствам, включая обычные низкомолекулярные лекарства.
Вирусные антигены - вирусные антигены кори, паротита, краснухи и ветряной оспы
00032 Корь, паротит и краснуха представляют собой три детских болезни, относящиеся к общим заболеваниям, вызванные вирусной инфекцией (соответственно, вирусом кори, (парамиксовирус), вирусом паротита (парамиксовирус) и вирусом краснухи (тогавирус)). Инфекционные поражения корью, паротитом и краснухой могут вызывать серьезные медицинские осложнения, которые могут приводить к смерти. Корь представляет собой инфекционное поражение дыхательной системы и вызывает ряд симптомов, включая лихорадку, кашель, насморк, распространенную сыпь и обычно приводит к осложнениям, таким как пневмония и энцефалит. Паротит представляет собой инфекционное поражение, которое вызывает ряд симптомов, включая воспаление, лихорадку, головную боль, орхит и может приводить к осложнениям, таким как асептический менингит и глухота. Краснуха, известная как немецкая корь, в основном вызывает сравнительно мягкие симптомы, хотя инфекционное поражение у беременных может быть вполне серьезной в плане последствий.
00033 Вакцины против кори, паротита и краснухи получают из живых ослабленных вирусов, которые культивируют на клеточных субстратах. Каждый компонент вакцины MMR изначально получают в моновалентной форме, которые затем смешивают вместе, чтобы получить тривалентную форму, в которой указанный компонент вирусной популяции представлен в точно определенном количестве достаточном, чтобы индуцировать эффективный иммунный ответ у вакцинированого рецепиента. Коммерчески доступные вакцины MMR представлены в лиофилизованном виде во флаконах, которые необходимо хранить при 2-8°C в течение не более 3 лет, как указано в инструкции по применению. Тем не менее, несколько факторов, включая композицию стабилизатора, условия хранения и остаточную влагу, могут повлиять на термическую стабильность указанной лиофилизованной вакцины. Для оценки активности живого вируса кори в вакцине Всемирная Организация Здравоохранения (ВОЗ) рекомендует тест средних инфекционных доз в тканевой культуре (TCID50), используя клетки Vera. Тем не менее, показатели измеренной активности могут различаться в зависимости от способа определения, лаборатории и условий на момент теста.
00034 ВОЗ установила минимальные требования для стабильности вакцин в замороженной сухой форме, а также для вакцин после разведения перед введением в виде жидкого раствора. В замороженном сухом состоянии применяющиеся на сегодняшний день противокоревые вакцины должны сохранять минимум активности, по меньшей мере, 3,0 log10 вирусных частиц на дозу для одного человека после выдерживания при температуре 37°C в течение, по меньшей мере, одной недели и титр вируса не должен снижаться более чем на 1,0 log10 в процессе инкубации. Тем не менее, вакцины против кори после разведения быстро теряют активность при выдерживании при комнатной температуре. При 22-25°C указанные вакцины теряют приблизительно 50% активности за один час. При температурах свыше 37°C вакцины инактивируются в течение одного часа (The Immunological Basis for Immunization Series, Module 7: Measles (WHO/EPI/GEN/93.17).
00035 Несколько ослабленных вакцин против кори, паротита и краснухи (MMR), которые на сегодняшний день разрешены к применению, успешно понижали заболеваемость вирусной инфекцией и могут быть использованы в соответствии с настоящемим изобретением.
00036 Согласно некоторым вариантам реализации композиции и способы согласно настоящему изобретению могут быть использованы с одним или большим количеством антигенов, включенных в вакцину, которая разрешена к применению или находится на стадии разработки. Таблица 1 представляет собой не ограничивающий список вакцин против кори, паротита, краснухи и ветряной оспы, которые разрешены к применению или находится на стадии разработки.

00037 В последующих разделах обсуждаются вышеуказанные и другие, использованные в качестве примера вирусные антигены, которые могли бы применяться в композициях и способах согласно настоящему изобретению.
00038 В США вакцина против кори, паротита и краснухи (MMR) была впервые разрешена к применению в 1971, вторая серия указанной вакцины запущена в производство в 1989. В основном, в странах, где детская вакцинация MMR является рядовой установившейся практикой, заболеваемость корью, паротитом и краснухой резко уменьшилась (например, более чем на 99% в 1995 по сравнению с количеством случаев в 1941).
00039 На сегодняшний день разрешено к применению несколько вакцин против кори, паротита и краснухи (MMR). Например, M-M-R-IIR разработана и производится Merck & Co., Inc. M-M-R-IIR содержит стерильный лиофилизованный препарат (1) AttenuvaxR (живая вакцина против кори) ослабленный штамм вируса кори, (2) MumpsvaxR (живая вакцина против паротита) штамм вируса паротита, культивируемый в клеточной культуре куриного эмбриона, и (3) Meruvax IIR (живая вакцина против краснухи) ослабленный штамм вируса краснухи. Каждая доза 0,5 мл содержит не менее чем 1000 TCID50 (средних инфекционных доз для клеточной культуры) вируса кори, не менее чем 5000 TCID50 вируса паротита и не менее чем 1000 TCID50 вируса краснухи. После разведения M-M-R-IIR (как и в случае других разрешенных к применению вакцин MMR) обычно вводят подкожно. Хотя одна доза M-M-R-IIR у детей старше 12 месяцев в основном индуцирует выработку нейтрализующих антител, некоторые пациенты не отвечают сероконверсией на первую дозу. Соответственно, рекомендован ревакцинация, особенно перед поступлением в начальную школу, чтобы достичь сероконверсии у тех, кто не ответил на первую дозу. Для уверенности, что нет потери активности вакцины M-M-R-IIR, она должна содержаться при температуре 10°C или более низкой в процессе доставки, содержаться при температуре 2-8°C в процессе хранения в лиофилизованном состоянии и использоваться в течение 8 часов после разведения.
00040 Еще один пример вакцины MMR, PROQUADR, которая также содержит компонент ветряной оспы. Указанная вакцина была лицензирована и продавалась в США Merck, хотя в настоящее время производство приостановлено. PROQUAD® вводят однократно детям старше 12 месяцев, наряду с возможной ревакцинацией, которую проводят, по меньшей мере, не ранее чем через три месяца после первого введения.
00041 Согласно одной из отличительных особенностей описания настоящего изобретения предложены иммуногенные композиции, которые включают ослабленный или инактивированный вирус. Очевидно, что иммуногенные композиции, предложенные согласно настоящему изобретению могут включать не только один или большее количество компонентов вакцины MMR (например, вирус кори, паротита, краснухи или их комбинации). Согласно некоторым вариантам реализации иммуногенные композиции включают компонент вируса ветряной оспы (например, отдельно, как в случае VARIVAXR или в комбинации с другими вирусными компонентами, как в случае PROQUADR).
00042 Как указано выше, все известные вакцины MMR включают ослабленные вирусы. Очевидно, что любые из указанных разрешенных к применению вакцин могут быть использованы, согласно описанию, приведенному в тексте данного документа, для получения иммуногеннной композиции. Например, для получения иммуногенной композиции может быть использована M-M-R-IIR. Согласно некоторым вариантам реализации лицензированные вакцины вначале очищают (например, чтобы удалить алюминиевый адъювант или другие компоненты вакцины). Согласно некоторым вариантам реализации лицензированные вакцины не очищают перед приготовлением композиции согласно описанию, приведенному в тексте данного документа.
00043 Как известно в данной отрасли техники, преимущество живого ослабленного вируса заключается в потенциально более высокой иммуногенности, которая является результатом его способности реплицироваться in vivo, не вызывая полномасштабного инфекционогенного процесса. Один из способов, который был использован в уровне техники, чтобы получить ослабленные вирусы представляет собой вирусную адаптацию, которая включает серийными пассированиями вирусного штамма во множественных клеточных культурах. Со временем штамм мутирует, и тогда могут быть идентифицированы ослабленные штаммы. Например, при получении M-M-R-IIR ослабленный штамм вируса кори культвируют в клеточной культуре куриного эмбриона, штамм уровня В паротита культивируют в клеточной культуре куриного эмбриона, а ослабленный штамм вируса краснухи культивируют в человеческих легочных диплоидных фибробластах. Согласно некоторым вариантам реализации вирус может быть пассивирован через различные клеточные культуры.
00044 Очевидно, что может быть использован любой штамм вируса кори, паротита и/или краснухи, например, что не имеет ограничительного характера, любой из следующих штаммов, описание которых известно в данной отрасли техники:
Штамм Edmonston ослабленного вируса кори Enders' (AttA)
Штамм AIK-C strain ослабленного вируса кори
Штамм Jeryl Lynn (B-level) вируса кори
Штамм Leningrad Zagreb вируса кори
Штамм Urabe Am 9 вируса кори
Штамм Wistar RA 27/3 вируса краснухи
Вирус краснухи Giguere; 1964 United States
Вирус краснухи HPV-77; 1961 United States
Вирус краснухи Judith; 1963 Liverpool U.K.
Вирус краснухи КО-1; 1967 Kochi, Japan
00045 Тогда как все лицензированные на сегодняшний день вакцины MMR включают ослабленные вирусы, согласно настоящему изобретению могут быть использованы альтернативные вакцины, которые включают инактивированные вирусы. Согласно некоторым вариантам реализации иммуногенная композиция может включать такие инактивированные вирусы. Очевидно, что может быть использован любой способ, чтобы получить инактивированный вирус. В основном указанные способы будут включать культивирование вируса в клетке-хозяине, лизирование клетки-хозяина, чтобы высвободить вирус, выделение и затем инактивацию вируса. Вирус обычно получают из клеточных культур и проводят скрининг для определения инфекционной дозы, а также, чтобы убедиться в отсутствии побочных агентов. Чтобы инактивировать вирус обычно используют химическую обработку (например, среди прочего, формалином, формальдегидом). Тем не менее, очевидно, что могут быть использованы и другие методики, например, обработка хлором, выдерживание при высоких температурах и т.д.
Другие вирусные антигены
00046 Таблица 2 представляет собой не ограничивающий список других живых ослабленных вакцин, которые лицензированы или находятся на стадии разработки. Очевидно, что композиции, предложенные согласно настоящему изобретению, могут включать один или большее количество компонентов указанных вакцин.

00047 Чумка собак представляет собой заболевание, вызванное вирусной инфекцией, вирусом чумки собак, который представляет собой парамиксовирус, близко связанный с вирусом кори. Вирус чумки собак может вызвать серьезные медицинские последствия, поражая множество видов млекопитающих, включая собак, куниц, гиен, енотов и диких кошачьих. Инфекция чумки собак может вызывать ряд симптомов, включая лихорадку, анорексию, насморк, выделения из глаз и обычно приводит к осложнениям, таким как пневмония и энцефалит. Вакцина ослабленного вируса чумки собак лицензирована, включая мультивалентную вакцину DA2PPC, которая защищает от чумки собак (D), адеровируса типа 2 (А2), парагриппа (Р), парвовируса собак (Р) и коронавируса собак (С). Очевидно, что иммуногенные композиции, предложенные согласно настоящему изобретению могут включать один или большее количество компонентов DA2PPC (например, антиген вируса чумки собак).
00048 Ротавирусная инфекция приводит к ротавирусному гастроэнтериту, который может особенно тяжело протекать у детей первого года жизни и детей раннего возраста. Лицензированные живые ослабленные вакцины для лечения ротавирусной инфекции включают RotaTeq® и Rotarix®. RotaTeq® предназначен для профилактики ротавирусного гастроэнтерита, вызванного G1, G2, G3, и G4 серотипами вируса. RotaTeq® вводят перорально последовательно всего три дозы детям первого года жизни в возрасте 6-32 недель. Каждые 2 мл дозы RotaTeq® содержат живой реассортант, содержащий G1, G2, G3, G4 и PIA, а также содержит минимум 2,0-2,8×106 инфекционных единиц (IU). Rotarix® предназначен для профилактики ротавирусного гастроэнтерита, вызванного G1, G3, G4, и G9 серотипами вируса. Rotarix® вводят перорально последовательно всего две дозы детям первого года жизни в возрасте 6-24 недель. Каждый 1 мл дозы Rotarix® содержит минимум 106 CCID50 живого ослабленного человеческого ротавируса G1P.
00049 Опоясывающий герпес представляет собой вирусную инфекцию нервных корешков, которая обычно вызывает боль и высыпание на одной стороне тела. Опоясывающий герпес наиболее типичен для взрослых старшего возраста и людей со слабой иммунной системой. Разрешенной к применению вирусной вакциной для лечения опоясывающего лишая, вызванного вирусом опоясывающего лишая является ZostavaxR, которая представляет собой лиофилизованный препарат штамма Oka/Merck живого ослабленного вируса ветряной оспы. ZostavaxR предназначена для подкожного введения лицам в возрасте 60 лет и старше. Каждые 0,65 мл дозы ZostavaxR содержит, по меньшей мере, 19400 бляшкообразующих единиц (БОЕ) живого ослабленного вируса.
00050 Еще одним примером разрешенной к применению вакцины на основе ослабленного вируса является DRYVAXR, которая представляет собой живой вирусный препарат вируса осповакцины для лечения натуральной оспы. DRYVAXR получают из лимфы телят, которую очищают, концентрируют и высушивают посредством лиофилизации. Показано, что после разведения вакцина содержит не более 200 жизнеспособных микроорганизмов в мл. DRYVAXR предназначена для использования в виде неоднократных пункций, т.е. введения вакцины в поверхностные слои кожи, используя вильчатую иглу. Обычно вакцинация DRYVAXR выражается в вирусном размножении, развитии иммунитета и клеточной гиперчувствительности. В результате первичной вакцинации на месте вакцинации появляется папула приблизительно на 2, 5 день. Папула переходит в везикулу на 5, 6 день, которая переходит в пустулу, у которой появляется в середине углубление, сопровождаемую эритемой и индурацией. Максимальной площади эритема достигает между 8 и 12 днями после вакцинации (обычно на 10 день). Указанная эритема и опухоль затем проходят, и образуется струп, который отпадает приблизительно на 14-21 день. На высоте первичной реакции, известной как ответ Jennerian, обычно бывает регионарная лимфаденопатия и могут быть системные проявления в виде лихорадки и недомогания. Показано, что первичная вакцинация DRYVAXR с активностью 100 миллионов бляшкообразующих единиц в мл вызывает у детей 97% частоты ответа, проявляющегося как общей реакцией, так и ответом нейтрализующих антител.
00051 YF-VAX® для лечения желтой лихорадки представляет собой еще один пример разрешенной к применению вакцины на основе ослабленного вируса. YF-VAX® получают культивированием штамма 17D вируса желтой лихорадки в живых не пораженных вирусом птичьего лейкоза куриных эмбрионах. YF-VAX® лиофилизуют и упаковывают в атмосфере азота для хранения, разводят непосредственно перед применением. YF-VAX® получают таким образом, чтобы вакцина содержала не менее 5,04 log10 БОЕ в дозе 0,5 мл. Обычно, иммунитет к желтой лихорадке развивается к 10 дню после первичной вакцинации YF-VAX®. Хотя и показано, что иммунитет к желтой лихорадке может сохраняться, по меньшей мере, в течение 30-35 лет, а в некоторых случаях пожизненно, ревакцинации необходимы каждые 10 лет для повышения титра антител.
00052 Вирус репродуктивного и респираторного синдрома свиней (PRRSV), также известный как болезнь сине-уха представляет собой вирус, который вызывает заболевание у свиней, называемое репродуктивный и респираторный синдром свиней (PRRSV). Указанное экономически важное, пандемическое, заболевание вызывает бесплодие у племенного поголовья и расстройство дыхательных путей у поросят. Для профилактики PRRSV уже разработана живая ослабленная вакцина.
00053 Псевдобешенство представляет собой вирусное заболевание свиней, эндемическое в большинстве частей мира. Указанное заболевание вызывет Suid herpesvirus 1 (SuHV-1), также называемый вирусом псевдобешенства (PRV), а также заболевание известно как болезнь Ауески, а у коров, как инфекционный бульбарный паралич. Другие домашние и дикие млекопитающие, такие как коровы, овцы, козы, кошки, собаки и еноты также восприимчивы, указанное заболевание обычно заканчивается смертью. Исследование RPV у свиней положило начало контролю заболевания у животных с помощью живых ослабленных вакцин. Хотя слово "псевдобешенство" значит " ложное бешенство" или "подобное бешенству", указанное слово используется неправильно. Псевдобешенство связано с вирусом герпеса, а не с вирусом бешенства.
Лекарственные белки
00054 Множество лекарственных белков (включая ряд термолабильных лекарственных белков) на сегодняшний день лицензировано или находится в стадии разработки, и могут быть использованы согласно настоящему изобретению.
00055 Термин "белок" обозначает полимер из аминокислот. Согласно некоторым вариантам реализации белки могут включать фрагменты отличные от аминокислот (например, гликоротеины, протеогликаны, липопротеины и т.д.) и/или могут быть по-другому обработаны или модифицированы. Специалистам в данной области очевидно, что "белок" может быть полной полипептидной цепью, в том виде как она продуцирована клеткой (с сигнальной последовательностью или без нее), или может быть частью последовательности. Специалистам в данной области очевидно, что белок иногда может включать более одной полипептидной цепи, например, связанные одной или большим количеством дисульфидных связей или связанные другими способами. Полипептиды могут содержать L-аминокислоты, D-аминокислоты или те и другие и могут содержать любые из многообразия модификаций аминокислот или аналогов аминокислот, известных в данной области.
00056 Лекарственные белки представляют собой белки или выделенные из человеческих клеток или сконструированные в лаборатории для фармацевтического использования. Большинство лекарственных белков представляют собой рекомбинантные человеческие белки, производимые с использованием нечеловеческих клеточных линий млекопитающих, которые сконструированы для экспрессии определенных генетических последовательностей, чтобы продуцировать определенные белки. Рекомбинантные белки представляют собой важную группу используемых лекарственных средств, например, чтобы устранить недостаточность в критических факторах крови и усилить иммунную систему, чтобы бороться с онкологическими и инфекционными заболеваниями. Лекарственные белки также используют, чтобы облегчить страдания пациента при многих патологических состояниях, включая различные онкологические заболевания (лечение моноклональными антителами и интерферонами), инфаркт, инсульт, муковисцидоз и болезнь Гоше (лечение ферментами и факторами крови), диабет (лечение инсулином), анемия (лечение эритропоэтином) и гемофилия (лечения факторами свертывания крови).
00057 Управление США по надзору в сфере пищевых продуктов и лекарственных средств (FDA) уже одобрило применение 75 лечебных белков, также известных как биофармацевтические препараты и более 500 дополнительных белков находятся в стадии разработки. Лекарственные биологические продукты, находящиеся на сегодняшний день под регулирующим надзором включают: моноклональные антитела, цитокины, факторы роста, ферменты, иммуномодуляторы, тромболитики и белки, предназначенные для лечебного применения, которые выделяют из тканей животных или из микроорганизмов, включая рекомбинантные варианты указанных продуктов и других, не относящихся к вакцинам лекарственных иммунологических средств.
00058 Согласно некоторым вариантам реализации лекарственный белок представляет собой антитело. Термин "антитело" включает иммуноглобулины и их фрагменты, которые специфично реагируют с целевым белком или пептидом или их фрагментами. Подходящие антитела включают, но не ограничены только перечисленным, человеческие антитела, приматизированные антитела, химерные антитела, биспецифичные антитела, гуманизированные антитела, конъюгированные антитела (например, антитела, конъюгированные или слитые с другими белками, изотопными метками, цитотоксинами), SMIPs™, одноцепочечные антитела, камелоид антитела, молекулы подобные антителам и фрагменты антител. Как использовано в тексте данного документа, термин "антитело" также включает интактные моноклональные антитела, поликлональные антитела, однодоменные антитела (например, однодоменные антитела акулы (например, IgNAR или его фрагменты)), мультиспецифичные антитела (например, биспецифичные антитела), образованные, по меньшей мере, двумя интактными антителами) и фрагменты антител, если они проявляют необходимую биологическую активность. Антитела могут быть любого типа (например, IgA, IgD, IgE, IgG, IgM).
00059 Согласно некоторым вариантам реализации лекарственный белок представляет собой фрагмент антитела. Как обозначено в тексте данного документа, "фрагмент антитела" содержит часть интактного антитела, такого как, например, антиген-связывающий или вариабельный участок антитела. Пример фрагментов антитела включают фрагменты Fab, Fab', F(ab')2, Fc и Fv; мультимерные антитела с тремя связывающими сайтами; мультимерные антитела с четырьмя связывающими сайтами; линейные антитела; молекулы одноцепочечных антител; и мультиспецифичные антитела, образованные из фрагментов антител. Термин "фрагмент антитела" также включает любой синтетический или генно-инженерный белок, который действует подобно антителу, связываясь со специфичным антигеном и образуя комплекс. Например, фрагменты антитела включают изолированные фрагменты, "Fv" фрагменты, состоящие из вариабельных участков тяжелых и легких цепей, рекомбинантные одноцепочеченые полипептидные молекулы, в которых вариабельные участки легкой и тяжелой цепи соединены пептидным линкером (ScFv белки) и минимальные молекулярные единицы распознавания, состоящие из остатков аминокислот, которые имитируют гипервариабельный участок.
00060 Некоторые использованные в качестве примера лекарственные белки, которые могут быть использованы в соответствии с настоящемим изобретением, перечислены ниже в Таблице 3. Одним из использованных в качестве примера лекарственных белков является Herceptin® (трастузумаб), гуманизированное моноклональное антитело, которое связывается с внешнеклеточным компонентом рецептора Her2/neu, 185 кДа трансмембранным онкопротеином, повышенная экспрессия которого наблюдается приблизительно у 20-25% пациентов, страдающих раком молочной железы. Указанное антитело и другие биоаналоги направленные на экспрессию человеческого Fc-гамма-1 изотипа, чтобы повысить функцию как комплементзависимой цитотоксичности (CDC), так и антителзависимой клеточной цитотоксичности (ADCC) антитела. Fab-связывающая функция трастузумаба делает возможным высокоафинное связывание с внеклеточным доменом рецептора Her2/neu, который ингибирует клеточную пролиферацию и предотвращает ангиогенез.
Полинуклеотиды
00061 Полинуклеотиды также могут быть использованы в соответствии с настоящим изобретением. Термин "полинуклеотид" обозначает полимер из нуклеотидов. Указанный полимер может включать натуральные нуклеозиды (т.е. аденозин, тимидин, гуанозин, цитидин, уридин, дезоксиаденозин, дезокситимидин, дезоксигуанозин и дезоксицитидин), аналогов нуклеозидов (например, 2-аминоаденозин, 2-тиотимидин, инозин, пироллопиримидин, 3-метиладенозин, 5-метилцитидин, С5-бромуридин, С5-фторуридин, С5-иодуридин, С5-пропинилуридин, С5-пропинилцитидин, С5-метилцитидин 7-диазоаденозин, 7-диазогуанозин, 8-оксоаденозин, 8-оксогуанозин, O(6)-метилгуанин, 4-ацетилцитидин, 5-(карбоксигидроксиметил)уридин, дигидроуридин, метилпсевдоуридин, 1-метиладенозин, 1-метилгуанозин, N6-метиладенозин и 2-тиоцитидин), химически модифицированные основания, биологически модифицированные основания (например, метилированные основания), интеркалированные основания, модифицированные сахара (например, 2'-фторрибоза, 2'-дезоксирибоза, 2'-O-метилцитидин, арабиноза и гексоза), или модифицированные фосфатные группы (например, фосфоротиоатные и 5'-N-фосфорамидатные соединения).
00062 Согласно некоторым вариантам реализации полинуклеотид, использованный в соответствии с настоящемим изобретением представляет собой ДНК, РНК, аптамер, образующие шпильки РНК, малые интерферирующие РНК, микроРНК, и/или антисмысловую РНК или антагомир РНК.
Полисахариды
00063 Полисахариды также могут быть использованы в соответствии с настоящемим изобретением. Как это использовано в тексте данного документа, термин "полисахарид" обозначает полимер из углеводов. Указанный полимер может включать натуральные углеводы (например, арабинозу, ликсозу, рибозу, ксилозу, рибулозу, ксилулозу, аллозу, альтрозу, галактозу, глюкозу, гулозу, идозу, маннозу, талозу, фруктозу, псикозу, сорбозу, тагатозу, манногептулозу, седогептулозу, октолозу и сиалозу) и/или модифицированные углеводы (например, 2'-фторрибозу, 2'-дезоксирибозу и гексозу).
Низкомолекулярные вещества
00064 Как указано выше, тогда как способы и композиции согласно настоящему изобретению представляются особенно полезными для термолабильных средств, очевидно, что согласно некоторым вариантам реализации они могут быть использованы с более стабильными средствами, включая традиционные низкомолекулярные лекарства. Разработано много низкомолекулярных лекарственных средств, которые могут быть использованы в соответствии с настоящим изобретением. Как это использовано в тексте данного документа, термин "низкомолекулярные лекарственные средства" обозначает неполимерные лекарственные молекулы, которые могут содержать несколько углерод-углеродных связей и имеют молекулярную массу приблизительно 1500 Да (например, менее чем приблизительно 1000 Да, менее чем приблизительно 500 Да или менее чем приблизительно 200 Да). Низкомолекулярные лекарства могут быть синтезированы в лаборатории (например, комбинаторным синтезом, используя генно-инженерные микроорганизмы и т.д.) или могут быть обнаружены в Природе (например, натуральный продукт). В основном низкомолекулярные лекарства могут изменять, ингибировать, активировать или по-другому влиять на биологическое событие. Например, низкомолекулярные лекарства могут включать, но не ограничены только перечисленным, вещества с активностью против ВИЧ, вещества с противоопухолевой активностью, антибиотики, противодиабетические вещества, иммуносупрессанты, противовирусные вещества, ингибиторы ферментов, нейротоксины, опиаты, снотворные, противогистаминные вещества, любриканты, транквилизаторы, противосудорожные средства, миорелаксанты и вещества для лечения болезни Паркинсона, спазмолитики и мышечные контрактанты, включая блокаторы ионных каналов, миотики и антихолинергические вещества, соединения для лечения глаукомы, противопаразитические и/или антипротозойные соединения, модуляторы взаимодействий внутриклеточной среды и внеклеточного матрикса, включая ингибиторы клеточного роста и антиадгезивные молекулы, сосудорасширяющие средства, ингибиторы синтеза ДНК, РНК или белков, гипотензивные вещества, анальгетики, антипиретики, стероидные и нестероидные противовоспалительные средства, факторы, препятствующие ангиогенезу, факторы, снижающие секреторную функцию, антикоагулянты, и/или противотромботические средства, местные анестетики, офтальмологические средства, простагландины, антидепрессанты, нейролептики, противорвотные средства и средства для диагностической визуализации. Более полное перечисление используемых в качестве примера низкомолекулярных средств подходящих для использования в способах согласно настоящему изобретению можно найти в Pharmaceutical Substances: Syntheses, Patents, Applications, Edited by Axel Kleemann and Jurgen Engel, Thieme Medical Publishing, 1999; Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals, Edited by Susan Budavari et al., CRC Press, 1996, и в the United States Pharmacopeia-25/National formulary-20, published by the United States Pharmacopeial Convention, Inc., 2001. Предпочтительно, хотя и не обязательно, низкомолекулярные средства представляют собой такие средства, которые признаны уполномоченным государственным органом или лицом безопасными и эффективными для использования. Например, все лекарственные средства для использования у человека, перечисленные FDA согласно 21 Своду федеральных правил §§330.5, 331-361 и 440-460, и все лекарственные средства для использования в ветеринарии, перечисленные FDA согласно 21 Своду федеральных правил §§500-589, считаются приемлемыми для использования в соответствии со способами согласно настоящему изобретению.
Использованные в качестве примера лекарственные средства
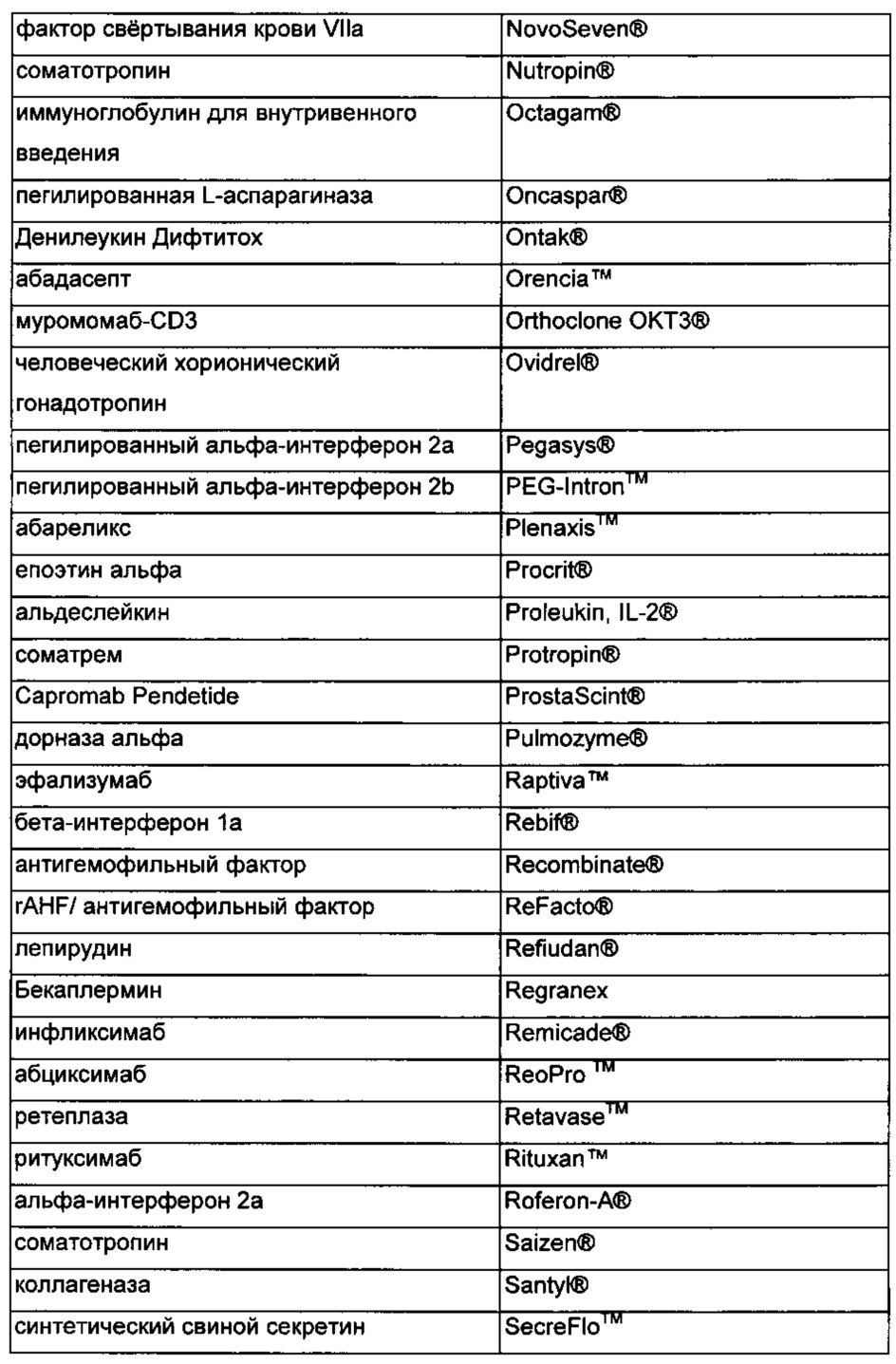
00065 В Таблице 3 приведен неограничивающий список дополнительных использованных в качестве примера средств, которые могут быть использованы в соответствии с настоящемим изобретением.




II. Способы получения композиций
00066 Согласно еще одной отличительной особенности описания настоящего изобретения предложены способы получения композиций, включая вышеуказанные композиции. Конкретный использованный способ может зависеть от природы лекарственного средства, природы липидного компонента, от того будут ли сформированы везикулы и от того будут ли указанные везикулы сформированы в присутствии или в отсутствии лекарственного средства.
Композиции с предварительно сформированными везикулами
00067 В случае композиций, которые включают предварительно сформированные везикулы, указанные везикулы могут быть получены в соответствии с любым известным способом и затем комбинированы с лекарственным средством, чтобы получить композицию. Например, используемая в качестве примера методика представляет собой способ испарения растворителя из пленки при вращении, в котором пленку везикул-формирующих липидов получают испарением при вращении из органического растворителя, например, углеводородного или хлорированного углеводородного растворителя, такого как хлороформ, например, см. Russell and Alexander, J. Immunol. 140: 1274, 1988. Полученную в результате тонкую пленку затем регидратируют в бикарбонатном буфере, чтобы получить везикулы.
00068 Еще один способ включает гидратацию в присутствии разделяющих сил. Устройство, которое может быть использовано для применения разделяющих сил, хорошо известно, подходящее оборудование (см., например, РСТ Publication No. WO 88/06882). Соникация и ультра-соникация (обработка ультразвуком) также эффективные средства для формирования везикул или изменения размера их частиц.
00069 Еще один способ для получения везикул раскрыт Collins et al, J. Pharm. Pharmacol. 42: 53, 1990. Указанный способ включает плавление смеси везикул-формирующих липидов и гидратацию с интенсивным перемешиванием в присутствии водного буфера.
00070 Очевидно, что другие способы, включая другие способы плавления и способы инжекционного распыления, описание которых приведено ниже, также могут быть использованы, чтобы получить предварительно сформированные везикулы.
Другие композиции
00071 Когда везикулы формируют в присутствии лекарственного средства, указанные везикулы предпочтительно (но не обязательно) получают одним из следующих способов плавления или инжекционного распыления. Композиции, которые необязательно содержат везикулы (например, композиции, которые получают, использую липидные компоненты, которые состоят из неионогенных ПАВ, таких как MPG или неионогенных ПАВ и стероида, такие как MPG/холестерин) могут быть также приготовлены подобным способом, хотя они необязательно могут формировать везикулы. Как уже было упомянуто, в указанных способах избегают контакта лекарственных средств с органическими растворителями или выдерживания при высоких температурах. Не ограничиваясь рамками каких-либо теоретических представлений, предполагается, что указанные способы, по вышеуказанной причине, сведут к минимуму повреждающие влияния в отношении лекарственных средств (и, следовательно, потерю эффективности), что вполне могло бы быть результатом применения других способов.
Способ плавления - стандартный
00072 Согласно некоторым вариантам реализации, приведенным в описании настоящего изобретения, предложены способы, которые включают плавление липидного компонента и затем смешивание с лекарственным средством. Согласно некоторым вариантам реализации указанные способы включают стадии получения расплавленной смеси одного или большего количества липидов, и затем добавление водного раствора, содержащего лекарственное средство, к расплавленной смеси (стандартный способ плавления). Согласно некоторым вариантам реализации указанные липиды формируются в везикулы, когда их добавляют в водный раствор.
00073 Очевидно, расплавленная смесь одного или большего количества липидов может быть получена любым способом, например, липиды плавят, чтобы сформировать расплавленную смесь. Согласно некоторым вариантам реализации липиды плавят при температуре в диапазоне 120-150°C (например, 120-125°C, 120-130°C, 120-140°C, 130-140°C, 135-145°C или 140-145°C).
00074 Согласно некоторым вариантам реализации смесь, полученная добавлением раствора антигена к расплавленной смеси липидов помещают в условия контролируемой температуры ниже 60°C, например, ниже 55°C, ниже 50°C, ниже 45°C, ниже 40°C, ниже 35°C, ниже 30°C, ниже 25°C или даже ниже 20°C. Согласно некоторым вариантам реализации расплавленная смесь липидов может быть помещена в условия контролируемой температуры (например, используя водяную баню) непосредственно перед добавлением раствора антигена. В качестве варианта раствор антигена может быть добавлен к расплавленной смеси липидов, и полученная в результате смесь может быть помещена в условия контролируемой температуры. Согласно некоторым вариантам реализации указанная смесь, полученная добавлением раствора антигена к смеси расплавленных липидов помещают в условия контролируемой температуры в диапазоне 20-60°C, например, 20-50°C, 20-40°C, 20-30°C, 30-60°C, 30-50°C, 30-40°C, 40-60°C, 40-50°C или 50-60°C. Также очевидно, что термин "условия контролируемой температуры" не требует, чтобы температура была зафиксирована на строго определенном уровне, но просто означает, что температура остается в пределах диапазона (например, ±1°C, ±2°C, ±5°C, ±10°C и т.д. от некоторого значения) или, что температура остается ниже или выше определенного значения.
00075 Согласно некоторым вариантам реализации водный раствор, содержащий антиген имеет температуру ниже 50°C при добавлении к смеси расплавленных липидов, например, ниже 45°C, ниже 40°C, ниже 35°C, ниже 30°C, ниже 25°C или даже ниже 20°C. Согласно некоторым вариантам реализации водный раствор, содержащий антиген имеет температуру в диапазоне 20-60°C, например, 20-50°C, 20-40°C, 20-30°C, 30-60°C, 30-50°C, 30-40°C, 40-60°C, 40-50°C или 50-60°C при добавлении к смеси расплавленных липидов. Согласно некоторым вариантам реализации водный раствор, содержащий антиген помещают в условия контролируемой температуры перед добавлением к смеси расплавленных липидов.
00076 Согласно некоторым вариантам реализации смесь расплавленных липидов имеет температуру, которая превышает не более чем на 50°C их температуру плавления перед добавлением раствора антигена. Согласно некоторым вариантам реализации указанная расплавленная смесь липидов имеет температуру, которая не превышает ее температуру плавления более чем на 45°C, 40°C, 35°C, 30°C, 25°C, 20°C, 10°C или 5°C, при добавлении раствора антигена. Согласно некоторым вариантам реализации указанная расплавленная смесь липидов имеет температуру, которая не превышает ее температуру плавления более чем на 5-50°C, например, 5-40°C, 5-30°C, 5-20°C, 5-10°C, 10-50°C, 10-40°C, 10-30°C или 10-20°C, при добавлении раствора антигена. Например, согласно некоторым вариантам реализации указанная расплавленная смесь липидов имеет температуру менее 110°C, 100°C, 90°C или 80°C, при добавлении раствора антигена.
Способ плавления - обратный
00077 Согласно некоторым вариантам реализации описания настоящего изобретения предложены способы, которые включают плавление липидов липидного компонента и затем добавление указанной расплавленной смеси липидов к водному раствору, содержащему лекарственное средство (обратный способ плавления). Согласно некоторым вариантам реализации указанные липиды формируются в везикулы при добавлении к водному раствору.
00078 Согласно некоторым вариантам реализации указанный водный раствор, содержащий лекарственное средство имеет температуру ниже 50°C при добавлении расплавленной смеси липидов, например, ниже 45°C, 40°C, 35°C, 30°C, 25°C или даже ниже 20°C. Согласно некоторым вариантам реализации водный раствор, содержащий профилактическое или лекарственное средство, имеет температуру в диапазоне 20-60°C, например, 20-50°C, 20-40°C, 20-30°C, 30-60°C, 30-50°C, 30-40°C, 40-60°C, 40-50°C или 50-60°C при добавлении расплавленной смеси липидов. Согласно некоторым вариантам реализации водный раствор, содержащий лекарственное средство находится в условиях контролируемой температуры.
00079 Согласно некоторым вариантам реализации указанная расплавленная смесь липидов имеет температуру в диапазоне 120-150°C (например, 120-125°C, 120-130°C, 120-140°C, 130-140°C, 135-145°C или 140-145°C) при добавлении к водному раствору.
00080 Согласно некоторым вариантам реализации указанная расплавленная смесь липидов имеет температуру, которая превышает ее точку плавления не более чем на 50°C при добавлении к водному раствору. Согласно некоторым вариантам реализации указанная расплавленная смесь липидов имеет температуру, которая превышает ее точку плавления не более чем на 45°C, 40°C, 35°C, 30°C, 25°C, 20°C, 10°C или 5°C при добавлении к водному раствору. Согласно некоторым вариантам реализации указанная расплавленная смесь липидов имеет температуру, которая превышает ее точку плавления не более чем на 5-50°C, например, 5-40°c, 5-30°C, 5-20°C, 5-10°C, 10-50°C, 10-40°C, 10-30°C или 10-20°C при добавлении к водному раствору. Например, согласно некоторым вариантам реализации указанная расплавленная смесь липидов имеет температуру ниже 120°C, 110°C, 100°C или 90°C при добавлении к водному раствору.
Способы введения растворителя
00081 Согласно некоторым вариантам реализации композиции могут быть получены, используя способ введения растворителя. Например, согласно некоторым вариантам реализации указанные способы могут включать получение раствора одного или большего количества липидов и добавление указанного раствора липидов к водному раствору, содержащему лекарственное средство, посредством введения.
00082 Способы введения растворителя обладают некоторыми преимуществами перед другими способами получения, например, способами, в которых применяют высокую температуру или давление, т.к. липиды могут быть растворены в органических растворителях в условиях контролируемой температуры. Кроме того, применение способов введения растворителя позволяет отказаться от гомогенизации при высоком давлении.
00083 Согласно некоторым вариантам реализации указанную смесь, полученную введением раствора одного или большего количества липидов в водный раствор, содержащий лекарственное средство, помещают в условия контролируемой температуры, которая ниже 55°C, например, ниже 50°C, 45°C, 40°C, 35°C, 30°C, 25°C или даже ниже 20°C. Согласно некоторым вариантам реализации смесь, полученную введением раствора одного или большего количества липидов в водный раствор, содержащий лекарственное средство, помещают в условия контролируемой температуры, которая находится в диапазоне 20-55°C, например, 20-50°C, 20-40°C, 20-30°C, 30-55°C, 30-50°C, 30-40°C, 40-55°C, 40-50°C или 50-55°C.
00084 Согласно некоторым вариантам реализации водный раствор, содержащий профилактическое лекарственное средство имеет температуру ниже 50°C перед введением раствора одного или большего количества липидов, например, ниже 45°C, 40°C, 35°C, 30°C, 25°C или даже ниже 20°C. Согласно некоторым вариантам реализации водный раствор, содержащий лекарственное средство, имеет температуру в диапазоне 20-60°C, например, 20-50°C, 20-40°C, 20-30°C, 30-60°C, 30-50°C, 30-40°C, 30-35°C, 40-60°C или 40-50°C перед введением раствора одного или большего количества липидов. Согласно некоторым вариантам реализации водный раствор, содержащий лекарственное средство, помещают в условия контролируемой температуры перед введением раствора одного или большего количества липидов.
00085 Согласно некоторым вариантам реализации раствор одного или большего количества липидов имеет температуру ниже 90°C при введении в водный раствор, содержащий лекарственное средство, например, ниже 80°C, 70°C, 65°C, 60°C или ниже 55°C. Согласно некоторым вариантам реализации раствор одного или большего количества липидов имеет температуру в диапазоне 50-90°C при введении в водный раствор, содержащий лекарственное средство, например, 50-80°C, 50-70°C, 50-65°C, 50-60°C, 50-55°C, 55-80°C, 55-70°C, 55-65°C или 55-60°C.
00086 Разнообразные способы введения растворителя были раскрыты и могут быть адаптированы в соответствии с настоящим изобретением. Например, описание способов введения растворителя, в которых липиды растворяли в диэтиловом эфире, приведено Syan et al. (Nanoparticle vesicular systems: A versatile tool for drug delivery, J. Chemical and Pharmaceutical Research 2 (2): 496, 2010). Другое описание способов введения растворителя, в которых липиды растворяли в этаноле, приведены Wagner et al. (Liposome Technology for Industrial Purposes, J. Drug Delivery; Volume 2011, Article ID 591325). Еще одно описание, в котором для растворения липидов использовали трет-бутиловый спирт, приведено Wang et al. (Colloids and Surfaces V: Biointerfaces 79: 254, 2010). См. также указанные способы Schubert М.А. et al. (European Journal of Pharmaceutics and Biopharmaceutics 55: 125-131, 2003).
00087 Согласно некоторым вариантам реализации указанные липиды растворяют в органическом растворителе. Согласно некоторым вариантам реализации растворитель представляет собой эфир, например, диэтиловый эфир. Согласно некоторым вариантам реализации растворитель представляет собой полярный протонный смешивающийся с водой растворитель. Протонные растворители представляют собой растворители, которые содержат способные к диссоциации протоны (например, атом водорода, связанный с кислородом в гидроксильной группе или азотом в аминогруппе). Согласно некоторым вариантам реализации полярный протонный смешивающийся с водой органический растворитель представляет собой алифатический спирт, содержащий 2-5 атомов углерода (например, 2 атома углерода, 3 атома углерода, 4 атома углерода или 5 атомов углерода). Согласно некоторым вариантам реализации указанный растворитель представляет собой трет-бутанол. Согласно некоторым вариантам реализации указанный растворитель представляет собой этанол.
00088 Согласно некоторым вариантам реализации один или большее количество липидов растворяют в полярном протонном смешивающимся с водой органическом растворителе в отсутствии какого-либо сорастворителя. Согласно некоторым вариантам реализации один или большее количество липидов растворяют в полярном протонном смешивающимся с водой органическом растворителе с одним или большим количеством сорастворителей. Согласно некоторым вариантам реализации указанный полярный протонный смешивающийся с водой органический растворитель составляет, по меньшей мере, 70% об/об системы растворителей, например, по меньшей мере, 75%, 80%>, 90%>, 95%>или 99%.%. Согласно некоторым вариантам реализации один или большее количество липидов растворяют в безводной системе растворителей. Согласно некоторым вариантам реализации один или большее количество липидов растворяют в системе растворителей, которая включает некоторое количество воды, такое, что везикулы не формируются. Согласно некоторым вариантам реализации один или большее количество липидов растворяют в системе растворителей, которая включает менее 5 об./об. % воды, например, менее 4%, 3%, 2%, 1%, 0,5%, или 0,1%.
Лиофилизация
00089 Согласно некоторым вариантам реализации композиция согласно настоящему изобретению может быть лиофилизована для дальнейшего применения и впоследствии, перед применением гидратирована.
00090 Лиофилизация включает замораживание указанной композиции, и затем снижение давления (и, возможно, нагревание), чтобы напрямую сублимировать замороженный растворитель из твердой фазы в газовую фазу (т.е. высушивание фазы). Согласно некоторым вариантам реализации высушивание фазы делят на первичное и вторичное высушивание фазы.
00091 Замораживание фазы можно провести помещением указной композиции в контейнер (например, колбу, пробирку Эппендорф и т.д.) и, возможно, вращением контейнера в бане, которую охлаждают механически (например, применяя сухой лед и метанол, жидкий азот и т.д.). Согласно некоторым вариантам реализации стадия замораживания включает охлаждение композиции до температуры, которая ниже эвтетической точки композиции. Т.к. эвтетическая точка достигается при самой низкой температуре, при которой твердая и жидкая фаза композиции могут находиться вместе, выдерживание композиции при температуре ниже указанной точки дает уверенность, что на последующих стадиях произойдет сублимация, а не испарение.
00092 Высушивание указанной фазы (или первичное высушивание фазы, когда используют два высушивания фазы) включает снижение давления и, возможно, нагревание препарата до температуры, при которой растворители могут сублимировать. Указанное высушивание фазы обычно удаляет большую часть растворителей из композиции. Очевидно, что замороженная и высушенная фазы не обязательно представляют собой отдельные фазы, но могут быть комбинированы любым способом. Например, согласно некоторым вариантам реализации замороженная и высушенная фазы могут совместно присутствовать.
00093 Вторичное высушивание фазы, возможно, может быть использовано, чтобы удалить остаточный растворитель, который был адсорбирован при замораживании фазы. Не ограничиваясь рамками каких-либо теоретических представлений, указанная фаза включает повышение температуры, чтобы прекратить любые физико-химические взаимодействия, которые происходят между молекулами растворителя и замороженным препаратом. Как только высушивание фазы завершено, пониженное давление может быть сброшено любым инертным газом (например, азотом или гелием) перед тем, как лиофилизованный продукт, возможно, герметично упаковывают.
00094 Согласно некоторым вариантам реализации в указанном лиофилизованном продукте в значительной степени отсутствуют органические растворители.
00095 Эксципиенты, такие как сахароза, аминокислоты или белки, такие как желатин или сывороточный альбумин, могут быть использованы, чтобы дополнительно защитить лекарственное средство при лиофилизации. Используемые в качестве примера лиопротекторы включают сахарозу, трегалозу, полиэтиленгликоль (ПЭГ), диметил-сукцинатный буфер (DMS), бычий сывороточный альбумин (BSA), маннит, сорбит и декстран. Любое подходящее количество и/или комбинация лиоппротекторов может быть использована, чтобы защитить указанный антиген. Например, как приведено в описании U.S. Patent 6290967, присутствие дисахарида (например, сахарозы) и 6-атомного полигидрированного спирта (например, сорбита), усиливало стабильность композиции вакцины по сравнению с композициями, использованными в качестве контроля. Сахарозу добавляли в количественном диапазоне 10-70 г на литр вакцины, а сорбит добавляли в количественном диапазоне 15-90 г на литр вакцины.
Регидратация
00096 После того как композиция была лиофилизована (и, возможно, хранилась), указанные способы согласно настоящему изобретению могут включать стадию регидратации лиофилизованного продукта. Согласно некоторым вариантам реализации указанная регидратация достигается смешиванием лиофилизованного продукта с водным раствором.
00097 Согласно некоторым вариантам реализации указанный водный раствор включает буфер. Используемый буфер обычно зависит от природы лекарственного средства. Например, согласно следующему неограничивающему перечислению могут быть использованы: РСВ буфер, Na2HPO4/NaH2PO4 буфер, PBS (фосфатно-солевой) буфер, бициновый буфер, Tris буфер, HEPES ((4-(2-гидроксиэтил)-1-пиперазин этансульфоновоя кислота)) буфер, MOPS (3-[N-Морфолино]пропансульфоновая кислота) буфер и т.д. РСВ буфер получают смешиванием пропионата натрия, какодилата натрия и бис-Tris пропана в молярном соотношении 2:1:2. Изменение количества добавляемой HCl позволяет поддерживать значение рН в диапазоне 4-9. Согласно некоторым вариантам реализации может быть использован карбонатный буфер.
00098 Согласно некоторым вариантам реализации композиция может быть лиофилизована для дальнейшего применения и впоследствии гидратирована (например, стерильной водой или водным буфером) перед применением. Согласно некоторым вариантам реализации композиция может храниться при -80°C перед лиофилизацией.
00099 Согласно некоторым вариантам реализации указанная регидратированная композиция проявляет в значительной степени такую же активность, как указанная композиция до лиофилизации.
000100 Согласно некоторым вариантам реализации указанная регидратированная композиция проявляет, по меньшей мере, 50% от активности композиции до лиофилизации (например, приблизительно 55%, 60%>, 65%, 70%, 75%, 80%, 85%, 90%, 95% или 99%). Согласно некоторым вариантам реализации показатель уровня активности, основан на измерениях IC50 или ЕС50 (или некоторых других измеренях активности, например, TCID50, основанный на тесте in vitro микротитрования в случае композиций, основанных на вакцине MMR). Согласно некоторым вариантам реализации показатель уровня активности основан на измерении реакции бляшкообразования.
000101 Согласно некоторым вариантам реализации указанная регидратированная композиция проявляет, по меньшей мере, в 1,5 раза большую активность по сравнению с другой эквивалентной композицией, которая была приготовлена без липидного компонента (например, приблизительно в 2; 2,5; 3; 3,5; 4 или 5 раз). Согласно некоторым вариантам реализации показатель уровня активности основан на измерениях IC50 или ЕС50 (или некоторых других измерениях активности, например, TCID50, основанный на тесте in vitro микротитрования в случае композиций, основанных на вакцине MMR). Согласно некоторым вариантам реализации показатель уровня активности основан на измерении реакции бляшкообразования.
Хранение
000102 Согласно некоторым вариантам реализации указанная лиофилизованная композиция может храниться в течение некоторого времени (например, дней, недель или месяцев) перед регидратацией и введением нуждающемуся в ней субъекту. Согласно некоторым вариантам реализации указанную лиофилизованную композицию выдерживают при температуре, превышающей 8°C при хранении (например, при температуре, превышающей 10°C, 15°C, 20°C, 25°C, 30°C, 35°C или 40°C, температуре в диапазоне 10-40°C, 20-40°C, 30-40°C, 10-30°C, 20-30°C, комнатной температуре, и т.д.). Согласно некоторым вариантам реализации указанную лиофилизованную композицию хранят, не соблюдая условий контролируемой температуры.
000103 Согласно некоторым вариантам реализации лиофилизованные композиции термостабильны в плане того, что активность композиции остается в значительной степени неизменной при хранении, несмотря на выдерживание при температуре превышающей 8°C (например, при температуре, превышающей 10°C, 15°C, 20°C, 25°C, 30°C, 35°C или 40°C, температуре в диапазоне 10-40°C, 20-40°C, 30-40°C, 10-30°C, 20-30°C, 37°C, комнатной температуре, и т.д.) в течение 1-6 месяцев (например, 1, 2, 3, 4, 5 или 6 месяцев, 12 недель и т.д.).
000104 Согласно некоторым вариантам реализации хранение указанной лиофилизованной композиции при указанной повышенной температуре уменьшает активность композиции менее чем на 20% (например, менее чем на 15%, 10%, 5%, 1%) по данным измеренным в тесте активности и по сравнению с эквивалентной лиофилизованной композицией, которую хранили при температуре 2-8°C в течение такого же времени.
000105 Согласно некоторым вариантам реализации активность указанной композиции после хранения, по меньшей мере, в 1,5 раза большую активность, чем другая эквивалентная композиция, которую хранили при такой же повышенной температуре, но которая была приготовлена без липидного компонента (например, по меньшей мере, приблизительно в 2; 2,5; 3; 3,5; 4 или 5 раз). Согласно некоторым вариантам реализации показатель уровня активности основан на измерениях IC50 или ЕС50 (или некоторых других измерениях активности, например, TCID50, основанный на тесте in vitro микротитрования в случае композиций, основанных на вакцине MMR). Согласно некоторым вариантам реализации показатель уровня активности основан на измерении реакции бляшкообразования.
000106 Согласно некоторым вариантам реализации один или большее число указанных результатов показателей активности, полученных, когда указанную лиофилизованную композицию хранят при 25°C в течение 1, 2, 3, 4, 5 или 6 месяцев. Согласно некоторым вариантам реализации указанные результаты показателей активности получают при хранении лиофилизованной композиции при 15°C, 20°C, 30°C, 35°C, 37°C или 40°C в течение 1 месяца. Согласно некоторым вариантам реализации указанные результаты получают при хранении лиофилизованной композиции при 15°C, 20°C, 30°C, 35°C, 37°C или 40°C в течение 2 месяцев. Согласно некоторым вариантам реализации указанные результаты получают при хранении лиофилизованной композиции при 15°C, 20°C, 30°C, 35°C, 37°C или 40°C в течение 3 месяцев (или 12 недель). Согласно некоторым вариантам реализации указанные результаты получают при хранении лиофилизованной композиции при 15°C, 20°C, 30°C, 35°C, 37°C или 40°C в течение 4 месяцев. Согласно некоторым вариантам реализации указанные результаты получают при хранении лиофилизованной композиции при 15°C, 20°C, 30°C, 35°C, 37°C или 40°C в течение 5 месяцев. Согласно некоторым вариантам реализации указанные результаты получают при хранении лиофилизованной композиции при 15°C, 20°C, 30°C, 35°C, 37°C или 40°C в течение 6 месяцев. Согласно некоторым вариантам реализации указанная температура может варьировать в диапазоне, например, ±2°C.
III. Дозирование и способы введения
000107 Композиции и способы согласно настоящему изобретению могут быть полезны для лечения людей, включая взрослых и детей. В основном, тем не менее, композиции и способы согласно настоящему изобретению могут быть использованы у любого животного. Согласно некоторым вариантам реализации композиции и способы, описание которых приведено в тексте данного документа, могут быть использованы в ветеринарии, например, ветеринарии собак и кошек. Если необходимо, композиции и способы, описание которых приведено в тексте данного документа, могут также быть использованы у сельскохозяйственных животных, таких как овцы, птица, крупный рогатый скот, свиньи и лошади.
000108 Композиции, описание которых приведено в тексте данного документа, в основном будут вводиться в таких количествах и такое число раз, которые необходимы или достаточны, чтобы индуцировать терапевтический ответ (например, терапевтически эффективная доза). Режимы дозирования могут состоять из одной дозы или множества доз за некоторое время. Точное количество композиции, которое необходимо ввести, может варьировать от субъекта к субъекту и может зависеть от нескольких факторов. Таким образом, очевидно, что в основном точная применяемая доза будет определяться предписанием врача, и будет зависеть не только от массы тела субъекта и способа введения, но также от возраста субъекта и тяжести симптомов и/или риска инфекционного поражения.
000109 Согласно некоторым вариантам реализации доза вирусного антигена в иммуногенной композиции достаточна, чтобы достичь значения TCID50 сравнимого с таковым у разрешенной к применению вакцины. Например, разрешенная к применению вакцина M-M-R-IIR включает, по меньшей мере, 1000 TCID50 вируса кори, по меньшей мере, 5000 TCID50 вируса паротита и, по меньшей мере, 1000 TCID50 вируса краснухи. TCID50 (средняя инфекционная доза для клеточной культуры) определяет количество вируса необходимое, чтобы инфицировать 50% инокулированной клеточной культуры. Обычно значения TCID50 измеряют высеванием на планшеты (или чашки Петри) клеток-хозяев (например, клеток Vero) и добавлением последовательных разведений вирусного антигена. После инкубации процент инфицированных клеток наблюдают без применения сложного оборудования и записывают для каждого разведения вируса, а результаты используют, чтобы математически подсчитать значение TCID50, например, в соответствии с методом Behrens-Karber (Karber, Arch Exp Pathol Pharmakol 162: 480-483, 1931).
000110 Согласно некоторым вариантам реализации лекарственное средство получают из разрешенного к применению у человека продукта (например, лекарственного продукта или вакцины) и указанную композицию вводят человеку в дозе, которая меньше стандартной дозы для человека (например, в диапазоне 10-90%, 10-80%, 10-70%, 10-60%, 10-50%, 10-40%, 10-30%, 10-20%, 20-90%, 20-80%, 20-70%, 20-60%, 20-50%, 20-40%, 20-30%, 30-90%, 30-80%, 30-70%, 30-60%, 30-50%, 30-40%, 40-90%, 40-80%, 40-70%, 40-60%, 40-50%, 50-90%, 50-80%, 50-70%, 50-60%, 60-90%, 60-80%, 60-70%, 70-90%, 70-80% или 80-90% стандартной дозы для человека).
000111 Согласно некоторым вариантам реализации указанную композицию вводят в виде одной дозы. Согласно некоторым вариантам реализации указанную композицию вводят в виде более чем одной дозы (например, 1-3 дозы, которые разделены 1-12 мес.).
000112 Согласно некоторым вариантам реализации указанная композиция может быть приготовлена для парентерального введения, например, посредством инъекции. Согласно таким вариантам реализации введение может быть, например, внутривенным, внутримышечным, внутрикожным, подкожным, посредством инфузии или посредством безыгольных инъекционных методов. Согласно некоторым вариантам реализации указанная композиция может быть приготовлена для внутримышечного введения. Согласно некоторым вариантам реализации указанная композиция может быть приготовлена для подкожного введения. Для такого парентерального введения указанные композиции могут быть приготовлены и содержаться в виде обычных лиофилизованных композиций и разводиться перед введением фармацевтически приемлемым физраствором, таким как 0,9% физраствор. Значение рН композиции, предназначенной для инъекции, может быть установлено, как известно в данной отрасли техники, фармацевтически приемлемой кислотой, такой как метансульфоновая кислота. Другие приемлемые растворители, которые могут быть применены, включают раствор Рингера и U.S.Р. Кроме того, стерильные жирные масла обычно применяют, в качестве растворителей. С этой целью может быть применено любое жидкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, при получении инъекционных форм используют жирные кислоты, такие как олеиновая кислота. Указанные композиции, предназначенные для инъекций, могут быть стерилизованы, например, фильтрацией через фильтр, задерживающий бактерии или включением стерилизующего средства в форму стерильной сухой композиции, которая может быть растворена или дисперегирована в стерильной воде или другой стерильной, подходящей для инъекции, среде перед применением.
ПРИМЕРЫ
000113 В следующих примерах приведено описание некоторых использованных в качестве примера режимов получения и применения определенных композиций, описание которых приведено в тексте данного документа. Следует учитывать, что указанные примеры предназначены только для иллюстративных целей и не предполагают ограничения объема композиций и способов, описание которых приведено в тексте данного документа.
Пример 1: двухстадийный обратный способ плавления
000114 В данном примере приведено описание двухстадийного обратного способа плавления, который был использован для получения определенных композиций (включая композиции, в которых везикулы были сформированы в присутствии вирусного антигена).
000115 На Стадии 1, следующие липиды: 1-монопальмитоилглицерин (MPG), холестерин и дицетилфосфат (DCP) в молярном соотношении 5:4:1 помещали в 50 мл плоскодонный стеклянный стакан, наблюдая, чтобы даже минимальное количество порошка не прилипало к стенкам. Указанные липиды плавили на нагретой масляной бане приблизительно при 120°C в течение 10 минут, периодически поворачивая для перемешивания, в мензурке, накрытой алюминиевой фольгой.
000116 На этом этапе стоковый раствор вакцины M-M-R-IIR (вирусная вакцина против кори, паротита и краснухи, живая ослабленная, Merck Frosst Std.) предварительно инкубировали в течение 5 минут при 30°C на нагретой водяной бане. На Стадии 2, полученный в результате стоковый раствор вакцины М-M-R-II® гомогенизировали на подходящей скорости (например, на 8000 об./мин), расплавленную смесь липидов добавляли в гомогенизированный стоковый раствор вакцины М-M-R-II® и гомогенизацию продолжали в течение еще 30 секунд приблизительно при 30°C.Полученный в результате гомогенат перемешивали встряхивнием в течение 30 минут на 220 об/мин и приблизительно при 30°C. Эквивалентный объем 400 мМ раствора сахарозы в 25 мМ бикарбонатном натриевом буфере (рН 9,7) добавляли к гомогенату после перемешивания и указанный гомогенат еще перемешивали встряхиванием в течение 5 минут на на 220 об./мин и приблизительно при 30°C. Указанную смесь разделяли на аликвоты и замораживали при -80°C, затем лиофилизовали и разводили 0,5 мл стерильной воды для инъекций (WFI) перед применением.
Пример 2: Тесты активности кори (TCID50 и тест бляшкообразования)
000117 Обычным методом теста, который используют, чтобы подсчитать число инфекционных частиц в живых вирусных вакцинах является тест средних инфекционных доз для клеточной культуры (TCID50). Указанный тест разведений до конечной точки позволяет подсчитать количество вируса, которое необходимо, чтобы погибло 50% инфицированных клеток-хозяев или получить цитопатический эффект в более чем 50% клеток инокулированной тканевой культуры. Указанный тест может быть более распространен в прикладных клинических исследованиях, если должна быть определена летальная доза вируса, или если вирус не формирует бляшек (см. описание альтернативного теста бляшкообразования ниже). В плане клеточной культуры, клетки-хозяева высевают на планшеты и добавляют последовательные разведения вируса. После инкубации процент погибших клеток (т.е. инфицированных клеток) наблюдают без применения сложного оборудования и записывают для каждого разведения вируса, а результаты используют, чтобы математически вычислить результат TCID50. Вследствие отличительных особенностей и принципов методов тестирования TCID50 и БОЕ/мл (результат теста бляшкообразования) или результаты других тестов инфицируемости не эквивалентны. Указанный способ может занять до недели вследствие времени инфицируемости клеток.
000118 В данных экспериментах использовали клетки Vero, чтобы оценить активность вирусов кори в модифицированных вакцинах M-M-R-II®. Модифицированную вакцину M-M-R-II®, полученную в соответствии с Примером 1, разводили после хранения (описание ниже) в воде для инъекций. Клетки Vero выращивали до конфлюэнтности более чем 80% в 96-луночных планшетах. 100 мкл 10-кратного разведения модифицированной вакцины добавляли в лунки, начиная с разведения 1/10 и производя семь дополнительных 10-кратных последовательных разведений модифицированной вакцины M-M-R-II® в культуральной среде. Титр вируса определяет количество вируса необходимое, чтобы получить цитопатический эффект в более чем 50% клеток инокулированной тканевой культуры. Титр вируса кори (TCID50) определяли после разведения согласно приведенному выше описанию.
000119 Как упоминалось выше, еще одним распространенным тестом, который используют для подсчета количества инфекционных частиц в живых вирусных вакцинах, является тест бляшкообразования. Указанный способ тестирования основан на цитопатическом эффекте вируса вакцины в отношении подверженных ему клеточных линий и является показателем активности композиции вакцины in vitro (Schalk et al, Journal ofVirological Methods 117: 179-187, 2004).
000120 Модифицированные вакцины M-M-R-II®, полученные согласно Примеру 1 разводили после хранения (например, согласно вышеприведенному описанию) в воде для инъекций. Поскольку вакцина M-M-R-II® представляет собой тривалентную вакцину, вирусы паротита и краснухи в вакцине первоначально нейтрализовали добавлением антисывороток против паротита и краснухи, затем инкубировали при 4°C в течение часа (указанные антисыворотки перед добавлением инактивировали нагреванием при 56°C в течение 30 минут). Затем получали 100, 500, 1000, 2500 и 5000-кратные последовательные разведения модифицированных вакцин M-M-R-II® в культуральной среде. Клетки Vero выращивали до конфлюэнтности 90% в 6-луночных планшетах. За день до инфицирования культуральную среду заменяли свежей. Клетки инфицировали 200 мкл каждого разведения (12 лунок на разведение). После адсорбции вируса в течение 45 минут при комнатной температуре, к клеткам добавляли 4 мл верхнего слоя агара, состоящего из среды MI 99 (BioWhittaker Europe) с 4,7% инактивированной фетальной сыворотки телят (Invitrogen), 0,11% NaHCCh и 0,33% агара. Планшеты переворачивали и инкубировали при 36°C и 2,5% СО2. Через 9 дней, удаляли верхний слой агара и клетки фиксировали 96% этанолом в течение 2 минут. Далее клетки окрашивали карбол-фуксином и высушивали. Бляшки в основном подсчитывали без применения сложного оборудования и результаты, в комбинации с фактором разведения, использованным, чтобы подготовить планшет, использовали для вычисления числа бляшкообразующих единиц в единице объема образца (БОЕ/мл). Результат БОЕ/мл представляет количество инфекционных частиц в образце и основан на предположении, что каждая бляшка представляет отображение одной инфекционной вирусной частицы.
Пример 3: Сравнение вирусных антиген-содержащих везикул и предварительно сформированных везикул, смешанных с вирусным антигеном: влияние концентрации липида на термостабильность и жидкостную стабильность
000121 Настоящее исследование имело целью оценку стабильности везикул на основе неионогенного ПАВ (NISV), содержащих живую ослабленную вакцину M-M-R-II®, модифицированную различными концентрациями липида, буферами и сахарозой, используя обратный способ плавления, как приведено в описании Примера 1. В указанном исследовании также сравнивали приготовление M-M-R-II® в везикулах и приготовление ее с предварительно сформированными везикулами. Образцы хранили при 5±3°C и 37±2°C. Выпускаемую промышленно вакцину M-M-R-II® использовали в качестве позитивного контроля для сравнения. В качестве in vitro теста применяли TCID50 (согласно описанию, приведенному в Примере 2), чтобы определить активность вакцины после 1, 2 и 12 недель хранения. Результаты сравнивали с показателями выпускаемой промышленно вакцины, чтобы оценить преимущества в термостабильности модифицированных образцов.
000122 Липиды: 1-монопальмитоилглицерин (MPG), холестерин и дицетилфосфат (DCP) в молярном соотношении 5:4:1 помещали на дно плоскодонного стеклянного стакана. Указанные липиды плавили на масляной бане при 120-122°C с периодическим перемешиванием. Раствор вакцины M-M-R-II14 гомогенизировали на 8000 об./мин и расплавленную смесь липидов немедленно переносили в раствор вакцины и нагревали при 30°C-32°C.
После гомогенизации (10 минут для ТА 8 и 9; 30 секунд для ТА 1-7 и 10-12), полученную в результате смесь перемешивали в течение 30 минут на 220 об./мин при 30-32°C. Для определенных образцов затем добавляли эквивалентный объем 400 мМ раствора сахарозы, возможно приготовленный на 25 мМ бикарбонатном натриевом буфере или стерильной воде. Полученный образец перемешивали еще 5 минут на 220 об./мин при 30-32°C. В случае ТА 4 к раствору вакцины M-M-R-II® добавляли концентрированный фосфатный буфер перед добавлением расплавленного липида. Раствор разделяли на аликвоты по 1 мл на флакон (ТА 1-4, 8, 9, 10, 11) и по 0,5 мл на флакон (ТА 5-7 и 12), после чего лиофилизовали. Лиофилизованные флаконы хранили при 5±3°C и 37±2°C. Каждый флакон лиофилизованных образцов разводили 1 мл стерильной воды перед анализом средних инфекционных доз для клеточной культуры (TCID50). Описание указанных образцов для данного исследования стабильности приведено в Таблице 4.


000123 Указанные лиофилизованные образцы собирали из термостата. Всем образцам присваивали код и хранили их при 4°C перед тестированием. Активность компонента кори определяли тестом микротитрования in vitro. Посредством теста TCID50 оценивали жизнеспособные вирусы, используя упорядоченный тест конечных точек разведения, который анализировали статистически. Вкратце, последовательные разведения указанных образцов и препараты стандартов сравнения инокулировали в ряды из 10 лунок планшетов для микротитрования, вместе с клетками Vero (эпителиальные клетки почки африканской зеленой обезьяны; АТСС-CCL 81), использованными для образцов 1, 2 и 12 недель. Клеточная линия Vero берет начало от почки нормальной взрослой африканской зеленой обезьяны. Планшеты для микротитрования инокулировали 50 мкл клеток Vero, чтобы получить титр 4,0×105 клеток/мл за 24 часа при 5% СО2/37°C (в данных условиях предполагается 75-80% клеточная конфлюэнтность). Каждый образец разводили 1000 мкл стерильной дистиллированной воды, перемешивали 15 секунд вручную после чего перемешивали на вортексе в течение 45 секунд на средней скорости (режим 5). Указанные разведенные образцы (4 флакона на временную точку) переносили на планшеты для микротитрования в течение 5 минут в неразведенном и в разведенном виде (от 10-1 до 10-7), на 96-луночный планшет в четырех повторениях (100 мкл на лунку). Разведения от 10-1 до 10-7 получали в 24-луночных планшетах, заполненных средой IMDM с добавкой 5% FBS, и по 100 мкл добавляли в отдельные лунки в четырех повторениях. Положительный и отрицательный контроли были включены (соответственно, модифицированные в данном исследовании вакцины, выпускаемые промышленно вакцины, и клетки). Указанные планшеты инкубировали при 5% СО2/37°C в течение 5 дней. На момент окончания инкубационного периода количество случаев специфического вирусного цитопатического воздействия (ВЦВ) подсчитывали и записывали. TCID50 на дозу для человека пересчитывали в соответствии с указанными критериями. Значения TCID50 использовали, чтобы вывести среднее геометрическое титров для статистического анализа.
000124 Для статистического анализа всех образцов, преобразованные переменные были сопоставлены, с использованием компьютерной программы Prism 5 для Windows (GraphPad Software, San Diego, CA), чтобы провести двунаправленный непарный t-тест и определить межгрупповое значение р. Статистическая значимость проявляется значением р равным 0,05-0,01, а высокая статистическая значимость проявляется значением р менее 0,01. Значения TCID50 обрабатывали, если указанный титр для всех экспериментов в одной группе был идентичен, т.е. значения титра отличались только по четвертому десятичному знаку, чтобы избежать ограничений программного обеспечения для непараметрического статистического анализа.
000125 На Фиг. 1 отображены результаты теста TCID50 образцов (ТА 1, 5 и 8), приготовленных с 25 мг/мл липида, модифицированных (но без липида) контролей ТА 10 и ТА 12 (выпускаемые промышленно вакцины, прошедшие все стадии подготовки без липида, с использованием или без использования сахарозы и буфера) и выпускаемые промышленно вакцины (М-M-R-II®, ТА 13) как при 5±3°C, так и при 37±2°C. Система укупорки флакона и заполняемый объем для ТА 1 (1 мл предлагаемого модифицированного образца в 6 см3 флаконах) отличался по сравнению с ТА 5 (по 0,5 мл в 2 см3 флаконы), но полученный результат в отношении TCID50 и физико-химические показатели (данные не указаны) были сравнимы. Активность ТА 1, 5 и 8, которые хранили более 1, 2 и 12 недель при 5±3°C и 37±2°C была выше, чем лимит, рекомендуемый ВОЗ (3,0 Iog10) (Фиг. 1). Модифицированные образцы с 25 мг/мл липида продемонстрировали отсутствие потери активности в течение 12 недель хранения при повышенной температуре (37±2°C), при этом активность выпускаемых промышленно вакцин значительно снижалась (р<0,0001). Вакцина M-M-R-II®, добавленная к предварительно сформированным NISV (ТА 9) и модифицированная по обратному способу плавления, продемонстрировала сравнимые результаты в отношении TCID50. Также обнаружено, что не содержащие липидов образцы контроля, прошедшие процесс модификации ТА 10 и ТА 12, не были стабильны в течение более чем одной недели при хранении при повышенной температуре (37±2°C) (Фиг. 1 ТА 10). ТА 12 не проявил стабильности после одной недели хранения при повышенной температуре по сравнению с выпускаемой промышленно вакциной, которая сохраняла стабильность до двух недель при 37±2°C. Данные результаты демонстрируют термостабильность вакцины M-M-R-II® с концентрацией липида 25 мг/мл (с использованием или без использования сахарозы и буфера) при повышенных температурах. При 5±3°C, ТА 1, 5 и 8, образцы контроля, прошедшие стадии модификации (ТА 10 и 12) и выпускаемые промышленно вакцины M-M-R-II® (ТА 13) проявляли отсутствие потери активности в течение 12 недель хранения. ТА 1,5 и 8, которые хранили при 37±2°C сохраняли более высокую активность по сравнению с выпускаемыми промышленно вакцинами.
000126 На Фиг. 2 отображены результаты теста TCID50 образцов (ТА 2, 4, 6 и 9), приготовленных с 12,5 мг/мл липида, модифицированных (но без липида) контролей ТА 10 и ТА 12 (выпускаемые промышленно вакцины, прошедшие все стадии подготовки без липида, с использованием или без использования сахарозы и буфера) и выпускаемые промышленно вакцины (М-M-R-II®, ТА 13), как при 5±3°C, так и при 37±2°C. Система укупорки флакона и заполняемый объем для ТА 2 (1 мл модифицированного Объекта тестирования в 6 см3 флаконах) отличался по сравнению с ТА 6 (по 0,5 мл в 2 см3 флаконы). ТА 6 был более стоек в процессе хранения при повышенной температуре. Активность ТА 2, 4, 6 и 9, которые хранили более 1, 2 и 12 недель при 5±3°C и 37±2°C, была выше, чем лимит, рекомендуемый ВОЗ (3,0 log10) (Фиг. 2). Модифицированные образцы с 12,5 мг/мл липида продемонстрировали отсутствие потери активности в течение 12 недель хранения при повышенной температуре (37±2°C), при этом активность выпускаемых промышленно вакцин значительно снижалась (р<0,0001). Предварительно сформированные NISV (ТА 9) и композиции, полученные по обратному способу плавления (ТА 2, 4 и 6) продемонстрировали сравнимые результаты в отношении TCID50. Также обнаружено, что образцы контроля, прошедшие процесс модификации (но без липидов), не были стабильны в течение более чем одной недели при хранении при повышенной температуре (37±2°C) (Фиг. 2 ТА 10 и ТА 11). ТА 12 не проявил потери активности после одной недели хранения при повышенной температуре по сравнению с выпускаемой промышленно вакциной, которая сохраняла стабильность до двух недель при 37±2°C. Данные результаты демонстрируют термостабильность вакцины M-M-R-II® с концентрацией липида 12,5 мг/мл. При 5±3°C, указанные образцы (ТА 2, 4, 6 и 9), образцы контроля, прошедшие стадии модификации (но без липидов) и выпускаемой промышленно вакцины проявляли стабильность до 12 недель. Образцы, приготовленные с NISV (ТА 9), которые хранились при обеих температурах (5±3°C и 37±2°C) сохраняли более высокую активность по сравнению с выпускаемыми промышленно вакцинами, которые хранились 2 и 12 недель.
000127 В целом указанные лиофилизованные образцы, содержащие вакцину M-M-R-II® в NISV (12,5 или 25,0 мг/мл липида), полученные по обратному способу плавления, не имели изменений активности после в течение 12 недель хранения при 5±3°C и 37±2°C. Наивысшая протестированная концентрация липида 25 мг/мл не проявила каких-либо дополнительных преимуществ в отношении сохранения активности по сравнению образцами, содержащими более низкую концентрацию липида (12,5 мг/мл). Указанный лиофилизованный образец, содержащий вакцину M-M-R-II®, добавленную к предварительно сформированным NISV, не имел потери активности в течение 12 недель хранения при 5±3°C и 37±2°C.
Пример 4: Определение физических свойства композиций, полученных с разными липидными компонентами
000128 Главной целью данного исследования было изучение применения дипальмитоилфосфатидилглицерина (DPPG) в качестве анионогенного ПАВ альтернативного DCP в композициях липид-M-M-R-II®, полученных по обратному способу плавления (согласно описанию, приведенному в Примере 1). Второй целью было изучение исключения DCP или DPPG (а также СНО) из композицй M-M-R-II®.
000129 Липиды: MPG, СНО и DCP или DPPG в молярном соотношении 5:4:1 помещали на дно плоскодонного стеклянного стакана. Указанные липиды плавили на масляной бане при 120-122°C (140°C для образцов с DPPG) с периодическим перемешиванием. Вакцину M-M-R-II® (разведенную прилагающимися разбавителями) нагревали при 30-32°C в течение 5 минут. Раствор вакцины M-M-R-IIR гомогенизировали на 8000 об/мин и расплавленную смесь липидов немедленно переносили в раствор вакцины, нагретый при 30°C-32°C. После 30-40 секунд гомогенизации, полученную в результате смесь перемешивали в течение 30 минут на 220 об/мин при 30-32°C. Раствор разделяли на аликвоты по 0,5 мл на флакон (флакон для лиофилизации объемом 2 см3), после чего лиофилизовали. Лиофилизованные флаконы хранили при 2-8°C после лиофилизации. Перед анализом каждый флакон лиофилизованного образца разводили 0,5 мл дистиллированной воды (GIBCO). ТА 5, контрольную модифицированную (но без липидов) вакцину M-M-R-II®, обрабатывая гидратированную выпускаемую промышленно вакцину M-M-R-II® по обратному способу плавления в отсутствии липидов. ТА 6 контрольная выпускаемая промышленно вакцина M-M-R-II® оставалась в виде лиофилизованного порошка до проведения анализа. Описание указанных образцов для данного исследования стабильности приведено в Таблице 5.
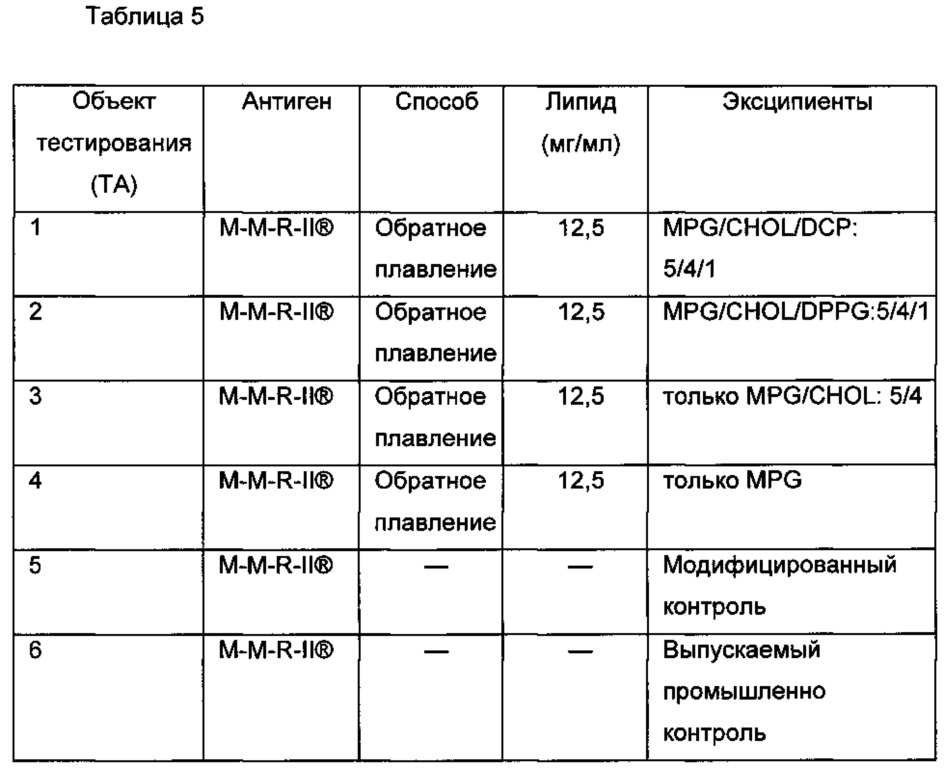
000130 Был проведен ряд определений биофизических свойств разнообразных образцов, описание указанных определений приведено в следующем пункте. Значение рН образцов измеряли стандартными методами. Зета-потенциал образцов анализировали, используя метод электрофоретического светорассеяния. Распределение по размерам каждого образца определяли методом динамического светорассеяния, используя Zetasizer Nano ZS (Модель № ZEN3600). Вкратце, все липидсодержащие образцы разбавляли до 50 мкг/мл липида в 0,2 мкм, фильтрованной WFI. Разбавленные образцы перед загрузкой в прибор интенсивно перемешивали вортексом. Показатель преломления образца устанавливали равным 1,45 и проводили три последовательных измерения каждого образца. ТА 1-6 оценивали при t=0, используя световой микроскоп с 40Х объективом. После лиофилизации образцы анализировали на содержание остаточной воды, используя титратор Фишера. Результаты определения биофизических свойств указанных образцов представлены в Таблице 6.

000131 Значения рН всех указанных образцов были сравнимы с выпускаемым промышленно контролем (ТА 6). Содержание остаточной влаги во всех образцах был в диапазоне 3,30-6,29%. Наименьшим указанное содержание было в ТА 1 с молярным соотношением 5:4:1 липидов MPG:СНО:DCP. Наиболее высокое содержание остаточной влаги наблюдали в ТА 3 (MPG:СНО; молярное соотношение липидов 5:4). Средний гидродинамический диаметр (Z-average) и показатель полидисперсности (PI) ТА 2 (содержащей MPG:CHO:DPPG) были немного выше по сравнению с ТА 1 (MPG:СНО:DCP), что говорит в пользу наличия в ТА 2 полидисперсной системы частиц (см. Таблицу 6). Гидродинамический диаметр и PI в ТА 3 (803,1 нм; PI=0,741) и ТА 4 (707,0 нм; PI=0,777) были больше, чем у образцов, полученных с ионогенным ПАВ (ТА 1 и ТА 2). Значения зета-потенциала для ТА 1 (-48,5 мВ) и 2 (-38.8, мВ), содержащих анионогенное ПАВ имели более негативные значения, чем у образцов, полученных без анионогенного ПАВ и у безлипидных контролей (от -5,68 до -16,7 мВ). Микроскопические частицы липидных везикул (LPV) наблюдали в образцах, содержащих ПАВ (ТА 1 и 2, данные не представлены). Тем не менее, видимые агрегаты липидных частиц наблюдали в не содержащих ПАВ образцах (ТА 3 и 4). В не содержащих липиды образцах контроля липидных частиц не наблюдали (ТА 5 и 6). Ярко-желтые лиофилизованные комки наблюдали во всех образцах (см. Таблицу 6).
Пример 5: Использование анионогенного ПАВ в везикулах и предварительно сформированных везикулах с использованным в качестве примера лекарственным белком
000132 Главной целью данного исследования было изучение использования 1,2-дипальмитоилфосфатидилглицерина (DPPG) в качестве анионогенного ПАВ альтернативного DCP в препаратах NISV, полученных по обратному способу плавления (согласно описанию, приведенному в Примере 1) с использованным в качестве примера лекарственным белком (трастузумаб, моноклональное антитело, которое негативно взаимодействует с рецептором HER2/neu). Второй целью было изучить, может ли смешивание лекарственного белка с предварительно сформированными везикулами на основе анионогенного ПАВ повысить термостабильность.
000133 Липиды: MPG, СНО и DPPG в молярном соотношении 5:4:1 помещали на дно плоскодонного стеклянного стакана. Указанные липиды плавили на масляной бане при 140°C с периодическим перемешиванием. Анализированный раствор трастузумаба (буфер заменен 5% сахарозой в 25 мМ Tris и 25 мМ натрий-цитратном буфере, рН 6,5) нагревали при 30-35°C в течение 5-10 минут. Раствор трастузумаба гомогенизировали на 8000 об./мин и расплавленные липиды немедленно переносили в раствор лекарственного белка, нагретый при 30-32°C. После 2 минут гомогенизации, смесь липосом перемешивали в течение 15-30 минут на 220 об./мин при 30-35°C в термостатируемом шейкере. Раствор разделяли на аликвоты по 0,5 мл на флакон (флакон для лиофилизации объемом 2 см3), после чего лиофилизовали. Лиофилизованные флаконы хранили при 2-8°C после лиофилизации. Перед анализом каждый флакон лиофилизованного Объекта Тестирования (ТА) разводили 0,5 мл воды WFI. Предварительно сформированные везикулы получали сходным образом, за исключением того, что стадию гомогенизации проводили только с буфером и трастузумаб смешивали с предварительно сформированными везикулами после приготовления, а не во время приготовления. Исследование стабильности Объекта Тестирования представлено в Таблице 7. Для образца контроля без LPV ("Контроль-4", немодифицированный трастузумаб), раствор трастузумаба не подвергали диализу и оставляли в буфере, содержащем 20 мМ гистидина, 7% сахарозы, 0,01% PS20, рН 6,0.
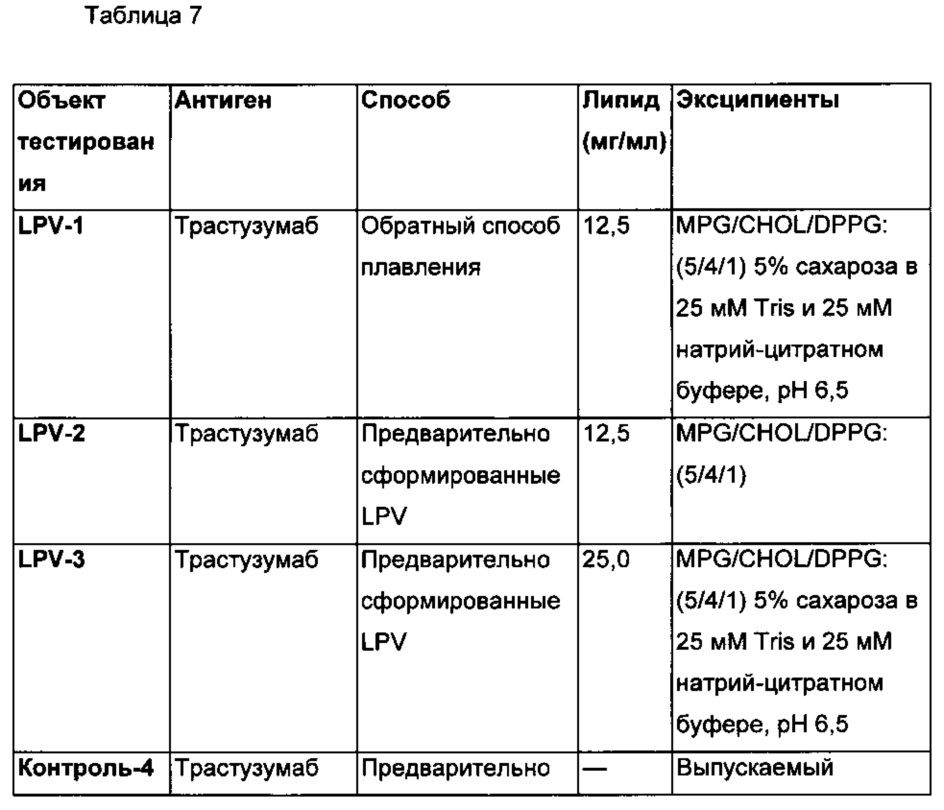

Пример 6: Сравнение термостабильности использованного в качестве примера лекарственного белка в везикулах на основе анионогенного ПАВ или смешанного с предварительно сформированными везикулами
000134 Степень чистоты и активность трастузумаба, приготовленного в NISV оценивали после 8 недель хранения при двух температурах (5°C±3°C и 37°C±2°C), используя метод эксклюзионной хроматографии (ЭХ), чтобы определить процент чистоты, а активность в тесте ВТ-474 антипролиферативной биологической активности. Утвержденным (аттестованным) тестом активности для трастузумаба является биотест ингибирования пролиферации ВТ-474. Указанный тест позволяет измерить связывающий аффинитет Fab. Принцип определения ингибирующих свойств трастузумаба в биотесте пролиферации заключается в том, что подходящую целевую клеточную линию, обычно клетки ВТ-474 приготовляют на клеточных планшетах, используя метод, направленный на оптимизацию экспрессии рецептора. Затем получают последовательные разведения трастузумаба, добавляют к планшету и оставляют связываться с клетками ВТ-474 на некоторое время. Результаты образца представляют в виде ингибирования клеточного роста в процентах или в виде относительной активности по сравнению со стандартом сравнения. Указанные результаты сравнивали с действием немодифицированного лекарственного белка, чтобы оценить преимущество модификации в отношении термостабильности.
000135 На Фиг. 3 представлены в процентах результаты ЭХ чистоты Объекта тестирования LPV-1 (трастузумаба, приготовленного с везикулами, содержащими DPPG) в сравнении с контрольным Объектом тестирования, не содержащим LPV (немодифицированный трастузумаб) для оценки эффекта в отношении термостабильности при хранении в течение 8 недель при 40°C в сравнении с 4°C. В противоположность Объекту тестирования, не содержащему LPV, разница в наблюдаемой степени чистоты (в процентах) отсутствовала в липидсодержащем Объекте тестирования (LPV-1) после хранения в течение 8 недель как при 4°C, так и при 40°C.
000136 На Фиг. 4 представлены в процентах результаты теста ВТ-474 антипролиферативной биологической активности Объекта тестирования LPV-1 (трастузумаба, приготовленного с везикулами, содержащими DPPG) в сравнении с контрольным Объектом тестирования, не содержащим LPV (немодифицированный трастузумаб) для оценки эффекта в отношении термостабильности при хранении в течение 8 недель при 40°C в сравнении с 4°C.Объект тестирования, не содержащий LPV продемонстрировал потерю активности (по данным УФ-спектрометрии) при хранении в течение 8 недель при 40°C в сравнении хранением в течение 8 недель при с 4°C. В противоположность Объекту тестирования, не содержащему LPV, разница в наблюдаемой степени чистоты (в процентах) отсутствовала в липидсодержащем Объекте тестирования (LPV-1) после хранения в течение 8 недель как при 4°C, так и при 40°C. Сравнимые результаты наблюдали как при приготовлении лекарственного белка трастузумаба в везикулах, содержащих DPPG, так и смешанного с предварительно сформированными везикулами на основе анионогенного ПАВ.
Другие варианты реализации настоящего изобретения
000137 Другие варианты реализации настоящего изобретения должны быть очевидны специалистам в данной области техники исходя из содержания настоящего описания или практических реализаций изобретения, раскрытых в тексте данного документа. Предполагается, что данное описание и примеры приведены только в иллюстративных целях, при этом действительный объем изобретения определен формулой изобретения. Содержание любого литературного источника, приведенного в тексте данного документа, включено в данный документ во всей полноте посредством ссылки.
Реферат
Изобретение относится к области фармакологии и раскрывает способ получения термостабильной лиофилизованной иммуногенной композиции. Способ включает получение предварительно сформированных везикул, содержащих липидный компонент, который содержит неионогенное ПАВ, представляющее собой 1-монопальмитоилглицерин (MPG), стероид, представляющий собой холестерин (CHO), и ионогенное амфифильное вещество, представляющее собой дифосфатидилглицерин (DPPG), комбинирование предварительно сформированных везикул с водным раствором, который содержит термолабильное лекарственное средство, с образованием смеси, гомогенизацию смеси с образованием гомогената и лиофилизацию гомогената. Термостабильная лиофилизированная композиция обладает повышенной стабильностью при температурах более 4°С по сравнению с лиофилизированной иммуногенной композицией, состоящей из термолабильного лекарственного средства. 6 з.п. ф-лы, 4 ил., 6 пр, 7 табл.

Комментарии