Липиды, подходящие для липосомной доставки кодирующей белок рнк - RU2577983C2
Код документа: RU2577983C2
Чертежи












Описание
В этой заявке заявлен приоритет к предварительной заявке на патент США № 61/378833, которая была подана 31 августа 2010 г., полное содержание которой включено сюда в качестве ссылки для всех целей.
Область техники
Данное изобретение относится к области не вирусной доставки РНК животным.
Уровень техники
Доставку нуклеиновых кислот для in vivo экспрессии кодированных белков используют для генотерапии и иммунизации. Были протестированы различные подходы к успешной доставке, включая применение ДНК или РНК, вирусных и не вирусных средств доставки (или даже при отсутствии средства доставки, в "голой" вакцине), или реплицирующие или не реплицирующие векторы, или вирусные или не вирусные векторы.
Все еще остается необходимость в дополнительных и улучшенных способах доставки нуклеиновых кислот животным для in vivo экспрессии их кодированных белков.
Описание изобретения
В соответствии с данным изобретением РНК доставляют инкапсулированной в липосому. РНК кодирует целевой полипептид. Липосома включает, по крайней мере, одно соединение, выбранное из группы, включающей соединения формулы (I) и формулы (XI). Эти липосомы могут эффективно доставлять РНК для in vivo экспрессии. Данное изобретение особенно полезно для иммунизации, при которой кодированным полипептидом является иммуноген.
Таким образом, в изобретении представлена липосома, в которую инкапсулирована РНК, кодирующая целевой полипептид, где липосома включает, по крайней мере, одно соединение, выбранное из группы, включающей соединения формулы (I) и формулы (XI).
Формула (I) представляет собой:
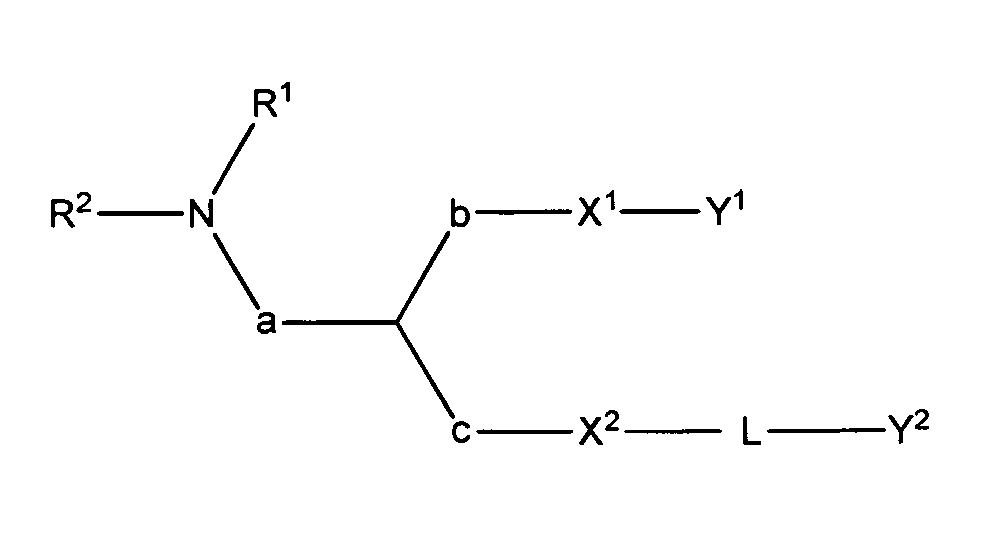
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a отсутствует или является необязательно замещенным C1-4алкиленом;
b отсутствует или является необязательно замещенным C1-4алкиленом;
c отсутствует или является необязательно замещенным C1-4алкиленом;
X1 является O или S;
X2 является O или S;
Y1 является необязательно замещенным C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом;
L отсутствует или является -(La)d-(Lb)e-(Lc)f-, где
La является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
Lb является необязательно замещенным C6-14ариленом или C5-13гетероариленом;
Lc является необязательно замещенным C1-15лкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
d равно 0 или 1;
e равно 0 или 1; и
f равно 0 или 1; и
Y2 является необязательно замещенным стероидом.
Формула (XI) представляет собой:
Ra-(AA)z-Rb,
где
Ra является N-концевым алкиламидом;
z является целым числом от 2 до 10;
каждый AA является аминокислотой, при условии, что присутствуют, по крайней мере, один гистидин и, по крайней мере, одна катионная аминокислота;
Rb является -H или -NH2.
В данном изобретении также представлен способ получения РНК-содержащей липосомы, включающий стадию смешивания РНК с соединением, выбранным из группы, включающей соединения формулы (I) и формулы (XI), в таких условиях, что соединения образуют липосому, в которую инкапсулирована РНК. РНК и соединение могут быть смешаны в присутствии других соединений, которые также становятся инкапсулированными в липосому, например, других липидов.
Липосома
В изобретении применяют липосомы, в которые инкапсулирована кодирующая полипептид РНК. Таким образом, РНК (как в природном вирусе) отделена от любой внешней среды. Было обнаружено, что инкапсулирование в липосому защищает РНК от переваривания рибонуклеазы. Липосомы могут включать некоторые внешние РНК {например, на их поверхности), но, по крайней мере, половина РНК (и, в идеале, все) инкапсулированы в оболочку липосомы. Инкапсулирование в липосомы отличается от, например, комплексов липид/РНК, описанных в ссылке 1, где РНК смешивают с предварительно полученными липосомами.
Различные амфифильные липиды могут образовывать двухслойные структуры в водной среде для инкапсулирования РНК-содержащей водной оболочки в виде липосомы. Эти липиды могут иметь анионную, катионную или цвиттерионную гидрофильные концевые группы. Получение липосом из анионных фосфолипидов ведет свое начало от 1960-х, и липиды, образующие катионные липосомы, изучают с 1990-х. Некоторые фосфолипиды являются анионными, в то время как другие являются цвиттерионными и другие являются катионными. Подходящие классы фосфолипида включают, но не ограничены ими, фосфатидилэтаноламины, фосфатидилхолины, фосфатидилсерины и фосфатидилглицерины, и некоторые полезные фосфолипиды перечислены таблице I. Полезные катионные липиды известного уровня техники включают, но не ограничены ими, диолеоил триметиламмонийпропан (DOTAP), 1,2-дистеарилокси-N,N-диметил-3-аминопропан (DSDMA), 1,2-диолеилокси-N,N-диметил-3-аминопропан (DODMA), 1,2-дилинолеилокси-N,N-диметил-3-аминопропан (DlinDMA), 1,2-дилиноленилокси-N,N-диметил-3-аминопропан (DLenDMA). Цвиттерионные липиды включают, но не ограничены ими, ацильные цвиттерионные липиды и простые эфирные цвиттерионные липиды. Примеры полезных цвиттерионных липидов включают DPPC, DOPC, ДСФХ, додецилфосфохолин, 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин (DOPE) и 1,2-дифитаноил-sn-глицеро-3-фосфоэтаноламин (DPyPE). Липиды в липосомах в соответствии с данным изобретением могут быть насыщенными или ненасыщенными. Применение, по крайней мере, одного ненасыщенного липида для получения липосом является предпочтительным. Если ненасыщенный липид имеет два хвоста, оба хвоста могут быть ненасыщенными, или он может иметь один насыщенный хвост и один ненасыщенный хвост. Липид может включать стероидную группу в одном хвосте, например, в виде RV05.
Липосомы в соответствии с данным изобретением могут быть получены из одного липида или, более часто, из смеси липидов. Смесь может содержать (i) смесь катионных липидов, (ii) смесь анионных липидов и катионных липидов, (iii) смесь цвиттерионных липидов и катионных липидов или (vii) смесь анионных липидов, катионных липидов и цвиттерионных липидов. Также смесь может содержать насыщенные и ненасыщенные липиды. Если применяют смесь липидов, не все составляющие липиды в смеси должны быть амфифильными, например, один или более амфифильных липидов могут быть смешаны с холестерином.
Липосомы в соответствии с данным изобретением включают, по крайней мере, одно соединение формулы (I) и/или, по крайней мере, одно соединение формулы (XI). Предпочтительные липосомы в соответствии с данным изобретением включают катионный липид формулы (I). Как показано в примерах, такие липосомы особенно полезны для in vivo доставки РНК для экспрессии белка. Другие предпочтительные липосомы в соответствии с данным изобретением включают липопептид формулы (XI).
Липосома может включать липосому формулы (I) и липопептид формулы (XI), но обычно включает только один из этих двух классов катионного соединения.
Если липосому в соответствии с данным изобретением получают из смеси липидов, предпочтительно, чтобы доля липидов, имеющих формулу (I) или (XI), должна составлять 20-80% от общего количества липидов, например, 30-70% или 40-60%. Например, полезные липосомы показаны ниже, в которых 40% или 60% от общего количества липидов являются липидами формулы (I). Остаток составляют, например, холестерин (например, 35-50% холестерина) и/или ДМГ (необязательно ПЭГилированный) и/или ДСФХ. Такие смеси используют ниже. Указанные процентные значения являются мольными процентами.
Липосома может включать амфифильный липид, гидрофильная часть которого ПЭГилирована (т.е. модифицирована ковалентным присоединением полиэтиленгликоля). Такая модификация может повысить стабильность и предотвратить не специфическую абсорбцию липосом. Например, липиды могут быть конъюгированы с ПЭГ с применением методов, таких как описаны в ссылках 2 и 3. Полезные ПЭГилированные липиды включают PEG-ДМГ и липиды из ссылки 8 формулы (XI). ПЭГ обеспечивает липосомам оболочку, которая может придавать благоприятные фармакокинетические характеристики. Могут применяться ПЭГ различной длины, например, 0,5-8 кДа.
Полезные смеси липидов для получения липосом в соответствии с данным изобретением включают: катионный липид формулы (I); холестерин; и ПЭГилированный липид, такой как ПЭГ-ДМГ, т.е. ПЭГ-конъюгированный 1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль)]. Эта смесь также может включать нейтральный цвиттерионный липид, такой как ДСФХ (1,2-диастеароил-sn-глицеро-3-фосфохолин) или DPyPE. Эти (и другие) смеси применяют в примерах ниже.
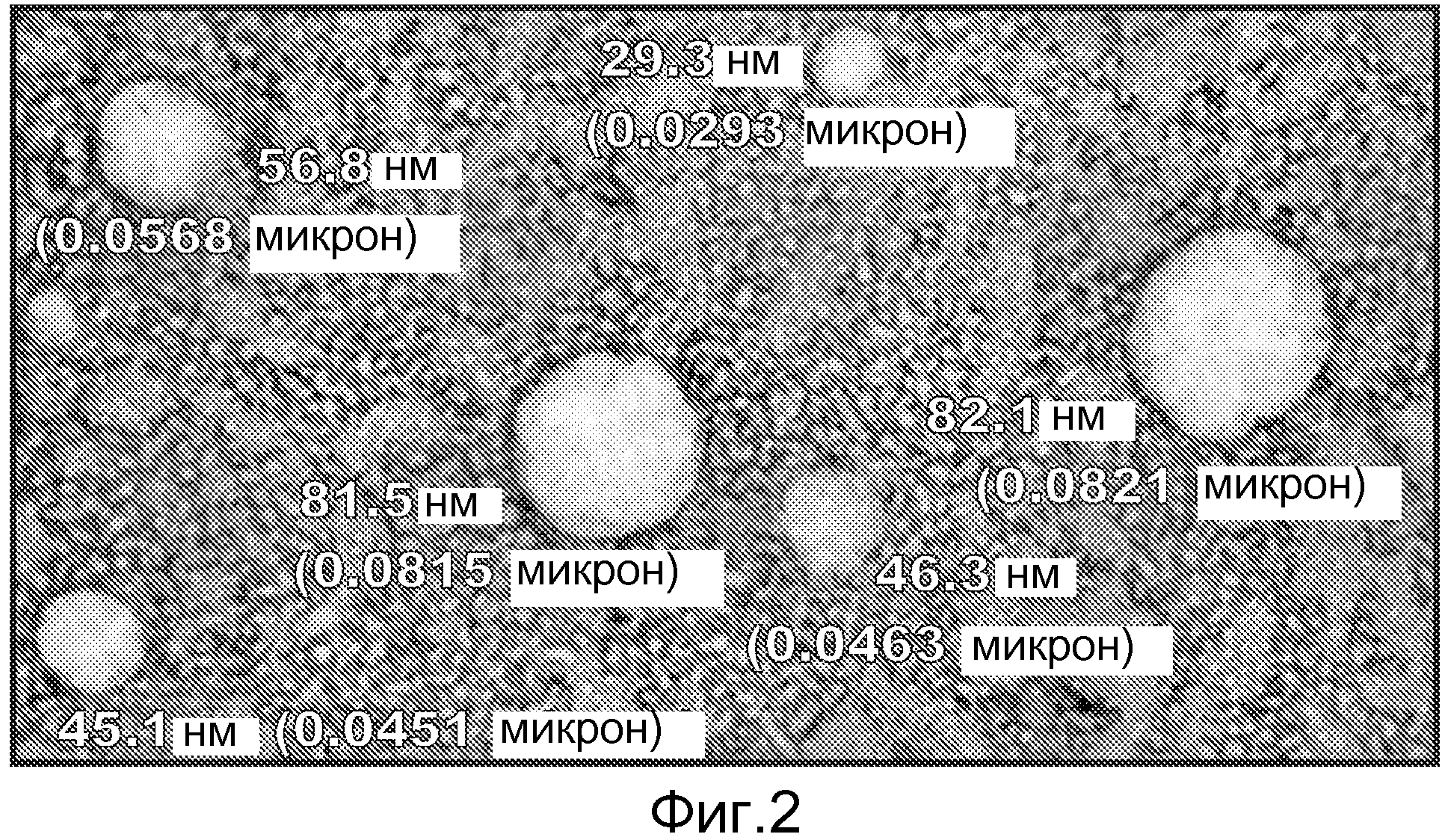
Липосомы обычно разделены на три группы: мультиламеллярные везикулы (MLV); малые моноламеллярные везикулы (SUV); и большие моноламеллярные везикулы (LUV). MLV имеют множество двухслойных структур в каждой везикуле, образуя несколько отдельных водных отделений. SUV и LUV имеют одну двухслойную структуру, инкапсулирующую водную оболочку; SUV обычно имеет диаметр <50 нм, и LUV имеют диаметр >50 нм. Липосомы в соответствии с данным изобретением являются идеальными LUV с диаметром в интервале 60-180 нм, и предпочтительно в интервале 80-160 нм.
Липосома в соответствии с данным изобретением может быть частью композиции, содержащей множество липосом, и липосомы во множестве могут иметь различные диаметры. Для композиции, включающей множество липосом с различными диаметрами: (i) по крайней мере, 80% от количества липосом должны иметь диаметры в интервале 60-180 нм, и предпочтительно в интервале 80-160 нм, и/или (ii) средний диаметр (по интенсивности, например, Z-средний) множества в идеале составляет 60-180 нм, и предпочтительно в интервале 80-160 нм. Диаметры во множестве в идеале должны иметь коэффициент полидисперсности <0,2. Комплексы липосома/РНК из ссылки 1 предположительно имеют диаметр в интервале 600-800 нм и имеют высокую полидисперсность. Диаметры во множестве могут быть измерены с применением динамического светорассеяния.
Методики получения подходящих липосом хорошо известны в данной области техники, например, см. ссылки 4-6. Одна из полезных методик описана в ссылке 7 и включает смешивание (i) этанольного раствора липидов, (ii) водного раствора нуклеиновой кислоты и (iii) буфера, с последующим смешиванием, уравновешиванием, разбавлением и очисткой. Предпочтительные липосомы в соответствии с данным изобретением получают таким методом смешивания.
Для получения липосом с желаемым диаметром(ами) смешивание проводят с применением способа, в котором два потока сырья водного раствора РНК объединяют в одной зоне смешивания с одним потоком этанольного раствора липидов, где все потоки имеют одинаковую скорость, например, в микрофлюидном канале, как описано ниже.
Формула (I)
Катионные липиды формулы (I) являются следующими:
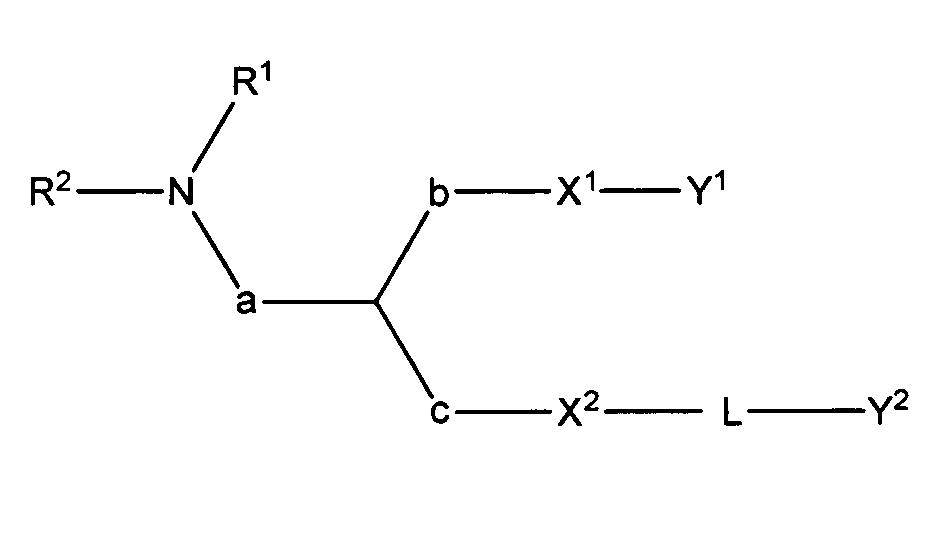
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a отсутствует или является необязательно замещенным C1-4алкиленом;
b отсутствует или является необязательно замещенным C1-4алкиленом;
c отсутствует или является необязательно замещенным C1-4алкиленом;
X1 является O или S;
X2 является O или S;
Y1 является необязательно замещенным C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом;
L отсутствует или является -(La)d-(Lb)e-(Lc)f-, где
La является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
Lb является необязательно замещенным C6-14ариленом или C5-13гетероариленом;
Lc является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
d равно 0 или 1;
e равно 0 или 1; и
f равно 0 или 1; и
Y2 является необязательно замещенным стероидом.
Таким образом, R1 и R2 вместе с атомом азота, к которому они присоединены, образуют циклическую "головную группу" с третичным амином. Эти соединения описаны более подробно в ссылке 8, полное описание которой включено сюда в качестве ссылки.
В некоторых вариантах соединения формулы (I) имеют формулу (II):
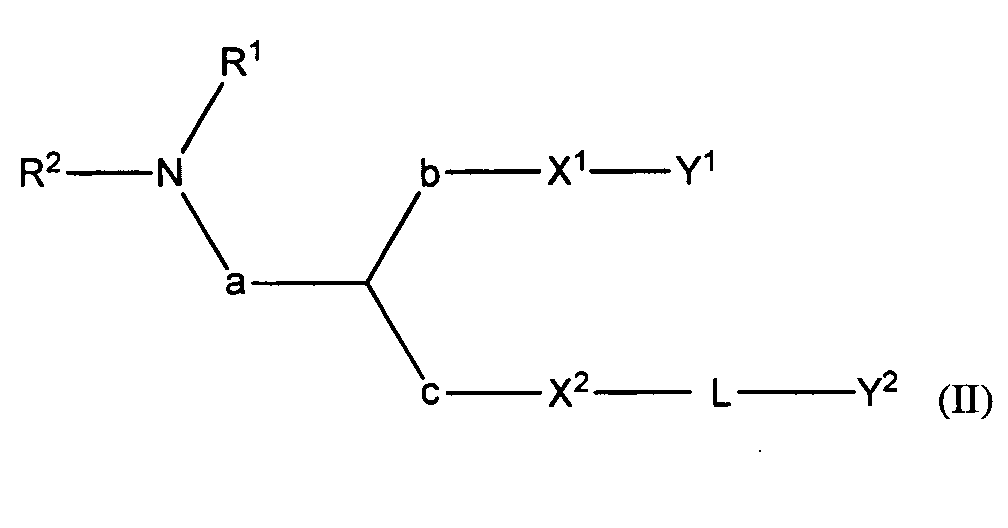
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a отсутствует или является необязательно замещенным C1-4алкиленом;
b отсутствует или является необязательно замещенным C1-4алкиленом;
c отсутствует или является необязательно замещенным C1-4алкиленом;
X1 является O или S;
X2 является O или S;
Y1 является необязательно замещенным C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом;
L является -(La)d-(Lb)e-(Lc)f-, где
La является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
Lb является необязательно замещенным C6-14ариленом или C5-13гетероариленом;
Lc является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
d равно 0 или 1;
e равно 0 или 1; и
f равно 0 или 1;
при условии, что L содержит один или более гетероатомов, и
Y2 является необязательно замещенным стероидом.
В некоторых вариантах соединения формулы (I) имеют формулу (III):
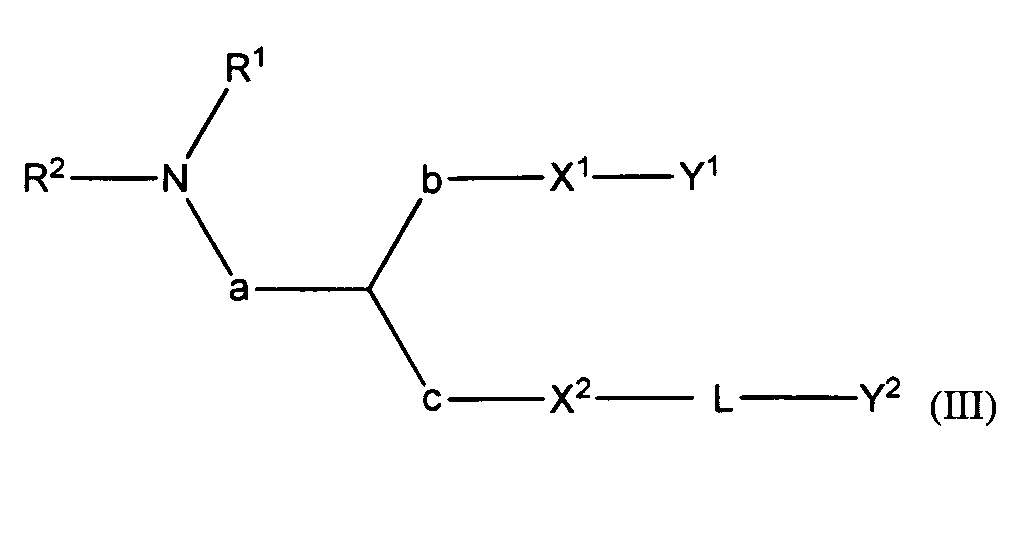
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a является метиленом;
b является метиленом;
c отсутствует;
X1 является O или S;
X2 является O или S;
Y1 является необязательно замещенным C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом;
L является -(La)d-(Lb)e-(Lc)f-, где
La является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
Lb является необязательно замещенным C6-14ариленом или C5-13гетероариленом;
Lc является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
d равно 0 или 1;
e равно 0 или 1; и
f равно 0 или 1; и
Y2 является необязательно замещенным стероидом.
В некоторых вариантах соединения формулы (I) имеют формулу (IV):
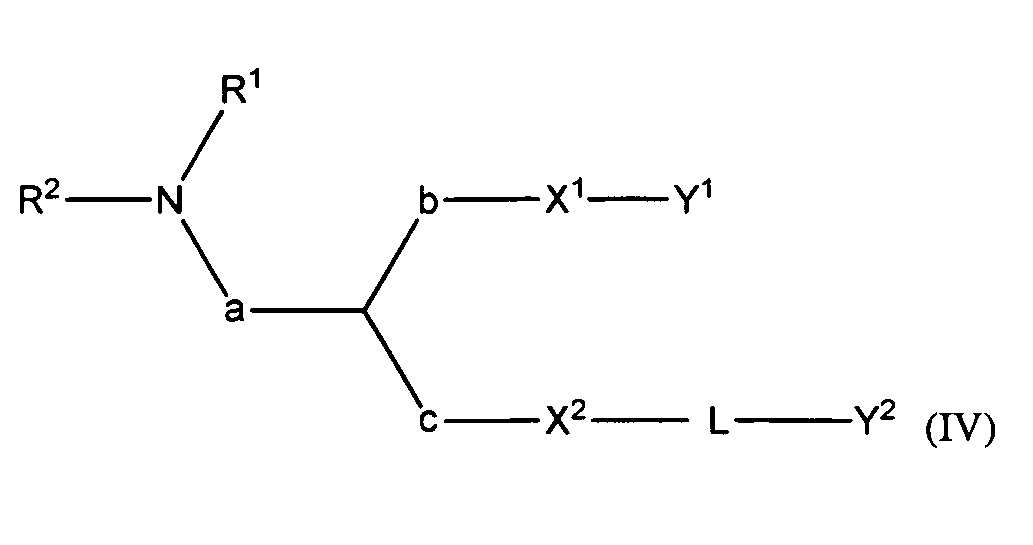
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a является метиленом;
b является метиленом;
c отсутствует;
X1 является O или S;
X2 является O или S;
Y1 является необязательно замещенным C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом;
L является -(La)d-(Lb)e-(Lc)f-, где
La является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
Lb является необязательно замещенным C6-14ариленом или C5-13гетероариленом;
Lc является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
d равно 0 или 1;
e равно 0 или 1; и
f равно 0 или 1;
при условии, что L содержит один или более гетероатомов, и
Y2 является необязательно замещенным стероидом.
В некоторых вариантах соединения формулы (I) имеют формулу (V):
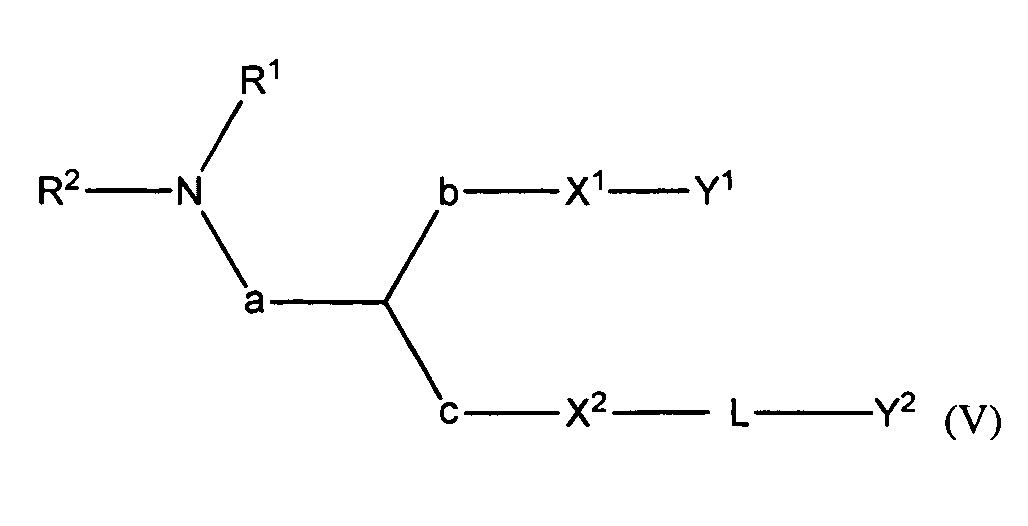
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a является метиленом;
b является метиленом;
c отсутствует;
X1 является O;
X2 является O;
Y1 является необязательно замещенным C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом;
L является -(La)d-(Lb)e-(Lc)f-, где
La является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
Lb является необязательно замещенным C6-14ариленом или C5-13гетероариленом;
Lc является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
d равно 0 или 1;
e равно 0 или 1; и
f равно 0 или 1;
при условии, что L содержит один или более гетероатомов, и
Y2 является необязательно замещенным стероидом.
В некоторых вариантах соединения формулы (I) имеют формулу (VI):
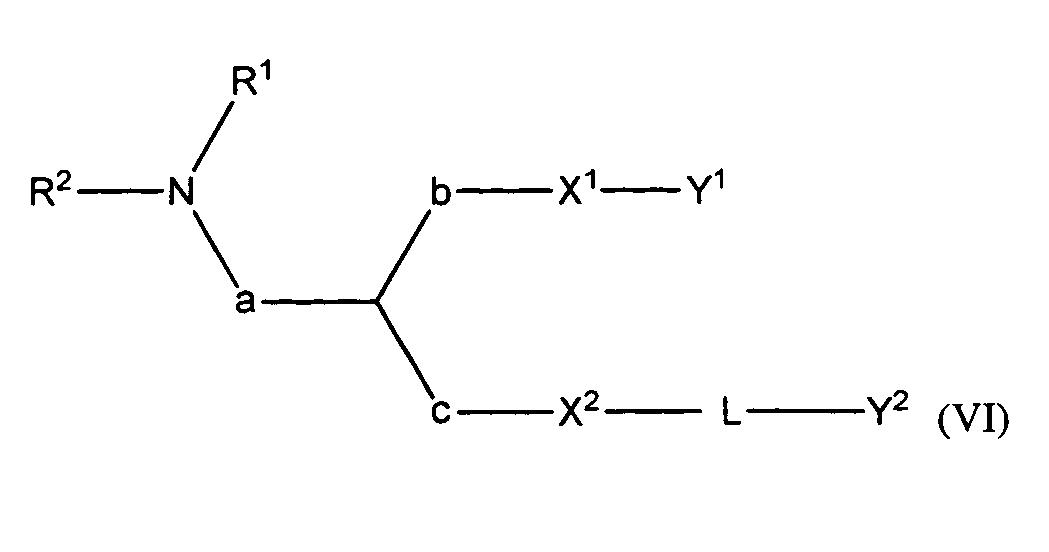
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a является метиленом;
b является метиленом;
c отсутствует;
X1 является O;
X2 является O;
Y1 является необязательно замещенным C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом;
L является -Lc-, где Lc является необязательно замещенным C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом; и
Y2 является необязательно замещенным стероидом.
В некоторых вариантах соединения формулы (I) имеет формулу (VII):
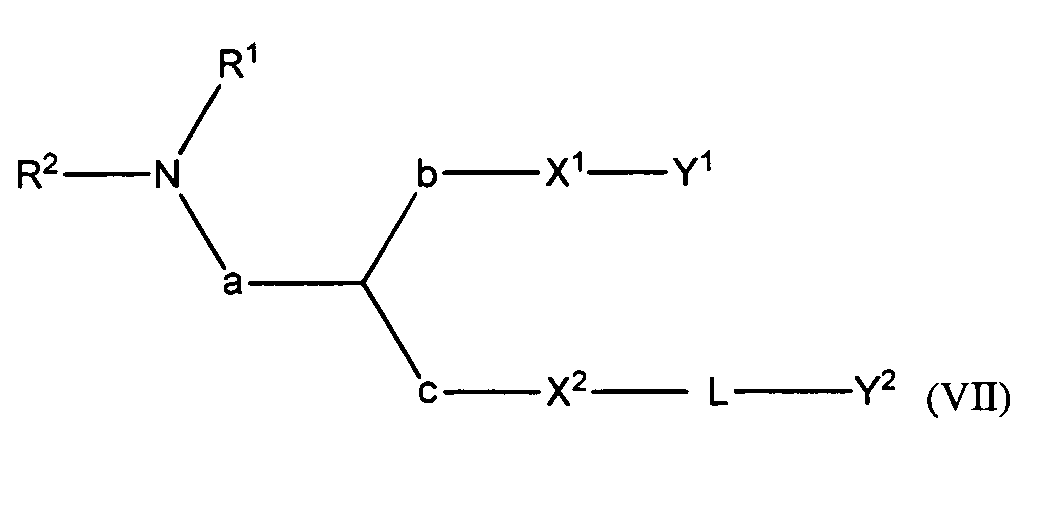
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a является метиленом;
b является метиленом;
c отсутствует;
X1 является O;
X2 является O;
Y1 является необязательно замещенной C16-22алкенильной группой;
L является -Lc-, где Lc является необязательно замещенным C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом; и
Y2 является необязательно замещенным стероидом.
В некоторых вариантах соединения формулы (I) имеют формулу (VIII):

где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a является метиленом;
b является метиленом;
c отсутствует;
X1 является O;
X2 является O;
Y1 является необязательно замещенной C16-22алкенильной группой;
L является -Lc-, где Lc является необязательно замещенным C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом; и
Y2 является холестерином, связанным через гидроксигруппу в положении 3 стероидного кольца А, где атом водорода в указанной гидроксигруппе отсутствует.
В некоторых вариантах соединения формулы (I) имеют формулу (IX):
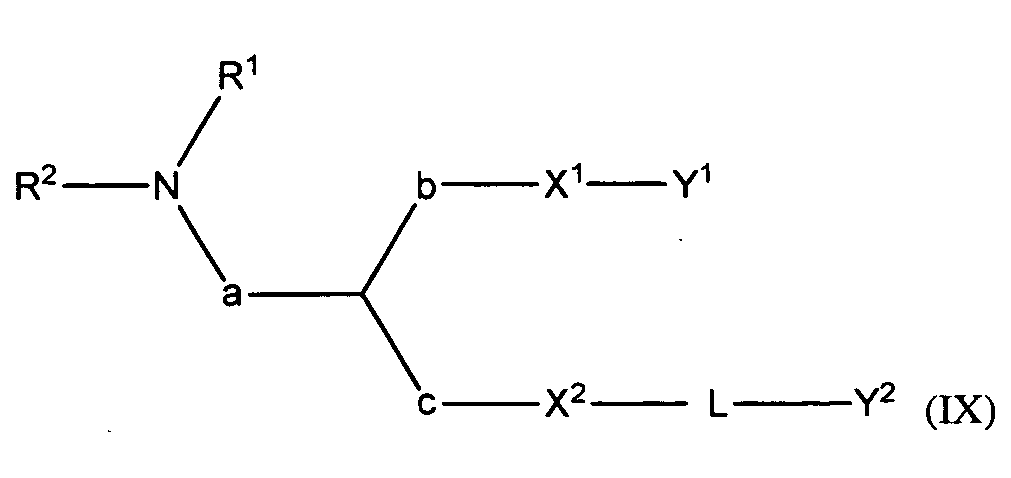
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a является метиленом;
b является метиленом;
c отсутствует;
X1 является O или S;
X2 является O или S;
Y1 является необязательно замещенным C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом;
L является -(La)d-(Lb)e-(Lc)f-, где
La является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
Lb является необязательно замещенным C6-14ариленом или C5-13гетероариленом;
Lc является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
d равно 0 или 1;
e равно 0 или 1; и
f равно 0 или 1;
при условии, что L содержит один или более гетероатомов,
Y2 является необязательно замещенным стероидом, и
pKa соединения составляет от около 5,9 до около 7.
В некоторых вариантах соединения формулы (I) имеют формулу (X):
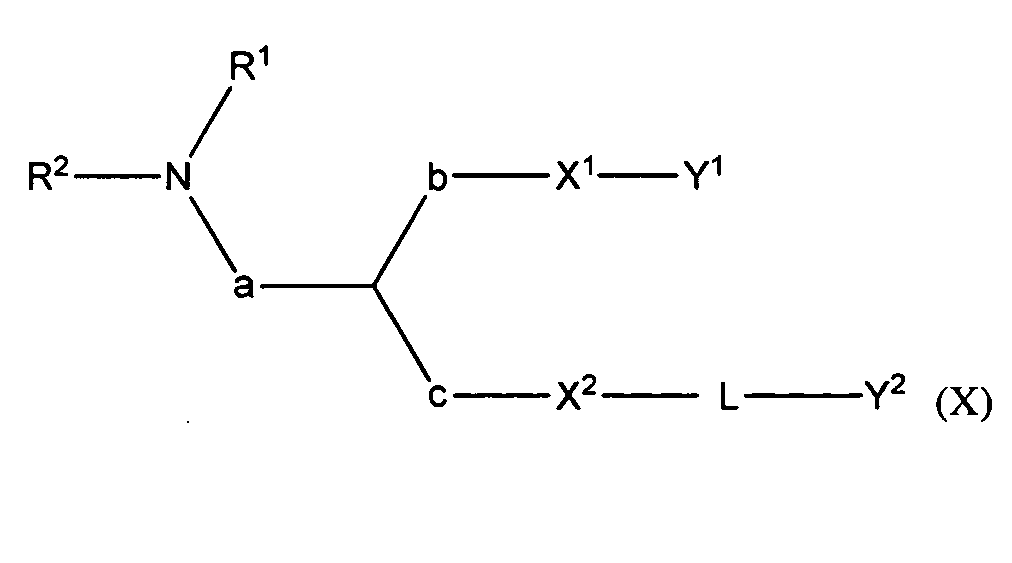
где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a является метиленом;
b является метиленом;
c отсутствует;
X1 является O или S;
X2 является O или S;
Y1 является необязательно замещенным C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом;
L является -(La)d-(Lb)e-(Lc)f-, где
La является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
Lb является необязательно замещенным C6-14ариленом или C5-13гетероариленом;
Lc является необязательно замещенным C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом;
d равно 0 или 1;
e равно 0 или 1; и
f равно 0 или 1;
при условии, что L содержит один или более гетероатомов,
Y2 является необязательно замещенным стероидом, и
pKa соединения составляет от около 4,5 до около 6,2.
a, b и c
В одном варианте a является необязательно замещенным C1-2алкиленом. В другом варианте a является необязательно замещенным C1-алкиленом.
В одном варианте b является необязательно замещенным C0-2 алкиленом. В другом варианте b является необязательно замещенным C1-алкиленом.
В одном варианте c отсутствует или является необязательно замещенным C1-алкиленом. В другом варианте c отсутствует.
В одном варианте a, b и c, если присутствуют, не замещены.
Головная группа
В одном варианте R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную группу, C5-гетероарильную или C6-гетероарильную группу. В одном варианте R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную или C3-20-гетероциклоалкинильную группу. В другом варианте R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную группу.
В одном варианте R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C5-16 группу. В другом варианте R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C5-12 группу. В другом варианте R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C5 группу, C6 группу или C7 группу. В другом варианте R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C5 группу или C6 группу.
В одном из предпочтительных вариантов данного изобретения, R1 и R2 вместе с атомом азота, к которому они присоединены, образуют соединения, которые включают, по крайней мере, один атом кислорода.
В одном варианте R1 и R2 вместе с атомом азота, к которому они присоединены, выбирают из H1-H48, представленных в таблице 1.



X1 и X2
В одном варианте X1 является O. В другом варианте X2 является O. В другом варианте оба X1 и X2 являются O.
Связующая группа
В предпочтительном варианте L содержит, по крайней мере, один гетероатом. Это означает, что группа, которая является прямой связью между X2 и Y2, содержит, по крайней мере, один гетероатом, или, другими словами, что любой гетероатом в a заместителе L не рассматривается для этих целей. В другом варианте L содержит, по крайней мере, один атом O.
В одном варианте L содержит, по крайней мере, два гетероатома. В другом варианте L содержит, по крайней мере, два атома O.
В одном варианте Lc является необязательно замещенным С1-15алкиленом или С1-15гетероалкиленом. В одном варианте Lc является необязательно замещенным С1-15алкиленом или С1-15гетероалкиленом и d и e оба равны 0.
В одном варианте Lc выбирают из одной из формул Lc-i-Lc-xxiii. В одном варианте Lc выбирают из одной из формул Lc-i-Lc-xxiii, и d и e оба равны 0.
Так как группы, в которых L содержит, по крайней мере, один гетероатом, являются предпочтительными, Lc предпочтительно выбирают из Lc-i, Lc-v-Lc-vii и Lc-ix-Lc-xxiii.
В одном варианте Lc является необязательно замещенным C1-15гетероалкиленом.
В одном варианте Lc является необязательно замещенной C1-11 группой. В другом варианте Lc является необязательно замещенной C1-9 группой. В другом варианте Lc является необязательно замещенной C3-8 группой. В другом варианте Lc является необязательно замещенной C4-7 группой. В другом варианте Lc является необязательно замещенной C5, C6 или C7 группой.
В предпочтительном варианте d равно 0; e равно 0; и f равно 1. В предпочтительном варианте d равно 0; e равно 0; и f равно 1; и Lc является, в пределах длины цепи, указанной выше, гетероалкиленом.
Y1
В одном варианте Y1 является C12-28 группой. В другом варианте Y1 является C14-26 группой. В другом варианте Y1 является C16-24 группой. В другом варианте Y1 является C16-22 группой. В другом варианте цепь Y1 имеет длину 18, 19, 20 или 21 атом.
В пределах количества углерода, указанного выше, Y1 предпочтительно является алкенилом или гетероалкенилом.
В одном варианте Y1 имеет, по крайней мере, одну алкеновую группу. В другом варианте Y1 имеет 1, 2 или 3 алкеновых группы.
В одном варианте Y1 имеет алкеновую группу в положении омега-3. В другом варианте Y1 имеет алкеновую группу в положении омега-6. В другом варианте Y1 имеет алкеновую группу в положении омега-9. В другом варианте Y1 имеет алкеновую группу в двух или трех из положений омега-3, омега-6 и омега-9. В одном варианте Y1 является ненасыщенным в положениях омега-6 и омега-9. В другом варианте Y1 является ненасыщенным в положениях омега-3, омега-6 и омега-9. В одном варианте Y1 является ненасыщенным в положении омега-9.
В одном варианте Y1 имеет, по крайней мере, одну цис-ненасыщенную алкеновую группу. В другом варианте Y1 имеет, по крайней мере, две цис-ненасыщенные алкеновые группы. В другом варианте Y1 имеет, по крайней мере, три цис-ненасыщенные алкеновые группы. По крайней мере, одна цис-ненасыщенная алкеновая группа может быть в одном, двух или трех положениях омега-3, омега-6 и омега-9. Ненасыщенность в липидных цепях обсуждается в MacLachlan et al., Journal of Controlled Release 107 (2005) 276-287.
В одном варианте Y1 выбирают из Y1-i-Y1-vi в таблице 2.

Y2
В одном варианте Y2 связан с L через атом кислорода на необязательно замещенном стероиде. В другом варианте Y2 связан с L через атом кислорода в положении 3 стероидного кольца A. В другом варианте Y2 является стерином, в котором атом водорода гидроксигруппы в положении 3 стероидного кольца A удален (и связь с L происходит через атом кислорода указанной гидроксигруппы).
В одном варианте указанный стерин выбирают из группы, включающей: аннастерин; авенастерин; бета-ситостерин; брассикастерин; кальциферол; кампестерин; чалиностерин; чинастерин; холестанол; холестерин; копростанин; циклоартенин; дегидрохолестерин; десмостерин; дигидрокальциферол; дигидрохолестерин; дигидроэргостерин; диностерин; эпихолестерин; эргостерин; фукостерин; гексагидролюмистерин; гексаол; гидроксихолестерин; ланостерин; люмистерин; паркеол; пориферастерин; сарингостерин; ситостанол; ситостерин; стигмастанол; стигмастерин; вейнберстерин; зимостерин; стериновые желчные кислоты (такие как холиновая кислота; ченодеоксихолиновая кислота; гликохолиновая кислота; таурохолиновая кислота; деоксихолиновая кислота и литохолиновая кислота); и их соли.
В другом варианте стерином является холестерин.
pKa
pKa липида является pH, при котором 50% жиров заряжены, который находится посередине между точкой, в которой липиды полностью заряжены, и точкой, в которой липиды полностью не заряжены. Он может быть измерен различными путями, но предпочтительно его измеряют с применением описанного ниже метода. pKa обычно должен быть измерен только для чистого липида, а не для липида в контексте смеси, которая также включает другие липиды (например, не такая, как указано в ссылке 2, который выглядит как pKa SNALP, а не отдельных липидов).
pKa липида измеряют в воде при стандартной температуре и давлении с применением следующей методики:
- 2 мМ раствор липида в этаноле получают взвешиванием липида и растворением в этаноле. 0,3 мМ раствор флуоресцентной пробы толуолнитросульфоновой кислоты (ТНС) в этанол:метанол 9:1 получают сначала получением 3 мМ раствора ТНС в метаноле с последующим разбавлением до 0,3 мМ этанолом.
- Получают водный буфер, содержащий фосфат натрия, цитрат натрия, ацетат натрия и хлорид натрия, в концентрациях 20 мМ, 25 мМ, 20 мМ и 150 мМ, соответственно. Буфер разделяют на восемь частей и pH доводят либо 12н HCl, либо 6н NaOH до 4,44-4,52, 5,27, 6,15-6,21, 6,57, 7,10-7,20, 7,72-7,80, 8,27-8,33 и 10,47-11,12. 400 мкл 2 мМ липидного раствора и 800 мкл 0,3 мМ раствора ТНС смешивают.
- 7,5 мкл смеси проба/липид добавляют к 242,5 мкл буфера в 1-мл 96-луночном планшете. Добавление проводят к каждому из восьми буферов. После смешивания 100 мкл каждой смеси проба/липид/буфер переносят в 250-мкл 96-луночный планшет, черный с прозрачным дном (например, модель COSTAR 3904, Corning).
- Флуоресценцию каждой смеси проба/липид/буфер измеряют (например, на спектрофотометре SpectraMax M5 с применением программы SoftMax pro 5.2) с возбуждением при 322 нм, испусканием при 431 нм (авто-предел при 420 нм).
- После измерения значение фоновой флуоресценции пустой лунки в 96-луночном планшете вычитают из каждой смеси проба/липид/буфер. Значения интенсивности флуоресценции затем нормализуют до значения при самом низком pH. Нормализованную интенсивность флуоресценции затем наносят на график к рН и проводят линию максимального соответствия.
- Находят точку на линии максимального соответствия, в которой нормализованная интенсивность флуоресценции равна 0,5. pH, соответствующий нормализованной интенсивности флуоресценции, равной 0,5, находят и считают pKa липида.
Наилучшие иммунологические результаты показаны для жиров, имеющих pKa в интервале от 5,0 до 7,6. В данном интервале pKa предпочтительные липиды имеют pKa от 5,5 до 6,7, например, от 5,6 до 6,8, от 5,6 до 6,3, от 5,6 до 6,0, от 5,5 до 6,2 или от 5,7 до 5,9.
Определенные соединения формулы (I)
Определенные соединения формулы (I), которые применяются в соответствии с данным изобретением, описаны в ссылке 8. Например, соединениями могут быть E0024, E0014, E0052, E0118, E0083, E0011, E0008, E0025, E0026, E0069, E0076, E0077, E0078, E0085 или E0088. Соединением могут быть липиды, показанные ниже, которые применяют в "RV03"-"RV12" липосомах, или в "RV15" липосомах. Предпочтительными соединениями являются E0026, E0069 и E0078. Предпочтительными соединениями являются липиды, показанные ниже, которые применяют в "RV05", "RV08" и "RV09" липосомах.
В альтернативном варианте, вместо применения соединения формулы (I), в липосоме в соответствии с данным изобретением применяется соединение "RV02" (структура показана ниже). За исключением этого замещения все другие аспекты таких RV02-содержащих липосом такие, как описаны здесь.
Формула (XI)
Соединения формулы (XI) являются катионными липопептидами, которые содержат N-концевой алкиламид и от 2 до 10 аминокислот. Формула (XI) представляет собой:
Ra-(AA)z-Rb,
где
Ra является N-концевым алкиламидом;
z является целым числом от 2 до 10;
каждый AA является аминокислотой, при условии, что присутствует, по крайней мере, один гистидин и, по крайней мере, одна катионная аминокислота;
Rb является -H, -OH или -NH2.
Группа Ra имеет формулу Rc-C(O)-NRd-, где Rc является C2-C24алкилом и Rd является -H или C1-C4алкилом. Подходящие Rc группы включают лаурил ('Lau'; C12) и пальмитоил ('Pal'; C16).
Амид из группы Ra присоединен к олигопептидной цепи из 2-10 аминокислот, например, из 3-8 аминокислот. Такая цепь включает, по крайней мере, один (например, 1, 2, 3, 4 или 5) гистидин. Она также включает, по крайней мере, одну катионную аминокислоту, например, по крайней мере, один аргининовый, лизиновый или орнитиновый остаток. Включение, по крайней мере, одного лизина является предпочтительным, в идеале, 2 или 3 лизинов. Гистидин включен благодаря тому, что его боковая цепь является слабощелочной и преимущественно не ионизирована при физиологическом pH, но является более высоко протонированной в слабокислой среде эндосомы. Катионная аминокислота, такая как лизин или аргинин, обеспечивает положительный заряд единицы на липопептиде при нейтральном pH. Полезные олигопептиды имеют последовательность аминокислоты -C-Ki-Hj-, где i равно 1, 2 или 3 и j равно 1, 2, 3, 4 или 5.
C-окончание олигопептидной цепи может быть оставлено как -COOH или, вместо этого, может образовывать амид.
Соединения формулы (XI) могут быть описаны терминами их алкильной цепи, их последовательности аминокислот и их C-концевой группы. Например, липопептид "Lau-(C-K-H-H)-NH2" имеет N-концевую лаурильную цепь, затем цистеин, затем лизин, затем два гистидина и C-концевой амин. Подходящие липопептиды формулы (XI), таким образом, включают, но не ограничены ими: Lau-(C-K-K-H)-NH2, Pal-(C-K-H-H)-NH2, Pal-(C-K-K-H-H)-NH2, Pal-(C-K-K-H-H-H)-NH2, Pal-(C-K-K-H-H-H-H)-NH2, Pal-(C-K-K-H-H-H-H-H)-NH2, Pal-(C-К-K-K-H-H)-NH2 и Pal-(C-К-K-К-H-H-H)-NH2. Эти и другие соединения описаны в ссылке 9 и включают:


РНК
Липосомы в соответствии с данным изобретением включают РНК молекулу, которая (в отличие от миРНК, как в ссылке 2) кодирует полипептид. После in vivo введения частиц РНК выделяется из частиц и транслируется вовнутрь клетки для получения полипептида in situ.
РНК является +-цепочечной, и поэтому она может быть транслирована клетками без необходимости проведения промежуточных стадий репликации, таких как обратная транскрипция. Она также может связываться с TLR7 рецепторами, экспрессируемыми иммунными клетками, тем самым инициируя вспомогательное действие, которое полезно для целей иммунизации.
Предпочтительные +-цепочечные РНК являются самореплицирующимися. Самореплицирующаяся молекула РНК (репликон) может, при доставке в клетку позвоночных даже без каких-либо белков, вызывать образование множественных дочерних РНК транскрипцией из самой себя (через антисмысловое копирование, которое она создает сама из себя). Самореплицирующаяся молекула РНК, таким образом, является обычно +-цепочечной молекулой, которая может быть напрямую транслирована после доставки в клетку, и такая трансляция дает РНК-зависимую РНК полимеразу, которая затем дает антисмысловые и смысловые транскрипты из доставленной РНК. Таким образом, доставленная РНК вызывает образование множественных дочерних РНК. Эти дочерние РНК, а также коллинеарные субгеномные транскрипты, могут быть транслированы сами с получением in situ экспрессии кодированного целевого полипептида, или могут быть считаны для получения других транскриптов с тем же смыслом, как доставленная РНК, которая транслируется для получения in situ экспрессии целевого полипептида. Общий результат этой последовательности транскрипций является значительная амплификация введенных репликонов РНК, и, следовательно, кодированный целевой полипептид становится основным продуктом клеток.
Одной из подходящих систем для достижения саморепликации является применение РНК репликона на основе альфавируса. Эти +-цепочечные репликоны транслируются после доставки в клетку для получения репликазы (или репликазы-транскриптазы). Репликаза транслируется в виде полипротеина, который саморасщепляется с получением комплекса репликации, который создает геномно-цепочечные копии +-цепочечной доставленной РНК. Эти -цепочечные транскрипты сами могут быть считаны с получением других копий +-цепочечной исходной РНК, а также с получением субгеномного транскрипта, который кодирует целевой полипептид. Трансляция субгеномного транскрипта приводит к in situ экспрессии полипептида инфицированными клетками. Подходящие альфавирусные репликоны могут применять репликазу из вируса Синдбис, вируса леса Симлики, вируса восточного лошадиного энцефалита, вируса венесуэльского лошадиного энцефалита и т.д. Могут применяться последовательности мутантов или вирусов дикого типа, например, ослабленный TC83 мутант VEEV применяли в репликонах [10].
Предпочтительные самореплицирующие РНК молекулы, таким образом, кодируют (i) РНК-зависимую РНК полимеразу, которая может считывать РНК из самореплицирующейся РНК молекулы, и (ii) целевой полипептид. Полимераза может быть репликазой альфавируса, например, содержать один или более белков альфавируса nsP1, nsP2, nsP3 и nsP4.
Хотя природные геномы альфавируса кодируют структурные белки вириона в дополнение к не структурному полипротеину репликазы, предпочтительно, чтобы самореплицирующаяся РНК молекула в соответствии с данным изобретением не кодировала структурные белки альфавируса. Таким образом, предпочтительная самореплицирующаяся РНК может вызывать образование геномных копий РНК самой себя в клетке, но не к образованию РНК-содержащих вирионов. Неспособность образовывать эти вирионы означает, что, в отличие от дикого альфавируса, самореплицирующаяся молекула РНК не может сама закрепляться в инфекционной форме. Структурные белки альфавируса, которые необходимы для закрепления в диких вирусах, отсутствуют в самореплицирующихся РНК в соответствии с данным изобретением, и их место занято геном(ами), кодирующим целевой полипептид, так, что субгеномный транскрипт кодирует этот полипептид вместо структурных белков вириона альфавируса.
Таким образом, самореплицирующаяся молекула РНК, применяемая в соответствии с данным изобретением, может иметь две открытых рамки считывания. Первая (5') открытая рамка считывания кодирует репликазу; вторая (3') открытая рамка считывания кодирует целевой полипептид. В некоторых вариантах РНК может иметь дополнительную (например, нисходящую) открытую рамку считывания, например, для кодирования других целевых полипептидов (см. ниже) или для кодирования вспомогательных полипептидов.
Самореплицирующаяся молекула РНК может иметь последовательность 5', которая совместима с кодированной репликазой.
Самореплицирующиеся молекулы РНК могут иметь различную длину, но они обычно имеют 5000-25000 нуклеотидов в длину, например, 8000-15000 нуклеотидов или 9000-12000 нуклеотидов. Таким образом, РНК длиннее, чем по причине миРНК доставки.
Молекула РНК, применяемая в соответствии с данным изобретением, может иметь 5'-кэп (например, 7-метилгуанозин). Этот кэп может улучшать in vivo трансляцию РНК.
5' нуклеотид молекулы РНК, применяемой в соответствии с данным изобретением, может иметь 5' трифосфатную группу. В кэпированной РНК она может быть связана с 7-метилгуанозином через 5'-до-5' мостик. 5' трифосфат может улучшать RIG-I связывание и, таким образом, оказывать вспомогательные действия.
Молекула РНК может иметь 3' поли-A хвост. Она также может включать последовательность, распознающую поли-A полимеразу (например, AAUAAA) рядом с ее 3'-концом.
Молекула РНК, применяемая в соответствии с данным изобретением, обычно является одноцепочечной. Одноцепочечные РНК могут обычно инициировать вспомогательное действие через связывание с TLR7, TLR8, РНК геликазы и/или PKR. РНК, доставляемая в двухцепочечной форме (дцРНК), может связываться с TLR3, и этот рецептор также может запускаться дцРНК, которая образуется либо во время репликации одноцепочечной РНК, либо во вторичной структуре одноцепочечной РНК.
Молекула РНК в соответствии с данным изобретением может быть получена in vitro транскрипцией (IVT). IVT может применять (кДНК) шаблон, созданный и распространяемый в плазмидной форме в бактерии, или созданный синтетически (например, генным синтезом и/или методами инжиниринга полимеразной цепной реакции (ПЦР)). Например, ДНК-зависимая РНК полимераза (такая как бактериофаг T7, T3 или SP6 РНК полимеразы) может применяться для транскрипции РНК из ДНК шаблона. Подходящие реакции кэпирования и добавления поли-A могут применяться при необходимости (хотя поли-A репликона обычно кодирована в пределах шаблона ДНК). Эти РНК полимеразы могут иметь жесткие требования к транскрибированному 5' нуклеотиду(ам), и в некоторых вариантах эти требования должны соответствовать требованиям кодированной репликазы, для того чтобы удостовериться, что IVT-транскрибированная РНК может функционировать эффективно в качестве субстрата для ее самокодированной репликазы.
Как описано в ссылке 11, самореплицирующаяся РНК может включать (в дополнение к любой 5' кэповой структуре) один или более нуклеотидов, имеющих модифицированное нуклеооснование. Таким образом, РНК может содержать m5C (5-метилцитидин), m5U (5-метилуридин), m6A (N6-метиладенозин), s2U (2-тиоуридин), Um (2'-O-метилуридин), m1A (1-метиладенозин); m2A (2-метиладенозин); Am (2'-O-метиладенозин); ms2m6A (2-метилтио-N6-метиладенозин); i6A (N6-изопентениладенозин); ms2i6A (2-метилтио-N6изопентениладенозин); io6A (N6-(цис-гидроксиизопентенил)аденозин); ms2io6A (2-метилтио-N6-(цис-гидроксиизопентенил)аденозин); g6A (N6-глицинилкарбамоиладенозин); t6A (N6-треонилкарбамоиладенозин); ms2t6A (2-метилтио-N6-треонилкарбамоиладенозин); m6t6A (N6-метил-N6-треонилкарбамоиладенозин); hn6A(N6.-гидроксинорвалилкарбамоиладенозин); ms2hn6A (2-метилтио-N6-гидроксинорвалилкарбамоиладенозин); Ar(p) (2'-O-рибозиладенозин(фосфат)); I (инозин); m11 (1-метилинозин); m'Im (1,2'-O-диметилинозин); m3C (3-метилцитидин); Cm (2T-O-метилцитидин); s2C (2-тиоцитидин); ac4C (N4-ацетилцитидин); f5C (5-фоннилцитидин); m5Cm (5,2-O-диметилцитидин); ac4Cm (N4ацетил2TOметилцитидин); k2C (лизидин); m1G (1-метилгуанозин); m2G (N2-метилгуанозин); m7G (7-метилгуанозин); Gm (2'-O-метилгуанозин); m22G (N2,N2-диметилгуанозин); m2Gm (N2,2'-O-диметилгуанозин); m22Gm (N2,N2,2'-O-триметилгуанозин); Gr(p) (2'-O-рибозилгуанозин(фосфат)); yW (вибутозин); o2yW (пероксивибутозин); OHyW (гидроксивибутозин); OHyW* (немодифицированный гидроксивибутозин); imG (виозин); mimG (метилгуанозин); Q (квеуозин); oQ (эпоксиквеуозин); galQ (галтактозил-квеуозин); manQ (маннозил-квеуозин); preQo (7-циано-7-деазагуанозин); preQi (7-аминометил-7-деазагуанозин); G* (архаэозин); D (дигидроуридин); m5Um (5,2'-O-диметилуридин); s4U (4-тиоуридин); m5s2U (5-метил-2-тиоуридин); s2Um (2-тио-2'-O-метилуридин); acp3U (3-(3-амино-3-карбоксипропил)уридин); ho5U (5-гидроксиуридин); mo5U (5-метоксиуридин); cmo5U (уридин 5-оксиуксусная кислота); mcmo5U (метиловый эфир уридин 5-оксиуксусной кислоты); chm5U (5-(карбоксигидроксиметил)уридин)); mchm5U (метиловый эфир 5-(карбоксигидроксиметил)уридин); mcm5U (5-метоксикарбонилметилуридин); mcm5Um (S-метоксикарбонилметил-2-O-метилуридин); mcm5s2U (5-метоксикарбонилметил-2-тиоуридин); nm5s2U (5-аминометил-2-тиоуридин); mnm5U (5-метиламинометилуридин); mnm5s2U (5-метиламинометил-2-тиоуридин); mnm5se2U (5-метиламинометил-2-селеноуридин); ncm5U (5-карбамоилметилуридин); ncm5Um (5-карбамоилметил-2'-O-метилуридин); cmnm5U (5-карбоксиметиламинометилуридин); cnmm5Um (5-карбоксиметиламинометил-2-L-O-метилуридин); cmnm5s2U (5-карбоксиметиламинометил-2-тиоуридин); m62A (N6,N6-диметиладенозин); Tm (2'-O-метилинозин); m4C (N4-метилцитидин); m4Cm (N4,2-O-диметилцитидин); hm5C (5-гидроксиметилцитидин); m3U (3-метилуридин); cm5U (5-карбоксиметилуридин); m6Am (N6,T-O-диметиладенозин); rn62Am (N6,N6,О-2-триметиладенозин); m2'7G (N2,7-диметилгуанозин); m2'2'7G (N2,N2,7-триметилгуанозин); m3Um (3,2T-O-диметилуридин); m5D (5-метилдигидроуридин); f5Cm (5-формил-2'-O-метилцитидин); m1Gm (1,2'-O-диметилгуанозин); m'Am (1,2-O-диметиладенозин)иринометилуридин); tm5s2U (S-тауринометил-2-тиоуридин)); imG-14 (4-деметилгуанозин); imG2 (изогуанозин); или ac6A (N6-ацетиладенозин), гипоксантин, инозин, 8-оксо-аденин, их 7-замещенные производные, дигидроурацил, псевдоурацил, 2-тиоурацил, 4-тиоурацил, 5-аминоурацил, 5-(Cl-C6)-алкилурацил, 5-метилурацил, 5-(C2-C6)-алкенилурацил, 5-(C2-C6)-алкинилурацил, 5-(гидроксиметил)урацил, 5-хлорурацил, 5-фторурацил, 5-бромурацил, 5-гидроксицитозин, 5-(C1-C6)-алкилцитозин, 5-метилцитозин, 5-(C2-C6)-алкенилцитозин, 5-(C2-C6)-алкинилцитозин, 5-хлорцитозин, 5-фторцитозин, 5-бромцитозин, N2-диметилгуанин, 7-деазагуанин, 8-азагуанин, 7-деаза-7-замещенный гуанин, 7-деаза-7-(C2-C6)алкинилгуанин, 7-деаза-8-замещенный гуанин, 8-гидроксигуанин, 6-тиогуанин, 8-оксогуанин, 2-аминопурин, 2-амино-6-хлорпурин, 2,4-диаминопурин, 2,6-диаминопурин, 8-азапурин, замещенный 7-деазапурин, 7-деаза-7-замещенный пурин, 7-деаза-8-замещенный пурин или абазический нуклеотид. Например, самореплицирующаяся РНК может включать одно или более модифицированных пиримидиновых нуклеооснований, таких как псевдоуридиновые и/или 5-метилцитозиновые остатки. В некоторых вариантах, однако, РНК не включает модифицированные нуклеооснования, и могут включать не модифицированные нуклеотиды, т.е. все нуклеотиды в РНК являются стандартными A, C, G и U рибонуклеотидами (за исключением любых 5' кэповых структур, которые могут включать 7'-метилгуанозин). В других вариантах РНК может включать 5' кэп, содержащий 7'-метилгуанозин, и первые 1, 2 или 3 5' рибонуклеотидов могут быть метилированы в положении 2' рибозы.
РНК, применяемая в соответствии с данным изобретением, в идеале включает только фосфодиэфирные связи между нуклеозидами, но в некоторых вариантах она может включать фосфорамидатные, фосфоротиоатные и/или метилфосфонатные связи.
В идеале липосомы включают менее 10 различных видов РНК, например, 5, 4, 3 или 2 разных вида; наиболее предпочтительно, липосома включает единственный вид РНК, т.е. все РНК молекулы в липосоме имеют одинаковую последовательность и одинаковую длину.
Количество РНК на липосому может варьироваться. Количество отдельных самореплицирующихся РНК молекул на липосому обычно составляет ≤50 например, <20, <10, <5 или 1-4 на липосому.
Целевой кодированный пептид
РНК молекулы, применяемые в соответствии с данным изобретением, кодируют целевой полипептид. После введения липосом РНК транслируется in vivo, и полученный белок может оказывать желаемое действие, например, он может вызывать иммунную реакцию у пациента, или он может обеспечивать целевую функцию, такую как ферментная активность.
РНК молекула может кодировать единственный целевой полипептид или множество полипептидов. Множество полипептидов может присутствовать в виде единого полипептида (слитый полипептид) или в виде отдельных полипептидов. Если полипептиды экспрессируются в виде отдельных полипептидов из репликона, тогда один или более из них могут иметь восходящий IRES или дополнительный вирусный промоторный элемент. Альтернативно, множество полипептидов может экспрессироваться из полибелка, который кодирует отдельный полипептид, слитый с короткой аутокаталитической протеазой (например, белок вируса ящера 2A), или в виде интеинов.
В отличие от ссылок 1 и 12, РНК кодирует полипептид с полезной in vivo функцией. Во избежание недопонимания, данное изобретение не охватывает РНК, которая кодирует люциферазу светляков, или которая кодирует слитый белок β-галактозидазы E.coli, или которая кодирует зеленый флуоресцентный белок (ЗФБ). Такие полипептиды могут быть полезны в качестве маркеров, но данное изобретение относится к доставке РНК для in vivo экспрессии полипептида, который может обеспечивать полезную терапевтическую или иммунологическую реакцию. Также РНК не является РНК полного мышиного тимуса.
Иммуногены
В некоторых вариантах РНК кодирует полипептидный иммуноген. После введения липосом РНК транслируется in vivo и иммуноген может вызывать иммунную реакцию у пациента. Иммуноген может вызывать иммунную реакцию против бактерии, вируса, гриба или паразита (или, в некоторых вариантах, против аллергена; и в других вариантах против опухолевого антигена). Иммунная реакция может включать реакцию антитела (обычно включая IgG) и/или медиированную клеткой иммунную реакцию. Полипептидный иммуноген обычно вызывает иммунную реакцию, которая распознает соответствующий полипептид бактерии, вируса, гриба или паразита (или аллергена или опухоли), но в некоторых вариантах полипептид может действовать как мимеотоп, вызывая иммунную реакцию, которая распознает сахарид бактерии, вируса, гриба или паразита. Иммуногеном обычно является поверхностный полипептид, например, адгезин, гемагглютинин, гликопротеин оболочки, гликопротеин шиповидных отростков и т.д.
В некоторых вариантах иммуноген вызывает иммунную реакцию против одной из этих бактерий:
Neisseria meningitidis: Полезные иммуногены включают, но не ограничены ими, мембранные белки, такие как адгезины, аутотранспортеры, токсины, белки восприимчивости к железу и белок, связывающий фактор Н. Сочетание трех полезных полипептидов описано в ссылке 13.
Streptococcus pneumoniae: Полезные полипептидные иммуногены описаны в ссылке 14. Они включают, но не ограничены ими, подъединицу RrgB пилуса, предшественник бета-N-ацетилгексозаминидазы (spr0057), spr0096, белок общего стресса GSP-781 (spr2021, SP2216), серин/треонин киназу StkP (SP1732) и адгезин поверхности пневмококка PsaA.
Streptococcus pyogenes: Полезные иммуногены включают, но не ограничены ими, полипептиды, описанные в ссылках 15 и 16.
Moraxella catarrhalis.
Bordetella pertussis: Полезные иммуногены коклюша включают, но не ограничены ими, токсин или токсоид коклюша (PT), филаментный гемагглютинин (FHA), пертактин и агглютиногены 2 и 3.
Staphylococcus aureus: Полезные иммуногены включают, но не ограничены ими, полипептиды, описанные в ссылке 17, такие как гемолизин, esxA, esxB, феррихром-связывающий белок (sta006) и/или sta011 липопротеин.
Clostridium tetani: Типовым иммуногеном является токсоид столбняка.
Cornynebacterium diphtheriae: Типовым иммуногеном является токсоид дифтерии.
Haemophilus influenzae: Полезные иммуногены включают, но не ограничены ими, полипептиды, описанные в ссылках 18 и 19.
Pseudomonas aeruginosa.
Streptococcus agalactiae: Полезные иммуногены включают, но не ограничены ими, полипептиды, описанные в ссылке 15.
Chlamydia trachomatis: Полезные иммуногены включают, но не ограничены ими, PepA, LcrE, ArtJ, DnaK, CT398, OmpH-подобные, L7/L12, OmcA, AtoS, CT547, Eno, HtrA и MurG (например, описанные в ссылке 20). LcrE [21] и HtrA [22] являются двумя предпочтительными иммуногенами.
Chlamydia pneumoniae: Полезные иммуногены включают, но не ограничены ими, полипептиды, описанные в ссылке 23.
Helicobacter pylori: Полезные иммуногены включают, но не ограничены ими, CagA, VacA, NAP и/или уреазу [24].
Escherichia coli: Полезные иммуногены включают, но не ограничены ими, иммуногены, полученные из энтеротоксигенной E. coli (ETEC), энтероаггрегатной E. coli (EAggEC), диффузно срощенной E. coli (DAEC), энтеропатогенной E. coli (EPEC), экстракишечной патогенной E. coli (ExPEC) и/или энтерогеморрагической E. coli (EHEC). ExPEC штаммы включают уропатогенную E. coli (UPEC) и связанную с менингитом/сепсисом E. coli (MNEC). Полезные UPEC полипептидные иммуногены описаны в ссылках 25 и 26. Полезные MNEC иммуногены описаны в ссылке 27. Полезным иммуногеном для нескольких типов E. coli является AcfD [28].
Bacillus anthracis
Yersinia pestis: Полезные иммуногены включают, но не ограничены ими, описанные в ссылках 29 и 30.
Staphylococcus epidermis
Clostridium perfringens или Clostridium botulinums
Legionella pneumophila
Coxiella burnetii
Brucella, такие как B. abortus, B. canis, B. melitensis, B. neotomae, B. ovis, B. suis, B. pinnipediae.
Francisella, такие как F. novicida, F philomiragia, F. tularensis.
Neisseria gonorrhoeae
Treponema pallidum
Haemophilus ducreyi
Enterococcus faecalis или Enterococcus faecium
Staphylococcus saprophyticus
Yersinia enterocolitica
Mycobacterium tuberculosis
Rickettsia
Listeria monocytogenes
Vibrio cholerae
Salmonella typhi
Borrelia burgdorferi
Porphyromonas gingivalis
Klebsiella
Некоторые варианты иммуногена вызывают иммунную реакцию против одного из этих вирусов:
Orthomyxovirus: Полезные иммуногены могут быть из вируса гриппа A, B или C, такие как белки гемагглютинина, нейраминидазы или матрицы M2. Если иммуногеном является гемагглютинин вируса гриппа A, он может быть получен из любого подтипа, например, H1, H2, H3, H4, H5, H6, H7, H8, H9, H10, H11, H12, H13, H14, H15 или H16.
Вирусы Paramyxoviridae: Вирусные иммуногены включают, но не ограничены ими, полученные из Пневмовирусов (например, респираторно-синцитиальный вирус, РСВ), Рубулавирусов (например, вирус эпидемического паротита), Парамиксовирусов (например, вирус парагриппа), Метапневмовирусов и Морбилливирусов (например, вирус кори).
Poxviridae: Вирусные иммуногены включают, но не ограничены ими, полученные из Orthopoxvirus, такого как Variola vera, включая, но не ограничиваясь ими, Variola major и Variola minor.
Picornavirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Пикорнавирусов, таких как Энтеровирусы, Риновирусы, Гепарнавирусы, Кардиовирусы и Афтовирусы. В одном варианте энтеровирусом является полиовирус, например, полиовирус 1 типа, 2 типа и/или 3 типа. В другом варианте энтеровирусом является EV71 энтеровирус. В другом варианте энтеровирусом является вирус коксаки A или B.
Bunyavirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Orthobunyavirus, такого как вирус калифорнийского энцефалита, Phlebovirus, такого как вирус лихорадки долины Рифт, или Nairovirus, такого как вирус крымской геморрагической лихорадки.
Heparnavirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Гепарнавируса, такого как вирус гепатита A (ВГА).
Filovirus: Вирусные иммуногены включают, но не ограничены ими, полученные из филовируса, такого как вирус Эбола (включая вирус Эбола из Заира, побережья Слоновой кости, Рестона или Судана) или вирус «марбургской болезни».
Togavirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Тогавируса, такого как Рубивирус, Альфавирус или Артеривирус. Они включают вирус краснухи.
Flavivirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Флавивируса, такого как вирус клещевого энцефалита (ВКЭ), вирус денге (типа 1, 2, 3 или 4), вирус желтой лихорадки, вирус японского энцефалита, вирус киасанурской лесной болезни, вирус энцефалита Западного Нила, вирус энцефалита Сент-Луиса, вирус русского весеннее-летнего энцефалита, вирус энцефалита Повассан.
Pestivirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Пестивируса, такого как вирус диареи крупного рогатого скота (ВДКРС), вирус классической чумы свиней (ВКЧС) или вирус пограничной болезни овец (ВПБО).
Hepadnavirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Гепаднавируса, такого как вирус гепатита В. Композиция может включать антиген поверхности вируса гепатита В (HBsAg).
Другие вирусы гепатита: Композиция может включать иммуноген из вируса гепатита С, вируса дельта-гепатита, вируса гепатита Е или вируса гепатита G.
Rhabdovirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Рабдовируса, такого как Лиссавирус (например, вирус бешенства) и Везикулавирус (VSV).
Caliciviridae: Вирусные иммуногены включают, но не ограничены ими, полученные из Calciviridae, такого как Norwalk (Norovirus) и Norwalk-подобные вирусы, такие как гавайский вирус и вирус Снежных гор.
Coronavirus: Вирусные иммуногены включают, но не ограничены ими, полученные из SARS коронавируса, инфекционного бронхита птиц (ИБП), вируса мышиного гепатита (ВМГ) и вируса трансмиссивного гастроэнтерита свиней (ВТГС). Иммуногеном коронавируса может быть зубчатый полипептид.
Retrovirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Онковируса, Лентивируса (например, ВИЧ-1 или ВИЧ-2) или Спумавируса.
Reovirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Ортореовируса, Ротавируса, Орбивируса или Колтивируса.
Parvovirus: Вирусные иммуногены включают, но не ограничены ими, полученные из Парвовируса B19.
Herpesvirus: Вирусные иммуногены включают, но не ограничены ими, полученные из вируса герпеса человека, такого как, например, вирус простого герпеса (ВПГ) (например, ВПГ типа 1 и 2), вирус ветряной оспы (ВВО), вирус Эпштейна-Барр (ВЭБ), цитомегаловирус (ЦМВ), вирус герпеса человека 6 (ВГЧ6), вирус герпеса человека 7 (ВГЧ7) и вирус герпеса человека 8 (ВГЧ8).
Papovaviruses: Вирусные иммуногены включают, но не ограничены ими, полученные из Папилломавирусов и Полиомавирусов. Папилломавирус (человека) может иметь серотип 1, 2, 4, 5, 6, 8, 11, 13, 16, 18, 31, 33, 35, 39, 41, 42, 47, 51, 57, 58, 63 или 65, например, от одного до более серотипов 6, 11, 16 и/или 18.
Adenovirus: Вирусные иммуногены включают полученные из аденовируса серотипа 36 (Ad-36).
В некоторых вариантах иммуноген вызывает иммунную реакцию против вируса, который инфицирует рыбу, такого как: вирус инфекционной анемии лосося (ВИАЛ), вирус инфекционного некроза поджелудочной железы (ВИНПЖ), вирус американского проточного сома (ВАПС), вирус лимфоцитоза рыбы (ВЛР), вирус инфекционного некроза гемопоэтической ткани лососевых (ВИНГТЛ), вирус герпеса карпов кои, пикорнаподобный вирус лососевых (также известный как пикорнаподобный вирус атлантического лосося), вирус пресноводного лосося (ВПЛ), ротавирус атлантического лосося (РАЛ), вирус земляничной болезни форели (ЗБФ), вирус опухоли горбуши (ФОГ) или вирус пастереллеза (ВП).
Иммуногены грибов могут быть получены из Dermatophytres, включая: Epidermophyton floccusum, Microsporum audouini, Microsporum canis, Microsporum distortum, Microsporum equinum, Microsporum gypsum, Microsporum nanum, Trichophyton concentricum, Trichophyton equinum, Trichophyton gallinae, Trichophyton gypseum, Trichophyton megnini, Trichophyton mentagrophytes, Trichophyton quinckeanum, Trichophyton rubrum, Trichophyton schoenleini, Trichophyton tonsurans, Trichophyton verrucosum, T. verrucosum var. album, var. discoides, var. ochraceum, Trichophyton violaceum и/или Trichophyton faviforme; или из Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus sydowi, Aspergillus flavatus, Aspergillus glaucus, Blastoschizomyces capitatus, Candida albicans, Candida enolase, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis, Candida stellatoidea, Candida kusei, Candida parakwsei, Candida lusitaniae, Candida pseudotropicalis, Candida guilliermondi, Cladosporium carrionii, Coccidioides immitis, Blastomyces dermatidis, Cryptococcus neoformans, Geotrichum clavatum, Histoplasma capsulatum, Klebsiella pneumoniae, Microsporidia, Encephalitozoon spp., Septata intestinalis и Enterocytozoon bieneusi; менее часто встречаются Brachiola spp, Microsporidium spp., Nosema spp., Pleistophora spp., Trachipleistophora spp., Vittaforma spp., Paracoccidioides brasiliensis, Pneumocystis carinii, Pythiumn insidiosum, Pityrosporum ovale, Sacharomyces cerevisae, Saccharomyces boulardii, Saccharomyces pombe, Scedosporium apiosperum, Sporothrix schenckii, Trichosporon beigelii, Toxoplasma gondii, Penicillium marneffei, Malassezia spp., Fonsecaea spp., Wangiella spp., Sporothrix spp., Basidiobolus spp., Conidiobolus spp., Rhizopus spp., Mucor spp., Absidia spp., Mortierella spp., Cunninghamella spp., Saksenaea spp., Alternaria spp., Curvularia spp., Helminthosporium spp., Fusarium spp., Aspergillus spp., Penicillium spp., Monolinia spp., Rhizoctonia spp., Paecilomyces spp., Pithomyces spp. и Cladosporium spp.
В некоторых вариантах иммуноген вызывает иммунную реакцию против паразитов рода Plasmodium, таких как P. falciparum, P. vivax, P. malariae или P. ovale. Таким образом, изобретение может применяться для иммунизации против малярии. В некоторых вариантах иммуноген вызывает иммунную реакцию против паразита из семейства Caligidae, особенно из родов Lepeophtheirus и Caligus, например, морских вшей, таких как Lepeophtheirus salmonis или Caligus rogercresseyi.
В некоторых вариантах иммуноген вызывает именную реакцию против аллергенов пыльцы (аллергенов пыльцы деревьев, трав, злаков и травы); аллергенов насекомых или пауков (аллергенов ингалянтов, слюны и яда, например, аллергенов клещей, аллергенов тараканов и мокрецов, аллергенов яда перепончатокрылых); аллергенов волос и перхоти животных (например, собак, кошек, лошадей, крыс, мышей и т.д.); и пищевых аллергенов (например, белок клейковины). Важные аллергены пыльцы от деревьев и трав включают такие, которые происходят из классификационных родов Fagales, Oleales, Pinales и platanaceae, включая, но не ограничиваясь ими, березу (Betula), ольху (Alnus), орешник (Corylus), граб (Carpinus) и оливу (Olea), кедр (Cryptomeria и Juniperus), платан (Platanus), рода Poales, включая травы родов Lolium, Phleum, Poa, Cynodon, Dactylis, Holcus, Phalaris, Secale и Sorghum, родов Asterales и Urticales, включая травы родов Ambrosia, Artemisia и Parietaria. Другие важные дыхательные аллергены включают аллергены от домашних пылевых клещей рода Dermatophagoides и Euroglyphus, амбарных клещей, например, Lepidoglyphys, Glycyphagus и Tyrophagus, аллергены от тараканов, мокрецов и мух, например, Blatella, Periplaneta, Chironomus и Ctenocepphalides, и аллергены от млекопитающих, таких как кошки, собаки и лошади, аллергены от ядов, включая яды от жала или укусов насекомых, таких, которые принадлежат к классификационному роду Hymenoptera, включая пчел (Apidae), ос (Vespidea) и муравьев (Formicoidae).
В некоторых вариантах иммуногеном является опухолевый антиген, выбранный из: (a) антигенов рака яичников, таких как NY-ESO-1, SSX2, SCP1, а также полипептидов семейств RAGE, BAGE, GAGE и MAGE, например, GAGE-1, GAGE-2, MAGE-1, MAGE-2, MAGE-3, MAGE-4, MAGE-5, MAGE-6 и MAGE-12 (которые могут применяться, например, в направлении меланомы, опухолей легких, головы и шеи, NSCLC, молочной железы, желудка и кишечника, и мочевого пузыря; (b) мутированных антигенов, например, p53 (связанные с различными твердыми опухолями, например, раком прямой и ободочной кишки, легких, головы и шеи), p21/Ras (связанные с, например, меланомой, раком поджелудочной железы и раком прямой и ободочной кишки), CDK4 (связанные с, например, меланомой), MUM1 (связанные с, например, меланомой), каспаза-8 (связанные с, например, раком головы и шеи), CIA 0205 (связанные с, например, раком мочевого пузыря), HLA-A2-R1701, бета катенин (связанные с, например, меланомой), TCR (связанные с, например, неходжкинской лимфомой Т-клеток), BCR-abl (связанные с, например, хронической миелогенной лейкемией), изомераза триосефосфата, KIA 0205, CDC-27 и LDLR-FUT; (c) чрезмерно экспрессирующихся антигенов, например, Galectin 4 (связанные с, например, раком прямой и ободочной кишки), Galectin 9 (связанные с, например, болезнью Ходжкина), протеиназа 3 (связанные с, например, хронической миелогенной лейкемией), WT 1 (связанные с, например, различными видами лейкемии), карбоангидраза (связанные с, например, раком почек), альдолаза A (связанные с, например, раком легких), PRAME (связанные с, например, меланомой), HER-2/neu (связанные с, например, раком молочной железы, прямой кишки, легких и яичников), маммаглобин, альфа-фетопротеин (связанные с, например, гепатомой), KSA (связанные с, например, раком прямой и ободочной кишки), гастрин (связанные с, например, раком поджелудочной железы и желудка), каталитический белок теломеразы, MUC-1 (связанные с, например, раком молочной железы и яичников), G-250 (связанные с, например, карциномой клеток почек), p53 (связанные с, например, раком молочной железы, прямой кишки) и карциноэмбрионный антиген (связанные с, например, раком молочной железы, раком легких и раком желудочно-кишечного тракта, такого как рак прямой и ободочной кишки); (d) разделенных антигенов, например, дифференциационные антигены меланомы-меланоцита, такие как MART-1/Melan A, gp100, MC1R, рецептор меланоцит-стимулирущего гормона, тирозиназа, родственный тирозиназе белок-1/TRP1 и родственный тирозиназе белок-2/TRP2 (связанные с, например, меланомой); (e) антигенов, связанных с простатой, такие как PAP, PSA, PSMA, PSH-P1, PSM-P1, PSM-P2, связанные с, например, раком простаты; (f) идиотипов иммуноглобулинов (связанные с миеломой и лимфомами B клеток, например). В определенных вариантах опухолевые иммуногены включают, но не ограничены ими, p15, Hom/Mel-40, H-Ras, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR, антигены вируса Эпштейна-Барр, EBNA, антигены папилломавируса человека (ПВЧ), включая E6 и E7, антигены вируса гепатита B и C, антигены лимфотропного вируса Т-клеток, TSP-180, p185erbB2, p180erbB-3, c-met, mn-23H1, TAG-72-4, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, p16, TAGE, PSCA, CT7, 43-9F, 5T4, 791 Tgp72, бета-HCG, BCA225, BTAA, CA 125, CA 15-3 (CA 27.29\BCAA), CA 195, CA 242, CA-50, CAM43, CD68\KP1, CO-029, FGF-5, Ga733 (EpCAM), HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS1, SDCCAG16, TA-90 (Mac-2 связывающий белок/циклофилин C-связанный белок), TAAL6, TAG72, TLP, TPS и подобные.
Генная терапия
В некоторых вариантах РНК кодирует полипептид, который применяют в контексте генной терапии. Такой кодированный белок получают в дополнение к любым полипептидам, которые кодированы на способность РНК к саморепликации. Таким образом, РНК может кодировать фермент (например, фермент, который не связан с РНК), цитокин, трансмембранный рецептор, ионный канал, гормон, белок крови или антитело. РНК предпочтительно кодирует человеческий полипептид в этих категориях.
Целевые ферменты включают, но не ограничены ими, ДНК полимеразу альфа, ДНК полимеразу дельта.
Целевые цитокины включают, но не ограничены ими, интерлейкин 1; интерлейкин 2; интерлейкин 4; интерлейкин 6; интерлейкин 7; интерлейкин 12; интерлейкин 17; GM-CSF; G-CSF; TNF-альфа; интерферон альфа; интерферон бета; интерферон гамма; и секретонейрин.
Целевые рецепторы включают, но не ограничены ими, рецептор лептина; рецептор липопротеина низкой плотности; рецептор морфогенного белка костей 2 типа; рецептор ФНО; рецептор гормона, выделяющего гонадотропин; рецептор допамина; рецептор соматостатина; рецептор витамина D; рецептор активатора плазминогена урокиназы; рецептор трансферрина; и т.д.
Целевые ионные каналы включают, но не ограничены ими, HCN2; HCN4; CFTR; -подъединицу канала Maxi-K; KCNQ2; KCNQ3; и Kv1.5.
Целевые гормоны включают, но не ограничены ими, хорионический гонадотропин; кортикотропин; эритропоэтин; глюкагоны; IGF-1; окситоцин; фактор роста тромбоцитов; кальцитонин; фолликулостимулирующий гормон; лютеинизирующий гормон; тиреотропный гормон; инсулин; гонадотропин-высвобождающий гормон; вазопрессин; соматостатин; пролактин; адренокортикотропический гормон; антидиуретический гормон; тиротропин-высвобождающий гормон; октреотид; гормон роста человека; релаксин; гормон, высвобождающий гормон роста; паратироидный гормон; кальцитрол; кальциферол; предсердный натрийуретический пептид; секретин; холецистокинин; лептин; нейропептид Y; грелин; ангиотензиноген; допамин; и тромбопоэтин. Если гормон требует множества полипептидных единиц для активности, РНК может кодировать одну или более из таких подъединиц, например, РНК может кодировать альфа подъединицу и/или бета подъединицу фолликулостимулирующего гормона.
Целевые белки крови включают, но не ограничены ими, гемоглобин; фибриноген; фактор VII; фактор VIIa; фактор VIII; фактор IX; фибриноген; тромбин; фактор фон Виллебранда.
Фармацевтические композиции
Липосомы в соответствии с данным изобретением применяют в качестве компонентов в фармацевтических композициях для иммунизации пациентов от различных болезней. Эти композиции обычно включают фармацевтически приемлемый носитель в дополнение к липосомам. Подробная дискуссия фармацевтически приемлемых носителей доступна в ссылке 31.
Фармацевтические композиции в соответствии с данным изобретением могут включать одну или более маленьких молекул иммунопотенциаторов. Например, композиция может включать агонист TLR2 (например, Pam3CSK4), агонист TLR4 (например, аминоалкил глюкозаминид фосфат, такой как E6020), агонист TLR7 (например, имиквимод), агонист TLR8 (например, резиквимод) и/или агонист TLR9 (например, IC31). Любой такой агонист в идеале имеет молекулярную массу <2000 Да. В некоторых вариантах такой агонист(ы) также инкапсулирован с РНК внутри липосом, но в других вариантах они не инкапсулированы.
Фармацевтические композиции в соответствии с данным изобретением могут включать липосомы в простой воде (например, в.д.и.) или в буфере, например, фосфатном буфере, Tris буфере, боратном буфере, сукцинатном буфере, гистидиновом буфере или цитратном буфере. Буферные соли обычно включены в количестве 5-20 мМ.
Фармацевтические композиции в соответствии с данным изобретением могут иметь pH от 5,0 до 9,5, например, от 6,0 и 8,0.
Композиции в соответствии с данным изобретением могут включать натриевые соли (например, хлорид натрия) с получением тоничности. Концентрация 10±2 мг/мл NaCl является типовой, например, около 9 мг/мл.
Композиции в соответствии с данным изобретением могут включать хелаторы иона металлов. Они могут пролонгировать стабильность РНК через удаление ионов, которые могут усиливать гидролиз фосфодиэфира. Таким образом, композиция может включать один или более из ЭДТК, ЭГТК, BAPTA, http://www.multitran.ru/c/m.exe?t=3729587_2_1 и т.д. Такие хелаторы обычно присутствуют в количестве от 10-500 мкМ, например, 0,1 мМ. Цитрат, такой как цитрат натрия, также может действовать как хелатор, одновременно также обеспечивая буферное действие.
Фармацевтические композиции в соответствии с данным изобретением могут иметь осмолярность от 200 мОсм/кг до 400 мОсм/кг, например, 240-360 мОсм/кг или 290-310 мОсм/кг.
Фармацевтические композиции в соответствии с данным изобретением могут включать один или более консервантов, таких как тиомерсал или 2-феноксиэтанол. Предпочтительны композиции, не содержащие ртуть, также могут быть приготовлены вакцины без консервантов.
Фармацевтические композиции в соответствии с данным изобретением предпочтительно являются стерильными.
Фармацевтические композиции в соответствии с данным изобретением являются предпочтительно не пирогенными, например, содержат <1 ЭЕ (эндотоксиновая единица, стандартная мера) на дозу, и предпочтительно <0,1 ЭЕ на дозу.
Фармацевтические композиции в соответствии с данным изобретением предпочтительно не содержат глютен.
Фармацевтические композиции в соответствии с данным изобретением могут быть получены в виде стандартных лекарственных форм. В некоторых вариантах стандартная лекарственная форма может иметь объем 0,1-1,0 мл, например, около 0,5 мл.
Композиции могут быть получены в виде форм для инъекций, либо в виде растворов, либо суспензий. Композиция может быть получена для легочного введения, например, через ингалятор, с применением мелкораспыленной струи. Композиция может быть получена для назального, ушного или глазного введения, например, в виде спрея или капель. Формы для инъекций для внутримышечного введения являются типовыми.
Композиции включают иммунологически эффективное количество липосом, а также любые другие компоненты, при необходимости. Под 'иммунологически эффективным количеством' понимают, что введение такого количества пациенту, либо одной дозой, либо несколькими, является эффективным для лечения или профилактики. Это количество меняется в зависимости от здоровья и физического состояния лечимого пациента, возраста, классификационной группы лечимого пациента (например, не человекообразные приматы, приматы и т.д.), способности иммунной системы пациента синтезировать антитела, степени желаемой защиты, композиции вакцины, оценки медицинской ситуации лечащим врачом, и других подобных факторов. Ожидают, что количество попадает в относительно широкий интервал, который может быть определен обычными испытаниями. Содержание липосомы и РНК в композициях в соответствии с данным изобретением обычно выражается в количестве РНК на дозу. Предпочтительная доза составляет ≤100 мкг РНК (например, 10-100 мкг, например, около 10 мкг, 25 мкг, 50 мкг, 75 мкг или 100 мкг), а также могут применяться более низкие уровни, например, ≤1 мкг/дозу, ≤100 нг/дозу, ≤10 нг/дозу, ≤1 нг/дозу и т.д.
В изобретении также представлено устройство доставки (например, шприц, небулайзер, распылитель, ингалятор, кожный пластырь и т.д.), содержащее фармацевтическую композицию в соответствии с данным изобретением. Это устройство может применяться для введения композиции позвоночному пациенту.
Липосомы в соответствии с данным изобретением не содержат рибосомы.
Способы лечения и медицинское применение
В отличие от частиц, описанных в ссылке 12, липосомы и фармацевтические композиции предназначены для in vivo применения для вызова иммунной реакции против целевого иммуногена или для генной терапии.
В изобретении представлен способ повышения иммунной реакции у позвоночных, включающий стадию введения эффективного количества липосомы или фармацевтической композиции в соответствии с данным изобретением. Иммунная реакция предпочтительно является защитной и предпочтительно вовлекает антитела и/или медиированный в клетках иммунитет. Возрастает подкрепляющая реакция.
В изобретении также представлена липосома или фармацевтическая композиция в соответствии с данным изобретением для применения в способе повышения иммунной реакции в позвоночных.
В изобретении также представлена липосома или фармацевтическая композиция в соответствии с данным изобретением для применения в способе генной терапии у позвоночных.
В изобретении также представлено применение липосомы в соответствии с данным изобретением в производстве лекарственного средства для повышения иммунной реакции у позвоночных.
При повышении иммунной реакции у позвоночных при указанном применении и способах, позвоночное может быть защищено от различных заболеваний и/или инфекций, например, от бактериальных и/или вирусных заболеваний, таких как описаны выше. Липосомы и композиции являются иммуногенными и являются более предпочтительно вакцинными композициями. Вакцины в соответствии с данным изобретением могут быть либо профилактическими (т.е. для профилактики инфекции), либо терапевтическими (т.е. для лечения инфекции), но обычно бывают профилактическими.
Позвоночным предпочтительно является млекопитающее, такое как человек или большое ветеринарное млекопитающее (например, лошадь, домашний скот, олень, коза, свинья). Если вакцина предназначена для профилактического применения, человеком предпочтительно является ребенок (например, ребенок ясельного возраста или грудной ребенок) или подросток; если вакцина предназначена для терапевтического применения, человеком предпочтительно является подросток или взрослый человек. Вакцина, предназначенная для детей, также может вводиться взрослым, например, для оценки безопасности, дозы, иммуногенности и т.д.
Вакцины, полученные в соответствии с данным изобретением, могут применяться для лечения детей и взрослых. Таким образом, человек может быть в возрасте менее 1 года, менее 5 лет, 1-5 лет, 5-15 лет, 15-55 лет или, по крайней мере, 55 лет. Предпочтительными пациентами для получения вакцин являются пожилые люди (например, ≥50 лет, ≥60 лет, и предпочтительно ≥65 лет), дети (например, ≤5 лет), госпитализированные пациенты, работники здравоохранения, военнослужащие, беременные женщины, хронические больные или пациенты с иммунодефицитом. Вакцины не предназначены только для этих групп, однако, и могут применяться более широко среди населения.
Композиции в соответствии с данным изобретением обычно могут вводиться непосредственно пациенту. Прямая доставка может проводиться парентеральной инъекцией (например, подкожно, внутрибрюшинно, внутривенно, внутримышечно, внутрикожно или в межклеточное пространство тканей; в отличие от ссылки 1, внутриязычная инъекция обычно не применяется в соответствии с данным изобретением). Альтернативные пути доставки включают ректальный, пероральный (например, таблетки, спрей), буккальный, подъязычный, вагинальный, местный, чрескожный или транскожный, интраназальный, глазной, ушной, легочный или другие способы введения через слизистую. Внутрикожное и внутримышечное введение являются двумя предпочтительными путями. Инъекция может проводиться с применением иглы (например, гиподермальной иглы), но могут альтернативно применяться инъекции без применения иглы. Типовая внутримышечная доза составляет 0,5 мл.
Изобретение может применяться для вызова системного и/или слизистого иммунитета, предпочтительно для вызова улучшенного системного и/или слизистого иммунитета.
Дозой может быть однократная доза или множество доз. Множество доз могут применяться в первичной схеме иммунизации и/или усиленной схеме иммунизации. При схеме с множеством доз различные дозы могут даваться одинаковыми или разными путями, например, первичный парентеральный и усиленный слизистый, первичный слизистый и усиленный парентеральный, и т.д. Множество доз обычно вводят, по крайней мере, с разрывом с 1 неделю (например, около 2 недель, около 3 недель, около 4 недель, около 6 недель, около 8 недель, около 10 недель, около 12 недель, около 16 недель и т.д.). В одном варианте множество доз может вводиться приблизительно через 6 недель, 10 недель и 14 недель после рождения, например, в возрасте 6 недель, 10 недель и 14 недель, как часто применяется в Расширенной Программе иммунизации Всемирной Организации Здравоохранения ('EPI'). В альтернативном варианте две первичные дозы вводят с интервалом около двух месяцев, например, с интервалом около 7, 8 или 9 недель, затем вводят одну или более усиленных доз в течение от около 6 месяцев до 1 года после второй первичной дозы, например, в течение около 6, 8, 10 или 12 месяцев после второй первичной дозы. В другом варианте три первичные дозы вводят с интервалом около двух месяцев, например, с интервалом около 7, 8 или 9 недель, затем вводят одну или более усиленные дозы в течение от около 6 месяцев до 1 года после третьей первичной дозы, например, в течение около 6, 8, 10 или 12 месяцев после третьей первичной дозы.
Химические термины и определения
Гало
Термин "галоген" (или "гало") включает фтор, хлор, бром и йод.
Алкил, алкилен, алкенил, алкинил, циклоалкил и т.д.
Термины "алкил", "алкилен", "алкенил" и "алкинил" применяют для обозначения прямых и разветвленных ациклических форм. Циклические аналоги обозначены как циклоалкил и т.д.
Термин "алкил" включает одновалентную, прямую или разветвленную, насыщенную, ациклическую гидрокарбильную группу. В одном варианте алкилом является C1-10алкил, в другом варианте C1-6алкил, в другом варианте C1-4алкил, такой как метил, этил, н-пропил, изопропил или трет-бутил.
Термин "циклоалкил" включает одновалентные, насыщенные, циклические гидрокарбильные группы. В одном варианте циклоалкилом является C3-10циклоалкил, в другом варианте C3-6циклоалкил, такой как циклопентил и циклогексил.
Термин "алкокси" означает алкил-O-.
Термин "алкенил" включает одновалентные, прямые или разветвленные, ненасыщенные, ациклические гидрокарбильные группы, содержащие, по крайней мере, одну двойную связь углерод-углерод и, в одном варианте, не содержащие тройные связи углерод-углерод. В одном варианте алкенилом является C2-10алкенил, в другом варианте C2-6алкенил, в другом варианте C2-4алкенил.
Термин "циклоалкенил" включает одновалентные, частично ненасыщенные, циклические гидрокарбильные группы, содержащие, по крайней мере, одну двойную связь углерод-углерод и, в одном варианте, не содержащие тройные связи углерод-углерод. В одном варианте циклоалкенилом является C3-10циклоалкенил, в другом варианте C5-10циклоалкенил, например, циклогексенил или бензоциклогексил.
Термин "алкинил" включает одновалентные, прямые или разветвленные, ненасыщенные, ациклические гидрокарбильные группы, содержащие, по крайней мере, одну тройную связь углерод-углерод и, в одном варианте, не содержащие двойные связи углерод-углерод. В одном варианте алкинилом является C2-10алкинил, в другом варианте C2-6алкинил, в другом варианте C2-4алкинил.
Термин "циклоалкинил" включает одновалентные, частично ненасыщенные, циклические гидрокарбильные группы, содержащие, по крайней мере, одну тройную связь углерод-углерод и, в одном варианте, не содержащие двойные связи углерод-углерод. В одном варианте циклоалкинилом является C3-10циклоалкинил, в другом варианте C5-10циклоалкинил.
Термин "алкилен" включает двухвалентные, прямые или разветвленные, насыщенные, ациклические гидрокарбильные группы. В одном варианте алкиленом является C1-10алкилен, в другом варианте C1-6алкилен, в другом варианте C1-4алкилен, такой как метилен, этилен, н-пропилен, изопропилен или трет-бутилен.
Термин "алкенилен" включает двухвалентные, прямые или разветвленные, ненасыщенные, ациклические гидрокарбильные группы, содержащие, по крайней мере, одну двойную связь углерод-углерод и, в одном варианте, не содержащие тройные связи углерод-углерод. В одном варианте алкениленом является C2-10алкенилен, в другом варианте C2-6алкенилен, в другом варианте C2-4алкенилен.
Термин "алкинилен" включает двухвалентные, прямые или разветвленные, ненасыщенные, ациклические гидрокарбильные группы, содержащие, по крайней мере, одну тройную связь углерод-углерод и, в одном варианте, не содержащие двойные связи углерод-углерод. В одном варианте алкиниленом является C2-10алкинилен, в другом варианте C2-6алкинилен, в другом варианте C2-4алкинилен.
Гетероалкил и т.д.
Термин "гетероалкил" включает алкильные группы, в которых вплоть до шести атомов углерода, в одном варианте вплоть до пяти атомов углерода, в другом варианте вплоть до четырех атомов углерода, в другом варианте вплоть до трех атомов углерода, в другом варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый замещен независимо O, S(O)q, N, P(O)r или Si (и предпочтительно O, S(O)q или N), при условии, что остается, по крайней мере, один атом углерода алкила. Гетероалкильная группа может быть C-связанной или гетеро-связанной, т.е. может быть связана с остатком молекулы через атом углерода или через O, S(O)q, N, P(O)r или Si.
Термин "гетероциклоалкил" включает циклоалкильные группы, в которых вплоть до шести атомов углерода, в одном варианте вплоть до пяти атомов углерода, в другом варианте вплоть до четырех атомов углерода, в другом варианте вплоть до трех атомов углерода, в другом варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый замещен независимо O, S(O)q или N, при условии, что остается, по крайней мере, один из атомов углерода циклоалкила. Примеры гетероциклоалкильных групп включают оксиранил, тиаранил, азиридинил, оксетанил, тиатанил, азетинидил, тетрагидрофуранил, тетрагидротиофенил, пирролидинил, тетрагидропиранил, тетрагидротиопиранил, пиперидинил, 1,4-диоксанил, 1,4-оксатианил, морфолинил, 1,4-дитианил, пиперазинил, 1,4-азатианил, оксепанил, тиепанил, азепанил, 1,4-диоксепанил, 1,4-оксатиепанил, 1,4-оксаазепанил, 1,4-дитиепанил, 1,4-тиеазепанил и 1,4-диазепанил. Гетероциклоалкильная группа может быть C-связана или N-связана, т.е. она может быть связана с остатком молекулы через атом углерода или через атом азота.
Термин "гетероалкенил" включает алкенильные группы, в которых вплоть до трех атомов углерода, в одном варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый замещен независимо O, S(O)q или N, при условии, что остается, по крайней мере, один атом углерода алкенила. Гетероалкенильная группа может быть C-связанной или гетеро-связанной, т.е. может быть связана с остатком молекулы через атом углерода или через O, S(O)q или N.
Термин "гетероциклоалкенил" включает циклоалкенильные группы, в которых вплоть до трех атомов углерода, в одном варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый замещен независимо O, S(O)q или N, при условии, что остается, по крайней мере, один атом углерода циклоалкенила. Примеры гетероциклоалкенильных групп включают 3,4-дигидро-2H-пиранил, 5-6-дигидро-2H-пиранил, 2H-пиранил, 1,2,3,4-тетрагидропиридинил и 1,2,5,6-тетрагидропиридинил. Гетероциклоалкенильная группа может быть C-связана или N-связана, т.е. она может быть связана с остатком молекулы через атом углерода или через атом азота.
Термин "гетероалкинил" включает алкинильные группы, в которых вплоть до трех атомов углерода, в одном варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый замещен независимо O, S(O)q или N, при условии, что остается, по крайней мере, один атом углерода алкинила. Гетероалкинильная группа может быть C-связанной или гетеро-связанной, т.е. может быть связана с остатком молекулы через атом углерода или через O, S(O)q или N.
Термин "гетероциклоалкинил" включает циклоалкинильные группы, в которых вплоть до трех атомов углерода, в одном варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый замещен независимо O, S(O)q или N, при условии, что остается, по крайней мере, один атом углерода циклоалкинила. Гетероциклоалкенильная группа может быть C-связана или N-связана, т.е. она может быть связана с остатком молекулы через атом углерода или через атом азота.
Термин "гетероалкилен" включает алкиленовые группы, в которых вплоть до трех атомов углерода, в одном варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый замещен независимо O, S(O)q или N, при условии, что остается, по крайней мере, один атом углерода алкилена.
Термин "гетероалкенилен" включает алкениленовые группы, в которых вплоть до трех атомов углерода, в одном варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый замещен независимо O, S(O)q или N, при условии, что остается, по крайней мере, один атом углерода алкенилена.
Термин "гетероалкинилен" включает алкиниленовые группы, в которых вплоть до трех атомов углерода, в одном варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый замещен независимо O, S(O)q или N, при условии, что остается, по крайней мере, один атом углерода алкинилена.
Арил
Термин "арил" включает одновалентные, ароматические, циклические гидрокарбильные группы, такие как фенил или нафтил (например, 1-нафтил или 2-нафтил). В общем, арильные группы могут быть моноциклическими или полициклическими конденсированными кольцевыми ароматическими группами. Предпочтительным арилом является C6-14арил.
Другие примеры арильных групп включают одновалентные производные ацеантрилена, аценафтилена, ацефенантрилена, антрацена, азулена, кризена, коронена, флуорантена, флуорена, as-индацена, s-индацена, индена, нафталина, овалена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена и рубицена.
Термин "арилалкил" означает алкил, замещенный арильной группой, например, бензил.
Термин "арилен" включает двухвалентные ароматические, циклические гидрокарбильные группы, такие как фенилен. В общем, ариленовые группы могут быть моноциклическими или полициклическими конденсированными кольцевыми ароматическими группами. Предпочтительным ариленом является C6-C14арилен. Другие примеры ариленовых групп включают двухвалентные производные ацеантрилена, асенафтилена, ацефенантрилена, антрацена, азулена, кризена, коронена, флуорантена, флуорена, as-индацена, s-индацена, индена, нафталина, овалена, перилена, феналена, фенантрена, пицена, плеядена, пирена, пирантрена и рубицена.
Гетероарил
Термин "гетероарил" включает одновалентные, гетероароматические, циклические гидрокарбильные группы, дополнительно содержащие один или более гетероатомов, независимо выбранных из O, S, N и NRN, где RN определен ниже (и в одном варианте является H или алкилом (например, C1-6алкилом)).
В общем, гетероарильные группы могут быть моноциклическими или полициклическими (например, бициклическими) конденсированными кольцевыми гетероароматическими группами. В одном варианте гетероарильные группы содержат 5-13 членов в кольце (предпочтительно 5-10 членов) и 1, 2, 3 или 4 гетероатомов кольца независимо выбирают из O, S, N и NRN. В одном варианте гетероарильная группа может быть 5, 6, 9 или 10-членной, например, 5-членной моноциклической, 6-членной моноциклической, 9-членной конденсированной кольцевой бициклической или 10-членной конденсированной кольцевой бициклической.
Моноциклические гетероароматические группы включают гетероароматические группы, содержащие 5-6 членов в кольце и 1, 2, 3 или 4 гетероатома, выбранных из O, S, N или NRN.
В одном варианте 5-членные моноциклические гетероарильные группы содержат 1 член в кольце, который является -NRN- группой, атомом -O- или атомом -S-, и необязательно 1-3 члена в кольце (например, 1 или 2 члена в кольце), которые являются атомами =N- (где остальными 5 членами кольца являются атомы углерода).
Примеры 5-членных моноциклических гетероарильных групп включают пирролил, фуранил, тиофенил, пиразолил, имидазолил, изоксазолил, оксазолил, изотиазолил, тиазолил, 1,2,3-триазолил, 1,2,4-триазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-тиадиазолил, пиридил, пиримидинил, пиридазинил, пиразинил, 1,3,5-триазинил, 1,2,4-триазинил, 1,2,3-триазинил и тетразолил.
Примеры 6-членных моноциклических гетероарильных групп включают пиридинил, пиридазинил, пиримидинил и пиразинил.
В одном варианте 6-членные моноциклические гетероарильные группы содержат 1 или 2 члена в кольце, которые являются атомами =N- (где оставшиеся 6 членов кольца являются атомами углерода).
Бициклические гетероароматические группы включают конденсированные кольцевые гетероароматические группы, содержащие 9-13 членов в кольце и 1, 2, 3, 4 или более гетероатомов, выбранных из O, S, N или NRN.
В одном варианте 9-членные бициклические гетероарильные группы включают 1 член в кольце, который является -NRN- группой, атомом -O- или атомом -S-, и необязательно 1-3 члена в кольце (например, 1 или 2 члена в кольце), которые являются атомами =N- (где оставшиеся 9 членов кольца являются атомами углерода).
Примеры 9-членных конденсированных кольцевых гетероарильных групп включают бензофуранил, бензотиофенил, индолил, бензимидазолил, индазолил, бензотриазолил, пирроло[2,3-b]пиридинил, пирроло[2,3-c]пиридинил, пирроло[3,2-c]пиридинил, пирроло[3,2-b]пиридинил, имидазо[4,5-b]пиридинил, имидазо[4,5-c]пиридинил, пиразоло[4,3-d]пиридинил, пиразоло[4,3-c]пиридинил, пиразоло[3,4-c]пиридинил, пиразоло[3,4-b]пиридинил, изоиндолил, индазолил, пуринил, индолининил, имидазо[1,2-a]пиридинил, имидазо[1,5-a]пиридинил, пиразоло[1,2-a]пиридинил, пирроло[1,2-b]пиридазинил и имидазо[1,2-c]пиримидинил.
В одном варианте 10-членные бициклические гетероарильные группы включают 1-3 члена кольца, которые являются атомами =N- (где оставшиеся 10 членов кольца являются атомами углерода).
Примеры 10-членных конденсированных кольцевых бициклическуих гетероарильных групп включают хинолинил, изохинолинил, циннолинил, хиназолинил, хиноксалинил, фталазинил, 1,6-нафтиридинил, 1,7-нафтиридинил, 1,8-нафтиридинил, 1,5-нафтиридинил, 2,6-нафтиридинил, 2,7-нафтиридинил, пиридо[3,2-d]пиримидинил, пиридо[4,3-d]пиримидинил, пиридо[3,4-d]пиримидинил, пиридо[2,3-d]пиримидинил, пиридо[2,3-b]пиразинил, пиридо[3,4-b]пиразинил, пиримидо[5,4-d]пиримидинил, пиразино[2,3-b]пиразинил и пиримидо[4,5-d]пиримидинил.
Термин "гетероарилалкил" означает алкил, замещенный гетероарильной группой.
Термин "гетероарилен" включает двухвалентные гетероароматические циклические гидрокарбильные группы, дополнительно содержащие один или более гетероатомов, независимо выбранных из O, S, N и NRN, где RN определен ниже (и в одном варианте является H или алкилом (например, C1-6алкилом)). В общем, гетероариленовые группы могут быть моноциклическими или полициклическими (например, бициклическими) конденсированными кольцевыми гетероароматическими группами. В одном варианте гетероариленовые группы содержат 5-13 членов в кольце (предпочтительно 5-10 членов) и 1, 2, 3 или 4 гетероатома в кольце, независимо выбранных из O, S, N и NRN. В одном варианте гетероариленовая группа может быть 5-, 6-, 9- или 10-членной, например, 5-членной моноциклической, 6-членной моноциклической, 9-членной конденсированной кольцевой бициклической или 10-членной конденсированной кольцевой бициклической. Термин "гетероарилен" включает двухвалентные производные каждой из гетероарильных групп, указанных выше.
Термины "арил", "ароматический", "гетероарил" и "гетероароматический" также включает группы, которые частично восстановлены. Таким образом, например, "гетероарил" включает виды, в которых одно из колец восстановлено до насыщенного кольца (например, 1,2,3,4-тетрагидро-1,8-нафтиридин-2-ил).
Отсутствующие группы
Если группа a, b или c в формуле (I) "отсутствует", это означает, что вместо нее присутствует одинарная связь, т.е. что две группы с любой стороны группы a, b или c непосредственно связаны друг с другом.
Общее
Если не указано иначе, если сочетания групп обозначены здесь как одна группа, например, арилалкил, последняя указанная группа содержит атом, через который группа присоединена к остатку молекулы.
Если указано, что атом углерода алкильной группы или другой группы заменен O, S(O)q, N или P(O)r, подразумевается, что:

-CH= заменена -N= или -P(O)r=;
≡C-H заменена ≡N или ≡P(O)r; или
-CH2- заменена -O-, -S(O)q- -NRN- или -P(O)rRN-, где RN является H или необязательно замещенным C1-6алкилом, C1-6гетероалкилом, C3-6циклоалкилом, C3-6гетероциклоалкилом, C2-6алкенилом, C2-6гетероалкенилом, C3-6циклоалкенилом, C3-6гетероциклоалкенилом, фенилом или гетероарилом, содержащим 5 или 6 членов в кольце. RN предпочтительно является H, C1-6алкилом или C3-6циклоалкилом.
q независимо равен 0, 1 или 2. В одном варианте q равен 0.
r независимо равен 0 или 1. В одном варианте r равен 0.
Если указано, что атом углерода заменен Si, подразумевают, что атом углерода заменен на атом кремния, но другие связи остаются такими же. Таким образом, например, -CH2- заменен -SiH2-; -CH= заменен -SiH=; и ≡C-H заменен ≡Si-H.
Для того чтобы внести ясность относительно указанных выше групп, содержащих гетероатом, (таких как гетероалкил и т.д.), где дано количество атомов углерода, например, C3-6гетероалкил, в таких случаях подразумевается группа на основе C3-6алкила, в которой один или более из 3-6 атомов углерода цепи заменены O, S(O)q или N. Соответственно, C3-6гетероалкильная группа, например, содержит менее 3-6 атомов углерода в цепи. В качестве другого примера, пиридильная группа классифицирована как C6 гетероарильная группа, даже если она содержит 5 атомов углерода.
Замещение
Группы соединений в соответствии с данным изобретением (например, алкил, циклоалкил, алкокси, алкенил, циклоалкенил, алкинил, алкилен, алкенилен, гетероалкил, гетероциклоалкил, гетероалкенил, гетероциклоалкенил, гетероалкинил, гетероалкилен, гетероалкенилен арил, арилалкил, арилгетероалкил, гетероарил, гетероарилалкил или гетероарилгетероалкил и т.д.) могут быть замещены или не замещены, в одном варианте не замещены. Обычно замещение включает теоретическое заменение атома водорода замещающей группой, или двух атомов водорода в случае замещения =O.
Если имеется замещение, обычно может быть от 1 до 5 заместителей на каждую группу, в одном варианте от 1 до 3 заместителей, в одном варианте 1 или 2 заместителя, в одном варианте 1 заместитель. Один вариант включает более одного заместителя на одном и том же атоме, например, ацетальную группу.
В одном варианте заместителем(ями) является/являются независимо Sub1 или Sub2 (в одном варианте Sub2), где:
Sub1 независимо является галогеном, тригалометилом, тригалоэтилом, -NO2, -CN, -N+(Rs)2О-, -CO2H, -CO2Rs, -SO3H, -SORs, -SO2Rs, -SO3Rs, -OC(=O)ORs, -C(=O)H, -C(=O)Rs, -OC(=O)Rs, =O, -NRS2, -C(=O)NH2, -C(=O)NRs2, -N(Rs)C(=O)ORs, -N(Rs)C(=O)NRs2, -OC(=O)NRs2, -N(Rs)C(=O)Rs, -C(=S)NRS2, -NRSC(=S)RS, -SO2NRs2, -NRsSO2Rs, -N(RS)C(=S)NRS2, -N(Rs)SO2NRs2, -Rs или -ZSRS, где
Zs независимо является O, S или NRS;
Rs независимо является H или C1-6алкилом, C1-6гетероалкилом, -(Alka)fC3-6циклоалкилом, -(Alka)fC3-6гетероциклоалкилом, C2-6алкенилом, C2-6гетероалкенилом, -(Alka)fC3-6циклоалкенилом, -(Alka)fC3-6гетероциклоалкенилом, C2-6алкинилом, C2-6гетероалкинилом, -(Alka)fC6-14арилом, -(Alka)fC6-14арилом или -(Alka)f-гетероарилом (где гетероарил содержит 5-13 членов в кольце), где
f равно 0 или 1;
Alka является C1-6алкиленом или C1-6гетероалкиленом; и
Rs является необязательно замещенным (в одном варианте не замещенным) от 1 до 3 заместителей Sub2;
Sub2 независимо является галогеном, тригалометилом, тригалоэтилом, -NO2, -CN, -N+(C1-6алкилом)2O-, -CO2H, -CO2C1-6алкилом, -SO3H, -SOC1-6алкилом, -SO2C1-6алкилом, -SO3C1-6алкилом, -OC(=O)OC1-6алкилом, -C(=O)H, -C(=O)C1-6алкилом, -OC(=O)C1-6алкилом, =O, -N(C1-6алкил)2, -C(=O)NH2, -C(=O)N(C1-6алкил)2, -N(C1-6алкил)C(=O)O(C1-6алкил), -N(C1-6алкил)C(=O)N(C1-6алкил)2, -OC(=O)N(C1-6алкил)2, -N(C1-6алкил)C(=O)C1-6алкилом, -C(=S)N(C1-6алкил)2, -N(C1-6алкил)C(=S)C1-6алкилом, -SO2N(C1-6алкил)2, -N(C1-6алкил)SO2C1-6алкилом, -N(C1-6алкил)C(=S)N(C1-6алкил)2, -N(C1-6алкил)SO2N(C1-6алкил)2, -C1-6алкилом, -C1-6гетероалкилом, -C3-6циклоалкилом, -C3-6гетероциклоалкилом, -C2-6алкенилом, -C2-6гетероалкенилом, -C3-6циклоалкенилом, -C3-6гетероциклоалкенилом, -C2-6алкинилом, -C2-6гетероалкинилом, -C6-14арилом, -C5-13гетероарилом, -Zt-C1-6алкилом, -Zt-C3-6циклоалкилом, -Zt-C2-6алкенилом, -Zt-C3-6циклоалкенилом или -Zt-C2-6алкинилом; и
Zt независимо является O, S, NH или N(C1-6алкил).
В то время как Rs в Sub1 может быть необязательно замещен от 1 до 3 заместителей Sub2, Sub2 является не замещенным. Однако, в одном варианте, Rs является не замещенным.
В одном варианте Rs является H или C1-6алкилом, необязательно замещенным 1-3 заместителями Sub2.
В одном варианте Sub2 независимо является галогеном, тригалометилом, тригалоэтилом, -NO2, -CN, -N+(C1-6алкил)2O-, -CO2H, -SO3H, -SOC1-6алкилом, -SO2C1-6алкилом, -C(=O)H, -C(=O)C1-6алкилом, =O, -N(C1-6алкил)2, -C(=O)NH2, -C1-6алкилом, -C3-6циклоалкилом, -C3-6гетероциклоалкилом, -Zt-C1-6алкилом или -Zt-C3-6циклоалкилом.
В одном варианте, где замещенная группа является ациклической (например, алкил, гетероалкил, алкенил и т.д.), Sub1 не является -Rs и Sub2 не является -C1-6алкилом, -C1-6гетероалкилом, -C2-6алкенилом, -C2-6гетероалкенилом, -C2-6алкинилом или -C2-6гетероалкинилом.
Если группа, отличная от Sub2, имеет, по крайней мере, 3 положения, которые могут быть замещены, группа может быть замещена на обоих концах алкиленовой, алкениленовой, алкиниленовой, гетероалкиленовой, гетероалкениленовой или гетероалкиниленовой цепи (в одном варианте содержащей от 1 до 6 атомов, в другом варианте от 3 до 6 атомов, и в другом варианте 3 или 4 атома) с получением циклической группы. Эта цепь является необязательно замещенной от 1 до 3 заместителей Sub2. В одном варианте эта цепь не замещена. Таким образом, термины необязательно замещенный "циклоалкил", "циклоалкенил", "циклоалкинил", "гетероциклоалкил", "гетероциклоалкенил", "гетероциклоалкинил", "арил" и "гетероарил" включают конденсированные виды. Например, "необязательно замещенный циклоалкил" включает виды, в которых два циклоалкильных кольца конденсированы, и "необязательно замещенный гетероарил" включает виды, в которых гетероциклоалкильное кольцо конденсировано с ароматическим кольцом (например, 5,6,7,8-тетрагидро-1,8-нафтиридин-2-ил).
Если группа, отличная от Sub2, имеет атом, который может быть замещен дважды, этот атом может быть замещен на обоих концах алкиленовой, алкениленовой, алкиниленовой, гетероалкиленовой, гетероалкениленовой или гетероалкиниленовой цепи (в одном варианте содержащей от 2 до 8 атомов, в другом варианте от 3 до 6 атомов, и в другом варианте 4 или 5 атомов) с получением циклической группы. Эта цепь является необязательно замещенной от 1 до 3 заместителей Sub2. В одном варианте эта цепь не замещена. Таким образом, термины необязательно замещенный "циклоалкил", "циклоалкенил", "циклоалкинил", "гетероциклоалкил", "гетероциклоалкенил", "гетероциклоалкинил", "арил" и "гетероарил" включают спиро виды.
С целью разъяснения, если группа имеет гетероатом, заместитель может быть связан с гетероатомом. Таким образом, например, "необязательно замещенный гетероалкил" включает -CH2-N(Sub1)-CH2-, -CH(Sub1)-NH-CH2- и -CH(Sub1)-N(Sub1)-CH2- и т.д.
Модификатор
Если списку предшествует модификатор, полагают, что модификатор может быть применим к каждому элементу списка. Например, фраза "необязательно замещенный C3-20-гетероциклоалкил, C3-20-гетероциклоалкенил, C3-20-гетероциклоалкинил или C5-20-гетероарил" означает, что каждый из четырех элементов списка, а именно C3-20-гетероциклоалкильная группа, C3-20-гетероциклоалкенильная группа, C3-20-гетероциклоалкинильная группа и C6-20-гетероарильная группа, может быть необязательно замещен.
Если группа характеризуется первым модификатором и затем, позже, та же группа характеризуется следующим модификатором, это означает, что группа характеризуется обоими модификаторами одновременно. Например, если группа описана как "C3-20-гетероциклоалкинильная" (первый модификатор) группа и затем та же группа описана как "C5-16" (следующий модификатор) группа, это означает C5-16гетероциклоалкинильную группу.
Стероиды
В данном описании термин "стероид" относится к любой группе, содержащей следующую структуру (где структура обозначена как "скелет стероида").

Только для целей иллюстрации, скелет стероида нарисован выше как полностью насыщенный. Термин стероид, однако, также используется для описания случаев, где в скелете стероида имеется ненасыщенность. Например, термин стероид включает группу, которая содержит полностью ненасыщенный (http://www.multitran.ru/c/m.exe?t=5656205_2_1) основной скелет, 15Н-циклопента[a]фенантрен:
Термин стероид также включает группу, которая содержит частично ненасыщенный скелет стероида.
Термин стероид также включает "секо" производные скелета стероида, т.е. групп, в которых было проведено расщепление кольца; "нор" и "гомо" производные скелета стероида, которые включают сокращение и расширение кольца, соответственно (см. Systemic Nomenclature of Organic Chemistry, by D. Hellwinkel, published by Springer, 2001, ISBN: 3-540-41138-0, страница 203 для "секо" и страница 204 для "нор" и "гомо"). В одном варианте, однако, такие секо производные не охвачены термином "стероид". В другом варианте такие нор производные не охвачены термином "стероид". В другом варианте такие гомо производные не охвачены термином "стероид". Таким образом, в одном варианте такие секо, нор и гомо производные не охвачены термином "стероид".
Термин стероид также включает случаи, когда один или более атомов углерода кольца в структуре меченого скелета стероида заменены гетероатомом. В одном таком варианте вплоть до шести атомов углерода, в одном варианте вплоть до пяти атомов углерода, в другом варианте вплоть до четырех атомов углерода, в другом варианте вплоть до трех атомов углерода, в другом варианте вплоть до двух атомов углерода, в другом варианте один атом углерода, каждый заменен независимо O, S(O)q, N, P(O)r или Si (и предпочтительно O, S(O)q или N). В одном варианте, однако, термин "стероид" содержит виды, в которых "основной скелет стероида" не содержит гетероатомы.
Стероидная кольцевая система пронумерована согласно представленной ниже схеме.
Термин стероид охватывает стерины, стероидные гормоны, желчные кислоты и соли желчных кислот. Стерином является любой стероид с гидроксильной группой в положении 3 кольца А.
Ненасыщенность
Согласно стандартному применению, положение омега-3 относится к третьей связи от (метильного) конца цепи; положение омега-6 относится к шестой связи от (метильного) кольца цепи; и положение омега-9 относится к девятой связи от (метильного) кольца цепи.
Общее
В практике в соответствии с данным изобретением применяются, если не указано иначе, обычные способы химии, биохимии, молекулярной биологии, иммунологии и фармакологии, в пределах компетенции специалиста в данной области техники. Такие методики полностью объясняются в литературе. См., например, ссылки 32-38, и т.д.
Термин "содержащие" включает "включающие" а также "состоящие", например, композиция, "содержащая" X, может включать только X или может включать некоторые дополнительные элементы, например, X+Y.
Термин "около" относительно численного значения x является необязательным и означает, например, х±10%.
Термин "практически" не исключает "полностью", например, композиция, которая "практически не содержит" Y, может вообще не содержать Y. При необходимости термин "практически" может быть исключен из определения в соответствии с данным изобретением.
Ссылки на заряд, катионы, анионы, цвиттерионы и т.д. даны при pH 7.
TLR3 является Toll-подобным рецептором 3. Он представляет собой одинарный трансмембранный рецептор, который играет ключевую роль во врожденной иммунной системе. Известные агонисты TLR3 включают поли(I:C). "TLR3" является одобренным наименованием HGNC для гена, кодирующего этот рецептор, и его уникальным идентификационным номером HGNC является HGNC:11849. Последовательностью RefSeq для человеческого гена TLR3 является GI:2459625.
TLR7 является Toll-подобным рецептором 7. Он представляет собой одинарный трансмембранный рецептор, который играет ключевую роль во врожденной иммунной системе. Известные агонисты TLR7 включают, например, имиквимод. "TLR7" является одобренным наименованием HGNC для гена, кодирующего этот рецептор, и его уникальным идентификационным номером HGNC является HGNC:15631. Последовательностью RefSeq для человеческого гена TLR7 является GI:67944638.
TLR8 является Toll-подобным рецептором 8. Он представляет собой одинарный трансмембранный рецептор, который играет ключевую роль во врожденной иммунной системе. Известные агонисты TLR8 включают, например, резиквимод. "TLR8" является одобренным наименованием HGNC для гена, кодирующего этот рецептор, и его уникальным идентификационным номером HGNC является HGNC:15632. Последовательностью RefSeq для человеческого гена TLR8 является GI:20302165.
Семейство RIG-I-подобных рецепторов ("RLR") включает различные РНК геликазы, которые играют ключевые роли во врожденной иммунной системе [39]. RLR-1 (также известный как RIG-I или индуцируемый ретиноевой кислотой ген I) имеет два домена рекрутирования каспазы около N-окончания. Одобренным наименованием HGNC для гена, кодирующего RLR-1 геликазу, является "DDX58" (для DEAD (Asp-Glu-Ala-Asp) фрагмента полипептида 58) и уникальным идентификационным номером HGNC является HGNC:19102. Последовательностью RefSeq для человеческого гена RLR-1 является GI:77732514. RLR-2 (также известный как MDA5 или ген 5, ассоциированный с дифференцировкой меланомы) также имеет два домена рекрутирования рядом с N-окончанием. Одобренным наименованием HGNC для гена, кодирующего RLR-2 геликазу, является "IFIH1" (для интерферона, индуцированного доменом 1 геликазы C) и уникальным идентификационным номером HGNC является HGNC:18873. Последовательностью RefSeq для человеческого гена RLR-2 является GI:27886567. RLR-3 (также известная как LGP2 или лаборатория генетики и физиологии 2) не имеет доменов рекрутирования каспазы. Одобренным наименованием HGNC для гена, кодирующего RLR-3 геликазу, является "DHX58" (для DEXH (Asp-Glu-X-His) фрагмента полипептида 58) и уникальным идентификационным номером HGNC является HGNC:29517. Последовательностью RefSeq для человеческого гена RLR-3 является GI:149408121.
PKR является двухцепочечной РНК-зависимой протеинкиназой. Она играет ключевую роль во врожденной иммунной системе. "EIF2AK2" (для эукариотического фактора инициации трансляции 2-альфакиназы 2) является одобренным наименованием HGNC для гена, кодирующего этот рецептор, и его уникальным идентификационным номером HGNC является HGNC:9437. Последовательностью RefSeq для человеческого гена PKR является GI:208431825.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1 показан гель с окрашенной РНК. Линии показывают (1) маркеры, (2) голый репликон, (3) репликон после обработки РНКзой, (4) репликон, инкапсулированный в липосому, (5) липосому после обработки РНКзой, (6) липосому, обработанную РНКзой, затем экстрагированную из фенола/хлороформа.
На ФИГ. 2 представлена электронная микрофотография липосом.
На ФИГ. 3 показана экспрессия белка (в виде относительных световых единиц, ОСЕ) на 6 день после доставки РНК в липосомах с различными катионными липидами.
На ФИГ. 4 показан гель с окрашенной РНК. Линии показывают (1) маркеры, (2) голый репликон, (3) репликон, инкапсулированный в липосому, (4) липосому, обработанную РНКзой, затем экстрагированную из фенола/хлороформа.
На ФИГ. 5 показана экспрессия белка в дни 1, 3 и 6 после доставки РНК в виде упакованного в вирион репликона (квадраты), в виде голой РНК (ромбы) или в виде липосом (+=0,1 мкг, x=1 мкг).
На ФИГ. 6 показана экспрессия белка в дни 1, 3 и 6 после доставки четырех различных доз инкапсулированных в липосому РНК.
На ФИГ. 7 показаны анти-F IgG титры у животных, получающих упакованный в вирион репликон (VRP или VSRP), 1 мкг голой РНК и 1 мкг инкапсулированной в липосому РНК.
На ФИГ. 8 показаны анти-F IgG титры у животных, получающих VRP, 1 мкг голой РНК и 0,1 г или 1 мкг инкапсулированной в липосому РНК.
На ФИГ. 9 показаны нейтрализующие антитело титры у животных, получающих VRP или либо 0,1 г, либо 1 мкг инкапсулированной в липосому РНК.
На ФИГ. 10 показаны уровни экспрессии после доставки репликона в виде голой РНК (круги), инкапсулированной в липосому РНК (треугольники & квадраты) или в виде липоплекс (перевернутый треугольник).
На ФИГ. 11 показаны F-специфические IgG титры (2 недели после второй дозы) после доставки репликона в виде голой РНК (0,01-1 мкг), инкапсулированной в липосому РНК (0,01-10 мкг) или упакованной в виде вириона (VRP, 106 инфекционных единиц или ИЕ).
На ФИГ. 12 показаны F-специфические IgG титры (круги) и PRNT титры (квадраты) после доставки репликона в виде голой РНК (1 мкг), инкапсулированной в липосому РНК (0,1 или 1 мкг) или упакованной в виде вириона (VRP, 106 ИЕ). Титры у мышей, не бывших в эксперименте, также показаны. Сплошные линии показывают среднее геометрическое.
На ФИГ. 13 показано межклеточное образование цитокина после повторного стимулирования синтетическим пептидом, представляющим основные эпитопы в F белке через 4 недели после второй дозы. Ось y показывает % цитокина+ CD8+CD4-.
На ФИГ. 14 показаны F-специфические IgG титры (средние log10 титры ± станд. откл.) через 63 дня после иммунизации коров в дни 0 & 21.
СПОСОБЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
РНК репликоны
Ниже применяют различные репликоны. В общем они основаны на гибридном геноме альфавируса с неструктурными белками вируса венесуэльского энцефалита лошадей (ВВЭЛ), сигналом упаковки от вируса Синдбис или мутантом ВВЭЛ. Репликон имеет длину около 10 т.н. и имеет поли-А хвост.
Плазмид ДНК, кодирующий репликоны альфавируса (названные: pT7-mVEEV-FL.PCBF или A317; pT7-mVEEV-SEAP или A306; pSP6-VCR-GFP или A50), служит в качестве шаблона для синтеза РНК in vitro. Репликоны содержат генетические элементы альфавируса, требуемые для репликации РНК, но не имеют те кодирующие ген продукты, которые необходимы для совокупности частиц; вместо этого структурные белки заменены целевыми белками (либо репортером, таким как SEAP или GFP, или иммуногеном, таким как белок РСВ F полной длины), и поэтому репликоны не способны вызывать генерацию инфекционых частиц. Промотор бактериофага (T7 или SP6), расположенный выше кДНК альфавируса, способствует синтезу репликона РНК in vitro и рибозим дельта-вируса гепатита (ДВГ), расположенный сразу же ниже поли(A)-хвоста, создает корректный 3'-конец через саморасщепление.
После линеаризации плазмида ДНК ниже рибозим ДВГ подходяще ограничивающей эндонуклеазой, убегающие транскрипты синтезируют in vitro с применением T7 или SP6 бактериофага, полученного из ДНК-зависимой РНК полимеразы. Транскрипции проводят в течение 2 часов при 37°C в присутствии 7,5 мМ (T7 РНК полимераза) или 5 мМ (SP6 РНК полимераза) каждого из трифосфатов нуклеозида (ATP, CTP, GTP и UTP) согласно инструкциям производителя (Ambion). После транскрипции шаблон ДНК переваривают с TURBO ДНазой (Ambion). Репликон РНК осаждают с LiCl и восстанавливают в не содержащей нуклеазу воде. Неограниченную РНК ограничивают посттранскрипционно кэппинг-фермента осповакцины (КФО) с применением ScriptCap m7G Capping System (Epicentre Biotechnologies), как описано в инструкции; репликоны, ограниченные таким образом, имеют префикс "v", например, vA317 является репликоном A317, ограниченным VCE. Посттранскрипционно ограниченные РНК осаждают LiCl и восстанавливают в не содержащей нуклеазу воде. Концентрацию образцов РНК определяют измерением OD260нм. Целостность in vitro транскриптов подтверждают электрофорезом в денатурирующем агарозном геле.
Инкапсулирование липосом на основе DlinDMA
РНК инкапсулируют в липосомах, полученных, в основном, способом из ссылок 7 и 40. Липосомы получают из 10% ДСФХ (цвиттерионной), 40% DlinDMA (катионной), 48% холестерина и 2% ПЭГ-конъюгированного ДМГ (2 кДа ПЭГ). Эти доли указаны в % моль от общей липосомы.
DlinDMA (1,2-дилинолеилокси-N,N-диметил-3-аминопропан) синтезируют с применением методики из ссылки 2. ДСФХ (1,2-диастеароил-sn-глицеро-3-фосфохолин) покупают у Genzyme. Холестерин получают от Sigma-Aldrich. ПЭГ-конъюгированный ДМГ (1,2-димиристоил-sn-глицеро-3-фосфоэтаноламин-N-[метокси(полиэтиленгликоль), аммониевая соль), DOTAP (1,2-диолеоил-3-триметиламмоний-пропан, хлорид) и DC-chol (гидрохлорид 3β-[N-(N',N'-диметиламиноэтан)-карбамоил]холестерина) получают от Avanti Polar Lipids.
Коротко, липиды растворяют в этаноле (2 мл), репликон РНК растворяют в буфере (2 мл, 100 мМ цитрат натрия, pH 6) и их смешивают с 2 мл буфера с последующим уравновешиванием в течение 1 ч. Смесь разводят 6 мл буфера, затем фильтруют. Полученный продукт содержит липосомы, с ~95% эффективностью инкапсулирования. На ФИГ. 2 показана примерная электронная микрофотография липосом, полученных этими способами. Эти липосомы содержат инкапсулированную РНК, кодирующую полный РСВ F антиген. Динамическое рассеяние света партии показало средний диаметр 141 нм (Zav по интенсивности) или 78 нм (по номеру).
В одном конкретном способе инкапсулирования получают свежие маточные растворы липидов в этаноле. 37 мг DlinDMA, 11,8 мг ДСФХ, 27,8 мг холестерина и 8,07 мг ПЭГ-конъюгированного ДМГ взвешивают и растворяют в 7,55 мл этанола. Применяют три различных конъюгированных ПЭГ: ПЭГ-1000, ПЭГ-2000 или ПЭГ-3000. Свежеприготовленные липидные маточные растворы осторожно встряхивают при 37°C в течение около 15 мин с получением гомогенной смеси. Затем 226,7 мкл маточного раствора добавляют в 1,773 мл этанола с получением рабочего липидного маточного раствора 2 мл. 2 мл рабочего раствора РНК также готовят из маточного раствора ~1 мкг/мл в 100 мМ цитратном буфере (pH 6). Три 20-мл стеклянных пробирки (с мешалками) промывают Away раствором РНКзы и промывают большим количеством воды MilliQ перед применением для удаления примесей из пробирок с РНКзами. Одну из пробирок применяют для рабочего раствора РНК и другие для сбора липидов и смесей РНК (как описано ниже). Рабочий липидный и РНК растворы нагревают при 37°C в течение 10 мин до загрузки в 3-см3 шприц Луер-лок. 2 мл цитратного буфера (pH 6) загружают в другой 3-см3 шприц. Шприцы, содержащие РНК и липиды, соединяют с T смесителем (PEEK™ 500 мкм ВД соединение) с применением системы трубок ФЭП (фторированный этилен-пропилен; все системы трубок ФЭП имеют 2 мм внутренний диаметр и 3 мм внешний диаметр; получены от Idex Health Science). Выход из T смесителя также имеет ФЭП систему трубок. Третий шприц, содержащий цитратный буфер, соединяют с отдельным участком системы трубок. Все шприцы затем приводят в действие со скоростью потока 7 мл/мин с применением шприцевой помпы. Выходные отверстия трубок располагают так, чтобы собирать смеси в 20-мл стеклянную пробирку (при перемешивании). Мешалку убирают и раствор этанола/воды уравновешивают до комнатной температуры в течение 1 ч. 4 мл смеси загружают в 5-см3 шприц, который соединен с участком ФЭП системы трубок, и в другой 5-см3 шприц, соединенный с ФЭП системой трубок равной длины, загружают равное количество 100 мМ цитратного буфера (pH 6). Два шприца приводят в действие со скоростью потока 7 мл/мин с применением шприцевой помпы, и конечную смесь собирают в 20-мл стеклянную пробирку (при перемешивании). Затем смесь, собранную на второй стадии смешивания (липосомы), пропускают через мембрану Mustang Q (анионообменную подложку, которая связывает и удаляет анионные молекулы, полученные от Pall Corporation). Перед применением этой мембраны для липосом, 4 мл 1M NaOH, 4 мл 1M NaCl и 10 мл 100 мМ цитратного буфера (pH 6) последовательно пропускают через нее. Липосомы нагревают в течение 10 мин при 37°C, затем пропускают через мембрану. Затем липосомы концентрируют до 2 мл и диализируют против 10-15 объемов 1X ФРФБ с применением тангенциальной поточной фильтрации перед восстановлением конечного продукта. Систему TFF и фильтрационные мембраны типа полых волокон покупают у Spectrum Labs (Rancho Dominguez) и используют согласно инструкции производителя. Применяют полисульфоновые фильтрационные мембраны типа полых волокон с размером пор 100 кД в сечении и площадью поверхности 8 см2. Для in vitro и in vivo экспериментальные композиции разводят до требуемых концентраций РНК добавлением 1X ФРФБ.
Процент инкапсулированной РНК и концентрацию РНК определяют с помощью набора реагентов РНК Quant-iT RiboGreen (Invitrogen) в соответствии с инструкциями производителя. Рибосомный РНК стандарт, представленный в наборе, используют для получения стандартной кривой. Липосомы разводят 10× или 100× в 1X TE буфере (из набора) перед добавлением красителя. Отдельно липосомы разводят 10× или 100× в 1X TE буфере, содержащем 0,5% Triton X перед добавлением красителя (для разрушения липосом и для исследования общей РНК). Затем равное количество красителя добавляют в каждый раствор, и затем ≈180 мкл каждого раствора после добавления красителя загружают дважды в 96-луночный планшет для культивирования тканей. Флуоресценцию (Ex 485 нм, Em 528 нм) считывают на микропланшетном ридере. Все композиции липосом дозируют in vivo на основе инкапсулированного количества РНК.
Для получения меньших липосом способ шприца/трубки заменяют на способ, в котором растворы липида и РНК смешивают в каналах на микрожидкостном чипе. Готовят свежий липидный маточный раствор в этаноле. 37 мг DlinDMA, 11,8 мг ДСФХ, 27,8 мг холестерина и 8,07 мг ПЭГ-ДМГ взвешивают и растворяют в 7,55 мл этанола. Свежеприготовленный липидный маточный раствор осторожно встряхивают при 37°C в течение около 15 мин с получением гомогенной смеси. Затем 226,7 мкл маточного раствора добавляют к 1,773 мл этанола с получением рабочего липидного маточного раствора 2 мл. 4 мл рабочего раствора РНК также получают из маточного раствора ≈1 мкг/мл в 100 мМ цитратном буфере (pH 6). Четыре 20-мл стеклянных пробирки (с мешалками) промывают Away раствором РНКзы и промывают большим количеством воды MilliQ перед применением для удаления примесей из пробирок с РНКзами. Две пробирки применяют для рабочего раствора РНК (2 мл в каждой пробирке) и другие применяют для сбора смесей липида и РНК. Рабочие растворы липида и РНК нагревают при 37°C в течение 10 мин, затем загружают в 3-см3 шприцы Луер-лок. Шприцы, содержащие РНК и липиды, соединяют с соединением кристалла с подложкой Mitos Droplet (стеклянное микрожидкостное устройство от Syrris, Part no. 3000158) с применением ПТФЭ системы трубок ВД 0,03 дюйма×ВнД 1/16 дюйма, (Syrris) с применением 4-стороннего краевого соединителя. Два потока РНК и один поток липида запускают шприцевыми помпами, и смешивание этанола и водной фазы проводят в соединении X (100 мкм×105 мкм) чипа. Скорость потока всех трех потоков поддерживают на уровне 1,5 мл/мин, следовательно, соотношение общего водного к этанольному потоку составляет 2:1. Выход пробирки располагают так, чтобы собирать смеси в 20-мл стеклянную пробирку (при перемешивании). Мешалку убирают и этанольный/водный раствор уравновешивают до комнатной температуры в течение 1 ч. Затем смесь загружают в 3-см3 шприц, который подгоняют к участку ПТФЭ системы трубок ВД 0,03 дюйма×ВнД 1/16 дюйма, и в другой 3-см3 шприц с равной длиной ПТФЭ системы трубок загружают равный объем 100 мМ цитратного буфера (pH 6). Два шприца приводят в действие при скорости потока 3 мл/мин с применением шприцевой помпы, и конечную смесь собирают в 20-мл стеклянную пробирку (при перемешивании). Затем липосомы концентрируют до 2 мл и диализируют против 10-15 объемов 1X ФРФБ с применением TFF системы до восстановления конечного продукта. Используют фильтрационные мембраны типа полого волокна с размером пор в разрезе 100 кДа и площадью поверхности 20 см2. Для in vitro и in vivo экспериментов композиции разводят до требуемой концентрации РНК добавлением 1X ФРФБ. В то время как липосомы, полученные способом шприц/пробирка с 75 мкг РНК, имеют Z средний диаметр 148 нм и коэффициент полидисперсности 0,122, чиповое смешивание дает липосомы с Z средним диаметром 97 нм и коэффициентом полидисперсности 0,086. Доля инкапсулированных РНК незначительно снижается от 90% до 87%.
Было показано, что инкапсулирование в липосомы защищает РНК от переваривания РНКзы. В эксперименте применяют 3,8 мОП РНКзы A на микрограмм РНК, инкубируют в течение 30 мин при комнатной температуре. РНКзу инактивируют Протеиназой K при 55°C в течение 10 мин. 1:1 об./об. смесь образца к 25:24:1 об./об./об. фенол/хлороформ/изоамиловый спирт затем добавляют для экстрагирования РНК из липидов в водную фазу. Образцы смешивают встряхиванием в течение нескольких секунд и затем помещают на центрифугу на 15 мин при 12k об./мин. Водную фазу (содержащую РНК) удаляют и используют для анализа РНК. До загрузки (400 нг РНК на лунку) все образцы инкубируют с формальдегидным загрузочным красителем, денатурируют в течение 10 мин при 65°C и охлаждают до комнатной температуры. Маркеры Ambion Millennium используют для аппроксимации молекулярной массы РНК конструкта. Гель запускают при 90 В. Гель окрашивают с применением 0,1% SYBR золотого согласно инструкциям производителя в воде встряхиванием при комнатной температуре в течение 1 ч. На ФИГ. 1 показано, что РНКза полностью переваривает РНК при отсутствии инкапсулирования (линия 3). РНК не определяется после инкапсулирования (линия 4), и изменений не происходит, если эти липосомы обработаны РНКзой (линия 4). После того, как обработанные РНКзой липосомы подвергают экстрагированию из фенола, видна не переваренная РНК (линия 6). Даже через 1 неделю при 4°C РНК можно увидеть без фрагментации (ФИГ. 4, стрелка). Экспрессия белка in vivo не изменяется через 6 недель при 4°C и после одного цикла замораживания-оттаивания. Таким образом, инкапсулированная в липосому РНК является стабильной.
Для оценки in vivo экспрессии РНК фермент репортер (SEAP; секретированную щелочную фосфатазу) кодируют в репликоне, а не в иммуногене. Уровни экспрессии измеряют в сыворотке, разведенной 1:4 в буфере для разведения 1X Phospha-Light с применением хемилюминесцетного щелочного фосфатного субстрата. Мышам BALB/c возрастом 8-10 недель (5/группу) вводят внутримышечно на день 0 50 мкл в ногу с 0,1 мкг или 1 мкг дозы РНК. Тот же вектор также вводят без липосом (в не содержащем РНКзу 1X ФРФБ) в дозе 1 мкг. Также тестируют упакованные в вирион репликоны. Упакованные в вирион репликоны, применяемые здесь (обозначенные как "VRP"), получают способами из ссылки 41, где репликон альфавируса получают из мутантного VEEV или химеры, полученной из генома VEEV, сконструированной так, чтобы содержать 3' UTR вируса Синдбис и сигнал упаковки вируса Синдбис (PS), упакованный совместной электропорацией их в BHK клетки с дефектной РНК хелпера, кодирующей капсид и гликопротеиновые гены вируса Синдбис.
Как показано на ФИГ. 5, инкапсулирование повышает уровни SEAP на около ½ log при дозе 1 мкг, и на 6 день экспрессия из 0,1 мкг инкапсулированной дозы соответствует уровням, показанным для 1 мкг не инкапсулированной дозы. На 3 день уровни экспрессии превышают уровни, полученные с VRP (квадраты). Таким образом, экспрессия повышается, если РНК составлены в липосомах, по сравнению с голой контрольной РНК, даже при дозе в 10х меньше. Экспрессия также выше по сравнению с VRP контролем, но кинетика экспрессии была совсем другой (см. ФИГ. 5). Доставка РНК с электропорацией дает повышенную экспрессию по сравнению с голой контрольной РНК, но эти уровни были меньше, чем с липосомами.
Для оценки того, был ли эффект, показанный в липосомных группах, достигнут только благодаря липосомным компонентам или связан с инкапсулированием, репликон вводят в инкапсулированной форме (с двумя различными протоколами очистки, 0,1 мкг РНК) или в смеси с липосомами после их получения (не инкапсулированный "липоплекс", 0,1 мкг РНК) или в виде голой РНК (1 мкг). ФИГ. 10 показывает, что липоплекс дает самые низкие уровни экспрессии, что показывает существенность инкапсулирования для мощной экспрессии.
Другие эксперименты SEAP показали чистую реакцию на дозу in vivo, где экспрессия видна после доставки не более 1 нг РНК (ФИГ. 6). В других экспериментах сравнивали экспрессию из инкапсулированных и голых репликонов, показывая, что 0,01 мкг инкапсулированной РНК эквивалентны 1 мкг голой РНК. В дозе 0,5 мкг РНК инкапсулированный продукт дает 12-кратную экспрессию на 6 день; при 0,1 мкг дозы дает 24-кратную экспрессию на 6 день.
Кроме наблюдения средних уровней в группе, также изучали отдельных животных. В то время как несколько животных не реагировали на голые репликоны, инкапсулирование исключило отсутствие реакции.
В других экспериментах заменили DlinDMA на DOTAP ("RV13"). Хотя липосомы DOTAP вызывают лучшую экспрессию, чем голый репликон, они хуже, чем DlinDMA липосомы (2-3-кратная разница на 1 день).
Для оценки in vivo иммуногенности репликон создают так, чтобы он экспрессировал полный F белок из респираторно-синцитиального вируса (РСВ). Его доставляют голым (1 мкг), инкапсулированным в липосомы (0,1 или 1 мкг) или упакованным в вирионы (106 ИЕ; "VRP") в дни 0 и 21. На ФИГ. 7 показаны анти-F IgG титры через 2 недели после второй дозы, и липосомы четко улучшают иммуногенность. На ФИГ. 8 показаны титры через 2 недели, на этот момент нет статистической разницы между инкапсулированной РНК в дозе 0,1 мкг, инкапсулированной РНК в дозе 1 мкг и группой VRP. Нейтрализационные титры (измеренные как 60% снижение пятен, "PRNT60") не имели значительных отличий в этих трех группах через 2 недели после второй дозы (ФИГ. 9). На ФИГ. 12 показаны IgG и PRNT титры через 4 недели после второй дозы.
ФИГ. 13 подтверждает, что РНК вызывает надежную реакцию CD8 T-клеток.
В других экспериментах сравнивали F-специфические IgG титры у мышей, получающих VRP, 0,1 мкг инкапсулированной в липосомы РНК или 1 мкг инкапсулированной в липосомы РНК. Соотношения титров (VRP:липосома) в различные моменты времени после второй дозы были следующие:
Таким образом, инкапсулированные в липосомы РНК вызывают практически ту же магнитуду иммунной реакции, которая имеется при доставке с вирионом.
Другие эксперименты показали превосходные F-специфические IgG реакции при дозе 10 мкг, эквивалентные реакции при дозах 1 мкг и 0,1 мкг, и более низкие реакции при дозе 0,01 мкг. На ФИГ. 11 показаны IgG титры у мышей, получающих репликон в голой форме в 3 различных дозах, в липосомах в 4 различных дозах, или в виде VRP (106 ИЕ). Реакция, полученная с 1 г инкапсулированных в липосому РНК, была статистически незначимой (ANOVA) по сравнению с VRP, но более сильная реакция, полученная с 10 мкг инкапсулированной в липосому РНК, была статистически значимой (p<0,05) при сравнении с обеими этими группами.
Другое исследование подтвердило, что 0,1 мкг инкапсулированной в липосому РНК дают значительно более высокие анти-F IgG реакции (15 дней после второй дозы), чем 0,1 мкг доставленной ДНК, и даже является более иммуногенным, чем 20 мкг плазмид ДНК, кодирующий F антиген, доставленный электропорацией (Elgen™ DNA Delivery System, Inovio).
Другое исследование проводят на хлопковых хомяках (Sigmodon hispidis) вместо мышей. В дозе 1 мкг инкапсулирование в липосомы повышает F-специфические IgG титры в 8,3 раза по сравнению с голой РНК и повышает нетрализационные титры (измеренные как PRN T60) в 9,5 раз. Магнитуда реакции антитела была эквивалентна той, которую вызывает 5×l06 ИЕ VRP. Голая и инкапсулированная в липосому РНК способна защищать хлопковых хомяков от заражения РСВ (1×105 бляшкообразующих единиц), снижая вирусную нагрузку на легкие на, по крайней мере, 3,5 log. Инкапсулирование повышает восстановление на около 2 раз.
Исследование на больших животных проводят на домашнем скоте. Коров иммунизируют 66 мкг репликона, кодирующего полный белок репликона РСВ F в дни 0 и 21, в липосомах. Чистый ФРФБ используют в качестве отрицательного контроля, и лицензированную вакцину применяют в качестве положительного контроля ("треугольник 4" из Fort Dodge, содержащий убитые вирусы). На ФИГ. 14 показаны F-специфические IgG титры в течение 63 дней, начиная с первой иммунизации. Репликон РНК является иммуногенным у коров, хотя он дает меньшие титры, чем лицензированная вакцина. Все вакцинированные коровы показали F-специфические антитела после второй дозы, и титры являются стабильными в течение от 2 до 6 недель после второй дозы (и особенно подходят для РНК вакцины).
Инкапсулирование в липосомы с применение альтернативных катионных липидов
В качестве альтернативы применению DlinDMA, применяют катионные липиды из ссылки 8.
Липосомы, полученные выше с применением DlinDMA, обозначены здесь как ряд "RV01". DlinDMA заменяют различными катионными липидами в рядах "RV02"-"RV12", описанных ниже. Формируют два различных типа каждой липосомы с применением 2% ПЭГ2000-ДМГ с либо (01) 40% катионного липида, 10% ДСФХ и 48% холестерина, либо (02) 60% катионного липида и 38% холестерина. Таким образом, сравнение (01) и (02) липосом показывает действие нейтрального цвиттерионного липида.
RV02 липосомы получают с применением следующего катионного липида:
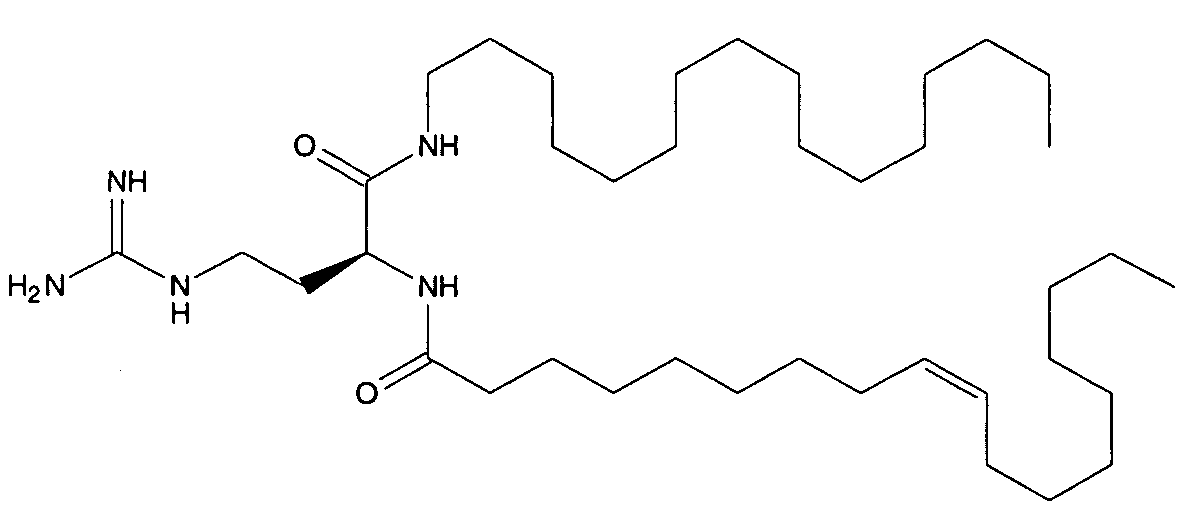
RV03 липосомы получают с применением следующего катионного липида:
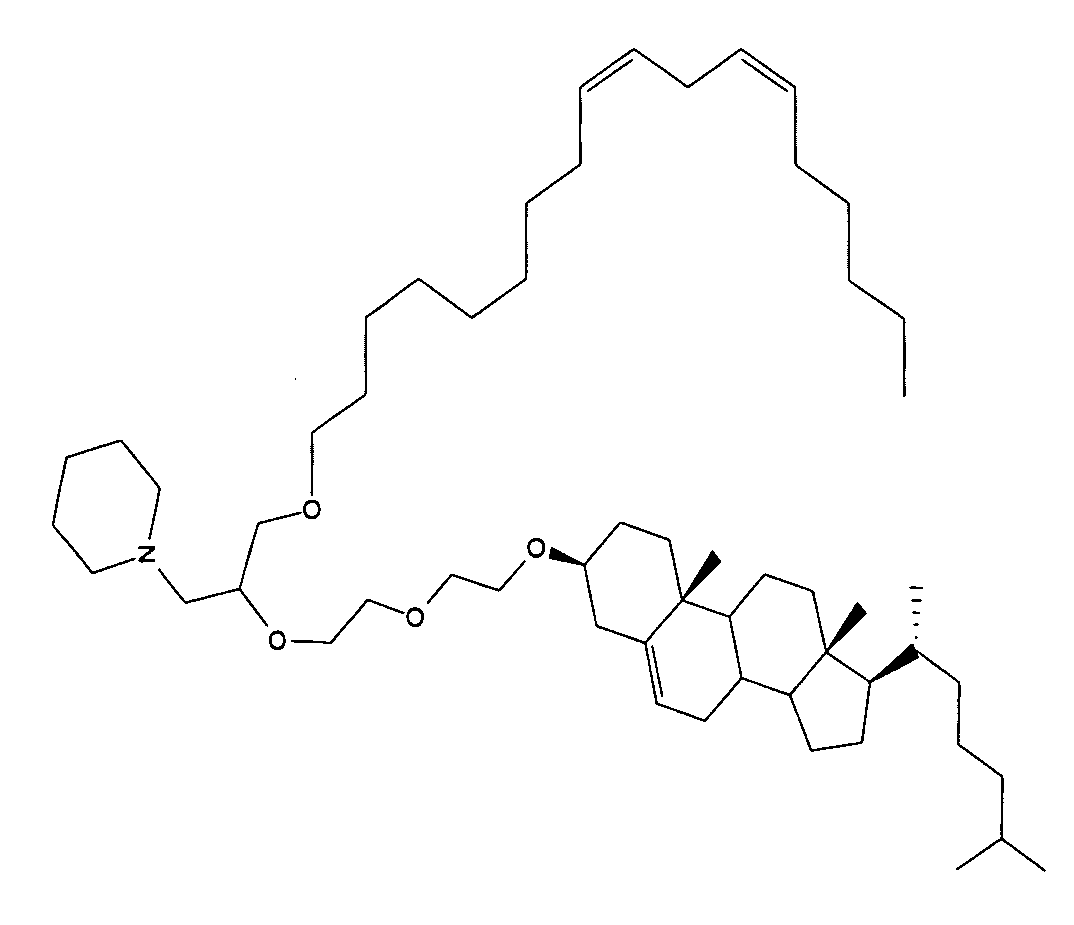
RV04 липосомы получают с применением следующего катионного липида:
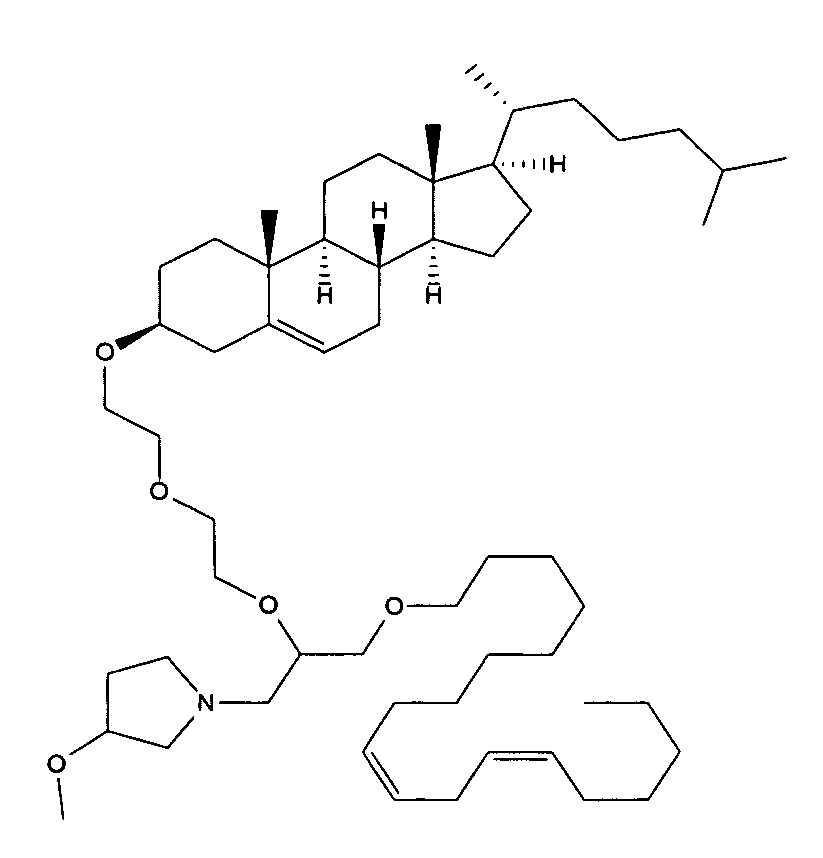
RV05 липосомы получают с применением следующего катионного липида:
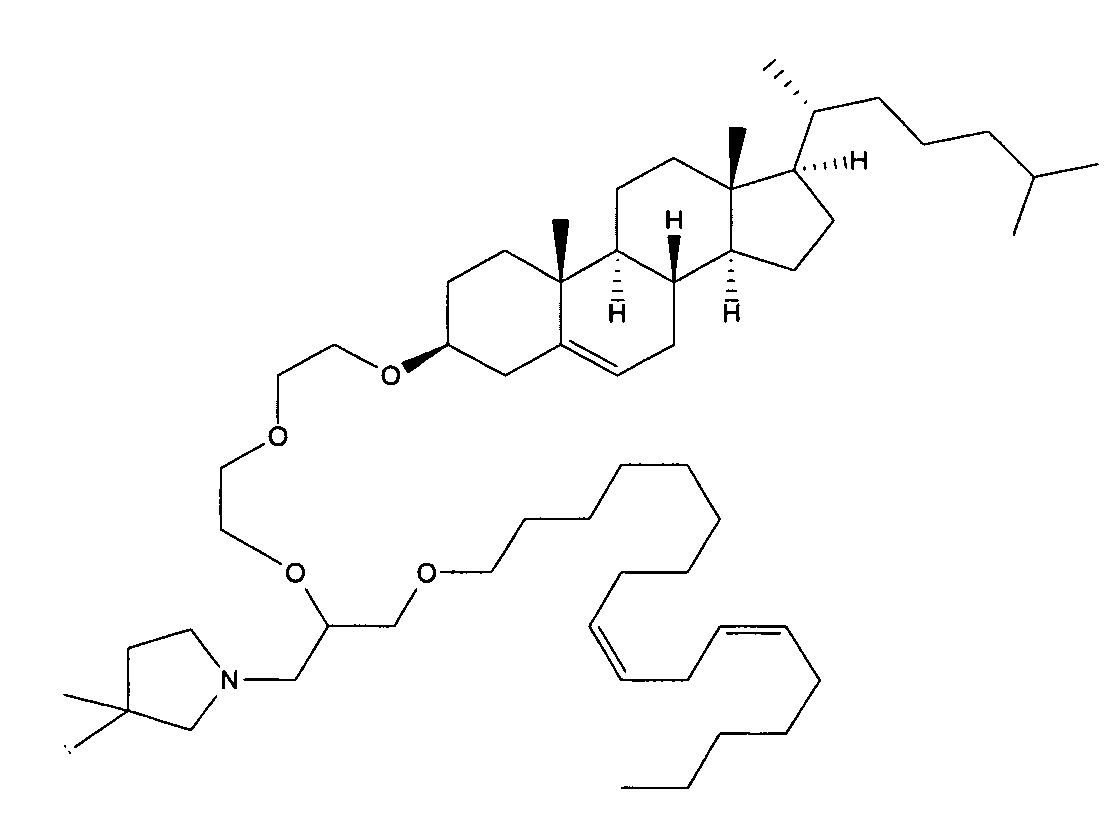
RV06 липосомы получают с применением следующего катионного липида:
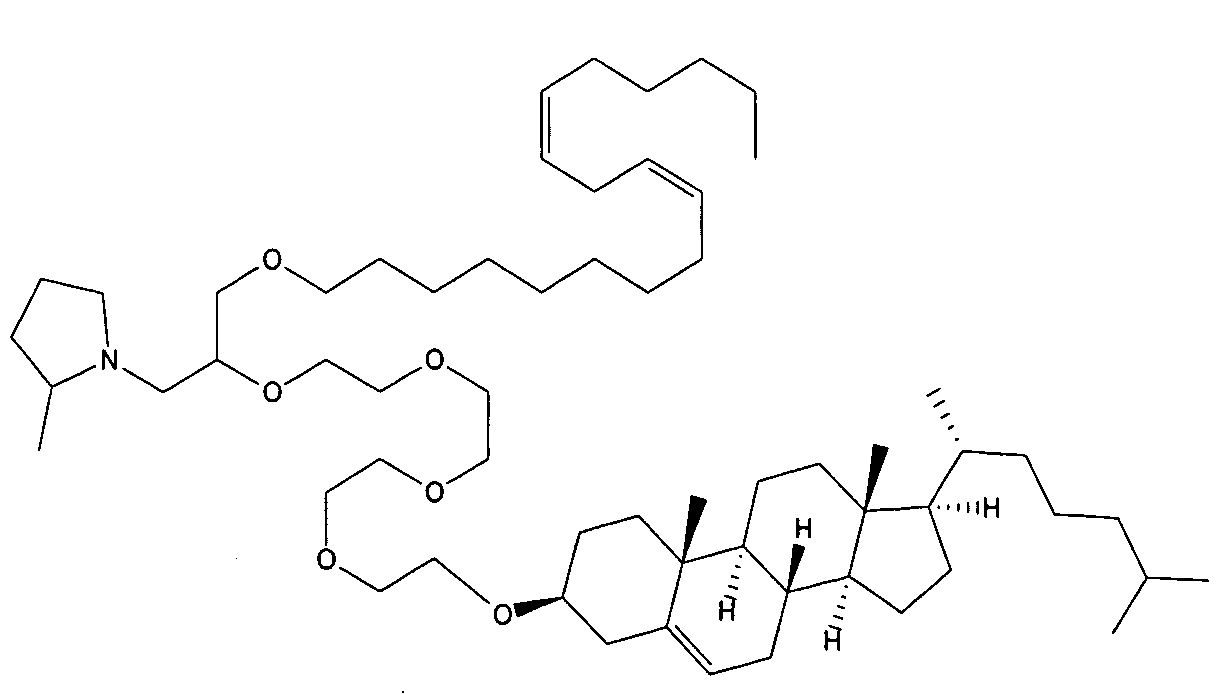
RV07 липосомы получают с применением следующего катионного липида:
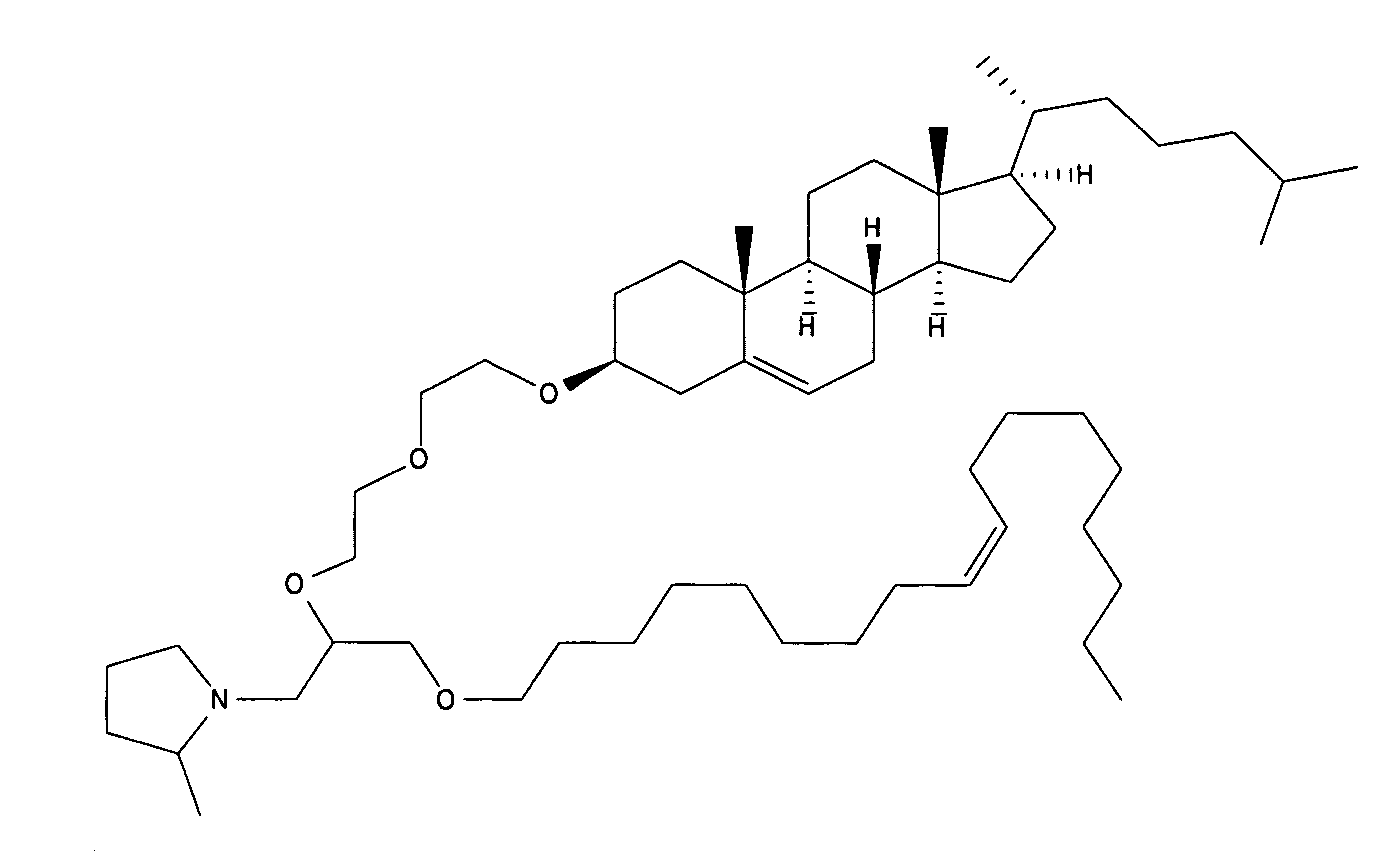
RV08 липосомы получают с применением следующего катионного липида:

RV09 липосомы получают с применением следующего катионного липида:
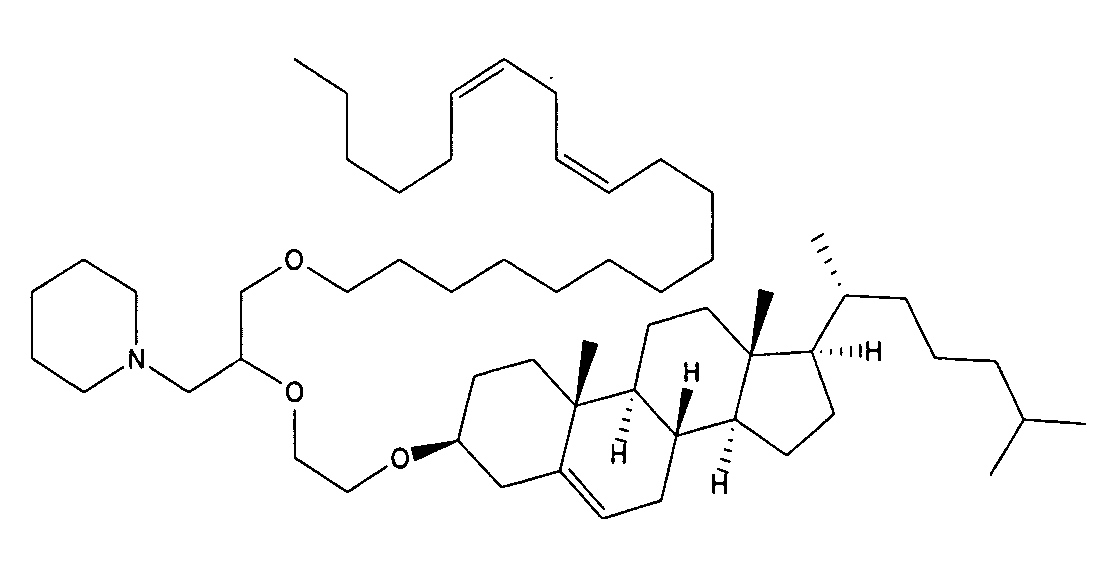
RV10 липосомы получают с применением следующего катионного липида:

RV11 липосомы получают с применением следующего катионного липида:

RV12 липосомы получают с применением следующего катионного липида:

RV13 липосомы получают с применением следующего катионного липида:
RV14 липосомы получают с применением следующего катионного липида:
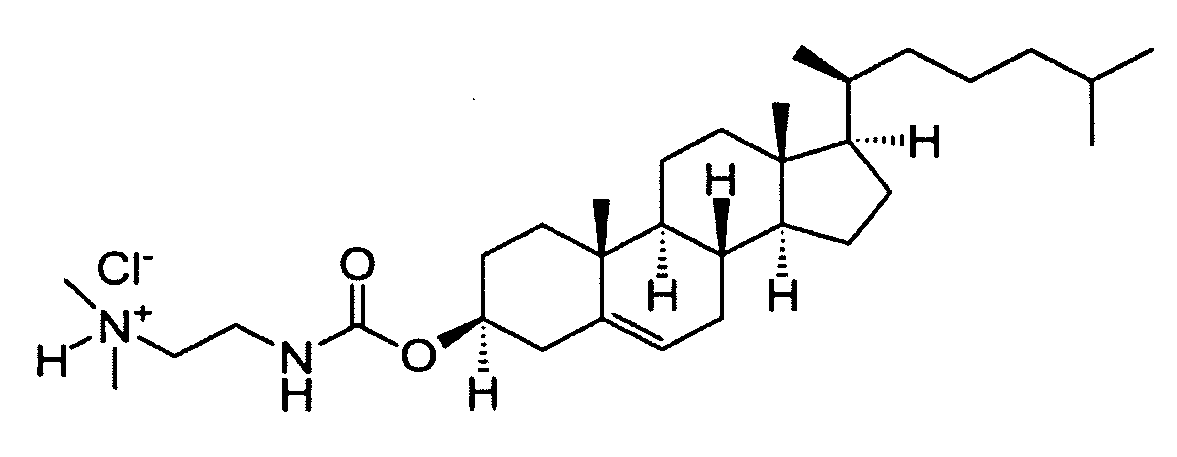
RV15 липосомы получают с применением следующего катионного липида:
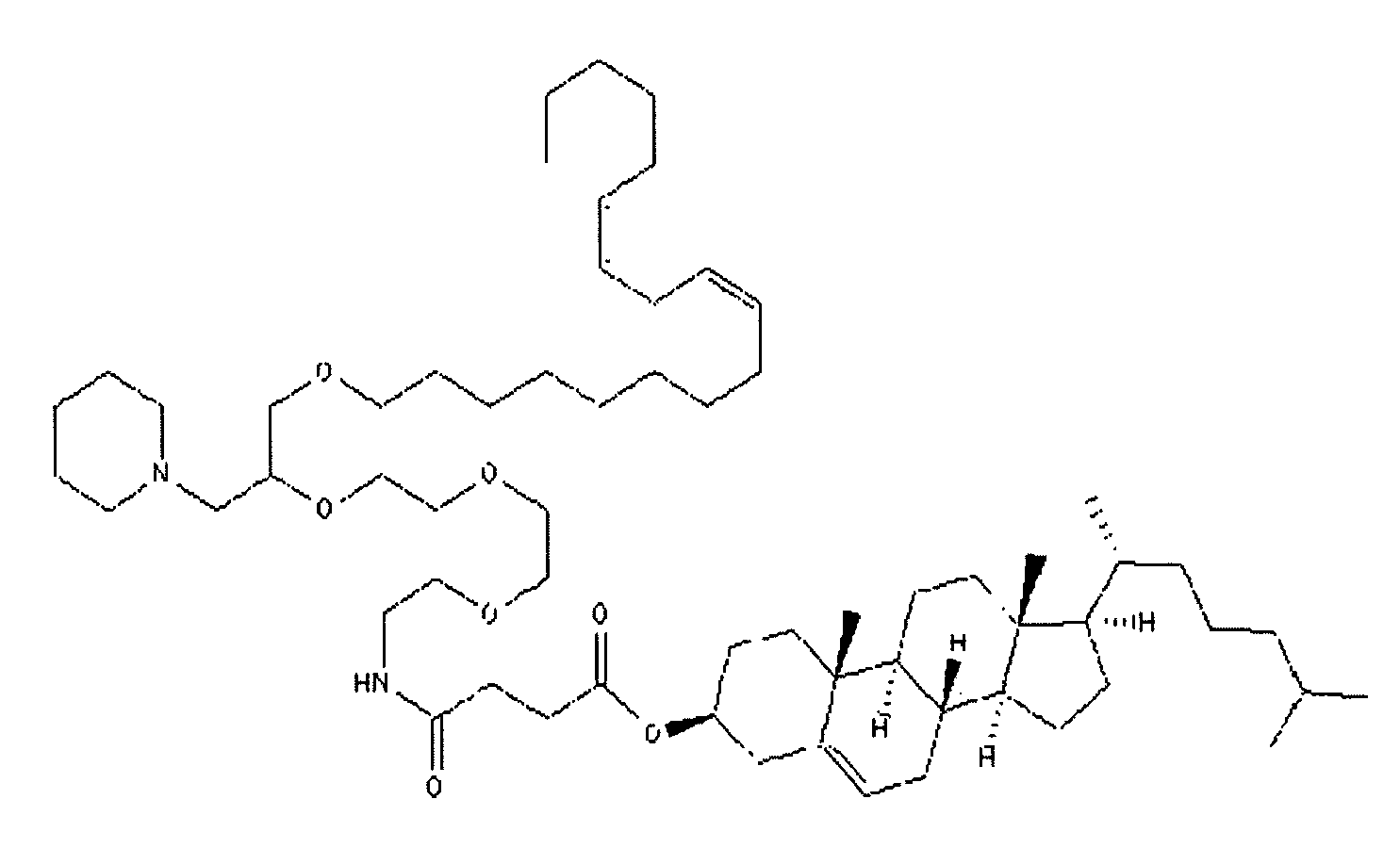
Эти липосомы тестируют с описанным выше репортером SEAP. В представленной ниже таблице показан размер липосом (Z средний и коэффициент полидисперсности), % инкапсулирования РНК в каждой липосоме, вместе с активностью SEAP, определенной на 1 и 6 дни после инъекции. SEAP активность дана относительно "RV01(02)" липосом, полученных из DlinDMA, холестерина и ПЭГ-ДМГ:
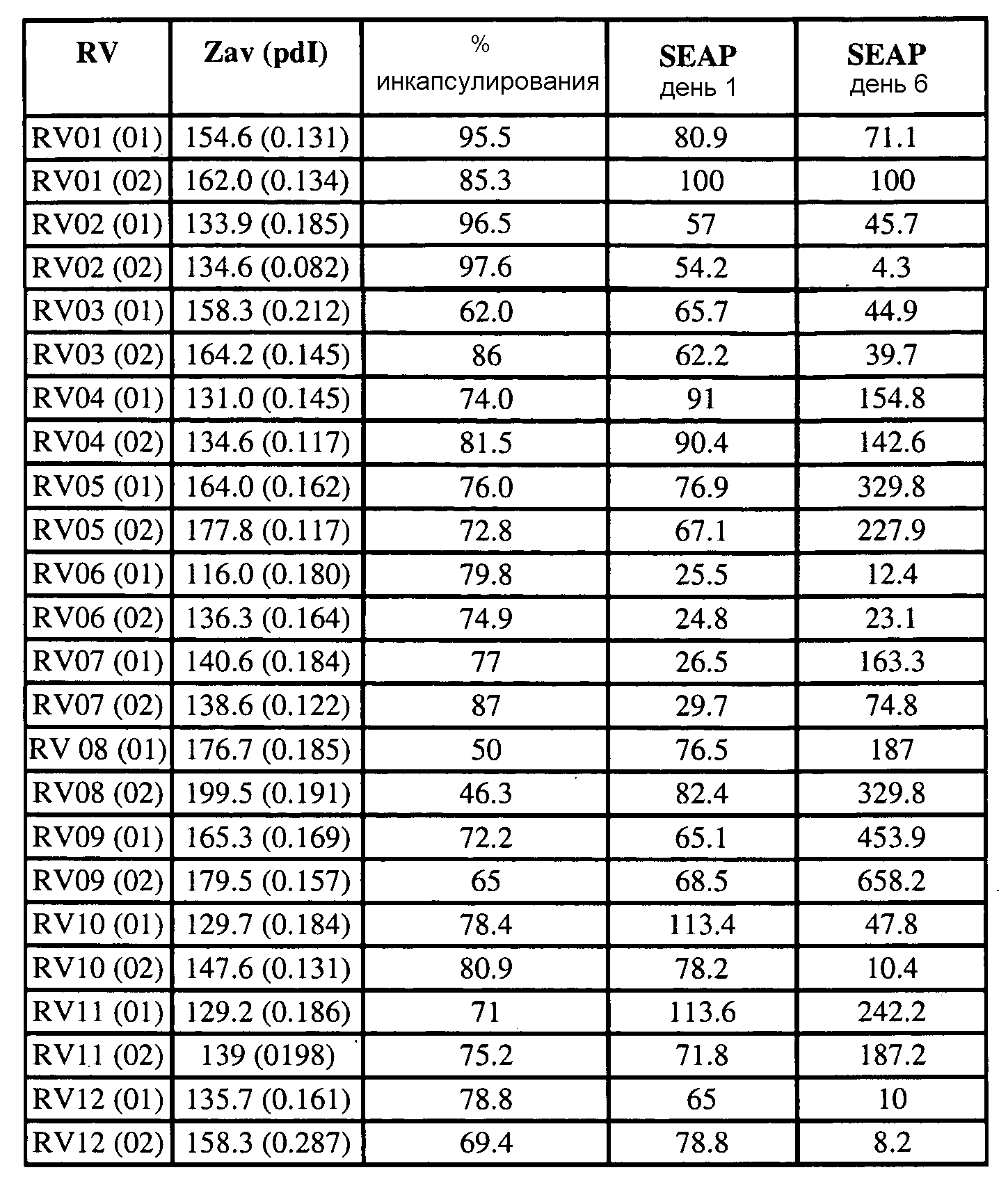
На ФИГ. 3 показаны уровни экспрессии SEAP на 6 день. Наилучшие результаты получены с RV04, RV05, RV07, RV08, RV09 и RV11.
Различные липосомы также применяют для доставки репликона, кодирующего полный РСВ F белок. В одном исследовании сравнивают RV01, RV05 и RV13; самые высокие F-специфические сывороточные IgG титры получены с RV01 и самые низкие с RV13. В другом исследовании сравнивают RV01, RV02, RV04 и RV07; самые высокие результаты снова показали RV01, RV07 показали плохие результаты. В другом исследовании сравнивают RV01, RV03, RV08, RV09 и RV14; самые высокие результаты снова показали RV01, RV03 и RV14 показали плохие результаты. В другом исследовании сравнивают RV01, RV10, RV11 и RV15; самые высокие результаты снова показали RV01. В целом, самые высокие результаты показали RV01, RV05, RV08 и RV09, а RV13 (DOTAP) и RV14 (DC-холестерин) показали плохие результаты.
Таким образом, не все липосомы были эффективны для вызова иммунной реакции. В общем было показано, что наилучшая иммунологическая эффективность была получена, когда катионные липиды в липосомах имели pKa в интервале от 5,0 до 7,6, и особенно, в интервале от 5,5 до 6,7, от 5,6 до 6,3, от 5,6 до 6,0 или от 5,7 до 5,9.
BHK экспрессия
Липосомы с различными липидами инкубируют с клетками BHK в течение ночи и оценивают силу экспрессии белка. От базового значения для липида RV05 экспрессия может быть увеличена 18x при добавлении 10% 1,2-дифитаноил-sn-глицеро-3-фосфоэтаноламина (DPyPE) к липосоме, или 10x при добавлении 10% 18:2 (цис) фосфатидилхолина. В общем, in vivo исследования показали, что ненасыщенные липидные хвосты имеют тенденцию улучшать IgG титры, повышающиеся против кодированных антигенов.
РСВ иммуногенность
vA317 самореплицирующийся репликон, кодирующий РСВ F белок, вводят мышам BALB/c, 4 или 8 животных на группу, двусторонней внутримышечной инъекцией (50 мкл в ногу) в 0 и 21 дни с чистым репликоном (1 мкг) или составленным в виде липосом с RV05 или (для сравнения) с RV01 или RV13. RV01 липосомы имеют 40% DlinDMA, 10% ДСФХ, 48% холестерина и 2% ПЭГ-ДМГ, но с различными количествами РНК. RV05 липосомы имеют либо 40% RV05, 10% ДСФХ, 48% холестерина и 2% ПЭГ-ДМГ, либо 60% RV05, 38% холестерина и 2% ПЭГ-ДМГ. RV13 липосомы имеют 40% DOTAP, 10% DOPE, 48% холестерина и 2% ПЭГ-ДМГ. Липосомы получают с применением различных методик. Для сравнения голый плазмид ДНК (20 мкг), экспрессирующий тот же РСВ-F антиген, доставляют либо с применением электропорации, либо с RV01(10) липосомами (0,1 мкг ДНК). Четыре мыши используют в качестве природной контрольной группы.
Z средний диаметр частиц и коэффициент полидисперсности:

Сыворотку собирают для анализа антител в 14, 36 и 49 дни. Селезенки собирают у мышей на 49 день для анализа Т-клеток.
F-специфические сывороточные IgG титры (GMT) были следующие:

Доли Т-клеток, которые были цитокин-положительными и специфическими к РСВ F51-66 пептиду были следующие, показаны только цифры, которые являются статистически значимыми выше нуля:

Таким образом, композиции липосом значительно улучшают иммуногенность относительно голой контрольной РНК, что определяется повышенными F-специфическими IgG титрами и частотами T-клеток. Плазмид ДНК, полученный с липосомами, или доставленный в голом состоянии с применением электропорации, были значительно менее иммуногенными, чем составленный с липосомой самореплицирующейся РНК.
РСВ иммуногенность у различных видов мышей
Репликон "vA142" кодирует полный дикий поверхностный белок (F) гликопротеин РСВ, но с удаленным слитым пептидом, и 3'-конец формируется рибозим-медиированным расщеплением. Его тестируют у трех различных видов мышей.
BALB/c мышам дают двустороннюю внутримышечную вакцинацию (50 мкл на ногу) на 0 и 22 день. Животных делят на 8 тестируемых групп (5 животных на группу) и природный контроль (2 животных):
Группа 1 получает голый репликон (1 мкг).
Группа 2 получает 1 мкг репликона, доставляемого в липосомах "RV01(37)" с 40% DlinDMA, 10% ДСФХ, 48% Хол, 2% ПЭГ-конъюгированного ДМГ.
Группа 3 получает то же, что группа 2, но с 0,1 мкг РНК.
Группа 4 получает 1 мкг репликона в "RV05(11)" липосомах (40% RV05 липида, 30% 18:2 PE (DLoPE, 28% холестерин, 2% ПЭГ-ДМГ).
Группа 5 получает 5 мкг РСВ-F подъединиц белка с добавлением гидроксида алюминия.
Группа 6 является природным контролем (2 животных).
Сыворотку собирают для анализа антител в 14, 35 и 49 дни. F-специфические сывороточные IgG GMT:
На 35 день F-специфические IgG1 и IgG2a титры (GMT) были следующие:
РСВ сыворотка, нейтрализующая титры антител на 35 и 49 дни, была следующей (данные включают 60% снижающие бляшки нейтрализационые титры для пулов 2-5 мышей, 1 пул на группу):
Селезенки собирают на 49 день для анализа Т-клеток. Средние частоты чистых F-специфических цитокин-положительных Т-клеток (CD4+ или CD8+) были следующие, показаны только цифры, которые являются статистически значимыми выше нуля (специфические для РСВ пептидов F51-66, F164-178, F309-323 для CD4+, или для пептидов F85-93 и F249-258 для CD8+):

C57BL/6 мышей иммунизируют так же, но 7 группа получает VRP (1×106 ИЕ), экспрессирующий полноразмерный поверхностный слитый гликопротеин дикого типа РСВ (делеция слитого пептида).
Сыворотку собирают для анализа антител в 14, 35 и 49 дни. F-специфические IgG титры (GMT):
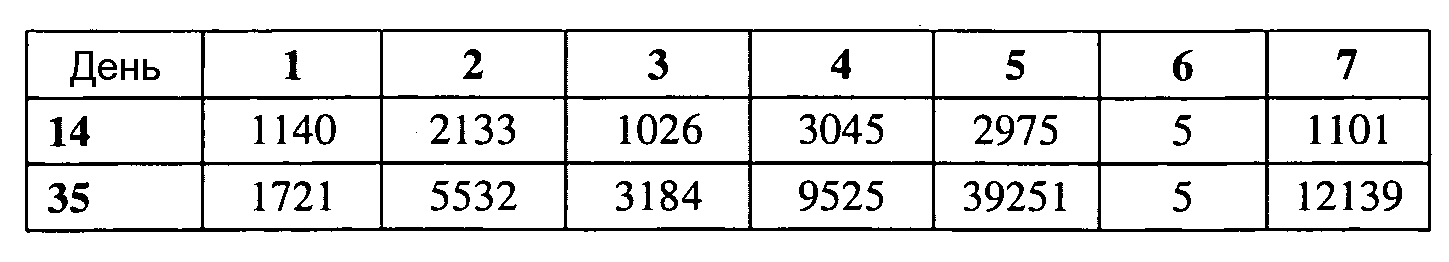
На 35 день F-специфические IgG1 и IgG2a титры (GMT) следующие:
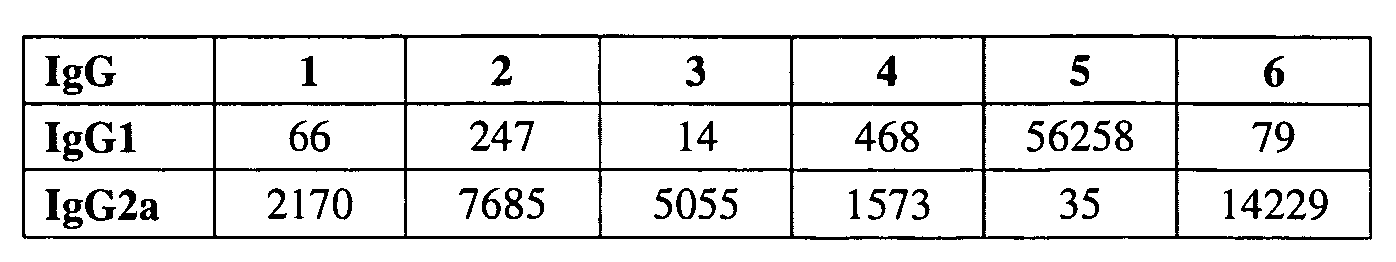
РСВ сыворотка, нейтрализующая титры антител на 35 и 49 дни, была следующей (данные включают 60% снижающие бляшки нейтрализационые титры для пулов 2-5 мышей, 1 пул на группу):
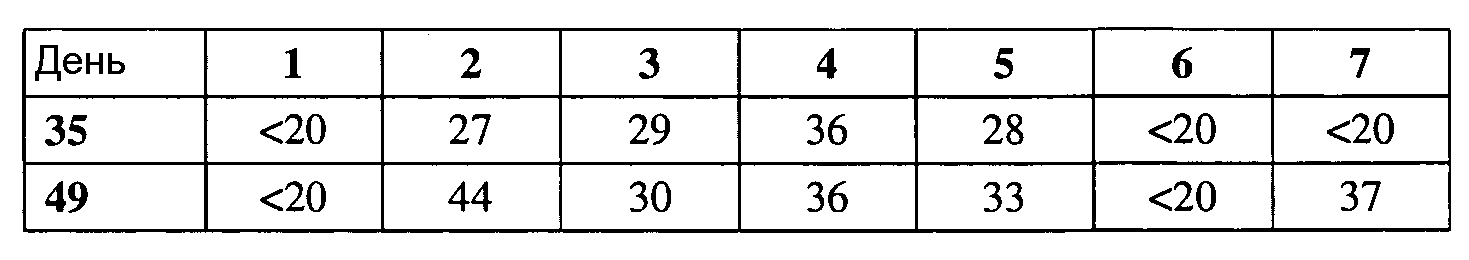
Селезенки собирают на 49 день для анализа Т-клеток. Средние частоты чистых F-специфических цитокин-положительных Т-клеток (CD8+) были следующие, показаны только цифры, которые являются статистически значимыми выше нуля (специфические для РСВ пептидов F85-93 и F249-258):

Девять групп мышей C3H/HeN иммунизируют так же. F-специфические IgG титры (GMT):
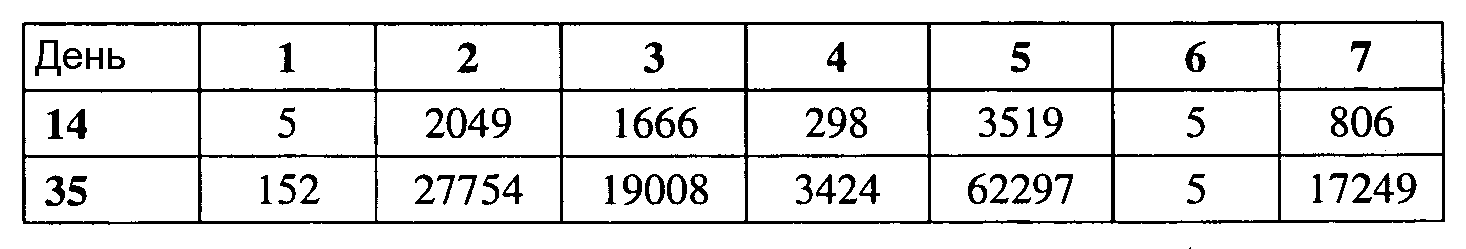
На 35 день F-специфические IgG1 и IgG2a титры (GMT) следующие:
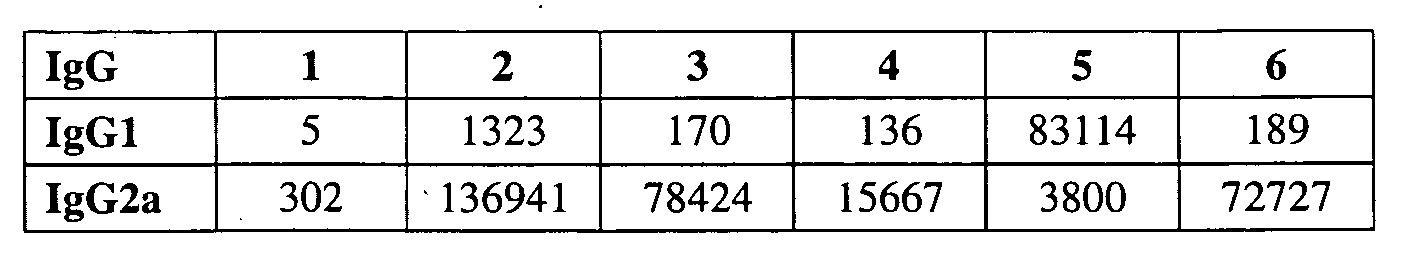
РСВ сыворотка, нейтрализующая титры антител на 35 и 49 дни, была следующей:

Таким образом различные липиды (RV01 & RV05; pKa 5,8 & 5,85) тестируют у трех различных инбредных видов мышей. Для видов BALB/c и C3H RV05 были менее эффективными, чем RV01, но они были более эффективными у вида B6. Во всех случаях, однако, липосомы были более эффективными, чем две катионные наноэмульсии, которые тестировали параллельно.
Хлопковые хомяки
vA142 репликон также тестируют на хлопковых хомяках с применением липосом, полученных из:
(a) 40% DlinDMA, 10% DPSC, 48% холестерина и 2% ПЭГ-ДМГ 2000.
(b) 40% RV05, 30% DLoPE (18:2 PE), 28% холестерина и 2% ПЭГ-ДМГ 2000.
Хлопковым хомякам, 4-8 животных на группу, делают внутримышечную вакцинацию (100 мкг в одну ногу) на 0 и 21 дни с:
Группа 1: самореплицирующаяся РНК (vA142, 0,1 мкг, РСВ-F), составленная в липосомах (a)
Группа 2: самореплицирующаяся РНК (vA142, 0,1 мкг, РСВ-F), составленная в липосомах (b)
Группа 3: самореплицирующаяся РНК (vA142, 1 мкг, РСВ-F), составленная в липосомах (a)
Группа 4: самореплицирующаяся РНК (vA142, 1 мкг, РСВ-F), составленная в липосомах (b)
Группа 5: VRP (1×106 ИЕ), экспрессирующие полноразмерный поверхностный F гликопротеин дикого типа РСВ
Группа 6: РСВ-F подъединица белковая вакцина (5 мкг) с добавлением гидроксида алюминия
Группа 7: природный контроль (3 животных)
Всех хлопковых хомяков (за исключением группы 7) вакцинируют 5 мкг F подъединицы + гидроксид алюминия на 49 день (четыре недели после второй вакцинации).
Сыворотку собирают для анализа антител на 0, 21, 35, 49, 64 дни.
F-специфические сывороточные IgG титры (GMT) следующие:

РСВ сывороточные нейтрализующие антитела титры следующие:

Этих хлопковых хомяков вакцинируют vA142 репликоном, составленным с RV01 или RV05, и репликон дают в двух дозах (1,0 и 0,1 мкг). После первой вакцинации репликона F-специфические сывороточные IgG титры были выше для RV01 по сравнению с RV05, но нейтрализационные титры были приблизительно равными. Титры во всех группах повышали гомологичной второй вакцинацией на 21 день. После второй вакцинации репликона F-специфические сывороточные IgG титры были снова выше для RV01 по сравнению с RV05, и РСВ нейтрализационные титры обычно имели ту же тенденцию.
Вакцинация белка на 49 день не повысила титры антител у хлопковых хомяков, которым ранее проводили вакцинацию белком, но значительно повысила титры у хлопковых хомяков, которых ранее вакцинировали РНК. Титры (общие, IgG и нейтрализационные) были выше на 64 день для RV05 по сравнению с применением RV01.
Различные катионные липиды с vA317 РСВ репликоном
В других экспериментах сравнивают четыре различных катионных белка (RV01, RV02, RV04 & RV07). Все липосомы содержат 2% ПЭГ-ДМГ 2000, но остальная композиция белка варьируется. Композиции и физические характеристики следующие:
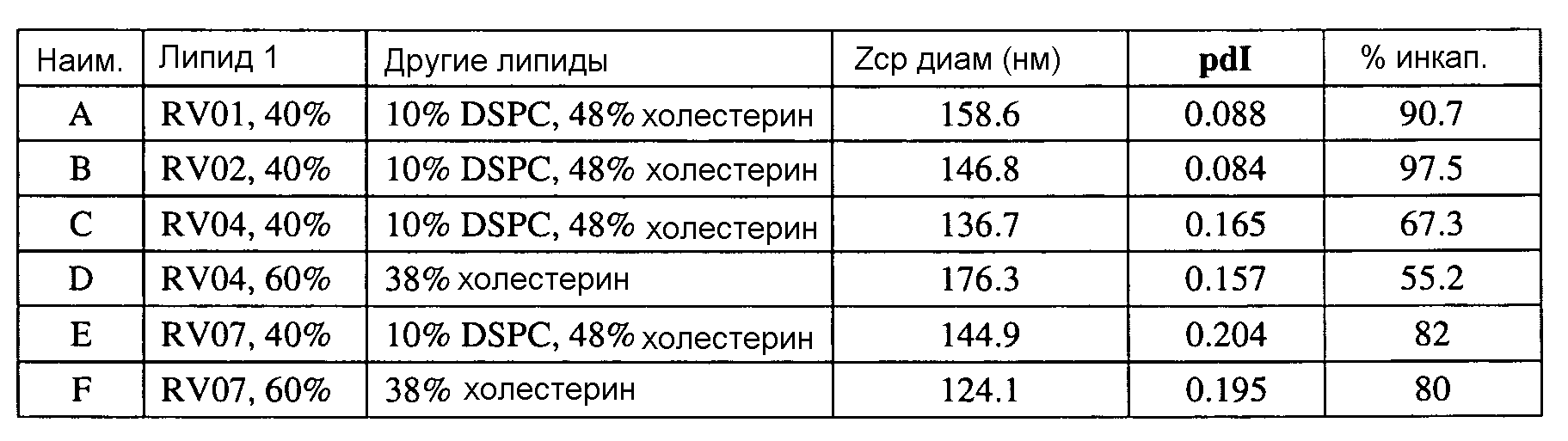
Для сравнения иммуногенности, HT, SUV и MLV липосомы также получают с RV01, используя те же компоненты в тех же пропорциях, но применяя методы производства, которые не могут быть масштабными (но быстрее). Коротко, получают этанольный маточный раствор, содержащий 37 мг/мл DLinDMA, 12 мг/мл ДСФХ, 28 мг/мл холестерина и 8 мг/мл ПЭГ-ДМГ 2000. 100 мкл маточного раствора разводят в 1 мл этанола. Липосомы готовят выпариванием этанольного раствора с применением роторного испарителя при 150 миллиТорр, давления в течение 30 мин при 50°C. Выпаривание остаточного этанола проводят помещением образцов на ночь в вакуум в лиофилизатор. Липидную пленку гидрируют и диспергируют добавлением 1,0 мл фильтрованной деионизированной воды и помещают при 50°C для получения полной суспензии липидов в MLV. Из MLV берут аликвоту и обрабатывают ультразвуком с применением зондового ультразвукового аппарата с импульсом 1 с в течение 5 мин при 100% мощности с получением SUV. Оба полученных раствора объединяют с репликоном РНК. HT липосомы получают с применением этанольного маточного раствора, содержащего 37 мг/мл DLinDMA, 12 мг/мл ДСФХ, 28 мг/мл холестерина и 8 мг/мл ПЭГ-ДМГ 2000. 100 мкл маточного раствора разводят до 400 мкл этанолом. Полученный этанольный раствор добавляют по каплям к 600 мкл 10 мМ цитратного буфера при pH 6,5, содержащего 40 мкг РНК при постоянном перемешивании. Полученный раствор диализируют в течение ночи с 4 л ФРФБ с применением 10000 MWCO диализной мембраны.
BALB/c мышам, 8 в группе, делают двусторонние внутримышечные вакцинации (50 мкл на ногу) на 0 и 21 дни голым репликоном (1 мкг) или 0,1 мкг инкапсулированной РНК. F-специфические сывороточные IgG титры (GMT) через 2 недели после этих двух инъекций были следующие:
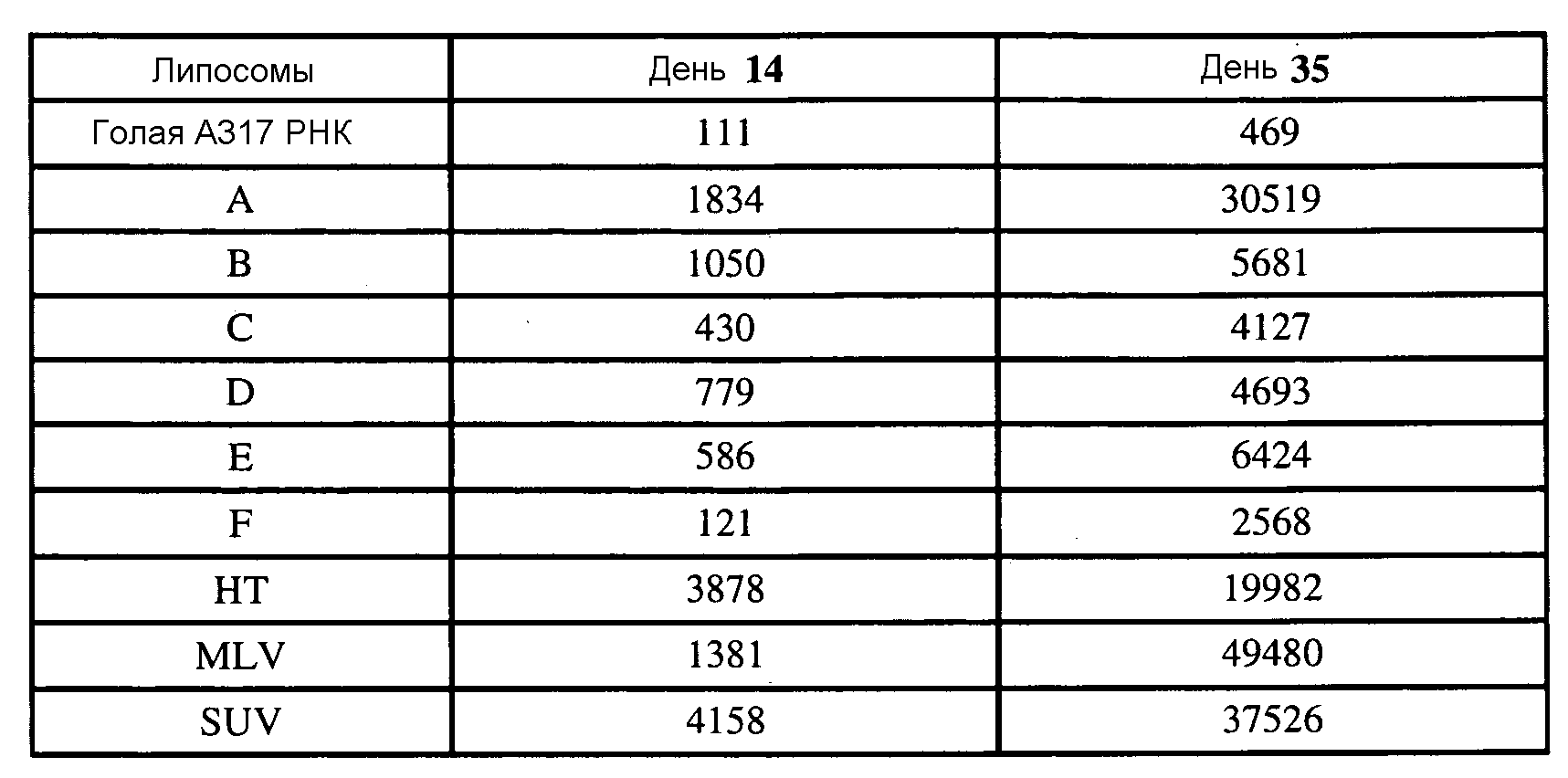
Для RV07 отсутствие ДСФХ вызывает значительное снижение иммуногенности.
Другие липиды (RV01, RV03, RV08, RV09, RV14) тестируют так же:


Липосома N (с DC-холестерин) показала плохой результат, даже ниже голой контрольной РНК. Наоборот, оставшиеся катионные липиды дают полезные результаты. Липосому O получают другим методом смешивания (микрожидкостный чип) из липосомы G, и эти меньшие липосомы дают лучшие результаты при приблизительно таком же инкапсулировании.
Другие липиды (RV01, RV10, RV11, RV15) тестируют так же:


За исключением липосомы Q каждая из этих липосом более эффективна, чем контроль. RV10 липид в липосоме Q имеет pKa 7,86, который оказался слишком высоким для того, чтобы быть полезным in vivo. Даже в пределах полезных pKa от 5,0 до 7,6, однако, хотя результаты и являются хорошими, ни один из липидов с одним алкильным хвостом и одним стероид-содержащим хвостом не является таким же эффективным, как RV01.
Другие липосомы получают с RV05. Все липосомы содержат 40% RV05 и 2% ПЭГилированного липида, но остальные компоненты варьируются (хотя холестерин всегда включен). Физические характеристики следующие:

BALB/c мышей тестируют, как описано выше:
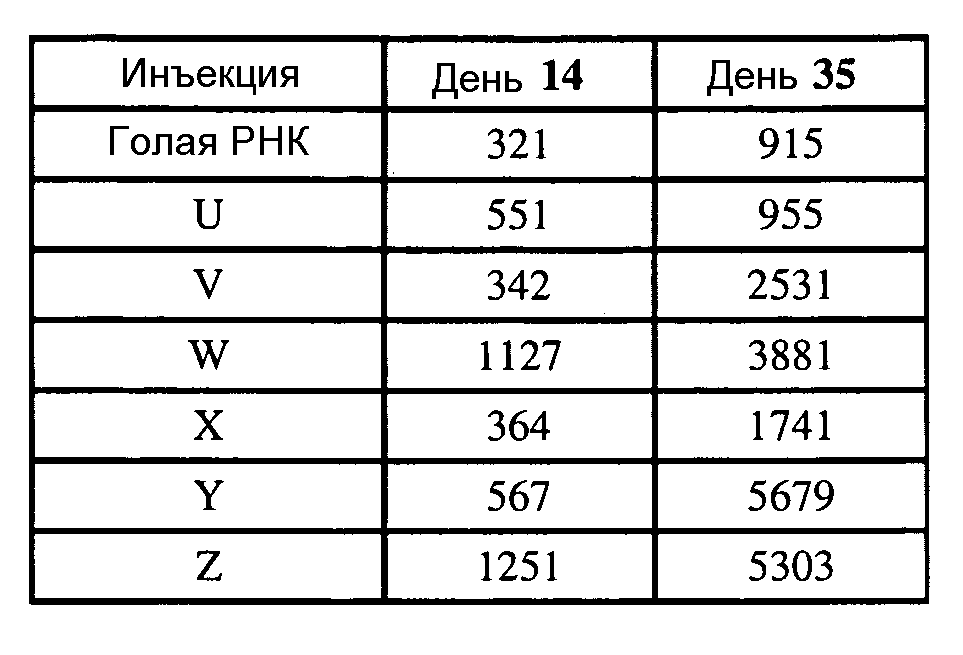
Для катионного липида с асимметричными липидными хвостами (алкил + холестерин) изменение нейтрального липида от ДСФХ (насыщенный C18 липидный хвост) до 18:2 или 18:3 PC (с 2 и 3 ненасыщенными двойными связями на хвост) повышает общие IgG титры. Сравнимые результаты получают при замене ДСФХ на DPyPE.
В последнем эксперименте с RV05 липидом липосому получают с 40% RV05, 10% 18:2 PC, 40% DPyPE, 8% холестерином и 2% ПЭГ-ДМГ 2000. Эти липосомы имеют Zср диаметр 124,7 нм, pdI 0,17 и РНК инкапсулирование 61,5%. Их применяют для вакцинации BALB/c мышей, как описано выше (0,1 мкг РНК доза), по сравнению с голой РНК (1 мкг) или с основанными на RV01 липосомами (40% DlinDMA, 10% DPSC, 48% холестерин, 2% ПЭГ-ДМГ 2000). F-специфические сывороточные IgG титры (GMT) следующие:

Таким образом, RV05 липосомы являются более иммуногенными, чем голая РНК, но менее иммуногенными, чем RV01 липосомы.
Селезенки собирают на 49 день для анализа Т-клеток. Средние частоты чистых F-специфических цитокин-положительных Т-клеток (CD4+ или CD8+) были следующие, показаны только цифры, которые являются статистически значимыми выше нуля (специфические для РСВ пептидов F51-66, F164-178, F309-323 для CD4+, или для пептидов F85-93 и F249-258 для CD8+):

Относительно реакции Т-клеток RV05 дает лучшие результаты по сравнению с RV01.
Понятно, что данное изобретение описано только примерами, и модификации могут быть сделаны, не выходя за объем и суть данного изобретения.
ССЫЛКИ
[I] Johanning et al. (1995) Nucleic Acids Res 23: 1495-1501.
[2] Heyes et al. (2005) J Controlled Release 107:276-87.
[3] WO2005/121348.
[4] Liposomes: Methods and Protocols, Volume 1: Pharmaceutical Nanocarriers: Methods and Protocols, (ed. Weissig). Humana Press, 2009. ISBN 160327359X.
[5] Liposome Technology, volumes I, II & III. (ed. Gregoriadis). Informa Healthcare, 2006.
[6] Functional Polymer Colloids and Microparticles volume 4 (Microspheres, microcapsules & liposomes), (eds. Arshady & Guyot). Citus Books, 2002.
[7] Jeffs et al. (2005) Pharmaceutical Research 22 (3):362-372.
[8] WO2011/076807.
[9] Tarwadi et al. (2008) Bioconjugate Chem. 19:940-950.
[10] WO2005/113782.
[I I] WO2011/005799.
[12] El Ouahabi et al. (1996) FEBS Letts 380:108-12.
[13] Giuliani et al. (2006) Proc Natl Acad Sci USA 103(29):10834-9.
[14] WO2009/016515.
[15] WO02/34771.
[16] WO2005/032582.
[17] WO2010/119343.
[18] WO2006/110413.
[19] WO2005/111066.
[20] WO2005/002619.
[21] WO2006/138004.
[22] WO2009/109860.
[23] WO02/02606.
[24] WO03/018054.
[25] WO2006/091517.
[26] WO2008/020330.
[27] WO2006/089264.
[28] WO2009/104092.
[29] WO2009/031043.
[30] WO2007/049155.
[31] Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th edition, ISBN: 0683306472.
[32] Methods In Enzymology (S. Colowick and N. Kaplan, eds., Academic Press, Inc.).
[33] Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell, eds, 1986, Blackwell Scientific Publications).
[34] Sambrook et al. (2001) Molecular Cloning: A Laboratory Manual, 3rd edition (Cold Spring Harbor Laboratory Press).
[35] Handbook of Surface and Colloidal Chemistry (Birdi, K.S. ed., CRC Press, 1997).
[36] Ausubel et al. (eds) (2002) Short protocols in molecular biology, 5th edition (Current Protocols).
[37] Molecular Biology Techniques: An Intensive Laboratory Course, (Ream et al, eds., 1998, Academic Press).
[38] PCR (Introduction to Biotechniques Series), 2nd ed. (Newton & Graham eds., 1997, Springer Verlag).
[39] Yoneyama & Fujita (2007) Cytokine & Growth Factor Reviews 18:545-51.
[40] Maurer et al. (2001) Biophysical Journal, 80:2310-2326.
[41] Perri et al. (2003) J Virol 77:10394-10403.
Реферат
Изобретения относятся к области биохимии. Описана группа изобретений, включающая липосому для доставки РНК для экспрессии, в которую инкапсулирована РНК, кодирующая целевой полипептид, фармацевтическую композицию для повышения иммунной реакции у позвоночного, содержащая вышеуказанную липосому, способ повышения защитной иммунной реакции у позвоночного. Изобретение расширяет арсенал средств доставки РНК. 3 н. и 8 з.п. ф-лы, 14 ил., 31 табл.,8 пр.
Формула

где
R1 и R2 вместе с атомом азота, к которому они присоединены, образуют необязательно замещенную C3-20-гетероциклоалкильную, C3-20-гетероциклоалкенильную, C3-20-гетероциклоалкинильную или C5-20-гетероарильную группу;
a отсутствует или является C1-4алкиленом, который может быть необязательно замещенным;
b отсутствует или является C1-4алкиленом, который может быть необязательно замещенным;
c отсутствует или является C1-4алкиленом, который может быть необязательно замещенным;
X1 является O или S;
X2 является O или S;
Y1 является C10-30алкенилом, C10-30алкинилом, C10-30гетероалкенилом или C10-30гетероалкинилом, который может быть необязательно замещенным;
L отсутствует или является -(La)d-(Lb)e-(Lc)f-, где
La является C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом, который может быть необязательно замещенным;
Lb является C6-14ариленом или C5-13гетероариленом, который может быть необязательно замещенным;
Lc является C1-15алкиленом, C1-15алкениленом, C1-15алкиниленом, C1-15гетероалкиленом, C1-15гетероалкениленом или C1-15гетероалкиниленом, который может быть необязательно замещенным;
d равно 0 или 1;
e равно 0 или 1; и
f равно 0 или 1; и
Y2 является стероидом, который может быть необязательно замещенным.
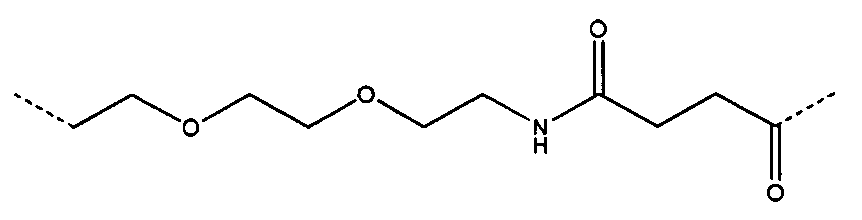
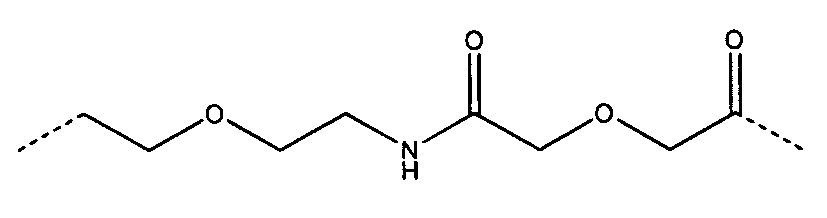




Комментарии