Средство для лечения фиброза кишечника - RU2637372C2
Код документа: RU2637372C2
Чертежи




Описание
Область изобретения
Настоящее изобретение относится к носителю для доставки вещества, нацеленного на клетки, продуцирующие внеклеточный матрикс в кишечнике, и композиции для лечения фиброза кишечника и способу лечения фиброза кишечника с использованием указанного носителя. Кроме того, настоящее изобретение также относится к полученной линии клеток фиброзного кишечника, продуцирующих внеклеточный матрикс, способу ее получения, способу с использованием линии клеток для скрининга лекарственного средства для лечения фиброза кишечника и набору, содержащему линию клеток, для скрининга лекарственного средства для лечения фиброза кишечника.
Уровень техники
Фиброз кишечника представляет собой патологическое состояние, характеризуемое избыточным отложением рубцовой ткани на стенке кишечника, и сопровождается хроническим воспалением кишечника, таким как, например, хроническая воспалительная болезнь кишечника (IBD) или повреждение ткани вследствие облучения (Непатентная литература 1). Воспалительные болезни кишечника включают болезнь Крона и язвенный колит; например, при болезни Крона фиброз кишечника происходит у приблизительно 25%-30% пациентов. Фиброз кишечника образует стриктуру кишечника, когда он прогрессирует, делает затруднительным прохождение пищи через него, и становится важной причиной нарушения QOL больного субъекта. Однако механизм фиброза кишечника еще не выяснен, и по этой причине в настоящее время не установлено определенной терапии.
Общепринятое лечение фиброза кишечника сфокусировано на лечении причинного воспаления; применяются разнообразные противовоспалительные средства, например лекарственное средство на основе аминосалициловой кислоты, такое как сульфосалазин, мезаламин, алсалазин или балсалазид, кортикостероидное лекарственное средство, такое как преднизолон или будесонид, иммуносупрессорное средство, такое как азатиоприн, меркаптопурин, циклоспорин или метотрексат, ингибитор TNFα, такой как инфликсимаб и, кроме того, антибиотик, такой как метронидазол или Ципроксан. Однако эти противовоспалительные средства не излечивают фиброз непосредственно, и при серьезном фиброзе кишечника становится необходимым хирургическим путем удалять фиброзную ткань, что возлагает огромную нагрузку на пациента.
В свете таких обстоятельств за последние годы было сделано несколько попыток непосредственно лечить фиброз кишечника. В результате сообщалось, что лекарственный препарат, такой как, например, вакцина TGFβ1 (Непатентная литература 2), пентоксифиллин или его метаболит (Непатентная литература 3), ингибитор фосфодиэстеразы 4 (Непатентная литература 4), ингибитор HMG-CoA редуктазы (Непатентная литература 5), дайкенчуто (Непатентная литература 6), правастатин (Непатентная литература 7), аналог липоксина A4 (Патентная литература 1) или ингибитор трансферазы сульфатной группы (Патентная литература 2) проявляли некоторую степень успеха при лечении фиброза кишечника у животной модели и т.д. Однако ни один из этих лекарственных препаратов не является удовлетворительным, и необходима дальнейшая разработка средств для лечения фиброза кишечника.
Список цитирования
Патентная литература
[Патентная литература 1] WO 2008/022807
[Патентная литература 2] WO 2009/084232
[Патентная литература 3] WO 2006/068232
[Патентная литература 4] WO 2009/036368
[Патентная литература 5] WO 2010/014117
[Патентная литература 6] WO 2009/116257
[Патентная литература 7] WO 2010/026766
Непатентная литература
[Непатентная литература 1] Rieder и Fiocchi, Nat Rev Gastroenterol Hepatol. 2009 Apr; 6(4):228-35
[Непатентная литература 2] Ma et al., Inflamm Bowel Dis. 2010 Jun; 16(6):1040-50
[Непатентная литература 3] Peterson et al., Eur J Pharmacol. 2011 Jul 15; 662(1-3):47-54
[Непатентная литература 4] Videla et al., J Pharmacol Exp Ther. 2006 Feb; 316(2):940-5
[Непатентная литература 5] http://www.ncbi.nlm.nih.gov/pubmed/21909991
[Непатентная литература 6] Inoue et al., Biol Pharm Bull. 2011; 34(11):1659-65
[Непатентная литература 7] Haydont et al., Clin Cancer Res. 2007 Sep 15; 13(18 Pt 1):5331-40
Краткое содержание сущности изобретения
Техническая задача
Задачей настоящего изобретения является обеспечение носителя, который может доставлять вещество, такое как лекарственное средство, конкретно к клеткам, продуцирующим внеклеточный матрикс в кишечнике, средство для лечения фиброза кишечника и способ лечения фиброза кишечника с использованием указанного носителя.
Решение задачи
Авторы настоящего изобретения достигли успеха при выделении клеток, продуцирующих внеклеточный матрикс из фиброзной ткани кишечника во время исследования нового средства для лечения фиброза кишечника и, кроме того, обнаружили, что носитель, который включает ретиноид в качестве нацеливающего средства, доставляет ингибитор продуцирования внеклеточного матрикса к указанным клеткам с высокой эффективностью и заметно ингибирует экспрессию молекулы, вовлеченной в продуцирование внеклеточного матрикса, и создание настоящего изобретения было, таким образом, завершено.
Известно, что носитель, который включает витамин А, может доставлять лекарственное средство к печеночным звездчатым клеткам (Патентная литература 3, Патентная литература 4) или линии печеночных звездчатых клеток (Патентная литература 3, Патентная литература 5), или клеткам, продуцирующим внеклеточный матрикс в легких (Патентная литература 6) и костном мозге (Патентная литература 7), и то, что композиция, в которой siPHK для HSP47 осуществляют на указанном выше носителе, может улучшить состояние печеночного фиброза (Патентная литература 3), фиброза легких (Патентная литература 6) и миелофиброза (Патентная литература 7), но любая взаимосвязь с клетками, продуцирующими внеклеточный матрикс в кишечнике, или фиброзом кишечника до сих пор полностью не известна.
То есть настоящее изобретение относится к следующему:
(1) Носителю для доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике, содержащему ретиноид в качестве нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике.
(2) Носителю в соответствии с п. (1), указанным выше, где ретиноид включает ретинол.
(3) Носителю в соответствии с п. (1) или п. (2), указанными выше, где он включает ретиноид и компонент носителя, отличный от ретиноида, молярное отношение ретиноида к компоненту носителя, отличному от ретиноида, составляет 8:1-1:4.
(4) Фармацевтической композиции для лечения фиброза кишечника, содержащей носитель в соответствии с любым из пп. (1)-(3), указанных выше, и лекарственному средству для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике.
(5) Фармацевтической композиции для регенерации нормальной ткани кишечника из фиброзной ткани кишечника, композиции, содержащей носитель в соответствии с любым из пп. (1)-(3), указанных выше, и лекарственному средству для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике.
(6) Фармацевтической композиции в соответствии с п. (4) или п. (5), указанным выше, где лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, выбирают из группы, состоящей из вещества для ингибирования продуцирования и секреции компонента внеклеточного матрикса, ингибитора роста клеток, апоптоз-индуцирующего вещества, ингибитора ΉΜΡ и ингибитора α1-антитрипсина.
(7) Фармацевтической композиции в соответствии с п. (6), указанным выше, где вещество для ингибирования продуцирования и секреции компонента внеклеточного матрикса представляет собой ингибитор HSP47.
(8) Фармацевтической композиции в соответствии с любым из пп. (4)-(7), указанных выше, где она находится в форме, полученной в момент применения.
(9) Набору для получения фармацевтической композиции в соответствии с любым из пп. (4)-(8), указанных выше, набору, содержащему один или несколько контейнеров, которые содержат либо по отдельности, или в комбинации лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, ретиноид и, при необходимости, компонент носителя, отличный от ретиноида.
(10) Способу получения носителя для доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике, включающему в себя стадию получения ретиноида в виде нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике.
(11) Способу получения фармацевтической композиции для лечения фиброза кишечника или фармацевтической композиции для регенерации нормальной ткани кишечника из фиброзной ткани кишечника, включающему в себя стадию получения ретиноида в виде нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике, и лекарственного средства для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике в качестве активного ингредиента.
(12) Линии клеток кишечника, продуцирующих внеклеточный матрикс, получаемой из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника, и имеющей виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип.
(13) Способу выделения клеток, продуцирующих внеклеточный матрикс кишечника, включающему в себя
(i) стадию получения клеток из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника, и
(ii) стадию селекции клеток, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип из клеток, полученных на (i).
(14) Способу получения линии клеток кишечника, продуцирующих внеклеточный матрикс, включающему в себя
(i) стадию получения клеток из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника, и
(ii) стадию селекции клеток, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип из клеток, полученных на (i),
способу, также включающему в себя стадию иммортализации клеток после стадии (i) или (ii).
(15) Способу скрининга фактора для лечения фиброза кишечника, включающему в себя
(i) стадию получения клеточной линии в соответствии с п. (12), указанным выше, для сосуществования с тестируемым фактором, и
(ii) стадию обнаружения изменения клеточной линии вследствие сосуществования с тестируемым фактором.
(16) Набору для скрининга фактора для лечения фиброза кишечника, содержащему линию клеток в соответствии с п. (12), указанным выше.
Преимущественные эффекты изобретения
В то время как точный механизм действия композиции для лечения фиброза кишечника по настоящему изобретению еще полностью не выяснен, полагают, что ретиноид функционирует как средство, которое нацелено на клетки, продуцирующие внеклеточный матрикс в кишечнике, и доставляет активный ингредиент, такой как, например, лекарственное средство, которое контролирует активность или рост клеток, продуцирующих внеклеточный матрикс в кишечнике к таким клеткам, таким образом проявляя эффект против фиброза кишечника.
Следовательно, поскольку активный ингредиент может быть эффективно доставлен к месту действия и, дополнительно для нацеливания на клетки посредством использования носителя по настоящему изобретению, содержащего ретиноид в качестве нацеливающего средства, излечение, подавление развития и предотвращение появления фиброза кишечника, для которого до настоящего времени отсутствует определенный терапевтический способ, становятся возможными, и настоящий носитель, таким образом, существенно способствует медицине и ветеринарии.
Более того, носитель по настоящему изобретению может комбинироваться с любым лекарственным средством (например, существующим терапевтическим лекарственным средством для фиброза кишечника) для увеличения его эффективности действия; существует, следовательно, также преимущество в том, что существует широкий диапазон применения с точки зрения разработки рецептуры готовой формы, обеспечивающий упрощение производства эффективных терапевтических средств.
Кроме того, клеточная линия по настоящему изобретению может использоваться при скрининге лекарственного средства для лечения фиброза кишечника или при установлении механизма фиброза кишечника, и это обстоятельство способствует развитию новых средств лечения или способов лечения фиброза кишечника.
Краткое описание чертежей
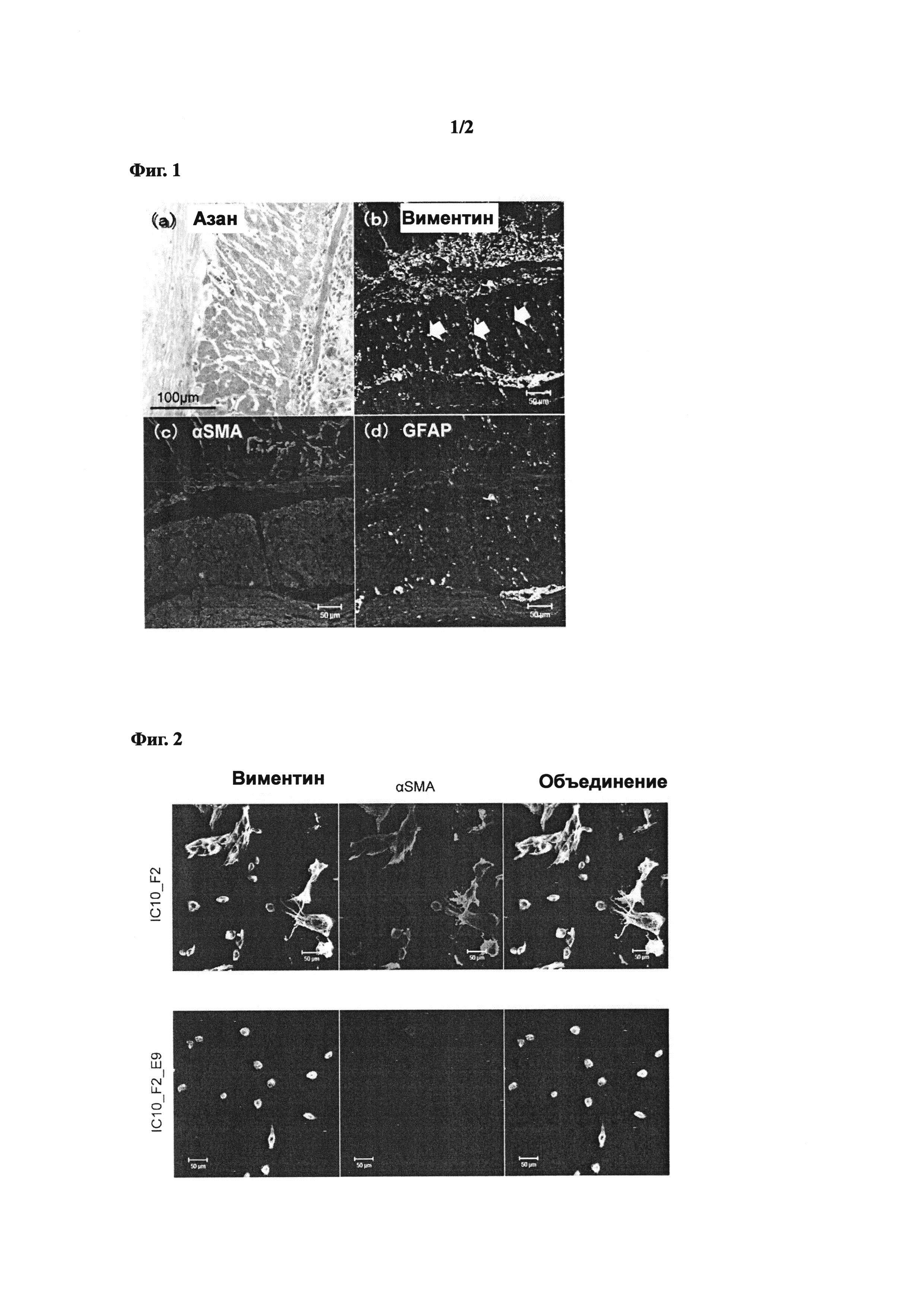
[Фиг. 1] Фиг. 1 представляет собой фотографическую диаграмму, показывающую локализацию подобных звездчатых мезенхимальных клеток на участке фиброза кишечника у мышей SAMP 1 Alt. Она показывает изображение окрашивания азаном (а) и изображения иммунофлюоресцентного окрашивания посредством антител против виментина (b), антител против αSMA (с) и антител против GFAP (d). Стрелки показывают локализацию подобных звездчатых мезенхимальных клеток. Шкала масштаба обозначает 100 мкм для (а) и 50 мкм для (b)-(d).
[Фиг. 2] Фиг. 2 представляет собой фотографическую диаграмму, показывающую экспрессию виментина и αSMA в мезенхимальной клеточной линии IC10_F2, выделенной из участка фиброза кишечника у мышей SAMPl/Yit (верхняя часть) и виментин-положительной, aSMA-отрицательной, GFAP-отрицательной клеточной линии IC10_F2_E9, полученной из нее (нижняя часть). Шкала масштаба обозначает 50 мкм.
[Фиг. 3] Фиг. 3 представляет собой график, показывающий относительную экспрессию виментина, αSMA, ADRP, LRAT и LXRJ3 в клетках IC10F2 и клетках IC10_F2_E9.
[Фиг. 4] Фиг. 4 представляет собой график, показывающий относительную экспрессию HSP47, когда siPHK, переносимую VA-связанными липосомами для HSP47, вводят в клетки IC10_F2_E9.
Описание вариантов выполнения изобретения
Один объект настоящего изобретения относится к носителю для доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике, носителю, содержащему ретиноид в качестве нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике. Один вариант выполнения носителя по настоящему изобретению включает эффективное количество ретиноида для нацеливания на клетки, продуцирующие внеклеточный матрикс в кишечнике. Кроме того, один вариант выполнения носителя по настоящему изобретению относится к носителю, нацеленному на клетки, продуцирующие внеклеточный матрикс в кишечнике, посредством ретиноида.
В настоящем изобретении, клетки, продуцирующие внеклеточный матрикс в кишечнике, не являются особым образом ограниченными, поскольку они представляют собой клетки, которые присутствуют в кишечнике и обладают способностью продуцировать внеклеточный матрикс; их примеры включают звездчатые клетки, фибробласты, перициты, фиброциты и миофибробласты, которые присутствуют в кишечнике. Продуцирующие матрикс клетки, которые присутствуют в кишечнике, могут включать не только клетки, полученные из клеток, которые присутствуют в кишечнике, но также клетки, полученные из фиброцитов в циркулирующей крови, и клетки, трансформированные из эпителиальных клеток или эндотелиальных клеток посредством эндотелиальной-мезенхимальной трансдифференцировки (Непатентная литература 1).
Примеры звездчатых клеток включают клетки, имеющие виментан-положительный, αSMA (α-актин гладкой мускулатуры)-отрицательный и GFAP (глиальный фибриллярный кислотный белок)-отрицательный фенотип, которые идентифицированы в примерах ниже. Такие клетки идентифицируют посредством иммуноокрашивания с использованием антител против виментина, антител против αSMA, и антител против GFAP, которые метят с целью обнаружения. Клетки могут экспрессировать ген, относящийся к накоплению VA (витамина А), например, ADRP (белка, относящегося к адипозной дифференцировки, LRAT (лецитин-ретинолацилтрансферазы), и/или LXRβ (печеночного X рецептора β), и т.д. Печеночные звездчатые клетки активируются при культивировании in vitro и становятся αSMA-положительными и GFAP-положительными, но клетки, подобные звездчатым клеткам, не становятся αSMA- и GFAP-положительными даже при культивировании in vitro. Миофибробласты бактеризуются экспрессией виментина и αSMA; фибробласты экспрессируют виментин, характерный для мезенхимальных клеток, но не экспрессируют αSMA, и они могут быть идентифицированы двойным окрашиванием и т.д. виментина и αSMA. Клетки, продуцирующие внеклеточный матрикс в кишечнике, могут также быть получены посредством селекции из клеток, полученных из ткани кишечника, клеток, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип.
Ретиноид по настоящему изобретению функционирует в качестве нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике, и стимулирует специфичную доставку вещества к этим клеткам. Механизм стимуляции доставки вещества посредством ретиноида полностью не выяснен; однако, например, полагают, что ретиноид, который был специфично связан ретинолсвязывающим белком (RBP) захватывается клетками, продуцирующими внеклеточный матрикс в кишечнике посредством определенного рецептора, присутствующего на поверхности этой клетки.
Ретиноид является членом класса соединений, имеющих скелет, в котором четыре изопреноидных единицы объединены по типу голова-к-хвосту (см. G.P. Moss, 'Biochemical Nomenclature and Related Documents', 2nd Ed. Portland Press, pp. 247-251 (1992)). Витамин А является родовым дескриптором для ретиноида, проявляющего качественно биологическую активность ретинола. Ретиноид, который может применяться в настоящем изобретении, не является особым образом ограниченным, и его примеры включают ретинол (включая all-транс-ретинол), ретиналь, ретиноевую кислоту (включая третиноин), производные ретиноидов, такие как сложный эфир ретинола и жирной кислоты, сложный эфир алифатического спирта и ретиноевой кислоты, этретинат, изотретиноин, адапален, ацитретин, тазаротен и ретинилпальмитат и аналоги витамина А, такие как фентретинид (4-HPR) и бексаротен.
Из перечисленных ретинол, ретиналь, ретиноевая кислота, сложный эфир ретинола и жирной кислоты (такой как, например, ретинилацетат, ретинилпальмитат, ретинилстеарат и ретиниллаурат) и сложный эфир алифатического спирта и ретиноевой кислоты (такой как, например, этилретиноат) являются предпочтительными с точки зрения эффективности специфической доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике.
Все ретиноидные изомеры, включая цис-транс изомеры, включены в объем настоящего изобретения. Ретиноид может быть замещен одним или несколькими заместителями. Ретиноид в настоящем изобретении включает ретиноид в выделенной форме, а также в форме раствора или смеси со средой, которая может растворять или удерживать ретиноид.
Ретиноид в настоящем изобретении включает соединение, содержащее ретиноид в качестве его части (соединение, содержащее ретиноидный фрагмент). Такое соединение может содержать один или несколько ретиноидных фрагментов, например один, два, три, четыре, пять, шесть, семь, восемь, девять, десять или более фрагментов. В таком соединении, ретиноид может присутствовать в состоянии, в котором его RBP-связывающий участок (например, фрагмент циклогексенового кольца в случае ретинола) может связываться с RBP. Примеры такого соединения включают, но не ограничены лишь перечисленными, соединение, в котором один или несколько ретиноидов и ПЭГ или его производное являются связанными. В таком ретиноид-ПЭГ конъюгате, RBP-несвязывающий участок (например, фрагмент, отличный от фрагмента циклогесенового кольца в случае ретинола, например, ОН-группа и т.д.) ретиноида могут быть ковалентно связаны с ПЭГ или его производным. ПЭГ или его производное могут иметь от 1 до 50 повторяющихся единиц (СН2СН2О). ПЭГ или его производное могут иметь молекулярную массу от 200 до 4000 г/моль. ПЭГ или его производное могут быть линейными или разветвленными. Производное ПЭГ может иметь группу, пригодную для связывания с ретиноидом по концу, например аминогруппу и т.д. Производное ПЭГ может иметь одну или несколько амидных групп в цепи, например одну, две, три, четыре, пять, шесть, семь, восемь, девять, десять или более амидных групп.
Носитель по настоящему изобретению составлен из ретиноида самого или может быть составлен посредством связывания ретиноида с компонентом носителя, отличным от ретиноида или посредством включения его в носитель. Следовательно, носитель по настоящему изобретению может включать компонент носителя, отличный от ретиноида. Такой компонент не является особым образом ограниченным, и может применяться любой компонент, известный в медицинской и фармацевтической областях, но те компоненты, которые могут включать в себя ретиноид или могут связываться с ретиноидом, являются предпочтительными.
Примеры таких компонентов включают липид, например фосфолипид, такой как глицерофосфолипид, сфинголипид, такой как сфингомиелин, стерин, такой как холестерин, растительное масло, такое как соевое масло или маковое масло, минеральное масло или лецитин, такой как лецитин яичного желтка, и полимер, но примеры не ограничиваются лишь ими. Среди них липиды, которые могут образовывать липосому, например природный фосфолипид, такой как лецитин, полусинтетический фосфолипид, такой как димиристоилфосфатидилхолин (DMPC), дипальмитоилфосфатидилхолин (DPPC) или дистеароилфосфатидилхолин (DSPC), диолеилфосфатидилэтаноламин (DOPE), дилауроилфосфатидилхолин (DLPC), холестерин и т.д., являются предпочтительными.
Особенно предпочтительным компонентом является компонент, который может избежать захвата ретикулоэндотелиальной системой, его примеры включают катионные липиды, такие как хлорид
N-(α-триметиламмониоацетил)-дидодецил-D-глутамата (TMAG), Ν,Ν',Ν'',N'''-тетраметил-N,N',Ν'',Ν''' -тетрапальмитил спермин (TMTPS), трифторацетат 2,3-диолеилокси-N-[2-(сперминкарбоксамидо)этил]-N,N-диметил-1-пропанаминия трифторацетат (DOSPA), хлорид
N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA), хлорид диоктадецилдиметиламмония (DODAC), бромид дидодециламмония (DDAB), 3β-[N-(N',N'-диметаламиноэтан)карбамоил]холестерина (DC-Chol), бромид 1,2-димиристоилоксипропил-3-диметилгидроксиэтиламмония (DMRIE),
и хлорид O,O'-дитетрадеканоил-N-(α-триметаламмониоацетил)диэтаноламина (DC-6-14).
Носитель в настоящем изобретении может иметь специфичную трехмерную структуру. Такая структура не является ограниченной и ее примеры включают прямоцепочечную или разветвленную линейную структуру, пленочную структуру и сферическую структуру. Следовательно, носитель может иметь, без ограничения, любую трехмерную форму, такую как дендример, дендрон, мицелла, липосома, эмульсия, микросфера или наносфера. Кроме того, один вариант выполнения носителя в настоящем изобретении представляет собой носитель, который обеспечивает активное нацеливание посредством нацеливающего средства (включающего нацеливающую молекулу, нацеливающий фрагмент и т.д.). Носитель, который имеет трехмерную конфигурацию, или носитель, который обеспечивает активное нацеливание, является хорошо известным в существующей области техники (ссылки, например, Marcucci and Lefoulon, Drug Discov Today. 2004 Mar 1; 9 (5):219-28, Torchilin, Eur J Pharm Sci. 2000 Oct; 11 Suppl 2: S81-91 и т.д.).
Связывание ретиноида с носителем по настоящему изобретению или включение его внутрь него также делается возможным посредством связывания ретиноида с компонентом носителя, отличным от ретиноида, или включения в носитель посредством химического и/или физического метода. Альтернативно, ретиноид может быть связан с носителем по настоящему изобретению или включен в него посредством смешивания ретиноида и компонента носителя, отличного от ретиноида, во время получения носителя. Количество ретиноида в носителе по настоящему изобретению может составлять, например, от 0,01 до 1000 нмоль/мкл, предпочтительно от 0,1 до 100 нмоль/мкл. Кроме того, в носителе по настоящему изобретению, содержащем ретиноид и компонент носителя, отличный от ретиноида, молярное отношение ретиноида к компоненту носителя, отличного от ретиноида, не является ограниченным и может составлять, например, от 8:1 до 1:4 или от 4:1 до 1:2. Ретиноид может быть связан с носителем или включен в него перед загрузкой вещества, подлежащего доставке, на носитель; или носитель, ретиноид, и вещество, подлежащее доставке, могут быть смешаны одновременно; или ретиноид может быть смешан с носителем, уже несущим вещество, подлежащее доставке, и т.д. Следовательно, настоящее изобретение также относится к способу получения готовой формы, специфичной к клеткам, продуцирующим внеклеточный матрикс в кишечнике, способу, включающему в себя стадию связывания ретиноида с любым существующим лекарственным средством, связанным с носителем, или лекарственным средством, инкапсулированным в носитель, например, липосомальную готовую форму, такую как DaimoXome®, Doxil, Caelyx®, или Myocet®.
Носитель по настоящему изобретению может находиться в любой форме, поскольку желательное вещество или объект могут транспортироваться к целевым клеткам, продуцирующим внеклеточный матрикс в кишечнике, и ее примеры включают, но не ограничены лишь перечисленными, полимер, дендример, дендрон, макромолекулярную мицеллу, липосому, эмульсию, микросферы и наносферы. В настоящем изобретении липосомальная форма является предпочтительной среди этих форм с точки зрения высокой эффективности доставки, широкого выбора веществ, подлежащих доставке, и простоте разработки рецептуры и т.д., и катионная липосома, содержащая катионный липид, является особенно предпочтительной. В случае, когда носитель находится в форме липосомы, молярное отношение ретиноида к другому компоненту липидов липосомы составляет предпочтительно от 8:1 до 1:4 и более предпочтительно от 4:1 до 1:2, с точки зрения эффективности связывания ретиноида с носителем или включения в него.
Носитель по настоящему изобретению может содержать вещество, подлежащее транспорту, в его внутренней части, он может быть присоединен к внешней части вещества, подлежащего транспорту, или он может быть смешан с веществом, подлежащим транспорту, поскольку он содержит ретиноид в такой форме, что ретиноид способен функционировать в качестве нацеливающего средства. 'Функционировать в качестве нацеливающего средства' здесь означает то, что носитель, который включает ретиноид, достигает и/или захватывается целевыми клетками, т.е., клетками, продуцирующими внеклеточный матрикс в кишечнике, более быстро и/или в большем количестве, чем с носителем, не содержащим ретиноид, и это может просто быть подтверждено посредством, например, добавления меченного или содержащего метку носителя к культуре целевых клеток и анализа распределения метки после предварительно определенного периода времени. Структурно, это требование может быть удовлетворено, например, если ретиноид по меньшей мере частично экспонирован на внешней стороне носителя (например, когда носитель имеет трехмерную структуру и т.д.) или готовой формы, содержащей носитель, как можно более поздно ко времени достижения целевых клеток. 'Готовая форма', как этот термин именуется здесь, представляет собой общее представление, которой включает композицию по настоящему изобретению, которая описана позже, и которая дополнительно имеет форму. Будет ли ретиноид экспонированным на внешней стороне готовой формы или нет, может быть оценено посредством контактирования готовой формы с веществом, которое специфически связывается с ретиноидом, таким как, например, ретинолсвязывающий белок (RBP), и исследования его связывания с готовой формой.
Экспонирование ретиноида по меньшей мере частично на внешней стороне носителя или готовой формы как можно более поздно ко времени достижения целевых клеток может достигаться, например, регулированием соотношения при составлении ретиноида и компонентов носителя, отличных от ретиноида. Кроме того, когда носитель имеет форму липидной структуры, такой как липосома, например, при образовании комплекса из ретиноида и компонента носителя, отличного от ретиноида, может применяться метод, в котором первую липидную структуру, образованную из компонента носителя, отличного от ретиноида, разбавляют в водном растворе, и этот раствор затем контактирует и смешивается и т.д. с ретиноидом. В этом случае ретиноид может находиться в состоянии, в котором он растворяется в растворителе, например, органическом растворителе, таком как ДМСО. Липидная структура, на которую здесь ссылаются, означает структуру, содержащую липид, в качестве компонента и имеющую любую трехмерную структуру, например форму, такую как линейная форма, пленочная форма или сферическая форма, и ее примеры включают, но не ограничены лишь перечисленным, липосому, мицеллу, липидную микросферу, липидную наносферу и липидную эмульсию. Возможность применить к другому носителю лекарственного средства такое же нацеливающее средство, как средство нацеливания липосомы описана, например, в Zhao and Lee, Adv Drug Deliv Rev. 2004; 56(8):1193-204, Temming et al., Drug Resist Updat. 2005; 8(6):381-402, и т.д.
Липидная структура может быть стабилизирована посредством, например, регулирования осмотического давления посредством применения средства, регулирующего осмотическое давление, такого как соль, сахарид, такой как сахароза, глюкоза или мальтоза или многоатомный спирт, такой как глицерин или пропиленгликоль, и предпочтительно, сахароза или глюкоза. Кроме того, может регулироваться рН посредством добавления соответствующего количества средства, регулирующего рН, такого как соль или буфер. Следовательно, является возможным осуществлять производство, хранение и т.д. липидной структуры в среде, содержащей указанные выше вещества. В этом случае, концентрацию средства, регулирующего осмотическое давление, предпочтительно регулируют таким образом, чтобы оно было изотоничным с кровью. Например, в случае сахарозы его концентрация в среде не ограничена, но может составлять от 3 15 масс. %, предпочтительно от 5 до 12 масс. %, более предпочтительно от 8 to 10 масс. %, и особенно 9 масс. %, и, в случае глюкозы ее концентрация в среде не является ограниченной но может составлять от 1 до 10 масс. %, предпочтительно от 3 до 8 масс. %, более предпочтительно от 4 до 6 масс. %, и особенно 5 масс. %.
Настоящее изобретение также относится к способу получения носителя для доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике, способу, включающему в себя стадию получения ретиноида в виде нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике. Способ разработки рецептуры ретиноида не является особым образом ограниченным, поскольку в носителе, в котором его составляют, ретиноид может функционировать в качестве нацеливающего средства на клетки, продуцирующие внеклеточный матрикс в кишечнике, и, например, могут применяться разнообразные способы, описанные в настоящем изобретении. Следовательно, разработка рецептуры ретиноида может осуществляться посредством связывания ретиноида с или заключения его в еще один компонент носителя посредством химического и/или физического метода или посредством смешивания ретиноида с еще одним компонентом носителя при получении носителя. Количество ретиноида в готовой форме и т.д. является таким, как описано выше по отношению к носителю по настоящему изобретению.
Вещество, подлежащее доставке настоящим носителем, не является особым образом ограниченным, и оно предпочтительно имеет такой размер, что оно может физически двигаться в интервале организма от участка введения к участку повреждения, где присутствуют целевые клетки. Следовательно, носитель по настоящему изобретению может транспортировать не только вещество, такое как атом, молекула, соединение, белок или нуклеиновая кислота, но также объект, такой как вектор, вирусная частица, клетка, система высвобождения лекарственного средства, который включает один или несколько элементов или микромашину. Вещество, подлежащее доставке, предпочтительно имеет свойство проявления некоторого эффекта на целевые клетки, и примеры включают вещества, вводящие метку в целевые клетки или управляющие (например, увеличивающие или подавляющие) активность или рост целевых клеток.
Следовательно, в одном варианте выполнения настоящего изобретения, вещество, подлежащее доставке посредством носителя, включает 'лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике'. Активность клеток, продуцирующих внеклеточный матрикс в кишечнике в настоящем изобретении, относится к разнообразным активностям, таким как секреция, поглощение или миграция, проявляемая клетками, продуцирующими внеклеточный матрикс в кишечнике, и в настоящем изобретении, в частности, среди перечисленных, она обычно означает активность, вовлеченную в появление, развитие и/или рецидив фиброза кишечника. Примеры такой активности включают, но не ограничены лишь перечисленными, продуцирование/секрецию компонента внеклеточного матрикса, такого как коллаген, протеогликан, тенасцин, фибронектин, тромбоспондин, остеопонтин, остеонектин или эластин, и подавление деструкционной активности этих компонентов внеклеточного матрикса.
Следовательно, лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, упоминаемое в настоящем изобретении, может представлять собой любое лекарственное средство, которое ингибирует непосредственно или косвенно физическое, химическое и/или физиологическое действие и т.д. этих клеток, вовлеченных в появление, развитие и/или рецидив фиброза кишечника; примеры включают, но не ограничены лишь перечисленными, вещества для ингибирования продуцирования и секреции компонентов внеклеточного матрикса и т.д., ингибитор роста клеток, апоптоз-индуцирующие вещества, ингибитор TIMP (тканевого ингибитора металлопротеазы), и ингибитор α1-антитрипсина.
Примеры веществ для ингибирования продуцирования и секреции компонента внеклеточного матрикса и т.д. включают, но не ограничены лишь перечисленными, вещество, такое как молекула PHKi, рибозим, или антисмысловая нуклеиновая кислота, или вещество, имеющее доминантный отрицательный эффект, такое как доминантный отрицательный мутант, который ингибирует экспрессию компонента внеклеточного матрикса, такого как коллаген, протеогликан, тенасцин, фибронектин, тромбоспондин, остеопонтин, остеонектин или эластин, вектор, экспрессирующий их, и клетки, трансформируемые им. Среди компонентов внеклеточного матрикса, лекарственные средства для ингибирования продуцирования и секреции коллагена включают, но не ограничены лишь перечисленными, ингибиторы HSP (белка теплового шока) 47, который является коллаген-специфичным молекулярным шапероном, существенным для внутриклеточного транспорта и молекулярного созревания, которые являются обычными для синтетических процессов разнообразных типов коллагена, например, ингибитор экспрессии HSP47, такой как молекула PHKi, рибозим или антисмысловая нуклеиновая кислота для HSP47, вещество, имеющее доминантный отрицательный эффект, такой как доминантный отрицательный мутант HSP47, вектор, экспрессирующий его, и клетки, трансформируемые им.
Примеры ингибитора роста клеток включают, но не ограничены лишь перечисленными, алкилирующее средство, такое как ифосфамид, нимустин (например, нимустина гидрохлорид), циклофосфамид, дакарбазин, мелфалан или ранимустин, антагонист метаболизма, такой как гемцитабин (например, гемцитабина гидрохлорид), эноцитабин, цитарабина окфостат, препарат цитарабина, тегафур/урацил, комбинированное лекарственное средство тегафур/гимерацил/отерацил калия (например, TS-1), доксифлуридин, гидроксикарбамид, фторурацил, метотрексат или меркптопурин, противоопухолевый антибиотик, такой как идарубицин (например, идарубицина гидрохлорид), эпирубицин (например, эпирубицина гидрохлорид), даунорубицин (например, даунорубицина гидрохлорид, даунорубицина цитрат), доксорубицин (например, доксорубицина гидрохлорид), пирпрубицин (например, пирарубицина гидрохлорид), блеомицин (например, блеомицина гидрохлорид), пепломицин (например, пепломицина сульфат), митоксантрон (например, митоксантрона гидрохлорид) или митомицин С, алкалоид, такой как этопозид, иринотекан (например, иринотекана гидрохлорид), винорелбин (например, винорелбина тартрат), доцетаксел (например, доцетаксела гидрат), паклитаксел, винкристин (например, винкристина сульфат), виндезин (например, виндезина сульфат) или винбластин (например, винбластина сульфат), лекарственное средство для гормональной терапии, такое как анастрозол, тамоксифен (например, тамоксифена цитрат), торемифен (например, торемифена цитрат), бикалутамид, флутамид или эстрамустин (например, эстрамустина фосфат), комплекс платины, такой как карбоплатин, цисплатин (CDDP) или недаплатин, ингибитор ангиогенеза, такой как талидомид, неовастат или бевацизумаб и L-аспарагиназа.
Примеры индуцирующего апоптоз вещества включают, но не ограничены лишь перечисленными, соединение 861, глиотоксин и аторвастатин.
Примеры ингибитора TIMP (например, TIMP1, TIMP2, TIMP3 и т.д.) включают, но не ограничены лишь перечисленными, ингибитор активности TIMP, такой как антитела для TIMP, ингибитор продуцирования TIMP, такой как молекула PHKi, рибозим или антисмысловая нуклеиновая кислота для TIMP, вектор, экспрессирующий их, и клетки, трансформированные им.
Примеры ингибитора α1-антитрипсина включают, но не ограничены лишь перечисленными, ингибитор активности α1-антитрипсина, такой как антитело для α1-антитрипсина, ингибитор продуцирования α1-антитрипсин, такой как молекула PHKi, рибозим или антисмысловая нуклеиновая кислота для α1-антитрипсина, вектор, экспрессирующий их и клетки, трансформированные им.
Кроме того, 'лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике' в настоящем изобретении может представлять собой любое лекарственное средство, которое стимулирует непосредственно или косвенно физическое, химическое и/или физиологическое действие и т.д. клеток, продуцирующих внеклеточный матрикс в кишечнике, вовлеченных непосредственно или косвенно в ингибирование появления, развития и/или рецидива фиброза кишечника.
Носитель по настоящему изобретению может доставлять один или несколько типов вышеуказанных лекарственных средств.
Молекула PHKi в настоящем изобретении включает дуплексные РНК такие как siPHK (малая интерферирующая РНК), miPHK (микро РНК), shPHK (РНК с малой шпилькой), piPHK (Piwi-взаимодействующая РНК) и rasiPHK (ассоциированная с повторами siPHK) и их модифицированные формы. Молекула PHKi и вектор, экспрессирующий молекулу PHKi, могут применяться, например, в соответствии с изложенным в стандартном практическом руководстве (например, Experimental Medicine Special Edition, Revised RNAi Experimental Protocol 2004, Yodosha, PHKi Experimental Frequently Asked Questions 2006, Yodosha и т.д.).
Конструирование молекулы PHKi может осуществляться соответствующим образом квалифицированным специалистом в области в соответствии с изложенным в стандартном практическом руководстве (Experimental Medicine Special Edition, Revised PHKi Experimental Protocol 2004, Yodosha, PHKi Experimental Frequently Asked Questions 2006, Yodosha) посредством ссылки на последовательность информационной РНК целевого гена и известную молекулярную последовательность PHKi.
Нуклеиновая кислота в настоящем изобретении включает РНК, ДНК, ПНК или их комплекс.
Вещество, подлежащее доставке посредством носителя по настоящему изобретению, также включает, но не ограничено лишь приведенными, лекарственное средство, отличное от описанных выше, для ингибирования появления, развития и/или рецидива фиброза кишечника, и примеры включают, но не ограничены лишь перечисленными, ингибитор TGFβ1 (включая вакцину TGFβ1), пентоксифиллин и его метаболит, ингибитор фосфодиэстеразы 4, ингибитор HMG-KoA-редуктазы, дайкенчуто, правастатин, аналог липоксина A4, ингибитор трансферазы сульфатной группы, ингибитор фактора инициации фиброза (например, EGF, bFGF, FGF2, PDGF, IGF-I, IGF-II, CTGF, IL-1β, IL-4, IL-13, МСР-1, ΜΙΡ-1α, ΜΙΡ-1β, ΜΙΡ-3α, лиганда NODI, TLR2, 4 и 5 лигандов, галектин 3, гиалуронан, ламинин, коллаген и т.д.), лекарственное средство для ингибирования воспаления, которое вызывает появление фиброза кишечника, такое как, например, лекарственное средство на основе аминосалициловой кислоты, такое как сульфосалазин, мезаламин, алсалазин или балсалазид, кортикостероидное лекарственное средство, такое как преднизолон или будесонид, иммуносуппресорное средство, такое как азатиоприн, меркптопурин, циклоспорин или метотрексат, ингибитор TNFα, такой как инфликсимаб и, более того, антибиотик, такой как метронидазол или ципроксан. Эти лекарственные средства могут применяться в комбинации с композицией по настоящему изобретению, которая описана позже. В настоящем описании 'используемое в комбинации' включает введение композиции по настоящему изобретению и лекарственного средства по существу в одно и то же время и введение их с временным интервалом в интервале одного и того же периода лечения. В предыдущем случае, композиция по настоящему изобретению может быть смешана с лекарственным средством и введена, или они могут вводиться последовательно без смешивания. В последнем случае композиция по настоящему изобретению может вводиться до или после лекарственного средства.
В одном варианте выполнения настоящего изобретения, примеры лекарственного средства для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, включают ингибитор, Н8Р47например, siPHK для HSP47.
Вещество или объект, доставляемые носителем по настоящему изобретению, могут быть меченными или немеченными. Введение метки позволяет проводить мониторинг успеха или неудачи доставки к целевым клеткам или увеличение или уменьшение клеток-мишеней и т.д., и является особенно применимым не только на уровне тестирования/исследования, но также на клиническом уровне. Метка может быть выбрана из любой метки, известной для специалиста в данной области техники, такой как, например, любой радиоизотоп, магнитный материал, газ или вещество, которое генерирует газ при физиологических условиях, элемент, который проявляет ядерный магнитный резонанс (например, водород, фосфор, натрий, фтор и т.д.), вещество, которое воздействует на время релаксации элемента, проявляющего ядерный магнитный резонанс (например, атом металла или соединение, содержащее его), вещество, которое связывается с меченым веществом (например, антитело и т.д.), флуоресцентное вещество, флуорофор, хемилюминесцентное вещество, биотин или его производное, авидин или его производное, фермент и т.д. Метка может быть присоединена к компоненту носителя или может переноситься носителем как независимое вещество, подлежащее доставке.
В настоящем изобретении, выражения 'для клеток, продуцирующих внеклеточный матрикс в кишечнике, ' или 'для доставки к клеткам, продуцирующим внеклеточный матрикс в кишечнике' означает то, что это пригодно для применения с клетками, продуцирующими внеклеточный матрикс в кишечнике в качестве целевых клеток, и это включает, например, что является возможным доставлять вещество к этим клеткам, более быстро, эффективно и/или в большем количестве, чем к другим клеткам, например, нормальным клеткам. Например, носитель по настоящему изобретению может доставлять вещество к клеткам, продуцирующим внеклеточный матрикс в кишечнике при скорости и/или эффективности в 1,1 раза или более, 1,2 раза или более, 1,3 раза или более, 1,5 раза или более, 2 раза или более, или даже в 3 раза или более по сравнению с другими клетками.
Настоящее изобретение также относится к композиции для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, для лечения фиброза кишечника, или для регенерации нормальной ткани кишечника из фиброзной ткани кишечника, композиции, содержащей вышеуказанный носитель и вышеуказанное лекарственное средство для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, и настоящее изобретение также относится к получению носителя при получении указанной композиции. Один вариант выполнения композиции по настоящему изобретению содержит эффективное количество ретиноида, чтобы сделать его нацеленным на клетки, продуцирующие внеклеточный матрикс в кишечнике. Кроме того, один вариант выполнения композиции по настоящему изобретению выполнен для нацеливания на клетки, продуцирующие внеклеточный матрикс в кишечнике, посредством ретиноида.
Фиброз кишечника в настоящем изобретении означает патологическое состояние, характеризуемое избыточным отложением рубцовой ткани на стенке кишечника, и включает хроническое воспаление кишечника, такое как, например, хроническая воспалительная болезнь кишечника (специфическое воспалительное заболевание кишечника, причина которого идентифицирована, такое как лекарственно-индуцированный энтерит, или инфекционный энтерит, и неспецифичное воспалительное заболевание кишечника, причина которого неизвестна, такое как болезнь Крона или язвенный колит), и болезнь, вызванная повреждением ткани вследствие излучения, спайка кишечника, ассоциированная с хирургической операцией или травмой и т.д.
В настоящем изобретении 'регенерация нормальной ткани кишечника из фиброзной ткани кишечника' означает восстановление ткани кишечника, которая была изменена фиброзом до по меньшей мере состояния с меньшей степенью фиброза. То есть ткань кишечника заменяется фиброзной тканью в основном из внеклеточного матрикса по мере развития фиброза кишечника, и обращение этой тенденции и замена увеличенной фиброзной ткани на исходную нормальную ткань является регенерацией нормальной ткани кишечника из фиброзной ткани кишечника в настоящем изобретении. Следовательно, регенерация нормальной ткани кишечника из фиброзной ткани кишечника в настоящем изобретении включает не только полное восстановление фиброзной ткани кишечника до исходного состояния, но также частичное восстановление фиброзной ткани кишечника до исходного состояния. Степень регенерации нормальной ткани кишечника может быть оценена на основании нормализации структуры ткани, снижения области, занятой фиброзной тканью, увеличение области, занятой нормальной тканью и т.д. посредством гистологического исследования биопсийной пробы и т.д. или может быть оценена по улучшению биохимического индикатора и т.д., когда патология вследствие образования фибрилл по биохимическому индикатору и т.д. наблюдалась до лечения настоящей композицией.
В композиции по настоящему изобретению, поскольку ретиноид, содержащийся в носителе, присутствует таким образом, что он функционирует в качестве нацеливающего средства, носитель может содержать вещество, подлежащее доставке внутри его внутренней части, он может быть присоединен к веществам на поверхности, подлежащим доставке, или может быть смешан с веществом, подлежащим доставке. Следовательно, в зависимости от пути введения и способов, которым лекарственное средство высвобождается и т.д., композиция может быть покрыта соответствующим материалом, таким как, например, кишечнорастворимое покрытие или материал с заданным временем разрушения, или может быть инкорпорирована в соответствующую систему высвобождения лекарства. Кроме того, композиция по настоящему изобретению может находиться в форме комплекса вещества, подлежащего доставке, и ретиноид-связанной липосомы, то есть липоплекса. Более того, когда носитель состоит только из ретиноида, композиция по настоящему изобретению может находиться в форме комплекса ретиноида и лекарственного средства для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике.
Композиция по настоящему изобретению может применяться как медицинский препарат (то есть, фармацевтическая композиция) и может вводиться через разнообразные пути, включающие как пероральный, так и парентеральный пути; их примеры включают, но не ограничены лишь перечисленными, пероральный, внутривенный, внутримышечный, подкожный, местный, внутрилегочный, через дыхательные пути, интратрахеальный, интрабронхиальный, трансназальный, желудочный, энтеральный, интраректальный, интраартериальный, интрапортальный, интравентрикулярный, интрамедуллярный, внутрь лимфатических узлов, интралимфатический, интрацеребральный, интратекальный, интрацеребровентрикулярный, трансмукозальный, чрескожный, интраназальный, интраперитонеальный и внутриматочный пути, и он может быть составлен в дозированную форму, пригодную для каждого пути введения. Такая дозированная форма и способ получения готовой формы могут быть выбраны соответствующим образом из любой известной дозированной формы и способа (см., например, Hyojun Yakuzaigaku (Standard Pharmaceutics), Ed. by Yoshiteru Watanabe et al., Nankodo, 2003).
Примеры дозированных форм, пригодных для перорального введения, включают, но не ограничены лишь перечисленным, порошок, гранула, таблетка, капсула, жидкость, суспензия, эмульсия, гель и сироп, и примеры дозированных форм, пригодных для парентерального введения, включают инъекционные формы, такие как раствор для инъекций, суспензия для инъекций, эмульсия для инъекций и инъекционная форма для получения во время применения. Готовые формы для парентерального введения могут находиться в таком виде, как водные или неводные изотонические стерильные раствор или суспензия.
Настоящее изобретение также относится к способу получения фармацевтической композиции для лечения фиброза кишечника или композиции для регенерации нормальной ткани кишечника из фиброзной ткани кишечника, способу, включающему в себя стадию получения ретиноида в виде нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике, и лекарственного средства для контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, в качестве активного ингредиента. Способ получения готовой формы ретиноида не ограничен особым образом, поскольку ретиноид может функционировать в качестве нацеливающего средства для клеток, продуцирующих внеклеточный матрикс в кишечнике, в композиции, в которой он составлен, и например, могут применяться разнообразные способы, описанные в настоящем изобретении. Кроме того, способ получения готовой формы активного ингредиента не ограничен особым образом, поскольку активный ингредиент может проявлять предварительно определенный эффект, и может применяться любой известный способ. Составление активного ингредиента в готовую форму может осуществляться в то же время, что и составление ретиноида или может осуществляться перед или после разработки рецептуры ретиноида. Например, когда композиция содержит компонент носителя, отличный от ретиноида, составление активного ингредиента может осуществляться таким образом, как посредством смешивания активного ингредиента с носителем, в котором ретиноид уже был составлен как нацеливающее средство, он может осуществляться таким образом, как посредством смешивания ретиноида, компонента носителя, отличного от ретиноида, и активного ингредиента в одно и тоже время, или он может осуществляться таким образом, как посредством разработки рецептуры активного ингредиента с компонентом носителя, отличным от ретиноида, и затем посредством его смешивания с ретиноидом.
Количество ретиноида для разработки рецептуры и т.д. является таким, как описано выше по отношению к носителю по настоящему изобретению. Кроме того, количество активного ингредиента для разработки рецептуры является таким, чтобы при введении в виде композиции, он мог подавлять появление или рецидив фиброза кишечника, улучшать клиническое состояние, смягчать его симптомы или задерживать или останавливать его развитие, предпочтительно может являться количеством, которое может предотвращать появление или рецидив фиброза кишечника или излечивать его, или может являться количеством, которое может регенерировать нормальную ткань кишечника из фиброзной ткани кишечника. Также оно предпочтительно является количеством, которое не вызывает неблагоприятный эффект, когда превышает благоприятное воздействие от введения. Такое количество может быть известным или быть соответствующим образом определено посредством исследования in vitro с использованием культивируемых клеток или посредством исследования на модельном животном, таком как мышь, крыса, собака или свинья, и такие методы тестирования являются хорошо известными квалифицированному специалисту в этой области техники. Примеры животных с фиброзом кишечника включают примеры, описанные у Pizarro et al., Trends Mol Med. 2003 May; 9 (5):218-22 (например, TNBS-индуцированная модель, DSS-индуцированная модель, оксазолон-индуцированная модель, CD4+ CD45RBвысокая SCID модель переноса, химерные мыши с tgε26 костным мозгом, IL-10 КО мыши, TNFΔARE модель, С3Н-HeJBir мыши, SAMP1/Yit мыши, SAMP1/YitFc мыши и т.д.). Среди них мыши SAMP1/Yit являются применимыми в качестве мышиной модели для фиброза кишечника болезни Крона человека. Количество активного ингредиента в готовой форме может варьировать в соответствии с формой введения композиции. Например, когда при одном введении применяют множество единиц композиции, количество активного ингредиента в одной единице композиции может быть получено делением количества активного ингредиента, требуемого для одного введения на число единиц. Такое регулирование количества готовой формы может осуществляться соответственно квалифицированным специалистом в этой области техники.
Носитель или композиция по настоящему изобретению могут быть обеспечены в любой форме, но с точки зрения стабильности при хранении, они могут быть предпочтительно обеспечены в форме, которая может быть получена во время применения, например, в такой форме, которая может быть получена в месте медицинского лечения или вблизи от него доктором и/или фармацевтом, медицинской сестрой или другим парамедиком и т.д. В этом случае, носитель или композиция по настоящему изобретению обеспечивают в форме одного или нескольких контейнеров, содержащих по меньшей мере один компонент, существенный для них, и его получают перед применением, например, в интервале 24 часов перед применением, предпочтительно в интервале 3 часов перед применением, и более предпочтительно, непосредственно перед применением. При осуществлении получения реагент, растворитель, оборудование для получения и т.д., которые обычно являются доступными в месте получения, могут использоваться соответствующим образом.
Соответственно, настоящее изобретение также относится к набору для получения носителя или композиции, набору, содержащему один или несколько контейнеров, которые содержат по отдельности или в комбинации ретиноид и/или вещество для доставки и/или компонент носителя, отличный от ретиноида, а также компонент, который является необходимым для носителя или композиции, обеспеченных в форме такого набора. Набор по настоящему изобретению может содержать, в дополнение к приведенному выше, инструкции, такие как, например, письменное пояснение или носитель электронной записи, такие как CD или DVD, касающиеся методов получения или введения носителя и композиции по настоящему изобретению, и т.д. Кроме того, набор по настоящему изобретению может содержать все из компонентов для завершения носителя или композиции по настоящему изобретению, но необязательно содержит все компоненты. Соответственно, набор по настоящему изобретению необязательно содержит реагент или растворитель, которые обычно являются доступными в месте медицинского лечения, экспериментального подразделения и т.д., такой как, например, стерильная вода, физиологический раствор или раствор глюкозы.
Настоящее изобретение дополнительно относится к способу контроля активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, для лечения фиброза кишечника, или для регенерации нормальной ткани кишечника из фиброзной ткани кишечника, способу, включающему в себя введение эффективного количества указанной выше композиция субъекту, нуждающемуся в этом. В настоящем изобретении эффективное количество, например, в способе лечения фиброза кишечника является количеством, которое подавляет появление или рецидив фиброза кишечника, улучшает клиническое состояние, смягчает его симптомы или замедляет или приостанавливает его развитие и может предпочтительно являться количеством, которое предотвращает появление или рецидив фиброза кишечника или излечивает его, или может являться количеством, которое может регенерировать нормальную ткань кишечника из фиброзной ткани кишечника. Оно также предпочтительно является количеством, которое не вызывает неблагоприятного эффекта, который превышает благоприятный эффект от введения. Такое количество может быть соответствующим образом определено посредством исследования in vitro с использованием культивируемых клеток или посредством исследования на животной модели, такой как мышь, крыса, собака или свинья, и такие методы тестирования являются хорошо известными квалифицированному специалисту в этой области техники. Более того, доза ретиноида, содержащая носитель, и доза лекарственного средства, используемые в способе по настоящему изобретению, являются известными квалифицированному специалисту в этой области техники, или могут быть соответствующим образом определены посредством вышеуказанного исследования и т.д. Животная модель фиброза кишечника является такой, как описано выше.
Конкретная доза композиции, вводимая в способе по настоящему изобретению, может быть определена, принимая во внимание разнообразные состояния по отношению к субъекту, нуждающемуся в лечении, такие как тяжесть симптомов, общее состояние здоровья субъекта, возраст, масса тела и пол субъекта, диета, путь введения, временной режим и частота введения, сопутствующее лечение, восприимчивость к лечению, согласие с лечением и т.д.
Путь введения включает разнообразные пути, включающие как пероральные, так и парентеральные пути, такие как, например, пероральный, внутривенный, внутримышечный, подкожный, местный, внутрилегочный, через дыхательные пути, интратрахеальный, интрабронхиальный, трансназальный, желудочный, энтеральный, интраректальный, интраартериальный, интрапортальный, интравентрикулярный, интрамедуллярный, внутрь лимфатических узлов, интралимфатический, интрацеребральный, интратекальный, интрацеребровентрикулярный, трансмукозальный, чрескожный, интраназальный, интраперитонеальный и внутриматочный пути.
Частота введения варьирует в зависимости от свойств композиции, подлежащей применению и указанных выше состояний субъекта, и может составлять, например, множество раз в день (более конкретно, 2, 3, 4, 5 или более раз в день), один раз в сутки, каждые несколько суток (более конкретно, каждые 2, 3, 4, 5, 6 или 7 суток и т.д.), несколько раз в неделю (например, 2, 3, 4 раза и т.д. в неделю), один раз в неделю или каждые несколько недель (более конкретно, каждые 2, 3, 4 недели и т.д.).
В способе по настоящему изобретению, термин 'субъект' означает любого живого индивидуума, предпочтительно животного, более предпочтительно млекопитающего и еще более предпочтительно человеческого индивидуума. В настоящем изобретении субъект может быть здоровым или заболевшим некоторым заболеванием и, когда предназначено лечение фиброза кишечника, это обычно означает, что субъект болен фиброзом кишечника или имеет риск заболеть им. Когда предназначено предотвращение фиброза кишечника, например, типичные примеры включают, но не ограничены лишь перечисленными, субъекта, пораженного заболеванием, которое вызывает фиброз кишечника, такое как воспалительное заболевание кишечника или спайка кишечника, ассоциированная с хирургическим вмешательством или травмой и т.д.
Кроме того, термин 'лечение' включает все типы с медицинской точки зрения приемлемой профилактической и/или терапевтической интервенции с целью излечения, временной ремиссии или предотвращения заболевания. Например, термин 'лечение' включает приемлемую с медицинской точки зрения интервенцию для разнообразных целей, включая замедление или приостановку развития фиброза кишечника, регрессию или исчезновение повреждения и предотвращение появления и предотвращение рецидива фиброза кишечника.
Настоящее изобретение также относится к способу использования указанного выше носителя для доставки вещества к клеткам, продуцирующим внеклеточный матрикс в кишечнике. Данный способ включает, но не ограничен лишь приведенным, например, стадию загрузки вещества, подлежащего доставке, на носитель, и стадию введения или добавления носителя, несущего вещество, для доставки в организм или среду, например, культуральную среду, которая содержит клетки, продуцирующие внеклеточный матрикс кишечника. Эти стадии могут соответственно достигаться в соответствии с любым известным способом или способом, описанным в настоящем изобретении. Способ доставки может комбинироваться с еще одним другим способом доставки, например, еще одним способом доставки для нацеливания на кишечник. Более того, способ включает вариант выполнения, осуществляемый in vitro, и вариант выполнения, в котором клетки, продуцирующие внеклеточный матрикс кишечника, внутри организма являются нацеленными. Вещество, которое может перемещаться носителем по настоящему изобретению, является таким, как описано выше.
Настоящее изобретение также относится к линии клеток кишечника, продуцирующих внеклеточный матрикс, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип, полученных из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника.
Примеры субъекта, страдающего от фиброза кишечника, включают, но не ограничены лишь перечисленными, субъекта с диагностированным фиброзом кишечника и животную модель с фиброзом кишечника. Диагноз фиброза кишечника осуществляют на основании медицинской истории болезни, подтверждения стриктуры кишечника посредством визуализации с барием и т.д., гистопатологического исследования биопсийной пробы и т.д. Сбор фиброзной кишечной ткани может осуществляться посредством любого возможного метода, такого как хирургическое вмешательство или биопсия с использованием эндоскопа и т.д. Фенотип может быть подтвержден посредством, например, иммуноокрашивания антителами против виментина, антителами против αSMA, и антителами против GFAP, анализа экспрессии генов виментина, αSMA и GFAP и т.д., но не ограничен лишь ими. Антитела могут являться продуктами, поставляемыми на рынок, или могут быть вновь получены известным методом, таким как иммунизация животного каждым белком. Клеточная линия может экспрессировать HSP47 или его гомолог (например, gp46), коллаген или ген, относящийся к хранению VA, такой как, например ADRP, LRAT и/или LXRβ. Клеточная линия не становится αSMA- и GFAP-положительной при культивировании in vitro. Клеточная линия может также быть иммортализована посредством трансфекции иммортализующего гена (например, SV40T, гена теломеразы, и т.д.).
Клеточная линия может культивироваться при стандартных условиях культивирования для мезенхимальных клеток. Примеры таких условий включают, но не ограничены лишь перечисленными, культивирование с 10% FBS-содержащей DMEM и 5% CO2 при 37°C.
Настоящее изобретение также относится к способу выделения клеток, продуцирующих внеклеточный матрикс в кишечнике, способу, включающему в себя
(i) стадию получения клеток из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника, и
(ii) стадию селекции клеток, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип из клеток, полученных на (i).
Сбор клеток из фиброзной кишечной ткани может осуществляться посредством, например, культивирования ткани, при необходимости нарезанной тонкими срезами, и получения клеток, мигрирующих из нее, или обработки ткани ферментом, разрушающим белок (например, коллагеназой, протеазой и т.д.), и получения клеток, отделенных от нее, но не ограничиваясь лишь приведенным выше.
Селекция клеток может осуществляться посредством, например, разделения клеток на одиночные клетки методом серийных разведений и т.д. и установления фенотипа каждого клона посредством иммуноокрашивания, анализа экспрессии гена и т.д. или подвергания суспензии одиночных клеток, меченых антителами против виментина, антителами против αSMA и/или антителами против GFAP, воздействию сортировщика клеток и т.д., но не ограничиваясь лишь приведенным выше.
Настоящее изобретение также относится к способу получения линии клеток кишечника, продуцирующих внеклеточный матрикс, способу, включающему в себя
(i) стадию получения клеток из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника, и
(ii) стадию селекции клеток, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип из клеток, полученных на стадии (i),
способу, включающему в себя стадию иммортализации клеток после стадии (i) или (ii).
Иммортализация клеток может осуществляться посредством трансфекции с иммортализующим геном (например, SV40T, геном теломеразы и т.д.). Иммортализация может осуществляться перед или после селекции клеток, имеющих желательный фенотип. Признаки, отличные от стадии иммортализации клеток, являются такими, как описано для способа выделения клеток, продуцирующих внеклеточный матрикс в кишечнике.
Настоящее изобретение также относится к способу скрининга фактора для лечения фиброза кишечника, способу, включающему в себя
(i) стадию создания возможности для тестируемого фактора сосуществовать с линией клеток кишечника, продуцирующих внеклеточный матрикс, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип, полученной из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника, и
(ii) стадию обнаружения изменения клеточной линии вследствие сосуществования с тестируемым фактором.
В настоящем изобретении, тестируемый фактор включает вещество, такое как соединение, а также разнообразные факторы, такие как тепло, электромагнитные волны (например, радиоволны, свет, рентгеновские лучи, гамма-лучи и т.д.), давление и рН. Создание возможности для клеточной линии 'сосуществовать' с тестируемым фактором означает размещение клеточной линии и тестируемого фактора в одной и той же среде, но не требует обязательно контакта между ими двумя. Сосуществование клеточной линии и тестируемого фактора включает, но не ограничено лишь приведенным, размещение клеточной линии и тестируемого фактора в одном и том же контейнере. Создание возможности для клеточной линии сосуществования с тестируемым фактором может осуществляться in vivo или in vitro.
Примеры изменения в клеточной линии вследствие сосуществования с тестируемым фактором включают, но не ограничены лишь перечисленным, ингибирование или стимуляцию активности клеточной линии (например, ингибирование или стимуляцию экспрессии гена или продуцирования вещества) и ингибирование или усиление пролиферации линии клеток. Следовательно, например, ингибирование пролиферации линии клеток или ингибирование активности клеточной линии вследствие сосуществования с тестируемым фактором означает то, что указанный тестируемый фактор является фактором для лечения фиброза кишечника.
Настоящее изобретение также относится к набору для скрининга фактора для лечения фиброза кишечника, набору, содержащему линию клеток кишечника, продуцирующих внеклеточный матрикс, имеющих виментин-положительный, αSMA-отрицательный и GFAP-отрицательный фенотип, полученную из фиброзной кишечной ткани, собранной от субъекта, страдающего от фиброза кишечника. Настоящий набор может включать в дополнение к клеточной линии реагент для обнаружения изменения в клеточной линии, инструкции, относящиеся к способу скрининга фактора для лечения фиброза кишечника с использованием настоящего набора, такие как письменное объяснение, носитель электронной записи, такой как CD или DVD, и т.д.
ПРИМЕРЫ
Настоящее изобретение поясняется с дополнительными подробностями посредством ссылки на Примеры, приведенные ниже, но они являются только иллюстративными и совсем не ограничивают настоящее изобретение.
Пример 1. Идентификация клеток, подобных звездчатых клеткам в кишечнике у мышиной модели болезни Крона SAMPl/Yit
Чтобы исследовать, вовлечены или нет клетки, соответствующие печеночным звездчатым клеткам, в фиброз при болезни Крона, использовали SAMP1/Yit, которые представляют собой мышиную модель болезни Крона. Мыши SAMP1/Yit являются спонтанной мышиной моделью, полученной инбридингом, через 20 поколений, мыши, имеющую язву на коже среди мышей SAMP1, которые получают скрещиванием однопометных мышей AKR/J через 24 поколения; они спонтанно продуцируют илеит при возрасте до 20 недель (Matsumoto et. al., Gut. 1998 Jul; 43(1):71-8), и гистопатологически характеризуются (i) воспалением, сходным воспалению при болезни Крона, обычно имеющем место в концевой части подвздошной кишки, (ii) повреждениями, распространяющимися дискретно и трансмурально, (Ш) наблюдением утолщением мышечного слоя, гиперплазией крипты, атрофией кишечных ворсинок, воспалительной инфильтрацией клеток в lamina propria и подслизистую оболочку, гиперплазией клеток Панета и зародышевых клеток, гранулемой и абсцессом крипты и т.д. (Kosiewicz et al., J Clin Invest. 2001 Маг; 107(6):695-702). Большинство мышиных моделей IBD являются моделями, которые подвержены колиту, в то время как полагают, что мыши SAMP1/Yit, имеющие приведенные выше характеристики, являются мышиными моделями, имеющие состояния, которые являются наиболее близкими к болезни Крона среди существующих животных моделей болезни (Pizarro et al., Trends Mol Med. 2003 May; 9(5):218-22).
Чтобы идентифицировать подобные звездчатые клетки в ткани кишечника мышей SAMP1/Yit, участок фиброза подвздошной кишки исследовали посредством метода иммуногистохимического окрашивания. Сначала, ткань подвздошной кишки от мышей SAMP1/Yit (возраст 29 недель, была получена в дар от Yakult Central Institute). Ткань фиксировали в 30% нейтральном формалине в течение 24 часов, затем погружали в парафин, и тонко нарезали для получения среза образца. Когда срез образца окрашивали азаном и исследовали на его фиброзное состояние, накопление коллагеновых волокон наблюдали между утолщенными клетками мышечного слоя (Фиг. 1(а)). Кроме того, последовательные срезы подвергали иммуногистохимическому анализу с использованием антител против маркеров печеночных звездчатых клеток. В качестве антител применяли антитела против виментина (Anti-vimentin, Abeam, clone RV202, cat. No.ab8978, label: Alexa Fluor 488), an anti-αSMA antibody (Anti-Glial Fibrillary Acidic Protein, Dako, Polyclonal Rabbit, Code No. Z0334, label: DyLight 633), и антитела против GFAP (Anti-a-Smooth Muscle Actin, SIGMA, clone 1A4, cat. No.A2547, label: Су). Затем иммунофлуоресцентное окрашивание осуществляли стандартным методом. Когда исследование осуществляли с помощью конфокального лазерного сканирующего микроскопа, большое количество локализации клеток, имеющих виментин (+)/αSMA(-)/GFAP(-) фенотип наблюдали наряду с аккумулированным коллагеном на участке фиброзного повреждения мышечного слоя подвздошной кишки (см. стрелки на Фиг. 1(b)-(d)). С другой стороны, таких клеток не наблюдали на участке мышечного слоя подвздошной кишки мышей AKR/J, которые были исходными мышами. Эти результаты позволяют предположить, что латентные печеночные звездчатые клетки, имеющие виментин (+)/αSMA(-)/GFAP(-) фенотип, вовлечены в фиброз.
Пример 2. Установление клеточной линии звездчатых клеток из фиброзной ткани тонкого кишечника мышей SAMP1/Yit
Чтобы подвергнуть клетки, исследованные в Примере 1, функциональному анализу in vitro и, кроме того, исследовать терапию фиброза кишечника, и т.д. с их использованием, звездчатые клетки, имеющие виментин (+)/αSMA(-)/GFAP(-) фенотип отделяли и культивировали из фиброзной ткани тонкого кишечника мышей SAMP1/Yit, чтобы, таким образом, установить клеточную линию звездчатых клеток.
Сначала ткань подвздошной кишки собирали от мышей SAMP1/Yit (возрастом 21 неделя), мелко нарезали на кусочки приблизительно 1 мм длиной, используя ножницы, затем погружали в 20 мл раствора ЭДТА (раствор 4,5 мМ ЭДТА в HBSS (рН 7,5), таком же, как применяют ниже), и слегка встряхивали. После обеспечения выстаивания при 4°C в течение 15 минут, супернатант удаляли, и осуществляли ресуспендирование в свежем растворе ЭДТА. После того как раствор ЭДТА заменяли пять раз, кусочки ткани подвздошной кишки суспендировали в 10% FBS-содержащей DMEM, помещали в 6-луночную чашку для культивирования и культивировали при 5% СО2 при 37°C. На 5-е сутки после начала культивирования, группу клеток с морфологией, как у мезенхимальных клеток, прикрепляли к чашке и оставляли для пролиферации. В это время осуществляли трансфекцию иммортализующего гена SV40T с использованием ретровирусного вектора pMFG-tsT-IRES-neo (Kawano et al, Blood. 2003 Jan 15; 101(2):532-40), таким образом получая клеточную линию IC10_F2 (Фиг. 2, верхняя часть). Далее, клеточную линию IC10_F2 подвергали методу серийных разбавлений и иммуноокрашиванию антителами против αSMA, антителами против GFAP и антителами против виментина, чтобы, таким образом, попытаться клонировать клетки, имеющие виментин (+)/αSMA(-)/GFAP(-) фенотип, и в результате клеточная линия звездчатых клеток, полученных из кишечника, имеющих такой фенотип смогла быть установлена (Фиг. 2, нижняя часть).
Экспрессировали или нет установленные IC10_F2_E9 группу генов, относящихся к накоплению VA, которое является характеристикой звездчатых клеток, исследовали с использованием ГЩР в режиме реального времени. Сначала, получали общую РНК из каждых из клеток IC10_F2 и клеток IC10_F2_E9 с использованием набора RNeasy Mini (QIAGEN, 74104), и кДНК получали посредством взаимодействия с обратной транскриптазой (High Capacity RNA-to-kDNA Master Mix, Applied Biosystems, 4390713). кДНК, полученную таким образом, использовали для измерения экспрессии генов, относящихся к накоплению витамина A (ADRP, LRAT и LXR-β) посредством ПЦР в режиме реального времени в системе LightCycler® 480 (Roche Applied Science). В качестве ПЦР-реагента, применяли LightCycler® 480 Probes Master (Roche Applied Science, 4707494). В качестве зондов, применяли зонды, включенные в Universal ProbeLibrary Probes (Roche Applied Science) (виментин: Зонд #79,4689020, αSMA: Зонд #11,4685105, ADRP: Зонд #79,4689020, LRAT: Зонд #79, 4689020, LXRp: Зонд #106, 4692250).
Кроме того, используемые праймеры были следующими (далее здесь, 'F' обозначает прямой праймер, и 'R' обозначает обратный праймер).
Виментин:
F 5' TGCGCCAGCAGTATGAAA 3'(SEQ ID №:1)
R 5' GCCTCAGAGAGGTCAGCAAA 3'(SEQ ID №:2)
αSMA:
F 5' TCACCATTGGAAACGAACG 3'(SEQ ID №:3)
R 5' ATAGGTGGTTTCGTGGATGC 3'(SEQ ID №:4)
ADRP:
F 5' CCTCAGCTCTCCTGTTAGGC 3'(SEQ ID №:5)
R 5' CACTACTGCTGCTGCCATTT 3'(SEQ ID №:6)
LRAT:
F 5' GAAGGTGGTCTCCAACAAGC 3'(SEQ ID №:7)
R 5' TACTGTGTCCACACGGATGC 3'(SEQ ID №:8)
LXRβ:
F 5' GCTCTGCCTACATCGTGGTC 3'(SEQ ID №:9)
R 5' CTCATGGCCCAGCATCTT 3'(SEQ ID №:10)
ADRP представляет собой один из типов белка PAT (перилипин-адипофилин-Т1Р47), который локализуется на мембране липидных капель и вовлечен в биосинтез или метаболизм липидных капель (Lee et al., J Cell Physiol. 2010 Jun; 223(3):648-57), LRAT является ретинол-этерифицирующим ферментом, локализуется на мембране эндоплазматического ретикулума в печеночных звездчатых клетках, и полагают, что он вовлечен в накопление VA (Nagatsuma et al., Liver Int. 2009 Jan; 29(1):47-54), и LXRβ является ядерным рецептором, вовлеченным в липидный метаболизм и противовоспалительную реакцию, и его экспрессию наблюдали на уровне мРНК в печеночных звездчатых клетках (Beaven SW. et al., Gastroenterology. 2011 Mar; 140(3):1052-62). Результаты показывают, что в сравнении с родительской линией клеток IC10F2, IC10_F2_E9 проявлял 2,4-кратную экспрессию гена для ADRP, 27-кратную экспрессию гена для LRAT, и 2,4-кратную экспрессию гена для LXRP (Фиг. 3). Данный результат указывает на то, что IC10_F2_E9 имеет характеристики звездчатых клеток.
Пример 3. Получение siPHK-содержащих VA-связанных липосом
(1) siPHK
В качестве siPHK, нацеленных на последовательность оснований HSP47 (мышь, GenBank номер доступа Х60676), который является обычным молекулярным шапероном для коллагенов (тип I - IV), применяли приведенные ниже.
A: GGACAGGCCUGUACAACUA (последовательность смысловой цепи siPHK, начиная от 969-го основания в последовательности оснований мышиного HSP47, SEQ ID №:11)
В: UAGUUGUACAGGCCUGUCC (последовательность антисмысловой цепи, SEQ ID №:12)
В качестве siRNArandom (также называемой siRNAscramble (сокращение: scr)), которая выступала в качестве контроля, применяли приведенные ниже.
С: CCUCCAAACCAAUUGGAGG (смысловая цепь siPHK, SEQ ID №:13)
D: CCUCCAAUUGGUUUGGAGG (антисмысловая цепь siPHK, SEQ ID №:14)
(2) Получение VA-lip-siPHK
В качестве катионного липида, катионные липосомы (LipoTrust), содержащие хлорид O,O'-дитетрадеканоил-N-(α-триметиламмониоацетил)диэтаноламина (DC-6-14), холестерин и диолеилфосфатидилэтаноламин (DOPE) при молярном отношении 4:3:3 приобретали от Hokkaido System Science Co., Ltd. (Sapporo, Japan).
Липосомы получали перед использованием при концентрации 1 мМ (DC-6-14) добавлением при перемешивании дважды дистиллированной воды (DDW) к лиофилизованной липидной смеси. Чтобы получить VA-связанные липосомы, 20 нмоль витамина А (ретинол, Sigma, USA), растворенные в ДМСО, смешивали с суспензией липосом (20 нмоль в расчете на DC-6-14) в пробирке 1,5 мл при 25°C во время перемешивания. Чтобы получить siPHK-несущую VA-связанную липосому HSP47 (VA-lip-HSP47 siPHK), раствор siPHK HSP47 (3 нмоль/мл в ДДВ) добавляли к раствору ретинол-связанных липосом при комнатной температуре во время перемешивания. Молярное отношение siPHK к DC-6-14 составляло 1:400. Чтобы получить дозу, желательную для применения in vitro, VA-lip-siPHK восстанавливали, используя забуференный фосфатом физиологический раствор (PBS).
Пример 4. Трансфекция клеток IC_F2_E9 с siPHK и ингибирование экспрессии HSP47
100 мкл siPHK-содержащих VA-связанные липосомы, полученных в Примере 3, добавляли к 6-луночному планшету (N140675, Nunc™), содержащему 1×104 клеток/лунку клеток IC_F2_E9 в 10% FBS-содержащей DMEM, инкубацию осуществляли при 37°C в 5% СО2 в течение 1 часа, среду затем меняли, и инкубацию осуществляли при 37°C в 5% СО2 в течение дополнительных 48 часов. Затем клетки собирали, и общую РНК получали таким же способом, как в Примере 2. Полученная таким образом общая РНК взаимодействовала с обратной транскриптазой, чтобы получить таким образом кДНК, и ингибирование экспрессии HSP47 затем оценивали с использованием ПЦР в режиме реального времени. Используемые праймеры были следующими.
F: 5' GAAGGCTGTCGCCATCTC 3'(SEQ ID №:15)
R: 5' CCCAGTCCTGCCAGATGT 3'(SEQ ID №:16)
По результатам, показанным на Фиг. 4, можно видеть, что ген HSP47 экспрессировался в клетках IC10_F2_E9, и экспрессия указанного гена ингибировалась только siPHK-содержащими VA-связанными липосомами. Принимая во внимание тот факт, что siPHK действует внутри клетки, этот результат указывает на то, что клетки IC10_F2_E9 обладают способностью продуцировать коллаген, и ретиноид действует в качестве нацеливающего средства для существенного стимулирования поглощения вещества в клетки IC10_F2_E9, как клетки, продуцирующие внеклеточный матрикс кишечника.
Реферат
Изобретение относится к области биотехнологии, конкретно к носителю для лекарственного средства для лечения фиброза кишечника посредством доставки лекарственного средства для ингибирования активности или роста клеток, продуцирующих внеклеточный матрикс в кишечнике, что может быть использовано в медицине. Указанный носитель содержит ретиноид и липид, где ретиноид способствует доставке лекарственного средства в указанные клетки и лечению фиброза кишечника, что применяется в составе фармацевтической композиции для лечения фиброза кишечника и для регенерации нормальной ткани кишечника из фиброзной ткани кишечника, в наборе для получения указанных фармацевтических композиций, способе лечения фиброза кишечника, а также регенерации нормальной ткани кишечника из фиброзной ткани кишечника. Изобретение позволяет высокоэффективно доставлять ингибитор продукции внеклеточного матрикса к клетке, продуцирующей внеклеточный матрикс, и ингибировать экспрессию молекулы, участвующей в продуцировании внеклеточного матрикса. 6 н. и 9 з.п. ф-лы, 4 ил., 4 пр.

Комментарии