Способ воздействия на пролиферативный статус клеток с помощью специфических нуклеотидных последовательностей g-цепи теломерной днк человека - RU2550267C2
Код документа: RU2550267C2
Чертежи








Описание
Область техники
Изобретение относится к области молекулярной генетики и клеточной биологии и предназначено для воздействия на деление клеток с помощью нативных однонитевых окончаний G-цепи теломерной ДНК человека (теломерных оверхенгов) и их синтетических аналогов. Заявленный способ применяется для составления корректирующего воздействия на пролиферативный статус клетки с целью подавления или активации клеточного деления. Способ основывается на специфическом влиянии различных последовательностей теломерного повтора ДНК человека и их окончаний на продвижение клеточного цикла. Выявление окончаний теломерных оверхенгов, ответственных за подавление и стимуляцию деления клетки, открыло новые перспективы использования синтетических аналогов теломерных ДНК-последовательностей для контролирования пролиферативного статуса клеток и тканей.
Изобретение является новой разновидностью ДНК-терапии и может найти применение в медицине в области лечения онкологических заболеваний, в иммунологии для контролирования иммунного статуса организма, в геронтологии, дерматологии и косметологии для поддержания способности клеток и тканей к регенерации и омоложению организма в целом.
Уровень техники
Из различных источников известно, что обработка клеток синтетическими аналогами теломерных оверхенгов (T-oligos) вызывает развитие в них процессов, подобных ответу на повреждение ДНК. При этом олигонуклеотиды, не связанные с теломерными последовательностями, не активны, а синтетические аналоги теломерной ДНК активны и выполняют роль открытых (не уложенных в петлю) форм нативных оверхенгов. Они являются для клетки сигналами повреждения теломерной ДНК, которые запускают процессы репарации и остановки клеточного цикла. На этом принципе основывается традиционная концепция использования синтетических аналогов теломерных оверхенгов для подавления клеточного деления.
Было установлено, что синтетические теломерные последовательности быстро накапливаются в ядре и активируют ряд регуляторных протеинов (ATM, р53, p95/Nbs1, р16, pRb, E2F1), что составляет основу противораковой терапии. При этом T-oligos вызывают гибель раковых клеток различными путями. Воздействие с их помощью привело к развитию апоптоза со стабилизацией в суб-G0-G1 фазах для клеток меланомы кожи (Puri N., Eller M.S., Byers H.R. Dykstra S., Kubera J., Gilchrest B.A. Telomere-based DNA damage responses: a new approach to melanoma (2004) FASEB J. Vol.18, №12, pp.1373-1381), карциномы груди (Yaar M., Eller M.S., Panova I., Kubera J., Wee L.H., Cowan K.H., Gilchrest B.A. Telomeric DNA induces apoptosis and senescence of human breast carcinoma cells. Breast Cancer Research (2007) Vol.9, №1, 13 pages, PMID: 17257427 [PubMed]), клеток яичника (Sarkar S., Faller D.V. T-oligos inhibit grows and induce apoptosis in human ovarian cancer cells. Oligonucleotides (2011) Vol.21, №1, pp.47-53). У клеток глиомы воздействие T-oligos вызывало автофагию, не связанную с апоптозом через ингибирование транскрипционного фактора STAT3 и регулятора автофагии mTOR (Aoki Н., Iwado Е., Eller M.S., Kondo Y., Fujiwara K., Li G.Z., Hess K.R., Siwak D.R., Sawaya R., Mills G.B., Gilchrest B.A., Kondo S. Telomere 3′-overhang-specific DNA oligonucleotides induce autophagy in malignant glioma cells. FACEB J. (2007) Vol.21, №11, pp.2918-2930).
В нормальных фибробластах синтетические аналоги G-оверхенгов вызывают арест в синтетической фазе и развитие сенесенизированного фенотипа, связанные с активацией p53 p21, p16 и pRb путей (Eller M.S., Liao X., Liu S., Hanna K., Backvall H., Opresko P.L., Bohr V.A., Gilchrest B.A. A role for WRN in telomere-based DNA damage responses. PNAS (2006) Vol.103, No. 41: 15073-15078).
В научной литературе описано несколько примеров использования синтетических теломерных последовательностей, которые являются ближайшими прототипами заявляемого способа. Важно акцентировать внимание на том, что чаще всего они использовались в качестве основы противораковой терапии в виде 11-членного олигонуклеотида pGTTAGGGTTAG, оканчивающегося терминальным триплетом TAG (Puri N. et al., 2004; Eller M.S. et al., 2006; Aoki H. et al., 2007; Yaar M. et al., 2007). Другие варианты окончаний, например димер рТТ и 16-членный вариант pGTTAGGGTTAGGGTTA окончания, не показали выраженного действия на деление клеток. Однако обработка клеток меланомы 16-членным вариантом олигонуклеотида с окончанием ТТА вызвала торможение ангиогенеза (Coleman С., Levine D., Kishore R., Qin G., Thome Т., Lambers E., Sasi S.P., Yaar M., Gilchrest B.A., Goukassian D.A. Inhibition of melanoma angiogenesis by telomere homolog oligonucleotides. J. Oncology (2010), 14 pages, PMID: 20652008[PubMed]).
Димер рТТ, который имеет очень низкую степень гомологии с теломерной ДНК из-за своей очень короткой длины, вызвал усиление пигментации волосяных фолликул (Atoyan R.Y., Sharov А.А., Eller M.S., Sargsyan A., Botchkarev V.A., Gilchrest B.A. Oligonucleotide treatment increases eumelanogenesis, hair pigmentation and melanocortin-1 receptor expression in the hair follicle. Experimental Dermatology (2007) Vol.16, №8, pp.671-677).
Важные результаты были получены при сравнении способной к гидролизу фосфодиэстерной формы и негидролизирущейся фосфотиоатной формы 11-членного варианта с окончанием TAG (Eller M.S. et al., 2006). Только фосфодиэстерная форма, которая полностью соответствовала физиологическим условиям существования G-оверхенга в клетке, вызвала апоптоз у клеток меланомы человека в течение 4-х дней со стабилизацией в cyб-G0-G1 фазах. Не способная к гидролизу фосфотиоатная форма (PS-T-oligos) с блокированным 3'-концом оказалась не эффективной. У нормальных клеток обработка полностью гидролизирующейся формой T-oligos привела к накоплению клеток в S-фазе клеточного цикла. Изучение продолжительности полураспада теломерных олигонуклеотидов показало, что фосфотиоатная форма (PS-T-oligos) обладала более долгим периодом полураспада в отличие от неблокированной формы. Это свидетельствовало о том, что последняя форма является активным субстратом для расщепления экзонуклеазами в противовес фосфотиоатной форме. При этом блокирование фосфотиоатными группами 5′-конца не имело значения.
Таким образом, была показана необходимость открытой формы 3′-конца синтетических аналогов G-оверхенгов, которая предполагает возможность ее гидролиза экзонуклеазами и появления новых окончаний, отличных от TAG. Несмотря на это, до сих пор нет ни одного литературного источника, исследующего влияние специфических теломерных последовательностей на прохождение основных фаз клеточного цикла и его общую продолжительность, на основе различных вариаций теломерного повтора и всех возможных вариантов его окончания. В связи с этим по указанному отличительному признаку теломерных последовательностей для заявляемого изобретения не существует прямого аналога.
Ранее T-oligos использовались только как молекулярные сигналы, свидетельствующие о нарушении петлевой структуры теломерной ДНК и ведущие к аресту клеточного цикла. При этом не уделялось никакого внимания специфической последовательности теломерных олигонуклеотидов. Чаще всего применялся TAG вариант окончания, который добавлялся в конечной концентрации 40 мкМ в культуральной среде, что значительно превышало физиологические количества теломерных оверхенгов в клетках. Такой переизбыток приводил к токсическим для клетки эффектам, связанным с арестом клеточного цикла. Именно эффект переизбытка лежал в основе старой концепции использования синтетических аналогов теломерных оверхенгов для воздействия на деление клеток. При этом чаще всего они применялись в противораковой терапии как подавляющие деления агенты и ни разу не использовались как стимуляторы пролиферации или как факторы, контролирующие наступление определенных фаз клеточного цикла.
Раскрытие изобретения
В связи с вышесказанным главной технической задачей заявляемого изобретения является разработка способа использования последовательностей теломерных оверхенгов в пределах физиологически нетоксических концентраций на основе понимания роли различий их нуклеотидных последовательностей и окончаний в делении клетки. Техническим результатом изобретения является снижение токсичности и повышение степени специфичности воздействия синтетических аналогов теломерных оверхенгов на клетки с целью воздействия на их пролиферативный статус.
Сущность изобретения заключается в использовании специфических нуклеотидных последовательностей и окончаний G-цепи теломерной ДНК человека для регуляции пролиферативного потенциала клеток с целью стимулирования или подавления деления.
Принципы использования заявляемого изобретения основаны на установлении полиморфизма окончаний теломерных оверхенгов, зависящего от фазы клеточного цикла.
Для активированного к делению состояния клетки, связанного с триггерным моментом перехода G0 фазы в G1 фазу, характерен несбалансированный неравновесный профиль терминальных нуклеотидов теломерных оверхенгов. Он связан с резким увеличением количества окончаний оверхенгов на триплет ТТА (до 70%). При этом процентное содержание терминальных триплетов TAG и AGG падает до нуля. Для неделящегося состояния клетки в G0 фазе, а также для активированного к делению состояния клетки после 10-12 часов от начала воздействия стимула характерен сбалансированный равновесный профиль терминальных нуклеотидов. Для него характерно высокое содержание AGG терминального триплета, приблизительно равное количеству GTT окончания (25-27%). При этом количество ТТА триплета приблизительно равно содержанию TAG варианта окончания (16-20%), a GGT триплета равно количеству GGG окончания (5-7%).
Условия существования описанных профилей обеспечиваются механизмами рендомизации окончаний теломерных оверхенгов за счет экзонуклеазного отщепления концевых нуклеотидов. При этом осуществляется цикл понуклеотидных смещений окончаний оверхенгов в сторону образования следующих терминальных триплетов: AGG→TAG→TTA→GTT→GGT→GGG→AGG.
Применение способа изучения флуоресцентных свойств и спектральных характеристик нуклеотидных последовательностей ДНК с помощью квантово-связанного спектра излучения красителей со свободными флуорофорными группами позволило установить специфические спектральные характеристики вариаций теломерного повтора, которыми могут оканчиваться теломерные оверхенги. Они составляют основу спектрального кодирования пролиферативной информации в клетке и определяют цветовые маркеры результирующей флуоресценции оверхенгов, характерные для неделящегося и активированного к делению состояния. Для неделящегося состояния клетки, в котором характерно присутствие терминальных триплетов AGG и TAG, наблюдается увеличение зеленого спектра флуоресценции. При активации деления преобладает флуоресценция в красном спектре, что связано с ростом содержания ТТА варианта окончания оверхенгов. Таким образом, современное представление о роли нуклеотидной последовательности теломерных повторов, входящих в состав теломерных оверхенгов, и их терминальных окончаний основывается на понимании их как субстратов световой энергии, регулирующей деление клетки.
Механизмом, сочетающим различные варианты теломерного повтора с его различными триплетными окончаниями, достигается существование в клетке многоликого семейства теломерных оверхенгов, каждый из которых обладает специфическими характеристиками и уникальным действием. В связи с указанными фактами была сформулирована новая концепция использования синтетических аналогов теломерных оверхенгов, которая легла в основу заявляемого способа. Каждый теломерный оверхенг в клетке представлен последовательностью одного из шести вариантов теломерного повтора, представленного в SEQ ID NO:1-6, который оканчивается специфическим сочетанием нуклеотидов, составляющих его терминальный триплет. При окончании теломерного оверхенга неполноразмерным повтором его терминальный триплет изменяется в зависимости от его длины. В связи с этим особую роль в клетке приобретает терминальный триплет нуклеотидов, которым оканчиваются теломерные оверхенги. Терминальный триплет может быть представлен одним из вариантов, представленных в SEQ ID NO:7-12.
В современном понимании терминальный триплет TAG, который ранее применялся для воздействия на делящиеся клетки, представляет собой лишь один из вариантов окончаний теломерных оверхенгов, возникающий в цикле понуклеотидных смещений: AGG→TAG→TTA→GTT→GGT→GGG→AGG. Его подавляющая деление функция, широко используемая ранее в противораковой терапии, основана на том, что он является одним из триплетов, характерных для неделящегося состояния клетки. При этом было показано, что окончание TAG отсутствует у злокачественно-трансформированных лимфоцитов в фазе митоза, в которой он обязательно должен присутствовать как критерий нормального осуществления деления. Сокращение количества или полное отсутствие AGG и TAG терминальных триплетов во всех фазах клеточного цикла за исключением момента перехода из G0 в раннюю G1 фазу может являться критерием злокачественности клеток.
В связи с этим AGG (SEQ ID NO:8) вариант окончания терминальных оверхенгов, специфичный для неделящегося состояния клетки и сбалансированного профиля терминальных нуклеотидов, составляет основу воздействия на пролиферативный статус клеток с целью подавления деления. Этим обуславливается его более эффективное использование в противораковой терапии по сравнению с TAG вариантом окончания.
Вариант окончания теломерных оверхенгов на основе ТТА (SEQ ID NO:12) терминального триплета в физиологически адаптированных концентрациях, не токсичных и не вызывающих арест клеточного цикла, может составлять основу воздействия, стимулирующего деление клетки. Эффективность его использования определяется тем, что с ним связано установление несбалансированного профиля терминальных нуклеотидов теломерной ДНК в клетке при активации деления. Он, в свою очередь, связан с возникновением неравновесного квантового состояния клетки с преобладанием красной флуоресценции теломерных оверхенгов.
Таким образом, новейшая концепция применения теломерных оверхенгов для коррекции пролиферативного статуса клетки исходит из того, что каждый вариант нуклеотидной последовательности теломерного повтора и его терминальный триплет играет роль молекулярного и квантового сигнала. Соотношение этих сигналов очень важно для регуляции деления клетки. В связи с этим основу воздействия на пролиферативный статус клетки составляют различные вариации нуклеотидных последовательностей теломерных оверхенгов и особенно их окончаний. При этом могут использоваться не только отдельные олигонуклеотидные последовательности, но и смеси с определенным количественным соотношением различных последовательностей.
При составлении корректирующих смесей синтетических теломерных олигонуклеотидов в противораковой терапии рекомендуется проводить предварительное исследование профилей терминальных нуклеотидов теломерной ДНК клеток-реципиентов. Это позволяет установить оптимальное соотношение терминальных триплетов TAG:AGG:GGG (SEQ ID NO:7, 8, 9) в корректирующей смеси, которое зависит от их нативных концентраций в клетках.
Отдельным направлением использования заявляемого способа является применение модифицированных синтетических аналогов теломерных оверхенгов. Модификация может заключаться во введении фосфотиоатных групп, препятствующих гидролизу и отщеплению определенных терминальных нуклеотидов. Например, введение таких групп в последовательности повторов GSGSG (SEQ ID NO:9), ASGSG (SEQ ID NO:8) и TASG (SEQ ID NO:7) может препятствовать осуществлению переходов GGG→AGG→TAG→TTA. При этом в цикле понуклеотидных смещений не будет вторично возникать ТТА триплет, активирующий деление, что очень важно в противораковой терапии.
Введение фосфотиоатных групп в последовательность терминального триплета ТТА (SEQ ID NO:12) также защитит его от трансформации в цикле понуклеотидных смещений и сохранит его стимулирующее действие.
Вторым направлением модификации синтетических аналогов теломерных оверхенгов является использование флуоресцентных меток и гасителей. Они позволяют усилить или ослабить естественную флуоресценцию синтетических аналогов теломерных оверхенгов в определенном спектре. Для подавления деления клетки перспективно использование флуоресцентного мечения AGG-терминального олигонуклеотида красителями зеленого спектра флуоресценции в диапазоне 520-540 нм, например, с помощью карбоксифлуоресцеина. При этом совместно можно использовать гасители красного спектра флуоресценции типа RTQ-2 или BHQ-3.
Для активации деления клетки перспективна модификация ТТА-терминального олигонуклеотида с использованием комбинации красителей оранжево-красного и красного спектров (ROX, Cy3.5, Cy5, Cy5.5, TexasRed) с гасителями зеленого спектра (RTQ1, BHQ1).
Предположительно сходное с зеленым спектром значение для развития фотореакций в клетке при ее делении имеет синий спектр. В этом случае возможно использование флуоресцентных красителей и гасителей синего спектра.
Следует отметить, что применение широко используемых для мечения ДНК красителей, возможно, будет ограничено из-за слишком большого квантового выхода, не соответствующего физиологическому уровню фотореакций в клетке. Известно, что клетки имеют определенный порог насыщения фотонами, выше которого достичь положительные реакции, например стимулировать деление митогенетическими излучением, невозможно. В связи с этим перспективна разработка специальных флуорофоров с подходящим квантовым выходом, в том числе представленных естественными флуоресцирующими метаболитами клеток.
Третьим направлением модификации является использование фотоотщепляемых групп, которые могут обеспечить регулируемое по времени разрушение теломерных олигонуклеотидов под воздействием света определенной длины волны. Введение таких групп позволит регулировать отщепление концевых нуклеотидов и тем самым контролировать взаимные переходы терминальных триплетов друг в друга в соответствии с циклом их понуклеотидных смещений в ходе клеточного цикла.
Одним из вариантов осуществления заявляемого способа является использование нативных фракций теломерных оверхенгов, что отображено в пункте 2 формулы изобретения. Особенностью этого варианта является то, что фракция теломерных оверхенгов в клетке представляет собой гетерогенную по длине и окончаниям популяцию, физиологически адаптированную для выполнения функций на определенных этапах клеточного цикла. Фактически этот вариант осуществления способа представляет собой механизм передачи пролиферативной информации от одних клеток к другим посредством молекулярного субстрата. Для этих целей используют культуры клеток-доноров, которые синхронизируют на определенных этапах клеточного цикла и используют для получения фракций нативных теломерных оверхенгов. Трудность использования этих фракций заключается в невозможности предотвращения их включения в цикл понуклеотидных смещений окончаний, происходящих за счет экзонуклеазных воздействий в клетках-реципиентах. В связи с этим эффект их воздействия может быть более кратковременным, чем при использовании модифицированных синтетических аналогов теломерных оверхенгов.
Регулирование деления клетки осуществляется пролиферативной информацией, записанной в вариациях последовательности теломерных повторов ДНК и регулируемой их нуклеотидными окончаниями. Механизм регулирования осуществляется на уровне генной экспрессии по принципу дальнодействия и суперпозиции солитонных волн различной природы, в том числе и оптической. Идеальным полигоном для образования вращательно-колебательных солитонных волн служат однонитевые теломерные оверхенги, нуклеотиды которых обладают максимальной степенью свободы по сравнению с двухнитевой ДНК. Установлено, что динамика солитонов чувствительна к месту инициации и зависит от нуклеотидной последовательности ДНК. Отражая специфическую нуклеотидную последовательность теломерных повторов, динамика солитонных возмущений является референтом чтения пролиферативной информации и способна осуществлять дальнодействующее влияние на экспрессию генов, ответственных за деление.
При этом необходимым источником фотонной накачки для образования оптических солитонов на теломерных оверхенгах может являться их специфическая флуорофор-связанная флуоресценция.
Поэтому в рамках развития волновой и биорезонансной медицины возможно использование волновых эквивалентов (реплик) теломерных оверхенгов, составляющих корректирующие волновые паттерны на основе заявляемых нуклеотидных последовательностей и окончаний. Подобные волновые отображения могут использоваться с целью омоложения организма и продления жизни, корректировки пролиферативного и иммунного статуса, лечения раковых и других заболеваний, в основе чего лежит их направленное воздействие на пролиферативный статус клеток. Все это определяет ближайший круг перспектив использования заявляемых последовательностей теломерных оверхенгов в области биологии, биотехнологии и медицины.
Краткое описание чертежей
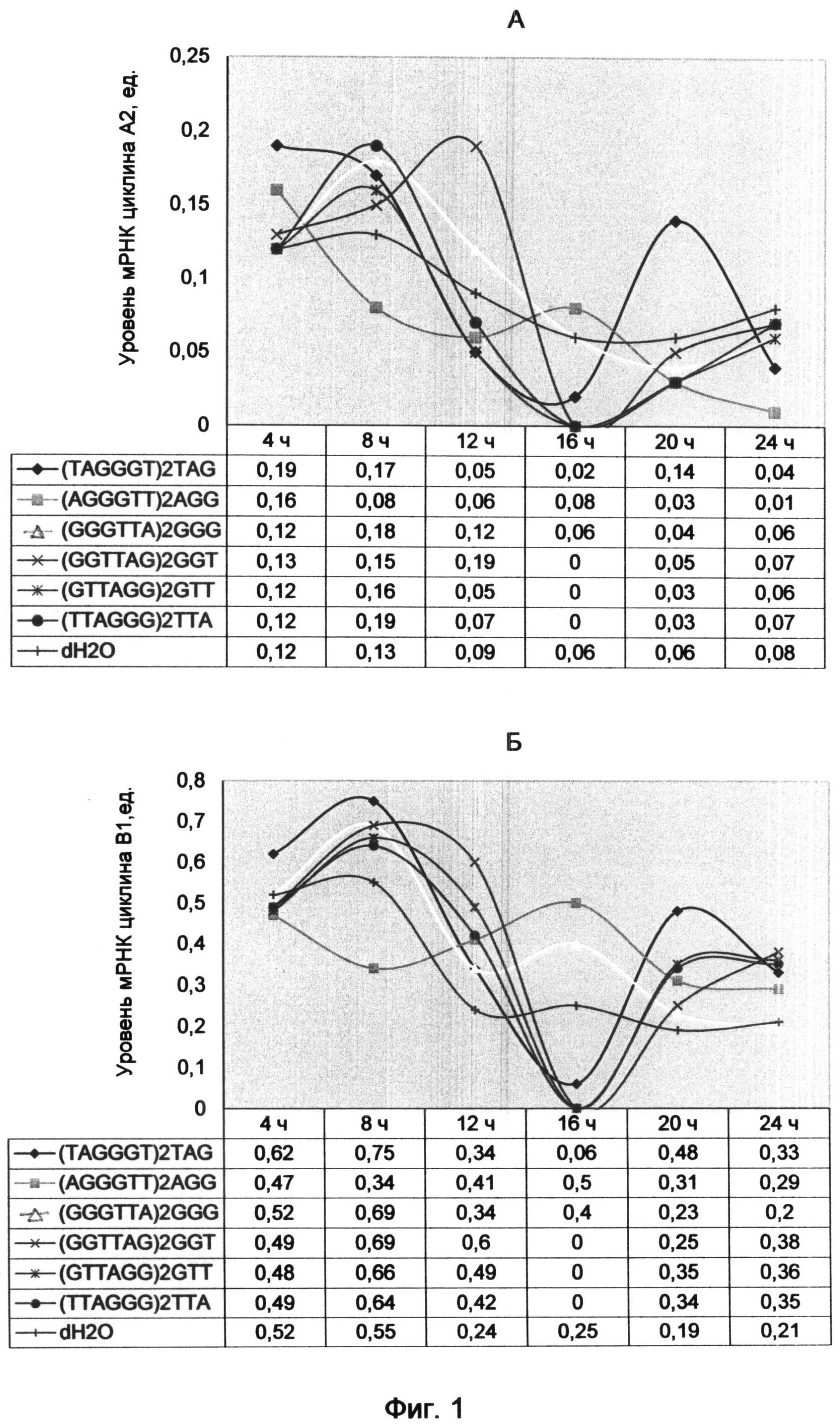
Фигура 1. Динамика экспрессии генов, связанных с делением лимфоцитов, после обработки клеток синтетическими аналогами теломерных оверхенгов, различающимися нуклеотидными последовательностями теломерного повтора и триплетными окончаниями (на примере олигонуклеотидов в конечной концентрации 20 мкМ). Отображает динамику изменений экспрессии генов во времени на протяжении 24 часов с интервалом 4 часа.
А - уровни мРНК циклина А2; Б - уровни мРНК циклина В1; В - уровни мРНК циклина Е1; Г - уровни мРНК циклина D2; Д - уровни мРНК интерлейкина-2.
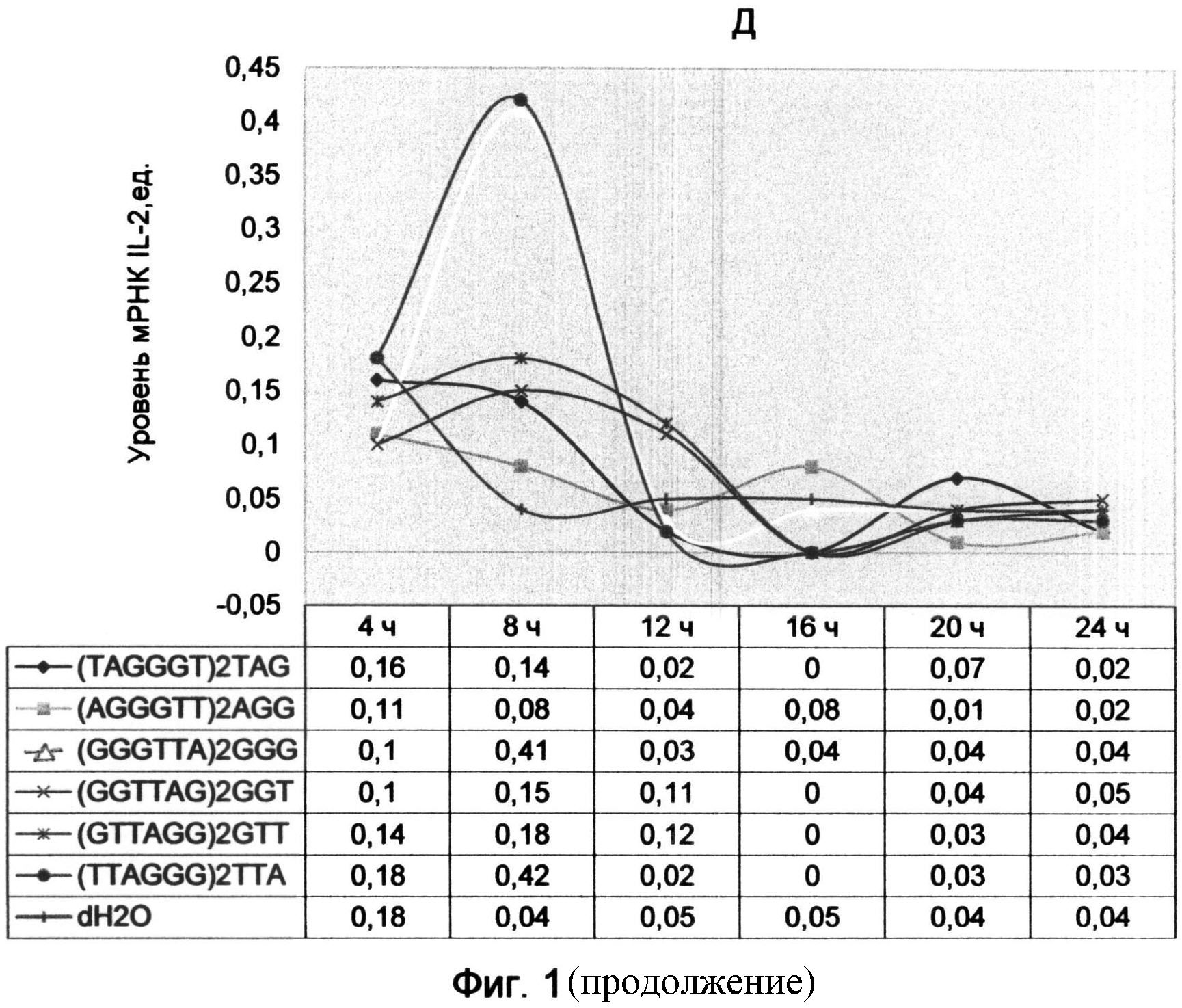
Фигура 2. Динамика уровня мРНК циклинов и интерлейкина-2 после обработки лимфоцитов человека AGG-терминальными аналогами теломерных оверхенгов (на примере (AGGGTT)2AGG олигонуклеотида в конечной концентрации 10 мкМ). Отображает динамику изменений экспрессии генов во времени на протяжении 15 часов с интервалом 5 часов. Максимумы экспрессии генов отмечены красной штрихпунктирной линией, а минимумы - черной штриховой линией.
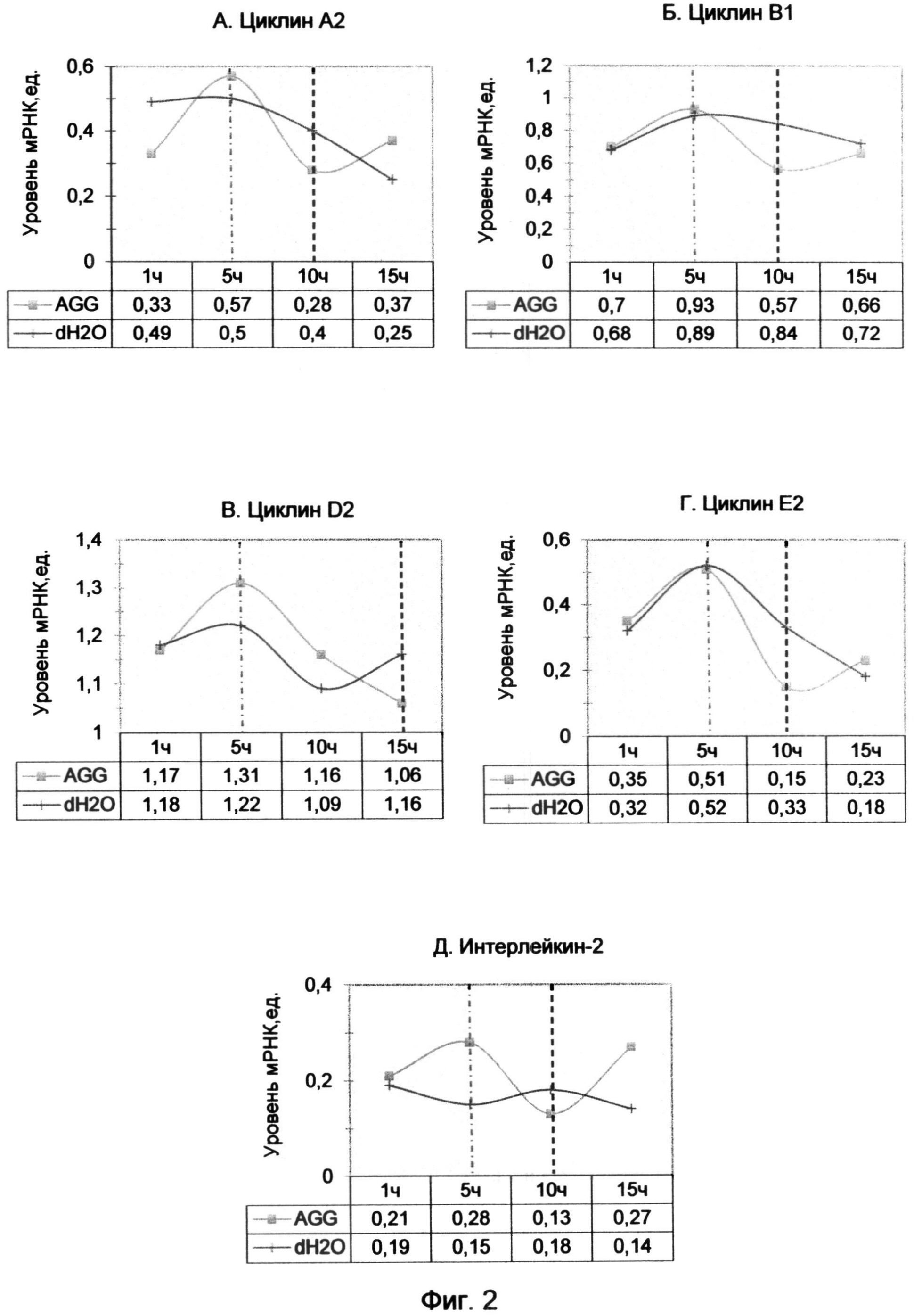
Фигура 3. Диаграмма уровня мРНК циклинов после 10 часов обработки лимфоцитов с помощью (AGGGTT)2AGG олигонуклеотида в конечной концентрации 10 мкМ.
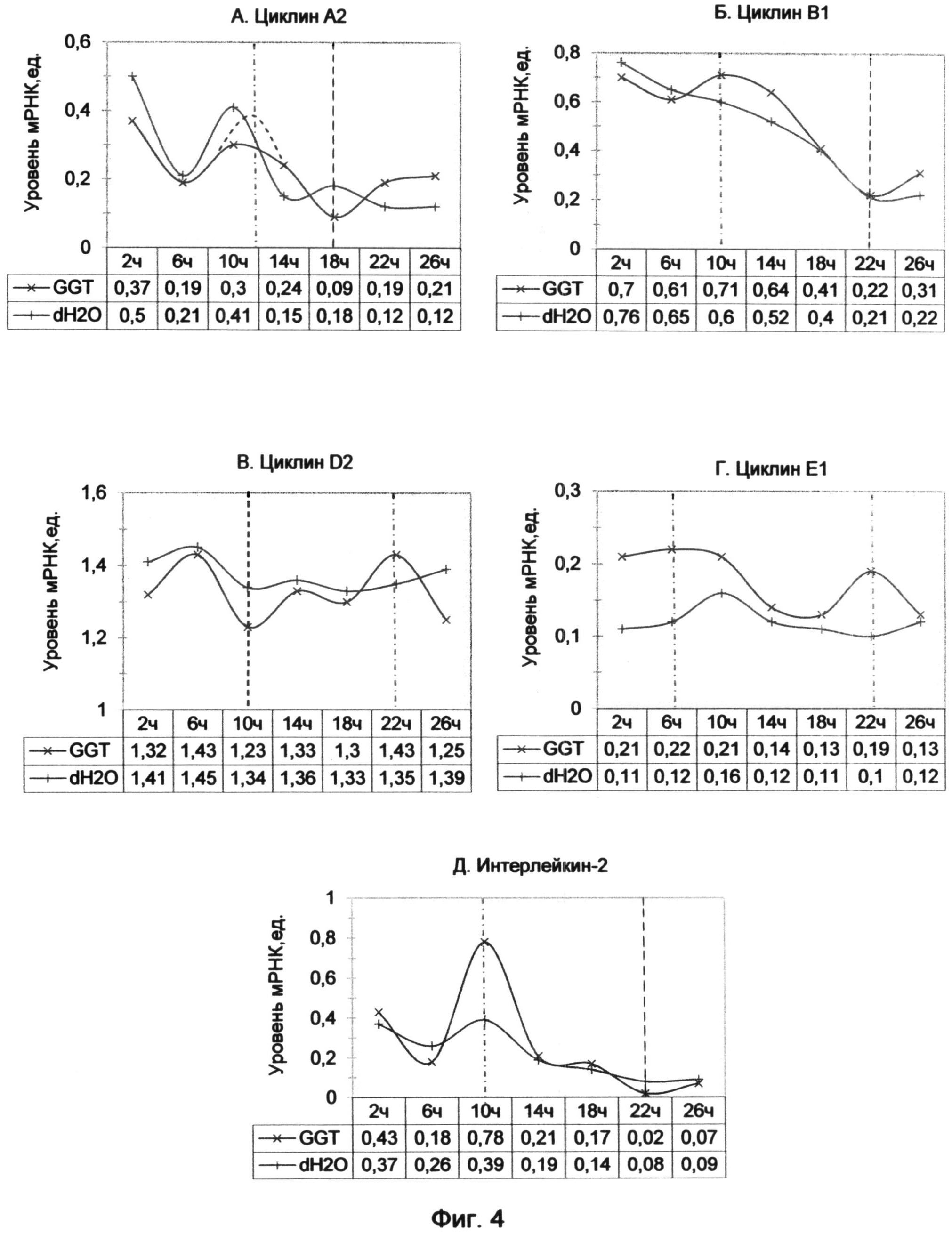
Фигура 4. Динамика уровня мРНК циклинов и интерлейкина-2 после обработки лимфоцитов человека GGT-терминальными аналогами теломерных оверхенгов (на примере (GGTTAG)2GGT олигонуклеотида в конечной концентрации 10 мкМ). Отображает динамику изменений экспрессии генов во времени на протяжении 26 часов с интервалом 4 часа. Максимумы экспрессии генов отмечены красной штрихпунктирной линией, а минимумы - черной штриховой линией.
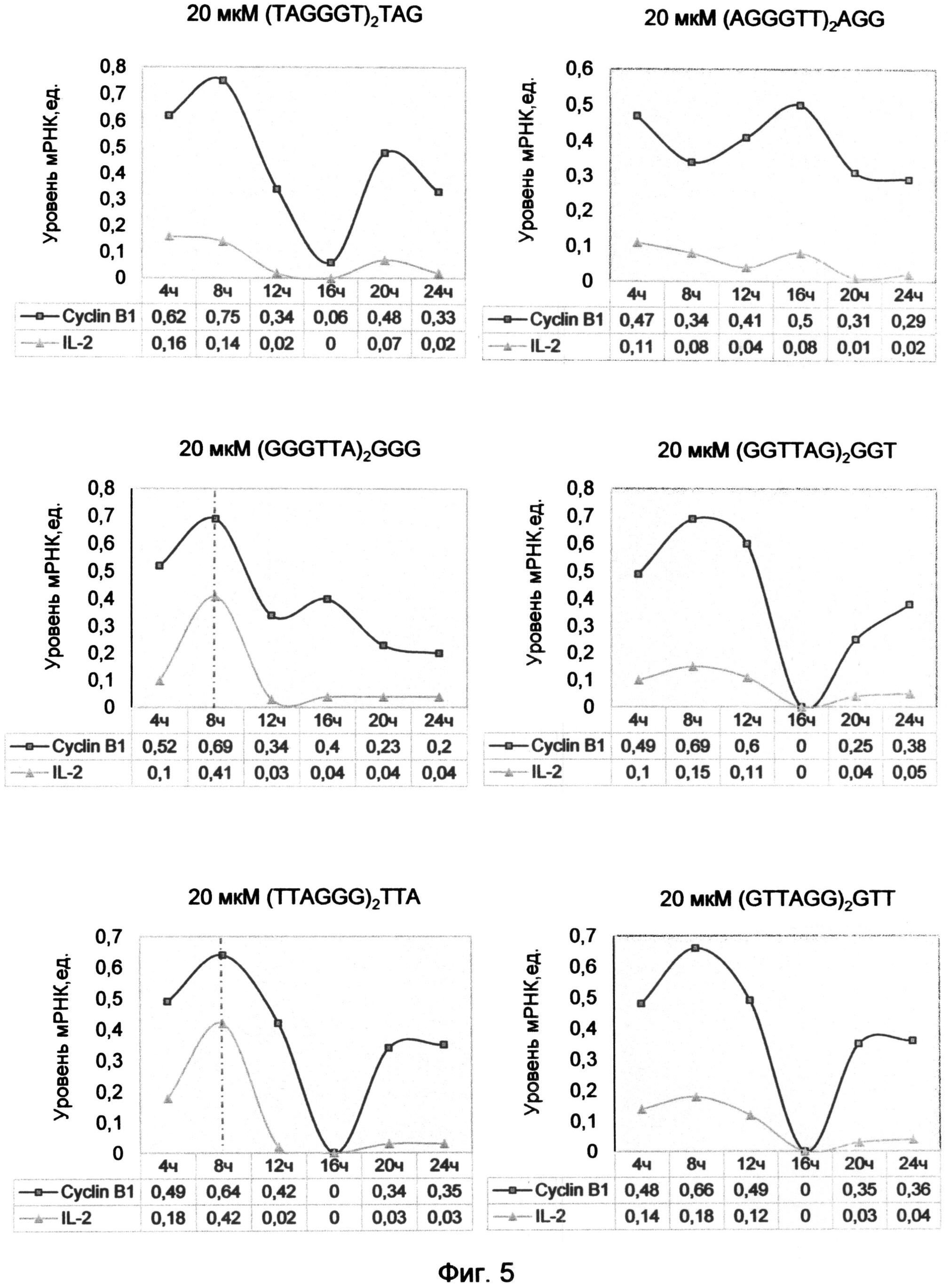
Фигура 5. Взаимосвязь экспрессии циклина В1 и интерлекина-2 под влиянием обработки лимфоцитов человека различными последовательностями синтетических аналогов теломерных оверхенгов в концентрации 20 мкМ. Сопряженные максимумы экспрессии генов отмечены красной штрихпунктирной линией.
Фигура 6. Профили терминальных нуклеотидов G-цепи теломерной ДНК лейкемических культур Jurkat (А) и К-562 (Б), синхронизированных с помощью колхицина в митотической фазе.
Фигура 7. Корректирующие профили окончаний теломерных оверхенгов, составленные для формирования равновесного сбалансированного профиля терминальных нуклеотидов G-цепи теломерной ДНК для культур Jurkat (А) и К-562 (Б).
Фигура 8. Диаграмма уровней FAM-связанной флуоресценции в зеленом спектре последовательностей G-цепи теломерной ДНК человека.
А - вариации теломерной последовательности, состоящей из двух полноразмерных гексануклеотидных повторов. Формула последовательности: 2n, где n - теломерный повтор, представленный в SEQ ID NOs: 1-6;
Б - вариации теломерной последовательности, состоящей из двух полноразмерных гексануклеотидных повторов, оканчивающихся неполноразмерным повтором в виде триплета, представленного в SEQ ID NOs: 7-12.
Формула последовательности: 2n+1/2n, где n - теломерный повтор, представленный в SEQ ID NOs: 1-6.
Осуществление изобретения
Заявленное изобретение иллюстрируется примерами, демонстрирующими возможность применения вариаций нуклеотидных последовательностей синтетических аналогов теломерной ДНК человека для воздействия на пролиферативный статус клеток. В качестве базовой модели для изучения влияния были выбраны лимфоциты периферической крови человека. Для контроля пролиферативного статуса клеток использовалось исследование экспрессии маркерных генов, контролирующих деление клетки.
Для стимулированных к делению лимфоцитов показана специфическая экспрессия циклинов А, В, Е и D, характерная для определенной фазы клеточного цикла. В связи с этим для изучения влияния специфических последовательностей теломерных оверхенгов на клеточный цикл лимфоцитов были выбраны гены циклинов А2, В1, Е1 и D2, а также ген интерлейкина-2 (IL-2), сопряженный с активной пролиферацией лимфоцитов.
Установление прямой зависимости экспрессии циклинов от вариации последовательности теломерного повтора и триплетных окончаний теломерных оверхенгов указывает на их бесспорное влияние на продвижение фаз клеточного цикла.
Пример 1. Воздействие на пролиферативный статус лимфоцитов человека с помощью синтетических аналогов теломерных оверхенгов, различающихся нуклеотидной последовательностью теломерного повтора и триплетными окончаниями.
Для получения культуры клеток были взяты лимфоциты периферической крови донора, переболевшего ОРВИ заболеванием, которые характеризовались естественной активацией деления в течение 2 недель исследуемого периода.
Для воздействия на культуру клеток использовались синтетические олигонуклеотиды, синтезированные стандартным фосфорамидитным способом синтеза в компании «Евроген» (Россия). Олигонуклеотиды представляли собой последовательности G-цепи теломерной ДНК человека длиной 15 н.о.:
1. (TAGGGT)2TAG;
2. (AGGGTT)2AGG;
3. (GGGTTA)2GGG;
4. (GGTTAG)2GGT;
5. (GTTAGG)2GTT;
6. (TTAGGG)2TTA.
Каждая последовательность состояла из вариации двух полноразмерных теломерных повторов, представленных в SEQ ID NOs: 1-6, и оканчивалась шестью возможными вариациями терминального триплета из числа SEQ ID NOs: 7-12.
Стерильные водные растворы олигонуклеотидов добавлялись в культуральную среду RPMI-1640 в конечной концентрации 20 мкМ. В качестве контроля использовался образец культуры клеток, в котором раствор олигонуклеотида был замещен стерильной дистиллированной водой.
Для оценки результатов влияния олигонуклеотидов на пролиферативный статус клеток осуществляли последовательные заборы части клеток на протяжении 24 часов с интервалом в 4 часа. Отобранные клетки использовали для выделения РНК и постановки стандартной процедуры ОТ-ПЦР. Для анализа экспрессии генов использовался денситометрический анализ электрофоретического разделения в агарозном геле продуктов амплификации последовательностей мРНК исследуемых генов в присутствии бромистого этидия. Уровень экспрессии каждого гена определялся как отношение уровня его мРНК к уровням мРНК нормировочных генов GAPDH, АСТВ и оценивался в долях от единицы.
Были получены следующие графики изменений уровня мРНК циклинов и интерлейкина-2 под воздействием теломерных последовательностей (фиг. 1).
Графики свидетельствуют о том, что используемые варианты теломерных олигонуклеотидов вызвали циклические изменения экспрессии генов, связанных с делением клетки. При этом каждый вариант последовательности приводил к специфическим изменениям в динамике циклинов и интерлейкина-2.
Наибольшие изменения динамики циклинов вызывал второй вариант последовательности, представленный двумя теломерными повторами AGGGTT (SEQ ID NO:5) с терминальным триплетом AGG (SEQ ID NO:8).
В дальнейшем при рассмотрении действия каждой последовательности мы будем акцентировать внимание на разновидности триплетного окончания. При этом будем иметь в виду, что специфическое действие оказывает вся последовательность, в том числе и уникальная вариация нуклеотидного повтора, а не только терминальный триплет.
Терминальный триплет AGG резко отличался по своему воздействию от остальных и являлся своеобразным антагонистом всех других вариантов окончаний теломерного оверхенга. Характер его воздействия на динамику основных циклинов находился в противофазе по сравнению с действием всех других вариантов окончаний, в том числе и контрольного образца.
В интервалах, где наблюдалось увеличение экспрессии генов под влиянием других вариантов терминальных триплетов (выпуклая форма графика), в образце, обработанном AGG вариантом окончания, наблюдался спад (вогнутая форма графика). И, наоборот, следующий за этим этапом рост экспрессии генов под влиянием AGG окончания олигонуклеотида сопровождался падением экспрессии генов в остальных образцах. Такой волнообразный характер динамики циклинов, связанный с противофазным влиянием AGG варианта окончания теломерной последовательности, особенно четко проявлялся для циклинов А2, В1 и Е1 (фиг. 1 А-В).
Циклин Е1 под воздействием AGG-терминального варианта последовательности характеризовался запаздывающим разгоранием экспрессии (фиг. 1В). При этом в тот момент, когда уровень мРНК этого циклина начинал падать под влиянием других вариантов окончаний, образец, содержащий AGG-терминальный олигонуклеотид, выявил стойкое возрастание мРНК уровня с пиком в 12-16 часов. Известно, что экспрессия циклина Е1 обеспечивает продвижение G1 фазы в раннюю синтетическую (S) фазу и появляется после 18 часов с момента начала стимуляции лимфоцитов к делению с помощью ФГА.
Этот факт имеет большое значение для понимания хода деления, так как именно AGG окончание теломерных оверхенгов преобладает в неделящемся состоянии клетки. Постепенное разрушение AGG окончания в клетке, связанное с его пошаговыми экзонуклеазными превращениями в другие окончания, приводит к снятию его подавляющего действия и последовательному переходу клетки сначала в G1 фазу, а затем в синтетический период. Это сопровождается разгоранием экспрессии циклина Е1 в течение 16-18-часового периода. В связи с этим становится понятной роль этого окончания в определении времени наступления синтетической фазы подготовки к делению клетки.
На экспрессию интерлейкина-2, по сравнению с другими окончаниями, AGG вариант терминального триплета оказал общее угнетающее действие, проявляющееся в первые 12 часов (фиг. 1Д). Однако более поздний эксперимент с использованием других временных интервалов выявил 5-часовой максимум интерлейкина-2 (пример 2, фиг. 2Д). Подобные максимумы экспрессии наблюдались также в 8-часовой период для вариантов ТТА и GGG окончаний и в 10-часовой период для GGT терминального триплета.
На экспрессию циклина D2 AGG-терминальный аналог оверхенга не оказал ярко выраженного влияния (фиг. 1Г). Видимо, это связано с тем, что клетки в G0 фазу клеточного цикла, когда возможна экспрессия этого циклина, характеризуются преобладанием AGG варианта окончания теломерных оверхенгов (основное состояние неделящейся клетки в фазе покоя). Известно, что циклин D2 экспрессируется в G0 и ранней G1 фазах клеточного цикла лимфоцитов, а циклин D3 отсутствует в G0 фазе и возрастает в поздней G1 фазе. В связи с этим мы предположили, что окончание AGG будет оказывать более сильное влияние на экспрессию циклина D3, который однозначно свидетельствует о продвижении клетки в G1 фазу подготовки к делению.
Для подтверждения общего характера воздействия AGG варианта окончания теломерных олигонуклеотидов, а именно его подавляющего действия в первые 10-12 часов на экспрессию большинства циклинов, был проведен дополнительный эксперимент. В нем изучалось влияние последовательности (AGGGTT)2AGG на уровень мРНК циклинов А2, В1, Е1, D2, в том числе и циклина D3 (пример 2).
Для 4-часового периода воздействия последовательности с TAG (SEQ ID NO:7) терминальным триплетом было характерно некоторое превышение уровня циклинов А2 и В1 по сравнению с остальными образцами, включая контрольный, которые группировались вокруг близких значений (фиг. 1 А и Б). В 8-часовой период наблюдался максимальный уровень мРНК (первый максимум) для циклинов В1 и Е1 (фиг. 1 Б и В). Для циклина А2 первый максимум пришелся на 4 часа (фиг. 1А).
Следующий 12-часовой период характеризовался снижением экспрессии генов для TAG варианта окончания, как и для большинства остальных образцов, включая контрольный, для которого снижение было более плавным. После 16 часов наблюдалось минимальное падение экспрессии циклинов А2, В1, Е1 и интерлейкина-2. Однако значения уровня мРНК этих генов под воздействием TAG-терминального триплета не достигли нулевого значения, как для ТТА, GTT и GGT вариантов окончания теломерных олигонуклеотидов. После 16-часового минимума экспрессии наблюдался рост уровня мРНК с вторичным максимумом в 20 часов для циклинов А2 и В1 и незначительным всплеском для интерлейкина-2. Особенно ярко вторичный максимум экспрессии под воздействием TAG-терминального олигонуклеотида проявился для циклина А2 на фоне его отсутствия для других вариантов (фиг. 1А). Для циклина Е1 вторичный максимум наступил после 24 часов воздействия (фиг. 1В).
Вариант последовательности с ТТА (SEQ ID NO:12) вариантом окончания напоминал действие TAG окончания с некоторыми специфическими отличиями. Это подтверждает близость действия теломерных оверхенгов, окончания которых различаются сдвигом последовательности на один нуклеотид. Тот факт, что ТТА вариант не показал существенного возрастания экспрессии циклинов, ответственных за продвижение фаз клеточного цикла, таких как циклины А2, Е1 и В1, свидетельствует о его преимущественном влиянии в другие фазы. Прежде всего, это касается триггерного момента активации деления клетки, осуществляемого при переходе G0 фазы в G1 фазу. Было показано, что именно в этот момент резко возрастает содержание ТТА варианта окончания теломерных оверхенгов в клетке. В связи с этим действие этого окончания в другие фазы клеточного цикла, не связанные с моментом активации деления, определяется влиянием на время их наступления через регуляцию экспрессии циклинов.
Особое значение имеет 8-часовой максимум экспрессии интерлейкина-2 под воздействием ТТА окончания, который более чем в 2,5 раза превышал значения контрольного образца (фиг. 1 Д). Это подтверждает перспективность использования ТТА окончания синтетических аналогов оверхенгов для стимуляции деления клетки.
GGT (SEQ ID NO:10) вариант окончания, подобный остальным по общему виду графиков, также находился в противофазе с AGG терминальным триплетом, но характеризовался самым поздним наступлением максимумов и минимумов экспрессии изучаемых генов. В динамике циклинов А2 и В1 наступление первичного максимума, как и вторичного, было сдвинуто. Оно наступало в 12 часов для циклина А2 и в 10 часов для циклина В1 (фиг. 1А и Б). Первичный минимум экспрессии генов наступал, как у GGT и ТТА терминальных триплетов, в 16 часов. Вторичный максимум экспрессии для всех циклинов затягивался во времени и наступал после 24 часов воздействия GGT окончания.
Данные по влиянию теломерных оверхенгов, оканчивающихся GGT триплетом, были уточнены дополнительным экспериментом, в котором использовалась 10 мкМ концентрация олигонуклеотида (GGTTAG)2GGT (пример 3).
Среднее по своему воздействию положение между ТТА и GGT вариантами окончания теломерных последовательностей занимал GTT терминальный триплет (SEQ ID NO:11). Это подтверждает их близость и различие сдвигом всего на один нуклеотид вправо или влево по ходу теломерной последовательности.
GGG (SEQ ID NO:9) терминальный вариант окончания занимал промежуточное положение между антифазным AGG вариантом окончания и остальными терминальными триплетами. Под его воздействием наблюдался всплеск уровня мРНК в 16-часовой период для циклинов В1 и Е1,что совпало с максимумом для AGG варианта окончания (фиг. 1Б и В). Таким образом, в первые 12 часов воздействие GGG варианта окончания было подобно влиянию терминальных триплетов TAG, ТТА, GTT и GGT, а затем стало похожим на воздействие AGG окончания. Это наблюдение подтверждает существование цикла понуклеотидного смещения теломерных окончаний, в ходе которого осуществляется переход терминальных триплетов GGG→AGG в результате экзонуклеазного отщепления 3′-концевого нуклеотида.
При общем рассмотрении влияния рассматриваемых теломерных последовательностей и их окончаний на экспрессию циклинов и интерлейкина-2 видно, что все они вызывают сдвиги в динамике уровней их мРНК. При этом контрольный образец культуры клеток, в котором вместо олигонуклеотида добавлялась вода, по характеру воздействия занимал промежуточное положение между ними. Этот факт указывает на то, что в нативной культуре лимфоцитов присутствуют все варианты окончаний теломерных оверхенгов в определенном уравновешенном соотношении. Добавление к этому исходному соотношению дополнительных синтетических аналогов оверхенгов вызвало сдвиги в экспрессии циклинов и интерлейкина-2, и, таким образом, влияло на прохождение фаз клеточного деления.
Пример 2. Подавляющее воздействие AGG (SEQ ID NO:8) варианта окончания синтетических аналогов теломерных оверхенгов на пролиферативный статус лимфоцитов человека.
В эксперименте использовалось в два раза меньшее, по сравнению с первым примером, количество олигонуклеотида (AGGGTT)2AGG в конечной концентрации 10 мкМ для того, чтобы оценить возможный дозозависимый эффект воздействия.
Результаты представлены графиками (фиг. 2), отображающими уровни мРНК циклинов А2, В1, D2 и Е1 и интерлейкина-2 после 15 часов воздействия теломерных олигонуклеотидов. Черной штриховой линией обозначены минимумы экспрессии генов, а красной штрихпунктирной линией - максимумы экспрессии.
Было установлено, что обработка культуры лимфоцитов с помощью синтетических аналогов теломерных оверхенгов имеет дозозависимый эффект. Однако общий характер изменений в экспрессии изучаемых генов, связанный с 10-12-часовым минимумом, сохранился независимо от концентрации (отмечен черной штриховой линией на графиках фиг. 2). Исключение составляет циклин D2, который напротив характеризовался превышением уровня мРНК над контрольным образцом в 10-часовой период (фиг.2В).
Так как 10-часовой период наиболее ярко демонстрировал эффект воздействия AGG-терминального олигонуклеотида, был проведен повторный анализ экспрессии циклинов с использованием того же образца кДНК с включением циклина D3. Результат исследования демонстрирует диаграмма фиг. 3, из которой видно, что для большинства циклинов (А2, В1, D3 и Е1) подтвердился 10-часовой спад уровня мРНК по сравнению с контрольным образцом. При этом наблюдалось возрастание экспрессии циклина D2 на фоне снижения уровня циклина D3, что, возможно, свидетельствует о задержке части клеток в G0 фазе.
Бесспорно, что 10 мкМ концентрация менее эффективно подавляла экспрессию циклинов, чем концентрация, использованная в примере 1. График уровней мРНК циклинов (фиг. 2) сохранял выпуклую форму в первые 5 часов, повторяя динамику контрольного образца. Даже на фоне сниженной концентрации олигонуклеотида наблюдался выраженный 10-12-часовой минимум экспрессии циклинов А2, В1 и Е1, что свидетельствовало о сдерживающей функции AGG-терминального триплета.
Таким образом, было установлено, что конечная концентрация 20 мкМ для AGG-терминального олигонуклеотида обладает большим подавляющим действием, чем 10 мкМ. Однако дальнейшее увеличение концентрации свыше 30 мкМ в терапевтических целях нецелесообразно. Из анализа литературных данных следует, что использование 40 мкМ концентрации TAG-терминального олигонуклеотида уже токсично для клетки и вызывает задержку роста культуры.
Важно также учитывать плотность клеток в культуре, в связи с чем рекомендуется рассчитывать показатель количества T-oligos, приходящийся на одну клетку. В эксперименте по влиянию 10 мкМ концентрации T-oligos использовалось суммарно 8 тыс. пикомоль олигонуклеотида на 6 млн клеток, что составляло приблизительно 1,33 фемтомоль на клетку. Учитывая не сильно выраженное подавляющее действие, которое наблюдалось при воздействии этой концентрации, такое количество можно считать минимальным для терапевтического эффекта. Лучше использовать 20 мкМ конечную концентрацию олигонуклеотида с количеством не менее 2,7-3 фемтомоль на клетку. Однако следует помнить, что эти величины теоретические и предполагают беспрепятственное проникновение всего количества олигонуклеотидов в клетки. В действительности поступление олигонуклеотидов в клетки зависит от скорости мембранной диффузии, в результате чего не все их количество поглощается клетками. Кроме того, влияние введенного синтетического аналога всегда накладывается на характеристики нативных теломерных оверхенгов в клетках и зависит от фазы клеточного цикла, в которой они находятся.
В заключении обзора влияния AGG (SEQ ID NO:8) варианта окончания теломерных олигонуклеотидов хочется отметить, что его характерной особенностью является волнообразный характер изменения динамики экспрессии основных циклинов, сопровождающийся угнетением в первые 10-12 часов. Исходя из анализа всех полученных графиков в ходе двух экспериментов можно сделать вывод о том, что минимальный уровень мРНК для циклина А2 приходился на 10-12 часов, для циклина В1 немного ранее - в 8-10 часов, для циклина D3 - в районе 10 часов, а для IL-2 - в 12 часов. Для циклина Е1, не во всех случаях, наблюдался минимум в 10 часов. Для циклина D2 уровень мРНК незначительно снизился - в 8 часов.
После периода первичного минимума экспрессии генов наблюдался последующий рост с максимумом практически в один период (в 16 часов) для большинства циклинов (А2, В1, Е1) и интерлейкина-2. Уже в 15 часов для циклинов А2 и Е1, а также для IL-2, наблюдалось превышение уровня мРНК над контрольным образцом (фиг. 2А, Г и Д). Это свидетельствовало о том, что эти циклины ранее всех других освободились от угнетающего воздействия AGG окончания T-oligos и дали возможность клетке перейти из G1 фазы в синтетическую.
Предположительно это связано с общим характером нуклеазных воздействий, происходящих с олигонуклеотидом в клетке, которые приводят к его деградации и потери подавляющих свойств. Поэтому к 16 часам после начала воздействия AGG-терминального олигонуклеотида экспрессия разгорается одинаково практически для всех исследуемых генов. Только циклин D2, отличающийся слабовыраженными изменениями всей динамики экспрессии под воздействием AGG окончания теломерной последовательности, характеризовался незначительным максимумом экспрессии в 16 часов.
AGG-терминальный вариант окончания теломерных оверхенгов, преобладающий по своему количеству и квантовой эмиссии среди других в основном квантовом состоянии неделящейся клетки, играет важную роль, сдерживая экспрессию циклинов и продвижение клетки к делению. Сдерживающая роль этого варианта терминального триплета, который обладает антагонистическим действием по отношению к другим вариантам, ответственным за продвижение фаз клеточного цикла, может эффективно использоваться в регулировании пролиферации клетки в терапевтических целях. Доказано, что использование AGG-терминальных вариантов T-oligos для подавления деления на несколько порядков эффективнее, чем использование популярного TAG окончания. При этом особое значение будут иметь фосфотиоатные производные этого окончания, защищающие его от деградации и продлевающие его подавляющее деление действие.
Пример 3. Воздействие GGT (SEQ ID NO:10) варианта окончания синтетических аналогов теломерных оверхенгов на пролиферативный статус лимфоцитов человека.
В эксперименте использовалась 10 мкМ концентрация олигонуклеотида (GGTTAG)2GGT. Уменьшение концентрации олигонуклеотида, по сравнению с первым примером, незначительно отразилось на характере его воздействия, несмотря на то, что плотность культуры оставалась такой же, как и в первом эксперименте, и каждая клетка получила меньшее количество олигонуклеотида.
Результаты представлены графиками фиг. 4, где черной штриховой линией обозначены минимумы экспрессии генов, а красной штрихпунктирной линией - максимумы их экспрессии. В период между 2-6 часами воздействия наблюдалось незначительное падение экспрессии для циклина В1 и более выраженное снижение для циклина А2 (фиг. 4А и Б). Скорее всего, это связано с естественным уровнем колебания циклинов, так как оно происходило синхронно с контрольным образцом. Поэтому более правомерным будет сравнение этих данных с результатами, полученными в примере 1 (фиг. 1А и Б), начиная с 6 часов воздействия.
Для циклина А2 также наблюдался сдвиг максимума экспрессии с 10 часов в 12 часов по сравнению с контролем, о чем свидетельствовала форма графика фиг. 4А. Предполагаемый пик уровня мРНК в 12 часов, отмечен красной штрихпунктирной линией на графике. В 18 часов наблюдался минимум значения экспрессии циклина А2, который был аналогичен таковому в 16 часов на графике фиг. 1А.
Для циклина В1 наблюдался пик в 10 часов, что соответствовало данным, полученным при 20 мкМ воздействии GGT окончания в примере 1 (фиг. 4Б). Однако минимум наступил гораздо позже, не в 16 часов, как раньше, а в 22 часа, и совпал с контрольным образцом.
Для циклина D2 выявился дополнительный минимум экспрессии в 10 часов, а также менее выраженный спад в 18 часов, который, по-видимому, являлся продолжением 16-часового спада, наблюдавшегося при воздействии 20 мкМ олигонуклеотида в примере 1 (фиг. 4В). Вторичный максимум экспрессии циклина D2 наблюдался в 22 часа, как и для циклина Е1.
Не совсем обычно было превышение уровня циклина Е1 над контрольными значениями (фиг. 4Г). Однако несмотря на это общий вид графика сохранился и соответствовал таковому при воздействии 20 мкМ GGT-терминального олигонуклеотида в примере 1 (фиг. 1В). Наблюдался характерный минимум между 14 и 18 часами, который совпал с 16 часовым отсутствием детектируемого сигнала в примере 1. Также наблюдался пик экспрессии циклина Е1 в 22 часа, который соответствовал возрастанию экспрессии после 20 часов воздействия в примере 1.
Для интерлейкина-2, как и для циклина А2, имело место некоторое падение экспрессии в первые 6 часов (фиг. 4Д). Но затем наблюдался рост уровня мРНК вплоть до максимума в 10 часов, который был более чем в два раза выше по сравнению с контрольным образцом. Таким образом, был обнаружен ранее не выявленный максимум экспрессии интерлейкина-2 под воздействием GGT-терминального варианта оверхенга. Он подобен 8-часовому максимуму экспрессии интерлейкина-2, наблюдавшемуся для ТТА и GGG вариантов окончания синтетической теломерной последовательности (фиг.1Д).
В завершении обзора влияния изучаемых последовательностей олигонуклеотидных аналогов теломерных оверхенгов можно сделать вывод о том, что каждый из них специфически влияет на динамику экспрессии основных циклинов, определяя наступление максимумов и минимумов уровней их мРНК.
В обобщении следует отметить, что для TAG (SEQ ID NO:7) варианта окончания наступление максимумов и минимумов (первичных и вторичных) происходит раньше по сравнению со всеми другими образцами, включая контрольный. Это вполне согласуется с представлениями о том, что TAG вариант является первичным в цепи циклических переходов терминального триплета AGG в другие окончания под воздействием экзонуклеазного отщепления концевых нуклеотидов. В динамике циклина А2 под воздействием TAG-терминального олигонуклеотида первичный максимум наступает ранее других, уже в 4 часа, а для вариантов ТТА, GGG, GTT окончаний и контроля - в 8 часов.
Для GGT-терминального олигонуклеотида наступление первичного максимума экспрессии генов циклинов сдвинуто во времени и наступает только в 12 часов. Для TAG варианта окончания первичный минимум наступает между 12 и 16 часами, а для ТТА, GTT и GGT окончаний - позже, в 16 часов. Причем уровень мРНК изучаемых генов падает до нуля на фоне более плавного снижения в контрольном образце.
Таким образом, по своему действию последовательности с терминальными триплетами TAG и GGT максимально отличаются друг от друга и являются антагонистами в отношении вариации теломерного повтора со сдвигом на целый триплет (TAG GGT и GGT TAG).
Особого внимания заслуживает влияние изученных синтетических аналогов теломерных оверхенгов на экспрессию интерлейкина-2. Максимум экспрессии этого гена для GGT (и возможно для GTT) терминальных триплетов отодвигается и наступает в 10 часов, в то время как для GGG и ТТА окончаний он наступает раньше, в 8 часов.
AGG вариант окончания, как было подробно рассмотрено, резко отличается от всех других вариантов и имеет антифазную по отношению к ним динамику действия. Минимумы экспрессии всех изучаемых генов под его влиянием соответствовали максимумам для остальных вариантов окончаний и наоборот. 12-часовой минимум экспрессии для циклина А2 под воздействием AGG терминального триплета совпал с максимумом для GGT варианта окончания, а 8-часовой минимум для циклина В1 совпал с максимумами для TAG, GGG, GTT терминальных триплетов и контрольного образца. И, наоборот, 16-часовой период минимума экспрессии циклинов А2 и В1 для вариантов TAG, GGT, GTT и ТТА окончаний и контроля совпал с максимумом для AGG терминального триплета.
В этот период воздействие терминального триплета GGG и контрольного образца напоминали динамику действия AGG окончания. Для циклина Е1 постепенное возрастание уровня мРНК под влиянием AGG варианта окончания наблюдалось на фоне падения его экспрессии в 16-часовой период для всех остальных вариантов окончаний. И только GGG терминальный триплет снова напоминал в этот период динамику AGG варианта.
В примере 2 под влиянием AGG окончания для большинства циклинов (А2, В1, D3 и Е1) подтвердился 10-часовой спад по сравнению с контрольным образцом (фиг. 2). При этом наблюдалось возрастание экспрессии циклина D2 на фоне снижения уровня циклина D3, что возможно свидетельствует о задержке части клеток в G0 фазе под воздействием AGG варианта окончания теломерного оверхенга (фиг. 3).
На экспрессию интерлейкина-2 AGG вариант окончания теломерной последовательности оказывал аналогичный антифазный эффект по сравнению с действием других вариантов. Несмотря на видимый угнетающий эффект, который наблюдался первые 12 часов в первом примере (фиг. 1Д), обнаружился максимум экспрессии интерлейкина-2 в 5 часов в примере 2 (фиг. 2Д). Это еще раз доказывает факт о том, что каждый терминальный нуклеотид в составе теломерного оверхенга определяет наступление специфического максимума экспрессии контролирующих деление клетки генов. При этом сдвиг окончания на один нуклеотид приводит к сдвигу в наступлении максимума экспрессии.
Для интерлейкина-2 под воздействием AGG варианта окончания был характерен 5-часовой максимум экспрессии. Учитывая связь между смещением на один нуклеотид в окончании теломерного олигонуклеотида и сдвигом в наступлении максимума экспрессии генов, для TAG варианта окончания, скорее всего, он наступил на час позже (в 6 часов). Об этом свидетельствует форма графика фиг. 1Д, где кривая, соответствующая TAG терминальному триплету, не такая пологая по сравнению с кривой, соответствующей AGG окончанию. Это свидетельствует в пользу того, что максимум экспрессии интерлейкина-2 под воздействием TAG окончания теломерного оверхенга наступает несколько позже, чем для AGG окончания.
Следующий максимум экспрессии интерлейкина-2 в 8 часов наблюдался для ТТА и GGG вариантов окончания теломерной последовательности, а в 10 часов - для GGT окончания. Исходя из закономерностей сдвига окончаний на один нуклеотид промежуточное положение между ними занимает GTT вариант окончания. Для него предположительный минимум экспрессии интерлейкина-2 находится в промежутке между 8 и 10 часами, то есть в 9 часов.
Таким образом, на примере экспрессии гена интерлейкина-2 было установлено, что наиболее ранним наступлением первичного максимума его экспрессии характеризуется AGG вариант окончания теломерного оверхенга (5 часов). Затем серия понуклеотидных смещений окончания за счет отщепления концевых нуклеотидов вызывает удлинение наступления максимума экспрессии гена вплоть до 10 часов, что соответствует GGT варианту окончания. Он характеризовался самым поздним наступлением первичного максимума экспрессии интерлейкина-2. Весь процесс сдвига наступления максимума экспрессии интерлейкина-2 в зависимости от варианта окончания теломерного оверхенга отражен схематично:
AGG (5 ч)→TAG (6 ч)→ТТА (8 ч)→GTT (9 ч)→GGT (10 ч)→GGG (8 ч)
Исключением из описанной схемы является GGG вариант окончания оверхенга, который, несмотря на то, что отличается на целый триплет от ТТА варианта окончания, обладает одинаковым с ним максимумом экспрессии интерлейкина-2. Однако по расчетам нуклеотидного смещения он должен иметь еще более пролонгированный максимум, чем GGT вариант окончания.
Исключительность GGG варианта окончания оверхенга скорее всего связана с его уникальными флуоресцентными характеристиками. Было установлено, что он, наряду с AGG окончанием, обладает максимальной FAM-связанной флуоресценцией в зеленом спектре. Это имеет важное значение, так как эти варианты окончания теломерных оверхенгов являются максимальными донорами световой энергии в зеленом спектре. Флуоресценция именно такого спектра характерна для равновесного квантового состояния неделящейся клетки. В связи с этим действие AGG и GGG окончаний теломерных оверхенгов близки не только спектрально, но и обладают одинаковыми во времени максимумами экспрессии генов, ответственных за деление клетки.
Сходные с интерлейкином-2 максимумы экспрессии были установлены и для гена циклина В1. Сопряжение экспрессии генов интерлейкина-2 и циклина В1 имеет большое значение для понимания механизмов прогрессии клеточного цикла и процесса малигнизации клеток.
Установлено, что в клетках карциномы уровень IL-2 в 5-10 раз выше в М фазу, когда высока экспрессия циклина В1 (Reichert Т.Е., Nagashima S., Kashii Y., Stanson J., Gao G., Dou Q.P., Whiteside T.L. Interleukin-2 expression in human carcinoma cell lines and its role in cell cycle progression. Oncogene (2000) 19, pp.514-525). Для нормальных лимфоцитов и кератиноцитов эта связь не была продемонстрирована. Однако, на основе данных по влиянию 20 мкМ концентрации синтетических оверхенгов в примере 1, была установлена синхронность динамики экспрессии этих генов для естественно стимулированных лимфоцитов (фиг.5). Данные, полученные для других временных интервалов, а именно интерлейкиновые максимумы для AGG варианта окончания в 5 часов, для TAG окончания в 6 часов и для GGT окончания в 10 часов, на рисунке не отображены.
Так как для TAG, AGG, GGT и GTT (SEQ ID NOs: 7, 8, 10, 11) терминальных триплетов теломерных олигонуклеотидов максимумы экспрессии циклина В1 и IL-2 приходились на другие интервалы времени, чем отображенные на графике, то их синхронность проявлялась только в общем виде кривых. В связи с этим синхронного повышение уровня мРНК интерлейкина-2, сопоставимого с ростом циклина В1, на графиках не наблюдалось. Только для GGG и ТТА вариантов окончаний оверхенга, максимумы которых приходились на точку построения графиков (8 часов), наблюдались синхронизированные максимумы для этих двух генов (фиг.5). Возможно, для других вариантов терминальных окончаний оверхенгов экспрессии этих двух генов сопряжены в другие промежутки времени.
Таким образом, в условиях эксперимента примера 1 экспрессия циклина В1 и IL-2 были максимально сопряжены друг с другом после 8 часов воздействия ТТА и GGG вариантов окончаний теломерных оверхенгов. Из этого следует, что сопряжение экспрессии этих двух генов, характерное для многих злокачественных клеток, связано с преобладанием в них ТТА-терминального окончания теломерной ДНК. Это было продемонстрировано в экспериментах по изучению профилей терминальных нуклеотидов G-цепи теломерной ДНК в лейкемических культурах лимфоцитов человека. Выявление этой закономерности важно для понимания процесса автостимуляции малигнизированных клеток к безудержному делению посредством активации в них интерлейкинового пути.
Исходя из схемы максимумов сопряженной экспрессии циклина В1 и IL-2 выясняется механизм антагонистического действия AGG варианта окончания оверхенга по сравнению с другими вариантами окончаний. Он вероятнее всего связан с тем, что максимум для AGG варианта окончания наступает и завершается раньше других (около 5 часов) и попадает в противофазу с действием остальных терминальных триплетов. При этом антифазная динамика AGG терминального триплета по сравнению с действием других терминальных триплетов хорошо просматривается на графиках фиг. 1. Выявленная особенность этого варианта окончания вступать в противовес по отношению к другим окончаниям, в том числе и к ТТА окончанию, характерному для активированного к делению состояния клеток, лежит в основе его использования для подавления пролиферации.
Важно отметить, что циклины группы В ответственны за прохождение поздней синтетической фазы, активируя деятельность циклинзависимой киназы Cdk2, и, что самое главное, обеспечивают формирование комплекса с Cdk1 (митоз-стимулирующего фактора), обеспечивающего вход клетки в митоз. В связи с этим становится ясным бесспорное влияние окончаний теломерных оверхенгов не только на подготовку клеточного деления в фазы G1, S и G2 через регулирование экспрессии циклинов групп D, А и Е, но и на определение времени наступления самого митоза посредством контроля экспрессии циклинов группы В.
Все эти факты свидетельствуют о том, что варианты терминальных окончаний теломерных оверхенгов находятся в клетке в определенном соотношении, которое изменяется в ходе клеточного цикла. Оно контролирует, таким образом, прохождение фаз клеточного цикла, в частности наступление митоза через регуляцию экспрессии генов, связанных с делением клетки.
Контрольный образец, содержащий только нативные оверхенги в физиологическом соотношении, занимал промежуточное положение по динамике изменений экспрессии генов циклинов и интерлейкина-2 (фиг. 1). Внесение в клетки искусственных аналогов теломерных оверхенгов различной последовательности с различными терминальными окончаниями вызвало сдвиги в динамике генов, контролирующих пролиферацию. При этом максимумы экспрессии изученных генов под воздействием различных последовательностей не перекрывались. Для каждого часа существовал один пик уровня мРНК генов циклинов и интерлейкина-2 под воздействием одного варианта нуклеотидной последовательности теломерного оверхенга. В этом заключается глубокий смысл и уникальность каждого варианта окончания оверхенга, который определяет свой уникальный максимум экспрессии генов, ответственных за прохождение фаз клеточного цикла и контролирующих деление клетки. Исключение составляют одинаковые по времени максимумы экспрессии интерлейкина-2 под воздействием ТТА и GGG терминальных окончаний теломерных оверхенгов.
Таким образом, четкий подбор нуклеотидной последовательности синтетических аналогов теломерных оверхенгов, лежащий в основе заявляемого способа, позволяет специфически влиять на экспрессию контролирующих деление генов и направленно регулировать, таким образом, пролиферативный статус клеток.
Все это создает новые перспективы в понимании механизмов запуска и контроля клеточного деления, а также злокачественного перерождения клетки, связанного с сокращением продолжительности клеточного цикла. Было доказано, что малигнизированные клетки характеризуются нарушенным механизмом регуляции соотношения вариантов нуклеотидных окончаний теломерных оверхенгов, что приводит к сокращению периода наступления фазы митоза клеточного цикла.
В связи с этим целесообразно ввести в диагностическую практику медицинских учреждений профилирование теломерной ДНК по содержанию терминальных нуклеотидов и исследование флуоресцентных и спектральных характеристик ее окончаний (теломерных оверхенгов). Проведение подобных диагностических мероприятий позволит получить наибольший терапевтический эффект от воздействия синтетических аналогов теломерных последовательностей с помощью заявляемого способа.
Исходя из того, что для клетки при определении ее пролиферативного статуса важно соотношение между определенными терминальными триплетами теломерной ДНК, составляются соответствующие корректирующие профили ее окончаний с целью контролирования времени наступления определенных фаз клеточного цикла и создания, таким образом, триггерных условий активации или подавления деления клеток.
Примером составления таких корректирующих профилей в противораковой терапии может служить пример 4.
Пример 4. Составление корректирующего профиля окончаний смеси синтетических аналогов теломерных оверхенгов с целью подавления деления клеток лейкемических культур Jurkat и K-562.
Для клеток культур были получены следующие профили терминальных нуклеотидов G-цепи теломерной ДНК после синхронизации в фазе митоза под воздействием колхицина (фиг. 6, А - Jurkat; Б - K-562). Они свидетельствовали о том, что в обеих культурах клеток присутствовали серьезные нарушения процессов, контролирующих понуклеотидные переходы окончаний теломерных оверхенгов.
Для нормальных лимфоцитов было установлено присутствие равновесного сбалансированного профиля терминальных нуклеотидов теломерных оверхенгов во всех фазах клеточного цикла, кроме начальной G1 фазы, знаменующей триггерный процесс активации деления клетки. В связи с этим для каждой лейкемической культуры были рассчитаны специфические соотношения синтетических аналогов окончаний оверхенгов, необходимые для восполнения равновесного сбалансированного профиля терминальных нуклеотидов в количественном соотношении: TAG (18%), AGG (26%), GGG (7%), GGT (5%), GTT (26%), TTA (18%). Полученные корректирующие профили представлены диаграммами процентного содержания терминальных триплетов (фиг. 7).
Оптимальные для воздействия концентрации олигонуклеотидов в соответствии с установленным процентным содержанием должны подбираться эмпирически и определяться количественным содержанием ТТА варианта окончания теломерных оверхенгов в клетках-реципиентах. При расчете концентрации вводимых олигонуклеотидов следует также исходить из предела конечной суммарной концентрации всех вариантов окончаний олигонуклеотидов, равного 10-20 микромолям. Увеличение концентрации более 30 мкМоль может вызвать цитотоксические эффекты.
Еще раз отметим, что воздействие смесей олигонуклеотидов в заявляемом способе не связано с ответной реакцией клеток на их переизбыточные концентрации, приводящие к аресту клеточного цикла и подавлению деления и роста. Смеси олигонуклеотидов предназначены для коррекции профиля терминальных нуклеотидов теломерной ДНК обрабатываемых клеток и возвращения их к контролируемому режиму деления.
При невозможности проведения индивидуального профилирования терминальных нуклеотидов теломерной ДНК злокачественных клеток рекомендуется использовать воздействие олигонуклеотидами с AGO (SEQ ID NO:8) вариантом окончания. Перспективно использование последовательностей на основе полноразмерного повтора GTTAGG (SEQ ID NO:2), так как они обладают максимальной флуоресценцией в зеленом спектре. Это очень важно для создания условий квантового состояния неделящейся клетки, для которого характерно одновременное присутствие зеленого и красного каналов флуоресценции теломерных оверхенгов. Кроме того, этот квантовый эффект можно усилить включением метки, флуоресцирующей в зеленом диапазоне, и гасителя красной флуоресценции. Возможно также включение в последовательность олигонуклеотида фосфотиоатных групп, блокирующих отщепление концевых нуклеотидов и продлевающих его терапевтическое действие. Применение различных модификаций AGG-терминальных олигонуклеотидов позволяет не только продлевать их терапевтическое действие, но и повышает его специфичность.
Таким образом, отличительной чертой заявляемого способа является возможность конструирования разнообразных теломерных последовательностей, различающихся не только окончаниями, но и последовательностью теломерного повтора. Это важно для достижения максимального терапевтического эффекта. В основе заявляемого способа лежит понимание роли различий последовательностей теломерного повтора для регулирования деления клетки.
В зависимости от вариации нуклеотидного окончания 3″ и 5′-концов теломерной ДНК совокупность ее G-оверхенгов представляет собой гетероморфную популяцию, различающуюся по нуклеотидному составу теломерных повторов. В зависимости от 5′-окончания С-цепи теломерной ДНК последовательность каждого однонитевого оверхенга G-цепи представляет собой n-е число одного из шести вариантов полноразмерного повтора из числа последовательностей SEQ ID NO:1-6. При этом оверхенги могут оканчиваться неполноразмерным повтором и различаться своими триплетными окончаниями, представленными в SEQ ID NO:7-12.
Было показано, что различные варианты теломерного повтора ДНК человека обладают уникальными спектральными характеристиками, обеспечивающими их специфическую флуоресценцию в клетке. В связи с этим становится понятна особая роль терминальных триплетов теломерных оверхенгов в регулировании деления клетки через установление баланса красного и зеленого цветов в их результирующей флуоресценции.
Таким образом, в основе заявляемого способа лежит использование различных вариаций последовательности теломерного повтора и его окончаний, которые обладают специфическим действием на экспрессию генов, регулирующих деление клетки. В примерах осуществления изобретения было показано, что терминальные нуклеотиды играют огромную роль в регуляции наступления максимумов экспрессии основных циклинов, а они, в свою очередь, регулируют наступление фаз клеточного цикла.
В связи с вышесказанным при конструировании теломерных олигонуклеотидов следует учитывать не только их окончание, но и начальные нуклеотиды. Именно они определяют последовательность теломерного повтора, который определяет их основные спектральные свойства. Было показано, что основную специфику флуоресценции теломерного олигонуклеотида определяет последовательность теломерного повтора, определяемая первыми шестью нуклеотидами, начиная с 5′-конца. Об этом свидетельствует проведенное исследование спектральных характеристик использованных в примерах теломерных последовательностей в зеленом спектре FAM-связанной флуоресценции (фиг. 8Б).
Диаграммы фигуры 8 демонстрируют прирост флуоресценции раствора свободного карбоксифлуоресцеинового красителя после добавления образцов теломерных олигонуклеотидов. При этом сравнение диаграмм фиг. 8 показало различие значений флуорофор-связанной флуоресценции последовательностей, состоящих из двух полноразмерных повторов (А), и последовательностей, оканчивающихся третьим неполноразмерным повтором в виде триплета (Б).
Основные функции в геноме клетки, подавляющие ее деление, должен обеспечивать теломерный повтор GTTAGG, обладающий высоким уровнем зеленой флуоресценции, характерной для неделящегося состояния клетки. Для последовательности (AGGGTT)2AGG ее основные спектральные свойства, связанные с невысоким уровнем зеленой флуоресценции, определил повтор AGGGTT (SEQ ID NO:5). Тем не менее, эта последовательность сохранила свое антифазное действие по отношению к другим вариантам окончаний теломерных олигонуклеотидов и показала подавляющее влияние на экспрессию циклинов в первые 10-12 часов воздействия на лимфоциты. Это привело к замедлению наступления митотической фазы клеточного цикла и увеличению его общей продолжительности, что демонстрирует сдвиг первичного максимума экспрессии циклина В1, ответственного за митотическую фазу деления, с 8 часов до 16 часов (фиг. 1Б). Таким образом, анализ влияния последовательностей, оканчивающихся неполноразмерным повтором, показал преимущественную роль терминальных окончаний в регуляции деления клетки.
Для последовательности (TTAGGG)2TTA основным теломерным повтором является последовательность TTAGGG (SEQ ID NO:3), которая определяет его основные спектральные характеристики, связанные с высокой флуоресценцией в зеленом диапазоне. При этом окончание ТТА вызвало некоторое снижение уровня зеленой флуоресценции этой последовательности по сравнению с олигонуклеотидом, состоящим из двух полноразмерных повторов. В связи с этим становится понятной роль окончаний полноразмерных теломерных повторов, входящих в состав последнего неполноразмерного повтора.
Последовательность (TTAGGG)2TTA не выявила ярко выраженного влияния на увеличение уровней мРНК циклинов. С одной стороны, это может быть связано с ее выраженной флуоресценцией в зеленом спектре и несоответствием квантовому режиму активированной к делению клетки, связанному с преобладанием красной флуоресценции. С другой стороны, может определяться воздействием этой последовательности, происходящим не в момент перехода G0-G1 фаз при активации клеточного деления, когда она оказывает максимальное стимулирующее воздействие. Тем не менее, продемонстрирована принципиальная роль ТТА окончания в стимуляции деления клетки через наступление оверэкспрессии интерлейкина-2 после 8 часов воздействия олигонуклеотида (фиг. 1Д). Результатом его стимулирующего действия также явилось ускорение прохождения фаз клеточного цикла и его самая укороченная продолжительность, о чем свидетельствует практически нулевой уровень циклина D2 на фоне отсутствия других циклинов после 16 часов воздействия (фиг. 1А-Г). При этом следует отметить синхронизирующую роль этой последовательности, приводящей к тому, что все пролиферирующие клетки к 16 часам закончили свое деление.
Интересен тот факт, что последовательность (GGGTTA)2GGG, представленная двумя полноразмерными повторами GGGTTA (SEQ ID NO:6), выявила такой же 8-часовой максимум экспрессии интерлейкина-2. Видимо, в этом случае ведущую роль сыграла последовательность основного теломерного повтора GGGTTA, ответственного за активацию деления клетки. Кроме того, окончание GGG также связано с активированным к делению состоянием клетки. Об этом свидетельствуют циклические периоды увеличения его содержания в клетках после триггерного момента активации деления, связанного с максимальным преобладанием ТТА окончания теломерных оверхенгов.
В связи с этим было установлено, что более эффективными по сравнению с использовавшимися в примерах осуществления изобретения последовательностями будут являться разновидности олигонуклеотидов, состоящие из полноразмерных теломерных повторов. Они сохраняют максимально выраженные различия спектральных свойств нуклеотидных окончаний, соответствующих целям воздействия на пролиферативный статус клеток. В частности, для подавления деления лучше использовать последовательности, состоящие из n-го количества полноразмерного повтора GTTAGG (SEQ ID NO:2).
Для активации деления клеток целесообразно использовать последовательности, состоящие из n-го количества полноразмерного повтора GGGTTA (SEQ ID NO:6). Эти последовательности, с одной стороны, обеспечат стимулирующее влияние окончания ТТА на деление клетки, а с другой стороны, благодаря преобладанию красной флуоресценции, будут полностью соответствовать квантовому состоянию активированной к делению клетки. В связи с этим использовавшаяся в примерах осуществления изобретения последовательность (TTAGGG)2TTA менее эффективна по сравнению с последовательностями на основе полноразмерного повтора GGGTTA. Вышеизложенные критерии принципиально отличают заявляемый способ от использовавшейся ранее концепции применения синтетических аналогов теломерной ДНК, которая исходила из понимания их роли лишь как сигналов повреждения ДНК, ведущих к аресту деления. Особое значение для заявляемого способа имеет понимание взаимоотношений между отдельными теломерными оверхенгами в клетке как элементами общей квантово-резонансной системы. При этом воздействие синтетическими аналогами оверхенгов понимается как внесение изменения в сложившуюся систему сложных связей. Таким образом, особое значение имеет момент внесения корректирующих олигонуклеотидов, что связано с установлением специфических для конкретной фазы клеточного цикла профилей терминальных нуклеотидов теломерных оверхенгов.
Особую роль играет установление антифазной динамики AGG терминального окончания оверхенгов по сравнению с другими вариантами окончаний. Именно этот вариант окончания теломерных олигонуклеотидов при использовании полноразмерных последовательностей теломерного повтора GTTAGG (SEQ ID NO:2) составляет основу воздействия на пролиферативный статус клетки с целью подавления деления. В связи с этим в противораковой терапии подобные аналоги теломерных последовательностей будут более эффективными по сравнению с использовавшейся ранее 11-членной формой GTTAGGGTTAG. При этом эффективность действия будет зависеть от того, в какие фазы клеточного цикла оно осуществляется. Внесение последовательностей на основе теломерного повтора GTTAGG (SEQ ID NO:2), обладающих терминальным триплетом AGG (SEQ ID NO:8) в момент активации деления будет носить блокирующее действие. Это связано с антифазным действием этого варианта окончания, наряду с TAG (SEQ ID NO:7) и GGG (SEQ ID NO:9) окончаниями, на неравновесный несбалансированный профиль терминальных нуклеотидов теломерных оверхенгов, связанный с преобладанием ТТА варианта их окончания. В здоровых клетках этот процесс приводит к торможению процесса триггерного перехода из G0 в G1 фазу клеточного цикла и накоплению клеток в фазе покоя.
В злокачественных клетках, кроме блокирования G0→G1 перехода при активации деления, воздействие AGG, TAG и GGG окончаниями в определенном соотношении способствует формированию равновесного сбалансированного профиля окончаний теломерных оверхенгов и осуществлению нормального хода клеточного цикла. Кроме того, это воздействие обеспечивает отключение эмбриоспецифической программы развития раковых клеток и осуществляет их возврат к тканеспецифической специализации.
После триггерного момента активации деления, когда в клетках устанавливается равновесный сбалансированный профиль терминальных нуклеотидов теломерной ДНК, добавление различных вариантов теломерных последовательностей приводит к сдвигам в наступлении фаз подготовки к делению и самого деления клеток. Специфичность воздействия различных окончаний и нуклеотидных вариаций теломерного повтора на наступление максимумов экспрессии генов, связанных с делением клетки, была показана в первых трех примерах осуществления изобретения. Таким образом, впервые была показана возможность влияния специфических последовательностей теломерной ДНК на время наступления фаз деления клетки и продолжительность всего клеточного цикла через регуляцию экспрессии генов циклинов.
Важно отметить, что в ходе прогрессии клеточного деления, связанной с установившимся равновесным профилем терминальных нуклеотидов теломерной ДНК, воздействие AGG варианта окончания, как и других вариантов терминальных триплетов, связано с влиянием на прохождение фаз митоза. На этом этапе функции AGG-терминального окончания отличаются от таковых при активации деления, так как это окончание способно предотвратить, но не прекратить уже начавшийся цикл деления.
Если подготовка к делению уже началась, AGG окончание, как и другие варианты окончаний, влияет на его ход. Было показано, что оно определяет наиболее пролонгированное наступление синтетической фазы подготовки к делению через 16-18 часов от начала нового клеточного цикла. Об этом свидетельствовала динамика экспрессии циклинов А2 и Е1 в примере 1 (фиг. 1А и В). Полное соответствие этого факта нормальной продолжительности клеточного цикла лимфоцитов определяет огромную роль AGG-терминального окончания теломерных оверхенгов в обеспечении этого процесса. В связи с этим становится понятной стратегия злокачественных клеток, связанная с уменьшением или полной редукцией этого окончания, для достижения сокращения продолжительности клеточного цикла. Возмещение недостатка AGG-терминального окончания теломерных оверхенгов составляет основу нового направления ДНК-терапии онкологических заболеваний.
Замедление наступления митотической фазы клеточного цикла и увеличение его общей продолжительности под воздействием AGG-терминальной теломерной последовательности демонстрирует сдвиг первичного максимума экспрессии циклина В1, ответственного за митотическую фазу деления, с 8 часов до 16 часов (фиг. 1Б). Это привело к увеличению общей продолжительности клеточного цикла на 8 часов. По сравнению с воздействием последовательности (TTAGGG)2TTA, при которой продолжительность клеточного цикла составила 16 часов, пролонгирование клеточного цикла под воздействием последовательности (AGGGTT)2AGG составило 50% от его общей продолжительности. Этот факт демонстрирует большие перспективы использования заявляемого способа для контролирования общей продолжительности клеточного цикла.
Подавление пролиферации клеток связано с антифазной динамикой воздействия AGG-терминального окончания на экспрессию генов циклинов и интерлейкина-2 по отношению к действию других теломерных окончаний. Это определяется тем, что все другие окончания представляют собой определенные этапы превращения исходного окончания AGG в цепи понуклеотидных переходов терминальных триплетов: AGG→TAG→TTA→GTT→GGT→GGG. При этом каждый сдвиг и каждое окончание характеризуются своим временем наступления максимумов экспрессии генов, контролирующих деление клетки.
В заявляемом способе открытые формы теломерных оверхенгов воспринимаются не только как сигнал о повреждении петлевой организации ДНК, запускающей репаративные процессы, блокирующие клеточный цикл, а прежде всего как особые сигналы молекулярной и квантово-оптической природы, управляющие клеткой. При этом важно использование тщательно подобранной концентрации теломерных олигонуклеотидов, находящейся в соответствии с физиологическим уровнем теломерных оверхенгов в клетках.
Применение физиологически адаптированных концентраций синтетических теломерных олигонуклеотидов, меньше использовавшейся ранее 40 микромолярной концентрации, позволяет избежать их токсического переизбытка. При этом синтетические последовательности вступают во взаимодействие с нативными оверхенгами, образуя единую систему квантово-оптического регулирования работы генома и процессов жизнедеятельности клетки, включая ее деление.
Внесение в клетки чрезмерного количества синтетических аналогов теломерных оверхенгов, как это было принято ранее, приводит к поломке тонкого механизма работы генома. Конечно, и в этом случае эксперименты имели свой результат, но далекий от того, что может дать точное оперирование концентрациями, нуклеотидными вариациями теломерных повторов и окончаниями теломерных оверхенгов. Именно на этих новых принципах базируется заявляемый способ воздействия на пролиферативный статус клеток с помощью специфических нуклеотидных последовательностей G-цепи теломерной ДНК человека. Это позволяет существенно повысить специфичность и эффективность использования теломерной ДНК-терапии с помощью заявляемых специфических последовательностей и открывает широкие перспективы ее использования в различных областях медицины.
Реферат
Изобретение относится к области биотехнологии, а именно к способу воздействия на пролиферативный статус клеток. Предложенное изобретение может быть использовано в медицине в области лечения онкологических заболеваний, в иммунологии, в геронтологии и косметологии. Способ включает внесение в среду, окружающую клетки, и последующее проникновение в них специфических нуклеотидных последовательностей однонитевых оверхенгов G-цепи теломерной ДНК человека в конечной концентрации, не превышающей 30 мкМ. Указанные последовательности различаются вариациями теломерного повтора ДНК и триплетными окончаниями. Предложенное изобретение позволяет контролировать время наступления определенных фаз клеточного цикла и его общую продолжительность. 7 з.п. ф-лы, 8 ил., 4 пр.

Комментарии