Рекомбинантная днк в качестве средства для торможения в живом организме функции рнк - RU2136751C1
Код документа: RU2136751C1
Чертежи











Описание
Изобретение относится к области ингибирования генов, более конкретно к рекомбинантной ДНК, служащей в качестве средства для торможения в живом организме функции РНК.
Общеизвестно ингибирование РНК в пробирке при помощи так называемого "рибозима", который обладает способностью распознавать определенные последовательности РНК, связываться с ними и расщеплять их. Этот принцип торможения был выведен из наблюдаемых в живом организме автокаталитических реакций расщепления молекул РНК в растительных вироидах и спутничных РНК.
Основываясь на определенных требованиях к структуре для катализированного рибозимом расщепления РНК можно поэтому конструировать рибозимы, которые имеют направленную на определенную целевую последовательность "in trans" активность эндонуклеазы. Так как такие рибозимы, из которых наиболее подробно исследованные до сих пор ввиду их структуры называют "молотоголовыми" рибозимами, могут действовать на многочисленные различные последовательности, можно практически для любого РНК-субстрата "сшить по размеру" соответствующий рибозим. Это делает рибозимы интересными, исключительно эластичными инструментами для ингибирования специфических генов и в качестве многообещающей альтернативы для анти -м.конструктов, которые ухе показали потенциальную пользу в терапии.
Одна из известных в настоящее время, наиболее подробно исследованных моделей рибозимов содержит три структурных домена, основываясь на этой модели, уже были построены с успехом рибозимы против CAT-мРНК (Haseloff и др., 1988; Nature 334, стр. 585 - 591; Uhlenbeck и др., (1987), Nature 328, стр. 596 - 600).
Эти три домена содержат:
а) Высококонсервированную область нуклеотидов, которая фланкирует место расщепления в 5'-направлении. При этом
речь идет обычно о последовательности GUC, хотя и модификация GUA или GUU показала, в основном, не уменьшенную активность расщепления. Расщепление проявилось также после последовательностей CUC, и в
меньшей степени также для AUC и UUC (предъявленные к эффективному расщеплению требования полностью не выяснены).
б). Содержащиеся в существующих в природе доменах расщепления рибозима высококонсервированные последовательности, которые образуют вид стебля с парами оснований.
в). Фланкирующие место расщепления на обеих сторонах области, которые гарантируют точное размещение рибозима относительно места расщепления и связь с ферментом (в проведенных до сих опытах выбирали с обеих сторон по 8 оснований).
РНК-ферменты могут конструироваться по этой модели и они оказались в пробирке уже пригодными для эффективного и специфического расщепления РНК-последовательностей (см. вышеназванную литературу Haselhoff и др.).
Проведенные в ходе разработки настоящего изобретения работы показали, что достигаемых в пробирке результатов нельзя было достигнуть при опытах в живом организме, что, в первую очередь, было обусловлено тем, что рибозимы нельзя было встроить в клетки в концентрации, достаточной для эффективности исключения определенной биологической реакции.
Следовательно, задачей изобретения является разработка рекомбинантной ДНК, при помощи которой можно достигать эффективного торможения в живом организме функции РНК.
Данная задача решается прелагаемым средством для торможения в живом организме функции РНК, представляющем собой рекомбинантную ДНК, содержащую нуклеотидную последовательность, кодирующую т-РНК, и кодирующую рибозим нуклеотидную последовательность, расположенную между сигналами инициации и терминации для транскрипции полимеразой III нуклеотидной последовательности, кодирующей т-РНК, в качестве средства для торможения в живом организме функции РНК.
Ингибирующей РНК может быть любой рибозим или другая РНК, ингибирующая мРНК, например, анти-мРНК.
В принципе было бы возможным осуществление эффективного переноса РНК или кодирующей ее ДНК-последовательности через вирусы или вирусные носители, например, ретровирусы.
Правда, эта система имеет некоторые существенные недостатки, такие, как мобилизация эндогенных вирусов, рекомбинация с эндогенными ретровирусами, активация эндогенных генов путем интеграции, ограничение относительно организма-хозяина и вида ткани.
В противоположность этому гены-носители по изобретению не имеют этих недостатков.
Гены, применяемые в качестве генов-носителей для РНК-генов в рамках настоящего изобретения, имеют следующие преимущества: они имеют компактную структуру, могут на основании своего небольшого размера легче транспортироваться в клетки, имеют повышенную скорость транскрипции и по своей экспрессии не ограничиваются определенными тканями, а экспримируют повсеместно, т.е. почти во всех типах клеток.
Другое преимущество генов полимеразы III заключается в наличии очень сильного сигнала терминации. В результате этого значительно сокращается вероятность, что расположенный вблизи клеточный ген нежелательным образом активируется.
Транскрибированные полимеразой III гены имеют следующие характерные особенности: при этом речь идет о генах, промотор которых находится не перед геном в направлении против течения, а внутри гена (Geiduschek и др., 1988, Ann. Rev.Biochem. 57, 873 - 914). Эти существенные для связывания полимеразы III внутренние контрольные области имеют периодическую структуру; они состоят из двух так называемых "боксов" или "блоков" (A-бокс и B-бокс), которые являются существенными для распознавания транскрипционными факторами и из расположенного между ними генного участка, который является критическим в отношении своей длины (Hofstetter и др.; 1981, Cell 24, 573 - 585). Длина этой последовательности составляет при транспортных РНК-генах (далее "гены т-РНК")) 31-74 пары оснований.
Представителями этих транскрибированных полимеразой III генов являются гены т-РНК, 5S-РНК и ряд других небольших ядро- и цитоплазменных генов РНК: ESK, 7SL, M, U6, в также гены VA1 и VA2 аденовируса (ср. указанную выше литературу Geiduschek и др.). Общим для этих генов являются их меньший размер, компактная структура, высокая скорость транскрипции и почти повсеместная транскрипция.
Неожиданно было установлено, что с помощью генетических единиц по изобретению можно достигнуть повышенной устойчивости тормозящей РНК без снижения их эффективности относительно активности.
Уже было показано Jennings и др., 1987, EMBO-1, том 6, N 10, стр. 3043 - 3047, что специфический, распознаваемый полимеразой III, промотор пригоден для управления синтезом анти-мРНК. Для этого XbaI/Bam H1-фрагмент VA1-гена, содержащий промотор, клонировали в 5'-направлении перед противочувствительной ДНК, что соответствует традиционному принципу при применении промотора полимеразы II. Стремились получать транскрипт, короткий по сравнению с транскриптами полимеразой II. Транскрипт имеет только незначительную модификацию, которая делает возможным спаривание оснований на концах, чтобы защищать концы от переваривания однонитевыми экзонуклеазами.
В противоположность этому предложению, в котором применяют только промоторную последовательность специфического гена полимеразы III (область между положениями -30 и 73, в то время как дикий тип VAI-гена распространяется до терминирующей последовательности в положениях +160 до+ 200), согласно настоящему изобретению целенаправленно применяют дополнительно те последовательности гена полимеразы III, которые имеют решающее значение для вторичной структуры транскрипта, чтобы использовать последнюю для стабилизации тормозящих РНК- последовательностей. В противоположность вышеописанному предложению кодирующая тормозящую РНК генная последовательность расположена внутри транскрибированного полимеразой III гена таким образом, что по изобретению существует "генная кассета".
Кроме того, применяемые в рамках настоящего изобретения гены- носители в противоположность вирусному VAI-гену нетоксичны.
Применение в
рамках изобретения транскрибированных полимеразой- III генов является гибким. Принимая во внимание их функцию в качестве генов-носителей для тормозящих РНК последовательностей, при выборе или
модификации природных или при конструировании искусственных генов необходимо учитывать следующие критерии:
1) A- и B-боксы имеют высокую консервацию.
2) Участок от 5 до 7 Т-остатков в направлении вниз по течению B-бокса отвечает за окончание транскрипции.
3) Расстояние между A- и B-боксом нельзя увеличивать до любого размера, при чем максимальная величина в настоящее время принимается около 90 пар оснований (далее "п.о.").
4) В некоторых системах 5'-фланкирующая последовательность оказывает влияние на транскрипцию.
5) Имеются указания на то, что интактная основная область антикодона имеет существенное значение для стабильности транскрипта.
Особенно пригодными в качестве генов-носителей для получения рекомбинантной ДНК по изобретению являются гены т-РНК. Кодированные этими генами РНК считают, кроме того, на основании их структуры в форме трилистника, особенно пригодными для придания стабильности тормозящей РНК. С их помощью можно получать компактные продуцирующие РНК рекомбинантные ДНК, причем кодирующую, тормозящую РНК последовательность вводят между A- и B-блоки (фиг. 1 позывает схематическое получение гена рибозима т-РНК) (фиг. 1-17 см. в конце описания).
Опыты в рамках настоящего изобретения были проведены с т-РНК стартового метионина, которая имеет рестрикционное место Apa 1 в расположенной между A- и B-блоком области штамма антикодона и его области в виде петли (т-РНК инициирующего метионина всех высших эукариотов имеют это место рестрикции в петле антикодона).
Кроме расположенной между A- и B-блоком области возможны также другие места вставки служащих в качестве носителей ДНК- последовательностях (гены т-РНК или другие гены полимеразы III, пока гарантировано, что сохраняются активность транскрипции полимеразы III и стабильность транкрипта.
Однако рекомбинантную ДНК по изобретению, в принципе, можно получать со всеми т-РНК; в случае необходимости можно конструировать подходящее место рестрикции, в которое вставляют кодирующую тормозящую РНК последовательность. При вставке следует только обращать внимание на то, чтобы в области штамма антикодона не происходил обмен оснований, который наносит ущерб скорости транскрипции гена или стабильности получающейся т-РНК. Кроме того, следует учитывать то обстоятельство, что вставки длиной более 60 п.о. могут причинять ущерб траскрипции.
Относительно выбора подходящих генов-носителей, в принципе, стремятся применять специальные виды РНК-генов или другие транскрибированные полимеразой III гены, которые не являются токсичными.
Опыты в рамках настоящего изобретения были проведены за счет встроения в нормальные гены т-РНК рибозимных последовательностей. Если т-РНК/рибозим, который транскрибируется этим геном, локализован преимущественно в цитоплазме, а для определенных целей, например, чтобы тормозить ядерно-специфические РНК, например, РНК частиц snRNP, желательно локализовать в ядре т-РНК/рибозим или т-РНК/анти-мРНК, то могут применяться мутанты, которые локализованы преимущественно в ядре, например, описанный Zastoff и др., 1982, Nature 300, 81 - 84, Zastoff и др., 1983, Proc. Acid Sci. 80, 6426 - 6440, ген met i т-РНК, который имеет один единственный обмен оснований.
Предлагаемую рекомбинантную ДНК можно получать, например, следующим образом.
Копию транскрибированного полимеразой III гена, например, гена т-РНК, содержащегося в бактериальной плазмиде, расщепляют подходящим рестрикционным энзимом в предусмотренном для вставки месте, например, между A- и B-блоком, куда вставляют полученную известными методами двухнитевую ДНК, кодирующую ингибирующую РНК. Получаемым при этом конструктом трансформируют организмы-хозяева, после чего осуществляют отбор, размножение и выделение амплифицированной плазмидной ДНК. Плазмиды исследуют на наличие в них предлагаемой рекомбинантной ДНК, что может осуществляться путем рестрикционного переваривания, анализа последовательностей или доказательства функционального in vitro транскрипта плазмидной ДНК.
Полученная таким образом рекомбинантная ДНК может применяться как в форме кругообразной плазмиды, так и в форме вырезанной из плазмиды генного конструкта, который содержит все необходимые для транскрипции полимеразой III информации.
При выборе формы руководствуются в общем областью применения и транспортной системой, выбранной для введения рекомбинантной ДНК в клетку.
Предлагаемая рекомбинантная ДНК может существовать также как многократные копии (при этом речь идет о тандемных структурах, в которых ДНК расположена многократно друг за другой, причем тормозящие вставки могут быть одинаковыми или различными).
Транскрипция такого тандема на основании содержащихся в каждой отдельной ДНК промоторных сигналов и сигналов терминации дает отделенные друг от друга РНК-единицы. На основании этого свойства фрагментов, то есть существование как соответственно комплектные транскрипционные единицы, и ориентация отдельных единиц относительно друг друга является незначительной. При получении таких тандемов исходят из плазмид, которые содержат многократные копии кодирующей тормозящие единицы области. Векторы, содержащие множественные гены т-РНК/рибозима можно получать, например, исходя из описанного в примере 1 метода, при котором с применением Т4 ДНК-лигазы отдельные фрагменты лигируют до полимеров, и полимерные гены повторно клонируют в соответствующее рестрикционное место подходящего плазмидного вектора. Получение таких тандемов становится возможным благодаря небольшому размеру рекомбинантной ДНК по изобретению, который составляет от 200 до 350 п. о. При помощи такого "тандем-ингибитора" после получения гетеромерного комплекса анти-мРНК или рибозимов можно в единственном опыте испытывать эффективность набора ингибиторов. Например, таким образом можно вводить смесь от 5 до 10 рибозимов в клеточную систему. После того как произошло торможение смесью, можно исследовать отдельные рибозимы на их эффективность. Это особенно выгодно с учетом того факта, что критерии для выбора подлежащих торможению целевых РНК-последовательностей еще не исследованы до конца.
В качестве хороших целевых последовательностей можно рассматривать, например, такие области, которые не имеют вторичной структуры, области, близкие к сигналам расщепления, области после иницирующего кодона, области без мест связи для специфических протеинов (как, например, Sm-место связи в SnPHK-молекулах). С помощью настоящего изобретения, особенно при применении в тандем- форме, становится возможным получение разъяснений о таких целевых последовательностях и эффективно тормозить их впоследствии.
Применение тандем-единиц имеет преимущество и в том случае, когда для инактивации биологических процессов требуется во многих местах расщеплять РНК, например, вирусные РНК. Многократное расщепление можно достигать, например, тогда, когда конструируют большее количество различных рибозимов, и вектор, содержащий рекомбинантную ДНК с соответственно кодирующими их ДНК-последовательностям, вводят в клетки. При транскрипции этих последовательностей рибозимные участки связываются с соответствующими целевыми последовательностями, вследствие чего мРНК расщепляется на обломки.
Множественные копии можно применять в тех случаях, когда для обеспечения эффективности в определенных случаях, например, при применении транспортной системы из трансферрина и поликатиона, требуется большие количества низкомолекулярного рибозима. Плазмиды, несущие множественные копии рекомбинантной ДНК, которые содержат кодирующую этот рибозим ДНК-последовательность, улучшают производство фрагментов повышением выхода в несколько раз.
Тандем-конструкты можно выгодно применять и в том случае, если одновременно должны вырабатываться тормозящие РНК, которые направлены против различных видов РНК.
При применении изобретения к анти-мРНК следует обратить внимание на то, что при генах т-РНК размер вставок ограничен. Принимая во внимание эффективную транскрипцию, размер составляет порядка около 60 п.о. Поэтому при применении более крупных конструктов анти-мРНК следует учитывать другие транскрибируемые полимеразой III гены, которые относительно транскрипции более длинных последовательностей имеют большую емкость.
Применяемые в рамках изобретения гены-носители можно получать также синтетически при условии, что они выполняют то условие, что они имеют необходимые для транскрипции
полимеразой III транскрипционные участки. Применение таких синтетических генов может дать следующие преимущества:
а) Такие гены не распознаются и рибосомами, вследствие чего предотвращается
вмешательство в механизмы трансляции клетки.
б) Существует возможность, благодаря созданию синтетических конструктов получать тормозящие РНК с большей стабильностью и с большей скоростью транскрипции, чем при применении природного гена.
в) Благодаря созданию синтетических последовательностей процесс клонирования можно сделать более гибким.
В рамках настоящего изобретения было установлено, что устойчивость молекул рибозима и т-РНК можно повышать тем, что удлиняют область штамма антикодона молекулы ДНК. Можно было показать, что удлинением имеющей 5 пар оснований области штамма антикодона гена т- РНК дикого типа до 9 пар оснований достигают количества транскрипта, повышенного в 6 раз по сравнению с укороченным геном т-РНК дикого типа, что может быть объяснено повышением стабильности и достигаемой этим реализуемости процесса.
Далее было установлено, что повышение стабильности рекомбинантной ДНК по изобретению в форме генов т-РНК и рибозима или генов т-РНК и анти-мРНК можно достигнуть также в том случае, если кодирующие тормозящую РНК-функцию ДНК-последовательности существуют как часть интронов (называемых в случае рибозимов как "рибинтроны"). При этом исходили из соображения, что существующие в природе интроны не изменяют вторичную структуру молекул-предшественников т-РНК и интроны РНК не показывают сохранения последовательностей, вследствие чего клонированием рибозимных или анти-м-последовательностей как части интронов изменение структуры получающегося предшественника т-РНК можно сводить до минимума и его стабильность повышать тем самым до максимума. На примере примененного в рамках настоящего изобретения гена tyrt-РНК, при котором соединение молекул предшественника т-РНК происходит медленно, можно было показать, что в результате применения содержащих "рибинтрон"-последовательности молекул т-ДНК можно эффективно повышать активность ribt-РНК.
Тем самым можно усиленно воздействовать на локализованные в цитоплазме РНК. Эта система дает возможность простым методом встраивать подходящие структурные элементы для повышения стабильности "рибинтронов" по сравнению с расщеплением экзонуклеазами. Этого можно достигнуть, например, дополнительными спариваниями оснований или большими областями в виде "шпильки" смежными с последовательностями рибозимов. При подобных модификациях следует принимать во внимание, что сохраняются решающие для соединения интронов структуры.
Природные последовательности интронов можно модифицировать, например, включением подходящих рестрикционных мест, чтобы способствовать клонированию олигонуклеотидов, или, если они не содержатся в существующем природном гене, включением нуклеотидов, которые способствуют спариванию оснований с триплетом антикодона, чтобы располагать дополнительно стабилизирующим структурным звеном.
Можно было показать в рамках настоящего изобретения, что экспрессия рибозимов как составной части интрона, в основном, не наносит никакого вреда вторичной структуры т-РНК, вследствие чего образующийся транскрипт накапливается в высокой концентрации и может правильно использоваться в процессе. Если выделяющийся во время процесса интрон оказывается недостаточно стабильным, можно предусматривать подходящие структурные звенья, которые вызывают повышение стабильности по сравнению с расщеплением экзонуклеазами.
Для осуществления введения рекомбинантной ДНК по изобретению в клетку можно применять много методов.
Стандартный метод введения ДНК в клетки тканевой культуры использует образование со-осадка между ДНК и фосфатом кальция (Graham и др., 1973, Viriology 52, 456 - 467). Осадок добавляют к клеткам, которые поглощают определенную часть, возможно, в результате процесса пиноцитоза. Побочный метод использует положительно зараженный материал, ДЕАЕ- декстран, (= гидрохлорид простого полидиэтиламиноэтилового эфира декстрана), который облегчает поглощение ДНК клеткой. Были разработаны также методы введения ДНК в клетку электропорообразованием (при этом благодаря пульсирующему электрическому полю образуются временно поры) (Langridge и др.., 1987, Methods, Enzymol. 153, 336 - 351). Применяют также техники микроинъекции для введения в большие клетки (Kressmann и др. 1980) и клетки тканевой культуры (Pepperkok и др., Proc. Natl. Acad. Sci. 1988, 72, 98 - 102). Однако эти методы пригодны только для работ в лаборатории или "in vitro". Недавно был разработан синтетический катионный пептид (ДОТМA), который самопроизвольно образует с ДНК липосомы и облегчает таким путем перенос в клетки (Feigner и др., 1987, Proc. Natl. Acad. Sci. 84, 7413 - 7417). В принципе, как уже упомянуто, для переноса генетического материала в клетку пригодны также ретровирусные носители (Steward и др., 1986, 1987 EMBO J. 6. 383 - 388; однако эти системы имеют уже указанные недостатки.
Другой механизм переноса основывается на использовании "обезвооруженных" токсинов в качестве транспортного средства.
Все применяемые до сих пор способы транспорта имеют тот недостаток, что могут транспортировать в клетку
недостаточное количество тормозящей нуклеиновой кислоты. Теперь с помощью настоящего изобретения на основании небольшого размера и компактности молекул можно достигнуть, в пересчете на транспортную
емкость, повышения числа активных единиц ингибитора. На основании небольшого размера и компактной структуры рекомбинантной ДНК по изобретению после незначительных модификаций, например, конъюгации с
холестерином, липофильными противоионами или локализированными в ядре пептидами, можно целиком отказаться также от транспортной системы
Предпочтительно в рамках настоящего изобретения
применяют растворимую систему для осуществления транспорта, который протекает через эндоцитоз с рецептором в качестве посредника. При этом особенно предпочитают образование комплекса конъюгата
трансферрина и поликатиона с рекомбинантной ДНК по изобретению; комплекс поглощается рецептором трансферрина, который имеется практически на всех растущих клетках.
Области применения настоящего изобретения многочислены; например, можно получать трансгенные животные, которые на основании наличия в генетическом материале генетических единиц по изобретению имеют внутриклеточный иммунитет против вирусов, например, вируса ящура, вируса болезни Ньюкастл, вируса папилломы крупного рогатого скота, псевдобешенства или инфекционного гастроэнтерита.
Соответственно можно создавать внутриклеточный иммунитет, например, против картофельного вируса PVX, также в трансгенных растениях.
Далее генетические единицы по изобретению можно вводить в соматические клетки, чтобы применять рибозимы или анти-мРНК для борьбы с патогенными вирусами, как HIV или сродственными ретровирусами.
Другой областью применения изобретения является генная терапия, где можно использовать конструкции РНК с комплементарностью к онкогенам или другим ключевым генам, которые контролируют рост и/или дифференцирование клеток. При подобных применениях получается эффективно достигаемая с помощью настоящего изобретения высокая специфичность торможения РНК, при помощи которой возможно, например, распознавание между транскриптами протоонкогена и онкогена.
Далее, рекомбинантная ДНК по изобретению можно применять для предотвращения в растениях или животных экспрессии специфических генов, чтобы таким путем создавать желательные свойства.
Тормозящее действие РНК можно также использовать для борьбы с заболеваниями с таким расчетом, что подавляют производство нежелательных генных продуктов, например, производство появляющегося при болезни Альцгеймера блешечного протеина, дающего основное пятно, или вызывающих аутоиммунные заболевания протеинов.
Настоящее изобретение можно применять также в тех случаях, в которых протеин-регулятор, способный к взаимодействию с РНК, должен исключаться присоединением РНК.
На основании проведенных в рамках настоящего изобретения опытов можно было доказать транскрипционную активность гена т-ДНК/рибозима. Для этого был сконструирован ген т-ДНК и рибозима за счет того, что ДНК-последовательность, кодирующая направленный против SnPHK U7- последовательности рибозим длиной 53 п.о., была вставлена в рестрикционное место Apal между A-боксом и B-боксом стартового метионинового т-ДНК (A-бокс и B-бокс представляют обе последовательности распознавания полимеразой; транскрипция начинается от 15 п.о. вверх против течения A-бокса и кончается на олиго-Т- последовательности вниз по течению B-бокса). После микроинъекции этого гена была обнаружена транскрипция; концентрация гибрида т-РНК/рибозима составляла 10 - 20% от концентрации т-РНК, которая продуцировалась со-инъецированного гена т-РНК дикого типа.
Молекулы РНК, синтезированные в пробирке геном т-РНК/рибозима, расщепляют целевые РНК в предусмотренном месте. Добавление т-РНК- структуры к последовательности рибозима не блокирует активность рибозима. Молекулы т-РНК и рибозима, синтезированные генами, которыми были инъецированы в ооциты, расщепляют целевые РНК также в предусмотренном месте и с такой же эффективностью, как синтезированные в пробирке рибозимы без дополнительной структуры т-РНК. Это доказывает, что синтез in vitro и реализация процессов с помощью т-РНК/рибозима не сопровождаются модификациями, которые препятствуют действию рибозима.
В рамках настоящего изобретения впервые на живом организме была доказана активность рибозима. Для этого гены т-ДНК/рибозима вместе с радиоактивными мечеными GTP были инъецированы в ядро ооцитов. После 8- часового инкубирования, которое было предусмотрено для синтеза рибозимов, в цитоплазму ооцитов была инъецирована радиоактивно меченая субстратная РНК (РНК U7). Еще через два часа была приготовлена нуклеиновая кислота из ооцитов: в ооцитах, в которых произошел синтез рибозима, не было обнаружено субстратной РНК. В противоположность этому субстратная РНК была устойчивой в тех ооцитах, которые не были инъецированы геном т-ДНК/рибозима или у которых ген не достиг ядра.
В рамках настоящего изобретения можно было также показать, что т- ДНК/рибозимы по изобретению могут тормозить трансформирующее действие онкогена. На примере эритроидных куриных клеток, трансформированных erеB-онкогеном, была доказана активность т-РНК/рибозима через наступающее в результате торможения eraB-экспрессии дифференцирование клеток в эритроцитах.
Эффективность рекомбинантной ДНК по изобретению можно проверить наблюдением резистентности мышиных клеток против инфекции, например, полиомных инфекций, после дачи рекомбинантной ДНК по изобретению, которая направлена против вируса (в случае необходимости против нескольких областей), например, против вируса папилломы.
Пример 1
Конструирование генов т-РНК/рибозима
а) Конструирование pSPT18metl
т-РНК-ген Xenopus метионинового инициатора, имеющийся на EcoRI-фрагменте размером 284 п. о. клонированного в pBR322 (Hinfl H-G- фрагмент), выделяют перевариванием вектора pBR322 с помощью EcoRI,
очищают электрофорезом на геле (2% агарозы/TBE-буфер) и вводят в EcoRI место бактериальной плазмиды pSPT 18 таким образом, что при транскрипции SP6-полимеразой плазмиды получают транскрипт
чувствительной т-РНК. Для этого применяют стандартные методы клонирования. Основное преимущество реклонирования гена т-РНК в pSPT18 заключается в наличии расположенных на плазмиде друг против друга
SP6- и Т7-РНК промоторов полимеразы. Поэтому можно транскрипцией в пробирке получать специфические РНК-транскрипты, которые содержат или последовательность т-РНК/рибозима или комплементарную к ней
последовательность.
Эти транскрипты полезны для того, чтобы определить активность расщепления молекулы РНК или доказать присутствие т-РНК/рибозима в клеточных экстрактах, экспримирующих т-РНК/рибозим, с использованием метода картирования при защите РНКазы.
б) Конструирование генов т-РНК/рибозима
Ген т-РНК на pSPT18 metl расщепляют в
единственном Apal месте в области штамма антикодона и его петлевой области (см. фиг.2). Этот рисунок показывает плазмиды, которые содержат кодирующие последовательности т-РНК и рибозима. pSPT18 metl
содержит EcoRI- фрагмент размером 284 п.о., который несет инициаторный ген т-РНК Xenopus laevis. При этом речь идет о G-Н-фрагменте, клонированном в EcoRI-место полилинкера pSPT18. Показаны
комплементарные олигонуклеотиды, кодирующие рибозимы, которые направлены против U7SnPHK (CD33 и обе последовательности ereB-м РНК (ES13, ES53). Применяемая здесь стратегия клонирования приводит к
удалению выступающих концов Apal-места в гене т-РНК. Отмечена часть вставки, кодирующей рибозим и комплементарные к целевой РНК области (Anti - U7, Anti - erbB), также показаны A- и B-боксы, участок
пять Т-остатков (терминирующий сигнал) и места инициирования транскрипции. Плазмида содержит
ColEl начало репликации, маркер резистентности к ампицилину и промоторы Т7- и SP6- РНК-полимеразы.
Для получения двунитевых синтетических ДНК-олигонуклеотидов, кодирующих вироидную последовательность расщепления, фланкированную комплементарными к целевой мРНК последовательностями, сначала получают однонитевые олигонуклеотиды стандартными методами. Комплементарные олигонуклеотиды фосфорилируют, "отжигают" и связывают с расщепленной Apal плазмидой pSPT18 met 1, применяя стандартные методы.
Смесь лигирования применяют для трансформации E.coli HP 101, клоны бактерий, которые содержат новую плазмиду, выделяют и наличие активных рибозимных последовательностей на
бактериальной плазмиде подтверждают двумя способами:
1) молекулы РНК, которые происходили от ДНК-плазмид, клонированных в пробирке SP6-транскрипцией, инкубируют вместе с радиоактивно
маркированной РНК, содержащей целевую последовательность для рибозима, и испытывают на специфическое расщепление целевой РНК (см. фиг. 4).
2) Наличие правильно вставленных ДНК-последовательностей было подтверждено известным дидеокиси-методом.
Фиг. 4 показывает рибозимную активность т-РНК/рибозима "in vitro". Молекулы плазмидной ДНК, которые содержат рибозимы ES13 и ES53, переваривают посредством PvuII и транскрибируют посредством SP6- РНК-полимеразы. Эта транскрипция дает молекулы т-РНК длиной 230 нуклеотидов, которые содержат последовательность т-РНК/рибозима и дополнительно 5'- и 3'-фланкирующие последовательности, которые происходят от фланкирующих последовательностей Xenopus и от фланкирующих бактериальных плазмидных последовательностей (см. фиг. 2). Рибозимные транскрипты инкубируют вместе с 20•10-15 М меченой 20 000 cpm (cpm = число отсчетов в минуту) молекулы РНК с областью erbB-мРНК, включающей инициирующий кодон. Молекула РНК имеет целевые последовательности для ES13 и ES53 (см. фиг.3). После 2-часового инкубирования рибозима плюс целевой РНК при 37oC в присутствии 10 ммолль хлористого магния, 20 моль трис-HCl, pH 7,5 и 150 ммоль хлористого натрия, добавляют этилендиаминтетрауксусную кислоту (далее: "ЭДТУК") в концентрации 15 ммоль, сушат пробу, растворяют в 80%-ном формамиде в TBE буфере, нагревают 30 сек. при 95oC и разделяют на геле, содержащем 9,5% акриламида и 8,3 моль мочевины в TBE-буфере. После электрофореза маркированные молекулы РНК доказывают ауторадиографией.
След m: маркер молекулярного веса: ДНК pBR322, расщепленная посредством HpaII с применением фрагмента кленова ДНК-полимеразы и радиоактивно маркированная альфа-32-P-GTP. Маркер молекулярного веса непосредственно перед нанесением на гель растворяют в 80%-ном формамиде в TBE-буфере и нагревают 3 мин при 95oC. Молекулярный вес некоторых фрагментов (в нуклеотидах) указаны слева.
След 1: erbB-целевая мРНК (20 000; 20•10-15 М) без инкубирования.
След 2: erbB-целевая мРНК (20 000 cpm; 20•10-15 М), инкубирование в присутствии хлористого магния при 37oC без рибозимов.
След 3: erbB-целевая мРНК (20 000 cpm; 20•10-15 М), инкубирование вместе с РНК ES13. (1•10-15 М).
След 4: erbB-целевая мРНК (20 000 cpm; 20 10 М), инкубирование вместе с РНК ES53.
Фиг. 3 показывает комплементарность между рибозимами и
целевыми РНК: CD33 (A) к U7snPHK,
ES13 (C) и ES53 (B) к последовательностям erbBм-РНК. Часть т-РНК по причине наглядности не показана. Места расщепления для рибозима показаны также как и
инициирующие кодоны erbB- мРНК.
Пример 2
Транскрипция т-РНК/рибозима в ооцитах Xenopus.
Транскрипцию генов т-РНК/рибозима, микроинъецированных в ооцитах Xenopus, осуществляют следующим образом. Имеющую стадию VI ооциты получают от стимулированных гуманным гонадотропином взрослых самок Xenopus laevis. Ооциты центрифугируют с тем, чтобы отводить ядро к краю ооцитов. В каждое ядро инъецируют приблизительно 50 нл раствора, содержащего 0,3 мкг/мкл переохлажденной плазмидной ДНК (содержащей ген т-РНК/рибозима по примеру 1) и 2 мкCi/мкл32 P-GTP. После 5-8-часвового инкубирования при 20oC отдельные инъецированные ооциты переваривают в среде, содержащей 1% додецилсульфата натрия (далее: "ДСН"), 1 мг/мл протеиназы К, 300 ммоль хлористого натрия, 20 ммоль трис, pH 8, 20 ммоль ЭДТУК, экстрагируют раз фенолом и раз смесью фенола и хлороформа и осаждают этанолом. Собранные из этанола осадки растворяют в 80%-ном формамиде в TBE-буфере, нагревают, с целью денатурации, при 90oC и разделяют путем электрофореза на геле, содержащем 10% акриламида и 8,3 моль мочевины в TBE-буфере, после чего осуществляют ауторадиографию. Во всех опытах с генами т-РНК/рибозима растворы для инъекции содержат ген met РНК дикого типа с концентрацией 1/6 от концентрации гена т-РНК/рибозима. TBE-буфер (трис, борат, ЭДТУК) приготовляют по общеизвестной рецептуре.
Результаты этих опытов показывает фиг. 3.
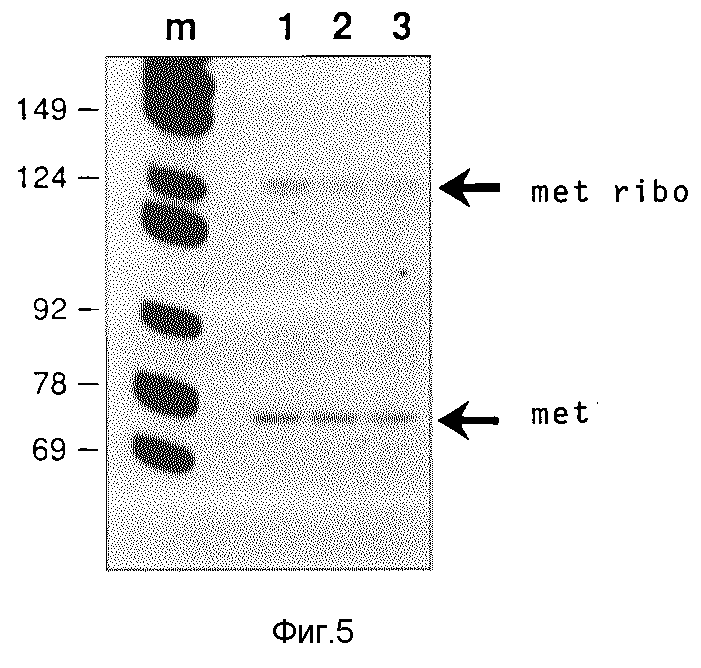
След n: маркер молекулярного веса: как на фиг.4. Молекулярный вес некоторых фрагментов (в нуклеотидах) указаны слева. Следы 1, 2, 3: нуклеиновые кислоты отдельных ооцитов инъецированных геном Met-т-РНК и геном metribo 33 Met-т-РНК/рибозима. Справа на фиг. 5 указаны положения Met-т-РНК (met; 77 нуклеотидов длиной) и т-РНКрибозима (met/ribo; 128 нуклеотидов длиной).
Пример 3
Определение рибозимной активности синтезированного ооцитами т-РНК/рибозима
по сравнению с синтетизированным в пробирке рибозимом, который не имеет т-РНК-последовательностей.
Направленный против U7 т-РНК/рибозим, синтетизированный в микроинъецированных ооцитах, получают разделением путем электрофореза, выявления ауторадиографией, вырезом из полиакриламидного геля и элюации инкубированием в течение ночи в вибраторе Эппендорфа в экстракционном буфере "Хайдельберг" состава 0,75 моль ацетата аммония, 10 ммоль ацетета магния, 1 объем.% фенола, 0,1 вес. % ДСН, 0,1 ммол ЭДТУК. Элюированную РНК экстрагируют раз смесью фенола и хлороформа и раз хлороформом и т-РНК в качестве носителя охлаждают этанолом в присутствии 10 мкг Е.coli. Осадок поглощают и количественно определяют посредством подсчета32P-маркировки с учетом величины удельной активности. Пробы т-РНК/рибозима с32P-маркированной РНК, содержащей U7- последовательность (10 00 cpm/проба; 10•10-15 М плюс указанные количества немаркированной U7-РНК), в присутствии 150 ммоль хлористого натрия, 10 ммоль хлористого магния и 20 ммоль трис-HCl, pH 7,5 при 37oC в течение 2 часов. Реакции прекращают добавкой ЭДТУК до 15 ммоль, пробы сушат, растворяют в 80%-ном формамиде в TBE-буфере, нагревают при 95oC в течение 30 сек. и разделяют на предварительно нагретом геле, содержащем 9,5% акриламида и 8,3 моль мочевины в TBE-буфере. Радиоактивно маркированные РНК-виды выявляют ауторадиографией при -80oC (с применением усилительной фольги типа "спешаль" фирмы Др. Гоос, ДЕ).
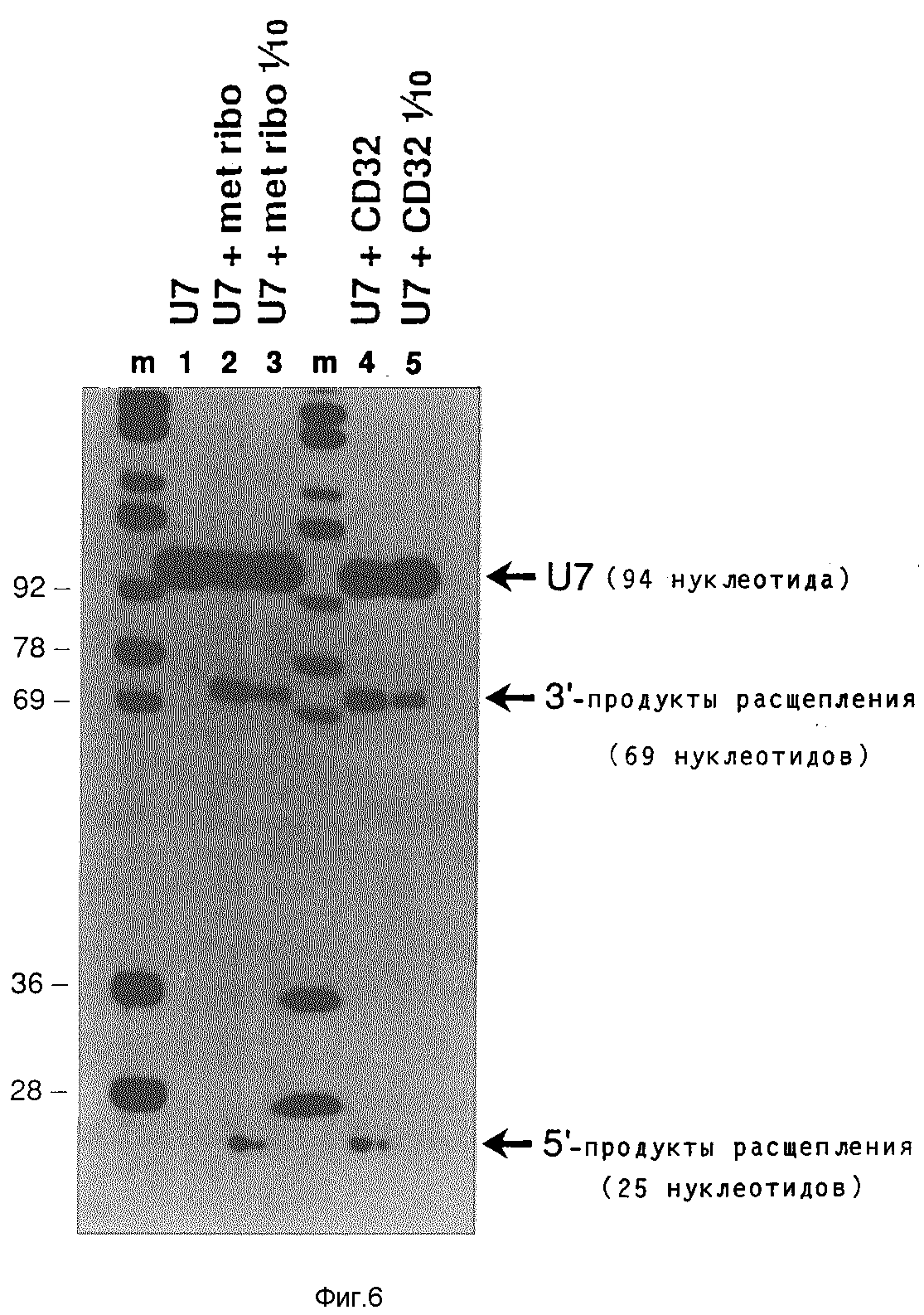
Рибозим CD32 получают транскрипцией Т7-полимеразы плазмиды, содержащие вставку CD33 (см. фиг.2) и клонированной в HindIII/Sal- места pSPT19 Этот транскрипт содержит только последовательность рибозима плюс комплементарные к U7 последовательности, фланкированные короткими участками векторной последовательности. Активность расщепления этого рибозима сравнивают с активностью расщепления синтетизированного ооцитами т-РНК/рибозима CD33 с тем, чтобы оценить влияние вторичной структуры т-РНК., а также синтеза и модификации на живом организме. Оказалось, что оба рибозима (CD32 и CD33) расщепляют содержащую U7-последовательность РНК (длиной 94 нуклеотида) на 5'-продукт 25 нуклеотидов и на 3'-продукт 69 нуклеотидов. Результаты этих опытов показывает фиг.6.
След m: маркер молекулярного веса аналогично фиг. 5.
След 1: U7-PHK (10000; 10•10-15), инкубированная без рибозима.
След 2: U7-PHK (10000; 100•10-15 М), инкубированная вместе с 10•10-15М синтезированного ооцитами т-РНК/рибозима CD33.
След 3: U7-PHK (10000 cpm; 1•10-15 M), инкубированная вместе с 10•10-15 М синтетизированного ооцитами т-РНК/рибозима CD33.
След 4: U7-PHK (10000 cpm; 100•10-15 М), инкубированная вместе с 10•10-15 синтетизированного в пробирке Т7-полимеразой рибозима CD32.
След 5: U7-РНК (10000•10-15 М), инкубированная вместе с 1•10-15 М синтетизированного в пробирке Т7- полимеразой рибозима CD32.
Пример 4
Определение расщепления субстрата в ооцитах
Смесь32P-GTP, гена
антииU7-т-РНК/рибозима и ген Met-т-РНК инъецируют в ядра ооцитов. Инъецированные ооциты, как описано в примере 2, инкубируют при 20oC в течение 8 часов, чтобы осуществлять процесс
транскрипции. После этого радиоактивно меченную U7-PHK (50 нл, 100 000 cpm/мкл, 100•10-15 М/мкл) инъецируют в цитоплазму ооцитов. Затем ооциты инкубируют в течение 2 часов.
Приготовление нуклеиновых кислот отдельных ооцитов и их разделение посредством гель-электрофореза осуществляют описанным выше образом.
Результаты этих опытов показывает фиг. 7.
След m: маркер молекулярного веса как по фиг. 5.
След 1: нуклеиновые кислоты из ооцита с инъекцией генов met и met ribo.
Следы 2 и 3: ооциты с инъекцией met и met ribo и последующей инъекцией U7-РНК.
Следы 4 и 5: ооциты с исключительной инъекцией U7-РНК.
След 6: аликвот U7-PHK, применяемой для инъекции.
След 7: U7-РНК (10•10-15 М), инкубированная вместе с рибозимом CD32 (10•10-15 М) в течение 2 часов при 37oC в присутствии 150 ммоль хлористого натрия, 10 ммоль хлористого магния и 20 ммоль трис-HCl, pH 7,5. Ввиду условий гель-электрофореза показан только 3'-продукт расщепления (69 нуклеотидов).
Пример 5
Транскрипционная
активность т-РНК/рибозимов в куриных клетках
Молекулы плазмидной ДНК, содержащие гены т-РНК/рибозима вводят в куриные клетки, чтобы определять транскрипционную активность генов. При этом
поступают следующим образом: 106 первичных фибробластных клеток куриного эмбриона подают в чашки размером 10 см и оставляют для роста в течение ночи. Утром каждую чашку трансфирируют 10 мкг
плазмидной ДНК (содержащей или erbB ES 13 или erb ES 53) с применением метода соосаждения фосфатом кальция. Осадку дают воздействовать на клетку в течение ночи, на следующее утро их промывают дважды
свежей средой и инкубируют следующие 48 часов в свежей среде. После этого удаляют среду, клетки подают в среду, содержащей 1% ДСП, 1 мг/мл протеиназы К, 300 ммоль хлористого натрия, 20 ммоль трис, pH
8,0, 10 ммоль ЭДТУК, и выделяют нуклеиновую кислоту. Затем нуклеиновую кислоту подвергают методу картирования при защите РНКазы с применением32P-маркированных анти-м-РНК- зондов erb ES 13
или erb ES 53, чтобы доказать присутствие транскриптов т-РНК/рибозима. Маркированную РНК (10000 cpm/10•10-15 анти-м-РНК на одну пробу) добавляют к высушенному осадку этанола, пробу
снова сушат и растворяют в среде, содержащей 10 мкл 80%-го деионизированного формамида, 400 ммоль хлористого натрия, 20 ммоль буфера PIPES, pH 6,5, 10 ммоль ЭДТУК. На пробы наносят слой стерильного
парафинового масла, нагревают 3 минуты при 95oC и быстро переводят в водяную баню с температурой 45oC, в которой культивируют в течение ночи. Утром добавляют 0,3 мл (300 ммоль)
холодного как лед хлористого натрия, 30 ммоль трис, pH 7,5, 1 ммоль ЭДТУК, 0,05 мг/мл РНКазы A и 80 единиц/мл РНКазы T1, при быстром осторожном перемешивании. Пробы культивируют при комнатной
температуре в течение 45 минут. Добавляют протеиназу K (до 1 мг/мл) и ДСН (до 0,5%), инкубирование продолжают при комнатной температуре и затем при 56oC в течение 20 минут. После добавки 10
мкг т-РНК пробы осаждают этанолом. Полученный осадок поглощают в 80%-ном формамиде в буфере TBE и разделяют на предварительно нагретом геле, содержащем 9,5% акриламида и 8,3 моль мочевины в буфере
TBE.
Результаты этого опыта показывает фиг. 8:
Следы m: маркер молекулярного веса как в предыдущих примерах.
След 1: анти-м-зонд ES13, гибридизированный 10 мкг т-РНК E.coli.
След 2: анти-м-зонд ES53, гибридизированный 10 мкг т-РНК E.coli.
Следы 3 и 4: картирование нуклеиновых кислот 10000 и 100000 клеток, которые не трансфицировались плазмидной ДНК, гибридизированной зондом ES 13.
Следы 5 и 6: Картирование нуклеиновых кислот 10000 и 100000 клеток, трансфицированных ES53, гибридизированной зондом ES 53.
Пример 6
Ослабление действия v-erb B онкогена генами тДНК/рибозима, которые вводят в v-erb B трансформированные эритробласти при помощи конъюгата полилизина и
трансферрина.
В настоящем опыте исследуют вопрос о том, может ли ДНК размером, соответствующим размеру тДНК/рибозимов (см. пример 1), эффективно транспортироваться во внутреннюю часть
клетки при помощи конъюгата трансферрина и полилизина. В настоящем примере применяют маркированную на концах γ32 P ATP и т-ДНК со вставкой последовательности
CGTTAACAAGCTAACGTTGAGGGGCATGATATCGGGCC
CCGGGCAATTGTTCGATTGCAACTCCCCGTACTATAGC,
имеющую молекулярный вес около 300000. Приблизительно 0,3 мкг этой ДНК, растворенной в 20 мкл TE-буфера,
смешивают или с 10 мкг натриевого трансферрина, растворенного в 50 мкл дважды дистиллированной воды, содержащей 400 мкг/мл сывороточного альбумина крупного рогатого скота, 10 мкг конъюгата
трансферрина и полилизина (состоящего из модифицированного пиридилтиопропионатом трансферрина (из белка куриного яйца) и модифицированного меркаптопропионатом полилизина), растворенного в 50 мкл
дважды дистиллированной воды, содержащей 40 мкг/мл сывороточного альбумина крупного рогатого скота, или с 50 мкл этого растворителя без трансферрина. Смеси ДНК-протеина добавляют по 2 мл к не
содержащей трансферрина среде для дифференцирования, к которой добавляют 4•106 куриных эритробластов (трансформированных ретровирусом рецептора фактора роста эпидермиса (далее. EGF)
и предварительно инкубированных 18 часов в не содержащей трансферрина среде в присутствии EGF), после чего инкубируют в присутствии 5% двуокиси углерода при 37oC в течение 8 часов. После
этого клетки центрифугируют, надосадочную жидкость удаляют и клетки промывают 3 раза в не содержащей трансферрина среде. Клеточный осадок и питательную среду подают в среду, содержащую 1% ДСН, 1 мг/мл
протеиназы К, 300 ммоль хлористого натрия, 20 ммоль трис с pH 8,0, 10 ммоль ЭДТУК, инкубируют 30 минут при 37oC, экстрагируют смесью фенола и хлороформа и ДНК выделяют путем осаждения
этанолом. Выделившуюся ДНК с радиоактивностью всего 2000 cpm разделяют на неденатурирующем 3,5%-ном акриламидном геле с применением TBE-буфера и ДНК доказывают ауторадиографией. Фиг.9 показывает
снимки флюоресценции крупных эритробластов, которые инкубируют 24 часа без конъюгата трансферрина и полилизина (A) или вместе с маркированным изоцианатом флуоресцеина (далее: FITC) конъюгатами
трансферрина и полилизина (B, C). При возбуждении синим светом (B, для доказательства FITC) в каждой клетке можно отчетливо узнавать несколько флюоресцирующих пузырьков. Специфичность этой
флюоресценции доказывается тем, что флюоресценция пузырьков при возбуждении зеленым светом (при котором можно видеть неспецифическую флюоресценцию клеток, подобную опыту по а) не появляется (C).
Фиг. 9 показывает, что в случае применения конъюгата трансферрина и полилизина клетками поглощено приблизительно в 5-10 раз больше ДНК, чем в контрольных пробах с использованием нативного трансферрина или без него.
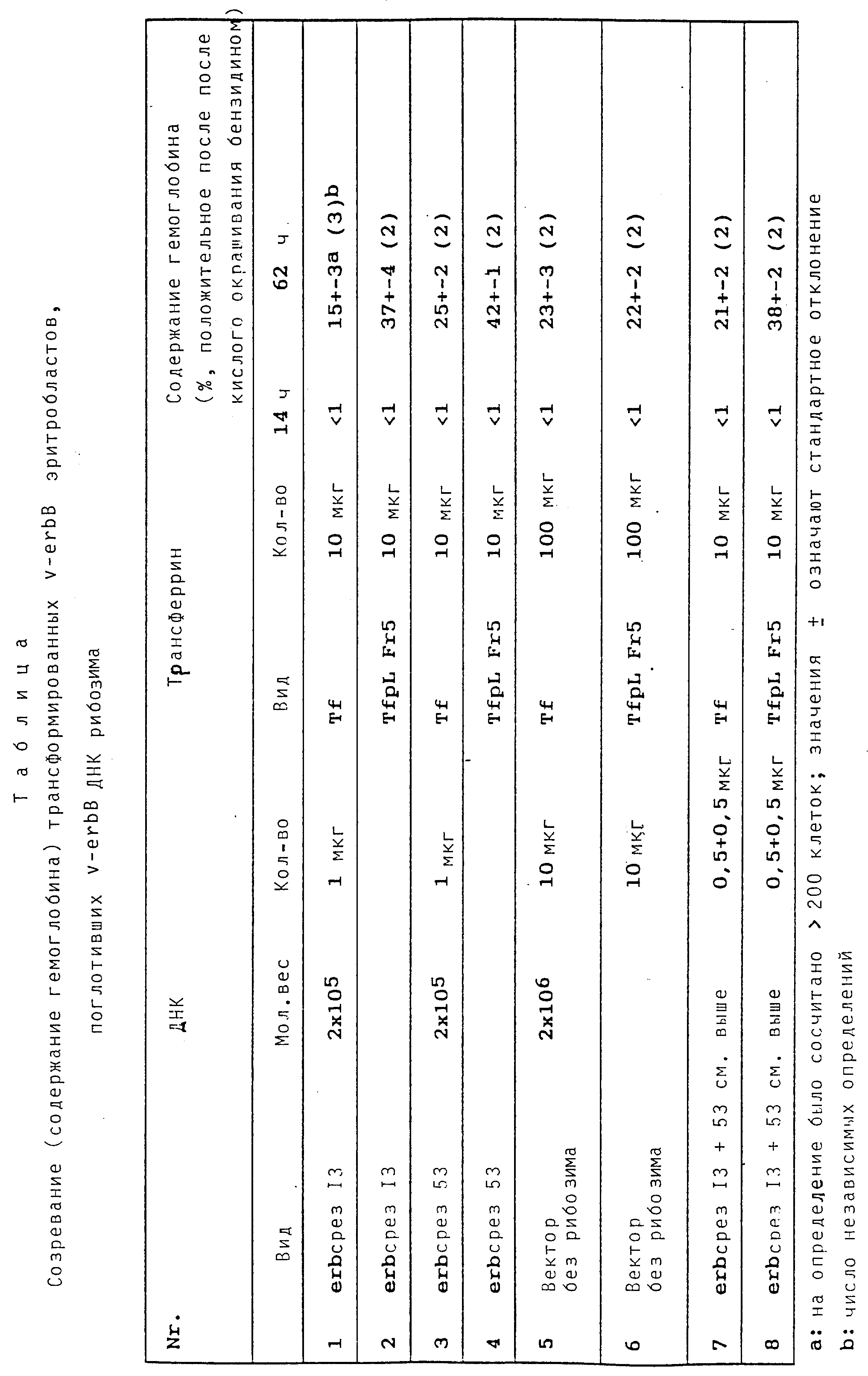
Конструируют два гена т-РНК/ рибозима, направленных против инициирующей области трансляции erbB (см. фиг. 2,3; пример 1). Около 100 мкг каждой содержащей ген плазмиды переваривают EcoRI, чтобы высвободить ген т-РНК/рибозима на фрагменте размером 225 п.о. Продукты переваривания маркируют на концах посредством фрагмента Кленова и очищают при помощи электрофореза на геле, содержащем 2% агароза в TBE-буфере. Векторный фрагмент и фрагменты гена т-РНК/рибозима локализируют окрашиванием бромида этидия (= бромид S-этил-3,8- диамино-6-фенилантриния), вырезают, выделяют электроэлюированием, экстракцией смесью фенола и хлороформа и повторной экстракцией хлороформом и осаждением этанолом. Очищенные, радиоактивно маркированные ДНК- фрагменты при использовании транспортной системы трансферрина/полилизина применяют для того, чтобы определить поглощение и торможение erbB-РНК. В качестве контрольной ДНК применяют вектор pSPT 18.
В качестве опытной клеточной системы выбирают клеточную линию куриных эритробластов, которая трансформирована чувствительным к температуре мутантом (ts34) птичьего эритробластозного вируса AEV (экспримированный также в этих клетках erb A онкоген можно тормозить специфическим ингибитором протеинкиназы (H 7). Было установлено, что v-erbA онкоген в живом организме и в пробирке (т.е. как бактериально экспримированный протеин) фосфорилируется в двух местах, а именно Ser 28 и Ser 29, протеинкиназой C или cAMP-зависимой протеинкиназой. Мутация этих серинов до аланинов препятствует фосфорилированию и разрушает активность v-erbA-онкогена. Н7 представляет специфический ингибитор этих двух киназ и в состоянии избирательно снимать вызываемые v-erbA изменения (например, блокирование дифференцирования в содержащих v-erbA и v-erbB эритробластах).
Известно, что эритробласти, erbB онкоген которых дезактивируется, например, повышением температуры в случае чувствительного к температуре erbB мутанта, индуцируются для созревания до эритроцитов. Одним из первых признаков для этого процесса является индукция синтеза гемоглобина, которая может быть доказана чувствительным доказательством (кислое окрашивание бензидином) на уровне отдельной клетки. Таким образом, в качестве фенотипного действия направленного против erbB рибозима в этой тест-системе можно было бы ожидать специфического повышения числа бензидин-положительных клеток.
Лежащую в основе данного примера серию опытов осуществляют следующим образом: различные ДНК-препараты (см. выше и приложенную таблицу), растворенные в 30 мкл ТЕ-буфера, смешивают соответственно с 10 мкг комплекса нативного трансферрина и железа или конъюгата трансферрина и полилизина (растворенного в 50 мкл дважды дистиллированной воды) и инкубируют 30 минут при 37oC.
В случае векторной ДНК (10 мкг) соответственно больше (100 мкг) трансферриновых препаратов. Смеси ДНК с трансферрином и без него соответственно добавляют к 1 мл не содержащей трансферрина среды для дифференцирования. Опытные клетки (по 3•106) инкубируют перед опытом 60 минут в не содержащей трансферрина среде для дифференцирования при 42oC (таким образом улучшается способность к приему трансферрина) и добавляют к содержащим ДНК и трансферрин смесям. Через 6 часов, 18 часов и 68 часов (обработку клеток см. ниже) отбирают пробы, разделяют описанным выше образом на надосадочную жидкость и клеточный осадок, поглощают в буфере, содержащем 1% ДСН, 1 мг/мл протеинкиназы K, 300 ммоль хлористого натрия, 20 ммоль трис, pH 8,0 и 10 ммоль ЭДТУК, после его осуществляют анализ ДНК.
После окончания инкубирования (6 часов) клетки центрифугируют и в содержащей трансферрин среде для дифференцирования еще 72 часа инкубируют вместе с эритропойэтином и инсулином (2 мл на смесь) при 37oC в присутствии активного V-erbB-протеина.
Получают следующие результаты:
1. Подобно вышеописанному опыту с применением конъюгата полилизина и трансферрина можно наблюдать усиленное поглощение ДНК в размере erb-ДНК в
обработанных трансферрином и полилизином клеточных пробах (приблизительно 5-кратное).
2. Трансфекцией куриных фибробластов erbB-ДНК можно показать, что erbB-т-ДНК/рибозим экспримируется в куриных клетках (см. пример 5).
3. Приложенная таблица показывает, что во всех случаях, в которых erbB-т-ДНК/рибозим вносят при помощи конъюгата полилизина и трансферрина в erbB трансформированные эритробласты, процент бензидин-положительных клеток является значительно (приблизительно вдвое) повышенным (в качестве этанола служат обработанные векторной ДНК пробы, (в которых применение конъюгата полилизина и трансферрина, как и следовало ожидать, не приводило к повышению числа бензидин- положительных клеток).
Пример 7
Удлинение
области штамма антикодона повышает выход rib- т-РНК Гуманный ген met-т-РНК (клонированный как BamHI/RSal-фрагмент, дополненный EcoRI линкером, в EcoRI место разреза вектора Bluescript) расщепляют в
его единственном Apal-месте разреза в области штамма антикодона. Однонитевые выступы удаляют обработкой Т4-ДНК- полимеразой, и вставляют олигонуклеотиды, содержащие рибозимные последовательности.
Применяемая в предшествующих примерах вставка рибозима приводит к получению молекулы ribт-РНК по фиг. 10, где показаны т-РНК met дикого типа и т-PHKrib с укороченным штаммом антикодона. Кроме того,
применяют олигонуклеотид, который отличается от первого комплементарной к последовательности дикого типа последовательностью GGTTAT на конце 5'. При этом восстанавливают штамм дикого типа, который
удлиняется 4 дополнительными парами оснований (фиг. 11 показывает конструкцию т-PHKrib с удлиненным штаммом антикодона. Последовательность рибозимов показана на фиг. 12; на левом(5') конце показаны
различия в нуклеотидной последовательности между областью, кодирующей укороченный штамм, и областью, кодирующей удлиненный штамм. Далее, на фиг. 12 показана последовательность гена met-т-РНК). Оба
продукта лигирования трансформируют в Е.coli HB 101, выбирают подходящие клоны и выделяют плазмидную ДНК, которую подвергают анализу для определения правильной структуры. Оба гена rib т-РНК исследуют
на активность транскрипции и накопление молекул rib-т-РНК в присутствии32Р-GTP. Ген-т-РНК
дикого типа соинъецируют в концентрации, которая в 10 раз меньше. Инъецированные ооциты
инкубируют в течение 7 часов при 20oC, получаемую РНК собирают (срв. пример 2) и разделяют электрофорезом (10% акриламида и 8,3 моль мочевины в TBE-буфере) и молекулы РНК выделяют
аугорадиографией (2-дневное экспонирование при - 70oC (фиг.13). Укороченный ген rib т-РНК дает около 1/10 количества РНК, которая транскрибируется геном дикого типа. В противоположность
этому ген, который кодирует молекулы rib т-РНК с удлиненным штаммом, дает 6- кратное количество РНК.
Пример 8
Экспрессия рибозимных генов как составная часть интронов В
качестве исходного гена выбирают tyrC-ген т-РНК Xenopus laevis (тип ооцитов), который содержит охватывающий 13 нуклеотидов интрон. Естественную последовательность интрона модифицируют следующим
образом: во-первых, включают подходящее место рестрикции (ApaI; GGGCCC, чтобы сделать возможным последующее клонирование олигонуклеотидов, во-вторых, включают комплементарные нуклеотиды к триплету
антикодона, чтобы благодаря удлинению последовательности интрона располагать дополнительно стабилизирующим структурным признаком. Размер интрона в модифицированном гене повышается с 13 нуклеотидов до
15 нуклеотидов (фиг. 14).
Модифицирование последовательности интрона осуществляют при помощи цепной реакции полимеразы (Но и др., 1989, Gene 77, 51 - 59). Для этого синтетизируют
четыре полимера, из которых два содержат измененную последовательность интрона (комплементарные друг к другу), а два направлены против 5'- или 3'-конца гена, чтобы ввести рестрикционное место EcoRI
или SalI. Ген дикого типа имеется как Hhal- фрагмент (258 п.о.), клонированный в pBR327
Получаемый продукт очищают при помощи агарозного геля, режут указанными рестрикционными энзимами и
лигируют с вектором pAALM (=pSP64 + Т7 промотор). Конструкт трансформируют в Е. coli НB 101, и клоны, содержащие требуемую вставку, идентифицируют анализом последовательностей.
Активность модифицированного гена (tyrM т-РНК) сравнивают с активностью гена дикого типа микроинъекцией в ооциты Xenopus, причем в качестве внутреннего стандарта соинъецируют ген 5S-РНК (концентрация в 50 раз ниже) на плазмиде pUC-10-5S в присутствии32P-GTP. Инъецированные ооциты инкубируют 20 часов при 20oC. РНК разделяют на геле, содержащем 8% акриламида и 8,3 моль мочевины в буфере ТBЕ и выделяют ауторадиографией (фиг.15). Наряду с 5S-РНК с 120 нуклеотидами выделяют первичный tyr транскрипт т-РНК с 100 (102) нуклеотидами, 5'- и 3'-переработанную форму предшественника с 90 (92) нуклеотидами, а также готовую переработанную т-РНК тирозина с 76 нуклеотидами. Связывание формы предшественника с 90 нуклеотидами появляется как лимитирующий фактор, так что большая часть образованного транскрипта (около 80%) существует в этой форме. Как ожидается, модификация по сравнению с геном дикого типа не приводит к уменьшению биологической активности.
В дальнейшем эксперименте проверяют функциональную способность системы.
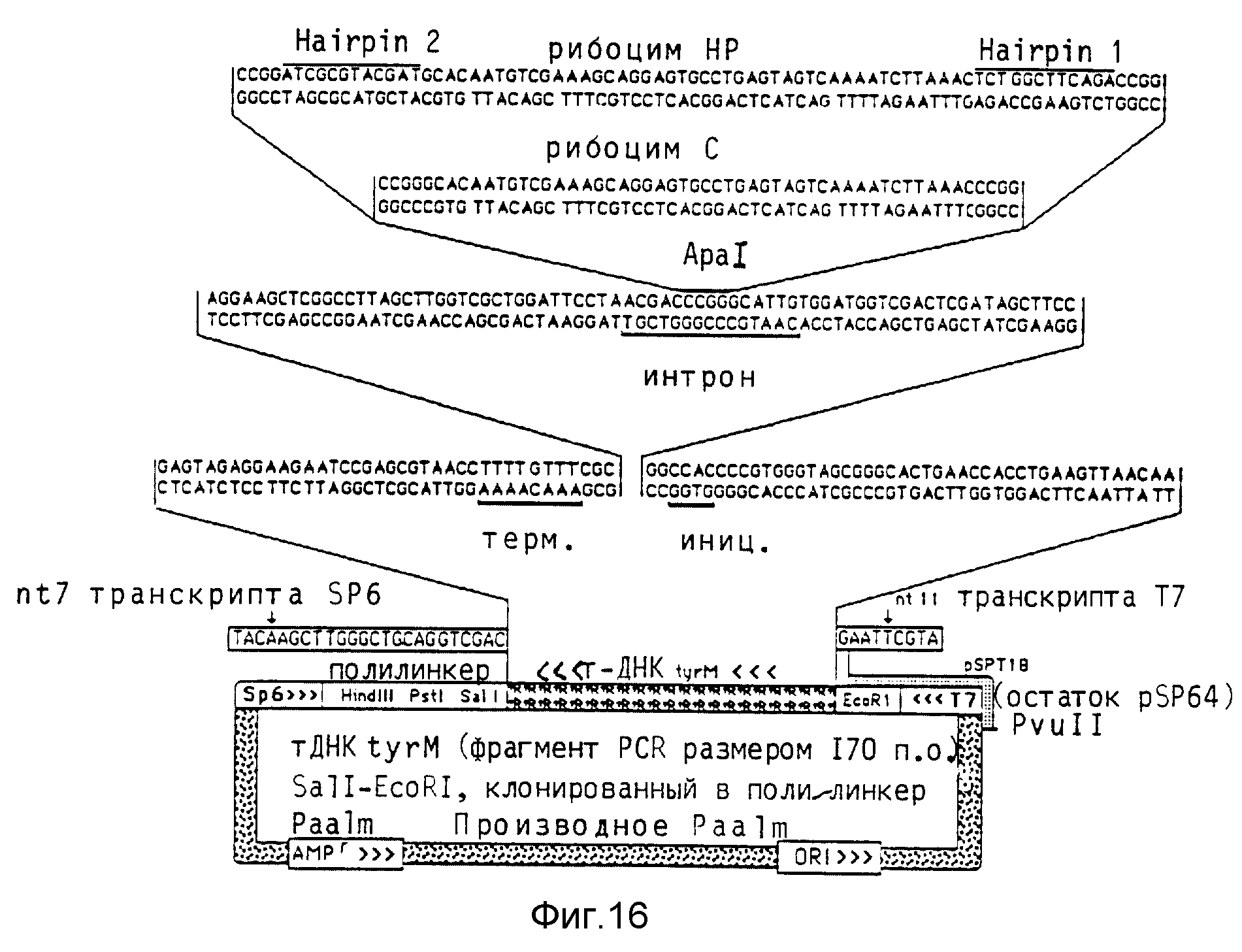
Синтезируют два содержащих рибозимные последовательности олигонуклеоксирибонуклеотида, которые содержат уже ApaI-концы и следовательно могут непосредственно клонироваться в последовательность интрона модифицированного tyr-гена т-РНК. При одном олигонуклеотиде на обоих концах включают 12 нуклеотидов, чтобы образовать стабильные в рибинтронах "шпильки" и тем самым противодействовать расщеплению экзонуклеазой. Общий размер получаемого при этом интрона составляет 89 нуклеотидов (рибозим HP) по сравнению с 65 нуклеотидами в случае незамещенной последовательности рибозима (рибозим C). Последовательности рибозимов и схема клонирования показаны на фиг. 16.
Для микроинъекций, проводимых аналогично вышеописанным микроинъекциям в ооцитах Xenopus, применяют наряду с двумя вышеописанными конструктами третий конструкт, который содержит рибозим HP в димерной форме и таким образом увеличивает размер интрона до 163 нуклеотидов (рибозим D). Концентрация соинъецированного 5S-стандарта составляет 1 : 20 в случае конструктов HP и D, а 1 :1 в случае конструкта C (фиг.17). Эксперимент показывает, что конструкты HP и C, несмотря на значительно увеличенный интрон, очень активно транскрибируются и перерабатываются с такой же эффективностью как и tyr-ген т-РНК дикого типа. В случае конструкта D можно обнаружить только минимальное количество транскрипта, так как, очевидно, необходимая для образования транскрипционного комплекса Pol III вторичная структура разрушается длинной последовательностью интрона.
Экспрессия рибозимов как интрона т-РНК не приводит к существенному ухудшению вторичной структуры т-РНК, вследствие чего образующийся транскрипт может накапливаться в высокой концентрации и правильно перерабатываться.
Рекомбинантная ДНК согласно изобретению применяется в качестве обычного фармацевтического препарата, например, лиофилизата, который содержит терапевтически эффективное количество единицы. Препараты могут дополнительно содержать конъюгат трансферрина и поликатиона, способный к комплексообразованию с рекомбинантной ДНК.
Реферат
Изобретение относится к ингибированию генов, а именно к рекомбинантной ДНК, служащей в качестве средства для торможения в живом организме функции РНК. Рекомбинантная ДНК содержит транскрибируемую полимеразой III нуклеотидную последовательность, кодирующую Т-РНК. Между сигналами инициации и терминации указанной нуклеотидной последовательности расположена кодирующая рибозим нуклеотидная последовательность. Полученная рекомбинантная ДНК позволяет эффективно тормозить в живом организме функции РНК. 17 ил., 1 табл.


Комментарии