Комбинационные липосомальные композиции для лечения рака - RU2640934C2
Код документа: RU2640934C2
Чертежи






Описание
Перекрестные ссылки на родственные заявки
По настоящей заявке испрашивается приоритет предварительной патентной заявки США №61/553,786, поданной 31 октября 2011, полное содержание которой включено в настоящее описание посредством ссылки.
Заявление о правах на изобретения, созданных при федеральном финансировании исследований и разработок
Не применяется.
Ссылка на «Перечень последовательностей», таблицу или компьютерную программу, поданных на компакт-диске
Не применяется.
Предшествующий уровень техники
Липосомы могут применяться в качестве эффективного носителя для доставки лекарств, и были разработаны коммерчески доступные липосомные продукты для лечения заболеваний, включая рак (Barenholz, Y., Curr. Opin. in Colloid & Interface Sci. 6(1): 66-77 (2001)). Липосома является пузырьком, включающим по меньшей мере один фосфолипидный двойной слой, отделяющий внутреннюю водную фазу от внешней водной среды. Липосома способна нести как гидрофобный груз в липидном двойном слое, так и гидрофильный груз в водной сердцевине. Размер липосом обычно находится в диапазоне от 50 до 250 нм, что особенно пригодно для направленной доставки агентов для химиотерапии к участкам солидных опухолей за счет усиленной проницаемости и удерживания в опухолевых тканях (EPR-эффект) (Maeda, Н., et al, J. Controlled Release. 65(1-2): 271 (2000)). Предпочтительное накопление содержащих лекарство липосом в участке опухоли за счет EPR обеспечивает средства для локализации лекарства, повышения эффективности лекарства, снижения токсичности лекарства для нормальных клеток или тканей. Например, Doxil™, утвержденный Управлением по контролю за продуктами питания и лекарственными средствами липосомный продукт, содержащий доксорубицин, как было показано, обладает сниженной токсичностью по сравнению со свободным лекарством (Martin, F.J., и др., "Clinical pharmacology and antitumor efficacy of DOXIL", Medical Applications of Liposomes. Ed. D.D. Lasic. Amsterdam: Elsevier, 1998, p.p. 635-688) («Клиническая фармакология и противоопухолевая эффективность DOXIL», Медицинское применение липосом).
Однако полезные эффекты липосомных носителей для доставки лекарств ограничены недостатками, включая метаболизм и экскрецию липосом из организма, а также определенный уровень собственной токсичности и побочные эффекты из-за системного распределения и доставки. В частности, оптимизация скорости высвобождения липосомного лекарства обеспечивается за счет сложного баланса между временем полужизни in vivo и высвобождением. Как правило, неплотные липосомы делают инкапсулированное лекарство более доступным, но повышают риск токсичности, подобно свободному лекарству. С другой стороны, более плотные липосомы могут снижать токсичность, но они могут не обеспечивать необходимое высвобождение лекарства для достижения эффективности, как показано для препарата цисплатина (SPI-077) (Kim, E.S. и др., Lung Cancer. 34(3): 427-432 (2001)). Таким образом, обеспечение баланса между эффективностью и безопасностью при разработке и применении липосомных лекарственных продуктов является существенной проблемой.
Соответственно, имеется потребность в разработке рецептур и способов доставки, преодолевающих ограничения лечения на основе единичных липосомных препаратов. Настоящее изобретение направлено на решение этих и других задач, предоставляя средства для повышения безопасности и эффективности лекарства.
Краткое изложение сущности настоящего изобретения
В одном аспекте настоящее изобретение обеспечивает способ доставки терапевтического агента субъекту, включающий:
(a) введение субъекту липосомы, содержащей терапевтический агент; и
(b) введение субъекту липидной наночастицы, содержащей инициирующий агент;
при этом высвобождение терапевтического агента из липосомы после введения указанной липидной наночастицы повышается по сравнению с высвобождением терапевтического агента из липосомы без применения указанной липидной наночастицы.
Во втором аспекте настоящее изобретение обеспечивает набор для доставки терапевтического агента субъекту, включающий:
(a) первую композицию, включающую липосому, содержащую терапевтический агент; и
(b) вторую композицию, содержащую липидную наночастицу, включающую неионный инициирующий агент;
где первую и вторую композицию хранят по отдельности до введения субъекту.
Краткое описание чертежей
Фиг. 1 демонстрирует высвобождение оксалиплатина из терапевтических липосом, активированное посредством атакующей липосомы 4460-075 при (а) pH=5,0 и (b) pH=7,4.
Фиг. 2 демонстрирует высвобождение цисплатина из терапевтических липосом, активированное различными количествами атакующей липосомы 4460-075 при (а) pH=7,4 и (b) pH=5.
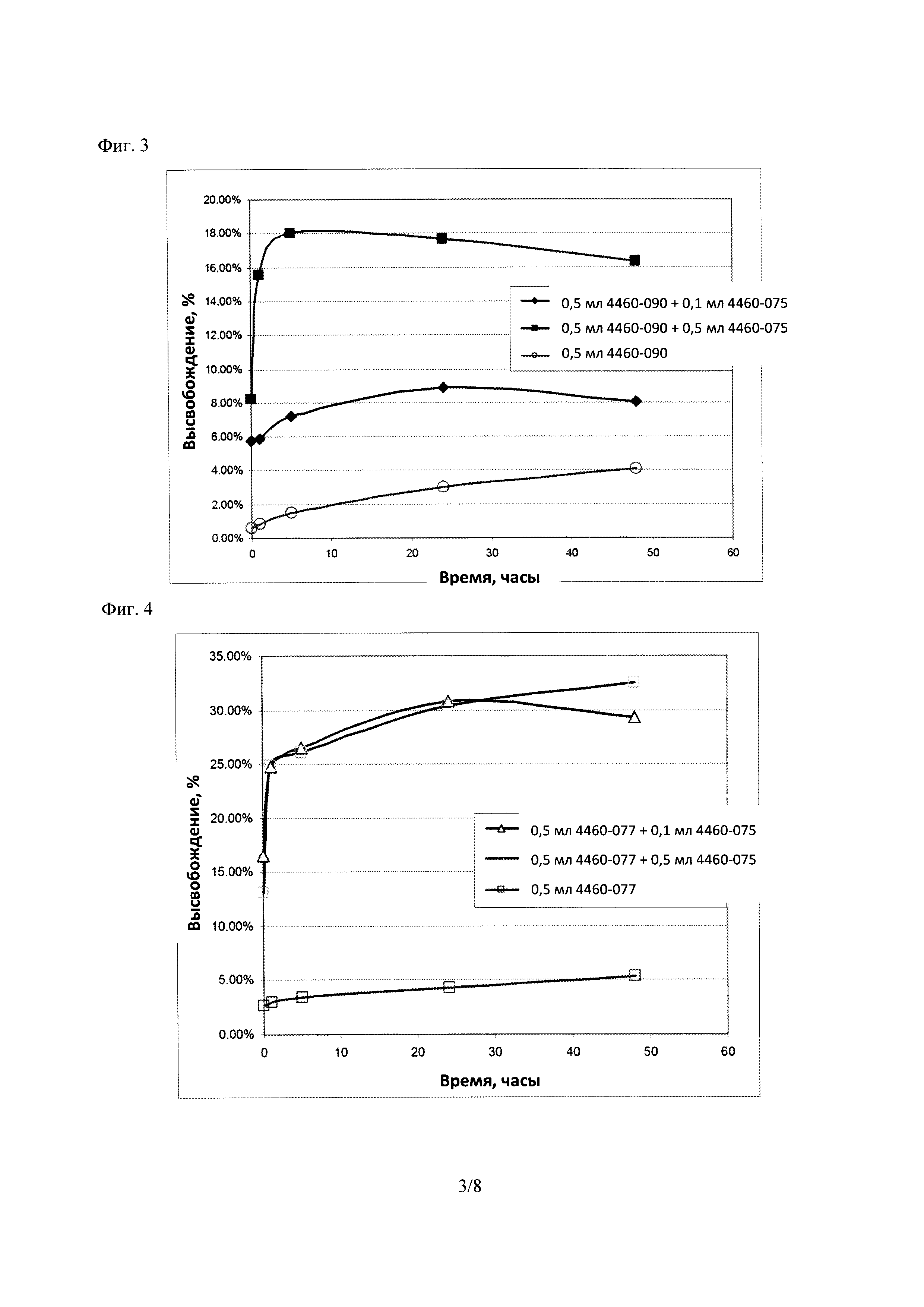
Фиг. 3 демонстрирует высвобождение 5-карбоксифлюоресцеина (5-CF) из терапевтической липосомы Части А (4460-090) при добавлении атакующей липосомы Части В (4460-075) при pH=7,4.
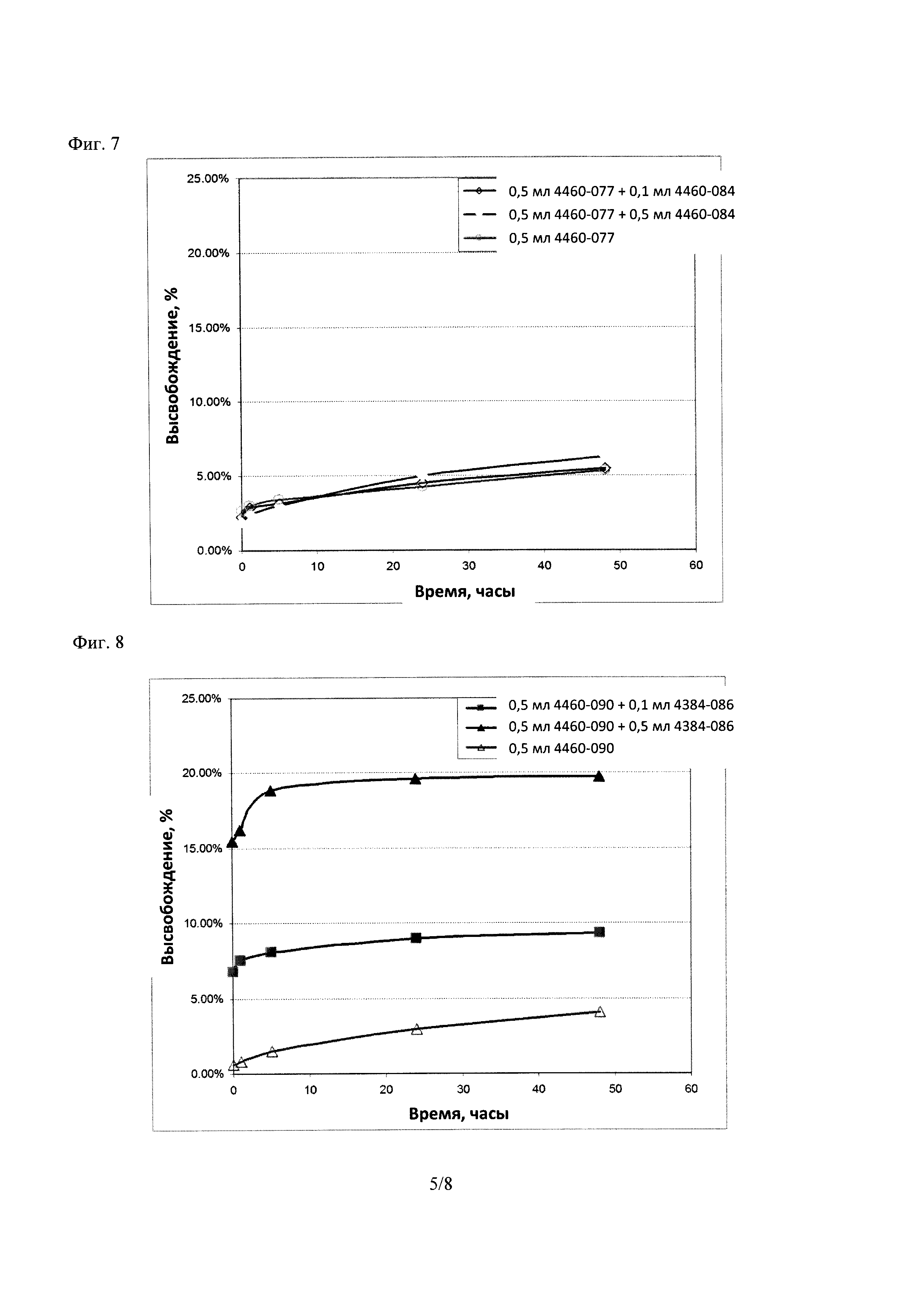
Фиг. 4 демонстрирует высвобождение 5-CF из липосомы Части А (4460-077) при смешивании с липосомой Частью В (4460-075).
Фиг. 5 демонстрирует высвобождение 5-CF из липосомы Части А (4386-143) при смешивании с липосомой Частью В (4460-075) при pH 7,4.
Фиг. 6 демонстрирует высвобождение 5-CF из липосомы Части А (4460-090) при смешивании с липосомой Частью В (4460-084) при pH 7,4.
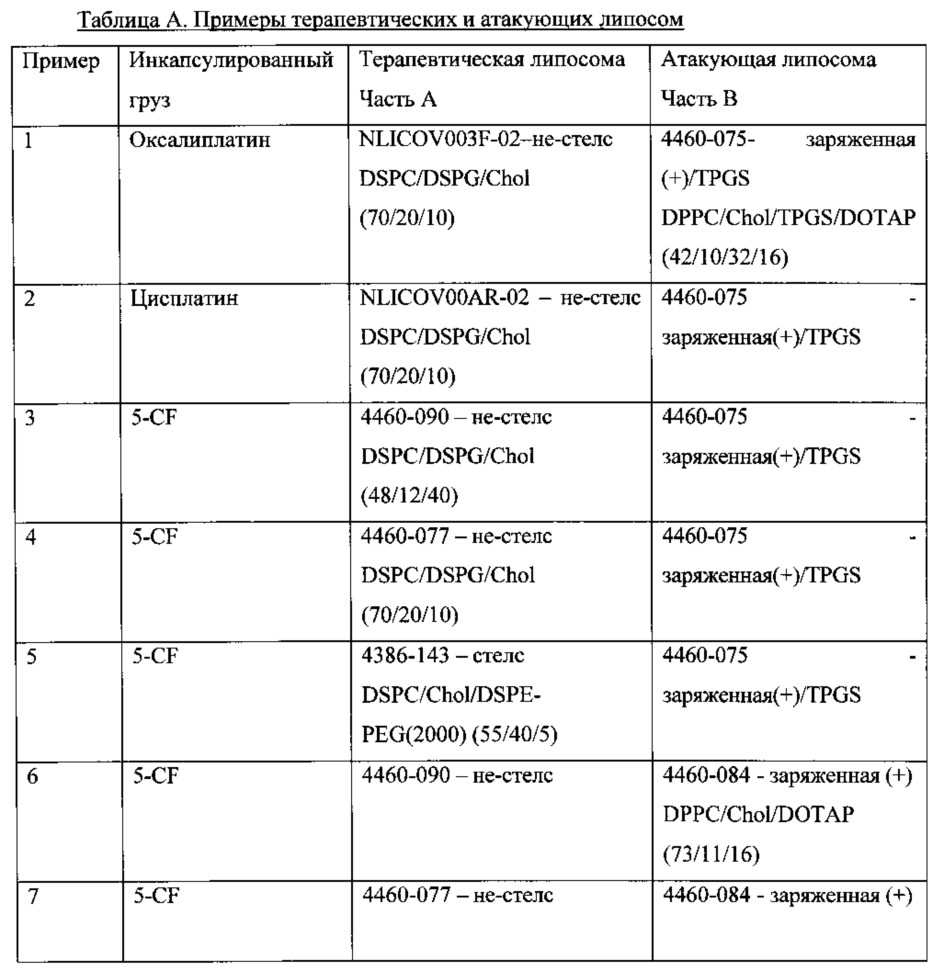
Фиг. 7 демонстрирует высвобождение 5-CF из липосомы Части А (4460-077) при смешивании с липосомой Частью В (4460-084) при pH 7,4.
Фиг. 8 демонстрирует высвобождение 5-CF из липосомы Части А (4460-090) при смешивании с липосомой Частью В (4384-086) при pH 7,4.
Фиг. 9 демонстрирует высвобождение 5-CF из липосомы Части А (4460-077) при смешивании с липосомой Частью В (4384-086) при pH 7,4.
Фиг. 10 демонстрирует высвобождение 5-CF из липосомы Части А (4460-090) при смешивании с липосомой Частью В (4460-075) при pH 5,0.
Фиг. 11 демонстрирует высвобождение оксалиплатина из липосомы (NLICOV003F-02) при добавлении атакующей липосомы 4460-104 при pH=7,4 и pH=5,0.
Фиг. 12 демонстрирует высвобождение цисплатина из терапевтических липосом (NLI 4481101) при добавлении атакующих липосом (4460-104) при (а) pH=5,0 и (b) pH=7,4.
Подробное описание изобретения
Общее описание
Настоящее изобретение относится к применению композиции из множества липидов для доставки лекарственных средств или других агентов субъекту. Способы согласно настоящему изобретению включают применение отдельных липидных композиций, содержащих терапевтическую липосому и атакующий агент. Терапевтическая липосома является липосомным компонентом, содержащим терапевтический агент и/или другие агенты (например, диагностические агенты). Атакующий агент является липидной наночастицей (липосомой, мицеллой, или их смесью), содержащей инициирующий агент, который может увеличивать высвобождение груза из терапевтической липосомы. В контексте настоящего изобретения термины «атакующий агент» и «липидная наночастица, содержащая инициирующий агент», применяются взаимозаменяемо. В некоторых вариантах осуществления терапевтическая липосома и атакующий агент вместе обозначаются как «дуалсома» ("dualsome"). Два компонента могут храниться по отдельности, а атакующий агент может вводиться после введения терапевтической липосомы для выполнения регулируемой доставки груза терапевтической липосомы. Способы согласно настоящему изобретению включают два этапа: (1) введение терапевтической липосомы, и (2) введение атакующего агента для активации увеличения высвобождения лекарства из терапевтической липосомы в сравнении с высвобождением в отсутствие атакующего агента. Способы согласно настоящему изобретению позволяют предотвратить раннее высвобождение агентов из терапевтической липосомы прежде, чем она достигнет целевого участка у субъекта. Указанные способы преодолевают существующую дилему при применении единичного липосомального препарата для доставки лекарственного средства, таким образом, повышая терапевтическую эффективность и безопасность, а также соблюдение режима лечения пациентом.
Определения
Термины «доставка» и «передача», применяющиеся в настоящем описании, означают транспортировку терапевтического агента субъекту с применением способов согласно настоящему изобретению. Доставка может быть локализована в конкретном участке у субъекта, таком как ткань, орган, или клетки определенного типа.
Термин «терапевтический агент», применяющийся в настоящем описании, означает соединение или молекулу, которая, когда присутствует в эффективном количестве, обеспечивает необходимый терапевтический эффект у субъекта, нуждающегося в нем. Настоящее изобретение подразумевает широкий диапазон терапевтических агентов и их применение в сочетании с липосомными композициями, как описано далее.
Термин «субъект», применяющийся в настоящем описании, означает любое млекопитающее, в частности человека, на любом этапе жизни.
Термины «вводить», «введенный» или «введение», применяющиеся в настоящем описании, относятся к способам введения липосомных композиций согласно настоящему изобретению. Липосомные композиции согласно настоящему изобретению могут применяться различными способами, включая местное, парентеральное, внутривенное, интрадермальное, внутримышечное, внутрикишечное, ректальное или интраперитонеальное введение. Липосомные композиции также могут применяться в виде части композиции или рецептуры.
Термин «липосома», применяющийся в настоящем описании, охватывает любой компартмент, покрытый липидным двойным слоем. Термин «липосома» включает моноламеллярные везикулы, содержащие один липидный двойной слой, и как правило, имеющие диаметр в диапазоне примерно от 20 до 400 нм. Липосомы могут также быть мультиламеллярными, как правило, имеющими диаметр в диапазоне от 1 до 10 мкм. В некоторых вариантах осуществления липосомы могут включать мультиламеллярные везикулы (МЛВ), большие моноламеллярные везикулы (БМВ), и малые моноламеллярные везикулы (ММВ).
Термин «мицелла», применяющийся в настоящем описании, означает агрегат из амфифильных молекул, таких как липиды, собранные с образованием частицы с гидрофобной внутренней частью и гидрофильной внешней частью. Мицеллы являются, как правило, сферическими комплексами с диаметром менее 100 нм, хотя диапазон диаметров мицелл и различных форм мицелл, таких как дисковидные мицеллы, известен в данной области техники.
Термин «неионный инициирующий агент», применяющийся в настоящем описании, означает вещество, не содержащее заряженных функциональных групп, включая анионные функциональные группы и катионные функциональные группы, которое при введении субъекту вызывает усиление высвобождения лекарственного груза из терапевтической липосомы согласно настоящему изобретению. Примеры неионных инициирующих агентов включают TPGS и полиоксиэтилен 40 стеарат.
Термин «накопленный», применяющийся в настоящем описании, относится к липосомам, которые собираются в определенном участке у субъекта после введения, прекращая системную циркуляцию в организме субъекта. В некоторых случаях накопление может быть обусловлено связыванием специфического биомаркера в целевом участке с липосомой, содержащей лиганд, распознающий указанный биомаркер. В некоторых случаях накопление липосом может быть обусловлено характеристиками повышенной проницаемости и удерживания для некоторых тканей, таких как раковые ткани. Накопление липосом можно оценить любым подходящим способом, таким как компартментный анализ тестируемых субъектов, или неинвазивными методиками, такими как однофотонная эмиссионная компьютерная томография (ОФЭКТ), позитронная эмиссионная томография (ПЭТ), или ядерно-магнитно-резонансная томография (ЯМР/МРТ). Однако специалист в данной области техники может спланировать сроки введения липосом конкретному субъекту таким образом, чтобы обеспечить достаточное накопление в целевом участке без непосредственного измерения накопления у субъекта.
Термин «целевой участок», применяющийся в настоящем описании, относится к участку, в котором необходимо накопление липосом и доставка активного агента. В некоторых случаях целевой участок может быть конкретной тканью или клеткой, и может быть связан с конкретным патологическим состоянием.
Термин «контакт», применяющийся в настоящем описании, означает взаимодействие первой липосомы со второй липосомой таким образом, чтобы дестабилизировать первую липосому или иным образом вызвать высвобождение инкапсулированных агентов из первой липосомы.
Термин «высвобождение», применяющийся в настоящем описании, означает перемещение активного агента в липосоме из сердцевины липосомы или липидного двойного слоя во внешнюю среду.
Термин «липид», применяющийся в настоящем описании, означает липидные молекулы, которые включают жиры, воски, стероиды, холестерин, жирорастворимые витамины, моноглицериды, диглицериды, фосфолипиды, сфинголипиды, гликолипиды, катионные или анионные липиды, производные липидов, и тому подобные, как подробно описано ниже. Липиды могут формировать мицеллы, однослойные и двуслойные мембраны. Липиды могут самостоятельно собираться в липосомы.
Термин «молярный процент» и «моль %», применяющийся в настоящем описании, означает число моль данного липидного или сурфактантного компонента липосомы, деленное на общее число моль всех липидных или сурфактантных компонентов. Если только не указано однозначно, количество активных агентов, растворителей или других компонентов не включают при расчете моль % липидного или сурфактантного компонента липосомы.
Термин «набор», применяющийся в настоящем описании, означает комплекс из двух или более компонентов, необходимых для осуществления способов согласно настоящему изобретению. Компоненты набора могут включать липосомы согласно настоящему изобретению, реагенты, буферные вещества, контейнеры и/или оборудование, но не ограничиваются ими.
Выражение «хранящиеся по отдельности», применяющееся в настоящем описании, означает способ хранения липосом, предотвращающий контакт первой популяции липосом с другой популяцией липосом.
Варианты осуществления настоящего изобретения
В одном аспекте настоящее изобретение обеспечивает способ доставки терапевтического агента субъекту. Способ включает: (а) введение субъекту липосомы, содержащей терапевтический агент; и (b) введение субъекту липидной наночастицы, содержащей неионный инициирующий агент; где высвобождение терапевтического агента из липосомы после введения инициирующего агента возрастает по сравнению с высвобождением терапевтического агента из липосомы без введения указанного инициирующего агента. Липосома, содержащая терапевтический агент, обозначается как «терапевтическая липосома».
Липосомы согласно настоящему изобретению содержат водный компартмент, закрытый по меньшей мере одним липидным двойным слоем. Когда липиды, содержащие гидрофильную головную группу, диспергируют в воде, они могут спонтанно формировать двухслойные мембраны, обозначаемые как ламеллы. Ламеллы состоят из двух однослойных листов липидных молекул с их неполярными (гидрофобными) поверхностями, обращенными друг к другу, и полярными (гидрофильными поверхностями), обращенными к водной среде. Термин «липосома» включает моноламеллярные везикулы, которые состоят из одного липидного двойного слоя, и как правило, имеют диаметр в диапазоне примерно от 20 до 400 нм, примерно от 50 до 300 нм, или примерно от 100 до 200 нм. Липосомы могут также быть мультиламеллярными, которые, как правило, имеют диаметр в диапазоне от 1 до 10 мкм с любым числом от двух до сотен концентрических липидных двойных слоев, чередующихся со слоями водной фазы. В некоторых вариантах осуществления липосомы могут включать мультиламеллярные везикулы (МЛВ), большие моноламеллярные везикулы (БМВ), и малые моноламеллярные везикулы (ММВ). Липиды из липосомы могут быть катионными, цвиттерионными, нейтральными или анионными, или любой их смесью.
Липидная наночастица представляет собой «атакующий агент» в способах согласно настоящему изобретению. В некоторых вариантах осуществления липидная наночастица выбрана из липосомы, мицеллы, или их смесей. Примеры несурфактантов, пригодных для применения в способах согласно настоящему изобретению, включают этоксилированный алкилфенол, этоксилированный жирный сложный эфир, производное сорбитана, производное токоферола, и тому подобное, но не ограничиваются ими.
Введение атакующего агента субъекту может осуществляться в любое время, достаточное для усиления высвобождения терапевтического агента из терапевтической липосомы. В некоторых вариантах осуществления атакующий агент вводят субъекту после введения терапевтической липосомы. Введение атакующего агента можно осуществлять, например, спустя несколько минут или несколько часов после введения терапевтической липосомы. В некоторых вариантах осуществления атакующий агент вводят субъекту после накопления терапевтической липосомы в необходимом целевом участке у субъекта (обычно в пределах примерно 72 часов после введения). Накопление липосомы в целевом участке можно оценить любыми подходящими средствами, такими как компартментный анализ исследуемых субъектов, или неинвазивными методиками, такими как однофотонная эмиссионная компьютерная томография (ОФЭКТ), позитронная эмиссионная томография (ПЭТ), или ядерно-магнитно-резонансная томография (ЯМР/МРТ). Диагностические агенты, как описано ниже, например, могут быть выбраны для встраивания в терапевтические липосомы для оценки накопления липосом. Однако специалисту в данной области техники понятно, что введение конкретному субъекту может быть спланировано по времени таким образом, чтобы обеспечить достаточное накопление терапевтических липосом в целевом участке без непосредственного измерения накопления в субъекте.
В некоторых вариантах осуществления высвобождение терапевтического агента индуцируется при контакте терапевтической липосомы с атакующим агентом. Количество терапевтического агента, высвобожденного из липосомы, можно повысить в любой степени путем введения атакующего агента по сравнению с отсутствием атакующего агента. В некоторых вариантах осуществления введение атакующего агента вызывает по меньшей мере 3-кратное повышение высвобождения терапевтического агента из липосомы по сравнению с введением липосомы без атакующего агента. В некоторых вариантах осуществления введение атакующего агента вызывает по меньшей мере 10-кратное увеличение высвобождения терапевтического агента из липосомы по сравнению с введением липосомы без атакующего агента. В некоторых вариантах осуществления введение атакующего агента вызывает по меньшей мере 25-кратное повышение высвобождения терапевтического агента из липосомы по сравнению с введением липосомы без атакующего агента.
В настоящем изобретении субъект может быть любым млекопитающим. В некоторых вариантах осуществления субъектом является человек. В некоторых вариантах осуществления липосому и липидную наночастицу доставляют путем интраперитонеальной инъекции. Специалисту в данной области техники понятно, что в настоящем изобретении могут применяться другие способы введения.
Липосомы и липидные наночастицы
Липосомы и липидные наночастицы согласно настоящему изобретению могут содержать любой подходящий липид, включая катионные липиды, цвиттерионные липиды, нейтральные липиды, или анионные липиды, как описано выше. Подходящие липиды могут включать жиры, воски, стероиды, холестерин, жирорастворимые витамины, моноглицериды, диглицериды, фосфолипиды, сфинголипиды, гликолипиды, катионные или анионные липиды, производные липидов, и тому подобное.
Подходящие фосфолипиды включают фосфатидилхолин (PC), фосфатидную кислоту (РА), фосфатидилэтаноламин (РЕ), фосфатидилглицерин (PG), фосфатидилсерин (PS), и фосфатидилинозитол (PI); димиристоилфосфатидилхолин (DMPC), дистеароилфосфатидилхолин (DSPC), диолеоилфосфатидилхолин (DOPC), дипальмитоилфосфатидилхолин (DPPC), димиристоилфосфатидилглицерин (DMPG), дистеароилфосфатидилглицерин (DSPG), диолеоилфосфатидилглицерин (DOPG), дипальмитоилфосфатидилглицерин (DPPG), димиристоилфосфатидилсерин (DMPS), дистеароилфосфатидилсерин (DSPS), диолеоилфосфатидилсерин (DOPS), дипальмитоилфосфатидилсерин (DPPS), диолеоилфосфатидилэтаноламин (DOPE), пальмитоилолеоилфосфатидилхолин (РОРС), пальмитоилолеоилфосфатидилэтаноламин (POPE) и диолеоилфосфатидилэтаноламин-4-(N-малеимидометил)-циклогексан-1-карбоксилат (DOPE-mal), дипальмитоил-фосфатидилэтаноламин (DPPE), димиристоилфосфоэтаноламин (DMPE), дистеароил-фосфатидилэтаноламин (DSPE), 16-О-монометил РЕ, 16-О-диметил РЕ, 18-1-транс РЕ, 1-стеароил-2-олеоилфосфатидилэтаноламин (SOPE), 1,2-диэлаидоил-зп-глицеро-3-фосфоэтаноламин (транс-DOPE), и кардиолипин, но не ограничиваются ими. Липидные экстракты, такие как PC яиц, экстракт сердца, экстракт головного мозга, экстракт печени, и PC сои, также пригодны для настоящего изобретения. В некоторых вариантах осуществления фосфатидилхолин сои может включать гидро-фосфатидилхолин сои (HSPC). В некоторых вариантах осуществления липиды могут включать производные липидов, такие как ПЭГ-илированные липиды. Производные липидов могут включать, например, DSPE-PEG2000, холестерин-PEG2000, DSPE-полиглицерин, или другие производные, общеизвестные в данной области техники.
Липосомы и липидные наночастицы согласно настоящему изобретению могут содержать стероиды, характеризующиеся наличием конденсированной, тетрациклической гонановой кольцевой системы. Примеры стероидов включают холестерин, холевую кислоту, прогестерон, кортизон, альдостерон, эстрадиол, тестостерон, дегидроэпиандростерон, но не ограничиваются ими. Синтетические стероиды и их производные также предполагаются для применения в настоящем изобретении.
Катионные липиды содержат положительно заряженные функциональные группы в физиологических условиях. Катионные липиды включают N,N-диолеил-N,N-диметиламмонийхлорид (DODAC), N,N-дистеарил-N,N-диметиламмонийбромид (DDAB), N-(1-(2,3-диолеилокси)пропил)-N,N,N-триметиламмонийхлорид (DOT АР), N-(1-(2,3-диолеилокси)пропил)-N,N,N-триметиламмонийхлорид (DOTMA), N-[1-(2,3-дитетрадецилокси)пропил]-N,N-диметил-N-гидроксиэтиламмонийбромид (DMRIE), N-[1-(2,3-диолеилокси)пропил]]-N,N-диметил-N-гидроксиэтиламмонийбромид (DORIE), β-[N-(Nʹ,Nʹ-диметиламиноэтан)карбамоил]холестерин (DC-Chol), диметилдиоктадециламмоний (DDAB) и N,N-диметил-2,3-диолеилокси)пропиламин (DODMA), но не ограничиваются ими.
В некоторых вариантах осуществления терапевтическая липосома включает один или несколько липидов, которые могут быть фосфолипидом, стероидом и/или катионным липидом. В некоторых вариантах осуществления фосфолипидом является фосфатидилхолин, фосфатидилглицерин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, или фосфатидная кислота. В некоторых вариантах осуществления фосфатидилхолином является DSPC. В некоторых вариантах осуществления фосфатидилглицерином является DSPG. В некоторых вариантах осуществления фосфатидилэтаноламином является DSPE-PEG(2000). В некоторых вариантах осуществления стероидом является холестерин.
Как описано выше, липидная наночастица, представляющая собой «атакующий агент», выбрана из группы, состоящей из второй липосомы, мицеллы, или их смесей. В некоторых вариантах осуществления липидная наночастица является второй липосомой. Вторая липосома обозначается как «атакующая липосома». В некоторых вариантах осуществления атакующая липосома содержит один или несколько липидов, выбранных из группы, состоящей из фосфолипида, стероида, и катионного липида. В некоторых вариантах осуществления фосфолипидом является фосфатидилхолин, фосфатидилглицерин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозитол, или фосфатидная кислота. В некоторых вариантах осуществления фосфатидилхолином является DPPC. В некоторых вариантах осуществления стероидом является холестерин. В некоторых вариантах осуществления катионным липидом является DOTAP. В некоторых вариантах осуществления неионным инициирующим агентом является TPGS.
Любую подходящую комбинацию липидов можно применять для получения липосом и липидных наночастиц согласно настоящему изобретению. Липидные композиции могут быть приспособлены для получения таких характеристик, как скорость протечки, стабильность, размер частицы, дзета-потенциал, связывание белков, циркуляция in vivo, и/или накопление в тканях или органах. Например, DSPC и/или холестерин можно применять для снижения протечки из липосом. Отрицательно или положительно заряженные липиды, такие как DSPG и/или DOT АР, могут быть включены для обеспечения поверхностного заряда липосомы или липидной наночастицы. В некоторых вариантах осуществления липидные композиции могут включать примерно десять или меньше типов липидов, или примерно пять или меньше типов липидов, или примерно три или меньше типов липидов. В некоторых вариантах осуществления молярный процент (моль %) присутствующего типа липидов, как правило, составляет примерно от 0% до 10%, примерно от 10% до 30%, примерно от 30% до 50%, примерно от 50% до 70%, примерно от 70% до 90%, или примерно от 90% до 100% от общего количества липидов, присутствующих в липосоме или липидной наночастице. В некоторых вариантах осуществления терапевтическая липосома содержит 40-80 моль % DSPC, 5-50 моль % холестерина, 0-30 моль % DSPG, и 0-10 моль % DSPE-PEG(2000). В некоторых вариантах осуществления атакующая липосома содержит 40-70 моль % DPPC, 5-20 моль % холестерина, 0-20 моль % DOTAP, и 20-40 моль % TPGS.
Липидные наночастицы согласно настоящему изобретению могут содержать сурфактанты, включая неионные сурфактанты, некоторые из которых могут действовать как инициирующие агенты для облегчения высвобождения груза терапевтических липосом. Примеры неионных сурфактантов включают этоксилированные алкилфенолы, этоксилированные сложные эфиры жирных кислот, производные сорбитана, и производные токоферола, но не ограничиваются ими. Сурфактанты, предполагаемые для применения в настоящем изобретении, включают D-α-токоферолполиэтиленгликольсукцинат (TPGS), который поставляется с различными размерами полиэтиленгликоля. В некоторых вариантах осуществления диапазон молекулярной массы полиэтиленгликоля в TPGS составляет 400-5000. В других вариантах осуществления диапазон молекулярной массы для полиэтиленгликоля в TPGS составляет 800-2000. В других вариантах осуществления диапазон молекулярной массы для полиэтиленгликоля в TPGS составляет 800-1500. Одним из особо пригодных TPGS является TPGS(1000), в котором общая молекулярная масса D-α-токоферолполиэтиленгликольсукцината составляет примерно 1543. Термин «TPGS», применяющийся в настоящем описании, относится к TPGS (1000), если не указан другой размер/масса. Другие подходящие неионные сурфактанты включают: полиэтиленгликоль п-(1,1,3,3-тетраметилбутил)фениловый эфир, полиоксиэтилен-(2)-изооктилфениловый эфир, полиоксиэтилен-(150)-динонилфениловый эфир, 2,3-дигидроксипропиловый эфир додекановой кислоты, полиоксиэтилен-(20)-сорбитан-монолаурат, полиоксиэтилен-(20)-сорбитанмонопальмитат, полиоксиэтилен-(20)-сорбитанмоностеарат, полиоксиэтилен-(20)-сорбитан-моноолеат, и тому подобные.
Специалисту в данной области техники понятно, что липидные композиции можно корректировать для модуляции свойств высвобождения или других характеристик липосом, необходимых для определенного приложения.
Терапевтические агенты
Терапевтические липосомы согласно настоящему изобретению содержат один или несколько терапевтических агентов, присутствующих где-либо в наноносителе, на нем или вокруг него. Например, терапевтический агент встраивают в липидный двойной слой липосомы, инкапсулируют в водную сердцевину липосомы, или присоединяют к внешней части липосомы. Терапевтический агент или агенты, используемые в настоящем изобретении, могут включать любой агент, предназначенный для лечения состояния у субъекта. Как правило, можно применять любой терапевтический агент, известный в данной области техники, включая без ограничения агенты, перечисленные в Фармакопее Соединенных Штатов (Фарм. США), «Goodman and Gilmanʹs The Pharmacological Basis of Therapeutics, 10th Ed.», McGraw Hill, 2001 («Фармакологическая основа лекарственных средств»); Katzung, Ed., «Basic and Clinical Pharmacology», McGraw-Hill/Appleton & Lange, 8th ed., September 21, 2000 («Базовая и клиническая фармакология»); «Physicianʹs Desk Reference» (Thomson Publishing («Справочник терапевта»); и/или «The Merck Manual of Diagnosis and Therapy, 18 ed.», 2006, Beers and Berkow, Eds., Merck Publishing Group («Руководство по диагностике и лечению Merck»); или, в случае животных, «The Merck Veterinary Manual, 9th ed.», Kahn Ed., Merck Publishing Group, 2005 («Руководство no ветеринарии Merck»); все из них включены в настоящее описание посредством ссылки.
Терапевтические агенты можно выбирать в зависимости от типа заболевания, которое необходимо лечить. Например, некоторые типы рака или опухолей, таких как карцинома, саркома, лейкемия, лимфома, миелома, и опухоли центральной нервной системы, такие как солидные опухоли и смешанные опухоли, могут требовать введения одних и тех же или по возможности разных терапевтических агентов. В некоторых вариантах осуществления терапевтический агент может быть доставлен для лечения или воздействия на онкологическое состояние у субъекта, и может включать агенты для химиотерапии, такие как алкилирующие агенты, антиметаболиты, антрациклины, алкалоиды, ингибиторы топоизомеразы, и другие противораковые агенты. В некоторых вариантах осуществления агенты могут включать антисмысловые агенты, микроРНК, миРНК и/или малую шпилечную РНК.
Терапевтические агенты могут включать противораковый агент или цитотоксический агент, включая авастин, доксорубицин, цисплатин, оксалиплатин, карбоплатин, 5-фторурацил, гемцитибин или таксаны, такие как паклитаксел и доцетаксел, но не ограничиваются ими. Дополнительные противораковые агенты могут включать 20-эпи-1,25-дигидроксивитамин D3,4-ипомеанол, 5-этинилурацил, 9-дигидротаксол, абиратерон, ацивицин, акларубицин, акодазол гидрохлорид, акронин, ацилфулвен, адеципенол, адоцелезин, альдеслейкин, все антагонисты тимидинкиназы, альтретамин, амбамустин, амбомицин, аметантронацетат, амидокс, амифостин, аминоглутетимид, аминолевулиновую кислоту, амрубицин, амсакрин, анагрелид, анастрозол, андрографолид, ингибиторы ангиогенеза, антагонист D, антагонист G, антареликс, антрамицин, анти-дорсализующий морфогенетический белок-1, антиэстроген, антинеопластон, антисмысловые олигонуклеотиды, афидиколинглицинат, модуляторы гена апоптоза, регуляторы апоптоза, апуриновую кислоту, ARA-CDP-DL-PTBA (1-β-D-арабинофуранозилцитозин 5-дифосфат-рац-1-S-октадецил-2-опальмитоил-1-тиоглицерин), аргинин-дезаминазу, аспарагиназу, асперлин, асулакрин, атаместан, атримустин, аксинастатин 1, аксинастатин 2, аксинастатин 3, азацитидин, азасетрон, азатоксин, азатирозин, азетепа, азотомицин, производные баккатина III, баланол, батимастат, бензохлорины, бензодепа, бензоилстауроспорин, производные бета-лактама, бета-алетин, бетакламицин В, бетулиновую кислоту, ингибитор основного фактора роста фибробластов, бикалутамид, бисантрен, бисантренагидрохлорид, бисазиридинилспермин, биснафид, биснафида димезилат, бистратен А, бизелесин, блеомицин, блеомицина сульфат, антагонисты BRC/ABL, брефлат, брехинар натрия, бропиримин, будотитан, бусульфан, бутионин сульфоксимин, кактиномицин, кальципотриол, кальфостин С, калустерон, производные камптотецина, канарипокс ИЛ-2, капецитабин, карацемид, карбетимер, карбоплатин, карбоксамид-амино-триазол, карбоксиамидотриазол, карест M3, кармустин, cam 700, хрящевой ингибитор, карубицина гидрохлорид, карцелезин, ингибиторы казеинкиназы, кастаноспермин, цекропин В, цедефингол, цетрореликс, хлорамбуцил, хлорины, хлорохиноксалин сульфонамид, цикапрост, циролемицин, цисплатин, цис-порфирин, кладрибин, аналоги кломифена, клотримазол, коллисмицин А, коллисмицин В, комбретастатин А4, аналог комбретастатина, конагенин, крамбесцидин 816, криснатол, криснатола мезилат, криптофицин 8, производные криптофицина А, курацин А, циклопентантрахиноны, циклофосфамид, циклоплатам, ципемицин, цитарабин, цитарабина окфосфат, цитолитический фактор, цитостатин, дакарбазин, дакликсимаб, дактиномицин, даунорубицина гидрохлорид, децитабин, дегидродидемнин В, деслорелин, дексифосфамид, дексормаплатин, декстразоксан, дексверапамил, дезагуанин, дазагуанина мезилат, диазихинон, дидемнин В, дидокс, диэтилнорспермин, дигидро-5-азацитидин, диоксамицин, дифенил спиромустин, дифенил спиромустин, доцетаксел, докозанол, доласетрон, доксифлуридин, доксорубицин, доксорубицин гидрохлорид, дролоксифен, дролоксифен цитрат, дромостанолон пропионат, дронабинол, дуазомицин, дуокармицин SA, эбселен, экомустин, эдатрексат, эдельфозин, эдреколомаб, эфломитин, эфломитин гидрохлорид, элемен, элсамитруцин, эмитефур, энлоплатин, энпромат, эпипропидин, эпирубицин, эпирубицин гидрохлорид, эпристерид, эрубилозол, векторную систему для генной терапии эритроцитов, эзорубицина гидрохлорид, эстрамустин, аналог эстрамустина, эстрамустинфосфат натрия, агонисты эстрогена, антагонисты эстрогена, этанидазол, этопозид, этопозид фосфат, этоприн, эксеместан, фадрозол, фадрозола гидрохлорид, фазарабин, фенретинид, филграстим, финастерид, флавопиридол, флезеластин, флоксуридин, флуастерон, флударабин, флударабина фосфат, флуородаунорубицина гидрохлорид, фторурацил, флуороцитабин, форфенимекс, форместан, фосхидон, фостриецин, фостриецин натрия, фотемустин, гадолиний тексафирин, нитрат галлия, галоцитабин, ганиреликс, ингибиторы желатиназы, гемцитабин, гемцитабина гидрохлорид, ингибиторы глутатиона, гепсульфам, херегулин, гексаметилена бисацетамид, гидроксимочевины гиперицин, ибандроновую кислоту, идарубицин, идарубицин гидрохлорид, идоксифен, идрамантон, ифосфамид, илмофосин, иломастат, имидазоакридоны, имиквимод, иммуностимулирующее пептиды, ингибитор рецептора инсулиноподобного фактора роста-1, агонисты интерферона, интерферон альфа-2А, интерферон альфа-2В, интерферон альфа-N1, интерферон альфа-N3, интерферон бета-IA, интерферон гамма-IB, интерфероны, интерлейкины, иобенгуан, йододоксорубицин, ипроплатин, иринотекан, иринотекана гидрохлорид, ироплакт, ирсогладин, изобенгазол, изогомогаликондрин В, итасетрон, джаспакинолид, кахалалид F, ламелларин-N триацетат, ланреотид, ланреотид ацетат, лейнамицин, ленограстим, лентинан сульфат, лептолстатин, летрозол, лейкемия-ингибирующий фактор, лейкоцитарный альфа-интерферон, лейпролида ацетата, лейпролид/эстроген/прогестерон, лейпрорелин, левамизол, лиарозол, лиарозол гидрохлорид, линейный полиаминовый аналог, липофильный дисахарид-пептид, липофильные соединения платины, лиззоклинамид 7, лобаплатин, ломбрицин, лометрексол, лометрексол натрия, ломустин, лонидамин, лозоксантрон, лозоксантрона гидрохлорид, ловастатин, локсорибин, луртотекан, лютеция тексафирин, лизофиллин, литические пептиды, майтанзин, манностатин А, маримастат, мазопрокол, маспин, ингибиторы матрилизина, ингибиторы матриксных металлопротеиназ, майтанзин, мехлорэтамин гидрохлорид, мегестрол ацетат, меленгестрол ацетат, мельфалан, меногарил, мербарон, меркаптопурин, метерелин, метиониназу, метотрексат, метотрексат натрия, метоклопрамид, метоприн, метуредепа, ингибиторы протеинкиназы С, ингибитор MIF, мифепристон, милтефозин, миримостим, не совпадающую двухцепочечную РНК, митиндомид, митокарцин, митокромин, митогиллин, митогуазон, митолактол, митомальцин, митомицин, митомициновые аналоги, митонафид, митоспер, митотан, митотоксин - фактор роста фибробластов - сапорин, митоксантрон, митоксантрон гидрохлорид, мофаротен, молграмостим, моноклональное антитело, человеческий хорионический гонадотропин, монофосфориллипид/СК клеточной стенки микобактрий, мопидамол, ингибитор гена множественной лекарственной устойчивости, терапию на основе супрессора множества опухолей 1, противораковый агент горчицы, микапероксид В, экстракт клеточной стенки микобактерий, микофеноловую кислоту, мириапорон, н-ацетилдиналин, нафарелин, нагрестип, налоксон/пентазоцин, напавин, нафтерпин, нартограстим, недаплатин, неморубицин, неридроновую кислоту, нейтральную эндопептидазу, нилутамид, низамицин, модуляторы оксида азота, нитроксидный антиоксидант, нитруллин, нокодазол, ногаламицин, н-замещенные бензамиды, 06-бензилгуанин, октреотид, окиценон, олигонуклеотиды, онапристон, ондансетрон, орацин, оральный индуктор цитокинов, ормаплатин, осатерон, оксалиплатин, оксауномицин, оксисуран, паклитаксел, аналоги паклитаксела, производные паклитаксела, палауамин, пальмитоилризоксин, памидроновую кислоту, панакситрол, паномифен, парабактин, пазеллиптин, пегаспаргазу, пелдезин, пелиомицин, пентамустин, пентозанполисульфат натрия, пентостатин, пентрозол, пепломицина сульфат, перфлуброн, перфосфамид, периллиловый спирт, феназиномицин, фенилацетат, ингибиторы фосфатазы, пицибанил, пилокарпина гидрохлорид, пипоброман, пипосульфан, пирарубицин, пиритрексим, пироксантрона гидрохлорид, плацетин А, плацетин В, ингибитор активатора плазминогена, комплекс платины, соединения платины, комплекс платина-триамин, пликамицин, пломестан, порфимер натрия, порфиромицин, преднимустин, прокарбазина гидрохлорид, пропил-бис-акридон, простагландин J2, антиандроген карциномы простаты, ингибиторы протеасом, иммуномодулятор на основе протеина А, ингибитор протеинкиназы С, белковые ингибиторы тирозин фосфатазы, ингибиторы фосфорилазы пуриновых нуклеозидов, пуромицин, пуромицина гидрохлорид, пурпурины, пиразофурин, пиразолоакридин, конъюгат пиридоксилированного гемоглобина-полиоксиэтилена, RAF антагонисты, ралтитрексед, рамосетрон, ингибиторы RAS фарнезил протеин-трансферазы, ингибиторы RAS, ингибитор RAS-GAP, деметилированный ретеллиптин, рений RE 186 этидронат, ризоксин, рибоприн, рибозимы, RII ретинамид, РНК-и, роглетимид, рохитукин, ромуртид, рохинимекс, рубигинон В1, рубоксил, сафингол, сафингола гидрохлорид, саинтопин, саркну, сакрофитол А, сарграмостим, SDI 1 миметики семустин, ингибитор из стареющих клеток - 1, смысловые олигонуклеотиды, ингибиторы передачи сигнала, модуляторы передачи сигнала, симтразен, одноцепочечный антиген связывающий белок, сизофуран, собузоксан, борокаптат натрия, фенилацетат натрия, солверол, соматомедин-связывающий белок, сонермин, спарфозат натрия, спарфозовую кислоту, спарсомицин, спикамицин D, спирогерманиум гидрохлорид, спиромустин, спироплатин, спленопентин, спонгистатин 1, скваламин, ингибитор стволовых клеток, ингибиторы деления стволовых клеток, стипиамид, стрептонигрин, стрептозоцин, ингибиторы стромелизина, сульфинозин, сулофенур, суперактивный антагонист вазоактивного интестинального пептида, сурадиста, сурамин, свайнсонин, синтетические гликозаминогликаны, тализомицин, таллимустин, тамоксифен метиодид, тауромустин, тазаротен, текогалан натрия, тегафур, теллурапирилиум, ингибиторы теломеразы, телоксантрона гидрохлорид, темопорфин, темозоломид, тенипозид, тероксирон, тестолактон, тетрахлородекаоксид, тетразомин, талибластин, талидомид, тиамиприн, тиокоралин, тиогуанин, тиотепа, тромбопоэтин, миметик тромбопоэтина, тималфазин, агонист рецептора тимопоэтина, тимотринан, тиреотропный гормон, тиазофурин, олово-этил-этиопурпурин, тирапазамин, титаноцена дихлорид, топотекана гидрохлорид, топсентин, торемифен, торемифена цитрат, фактор тотипотентных стволовых клеток, ингибиторы трансляции, трестолона ацетат, третиноин, триацетилуридин, трицирибин, трицирибина фосфат, триметрексат, триметрексата глюкуронат, трипторелин, трописетрон, туболозола гидрохлорид, туростерид, ингибиторы тирозинкиназы, тирфостины, ингибиторы UBC, убенимекс, урамустин, уредепа; рост-ингибирующий фактор, полученный из мочеполового синуса; антагонисты рецепторов урокиназы, вапреотид, вариолин В, веларесол, верамин, вердинс, вертепорфин, винбластина сульфат, винкристина сульфат, виндезин, виндезина сульфат, винепидина сульфат, винглицината сульфат, винлейрозина сульфат, винорелбин, винорелбин тартрат, винросидина сульфат, винксалтин, винзолидина сульфат, витаксин, ворозол, занотерон, зениплатин, зиласкорб, зиностатин, зиностатин стималамер или зорубицина гидрохлорид, но не ограничиваются ими.
В некоторых вариантах осуществления терапевтические агенты могут быть частью коктейля из агентов, что включает введение двух или более терапевтических агентов. Например, можно вводить липосому, содержащую цисплатин и оксалиплатин. Кроме того, терапевтические агенты можно применять до иммуностимулирующих адьювантов, после них или вместе с ними, такими как адъювантные гели или соли алюминия (например, фосфат алюминия или гидроксид алюминия), фосфат кальция, эндотоксины, адъюванты толл-подобного рецептора, и тому подобное.
Терапевтические агенты согласно настоящему изобретению могут также включать радионуклиды для применения в лечебных целях. Например, источники электронов Оже, такие как111In, можно объединять с хелатом, таким как диэтилентриаминпентауксусная кислота (DTPA) или 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусная кислота (DOTA), и включить в липосому, предназначенную для лечения. Другие подходящие радионуклиды и/или комбинации радионуклид-хелат могут включать бета-радионуклиды (177Lu,153Sm,88/90Y) с DOTA,64Cu-TETA,188/186Re(CO)3-IDA;188/18Re(СО)триамины (циклические или линейные),188/186Re(CO)3-Enpy2, и188/186Re(CO)3-DTPA, но не ограничиваются ими.
В некоторых вариантах осуществления настоящего изобретения терапевтическим агентом может быть цисплатин, оксалиплатин, карбоплатин, гемцитабин, 5-фторурацил, доксорубицин, и таксан. В некоторых вариантах осуществления терапевтическим агентом является цисплатин или оксалиплатин.
Загрузку терапевтическими агентами можно проводить с применением множества способов, известных в данной области техники, как описано, например, в следующих ссылках: de Villiers, М.М. и др., Eds., «Nanotechnology in Drug Delivery», Springer (2009) («Нанотехнология в доставке лекарств»); Gregoriadis, G., Ed., «Liposome Technology: Entrapment of drugs and other materials into liposomes», CRC Press (2006) («Технология липосом: захват лекарств и других материалов в липосомах»). В некоторых вариантах осуществления в липосомы можно загрузить один или несколько терапевтических агентов. Загрузку липосом можно проводить, например, активным или пассивным образом. Например, терапевтический агент можно включить во время процесса самосборки липосом в растворе, так чтобы терапевтический агент был инкапсулирован в липосоме. В некоторых вариантах осуществления терапевтический агент может также быть встроен в двойной слой липосомы или внутри множества слоев мультиламеллярной липосомы. В альтернативных вариантах осуществления терапевтический агент может быть загружен в липосомы активным способом. Например, липосомы можно подвергнуть воздействию таких условий, как электропорация, в которых двуслойная мембрана становится проницаемой для раствора, содержащего терапевтический агент, позволяя, таким образом, терапевтическому агенту проникать во внутренний объем липосом.
Диагностические агенты
Терапевтические липосомы согласно настоящему изобретению могут также содержать диагностические агенты. Диагностический агент, используемый в настоящем изобретении, может включать любой диагностический агент, известный в данной области техники, как указано, например, в следующих ссылках: Armstrong и др., ((Diagnostic Imaging», 5th Ed., Blackwell Publishing (2004) («Диагностическая визуализация»); Torchilin, V.P., Ed., ((Targeted Delivery of Imaging Agents», CRC Press (1995) («Направленная доставка агентов для визуализации»); Vallabhajosula, S., Molecular Imaging: «Radiopharmaceuticals for PET and SPECT», Springer (2009) («Молекулярная визуализация: Радиофармацевтические средства для ПЭТ и ОФЭКТ»). Диагностический агент может быть обнаружен посредством множества способов, включая доставку агента и/или усиление выявляемого сигнала, в том числе гамма-излучающих, радиоактивных, эхогенньгх, оптических, флуоресцентных, абсорбционных, магнитных или томографических сигналов, но не ограничиваясь ими. Методики визуализации диагностического агента могут включать однофотонную эмиссионную компьютерную томографию (ОФЭКТ), магнитно-резонансную томографию (МРТ), оптическую визуализацию, позитронную эмиссионную томографию (ПЭТ), компьютерную томографию (КТ), рентгеновскую визуализацию, гамма-лучевую визуализацию, и тому подобное, но не ограничиваются ими.
В некоторых вариантах осуществления диагностический агент может включать хелатирующие агенты, которые связывают ионы металлов, применяемые в различных методиках диагностической визуализации. Примерами хелатирующих агентов включают этилендиаминтетрауксусную кислоту (EDTA), [4-(1,4,8,11-тетраазациклотетрадек-1-ил)метил]бензойную кислоту (СРТА), циклогександиаминтетрауксусную кислоту (CDTA), этиленбис(оксиэтиленнитрило)тетрауксусную кислоту (EGTA), диэтилентриаминпентауксусную кислоту (DTPA), лимонную кислоту, гидроксиэтил-этилендиамин-триуксусную кислоту (HEDTA), иминодиуксусную кислоту (IDA), триэтилен-тетраамин-гексауксусную кислоту (ТТНА), 1,4,7,10-тетраазациклододекан-1,4,7,10-тетра(метилен-фосфоновую кислоту) (DOTP), 1,4,8,11-тетраазациклододекан-1,4,8,11-тетрауксусную кислоту (ТЕТА), 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA), и их производные, но не ограничиваются ими.
Радиоизотоп может быть встроен в некоторые из диагностических агентов, описанных в настоящей заявке, и может включать радионуклиды, испускающие гамма-лучи, позитроны, бета- и альфа-частицы, и рентгеновские лучи. Подходящие радионуклиды включают225Ас,72As,211At,UB,128Ва,212Bi,75Br,77Br,14C,109Cd,62Cu,64Cu,67Cu,18F,67Ga,68Ga,3H,123I,125I,130I,131I,111In,177Lu,13N,15O,32P,33P,212Pb,103Pd,186Re,188Re,47Sc,153Sm,89Sr,99mTc,88Y и90Y, но не ограничиваются ими. В некоторых вариантах осуществления радиоактивные агенты могут включать111In-DTPA,99mTc(CO)3-DTPA,99mTc(CO)3-ENPy2,62/64/67Cu-TETA,99mTc(CO)3-IDA, и99mTc(СО)3триамины (циклические или линейные). В других вариантах осуществления агенты могут включать DOTA и ее различные аналоги с111In,177Lu,153Sm,88/90Y,62/64/67Cu, или67/68Ga. В некоторых вариантах осуществления липосомы могут быть меченными радиоактивным изотопом, например, путем встраивания липидов, присоединенных к хелатам, таких как DTPA-липид, как описано в следующих ссылках: Phillips и др., «Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology», 1(1): 69-83 (2008) («Междисциплинарный обзор Wiley: наномедицина и нанотехнологии»); Torchilin, V.P. & Weissig, V., Eds. «Liposomes 2nd Ed".»: Oxford Univ. Press (2003) («Липосомы, 2-е изд.»); Elbayoumi, T.A. & Torchilin, V.P., Eur. J. Nucl. Med. Mol. Imaging 33:1196-1205 (2006); Mougin-Degraef, M. и др., Intʹl U. Pharmaceutics 344:110-117 (2007).
В других вариантах осуществления диагностические агенты могут включать оптические агенты, такие как флюоресцентные агенты, фосфоресцентные агенты, хемилюминесцентные агенты, и тому подобные. Многочисленные агенты (например, красители, зонды, метки или индикаторы) известны в данной области техники и могут применяться в настоящем изобретении (см., например, Invitrogen, «The Handbook - А Guide to Fluorescent Probes and Labeling Technologies, Tenth Edition» (2005) («Учебник - Руководство по флуоресцентным зондам и методикам маркировки, 10-е издание»)). Флуоресцентные агенты могут включать разные органические и/или неорганические малые молекулы или разные флуоресцентные зонды и их производные. Например, флуоресцентные агенты могут включать цианины, фталоцианины, порфирины, индоцианины, родамины, феноксазины, фенилксантены, фенотиазины, феноселеназины, флуоресцеины, бензопорфирины, сквараины, дипирроло-пиримидоны, тетрацены, хинолины, пиразины, коррины, крокониевые соединения, акридоны, фенантридины, родамины, акридины, антрахиноны, аналоги халькогенопирилия, хлорины, нафталоцианины, метановые красители, индолениевые красители, азо соединения, азулены, азаазулены, трифенилметановые красители, индолы, бензоиндолы, индокарбоцианины, бензоиндокарбоцианины, и производные BODIPY™, имеющие общую структуру 4,4-дифторо-4-бора-3а,4а-диаза-s-индацена, и/или конъюгаты и/или производные любых этих соединений, но не ограничиваются ими. Другие агенты, которые можно применять, включают, например, флуоресцеин, конъюгаты флуоресцеина-полиаспарагиновой кислоты, конъюгаты флуоресцеина-полиглутаминовой кислоты, конъюгаты флуоресцеина-полиаргинина, индоцианин зеленый, конъюгаты индоцианина-додекааспарагиновой кислоты, конъюгаты индоцианина-полиаспарагиновой кислоты, изосульфан синий, индол-дисульфонаты, бензоиндол дисульфонат, бис(этилкарбоксиметил)индоцианин, бис(пентилкарбоксиметил)индоцианин, полигидроксииндол-сульфонаты, полигидроксибензоиндол-сульфонат, ригидный гетероатомный индол-сульфонат, индоцианинбиспропановую кислоту, индоцианинбисгексановую кислоту, 3,6-дициано-2,5-[(N,N,Nʹ,Nʹ-тетракис(карбоксиметил)амино]пиразин, 3,6-[(N,N,Nʹ,Nʹ-тетракис(2-гидроксиэтил)амино]пиразин-2,5-дикарбоновую кислоту, 3,6-бис(N-азатедино)пиразин-2,5-дикарбоновую кислоту, 3,6-бис(N-морфолино)пиразин-2,5-дикарбоновую кислоту, 3,6-бис(N-пиперазино)пиразин-2,5-дикарбоновую кислоту, 3,6-бис(N-тиоморфолино)пиразин-2,5-дикарбоновую кислоту, 3,6-бис(N-тиоморфолино)пиразин-2,5-дикарбоновой кислоты S-оксид, 2,5-дициано-3,6-бис(N-тиоморфолино)пиразина S,S-диоксид, индокарбоцианинтетрасульфонат, хлороиндокарбоцианин, и 3,6-диаминопиразин-2,5-дикарбоновую кислоту.
Рядовому специалисту в данной области техники понятно, что конкретные используемые оптические агенты могут зависеть от длины волны, используемой для возбуждения, глубины под кожной тканью, и других факторов, общеизвестных в данной области техники. Например, оптимальное поглощение или максимумы возбуждения для оптических агентов могут варьировать в зависимости от применяемого агента, но как правило, оптические агенты согласно настоящему изобретению поглощают или возбуждаются светом в ультрафиолетовом (УФ), видимом или инфракрасном (ИК) диапазоне электромагнитного спектра. Для визуализации предпочтительными являются красители, которые поглощают и испускают в области, близкой к ИК (~700-900 нм, например, индоцианины). Для местной визуализации, используемой в эндоскопическом способе, пригодны любые красители, поглощающие в видимом диапазоне.
В некоторых вариантах осуществления неионизирующее облучение, применяемое в способе согласно настоящему изобретению, может находиться в диапазоне длин волн примерно от 350 нм до 1200 нм. В одном варианте осуществления, использующемся в качестве примера, флуоресцентный агент может возбуждаться светом, имеющим длину волны в синем диапазоне видимой области электромагнитного спектра (примерно от 430 нм до 500 нм) и испускать свет с длиной волны в зеленом диапазоне видимой части спектра (примерно от 520 нм до 565 нм). Например, флуоресцеиновые красители могут возбуждаться светом с длиной волны примерно 488 нм, и иметь длину волны эмиссии примерно 520 нм. В качестве другого примера, 3,6-диаминопиразин-2,5-дикарбоновая кислота может возбуждаться светом с длиной волны около 470 нм, и флуоресцирует при длине волны примерно 532 нм. В другом варианте осуществления длины волн возбуждения и эмиссии оптического агента могут находиться рядом с инфракрасной областью электромагнитного спектра. Например, индоцианиновые красители, такие как индоцианин зеленый, могут быть возбуждены светом с длиной волны примерно 780 нм, и имеют длину волны эмиссии около 830 нм.
В еще одних вариантах осуществления диагностические агенты могут включать агенты для магнитного резонанса (MP) и рентгено-контрастные агенты, общеизвестные в данной области техники, включая, например, рентгено-контрастные агенты на основе йода, суперпарамагнитный оксид железа (SPIO), комплексы гадолиния или марганца, и тому подобные, но не ограничиваются ими. (См., например, Armstrong и др., ((Diagnostic Imaging», 5th Ed., Blackwell Publishing (2004) («Диагностическая визуализация»)). В некоторых вариантах осуществления диагностический агент может включать агент для магнитно-резонансной (MP) визуализации. Магнитно-резонансные агенты, использующиеся в качестве примера, включают парамагнитные агенты, суперпарамагнитные агенты, и тому подобные, но не ограничиваются ими. Парамагнитные агенты, использующиеся в качестве примера, могут включать гадопентетовую кислоту, гадотеровую кислоту, гадодиамид, гадолиний, гадотеридол, мангафодипир, гадоверсетамид, двойную соль лимоннокислого железа и лимоннокислого аммония, гадобеновую кислоту, гадобутрол, или гадоксетовую кислоту, но не ограничиваются ими. Сверхпрамагнитные агенты могут включать сверхпарамагнитный оксид железа и ферристен, но не ограничиваются ими. В некоторых вариантах осуществления диагностические агенты могут включать рентгеноконтрастные агенты, как описано, например, в следующих ссылках: H.S Thomsen, R.N. Muller and R.F. Mattrey, Eds., «Trends in Contrast Media», (Berlin: Springer-Verlag, 1999 («Направления в области контрастных сред»); P. Dawson, D. Cosgrove and R. Grainger, Eds., ((Textbook of Contrast Media» (ISIS Medical Media 1999) («Учебник по контрастным средам»); Torchilin, V.P., Curr. Pharm. Biotech. 1:183-215 (2000); Bogdanov, A.A. и др., Adv. Drug Del. Rev. 37:279-293 (1999); Sachse, А. и др., Investigative Radiology 32(1):44-50 (1997). Примеры рентгеноконтрастных агентов включают иопамидол, иомепрол, иогексол, иопентол, иопромид, иосимид, иоверсол, иотролан, иотасул, иодиксанол, иодецимол, иоглукамид, иоглунид, иогуламид, иосакрол, иоксилан, иопамирон, метризамид, иобитридол и иосименол, но не ограничиваются ими. В некоторых вариантах осуществления рентгеноконтрастные агенты могут включать иопамидол, иомепрол, иопромид, иогексол, иопентол, иоверсол, иобитридол, иодиксанол, иотролан и иосименол.
Как и терапевтические агенты, описанные выше, диагностические агенты могут быть ассоциированы с терапевтической липосомой множеством способом, включая, например, встраивание или инкапсулирование в липосому. Подобным образом, загрузку диагностических агентов можно проводить с помощью различных способов, например, как описано в следующих ссылках: de Villiers, М.М. и др., Eds., ((Nanotechnology in Drug Delivery)), Springer (2009) («Нанотехнология в доставке лекарств»); Gregoriadis, G., Ed., «Liposome Technology: Entrapment of drugs and other materials into liposomes)), CRC Press (2006) («Технология липосом: захват лекарств и других материалов в липосомах»).
Получение и применение
В некоторых вариантах осуществления настоящее изобретение может включать липосомную композицию и физиологически (т.е. фармацевтически) пригодный носитель. Термин «носитель», применяющийся в настоящем описании, относится к типично инертному веществу, используемому в качестве разбавителя или растворителя для лекарства, такого как терапевтический агент. Указанный термин также охватывает типично инертное вещество, придающее когезивные свойства композиции. Как правило, физиологически пригодные носители присутствуют в жидкой форме. Примеры жидких носителей включают физиологический солевой раствор, фосфатный буферный раствор, нормальный буферный солевой раствор (135-150 мМ NaCl), воду, забуференную воду, 0,4% солевой раствор, 0,3% глицин, гликопротеины для обеспечения повышенной стабильности (например, альбумин, липопротеин, глобулин и т.д.), и тому подобное. Поскольку физиологически пригодные носители определяются отчасти конкретной композицией, предназначенной для применения, а также конкретным способом введения композиции, имеется широкий ряд пригодных рецептур фармацевтических композиций согласно настоящему изобретению (см., например, «Remingtonʹs Pharmaceutical Sciences)), 17th ed., 1989) («Фармацевтический справочник Remington»).
Композиции согласно настоящему изобретению могут быть стерилизованы посредством обычных, хорошо известных методик, или могут быть получены в стерильных условиях. Водные растворы могут быть упакованы для применения или фильтрованы в асептических условиях и лиофилизированы, лиофилизированный препарат объединяют со стерильным водным раствором перед применением. Композиции могут содержать фармацевтически пригодные вспомогательные вещества, как необходимо для приближения к физиологическим условиям, такие как агенты для регуляции pH и буферные агенты, агенты для регуляции тоничности, увлажняющие агенты, и тому подобное, например, ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитан монолаурат, и триэтаноламина олеат. Сахара могут также быть включены для стабилизации композиции, такие как стабилизатор для лиофилизированных липосомных композиций.
Выбранная липосомная композиция, по отдельности или в комбинации с другими подходящими компонентами, может быть выполнена в виде аэрозольных рецептур (т.е. они могут быть «распыляться») для применения посредством ингаляции. Аэрозольные рецептуры можно поместить в подходящие пропелленты под давлением, такие как дихлордифторметан, пропан, азот, и тому подобное.
Подходящие рецептуры для ректального применения включают, например, суппозитории, содержащие эффективное количество упакованной липосомной композиции с основой суппозитория. Подходящие основы суппозитория включают натуральные или синтетические триглицериды или парафиновые углеводороды. Кроме того, можно применять желатиновые ректальные капсулы, содержащие комбинацию выбранной липосомной композиции и основы, включающие, например, жидкие триглицериды, полиэтиленгликоли, и парафиновые углеводороды.
Рецептуры, пригодные для парентерального применения, например, такие как для внутрисуставного, внутривенного, внутримышечного, внутриопухолевого, интрадермального, интраперитонеального и подкожного введения, включают водные и неводные, изотонические стерильные растворы для инъекций, которые содержат антиоксиданты, буферные агенты, бактериостатики, и растворенные вещества, обеспечивающие изотоничность рецептуры с кровью назначенного реципиента, и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, уплотнители, стабилизаторы, и консерванты. Растворы и суспензии для инъекций можно также приготовить из стерильных порошков, гранул и таблеток. При осуществлении настоящего изобретения композиции могут быть применены, например, путем внутривенной инфузии, местно, интарперитонеально, интравезикально, или интратекально. Предпочтительными способами применения являются парентеральное применение и внутривенное применение. Рецептуры липосомных композиций могут быть представлены в однодозовых и многодозовых контейнерах, таких как ампулы и флаконы.
Фармацевтический препарат предпочтительно находится в виде лекарственной формы. В такой форме препарат подразделяется на отдельные дозы, содержащие подходящие количества активного компонента, например, липосомной композиции. Лекарственная форма может быть упакованным препаратом, где упаковка содержит дискретные количества препарата. Композиция может, если необходимо, также содержать другие совместимые терапевтические агенты.
При терапевтическом применении для лечения рака липосомные композиции, включающие терапевтический и/или диагностический агент, используемый в фармацевтических композициях согласно настоящему изобретению, могут применяться в исходной дозировке примерно от 0,001 мг/кг до 1000 мг/кг в сутки. Может применяться диапазон суточной дозы примерно от 0,01 мг/кг до 500 мг/кг, или примерно от 0,1 мг/кг до 200 мг/кг, или примерно от 1 мг/кг до 100 мг/кг, или примерно от 10 мг/кг до 50 мг/кг. Однако дозировка может варьировать в зависимости от потребностей пациента, тяжести состояния, которое нужно лечить, и используемой липосомной композиции. Например, дозировку можно определить эмпирически с учетом типа и стадии рака, диагностированного у конкретного пациента. Доза, применяемая у пациента в контексте настоящего изобретения, должна быть достаточной для обеспечения благоприятного ответа на лечение у пациента со временем. Величину дозы также можно определить по наличию, природе и степени каких-либо побочных эффектов, сопровождающих применение конкретной липосомной композиции у конкретного пациента. Определение надлежащей дозировки для конкретной ситуации находится в пределах компетенции специалиста в данной области техники. Как правило, лечение начинают с наименьших дозировок, которые меньше оптимальной дозы липосомной композиции. Затем дозу постепенно увеличивают небольшими шагами, пока не будет достигнут оптимальный эффект в данных условиях. Для удобства общую суточную дозу можно разделить и применять по частям в течение суток, если необходимо.
Нацеливающие агенты
В некоторых случаях накопление липосом в целевом участке может быть обусловлено повышением характеристик проницаемости и удерживания в определенных тканях, таких как раковые ткани. Такое накопление часто развивается отчасти из-за размера липосомы, и может не требовать специальной таргетинговой функциональности. В других случаях липосомы согласно настоящему изобретению могут также включать нацеливающий агент. Как правило, нацеливающие агенты согласно настоящему изобретению могут связываться с любой интересующей мишенью, такой как мишень, ассоциированная с органом, тканью, клеткой, экстрацеллюлярным матриксом, или внутриклеточным участком. В некоторых вариантах осуществления мишень может быть ассоциирована с конкретным патологическим состоянием, таким как онкологическое заболевание. В некоторых вариантах осуществления нацеливающий компонент может быть специфичным только к одной мишени, такой как рецептор. Подходящие мишени могут включать нуклеиновую кислоту, такую как ДНК, РНК, или их модифицированные производные, но не ограничиваются ими. Подходящие мишени могут также включать белок, такой как экстрацеллюлярный белок, рецептор, рецептор клеточной поверхности, маркер опухоли, трансмембранный белок, фермент, или антитело, но не ограничиваются ими. Подходящие мишени могут включать углевод, такой как моносахарид, дисахарид, или полисахарид, который может, например, присутствовать на поверхности клетки.
В некоторых вариантах осуществления нацеливающий агент может включать целевой лиганд (например, RGD-содержащий пептид), малую молекулу, имитирующую целевой лиганд (например, пептид-миметический лиганд), или антитело или фрагмент антитела, специфичный для конкретной мишени. В некоторых вариантах осуществления нацеливающий агент может дополнительно включать производные фолиевой кислоты, производные В-12, интегрин-RGD пептиды, производные NGR, производные соматостатина или пептиды, связывающиеся с рецептором соматостатина, например, октреотид и октреотат, и тому подобные. Нацеливающие агенты согласно настоящему изобретению могут также включать аптамер. Аптамеры могут быть сконструированы для ассоциации или связывания с интересующей мишенью. Аптамеры могут включать, например, ДНК, РНК и/или пептиды, и некоторые аспекты аптамеров хорошо известны в данной области техники (См., например, Klussman, S., Ed., «The Aptamer Handbook», Wiley-VCH (2006) («Руководство по аптамерам»); Nissenbaum, E.T., Trends in Biotech. 26(8): 442-449 (2008)).
Наборы для введения активных агентов
В другом аспекте настоящее изобретение также обеспечивает наборы для введения липосом и липидных наночастиц у субъекта для лечения патологического состояния. В некоторых вариантах осуществления изобретение обеспечивает набор для доставки терапевтического агента субъекту, включающий: (а) первую композицию, содержащую липосому, включающую терапевтический агент; и (b) вторую композицию, содержащую липидную наночастицу, включающую неионный инициирующий агент; где первую и вторую композицию хранят по отдельности перед введением субъекту.
Такие наборы, как правило, включают два или более компонента, необходимых для лечения патологического состояния, такого как онкологическое заболевание. Компоненты могут включать липидные композиции согласно настоящему изобретению, реагенты, буферные вещества, контейнеры и/или оборудование. Липосомы и липидные наночастицы могут быть в лиофилизированной форме, а затем восстановлены перед введением. В некоторых вариантах осуществления наборы согласно настоящему изобретению могут включать упаковочные комплекты, которые могут содержать один или несколько компонентов, используемых для лечения патологического состояния у пациента. Например, упаковочный комплект может включать отдельные контейнеры, которые вмещают терапевтические липосомы и атакующие агенты, как описано в настоящей заявке. Отдельный контейнер может включать другие наполнители или агенты, которые могут быть смешаны с композициями перед введением пациенту. В некоторых вариантах осуществления врач может выбирать и сочетать определенные компоненты и/или упаковочные монтажи, в зависимости от лечения или диагноза, необходимого для конкретного пациента.
Примеры
Осуществление настоящего изобретения иллюстрировано, но не предназначено для ограничения примерами в Таблице А. В этих примерах ясно показано in vitro, что атакующая липосома может применяться для инициации высвобождения груза из терапевтических липосом с характеристиками высвобождения, неудовлетворительными в других случаях. В Примерах 1, 2 и 11-12, терапевтические липосомы содержат цитотоксические агенты, включая цисплатин или оксалиплатин. В Примерах 3-10 используют 5-карбоксифлюоресцеин (5-CF) в качестве маркера композиций терапевтических липосом. Характеристики этих образцов обобщены в Таблице А ниже. Примеры 1-5 и 10 показывают, что одну и ту же атакующую липосому (Часть В) применяют для инициации и/или усиления высвобождения разных композиций терапевтических липосом (Часть А) со "стелс"-функциональностью или без нее. Примеры 6-9 показывают критическую роль инициирующего агента в атакующей липосоме. Поверхностный заряд атакующей липосомы является по существу нейтральным в Примерах 8 и 9.

Пример 1
Композиции терапевтической липосомы (NLICOV003F-02), содержащей оксалиплатин, и атакующей липосомы (4460-075 DPPC/Chol/DOTAP/TPGS) показаны в Таблице 1. Терапевтическая липосома (Northern Lipid Inc.) содержала 2,9 мг/мл оксалиплатина и 71,8 мг/мл общих липидов. Атакующую липосому готовили с помощью следующих этапов.
1) Готовили навески всех липидов и помещали в круглодонную колбу.
2) В колбу добавляли 3:1 (о/о) хлороформ/метанол для растворения всех липидов; концентрация липидов составила примерно 2,5 масс. %.
3) Растворители удаляли из липидной смеси с применением ротационного испарителя при 40°C, и применяли вакуум с помощью ротационного испарителя в течение 0,5 часов при 40°C для удаления остаточных растворителей.
4) Проводили сушку под вакуумом в течение ночи при комнатной температуре для удаления следовых количеств растворителей.
5) Фосфатно-солевой буферный раствор (ФБР) 1X (0,0067 М) добавляли к сухой липидной пленке на дне колбы, и дисперсию перемешивали при 70°C в течение 1 часа.
6) Липидную дисперсию (дисперсию мультиламеллярных везикул) экструдировали 5 раз через двойную 200 нм поликарбонатную пленку при 70°C в 10-мл экструдере под давлением около 200 ф./кв. дюйм.
7) Экструзию продолжали 10 раз через двойную 100 нм поликарбонатную пленку при 70°C под давлением около 300 ф./кв. дюйм.
8) Собирали образец экструдированных липосом, и определяли размер частиц и дзета-потенциал с применением Malvern Zetasizer Nano ZS.
Высвобождение оксалиплатина in vitro из NLICOV003F-02 проводили в растворах ФБР IX (pH=7,4 и 5,0) путем смешивания аликвоты атакующей липосомы с терапевтической липосомой. Первый образец немедленно собирали (в пределах менее 3 минут) при комнатной температуре, и готовили для измерения высвобождения оксалиплатина. Высвобождение определяли путем фильтрации образцов через центрифужные фильтры Amicon 50К MWCO при 16500 об/мин в течение 5 минут. Высвобожденный оксалиплатин в водной фазе, не содержащей липосом, анализировали посредством ИСП-ОЭС (оптической эмиссионной спектрометрии с индуктивно связанной плазмой). После отбора немедленного образца, смесь инкубировали при 37°C в течение 48 часов. Образцы отбирали последовательно спустя 1, 6, 24 и 48 часов для анализа высвобождения оксалиплатина. Результаты показаны в Таблице 1 и Таблице 2. Данные, показанные в Таблице 2 и приведенные на графике на Фигуре 1, указывают, что общее высвобождение терапевтической липосомы (NLICOV003F-02) увеличилось от ~5% в исходный момент времени до ~40% спустя 6 часов, при добавлении эквивалентного количества атакующей липосомы (4460-075). Результаты также указывают, что общее высвобождение содержимого терапевтической липосомы повышается с количеством атакующей липосомы при обоих условиях pH. Терапевтическая липосома является не-стелс заряженной липосомой, содержащей 10 моль % холестерина. Атакующая липосома имеет противоположный заряд и содержит 32 моль % TPGS.


Пример 2
Этот пример иллюстрирует повышенное высвобождение цисплатина из терапевтических липосом при добавлении различных количеств атакующей липосомы. Терапевтические липосомы, содержащие 2,5 мг/мл цисплатина и 77,5 мг/мл общих липидов (NLICOV00AR-02, Northern Lipids Inc.), готовили посредством процедуры пассивной нагрузки. Атакующую липосому, состоящую из DPPC, холестерина, DOTAP, и TPGS (4460-075), готовили, как описано в Примере 1.
Высвобождение цисплатина in vitro из NLICOV00AR-02 проводили в ФБР IX (pH=7,.4 и 5,0) растворах путем добавления атакующей липосомы (4460-075) к терапевтической липосоме. Образцы собирали немедленно при комнатной температуре, и спустя 1, 6, 24 и 48 часов инкубации при 37°C. Образцы фильтровали через центрифужные фильтры Amicon 50K MWCO при 16500 об./мин в течение 5 минут. Цисплатин, высвобожденный в водную фазу вне липосом, анализировали путем ИСП-ОЭС. Результаты показаны в Таблицах 3 и 4. Данные показаны в Таблице 4, графики построены и показаны на Фигуре 2. Результаты показывают, что общее высвобождение терапевтической липосомы (NLICOV00AR-02) спустя 48 часов возросло от ~1% без атакующей липосомы до ~27% с равным количеством атакующей липосомы. Результаты также показали, что общее высвобождение терапевтической липосомы возросло при увеличении количества атакующей липосомы при обоих значениях pH. В этом примере терапевтическая липосома была не-стелс, заряженной липосомой, содержащей 10 моль % холестерина. Атакующая липосома была противоположно заряженной и содержала 32 моль % TPGS.


Пример 3
В этом примере атакующая липосома (Часть В, 4460-075) состояла из DPPC, холестерина, DOTAP, и TPGS, как показано в Таблице 5; способ приготовления был тем же самым, как описано в Примере 1. Терапевтическая липосома (Часть А, 4460-090) содержала 5-карбоксифлюоресцеин (5-CF) в качестве маркера. Липосому, содержащую 5-CF, готовили путем процедуры пассивной нагрузки, как описано ниже.
1) Готовили навески всех липидов и помещали в круглодонную колбу.
2) В колбу добавляли 3:1 (о/о) хлороформ/метанол для растворения всех липидов; концентрация липидов составила примерно 2,5 масс. %.
3) Растворители удаляли из липидной смеси с применением ротационного испарителя при 40°C, и применяли вакуум с помощью ротационного испарителя в течение 0,5 часов при 40°C для удаления остаточных растворителей.
4) Проводили сушку под вакуумом в течение ночи при комнатной температуре для удаления следовых количеств растворителей.
5) Фосфатно-солевой буферный раствор (ФБР) IX (0,0067 М) добавляли к сухой липидной пленке на дне колбы, и полученную дисперсию перемешивали при 70°C в течение 1 часа. На этом этапе добавляли 5-карбоксифлюоресцеин (5-CF) к ФБР при концентрации 2,0 мг/мл. Значение pH дисперсии доводили до 7,1.
6) Дисперсию липидных везикул экструдировали 5 раз через двойную 200 нм поликарбонатную пленку при 70°C в 10-мл экструдере под давлением около 200 ф./кв. дюйм.
7) Экструзию продолжали 10 раз через двойную 100 нм поликарбонатную пленку при 70°C под давлением около 300 ф./кв. дюйм.
8) Итоговый препарат липосом вводили в 3,0-12,0 мл 20,000 MWCO кассету для диализа.
9) Препарат липосом диализовали против 1000 мл ФБР IX раствора в течение 24 часов.
10) Диализ повторяли еще два раза с 1000 мл свежего ФБР IX буферного раствора.
11) Собирали диализованные липосомы, и определяли размер частиц и дзета-потенциал с применением Malvern Zetasizer Nano ZS.
Часть А липосомы смешивали с частью В, и определяли высвобождение 5-CF в свободную от липосом водную фазу посредством Agilent 1200 ВЭЖХ с флюоресцентным детектором для множества длин волн Waters 2475(S/N 608975406М). Использовали колонку BDS Hypersil С18 (150 мм Х3,0 мкм, Thermo Scientific, S/N: 0908389Т, Серия №10770). Мобильная фаза состояла из 5 масс. % IPA/ 5 масс. % ACN/ 90 масс. % воды с 50 мМ ацетатом аммония. Градиент не применяли. Скорость потока составляла 0,8 мл/мин при 40°C. Объем инжекции 5,0 мкл. Время пробега 5 минут, CF-5 элюировался примерно на 1,0 мин. Для флюоресцентной детекции применяли длину волны возбуждения 492 нм, и длину волны эмиссии 514 нм. EUFS устанавливали на 50,000, а прирост устанавливали на 1,0 на детекторе. Для калибровки использовали внешние стандарты CF-5 в ФБР 1X. Линейный диапазон калибровки составил от 0,05 мкг/мл до 2,0 мкг/мл, с получением значения R2 больше 0,99.
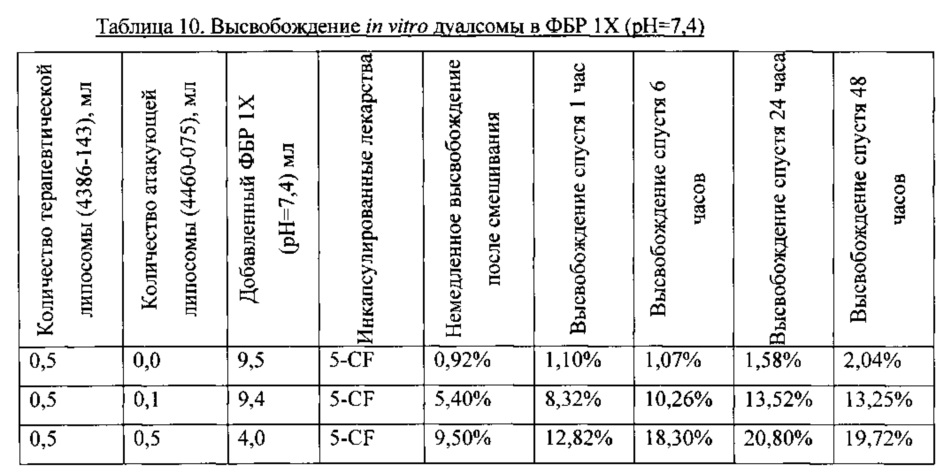
Результаты, показанные в Таблице 6, и графики, построенные на Фигуре 3, свидетельствуют, что общее высвобождение из терапевтической липосомы (4460-090) спустя 48 часов увеличилось от ~4% до ~16% при добавлении равного количества атакующей липосомы (4460-075) в ФБР IX при pH 7,4. Результаты также позволяют предположить, что высвобождение терапевтической липосомы увеличивается при повышении исходного количества атакующей липосомы. В этом примере липосома Часть А была не-стелс-, заряженной липосомой, содержащей 40 моль % холестерина. Атакующая липосома, часть В, была противоположно заряжена и содержала TPGS.


Пример 4
В данном примере терапевтическая липосома Часть А (4460-077) содержала 5-CF (5-карбоксифлюоресцеин) в качестве маркера, а липидный состав был таким же самым, как состав терапевтической липосомы в Примерах 1 и 2. Состав атакующей липосомы, Часть В, был таким же самым, как в Примерах 1 и 2 (см. Таблицу 7).
Результаты, показанные в Таблице 8, и графики, построенные на Фигуре 4, указывают, что общее высвобождение 5-CF из липосомы Части А (4460-077) спустя 48 часов возросло от ~5% до ~32% при добавлении равного количества атакующей липосомы Части В (4460-075) в ФБР 1X при pH 7,4. Результаты также показывают, что высвобождение 5-CF из липосомы Части А возросло при увеличении исходного количества липосомы Части В. Эти результаты согласуются с наблюдениями из Примера 1 и 2. В этом примере липосома Часть А была не-стелс-, заряженной липосомой, содержащей 10 моль % холестерина. Атакующая липосома Часть В была противоположно заряженной, и содержала TPGS.


Пример 5
В этом примере липосому Часть А (4386-143) нагружали 5-карбоксифлуоресцеином (5-CF) во внутренней водной фазе, как в Примерах 3 и 4. Состав липосомы Части А и В (4460-075) приведен в Таблице 9.
Результаты, показанные в Таблице 10, и графики, построенные на Фигуре 5, указывают, что общее высвобождение 5-CF из липосомы Части А (4386-143) спустя 48 часов возрастает от ~2% до ~20% при добавлении равного количества атакующей липосомы Части В (4460-075) в ФБР 1X при pH 7,4. Результаты также показали, что высвобождение липосомы Части А повышалось при увеличении исходного количества атакующей липосомы Части В. В этом примере терапевтическая липосома была стелс-липосомой, содержащей 40 моль % холестерина. Атакующая липосома была противоположно заряженной и содержала TPGS.
Пример 6
В этом примере состав липосомы Части А и В приведен в Таблице 11. Терапевтическая липосома Часть А (4460-090) содержала 5-CF. Необходимо отметить, что атакующая липосома, Часть В (4460-084) не содержала инициирующий TPGS в составе. Результаты, показанные в Таблице 12, и графики, построенные на Фигуре 6, указывают, что на общее высвобождение из липосомы Части А (4460-090) не влияло добавление атакующей липосомы Части В (4460-084) в ФБР IX при pH 7,4. В этом примере терапевтическая липосома была не-стелс-липосомой, содержащей 40 моль % холестерина. Атакующая липосома была противоположно заряженной и не содержала TPGS.
Этот пример ясно иллюстрирует необходимость инициирующего агента TPGS в составе атакующей липосомы для запуска высвобождения липосомы Части А. По существу, без TPGS не отмечалось повышения высвобождения, как показано в данном примере.

Пример 7
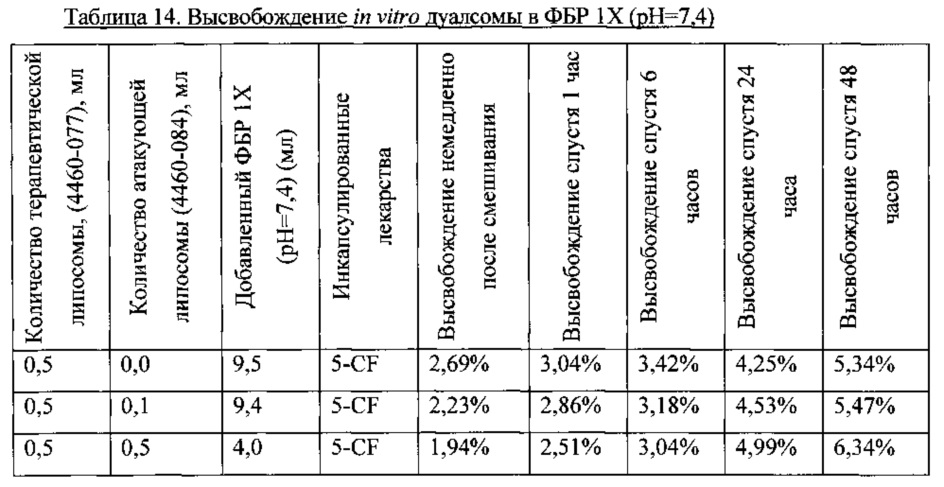
В этом примере состав липосомы Части А и В приведен в Таблице 13. Терапевтическая липосома Часть А (4460-077) содержала 5-CF. Необходимо отметить, что атакующая липосома, Часть В (4460-084) не содержала инициирующий агент TPGS в составе. Результаты, показанные в Таблице 14, и графики, построенные на Фигуре 7, указывают, что на общее высвобождение из липосомы Части А (4460-077) не влияло добавление атакующей липосомы Части В (4460-084) в ФБР 1X при pH 7,4. В этом примере терапевтическая липосома была не-стелс-липосомой, содержащей 10 моль % холестерина. Атакующая липосома была противоположно заряженной, но без TPGS. Без TPGS в Части В не отмечалось повышения высвобождения из Части А в данном примере.

Пример 8
В этом примере состав липосомы Части А и В приведен в Таблице 15. Терапевтическая липосома Часть А (4460-090) содержала 5-CF, который был таким же, как в Примере 6. Атакующая липосома (4384-086) не содержала положительно заряженного липида DOTAP, но содержала 30 моль % TPGS. Результаты, показанные в Таблице 16, и графики, построенные на Фигуре 8, указывают, что общее высвобождение 5-CF спустя 48 часов из липосомы Части А (4460-090) в ФБР IX при pH 7,4 повысилось от ~4% до ~20% при добавлении равного количества атакующей липосомы. Терапевтическая липосома была стелс-липосомой, содержащей 40 моль % холестерина.


Пример 9
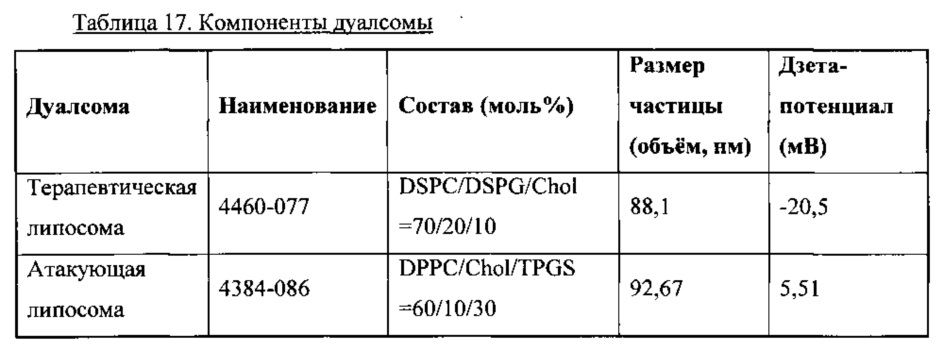
В этом примере составы липосомы Части А и В приведены в Таблице 17. Терапевтическая липосома Часть А (4460-077) содержала 5-CF, который был таким же, как в Примере 4. Терапевтическая липосома была стелс-липосомой, содержащей 10 моль % холестерина. Атакующая липосома (4460-086) содержала 30 моль % TPGS, и не содержала заряженный липид DOTAP, как в Примере 5. Результаты, показанные в Таблице 18, и графики, построенные на Фигуре 9, указывают, что общее высвобождение 5-CF спустя 48 часов из липосомы (4460-077) повысилось от ~5% до ~34% при добавлении равного количества атакующей липосомы (4384-086) в ФБР IX при pH 7,4. Результаты также показали, что высвобождение 5-CF из липосомы (4460-077) возрастает при повышении исходного количества атакующей липосомы.

Пример 10
В этом примере состав липосомы Части А и В приведен в Таблице 19. Терапевтическая липосома Часть А (4460-090) содержала 5-CF, как в Примере 6. Терапевтическая липосома была не-стелс-липосомой, содержащей 40 моль % холестерина. Атакующая липосома, Часть В (4460-075) содержала 32 моль % TPGS и 16 моль % DOTAP, обеспечивая положительные заряд атакующей липосомы. Результаты, показанные в Таблице 20, и графики, построенные на Фигуре 10, указывают, что общее высвобождение 5-CF спустя 48 часов из терапевтической липосомы (4460-090) повысилось от ~5% до ~26% при добавлении атакующей липосомы (4460-075), даже когда значение pH изменилось с 7,4 до 5,0. Эти результаты ясно показали, что общее высвобождение из липосомы (4460-090) возросло при повышении исходного количества атакующей липосомы.


Пример 11
В данном примере состав липосомы Части А и Части В показан в Таблице 21. Терапевтическая липосома (NLICOV003F-02) содержала оксалиплатин, как в Примере 1. Терапевтическая липосома была не-стелс-липосомой, содержащей 10 моль % холестерина. Атакующая липосома (4460-104) содержала 32 моль % TPGS и 16 моль % DOTAP, обеспечивающих положительный заряд липосомы. Результаты, показанные в Таблице 22, и графики, построенные на Фигуре 11, указывают, что общее высвобождение из терапевтической липосомы (COV003F-02) спустя 48 часов возросло примерно от ~5% до ~25% при добавлении 20% атакующей липосомы (4460-104) в ФБР 1X при pH 7,4 и pH 5,0.


Пример 12
В данном примере состав липосомы Части А и Части В показан в Таблице 23. Терапевтическая липосома (NLI 4481101) содержала цисплатин. Терапевтическая липосома была стелс-липосомой, содержащей 40 моль % холестерина. Атакующая липосома (4460-104) содержала 32 моль % TPGS и 16 моль % DOTAP, обеспечивающих положительный заряд липосомы. Результаты, показанные в Таблице 23, и графики, построенные на Фигуре 12, указывают, что общее высвобождение из терапевтической липосомы (NLI4481101) спустя 48 часов возросло примерно от ~1% до ~5% при добавлении атакующей липосомы (4460-104) в ФБР 1X при pH 7,4 и pH 5,0. Результаты также показывают, что высвобождение цисплатина из терапевтической липосомы возросло с повышением количества атакующей липосомы. Терапевтическая липосома была стелс-липосомой, содержащей 40 моль % холестерина. Атакующая липосома была противоположно заряженной, и содержала 32 моль % TPGS.

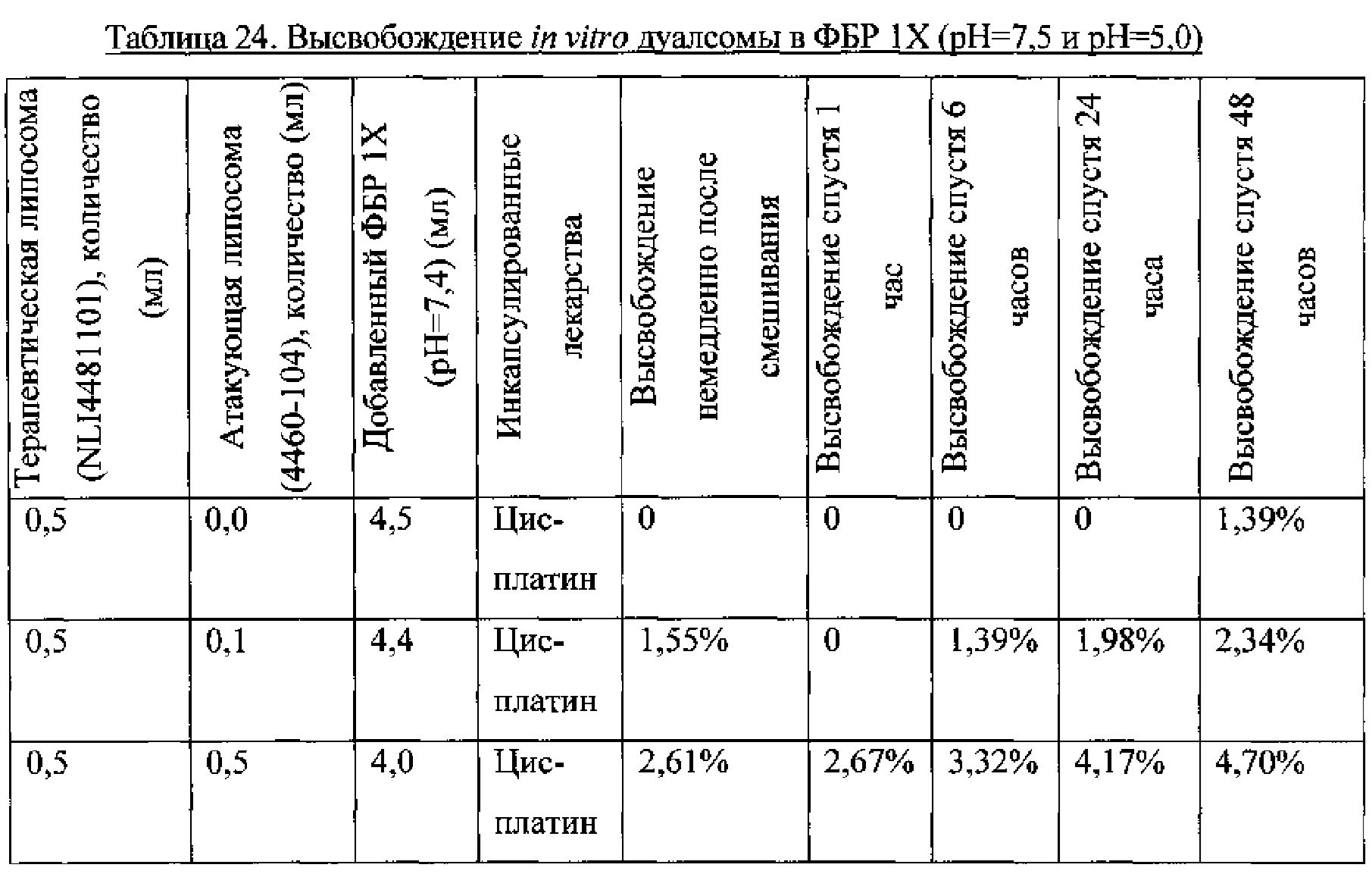

Хотя вышеизложенное изобретение описано в некоторых подробностях в качестве иллюстрации и примера, чтобы облегчить понимание, специалисту в данной области техники понятно, что возможны определенные изменения и модификации в пределах объема формулы изобретения. Кроме того, каждая приведенная в настоящей заявке ссылка включена посредством ссылки во всей полноте во той же самой степени, как если бы каждая ссылка была включена индивидуально посредством ссылки. Там, где существует противоречие между настоящей заявкой и ссылкой, приведенной в настоящей заявке, преобладает настоящая заявка.
Реферат
Изобретение относится к фармацевтической промышленности, а именно к способу доставки терапевтического агента субъекту, а также к набору для доставки терапевтического агента субъекту. Способ доставки включает: (a) введение субъекту липосомы, содержащей терапевтический агент, выбранный из группы, включающей цисплатин, оксалиплатин, карбоплатин, гемцитибин, 5-фторурацил, доксорубицин и таксан; и (b) введение субъекту липидной наночастицы, содержащей неионное вещество, инициирующее высвобождение терапевтического агента из указанной липосомы, содержащей терапевтический агент, при этом указанное неионное вещество выбрано из группы, включающей D-α-токоферолполиэтиленгликоль-сукцинат (TPGS), полиоксиэтилен 40 стеарат, полиэтиленгликоль п-(1,1,3,3-тетраметилбутил)фениловый эфир, полиоксиэтилен-(2)-изооктилфениловый эфир, полиоксиэтилен-(150)-динонилфениловый эфир, 2,3-дигидроксипропиловый эфир додекановой кислоты, полиоксиэтилен-(20)-сорбитан-монолаурат, полиоксиэтилен-(20)-сорбитанмонопальмитат, полиоксиэтилен-(20)-сорбитанмоностеарат, полиокси-этилен-(20)-сорбитан-моноолеат. Набор для доставки включает: (a) первую композицию, содержащую липосому, включающую терапевтический агент; и (b) вторую композицию, содержащую липидную наночастицу, включающую неионное вещество, инициирующее высвобождение терапевтического агента из указанной липосомы, содержащей терапевтический агент, где первую и вторую композиции хранят отдельно перед введением субъекту. Изобретение обеспечивает повышение высвобождения терапевтического агента из терапевтической липосомы за счет использования атакующей липосомы, содержащей неионное вещество, инициирующее высвобождение терапевтического агента. 2 н. и 21 з.п. ф-лы, 12 ил., 24 табл., 12 пр.

Комментарии