Способ повышения устойчивости растений к патогенным микроорганизмам - RU2380419C2
Код документа: RU2380419C2
Чертежи









Описание
Изобретение относится к области фитопатологии, более конкретно к повышению устойчивости растений к патогенным микроорганизмам, более конкретно к усилению механизма индуцированной устойчивости.
ВВЕДЕНИЕ
Когда растения сталкиваются с патогенными микроорганизмами, активируются механизмы устойчивости, которые могут предотвращать инфекцию, способствовать восстановлению от заболевания и даже предотвращать будущие инфекции. Общей чертой устойчивости является то, что она индуцируется в ответ на первую исходную встречу или атаку патогенных микроорганизмов.
Недавно стало ясно, что белки устойчивости растений, при активации путем взаимодействия с происходящими из патогенного микроорганизма провоцирующими молекулами, способны индуцировать путь передачи сигнала. Установлено, что при некоторых взаимодействиях по меньшей мере частично используется общий путь (Science, 1997, 278, 1963-1965). В данной публикации было показано, что локус NDR1 требуется для устойчивости в отношении патогенной бактерии Pseudomonas syringae pv. tomato, и он же индуцируется патогенным грибком Peronospora parasitica. Также Parker, J.E. et al. (The Plant Cell, 1996, 8, 2033-2046) показали, что продукт, кодируемый в локусе EDS1 Arabidopsis thaliana, также имеет ключевую функцию в пути передачи сигнала после инфицирования Peronospora parasitica, но не после инфицирования Pseudomonas syringae pv glycinae.
Во многих научных группах вводили гены, кодирующие такие вызывающие реакцию сенсорные или рецепторные молекулы в растения с тем, чтобы данные трансформированные растения стали устойчивыми в отношении патогенной инфекции. В общем, данные вызывающие реакцию рецепторы были способны лишь распознавать один патогенный микроорганизм или даже один вирулентный штамм вида патогенного организма. Более того, патогенный микроорганизм может быстро и легко адаптироваться к данной форме давления селекции, и, как доказано, достаточно было небольших модификаций молекулы, вызывающей реакцию, чтобы растение сделалось неспособным распознавать данный патогенный микроорганизм. Хотя имеется большое количество возможных сенсорных молекул, число генов, вовлеченных в передачу сигнала, очень мало и состоит из эволюционно консервативных белков. Более широкий диапазон восприятия и реакций устойчивости к заболеванию опосредуется восприятием молекул патогенных микроорганизмов, которые являются консервативными в разнообразных патогенных микроорганизмах. Данные ассоциированные с патогенами молекулярные профили (PAMP) распознаются рецепторами растений, такими как рецептор флагеллинового пептида FLS2 (Mol Cell., 2000, 5, 1003-1011) или рецептор фактора элонгации Tu (The Plant Cell, 2004, 16, 3496-3507).
Внутриклеточные сигналы предупреждения, переносимые вызывающими реакцию рецепторами, предоставляют подходящую мишень для базового управления устойчивостью (Trends in Genetics, 2000, 16, 449-450). Каскады внутриклеточной сигнализации в участии первичной инвазии являются сходными и консервативными в большей части видов растений. Модулирование базовой сигнализации в трансгенных растениях до более высокого уровня (см. WO99/45129) приводило к индуцированному уровню базовой устойчивости.
Таким образом, продолжительная активация первичного сигнала защиты представляется стратегией выбора для повышения устойчивости первого барьера защиты. Однако постоянная гиперстимуляция данного уровня устойчивости нежелательна вследствие вовлеченных затрат энергии (Trends in Plant Science, 2002, 7, 61-67).
Второй барьер устойчивости предоставляется процессом реакций индуцированной устойчивости (IR) во всем растении. Данный барьер защиты необходим в борьбе с патогенными микроорганизмами. Он может примерно подразделяться на два различных механизма:
(a) высвобождение сигналов тревоги из исходного участка инфицирования и системное распространение сигналов по растению; (b) восприятие данных сигналов в различных органах и активация индуцированной устойчивости (IR).
Восприятие сигналов тревоги и последующий процессинг, который приводит к активированной устойчивости, представляют собой процессы, которые могут отличаться при разных сигналах тревоги. Давно выявлено, что салициловая кислота (SA) является одним из основных сигналов тревоги. Она также действует как гормон, вовлеченный в процессы развития растения, такие как старение и теплообразование (Plant Physiol., 1992, 99, 799-803; Science, 1987, 237, 1601-1602; PNAS, 1989, 86, 2214-2218). В области медицины животных салициловая кислота (и ее производные) давно используются против индуцированной воспалением лихорадки. Повышение температуры в человеческом организме может быть снижено с помощью салициловой кислоты, которая опосредует свой эффект через COX2, циклооксигеназу. Связь между устойчивостью к воспалению и заболеванием в животных системах (Journal of Endocrinology, 2003, 178, 1-4) и в растительных системах опосредована активностью COX2. COX2 имеет четкие гомологи в царстве растений, такие как Piox в табаке (The Plant Cell, 1998, 10, 1523-1537) или pCa-COX1 в перце, профиль экспрессии которой сильно и быстро индуцируется после инвазии патогенного микроорганизма (J. Exp.Botany, 2002, 53, 383-385). В настоящем описании авторы изобретения определяют растительные гомологи данных гомологов циклооксигеназы в качестве молекул восприятия (рецепторов) салициловой кислоты. Связывание SA с циклооксигеназой приводит к модификации ее ферментативной активности, что приводит к изменениям во внутриклеточных (липидных) процессах, которые в конечном результате дают опосредованную SA индукцию устойчивости в растении.
Другой молекулой, вовлеченной в функцию посредника ответа SA в направлении устойчивости в растениях, является SABP2. SABP2 связывает салициловую кислоту с высоким сродством (PNAS, 2003, 100, 16101-16106). Таким образом модулируется гидролазная ферментативная активность SABP2, что приводит к изменениям в липидных процессах, которые в конечном результате дают опосредованную SA индукцию устойчивости в растении. Недавно стало известно, что SABP2 представляет собой метилэстеразу, которая преобразует MeSA в SA, активируя SAR, и что SA ингибирует данную реакцию по принципу отрицательной обратной связи (PNAS, 2005, 102, 1773-1778). Поэтому данная молекула предположительно не может быть определена как рецептор.
Брассиностероидный рецептор BRI1 (Брассиностероидный нечувствительный 1) представляет собой LRR (содержащую богатые лейцином повторы) трансмембранную рецепторную киназу (Cell, 1997, 90, 929-938). Он принадлежит к небольшому семейству из Arabidopsis, содержащему BRI1 (At4g39400); BRL1 (Atlg55610), BRL2 (At2g01950) и BRL3 (At3g13380) (Development, 2004, 131, 5341-5351). BRI1 и его гомологи не только вовлечены напрямую в восприятие стероидов (Nature 2005, 433, 167-171), но также связываются с высоким сродством с системином (гомолог просистемина из Arabidopsis: At2g22940), пептидным гормоном, вовлеченным в системную сигнализацию ответов, связанных с устойчивостью (PNAS, 2002, 99, 9090-9092). Описаны нижележащие внутриклеточные пути для передачи сигнала растительных стероидов (Bioassays, 2001, 23, 1028-1036; Trends in Plant Science, 2004, 9, 91-95).
Другое семейство рецепторов, вовлеченных в восприятие брассиностероидов, определяется продуктами гена RKS (SERK, подобная рецепторной киназе; Development, 1997, 124, 2049-2062) (WO 04/007712). Данные продукты гена RKS также вовлечены в функцию посредника брассиностероидной сигнализации в растениях и, как оказалось, образуют комплексы с BRI1-подобными рецепторами (The Plant Cell, 2004, 16, 3216-3229; Cell, 2002, 110, 213-222; Cell, 2002, 110, 203-212). Они также вовлечены в связывание внеклеточных пептидных лигандов, представленных кандидатными пептидными лигандами, такими как генные продукты GASA 14 Arabidopsis (продукты стимуляции Arabidopsis гибберелиновой кислотой; Plant Mol Biol., 1995, 27, 743-752), которые, как утверждается, непосредственно связываются с продуктами гена RKS 14 Arabidopsis (WO 04/007712). Белки GASA содержат в своей структуре карман, который, как утверждается, вовлечен в связывание брассиностероидов с высоким сродством. Пептидные лиганды GASA, таким образом, действуют в качестве промежуточных соединений между RKS/BRI-димерами и молекулой брассиностероида. Комплекс димеризации между RKS и другими рецепторами, такими как BRI1, является динамическим комплексом плазматической мембраны, в котором могут участвовать различные представители семейства в качестве партнеров по димеризации (см. фиг.1).
Модулирование активности данных классов рецепторных киназ регулируется как пептидными лигандами, так и стероидными гормонами. Растительные брассиностероиды доступны в различных формах (описано в J. Exp.Botany, 1999, 50, 275-282; The Plant Cell, 2002, S97-S110; Plant Physiol, 2003, 131, 287-297). Отдельно от этого, некоторое количество синтетических агонистов или антагонистов (Trends in Plant Science, 1999, 4, 348-353) может использоваться для регуляции активности данных рецепторов.
В описанном выше рецепторном белковом комплексе белки ELS (WO 04/007712) также вовлечены в восприятие брассиностероидов и передачу сигнала и, таким образом, в распространение реакций устойчивости по организму растения. LRP, имеющийся в томате гомолог продуктов гена ELS Arabidopsis, специфично индуцируется и также неожиданно процессируется протеолитически во время патогенеза (Mol. Gen. Genet., 1994, 243, 47-53; Plant J., 1996, 10, 315-330). Таким образом, белковые продукты ELS явно вовлечены в реакции устойчивости и могут играть некоторую роль в модуляции опосредованной брассиностероидами регуляции устойчивости.
Передача сигнала жасмоната, опосредованная жасминовой кислотой (JA) и некоторым количеством производных молекул, также, как известно, играет важную роль в устойчивости растений, а также в процессах развития, таких как созревание плодов, старение и развитие зародышей и пыльцы (The Plant Cell, 2002, 14, S153-S164). JA вовлечена в функцию посредника путей убиквитинилирования, через действие белков F-бокса, таких как COI1. Восприятие JA может опосредоваться генными продуктами, такими как те, что кодируются в локусе JAI-1 (PNAS, 2002, 99, 6416-6422), или рецепторами, которые пока не идентифицированы. В растениях развиваются сложные процессы активации механизма системного иммунитета по всему растению. Во многих аспектах данный вторичный защитный барьер сравним с ответом после вакцинации у людей, и перекрывающиеся элементы зависят от генных продуктов и сигнальных путей, которые кажутся консервативными во время эволюции растений и животных (EMBO reports, 2005, 6, 504-507). Системный ответ устойчивости у растений может быть широко разделен на системную приобретенную устойчивость (SAR) и индуцированную системную устойчивость (ISR) (Curr Opin Plant Biol., 2004, 7, 456-464). Хотя данные различные варианты устойчивости эффективны против широкого спектра патогенных микроорганизмов, их реакции на данной стадии более или менее специфичны в отношении различных классов патогенных микроорганизмов (Mol Plant Microbe Interact., 2002, 15, 27-34). Реакция устойчивости широкого спектра, помогающая в борьбе с бактериями или вирусами, не обязательно приводит к индуцированную уровню устойчивости, например, против нематод или тлей. Кроме того, каждый сигнальный каскад индуцируется и переносится комбинацией различных сигнальных молекул (Trends in Genetics, 2000, 16, 449-455).
Обычно системный перенос данных продуцированных растением сигналов приводит к системной индукции долгосрочной устойчивости широкого спектра. Однако конкретные комбинации растительных сигналов вместе диктуют специфическую природу полученного в результате долгосрочного системного ответа. Некоторые реакции запускают уже в присутствии одного сигнального химического соединения; другие требуют перекрывающегося во времени присутствия различных химических веществ. Примерами сигнальных соединений являются салициловая кислота, жасминовая кислота, этилен (Nature Biotechn., 2000, 18, 779-783) и брассиностероиды (WO 04/007712). Пептидные факторы, такие как системин и GASA, как известно, перекрываются с восприятием сигнала от брассиностероидов, как описано выше. Искусственное применение извне, например, распыление на растение данных специфичных сигнальных молекул может активировать требуемые ответы к индуцированной в растении устойчивости. Модулирование концентрации и композиции различных системных сигналов в растении в распыляемом растворе позволяет модулировать приобретение системной устойчивости. Данные системные сигналы воспринимаются клетками и органами в частях растения, которые не вовлечены непосредственно в процесс инфекции. Данное восприятие осуществляется специфичными рецепторами для каждой из данных системных сигнальных молекул.
Контроль за уровнем устойчивости к заболеваниям в (моно)культурах сельскохозяйственных растений в полевых условиях является постоянной борьбой между получающим продукт фермером с одной стороны и различными природными патогенными организмами с другой стороны. Растение само по себе часто состоит из клонального варианта, выведенного для высокой урожайности, и его геномный состав в основном не оптимизирован в плане улучшенной устойчивости к заболеваниям. Основной инструмент, доступный для защиты растущих растений или последующей защиты собранного урожая, состоит в применении биоцидов, таких как фунгициды, бактерициды и инсектициды. Современное понимание проблем окружающей среды, связанных с данными химикатами, привело к запрету многих доступных химикатов, что оставило фермеров без доступных альтернатив для контроля заболеваний. Многие из реализуемых в настоящее время классических стратегий селекции, направленных на устойчивость к заболеванию, потребуют многих лет для продукции новых ценных гибридов и культурных сортов для коммерческого применения. Однако в последние десятилетия были сделаны многочисленные попытки для повышения устойчивости путем генной инженерии, например путем трансформации растений компонентами реакции гиперчувствительности и промежуточными соединениями сигнальных молекул (Transgenic Res., 2002, 11, 599-613). Большинство из данных трансгенных альтернатив пока не вышли на рынок.
Одним из способов, посредством которого фермер извлекает выгоду из механизма природной защиты растения, является индукция защитной реакции путем введения сигнальных соединений, таких как салициловая кислота. Данные сигнальные соединения могут применяться в окружающей среде (добавки к почве, распыление жидкости и порошка, и т.д.). Недостатком данного подхода, однако, является то, что сигнальные соединения, когда их необходимо ввести в высоких дозах для компенсации потерь при распылении и потерь во время захвата растением, по меньшей мере в концентрации, в которой они должны использоваться для индукции ISR, частично токсичны и/или вредны для окружающей среды. Использование собственных механизмов растения предоставляет альтернативу за счет повышенной эндогенной продукции сигнальных соединений в самом растении. Таким образом, гены, регулирующие уровень активных сигнальных соединений (таких как SA, брассиностероиды и т.д.) экспрессируются в самом трaнсгенном растении под контролем индуцируемого/тканеспецифического или специфического для данной стадии промотора. Модулирование стабильного уровня данных генных продуктов, в свою очередь, регулирует уровень активных сигнальных соединений. Примерами таких генных продуктов являются протеазы, вовлеченные в расщепление пептида просистемина, или продукт гена DWARF4 (Plant Journal 26 2001 573-582). Специфичным недостатком данного последнего подхода является то, что индуцируется целое растение, что часто не является необходимым и снижает общее состояние (и урожайность) растения. Таким образом, все еще имеется потребность в альтернативных стратегиях усиления устойчивости к заболеванию в растениях, которые как можно меньше ухудшают характеристики состояния и урожайности растения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу усиления устойчивости к патогенным организмам в растениях путем предоставления данным растениям генной конструкции, содержащей последовательность ДНК, кодирующей рецептор для системного сигнального соединения, где такое системное сигнальное соединение представляет собой одно или несколько из группы, состоящей из салициловой кислоты, жасминовой кислоты и брассиностероидов. Более конкретно, рецептор выбран из рецептора жасминовой кислоты, рецепторов салициловой кислоты и RKS-рецепторов.
Усиление чувствительности растений в плане индуцированной устойчивости достигается повышением числа рецепторных молекул, соответствующих одному или нескольким указанным выше рецепторам на клетку/орган.
Повышение восприятия может осуществляться путем повышения количества рецепторов сигнала нагревания, но также и путем повышения (локальной) концентрации данных сигналов нагревания как таковых. Это может осуществляться введением или (локальной) эндогенной продукцией данных сигналов, таких как SA или брассиностероиды.
Конкретное осуществление связано со способом, в котором последовательность ДНК, кодирующая рецептор, находится под контролем тканеспецифического промотора (такого как промоторы, специфически экспрессированные в плодах, семенах или цветках) или индуцируемого промотора, такого как индуцируемый патогенным организмом промотор, индуцируемые детергентом промоторы (TWEEN20; Hunzicker, G.M., et al. (2004) Proceedings for the 4th International Crop Science Congress, Brisbane, Australia, 26 September - 1 October 2004), индуцируемые тепловым шоком (Biochem Biophys Res Commun., 200, 321, 364-369), индуцируемые стероидами промоторы (животными стероидами (например, Plant J., 2005, 41, 899-918) или растительными стероидами (например, промотор At2g14560), основанные на тетрациклиновом репрессоре промоторные системы (Plant J., 2000, 21, 579-588) и т.д.
Дальнейшее конкретное осуществление образовано способом, в котором кодирующая рецептор последовательность ДНК является химерной, где химерный означает, что лиганд-распознающая часть указанных выше рецепторов замещена лиганд-распознающей частью другого рецептора, такого как другой распознающий сигнальное соединение рецептор, выбранный из указанных выше, стероидный рецептор, рецептор для PAMP, стеролов, пептидов или рецептор для других диффундирующих молекул, вовлеченных в функцию посредника реакции системной устойчивости.
Также частью изобретения являются растения, продуцируемые способом согласно изобретению. Конкретное осуществление такого растения представляет собой растение, в которое введены два или более рецептора, которые могут быть или могут не быть химерными.
Дальнейшей частью изобретения является разновидность растения, продуцируемая из потомства указанного растения, где указанная разновидность еще содержит повышенную чувствительность в плане индуцированной устойчивости. Сходные результаты могут быть получены путем комбинации различных гиперэкспрессированных конструкций, вовлеченных в тот же путь, что и конструкции, кодирующие рецептор в комбинации с конструкциями, кодирующими нижележащую целевую молекулу, такую как фактор транскрипции.
Другой вариант осуществления изобретения представляет собой способ индукции устойчивости в растении или разновидности согласно изобретению, включающий в себя применение молекулы лиганда в отношении указанного растения или разновидности, которое способно связываться с ним и стимулировать гетерологичный или химерный рецептор, с которым предоставляется данное растение или разновидность.
Указанное применение предпочтительно включает в себя распыление молекулы.
ОПИСАНИЕ ФИГУР
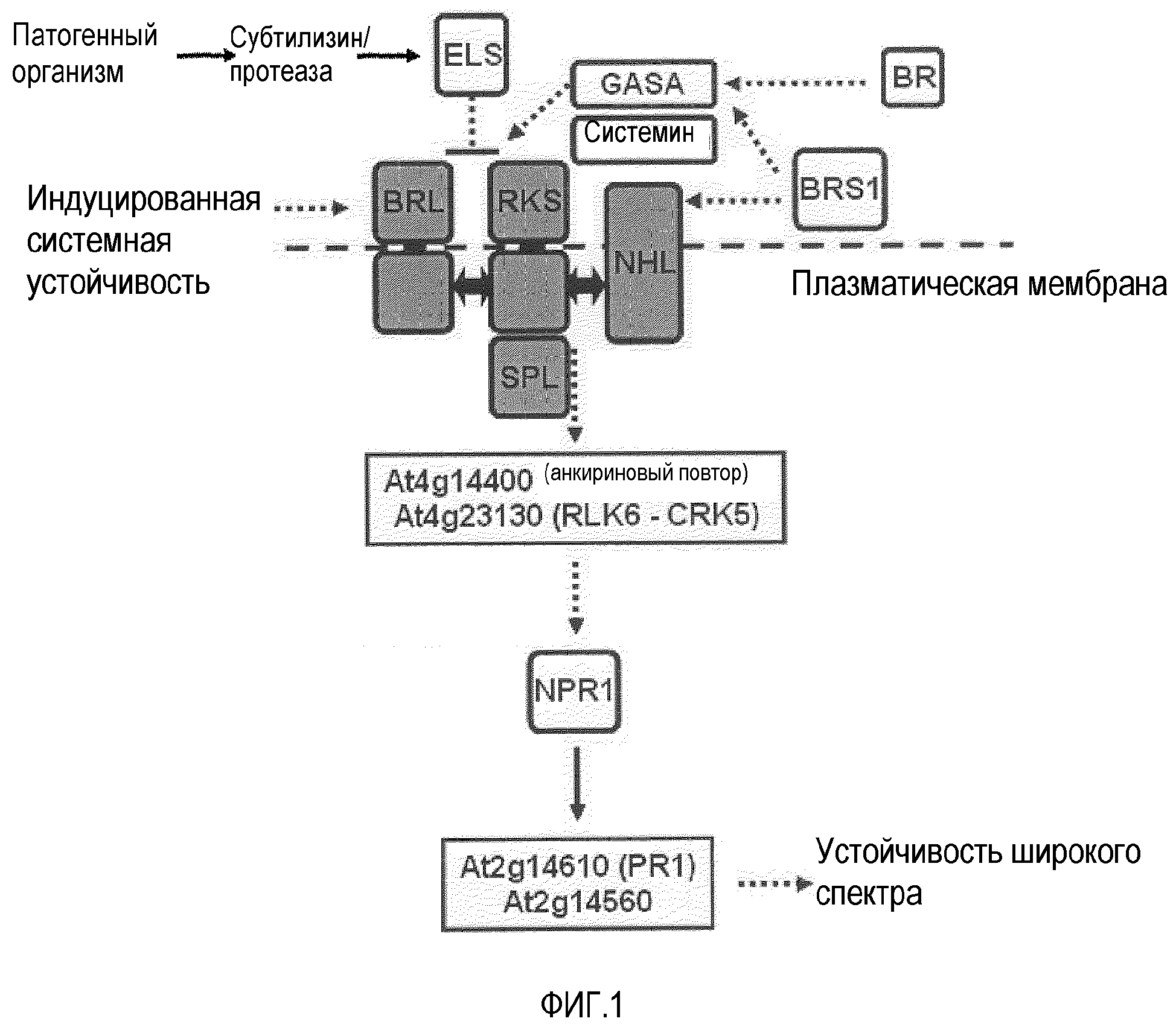
Фиг.1. Предложенная модель опосредованной BRI/RKS передачи сигнала в отношении устойчивости сигнала.
Белки, взаимодействующие с RKS-рецепторами показаны темно-серым. BRL указывает на BRI1-подобные киназы и другие RLK (рецептор-подобные киназы), которые могут образовывать гетеродимеры с RKS. NHL (NDR1/HIN1-подобный) и SPL (подобный Squamosa-связывающему белку) соответствуют членам данных двух семейства, которые взаимодействуют с RKS. Выше- и нижележащие компоненты показаны светло-серым.
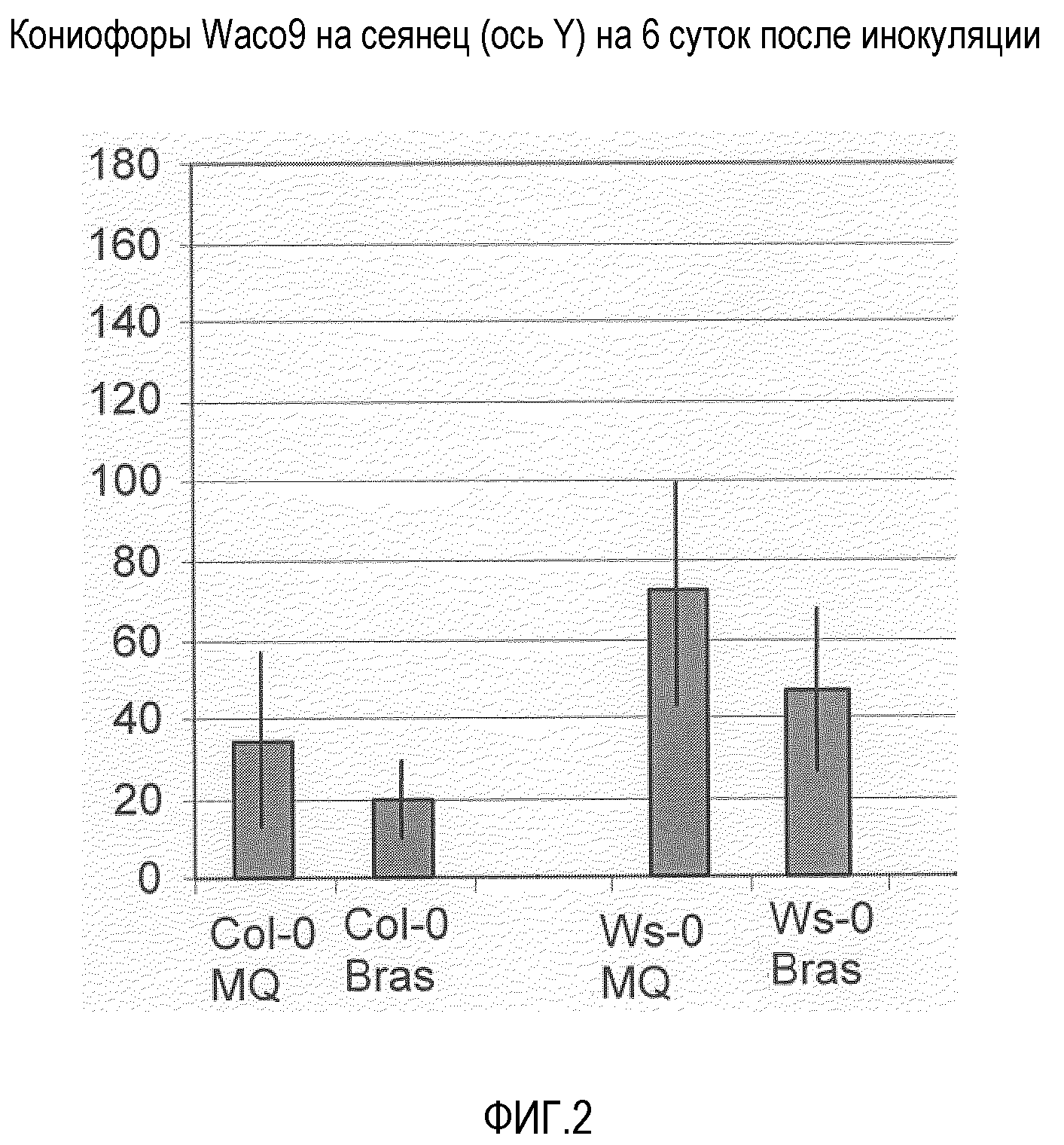
Фиг.2. Брассиностероиды повышают устойчивость к Peronospora parasitica.
Девятидневные сеянцы Arabidopsis, экотип Columbia (Col-0) или Wassilewskija (WS-O), опрыскивали пустым раствором - Silwet L-77 (0,01%) (MQ=вода+Silwet) или 0,05 мМ раствором брассиностероидов (+0,01% Silwet L-77=Bras). После высыхания растения инкубировали в камере роста с длинным световым днем (MPMI 2005, 18, 583-592). Через двое суток листья половины растений опрыскивали Waco9 (50 спор/мкл; European journal of Plant Pathology, 2001, 107, 63-68). На растениях (40 сеянцев на линию) подсчитывали споруляцию через 7 суток после инокуляции. В качестве контроля использовали пустой раствор. Экспериментальные инфекции и анализы проводили, как описано ранее (MPMI 2005, 18, 583-592). Эксперименты показали, что через двое суток после опрыскивания контрольным раствором и смесью брассиностероидами, растения, опрысканные брассиностероидами, были вытянуты, но через шесть суток они выглядели почти так же, как контроль, обработанные только 0,01% Silwett-L77 в воде (лишь слегка более вытянуты). Также некоторые семядоли были перевернуты. Растения CoI-0 и Ws-0, опрысканные брассиностероидами, характеризовались меньшей споруляцией Waco9, по сравнению с контролем.
Фиг.3. Рецептор RKS4 участвует в восприятии брассиностероидов.
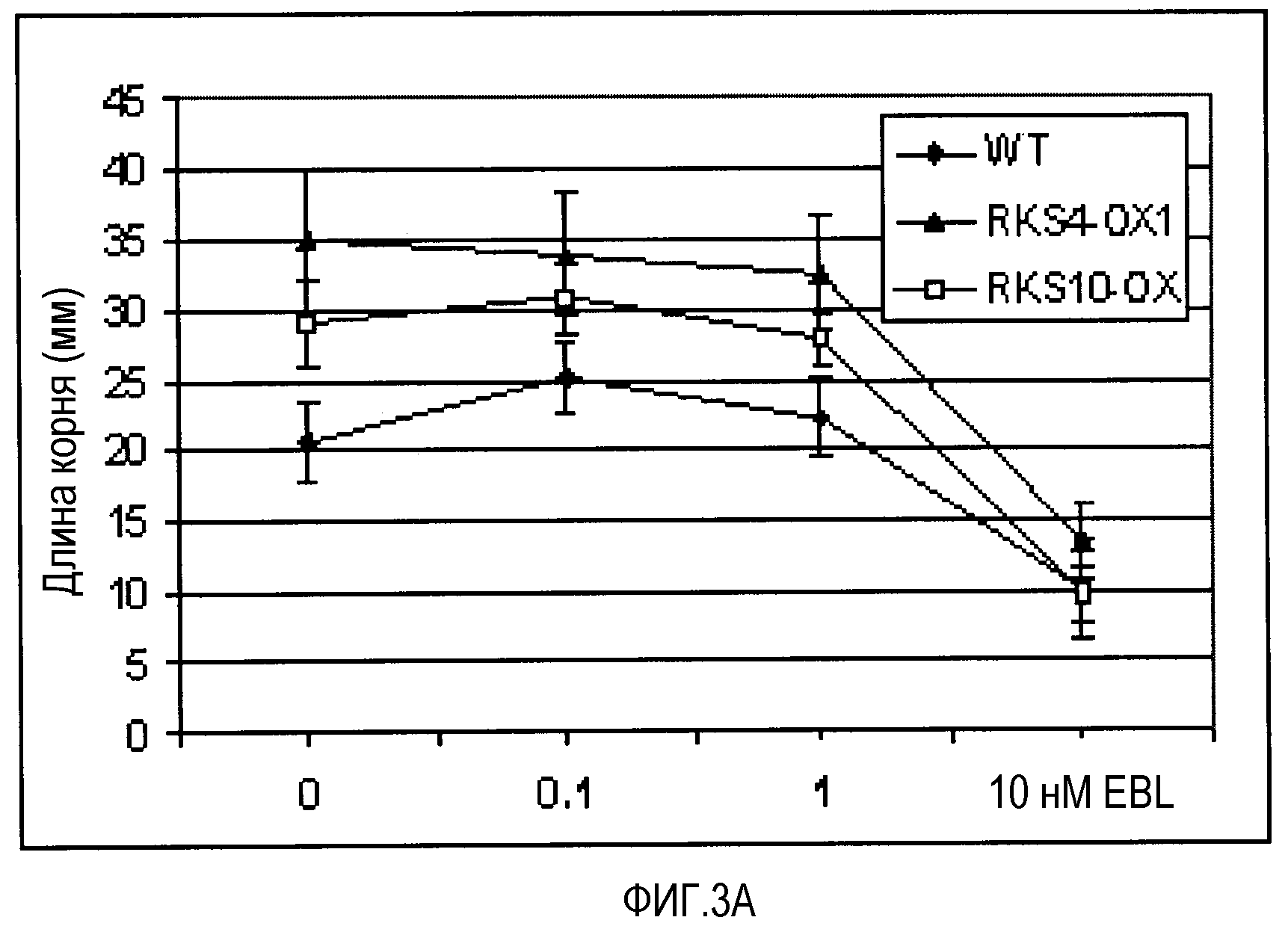
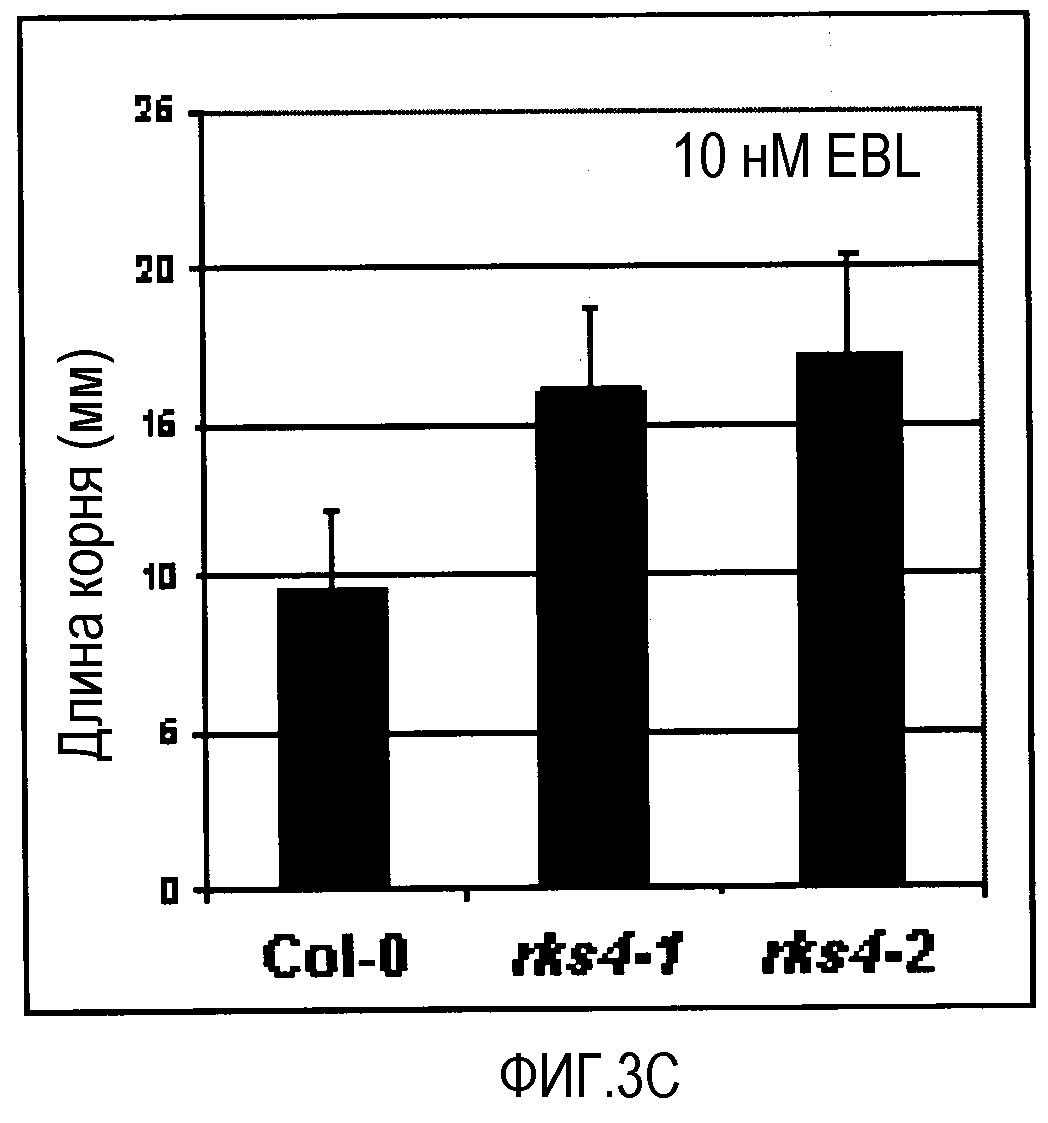
A. Влияние концентрации 24-эпибрассинолида (EBL) на рост корней, измеряемое на сеянцах Ws-0 (WT), и сеянцах с гиперэкспрессией RKS4-OX1 и RKS10 (BAKl, Cell, 2002, 110, 213-222) (RKS10-OX) через 9 суток на вертикальных чашках. B. Длина корней на 0,1 нМ EBL. Каждый квадрат представляет собой 1 см2. C. Эффект высокой концентрации EBL на рост корней RKS4 НА-(нокаут)-линий (см. фиг.4A для подробностей). D. Длина корней на 10 нМ EBL. Каждый квадрат представляет собой 1 см2.
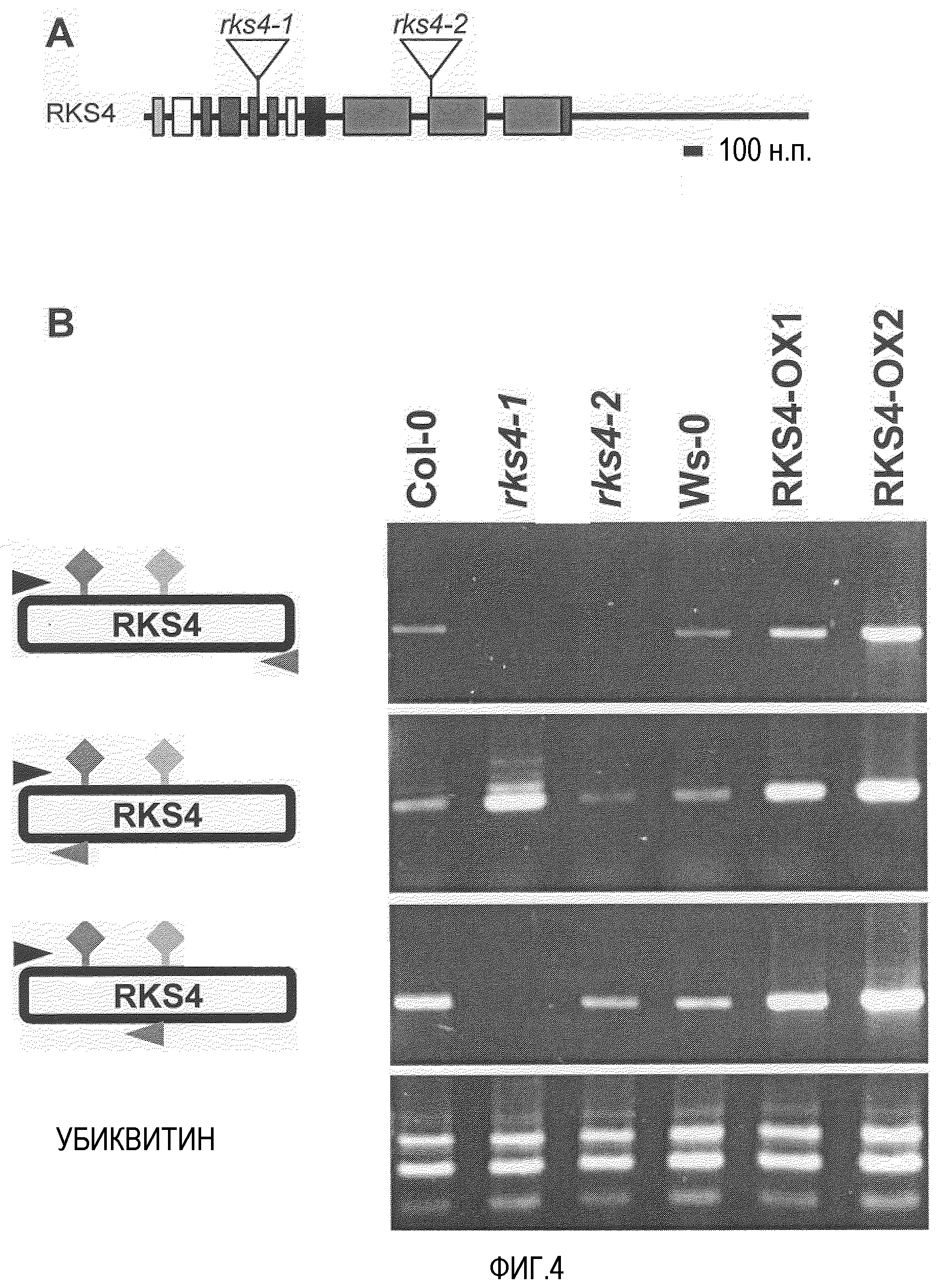
Фиг.4. Уровни мРНК RKS4 в нокаут-сеянцах и сеянцах с гиперэкспрессией.
A. Участки вставки T-ДНК в ген RKS4. B. Анализ ОТ-ПЦР полноразмерной мРНК RKS4 в 10-суточных сеянцах из дикого типа (Ws-0 и Col-0), линии с гиперэкспрессией (RKS4-OX) и двух линиях со вставкой Т-ДНК (rks4-1 и rks4-2). В эксперимент включали контроль без матрицы, и равные количества матрицы кДНК оценивали по конститутивному гену убиквитина (Ubi). Положение различных олигонуклеотидов, используемых в реакции ОТ-ПЦР, указано в отношении различных участков интеграции T-ДНК.
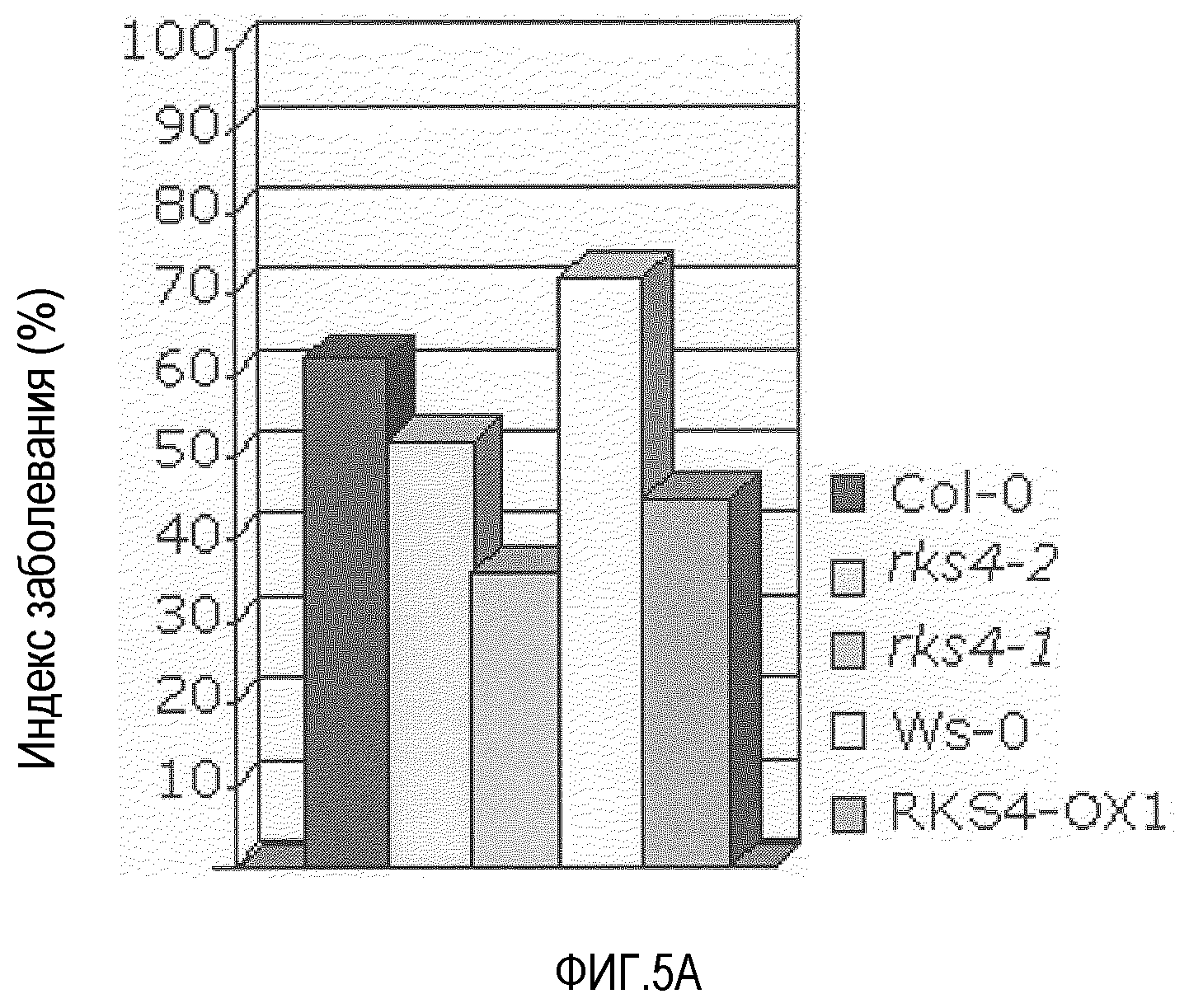
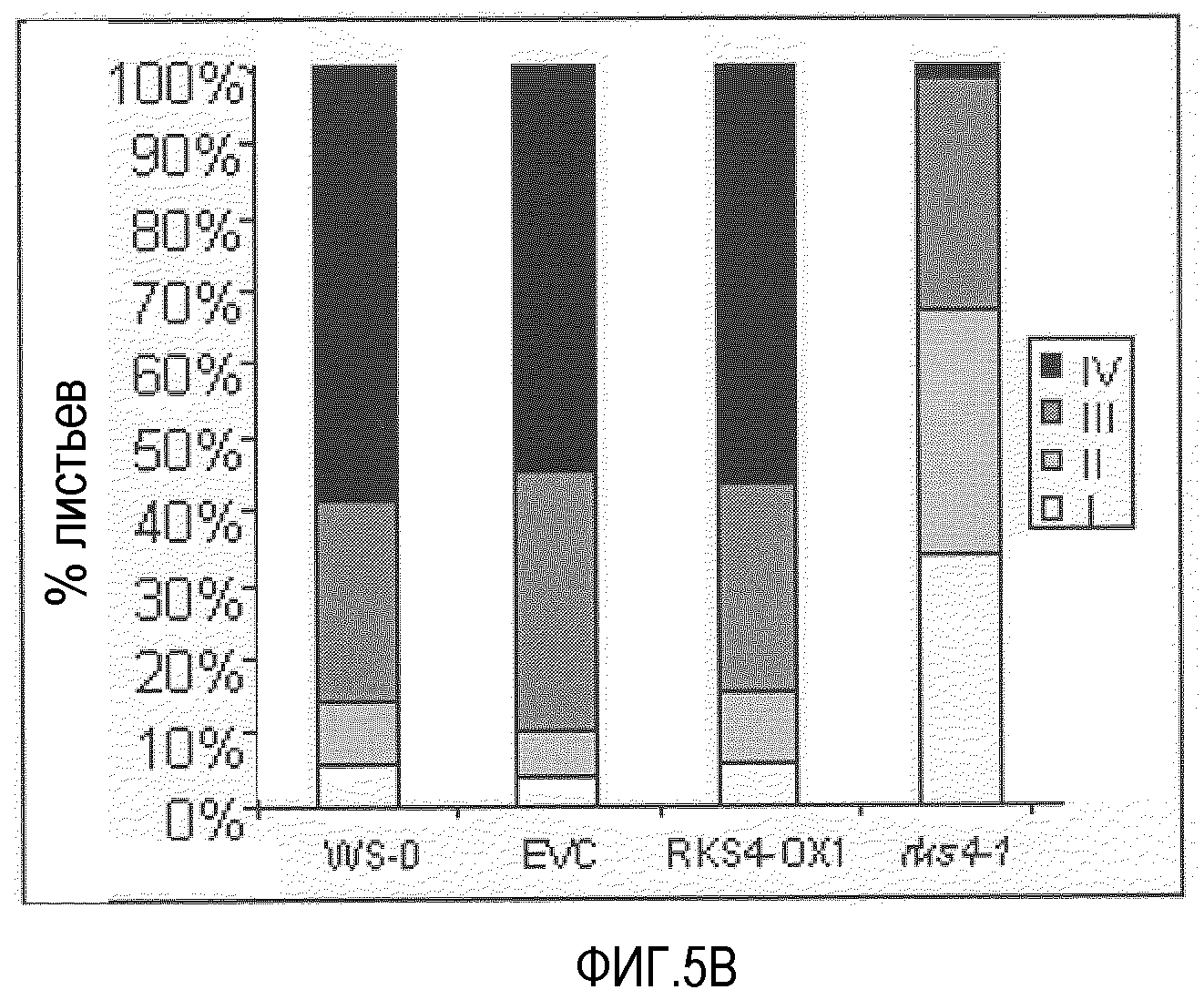
Фиг.5. RKS4 модулирует устойчивость против Pseudomonas syringae pv. tomato DC3000 и Peronospora parasitica.
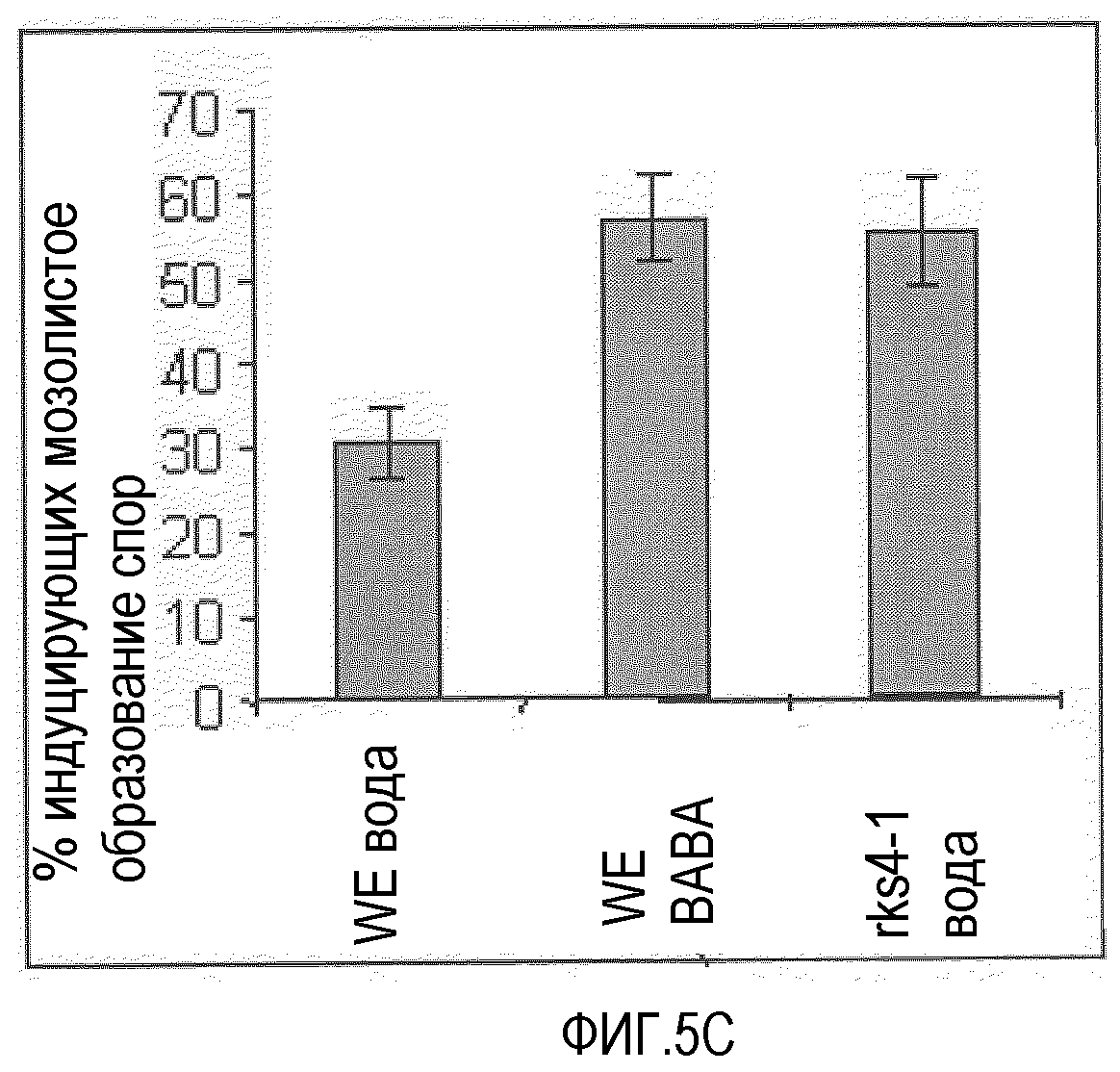
A. Гиперэкспрессия RKS4 (RKS4-OX1) характеризуется повышенным уровнем устойчивости против патогена Pseudomonas syringae. Данное явление представлено индексом заболевания по оси Y. Экстраполяция доступных данных указывает на то, что нокаут-линии RKS4 также вовлечены в функцию посредника реакций устойчивости. Анализы устойчивости проводили, как описано ранее (Plant Cell 1996, 8, 1225-1237; Plant cell 1998, 10, 1571-1580). B. Нокаут RKS4 (rks4-l; повышенная экспрессия N-конца, см. фиг.4) также характеризовался повышенной устойчивостью в отношении Peronospora parasitica, хотя она была меньше, чем положительный контроль, индуцированный бета-аминомасляной кислотой (BABA). Растения оценивали по условной шкале I-IV, в которой I означает норму до очень слабых симптомов и IV означает тяжелые симптомы до гибели. C. В некоторых растениях подтверждали мозолистые отложения, и было выявлено, что, как и после обработки BABA, в растениях rks4-1 повышались мозолистые отложения, указывая на то, что повышенная устойчивость, опосредованная измененными уровнями RKS4, включает в себя усиленные мозолистые отложения. Оба теста проводили, как описано (Plant Cell., 2005, 17, 987-999).
Фиг.6 Экспрессионный анализ генов устойчивости к заболеванию в условиях гиперэкспрессии RKS4.
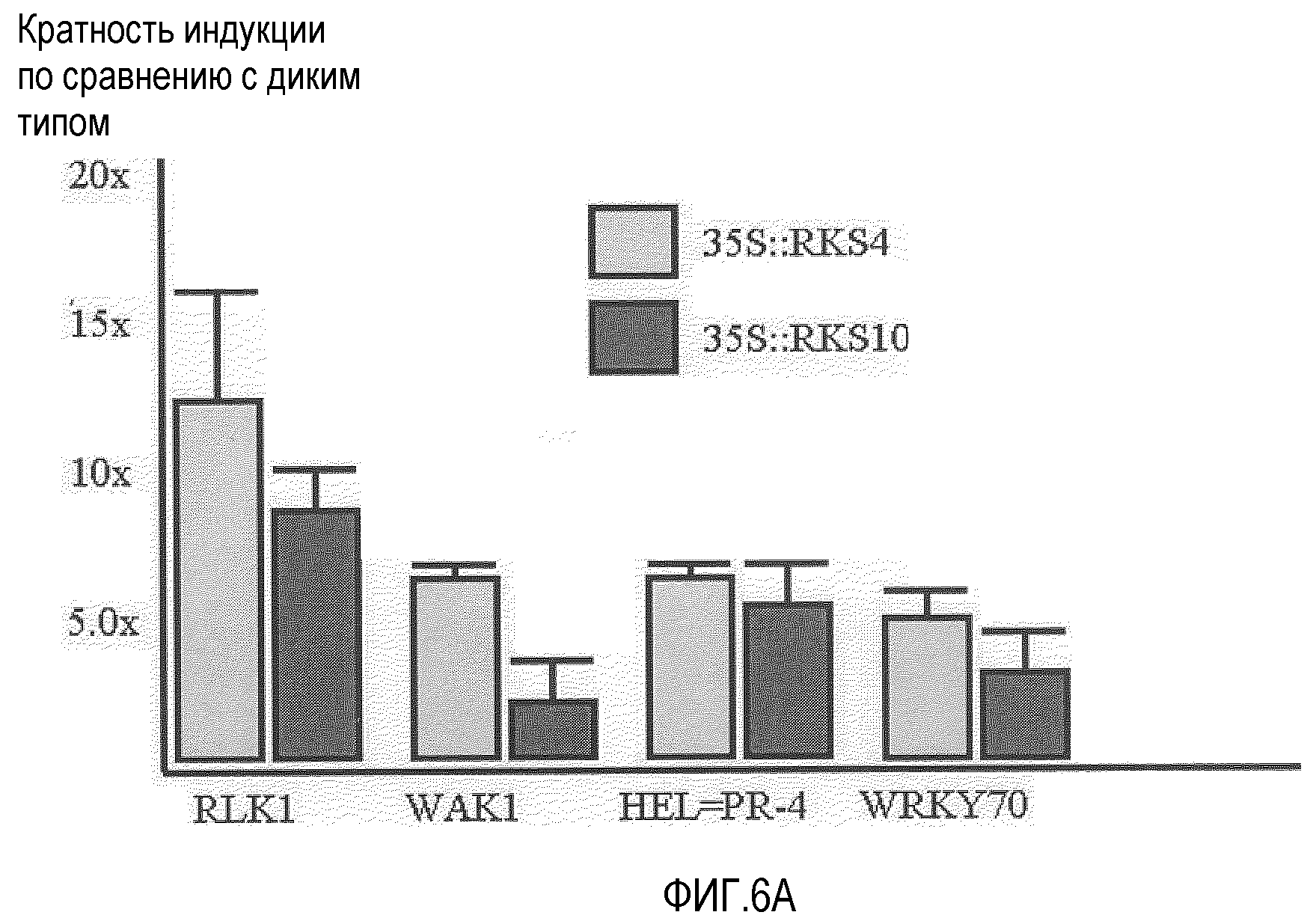
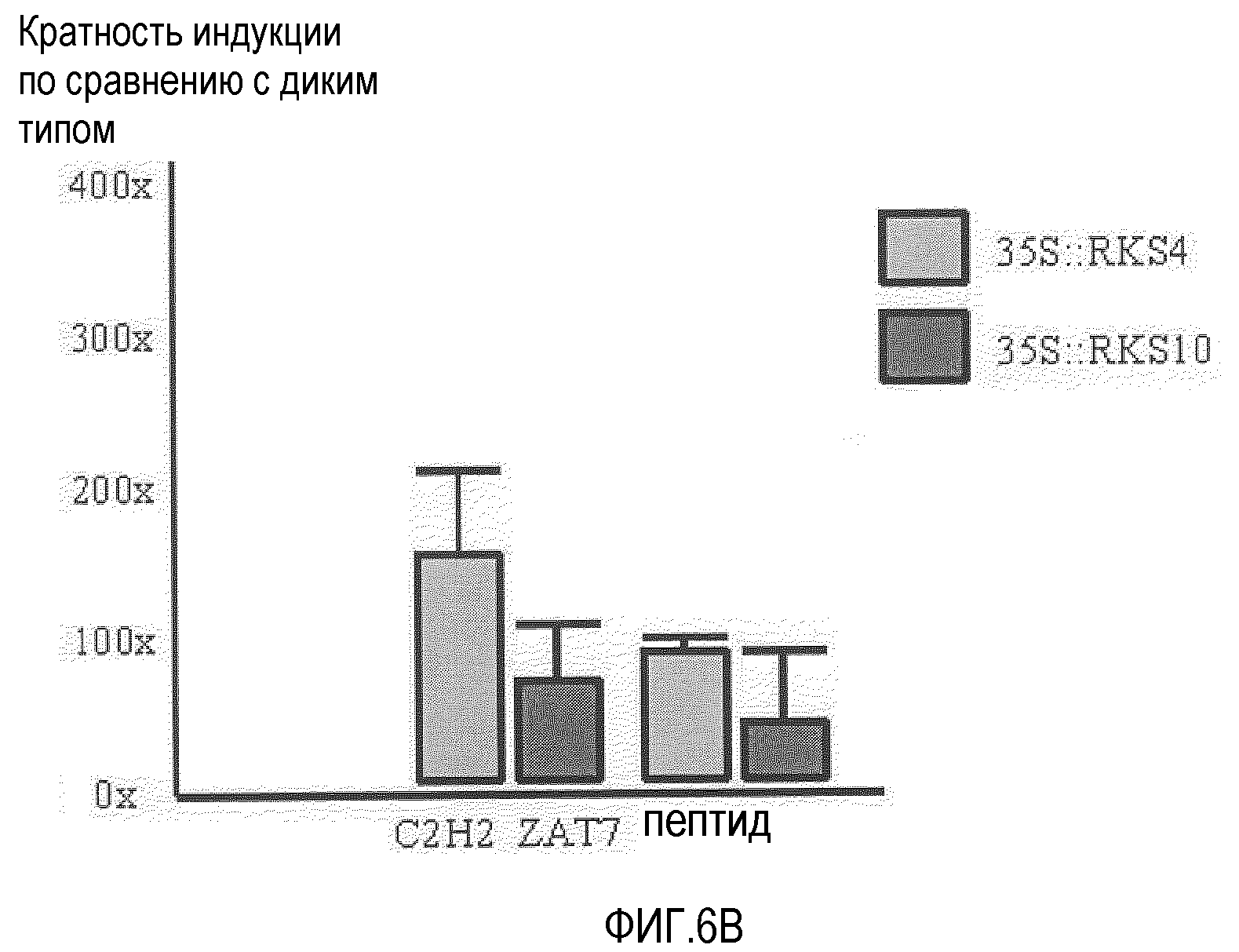
Анализ проводили путем количественной ОТ-ПЦР (кОТ-ПЦР) с использованием библиотеки праймеров для генов Arabidopsis, индуцируемых патогенами (SIGMA) на РНК, выделенной от сеянцев Ws-0 35S::RKS4 и 35S::RKS10, возрастом 10 суток. Кратность индукции соответствует среднему из трех параллельных измерений изменения экспрессии (значения 2-ΔΔCt) после нормализации с использованием актина (контрольные праймеры библиотеки) и с использованием в качестве препарата сравнения дикого типа. Интервалы ошибки соответствуют стандартному отклонению повторностей. A. RLK1=At5g60900, WAK1=At1g21250, HEL (гевеин-подобный белок)=PR4=At3g04720 и WRKY70=At3g56400. B. ZAT7 (белок цинковых пальцев C2H2)=At3g46090, и пептид кодируется At2g32200. Показано, что гиперэкспрессия RKS4 индуцирует экспрессию специфичных связанных с защитой генов, подтверждая их участие в устойчивости к заболеваниям.
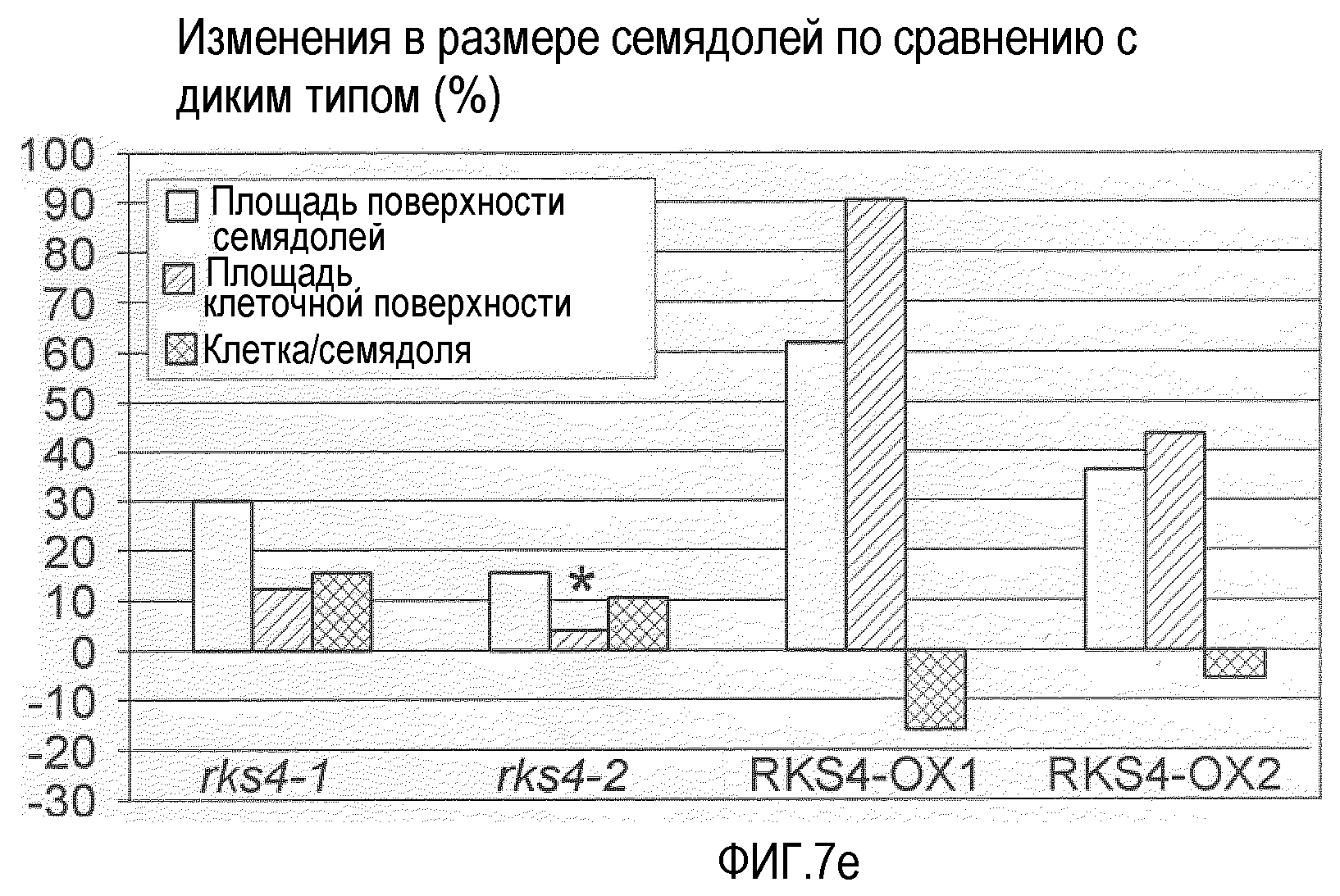
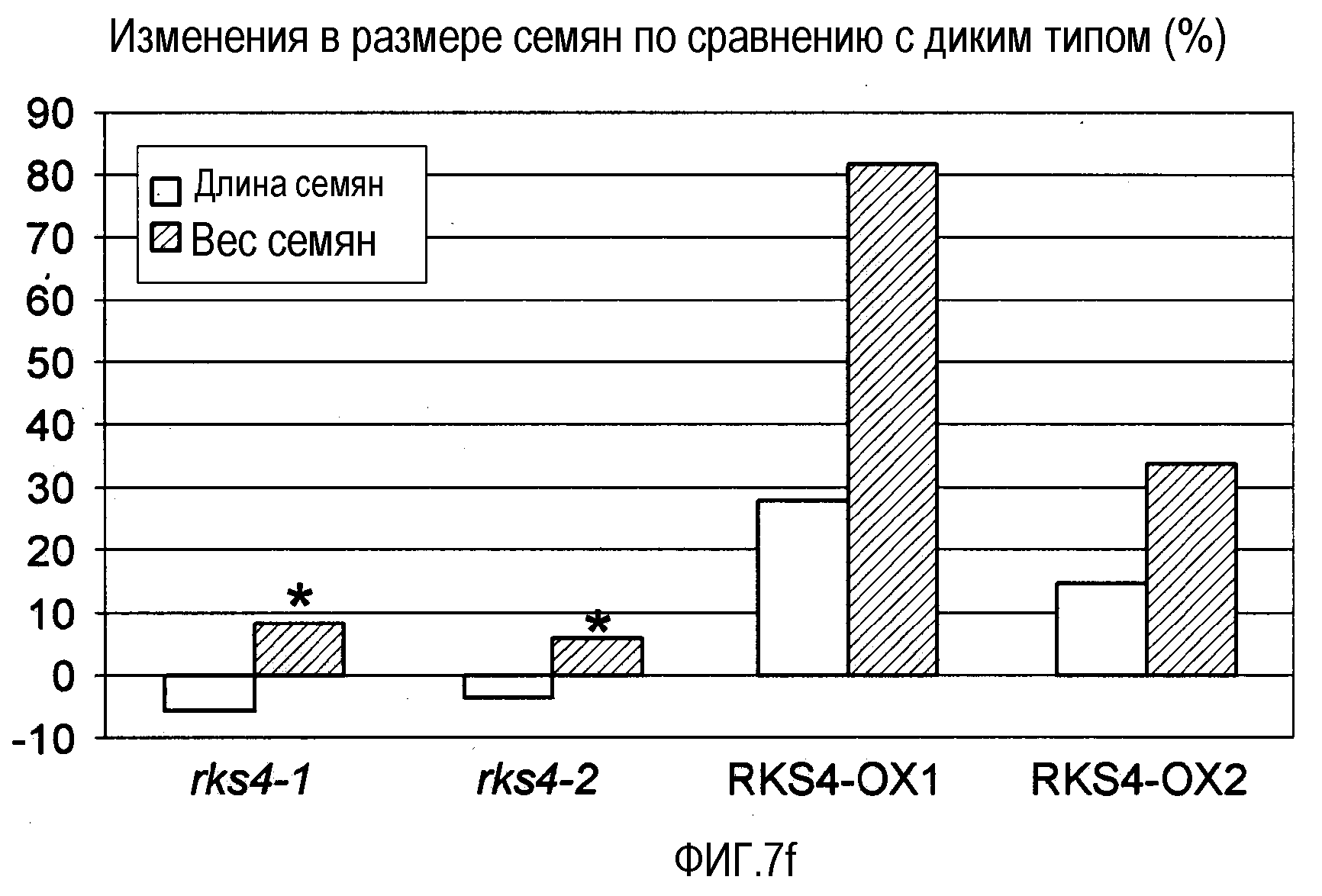
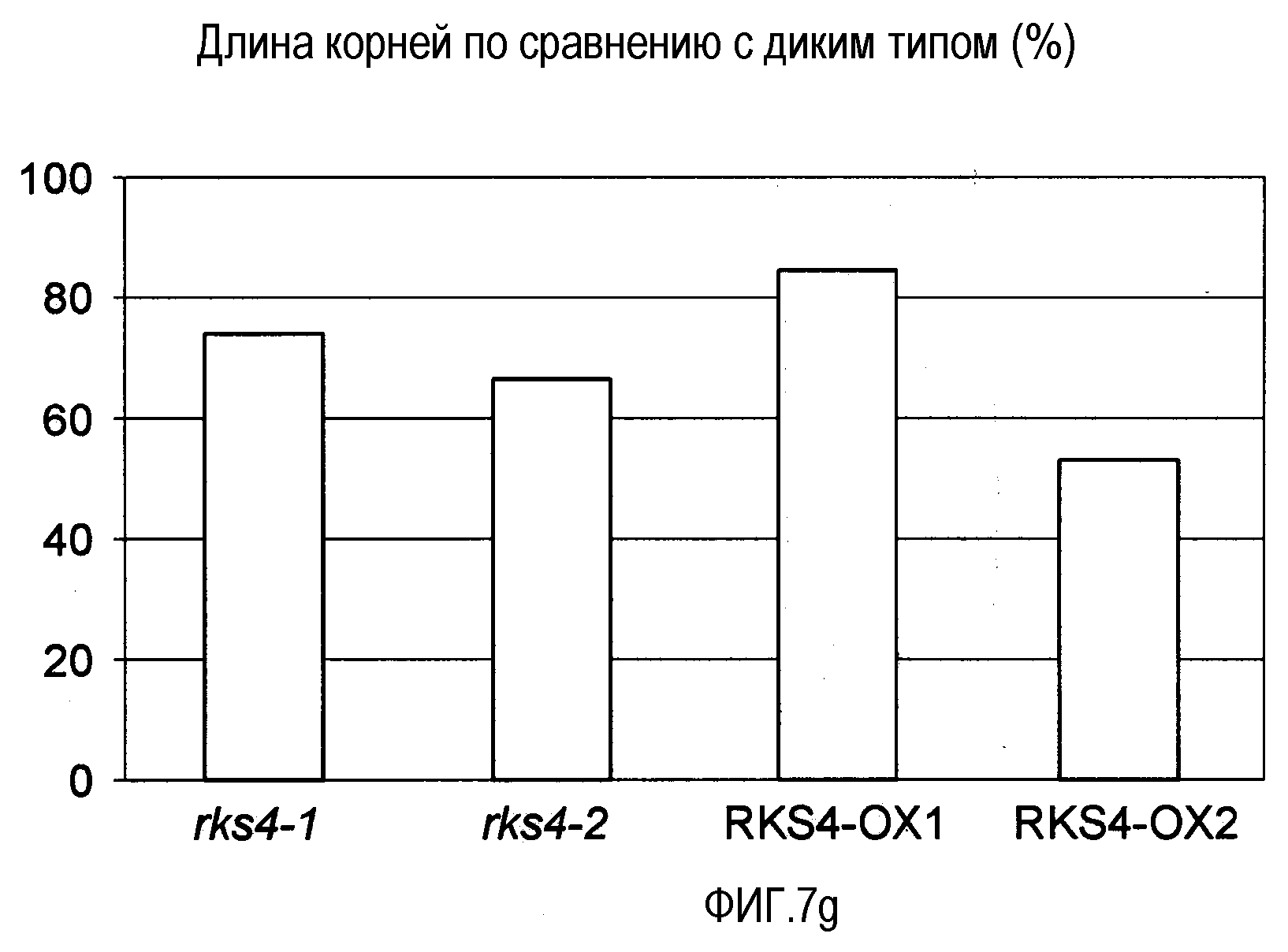
Фиг.7. Морфологические фенотипы, индуцируемые измененной экспрессией RES4. Гистограммы, показанные на панелях (b), (e), (f) и (g), основаны на измерениях, проведенных на растениях с измененной экспрессией RKS4 и означают изменения в процентах относительно соответствующих диких типов (Col-0 для rks4-1 и -2; Ws-0 для RKS4-OX1 и 2). Статистическую значимость наблюдаемых отличий анализировали с использованием t-теста и * указывает на то, что измеряемые отличия не являются статистически значимыми (т.е. значение p>0,05).
(a) Повышенный размер цветков вследствие гиперэкспрессии RKS4 (RKS4-OX1) по сравнению с диким типом Ws-0 (WT) (размерность шкалы=1 мм).
(b) Влияние гиперэкспрессии RKS4 на лепесток и размер клеток эпидермиса лепестка. Число клеток/лепесток получали путем разделения средней площади лепестка на среднюю площадь поверхности клетки.
(c) Измененная форма листа в розетках растений RKS4-OX1 (размерность шкалы в см).
(d) Обзор формы и размера розетки в растениях RKS4-OX1 и WT (размерность шкалы в см).
(e) Влияние измененной экспрессии RKS4 на форму семядоли, основанное на измерениях площади поверхности семядолей и их палисадных клеток мезофилла. Число клеток на семядолю получали разделением средней площади семядолей на среднюю площадь мезофильных клеток.
(f) Влияние измененной экспрессии RKS4 на урожай семян, определенный путем измерения длины и массы семян.
(g) Влияние измененной экспрессии RKS4 на длину корня, измеренное в сеянцах возрастом 9 суток, выращенных на вертикальных чашках.
(h-i) Изменения митотической активности корневого конуса нарастания, вызванные гиперэкспрессией RKS4. (h) Слева направо: положительные в отношении GUS/делящиеся клетки в корневом конусе нарастания у сеянцев возрастом 7 суток, содержащих конструкцию только pCDG (Colon-Carmona, A., You, R., Haimovitch-Gal, T. and Peter Doerner, O. (1999) Spatio-temporal analysis of mitotic activity with a labile cyclin-GUS fusion protein. Plant J. 20, 503-508); сниженное число делящихся клеток в корневом конусе нарастания сеянцев F1 возрастом 7 суток, полученных от скрещивания между RKS4-OX1 и pCDG; корневой конус нарастания сеянцев F1 возрастом 7 суток, полученных от скрещивания между RKS4-OX2 и pCDG (размерность шкалы=50 мкм). (i) Гистограмма среднего числа GUS-положительных клеток на корневой конус нарастания в главном корне (стандартное отклонение показано интервалами ошибки).
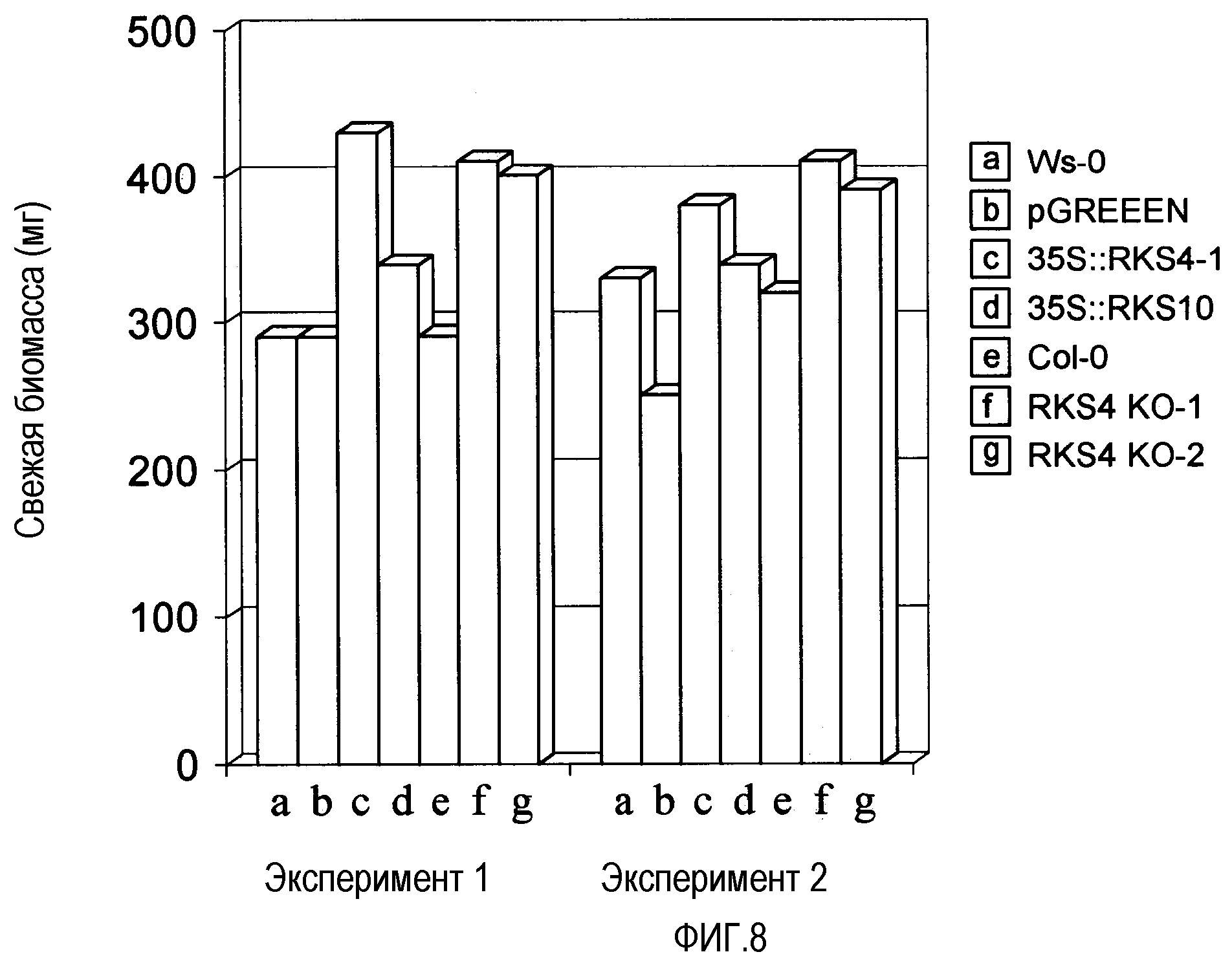
Фиг.8. Измененная экспрессия RES4 повышает биомассу. Ws-0, Col-0, pGREEN 4K (контрольный пустой вектор) и 35S::RKS 10 использовали в качестве контроля. На графике показано, что биомасса опять повышается в линиях с гиперэкспрессией и в нокаут-линиях, что согласуется с данными фиг.7. Таким образом, модулирование уровней RKS4 повышает, кроме устойчивости к заболеваниям, еще и характеристики жизнеспособности (роста) растения.
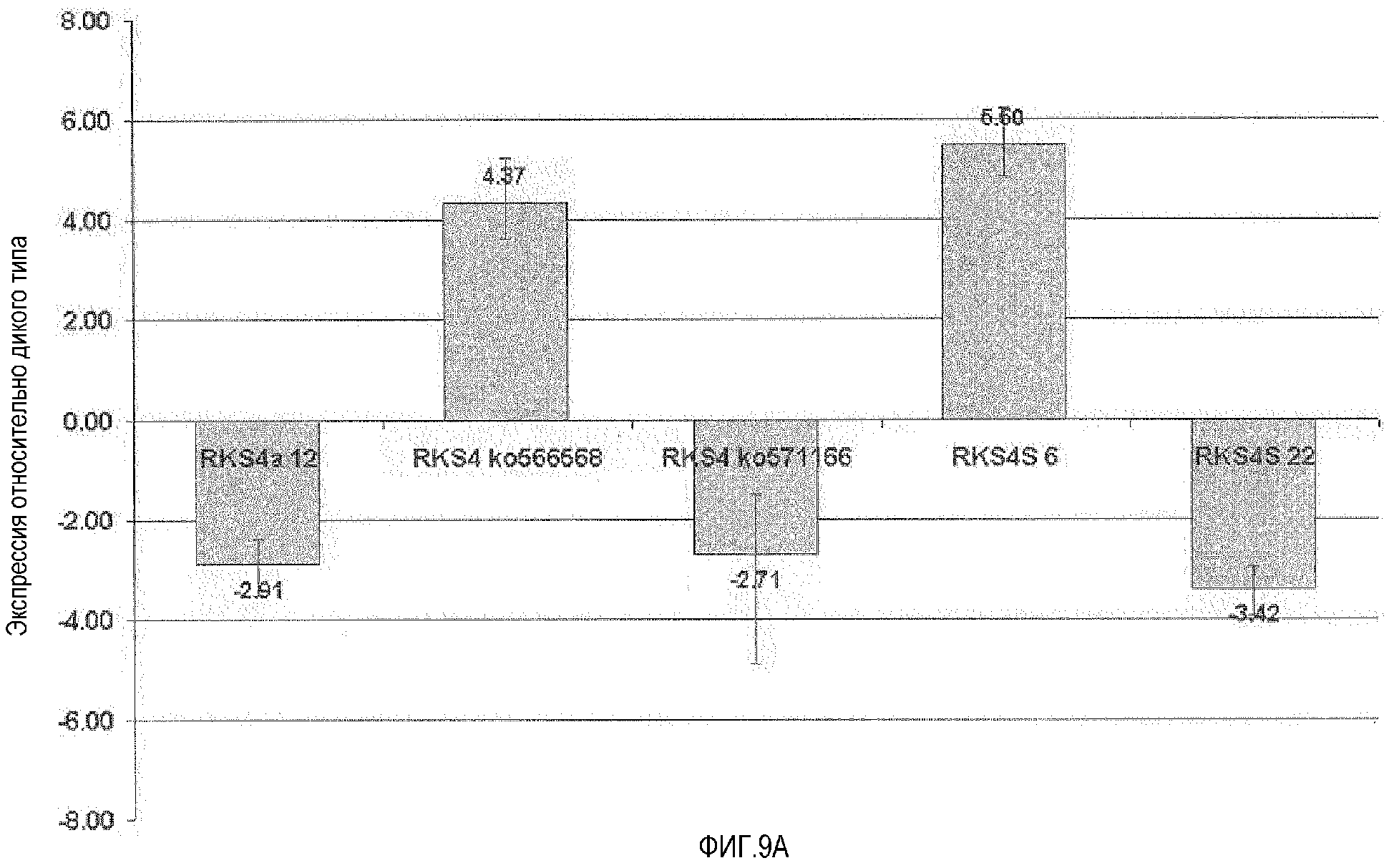
Фиг.9. Влияние измененного уровня экспрессии RKS4 на экспрессию At2g14560 и маркерного гена PR1. A. Анализ кОТ-ПЦР репортерного гена At2g14560 (маркер индукции брассиностероидов и для опосредованной NPR-I активации устойчивости). RKS4-OX1 (RKS4S 6) и rks4-1 (ko566568) обе характеризовались повышением уровня мРНК данного репортера, указывая на функцию N-концевого фрагмента RKS4 (как это визуализировано на фиг.4) при регуляции опосредованной сигнализацией RKS4 генной экспрессии. RKS4-OX2 (RKS4S 22), линия с нокдауном RKS4 (RKS4a 12) и линия с нокаутом RKS4 (rks4-2=ko571166) все приводили к снижению уровня данного маркерного гена. B. Анализ кОТ-ПЦР репортерного гена PR-1=At2gl4610 (маркер индукции SAR и опосредованной NPR-I активации устойчивости). At2g14560 и PR-1 расположены близко друг к другу на геноме Arabidopsis, и этот и другие гены в данном локусе, как и At2g 14620, ксилоглюкан:ксилоглюкозилтрансфераза, находятся под прямым контролем модулируемой устойчивостью транскрипционной активации. rks4-l (ko566568) характеризуется сильным повышением уровней мРНК репортера PR-1, что указывает на функцию N-концевых фрагментов RKS4, визуализированных на фигуре 4, в регуляции опосредованной сигнализацией RKS4 генной экспрессии. RKS4-OX2 (RKS4S 22) и нокдаун-линия RKS4 (RKS4a 12) приводят к снижению уровня продукта данного репортерного маркерного гена. Эти данные показывают, что уровень рецепторной мРНК определяет реакции продуктов нижележащих генов-мишеней.
Фиг.10. Влияние обработки брассиностероидами в комбинации с гиперэкспрессией RKS4 на экспрессию маркерного гена At2g14560. Уровни мРНК At2g14560 выявляли путем кОТ-ПЦР после распыления Brassinomix (разбавленного маточного раствора брассиностероидов, 0,05 или 0,01 мМ (соответственно, разбавление 1:1000 или 1:5000), смешанного с Silwett L-77 (конечная концентрация 0,01%) или контрольного раствора 0,01% Silwett L-77. Эксперимент показывает очень сильное повышение амплитуды ответов на брассиностероиды в линии RKS4-OX1 (RKS4S 6) по сравнению с контролем дикого типа WS. Данное повышение выявляется уже через 3 часа после распыления брассиностероидов. Данное время слишком мало для реакций непрямой активации. Поэтому опосредованная RKS передача сигнала имеет непосредственное действие на активации транскрипции данным брассиностероидом и активируемыми NPR-I репортерными генами. Уровни мРНК At2g14560 в растениях дикого типа и трансформированных растениях в момент времени t=0, непосредственно перед распылением, использовали в качестве базовой линии на данной фигуре. Для каждого эксперимента обрабатывали и собирали 3 растения. Материал смешивали для выделения мРНК. Эксперименты по к-ПЦР проводили в трех параллелях, показаны стандартные ошибки. Интересно то, что оптимальная концентрация брассиностероидов в растениях RKS4-OX1 представляет собой максимальное разбавление plants (0,01 мМ), подтверждая то, что слишком много брассиностероидов не имеют стимулирующего эффекта. Поэтому конечные реакции растения определяются уровнем рецептора и уровнем брассиностероидов.
ПОДРОБНЫЙ ВАРИАНТ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Основой согласно изобретению является увеличение чувствительности растения для усиления устойчивости. Как обсуждалось во введении, усиление устойчивости достигается первичной реакцией растения на атаку патогена, которая в дальнейшем приводит к распространению системных сигнальных соединений, таких как салициловая кислота, жасминовая кислота и брассиностероиды. Эти соединения воспринимаются специфичными рецепторами в клетке растения. К настоящему времени нами было обнаружено, что количество рецепторов этих сигнальных соединений является лимитирующим фактором для устойчивости. Таким образом, увеличением числа рецепторов в клетке или ткани можно добиться более сильного ответа на циркулирующие системные и/или поступившие извне сигнальные соединения. Это увеличение, предпочтительно, должно осуществляться путем трансформации растительной клетки нуклеотидной конструкцией, которая содержит кодирующую последовательность для такой рецепторной молекулы.
Димеризующийся трансмембранный белковый комплекс BRI/RKS (см. фиг.1) вовлечен в процессы развития (The Plant Cell, 2004, 16, 3216-3229; Cell, 2002, 110, 213-222; Cell, 2002, 110, 203-212), а также регуляции устойчивости, через перцепцию брассиностероидов (Plant Journal, 2003, 33, 887-898; и данные, полученные нами, например, фиг.2 и фиг.5). Перцепция диффундирующих системных пептидов и, возможно, лигандов GASA, также вовлечена в опосредование ответа устойчивости через этот белковый комплекс, ассоциированный с мембраной. Гетеродимеризующиеся белковые партнеры в этом комплексе (фиг.1), таким образом, опосредуют ряд различных процессов, таких как устойчивость, рост и развитие органов растения.
Неожиданно авторами изобретения было установлено, что избыточная экспрессия рецептора BRI1 не увеличивает устойчивость растения патогену, тогда как избыточная экспрессия рецептора BKS имеет выраженный эффект (см. экспериментальный раздел). Это позволяет предположить, что, при наличии вовлечения в процесс устойчивости патогену рецепторы BKS являются лимитирующим фактором.
Это делает их важной группой рецепторов, весьма подходящей для использования согласно изобретению. Механизм перцепции этих рецепторов подобен такому механизму при воспалительных ответах в животных системах, контролируемых стероидами. При них применение глюкокортикоидов уменьшает первичные ответы на инвазию патогеном. Этот процесс модулируется снижением стабильности мРНК некоторых ключевых регуляторов воспалительного ответа, например СОХ2. Далее, эти стероиды регулируют активность некоторых трансмембранных TOLL-подобных рецепторных комплексов, таких как IL-1 (J. Endocrinology, 2003, 178, 1-4). Гомологи TOLL-подобных рецепторов у растений представлены подгруппой LRR рецепторных киназ, содержащей, помимо прочих, гомологи BRI1 и RKS, вместе вовлеченные в передачу стероидного сигнала у растений. Одним из путей, модулируемых стероидной сигнализацией у растений, является внутриклеточный МАР-киназный путь (FEBS Lett., 2001, 2, 346-50), который в животных системах является мишенью для ингибирования глюкокортикоидами (Curr Opin Pharmacol., 2003, 3, 404-11). Эти данные приводят к гипотезе о том, что стероидная сигнализация у растений и SA сигнализация проявляют широкое взаимодействие друг с другом, и что они осуществляют это взаимодействие с использованием тех же сходных путей и генных продуктов, что и в животных системах. Каждое из этих сигнальных соединений само по себе способно регулировать ответы устойчивости, в связи с чем они частично перекрывают внутриклеточные процессы.
В настоящее время установлено, что избыточная экспрессия такого рецептора вызывает повышенный уровень устойчивости растения к патогену. Именно повышенный уровень, потому что, очевидно, исходно имеется эндогенный (низкий) уровень сигнального соединения, который способен стимулировать рецептор, запускающий каскад, описанный выше, и который ведет затем к (низкому) уровню индуцированной устойчивости. Это, в частности, является преимуществом, так как исходно создает определенный уровень устойчивости без необходимости дополнительного применения сигнального соединения. Кроме того, это также дает повышенную чувствительность нисходящего каскада, что позволяет использовать лиганды, которые могут стимулировать соединения нисходящего каскада для увеличения уровня устойчивости. Эти лиганды могут, помимо прочего, быть выбраны из группы, состоящей из SPL, At4g14400, At4g23130, NPR1, At2914610, At2g14560 и других белков, являющихся частью нисходящего каскада. Исходя из представления о существовании перекрестного взаимодействия между брассиностероидным антипатогенным каскадом и, например, SA каскадом устойчивости к патогену, возможно, что применение других факторов, таких как растительные стероиды, вещества, происходящие из патогенов или их фрагменты, SA, JA и внеклеточные пептиды с сигнальной функцией, подобной GASA или системину или фрагментов этих пептидов, также может быть использовано для стимуляции активированного каскада. Вместе с тем, возможно заменить сигнальную молекулу, нежелательную для использования в определенных условиях (например, вследствие токсичности, воздействия на окружающую среду и т.д.) лигандом, действующим на нисходящий каскад.
Далее, было обнаружено, что избыточная экспрессия рецептора для повышения устойчивости стремится к оптимуму. По-видимому, слишком много рецепторов могут вызвать избыточную стимуляцию нисходящего каскада, что предполагает наличие ингибирующих механизмов ауторегуляции (см. фиг.4 и 7). Следовательно, при введении растениям генетической конструкции, кодирующей рецептор сигнального соединения, внимание должно быть направлено не на то, чтобы выбрать самые сильные экспрессоры, а чтобы протестировать их на оптимальные параметры устойчивости. Такие тесты, легко проводимые специалистом в этой области науки, описаны ниже. В основном, это несколько способов определения оптимальной устойчивости, такие как: 1) проведение анализов устойчивости, таких как анализ АТТА (Cell, 1996, 87, 1307-1316); и 2) определение количества маркерных генов, таких как PR-1 или At2g14560 (ген под прямым транскрипционным контролем NPR1, сильно индуцируемый при применении SA и брассиностероидов (Plant Physiology 2005, 137, 1147-1159; Science 2005, 308, 1036-1040)), или At3946090 (ZAT7), или At2932200 (см. также фиг.9 и 10).
Возможность использовать гены с модифицированной экспрессией после избыточной экспрессии в растениях с RKS4 или другими рецепторами RKS, как маркеры (как показано выше, в способе 2), дает возможность создания анализов для оптимизации обработки трансгенных или нетрансгенных растений путем распыления.
Рецепторы RKS, среди которых наиболее предпочтительными являются рецепторы RKS1, RKS4, RKS7, RKS11 и RKS14 (см., например, WO04/007712). Большинство рецепторов и их соответствующих кодирующих последовательностей были изолированы из Arabidopsis. Однако ортологичные рецепторы из других растений и кодирующие последовательности для этих рецепторов, которые пока не были изолированы, также могут использоваться. Можно предположить, что эти кодирующие последовательности будут гомологичны последовательностям, открытым в упоминавшихся выше ссылках. Таким образом, в принципе, любая нуклеотидная последовательность, которая является гомологичной указанным последовательностям и которая кодирует белок, который по меньшей мере функционирует как рецептор системного сигнального соединения, может быть использована. Эта нуклеотидная последовательность может быть изолирована из растений, экспрессирующих ортологичные рецепторы, однако эти нуклеотидные последовательности также могут быть получены путем модификации имеющихся нуклеотидных последовательностей, которые затем будут кодировать мутеины уже известных рецепторов.
Мутеины рецепторов согласно изобретению являются белками, полученными из уже известных рецепторов путем замещения, добавления и/или удаления одной или более аминокислот, при этом продолжающими выполнять свою функцию как рецепторы системных сигнальных соединений. Такие мутеины легко могут быть получены с помощью белковой инженерии, например, путем замены открытой рамки считывания, способной кодировать белок так, что аминокислотная последовательность изменяется. В случае, если изменения в аминокислотных последовательностях не нарушают в целом активности белка, такие мутеины используются в данном изобретении. Далее, должно быть понятно, что мутеины должны быть производными известных рецепторов, сохраняя биологическую активность, то есть все, или большая часть, интермедиатов между мутеином и белком, описанным в списке последовательностей, должны быть способны индуцироваться системными сигнальными соединениями. Большая часть означает 30% или более от всех интермедиатов, предпочтительнее 40% или более, более предпочтительно 50% или более, более предпочтительно 60% или более, более предпочтительно 70% или более, более предпочтительно 80% или более, более предпочтительно 90% или более, более предпочтительно 95% или более, более предпочтительно 99% или более.
Таким образом, частью согласно изобретению также являются рецепторы, которые по меньшей мере на 70% идентичны известным белкам, но, более предпочтительно, идентичны более чем на 80%, более предпочтительно, идентичны более чем на 90% и, наиболее предпочтительно, идентичны более чем на 95% обсуждавшимся выше известным рецепторам. Для подсчета процента идентичности может быть использован алгоритм BLAST (Nucl. Acids Res., 1997, 25, 3389-3402), с применением стандартных параметров или, альтернативно, алгоритм GAP (J. Mol. Biol., 1970, 48, 443-453), с применением стандартных параметров, они оба включены в пакет программного обеспечения Wisconsin Genetics Software Package, Genetics Computer Group (GCG), 575 Science, Madison, Wisconsin, USA. BLAST рассматривает допущение, что белки могут быть смоделированы как случайные последовательности. Однако многие реальные белки содержат области неслучайных последовательностей, которые могут быть гомополимерными трактами, короткопериодичными повторностями или областями, обогащенными одной или более аминокислотами. Такие низковариабельные области могут быть одинаковыми у разных белков, даже если другие области этих белков полностью различаются. Большое количество программ-фильтров низковариабельных областей может быть использовано для снижения числа таких низковариабельных последовательностей. Например, низковариабельные фильтры SEG (Comput. Chem., 1993, 17, 149-163) и XNU (Comput. Chem., 1993, 17, 191-201) могут использоваться по отдельности или в комбинации.
Используемые здесь термины «идентичность последовательностей» или «идентичность» или «гомология» в контексте двух белковых последовательностей (или нуклеотидных последовательностей) включают в себя ссылку на остатки в двух последовательностях, которые являются одинаковыми, при выравнивании до максимального соответствия в специальном окне сравнения. Когда процент идентичности последовательностей используется в отношении белков, обнаружено, что неидентичные остатки часто отличаются консервативными аминокислотными заменами, в которых аминокислоты замещены на другие аминокислотные остатки со сходными химическими свойствами (например, зарядом или гидрофобностью) и, таким образом, не происходит изменения функциональных свойств молекулы. Когда последовательности различаются консервативными заменами, процент идентичности последовательностей может быть определен более высоким, для учета консервативной природы замещений. О последовательностях, которые различаются такими консервативными заменами, говорят, что они имеют «сходство последовательностей» или «сходство». Значение проведения подобных расчетов хорошо известно специалистам в этой области науки. Обычно они включают в себя учет консервативного замещения как частичной, а не полной замены, увеличивая, таким образом, процент идентичности последовательностей. Следовательно, например, если идентичная аминокислота имеет коэффициент 1, а неконсервативное замещение имеет коэффициент ноль, консервативное замещение имеет коэффициент между 0 и 1. Подсчет консервативных замещений проводится, например, в соответствии с алгоритмом Meyers and Miller (Computer Applic. Biol. Sci., 1998, 4, 11-17).
Используемый здесь термин «процент идентичности последовательностей» означает величину, определенную путем сравнения двух оптимально выровненных последовательностей через окно сравнения, когда фрагмент аминокислотной последовательности или нуклеотидной последовательности в окне сравнения может содержать вставки или делеции (например, разрывы) в сравнении с референтной последовательностью для оптимального выравнивания двух последовательностей. Процент высчитывается путем определения количества положений, в которых идентичные аминокислотные остатки или остатки нуклеиновых кислот присутствуют в обеих последовательностях, для получения числа совпадающих положений, деления числа совпадающих положений на общее число положений в окне сравнивания, и умножения результата на 100 для получения процента идентичности последовательностей.
В целом, не все аминокислоты белка и не все нуклеотиды нуклеотидной последовательности способны к замещению в равной степени. В большинстве случаев белки имеют одну или более область, которая является важной или критичной для функционирования. Для рецепторов RKS согласно изобретению легко определить наименее вариабельные области путем выравнивания последовательностей (которые могут быть найдены в WO 04/007712) и определения так называемых консенсусных последовательностей, то есть фрагментов белка, которые являются наиболее консервативными среди гомологичных последовательностей с такой же функцией. При попытке создания вариантов (или мутеинов) RKS рецепторов эти консенсусные последовательности должны быть, предпочтительно, оставлены интактными, тогда как другие области могут быть изменены в большей степени. В группе рецепторов RKS наиболее предпочтительными являются RKS1, RKS4, RKS7, RKS11 и RKS14. В этих подгруппах имеются специфические консенсусные последовательности.
Очень важно отметить, что части рецепторов, например только внеклеточный домен (или его части), или только внутриклеточный домен, или их фрагменты способны действовать как конститутивные активные соединения в гетеродимерном рецепторном белковом комплексе. Наши результаты показывают, что N-концевая часть RKS4 (внеклеточный домен) может действовать как конститутивный активатор брассиностероидного ответа в отношении устойчивости (фиг.5) и, возможно, также приспособляемости растения, что проявляется в увеличении размеров органов и живого веса (фиг.7 и 8).
Когда в настоящем изобретении упоминается N-концевая часть рецептора RKS, имеется в виду внеклеточный домен указанного рецептора RKS. Специалисту в данной области науки будет понятно, какая часть рецептора имеется в виду при упоминании внеклеточного домена. Кроме того, в WO 04/007712 показаны внеклеточные домены рецепторов RKS.
Следующий вариант осуществления согласно изобретению состоит из химерных рецепторов, в которых часть вышеупомянутого рецептора, связывающая лиганд, замещена частью, связывающей лиганд другого рецептора, такого как рецептор, распознающий другое сигнальное соединение, например стероидный рецептор. В этом случае становится возможным индуцировать другой IR путь, который запускается другим рецептором, как обсуждалось выше, одной и той же сигнальной молекулой или лигандом. Это также позволяет использовать более дешевые и легко доступные соединения для индуцирования IR ответа. Например, может быть проведено замещение связывающей лиганд части рецептора RKS SA-связывающей частью рецептора салициловой кислоты. После трансформации растений с обоими рецепторами - нативными рецепторами салициловой кислоты и химерными рецепторами RKS - применение салициловой кислоты запустит как ответ, индуцируемый салициловой кислотой, так и ответ, индуцируемый брассиностероидами. Однако также возможно использовать связывающие лиганд части рецепторов и лиганды, которые не вовлечены в патогенную устойчивость. Можно, например, заместить связывающую лиганд часть любого из упомянутых выше рецепторов связывающей лиганд частью другой, не относящейся к LRR-рецепторам, киназы, такой как ERECTA (Plant Cell, 1996, 8, 735-746).
Нуклеотидные последовательности должны экспрессироваться в растении(ях), в которые они трансформированы. Для этого необходима генетическая конструкция (кассета экспрессии), содержащая экспрессирующую нуклеотидную последовательность. Экспрессия нуклеотидной последовательности зависит от операционных элементов, содержащихся в такой конструкции, таких как промотор, терминатор и усиливающие элементы.
Термин «промотор» должен означать короткую последовательность ДНК, с которой РНК полимераза и/или другие факторы, инициирующие транскрипцию, связываются перед транскрипцией ДНК, с которой промотор функционально связан, позволяя транскрипции иметь место. Промотор обычно располагается выше (5') кодирующей последовательности. В широком смысле, термин «промотор» включает в себя участок связывания РНК полимеразы, а также элементы регуляторных последовательностей, расположенные на расстоянии нескольких сотен пар оснований, а иногда и дальше, от места начала транскрипции. Такие регуляторные последовательности являются, например, последовательностями, вовлеченными в связывание белковых факторов, контролирующих эффективность инициации транскрипции в ответ на физиологические условия. Область промотора должна быть функциональна в клетке-хозяине и предпочтительно взаимодействовать с естественной промоторной областью рецепторного белка. Однако может использоваться любая гетерологичная промоторная область, если она функционирует в клетке-хозяине, когда экспрессия желательна. Гетерологичный промотор может быть конститутивным, специфичным для ткани или развития, или регуляторным. Конститутивные промоторы, такие как CaMV 35S промотор или Т-ДНК промотор, оба хорошо известные специалистам в этой области науки, являются промоторами, которые практически не подвержены такой регуляции, как индукция или репрессия, но которые вызывают стабильную транскрипцию, без существенных изменений, последовательности ДНК, с которой они функционально связаны, во всех или в большинстве активных клеток организма, показывая, что другие требования к началу транскрипции выполнены. Промотор, специфичный для ткани, является промотором, запрещающим экспрессию кодирующей последовательности в определенных частях растения, то есть в определенной ткани и/или определенном типе клеток. Часто используемым тканеспецифичным промотором является промотор Rubisco (который специфичен для зеленых частей растений). Регуляторный или индуцирующий промотор является промотором, функция которого регулируется одним или более факторами, как присутствующими в клетке, так и поступающими извне (Trends in biotechnology 2005, 23, 283-290). В отсутствие индуцирующего агента последовательность ДНК или не будет транскибироваться, или будет транскибироваться на более низком уровне, в сравнении с уровнем транскрипции в присутствии индуцирующего агента. В определенных обстоятельствах фактор может специфично связываться с индуцируемым промотором для активации транскрипции, указанный фактор присутствует в неактивной форме и превращается (напрямую или опосредовано) в активную форму под воздействием индуцирующего агента. Индуцирующий агент может быть химическим/биохимическим агентом, таким как белок, метаболит (сахар, алкоголь и т.д.), регулятором роста, гербицидом или феноловым соединением. Альтернативно, индуцирующим агентом может быть прямой физиологический стресс (например, перегревание, соль, повреждение, токсические элементы и т.д.) или опосредованный физиологический стресс (например, воздействие патогена или болезнетворного агента, такого как вирус). Растительная клетка, содержащая индуцируемый промотор, может подвергнуться действию индуцирующего агента путем внешнего воздействия индуцирующего агента на клетку, такого как распыление, увлажнение, нагревание или подобными способами. Примеры индуцируемых промоторов включают в себя индуцируемый промотор теплового шока Drosophila melanogaster весом 70 kD (Ann. Rev. Genet., 1985, 19, 297-323) промотор алкогольдегидрогеназы, который индуцируется этанолом (Nagao, R.T. et al., in: Miflin, B.J. (ed.) Oxford Surveys of Plant Molecular and Cell Biology, Vol.3., pp.384-438, Oxford Univ. Press, 1986). Примеры промоторов, которые индуцируются простыми химическими веществами, описаны в Gurr and Rushton (Trends in biotechnology 2005, 23, 283-290), WO 90/08826, WO 93/21334, WO 93/031294 и WO 96/37609.
Терминатор является коротким фрагментом ДНК, который служит для прекращения транскрипции ДНК в РНК и преимущественно выбирается из группы, состоящей из растительных последовательностей терминаторов транскрипции, бактериальных последовательностей терминаторов транскрипции и терминаторных последовательностей растительных вирусов, известных специалистам в этой области науки.
Усиливающие элементы (такие как усилитель 35S) и другие элементы, как области прикрепления каркаса (SARs), могут использоваться для повышения экспрессии генов согласно изобретению. Также возможно усилить экспрессии путем введения интрона (например, Adh-интрона) в открытую рамку считывания или использовать вырусные усиливающие последовательности.
Термин «ген» используется для обозначения последовательности ДНК, которая вовлечена в образование полипептидной цепи и которая включает в себя области, предшествующие и последующие кодирующей области (5'-вышележащие и 3'-нижележащие последовательности), а также промежуточные последовательности, так называемые интроны, которые расположены между индивидуальными кодирующими сегментами (так называемые экзоны) или в 5'-вышележащих или 3'-нижележащих областях. 5'-вышележащая область может содержать регуляторную последовательность, которая контролирует экспрессию гена, обычно промотора. 3'- нижележащая область может содержать последовательность, которая вовлечена в прекращение транскрипции гена и, обычно, последовательности, ответственные за полиаденилирование транскрипта и 3' нетранслируемую область.
В эукариотических клетках кассета экспрессии обычно содержит также область прекращения транскрипции, расположенную ниже открытой рамки считывания, позволяющую завершить транскрипцию и произойти процессу полиаденилирования первичного транскрипта. Кроме того, использование кодона может быть адаптировано к принятому использованию кодона выбранного хозяина. Принципы, управляющие экспрессией конструкции ДНК в выбранной клетке-хозяине, вполне понятны обычному специалисту в этой области науки, и построение экспрессируемой конструкции ДНК является сейчас рутинной для любого типа клетки-хозяина, будь то прокариотическая или эукариотическая клетка.
С целью сохранения открытой рамки считывания в клетке-хозяине она, как правило, будет находиться в форме репликона, содержащего указанную открытую рамку считывания, в соответствии с изобретением связанную с ДНК, которая распознается и реплицируется выбранной клеткой-хозяином. Вместе с тем, отбор репликона во многом определяется выбранной клеткой-хозяином. Принципы, определяющие отбор приемлемого репликона для конкретной выбранной клетки-хозяина, хорошо известны обычному специалисту в этой области науки.
Особым типом репликона является репликон, способный переносить себя, или свою часть, в другую клетку-хозяина, такую как растительная клетка, таким образом перенося, вместе с собой, открытую рамку считывания, в соответствии с изобретением, в указанную растительную клетку. Репликоны с такой способностью обозначаются здесь как векторы. Примером такого вектора является Ti-плазмидный вектор, который, будучи представленным в подходящем хозяине, таком как Agrobacterium tumefaciens, способен переносить свой фрагмент, так называемую T-область, в растительную клетку. Известны различные типы Ti-плазмидных векторов (см.: Европейский патент EP 0 116 718 Bl), которые в настоящее время рутинно используются для переноса последовательностей ДНК в растительные клетки, или протопласты, из которых могут происходить новые растения со стабильно включенными указанными последовательностями ДНК в их геномы. Особенно предпочтительной формой Ti-плазмидных векторов являются так называемые бинарные векторы (как заявлено в Европейском патенте EP 0120516 B1 и патенте США 4940838). Другие приемлемые векторы, которые могут быть использованы для введения ДНК, в соответствии с изобретением, в растительную клетку-хозяина, могут быть отобраны из вирусных векторов, например неинтегративных растительных вирусных векторов, таких как получаемые из растительных вирусов с двойной цепью (например, CaMV) вирусов с одной цепью, бивалентных вирусов и подобных. Использование таких векторов может иметь преимущества, в особенности, если сложно стабильно трансформировать растительную клетку-хозяина. Такие случаи возможны с древесными растениями, особенно с деревьями и виноградом.
Выражение «клетки-хозяева, включающие последовательности ДНК, в соответствии с изобретением, в свои геномы» относится к клеткам, а также к многоклеточным организмам, содержащим такие клетки, или полностью состоящим из таких клеток, которые стабильно включают указанные ДНК в свои геномы, сохраняя, таким образом, ДНК и преимущественно передавая копии таких ДНК следующим поколениям клеток, происходит ли это путем митоза или мейоза. В соответствии с предпочтительным вариантом осуществления согласно изобретению применяются растения, которые полностью состоят из клеток, включающих одну или более копий указанных ДНК в свои геномы, и которые способны передавать копию или копии своим потомкам, преимущественно в соответствии с законами Менделя. В связи с улучшением транскрипции и трансляции ДНК в соответствии с изобретением в некоторых или во всех клетках растения, эти клетки, способные вырабатывать рецептор(ы) для системных сигнальных соединений, будут проявлять повышенную устойчивость к патогенным инфекциям.
Трансформация растений является в настоящее время рутинной для значительного их числа, включающего в себя как двудольные, так и однодольные растения. В принципе любой способ трансформации может быть использован для введения химерной ДНК, в соответствии с изобретением, в подходящую клетку-предшественника, в случае, если клетки способны к регенерации в целое растение. Способы могут быть выбраны из кальций/полиэтиленгликольного способа для протопластов (Nature, 1982, 296, 72-74; Plant Mol. Biol., 1987, 8, 363-373), электропорации протопластов (Bio/Technol., 1985, 3, 1099-1102), микроинъекции в растительный материал (Mol. Gen. Genet., 1986, 202, 179-185), бомбардировки различного растительного материала частицами, покрытыми ДНК или РНК (Nature, 1987, 327, 70), инфицирования вирусами (неинтегративными) и тому подобных. Предпочтительный способ в соответствии с изобретением включает в себя Agrobacterium-опосредованный перенос ДНК. Особенно предпочтительным является использование так называемой бинарной векторной технологии, как описано в Европейском патенте EP A 120516 и патенте США 4940838.
Трансформацию можно облегчить путем использования приемлемых для отбора и скрининга маркеров для различения трансформированных растений или растительных клеток и нетрансформированных растений или растительных клеток. Однако возможно использование так называемых безмаркерных трансформационных протоколов, таких, например, как описанный в WO 01/29240.
В целом, после трансформации растительные клетки или группы клеток проверяют на наличие одного или более маркеров, которые кодируются растительными экспрессирующими генами, совместно перенесенными с последовательностью нуклеиновой кислоты в соответствии с изобретением, после чего трансформированный материал регенерируют в целое растение. Гены, которые могут быть использованы в качестве маркерных генов, можно примерно разделить на маркерные гены устойчивости к антибиотикам, такие как nptII (вызывают устойчивость к канамицину) и hpt (вызывают устойчивость к фосфонотрицину), и маркерные гены, связанные с развитием и метаболизмом, такие как ген трегалазы, ген маннозы (оба являются метаболическими маркерами) и ген IPT или гены RKS рецепторной киназы (маркеры развития). Для безмаркерной трансформации возможно использовать ранее описанную T/R систему, основанную на преходящей активности продуктов регенерирующих генов WO9743427 или стабильной интеграции индуцируемых продуктов регенерирующих генов.
Хотя однодольные растения принято считать более устойчивыми к генетической трансформации, они вполне восприимчивы к ней, и из трансформированных клеток, зародышей или другого растительного материала могут быть получены способные к размножению растения. В настоящее время предпочтительными способами трансформации однодольных являются бомбардировка зародышей, эксплантатов или суспензии клеток микрочастицами и прямое введение ДНК, или электропорация (Shimamoto, et al, 1989, Nature 338, 274-276). Трансгенные растения маиса получали путем введения bar-гена Streptomyces hygroscopicus, который кодирует фосфинотрицин ацетилтрансферазу (фермент, который инактивирует гербицид фосфинотрицин) в эмбриогенные клетки суспензии культуры маиса путем бомбардировки микрочастицами (Plant Cell, 1990, 2, 603-618). Введение генетического материала в алейроновые протопласты других однодольных зерновых, таких как пшеница и ячмень, было описано ранее (Plant Mol. Biol., 1989, 13, 21-30). Растения пшеницы регенерировали из эмбриогенной суспензии культуры путем отбора только взрослых компактных и узловатых эмбриогенных каллюсных тканей для получения эмбриогенной суспензии культуры (Bio/Technol., 1990, 8, 429-434). Комбинация с трансформационными системами для этих зерновых делает возможным применение согласно изобретению для однодольных.
Однодольные растения, включающие в себя коммерчески важные зерновые, такие как рис и кукуруза, также поддаются переносу ДНК с помощью штаммов Agrobacterium (см. WO 94/00977; Европейский патент EP 0 159 418 B1; Plant. Physiol, 1991, 95, 426-434; The Plant J., 1994, 6, 271-282). После переноса ДНК и регенерации, предположительно трансформированные растения могут быть изучены, например, с помощью Саузерн-анализа, на присутствие ДНК в соответствии с изобретением, количество копий и/или организацию генома. После первичного анализа трансформированные растения с желаемым количеством копий и уровнем экспрессии новой введенной ДНК согласно изобретению могут быть проверены на уровни устойчивости к патогену.
Другие исследования могут включать в себя тестирование на устойчивость к патогену в полевых условиях, проверку способности к размножению, урожайности и других характеристик. Такое тестирование в настоящее время является рутинным и может проводиться обычными специалистами в этой области науки. После этих исследований трансформированные растения можно непосредственно выращивать, но обычно их используют в качестве родительских линий в селекции новых (инбредных) сортов или в создании гибридов и тому подобного.
Эти растения, включающие в себя сорта растений с повышенной устойчивостью против патогенов, могут выращиваться в полевых условиях, в теплицах, дома или в любом другом месте. Растения или их съедобные части могут использоваться для кормления животных или потребления человеком, или могут перерабатываться для питания, кормления или других нужд любыми предприятиями сельского хозяйства или промышленности. Под сельским хозяйством подразумевается овощеводство, лесоводство, цветоводство и тому подобное. Промышленность, которая может получить пользу от растений согласно изобретению, включает в себя, но не ограничивается ими, фармацевтическую промышленность, бумажную и деревоперерабатывающую промышленность, производство сахара, пищевую и кормовую промышленность, производство ферментов и тому подобное.
Преимуществами растений, или их частей, в соответствии с изобретением, являются сниженная потребность в обработке пестицидами и, следовательно, меньшая стоимость материалов, труда, меньшее загрязнение окружающей среды, длительное хранение продуктов (например, фруктов, семян и тому подобного) этих растений. Растения согласно изобретению означают многоклеточные организмы, способные к фотосинтезу и подверженные некоторым формам заболеваний, вызванных патогенами. Они включают в себя по меньшей мере как покрытосеменные, так и голосеменные, как однодольные, так и двудольные растения.
Одной из целей согласно изобретению является получение повышенной устойчивости к патогенам, повышая приспособляемость и урожайность растений. Было показано (см., например, WO 04/007712), что введение рецептора RKS вызывает фенотипические изменения у растения. Однако изменения, вызванные избыточной экспрессией молекул рецептора RKS, вызывали не понижение, а повышение приспособляемости и урожайности. Следовательно, дополнительным преимуществом индуцирования повышенной устойчивости к патогенам путем введения в растение генной конструкции, кодирующей рецептор, отвечающий на сигнальное соединение, является то, что избыточная экспрессия этого рецептора также повышает урожайность и/или общую приспособляемость растения.
Далее, если подобные эффекты менее желательны, может быть предпочтительным, с целью поддержания оптимальной приспособляемости растений, экспрессировать рецепторные молекулы тканеспецифично, то есть только в тех тканях, которые (наиболее) подвержены патогенной инфекции. Конечно, выбор ткани также зависит от патогена, защита от которого требуется: некоторые патогены инфицируют только, например, корни растений, тогда как другие патогены специфичны для зеленых частей или только для листьев или ствола. Должно быть понятно, что экспрессия рецептора только в определенных частях растения не нанесет значительного ущерба приспособляемости растения, и, в то же время, будет достаточной для получения растением повышенной устойчивости против заболевания.
Хотя трансгенные растения, сами по себе, будут проявлять повышенную чувствительность к системным сигнальным соединениям, которые будут продуцироваться теми же самыми растениями систематически на прежнем уровне или в больших количествах после патогенной атаки, частью согласно изобретению является достижение повышенной индуцированной устойчивости путем применения системного сигнального соединения, которое распознается рецептором(ами) или лиганда, который распознается химерным рецептором(ами), по которым растения является трансгенным. Предпочтительно системные сигнальные соединения применяются путем распыления. Для большинства зерновых растений известно, когда они наиболее уязвимы для патогенной инфекции или когда патогены, использующие эти растения как хозяина, наиболее патогенны. С целью оптимальной защиты этих растений от заболевания целесообразно опылять эти растения в такое время, которое позволит индуцированной устойчивости сформироваться перед ожидаемой патогенной атакой.
С целью проведения быстрого и простого теста на то, действительно ли новое растение может проявлять повышенную устойчивость после распыления системного сигнального соединения, специалист в этой области науки может предпринять быстрый тест транзиторной экспрессии, известный под названием ATTA (анализ транзиторной экспрессии Agrobacterium tumefaciens). В этом анализе (детальное описание которого можно найти в Van den Ackerveken, G. et al. (Cell, 1996, 87, 1307-1316) нуклеотидную последовательность, кодирующую выбранный рецептор, помещают под контроль конститутивного промотора растения и вводят в штамм Agrobacterium, который также используется в протоколе для стабильной трансформации. После инкубации бактерии с ацетосирингоном или другим фенольным соединением, о котором известно, что оно повышает перенос Т-ДНК Agrobacterium, 1 мл культуры Agrobacterium инфильтрируют in situ в растение путем инъекции, после чего растение помещают в теплицу. Через 2-5 дней листья опыляют сигнальным соединением и на следующий день тестируют на устойчивость к патогену, либо нанося патоген непосредственно на листья, либо используя листья в хорошо известном анализе изолированного листа. Также возможно не опылять активно сигнальным соединением, а использовать собственную сигнальную систему растения для проверки повышения устойчивости частей растения, не подвергшихся непосредственному воздействию.
Альтернативным тестом для определения уровня устойчивости является исследование маркеров устойчивости, то есть молекул, показывающих возросшую устойчивость к патогенам. Маркерами, которые могут быть использованы в этом отношении, являются PR-1, который является маркером индукции салициловой кислоты; At2g14560, который является маркером индукции брассиностероидов и салициловой кислоты, но не индукции ауксина, и который находится под непосредственным транскрипционным контролем NPR1 (Plant Physiology 2005, 137, 1147-1159; Science 2005, 308, 1036-1040). Белок с цинковыми пальцами ZAT7 (At3g46090); и At2g32200, кодирующий внеклеточную пептидную сигнальную молекулу, представляют другие маркеры для SAR-опосредованных ответов, связанных с устойчивостью (см. фиг.6, 9 и 10). Другие гены с измененной экспрессией после избыточной экспрессии RKS4 также могут быть использованы как маркеры. Большое количество этих маркеров, при сравнении с контролем дикого типа показывает повышенную устойчивость к патогену у растения.
Внутриклеточные количества этих маркеров легко определить стандартными анализами, которые хорошо известны специалисту в этой области науки (см. также Экспериментальную часть).
Молекулы лигандов или сигнальных соединений, которые могут применяться для опыления, известны специалисту в этой области науки. Салициловая кислота, жасминовая кислота и брассиностероиды являются соединениями, производимыми в большом количестве и легко доступными. Пептидергические сигнальные соединения GASA, которые изменяют активность рецепторов RKS, описаны и могут быть получены как синтетически, так и с помощью способов рекомбинации ДНК, хорошо известных в науке. Концентрация применяемых соединений зависит от характеристик собственно соединения, плотности эндогенных и трансгенных рецепторов, представленных в ткани растения, которое будет обрабатываться, и способа, которым соединение будет применяться (например, опыление, с питательными веществами или водой и т.д.). Например, специально созданные брассиностероиды с оптимизированным действием и антагонисты брассиностероидных сигналов, вмешивающиеся в нормальное связывание активных брассиностероидов, могут быть в дальнейшем оптимизированы на основе молекулярных репортерных систем, основанных на количественном и качественном определении внутриклеточных ответов на брассиностероидные агонисты и антагонисты. Оптимизированное определение ответов, связанных с повышенной устойчивостью, может быть проведено на модельных растениях с различным генетическим фоном или на растениях, у которых мутированы определенные сигнальные пути.
Активация GASA или пептидных лигандов системина возможна путем удаления N-концевой части последовательности про-белка. Активные пептидные продукты могут доставляться либо путем распыления активной GASA и/или белка системина, активации про-белков внеклеточными протеазами, либо путем введения в растение индуцирующих/тканевых или стадиеспецифичных промоторных конструкций, непосредственно слитых с последовательностями активных пептидных лигандов.
Если принято увеличивать эффект обработки растений с помощью большего количества рецепторных молекул для сигнальных соединений, вторая конструкция, кодирующая один или более нижележащих интермедиатов данного процесса может увеличить эффекты усиления устойчивости. Соединения, которые могут применяться с этой целью, представлены или генными продуктами, передающими сигнальный каскад ниже рецептора, или генными продуктами, активированными после активации рецептора. Пример прямой передачи сигнала представлен генными продуктами NHL и SPL, которые, как было показано, непосредственно взаимодействуют как двухгибридные белковые партнеры с белками RKS. Пример генов, контролируемых на транскрипционном уровне этим сигнальным каскадом, представлен генными продуктами, вовлеченными в инициацию устойчивости, как ранее описанный At2g14560, или, альтернативно, At4g14400 (белок с анкириновыми повторами, вовлеченный в процесс смыкания различных внутриклеточных белков) и At4g23130 (трансмембранная рецепторная киназа).
Примеры
Пример 1. Стратегии клонирования
Продукция и экспрессия рецепторов происходит, например, при помощи клонирующей системы gateway, как описано в (http://www.psb.rug.ac.be/gatewav/). Конструкции избыточной экспрессии получают путем клонирования кДНК полной длины, полученной из SALK, RIKEN или других источников, как показано в инструменте картирования генов Arabidopsis (http://signal.salk.edu/cgi-bin/tdnaexpress), например, путем рекомбинационного клонирования с использованием векторных последовательностей (прямой и обратный праймеры M13 или праймеры T7 и SP6/T3) и, например, их слияния с участками рекомбинации Bl и B2, как это применяется в технологии клонирования «gateway». Рекомбинация в эктопический бинарный вектор экспрессии проводиться, например, путем рекомбинации gateway. ПЦР-амплификация кассет экспрессии и последующая бомбардировка частицами с использованием, например, технологии трансформации T/R без использования маркеров (WO 01/29240) может в дальнейшем применяться для рутинной трансформации растений желаемым генным продуктом. Специфичная индуцирующая система для экспрессии может применяться в том же векторе клонирования gateway, где применяются и индуцирующие промоторы, как, например, индуцируемый Tween 20 промотор OPR1 Arabidopsis thaliana длиной 1200 н.п.(Plant Mol Biol. 2001 Nov;47(5):595-605) или тканевые или стадийные индуцирующие промоторы, как, например, промотор раннего старения 2000 длиной н.п.CDPK1 (Atlg18890) (Mol Gen Genet., 1994, 244, 331-340).
Химерные рецепторы могут быть получены с использованием ОТ-ПЦР продукции различных рецепторных доменов. Последующее клонирование (как описано в Science, 2000, 288, 2360-2363) и экспрессия полученных в результате химерных рецепторов может снова проводиться с использованием клонирующей и экспрессирующей системы «gateway».
Пример 2. Применение брассиностероидов, индуцирующих устойчивость у растений
Две линии Arabidopsis использовали для эксперимента; Ws-0 и Col-0. Девятидневные саженцы опыляли имитацией Silwet L-77 (0,01%) или брассиностероидами (+0,01% Silwet L-77) После высушивания растения инкубировали ростовой камере длительного светового дня (MPMI 2005, 18, 583-592). Через два дня у половины растений листья опыляли Waco9 (50 спор/мкл) штамма Peronospora parasitica (MPMI 2005, 18, 583-592). Через семь дней после инокуляции у растений (40 саженцев на линию) определяли величину спорообразования. Имитацию использовали в качестве контроля. Экспериментальные инфицирование и анализы проводили, как описано ранее (MPMI 2005, 18, 583-592).
Результаты (см. фиг.2 и Таблицу 1) показывают, что через два дня после опыления имитацией и смесью брассиностероидов растения, опыленные брассиностероидами, увеличивались в длине, но через шесть дней они выглядили почти также, как контрольные, только обработанные 0,01% Silwett-L77 в воде, лишь слегка длиннее. Также некоторые семядоли были перевернуты. Растения Col-0 и Ws-0, опыленные брассиностероидами, показали меньшее спорообразование при воздействии Waco9, по сравнению с имитационным контролем, проявляя, таким образом, индукцию устойчивости при применении брассиностероидов.
Пример 3. Рецепторы RKS опосредуют перцепцию брассиностероидов
Избыточная экспрессия генов RKS приводит к изменению ответов на различные концентрации брассиностероидов в биоанализе реакции корней (Cell 2002, 110 203-112 & 213-222). На фиг.3 показано, что обе линии, и RKS10-OX, и RKS4-OX, показывают повышенную чувствительность к различным концентрациям брассиностероидов. Нокаут-линии RKS4, ген которых, в корнях, специфично экспрессирован в зачатках меристемы стелы и в проваскулярной ткани, показывают, с другой стороны, значительное снижение чувствительности к брассиностероидам, что проявляется более длинными корнями при высоких концентрациях. Это не только показывает, что RKS4 является важной регуляторной молекулой в процессе роста корня, но что он также действует через брассиностероидную сигнализацию. RKS4 контролирует как рост растения, так и уровень клеточного деления в некоторых органах растения (см. фиг.8). Его нарушенная экспрессия в меристемальных клетках показывает важную роль продукта гена RKS4 в росте, в зависимости от рецептора и концентраций гормона.
Для детального изучения функции RKS4 применяли подходы с повышением и понижением функции. кДНК RKS4 полной длины эктопически экспрессировали в растениях Arabidopsis Ws-0 под контролем промотора CaMV 35S и изучали T-ДНК инсерционных линий в коллекции SALK (Alonso et al., 2003, доступно в NASC Европейском центре хранения зерновых культур Arabidopsis). Две инсерционные линии, SALK_066568 и SALK_071166, переименованные в rks4-l и rks4-2 соответственно, изучали вместе с линиями избыточной экспрессии (RKS4-OX). Изменения в стационарном уровне мРНК RKS4 верифицировали с помощью ОТ-ПЦР в 12 саженцах (фиг.4), которые показали, что ген RKS4 действительно избыточно экспрессирован в растениях RKS4-OX и что его мессенджер полной длины более не определяется в любой из двух T-ДНК инсерционных линий. Тем не менее, 5'конец мРНК RKS4 (выше T-ДНК вставки) продолжал транскрибироваться в обеих нокаут-линиях rks4-l и rks4-2. В rks4-1 уровень продукции укороченного мессенджера был выше, чем во всех других образцах. Этот фрагмент взаимодействовал с внеклеточным доменом рецептора RKS4. Данные из фиг.4 показывают, что нокаут-линия rks4-1 имеет значительно повышенный стационарный уровень 5'мРНК, по сравнению с уровнем продукта гена RKS4 дикого типа. Обе нокаут-линии более не экспрессировали мРНК RKS4 полной длины. Результаты в фиг.5 и данные К-ПЦР репортеров PR-1 и At2g14560 (фиг.9 и 10) показывают, что этот фрагмент имеет положительный эффект на устойчивость к заболеванию Pseudomonas и на уровень мРНК продуктов репортерного гена устойчивости.
Сходный N-концевой белковый продукт, белок LRP томата (гомологичный генным продуктам ELS, очень схожий с внеклеточным доменом RKS) описан ранее, как ассоциированный с вирусной инфекцией. Этот белок LRP продуцируется субтилизинами в процессе патогенеза (Plant Journal 1996, 10, 315-330). Эти специфичные эндопротеиназы вовлечены в изменение ответов растения на патогенную инвазию через специфичную модификацию регуляторных генных продуктов клеточной стенки. Наблюдаемые в результате изменения в устойчивости показывают роль N-концевого домена RKS-подобных генных продуктов в активации индуцированной устойчивости растения, как описано ниже.
Показано, что значительное количество генных продуктов RKS вовлечено в устойчивость к вирусам, опосредуя устойчивость к широкому спектру геминивирусов (Genes and Development 2004, 18, 2545-2556). Здесь изучалась эндогенная функция RKS 7, 14 и 1 в отношении их влияния на вирусную инфекцию. Доказано, что успешное инфицирование растения зависит от подавления рецепторов RKS вирулентным вирусным фактором NSP. Вирулентный белок NSP взаимодействует непосредственно с белком RKS, приводя к подавлению антивирусных ответов (Virology 2004, 318, 24-31).
Наши данные подтверждают роль этого подкласса рецепторов RKS, так как растения, у которых экспрессия RKS4 была изменена, показали повышенный уровень устойчивости. Эктопическая экспрессия RKS4 в Arabidopsis thaliana действительно привела к, примерно, 50% уменьшению инфекции Pseudomonas syringae (фиг.5). Интересно, что этот уровень устойчивости увеличивался в дальнейшем в нокаут-линии rks4-l (фиг.5), в которой уровень экспрессии 5'конца мессенджера повышен (фиг.4). Это предполагает активацию рецептора протеолитическим ферментов. Эти растения также устойчивы к Peronospora parasitica (фиг.5B), показывая основную роль генных продуктов RKS, по меньшей мере в этом подклассе, в опосредовании устойчивости против различных патогенов.
Пример 4. Гены RKS регулируют различные гены-маркеры устойчивости
В растениях, гиперэкспрессирующих RKS4, положительно регулируется продукт гена At2g14560, маркер индукции брассиностероидами, но не индукции ауксином (см. фиг.9 и 10). Маркер At2g14560 находится под прямым транскрипционным контролем NPR1, и сильно индуцируется применением SA (Plant Physiology 2005, 137, 1147-1159; Science 2005, 308, 1036-1040). Данные находки полностью согласуются с наблюдением, что PR-I вместе с другими маркерами устойчивости сильно позитивно регулируется в растениях с модифицированными уровнями RKS4 по сравнению с контрольными растениями (см. фиг.6, 9 и 10).
Из данных результатов авторы изобретения заключают, что передача сигнала брассиностероидов, опосредованная RKS4, индуцирует в растении реакции сигнализации SA, что визуализируется сильной положительной регуляцией PR-I. Другие сильно индуцированные маркерные гены устойчивости, такие как C2H2/ZAT7 (см. фиг.6), продукт гена транскрипционного регулятора (At3g46090) или ген, ассоциированный с устойчивостью At2g32200, индуцированы, соответственно в 160 раз и в 100 раз в растениях, экспрессирующих RKS4 в результате вмешательства извне.
Пример 5. Индуцированные RKS фенотипические изменения
Наблюдение растений с гиперэкспрессией RKS4 выявляет широкий спектр морфологических изменений, причем наиболее кардинальные эффекты обнаружены в цветках, размер которых сильно повышается в RKS4-OX1 (фиг.7a), но остается не затронутым в растениях RKS4-OX2 и нокаут-растениях (данные не показаны). Хотя авторами не проводился количественный анализ всех генеративных органов, данное изменение размера может по меньшей мере коррелировать с повышенным размером лепестков. В подтверждение данного факта оказалось, что площадь поверхности лепестков в RKS4-OX1 повышалось на 60% по сравнению с диким типом (фиг.7b). Измерение размера клеток ясно демонстрировало, что причиной этого являлось повышение размера клеток (37,6%) и числа клеток (16,3%). Однако не наблюдалось существенных различий в растениях RKS4-OX2 (фиг.7b, значение p=0,09) или в нокаут-растениях по гену rks4 (данные не показаны). Последнее не является неожиданным, поскольку ген RKS4 не экспрессируется в лепестках. Однако различие, наблюдаемое между двумя гиперэкспрессирующими линиями, является более трудным для объяснения и позволяет предположить, что экспрессия RKS4 выше некоторого уровня может обращать ситуацию к дикому типу. Измененная экспрессия RKS4 не влияет на форум и размер стручка (данные не показаны), в отличие от размеров семян (как уже указывалось выше) и массы (фиг.7f). Размер семян, определенный по их длине, действительно значимо снижался в нокаут-линиях, хотя только на 5,2% и 3,5% для rks4-1 и -2, соответственно. Обратное явление наблюдается в линиях с гиперэкспрессией, которые, как и с цветками, характеризуются сильным повышением длины семян в RKS4-OX1 (27,6%) и слабым, хотя и значительным, в RKS4-ОX2 (14,9%). В плане массы семян различия имеют ту же тенденцию, но даже более выраженную при том, что семена RKS4-OX1 и -ОX2 тяжелее на 81,9% и 33,7%, соответственно. Нокаут-линии, с другой стороны, не характеризуются значимыми различиями. Примечательно, что изменения размеров/массы семян не влияют на созревание семян (данные не показаны). Изменения размера эмбриона или содержания эндосперма не исследованы, но после созревания измеряли размер семядоли (фиг.7e). Неожиданно семядоли оказались явно больше в нокаут-линиях (30,1% для rks4-1 и 15,8% для rks4-2), а также в линиях с гиперэкспрессией (61,7% и 36,9% для RKS4-OX1 и -ОX2, соответственно). Более крупные семядоли могут приводить к повышению размера зародыша и, следовательно, повышать массу и размер семян, как наблюдалось в RKS4-OX1 и -ОХ2. Однако это не согласовывалось с семенами rks4-1 и -2, которые меньше по размерам, чем дикий тип. Более подробные наблюдения могут объяснить это несоответствие. В основе данного фактора лежит то, что семядоли в нокаут-линиях больше в основном вследствие повышения уровня деления клеток (15% для rks4-l и 10,7% для rks4-2). С другой стороны, в линиях с гиперэкспрессией деление клеток в действительности снижено на 15,5% (RKS4-OX1) и 4,9% (RKS4-OX2), и поэтому более крупные семядоли являются только результатом сильного удлинения клеток (на 91,3% и 43,9%, соответственно). Интересно, что клетки удлинены также в rks4-l (13,1%), что также вносит вклад в изменение размера семядоли, но этого не происходит в rks4-2 (значение p=0,38), и это показывает, как и в семенах, отличие в силе фенотипа. Большое повышение размера семядоль, наблюдаемое в RKS4-OX1, также видно позже в размере и форме листьев розетки, особенно в условиях короткого светового дня, когда возникают очень мощные розетки с более круглыми и широкими листьями (фиг.7c-d). Однако, как и в случае лепестков, это не имеет место в RKS4-OX2 или в нокаут-растениях, которые не характеризовались значимыми различиями (данные не показаны). Как и ожидалось из его экспрессионного профиля, изменение уровня экспрессии RKS4 также влияло на развитие корней. Измерение корней сеянцев, растущих на вертикальных чашках, действительно выявило, что, как и в семядолях, размер/длина корней значимо повышена в нокаут-линиях и линиях с гиперэкспрессией (фиг.7g). Ситуация, даже с учетом степени повышения, является идентичной (ср. фиг.5e и g), причем rks4-1 характеризуется более сильным повышением, чем rks4-2 (74% против 65,9%), а RKS4-OX1 характеризуется самым большим повышением из всех (83,7%), при том, что в RKS4-OX2 явление опять менее выражено и составляет только 52,7%. Для исследования природы данного повышения авторы изобретения использовали маркер митотической активности, описанный Colon-Carmona et al. (1999), который исследовали в линиях RKS4-OX (фиг.7h). Количественный анализ числа GUS-позитивных клеток в конусах нарастания показал, что скорость деления клеток сильно снижена в RKS4-OX1, но значимо не изменилась в RKS4-OX2 (фиг.7i), что более или менее согласуется с ограниченным снижением (4,9%) наблюдаемым в размере семядоли (фиг.8e). Несмотря на 3-кратное снижение в делении клеток, наблюдаемое в RKS4-OX1, длина корней все же повышалась на 84%, что указывало на то, что, как и в семядолях, повышение размера в корнях вызвано существенным повышением удлинения клеток. Однако в нокаут-линиях авторы не смогли исследовать, соответствует ли также ситуация наблюдаемой в семядолях, т.е. вносит ли в получение более длинных корней деление клеток или их удлинение.
Сумма данных наблюдений согласуется с активностью промотора RKS4 и указывает на то, что рецептор RKS4 вовлечен в поддержание размера органов, в которых он экспрессирован. Тот факт, что и повышение, и снижение его экспрессии может приводить к увеличению органов (кроме семян) указывает на потребность в конкретном оптимальном уровне рецептора RKS4, поддерживающем постоянный размер органов. Хотя потеря функции рецептора не дает начала таким же фенотипам, как полученные при его гиперэкспрессии, ясно, что в нокаутах RKS4 деление клеток стимулируется по меньшей мере в семядолях и, возможно, также в корнях, в то время как обратное наблюдается в тех же органах гиперэкспрессирующих растений, и это подтверждает то, что деление клеток за счет RKS4 может репрессироваться/сохраняться на конкретном уровне. С другой стороны, это не наблюдается в лепестках, в которых гиперэкспрессия RKS4 стимулировала деление клеток, а также элонгацию. Однако RKS4 обычно не экспрессируется в лепестках, и авторы, возможно, наблюдали плейотропный эффект вследствие внесенных извне взаимодействий, которые могут не относиться к эндогенной функции рецептора. Интересно, что в линии RKS4-OX2, которая характеризуется более сильной экспрессией RKS4, наблюдаемые фенотипы слабее отличаются от нормы, чем в других гиперэкспрессированных линиях, или даже отсутствуют, как в лепестках. Это, вероятно, указывает на достижение уровня насыщения при некотором количестве продуцированных рецепторов, что ведет к более слабым эффектам.
Влияние условий освещения на наблюдаемые фенотипы во время вегетативного роста и известное участие брассиностероидов в модулировании фотоморфогенеза согласуются с ролью RKS4, в соответствии с литературой по участию RKS10 (BAK1/AtSERK3) при передаче сигнала брассиностероидов (BR), что также иллюстрируется описанным здесь выше анализом роста корней.
Таким образом, продукты генов RKS вовлечены в восприятие брассиностероидов. Модулирование данных рецепторов приводит к повышенному уровню устойчивости в отношении различных патогенных организмов, таких как бактерии Pseudomonas и вирусы. Растения с модифицированными уровнями RKS характеризуются не только устойчивостью к различным заболеваниям, но также имеют индуцированные характеристики жизнеспособности.
Реферат
Растение трансформируют генетической конструкцией, включающей в себя последовательность ДНК, кодирующую рецептор для системного сигнального соединения, выбранного из группы, состоящей из салициловой кислоты, жасминовой кислоты и брассиностероидов. Предпочтительно, рецептор представляет собой RKS-рецептор. Также могут быть использованы комбинации рецепторов и/или химерные рецепторы. За счет указанной трансформации растение приобретает повышенную устойчивость к патогенным микроорганизмам. 4 н. и 9 з.п. ф-лы, 25 ил.

Комментарии