Фрагмент днк (варианты), вектор, способ получения растения, способ индуцирования продукции гамма-линоленовой кислоты (варианты), способ индуцирования продукции октадекатетраеновой кислоты и дельта-6-десатураза цианобактерий - RU2152996C2
Код документа: RU2152996C2
Чертежи










Описание
Линолевая кислота (18:2) (LA) может быть превращена в γ-линоленовую кислоту (18: 3) (GLA) посредством фермента Δ6- -десатуразы. Если этот фермент или нуклеиновую кислоту, кодирующую этот фермент, перенести в LA-продуцирующие клетки, то будет продуцироваться GLA.
Настоящее изобретение относится к нуклеиновой кислоте, содержащей ген Δ6-десатуразы. В частности, указанная нуклеиновая кислота включает в себя промотор, кодирующую область и область терминации гена Δ6-десатуразы. Кроме того, настоящее изобретение относится к рекомбинантным конструкциям, содержащим область, кодирующую Δ6-десатуразу, в функциональной комбинации с гетерологическими регуляторными последовательностями. Нуклеиновые кислоты и рекомбинантные конструкции настоящего изобретения могут быть использованы для продуцирования GLA в трансгенных организмах.
Ненасыщенные жирные кислоты, такие как линолевая кислота (C18Δ9,12) и α-линоленовая кислота (C18Δ9,12,15), представляют собой незаменимые составные компоненты пищи, и не могут быть синтезированы позвоночными, поскольку клетки позвоночных могут вводить двойные связи в Δ9-положение жирных кислот, но при этом они не могут вводить дополнительные двойные связи между двойной связью Δ9 и метиловым концом цепи жирной кислоты. Поскольку линолевая и α-линоленовая кислоты являются предшественниками других продуктов, то эти кислоты относят к незаменимым жирным кислотам, которые обычно получают из растительных источников. В организме млекопитающего линолевая кислота превращается в γ-линоленовую кислоту (GLA, C18Δ6,9,17), которая, в свою очередь, может быть превращена в арахидоновую кислоту (20:4), играющую особо важную роль в организме млекопитающего, поскольку она является главным предшественником большинства простагландинов.
Продукты питания, в состав которых входит линолевая кислота, обычно удовлетворяют потребность организма в GLA и арахидоновой кислоте, поскольку GLA и арахидоновая кислота являются метаболитами линолевой кислоты. Однако было установлено, что имеется определенная зависимость между потреблением насыщенных жиров и повышенным риском для здоровья, связанным с такими нарушениями в организме, как гиперхолестеринемия, атеросклероз и другие расстройства химического баланса организма, которые коррелируют с его восприимчивостью к ишемической болезни сердца; тогда как потребление ненасыщенных жиров ассоциируется с понижением концентрации холестерина в крови и со снижением риска заболевания атеросклерозом. Положительный терапевтический эффект, связанный с присутствием GLA в пище, очевидно, обусловлен тем, что GLA, будучи предшественником арахидоновой кислоты, вносит свой вклад в синтез простагландина. В соответствии с этим употребление в пищу большего количества ненасыщенной GLA, вместо линолевой кислоты, оказывает благоприятное воздействие на здоровье организма. Однако, фактически, ни в одной из возделываемых сельскохозяйственных культур GLA не присутствует.
В организме линолевая кислота превращается в GLA с помощью фермента Δ 6-десатуразы. Δ6-Десатураза, которая представляет собой фермент, состоящий примерно из 359 аминокислот, имеет связанную с мембраной область и активный сайт десатурации жирных кислот. При перенесении указанного фермента в клетки, эндогенно продуцирующие линолевую кислоту, но не продуцирующие GLA, эти клетки приобретают способность продуцировать GLA. В соответствии с настоящим изобретением, выделение гена, кодирующего Δ6-десатуразу, дает возможность получить трансгенные организмы, которые содержат функциональную Δ6-десатуразу и обладают способностью продуцировать GLA. Кроме того, настоящее изобретение, позволяющее продуцировать большие количества GLA, открывает новые возможности для получения ценных пищевых продуктов, являющихся источниками GLA.
Настоящее изобретение относится к выделенному гену Δ6-десатуразы. В частности, указанный выделенный ген включает в себя промоторную область Δ6-десатуразы, ее кодирующую область и область терминации.
Настоящее изобретение также относится к экспрессирующим векторам, содержащим промотор, кодирующую область и область терминации Δ 6-десатуразы.
Кроме того, настоящее изобретение относится к экспрессирующим векторам, содержащим кодирующую область Δ6-десатуразы в функциональной комбинации с гетерологическими регуляторными областями, то есть элементами, не происходящими от гена Δ 6-десатуразы.
Настоящее изобретение также относится к клеткам и организмам, содержащим векторы настоящего изобретения, и к потомству указанных организмов.
Кроме того, настоящее изобретение относится к выделенной бактериальной Δ6-десатуразе, а также к выделенной нуклеиновой кислоте, кодирующей бактериальную Δ6-десатуразу.
Настоящее изобретение также относится к способу получения растений с повышенным содержанием гамма-линоленовой кислоты (GLA), предусматривающему трансформацию клетки растения с помощью выделенной нуклеиновой кислоты настоящего изобретения, и регистрацию растения с повышенным содержанием GLA из указанной клетки растения.
Настоящее изобретение также относится к способу продуцирования растений, обладающих устойчивостью к низким температурам.
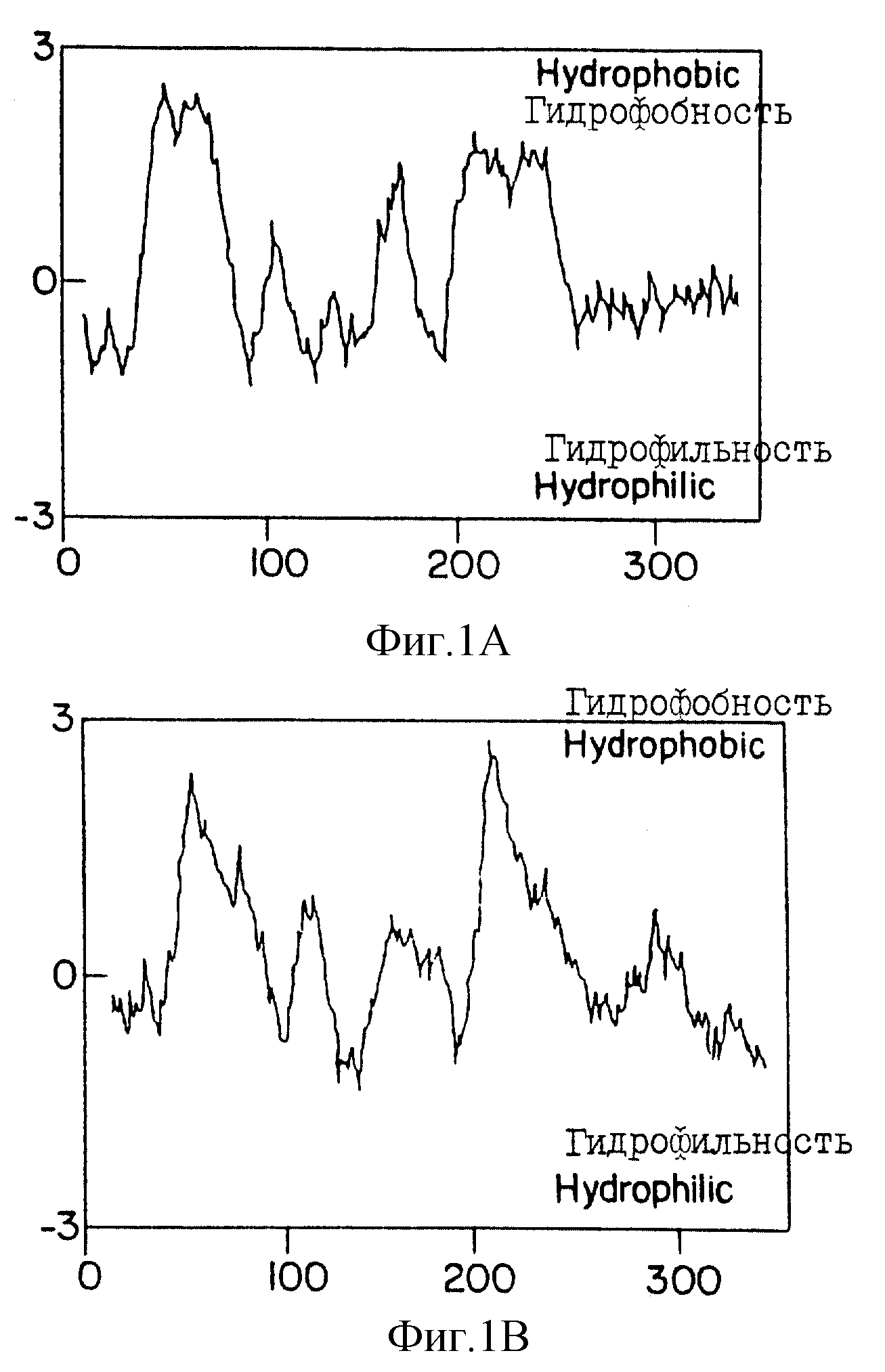
На фиг. 1 представлены профили гидрофобности и гидрофильности выведенных аминокислотных последовательностей Δ6-десатуразы Synechocystis (фиг. 1A) и десатуразы Δ12 Synechocystis (фиг. 1B). Предполагаемые мембранные области показаны сплошными отрезками. Показатель гидрофобности вычисляли для фрагмента из 19 аминокислотных остатков (Kyte и др., 1982, J. Moles. Biol. 157).
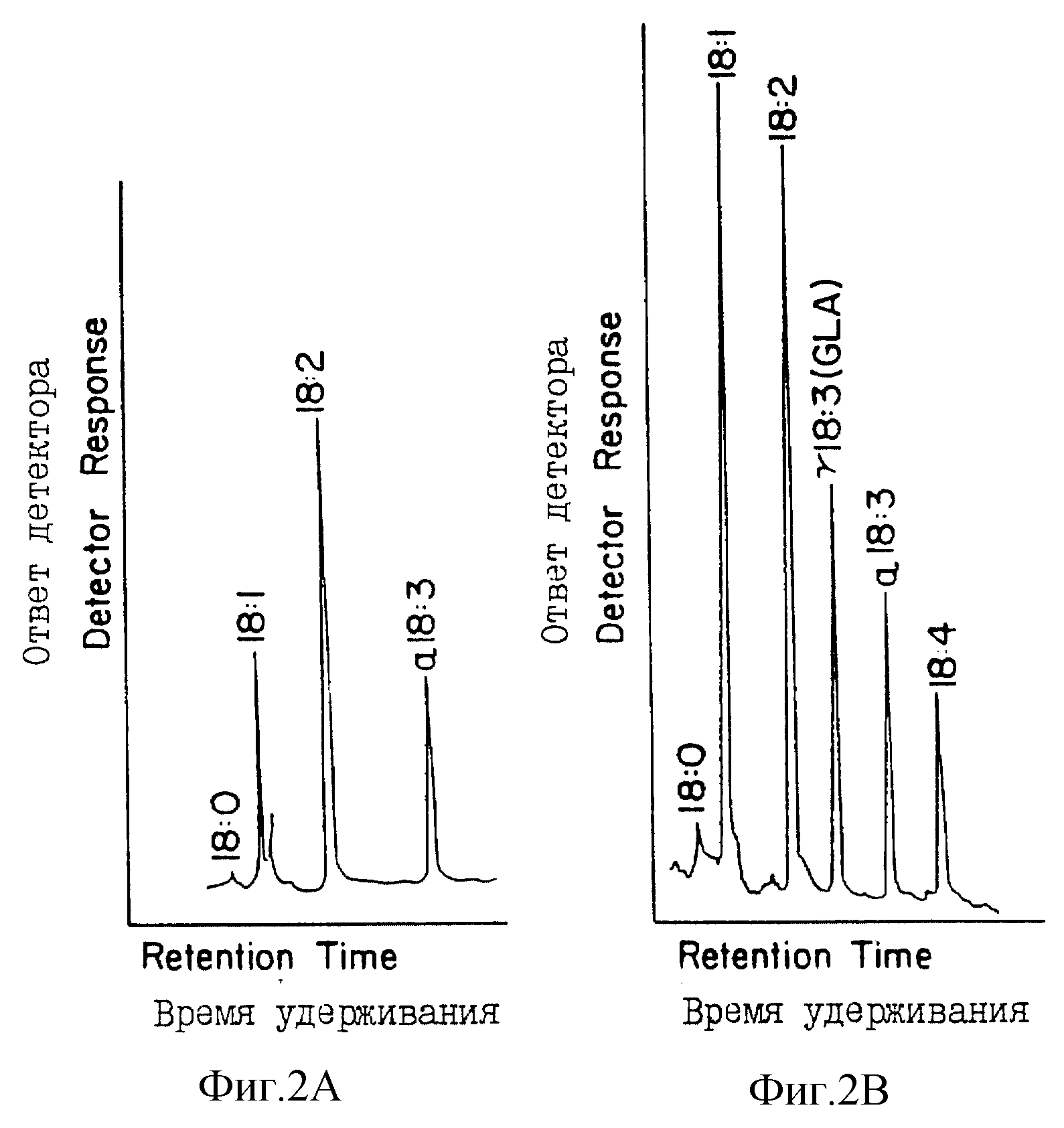
На фиг. 2 представлены профили газожидкостной хроматографии Anabaena дикого типа (фиг. 2А) и трасгенной Anabaena (фиг. 2B).
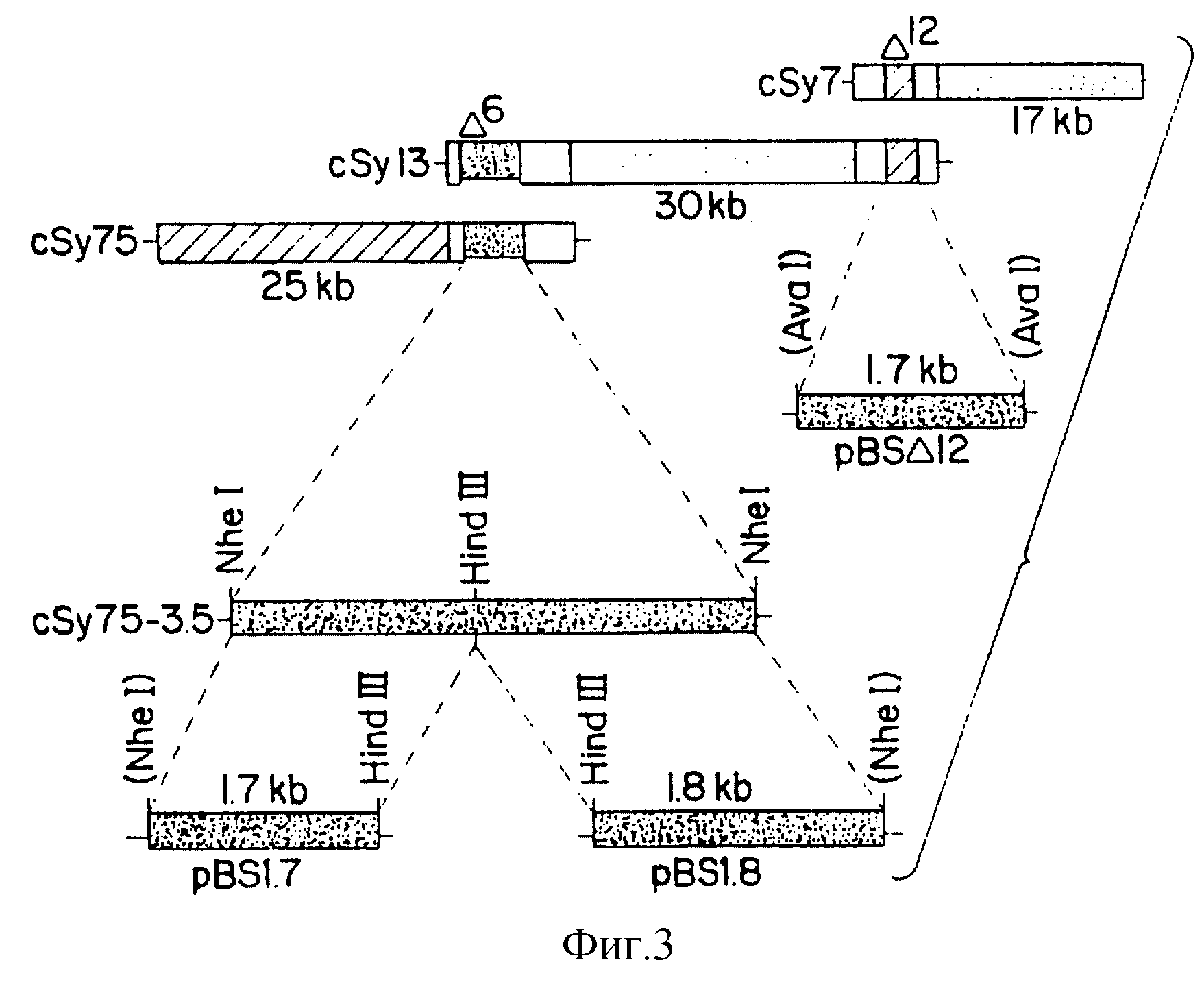
На фиг. 3 схематически представлены карты космид csy 75, csy 13 и csy 7 с перекрывающимися областями и субклонами. Происхождение субклонов csy 75, csy 75 - 3,5 и csy 7 показаны диагональными пунктирными линиями. Сайты рестрикции, которые были инактивированы, указаны в скобках.
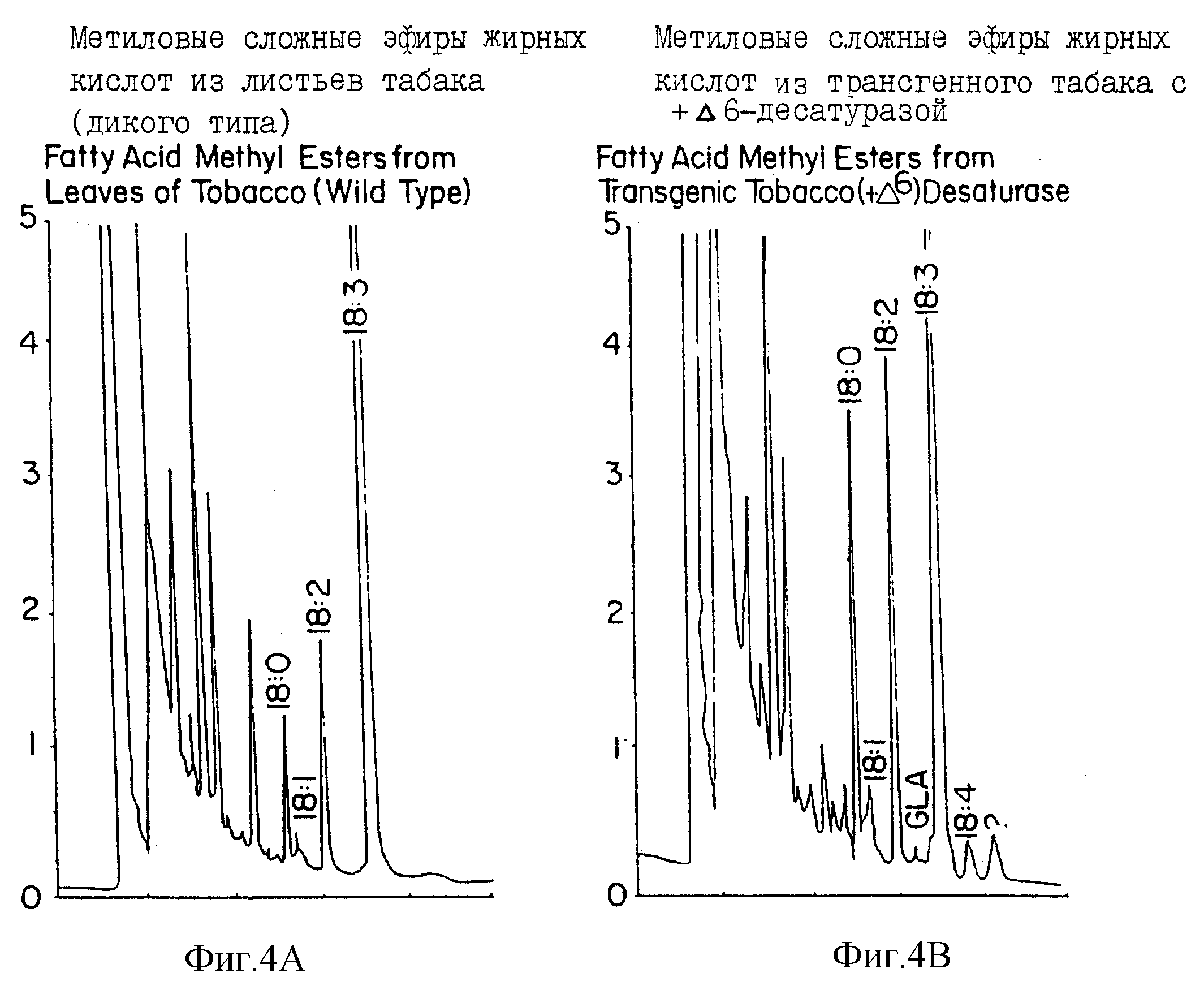
На фиг. 4 представлены профили газожидкостной хроматографии, относящиеся к растению табака дикого типа (фиг. 4A) и трансгенному растению табака (фиг. 4B).
Настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей Δ6-десатуразу. Для идентификации нуклеиновой кислоты, кодирующей Δ6-десатуразу, из организма, который продуцирует GLA, выделяли ДНК. Таким организмом может быть, например, клетка животного, некоторые грибки (такие, как Mortierella), некоторые бактерии (такие, как Synechocystis), либо некоторые растения (бурачник, ослинник (Oenothera), смородина). Выделение геномной ДНК может быть осуществлено различными методами, хорошо известными специалистам, и описанными, например, Сэмбруком и др. (1989) в "Molecular cloning : A. Laboratory Manual, Cold Spring Harbor, NY. Выделенную ДНК подвергали фрагментации с использованием физических методов или путем ферментного переваривания и клонировали в соответствующий вектор, например, фазовый или космидный вектор, с помощью любого из хорошо известных способов, описанных, например, Сэмбруком и др. (1989). В настоящей заявке рассматриваются векторы экспрессии, содержащие ДНК настоящего изобретения, ДНК, кодирующая Δ6-десатуразу, может быть идентифицирована посредством функционального анализа. Вектор, содержащий фрагментированную ДНК, переносят, например, путем инфекции, трансконъюгирования, трансфекции, в организм хозяина, который продуцирует линолевую кислоту, но не гамма-линоленовую кислоту (GLA). Используемый в настоящем описании термин "трансформация" означает, в основном, введение чужеродной ДНК в клетку-хозяина. Введение рекомбинантной ДНК в организм хозяина может быть осуществлено любым из хорошо известных традиционных методов, описание которых приводится, например, в работе Сэмбрука и др. (1989). Продуцирование GLA указанными организмами (т.е., приобретение ими этой функции) оценивают с помощью газовой хроматографии или другими традиционными методами, хорошо известными специалистам. Организмы, наделенные способностью продуцировать GLA, т.е. обладающие этой функцией благодаря введению им вышеуказанного вектора, идентифицируют как организмы, экспрессирующие ДНК, которая кодирует Δ6-десатуразу; и после такой идентификации указанную ДНК выделяют из этих организмов. Выведенная ДНК может быть снова подвергнута фрагментации, клонированию в векторы экспрессии, и функциональной оценке с использованием вышеуказанных процедур в целях более конкретной характеристики ДНК, кодирующей Δ 6-десатуразу.
В качестве иллюстрации настоящего изобретения могут служить следующие процедуры: "случайную" ДНК выделяют из цианобактерии Synechocystis [Пастеровская коллекция культур (РСС) 6803, Американская коллекция типовых культур (АТСС) 27184]; клонируют в космидный вектор; и путем трансконъюгирования вводят в штамм РСС 7120, АТСС 27893 цианобактерии Anabaena. Продуцирование GLA из линолевой кислоты Anabaena контролируют с помощью газовой хроматографии, а соответствующий ДНК-фрагмент выделяют.
Выделенную ДНК секвенируют стандартными способами, хорошо известными специалистам, и описанными, например, Сэмбруком и др. (1989).
В соответствии с настоящим изобретением, была выделена ДНК, содержащая ген Δ6-десатуразы. Более конкретно, из цианобактерии Synechocystis было выделено 3,588 тыс. пар оснований (kb) ДНК, содержащей ген Δ6-десатуразы. Была определена нуклеотидная последовательность указанной 3,588 kb-ДНК, представленная в SEQ ID N 1. Открытые рамки считывания, определяющие потенциальные кодирующие области, находятся на участке от нуклеотида 317 до нуклеотида 1507 и от нуклеотида 2002 до нуклеотида 3081. Для идентификации нуклеотидов, ответственных за кодирование Δ6-десатуразы, 3,588 kb-фрагмент, несущий Δ6-десатуразную активность, расщепляли на два субфрагмента, каждый из которых содержал лишь одну открытую рамку считывания. Фрагмент ORF1 содержал нуклеотиды 1 - 1704, а фрагмент ORF2 содержал нуклеотиды 1705 - 3588. Каждый фрагмент субклонировали как в прямой, так и в обратной ориентации в конъюгированный вектор экспрессии (AM 542, Wolk и др., 1984 Proc. Natl. Acad. Sci. USA 81,1581), который содержал промотор карбоксилазы цианобактерии. Полученные конструкции (т.е., ORF1(F), ORF1(R), ORF2(F) и (ORF2(R)) конъюгировали в штамм дикого типа PCC 7120 Anabaena стандартными методами (например, Wolk и др. (1984) Proc. Natl. Acad. Sci. USA 81, 1561). Конъюгированные клетки Anabaena идентифицировали как зеленые колонии NeoR на коричневом фоне погибших неконъюгированных клеток через две недели после их культивирования на селективных средах (стандартная минеральная среда BGIIN + 30 мкг/мл неомицина, согласно Rippka и др., (1979) J. Gen. Microbiol. III, I). Эти зеленые колонии отбирали и культивировали на жидкой среде (BGIIN + 15 мкг/мл неомицина). Из полученных трансконъюгантов, содержащих конструкции с прямо и обратно ориентированными ORF1 и ORF2, экстрагировали липиды с использованием стандартной техники (например, Dahmer и др. (1989) Journal of American Oil chemical Society 66, 543). Для сравнения, липиды также экстрагировали из культур Anabaena и Syneehocystis дикого типа. Метиловые сложные эфиры жирной кислоты анализировали с помощью газожидкостной хроматографии (ГЖХ), используя, например, газожидкостный хроматограф Tracor-560, снабженный пламенно-ионизационным детектором (где источником ионизации является водородное пламя), и капиллярной колонкой. Результаты ГЖХ - анализа приводятся в таблице 1.
Как показал ГЖХ-анализ, Anabaena, не продуцирующая GLA, приобретает способность к GLA-продуцированию после введения в нее конструкции, содержащей ORF2 в прямой ориентации, посредством трансконъюгирования. Трансконъюганты, содержащие конструкции с ORF2 в обратной ориентации по отношению к промотору карбоксилазы, и конструкции с ORF1 в обеих ориентациях, не обнаруживали продуцирования GLA. Это свидетельствует о том, что лишь одна открытая рамка считывания (ORF2), находящаяся в 1884 п.о. - фрагмента, кодирует Δ6-десатуразу. Этот 1884 п. о. - фрагмент показан на SEQID N 3. Этот факт полностью подтверждается идентичностью профилей гидрофильности и гидрофобности между Δ6-десатуразой и Δ12-десатуразой (Wada и др., 1990, Nature 347), как показано на фиг. 1A и 1B, соответственно.
Выделенные нуклеиновые кислоты, кодирующие Δ 6-десатуразу, могут быть идентифицированы из других GLA-продуцирующих организмов с помощью функциональных анализов, описанных выше, либо с помощью техники гибридизации нуклеиновой кислоты, где в качестве гибридизационного зонда используется выделенная нуклеиновая кислота, которая кодирует Δ6-десатуразу Anabaena. Методы клонирования кДНК и геномной ДНК хорошо известны специалистам и могут быть использованы в целях настоящего изобретения. Гибридизационный зонд может содержать полную ДНК-последовательность, представленную в SEQ ID N 1, либо ее рестракционный фрагмент, либо какой-нибудь другой фрагмент ДНК, например олигонуклеотидный зонд. Методы клонирования гомологичных генов посредством перекрестной гибридизации известны каждому специалисту и описаны, например, Sambrook (1989) и Beltz и др. [(1983) Methods in Enzymology 100, 226].
Трансгенные организмы, наделенные способностью к GLA-продуцированию путем введения им ДНК, кодирующей Δ -десатуразу, приобретают также способность продуцировать октадекатетраеновую кислоту (18:4 Δ6,9,12,15). Обычно, октадекатетраеновая кислота присутствует в рыбьем жире и в некоторых видах растений семейства Boraginaceae (Craig et al. 1874 J. Amer. Oil Chem Soc. 41, 209-211; Cross et al., 1976 Can. J. Plant Sci. 56, 659-664). В трансгенных организмах настоящего изобретения октадекатетраеновая кислота образуется в результате последующей десатурации α-линоленовой кислоты, опосредованной Δ6-десатуразой, либо десатурации GLA, опосредованной Δ 15-десатуразой.
На SEQ ID N 2 показаны 359 аминокислот, кодируемых открытой рамкой считывания ORF2, т.е., открытой рамкой считывания, кодирующий Δ6-десатуразу. В рамках настоящего изобретения также рассматриваются и другие олигонуклеотидные последовательности, которые кодируют аминокислоты в SEQ ID N 2. Идентификация последовательностей, которые, например, являются результатом вырожденности генетического кода, может быть осуществлена любым специалистом. Кроме того, с помощью функционального анализа, описанного выше, любой специалист может определить более мелкие субфрагменты из 1884 п.о. - фрагмента, содержащего ORF2, которая кодирует Δ6-десатуразу.
В настоящем описании рассматриваются любой из указанных полипептидных фрагментов Δ 6-десатуразы и нуклеиновые кислоты, которые сохраняют способность к превращению LA в GLA.
В другом варианте осуществления настоящее изобретение, вектор, включающий в себя либо 1884 п.о. - фрагмент, либо более мелкий фрагмент, содержащий промотор, кодирующую последовательность, и область терминации гена Δ6-десатуразы, переносят в организм, например цианобактерию, где промотор и область терминации Δ6-десатуразы являются функциональными. В соответствии с этим настоящее изобретение относится к организмам, продуцирующим рекомбинантную Δ6-десатуразу. В еще одном варианте своего осуществления, настоящее изобретение относится к выделенной Δ6-десатуразе, которая может быть очищена из рекомбинантных организмов стандартными методами, обычно используемыми для очистки белков. (См., например, Ausubel и др., [1987] Current Protocols in Molecular Biology, Grun, Publishing - Associates. New York).
Настоящее изобретение также относится к векторам, содержащим ДНК, которые кодируют Δ6-десатуразу. Каждому специалисту ясно, что могут быть сконструированы соответствующие векторы для непосредственной экспрессии последовательности, кодирующей Δ6-десатуразу, в ряде организмов. Особенно предпочтительными являются реплицируемые векторы экспрессии. Реплицируемые векторы экспрессии, описываемые в настоящей заявке, представляют собой ДНК- или РНК-молекулы, сконструированные для регулируемой экспрессии нужного гена, т. е. гена Δ6-десатуразы. Предпочтительными векторами являются плазмиды, бактериофаги, космиды или вирусы. В соответствии с настоящим изобретением могут быть также использованы челночные векторы, описанные Wolk и др. [(1984) Proc. Natl. Acad. Sci. USA, 1561-1565], и Bustos и др., [(1991) J. Bacteriol. 174, 7525-7533]. Детальный обзор вектора, в который может быть введена и экспрессирована нуклеиновая кислота, кодирующая Δ6-десатуразу настоящего изобретения, приводится в работах Sambrook (1989), Goeddel, ed. (1990) Methods in Enrymology 185 Academic Press, and Perbal (1988) A Practical Guide to Molecular Cloning Johm Wiley se Sons, Jnc. Указанные векторы также содержат нуклеиновокислотные последовательности, которые могут осуществлять экспрессию нуклеиновых кислот, кодирующих Δ6-десатуразу. Элементами последовательности, способными осуществлять экспрессию генного продукта, являются промоторы, элементы энхансера, расположенные "выше по течению" активирующие последовательности, сигналы терминации транскрипции, и сайты полиаденилирования. При этом могут быть использованы как конститутивный (т.е., нерегулируемый), так и тканеспецифический промоторы. В отношении трансформации растительных клеток, особый интерес представляют промотор 35 S вируса мозаики цветной капусты (CaMV) и промоторы, регулируемые в процессе созревания семян растения. Все указанные промоторы и элементы, регулирующие транскрипцию, взятые отдельно или в сочетании друг с другом, могут быть использованы в реплицируемых векторах экспрессии настоящего изобретения, и хорошо известны специалистам. Например, промотор 35 S описан Restrepo и др. (1990) (Plant Cell, 2, 987). В настоящем описании также рассматриваются генетически сконструированные и мутированные регуляторные последовательности.
Выбор векторов и регуляторных элементов, подходящих для экспрессии в конкретных клетках-хозяевах, может быть осуществлен любым специалистом. Например, для экспозиции Δ6-десатуразы в цианобактерии, подходящим является вектор, содержащий промотор от гена, кодирующего карбоксилазу Anabaena, и правильно присоединенный к области, кодирующей Δ6-десатуразу, а также правильно присоединенный к сигналу терминации, происходящему от Syneehocystis. Термин "правильно присоединенный" в контексте настоящего описания означает, что присоединенные промоторные и терминаторные последовательности эффективно осуществляют свои функции регуляции транскрипции. Еще одним примером вектора, подходящего для экспрессии Δ6-десатуразы в трансгенных растениях, может служить вектор, содержащий семяспецифический промотор, происходящий от гена гелиантинина, напина или глицина, и правильно присоединенный к области, кодирующий Δ6-десатуразу, а также к области сигнала терминации, происходящего из семян, или сигнала терминации нопалин-синтазы.
В частности, регуляторные элементы гелиантинина раскрываются в одновременно рассматриваемой заявке на патент США рег. N 682354 (поданной 8 апреля 1991, и вводимой в настоящее описание посредством ссылки), где они рассматриваются как промоторные элементы, под контролем которых осуществляется экспрессия Δ6-десатуразы настоящего изобретения.
Однако модификации нуклеотидных последовательностей и регуляторных элементов, раскрываемых в настоящей заявке, и сохраняющих свои основные функции, не выходят за рамки объема настоящего изобретения. Такими модификациями являются инсерции, замещения и делеции, а предпочтительно замещения, которые отражают вырожденность генетического кода.
Стандартная техника конструирования таких гибридных векторов хорошо известна каждому специалисту и описана в работах Сэмбрука и др. (1989), либо в любом из многочисленных пособий по лабораторным исследованиям, относящихся к технике рекомбинантных ДНК. Для осуществления лигирования фрагментов ДНК также имеется ряд стандартных методик, выбор которых зависит от природы концов ДНК-фрагментов. Кроме того, настоящее изобретение также предусматривает введение в гибридные векторы других элементов нуклеотидной последовательности, которые облегчают клонирование, экспрессию или процессинг, например, последовательности, кодирующие сигнальные пептиды; последовательность, кодирующая KDEL, и необходимая для удерживания белков в эндоплазматическом ретикулуме; или последовательности, кодирующие транзитные пептиды, которые направляют Δ6-десатуразу в хлоропласт. Все указанные последовательности хорошо известны каждому специалисту. Оптимизированный транзитный пептид описан, например, Van den Broeck и др., (1985) Nature 313, 358. Прокариотические и эукариотические сигнальные последовательности раскрываются, например, Michaelis и др. (1982), Ann. Rev. Microbiol. 36, 425.
В другом варианте своего осуществления, настоящее изобретение относится к организмам, которые не являются цианобактериями и которые содержат ДНК, кодирующую Δ6-десатуразу настоящего изобретения. В соответствии с настоящим изобретением трансгенными организмами могут быть бактерии, цианобактерии, грибки, растения и животные. Выделенная ДНК настоящего изобретения может быть введена в организм хозяина любыми стандартными методами, например путем инфицирования, трансфекции, трансформации или трансконъюгирования. Техника перенесения ДНК настоящего изобретения в указанные организмы хорошо известна специалистам и описана в литературе, например, Сэмбруком и др. (1989).
Существуют различные методы трансформации растений, хорошо известные специалистам. Ген Δ6-десатуразы может быть введен в растения с использованием процедуры трансформации дисков листьев с последующей регенерацией растения из этих листьев, которая описана Horsсh и др. (1985) Science 227, 1229. В настоящем изобретении могут быть также использованы другие методы трансформации, такие как культивирование протопластов (Horsch et al (1984) Science 223, 496; Deblock et al., (1984) EMBO J. 2, 2143; Barton et al. (1983) Cell 32, 1033). В предпочтительном варианте настоящего изобретения растения могут быть трансформированы с помощью векторов, происходящих от Agrobaeterium. Однако для введения гена Δ 6-десатуразы настоящего изобретения в растительные клетки могут быть использованы и другие методы. Такими альтернативными методами могут быть биологические методы (Klein и др. (1987) Natyre 327, 70), электропорация, химически индуцированное внедрение ДНК, а также использование вирусов или пыльцы в качестве векторов.
В методе трансформации, если это необходимо, ген Δ 6-десатуразы настоящего изобретения может быть введен в растение-трансформирующий вектор, например в бинарный вектор, описанный Bevan (1984) Nucleic Acids Res 12, 8111. Растение-трансформирующие векторы могут быть получены путем модификации натуральной системы переноса гена, происходящей от Agrobacterium tumefaciens. Указанная натуральная система включает в себя крупные Ti (опухоль-индуцирующие)-плазмиды, содержащие крупный сегмент, известный как Т-ДНК, который переносят в трансформируемое растение. Другой сегмент Ti-плазмиды, а именно Vir-область, является ответственным за перенос Т-ДНК. По краям указанной Т-ДНК-области находятся концевые повторы. В модифицированных бинарных векторах опухоль-индуцирующие гены были делетированы, а функции Vir-области были использованы для переноса чужеродной ДНК, окаймленной концевыми последовательностями Т-ДНК. Т-область также содержит маркер, селектируемый на резистентность к антибиотику, и сайт многократного клонирования для инсерции последовательностей, предназначенных для переноса. Сконструированные таким образом штаммы известны как "обезвреженные" штаммы A. tumefaciens, и используются для эффективной трансформации последовательностей, фланкированных Т-областью, в нуклеарные геномы растений.
Диски листьев со стерилизованной поверхностью инокулируют штаммом A. tumefaciens, содержащим "обезвреженную" чужеродную ДНК; культивируют два дня, а затем переносят в среду, содержащую антибиотик. Трансформированные проростки отбирают после образования корней в среде, содержащей соответствующий антибиотик, переносят в почву и регенерируют.
В другом варианте своего осуществления, настоящее изобретение относится к трансгенным растениям или их потомству, содержащим выделенную ДНК настоящего изобретения. В целях настоящего изобретения могут быть использованы как однодольные растения, так и двудольные растения. Растительные клетки трансформируют посредством выделенной ДНК, кодирующей Δ\6-десатуразу, с использованием любого из описанных выше методов трансформации растения. Трансформированные растительные клетки, обычно, в каллюсной культуре или диске листьев, регенерируют в цельное трансгенное растение традиционными методами, хорошо известными специалистам (например, Horsсh и др., 1985. Science, 227, 1129). В предпочтительном варианте настоящего изобретения трансгенным растением является подсолнечник, масличный рапс, кукуруза (маис), табак, арахис или соя. Поскольку потомство трансформированных растений наследует ДНК, кодирующую Δ6-десатуразу, то для сохранения линии трансгенного растения используются семена или черенки.
Кроме того, настоящее изобретение относится к способу получения трансгенных растений с повышенным содержанием GLA. Этот способ предусматривает введение ДНК, кодирующей Δ 6-десатуразу, в клетки растений, содержащие низкие уровни GLA или вообще не содержащие GLA, но при этом содержащие LA; и регенерацию растений с повышенным содержанием GLA из трансгенных клеток. В частности, в качестве трансгенных организмов могут быть использованы коммерчески культивированные культурные растения, примерами которых, не ограничивающими, однако, объема изобретения, являются подсолнечник, соя, масличный рапс, маис, арахис и табак.
Настоящее изобретение также относится к способу получения трансгенных организмов, содержащих GLA. Этот способ предусматривает введение ДНК, кодирующей Δ6-десатуразу, в организм, который содержит очень низкие уровни GLA или вовсе не содержит GLA, но содержит LA. В другом варианте осуществления настоящего изобретения этот способ предусматривает введение одного или нескольких векторов экспрессии, которые содержат ДНК, кодирующую Δ12-десатуразу, и Δ6-десатуразу, в организмы с недостаточностью GLA и LA. В соответствии с этим, в организмах с недостаточным содержанием LA и GLA стимулируют продуцирование LA посредством экспрессии Δ12-десатуразы, а затем генерируют GLA посредством экспрессии Δ6-десатуразы. Векторы экспрессии, содержащие ДНК, которая кодирует Δ12-десатуразу, или Δ12-десатуразу и Δ6-десатуразу, могут быть сконструированы методами с использованием технологии рекомбинантных ДНК, хорошо известной специалистам (Sambrook и др., 1989), и уже описанной последовательности Δ12-десатуразы (Wada и др., 1990, Nature (London) 347, 200-203). Кроме того, в соответствии с настоящим изобретением было установлено, что нуклеотиды 2002-3081 последовательности SEQ ID N 1 кодируют Δ12-десатуразу цианобактерии. Поэтому указанная последовательность может быть использована для конструирования нужных векторов экспрессии. В частности, в качестве трансгенных организмов могут быть использованы коммерчески возделываемые культурные растения, примерами которых являются, не ограничивая при этом объема изобретения, подсолнечник, соя, масличный рапс, маис, арахис и табак.
Настоящее изобретение, кроме того, относится к способу продуцирования растений, устойчивых к низким температурам. Чувствительность к холоду может быть обусловлена фазовым переходом липидов в клеточных мембранах. Температура фазового перехода зависит от степени ненасыщенности жирных кислот в мембранных липидах, а поэтому индуцирование или повышение холодоустойчивости растения может быть осуществлено путем увеличения уровня ненасыщенности, например, посредством введения Δ6-десатуразы в целях превращения LA в GLA. В соответствии с этим способ настоящего изобретения предусматривает введение ДНК, кодирующей Δ6-десатуразу, в клетку растения; и регенерацию растения с повышенной устойчивостью к низким температурам из указанной трансформированной клетки растения. В предпочтительном варианте осуществления настоящего изобретения указанным растением является подсолнечник, соя, масличный рапс, кукуруза (маис), арахис или табак.
Настоящее изобретение проиллюстрировано нижеприведенными примерами.
Пример 1
Штаммы и условия культивирования
Synechocystis (PCC 6803, ATCC 27184), Anabaena (PCC 7120, ATCC 27893) и Syneehococcus ( PCC 7942, ATCC 33912) культивировали в условиях фотоавтотрофии при 30oC в BGIIN + среда Rippka
(Rippka и др., 1979, J. Gen. Microbiol. III, 1-61) при освещении ламп накаливания (60 мкЭ • м-2 • с-1). Космиды и плазмиды подвергали селекции и культивированию в
штамме DH5 α Escherichia coli на LB-среде, дополненной антибиотиками при стандартных концентрациях, указанных в работе Maniatis et al, (1982) Molecular Cloning: A Laboratory Manual, Cold Spring
Harbor Laboratory Cold Spring, New York.
Пример 2
Конструирование космидной геномной библиотеки из Syneсhocystis
Полную геномную ДНК из Synechocystis (PCC 6803)
частично переваривали ферментом Sau 3A и фракционировали на градиенте сахарозы (Ausubel и др., 1987, Current Protocols in Molecular Biology Creene Publish-, ing Associates and Wiley Interscience, New
York). Фракции, содержащие 30-40 kb-ДНК-фрагменты, отбирали и лигировали в дефосфорилированный Bam H1-сайт космидного вектора, pDUCA 7 (Buikema и др., 1991, J. Bacteriol. 173, 1879-1885). Лигированную
ДНК упаковывали in vitro, как описано Ausubel и др. (1987), и упакованный фаг размножали в DH5 α E. coli содержащем хелперную плазмиду, кодирующую Aval - Eco 4711-метилазу, а именно плазмиду
pPL 528, описанную Buikema и др. (1991). Всего произвольно было выделено 1152 колоний, которые поддерживали отдельно в двенадцати 96-луночных планшетах для микротитрования.
Пример 3
Индуцирование способности к экспрессии GLA в Anabaena
Anabaena (PCC 7120), которая представляет собой нитевидную цианобактерию, не содержит GLA, но содержит значительное количество
линолевой кислоты, являющейся предшественником GLA (фиг. 2, табл. 2). Synechocystis - космидную библиотеку, описанную в примере 2, конъюгировали с Anabaena (PCC 7120) для идентификации
трансконъюгантов, продуцирующих GLA. Клетки Anabaena культивировали до середины логарифмического роста в BGIIN + жидкая среда и ресуспендировали в той же самой среде до конечной концентрации,
составляющей приблизительно 2 x 108 кл/мл. Культуру RP4 E. coli, находящуюся в средней фазе логарифмического роста (Burkardt et al, 1979, J. Gen. Microbiol 114, 341-348), культивировали в
LB-среде, содержащей ампициллин, а затем промывали и ресуспендировали в свежей LB-среде. После этого Anabaena и RP4 смешивали, и равномерно распределяли по (BGIIN+)-чашкам, содержащим 5% LB. Космидную
геномную библиотеку перепечатывали (т.е. пересевали) в LB-чашки, содержащие 50 мкг/мл канамицина и 17,5 мкг/мл хлорамфеникола, а затем пятнами наносили на (BGIIN +)-чашки, содержащие Anabaena и RP4.
После 24-часового инкубирования при 30oC вводили 30 мкг/мл неомицина и инкубировали при 30oC до тех пор, пока не появятся трансконъюганты.
Отдельные трансконъюганты были выделены после конъюгирования и культивирования в 2 мл BGIIN + жидкая среда с 15 мкг/мл неомицина. Метиловые сложные эфиры жирных кислот получали из культур дикого типа и культур, содержащих пулы 10 трансконъюгантов, следующим образом. Культуры дикого типа и трансгенные цианобактериальные культуры собирали путем центрифугирования и дважды промывали дистиллированной водой. Из этих культур в соответствии с описанием Dahmer и др. (1989) (J. Amer. Oil Chem. Soc. 66, 543-548) экстрагировали сложные метиловые эфиры жирных кислот и анализировали с помощью газожидкостной хроматографии (ГЖХ), используя хроматограф Tracor-560, снабженный детектором, где источником ионизации является водородное пламя, и капиллярной колонкой (30 м x 0,25 мм, связанной с PSOT Superox 11, Alltech Associates Jnc IL). Для идентификации жирных кислот использовали время удерживания и кохроматографию стандартов (полученных от Sigma Chemical Co). Средний состав жирных кислот определяли как отношение площади пика каждой C18-жирной кислоты, нормализованной по отношению к внутреннему стандарту.
Характерные GLA-профили представлены на фиг. 2, где показаны сложные метиловые эфиры C18-жирных кислот. Пики были идентифицированы путем сравнения времен элюирования известными стандартами метиловых сложных эфиров жирных кислот, и подтверждены с помощью хроматогазовой масс-спектрометрии. Фиг. 2A иллюстрирует ГЖХ-анализ жирных кислот Anabaena дикого типа. Стрелкой показано время перемещения GLA. Фиг. 2B иллюстрирует ГЖХ-профиль жирных кислот трансконъюгантов Anabaena с pAM542 + 1,8F. Было идентифицировано, что два GLA-продуцирующих пула (из 25 пулов, представляющих 250 трансконъюгантов), продуцируют GLA. Отдельные трансконъюганты каждого GLA-положительного пула были проанализированы на продуцирование GLA; при этом было идентифицировано, что два независимых трансконъюганта, AS13 и AS75 (по одному от каждого пула) экспрессировали значимые уровни GLA и содержали космиды csy 13 и csy 75, соответственно (фиг. 3). Эти космиды перекрываются в области, длиной примерно 7,5 kb. Nhe I-фрагмент с 3,5 kb космиды csy 75 субклонировали в вектор pDUCA7 и переносили в Anabaena, в результате чего Anabaena приобретала способность экспрессировать GLA (табл. 2).
Два Nhe I / Hind III-субфрагмента (1,8 и 1,7 kb) 3,5 kb - фрагмента csy 75-3,5 субклонировали в вектор "p BLUESCRIPT" (Stratagene) (фиг. 3) для секвенирования. При этом использовали стандартную технику, обычно используемую в молекулярной биологии и описанную Maniatis и др. (1982) и Ausubel и др. (1987). Дидезокси-секвенирование (Sanger и др., 1977, Proc. Natl. Acad. Sci. USA 74, 5463-5467) pBS 1,8 осуществляли с использованием секвеназы ("SEQUENASA", United States Biochemical) (по обеим цепям) и специфических олигонуклеотидных праймеров, синтезированных в Advanced DNA Technologies Laboratory (Biology Department, Texas A. X. M. University). Анализы ДНК-последовательностей проводили с использованием программного обеспечения GCG (Madison, WI), как описано Devereux и др. (1984, Nucleic Acids Res 12, 387-395).
Оба Nhe I / Hind III-субфрагмента переносили в конъюгированный вектор экспрессии, AM542, как в прямой, так и в обратной ориентациях по отношению к промотору цианобактериальной карбоксилазы, и путем конъюгирования вводили в Anabaena. Трансконъюганты, содержащие 1,8 kb-фрагмент в прямой ориентации (AM542-1,8F), продуцировали значительные количества GLA и октадекатетраеновой кислоты (фиг. 2, табл. 2). Трансконъюганты, содержащие другие конструкции, либо 1,8-kb-фрагмент в обратной ориентации, либо 1,7 kb-фрагмент в прямой и обратной ориентации, не продуцировали обнаружимых уровней GLA (табл. 2).
На фиг. 2 сравниваются профили C18-жирных кислот экстракта из Anabaena дикого типа (фиг. 2A) с профилями трансгенной Anabaena, содержащей 1,8 kb-фрагмент csy-75-3,5 в прямой ориентации (фиг. 2B). ГЖХ-анализ метиловых сложных эфиров жирных кислот от AM542-1,8F обнаруживал пик со временем удерживания, равным времени удерживания для аутентичного стандарта. Анализ этого пика с помощью газовой хроматографии - масс-спектрометрии (ГХ-МС) подтвердил, что он имеет тот же тип масс-фрагментации, что и эталонный образец GLA. По скорости роста и морфологии трансгенные Anabaena с измененными уровнями полиненасыщенных жирных кислот и Anabaena дикого типа были идентичными.
Пример 4
Трансформация Synechococcus с использованием генов Δ6- и Δ
12-десатуразы
Третью космиду, csy 7, которая содержала ген Δ12-десатуразы, выделяли путем скрининга Synechocystis - геномной библиотеки с использованием олигонуклеотида,
синтезированного из известной последовательности гена Δ12-десатуразы Synechocystis (Wada и др., 1990, Nature (London) 347, 200-203). 1,7 kb-Aval-фрагмент из этой космиды, содержащей ген Δ
12-десатуразы, был идентифицирован и использован в качестве зонда для иллюстрации того факта, что csy 13 содержит не только ген Δ6-десатуразы, но и также ген Δ12-десатуразы (фиг. 3).
Кроме того, геномный блот-анализ по Саузерну показал, что оба гена (Δ6- и Δ12-десатуразы) являются уникальными в геноме Syneehocystis, так, что оба эти функциональные гена, участвующие в
десатурации C18-жирных кислот, являются тесно связанными в геноме Synechocystis.
Одноклеточная цианобактерия Synechocystis (PCC 7942) не содержит ни линолевой кислоты, ни GLA (3). Гены Δ12- и Δ6-десатуразы были клонированы как отдельно, так и вместе, в челночный вектор pAM854 (Bustos и др., 1991, J. Bacteriol. 174, 7525-7633), который содержит последовательности, необходимые для интеграции чужеродной ДНК в геном Synechococcus (Golden и др., 1987, Methods in Enzymol, 153, 215-231). Synechococcus трансформировали с использованием указанных генных конструкций, и колонии отбирали путем селекции. Из трансгенной Synechococcus экстрагировали метиловые сложные эфиры жирных кислот и анализировали их с помощью газожидкостной хроматографии.
Как видно из табл. 2, основными жирными кислотами Synechococcus дикого типа являются стеариновая кислота (18:0) и олеиновая кислота (18:1). Помимо основных жирных кислот, Synechococcus, трансформированная с помощью pAM854 Δ12, экспрессировала линолевую кислоту (18:2). pAM854- Δ6- и - Δ12-трансформанты продуцировали линолеат и GLA (табл. 1), Полученные результаты показали, что Synechococcus содержащая оба гена Δ12- и Δ6-десатуразы, приобрела способность к введению второй двойной связи в Δ12-положение и третьей двойной связи в Δ6-положение C18-жирных кислот. Однако в трансформантах, содержащих pAM854- Δ6, изменения в составе жирных кислот не наблюдалось, что указывает на то, что при отсутствии субстрата, синтезированного посредством Δ12-десатуразы, Δ6-десатураза является активной. Кроме того, этот эксперимент подтвердил тот факт, что 1,8 kb-Nhe I / Hind 111-фрагмент (фиг. 3) содержит как кодирующую, так и промоторную области гена Δ6-десатуразы Synechocystis. По своим скорости роста и морфологии, Synechococcus дикого типа и трансгенная Synechococcus с измененными уровнями полиненасыщенных жирных кислот являются идентичными.
Пример 5
Нуклеотидная последовательность Δ6-десатуразы
Определяли нуклеотидную последовательность 1,8
kb-фрагмента csy 75-3,5, включающего в себя функциональный ген Δ6-десатуразы. Идентифицировали открытую рамку считывания, кодирующую полипептид в 359 аминокислот (фиг. 4). С помощью
гидрофобно-липофильного анализа по методу Kyte-Doolittle (Kyte и др. , 1982, J. Mol. Biol 157, 105-132) были идентифицированы две области гидрофобных аминокислот, которые должны представлять
трансмембранные домены (фиг. 1A); и, кроме того, было установлено, что профиль гидрофобности и гидрофильности Δ6-десатуразы аналогичен профилю Δ 12-десатуразы (фиг. 1B; Wada и др. ) и
Δ 9-десатураз (Thiede и др., 1986, J. Biol. Chem. 261, 13230-13235). Однако сходство между последовательностями Δ6- и Δ12-десатураз Synechocystis составляет менее чем 40% для
нуклеотидных последовательностей и приблизительно 18% для аминокислотных последовательностей.
Пример 6
Перенос гена цианобактериальной Δ6-десатуразы в растение
табака
Ген Δ6-десатуразы цианобактерии вводили в растительный вектор экспрессии и переносили в табак, используя технику Agrobacterium - опосредованного переноса гена. Для обеспечения
соответствующей экспрессии перенесенного гена десатуразы в листьях и прорастающих семенах растений, а также направленной доставки продукта гена десатуразы в эндоскопический ретикулум или хлоропласт,
конструировали различные полигенные экспрессирующие кластеры, содержащие открытую рамку считывания (ORF) Δ-десатуразы Synechocystis. Эти кластеры имели следующие компоненты: (I) промотор 35S
или семя-специфический промотор, происходящий от гена гелиантинина подсолнечника для контроля экспрессии гена Δ6-десатуразы во всех тканях растения или только в прорастающих семенах,
соответственно; (II) предполагаемый сигнальный пептид, происходящий либо от гена экстенсина моркови, либо от гена гелиантинина подсолнечника для доставки вновь синтезированной Δ6-десатуразы в
эндоплазматический ретикулум (ER); (III) сигнальная последовательность у COOH-конца ORF Δ6-десатуразы для удерживания белков в полости ER (KDEL); и (IV) оптимизированный транспортный пептид для
доставки Δ6-десатуразы в хлоропласт. Промотор 35S происходит от pPTL2, описанной Restrepo и др. (1990). Последовательность оптимизированного транспортного пептида описана Van de Broeck и др.
(1985). Сигнальный пептид экстенсина моркови описан Chen и др. (1985, EMBO J, 9, 2145).
Были продуцированы трансгенные растения табака, содержащие химерный ген десатуразы цианобактерии, состоящий из гена Δ6-десатуразы Synechocystis, сшитого с последовательностью, ответственной за удержание белков в эндоплазматическом ретикулуме (KDEL), и сигнальным пептидом экстенсина под контролем промотора CaMV 35S. PCR-амплификация геномной ДНК трансгенного табака свидетельствовала о том, что ген Δ6-десатуразы был введен в геном табака. Метиловые сложные эфиры жирных кислот листьев указанных трансгенных растений табака были экстрагированы и проанализированы с помощью газожидкостной хроматографии (ГЖХ). Эти трансгенные растения табака аккумулировали значительное количество GLA (фиг. 4). На фиг. 4 показаны ГЖХ-профили метиловых сложных эфиров жирных кислот. Пики были идентифицированы путем сравнения времен элюции с известными стандартами метиловых сложных эфиров жирных кислот. В соответствии с вышеуказанным, гены цианобактерий, ответственные за метаболизм жирных кислот, могут быть использованы для генерирования трансгенных растений с измененным составом жирных кислот.
Реферат
Изобретение может быть использовано в селекции растений. Введение в растение нуклеотидной последовательности, кодирующей фермент дельта-6-десатуразы, приводит к изменению обмена веществ в тканях растения, выражающемуся в повышении выработки в них гамма-линоленовой кислоты за счет превращения линолевой кислоты. 9 с. и 1 з.п. ф-лы, 2 табл., 7 ил.
Формула
10.10.91 - по пп.1 - 5 и 10;
08.01.92 - по пп.6 - 9.

Комментарии