Способ получения растения подсолнечника, способ получения семян подсолнечника и рекомбинантная плазмида - RU2185439C2
Код документа: RU2185439C2
Описание
Область техники, к которой
относится изобретение
Данное изобретение относится к трансгенным растениям подсолнечника, дающим семена с высоким содержанием насыщенных жирных кислот. Более конкретно, изобретение относится
к антисмысловой экспрессии ДНК-фрагмента, имеющего последовательность, полученную из гена стеароил-АПБ-десатуразы (стеароил-[ацил-переносящий белок]-десатуразы) подсолнечника.
Уровень
техники
Растительное масло из семечек подсолнечника (Helianthus annuus) является наиболее распространенным пищевым маслом во всем мире. Масляный компонент семени подсолнечника обычно
составляет примерно до 80% ценности культуры подсолнечника и главным образом используется как средство для приготовления пищи. Подсолнечное масло также используют в качестве салатного масла, а также в
производстве маргарина, мыла и шортенинга. Шортенинг представляет собой жировую добавку в тесто, например, как масло или лярд, используемый обычно для приготовления торта, пирожных или сдобного теста,
песочного или слоеного. Однако использование подсолнечного масла для этих целей ограничено объемом его переработки, которая необходима для модификации состава жирных кислот подсолнечного масла для
устранения прогорклости, улучшения вкуса и консистенции.
Известно, что из-за высокой степени ненасыщенности подсолнечное масло способно к изменению состава в результате окисления в течение процесса его обработки и хранения (см., например, C.F. Adams, Nutritive Value of American Foods, Agricultural Handbook, p. 456 (U.S. Department of Agriculture, 1975).
Стабильность и вкус подсолнечного масла улучшают гидрогенизацией, которая приводит к уменьшению количества двойных связей жирных кислот. Однако необходимость проведения такой обработки снижает экономическую привлекательность подсолнечного масла.
К главным жирным кислотам, содержащимся в семечках подсолнечника, относятся линолеат ди-ненасыщенных жирных кислот, составляющий в сумме примерно 65%, и олеат мононенасыщенных жирных кислот, составляющий в сумме примерно 25%. Подсолнечное масло также включает в свой состав небольшие количества насыщенных жирных кислот, прежде всего пальмитата и стеарата. Пальмитат составляет примерно от 4,5 до 6,0%, а стеарат составляет примерно от 5,0 до 6,0% в жирнокислотном составе семян подсолнечника.
Эти жирные кислоты присутствуют в растительном масле не в виде свободной кислоты, а они, как установлено, главным образом этерифицированы до глицерина в виде триглицеридов. При проведении анализа жирнокислотного состава растительного масла обнаружено, что триглицериды обычно разлагаются с высвобождением метильных производных жирных кислот.
Из-за своего жирнокислотного состава, немодифицированное подсолнечное масло не совсем пригодно для производства высококачественного маргарина. Один из способов для решения этой проблемы заключается в переэтерифирикации подсолнечного масла с другим гидрогенизированным растительным маслом по методике, предложенной Freier et al., Ind. Aliment. (Bucharest), 24: p. 604-607 (1973). Производители маргарина в Соединенных Штатах часто осуществляют переэтерификацию подсолнечного масла с маслом сафлоры красильной или соевым маслом, и затем его смешивают с порцией отвержденного гидрогенизированного масла. К сожалению, такая технология переработки приводит к увеличению себестоимости масла и проблемам здоровья из-за нежелательного образования жирных кислот транс-конфигурации. Если бы подсолнечное масло содержало большую долю пальмитата и стеарата, то это позволило бы сократить процесс его переработки в производстве маргарина.
Растительное масло можно превратить в пищевой жир для кондитерской промышленности. К сожалению, жирнокислотный состав обычного подсолнечного масла мешает широкому его использованию в кондитерской промышленности, например, в качестве заменителя масла какао.
Ежегодно в мире производится более 2 миллиардов фунтов масла какао, самого дорогостоящего пищевого масла. США ежегодно импортируют масло какао на несколько сотен миллионов долларов. Высокая стоимость масла какао, цены и нестабильные его поставки содействовали созданию заменителей масла какао, имеющих жирнокислотный состав, аналогичный составу масла какао.
В составе жирных кислот масла какао обычно содержится 26% пальмитата, 34% стеарата, 35% олеата и 3% линолеата. Благодаря уникальному жирнокислотному составу сырья получают масло какао со свойствами, которые делают этот пищевой жир особенно пригодным для использования в кондитерской промышленности. Масло какао относится к твердым маслам, которое не осаливается при обычных температурах и тает очень быстро во рту. Это масло отличается особенно большой стойкостью к окислительным реакциям. По этим причинам, получая подсолнечное масло с повышенным содержанием стеарата и пальмитата и пониженным содержанием ненасыщенных жирных кислот, можно было бы расширить диапазон его использования в качестве заменителя масла какао. Такая замена масла какао подсолнечным маслом повысила бы его ценность, а также позволила бы снизить объем импорта масла из тропических растений.
Подсолнечное масло с повышенным содержанием в нем стеарата и пальмитата могло бы удовлетворить потребности других традиционных областей применения жира с высоким содержанием насыщенных жирных кислот, например, используя его в качестве сырья в производстве мыла и получения жира для глазури. Для этих целей используют животный жир из-за высокого содержания в нем насыщенных жирных кислот, благодаря чему он имеет большую устойчивость к окислению. Подсолнечное масло с повышенным содержанием в нем стеарата и пальмитата имело бы аналогичным образом большую устойчивость к окислению.
В комбинации с традиционными методами растениеводства, мутагенез использовали для выведения сортов подсолнечника, у которых был модифицирован состав жирных кислот. В качестве одного примера сорта подсолнечника, созданного этим методом, может служить гибрид Pioneer® 6661, из семян которого получают подсолнечное масло длительного хранения, причем примерно 85% в составе его жирных кислот составляет олеат. В качестве другого примера можно привести сорт подсолнечника, дающий семена с высоким содержанием стеарата, который описан Osorio и другими в журнале Crop Sci., 35: р.739-742 (1995).
Указанный метод, использующий мутагенез, однако, строго ограничен в данном контексте. Маловероятно, что возможно создание мутантного сорта, в котором доминантый фенотип или фенотип типа "улучшение по функции" создается либо геном, играющим важную роль для роста растения, либо одно-копийным геном. Кроме того, рутинные и дорогостоящие традиционные методы разведения необходимы для интрогрессии мутации в элитную линию. Эта проблема вытекает из полигенного наследования генов, которые приводят к получению желаемого состава масла.
Проблема полигенного наследования становится очевидной из линий растений с высоким содержанием стеарата, выведенных Osorio и другими (1995), упомянутыми выше, содержание стеарата в составе семян которых было изменено через несколько поколений. Через три поколения инбридинга, семена подсолнечника, полученные из двух линий, о которых сообщал Osorio и другие, содержали более 10% стеарата, менее 6% процентов пальмитата и более 13% олеата.
В разработанных за последнее время методах молекулярной и клеточной биологии предлагается возможный путь преодоления некоторых ограничений, накладываемых на метод, использующий мутагенез, в том числе необходимость проведения широкомасштабных исследований по селекции. К особенно пригодным технологиям относятся (а) семя-специфическая экспрессия чужеродных генов в трансгенных растениях, (b) использование антисмысловой РНК для ингибирования генов-мишеней растения по доминантному и тканеспецифическому пути, (с) перенос чужеродных генов в элитный коммерческий сорт масличных культур, например, таких, как подсолнечник, по методике описаннной Everett и другими в журнале Bio/Technology, 5: р. 1201-1204 (1987), и использование (d) генов маркеров полиморфизма длины рестрикционных фрагментов в программе по селекции, которая предлагает быструю и менее дорогостоящую технологию интрогрессии рецессивных признаков в элитные линии, описанную Tanksley и другими в журнале Bio/Technology, 7: р. 257-264 (1989). Однако каждая из этих технологий требует идентификации и выделения генов промышленного назначения.
В настоящее время идентифицировано несколько таких генов, участвующих в синтезе жирных кислот в растениях. Например, биосинтез пальмитата, стеарата и олеата происходит в пластидах при взаимодействии трех ключевых ферментов "АПБ-пути": пальмитоил-АПБ-элонгазы, стеароил-АПБ-десатуразы и ацил-АЦП-тиоэстеразы.
Стеароил-АПБ-десатураза вводит первую двойную связь у стеароил-АПБ с образованием олеоил-АПБ. Этот фермент является ключевым и определяет в растительных маслах степень ненасыщенности жирных кислот, содержащих в цепи 18 атомов углерода.
Жирные кислоты, синтезируемые в пластидах, переносятся в виде ацил-СоА в цитоплазму. По крайней мере, три различных глицерол-ацилирующих фермента, а именно глицерол-3-фосфат-ацилтрансфераза, 1-ацилглицерол-3-фосфат-ацилтрансфераза и диацилглицерол-ацилтрансфераза, обеспечивают перенос ацильных остатков из цитоплазмы в триглицериды в процессе биосинтеза масла. Эти ацилтрансферазы проявляют сильное, но не абсолютное предпочтение по включению насыщенных жирных кислот в положения 1 и 3 триглицерида и мононенасыщенных жирных кислот в положение 2 триглицерида. Таким образом, изменение состава жирных кислот ацильного пула может инициировать массовые действия, соответствующие изменениям в жирнокислотном составе масла. Кроме того, имеются экспериментальные данные, свидетельствующие о том, что вследствие этой специфичности, растения могут создавать заменители масла какао, если им задан точный состав жирных кислот (см. Bafor и другие, JAOCS, 67: р. 217-225 (1990).
Таким образом, один из методов изменения содержания стеарата и олеата в подсолнечном масле влечет за собой модификацию содержания ацил-СоА в цитоплазме. Такую модификацию можно осуществить генетически двумя путями. Во-первых, изменение процесса биосинтеза стеарата и олеата в пластиде можно осуществить путем модуляции содержания стеароил-АПБ-десатуразы в семенах либо через сверхсинтез или антисмысловое ингибирование экспрессии гена стеароил-АПБ-десатуразы. Второй способ заключается в превращении стеароил-СоА в олеил-СоА в цитоплазме через экспрессию в ней стеароил-АПБ-десатуразы.
Антисмысловое ингибирование экспрессии гена стеароил-АПБ может быть обеспечено путем введения ДНК-фрагмента в клетку, в результате чего образуется РНК, которая комплементарна мРНК, кодирующей стеароил-АПБ-десатуразу. При этой стратегии, сначала выделяют ген стеароил-АПБ-десатуразы, из которого получают ДНК-фрагмент. Предпочтительно, чтобы истинный ген (гены) или кДНК-последовательность (последовательности), кодирующие стеароил-АПБ-десатуразу, были выделены из культуры подсолнечника, а не из других видов растений. Это обусловлено тем, что механизм антисмыслового ингибирования экспрессии гена действует лучше всего, когда имеет место высокая степень комплементарности между антисмысловой РНК и геном-мишенью. Knutzon и другие сообщали в журнале Proc. Nat'l Acad. Sci., USA, 89: р. 2624-2628 (1992) об антисмысловом ингибировании экспрессии гена стеароил-АПБ-десатуразы в культуре canola; см. также патент США 5443974. В этих публикациях описывается метод повышения количества стеарата в семенах культуры canola и сои, соответственно, путем антисмыслового ингибирования экспрессии гена. В случае культуры canola, семена трансгенных растений, имеющие самое большое количество стеарата, содержали около 15% олеата, что свидетельствует о снижении в них содержания олеата в 4 раза по сравнению с контрольным его значением, составляющим примерно 60%. В случае сои, повышение содержания стеарата происходило без снижения содержания олеата. В обоих случаях использовали клонированный ген стеароил-АПБ-десатуразы из соответствующего вида растения для конструирования трансгенных ДНК- фрагментов.
Предположение о том, что антисмысловая экспрессия гена стеароил-АПБ-десатуразы повлияет только на концентрацию C18-жирных кислот, было подтверждено данными Knutzon и других (1992), упоминаемого выше, который установил, что увеличение количества стеарата не сопровождается увеличением количества пальмитата. Экспериментальные данные, приведенные в патенте США 5443974, также свидетельствуют о том, что увеличение количества стеарата происходит без повышения содержания пальмитата.
Таким образом, генетическое изменение стеароил-АПБ-десатуразы в растении может влиять на содержание С18-жирных кислот, но как известно, не оказывает влияния на их метаболизм. Однако, для некоторых областей промышленности желательно получить повышенное содержание как стеарата, так и пальмитата методами, о которых вкратце говорилось выше. В соответствии с этим, метод, делающий возможным получение растительного масла с высоким содержанием как стеарата, так и пальмитата стал бы ценным вкладом в данную область техники.
Сущность изобретения
Целью настоящего изобретения,
таким образом, является получение подсолнечного масла с более высоким содержанием в нем стеарата по сравнению с традиционными марками подсолнечного масла, которое не требует большой переработки в
производстве маргарина и кондитерских изделий.
Еще одной целью настоящего изобретения является получение подсолнечного масла с повышенным содержанием в нем стеарата и пальмитата по сравнению с традиционными сортами подсолнечного масла.
Целью настоящего изобретения является также создание сортов трансгенных растений подсолнечника при скрещивании гомозигот, дающих семена с более высоким содержанием в них стеарата и пальмитата по сравнению с сортом растения дикого типа.
Очередной целью настоящего изобретения является создание гибридного сорта трансгенных растений подсолнечника, дающих семена с более высоким содержанием в них стеарата и пальмитата по сравнению с сортом растения дикого типа.
Эти и другие цели достигаются тем, что в соответствии с одним аспектом настоящего изобретения предлагается способ получения растения подсолнечника путем инсерции фрагмента ДНК, транскрибируемая нить которой имеет транскрипт, комплементарный эндогенной мРНА стеароил-АПБ-десатуразы в растении, в результате чего стеароил-АПБ-десатуразная активность в указанном растении снижается относительно растения дикого типа, с получением трансгенного растения, которое дает семена с содержанием в них стеарата примерно от 10 до 40% от общего содержания в семенах жирных кислот.
В соответствии с другим аспектом настоящего изобретения предлагается способ получения семян подсолнечника, образуемых растением, содержащим хромосому, которая содержит ДНК, кодирующая нить которой имеет транскрипт, комплементарный эндогенной мРНА стеароил-АПБ-десатуразы в растении, в результате чего стеароил-АПБ-десатуразная активность в указанном растении снижается относительно растения дикого типа, причем указанное растение дает семена с содержанием в них стеарата примерно от 10 до 40% от общего содержания в семенах жирных кислот.
Следующий объект изобретения представлен рекомбинантной плазмидой р7874, предназначенной для получения трансгенного растения подсолнечника согласно указанному способу.
В соответствии с еще одним аспектом настоящего изобретения предлагается сорт культуры подсолнечника, созданный при скрещивании гомозигот, с содержанием в нем стеарата примерно от 10 до 40% от общего содержания в семенах жирных кислот.
Другие цели, признаки и преимущества настоящего изобретения очевидны из нижеследующего подробного его описания. Необходимо иметь в виду, что подробное описание и конкретные примеры, раскрывающие предпочтительные варианты его осуществления, приведены только в качестве иллюстрации, поскольку различные изменения и модификации в пределах существа и объема изобретения станут очевидны специалистам в данной области техники из нижеследующего подробного описания.
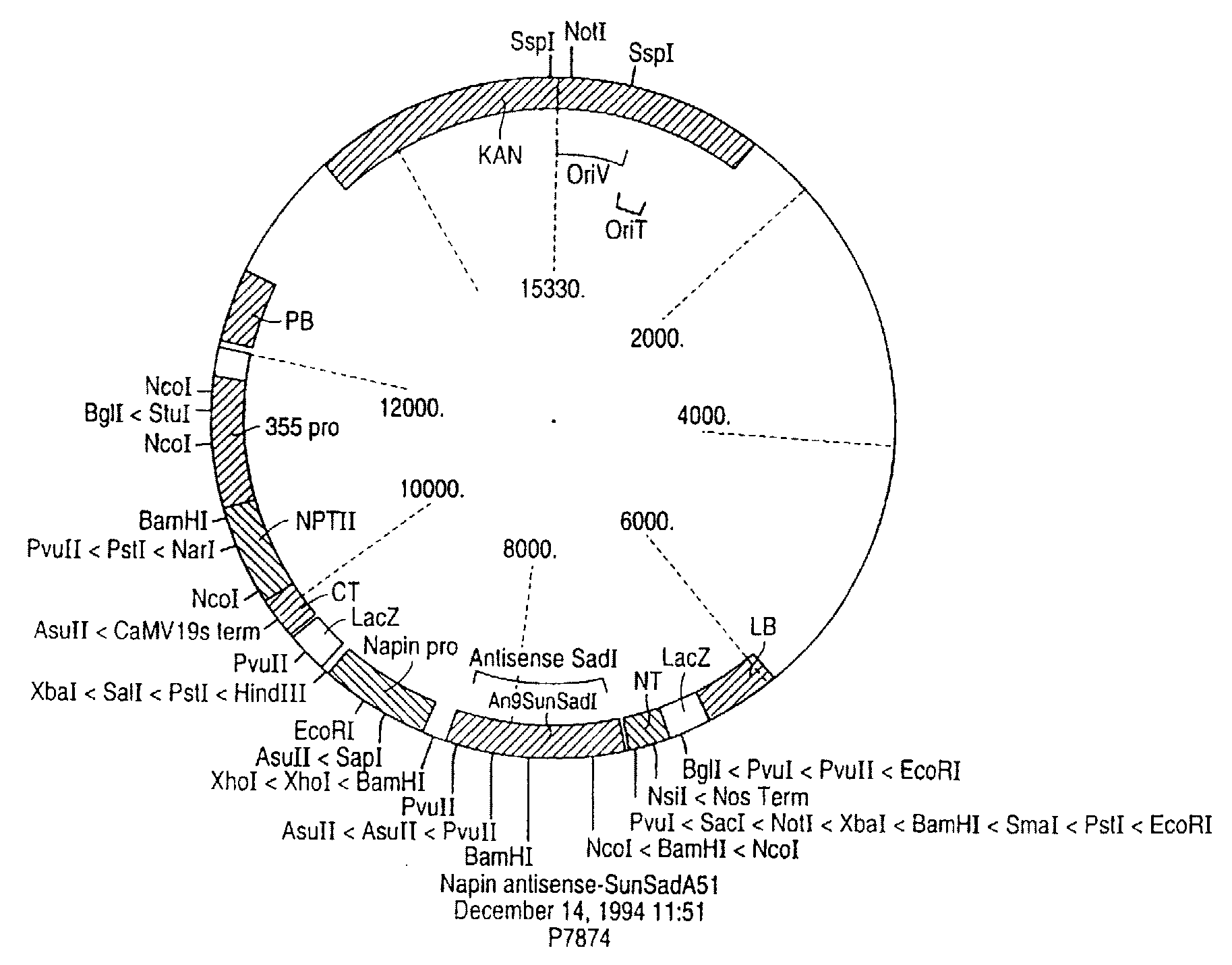
На чертеже показана в схематическом виде карта плазмиды р7874, которую можно использовать для введения фрагмента ДНК в культуру подсолнечника.
Сведения, подтверждающие возможность осуществления изобретения
Установлено, что содержание стеарата в культуре подсолнечника можно повысить путем антисмысловой экспрессии гена,
кодирующего стеароил-АПБ-десатуразы подсолнечника. Установлено также, что содержание пальмитата в культуре подсолнечника можно повысить путем антисмысловой экспрессии гена, кодирующего
стеароил-АПБ-десатуразы подсолнечника. Таким образом, в соответствии с настоящим изобретением предлагается способ повышения содержания стеарата путем трансгенной экспрессии гена, кодирующего
уникальный ДНК-фрагмент, введенный в клетки растения подсолнечника. В предпочтительном варианте, в результате трансгенной экспрессии гена, кодирующего уникальный ДНК-фрагмент, содержание стеарата и
пальмитата, соответственно, повышаются, а содержание олеата уменьшается.
Настоящее изобретение позволяет получить сорт растений подсолнечника в результате скрещивания гомозигот, которые дают семена, имеющие повышенное количество стеарата и пальмитата по сравнению с сортом растения дикого типа. Термин "сорт" означает группу растений в пределах одного вида, которые обладают устойчивыми признаки, которые отделяют их от типичной формы и от других возможных сортов в пределах этого вида. Имея по меньшей мере один отличительный признак, сорт также характеризуется некоторой изменчивостью между отдельными индивидами в пределах данного сорта, основанной главным образом на менделевском расщеплении признаков среди потомства последующих поколений.
Сорт подразумевается "истинно выведенным" по конкретному признаку, если он генетически гомозиготен по этому признаку в такой степени, что когда сорта в результате скрещивания самоопыляются, то среди потомства не наблюдается существенного самостоятельного расщепления признака. В настоящем изобретении, признак проистекает из трансгенной экспрессии гена, кодирующего уникальный ДНК фрагмент, введеннный в сорт растения подсолнечника.
Трансгенный гибридный сорт с пониженной стеароил-АПБ-десатуразной активностью относительно "дикого типа " может быть создан путем его гибридизации с сортом, который является инбредным по антисмысловой экспрессии гена стеароил-АПБ-десатуразы подсолнечника.
В соответствии с настоящим изобретением, конструируют молекулу ДНК, содержащую вектор трансформации/экспрессии, с введением в нее последовательности из гена стеароил-АПБ-десатуразы подсолнечника. Накопленные в настоящее время знания о последовательности генов стеароил-АПБ растения позволяют выделить и клонировать ген подсолнечника в соответствии со стандартной методикой. В особенно предпочтительном варианте, целесообразно использовать клонированный из другого растения ген для скрининга библиотеки кДНК развивающейся семядоли подсолнечника для гена подсолнечника.
Сразу же после выделения гена стеароил-АПБ-десатуразы, копию его последовательности вводят в вектор экспрессии стандартными способами. Выбор соответствующего вектора экспрессии обычно зависит от способа введения вектора экспрессии в клетки-хозяева.
Стандартный вектор экспрессии содержит: прокариотические ДНК-элементы, кодирующие бактериальный сайт инициации репликации и ген устойчивости к антибиотикам для выращивания и отбора экспрессионного вектора в бактериальной клетке-хозяине; сайт клонирования для вставки экзогенной ДНК-последовательности; эукариотные ДНК-элементы, контролирующие инициацию транскрипции экзогенной ДНК-последовательности, например, как промотор и необязательный энхансер; и ДНК-элементы, которые контролируют процессинг транскриптов, например, как участок полиаденилирования/терминации транскрипции. Экспрессионный вектор может также содержать дополнительные последовательности, которые необходимы для обеспечения возможной интеграции вектора в хромосому.
Выбранный участок ДНК клонируют в обратном направлении с осуществлением антисмысловой экспрессии гена стеароил-АПБ-десатуразы. Под термином "антисмысловая экспрессия" подразумевается образование транскрипта из введенного участка ДНК, комплементарного мРНА стеароил-АПБ-десатуразы, эндогенной относительно клетки растения. Антисмысловая экспрессия ДНК-фрагмента приводит к снижению стеароил-АПБ-десатуразной активности по сравнению со степенью активности, характерной сорту подсолнечника перед трансформацией ("дикий тип").
В соответствии с настоящим изобретением, можно использовать фрагмент или полную генную последовательность стеароил-АПБ-десатуразы, ориентированную так, что она образует транскрипт, который комплементарен эндогенной мРНА, кодирующей стеароил-АПБ-десатуразу. В предпочтительном варианте используют полную последовательность, наряду с 3'-концевыми некодирующими последовательностями, которые, как полагают, участвуют в антисмысловом ингибировании. См. Ch'ng и другие, Proc. Naf'l Acad. Sci. USA, 86: р. 10006-10010 (1989).
Сегмент ДНК настоящего изобретения может быть образован естественным путем или синтезирован из известной последовательности. Эту последовательность можно получить путем синтеза кДНК из мРНК. Указанная последовательность может также быть получена из геномной ДНК-последовательности. В предпочтительном варианте эту последовательность получают путем синтеза кДНК из мРНК, кодирующей белок стеароил-АПБ-десатуразы.
Антисмысловая экспрессия ДНК-последовательности находится под контролем промотора. В качестве промоторов можно использовать, например, промотер для небольшой субъединицы рибулоза-1,5-бис-фосфаткарбоксилазы, промотеры из опухоль-индуцирующих плазмид Agrobacterium tumefaciens, например, нопалин-синтазные и октопин-синтазные промоторы и вирусные промоторы, например, промоторы 19S и 35S вируса мозаики цветной капусты (CaMV) или промотер 35S вируса мозаики норичника шишковатого. Промотор может быть конститутивным или индуцируемым. Антисмысловая экспрессия под контролем индуцируемого промотора особенно пригодна для синтеза масла на стадии созревания семян. Особенно предпочтительно использование "тканеспецифического промотора семени", то есть промотора, индуцирующего экспрессию на высоком уровне гетерологичного ДНК-фрагмента в ткани семян, где желателен контроль генов, которые участвуют в метаболизме семени; незначительная экспрессия может иметь место в других частях растения. В качестве примеров известных, тканеспецифических промотеров в семени могут служить соевый промотор β-конглицинина, также известный как белок 7S, который обеспечивает семя-направленную транскрипцию (Bray, Planta, 172: р. 364-370 (1987)), и семя-направленные промотеры из генов зеина эндосперма кукурузы (Pedersen и другие, Cell, 29: р. 1015-1026 (1982)).
Промотеры генов, экспрессируемых на ранней стадии эмбриогенеза и биосинтеза масла, особенно предпочтительны. Нативные регуляторные последовательности, в том числе промотер гена нативной стеароил-АПБ-десатуразы, можно использовать после его выделения специалистом данной области техники. Для использования также пригодны гетерологичные промотеры, полученные из других генов, участвующих в биосинтезе масла в семенах, например такие, как промоторы генов изоцитратлиазы и малатсинтазы Brassica napus, описанные Cornai и другими в журнале Plant Cell, 1: р.293-300, (1989); АПБ Arabidopsis, описанные Post-Beittenmiller и другими в журнале Nucl. Acids Res., 17: р. 1777 (1989); АПБ В. napus, описанные Safford и другими в журнале Eur. J. Biochem. , 174: р.287-295 (1988); и АПБ В. campestris, которые описаны Rose и другими в журнале Nucl. Acids Res., 15: р.7197 (1987). Кроме того, имеются известные последовательности для относительно избыточных белков эноил-АПБ-редуктазы и ацетил-СоА-карбоксилазы, которые можно использовать при выделении традиционными методами промотеров этих генов семени.
Кроме того, наряду с подходящими промоторами можно использовать в объеме данного изобретения один или несколько энхансеров для усиления транскрипции введенного ДНК-фрагмента. Энхансер или энхансероподобный элемент может быть вставлен либо в промотор нативной стеароил-АПБ-десатуразы, либо в другие промотерные конструкции для обеспечения более высокого уровня транскрипции. В качестве таких энхансеров можно ко всему прочему использовать вирусные энхансеры, аналогичные тем, которые введены в промотор 35S по методике Odell и других, Plant Mol. Biol., 10: р.263-272 (1989), и энхансер, полученный из опинового гена по методике, описанной Fromm и другими в журнале Plant Cell, 1: р.977-984 (1989). В случае использования промотора 35S, предпочтительно, чтобы энхансероподобный элемент, связанный с этим промотором, был введен в участок последовательности с прямым тандемным повтором вместе с вирусным промотером 35S мозаики цветной капусты (см. Кау и другие, Science, 236: р. 1299 (1987).
Особенно предпочтительно использование семя-специфического энхансера, например, усиливающий транскрипцию ДНК-фрагмент, выделенный из гена для α субъединицы β-конглицинина. Этот энхансер, который может обеспечить 40-кратное семя-специфическое усиление транскрипции по отношению к конститутивному промотеру, особенно предпочтителен. Специалист в данной области техники может выделить этот генетический элемент и вставить его в промотерный участок, расположенный перед сайтом транскрипции и введенной ДНК последовательностью для получения семя-специфической депрессии стеароил-АПБ десатуразы.
Уровень трансгенной экспрессии введенного ДНК-фрагмента может поддерживаться стабильностью ДНК-фрагмента, наряду с любыми регуляторными промотерами и энхансерами, на хромосоме трансгенного растения. Использование сцепленных гербицидоустойчивых генов в непосредственной близости к встроенному ДНК-фрагменту, позволяет поддерживать давление отбора в популяции трансгенных растений и для тех растений, где указанный ДНК-фрагмент не утрачен.
В соответствии с настоящим изобретением создано трансгенное растение, которое содержит молекулу ДНК, состоящую из элементов, описанных выше, встроенную в геном для обеспечения экспрессии гена стеароил-АПБ-десатуразы. Для создания такого трансгенного растения экспрессионный вектор, несущий ДНК-фрагмент, может быть вставлен в протопласты; в интактные ткани, например, зрелые зародыши и меристемы; в каллюсные культуры или в изолированные клетки. В предпочтительном варианте, векторы экспрессии вставляют в интактные ткани. Общую методику по культивированию растительных тканей предлагает, например, Miki и другие "Procedures for Introducing Foreign DNA into Plants" в книге Methods in Plant Molecular Biology and Biotechnology, p. 67-88 (CRC Press 1993). Способы для введения экспрессионного вектора в ткань растений включают непосредственное инфицирование или совместное культивирование ткани растения с Agrobacterium tumefaciens (Horsch et al., Science, 227: p. 1229 (1965). В предпочтительном варианте, в качестве векторов, несущих последовательности чужеродной ДНК, используют Ti-плазмиду (плазмиду, индуцирующую образование опухоли), не содержащую "спейсерной ножки". Наиболее предпочтительно использование вектора из Agrobacterium с расщепленными эмбриональными эксплантатами, полученного по методике, описанной Malone-Schoneberg и другими в журнале Plant Science, 103: р. 199-207 (1994). Хотя Agrobacterium и является предпочтительным вектором, для трансформации можно использовать другие типы векторов в соответствии с методиками, например, как непосредственный перенос гена, раскрываемых, например, в международной заявке РСТ WO 85/01856 и заявке на Европатент No.0275069; трансформация протопластов in vitro, которая является объектом изобретения, раскрываемым, например, в патенте США No. 4684611; вирус-опосредованная трасформация растений проиллюстрирована в заявке на Европатент No. 067553 и в патенте США No. 4407956; а в патенте США No.4536475, наряду с другими публикациями, раскрыта липосома-опосредованная трансформация растений. В качестве примера имеющихся в настоящее время методов непосредственного переноса генов в клетки растения, можно указать доставку бомбардировкой заряженных микрочастиц, микроинъекции растворимой ДНК и электропорацию (см., например, Gruber и другие, "Vectors for Plant Transformation" в книге Methods in Plant Molecular Biology and Biotechnology (CRC Press 1993); Miki и другие, "Procedures for Introducing Foreign DNA into Plants" в упомянутом выше месте; и Klein и другие, Bio/Technology, 10: р.268 (1992). В предпочтительном варианте осуществления изобретения вектор также содержит ген, кодирующий селектируемый маркер, функционально сцепленный с промоторами, которые обеспечивают контроль инициации транскрипции. Общую информацию по векторам экспрессии генов для растения и репортерных генах см. Gruber и другие "Vectors for Plant Transformation" в книге Methods in Plant Molecular Biology and Biotechnology, p. 89-119 (CRC Press, 1993). Селектируемый маркер используют для выделения трансформированных клеток как положительной генетической селекцией, так и скринингом. Многие из положительно селектируемых маркерных генов, традиционно используемых для трансформации растений, выделены из бактерий, и они кодируют ферменты, которые метаболически обезвреживают избирательный химический агент, который может быть антибиотиком или гербицидом. Другие положительно селектируемые маркерные гены кодируют модифицированную клетку-мишень, которая невосприимчива к ингибитору.
Предпочтительным геном селектируемого маркера, используемого для трасформации растения, является ген неомицин-фосфотрансферазы II (npt-11), выделенной из Тn5, которая сообщает устойчивость клеткам растения к канамицину, когда находится под контролем сигналов регуляторных генов (Fraley и другие, Proc. Nac'l Acad. Sci. USA, 80: р.4803 (1983). В качестве другого пригодного для использования селектируемого маркера можно привести ген гигромицин-фосфотрансферазы, который придает устойчивость клеткам к антибиотику гигромицину (Vanden Elzen и другие, Plant Mol. Biol., 5: р.299 (1985). В качестве дополнительных позитивно селектируемых маркерных генов бактериального происхождения, которые придают клеткам устойчивость к антибиотикам, можно использовать гентамицин-ацетилтрансферазу, стрептомицин-фосфотрансферазу, аминогликозид-3'-аденилтрансферазу и детерминанту устойчивости к блеомицину (Hayford и другие, Plant Physiol., 86: р.1216 (1988); Jones и другие, Mol. Gen. Genet. , 210: р. 86 (1987); Svab и другие, Plant Mol. Biol. 14: p. 197 (1990); Hille и другие, Plant Mol. Biol., 7: p. 171 (1986).
К другим позитивно селектируемым маркерным генам небактериального происхождения, пригодным для трансформации клеток растения, относятся мышиная дигидрофолатредуктаза, растительная 5-енолпирувилшикимат-3-фосфатсинтаза и растительная ацетолактатсинтаза (Eichholtz и другие, Somatic Cell Mol. Genet., 13: р. 67 (1987); Shah и другие, Science 233: р. 478 (1986); Charest и другие, Plant Cell Rep., 8: р. 643 (1990).
Для другого класса маркерных генов, пригодных для трансформации клеток растений с использованием ДНК-последовательности, необходим скорее скрининг предположительно трансформированных клеток, а не прямой отбор трансформированных клеток по генотипу на устойчивость к токсическим веществам, например таких, как антибиотики. Эти гены особенно пригодны для количественного анализа или визуализации пространственной картины экспрессии кодируемой геном ДНК-последовательности в специфических тканях, и их часто называют репортерными генами, поскольку они могут быть слиты с любым геном или регуляторной последовательностью в гене для исследования экспрессии гена. К генам, традиционно используемым для скрининга предположительно трансформированных клеток, относятся β-глюкуронидаза (GUS), β-галактозидаза, люцифераза и хлорамфениколацетилтрансфераза (Jefferson, Plant Mol. Biol. Rep., 5: p. 387 (1987); Teeri и другие, ЕМВО J, вып.8: стр. 343 (1989); Koncz и другие, Proc. Nat'l. Acad. Sci. USA, 84: p. 131 (1987); De Block и другие, ЕМВО J., 3: р. 1681 (1984). В другом методе для идентификации относительно редких случаев наступления события трансформации использовали ген, кодирующий доминантный конститутивный регулятор пути окрашивания антоцианиновым красителем клеток кукурузы Zea mays (Ludwig и другие, Science, 247: р. 449 (1990). После скрининга, трансгенное растение укореняют традиционными методами, хорошо известными специалисту в данной области техники. Предпочтительный метод заключается в укоренении проростков прививкой in vitro регенерированных побегов подсолнечника из расщепленных по оси зародышевых эксплантатов по методике, описанной Paterson в журнале Am. J. Bot. 71: р. 925-31 (1984).
Семена, полученные от трансгенных растений, содержат, согласно настоящему изобретению, повышенное содержание стеарата и пальмитата и пониженное содержание олеата по сравнению с семенами от нетрансформированных растений. Содержание жирных кислот в семенах можно определить стандартными методами, которые известны специалисту в данной области техники. В предпочтительном варианте, экстракты семян подвергают метанолизу, а затем проводят количественый анализ полученных метиловых эфиров жирных кислот методом капиллярной газовой хроматографии по стандартной методике СЕ1Е-91, описанной в книге Американского общества по химии масел "Methods and Recommended Practices of the American Oil Chemistry Society" (The American Oil Chemistry Society, 1995). Содержание стеарата, пальмитата и олеата выражается как % от "общего содержания жирных кислот", то есть суммарное количество 16:0, 16:1, 18:0, 18:1, 18:2 и 18:3 жирных кислот в образце семени. Количества каждой из указанных жирных кислот предпочтительно определяют одновременно при анализе каждого образца семени.
Самое высокое содержание стеарата и пальмитата можно получить антисмысловой экспрессией ДНК-фрагмента, введенного в сорт растения, которое уже дает более высокое количество продукции насыщенных и/или мононасыщенных жирных кислот по сравнению с обычными сортами. В данном контексте предпочтение отдают сорту, который был выведен для получения высокого содержания пальмитата и олеата, например, как гибридный сорт Pioneer® 6661. Особенно предпочтителен сорт, имеющий в семенах масляный компонент, содержащий от 15 до 20% пальмитата и около 70% олеата. Антисмысловая экспрессия введенного в такой сорт фрагмента ДНК приводит к получению подсолнечного масла, содержащего по меньшей мере 20% пальмитата и по меньшей мере 20% стеарата.
Генетическую карту можно создать для трансгенных растений, дающих семена с желаемым жирнокислотным составом. Эту карту можно получить главным образом с помощью традиционного анализа полиморфизма длин рестрикционных фрагментов и полимеразных цепных реакций для идентификации местоположения вблизи хромосом введенного ДНК-фрагмента. В качестве руководства по этому вопросу см., например, Click & Thompson в книге Methods in Plant Molecular Biology and Biotechnology, p. 269-284 (CRC Press, 1993). Данные хромосомной карты используют для надлежащей защиты исследуемого трансгенного растения. В случае попытки несанкционированного разведения и при осуществлении скрещиваний с другой зародышевой плазмой, карту области интеграции можно сравнивать с аналогичными картами подозрительных растений для того, чтобы определить, имеют последние общую родительскую линию с исследуемым растением или нет. Сравнительный анализ результатов картирования обычно включает проведение гибридизации, определение полиморфизма длин рестрикционных фрагментов, полимеразные цепные реакции и секвенирование, каждый из которых относится к традиционным методам.
Настоящее изобретение далее раскрывается со ссылкой на нижеследующие иллюстративные примеры.
Трансформация культуры подсолнечника для получения масличного семени с высокой концентрацией насыщенных жирных кислот
А.
Выделение и клонирование гена стеароил-АПБ подсолнечника
Конструируют библиотеку кДНК развивающейся семядоли подсолнечника (SMF-3) (через 10-20 дней после опыления) в среде UNIZAP® (фирма Stratagene Inc. , La Jolla, CA), полученную из поли А+ избирательной РНК. Амплифицированную библиотеку скринируют с использованием кДНК из бобра, кодирующей стеароил-АПБ-десатуразу,
поставляемую из С. Somerville Мичиганского Государственного университета (East Lansing, Ml). Позитивно гибридизующиеся клоны очищают до гомогенного состояния с проведением повторного скрининга.
Вставки вводят в p-Bluescript SK'. Самую большую вставку длиной 1500 пар оснований секвенируют полностью в обоих направлениях.
Не образующий выростов штамм ЕНА105 из A. tumefaciens, описанный Hood и другими в журнале Transgenic Research, 2: р. 208-218 (1993), трансформируют бинарным плазмидным вектором РНР. 158, несущим Т-ДНК, и используют во всех экспериментах по трансформации (См. Bidney и другие Plant Mol. Biol., 18: р. 301-313 (1992) и Malone-Schoneberg и другие, Plant Science, 103: р. 199-207. Полную последовательность кДНК клонируют в обратном направлении в указанный плазмидный вектор, расположенный по ходу транскрипции напинового промотора, полученного из гена напина Brassica napus. Указанный промотор обеспечивает мощную экспрессию цис-контролируемой генной последовательности в процессе созревания семени. Полученная конструкция, обозначенная как плазмида р7874 (см. чертеж), содержала уникальный промотор 35S и ген NPTII, придающий устойчивость к канамицину.
В. Получение, трансформация эксплантатов и выделение трансгенного растения
Зрелые семечки подсолнечника, полученные из гибридного сорта Pioneer®
6440 или опытной сорта-линии SMF-3, отлущивали от кожуры и поверхность обрабатывали стерилизацией в течение 30 минут в 20% растворе отбеливателя Chlorox® с добавлением к нему 2
капель Твин 20 на 50 мл раствора. Затем семечки ополаскивали дважды дистиллированной водой.
Семечки оставляли на 60 минут в дистиллированной воде для насыщения их влагой с последующей обработкой их поверхности стерилизацией. Семядоли каждой семечки расщепляли вдоль оси зародыша для получения очищенного дробленного кусочка. После отсечения кончика корня эксплантаты разрезали продольно на две половинки между зачаточными листочками. Эти две половинки с поверхностной надсечкой помещали на GBA-среду, содержащую минеральные элементы, полученные по методике Murashige и Skoog, витаминные добавки Shepard, 40 мг/л сульфата аденина, 30 г/л сахарозы, 0,5 мг/л 6-бензиламинопурина, 0,25 мг/л индол-3-уксусной кислоты, 0,1 мг/л гибберелловой кислоты с рН 5, 6, 8 г/л Фитоагара.
Примерно 30-40 эксплантатов помещали одновременно в круг, расположенный в центре чашки размером 60х20 мм для бомбардировки заряженными микрочастицами. Примерно 4,7 мг заряженных микрочастиц вольфрама размером 1,8 мкм ресуспендировали в 25 мл стерильного ТЕ-буфера (10 мМ Tris-CI, 1 мМ ЭДТА, рН 8) и 1,5 мл аликвоты его использовали на каждое бомбардирование. Каждую чашку бомбардировали дважды в ускорителе частиц PDS 1000® через экран Nytex 150 мкм, помещенный на 2 см выше образцов.
Плазмиду р7874 вводили в клетки Agrobacterium tumefaciens методом замораживания-оттаивания, описанного Holsters и другими, Mol. Gen. Genet., 163: р. 181-187 (1978). Бактериальные клетки, используемые для трансформации, выращивали в течение ночи (при 28oС и непрерывном перемешивании со скоростью 100 об/мин) в жидкой YEP-среде (10 г/л дрожжевого экстракта, 10 г/л Бактопептона и 5 г/л NaCl, рН 7.0) в присутствии канамицина. Культуры бактериальных клеток, выращенные в логарифмической фазе роста 0,6, использовали для приготовления 0,6 г суспензии с OD600 в среде для инкубирования, содержащей 12,5 мМ 2-(N-морфолино)этансульфокислоты (MES), 1 г/л NH4Cl и 0,3 г/л MgSO4 при рН 5,7.
Свеже-бомбардированные эксплантаты помещали в суспензию Agrobacterium, перемешивали и выдерживали в течение 30 мин. Эксплантаты затем переносили в GBA-среду с совместным сокультивированием срезов при 26oС в течение 18 дней. Через 3 дня сокультивирования, эксплантаты переносили в среду 374В (GBA-среда, не содержащая регуляторов роста и с пониженным содержанием сахарозы до 1%), дополненную 250 мг/л цефотаксима и 50 мг/л сульфата канамицина. Эксплантаты выращивали в течение 2-5 недель на указанной среде и затем переносили в свеже-приготовленную среду 374В, не содержащую канамицин, и продолжали выращивание в течение 1-2 недель. Эксплантаты, имеющие участки роста клеток с дифференцировкой устойчивости к антибиотикам, которые не давали побегов, пригодных для отсечения, переносили в GBA-среду, содержащую 250 мг/л цефотаксима для второй 3-дневной фитогормональной обработки. Образцы листочков с зеленых канамициноустойчивых побегов анализировали на наличие NPTII-активности (неомицин-фосфотрансферазной активности). Побеги, в которых не было обнаружено NPTII-активности, отбрасывали.
NPTII - положительно реагирующие побеги прививали к корневому побегу гибрида подсолнечника Pioneer® 6440, выращенному in vitro. Семена с обработанной стерилизацией поверхностью проращивали в среде 48-0 (полуразбавленный раствор солей Murashige и Skoog, 0,5% сахарозы, 0,3% гельрита, рН 5,6) и выращивали в условиях, упоминаемых выше для культивирования эксплантатов. Верхушку каждого проростка удаляли, в каждом гипокотиле делали 1-см вертикальный надрез и каждый трансформированный побег вставляли в указанный надрез. Поверхность каждого полученного привоя полностью обвертывали парапленкой для фиксации каждого побега. Привитые растения переносили в почву через 1 неделю выращивания in vitro. Перенесенные в почву растения подращивали в условиях высокой влажности с последующей их постепенной акклиматизацией до тепличных условий.
Трансформированные участки растений Тo (родительское поколение), пророщенные в теплице, идентифицировали путем проведения анализа на наличие NPTII-активности лиственных экстрактов. Трансгенные семена, собранные с NPTII-положительно реагирующих растений Тo, идентифицировали путем проращивания вначале каждого семени и укоренения проростков в теплице, а затем проведением анализа на активность NPTII в ткани листа Т1. Первоначальный жирнокислотный анализ выполняли с использованием кусочков семядолей из популяций семян, полученных от трансгенных растений, подтвержденных данными анализа на активность NPTII в ткани листа Т1. Результаты количественного определения состава семян можно использовать для анализа расщепления популяций по самоскрещенному потомству.
NPTII детектировали с использованием набора для проведения твердофазного иммуноферментого анализа на неомицинфосфотрансферазу, поставляемый фирмой Agdia Inc. (каталог #F730; Elkhart, IN). Тканевые экстракты инкубировали в MWBI-буферном растворе (MES, NaCl, Tween-20, рН 7,2) в лунках микротитровального планшета, покрытого кроличьими анти-NPTII IgG-антителами. Связанную NPTII в образцах экстрактов детектировали путем прибавления меченных пероксидазой кроличьих анти-NPTII специфических IgG-антител с последующей калориметрической реакцией при введении перекиси водорода. Данные полосы поглощения в лунках с образцами при длине волны 450 нм использовали для количественного определения NPTII в исходных экстрактах путем сравнения стандартных кривых изменения NPTII, полученных на основании данных иммуноанализа в аналогичных условиях. Общее содержание белка в каждом анализируемом образце определяли методом Bradford (См. Bradford, Anal. Biochem., 72: р. 248-254 (1976).
ДНК выделяли из зрелых листьев растений подсолнечника, выращенных в теплице модифицированным методом экстракции с использованием гексадецилтриметиленаммонийбромида (СТАВ). Для получения каждого образца ткань листа (2 g) замораживали в геле жидкого азота, растирали в ступке с пестиком и примешивали к 9 мл буфера для экстракции СТАВ (200 мл 1 М Tris, рН 7,5, 20 г СТАВ, 81,76 г NaCl, 40 мл 0,5М ЭДТА, рН 7,5, H2O до конечного объема 21). Затем прибавляли 5 мл смеси хлороформ/октанол (24:1) и полученную смесь перемешивали. Водный слой, полученный после центрифугирования, отделяли и прибавляли 11 мл буфера для осаждения СТАВ (100 мл 1М Tris, рН 7,5, 40 мл 0,5М ЭДТА, рН 7,5, 20 г СТАВ, Н2О) до конечного объема 21). Дебрис, полученный после центрифугирования, растворяли в 2 мл буфера, содержащего 100 мМ Tris, рН 7,5, 10 мМ ЭДТА, рН 7,5 и 0,7М NaCl. Для осаждения ДНК прибавляли 5 мл 95-100% раствора EtOH. ДНК извлекали пипеткой с загнутым стеклянным концом и сначала промывали в 1 мл 76% EtOH, 0,2M ацетата натрия, а затем ополаскивали 1 мл 76% EtOH, 10 мМ ацетата аммония. Дебрис ресуспендировали в ТЕ-буфере до концентрации 0,25 мкг/мкл. ДНК (примерно 10 мг) переваривали 5-10 ед. ДНК Xbal/мг при 37oС в течение 3 часов. Образцы подвергали электрофорезу на 1% агарозном геле и переносили на нейлоновые мемраны для анализа методом Саузерн-гибридизации, описанным в журнале, J. Moi. Biol. , 98: р. 503-517 (1975). Xbal проистекает из антисмысловой экспресии гена напина: SADI плазмиды р7874. Ген NPTTI, как свидетельствуют данные, располагается между Xbal-сайтом и участком Т-ДНК у правой границы. См. карту плазмиды р7874 на чертеже. Точки соединения Т-ДНК с геномной ДНК растения у правой границы устанавливают с использованием расщепления рестриктазой Xbal с последующей гибридизацией с радиоактивно-меченным зондом, полученным произвольным мечением затравки фрагмента NPTII по методике, описанной Feinberg & Vogelstein, Anal. Biochem., 137: р. 266-267 (1984). ДНКазы, выделенные из индивидуального потомства трансгенных растений ТО, анализируют на присутствие в них антисмысловой SADI-ДНК. ДНК растения обрабатывали рестриктазой wi Xbal, переносили на НЦ-мембраны и затем зондировали с использованием радиоактивно-меченного фрагмента гена Napin-Antisunsad I длиной 2300 п.о., полученного мечением с произвольной затравкой антисмыслового SADI-фрагмента по методике, описанной Feinberg & Vogelstein, упоминаемых выше. У потомства определяют антисмысловую ДНК-последовательность. Только одна окрашенная полоса была обнаружена из гибридизационного иммуноанализа с NPTII-зондом, и следовательно антисмысловой ДНК-фрагмент присутствовал только в одной копии.
С. Семена, полученные от трансгенных растений
Было подвергнуто
трансформации 8 растений. Трансгенные семена, полученные от трансформированных растений, содержали повышенное количество стеарата и пониженное количество олеата по сравнению с семенами, полученными от
нетрансформированных растений. В нескольких образцах семян в составе их жирных кислот по меньшей мере 35% составлял стеарат.
Была установлена обратная взаимосвязь между жирнокислотными составами по содержанию стеарата и олеата в семенах трансгенных растений. В жирнокислотных составах семян с самым высоким содержанием стеарата количество олеата составляло менее 5%.
Взаимосвязь между содержанием стеарата и пальмитата в жирнокислотном составе семян была положительной и достоверно значимой. Семена, имеющие жирнокислотный состав с более 30% стеарата, также содержали в среднем 7,8% жирной кислоты в виде пальмитата, при этом среднее содержание насыщенных жирных кислот составляло более 40%. Контрольные, нетрансгенные семена содержали в среднем менее 5,5% жирной кислоты в виде пальмитата.
Реферат
Изобретение относится к биотехнологии, в частности к генной инженерии, и может быть использовано в селекции растений. Фрагмент ДНК, комплементарный эндогенной ДНК, кодирующей стеароил-АПБ-десатуразу, вводят в клетки растения в виде плазмиды р7874. Трасформация растения подсолнечника или его семян ДНК, транскрипт которой компленментарен указанной эндогенной мРНК, приводит к снижению в них стеароил-АПБ-десатуразной активности, что позволяет получать семена подсолнечника с содержанием стеарата 10-40% от общего содержания в них жирных кислот. 3 с. и 6 з.п. ф-лы, 1 ил.

Комментарии