Ген-специфический анализ на fluory2 в маисе для интрогрессии мучнистого признака (fl2) - RU2661110C2
Код документа: RU2661110C2
Чертежи
















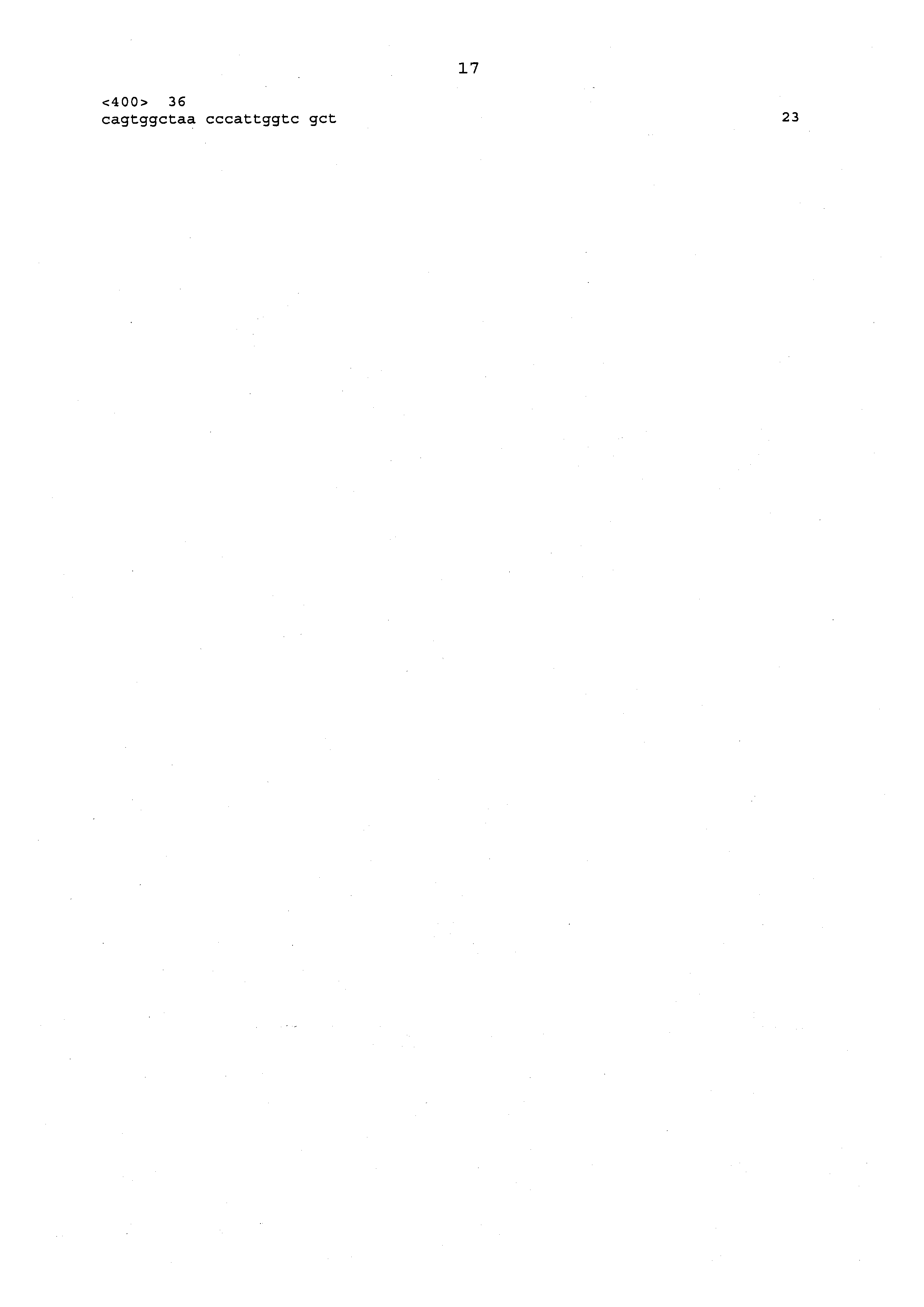

















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по 35 U.S.C. § 119(e) предварительной заявки на патент США No. 61/653287, поданной 30 мая 2012 года, полное содержание которой включено в настоящее описание в полном объеме посредством ссылки.
Включение посредством ссылки материала, представленного в электронном виде
Включено посредством ссылки полное содержание считываемых компьютером списков последовательностей, представленных одновременно c настоящим документом и идентифицированных следующим образом: файл ASCII (текстовый) из 28672 байт под названием "225450_SEQ_LISTING_ST25.txt", созданный 28 мая, 2013.
Область техники, к которой относится изобретение
Открытие в целом относится к отбору растений. Предоставлены способы для определения наличия мутации fl2 и зиготности растений по этой мутации. Способы по открытию пригодны для отбора растений, несущих признак fluory2 (мучнистый, fl2), и для интрогрессии признака fl2 в растения, такие как маис.
Уровень техники, предшествующий изобретению
Кукурузный силос является распространенным кормом для жвачных животных из-за его высокой энергетической ценности и перевариваемости. Кукурузное зерно часто добавляют в составы рациона для улучшения питательного баланса. Твердость и текстура зерна играют важную роль в перевариваемости крахмала. Более мягкое зерно или гибрид, который собирают, когда он является менее зрелым, легче перевариваются в рубце. Встречающиеся в природе мутации маиса, такие как коричневая центральная жилка (BMR), fluory2 (fl2) и opaque2 (непрозрачный, O2) стали целью развития силосного продукта, так как они ассоциированы с более мягким зерном. Зародышевые плазмы BMR, например, снижали содержание лигнина в клеточной стенке. Cherney et al (1991) Adv. Agron. 46:157-98. Растения с мутациями fl2 или O2 вырабатывают мягкий крахмалистый эндосперм с белковыми телами неправильной формы и более высоким содержанием лизина, чем у дикого типа. Coleman et al. (1997) PNAS 94:7094-97. Добавление зерна с мутациями fl2 или O2 в рационы может повысить перевариваемость у жвачных, снижая количество зерна, необходимое для пищевых потребностей, и снижая потребность в обработке зерна при сборе. См. Ladely et al (1995) J. Anim. Sci. 73:228-235.
Признак fluory2 по сообщениям ассоциирован с мутацией в одном из членов семейства генов зеина, главных запасных проламиновых белков в маисовом семени. Song et al. (2001) Gen. Res. 11:1817-25. Интрогрессия мутации fl2 в линии кукурузы является времязатратным процессом. Так как мутантный аллель fl2 является полудоминантным, фенотипирование на основании стекловидности зерна является сложным и часто неоднозначным. Coleman et al. (1997). Быстрый ген-специфический молекулярный анализ необходим для детектирования мутантного аллеля fl2 и определения зиготности в растениях-кандидатах. Этот анализ сильно облегчит затраченные на отбор усилия, снижая время, необходимое для селекции растений с желаемыми свойствами.
Сущность изобретения
В данном документе описаны способы молекулярной характеризации с высокой пропускной способностью на основании ПЦР разновидностей кукурузы fluory2 (например, fl2 мутанты), которые могут значительно улучшить процесс отбора для интрогрессии линий кукурузы, содержащих fl2. Раскрыты способы для определения зиготности образца растительной ткани и, следовательно, растения, из которого был приготовлен образец, определением наличия или отсутствия аллелей fl2 мутанта и альфа-зеина дикого типа. Таким образом, предусмотрен анализ зиготности с флуоресцентным зондом на основании ПЦР (обозначаемый в данном документе как анализ KASPar®), который специфично детектирует и тестирует состояние зиготности в fl2 локусе и приспособлен к различению уникального SNP варианта в гене между сегрегирующими популяциями. Также раскрыта нуклеотидная последовательность, содержащая этот уникальный SNP, и растения и зародышевая плазма, отобранные с применением таких способов.
В конкретном варианте осуществления способ определения зиготности и/или наличия/отсутствия аллеля с применением растительной ткани кукурузы содержит: получение образца выделенной геномной ДНК из растительной ткани кукурузы; приведение выделенной геномной ДНК в контакт с по меньшей мере одной молекулой нуклеиновой кислоты, содержащей нуклеотидную последовательность, способную к гибридизации с SEQ ID NO: 9 в очень жестких условиях и по меньшей мере одной молекулой нуклеиновой кислоты, способной к гибридизации с SEQ ID NO: 10 в очень жестких условиях; и определение зиготности мутации fl2 в выделенной геномной ДНК.
В другом варианте осуществления способ для надежной и предсказуемой интрогрессии признака высокого содержания лизина в растительную зародышевую плазму содержит: скрещивание растения, имеющего мутацию в гене fl2, с другим растением; получение образца выделенной геномной ДНК из растения потомства, полученного скрещиванием; приведение выделенной нуклеиновой кислоты в контакт с по меньшей мере одной молекулой нуклеиновой кислоты, имеющей нуклеотидную последовательность, способную к гибридизации с SEQ ID NO: 10 в очень жестких условиях; и отбор потомства скрещивания, которое содержит мутацию в гене fl2 репродуцированием растения, из которого был получен образец, который связывает по меньшей мере одну молекулу нуклеиновой кислоты с высокой точностью, посредством этого вырабатывая генетически сконструированное растение, где признак высокого содержания лизина был интрогрессирован в зародышевую плазму генетически сконструированного растения.
Краткое описание фигур
Фиг. 1 показывает выравнивание геномных последовательностей α-зеина размером 22 кДа из линии кукурузы дикого типа B73 (B73), линии кукурузы дикого типа 1 (NF7_3), L3430, являющейся общедоступной fluory2 линией кукурузы 1 (L3430), fluory2 линии кукурузы 2 (FF1_1) и fluory2 линии кукурузы 3 (FF2_1). Идентифицированы 72 SNP и 7 InDel.
Фиг. 2 показывает выравнивание предсказанной последовательности белка размером 22 кДа α-зеина из B73, линии 1кукурузы дикого типа (NF7_3), линии 1 кукурузы fluory2 (L3430), линии 2 кукурузы fluory2 (FF1_1) и линии 3 кукурузы fluory2 (FF2_1). Более светлый шрифт указывает замену A на V в сигнальном пептиде 1.
Фиг. 3 показывает анализ данных KLIMS 23 инбредных линий маиса, генотипированных с анализом KASPar® (сигнал FAM для мутантного аллеля в качестве x-оси и сигнал CAL для аллеля дикого типа в качестве y-оси) на основании замены аланина на валин в -1 сигнального пептида.
Фиг. 4 показывает анализ данных KLIMS 23 инбредных линий маиса, генотипированных с анализом KASPar® на основании замены аланина на валин в 39-ой аминокислоте (сигнал FAM для мутантного аллеля в качестве x-оси и сигнал CAL для аллеля дикого типа в качестве y-оси).
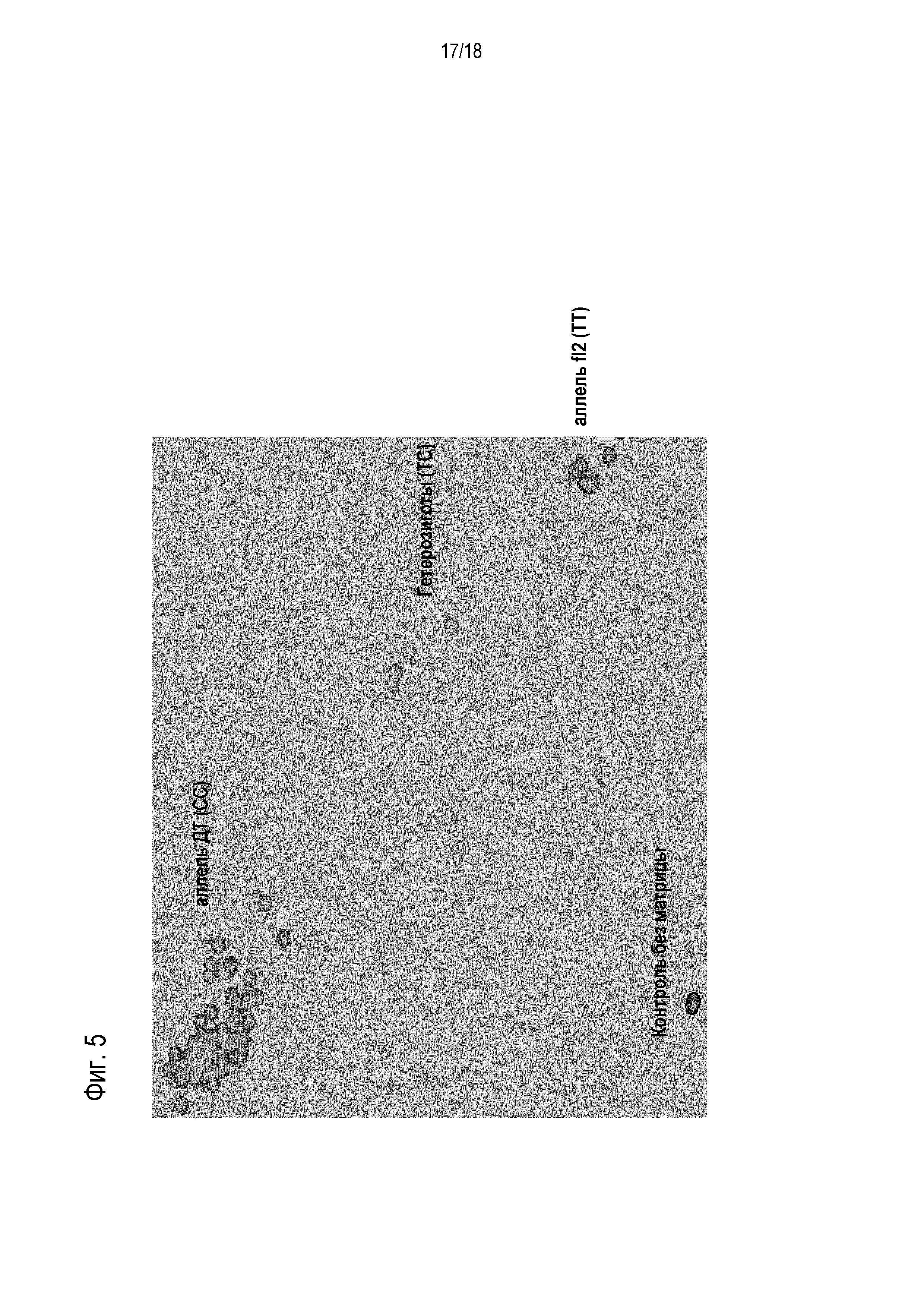
Фиг. 5 показывает тест подтверждения с инбредными линиями маиса, генотипированными с KASPar® анализом на основании замены аланина на валин в 39-ой аминокислоте (сигнал FAM для мутантного аллеля в качестве x-оси и сигнал CAL для аллеля дикого типа в качестве y-оси).
Фиг. 6 показывает проверочный тест с сегрегирующими популяциями, генотипированными с анализом KASPar® (fl2_zygo) на основании замены аланина на валин в 39-ой аминокислоте (сигнал FAM для мутантного аллеля в качестве x-оси и сигнал CAL для аллеля дикого типа в качестве y-оси).
Список последовательностей
Последовательности нуклеиновых кислот, приведенные в прилагаемом списке последовательностей, отображены с применением общепринятых буквенных обозначений для нуклеотидных оснований, как определено в 37 C.F.R. § 1.822. Приведена только одна цепь каждой последовательности нуклеиновой кислоты, но подразумевается, что комплементарная цепь включена посредством любой ссылки на показанную цепь. В прилагаемом списке последовательностей:
SEQ ID NO: 1 показывает последовательность прямого праймера (Zein_68F), применяемого для амплификации гена размером 22 кДа α-зеина B73: GAGATCATGCATGTCATTCCA.
SEQ ID NO: 2 показывает последовательность обратного праймера (Zein_68R), применяемого для амплификации гена α-зеина B73 размером 22 кДа: TTGGTGTTGTTAAGTTCACATGC.
SEQ ID NO: 3 показывает олигонуклеотидную последовательность (Zein_513F) из гена α-зеина, применяемую для секвенирования неполного гена α-зеина B73: AATCCTTGGCACATCTAA.
SEQ ID NO: 4 показывает олигонуклеотидную последовательность (Зеин-23R) из гена α-зеина, применяемую для секвенирования неполного гена α-зеина B73: TAGGTGGCTCAGTGATGGCAGAA.
SEQ ID NO: 5 показывает олигонуклеотидную последовательность (385_R) из гена α-зеина, применяемую для секвенирования неполного гена α-зеина B73: CTAAAAGATGGCACCTCCAA.
SEQ ID NO: 6 показывает последовательность аллель-специфического праймера (A1).
SEQ ID NO: 7 показывает последовательность аллель-специфического праймера (A2).
SEQ ID NO: 8 показывает последовательность общего (обратного) праймера (C1).
SEQ ID NO: 9 показывает нуклеотидную последовательность гена α-зеина размером 22 кДа из растительной линии B73.
SEQ ID NO: 10 показывает нуклеотидную последовательность гена α-зеина размером 22 кДа из растительной линии L34340.
SEQ ID NO: 11 показывает нуклеотидную последовательность гена α-зеина размером 22 кДа из растительной линии FF2_1.
SEQ ID NO: 12 показывает нуклеотидную последовательность гена α-зеина размером 22 кДа из растительной линии FF1_1.
SEQ ID NO: 13 показывает нуклеотидную последовательность гена α-зеина размером 22 кДа из растительной линии NF7_3.
SEQ ID NO: 14 показывает предсказанную аминокислотную последовательность гена α-зеина из растительной линии B73.
SEQ ID NO: 15 показывает предсказанную аминокислотную последовательность гена α-зеина из растительной линии L34340.
SEQ ID NO: 16 показывает предсказанную аминокислотную последовательность гена α-зеина из растительной линии FF2_1.
SEQ ID NO: 17 показывает предсказанную аминокислотную последовательность гена α-зеина из растительной линии FF1_1.
SEQ ID NO: 18 показывает предсказанную аминокислотную последовательность гена α-зеина из растительной линии NF7_3.
SEQ ID NO: 19 показывает последовательность праймера A1-1.
SEQ ID NO: 20 показывает последовательность праймера A2-1.
SEQ ID NO: 21 показывает последовательность праймера C1-1.
SEQ ID NO: 22 показывает последовательность праймера A1-2.
SEQ ID NO: 23 показывает последовательность праймера A2-2.
SEQ ID NO: 24 показывает последовательность праймера C1-2.
SEQ ID NO: 25 показывает последовательность праймера A1-3.
SEQ ID NO: 26 показывает последовательность праймера A2-3.
SEQ ID NO: 27 показывает последовательность праймера C1-3.
SEQ ID NO: 28 показывает последовательность праймера A1-4.
SEQ ID NO: 29 показывает последовательность праймера A2-4.
SEQ ID N0:30 показывает последовательность праймера C1-4.
SEQ ID NO: 31 показывает последовательность праймера A1-5.
SEQ ID NO: 32 показывает последовательность праймера A2-5.
SEQ ID NO: 33 показывает последовательность праймера C1-5.
SEQ ID NO: 34 показывает последовательность праймера A1-6.
SEQ ID NO: 35 показывает последовательность праймера A2-6.
SEQ ID NO: 36 показывает последовательность праймера C1-6.
Подробное описание изобретения
I. Обзор некоторых вариантов осуществления
В данном документе раскрыты способы ген-специфических молекулярных анализов на основании ПЦР для детектирования наличия признака fluory2 (fl2) в маисе.
В вариантах осуществления в данном документе способ может раскрывать способ определения зиготности растения в отношении мутантных аллелей fl2.
Варианты осуществления в данном документе описывают клонирование гена α-зеина из разнообразных линий маиса. В некоторых вариантах осуществления идентифицированы некоторые мутации, ассоциированные с мучнистым фенотипом.
В предпочтительном варианте осуществления описан ген-специфический анализ в отношении признака fl2. В конкретных вариантах осуществления описан способ для применения ген-специфического анализа в отношении fl2 для отбора растительной зародышевой плазмы.
В некоторых вариантах осуществления описан способ для применения ген-специфического анализа в отношении fl2 для облегчения интрогрессии мутантного гена fl2. Интрогрессия fl2 не является такой затруднительной, как для O2.
II. Сокращения
III. Термины
Положение основания: "положение основания" в применяемом в данном документе значении, относится к расположению данного основания или нуклеотидного остатка в обозначенной нуклеиновой кислоте. Обозначенная нуклеиновая кислота может быть определена выравниванием (см. далее) с референсной нуклеиновой кислотой.
Элитная линия: в применяемом в данном документе значении термин "элитная линия" обозначает любую линию, которую получили в результате отбора и селекции на превосходящую агрономическую продуктивность. Элитное растение является любым растением из элитной линии.
Интрогрессия: в применяемом в данном документе значении относится к геномному сегменту, который был перенесен из одного индивида, видов, разновидности или культивара в геном другого индивида, видов, разновидности или культивара скрещиванием этих индивидов, видов, разновидностей или культиваров. В применяемом в данном документе значении термины "интрогрессирование", "интрогрессировать" и "интрогрессирован" относятся как к природному, так и к искусственному процессу, посредством которо
го гены индивида или целые признаки переносятся от одних индивида, видов, разновидности или культивара в геном других видов, разновидности или культивара посредством скрещивания этих видов, разновидностей или культиваров. В отборе растений процесс обычно содержит самоопыление или обратное скрещивание с рекуррентным родителем для обеспечения в возрастающей степени гомозиготного растения, имеющего по существу характеристики рекуррентного родителя в добавление к интрогрессированному гену или признаку.
Линия: в применяемом в данном документе значении "линия" или "растительная линия " относится к группе растений, которые проявляют небольшую генетическую вариативность (например, нет генетической вариативности) между индивидами по меньшей мере по одному признаку. Инбредные линии могут быть созданы несколькими генерациями самоопыления и селекцией или альтернативно вегетативным размножением от одного родителя с применением технологий тканевого или клеточного культивирования. В применяемом в данном документе значении термины "культивар", "разновидность" и "тип" являются синонимическими и эти термины относятся к линии, которая применяется для коммерческого производства.
Молекула нуклеиновой кислоты: в применяемом в данном документе значении, термин "молекула нуклеиновой кислоты" (или "нуклеиновая кислота" или "полинуклеотид") могут относиться к полимерной форме нуклеотидов, которые могут содержать как смысловые, так и антисмысловые цепи РНК, кДНК, геномной ДНК и синтетические формы и смешанные полимеры приведенного выше. Нуклеотид может относится к рибонуклеотиду, дезоксирибонуклеотиду или модифицированной форме любого типа нуклеотида. "Молекула нуклеиновой кислоты" в применяемом в данном документе значении является синонимической "нуклеиновой кислоте" и "полинуклеотиду". Молекула нуклеиновой кислоты обычно имеет по меньшей мере 10 оснований в длину, если не указано иное. Термин может относиться к молекуле РНК или ДНК неопределенной длины. Термин содержит одно- и двухцепочечные формы ДНК. Молекула нуклеиновой кислоты может содержать любой из двух или оба вместе из встречающихся в природе и модифицированных нуклеотидов, связанных вместе встречающимися в природе и/или не встречающимися в природе нуклеотидными связями.
Олигонуклеотид: олигнуклеотид является коротким полимером нуклеиновой кислоты. Олигонуклеотиды могут быть образованы расщеплением более длинных сегментов нуклеиновой кислоты или полимеризацией индивидуальных прекурсоров нуклеотидов. Автоматизированные синтезаторы позволяют синтез олигонуклеотидов вплоть до нескольких сотен пар оснований в длину. Так как олигонуклеотиды могут связаться с комплементарной нуклеотидной последовательностью, они могут быть применены в качестве зондов для детектирования ДНК или РНК. Олигонуклеотиды, составленные из ДНК (олигодезоксирибонуклеотиды), могут быть применены в ПЦР, технологии для амплификации небольших последовательностей ДНК. В ПЦР олигнуклеотид, как правило, называемый "праймер", позволяет ДНК полимеразе удлинить олигнуклеотид и реплицировать комплементарную цепь.
Идентичность последовательности: термин "идентичность последовательности" или "идентичность" в применяемом в данном документе значении в контексте двух последовательностей нуклеиновых кислот или полипептидов может относиться к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании для максимального соответствия на протяжении установленного окна сравнения.
В применяемом в данном документе значении термин "процент идентичности последовательности" может относиться к величине, определяемой сравнением двух оптимально выровненных последовательностей (например, последовательности нуклеиновой кислоты, аминокислотные последовательности) на протяжении окна сравнения, в котором участок последовательности в окне сравнения может содержать дополнения или делеции (т.е., разрывы) по сравнению с референсной последовательностью (которая не содержит дополнения или делеции) для оптимального выравнивания двух последовательностей. Процент рассчитывают определением количества положений, в которых идентичный нуклеотидный или аминокислотный остаток имеется в обеих последовательностях с получением процента идентичности последовательности посредством деления количества совпадающих положений на общее количество положений в окне сравнения и умножения результата на 100.
Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Различные программы и алгоритмы выравнивания описаны, например в: Smith and Waterman (1981) Adv. Appl. Math. 2:482; Needleman and Wunsch (1970) J. Mol. Biol. 48:443; Pearson and Lipman (1988) Proc. Natl. Acad. Sci. U.S.A. 85:2444; Higgins and Sharp (1988) Gene 73:237-44; Higgins and Sharp (1989) CABIOS 5:151-3; Corpet et al. (1988) Nucleic Acids Res. 16:10881-90; Huang et al. (1992) Comp. Appl. Biosci. 8:155-65; Pearson et al. (1994) Methods Mol. Biol. 24:307-31; Tatiana et al. (1999) FEMS Microbiol. Lett. 174:247-50. Подробное рассмотрение способов выравнивания последовательностей и расчетов гомологии можно найти, например, в Altschul et al. (1990) J. Mol. Biol. 215:403-10.
Основное средство поиска локального выравнивания (Basic Local Alignment Search Tool, BLAST™; Altschul et al. (1990)) Национального центра биотехнологической информации (NCBI) доступно из нескольких источников, включая Национальный центр биотехнологической информации (Bethesda, MD), и в интернете для применения вместе с некоторыми программами для анализа последовательности. Описание того, как определить идентичность последовательности с применением этой программы доступно в интернете в разделе "помощь" для BLAST™. Для сравнений последовательностей нуклеиновой кислоты может быть применена функция "Blast 2 последовательности" программы BLAST™ (Blastn) с использованием параметра по умолчанию. Последовательности нуклеиновых кислот даже с большим сходством с референсной последовательностью будут демонстрировать возрастающий процент идентичности при оценке этим способом.
Однонуклеотидный полиморфизм (Single nucleotide polymorphism, SNP): в применяемом в данном документе значении термин "однонуклеотидный полиморфизм" может относиться к вариации последовательности ДНК, происходящей, когда одиночный нуклеотид в геноме (или другая совместная последовательность) отличается между членами видов или спаренными хромосомами у индивида.
Признак или фенотип: термины "признак" и "фенотип" в данном документе применяются взаимозаменяемо. В целях данного открытия признаком, представляющим особый интерес, является цвет покрытия семени. Некоторые разновидности проявляют желтое покрытие семени, тогда как другие дополнительные разновидности проявляют темное (например, черное, темное и пятнистое) покрытие семени.
Зеин: в применяемом в данном документе термин "зеин" будет относится к любому члену класса генов и продуктам их гена, фрагментам гена, неполным генам, белковым продуктам и РНК продуктам в или производным из зеинового суперсемейства в маисе и других растениях. Зеины могут содержать следующие известные классы или члены семейств: α-зеины, β-зеины, γ-зеины и δ-зеин. В вариантах осуществления представлены ген α-зеина, сегмент гена, неполный ген или его белковые или РНК продукты.
Зиготность: в применяемом в данном документе значении термин "зиготность" относится к сходству или его отсутствию аллелей гена для наследственного признака в организме. Если оба аллеля являются одинаковыми, организм является "гомозиготным" по этому признаку. Если оба аллеля являются различными, организм является "гетерозиготным" по этому признаку. Если один аллель отсутствует, он является "гемизиготным". Если оба аллеля отсутствуют, он является "нуль-зиготным".
Если особо не указано иное, все технические и научные термины, применяемые в данном документе, имеют такое же значение как общепринято среди рядовых специалистов в области, к которой относится данное открытие. Определения общепринятых терминов в молекулярной биологии можно найти, например, в Lewin B., Genes V, Oxford University Press, 1994 (ISBN 0-19-854287-9); Kendrew et al. (eds.), The Encyclopedia of Molecular Biology, Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); and Meyers R.A. (ed.), Molecular Biology and Biotechnology: A Comprehensive Desk Reference, VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
Если особо не указано иное, при применении в данном документе терминов в единственном числе подразумевается по меньшей мере один.
Все ссылки, включая публикации, патенты и патентные заявки, приведенные в данном документе, настоящим включены посредством ссылки при условии, что они не противоречат приведенным подробностями данного открытия, и таким образом они включены в той же степени, как если бы для каждой ссылки было указано, что она индивидуально и специфично включена в данный документ в полном объеме посредством ссылки. Ссылки, обсуждаемые в данном документе, предоставлены только для их раскрытия перед датой регистрации данной заявки. Ничего в данном документе не должно истолковываться как признание того, что изобретатели не обозначили открытие более ранним числом на основании предшествующего открытия.
IV. Ген-специфический молекулярный анализ для определения генотипа и зиготности fl2
A. Обзор
В данном документе описан ген-специфический молекулярный анализ для характеризации признака fluory2 (fl2) в растениях. В конкретных примерах применяется система для анализа KASPar® на основании ПЦР для детекции специфической мутации fl2, и сравнения с соответствующей последовательностью дикого типа в том же анализе. В некоторых примерах зиготность растения может быть определена по наличию или отсутствию мутантного аллеля fl2 и аллеля α-зеина дикого типа. Конкретные примеры описывают единственную замену аланина на валин в 39 аминокислотном положении, которая может быть применена для молекулярной характеризации. Этот анализ может дифференцировать мутантный аллель fl2 от аллеля дикого типа, и он был подтвержден с сегрегирующим популяциями. В примерах анализ может быть применен для интрогрессии требуемого признака, такого как признак fluory2, в растительные линии, несущие другие желаемые свойства. Этот маркер/анализ на генной основе будет мощным средством для ускорения процессов молекулярного отбора с fl2.
B. Кукуруза fluory2 (fl2)
Зеины являются главными запасными проламиновыми белками в маисовых семенах, синтезируются, начиная с 10 по 45 день после опыления, и представляют 60-70% общего белка семени. Coleman et al. (1997); Kodrzycki et al. (1989) Plant Cell 1:105-114. Зеиновые белки дикого типа являются обогащенными глутамином и пролином, но имеют недостаток лизина и триптофана, что делает зерно бедным питательными веществами, особенно для моногастрических животных. Coleman (1995) PNAS 92:6828-31.
Выделяют четыре различных класса зеиновых белков, классифицируемых как α-, β-, γ- и δ-зеин. Coleman et al. (1997). Альфа зеины, наиболее распространенный класс, имеют размер 19 и 22 кДа. Hagen and Rubenstein (1981) Gene 13(3):239-49. Song et al. выделили и секвенировали все 23 члена альфа семейства генов зеина размером 22 кДа из маиса. (2001) Gen. Res. 11:1817-25. Двадцать два гена α-зеинов расположены в тандемном повторе на коротком плече хромосомы 4S, с двадцать третьим геном, расположенным в проксимальном расположении на той же хромосоме. Song (2001). Как сообщается, только семь из этих генов являются экпрессируемыми на основании профилей кДНК, с экпрессируемыми генами, рассеянными среди неэкпрессируемых генов. Song (2001).
Признаки fluory2 (fl2) и opaque2 (O2) в маисе ассоциированы с более мягким зерном с почти двойным содержанием лизина по сравнению с обычным маисом и повышенной перевариваемостью у жвачных и куриц. Nelson et al. (1965) Science 150:1469-70. Курицы, вскармливаемые с fl2, растут быстрей. Cromwell et al. (1968) Poul. Sci. 57:840-47. Телята, вскармливаемые с кукурузной диетой с высоким содержанием лизина, на 10% производительны и разлагают сырой белок на 27% быстрей, чем телята, вскармливаемые обычной кукурузой. Ladely et al. (1995) J. Anim. Sci. 73:228-35. Из-за мягкого зерна семена fluory2 подвержены механическому разрушению, что делает их подверженными воздействию насекомых и грибов, но интрогрессия аллеля fl2 в растительные линии, несущие другие желаемые свойства, может облегчить эту проблему.
Фенотип fluory2 вызван мутациями в семействе генов зеина. Coleman et al. (1997) PNAS 94:7094-97. Аллель дикого типа, ассоциированный с мутацией fl2, является одним из экпрессируемых генов альфа зеина. Coleman et al. идентифицировали замену аланина на валин в -1 положении сигнального пептида (a [T/C] SNP) в 22-кДа гене альфа зеина маиса, как ответственную за мутацию fl2. (1995 и 1997). Сигнальный пептид обычно направляет альфа зеиновый белок в просвет шероховатого эндоплазматического ретикулума (RER). Мутация предотвращает расщепление сигнального пептида и приводит в результате к зрелому белку, который на 2 кДа больше чем ожидалось. Дефектный 24 кДа белок запускает неправильную сборку и упаковку семейства зеиновых белков во время развития эндосперма, приводя к уменьшению синтеза запасных проламиновых белков и накоплению лизина. Coleman et al. (1997).
C. Фенотипическая селекция в отношении признака fluory2
Производители предприняли попытку ввести fl2 и O2 мутации в высокоэффективные линии BMR, но отбор этих мутантов являлся затруднительным. Стекловидность может быть применена фенотипической селекции в отношении мутаций, которые влияют на непрозрачность маисового зерна, включая мутации fl2 и O2. К сожалению, стекловидность также подвергалась воздействию морфологии и естественному обесцвечиванию зерна, что делает фенотипическую характеризацию с применением светонепроницаемого ящика времязатратной и зачастую обманчивой. Фенотипическая селекция в отношении O2 также является затруднительной из-за наличия множества генов-модификаторов. Holding et al. (2010) Theor. App. Gen. 122:783-94. Мутантный аллель fl2 является полудоминантным, с трудностью фенотипа, определяемой количеством копий мутантного аллеля. Эндосперм маиса содержит две копии генетического материала от материнской особи и одну копию от отцовской особи. Фенотип семян потомства, таким образом, значительно варьируется, в зависимости от какого родителя происходит мутантный аллель fl2.
D. Молекулярный детекционный анализ
Ген-специфические молекулярные анализы в отношении признаков BMR и fl2 могли бы значительно облегчить программы для производства силоса с низким содержанием лигнина и мягким зерном посредством улучшения точности селекции и уменьшения цикла отбора. Ген-специфический анализ ранее был разработан для коричневой центральной жилки 1 (bml) и коричневой центральной жилки 3 (bm3), но ранее не был доступен никакой ген-специфический анализ для мутации fl2.
В экспериментах 22-кДа ген α-зеина клонировали и секвенировали из двух доноров fluory2, происходящих из линий J15 и Oh-43, так же как и из инбредной линии маиса дикого типа. SNP мутацию в -1 положении подтверждали и выполняли анализы зиготности. Однако в этом анализе не удалось дифференцировать мутанты от дикого типа из-за высокой гомологии генов зеинового семейства. Была обнаружена единственная замена аланина на валин в 39 аминокислотном положении. Разрабатывали молекулярный анализ, нацеленный на ассоциированные SNP, и было обнаружено, что он был пригоден для дифференциации мутантного аллеля fl2 от аллеля дикого типа. Достоверность анализа подтверждали сегрегирующими популяциями.
В данном документе описан ген-специфический ПЦР анализ KASPar®, пригодный в целом для анализа зиготности fl2 кукурузы или предполагаемой fl2 кукурузы. В конкретных вариантах осуществления ген (аллель)-специфический ПЦР анализ KASPar® может быть применен для анализа зиготности кукурузы в отношении мутации fl2. В вариантах осуществления ген-специфический анализ может обеспечить высокопроизводительную систему и способ для быстрого скринирования растения в отношении выбранного генотипа, включая, например, признак fluory2 (fl2). В некоторых из этих вариантов осуществления, например, микроматричная система или луночный планшет, содержащий 96, 384 или 1536 образцов в лунках, могут подвергаться анализу одновременно.
Праймеры и зонды для применения в ген-специфическом ПЦР анализе KASPar® могут быть сконструированы на основании известной мутации в гене, представляющем интерес. Мутация может являться, например, однонуклеотидным полиморфизмом (SNP), или вставкой, или делеционной мутацией. В некоторых вариантах осуществления праймеры и зонды для fl2-специфического анализа могут быть сконструированы на основании SNP (C/T) в нуклеотиде 495, который ассоциирован с заменой аланина на валин в -1 сигнального пептида гена fl2. В предпочтительном варианте осуществления праймеры и зонды могут быть сконструированы на основании SNP, ассоциированного с заменой аланина на валин в положении 39 аминокислоты в гене. В некоторых вариантах осуществления ген-специфический ПЦР анализ KASPar® может быть направлен на другие мутации, которые могут быть ассоциированы с признаком, представляющим интерес, таким как признак fluory2.
В вариантах осуществления два аллель-специфических праймера могут быть применены с одним общим (обратным) праймером для селективной амплификации аллель-специфического фрагмента гена fl2. В некоторых вариантах осуществления fl2-специфический анализ амплифицирует фрагмент, который является единственным для одной аллельной формы fl2, такой как аллель, несущий C/T SNP в положении 495. В некоторых вариантах осуществления мишень-специфический олигнуклеотидный зонд гибридизуется в очень жестких условиях с целевой последовательностью в образце геномной ДНК между двумя праймерами для ПЦР.
Мишень-специфические олигонуклеотиды могут быть помечены, например, флуоресцентными красителями (например, FAM, VIC, и MGBNFQ), что может позволить быстрое количественное определение мишень-специфического флуоресцентного сигнала. Продукты ПЦР могут быть измерены после заранее определенного количества циклов, например, когда реакция находится в ранней экспоненциальной фазе. Негативные контрольные образцы могут содержать геномную ДНК из любой разновидности, например, без мутации fl2. Позитивные контрольные образцы могут содержать геномную ДНК из разновидности кукурузы с известной мутацией fl2. Контрольные гемизиготные образцы могут содержать или геномную ДНК из разновидности кукурузы, которая, как было определено заранее, является гемизиготной по отношению к мутации fl2; или гемизиготный образец может содержать равные соотношения негативных контрольных ДНК к ДНК из разновидности кукурузы, которая, как было определено заранее, является гемизиготной по отношению к fl2.
ДНК может быть выделена (например, экстрагирована и очищена) из растительной ткани кукурузы способами, известными специалисту в данной области. Коммерческие наборы выделения ДНК доступны, например, у Qiagen, Inc. В некоторых вариантах осуществления листовые диски конкретного растения перфорируют и их переносят в пробирки для сбора. Перфоратор может быть подвержен очистке после каждого пробоотбора с 70% спиртом, промывке в воде и сушке. ДНК буферы для экстракции могут быть приготовлены в соответствии с рекомендациями производителя. Затем ДНК может быть выделена с применением набора в соответствии с рекомендациями производителя. В заключение, концентрация выделенной ДНК может быть определена с применением, например, Quant-iT™ PicoGreen® Quantfication Kit (Invitrogen, Carlsbad, CA) и спектрофотометра, или любой другой пригодной технологии.
Так как праймеры, зонды и образец(ы) геномной ДНК были приготовлены или иным образом подготовлены к использованию, конкурирующий аллель-специфический ПЦР анализ (KASPar®) может быть выполнен с применением коммерческого программного обеспечения, такого как диспетчер потока операций Dow AgroSciences Kraken workflow manager, доступного у KBiosciences (KBiosciences, Hoddesdon, Hertfordshire, UK) для идентификации последовательностей нуклеиновых кислот, представляющих интерес (например, последовательности, соответствующие мутации fl2) в образце(ах) геномной ДНК. В конкретных вариантах осуществления готовят отдельные реакционные смеси для ПЦР, которые содержат все реакционные компоненты, за исключением образца(ов) геномной ДНК. Для реакции KASPar®, содержащей праймеры и ген-специфические зонды для fl2 мутантной и кукурузы дикого типа, реакционная смесь может содержать смесь для анализа, содержащую два аллель-специфических (прямых) праймера, общий (обратный) праймер, буфер, реакционную смесь, 50 мМ MgCl2 и воду. К этой смеси может быть добавлена геномная ДНК, и ПЦР циклы могут быть инициированы в соответствии со стандартными протоколами для амплификации фрагментов, представляющих интерес.
В некоторых вариантах осуществления анализ ПЦР (например, KASPar®) может быть установлен с соответствующими контролями. Например, реакция в многолуночном планшете может быть выполнена с контрольными лунками содержащими: (1) негативный(ые) контроль(и) с реагентами, но без ДНК образца; (2) гомозиготный(ые) позитивный(ые) контроль(и), содержащий(ие) геномной ДНК fl2 кукурузы; (3) и гемизиготный(ые) позитивный(ые) контроль(и), как описано выше. Затем ДНК амплифицируют посредством ПЦР при пригодных условиях цикла. Например, в некоторых вариантах осуществления с применением GenAmp® PCR System 9700, может иметь место один первоначальный цикл денатурации при 94°C в течение 15 минут, затем 20 циклов денатурации (94°C в течение 10 секунд) и отжиг (57°C в течение 5 секунд) и удлинение (72°C в течение 40 секунд), с последующими 22 дополнительными циклами с более длительным отжигом (денатурация при 94°C в течение 10 секунд; отжиг при 57°C в течение 20 секунд, удлинение при 72°C в течение 40 секунд). Специалист в данной области признает, что условия цикла ПЦР могут варьироваться в соответствии с индивидуальным решением практикующего специалиста или специфическими последовательностями задействованного праймера/олигнуклеотида, с получением сопоставимых результатов.
E. Определение генотипа и/или зиготности признака fluory2 (fl2)
Молекулярный анализ на генной основе (аллель-специфический) может быть применен для анализа генотипа и/или зиготности растения. В некоторых вариантах осуществления уникальные SNP могут быть помечены с применением системы для анализа на основании ПЦР KASPar®. В предпочтительном варианте осуществления SNP, который является меченным, может быть ассоциирован с заменой аланина на валин в положении аминокислоты 39 гена α-зеина размером 22 кДа. Для анализов с применением способа KASPar® ПЦР продукты могут быть подвергнуты анализу с применением флуорометрического детектирования. Например, флуоресцентный краситель может быть измерен с длиной волны возбуждения 485 нм и длиной волны излучения 520 нм для флуоресцентного сигнала FAM и 520 нм и 560 нм для CAL.
После окончания ПЦР реакции и детектирования зонда могут быть созданы таблица и график распределения с применением, например, любого пригодного программного обеспечения для компьютерной графики. Результаты, полученные с ДНК дикого типа, гемизиготной и гомозиготной ДНК схожих и/или известных генотипических окружений, могут служить в качестве позитивных или негативных контролей. В сегрегирующей популяции могут быть получены три кластера точек данных, позволяющие визуальное определение результата образца, как вероятно принадлежащего одному из сегрегированных кластеров. Альтернативно, компьютерное программное обеспечение для анализа данных может быть применено для расчета вероятности того, что результат образца принадлежит каждому одному сегрегированному кластеру, с наиболее вероятным кластером, служащим в качестве обозначения образца. Когда визуальное определение осуществлено, граница каждого кластера может быть произвольной, например, когда три кластера точек данных явно различимы.
Необработанные данные интенсивности флуоресценции могут также быть проанализированы непосредственно из планшет-ридера с применением пригодного пакета аналитических программ, таких как KLIMS (KBioscience laboratory information management system). Может быть построен график с относительными единицами флуоресценции (ОЕФ) флуоресцентного сигнала, вырабатываемого специфическим зондом на мутантный аллель, отложенными по одной оси, и ОЕФ флуоресцентного сигнала, вырабатываемого специфическим зондом на аллель дикого типа, отложенными по другой оси. Затем могут быть выполнены определения зиготности на основании разделения кластеров на графическом отображении данных.
Образцы, которые не содержат мутантную геномную ДНК (например, мутация BMR), могут только привести к флуоресцентным показаниям ПЦР продукта дикого типа. Образцы, содержащие гемизиготную или гомозиготную мутантную геномную ДНК, могут привести к ОЕФ показаниям для мутант-специфического зонда выше чем показания негативного фонового контроля. Если образец не приводит к приемлемым результатам, возможно геномная ДНК в образце не имеет приемлемое качество и/или размер, и должно быть выполнено новое приготовление ДНК и/или новая ПЦР реакция. Предпочтительно, негативный контрольный образец, не содержащий ДНК образец, показывает очень низкое детектирование ген-специфического(их) зонда(ов). Также предпочтительно, чтобы известные гомозиготные контроли демонстрировали только высокое детектирование мутантной или ДНК дикого типа в контроле, и чтобы известные гемизиготные контроли демонстрировали высокое детектирование как мутантной, так и ДНК дикого типа.
"Пробное испытание" ПЦР способа и определение генотипа и/или зиготности может быть выполнено со всеми соответствующими контролями перед скринированием образцов. Дополнительная оптимизация способов может быть желательна для компонентов, которые могут отличаться в применениях (например, способ приготовления геномной ДНК, ДНК полимераза Taq, олигонуклеотиды, лабораторное оборудование и т.д.). Условия ПЦР и термоциклирования могут быть установлены так, чтобы амплифицировать мутантные и/или последовательности дикого типа по известной матрице геномной ДНК с приемлемыми уровнями детектирования зонда (например, приемлемый ОЕФ флуоресцентно меченых олигнуклеотидных зондов).
VI. Интрогрессия признака высокого содержания лизина в растительную зародышевую плазму
Интрогрессия желаемого признака в растения может быть облегчена посредством повторного обратного скрещивания.
В данном документе описаны способы продуцирования растения кукурузы с высоким содержанием лизина (например, кукуруза fl2), посредством общепринятого отбора растений, содержащего половое размножение. Способы могут содержать скрещивание первого родительского растения кукурузы, которое содержит в своем геноме по меньшей мере одну копию мутации fl2, со вторым родительским растением кукурузы, так чтобы продуцировать потомство F1. Первое растение может являться любым растением fl2 или разновидностью кукурузы, включая, например, Oh-43 или J15. Второе родительское растение кукурузы может являться любым растением кукурузы, которое способно продуцировать жизнеспособное потомство растений кукурузы (т.е., семена) при скрещивании с первым растением кукурузы. Первое и второе родительские растения кукурузы могут быть одинакового вида кукурузы (например, Zea mays (маис)). Способы могут дополнительно содержать самоопыление потомства F1 для продуцирования потомства F2. Способы могут дополнительно сдержать одно или более генерирований обратного скрещивания растений потомства F1или F2 с растением той же линии или генотипа, как или первое, или второе родительское растение кукурузы. Альтернативно, потомство F1 первого скрещивания или любого последующего скрещивания может быть скрещено с третьим растением кукурузы, которое принадлежит отличающейся линии или генотипу, чем или первое, или второе растение.
В некоторых вариантах осуществления потомство растения подвергается определению генотипа и/или зиготности, как изложено в открытии. После того, как потомство растения было генотипировано и/или определена его зиготность, опытный специалист может выбрать такое потомство растения, которое имеет требуемую генетическую композицию. Такое выбранное потомство растения может быть применено в дополнительных скрещиваниях, самоопылении или культивировании. Способы интрогрессии мутации fl2, которые направлены в соответствии со способами открытия, снижают или элиминируют культивирование и/или репродукцию растений, которые не имеют требуемую генетическую композицию, и посредством этого обеспечивают желаемую достоверность и предсказуемость (посредством ожидаемых менделевских моделей наследования).
Следующие примеры предоставлены для иллюстрации некоторых конкретных особенностей и/или аспектов. Эти примеры не должны истолковываться как ограничивающие открытие конкретными описанными особенностями или аспектами.
ПРИМЕРЫ
ПРИМЕР 1: Клонирование гена α-зеина размером 22 кДа из зародышевых плазм DAS
Отобранные линии J15 и Oh-43 растения маиса заказали из генетического сток-центра для маиса и репродуцировали размножителями DAS для растений. Растения кукурузы являлись производными линии J15 и являлись гомозиготными в отношении признака fluory2. Подобным образом, дополнительные растения кукурузы являлись производными линии Oh-43 и содержали признак fluory2. В добавление другую группу растений кукурузы с отсутствующими мучнистым фенотипом (дикий тип) применяли для выполнения анализа.
Выделение ДНК
Для экстрагирования ДНК эмбрион, вырезанный из семян, или свежие нарезки листьев измельчали в мелкий порошок, используя Genogrinder 2000™, и экстрагировали со стандартным набором MagAttract 96 ДНК Plant Core Kit™ (Qiagen, Valencia, CA) с применением специализированной роботизированной системы BioCel robot system™ от Agilent Technologies (Santa Clara, CA). Перед ПЦР ДНК образцы обсчитывали количественно с набором для количественного определения Quant-iT™ PicoGreen® Kit (Invitrogen, Carlsbad, CA) с применением рекомендаций производителя.
Амплификация ПЦР и секвенирование α-зеина размером 22-кДа
Инбредная геномная последовательность B73 α-зеина размером 22-кДа из маиса, содержащая приблизительно 1,7 т.п.о. с одним единственным экзоном, была извлечена из NCBI (AC229981.2). Праймеры сконструировали на основании последовательности B73 Zein_68F (SEQ ID NO: 1 5'-GAGATCATGCATGTCATTCCA-3') Zein_68R (SEQ ID NO: 2 5'-TTGGTGTTGTTAAGTTCACATGC-3') и ПЦР выполняли в ABI GeneAmp® PCR System 9700 (Applied Biosystems, Foster City, CA) в реакциях, содержащих 2,5 единиц TaKaRa LA Taq™ (Takara Bio Inc.,Shiga, Japan), 400 нМ dNTP, 200 нМ прямого и обратного праймера и 30 нг геномной ДНК. Применяли следующую программу для ПЦР: начинали ПЦР с 2 минут денатурирования при 94°C, согласно рекомендациям, с последующими 30 циклами: 94°C в течение 45 секунд, 55°C в течение 45 секунд и 72°C в течение 2 минут. ПЦР продукты визуализировали в 2% Ε-Gel™ и затем экстрагировали с применением набора для экстрагирования Purelink™ Quick Gel extraction kit (Invitrogen, Carlsbad, CA). Очищенные ПЦР продукты затем клонировали в pCR4-TOPO vector™ (Invitrogen, Carlsbad, CA) согласно рекомендациям производителя. Отобранные колонии выращивали в течение ночи в среде 1X freezer media, содержащей 2,5% LB (10 г триптона ,10 г NaCl и 5 г дрожжевого экстракта на 1 л среды LB), 36 мМ K2HPO4, 13 мМ KH2PO4, 1,7 мМ цитрата натрия, 6,8 мМ (NH4)2SO4, 4,4% глицерина, 0,4 мМ MgSO47H2O и 12,5 мкг/мл хлорамфеникола (добавленного непосредственно перед использованием) с 50 мкг/мл канамицина, и передавали постороннему исполнителю (Houston, TX) для секвенирования с праймерами, сконструированными для связывания с промотерами T7 и T3 (которые фланкируют сайт вставки в вектор pCR4-TOPO™), а также олигами Zein513F (SEQ ID NO: 3 5' AATCCTTGGCACATCTAA 3'), Zein-23R (SEQ ID NO: 4 5' TAGGTGGCTCAGTGATGGCAGAA 3') и Zein-385_R (SEQ ID NO: 5 5' CTAAAAGATGGCACCTCCAA 3') в гене α-зеина размером 22-кДа. Последовательности анализировали с применением компьютерной программы для выравнивания последовательностей Sequencher 4.8™.
Оформление анализа KASPar® и условия циклирования
Сконструировали конкурентные аллель-специфические ПЦР анализы (KBiosciences Competitive allele specific PCR® (KASPar®) на основании SNP или вставки и делеций (In/Dels) (KBiosciences, Hoddesdon, Hertfordshire, UK). Реакции KASPar® устанавливали в соответствии с таблицей 1 и таблицей 2. ПЦР циклы начинали при 94°C в течение 15 минут; затем 20 циклов с 10 секундами денатурирования при 94°C и 5 секундами отжига при 57°C; затем 10 секундами удлинения при 72°C; с последующими 22 циклами с 10 секундами денатурации при 94°C и 20 секундами отжига при 57°C; затем 40 секундами удлинения при 72°C. Для амплификации применяли ABI GeneAmp® PCR System 9700 (Applied Biosystems, Foster City, CA). ПЦР продукты измеряли спектрофлуорометром PheraStar spectrofluorometer™ (BMG LABTECH Inc., Cary, NC) с длиной волны возбуждения 485 нм и длиной волны излучения 520 нм для флуоресцентного сигнала FAM и 520 нм и 560 нм для CAL.
Геномные фрагменты из 1,7 т.п.о. α-зеина размером 22-кДа были успешно клонированы ПЦР из двух мучнистых линий и линии кукурузы дикого типа. Последовательности выравнивали с B73 (номер доступа в NCBI AC229981.2) и общедоступным fl2 аллелем (L34340, мутант fluory2 из W64FL2). В общем идентифицировали 72 SNP и 7 вставок/делеций (InDels) (Фиг. 1) с 24 вариациями внутри области экзона. Замена аланина на валин в -1 сигнального пептида, причина проявления мучнистости, представлена как в fl2 линии кукурузы 2, так и в fl2 линии кукурузы 3 (Фиг. 2), которые происходят из J15 и Oh-43, соответственно.
Ни одна из линий кукурузы не содержала гистидиновую вставку между 164-ой и 165-ой аминокислотой или замену аланина на треонин в 173-ей аминокислоте, другие две мутации, о которых сообщалось как об ответственных за фенотип fluory2. Усилия были направлены на ген-специфические анализы для детекции мутации от J15 и Oh43, которые коррелировали с фенотипом fluory2. Сравнение fl2 линии кукурузы 2 с fl2 линией кукурузы 3 на уровне белка выявило одно изменение гистидина (H) на глутамин (Q) в аминокислотном положении 159 (Фиг. 2). Так как не сообщалось о фенотипической вариации между этими двумя источниками мутаций fluory2, не было осуществлено дополнительной характеризации этой мутации.
ПРИМЕР 2: Ген-специфический молекулярный анализ в отношении fl2
Замены аланина на валин в -1 положении сигнального пептида достаточно для создания непроцессированного α-зеина размером 24 кДа и фенотипа fluory2. Для развития ген-специфических молекулярных анализов в отношении fl2, разрабатывали KASPar® анализ на основании этого однонуклеотидного полиморфизма от C к T. Это тестировали с диверсифицированной моделью 23 инбредных линий маиса, включая шесть линий образцов fluory2. Анализ был эффективным для дифференциации линии fluory2 от остальных инбредов на основании количества копий вариаций мутантного аллеля, который содержит SNP пару оснований C. Однако, аллели дикого типа с парой оснований Τ амплифицировались из всех образцов с равной интенсивностью, что указывает на то, что анализ не может быть применен для ген-специфического детектирования (Фиг. 3). По-видимому, это было в основном обосновано высокой гомологией α-зеина размером 22-кДа с другими членами зеинового семейства. α-зеиновое семейство содержит 75 членов с более чем 75% аминокислотной идентичностью.
Четыре дополнительных замены и две In/Dels с аминокислотными изменениями в единичном экзоне 22-кДа гена α-зеина (Таблица 3) тестировали в качестве кандидатов с применением описанного молекулярного анализа KASPar®. Большинство испытаний демонстрировали такую же кластерную модель, как показано на фиг. 3, тестированную с 23 инбредными линиями маиса. Хотя эти анализы могли детектировать количество копий вариаций, они не являлись достаточно устойчивыми для широкомасштабного анализа зиготности, в котором явное разделение между fl2 аллелем и аллелем дикого типа является критичным.
Однако один анализ KASPar® на основании второй замены аланина на валин в положении 39-ой аминокислоты продуцировал раздельные кластеры между образцами fluory2 и дикого типа, с сигналом FAM, указывающим на ген fl2 (Фиг. 4). Этот анализ описан в таблице 3 в виде номера в анализе 3. Для подтверждения специфичности анализа затем тестировали дополнительные 82 немучнистые инбредные линии маиса. Все 82 линии дикого типа тестировали негативно на целевой аллель fl2, что убедительно указывает на то, что анализ является высокоселективным в отношении гена fluory2. Анализ впоследствии назвали fl2_zygo.
ПРИМЕР 3: Подтверждение анализа с сегрегирующими популяциями
Подтверждение с сегрегирующим популяциями
Ген-специфический анализ fl2_zygo подтверждали с применением сегрегирующих образцов из двух генетических окружений. Каждая совокупность содержала 25 образцов. Десять семян из каждого образца разрезали и ДНК экстрагировали из эмбриона, с 500 семенами в общем (50 початков с 10 семенами на початок), и тестировали с fl2_zygo (Фиг. 6). Образцы с расхождениями дополнительно оценивали экспериментами на практике: десять семян из каждого образца сеяли в Arlington, IL. Свежие нарезки листьев собирали для экстрагирования ДНК и тестирования генотипа. Затем растения самоопыляли и собирали початки. Данные о фенотипе собирали помещением зерен в светонепроницаемый ящик и оценивали на основании шкалы стекловидности: полупрозрачный - дикий тип; частично непрозрачные - гетерозиготы и полностью непрозрачные - гомозиготы.
В анализе однозначно различали гомозиготный, гетерозиготный генотипы и генотип дикого типа. Для гомозиготного fluory2 так же как и для початков дикого типа у 97% имелось соответствие между генотипическими и фенотипическими данными, с больше чем половиной гетерозиготных початков (15 из 26), демонстрирующих несоответствие между генотипическими и фенотипическими результатами.
Подтверждение анализа зиготности
В связи с неоднозначностью способа со светонепроницаемым ящиком, можно ожидать низкую точность, когда фенотип основан на малом количестве семян. Для идеального анализа зиготности, однако, потребовалось бы совершенное совпадение.
Для дополнительного подтверждения специфичности анализа fl2_zygo десять семян из каждого початка с несоответствиями выращивали в Arlington, IL. ДНК экстрагировали из нарезки листьев, собранных из растений возрастом 2 месяца, и генотипировали с fl2_zygo. Затем растения подвергали самоопылению и собирали семена. Семена подвергали фенотипированию со светонепроницаемым ящиком после сушки.
Сравнение визуальной оценки с генотипическими данными из анализа fl2_zygo выявило 95% совпадение (145 из 152) со всеми оставшимися семью початками, сегрегирующими с сомнительными фенотипами. Они или происходили из линии Iodent c бронзовым обесцвечиванием, или имели круглые массивные формы, и таким образом их было чрезвычайно сложно оценить со светонепроницаемым ящиком. Если фенотип был корректным, мог(могли) иметь место ген(ы) в добавление к α-зеину размером 22-кДа, способствующие признаку fluory2, так как все семь початков были тестированы как генетически дикий тип. С применением селекции с помощью маркера нулевые растения исключали из рассмотрения. Замена аланина на валин в α-зеин размером 22-кДа достаточна для вызывания мутации fluory2. Расширенное применение ген-специфического анализа fl2_zygo должно отобрать среди других мутаций ассоциированную с фенотипом fluory2, учитывая высокую специфичность анализа в отношении 39 аминокислоты, ассоциированной с мутацией. Все донорные линии fl2 линии, используемые в настоящее время, содержали мутированный α-зеин размером 22-кДа и тестировались позитивно в отношении fl2 аллеля с применением fl2_zygo (данные не приведены).
Определения генотипа и зиготности из этого fl2 ген-специфического молекулярного очень точно совпадали с фенотипическими данными, полученными в данной области. Это анализ предоставляет легкий, быстрый и точный путь для характеризации состояния зиготности fl2 с применением системы для анализа на молекулярной основе с высокой пропускной способностью.
ПРИМЕР 4: Интрогрессия признака fluory2 (fl2) в растительные линии
Интрогрессия fl2
Мутация fl2_zygo может быть применена в качестве устойчивого анализа для fl2 интрогрессии. Зиготность растения кукурузы по отношению к мутации fl2 может быть определена, как описано в примерах 1-2. Отобранное растение кукурузы, которое, как определено, является гомозиготным в отношении мутации fl2 может быть скрещено посредством общепринятого отбора растений с растением кукурузы, которое как известно является гомозиготным в отношении требуемого признака, таким как BMR или COMT. Потомство F1 затем может быть самоопылено для получения потомства F2. Могут быть приготовлены образцы геномной ДНК потомства F2 и определена зиготность растений потомства F2, как описано выше. Потомство F2растения, которое является гомозиготным в отношении мутации fl2, затем может быть отобрано. Отобранное потомство затем анализируют на высокое содержание лизина, сниженное содержание лигнина в клеточной стенке и/или повышенную перевариваемость, и то потомство, которое проявляет желаемые признаки, может быть дополнительно репродуцировано скрещиванием и самоопылением, при этом полученное в результате потомство культивируют.
Хотя данное изобретение было описано в данном документе посредством предпочтительных вариантов осуществления, специалисты в данной области признают и примут во внимание, что изобретение не ограничено ими. Точнее, многие дополнения, исключения и модификации к предпочтительным вариантам осуществления могут быть осуществлены без выхода за рамки изобретения, как указано далее в формуле изобретения. Вдобавок особенности одного варианта осуществления могут быть комбинированы с особенностями другого варианта осуществления, при этом, не выходя за рамки объема изобретения, как установлено изобретателями.
Реферат
Изобретение относится к области биотехнологии, а именно к способу определения наличия/отсутствия мутации fl2 с применением растительной ткани кукурузы, а также к генетически сконструированному растению кукурузы. В некоторых вариантах осуществления раскрыты способ надежной и предсказуемой интрогрессии признака высокого содержания лизина в растительный генетический материал, а также молекула нуклеиновой кислоты, кодирующая белок альфа-зеин. Изобретение позволяет эффективно детектировать мутантный аллель fl2 и определять зиготность в растениях-кандидатах, снижая время, необходимое для селекции растений с желаемыми свойствами. 4 н. и 8 з.п. ф-лы, 6 ил., 3 табл., 4 пр.

Комментарии