Регулирующий высоту растений ген и его применения - RU2458132C2
Код документа: RU2458132C2
Чертежи




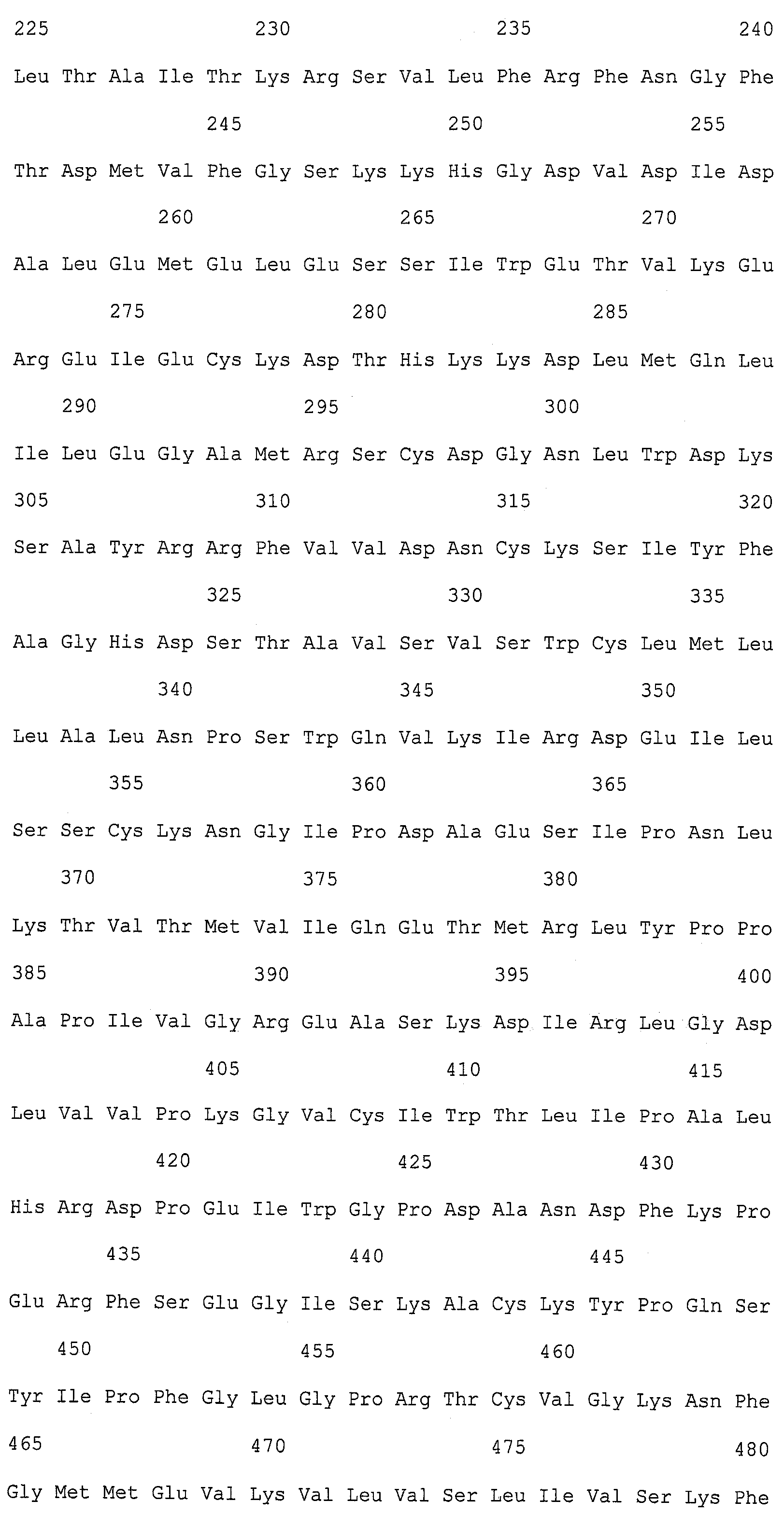




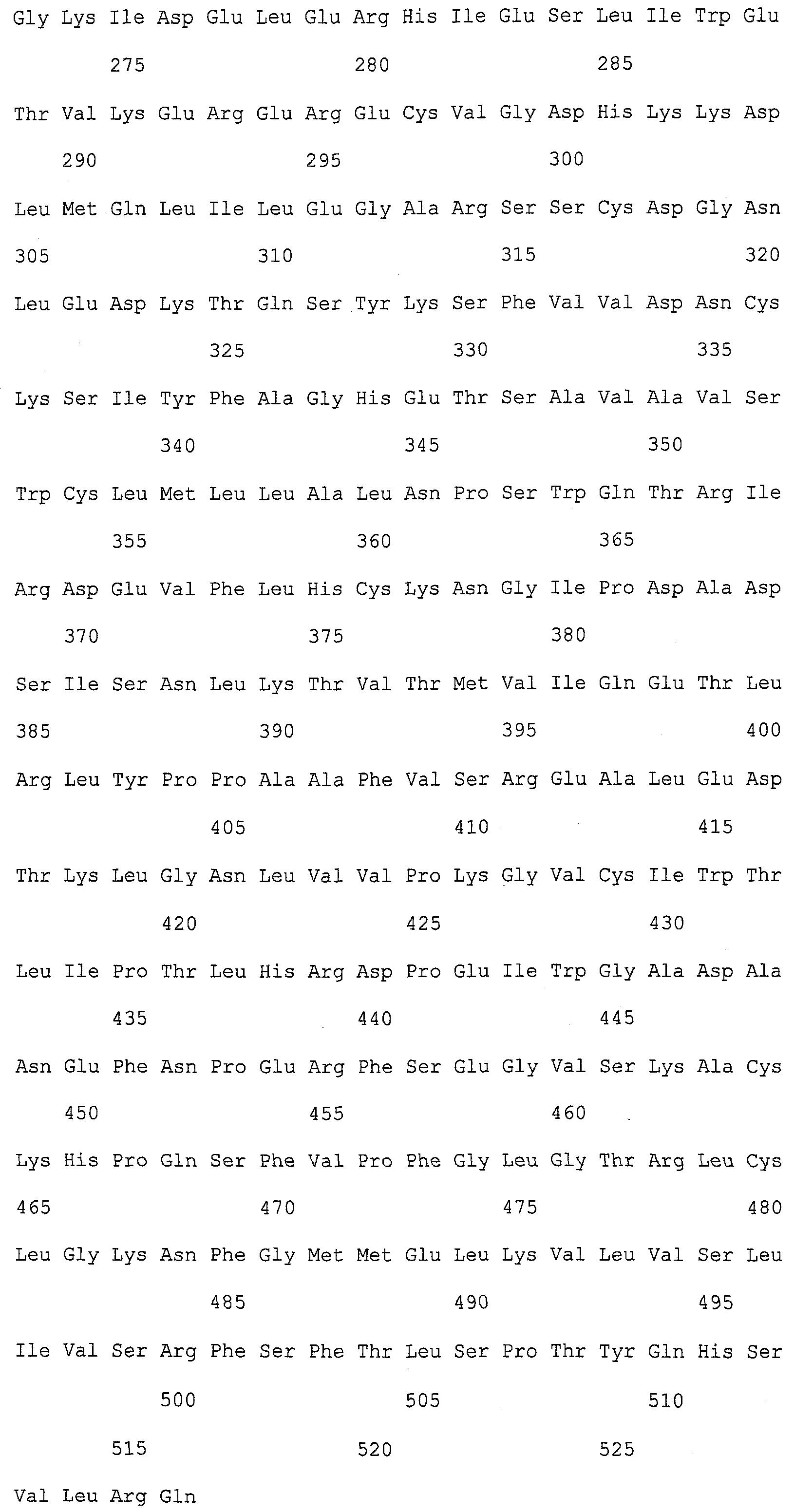






Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области генетической технологии и ботаники. В частности, настоящее изобретение относится к регулирующему высоту растений гену и его применениям.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
В настоящее время исследования выведения высокоурожайных сельскохозяйственных культур в основном сфокусированы на улучшении формы растений и характерных признаков метелок. Множество сортов высокоурожайных сельскохозяйственных культур разработано к настоящему времени благодаря прогрессу в улучшении культиваров.
Однако одной из главных проблем, существующей для многих высокоурожайных сельскохозяйственных культур, таких как высокоурожайные культивары риса (особенно, супергибридные сорта риса), является слишком большая высота растений. Слишком большая высота может приводить к большей тенденции к полеганию (плоскому распластыванию по почве) и ограничению потенциала более высокой урожайности. Эта проблема значительно влияет на урожайность сельскохозяйственных культур и широкое внедрение высокоурожайных сортов.
Соответственно, в данной области существует необходимость разработки способа регуляции высоты сельскохозяйственных растений для дальнейшего улучшения признаков сельскохозяйственных растений и увеличения урожайности сельскохозяйственных растений.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предоставление регулирующего высоту растений гена и его применений.
В первом аспекте изобретение относится к выделенным регулирующим высоту растений полипептидам, выбранным из группы, состоящей из:
(a) полипептида, обладающего аминокислотной последовательностью, указанной в SEQ ID NO: 3; и
(b) полипептида, полученного из (a), содержащего замену, делецию или добавление одного или нескольких аминокислотных остатков в аминокислотную последовательность, указанную в SEQ ID NO: 3, и обладающего функцией регуляции высоты растений.
В предпочтительном варианте осуществления указанный полипептид представляет собой полипептид, обладающий аминокислотной последовательностью, указанной в SEQ ID NO: 3.
Во втором аспекте изобретение относится к выделенным полинуклеотидам, каждый из которых обладает нуклеотидной последовательностью, выбранной из группы, состоящей из:
(a) полинуклеотида, кодирующего полипептид, описанный выше; и
(b) полинуклеотида, комплементарного полинуклеотиду из (a).
В предпочтительном варианте осуществления полинуклеотид кодирует полипептид, обладающий аминокислотной последовательностью, указанной в SEQ ID NO: 3.
В другом предпочтительном варианте осуществления последовательность полинуклеотида обладает нуклеотидной последовательностью, указанной в SEQ ID NO: 2; или нуклеотидной последовательностью, указанной в SEQ ID NO: 1.
В третьем аспекте изобретение относится к векторам, каждый из которых содержит полинуклеотид, описанный выше.
В четвертом аспекте изобретение относится к генетически модифицированным клеткам-хозяевам, каждая из которых содержит вектор, описанный выше.
В пятом аспекте изобретение относится к растениям, каждое из которых содержит полинуклеотид, описанный выше.
В шестом аспекте изобретение относится к способам получения растений, описанных выше, где способ включает в себя введение полинуклеотида, описанного выше, в растение.
В предпочтительном варианте осуществления способ, описанный выше, включает в себя:
(1) получение клеток Agrobacterium, несущих экспрессирующий вектор, содержащий полинуклеотид, описанный выше;
(2) приведение клеток, тканей или органов растений в контакт с клетками Agrobacterium, описанными на стадии (1), для введения указанного полинуклеотида в клетки растений и обеспечение возможности интеграции полинуклеотида в хромосомы клеток растений;
(3) отбор клетки, ткани или органа растения, содержащих указанный полинуклеотид; и
(4) обеспечение возможности клетке, ткани или органу растения, описанным на стадии (3), регенерировать до нового растения.
В седьмом аспекте изобретение относится к способам получения растения. Каждый способ включает в себя скрещивание растения с введенным полинуклеотидом с нетрансгенным растением, таким образом получая гибридное потомство, содержащее указанный полинуклеотид.
В восьмом аспекте изобретение относится к способам получения полипептидов, описанных выше. Способ включает в себя:
(a) культивирование клетки-хозяина, содержащей указанный полинуклеотид, в условиях, подходящих для экспрессии;
(b) выделение указанного полипептида из культуры.
В девятом аспекте изобретение относится к применениям полипептида или кодирующего его полинуклеотида, описанного выше, для:
регуляции для растений высоты, размеров, кущения, урожайности, размеров цветковых органов или размеров семян сельскохозяйственных растений; или
получения материала для регуляции для растений высоты, размеров, кущения, урожайности, размеров цветковых органов или размеров семян сельскохозяйственных растений.
В десятом аспекте изобретение относится к способам регуляции для растений высоты, размеров, кущения, урожайности, размеров цветковых органов или размеров семян сельскохозяйственных растений. Способ включает в себя регуляцию экспрессии или активности регулирующего высоту растений гена в сельскохозяйственных растениях.
В другом предпочтительном варианте осуществления уменьшенных высоты и размеров растений и увеличенных кущения и урожайности можно достигать усилением экспрессии или активности регулирующего высоту растений гена в сельскохозяйственных растениях; и увеличения размеров цветковых органов, размеров семян, высоты или размеров растений можно достигать ингибированием экспрессии или активности регулирующего высоту растений гена в сельскохозяйственных растениях.
В одиннадцатом аспекте изобретение относится к агонистам или антагонистам регулирующего высоту растений полипептида, описанного выше, или кодирующего его гена.
В двенадцатом аспекте изобретение относится к промоторам для специфической экспрессии в стеблях или листьях растений. Промотор выбран из группы, состоящей из:
(1) полинуклеотида, обладающего нуклеотидной последовательностью, указанной в SEQ ID NO: 13;
(2) полинуклеотида, способного гибридизоваться с последовательностью полинуклеотида, описанного в (1), в строгих условиях и способного управлять специфической экспрессией гена-мишени в стеблях или листьях растений; и
(3) полинуклеотида, имеющего более 70% (предпочтительно, более 80%, более предпочтительно, более 90%, наиболее предпочтительно, более 95%, например, 98%, 99%) идентичности с нуклеотидной последовательностью, указанной в SEQ ID NO: 13, и способного управлять специфической экспрессией гена-мишени в стеблях или листьях растений.
В тринадцатом аспекте изобретение относится к применениям указанных промоторов для управления специфической экспрессией гена-мишени в стеблях или листьях растений.
В четырнадцатом аспекте изобретение относится к конструкциям, каждая из которых содержит промотор, описанный выше, для специфической экспрессии в стеблях или листьях растений.
В другом предпочтительном варианте осуществления конструкция, описанная выше, содержит по меньшей мере один участок для множественного клонирования (такой как участки рестрикции) для вставки гена-мишени, на 3'-конце по отношению к промотору и функционально связанный с ним для специфической экспрессии в стеблях или листьях растений.
В другом предпочтительном варианте осуществления указанная конструкция представляет собой экспрессирующий вектор.
В другом предпочтительном варианте осуществления указанная конструкция содержит следующие элементы, функционально связанные друг с другом: указанный промотор и ген-мишень.
В другом предпочтительном варианте осуществления указанный ген-мишень представляет собой экзогенный ген.
В другом предпочтительном варианте осуществления указанный ген-мишень представляет собой структурный ген.
В другом предпочтительном варианте осуществления указанный ген-мишень может кодировать белок с конкретной функцией.
В другом предпочтительном варианте осуществления указанный ген-мишень локализован через менее 2000 п.о. (предпочтительно, менее 1000 п.о., более предпочтительно, менее 500 п.о., наиболее предпочтительно, менее 300 п.о.) на 3'-конце по отношению к указанному промотору.
В свете представленного в настоящем документе описания другие аспекты изобретения очевидны специалистам в данной области.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
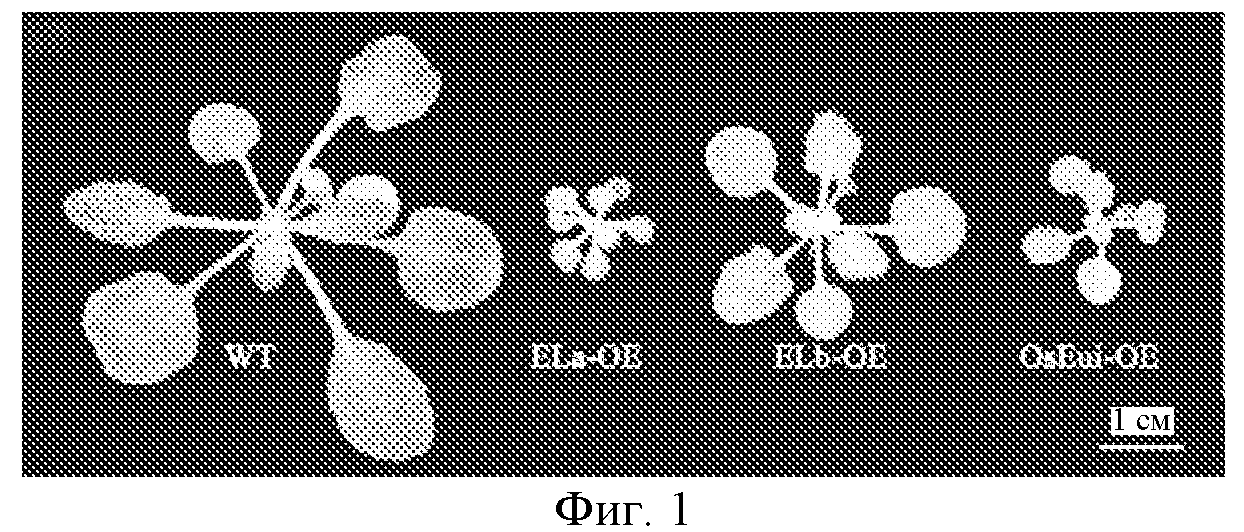
На фигуре 1 показан вид сверху растения Arabidopsis дикого типа (Wt) и трансгенного растения Arabidopsis со сверхэкспрессией ELb (Eui-подобного b) (ELb-OE). трансгенное растение Arabidopsis со сверхэкспрессией ELa (Eui-подобного a) (ELa-OE) и трансгенное растение Arabidopsis со сверхэкспрессией OsEui риса (OsEui-OE) выступают в качестве контролей.
На фигуре 2 показано сравнение профилей роста растения Arabidopsis дикого типа (WT) и растений ArabidopsisELb РНКи/ela.
На фигуре 3 показано сравнение профилей роста цветковых органов и семян растений ArabidopsisElb РНКи/ela и растения Arabidopsis дикого типа (WT).
На фигуре 4 показана тканеспецифическая экспрессия репортерного гена GUS, инициированная промотором ELb. Стрелками показаны области, имеющие синюю окраску.
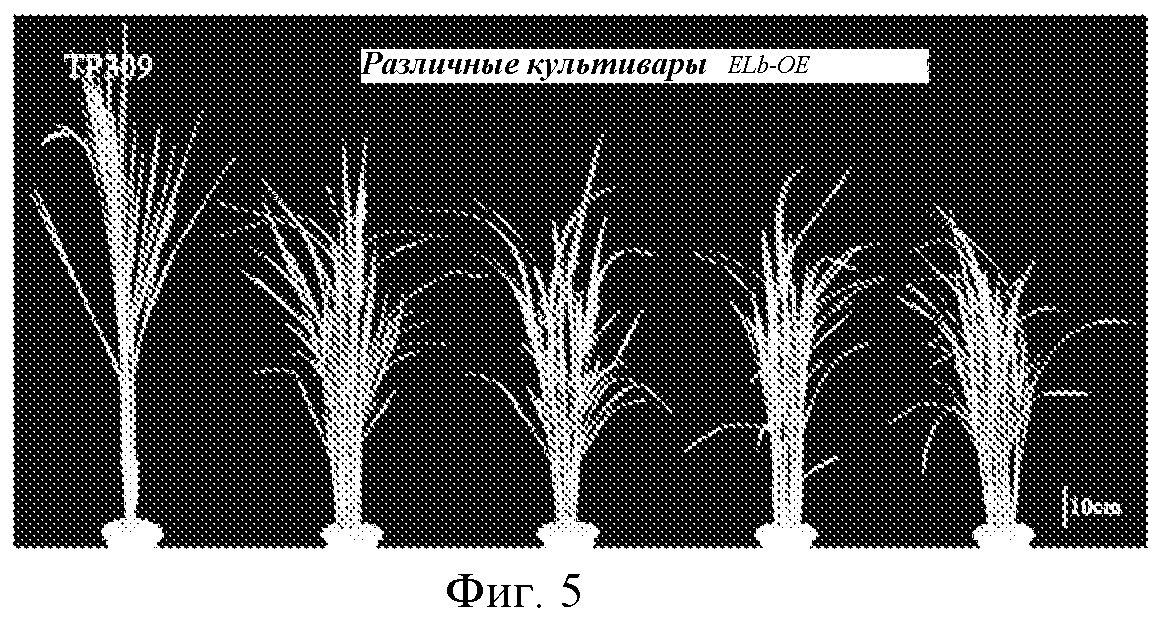
На фигуре 5 показано сравнение профилей роста растения риса дикого типа (TP309) и растений риса со сверхэкспрессией Elb (ELb-OE).
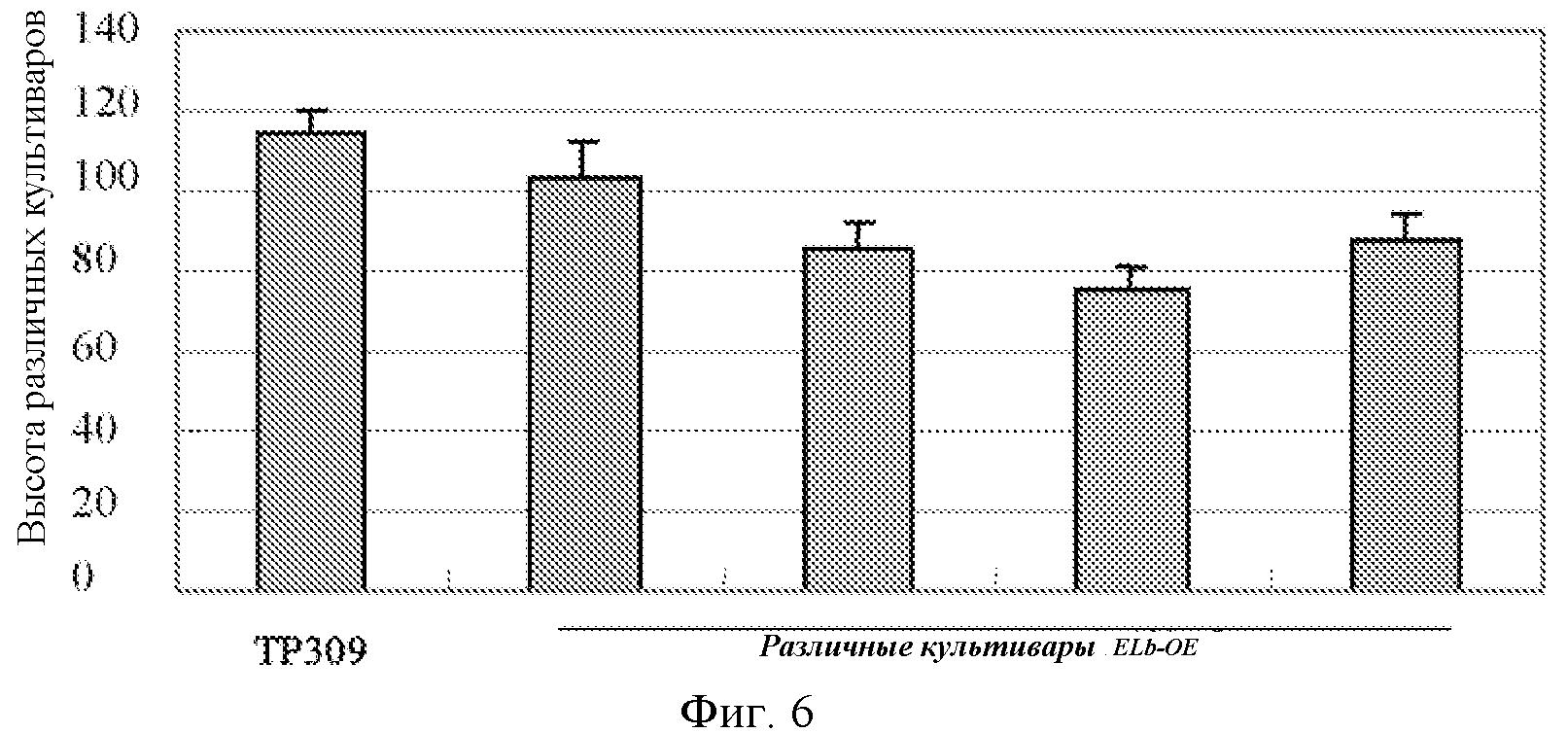
На фигуре 6 показан статистический анализ высоты растений для растения риса дикого типа (TP309) и растений риса со сверхэкспрессией Elb (ELb-OE).
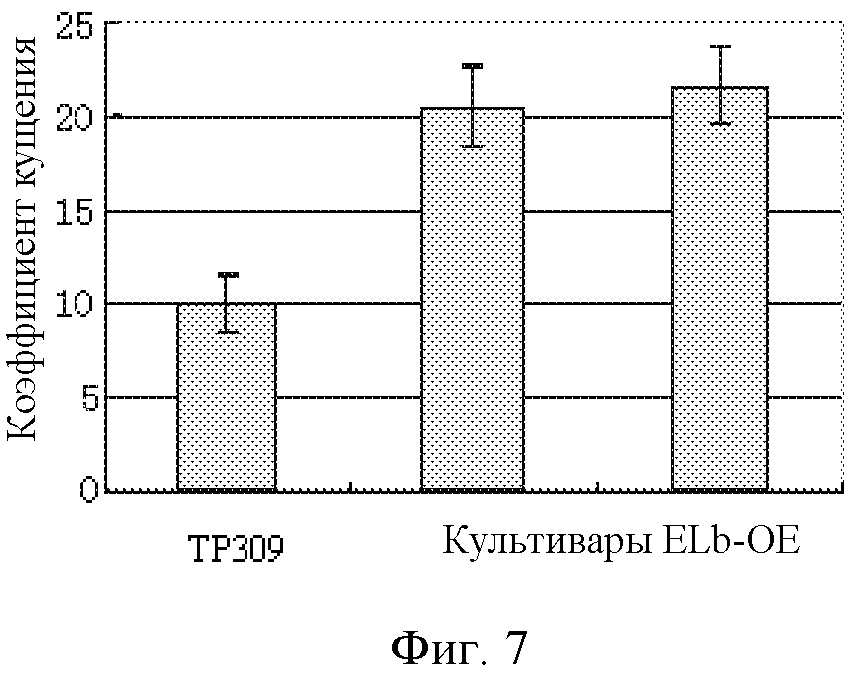
На фигуре 7 показан статистический анализ эффективных коэффициентов кущения растения риса дикого типа (TP309) и растений риса со сверхэкспрессией Elb (ELb-OE).
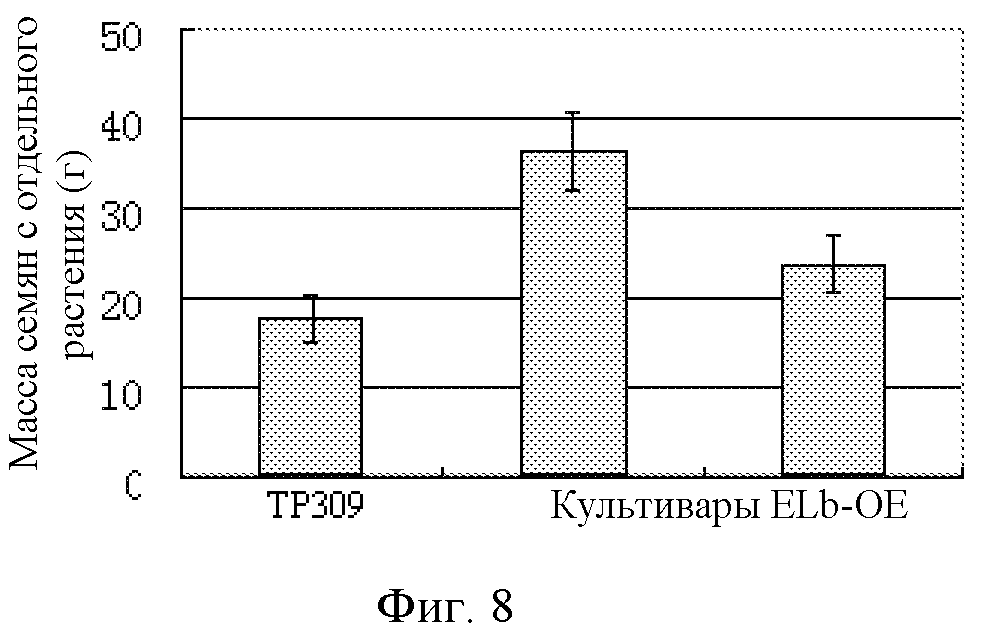
На фигуре 8 показано сравнение массы семян с отдельного растения между растением риса дикого типа (TP309) и растениями риса со сверхэкспрессией Elb (ELb-OE).
КОНКРЕТНЫЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Посредством интенсивных исследований авторы изобретения открыли ген ELb, применимый для регуляции для растений высоты, размеров, кущения, урожайности, размеров цветковых органов и размеров семян сельскохозяйственных растений. Является возможным уменьшать высоту и размеры растений и увеличивать эффективные коэффициенты кущения и урожайность сельскохозяйственных растений посредством увеличения экспрессии этого гена. Является возможным также увеличивать размеры цветковых органов и размеры семян посредством уменьшения экспрессии этого гена. Настоящее изобретение основано на этих обнаружениях.
Как применяют в настоящем документе, термин «сельскохозяйственное растение» или «сельскохозяйственные растения» включают в себя в качестве неограничивающих примеров: Gramineae, Cruciferae и деревянистые растения, и т.п. Более предпочтительно, Gramineae включают в себя, в качестве неограничивающих примеров: рис, пшеницу, ячмень, кукурузу, сорго и т.п.; или Cruciferae включают в себя, в качестве неограничивающих примеров: Arabidopsis.
Как применяют в настоящем документе, «выделенный» относится к материалу, выделенному из его исходного окружения (исходное окружение представляет собой природное окружение для природного материала). Например, природные полинуклеотиды и полипептиды в живых клетках являются невыделенными или неочищенными, однако полинуклеотиды и полипептиды являются выделенными или очищенными при отделении от других материалов, обычно сопутствующих им в природном состоянии.
Как применяют в настоящем документе, «выделенный регулирующий высоту растений полипептид», «выделенный белок ELb» или «выделенный полипептид ELb» относится к белку ELb, по существу свободному от других белков, липидов, сахаридов или других материалов, сопровождающих белок ELb в природных состояниях. Специалисты в данной области способны очистить белок ELb с использованием общепринятых способов очистки белка. По существу чистый полипептид образует отдельную главную полосу в невосстанавливающем полиакриламидном геле.
Как применяют в настоящем документе, термин «содержать», «обладать» или «охватывать» включает значения «включающий», «в основном состоящий из», «по существу состоящий из» и «состоящий из»; «в основном состоящий из», «по существу состоящий из» и «состоящий из» представляют собой конкретные термины из «содержать», «обладать» или «охватывать».
Полипептид ELb и его применения
Полипептиды по изобретению могут представлять собой рекомбинантные полипептиды, природные полипептиды или синтетические полипептиды, предпочтительно, рекомбинантные полипептиды. Полипептиды по изобретению могут представлять собой очищенные природные продукты или химически синтезированные продукты, или продукты, полученные из прокариотических или эукариотических хозяев (таких как клетки бактерий, дрожжей, высших растений, насекомых и млекопитающих) с использованием рекомбинантных способов. Полипептиды по изобретению могут являться гликозилированными или негликозилированными, в зависимости от клеток-хозяев, применяемых для рекомбинантной продукции. Полипептиды по изобретению могут содержать или не содержать остаток метионина в участке инициации.
Кроме того, изобретение относится к фрагментам, производным и аналогам белков ELb. Как применяют в настоящем документе, термин «фрагмент», «производное» и «аналог» относятся к полипептиду, сохраняющему по существу такие же биологические функции или виды активности, как полипептиды ELb по изобретению. Фрагменты, производные и аналоги по изобретению могут представлять собой (i) полипептиды с одним или несколькими замененными консервативными или неконсервативными аминокислотными остатками (предпочтительно, консервативным остатком), где указанные замененные остатки могут являться или могут не являться кодированными генетическими кодами, или (ii) полипептиды с замещающей группой (группами) в одном или нескольких аминокислотных остатках, или (iii) полипептид, полученный из зрелого полипептида, присоединенный к другому соединению (такому как соединение, способное продлевать время полужизни полипептида, например полиэтиленгликоль), или (iv) полипептид, полученный из указанного полипептида, присоединенный к дополнительной аминокислотной последовательности (например, к лидерной последовательности, секретирующей последовательности, последовательности, применяемой для очистки указанного полипептида, протеиногенной последовательности или слитому белку). Как определено в настоящем документе, эти фрагменты, производные и аналоги хорошо известны специалистам в данной области.
По изобретению термин «белок ELb» обозначает полипептид, указанный в SEQ ID NO: 3, обладающий активностью белка ELb. Этот термин включает в себя также варианты полипептида из SEQ ID NO: 3, обладающие такой же функцией, как белок ELb. Эти варианты включают в себя (но не ограничиваются ими) делецию, вставку и/или замену нескольких (как правило, 1-50, предпочтительно, 1-30, более предпочтительно, 1-20, наиболее предпочтительно, 1-10, еще более предпочтительно, 1-8 или 1-5) аминокислот, так же как добавление одной или нескольких (как правило, менее 20, предпочтительно, менее 10, более предпочтительно, менее 5) аминокислот на C-конце и/или N-конце. Например, функции белков, как правило, не изменяют замещением одной аминокислоты на другую аминокислоту, обладающую таким же или сходным свойством. В качестве другого примера, функции белков, как правило, также не изменяют добавлением одной или нескольких аминокислот на C-конце и/или N-конце. Этот термин, белок ELb, включает в себя также активные фрагменты и производные белка ELb.
Варианты полипептида включают в себя: гомологичные последовательности, консервативные варианты, аллельные варианты, природные мутанты, индуцированные мутанты, белки, кодируемые последовательностью ДНК, которая гибридизуется с последовательностью ДНК, кодирующей ELb-белок, в условиях высокой или низкой строгости, и полипептиды или белки, полученные с использованием антител против белка ELb. Изобретение относится также к другим полипептидам, таким как слитые белки, содержащие белок ELb или его фрагмент. В дополнение к почти полноразмерному полипептиду, изобретение, кроме того, относится к растворимым фрагментам белка ELb. Эти фрагменты, как правило, содержат по меньшей мере приблизительно 20 непрерывных аминокислот, как правило, по меньшей мере приблизительно 30 непрерывных аминокислот, предпочтительно, по меньшей мере приблизительно 50 непрерывных аминокислот, более предпочтительно, по меньшей мере приблизительно 80 непрерывных аминокислот, наиболее предпочтительно, по меньшей мере приблизительно 100 непрерывных аминокислот в последовательности белка ELb.
Изобретение, кроме того, относится к аналогам белков или полипептидов ELb. Различие между этими аналогами и природным белком ELb может представлять собой различие в аминокислотной последовательности, различие в характерах модификации, не приводящее к какому-либо изменению последовательности, или и то, и другое. Эти полипептиды включают в себя природные или индуцированные генетические варианты. Индуцированные варианты можно получать различными способами, такими как случайный мутагенез посредством подвергания воздействию радиоактивного излучения или мутагена, так же как сайт-направленный мутагенез или другие известные способы молекулярной биологии. Эти аналоги включают в себя также аналоги, содержащие остаток (например, D-аминокислоты), отличающийся от природных остатков L-аминокислот, и аналоги, содержащие не встречающиеся в природе или синтетические аминокислоты (например β,γ-аминокислоты). Следует понимать, что полипептиды по изобретению не являются ограниченными репрезентативными полипептидами, описанными выше.
Модифицированные (как правило, не в результате изменения первичной структуры) формы включают в себя: полученную химически форму, такую как ацетилированная или карбоксилированная форма пептида in vivo или in vitro. Модификации включают в себя также гликозилирование. Модифицированные формы включают в себя также последовательность, содержащую фосфорилированную аминокислоту (например, фосфотирозин, фосфосерин, фосфотреонин), или полипептид, модифицированный для увеличения устойчивости к протеолизу или оптимизации растворимости.
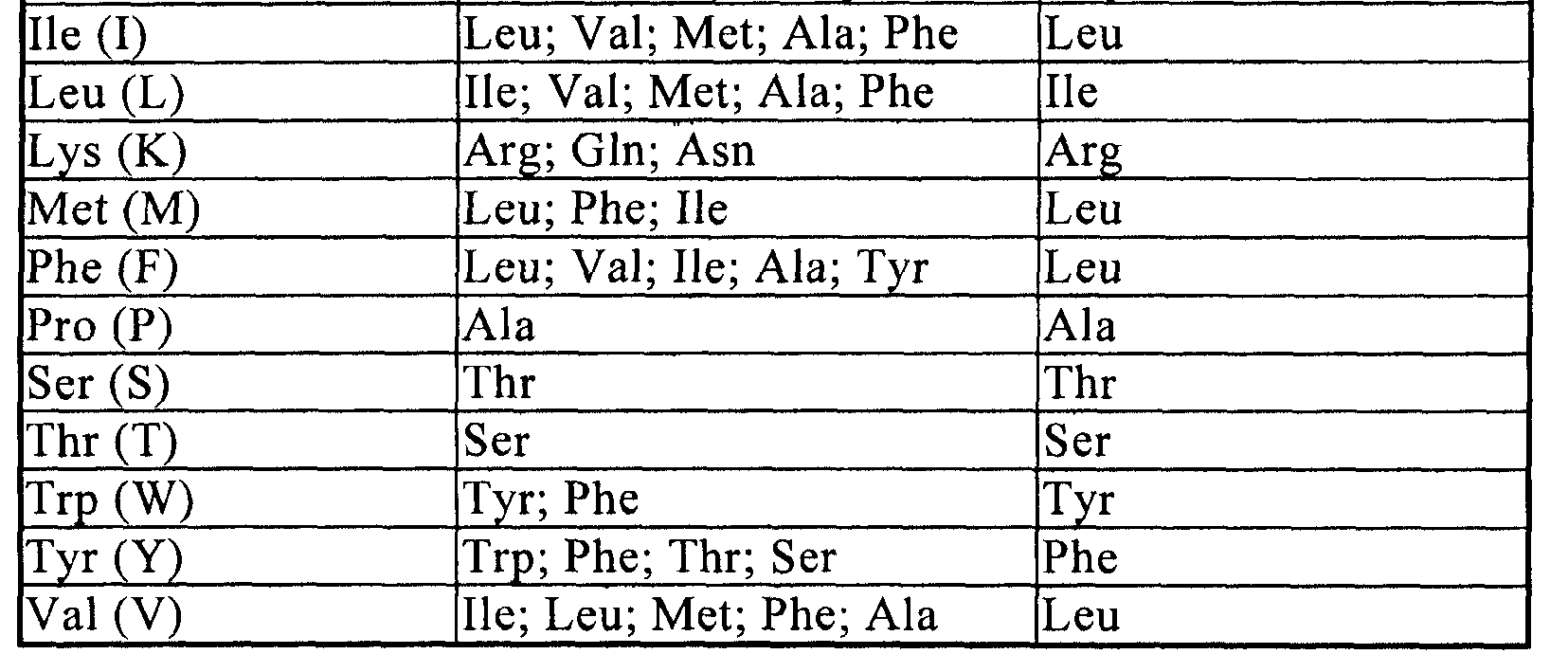
По настоящему изобретению «консервативный вариант полипептида белка ELb» относится к полипептидам, содержащим вплоть до 20, предпочтительно, не более 10, более предпочтительно, не более 5, наиболее предпочтительно, не более 3 аминокислот, замененных другими аминокислотами со сходными или сравнимыми свойствами по сравнению с аминокислотной последовательностью, указанной в SEQ ID NO: 3. Предпочтительно, эти консервативные варианты пептидов получают заменой аминокислот в соответствии с таблицей 1.

Изобретение, кроме того, относится к полинуклеотидным последовательностям, кодирующим белки ELb по изобретению или консервативные варианты их полипептидов.
Полинуклеотиды по изобретению могут представлять собой ДНК или РНК. ДНК включает в себя кДНК, геномную ДНК или искусственную синтетическую ДНК. ДНК может являться одноцепочечной или двухцепочечной. ДНК может представлять собой кодирующую цепь или некодирующую цепь. Последовательность кодирующей области, кодирующей зрелый полипептид, может являться такой же, как последовательность кодирующей области, указанная в SEQ ID NO: 2, или ее вырожденный вариант. Как применяют в настоящем документе, «вырожденный вариант» обозначает полинуклеотидную последовательность, кодирующую белок с последовательностью, указанной в SEQ ID NO: 3, но отличающуюся от последовательности кодирующей области, указанной в SEQ ID NO: 2.
Полинуклеотиды, кодирующие зрелый полипептид, указанный в SEQ ID NO: 3, включают в себя: кодирующую последовательность, кодирующую только зрелый полипептид; последовательность, кодирующую зрелый полипептид и различные дополнительные кодирующие последовательности; последовательность, кодирующую зрелый полипептид (и любую дополнительную кодирующую последовательность) и некодирующую последовательность.
Термин «полинуклеотид, кодирующий полипептид» относится к полинуклеотиду, кодирующему полипептид, или полинуклеотиду, дополнительно содержащему кодирующие и/или некодирующие последовательности.
Изобретение также относится к вариантам указанных выше полинуклеотидов, кодирующих полипептиды с такими же аминокислотными последовательностями как описано в настоящем документе, или их фрагментам, аналогам и производным. Варианты полинуклеотидов могут представлять собой природные аллельные варианты или неприродные варианты. Эти нуклеотидные варианты включают в себя варианты с заменами, варианты с делециями и варианты со вставками. Как известно в данной области, аллельный вариант представляет собой альтернативный полинуклеотид, который может включать один или несколько замененных, делетированных или вставленных нуклеотидов, что не приводит к значительным функциональным изменениям полипептида, кодируемого вариантом.
Изобретение также относится к полинуклеотидам, гибридизующимся с последовательностями, описанными выше и имеющим по меньшей мере 50%, предпочтительно, по меньшей мере 70%, более предпочтительно, по меньшей мере 80%
идентичности с последовательностями, описанными выше. Изобретение, в частности, относится к полинуклеотидам, гибридизующимся с полинуклеотидами, описанными в настоящем документе, в строгих условиях. По изобретению «строгие условия» относятся к (1) гибридизации и отмывке при более низкой ионной силе и более высокой температуре, например 0,2x SSC, 0,1% SDS, 60°C; или (2) гибридизации в присутствии денатурирующего средства, например 50% (об./об.) формамида, 0,1% бычьей сыворотки/0,1% фиколла, 42°C, и т.д.; или (3) гибридизации, происходящей только между двумя последовательностями, имеющими по меньшей мере 80%, предпочтительно, по меньшей мере 90%, более предпочтительно, более 95% идентичности. Более того, биологические функции и виды активности полипептидов, кодируемых способными гибридизоваться полинуклеотидами, являются такими же, как у зрелого полипептида, указанного в SEQ ID NO: 3.
Изобретение также относится к полинуклеотидным фрагментам, гибридизующимся с последовательностями, описанными выше. Как применяют в настоящем документе, «полинуклеотидный фрагмент» имеет длину по меньшей мере 15, предпочтительно, по меньшей мере 30, более предпочтительно, по меньшей мере 50, наиболее предпочтительно, по меньшей мере 100 или более нуклеотидов. Полинуклеотидные фрагменты можно использовать вместе со способами амплификации (например, PCR) для определения и/или выделения полинуклеотидов, кодирующих белок ELb.
Следует понимать, что в соответствии с вариантами осуществления по изобретению, ген ELb предпочтительно получают из Arabidopsis. Однако варианты осуществления изобретения также включают в себя другие гены, имеющие высокую гомологию (например, более 60%, например, 70%, 80%, 85%, 90%, 95%, даже 98% идентичности последовательности) с геном ELb Arabidopsis и полученные из других растений. Способы выравнивания и средства определения идентичности или гомологии последовательности (такие как BLAST) хорошо известны в данной области.
Полноразмерные нуклеотидные последовательности, кодирующие белок ELb по изобретению, или его фрагменты, можно получать с использованием амплификации PCR, рекомбинантных способов или химического синтеза. Для амплификации PCR праймеры можно конструировать в соответствии с родственными нуклеотидными последовательностями, особенно последовательностями описанных открытых рамок считывания, и коммерчески доступную библиотеку кДНК или библиотеку кДНК, полученную общепринятыми способами, известными специалистам в данной области, можно использовать в качестве матриц. С использованием этих праймеров и библиотек можно проводить амплификацию PCR для получения желаемых последовательностей. Когда последовательности являются длинными, обычно необходимо проводить PCR дважды или несколько раз, и затем лигировать амплифицированные фрагменты в правильном порядке.
После получения желаемой последовательности большое количество желаемой последовательности можно получать рекомбинантными способами. Обычно желаемую последовательность клонируют в вектор, и вектор вводят в клетки, и затем желаемые последовательности выделяют из размноженных клеток-хозяев общепринятыми способами.
Кроме того, желаемые последовательности, особенно более короткие фрагменты, можно получать химическим синтезом. Как правило, можно сначала синтезировать множество малых фрагментов, и затем лигировать вместе для получения длинного фрагмента.
В настоящее время является возможным получать последовательность ДНК, кодирующую белок по настоящему изобретению (или его фрагмент, или производное), исключительно химическим синтезом. Затем эту ДНК можно вводить в различные существующие молекулы ДНК (например, векторы) и клетки, известные в данной области. Кроме того, некоторые мутации также можно вводить в белок по настоящему изобретению химическим синтезом.
Изобретение также относится к векторам, содержащим полинуклеотиды по изобретению, клеткам-хозяевам, полученным генетической модификацией с использованием этих векторов или кодирующих белок ELb последовательностей, так же как способам получения полипептидов по изобретению рекомбинантными способами.
С использованием общепринятых способов рекомбинантной ДНК (Science, 1984; 224:1431) полинуклеотидные последовательности по изобретению можно использовать для экспрессии или продукции рекомбинантных белков ELb. Это, как правило, включает в себя следующие стадии:
(1) трансформацию или трансдукцию подходящих клеток-хозяев полинуклеотидом (или его вариантами), кодирующим белок ELb, или рекомбинантным экспрессирующим вектором, содержащим указанный полинуклеотид;
(2) культивирование клеток-хозяев в подходящей среде;
(3) выделение и очистку белка из среды или клеток.
По изобретению полинуклеотидную последовательность, кодирующую белок ELb, можно вставлять в рекомбинантный экспрессирующий вектор. Термин «рекомбинантный экспрессирующий вектор» обозначает бактериальную плазмиду, фаг, дрожжевую плазмиду, вирус клеток растений, вирус клеток млекопитающих или другие векторы. В общей сложности, можно использовать любую плазмиду и вектор при условии, что они способны к репликации и стабилизации в хозяине. Важным свойством экспрессирующего вектора является наличие точки начала репликации, промотора, маркерного гена и контролирующего трансляцию элемента.
Экспрессирующий вектор, содержащий кодирующую белок ELb последовательность ДНК и подходящие сигналы контроля транскрипции/трансляции, можно конструировать с использованием способов, хорошо известных специалистам в данной области. Эти способы включают в себя способы рекомбинантной ДНК in vitro, способы синтеза ДНК, рекомбинантные способы in vivo и т.п. Указанную последовательность ДНК можно эффективно связывать с подходящим промотором в экспрессирующем векторе, чтобы управлять синтезом мРНК. Экспрессирующий вектор может содержать участок связывания рибосомы в качестве участка инициации трансляции и терминатор транскрипции.
Кроме того, экспрессирующий вектор предпочтительно содержит один или несколько генов селективных маркеров, например, дигидрофолатредуктазы, устойчивости к неомицину или зеленого флуоресцентного белка (GFP), применимые в культуре эукариотических клеток, или устойчивости к канамицину, или устойчивости к ампициллину, применимые в культуре E. coli, для обеспечения фенотипов, применимых для отбора трансформированных клеток-хозяев.
Вектор, содержащий подходящую последовательность ДНК, описанную выше, и подходящий промотор или контрольную последовательность, описанные выше, можно использовать для трансформации подходящих клеток-хозяев для экспрессии белков.
Клетки-хозяева могут представлять собой клетки прокариот, такие как клетки бактерий; или клетки низших эукариот, такие как клетки дрожжей; или клетки высших эукариот, такие как клетки растений. Репрезентативными примерами являются E.coli, Streptomyces, Agrobacterium; клетки грибов, например, дрожжей; клетки растений и т.п.
Вставленная в вектор энхансерная последовательность может усиливать транскрипцию, когда полинуклеотид по изобретению экспрессируют в клетках высших эукариот. Энхансер, цис-действующий фактор ДНК, как правило, содержит приблизительно 10-300 пар оснований и действует на промотор для усиления транскрипции гена.
Обычным специалистам в данной области понятно, как выбирать подходящие векторы, промоторы, энхансеры и клетки-хозяева.
Трансформацию клеток-хозяев рекомбинантной ДНК можно проводить с использованием общепринятых способов, хорошо известных специалисту в данной области. В случае прокариотических хозяев, таких как E.coli, компетентные клетки, способные поглощать ДНК, можно получать сбором клеток после фазы экспоненциального роста и обработкой клеток CaCl2. Эти способы получения хорошо известны в данной области. В другом способе используют обработку MgCl2. Трансформацию, при необходимости, можно проводить также электропорацией. В случае эукариотических хозяев, можно использовать любые подходящие способы трансфекции ДНК, например копреципитацию фосфатом кальция, общепринятые механические способы, такие как микроинъекция, электропорация, инкапсуляция в липосомы и т.п. Клетки растений можно трансформировать с использованием способов, подобных трансформации Agrobacterium или трансформации генной пушкой, и других способов, таких как способ листовой пластинки, трансформации незрелого зародыша риса и т.д. Трансформированным клеткам, тканям или органам растений обеспечивают возможность регенерировать до новых растений посредством общепринятых способов, для получения растений с измененными признаками.
Полученные трансформанты можно выращивать общепринятыми способами для экспрессии полипептида, кодируемого генами по изобретению. Культуральную среду можно выбирать из различных общепринятых сред, в зависимости от используемых клеток-хозяев. Культивирование проводят в условиях, подходящих для роста клетки-хозяина. Выбранный промотор можно индуцировать с использованием подходящего способа (например, изменениями температуры или химическими индукторами), когда клетки-хозяева выращены до подходящей плотности, и затем клетки культивируют в течение дополнительного периода.
Рекомбинантные полипептиды, описанные выше, можно экспрессировать внутри клеток или на мембране клеток, или секретировать из клеток. При необходимости рекомбинантные белки можно выделять и очищать различными способами выделения, используя преимущества их физических, химических и других свойств. Эти способы хорошо известны специалистам в данной области. Такие способы включают в себя в качестве неограничивающих примеров общепринятые обработки для ренатурации, обработки преципитирующими белок средствами (высаливание), центрифугирование, разрушение бактерий осмосом, ультраобработку, ультрацентрифугирование, хроматографию на молекулярных ситах (гель-фильтрацию), адсорбционную хроматографию, ионообменную хроматографию, высокоэффективную жидкостную хроматографию (HPLC) и другую жидкостную хроматографию, и их сочетания.
Рекомбинантные белки ELb можно использовать, например, для скрининга антител, полипептидов или других лигандов, способных усиливать или ингибировать функции белка ELb. Скрининг библиотеки полипептидов с помощью экспрессированного рекомбинантного белка ELb можно использовать для поиска полезных полипептидных молекул, ингибирующих или стимулирующих функции белка ELb.
Частичные или полные полинуклеотиды по изобретению можно иммобилизовать на микромассиве или чипе ДНК («генном чипе») в качестве зондов для анализа дифференциальной экспрессии генов в тканях. Транскрипты белка ELb можно детектировать амплификацией in vitro с использованием РНК-полимеразной цепной реакции (RT-PCR) и специфических праймеров для белка ELb.
Изобретение также относится к способам для улучшения сельскохозяйственных растений, включающим в себя регуляцию экспрессии или активности гена ELb или гомологичного ему гена у растений. Усиление или ингибирование экспрессии или активности ELb зависит от признаков растений, подлежащих улучшению. Потребности в уменьшении высоты и размеров растений, или увеличении кущения и урожайности растений можно удовлетворять увеличением экспрессии или активности ELb в сельскохозяйственных растениях; альтернативно, потребности в увеличении размеров цветковых органов, размеров семян, высоты или размеров растений можно удовлетворять ингибированием экспрессии или активности регулирующих высоту растений генов в сельскохозяйственных растениях.
Способы усиления экспрессии гена ELb или гомологичного ему гена хорошо известны в данной области. Например, экспрессирующую конструкцию, содержащую кодирующий ELb ген, можно вводить в растение для сверхэкспрессии ELb; или усилением экспрессии гена ELb или гомологичного ему гена можно управлять посредством сильного промотора; или экспрессию гена ELb можно усиливать посредством энхансера (например, первого интрона гена waxy риса, первого интрона гена актина и т.д.). Сильные промоторы, подходящие для этих способов, включают в себя в качестве неограничивающих примеров: промотор 35s, промоторы Ubi риса и кукурузы и т.д.
Способы ингибирования экспрессии гена ELb или гомологичного ему гена хорошо известны в данной области. Например, ингибирования можно достигать способами РНК-интерференции (РНКи) или выключения (нокаута) гена.
В качестве предпочтительного варианта осуществления изобретения, способ получения растения с высокой экспрессией ELb включает в себя следующие стадии:
(1) получение клеток Agrobacterium, несущих экспрессирующий вектор, содержащий кодирующую последовательность ДНК для белка ELb;
(2) приведение клеток, тканей или органов растений в контакт с клетками Agrobacterium, описанными на стадии (1), для введения указанной кодирующей последовательности ДНК для белка ELb в клетки, ткани или органы растений и обеспечение для нее возможности интеграции в хромосомы клеток растений;
(3) отбор клеток, тканей или органов растений, содержащих указанную кодирующую последовательность ДНК для белка ELb; и
(4) обеспечение возможности клеткам, тканям или органам растений, описанным на стадии (3), регенерировать до нового растения.
Любые подходящие общепринятые средства, включая реагент, температуру, давление и т.д., можно использовать для осуществления этого способа на практике.
Кроме того, настоящее изобретение относится к агонистам или антагонистам белка ELb или кодирующего его гена. Агонисты или антагонисты могут регулировать активность или экспрессию ELb, таким образом, их можно использовать для регуляции высоты, размеров, кущения, урожайности, размеров цветковых органов или размеров семян растений, и т.п., для сельскохозяйственных растений посредством их эффектов на функции ELb, для достижения цели улучшения признаков.
Антагонист ELb относится к средству, способному уменьшать активность и стабильность ELb, осуществлять понижающую регуляцию экспрессии ELb, уменьшать эффективное время действия ELb или ингибировать транскрипцию или трансляцию ELb. Эти средства можно использовать, в соответствии с настоящим изобретением, в качестве средств, применимых для увеличения размеров цветковых органов, размеров семян, высоты растений или размеров сельскохозяйственных растений.
Агонист ELb относится к средству, способному усиливать активность ELb, поддерживать стабильность ELb, стимулировать экспрессию ELb, увеличивать эффективное время действия ELb или стимулировать транскрипцию или трансляцию ELb. Эти средства можно использовать, в соответствии с настоящим изобретением, в качестве средств, применимых для уменьшения высоты и размеров растений и увеличения кущения и урожайности сельскохозяйственных растений.
В одном варианте осуществления изобретение относится к гену ELb, обладающему геномной последовательностью, как указано в SEQ ID NO: 1, где открытая рамка считывания (ORF) локализована в областях 61-353, 1363-1585, 1690-1943, 2028-2414, 2559-2979, и полноразмерная кДНК (SEQ ID NO: 1) обладает 1578 п.о., кодирующими белок, содержащий 525 аминокислот (SEQ ID NO: 3). Ген ELb предоставляет новые средства для улучшения высоты, размеров, урожайности, кущения растений и т.д. для сельскохозяйственных растений и обладает, таким образом, многообещающими перспективами.
Промотор для специфической экспрессии в стеблях или листьях растений и управления экспрессией гена
Как применяют в настоящем документе, «промотор» или «промоторная область» обозначает нуклеотидную последовательность, обычно локализованную выше (на 5'-конце) по отношению к кодирующей последовательности гена-мишени, которая инициирует транскрипцию полинуклеотидной последовательности в мРНК. Как правило, промотор или промоторная область может предоставлять участок узнавания для РНК-полимераз и других факторов, необходимых для правильной инициации транскрипции. В настоящем документе промотор или промоторная область включает в себя вариант промотора, т.е., природный аллельный вариант или неприродный вариант, включая вариант с заменами, вариант с делециями и вариант со вставками.
Как применяют в настоящем документе, «тканеспецифический промотор» или «органоспецифический промотор» означает, что экспрессия гена обычно происходит только в конкретных определенных органах или тканях под контролем этих промоторов.
Как применяют в настоящем документе, «функционально связанный» обозначает функциональное пространственное расположение двух или более областей нуклеиновой кислоты или последовательностей нуклеиновой кислоты. Например, промоторная область локализована в определенном положении по отношению к последовательности нуклеиновой кислоты гена-мишени, так что транскрипция последовательности нуклеиновой кислоты находится под контролем промоторной области, соответственно, промоторная область может являться «функционально связанной» с последовательностью нуклеиновой кислоты.
Как правило, промотор считают тканеспецифическим или органоспецифическим, если экспрессия мРНК в ткани или органе по меньшей мере в 2 раза, предпочтительно, по меньшей мере в 5 раз, более предпочтительно, по меньшей мере в 10 раз, более предпочтительно, по меньшей мере в 25 раз, более предпочтительно, по меньшей мере в 50 раз, еще более предпочтительно, по меньшей мере в 100 раз, наиболее предпочтительно, по меньшей мере в 1000 раз выше, чем в других тканях или органах.
Изобретение относится к промотору, выбранному из группы, состоящей из:
(1) полинуклеотида, обладающего нуклеотидной последовательностью, указанной в SEQ ID NO: 13; или
(2) полинуклеотида, гибридизующегося с последовательностью полинуклеотида, описанного в (1), в строгих условиях и управляющего специфической экспрессией гена-мишени в стеблях или листьях растений.
По изобретению, «строгие условия» относятся к (1) гибридизации и отмывке при более низкой ионной силе и более высокой температуре, например, 0,2x SSC, 0,1% SDS и 60°C; или (2) гибридизации в присутствии денатурирующего средства, например, 50% (об./об.) формамида, 0,1% бычьей сыворотки/0,1 % фиколла и 42°C, и т.д.; или (3) гибридизации, происходящей только между двумя последовательностями, имеющими по меньшей мере 80%, предпочтительно, по меньшей мере 90%, более предпочтительно, более 95% идентичности. Более того, способный гибридизоваться полинуклеотид может управлять специфической экспрессией гена-мишени в стеблях или листьях растений.
Гибридизация полинуклеотидов является способом, хорошо известным специалистам в данной области, и профиль гибридизации пары определенных полинуклеотидов показывает их сходство или идентичность. Таким образом, изобретение, кроме того, относится к полинуклеотиду, гибридизующемуся с нуклеотидной последовательностью, указанной в SEQ ID NO: 13, и имеющему по меньшей мере 50%, предпочтительно, по меньшей мере 60%, более предпочтительно, по меньшей мере 70%, еще более предпочтительно, по меньшей мере 80%, даже еще более предпочтительно, по меньшей мере 85%, более предпочтительно, по меньшей мере 90% (например, 95%, 96%, 97%, 98% или 99%) идентичности с нуклеотидной последовательностью, указанной в SEQ ID NO: 13.
Промотор по изобретению является специфическим для ткани или органа растений, в частности для стеблей или листьев растений. В некоторых вариантах осуществления изобретения авторы изобретения открыли, что ген ELb или ген GUS можно специфически экспрессировать в стеблях и листьях растений, по существу, без экспрессии в других тканях или органах, под контролем промотора по изобретению.
Промотор по изобретению можно функционально связывать с геном-мишенью, который может являться экзогенным (гетерогенным) по отношению к промотору. Ген-мишень обычно представляет собой нуклеотидную последовательность (предпочтительно, структурную нуклеотидную последовательность), и предпочтительно, кодирует белок с определенной функцией, такой как конкретные белки, регулирующие рост стеблей и листьев растений, в частности белки, связанные с высотой растений, согласно вариантам осуществления по изобретению.
Промотор по изобретению можно также функционально связывать с улучшенным геном-мишенью, который является экзогенным (гетерогенным) по отношению к промотору. Ген-мишень можно улучшать, чтобы он обладал различными желательными свойствами, такими как усиленная экспрессия, измененная посттрансляционная модификация (например, участок фосфорилирования), транспорт продукта трансляции из клетки, улучшенная стабильность, вставка или делеция клеточного сигнала и т.д.
Кроме того, промотор и ген-мишень можно сконструировать для понижающей регуляции определенного гена, что обычно достигают связыванием промотора с последовательностью гена-мишени и инициацией считывания последовательности в обратном направлении и антисмысловым образом. Специалистам в данной области знакомы антисмысловые способы. Любые нуклеотидные последовательности можно регулировать таким образом.
Любой промотор и последовательность гена-мишени, описанные выше, можно включать в конструкцию, в частности в рекомбинантный вектор.
Рекомбинантный вектор обычно содержит функционально связанные (обычно 5'→3') промотор для инициации транскрипции гена-мишени и ген-мишень. При необходимости рекомбинантный вектор может дополнительно содержать 3'-терминатор транскрипции, 3'-сигнал полиаденилирования, другие нетранслируемые нуклеотидные последовательности, нуклеотидную последовательность для транспорта или нацеливания, селективный маркер устойчивости, энхансер или оперон.
Как правило, ген-мишень локализован через менее 2000 п.о. (предпочтительно, менее 1000 п.о., более предпочтительно, менее 500 п.о., наиболее предпочтительно, менее 300 п.о.) на 3'-конце по отношению к промотору для специфической экспрессии в стеблях или листьях растений.
В дополнение к промотору по изобретению, рекомбинантный вектор может дополнительно содержать один или несколько других промоторов, таких как тканеспецифические, конститутивные или индуцибельные промоторы.
Вектор, содержащий подходящий промотор, описанный выше, и ген-мишень, можно использовать для трансформации подходящих клеток-хозяев для экспрессии белка.
Преимуществами изобретения являются:
(1) Предоставление нового выделенного регулирующего высоту растений гена, который является способным регулировать для растений высоту, размеры, кущение, урожайность, размеры цветковых органов или размеры семян сельскохозяйственных растений; таким образом, его можно использовать для улучшения культиваров сельскохозяйственных растений.
(2) Регуляторным геном по изобретению можно трансформировать сельскохозяйственные растения для уменьшения высоты растений, что может являться применимым в выведении карликовых форм растений, поскольку умеренно пониженная высота растений и увеличенные эффективные коэффициенты кущения являются идиотипами высокоурожайного скрещивания. Например, различные уровни экспрессии в сельскохозяйственных растениях Gramineae можно использовать для уменьшения высоты растений до различных степеней для увеличения эффективных коэффициентов кущения и урожайности.
(3) Впервые выделен промотор регулирующего высоту растений гена, который управляет специфической экспрессией в стеблях или листьях растений, и который можно использовать для регуляции специфической экспрессии гена-мишени в стеблях или листьях растений.
Изобретение в настоящее время более подробно описано в сочетании со следующими ниже примерами. Следует понимать, что эти примеры представлены только для иллюстрации без ограничения объема изобретения. Анализы, которые не описаны конкретно в следующих ниже примерах, можно выполнять согласно общепринятым способам, как описано в Sambrook et al, Molecular Cloning: Laboratory Manual (Cold Spring Harbor Laboratory Press, New York, 2001) или PCR primer: Laboratory Manual (Carl W. Dieffenbach and Oabriela S. Devksler eds., Cold Spring Harbor Laboratory Press, 1995), или по рекомендациям производителей.
Материалы
1.1 Растительные материалы
Arabidopsis thaliana, экотип Columbia (Col-0).
Мутант со вставкой T-ДНК: ELa (SALK_016089)
Культивар риса: Taipei 309 (Oryza sativa L.ssp Japonica. cv Taipei309, TP309).
1.2 Штаммы бактерий и плазмидные векторы
Agrobacterium tumefaciens: GV3101 (смотри Narasimhulu, S.B, et al, Gelvin. 1996. Early transcription of Agrobacterium t-DNA genes in tobacco and maize. Plant Cell 8:873-886), EHA105 (см. Hood, E.E. et al, 1993, New Agrobacterium helper plasmids for gene transfer to plants. Transgen. Res. 2:208-218).
Плазмидные векторы:
pBlucscript SK (pSK): закуплен из Invitrogen Inc.
pCambia1300S: pCambia1300RS, закуплен из CAMBIA.
pBI101.1: закуплен из Invitrogen Inc.
вектор pGEM-T Easy: закуплен из Promega Inc.
вектор для РНКи 1300RS: доступен из Arkansas State University, USA.
1.3 Реагенты и ферменты
T4 ДНК-лигаза, различные рестрикционные эндонуклеазы и Taq ДНК-полимераза закуплены из MBI Ferment, TaKaRa, New England Biolabs или Promega. Набор для выделения фрагментов ДНК из геля закуплен из Omega Inc. Система для обратной транскрипции закуплена из GIBCOBRL. Маркеры молекулярной массы нуклеиновых кислот являются продуктами MBI. Вектор pGEM-Teasy закуплен из Promega Inc. (Madison, USA). (α-32P)dCTP закуплен из YaHui Bioengineering Inc. (Beijing, China). Для RT-PCR использовали набор для обратной транскрипции с использованием системы синтеза первой цепи SuperScript (#11904-018, Invitrogen). Другие общепринятые химические реагенты представляли собой аналитически чистые продукты, импортированные или изготовленные в Китае. Различные дезоксинуклеотидные праймеры синтезированы в Sangon Inc, Shanghai, China. Последовательности ДНК определяли в JiKang Inc., Shanghai; или Invitrogen Inc., Shanghai. Анализ последовательности завершали с использованием программного обеспечения Genedoc, DNAStar и т.д.
Методы
1. Культивирование и трансформация Arabidopsis thaliana
Для стерильного культивирования Arabidopsis thaliana, семена стерилизовали на поверхности (посредством 70% этанола в течение 30 сек, затем промывки 4X стерильной водой) и внутри (посредством 7% гипохлорита натрия в течение 10 мин, затем промывки 3X стерильной водой), и затем высевали на твердую среду 1/2 MS (1/2 основной среды Мурасиге и Скуга, 0,8% агар, pH 5,8), помещали на 4°C на 72 час, и затем переносили на 22°C. Через одну неделю сеянцы пересаживали в искусственную почву (вермикулит: чернозем: перлит = 3:1:0,5), увлажненную питательным раствором (HuaWuQue 3 г/10 л, YongTong Chemical Ltd, Shanghai, China), и затем переносили в камеру с искусственным климатом с суточным циклом 14/10(L/D).
Для трансформации Arabidopsis thaliana растения в возрасте 4-5 недель с благоприятным характером роста (с отрезанным за 1 неделю до трансформации главным побегом, чтобы стимулировать развитие большего числа боковых побегов и большего числа цветков, увеличивая таким образом эффективность трансформации) обрабатывали опрыскиванием. Клетки Agrobacterium tumefaciens, содержащие трансгенные векторы, выращивали до OD600 ~ 2,0 при 28°C и затем центрифугировали при 4000 об/мин в течение 10 мин, осадок ресуспендировали в свежеприготовленном растворе для трансформации (жидкая среда 1/2 MS, содержащая 5% сахарозы и 0,02% Silwet L-77), и выращивали до конечной концентрации, соответствующей OD600 ~ 0,6-0,8. Опыленные цветки и плоды удаляли перед трансформацией, и затем почве позволяли адсорбировать достаточное количество воды. Во время трансформации суспензией бактерий опрыскивали растения Arabidopsis thaliana, пока небольшое количество капель суспензии не начинало капать с листьев. Растения накрывали темными пакетами для поддержания влажности в течение ночи в темноте. Через 24 час растения переносили в нормальные условия. Через 7 суток трансформацию повторяли один раз согласно способу, описанному выше. Растения собирали и перемешивали в бумажном пакете после созревания семян. Собранные растения помещали в десикатор на 7 суток и затем обмолачивали. Стерилизованные семена поколения T1 высевали на среду 1/2 × MS, содержащую 50 мкг/мл Kan или гигромицина, помещали на 4°C на 72 час и затем помещали в нормальные условия освещения.
2. Генная трансформация каллюса зрелого зародыша риса, опосредованная Agrobacterium tumefaciens
(1) индукция образования каллюса зрелого зародыша риса
Семена риса 307T обрушивали, затем замачивали в 70% этаноле в течение 1 мин и в 20%(об./об.) гипохлорите натрия в течение 20-30 мин, с постоянным встряхиванием. Семена ополаскивали стерильной водой 5-6 раз. После осушения впитыванием стерильной фильтровальной бумагой, семена риса высевали на среду MSD и выращивали при 26°C в темноте для индукции образования каллюса. Через одну неделю эндосперм, почечку зародыша и зародышевый корень удаляли для получения каллюса, и полученный каллюс пассировали на MSD в темноте. Его пассировали каждые 2-3 недели. В случае каллюса семян TP309 используемая среда представляла собой NBD.
(2) Получение суспензии бактерий, применимой для трансформации
Утром суток 1: небольшую часть бактерий, хранящихся при -70°C, инокулировали в 5 мл жидкой среды YEB (Rif 20 мг/л + Kan 50 мг/л) и культивировали с покачиванием при 28°C в течение ночи.
Утром суток 2: 1-2 мл среды YEB, содержащей бактерии, собирали и переносили в 25-50 мл жидкой среды AB (20 мг/л Rif + 50 мг/л Kan) и затем выращивали при 28°C в течение приблизительно 4 час до OD600 ~ 0,5.
(3) Совместное культивирование
Вечером суток 2: после определения значения OD600 суспензию бактерий центрифугировали при 5000 об/мин в течение 15 мин, осадок ресуспендировали в AAM (содержащей AS100) и культивировали до OD600=0,4-0,6. Суспензию бактерий заливали в треугольную колбу, содержащую каллюс риса, и каллюс замачивали в течение 20 мин с перемешиванием время от времени; после осушения суспензии бактерий впитыванием стерильной фильтровальной бумагой (или пипеткой), смоченный каллюс переносили в среду NBD (AS100), содержащую 2,5% фитагель со слоем стерильной фильтровальной бумаги на нем, и проводили совместное культивирование в течение 2-3 суток, и затем в каждую чашку добавляли 1 мл среды AAM (+AS100) для достаточного увлажнения стерильной фильтровальной бумаги.
(4) Скрининг
После осушения впитыванием стерильной фильтровальной бумагой (новой фильтровальной бумагой), каллюс переносили на среду для скрининга, содержащую гигромицин (Hyg), для скрининга устойчивого каллюса. Каллюс культивировали в темноте в течение приблизительно 30 суток, в течение которых среду для скрининга меняли один раз. Используемые среды для скрининга представляли собой:
среду для первого скрининга, содержащую 0,26% фитагель MS + тиментин 100 мг/л + Hyg 30 мг/л;
среду для второго скрининга, содержащую 0,26% фитагель NBD + тиментин 100 мг/л + Hyg 50 мг/л;
среду для третьего скрининга, содержащую 0,26% фитагель MS + тиментин 100 мг/л + Hyg 50 мг/л.
(5) Предварительная дифференцировка
Каллюс риса после скрининга переносили в среду для предварительной дифференцировки и выращивали в течение 10 суток.
Среда для предварительной дифференцировки: содержащая 0,45% фитагель MS+ BAP 2 мг/л + NAA 1 мг/л + ABA 5 мг/л + Hyg 50 мг/л, pH 5,7, без 2,4-дихлорфеноксиуксусной кислоты (2,4-D).
(6) Дифференцировка
Каллюс риса после предварительной дифференцировки переносили в среду для дифференцировки и культивировали до дифференцировки до молодого растения (при свете, 15-30 суток).
Среда для дифференцировки: содержащая 0,45% фитагель NB+BAP 3 мг/л + NAA 0,5 мг/л, pH 5,7, без 2,4-D.
(7) Укоренение
Для укоренения зеленое молодое растение переносили в среду для укоренения.
Среда для укоренения: содержащая 0,45% фитагель 1/2 MS + Hyg 50 мг/л, pH 5,7, без 2,4-D.
3. Конструирование вектора
Конструирование вектора p35S::ELb
Последовательность кодирующей области кДНК белка ELb амплифицировали посредством RT-PCR. Стадии являлись следующими: тотальную РНК растения Arabidopsis thaliana выделяли посредством набора RNeasy Plant Mini (Qiagen) согласно инструкции, предоставленной производителем, и затем проводили обратную транскрипцию полученной тотальной РНК для получения кДНК ELb с помощью M-MLV обратной транскриптазы (Promega). Последовательность кодирующей области кДНК белка ELb амплифицировали посредством реакции PCR с использованием ДНК-полимеразы Takara perobest и вышеуказанную кДНК использовали в качестве матриц. Используемые праймеры представляли собой:
Верхний праймер (SEQ ID NO: 7):
5'-TGAGGATCCAAATAAAATAAAAAG-3' (подчеркнуто: участок для BamHI);
Нижний праймер (SEQ ID NO: 8):
5'-AAAGTCGACCACACACAAAGCAAA-3' (подчеркнуто: участок для ClaI).
Условия PCR: 94°C в течение 3 мин; 35 циклов 94°C в течение 30 с, 58°C в течение 30 с и 72°C в течение 2 мин; 72°C в течение 10 мин. Продукт сохраняли при 16°C.
Продукт PCR выделяли и расщепляли и BamHI, и ClaI. Продукт выделяли и затем лигировали в вектор pSK, который был также расщеплен и выделен, как выше. Полученный вектор использовали для трансформации клеток DH5α. Правильный клон, подтвержденный рестрикционным расщеплением, выбирали для секвенирования. Для клона с правильной последовательностью, подтвержденной секвенированием, кодирующую область кДНК ELb расщепляли посредством BamHI/ClaI и лигировали в бинарный экспрессирующий вектор pCambia1300S, расщепленный посредством BamHI/ClaI, и трансформировали клетки DH5α для получения трансгенных клонов. После выделения правильной плазмидой, подтвержденной рестрикционным расщеплением, трансформировали клетки Agrobacterium tumefaciens GV3101 и EHA105. Плазмиду выделяли из клеток Agrobacterium tumefaciens и повторно трансформировали ею клетки DH5α. Плазмиду выделяли из DH5α и расщепляли рестрикционными ферментами для верификации клеток Agrobacterium tumefaciens, трансформированных правильной плазмидой. Трансгенные растения Arabidopsis thaliana получали трансформацией клеток Arabidopsis thaliana способом опрыскивания, и трансгенные растения риса получали опосредованной Agrobacterium tumefaciens генной трансформацией каллюса зрелого зародыша риса.
Конструирование вектора pELbпромотор::GVS
Верхний и нижний праймеры конструировали на основании последовательностей (GeneID: 832559), доступных из GenBank, и праймеры находились в диапазоне 1,4 т.п.о. выше участка инициации трансляции гена ELb. Геномную ДНК, выделенную из молодого растения (в возрасте 7 суток) Arabidopsis thaliana Columbia дикого типа использовали в качестве матрицы для проведения PCR. Указанные праймеры являлись следующими:
Верхний праймер (SEQ ID NO: 9): 5'-CTGCTGCAGACTCTATTTCCA-3' (подчеркнуто: участок для PstI);
Нижний праймер (SEQ ID NO: 10):
5'-TTCAGGATCCTTTACTTTTTATTTT-3' (подчеркнуто: участок для BamHI);
Условия амплификации: 94°C в течение 3 мин; 35 циклов 94°C в течение 30 с, 58°C в течение 30 с, 72°C в течение 2 мин; 72°C в течение 10 мин. Продукт сохраняли при 16°C.
Продукт PCR расщепляли ферментами PstI/BamHI и затем лигировали в соответствующий участок PstI/BamHI в векторе pSK. Правильный клон, подтвержденный рестрикционным расщеплением, выбирали для секвенирования. Для клона с правильной последовательностью, подтвержденной секвенированием, промоторную область ELb (как указано в SEQ ID NO: 13) расщепляли PstI/BamHI и лигировали в бинарный экспрессирующий вектор pBHI101.1, расщепленный посредством PstI/BamHI, и трансформировали клетки E.coli. DH5α. После выделения правильной плазмидой, подтвержденной рестрикционным расщеплением, трансформировали клетки Agrobacterium tumefaciens GV3101. Плазмиду выделяли из клеток Agrobacterium tumefaciens и повторно трансформировали ею клетки DH5α. Плазмиду выделяли из DH5α и расщепляли рестрикционными ферментами для верификации клеток Agrobacterium tumefaciens, трансформированных правильной плазмидой. При этом векторами pBHI101.1 трансформировали клетки GV3101 в качестве отрицательного и положительного контролей, соответственно.
Конструирование трансгенного по РНКи ELb растения на фоне мутанта со вставкой T-ДНК Ela
Трансгенный клон конструировали с использованием вектора 1300RS для РНКи следующим образом.
Геномную ДНК молодого растения (в возрасте 7 суток) Arabidopsis thaliana Columbia дикого типа использовали в качестве матрицы для проведения PCR для амплификации последовательности приблизительно 500 п.о. в четвертом экзоне гена ELb. Указанные праймеры являлись следующими:
Верхний праймер (SEQ ID NO: 11): 5'-AATGGTACCACAAGAAACAA-3' (подчеркнуто: участок для KpnI);
Нижний праймер (SEQ ID NO: 12):
3'-TCTAGATTTGAGCTGAAAAAA-3' (подчеркнуто: участок для XbaI).
Условия амплификации: 94°C в течение 3 мин; 35 циклов 94°C в течение 30 c, 50°C в течение 30 c, 72°C в течение 30 sec; 72°C в течение 10 мин. Продукт сохраняли при 16°C.
Продукт PCR расщепляли ферментами KpnI/XbaI и затем лигировали в соответствующий участок KpnI/XbaI вектора pSK. Правильный клон, подтвержденный рестрикционным расщеплением, выбирали для секвенирования. Для клона с правильной последовательностью, подтвержденной секвенированием, частичный фрагмент ELb расщепляли посредством KpnI/XbaI и лигировали в бинарный экспрессирующий вектор 1300RS, расщепленный посредством KpnI/XbaI, и трансформировали клетки E.coli DH5α. После выделения правильной плазмидой, подтвержденной рестрикционным расщеплением, трансформировали клетки Agrobacterium tumefaciens GV3101. Плазмиду выделяли из клеток Agrobacterium tumefaciens и повторно трансформировали ею клетки DH5α. Плазмиду выделяли из DH5α и расщепляли рестрикционными ферментами для верификации клеток Agrobacterium tumefaciens, трансформированных правильной плазмидой.
С мутантом со вставкой T-ДНК ELa проводили трансформацию способом опрыскивания для получения трансгенного растения с РНКи для ELb (ELb РНКи/eLa) Arabidopsis thaliana на фоне мутанта со вставкой T-ДНК ELa.
Пример 1: Клонирование гена ELb
Авторы изобретения открыли 2 гена монооксигеназы p450, т.е., 714A1 и 714A2, посредством поиска в геномных последовательностях Arabidopsis thaliana и проведения биоинформатического исследования. Первоначально авторы изобретения предсказали, что они вовлечены в рост и развитие растения под контролем гиббереллина, и обозначили их как ELa (или AtEuila) и ELb (или AtEuilb).
Геномная последовательность ДНК кодирующей области гена ELb указана в SEQ ID NO: 1; последовательность кДНК кодирующей области гена ELb указана в SEQ ID NO: 2; белковая последовательность ELb указана в SEQ ID NO: 3. Геномная последовательность ДНК кодирующей области гена ELa указана в SEQ ID NO: 4; последовательность кДНК гена ELa указана в SEQ ID NO: 5; белковая последовательность ELa указана в SEQ ID NO: 6.
Пример 2: Уменьшение высоты и размера растений у трансгенных растений Arabidopsis thaliana со сверхэкспрессией гена ELb
В этом примере авторы изобретения получили трансгенные растения Arabidopsis thaliana со сверхэкспрессией ELb, ELa или OsEui, соответственно. Растение дикого типа (WT), трансгенное растение со сверхэкспрессией ELa Arabidopsis (ELa-OE) и трансгенное растение со сверхэкспрессией OsEui риса использовали в качестве контролей.
Профили роста наблюдали после 4 недель роста, и результаты показаны на фигуре 1. Как показано на фигуре, растение Arabidopsis thaliana дикого типа было наибольшим, растение со сверхэкспрессией ELb было по существу меньше, чем растение дикого типа, а растение со сверхэкспрессией ELa и растение со сверхэкспрессией OsEui были наименьшими.
Через 7 недель роста, авторы изобретения определили высоту растений для растения дикого типа и растений со сверхэкспрессией ELb, ELa и OsEui риса, и средние значения высоты растений составляли 26,2 см, 14,2 см, 9,63 см и 3,7 см, соответственно. Таким образом, высота растений для трансгенного растения Arabidopsis thaliana со сверхэкспрессией ELb была существенно ниже, чем для растения дикого типа.
Пример 3: РНКи или мутация нокаута ELb увеличивают высоту и размер растений
В этом примере авторы изобретения получили, начиная с варианта растения, представляющего собой мутант со вставкой T-ДНК ELa, трансгенные растения Arabidopsis thaliana с РНКи ELb (ELb РНКи/eLa) и варианты растений Arabidopsis thaliana с нокаутом гена ELb. Через 10 суток роста обоих растений наблюдали эффекты РНКи ELb или мутаций нокаута на высоту и размеры растений и сравнивали с растением дикого типа, культивированным в тех же самых условиях, в качестве контроля.
Профили роста растений ELb РНКи/eLa и растения дикого типа показаны на фигуре 2. По сравнению с растением дикого типа площади листьев, высота растений и размеры растений ELb РНКи/eLa были значительно увеличены.
Более того, по сравнению с растением дикого типа площади листьев, высота растений и размеры мутантов с нокаутом ELb (на фоне вставки T-ДНК ELa) также были значительно увеличены.
Соответственно, можно заключить, что уменьшенная или выключенная экспрессия ELb приводит к увеличенной высоте и размерам растений, т.е., ELb является геном, ассоциированным с уменьшенной высотой и размерами растений.
Пример 4: Мутация ELb РНКи/ela или мутация нокаута ELb увеличивают размеры цветковых органов и размер семян.
В этом примере авторы изобретения наблюдали профили роста для цветковых органов и семян растений Arabidopsis thaliana ELb РНКи/eLa или растений Arabidopsis thaliana с нокаутом ELb (полученных в примере 3), и сравнивали с цветковыми органами и семенами растения Arabidopsis thaliana дикого типа в качестве контролей.
Профили роста для цветковых органов и семян растений Arabidopsis thaliana ELb РНКи/eLa и растения Arabidopsis thaliana дикого типа показаны на фигуре 3. Цветковые органы и семена растения Arabidopsis thaliana ELb РНКи/eLa были значительно больше, чем у растения дикого типа.
Более того, цветковые органы и семена мутанта с нокаутом ELb также были по существу больше, чем у растения дикого типа.
Соответственно, можно заключить, что уменьшенная или выключенная экспрессия ELb приводит к увеличенным размерам цветковых органов и размерам семян растений, т.е., ELb является геном, ассоциированным с уменьшенными размерами цветковых органов и размерами семян.
Пример 5: Тканеспецифическая экспрессия репортерного гена GU8, инициированная промотором ELb
В этом примере авторы изобретения сконструировали вектор промотор p ELb::GUS, которым можно трансформировать клетки Agrobacterium tumefaciens для получения трансгенных растений Arabidopsis thaliana. Экспрессию репортерного гена GUS в растениях наблюдали общепринятым анализом для детекции репортерного гена GUS.
Результаты показаны на фигуре 4. Репортерный ген GUS был экспрессирован в буйно растущих участках стеблей и листьев растений, но по существу не был экспрессирован в корнях. Таким образом, ген ELb является тканеспецифическим геном.
Пример 6: Уменьшенная высота трансгенных растений риса со сверхэкспрессией ELb
В этом примере авторы изобретения получили трансгенные растения риса со сверхэкспрессией ELb (ELb-OE) и наблюдали сверхэкспрессию ELb в растениях риса. Растение дикого типа TP309, культивируемое в таких же условиях роста, использовали в качестве контроля.
Профили роста растений через 110 суток роста показаны на фигуре 5. Можно видеть, что высота растений для трансгенных растений риса со сверхэкспрессией ELb была значительно ниже, чем для растения дикого типа. Фигура 6 представляет собой статистическую гистограмму, показывающую высоту растений для растений со сверхэкспрессией ELb и растения дикого типа.
Пример 7: Увеличенные эффективный коэффициент кущения и урожайность трансгенного риса со сверхэкспрессией ELb
В этом примере авторы изобретения детектировали коэффициент кущения и урожайность трансгенных растений риса со сверхэкспрессией ELb (ELb-OE) и растения дикого типа TP309, чтобы продемонстрировать эффект сверхэкспрессии ELb на кущение и урожайность растений риса.
Эффективные коэффициенты кущения подсчитывали после выбрасывания метелок культивируемыми растениями, и статистические результаты показаны на фигуре 7. Коэффициент кущения растения дикого типа составлял приблизительно 10, в то время как коэффициенты кущения растений со сверхэкспрессией ELb составляли приблизительно 20-22. Можно заключить, что сверхэкспрессия ELb может значительно увеличивать эффективные коэффициенты кущения растений.
Урожайность растений со сверхэкспрессией ELb и растения дикого типа анализировали после созревания растений. Результаты показаны на фигуре 8. Можно заключить, что массы семян отдельного растения для трансгенных растений риса со сверхэкспрессией ELb были значительно увеличены.
Пример 8: Функция вариантов ELb
Кодирующую область кДНК ELb в векторе p35S::ELb заменяли на кодирующую последовательность, кодирующую белок, обладающий последовательностью, сходной с SEQ ID NO: 3, и единственным различием является Leu в положении 522 последовательности по сравнению с Ile в том же самом положении белка ELb дикого типа. Вектором трансформировали клетки Agrobacterium tumefaciens, как описано выше, для получения трансгенных растений. Результаты показали, что высота растений для трансгенных растений была ниже, чем для растения дикого типа.
Полное содержание всех публикаций, патентов и патентных заявок, процитированных в настоящем документе, таким образом, приведено в качестве ссылки, как если бы каждая отдельная публикация, патент или патентная заявка были по отдельности указаны как приведенные в качестве ссылки. Кроме того, понятно, что специалисты в данной области могут выполнять различные модификации или изменения в свете содержания, описанного в настоящем документе, и эти эквиваленты следует также включать в объем, определенный следующими пунктами формулы изобретения в заявке.
Реферат
Изобретение относится к области биотехнологии и может быть использовано в сельском хозяйстве. Предложен способ получения растения, предусматривающий введение гена из Arabidopsis thaliana, который кодирует полипептид, обладающий функцией подавления роста растений. Введение указанного гена может быть использовано не только с целью регуляции высоты растений, но и для повышения кущения и/или урожайности сельскохозяйственных культур. 2 н. и 5 з.п.ф-лы, 8 ил., 1 табл., 8 пр.
Формула
(i) нуклеотидной последовательности SEQ ID NO: 2 или
(ii) нуклеотидной последовательности SEQ ID NO: 1.
(1) получение Agrobacterium, несущей экспрессирующий вектор, содержащий полинуклеотид;
(2) приведение клетки, ткани или органа растения в контакт с Agrobacterium, описанной в (1), для введения полинуклеотида в клетку растения и обеспечение возможности его интеграции в хромосомы клеток растений;
(3) отбор клетки, ткани или органа растения, содержащих полинуклеотид, и
(4) обеспечение возможности клетке, ткани или органу растения, описанным на стадии (3), регенерировать до нового растения.
(i) нуклеотидной последовательности SEQ ID NO: 2 или
(ii) нуклеотидной последовательности SEQ ID NO: 1.

Комментарии