Способ подавления образования побегов (варианты), днк-конструкция ( варианты) и способ скрининга библиотек нуклеиновых кислот - RU2233332C2
Код документа: RU2233332C2
Чертежи







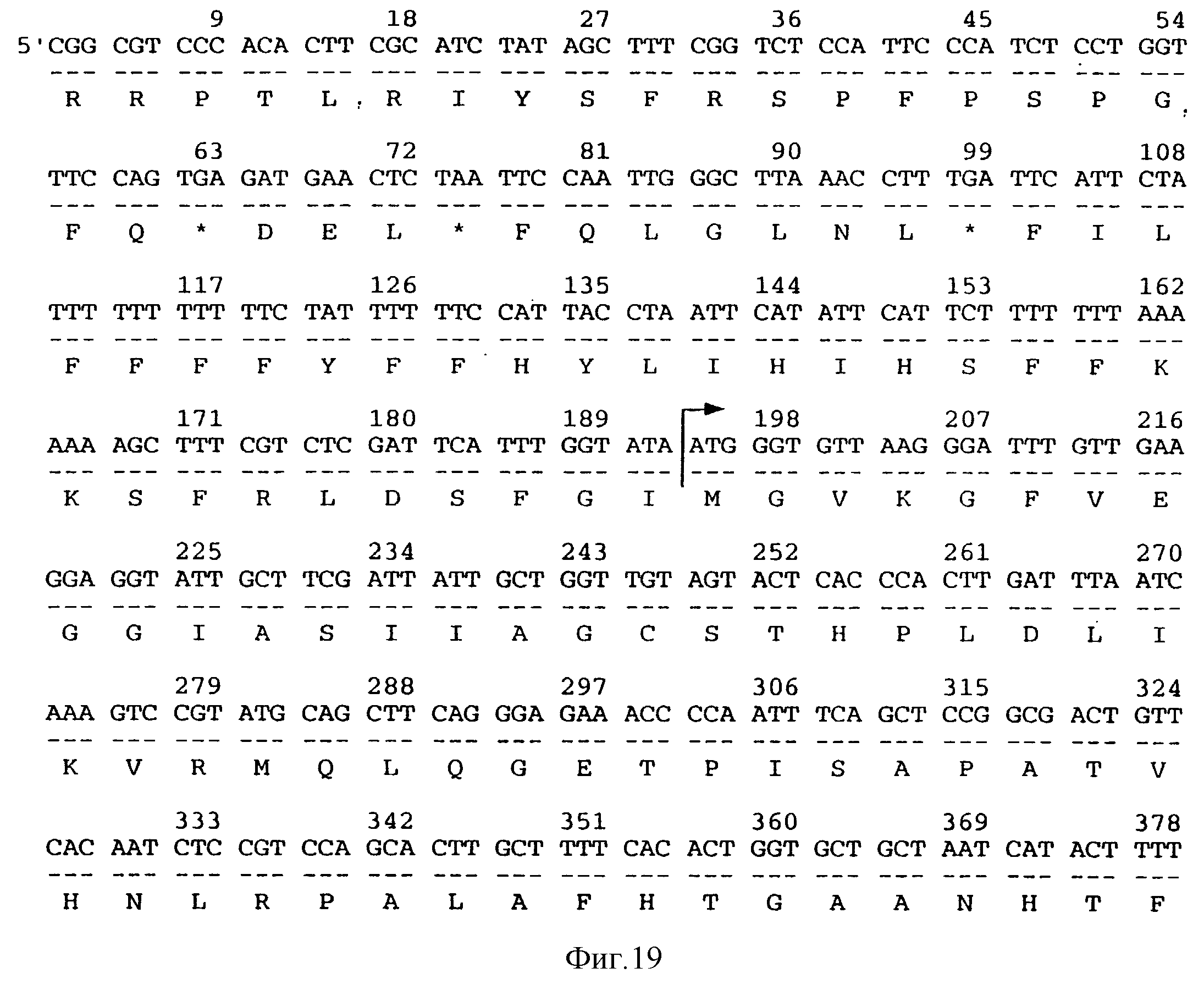

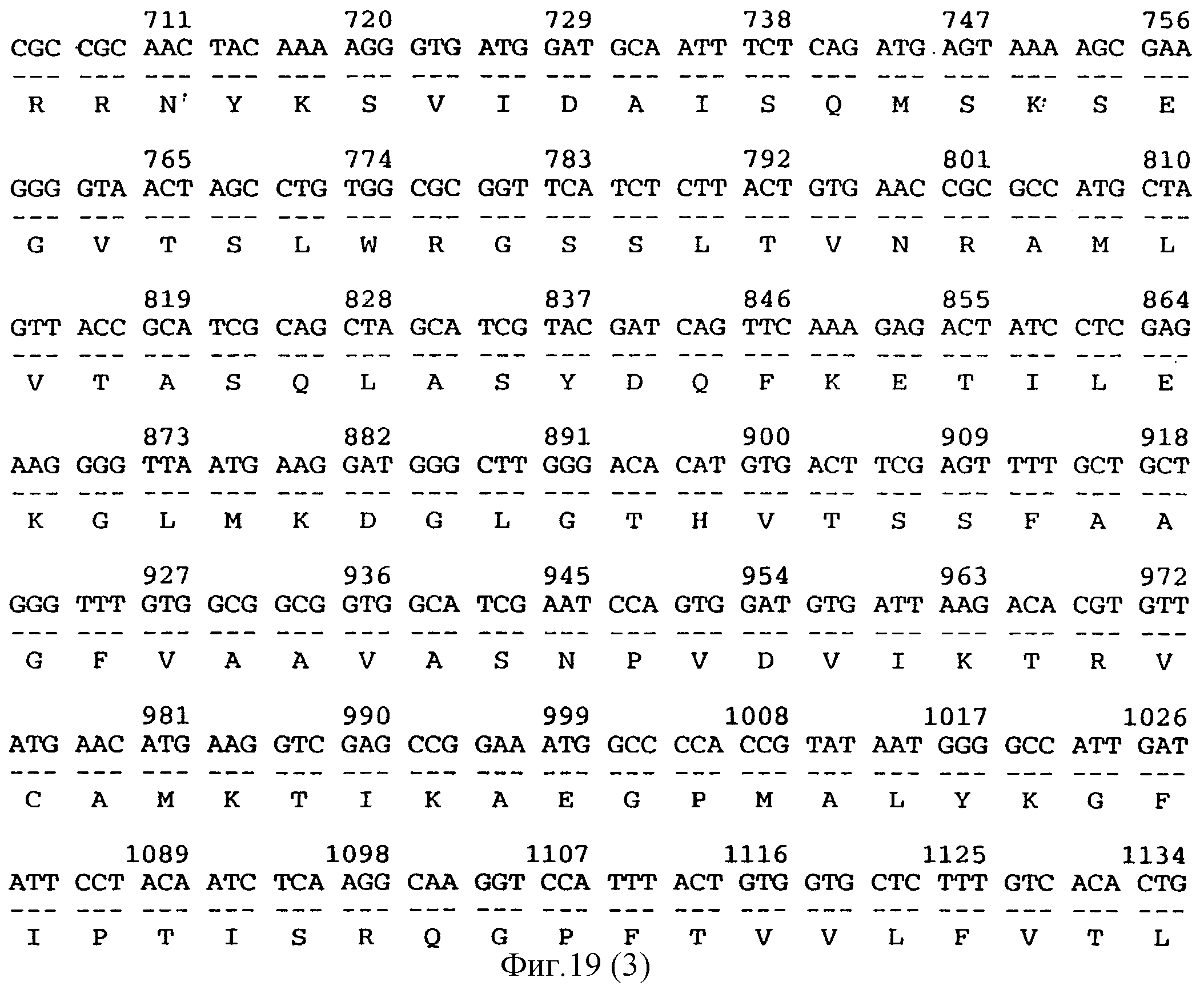







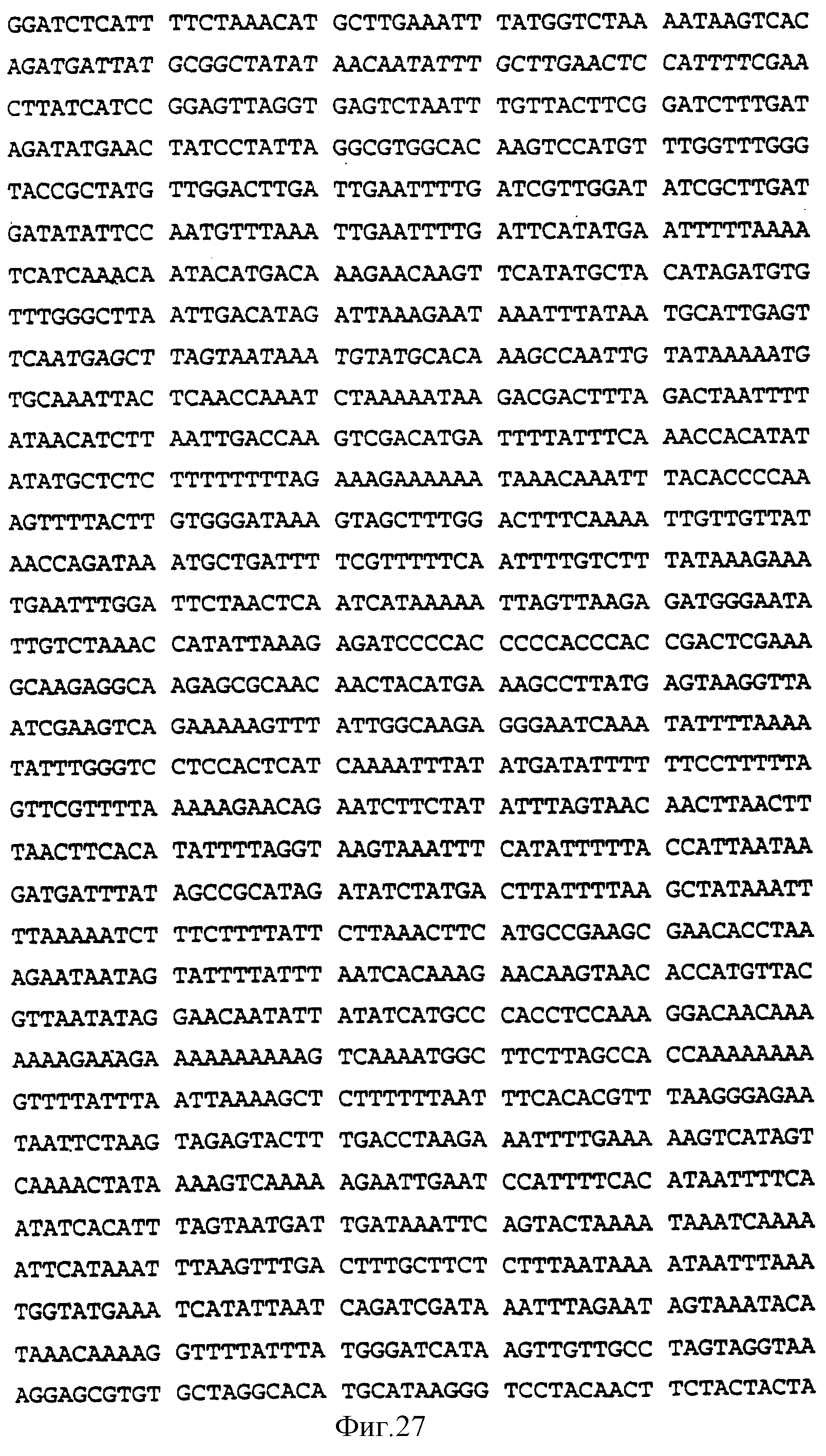


Описание
Настоящее изобретение касается способа предотвращения образования побегов растений и их частей, включая запасающие вегетативные органы.
Клубни картофеля имеют важнейшее экономическое значение. Они представляют источник углеводов для многих диет и используются в качестве основы для выработки разнообразных кулинарных продуктов. Помимо крахмала клубни содержат высококачественные белки, значительное количество витаминов, минеральных солей и микроэлементов. Непрерывное получение клубней картофеля в течение всего года в большинстве регионов мира, где он выращивается, невозможно. Соответственно, требуется обеспечение хранения собранного урожая клубней.
Одним из самых потенциально вредных явлений при хранении картофеля является преждевременное развитие побегов. Долговременное хранение требует охлаждения, принудительной вентиляции и использования химических супрессантов образования побегов. Проблемы, непосредственно связанные с длительным хранением картофеля, разнообразны.
Охлаждение, обычно применяемое в странах Северной Европы, путем вентиляции воздухом, имеющим температуру среды, является одним из способов предотвращения образования побегов. Помимо связанного с этим удорожания длительное охлаждение до 4°С ставит проблему холодового подслащивания ("подмерзания") и почернения (потемнения) клубней.
Химические супрессанты побегов являются в настоящее время единственным средством предотвращения образования побегов у картофеля, предназначенного для переработки и употребления в свежем виде, поскольку низкотемпературное длительное хранение приводит к неизбежному накоплению редуцирующих сахаров. Однако, в последние годы возникли проблемы, связанные с негативным средовым и пищевым вкладом химических супрессантов, таких как хлорированные углеводороды. Соответственно, имеется насущная необходимость нахождения альтернативного способа предотвращения образования побегов запасающими вегетативными органами растений, такими как клубни.
Альтернативный подход к задержке развития побегов связан с использованием трансгенных растений, характеризующихся удлиненным периодом покоя. Образование побегов на клубнях картофеля включает ряд независимых стадий, которые могли бы быть мишенью для генетической инженерии. Первая стадия - это мобилизация резервных веществ, главным образом, крахмала. Разрушение крахмала происходит в аминопластах и опосредуется активностью фосфорилазы крахмала и(или) амилаз. На следующей стадии после гидролиза крахмала образовавшиеся в результате гексозы и(или) гексозофосфаты экспортируются из аминопластов. После переноса в цитозоль образовавшиеся гексозы и гексозофосфаты распределяются между реакциями гликозита и синтеза сахарозы. На третьей стадии происходит образование сахарозы в цитозоле. Синтез сахарозы является энергетически зависимым, поэтому гликозит и дыхание являются необходимыми. На четвертой стадии происходит транспорт сахарозы и развивающийся побег. Наконец, импортированная сахароза утилизируется в побеге на поддержку роста и развития.
Заявители разработали способ предотвращения образования побегов в запасаемых вегетативных органах, в которых образование побегов может быть заблокировано и вновь запущено без каких-либо нежелательных побочных эффектов, таких как потеря урожайности. Этот новый способ включает целенаправленную экспрессию генов, в результате которой происходит нарушение образования побегов, в сочетании с технологией переключения генов, обеспечивающей восстановление образования побегов, когда это необходимо.
В соответствии с первым аспектом настоящего изобретения представляется способ избирательной индукции или предотвращения образования побегов у растений, включающий внесение, предпочтительно стабильное внесение, в геном указанного растения путем трансформации конструкции ДНК, в составе которой находится первая полинуклеотидная последовательность, включающая по крайней мере одну последовательность ДНК, функционально присоединенную к ткане- или органоспецифическому промотору и необязательно с сайтом терминации транскрипции, и вторую полинуклеотидную последовательность, включающую по крайней мере одну последовательность ДНК, функционально присоединенную к регулируемому промотору, которым она и контролируется, и необязательно к сайту терминации транскрипции, притом, что последовательность (последовательности) ДНК в указанной первой последовательности экспрессируется в диапаузе вегетативного органа, производного от указанного трансгенного растения, в результате чего достигается эффективное предотвращение образования побегов, а указанное предотвращение нейтрализуется индукцией экспрессии последовательности (последовательностей) ДНК указанной второй полинуклеотидной последовательности из состава указанного регулируемого промотора путем применения внешнего индуцирующего стимула таким образом, что восстановление образования побегов у указанного вегетативного запасающего органа зависит от применения такого индуктора.
Используемый здесь термин "ткане- или органоспецифичный промоторный участок" обозначает те промоторные участки, которые обеспечивают предпочтительную экспрессию интересующей последовательности (последовательностей) ДНК в желательных ткани или органе.
Последовательности ДНК в составе ДНК-конструкций могут быть эндогенными или гетерологическими по отношению к трансформированному организму-хозяину.
Примеры последовательностей ДНК, которые могут быть использованы в способе по настоящему изобретению для предотвращения образования побегов, включают те последовательности ДНК, которые кодируют белки, участвующие в мобилизации ресурсов во время диапаузы, такой как гидролиз запасаемых соединений, например гидролиз крахмала, т.е. фосфорилаза крахмала, амилаза (например, α- или β-амилаза) и мальтаза; например в гликолизе и последующем метаболизме, например фосфофруктокиназа, гексокиназа; в биосинтезе углеводов, например синтез сахарозы; в транспорте ресурсов во время диапаузы, таком как вход во флоэмные пути, например, АТФаза; в протяженном флоэмном транспорте и в выходе из флоэмы, например неорганическая пирофосфорилаза; и в утилизации ресурсов во время диапаузы, такой как ассимиляционное расщепление, например расщепление сахарозы в процессе роста побегов, например инвертаза; и в утилизации продуктов ассимиляции, например утилизация производных от сахарозы метаболитов в ходе выработки энергии, необходимой для развития побегов, например последовательности ДНК, кодирующие белки, которые участвуют в функциях митохондрий, таких как дыхание, например митохондриальные ферменты и транспортные белки, такие как транслокаторы (белки-переносчики), например переносчик адениннуклеотидов (ANT) и переносчик малатоксоглутара (МОТ), и их ингибиторы, такие как несвязывающиеся белки. Примеры применимых последовательностей ДНК также включают любые другие последовательности, которые вовлечены в процессы образования побегов у картофеля.
Примеры предпочтительных последовательностей ДНК, которые могут быть использованы в способе по настоящему изобретению для предотвращения образования побегов, включают те, которые обеспечивают выработку смысловых, антисмысловых или частично смысловых последовательностей по отношению к тем, которые кодируют белки, участвующие в мобилизации и(или) утилизацию сахарозы, с образованием побегов у картофеля и в функции митохондрий, такие как дыхание.
Примеры конкретных предпочтительных последовательностей ДНК включают те, которые кодируют инвертазу у различных источников - растений, бактерий или грибов, например дрожжей, пирофосфатазу растений, бактерий или грибов, и белки, участвующие в митохондриальных функциях, такие как МОТ и ANT, происходящие от растений, бактерий или грибов, которые здесь будут описаны.
Подавление образования побегов может быть достигнуто различными путями. Первая последовательность (последовательности) ДНК может быть экспрессирована во время диапаузы запасающих вегетативных органов и затем подвергнута негативной регуляции тогда, когда образование побегов становится желательным. Когда образование побегов желательно, экспрессия второй последовательности (последовательностей) ДНК обеспечивает негативную регуляцию первой последовательности ДНК с последующим восстановлением образования побегов.
Негативная регуляция желательной последовательности (последовательностей) ДНК может быть достигнута с использованием методов, хорошо известных в данной области техники, таких как, например, использование репрессорных белков, смысловых, антисмысловых, частично смысловых последовательностей и экспрессия комплементарных белков. Примеры подходящих систем оператор/репрессор включают системы lac, tet или лямбда 434 и их мутантные формы, такие как гистидиновый мутант LacIΔHis (N.Lehming, J.Sartoris, M.Niemoeller, G.Genenger, В, von Wilcken-Bergman & В.Muller-Hill, 1987, EMBO J., 6, 3145-3153 - здесь мутант характеризуется аминокислотной заменой в полипептиде (LacI замена тирозина-17 на гистидин). С другой стороны, для негативной регуляции генов может быть использована система AmpliconTM (S.M.Angell, D.C.Baulcombe, 1997, 16, 3675-3684). В этом отношении используется кДНК, соответствующая РНК реплицируемого вируса (PVX) картофеля, в состав которого внесен трансген, притом, что временно экспрессируемая РНК, проявляющая гомологию с трансгеном, подавляется.
С другой стороны, экспрессия последовательности (последовательностей) первой полинуклеотидной последовательности может приводить к образованию смысловой, антисмысловой или частично смысловой последовательности, которая способна подавлять ген, участвующий в развитии побегов, или экспрессию конструкции AmpliconTM. В этом случае образование побегов восстанавливается в результате переключения экспрессии последовательности (последовательностей) ДНК второй полинуклеотидной последовательности, в результате чего вырабатывается белок или некий ему соответствующий белок, выработка которого была перед этим подавлена смысловой, антисмысловой или частично смысловой последовательностью первой последовательности ДНК. Образование побегов также может быть восстановлено с помощью подходящей "системы оператор/репрессор".
Тогда, когда обе полинуклеотидные последовательности в составе конструкции включают более одной последовательности ДНК, предпочтительно, чтобы они не были идентичны друг другу, чтобы предотвратить какой-либо нежелательный супрессионный эффект.
Экспрессия последовательности (последовательностей) ДНК первой полинуклеотидной последовательности находится под контролем ткане- или органоспецифичного промотора, что обеспечивает нацеленную экспрессию последовательности ДНК, т.е. тем самым экспрессия индуцируется в ткани или органе специфическим образом. Примеры тканеспецифичных промоторов включают специфичные для флоэмы промоторы, например промотор rоlС, а примеры органоспецифичных промоторов включают промоторы, специфичные для клубней, такие как промотор гена пататина. Использование ткане- и органоспецифичных промоторов, таких как промотор rо1С и клубнеспецифичные промотры, является предпочтительным.
Последовательность (последовательности) ДНК второй полинуклеотидной последовательности в составе конструкции находится под контролем регулируемого промоторного сегмента.
По использованию в данном тексте термин "регулируемый промоторный сегмент" обозначает промоторы, которые могут быть индуцированы химическими стимулами. Использование промоторной последовательности, которая регулируется применением внешнего химического стимула, является наиболее предпочтительным. Внешним химическим стимулом предпочтительно является агротехнически приемлемый химический препарат, применение которого совместимо с сельскохозяйственной практикой и не является вредным для растений или млекопитающих.
Регулируемый промоторный сегмент наиболее предпочтительно включает индуцибельную переключающую промоторную систему, такую как например, двухкомпонентная система, такая как промотор переключения генов alcA/alcR, описанная заявителями в международной патентной заявке № WO 93/21334; промотор GST, описанный заявителями в международных патентных заявках № WO 90/08826 и № WO 93/031294; и экдизоновая переключающая система, описанная заявителями в международной патентной заявке № WO 96/37609, которые включены в качестве ссылки. Такие промоторные системы в данном тексте обозначаются как "переключающие промоторы". "Переключающие химикаты", применяемые в сочетании с переключающими промоторами, являются агротехнически приемлемыми химическими соединениями, что делает данную систему пригодной для использования в способе по настоящему изобретению. В случае с переключающим промотором alcA/alcR предпочтительным химическим переключателем является этиловый спирт либо в жидкой форме, либо, что предпочтительнее, в виде паров. Одним из основных преимуществ применения паров этанола является его очень экономное использование, но при этом достигается высокий уровень индуцируемой экспрессии. Подобные описания химических переключателей представлены в патентных заявках, названных выше.
Подходящие терминаторы транскрипции, которые могут быть использованы, также хорошо известны в данной области техники: они включают, например, терминатор гена нопалинсинтазы и терминатор гена октопинситазы. Наиболее желательным промотором является поздний специфичный для клубней промотор, который активен в конце периода диапаузы, т.е. непосредственно перед образованием побегов.
Регулируемым промоторным сегментом для использования в способе по настоящему изобретению предпочтительно является переключающая промоторная система GST или alcA/alcR.
Восстановление образования побегов предпочтительно достигается с использованием способов по смысловому, антисмысловому или частично смысловому переключению, которые подробно описаны здесь, или же, с другой стороны, с использованием системы AmpliconТМ, или с помощью подходящей системы оператор/репрессор. Негативная регуляция генной активности за счет частично-смысловой супрессии описывается заявителями в международной патентной заявке № WO 91/08299, информация из которой включена здесь для сведения, и этот эффект может быть выключен при необходимости путем использования генных последовательностей, производных от различных организмов.
В соответствии со вторым аспектом настоящего изобретения представляется ДНК-конструкция, включающая первую полинуклеотидную последовательность, в составе которой последовательность ДНК функционально присоединена к ткане- или органоспецифичному промотору и необязательно к сайту терминации транскрипции, и вторую полинуклеотидную последовательность, в составе которой по крайней мере одна последовательность ДНК функционально присоединена к регулируемому промотору, которым она и контролируется, и к сайту терминации транскрипции, притом, что указанная первая полинуклеотидная последовательность включает последовательность ДНК, кодирующую белок, участвующий в мобилизации и(или) утилизации сахарозы, а указанная вторая полинуклеотидная последовательность включает последовательность ДНК, которая является смысловой, антисмысловой или частично смысловой по отношению к указанному белку, или последовательность ДНК, которая способна обуславливать супрессию указанного белка.
В соответствии с третьим аспектом настоящего изобретения представляется конструкция ДНК, в составе которой первая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к ткане- или органоспецифичному промотору и необязательно к сайту терминации транскрипции, а вторая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к регулируемому промотору, которым она и контролируется, и к сайту терминации транскрипции, притом, что указанный первый полинуклеотид включает вначале последовательность ДНК, кодирующую белок, участвующий в мобилизации и(или) утилизации сахарозы, и далее последовательность ДНК, кодирующую операторную последовательность, функционально присоединенную к начальной последовательности ДНК, а вторая полинуклиотидная последовательность включает последовательность ДНК, кодирующую репрессорный белок, способный связываться с указанной операторной последовательностью.
В соответствии с четвертым аспектом настоящего изобретения представляется конструкция ДНК, в составе которой первая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к ткане- или органоспецифичному промотору и необязательно к сайту терминации транскрипции, а вторая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к регулируемому промотору, которым она и контролируется, и к сайту терминации транскрипции, притом, что указанный первый полинуклеотид включает последовательность (последовательности) ДНК, являющиеся смысловой, антисмысловой или частично смысловой последовательностью по отношению к белку, участвующему в образовании побегов, или последовательность ДНК, способную обусловливать супрессию белка, участвующего в образовании побегов у картофеля, а указанная вторая полинуклиотидная последовательность включает последовательность (последовательности) ДНК, кодирующую белок, участвующий в образовании побегов у картофеля.
В соответствии с пятым аспектом настоящего изобретения представляется конструкция ДНК, в составе которой первая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к ткане- или органоспецифичному промотору и необязательно к сайту терминации транскрипции, а вторая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к регулируемому промотору, которым она и контролируется, и к сайту терминации транскрипции, притом, что указанный первый полинуклеотид включает вначале последовательность (последовательности) ДНК, являющуюся смысловой, антисмысловой или частично смысловой последовательностью по отношению к белку, участвующему в образовании побегов у картофеля, и далее последовательность ДНК, кодирующую операторную последовательность, функционально присоединенную к начальной последовательности ДНК, а указанная вторая полинуклиотидная последовательность включает последовательность (последовательности) ДНК, кодирующую репрессорный белок, способный связываться с указанной операторной последовательностью.
В соответствии с шестым аспектом настоящего изобретения представляется конструкция ДНК, в составе которой первая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к ткане- или органоспецифичному промотору и необязательно к сайту терминации транскрипции, а вторая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к регулируемому промотору, которым она и контролируется, и к сайту терминации транскрипции, притом, что указанный первый полинуклеотид включает последовательность (последовательности) ДНК, являющиеся смысловой, антисмысловой или частично смысловой последовательностью по отношению к белку, участвующему в функциях митохондрий, или последовательность ДНК, которая способна обусловливать супрессию белка, участвующего в функциях митохондрий, а указанная вторая полинуклиотидная последовательность включает последовательность (последовательности) ДНК, кодирующие белок, вовлеченный в функции митохондрий.
В соответствии с седьмым аспектом настоящего изобретения представляется конструкция ДНК, в составе которой первая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к ткане- или органоспецифичному промотору и необязательно к сайту терминации транскрипции, а вторая полинуклеотидная последовательность включает по крайней мере одну последовательность ДНК, функционально присоединенную к регулируемому промотору, которым она и контролируется, и к сайту терминации транскрипции, притом, что указанный первый полинуклеотид включает вначале последовательность (последовательности) ДНК, являющиеся смысловой, антисмысловой или частично смысловой последовательностью по отношению к белку, участвующему в функциях митохондрий, или последовательность ДНК, которая способна обусловливать супрессию белка, участвующего в функциях митохондрий, и затем последовательность ДНК, кодирующую операторную последовательность, функционально присоединенную к начальной последовательности ДНК, а указанная вторая полинуклиотидная последовательность включает последовательность (последовательности) ДНК, кодирующую репрессорный белок, способный связываться с указанной операторной последовательностью.
Заявители определили следующее сочетание последовательностей ДНК как конкретно применимое в способе по настоящему изобретению: путем помещения последовательности ДНК, кодирующей инвертазу, под контроль специфичного для флоэмы промотора, такого как промотор го1С, возможным становится точно направить экспрессию последовательности ДНК во флоэме и эффективно подавить образование побегов, а затем восстановить образование побегов за счет переключения последовательности ДНК, кодирующей антисмысловой инвертазный мотив с использованием индуцируемого химическими стимулами переключающего промотора alcA/alcR. Концентрация сахарозы во флоэме листьев настолько высока, что является достаточной для того, чтобы проявления экспрессии инвертазы эффективно подавлялись, тем самым не допуская каких-либо нежелательных побочных эффектов. Это контрастирует с ситуацией, имеющей место во флоэме побегов, где экспрессия инвертазы обладает доминирующим эффектом, в результате чего сахароза гидролизуется и образование побегов эффективно предотвращается.
Далее применимой комбинацией является последовательность ДНК, кодирующая неорганическую пирофосфатазу (iPPaSy), помещенная под контроль специфичного для клубней промотора. Поглощение сахарозы и транспорт ее во флоэму являются энергозависимым процессом: следовательно, путем ингибирования источника энергии за счет экспрессии последовательности ДНК, кодирующей неорганическую пирофосфатазу, возможным является подавить процесс поглощения. Подавление может быть ревертировано путем использования, например, индуцируемого химическими стимулами переключающего промотора alcA/alcR, с целью переключения последовательности ДНК, кодирующей антисмысловую, смысловую или частично смысловую последовательность по отношению к iPP, - и образование побегов восстанавливается. Опять-таки использование ткане- и органоспецифичного промотора обеспечивает то, что подавление поглощения сахарозы и переноса ее во флоэму происходят не во всем растении, а только в клубнях, тем самым минимизируя любые вредные проявления у растения.
В обоих случаях возможны альтернативные способы восстановления образования побегов, основанные на использовании системы AmpliconТМ, при которой супрессируется конкретный трансген, характеризующийся гомологией со временно экспрессирующейся РНК. Таким трансгеном может быть, например, кДНК, кодирующая инвертазу или iPP. Другим альтернативным способом восстановления образования побегов является использование подходящей системы оператор/репрессор.
Заявители также обнаружили, что путем избирательного подавления источника энергии, необходимой для роста и развития побегов у клубней, за счет помещения последовательности ДНК, кодирующей смысловой, антисмысловой или частично смысловой мотив по отношению к последовательности ДНК, кодирующей белок, участвующий в функциях митохондрий, такой как белок-переносчик адениннуклеотида (ANT) или митохондриальный переносчик оксоглутарата, под контроль промотора, специфичного для клубней, образование побегов может быть предотвращено без каких-либо отрицательных побочных эффектов. С другой стороны, может быть использована последовательность ДНК, которая обусловливает подавление таких белков. Одним из путей, с помощью которого может быть достигнута реверсия ингибирования, является переключение экспрессии второй последовательности ДНК, продукт которой комплементарен первой последовательности ДНК, например, последовательность ДНК, кодирующая ANT, производная от стороннего источника (предпочтительно от резуховидки рода Arabidopsis), может быть использована для противодействия влиянию антисмысловой экспрессии ANT. В случае с белком МОТ подходящая комплементарная последовательность может происходить от проса Panicum miliaceum в соответствии с описанным Танигучи и Сугияма (Taniguchi & Sugiyama, 1996, Plant Mol. Biol., 30, 51-64). С другой стороны, для реверсии ингибирования может быть использована система оператор/репрессор. Может быть использован упоминавшийся выше переключаемый химическими стимулами промотор alcA/alcR. Здесь и далее будут более подробно описаны вышеприведенные примеры.
В соответствии с некоторыми вариантами настоящего изобретения первая полинуклеотидная последовательность включает дополнительную последовательность ДНК, кодирующую операторную последовательность, функционально присоединенную к начальной последовательности ДНК, а вторая полинуклеотидная последовательность включает последовательность ДНК, кодирующую репрессор, способный связываться с операторной последовательностью под контролем переключающего промотора таким образом, что применение индуктора приведет к экспрессии последовательности ДНК, кодирующей репрессор, который затем связывается с оператором, в результате чего экспрессия первой последовательности ДНК в составе первой полинуклеотидной последовательности переключается. Примером такой системы является лактозный оператор и репрессорный белок: эта система описана в опубликованной международной патентной заявке № WO 90/08830. Другие примеры включают тетрациклиновую и лямбда 434 системы оператор/репрессор.
Растительные клетки могут быть трансформированы с использованием рекомбинантных ДНК-конструкций в соответствии с рядом известных методов, например, с помощью Ti-плазмид Agrobacterium, электропорации, микроинъекций и бомбардировки микрочастицами. Затем трансформированные клетки могут быть в подходящих случаях регенерированы в цельные растения, у которых окажется внесенным новый ядерный материал, предпочтительно стабильно встроенный в их геном. Таким путем могут быть получены и однодольные, и двудольные трансформированные растения.
В соответствии с восьмым аспектом настоящего изобретения представляется растительная клетка, трансформированная любой из вышеперечисленных ДНК-конструкций.
В соответствии с девятым аспектом настоящего изобретения представляется целое растение, трансформированное ДНК-конструкцией в соответствии с определявшимися выше аспектами настоящего изобретения, притом, что указанная ДНК-конструкция внесена (предпочтительно стабильным образом) в геном указанного растения.
Далее настоящее изобретение включает в соответствии с десятым аспектом настоящего изобретения потомство растений, определенных предыдущим параграфом, притом, что это потомство несет ДНК-конструкцию в соответствии с вышеназванными аспектами настоящего изобретения, встроенную (предпочтительно стабильным образом) в геном потомков и семян, и клубней, образующихся у таких растений-потомков.
Способ по настоящему изобретению, в частности, пригоден для предотвращения образования побегов на клубнях картофеля.
В предпочтительном варианте настоящее изобретение представляет способ избирательной индукции или предотвращения образования побегов у картофеля, включающий стабильное встраивание с помощью трансформации в геном указанного картофеля ДНК-конструкции, в составе которой находится первая полинуклеотидная последовательность, включающая по крайней мере одну последовательность ДНК, функционально присоединенную к ткане- или органоспецифическому промотору и необязательно с сайтом терминации транскрипции, и вторая полинуклеотидная последовательность, включающая по крайней мере одну последовательность ДНК, функционально присоединенную к регулируемому промотору, которым она и контролируется, и необязательно к сайту терминации транскрипции, притом, что последовательность (последовательности) ДНК указанной первой последовательности экспрессируется в диапаузе клубня, образующегося на указанном трансгенном растении картофеля, в результате чего достигается эффективное предотвращение образования побегов, а указанное предотвращение нейтрализуется индукцией экспрессии последовательности (последовательностей) ДНК указанной второй полинуклеотидной последовательности из состава указанного регулируемого промотора путем применения внешнего индуцирующего стимула таким образом, что восстановление образования у указанного клубня зависит от применения такого индуктора.
Также заявители идентифицировали пять конкретно предпочтительных последовательностей ДНК, которые, как считается, также могут быть применены в способе по настоящему изобретению. Авторы выявили эти последовательности ДНК, как индуцируемые в ходе хранения клубней, и обозначили их как 16-3 (последовательность 2), 16-8 (последовательность 3), 10-1 (последовательность 4) и АС4 (последовательность 5), М-1-1 (МОТ) (последовательность на фиг.19) и МОТ-вариант (последовательность 6 - она имеет депозитарный № Х99853 в базе данных EMBL). Последовательности ДНК и их выделение полностью описаны в соответствующих примерах. Тем самым настоящее изобретение представляет, в соответствии со следующим своим аспектом, использование всех или части последовательностей ДНК клонов 16-3, 10-1, ВС4, 16-8, М-1-1 и МОТ-варианта в способе по настоящему изобретению с целью предотвращения образования побегов у растений.
Последовательности ДНК 16-3, 16-8, АС4, М-1-1, по-видимому, являются новыми, и двенадцатый аспект настоящего изобретения представляет полинуклеотиды, включающие полинуклеотиды 1-870 последовательности 2 (соответствуют клону 16-3), нуклеотиды 1-712 последовательности 3 (соответствуют клону 16-8), или нуклеотиды 1-360 последовательности 5 (соответствуют клону АС4), или нуклеотиды 1-1351 последовательности, показанной на фиг.19 (соответствуют клону М-1-1, кодирующему белок МОТ), и далее кодируемые ими пептидные продукты, а также белки, характеризующиеся существенно сходным уровнем активности и имеющие аминокислотную последовательность, которая по крайней мере на 85% сходна с указанным продуктом. Предпочтительно, чтобы уровень сходства был по крайней мере 90%, более предпочтительный уровень сходства 95%, а наиболее предпочтительный уровень сходства 97%.
Конкретный предпочтительный вариант полинуклеотидов включает нуклеотиды 55-751 последовательности 2, нуклеотиды 87-473 последовательности 3 и нуклеотиды 192-1164 последовательности, показанной на фиг.19, а также транслируемые с них продукты и те белки, характеризующиеся существенно сходным уровнем активности и имеющие аминокислотную последовательность, которая по крайней мере на 85% сходна с указанным продуктом. Предпочтительно, чтобы уровень сходства был по крайней мере 90%, более предпочтительный уровень сходства 95%, а наиболее предпочтительный уровень сходства 97%.
По использованию в данном тексте термин "уровень сходства" используется для описания последовательностей, которые при сопоставлении характеризуются присутствием сходных (т.е. идентичных или замененных по консервативному типу) аминокислот в аналогичных положениях или участках, где идентичные или консервативно замененные аминокислоты - это те, которые не изменяют активность или функции данного белка по сравнению с исходным белком. Например, две аминокислотные последовательности с уровнем сходства друг с другом по крайней мере 85% характеризуются наличием по крайней мере 85% сходных (идентичных или консервативно замененных) аминокислотных остатков в аналогичных положениях при их линейном сопоставлении при наличии не более трех разрывов, притом, что этими разрывами захватывается не более чем 15 аминокислотных остатков. Уровень сходства может быть определен с использованием методов, хорошо известных в данной области техники (см., например, W.J.Wilbur & D.J.Lipman, 1983, "Rapid similarity searches of nucleic acid and protein data banks", Proc. Natl. Acad. Aci., USA, 80, 726-730; и E.Myers & W.Miller, 1988, "Optimal alignments in linear space". Comput. Appl. Biosci., 4, 11-17). Одной из программ, которые можно использовать для определения уровня сходства, является метод попарного сопоставления MegAlign по Липману-Пирсону (с использованием параметров по умолчанию), которую можно приобрести у DNAstar Inc. (1228 Selfpark str., Madison, WI 53715; США), входящая частью в систему Lasergene.
В соответствии с тринадцатым аспектом настоящего изобретения представляется полинуклеотидная последовательность (последовательности), кодирующая белок, характеризующийся существенно сходной активностью по сравнению с таковой у белков, кодируемых нуклеотидными последовательностями 2, 3, 5 и показанной на фиг.19, притом, что этот полинуклеотид комплементарен тому, который гибридизует с последовательностью, входящей в состав последовательностей 2, 3, 5 и показанной на фиг.19, притом что инкубация осуществляется при низкой или высокой жесткости, или в пределах такого диапазона. В целом условия низкой жесткости могут быть определены как 3×SSС при температуре примерно до 65°С, а условия жесткости 0,1×SSC при примерно 65°С. SSC обозначает буферный раствор 0,15 М хлорида натрия и 0, 015 М цитрата натрия, 3×SSС втрое концентрированнее чем SSC, a 0,1×SSC - в десять раз слабее буфера SSC.
Далее настоящее изобретение представляет полинуклеотидную последовательность (последовательности), кодирующие белок, который характеризуется существенным сходством активности с тем белком, который кодируется нуклеотидами 55-751 последовательности 2, нуклеотидами 87-473 последовательности 3 или нуклеотидами 192-1164 последовательности, показанной на фиг.19, притом, что этот полинуклеотид комплементарен тому полинуклеотиду, который гибридизует с последовательностью, включающей нуклеотиды 55-751 последовательности 2, нуклеотиды 87-473 последовательности 3 или нуклеотиды 192-1164 последовательности, показанной на фиг.19, притом что инкубация осуществляется при низкой или высокой жесткости, или в пределах такого диапазона. В целом условия низкой жесткости могут быть определены как 3×SSС при температуре примерно до 65°С, а условия жесткости 0,1×SSC при примерно 65°С. SSC обозначает буферный раствор 0,15 М хлорида натрия и 0,015 М цитрата натрия, 3×SSС втрое концентрированнее чем SSC, a 0,1× SSC - в десять раз слабее буфера SSC.
Полинуклеотиды в соответствии с настоящим изобретением, определенные в последовательностях 2, 3 и 5 и фиг.19, могут быть функционально присоединены к промотору, который может быть гомологичным или гетерологичным по отношению к такому полинуклеотиду: настоящее изобретение представляет такие конструкции. Также настоящее изобретение представляет ДНК-конструкцию, включающую указанные полинуклеотиды, дополнительно включающие участок, кодирующий пептид, который способен направлять продукты, транслируемые с данных полинуклеотидов, в желательные клеточные или субклеточные сайты. Также настоящее изобретение представляет вектор, включающий указанную полинуклеотидную последовательность в соответствии с показанным в последовательностях 2, 3, 5 и на фиг.19, предпочтительно присоединенную к промотору и необязательно к сайту терминации транскрипции или к направляющей последовательности в соответствии с описанным выше.
Последовательности, представленные здесь в клонах 16-3, 16-8, 10-1, АС4, М-1-1 и МОТ-варианте, являются последовательностями кДНК и могут быть, в соответствии со следующим аспектом настоящего изобретения, использованы в качестве зондов для выделения и идентификации в составе геномных библиотек последовательностей, расположенных с 5'-стороны и являющихся естественными промоторами. Затем такой промотор может быть идентифицирован, выделен и секвенирован.
В соответствии с пятнадцатым аспектом настоящего изобретения представляется клетка-хозяин, трансформированная ДНК-конструкцией, включающей полинуклеотидную последовательность, соответствующую описанной в последовательностях 2, 3, 5 или на фиг.19, или описанный выше вектор, включающий указанную полинуклеотидную последовательность. Клетка-хозяин предпочтительно является растительной клеткой в соответствии с описанным выше, и настоящее изобретение также представляет целые растения, в геном которых встроены (предпочтительно стабильным образом) полинуклеотидная последовательность, ДНК-конструкция или вектор, описанные выше, а также семена, клубни и потомства указанных растений.
В соответствии с шестнадцатым аспектом настоящего изобретения представляется ДНК-конструкция, включающая полинуклеотидную последовательность, включающую переключающий промотор, функционально присоединенный к полинуклеотидной последовательности, включающей смысловую, антисмысловую или частично смысловую транскрибируемую конструкцию, притом, что, когда экспрессия указанной полинуклеотидной последовательности переключается с переключающего промотора, то обусловливаемая в результате экспрессия указанной смысловой, антисмысловой или частично смысловой последовательности приводит к негативной регуляции экспрессии последующей полинуклеотидной последовательности, кодирующей трансген.
В своем семнадцатом аспекте настоящее изобретение представляет способ контроля за экспрессией трансгена, включающий трансформацию клетки-хозяина ДНК-конструкцией, включающей переключающий промотор, функционально присоединенный к полинуклеотидной последовательности, включающей смысловую, антисмысловую или частично смысловую транскрибируемую конструкцию, а также последующей ДНК-конструкцией, включающей последовательность, кодирующую трансген и регулирующую экспрессию полинуклеотидной последовательности с указанного переключающего промотора таким образом, что в результате экспрессия указанной смысловой, антисмысловой или частично смысловой конструкции приводит к негативной регуляции экспрессии указанного трансгена.
По использованию в данном тексте термин "трансген" используется для обозначения гена, который является чужеродным или гетерологичным для трансформируемой клетки-хозяина.
В предпочтительном варианте вышеназванных аспектов настоящее изобретение представляет ДНК-конструкцию, включающую переключающий промотор alcA/alcR, функционально присоединенный к полинуклеотидной последовательности, включающей смысловую, антисмысловую или частично смысловую транскрибируемую конструкцию.
Также настоящее изобретение представляет вектор, включающий указанные ДНК-конструкции в соответствии с вышеизложенными аспектами настоящего изобретения.
В соответствии с восемнадцатым аспектом настоящего изобретения представляется клетка-хозяин, трансформированная ДНК-конструкцией, включающей полинуклеотидную последовательность, включающую переключающий промотор, который может быть переключен с помощью применения химического стимула, функционально присоединенный к полинуклеотидной последовательности, включающей смысловую, антисмысловую или частично смысловую транскрибируемую конструкцию, притом, что, когда экспрессия указанной полинуклеотидной последовательности переключается с переключающего промотора, в результате экспрессия указанной смысловой, антисмысловой или частично смысловой последовательности приводит к негативной регуляции экспрессии последующей полинуклеотидной последовательности, кодирующей трансген.
Клетка-хозяин предпочтительно является растительной клеткой в соответствии с описанным выше, а настоящее изобретение также представляет целые растения, производные от этих клеток, несущие встроенные (предпочтительно стабильным образом) в их геном полинуклеотидную последовательность, ДНК-конструкцию или вектор в соответствии с описанным выше, а также семена, клубни и потомства указанных растений.
Использование переключающих промоторных систем для контроля за экспрессией смысловой, антисмысловой или частично смысловой конструкций имеет много разнообразных направлений. Негативная регуляция гена, экспрессия которого обусловливает летальность или ингибирующий эффект, может быть зарегулирована с использованием способных к переключению смысловых, антисмысловых или частично смысловых конструкций с целью идентификации подходящих мишеней для гербицидов. Основанная на переключении негативная регуляция с использованием смысловых, антисмысловых или частично смысловых конструкций также может быть использована для выявления механизмов абляции (экстирпации) клеток.
Соответственно настоящее изобретение в своем девятнадцатом аспекте представляет способ идентификации сайта, который может быть эффективной мишенью для взаимодействия с гербицидом, включающий стадии трансформации растения полинуклеотидной последовательностью, включающей вначале последовательность ДНК, которая способна подавлять экспрессию ДНК в указанном сайте-мишени, притом, что экспрессия указанной начальной последовательности ДНК находится под контролем переключающего промотора; таким образом, регулируемая экспрессия указанной последовательности ДНК с указанного переключающего промотора обеспечивает то, что экспрессия ДНК, кодирующей сайт-мишень, для гербицида негативно регулируется и определяет влияние указанной негативной регуляции на жизнеспособность растения.
Типы проявлений, которые можно таким образом контролировать, включают промежуток времени, в течение которого должна поддерживаться негативная регуляция в сайте-мишени, а также степень негативной регуляции, который необходим, а на основе полученных результатов можно решить, является ли сайт-мишень подходящим в качестве сайта-мишени для гербицида.
Заявители совершенно неожиданно обнаружили, что специфичная для листьев промоторная последовательность STLS-1 действует в качестве энхансера экспресии генов в клубнях: использование последовательности STLS-1 в качестве энхансера экспрессии генов в клубнях является следующим аспектом настоящего изобретения.
В двадцатом аспекте настоящего изобретения, соответственно, представляется способ усиления экспрессии генов в клубнях, включающий трансформацию растительной клубневой клетки полинуклеотидной последовательностью, включающей последовательность ДНК, которая кодирует весь или часть специфичного для листьев промотора STLS-1, функционально присоединенную к последующему промоторному сегменту.
Специфичный для листьев промотор STLS-1 известен в данной области техники (Eckes et al., 1986, Mol. Gen. Genet., 205, 14-22) и описан в нижеследующих примерах. Полная или частичная последовательность специфичного для листьев промотора STLS-1 может быть использована в качестве энхансера в соответствии с настоящим изобретением. Активные участки STLS-1 могут быть идентифицированы с использованием методик, хорошо известных в данной области техники, таких как расщепление рестриктазами с последующим тестированием уровня усиления экспрессии генов с участием полученных таким путем фрагментов промотора. Промоторная последовательность STLS-1 может быть внесена либо сверху (т.е. с 5'-конца), либо снизу (т.е. с 3'-конца) по отношению к другому промоторному сегменту. В частности, предпочтительным является размещение последовательности STLS-1 перед основным промоторным сегментом. В конкретном предпочтительном варианте данного аспекта настоящего изобретения последовательность STLS-1 встраивается выше промотора 35S-CaMV.
В двадцать первом аспекте настоящее изобретение представляет клубни, которые предпочтительно являются клубнями картофеля, полученные на трансгенных растениях, на которых не образуются побеги до тех пор, пока не они будут обработаны химическим индуктором.
В соответствии с двадцать вторым аспектом настоящего изобретения представляется полинуклеотидная последовательность, включающая полностью или частично последовательности, обозначенные на фиг.25, 26 или 27, и полинуклеотиды, характеризующиеся теми же функциями, что и полинуклеотиды, показанные на фиг.25, 26 или 27, притом, что эти полинуклеотиды комплементарны такому полинуклеотиду, который гибридизует с последовательностью, показанной на фиг.25, 26 или 27, при инкубации при низкой или высокой жесткости или жесткости в пределах этого диапазона. Такие последовательности предпочтительно являются специфичными для клубней промоторами.
В соответствии с двадцать третьим аспектом настоящего изобретения представляется способ контроля за экспрессией генов растения или его части, включающий трансформацию растительной клетки индуцибельным по химическому стимулу геном в составе экспрессионной кассеты, включающей вначале промотор, функционально присоединенный к регуляторной последовательности, производной от гена alcR, и регулируемый промотор, производный от промотора гена а1сА, функционально присоединенный к гену-мишени, притом, что регулируемый промотор активируется регуляторным белком в присутствии паров спирта, что тем самым обеспечивает экспрессию данного гена-мишени.
Настоящее изобретение далее будет описано следующими, не являющимися в чем-то ограничивающими примерами с отсылками к сопроводительным чертежам, где:
фиг.1 показывает схему конструкции плазмиды pBIN-IN8.
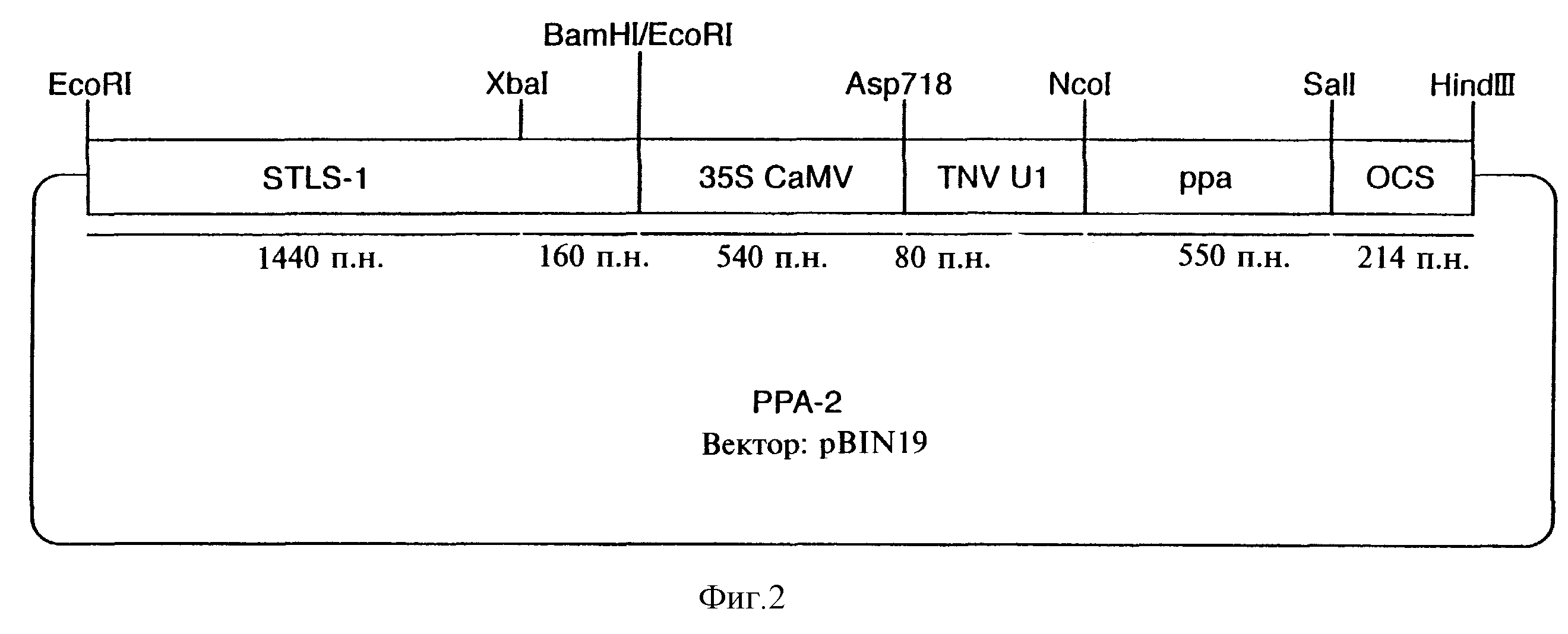
Фиг.2 показывает схематическое изображение плазмиды РРА-2.
Фиг.3 показывает фотографии растений дикого типа (сорт Desiree) и трансгенных растений картофеля, несущих специфичную для флоэмы цитоплазматическую инвертазу (генотип DIN-87, DIN-90 и DIN-30) с последующим длительным хранением в темноте при комнатной температуре.
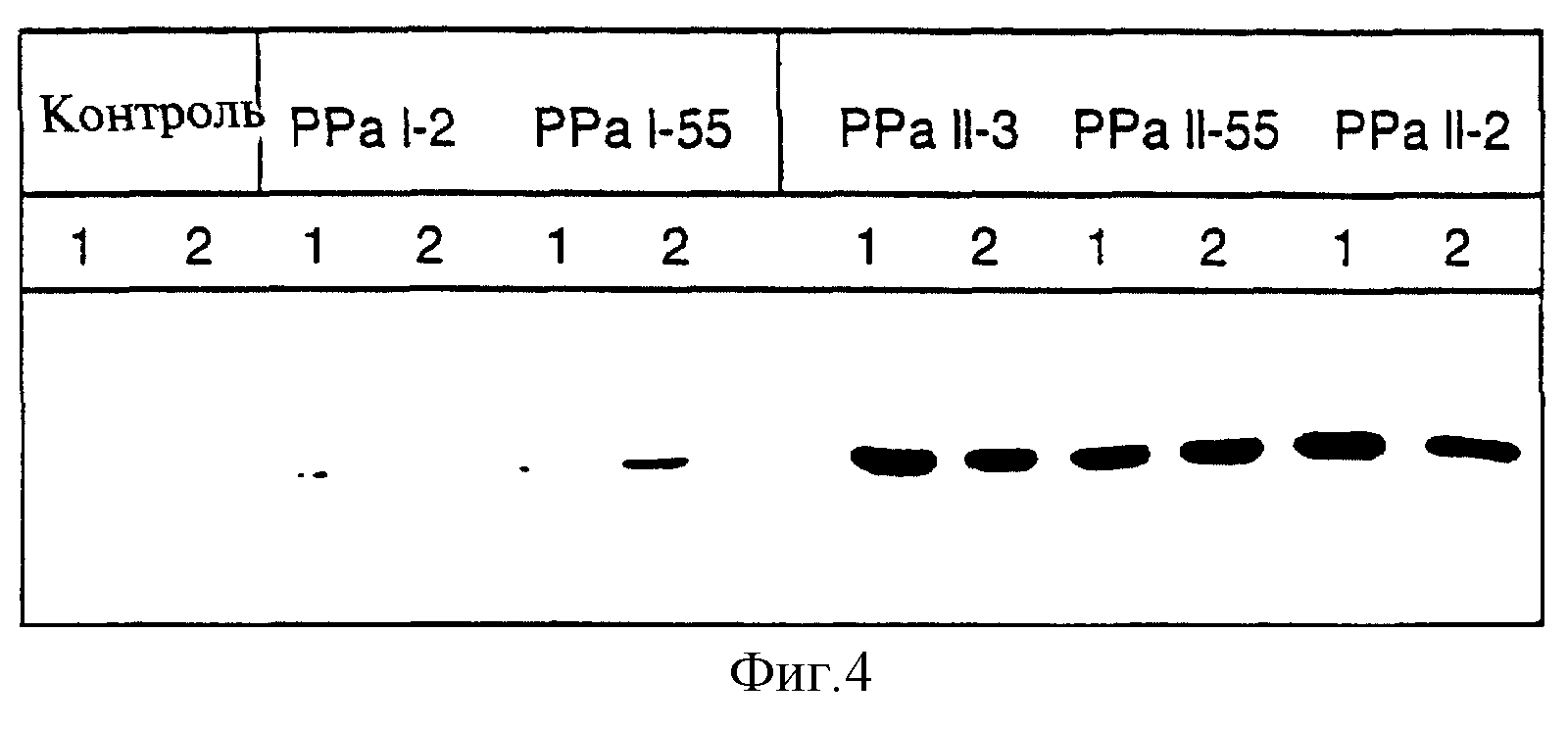
Фиг.4 показывает данные Вестерн-блоттинга белкового экстракта, полученного из клубней картофеля контрольных растений и вариантов PPaII-2, PPaII-3, PPaII-5, PPaI-2 и PPaI-55 с использованием антител к неорганической пирофосфатазе. Полосы 1 и 2 соответствуют образцам, полученным от двух независимых клубней.
Фиг.5 показывает фотографии клубней, собранных на растениях дикого типа и трансгенных растениях, после 5-месячного хранения при комнатной температуре и в полной темноте: А: контроль дикого типа (сорт Desiree); В: трансгенное растение PPaII-2; С: трансгенное растение PPaII-3; D: трансгенное растение PPaII-5.
Фиг.6 показывает (А) схему плазмиды рJIТ166; и (В) схему конструкции pAGS/pUC, включающей репортерный ген GUS.
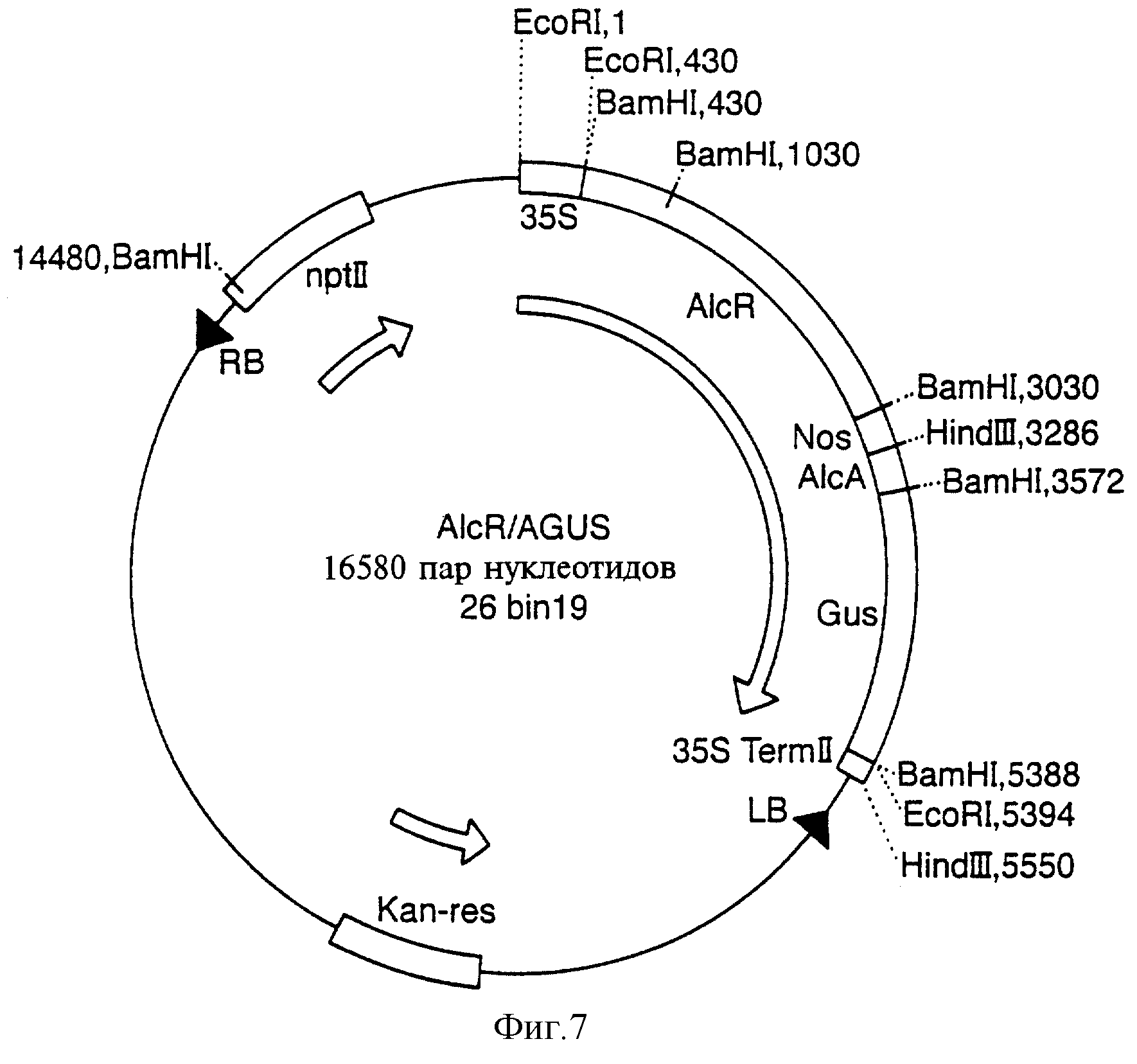
Фиг.7 показывает карту плазмиды AlcR/AGUS.
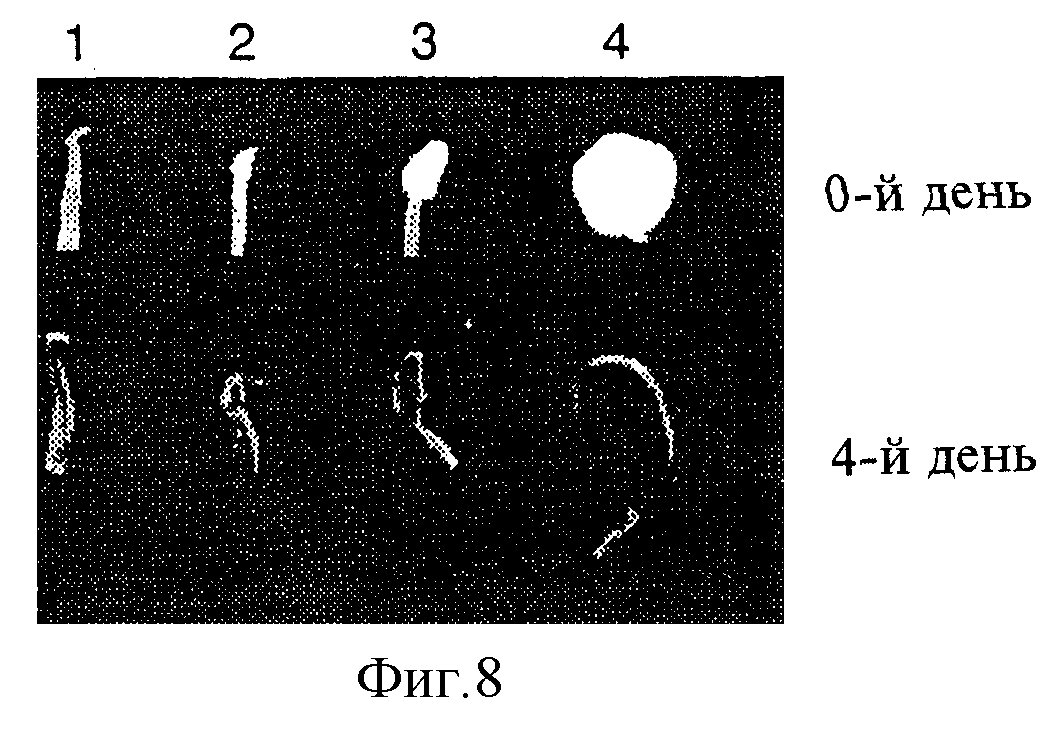
Фиг.8. Регенерированные из тканевых культур растения картофеля переносили в теплицу, где выращивали в течение 8 недель в 2,5-литровых емкостях. Экспрессию гена Alc индуцировали путем трехкратного вымачивания растения (в 0-й, 1-й и 2-й дни) с использованием 50 мл 5%-ного раствора этилового спирта. На 4-й день после исходной индукции столоны и развивающиеся клубни собирали для визуальной оценки активности GUS с использованием гистохимического окрашивания: 0-й день - до индукции; 4-й день - на 4-й день после индукции гистохимически выявляется активность Ale:GUS в стеблях, корнях и столонах: 1 - неиндуцированный столон; 2 - набухший клубень; 3 - развивающийся клубень; 4 - зрелый клубень.
Фиг.9 показывает фотографию клубней картофеля после гистохимического тестирования активности Ale:GUS после обработки парами этанола: А - 0 дней; В - 3 дня; С - 7 дней; D - необработанный контроль; Е - 7 дней после обработки.
Фиг.10 показывает карту плазмиды pGSTTAK.
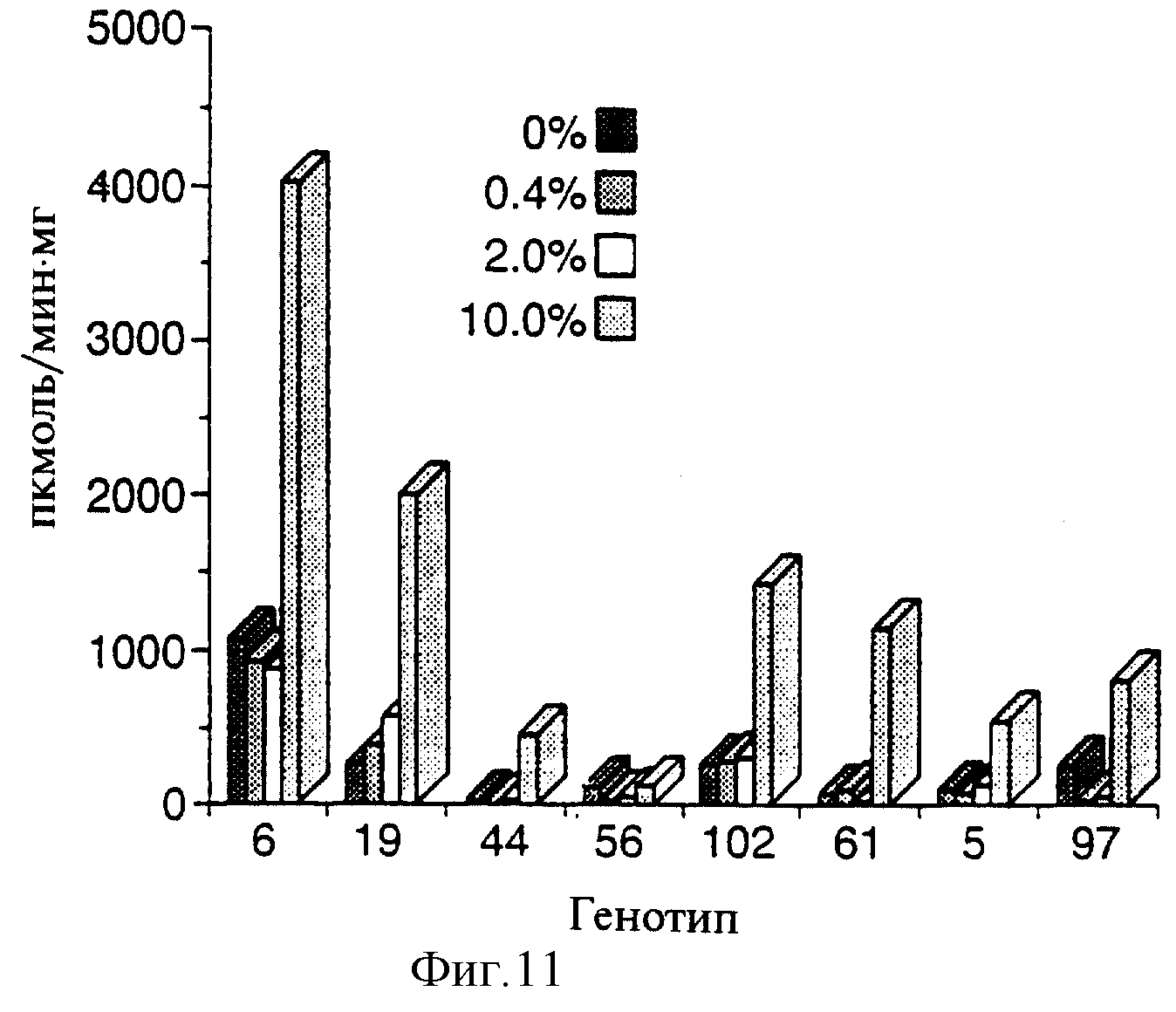
Фиг.11 показывает гистограмму данных анализа активности GUS в полностью развившихся листьях трансформированных растений GST-GUS после выращивания в течение 14 дней в среде MS, содержащей R-25788 в количестве 0%(



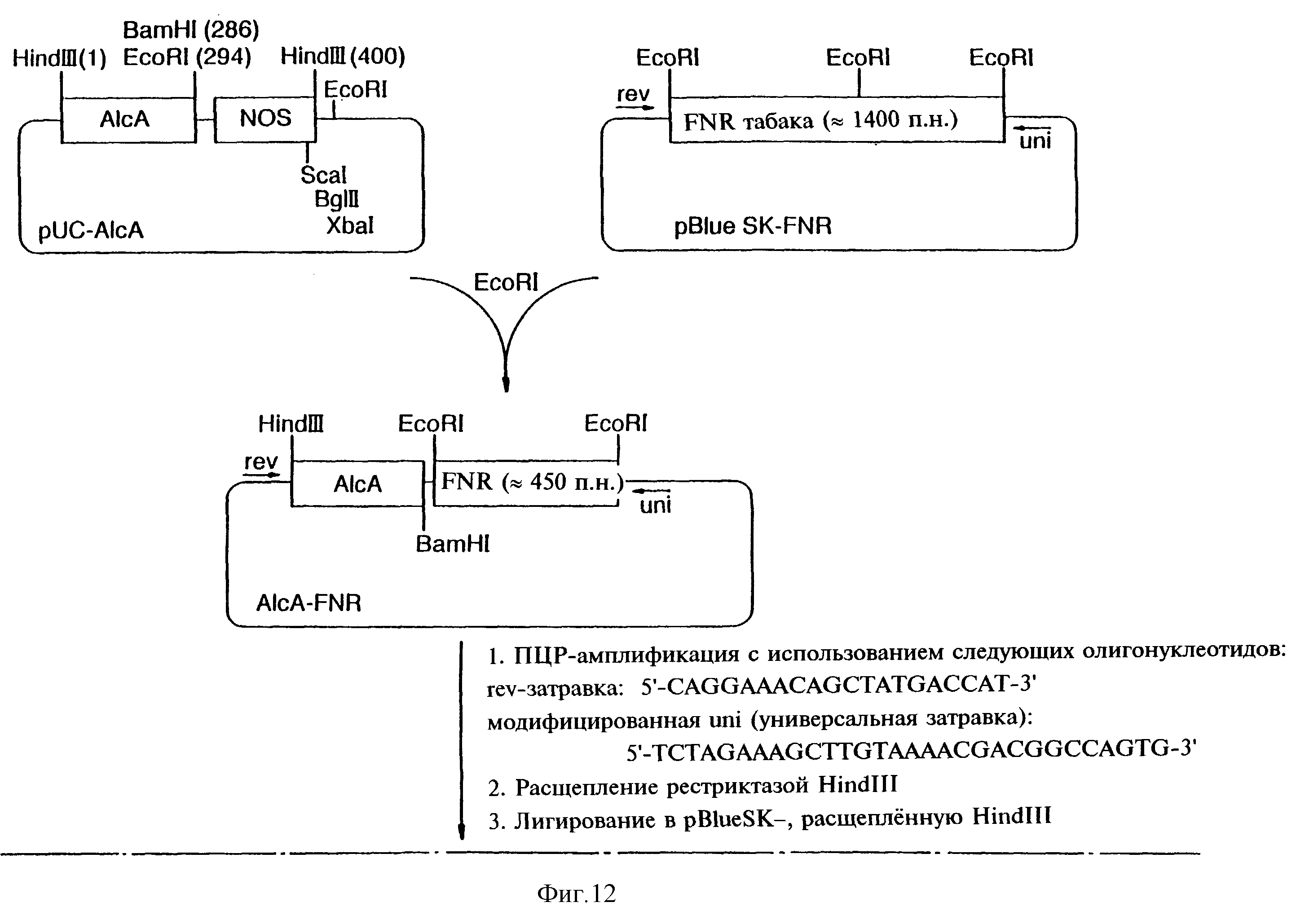
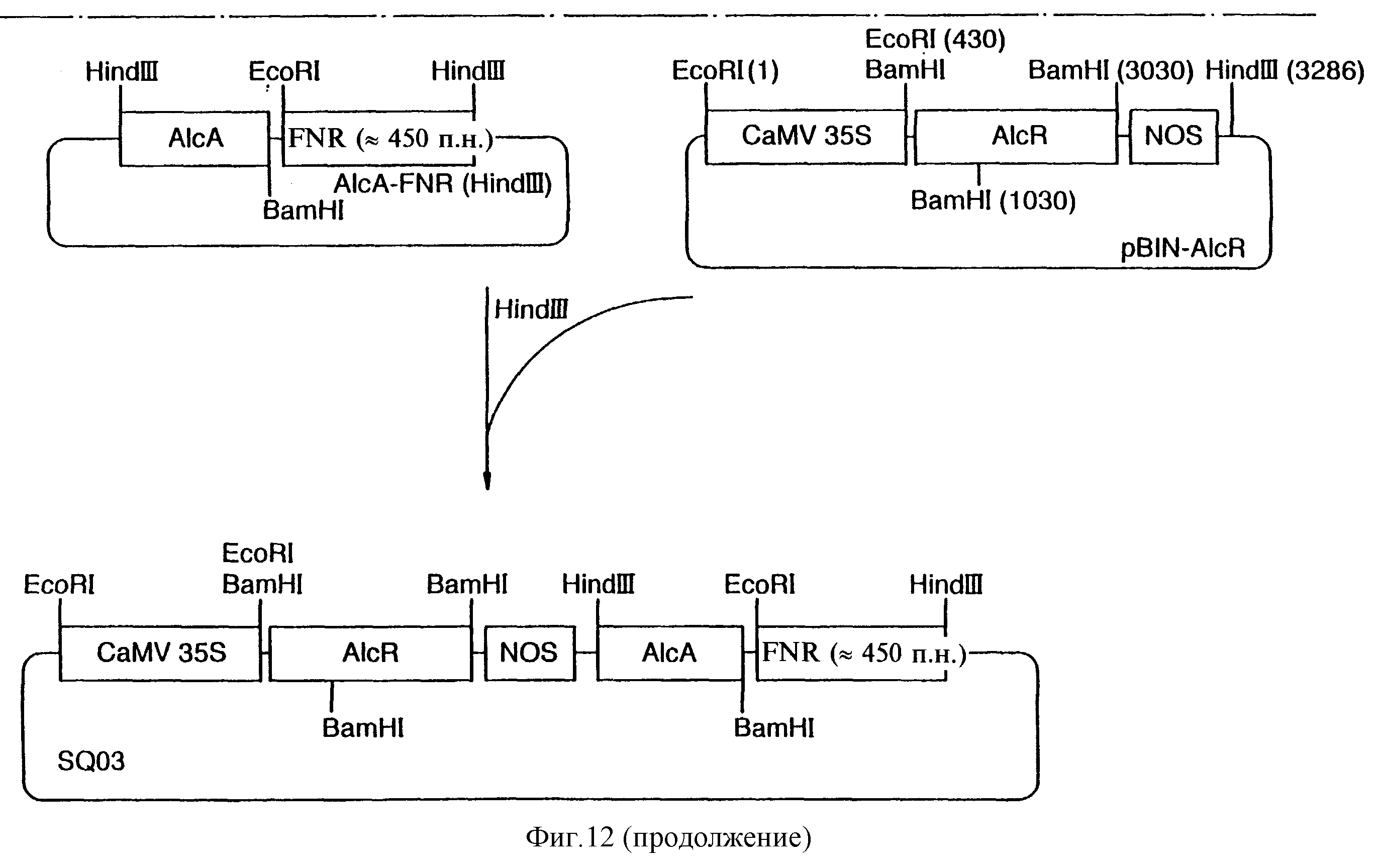
Фиг.12 показывает схему конструкции плазмиды SQ03.
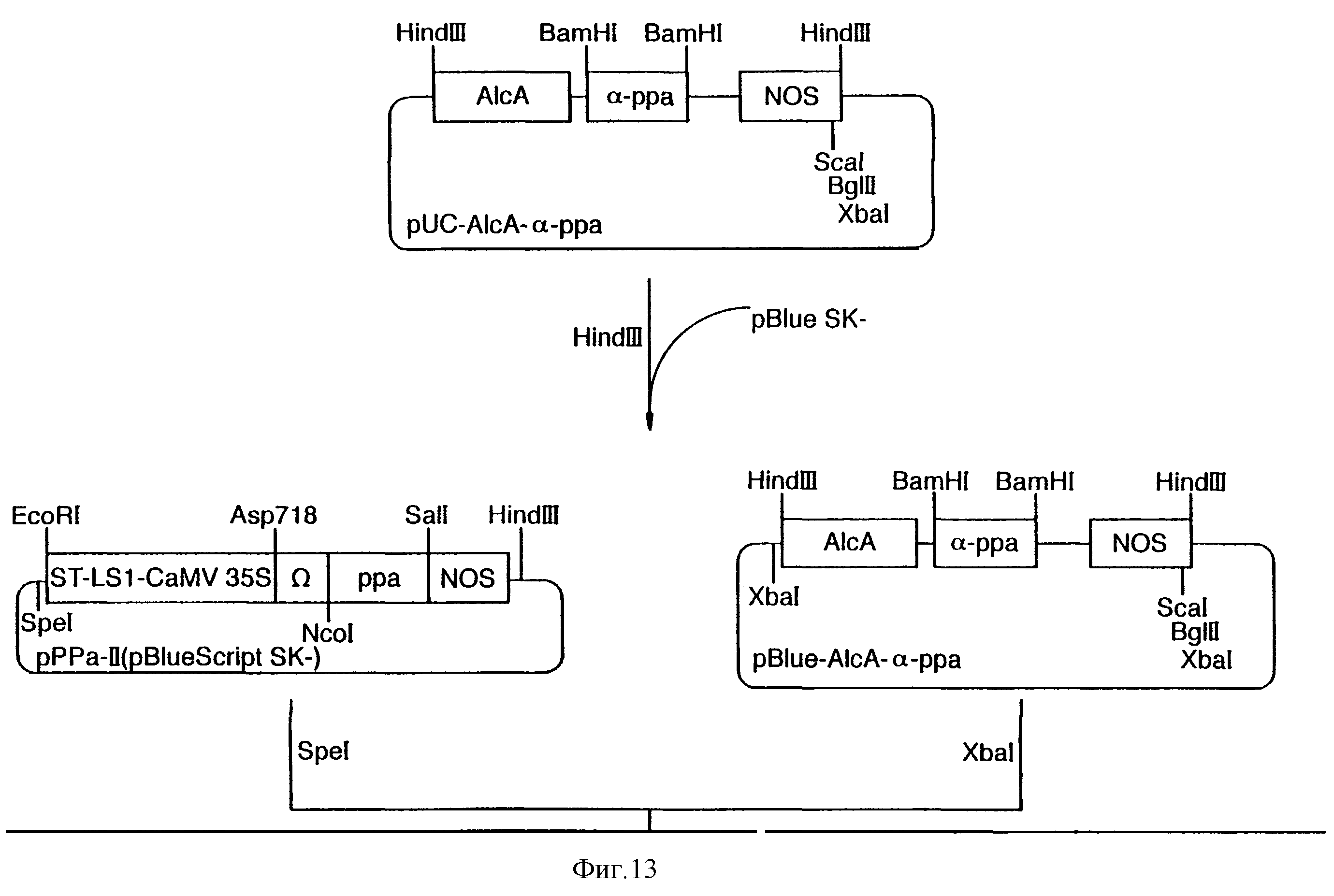
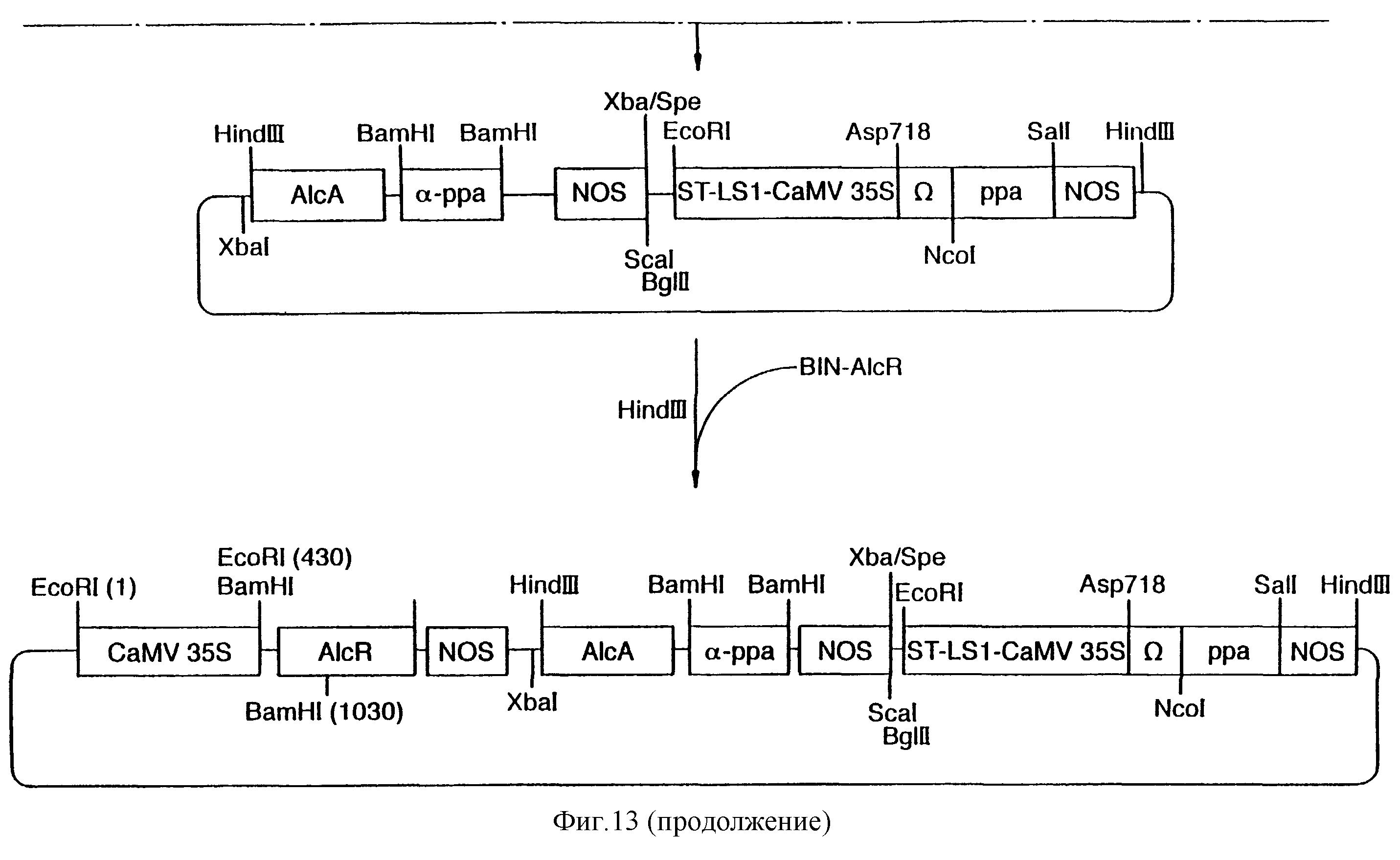
Фиг.13 показывает схему конструкции плазмиды SQ-01.
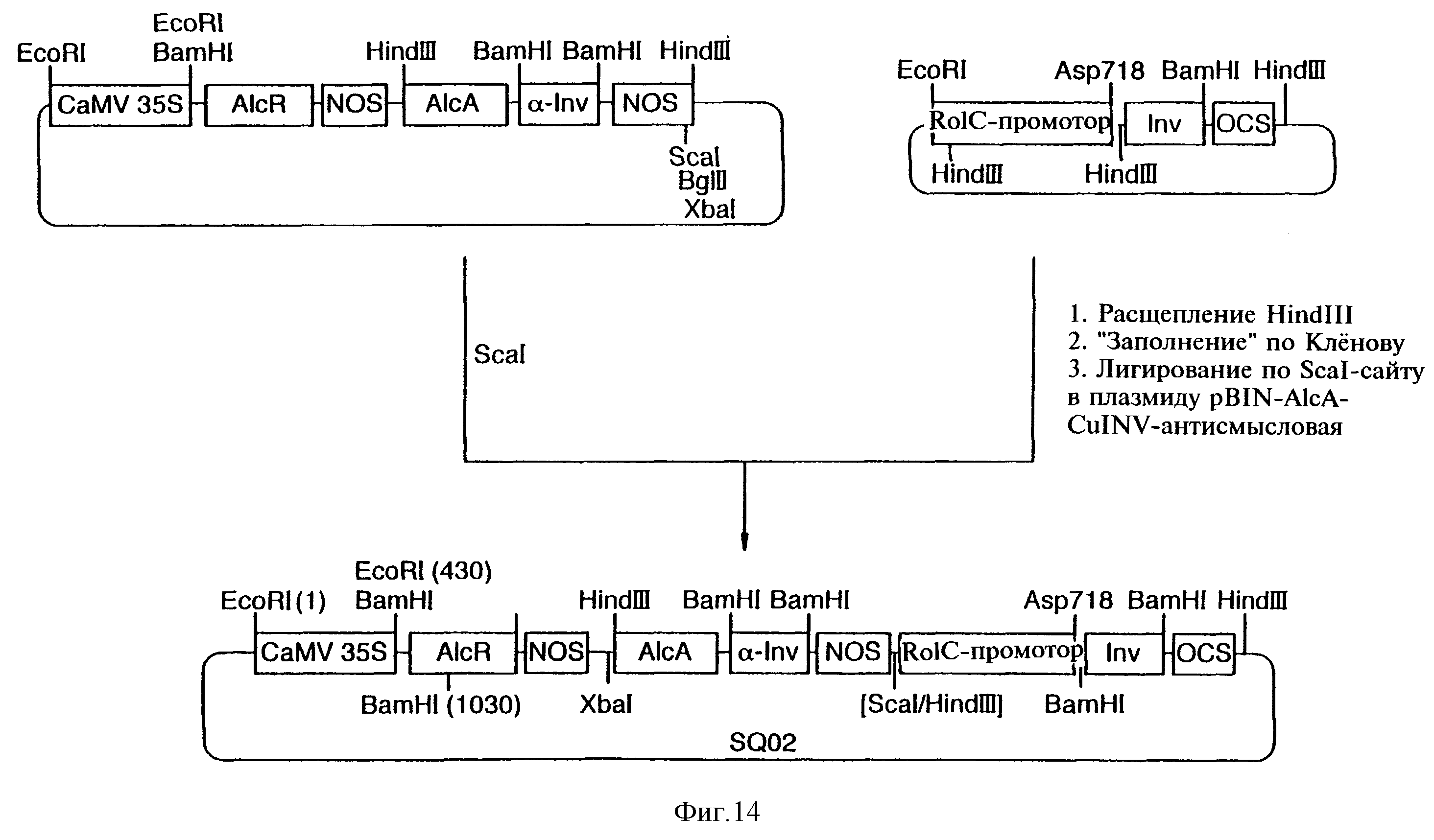
Фиг.14 показывает схему конструкции плазмиды SQ-02.
Фиг.15 показывает схему клонирования гена ANT картофеля.
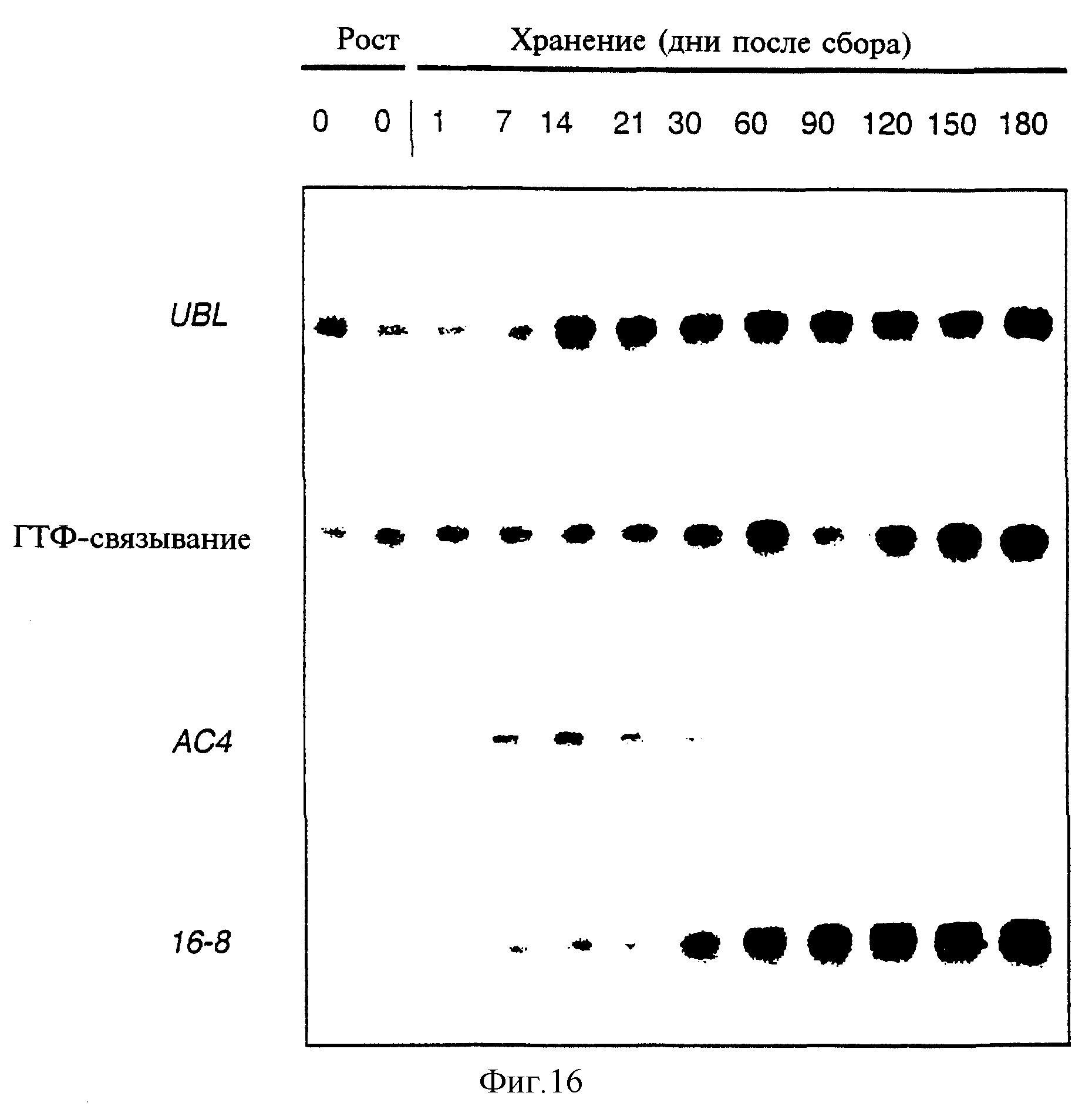
Фиг.16 показывает накопление UBL-, ГТФ-связывающе-, 16-8- и МОТ-специфичных транскриптов в различных районах, формирующих побеги клубни.
Фиг.17 показывает накопление UBL-, ГТФ-связывающе-, 16-8- и МОТ-специфичных транскриптов в различных районах, формирующих побеги клубни.
Фиг.18 показывает схему конструкции МОТ-антисмысловой конструкции.
Фиг.19 показывает последовательность ДНК, кодирующую белок МОТ, выделенную у картофеля.
Фиг.20 показывает гомологичность последовательностей белка, кодируемого клоном М-1-1 (МОТ), и митохондриального переносчика оксоглутарата Panicum milliaceum.
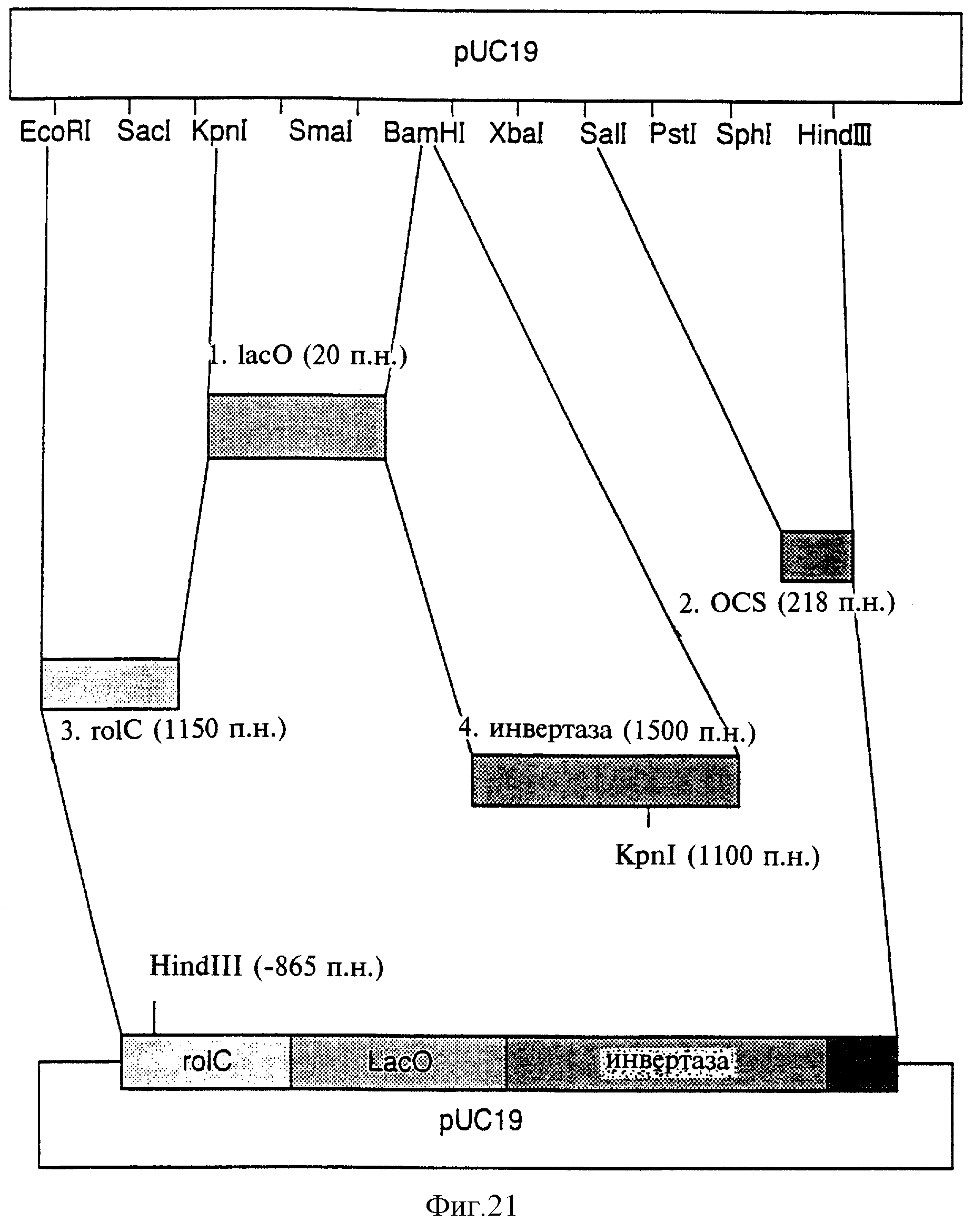
Фиг.21 показывает стратегию клонирования последовательности lac-оператора в состав RolC-инвертазной плазмиды.
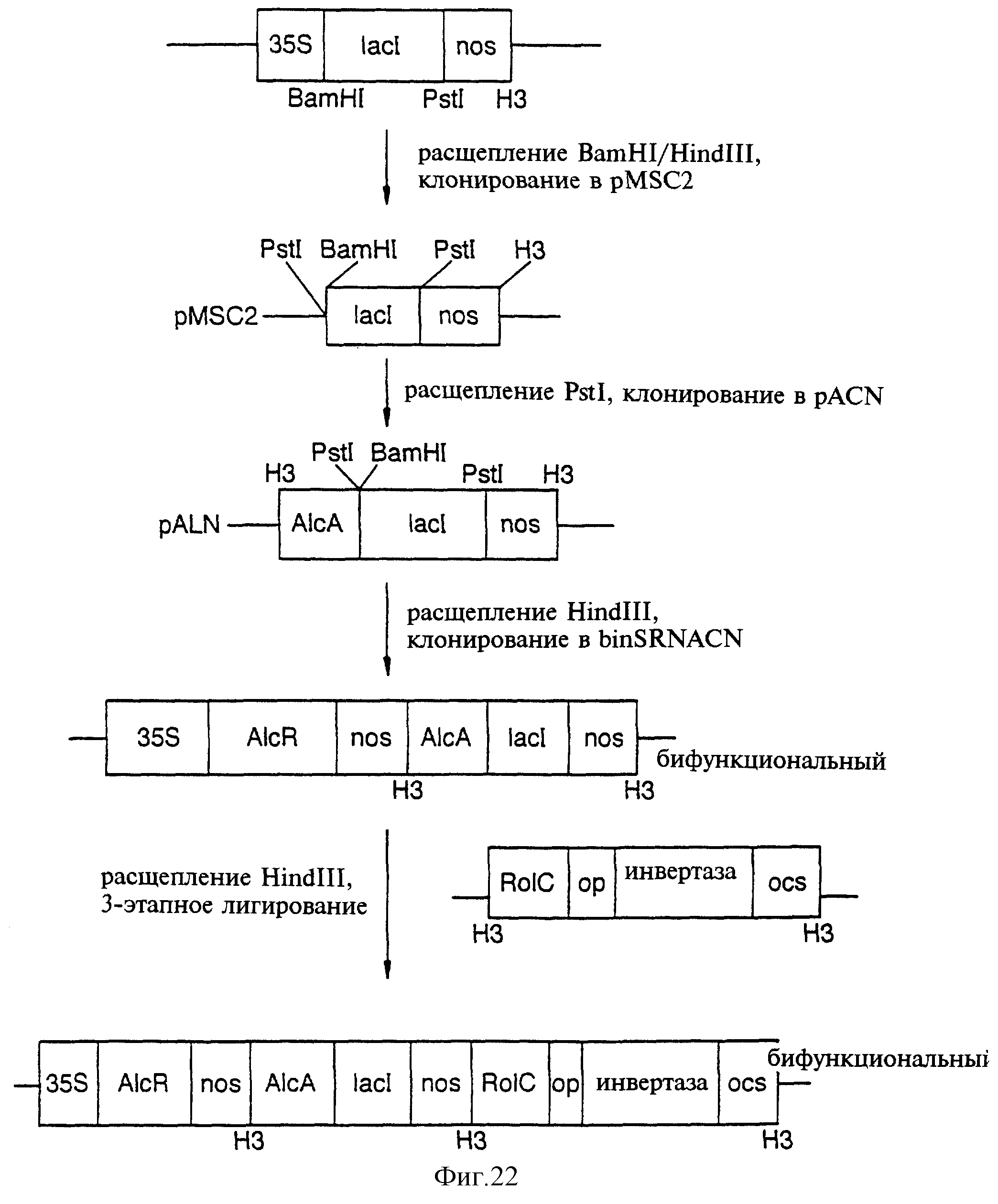
Фиг.22 показывает стратегию клонирования LacI в состав Alc-переключающего бифункционального вектора и лигирование в состав RolCopINV.
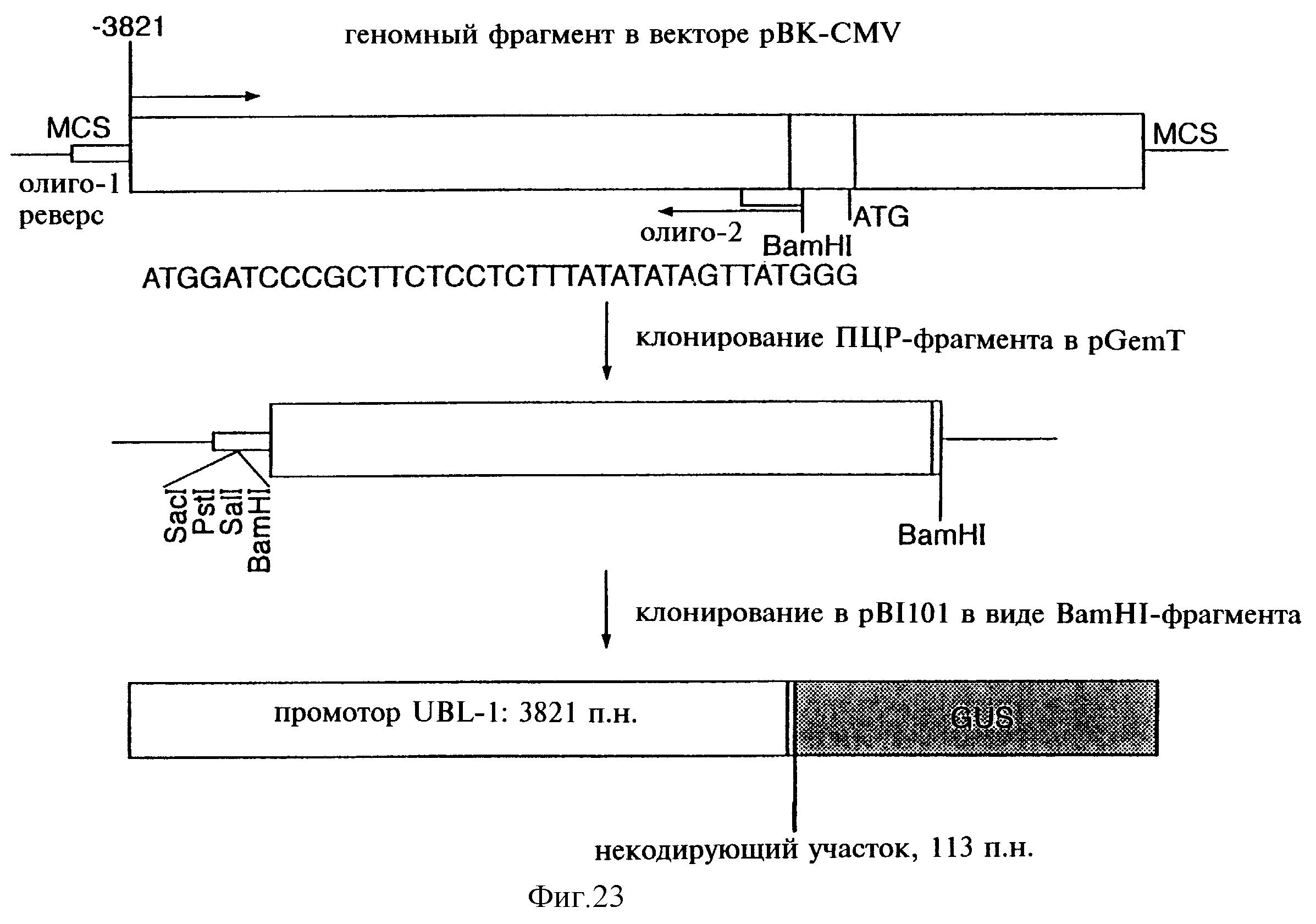
Фиг.23 показывает выделение промотора UBL-1 с помощью ПЦР.
Фиг.24 показывает выделение МОТ-промоторов с помощью ПЦР.
Фиг.25 показывает нуклеотидную последовательность промотора UBL-1.
Фиг.26 показывает нуклеотидную последовательность промотора МОТ3.
Фиг.27 показывает нуклеотидную последовательность промотора МОТ6.
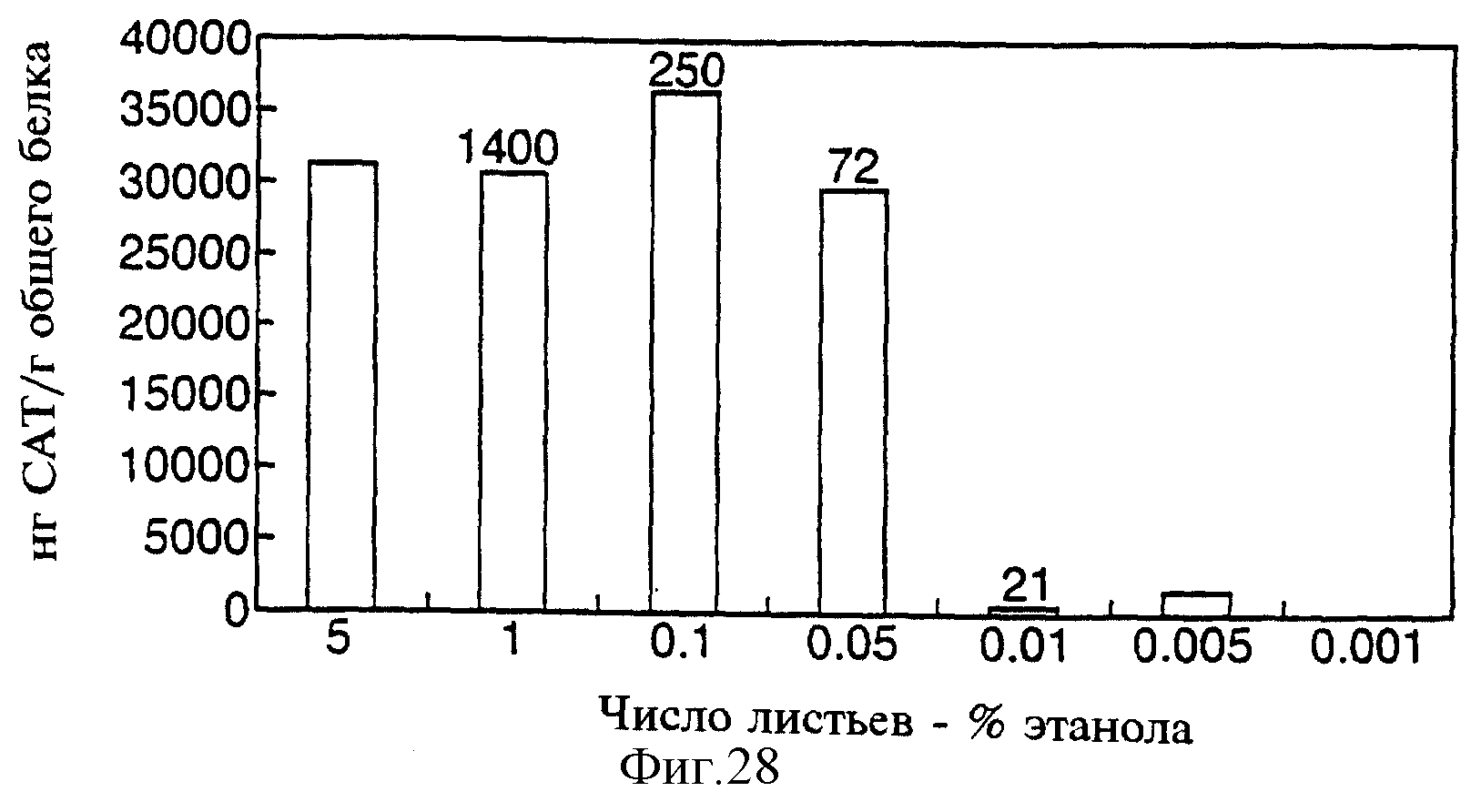
Фиг.28 показывает данные САТ-теста трансформированных системой ALC-CAT листьев табака после помещения в закрытую емкость с парами этанола на 24 часа. Число над колонками обозначает соотношение количества (в нг) этанола и объема пробы соцветия (мл).
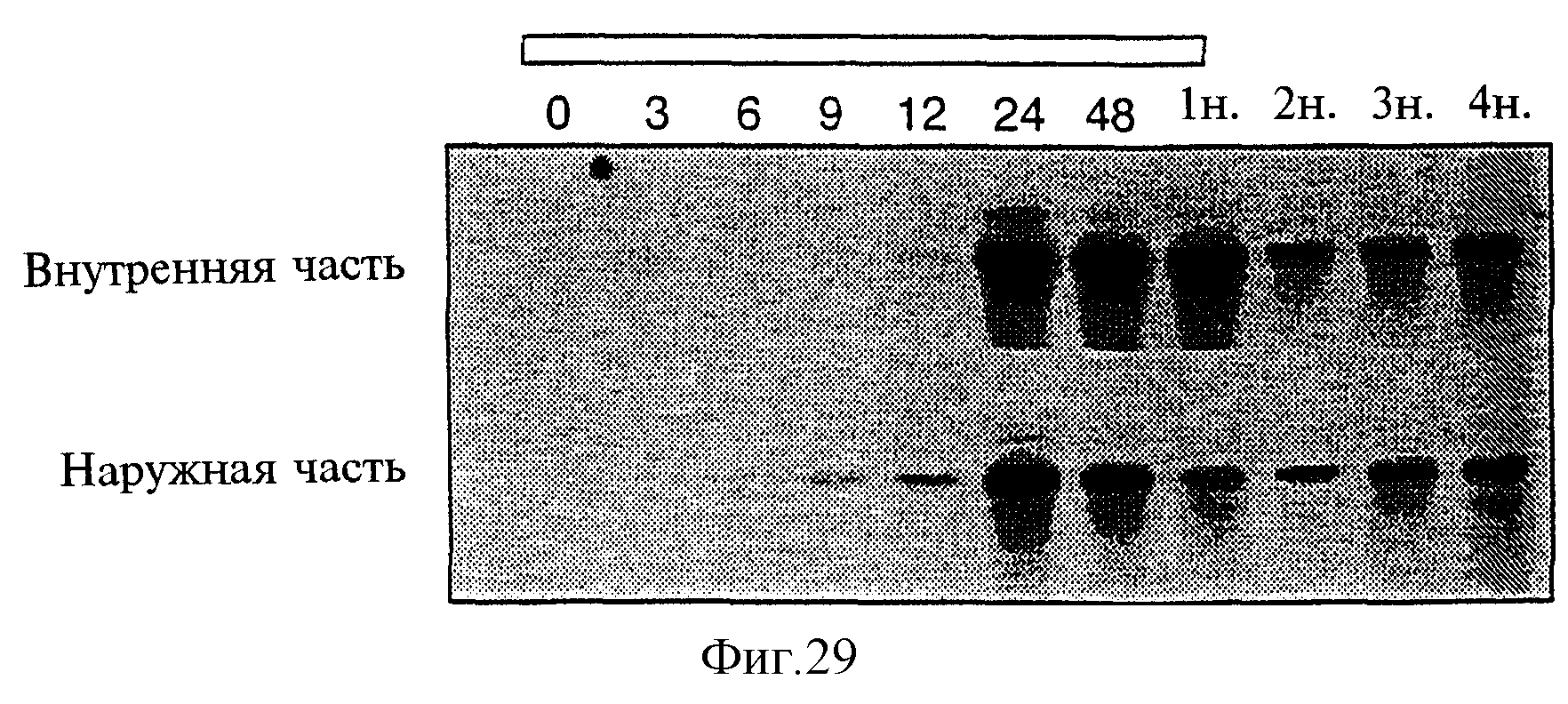
Фиг.29 показывает кинетику транскрипта GUS в клубнях трансгенного картофеля 35S-Alc-GUS после индукции этанолом. Внешняя часть клубня соответствует 1-3-мм слою кожицы картофельного клубня, в то время как остальная часть клубня рассматривается как внутренняя часть. Индукция была осуществлена в 40-литровых пластиковых емкостях, плотно закрытых резиновой пробкой, в течение 1 недели. Концентрация паров этанола составляла 0,2% (8 мл 96%-ного этанола на 40-литровый объем) при загрузке 20 мкг тотальной РНК в каждый вариант.
Фиг.30 показывает кинетику транскрипта GUS и активность в клубнях трансформированных растений картофеля 35S-Alc-GUS после индукции 1%-ным этанолом.
ПРИМЕРЫ
I. Примеры подавления образования побегов
1. Подавление образования побегов на клубнях картофеля путем экспрессии специфичной для флоэмы инвертазы
1.1. Конструирование плазмиды pBIN-RolC
Промотор го1С почвенной бактерии Agrobacterium rhizogenes был клонирован с применением полимеразной цепной реакции (ПЦР) в соответствии с инструкциями производителя (Perkin-Elmer, Ueberlingen; Германия). Температурный режим ПЦР на протяжении 40 циклов был таким: 1 минута при 95°, 1 минута при 45° и 2 минуты при 72°. Плазмидную ДНК, включающую промотор rо1С, выделяли из A.rhizogenes, несущих плазмиду рАВС002 (Schmulling et al., 1989, Plant Cell, 1, 665-670), с использованием стандартной процедуры (Sambrook et al., 1989, "A Cloning Manual", Cold Spring Harbor Lab. Press). Синтетические олигонуклеотиды были сформированы на основе опубликованных нуклеотидных последовательностей фрагмента промотора rolC (Slighton et al., 1986, J. Biol. Chem., 261, 108-121). Последовательности затравок были таковы: затравка 5'-rо1С (GGAATTCGATACGAAAAAGGCAAGTGAA AGGGCC) и затравка 3'-го1С (CCCATG GTACCCCATAACTCGAA GCATCC). Амплифицированную ДНК клонировали в состав ПЦР-вектора pCR1000TM (Invitrogen, Norwalk, CT). Для исключения мутаций в составе амплифицированной ДНК в ходе циклов ПЦР осуществляли секвенирование клона по методу Сэйнджера. Фрагмент промотора длиной 1150 пар нуклеотидов клонировали в растительную экспрессионную кассету pBINAR (
1.2. Конструирование плазмиды pBIN-IN8 (фиг.1)
Для получения укороченного варианта гена Suc2 дрожжей была применена ПЦР с олигонуклеотидными затравками 5'-Suc2 (GAGCTGCAGATGGCAAACGAAACTAGCGATAGACCTTTGGTCACA) и 3'-Suc (GAGACTAGTTTATAACCTCTATTTTACTTCCCTTACTTGGAA) была применена с целью амплифицирования гена инвертазы из состава плазмиды PI-3-INV (von Schaewen et al., 1990, ENBO J., 9, 3033-3044). ПЦР-продукт расщепляли рестриктазами PstI/SpeI и клонировали по сайтам PstI/XbaI плазмиды YIP128A1 с получением в результате плазмиды 181A1-INV (Reismeier et al., 1992, EMBO J., 11, 4705-4713). Для получения BamHI-сайтов по обоим концам гена инвертазы плазмиду 181A1-INV обрабатывали рестриктазами PstI/BamHI, а инвертазный фрагмент лигировали в вектор pBlueSK- с получением в результате конструкции pBlue-Suc2. Затем плазмиду pBlue-Suc2A обрабатывали рестриктазами SpeI/EcoRV, "затупляли" концы ДНК-полимеразой и клонировали по SmaI-сайту в pBlueSK- с получением плазмиды pBlue-Suc2B.
С использованием плазмиды pBlue-Suc2B ген инвертазы был выделен в виде BamHI-фрагмента и клонирован по BamHI-сайту в составе плазмиды pBIN-RolC. Полученная в результате плазмида (pBIN-IN8) включала ген Suc2 (нуклеотиды 849-2393), расположенный между промотором rо1С и полиадениловым сигналом гена октопинсинтазы (Gielen et al., 1984, EMBO J., 3, 835-846).
1.3. Трансформация конструкцией pBIN-IN8
Бактерия Agrobacterium tumefaciens штамма С58С1, несущая плазмиду pGV2260 (Deblaere et al., 1989, Nucl. Acids Res., 13, 4777-4788) была трансформирована путем прямой трансформации растений сорта Desiree с использованием плазмиды pBIN-IN8 в соответствии с описанным ранее (Hofgen & Willmitzer, 1988, Nucl. Acids Res., 16, 9877). Трансформацию картофеля осуществили с применением известного протокола (Rocha-Sosa et al., 1989, EMBO J., 8, 23-29). Первичный скрининг увеличенного уровня активности инвертазы был проведен в срединных жилках листьев растений, регенерированных из тканевых культур. Три линии (DIN-87, DIN-90, DIN-30) из 75 независимо полученных трансформантов были отобраны для дальнейшего анализа. Для подробного анализа десять повторностей каждого заранее отобранного трансформанта были перенесены в теплицу для выращивания клубней.
1.4. Активность инвертазы
Инвертазный тест. Ткань растения, быстро замороженную на жидком азоте, гомогенизировали в экстракционном буфере (50 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты [HEPES]-KOH: pH 7,4; 5 мМ MgCl2; 1 мМ EDTA; 1мМ этиленгликоль-бис (b-аминоэтилэфир)-N,N,N',N'-тетрауксусная кислота (EGTA); 1 мМ фенилметилсульфонилфторида (PMSF); 5 мМ дитиотреитола (DTT); 0,1% Тритон Х-100, 10% глицерина) и центрифугировали в течение 5 минут при 4°С, при 9000g (центрифуга Biofuge-13: Heraeus, Hanau; Германия). Для тестирования нейтральной инвертазы реакционная смесь содержала 20 мМ HEPES-КОН (рН 7,5), 100 мМ сахарозы и 10-30 мкл белкового экстракта при конечном объеме 100 мкл. Инкубация была осуществлена при 30°С в течение 50-60 минут и остановлена нагреванием до 90°С на 3 минуты. "Пустышки" характеризовались той же реакционной смесью, но их инактивировали нагреванием без периода инкубации. Определение глюкозы и фруктозы было описано ранее (Stitt et al., 1989, Methods Enzymol., 174, 518-522). Для тестирования растворимой кислой инвертазы реакционная смесь включала 20 мМ ацетата натрия (рН 4,7), 100 мМ сахарозы и 10-30 мкл белкового экстракта при конечном объеме 100 мкл. Инкубация была осуществлена при 30°С в течение 30-90 минут. Для нейтрализации реакционной смеси перед остановкой реакции нагреванием до 95°С на 3 минуты добавляли 10 мкл 1 М фосфата натрия (рН 7,2). "Пустышки" характеризовались той же реакционной смесью, но инактивацию нагреванием проводили без инкубации.
После сбора с трансформированных и нетрансформированных растений картофеля клубни были запасены на 5 месяцев при 20°С. Затем активность нейтральной и кислой инвертаз определяли на срезах клубней. Результаты показаны в таблице 1.

Даны средние значения ± стандартные отклонения (при n=4). Активность инвертаз дана в наномолях на грамм свежего веса в минуту. В качестве контроля использованы растения дикого типа (сорт Desiree).
1.5. Вклад инвертазы в накопление углеводов в клубнях картофеля
Определение растворимых углеводов. Клубни были собраны и срезы клубней (60-70 мг свежего веса, средний объем 0,1 см3) немедленно замораживали на жидком азоте. Срезы экстрагировали в 1 мл 80%-ного этанола (10 мМ HEPES-KOH - рН 7,4) при 80°С в течение 1-2 часов. Надосадочную фракцию использовали для определения глюкозы, фруктозы и сахарозы в соответствии с описанным ранее (Stitt et al., 1989). Центрифугат экстрагировали вторично, промывали водой и высушивали. Определение содержания крахмала было проведено с использованием набора реактивов для определения крахмала (Boehringer Mannheim). Результаты показаны в таблице 2.

Даны средние значения ± стандартное отклонение (n=12 - контроль; n=4 - трансгенные варианты). Содержание углеводов дано в микромолях гексозы на 1 г свежего веса. Контролем являлись растения дикого типа сорта Desiree.
1.6. Урожайность
Растения картофеля выращивали в закрытом грунте при 60%-ной относительной влажности при соотношении 16 часов дня (22°С) и 8 часов ночи (15°С) (при освещенности 300 мкМ/м2c). Для оценки вклада специфичной для флоэмы цитоплазматической дрожжевой инвертазы на свежую маску клубней и число клубней по 10 растений каждого генотипа были выращены в 2-литровых емкостях. Как показано в таблице 3, общий вес и число клубней на трансгенных растениях не отличаются от этих признаков у растений дикого типа.
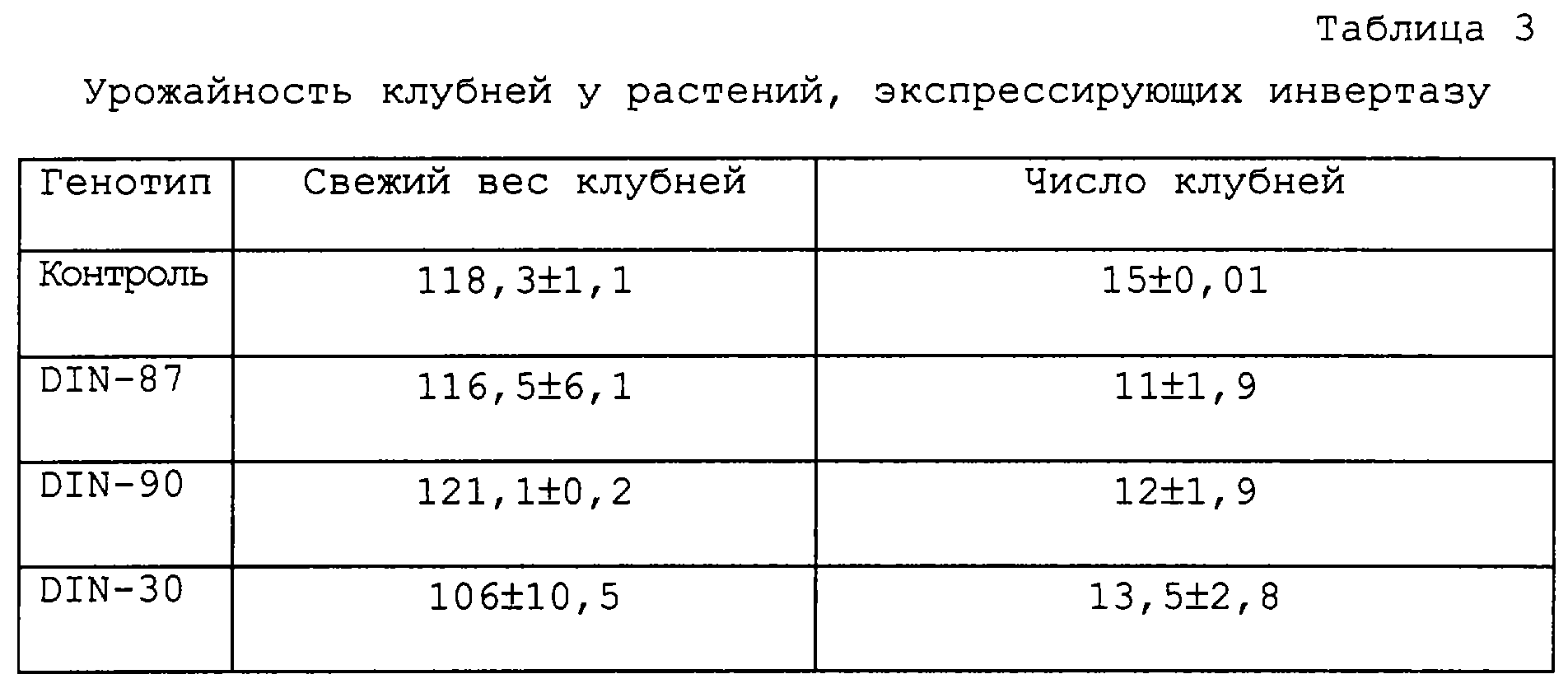
Даны средние значения ± стандартное отклонение (n=10). Свежий вес клубней дан в граммах. Контролем являлись растения дикого типа сорта Desiree.
1.7. Предотвращение образования побегов у трансгенных растений
Для анализа вклада специфичной для флоэмы цитоплазматической инвертазы в образование побегов на клубнях собранные клубни трансформированных и контрольных растений запасали в течение длительного времени в темноте при комнатной температуре. У клубней дикого типа сорта Desiree образование побегов начиналось через 5-6 месяцев хранения, в то время как клубни трансгенных растений не образовывали жизнеспособных побегов вообще (фиг.3). Таким образом, экспрессия специфичной для флоэмы инвертазы приводит к полному предотвращению образования побегов на картофельных клубнях.
2. Предотвращение образования побегов на клубнях в результате экспрессии неорганической пирофосфатазы кишечной палочки E.coli
2.1. Конструирование плазмиды РРА-2 и трансформация картофеля (фиг.1)
Фрагмент промотора STLS-1 длиной 1600 пар нуклеотидов (Eckes et al., 1986, Mol. Gen. Genet., 205, 14-22) был выделен в виде EcoRI/BamHI-фрагмента из состава плазмиды 1600-САТ (Stockhaus et al., 1987). После удаления перекрывающихся нуклеотидов этот фрагмент клонировали в состав "затупленного" EcoRI-сайта в составе химерного гена РРА, описанного ранее (Sonnewald, 1992, Plant J., 2, 571-581). Конечная конструкция, включающая промотор-энхансер STLS-1, промотор 35S-CaMV, энхансер трансляции TMV-U1, кодирующий ген РРА E.Coli и полиадениловый сигнал гена октопинсинтазы, была клонирована в виде EcoRI/HindIII-фрагмента в состав бифункционального вектора Binl9 (Bevan, 1984; цит. выше). Прямая трансформация C58C1:pGV2260 бактерии Agrobacterium tumefaciens была осуществлена в соответствии с описанным ранее (Hofgen & Willmitzer, 1988, Nucl. Acids Res., 16, 9877). Трансформация картофеля с использованием опосредованного Agrobacterium переноса генов была осуществлена так, как это было ранее описано (Rocha-Sosa et al., 1989, EMBO J., 8, 23-29).
После опосредованного Agrobacterium переноса гена сорок независимых трансформированных растений были проанализированы на присутствие белка пирофосфатазы (ПФФ) с применением метода иммуноблоттинга. Три растения (PPaII-2, PPaII-3, PPaII-5), характеризовавшиеся наивысшим количеством белка ПФФ, отобрали для последующего анализа. Для сравнения силы химерного промотора 353-CaMV (PPaII) и немодифированного промотора 353-CaMV (PPaI) белковые экстракты картофельных клубней были проанализированы с помощью Вестерн-блоттинга. Как показано на фиг.4, количество белка ППФ, маркируемое в белковых экстрактах растущих клубней PPaII, оказывается существенно выше по сравнению с контрольным вариантом PPaI. Такие же результаты были получены на клубнях, хранившихся в течение трех и двенадцати месяцев при комнатной температуре. В этом анализе сравнивали высокоэкспрессирующие линии популяций PPaI и PPaII: были отобраны 70 независимых трансформантов в варианте PPaI и 40 - в варианте PPaII. Из данного анализа ясно, что промотор STLS-1 усиливает экспрессию неорганической пирофосфатазы в клубнях. Экспрессия неорганической пирофосфатазы E.coli увеличивалась параллельно с увеличением пирофосфатазной активности, замеряемой в белковых экстрактах клубней PPaI (табл.4) в зависимости от уровня пирофосфатазной активности, содержание пирофосфатазы сокращалось максимально вдвое (таблица 4).

Клубни собирали на растениях, выращивавшихся в теплице на протяжении 150 дней. Приведены средние величины ± стандартное отклонение (n=3 для растений дикого типа и n=4 для трансгенных растений) для трех клубней, взятых от трех разных растений дикого типа, и для 2-4 клубней от каждого растения генотипа PPaII.
2.2. Анализ методом иммуноблоттинга
После разделения методом электрофореза в 12,5%-ном SDS-полиакриламидном геле (Laemmli, 1970) белки переносили на нитроцеллюлозные мембраны (Millipore, Bradford, MA: США) с использованием прибора для полусухого электроблоттинга (Multiphore II: LKB, Bromma, Швеция). Инкубация с поликлональными антителами к пирофосфатазе (Lerchl et al., 1995, Plant Cell, 7, 259-270), разведенными 1:1000, продолжалась 90 минут при комнатной температуре. Иммунологическое выявление антигена было осуществлено с использованием биотин-стрептавидиновой системы (Amercham Buchler) с кроличьими биотинилированными видоспецифичными полными антителами (от осла) и стрептавидин-биотинилированную пероксидазу редьки.
2.3. Тест на активность пирофосфатазы
Для измерения пирофосфатазной активности 100-200 мг среза клубня гомогенизировали в 0,5 мл 100 мМ 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (HEPES)-KOH (рН 7, 5), 2 мМ MgCl2, 1 мМ EDTA, 1 мМ EGTA, 5 мМ меркаптоэтанола. После центрифугирования (10 минут при 13000 об/мин, 4°С) 200 мкл надосадочной фракции тестировали в 160 мкл 50 мМ Трис-НСl (рН 8,0), 16 мМ MgSO4 и 100 мМ КС1 на активность пирофосфатазы. После добавления 20 мкл 50 мМ пирофосфата натрия реакцию проводили в течение 20 минут при 30°С. Реакцию останавливали добавлением 20 мкл 1 М лимонной кислоты и выход неорганического фосфата оценивали по методу Хейнонена-Лати (Heinonen & Lathi, 1981, Anal. Biochem., 113, 313-317). Данные теста характеризовались линейной зависимостью от времени и количества экстракта.
2.4. Определение неорганического пирофосфата в ткани клубня
Для измерения содержания пирофосфата 200-300 мг ткани клубня замораживали на жидком азоте. Замороженный материал затем гомогенизировали в мелкий порошок в жидком азоте, используя ступку, помещенную в измельченный сухой лед (твердая углекислота). Добавляли 15-мл аликвоты 16%-ной трихлоруксусной кислоты в диэтиловом эфире (объемные проценты), предварительно охлажденные до температуры сухого льда, и затем образцы гомогенизировали. После оставления гомогената на 20 минут на сухом льду добавляли 0,8 мл 16%-ной трихлоруксусной кислоты в воде (объемные проценты), содержащей 5 мМ фторида натрия. Смесь нагревали до 4°С и оставляли на 3 часа. Затем гомогенат экстрагировали четырежды в диэтиловом эфире и нейтрализовали смесью едкого кали и триэтаноламина в соответствии с (Weiner et al., 1987, Biochem. Biophys. Acta, 893, 13-21). Все ступки и материалы предварительно промывали в течение 12 часов 2 Н НС1 и готовили псевдоэкстракты параллельно проверке того, не содержат ли реагенты и оборудование каких-либо посторонних пирофосфатов. Перед тестированием на содержание пирофосфатов 400 мкл экстракта добавляли к 400 мкл катионного обменника (Serva, Heidelberg, Германия: Dowex AG 50×8, ячея 100-200, предварительно уравновешен 2 Н НС1, доведен водой до рН 5 и затем высушен при комнатной температуре в течение 12 часов), смешивали в течение 20 секунд и центрифугировали до удаления из экстракта соединений, которые могут помешать проведению метаболического теста. Надежность оценки экстракта и данных теста проверяли путем добавления небольшого информативного количества пирофосфата (вдвое-втрое большего по сравнению с "внутренним" содержанием) к растительному материалу в убитой смеси трихлоруксусной кислоты и диэтилового эфира.
2.5. Урожайность
Растения картофеля выращивали в закрытом грунте при 60%-ной относительной влажности при соотношении освещенности (22°С) и темноты (15°С) 16:8 часов (освещенность 300 мкмоль/м2c). Для оценки вклада неорганической пирофосфатазы E.coli в свежую массу клубней и число клубней по пять растений каждого генотипа выращивали в 2-литровых емкостях. Общий свежий вес клубней с растений PPaII не отличался от такого у контрольных растений дикого типа (таблица 5).

Клубни были собраны с растений, которые выращивали в закрытом грунте на протяжении 150 дней. Даны средние величины по пяти отдельным растениям каждого генотипа.
2.6. Предотвращение образования побегов у трансгенных растений
Клубни, собранные на растениях дикого типа, начинают прорастать через пять-шесть месяцев хранения, в то время как клубни генотипов PPaII видимых побегов не образуют вовсе (фиг.5). Притом, что прорастание клубней дикого типа во время хранения продолжается вплоть до 12-го месяца хранения, побеги на картофелинах PPaII по-прежнему не отмечаются. Даже после еще более длительного хранения - на протяжении двух лет - у клубней PPaII побегов нет. Обработка картофельных клубней гибберелловой кислотой, этефоном, высокими и низкими температурами или светом не приводит к образованию побегов у клубней PPaII. При этом низкий уровень экспрессии у трансгенных растений PPaI оказывается недостаточным для предотвращения образования побегов.
II. Примеры индуцибельной экспрессии у картофельных клубней
3. Индуцируемая этанолом экспрессия генов
3.1. Конструкция плазмиды Alc:GUS
Источником гена GUS служила плазмида рJIТ166, производная от плазмиды pUC (фиг.6). Фрагмент плазмиды рJIТ166, включающий кодирующий участок гена GUS (бактериальная β-глюкуронидаза) и терминатор 35S-CaMV, клонировали в состав вектора pACN/pUC с использованием рестриктаз SalI и BglII. Рестриктаза BglII разрезает терминатор 353-CaMV трижды. Первый разрез находится через 250 пар нуклеотидов после конца гена GUS. Хотя отрезаемый фрагмент содержит лишь малую часть терминатора, в его составе оказываются все последовательности, необходимые для обеспечения терминации транскрипции. В результате расщепления плазмиды рJIТ166 рестриктазами SalI/BglII образуется фрагмент длиной 1800 пар нуклеотидов, включающий весь ген GUS и укороченный терминатор 353-CaMV. Этот фрагмент был клонирован в состав PACN/pUC, расщепленной рестриктазами SalI и BglII с целью удаления гена CAT и терминатора NOS, в результате чего образовывались SalI-выступ по 5'-концу перед промотором а1сА и BglII-выступ по 3'-концу линеаризованного вектора. Фрагмент, включающий ген GUS и терминатор 35S-CaMV, лигировали в состав линеаризованного вектора pUS, включающего промотор а1сА, используя стандартные методики. Конечная стадия процедуры клонирования была связана с клонированием фрагмента alcA-GUS-35St в состав pSRN-ACN/Bin19 на место фрагмента alcA-CAT-NOS. Полученный в результате вектор Bin19 должен был включать все компоненты регулона "alc" притом, что геном-репортером в нем оказывался ген GUS. Фрагмент alcA-CAT-NOS вырезали из вектора pSRN-CN/Bin19 с помощью рестриктазы HindIII. Оставшийся фрагмент длиной 16100 пар нуклеотидов, являющийся вектором Binl9, еще сохраняющим участок 35S-alR-NOS, экстрагировали из геля методом электроэлюции. Фрагмент alcA-GUS-35St затем вырезали методом двойного расщепления рестриктазами HindIII/XmnI из плазмиды pAGS/pUC. Рестриктаза XmnI отрезает примерно 850 пар нуклеотидов из плазмиды pUC19, обеспечивая отделение и возможность удаления фрагмента alcA-GUS-35St. Затем фрагмент alcA-GUS-35St клонировали по свободному HindIII-сайту в плазмиду pSRN/Bin19. Этот фрагмент был ориентирован с помощью рестриктазного картирования и затем подвергнут секвенитрованию для подтверждения того, что он содержит искомые последовательности. Карта плазмиды AlcR/AGUS показана на фиг.7.
3.2. Трансформация полученной конструкцией
Прямая трансформация бактерий Agrobacterium tumefaciens штамма C58Cl:pGV2260 была осуществлена в соответствии с описанным ранее (Hofgen & Willmitzer, 1988, цит. выше). Трансформация картофеля (сорта Solara) с использованием метода опосредованного Agrobacterium переноса генов была проведена согласно (Rocha-Sosa et al., 1989, цит. выше).
Вслед за опосредованным Agrobacterium переносом генов были отобраны 100 независимых трасформированных растений. Для тестирования индуцируемости активности гена-репортера GUS побеги трансгенных растений были дуплицированы в тканевой культуре. После образования корешков одна группа растений была перенесена в теплицу. Через две недели после высадки в закрытый грунт проводили тестирование индуцируемости этанолом путем добавления 50 мл 5%-ного раствора этилового спирта к корневой системе растений картофеля. Затем активность GUS визуализировали с использованием гистохимического протокола. После индукции этанолом активность GUS визуально проявлялась во всех тестированных тканях (опавшие и нормальные листья, стебли, корни и столоны). Как показано на фиг.8, активность GUS оказалась высокоиндуцибельной в развивающихся и сформированных клубнях. Не было выявлено активности GUS в любых органах растений, не подвергавшихся индуцирующему воздействию.
С целью изучения чувствительности Alc-переключающей системы к парам этанола была использована экспериментальная система, в которой трансгенные растения табака Alc-CAT (ген-репортер, кодирующий хлорамфениколацетилтрансферазу) (CAMV35S-AlcR-NOS, AlcA-CAT; Caddick et al., 1988) закрывали в герметичных сосудах, содержащих источник этанола, обеспечивающий определенную концентрацию спиртовых паров. Образцы соцветий и листьев были взяты спустя 24 часа. Абсолютное содержание этанола в соцветиях определяли путем соотнесения пиковой этанольной зоны, наблюдаемой после инъекции газовым шприцем в устройство для газовой хроматографии, снабженное масс-спектральным детектором, к параметру стандартного раствора этанола. Общие уровни экспрессии CAT в листьях были определены с помощью ТИФА в отношении CAT. Экспрессия CAT у растений табака, закрытых с растворами этанола 5; 1; 0,1 и 0,05%, была относительно стабильной, однако резко снижалась при концентрациях этанола 0,01; 0,005 и 0,001% (см. фиг.28). Путем соотнесения уровня активности CAT и концентрации паров этанола в закрытом контейнере пороговая концентрация паров этанола для переключения в системе Alc-активации была определена на уровне между 72 и 21 нг/мл воздуха.
Для дальнейшего изучения индуцибельности GUS в запасаемых клубнях картофеля для анализа были отобраны четыре GUS-позитивные трансгенные линии. После мультипликации тканевых культур по пять растений каждого генотипа были перенесены в закрытый грунт для получения клубней. После сборки клубней их помещали в закрытые стеклянные емкости, содержащие 3ММ-бумагу, пропитанную 5%-ным этанолом.
Для подтверждения того, что индукция этанолом будет эффективной в отношении целого клубня, срезы клубней были взяты в разное время этанольной индукции, а активность GUS визуализировали с применением гистохимического протокола. Как показано на фиг.9, равномерная индукция активности GUS была отмечена у целых картофельных клубней.
Использование паров этанола для целей активации Alc-переключения было исследовано на материале трансформированных клубней Alc-GUS (CAMV35S-Alc-R-NOS, AlcA-GUS-NOS). Кинетика накопления транскриптов гена GUS была изучена с применением метода Нозерн-блоттинга. Картофелины закрывали в сосуде с источником этанола на 3, 6, 9, 12, 24 и 48 часов и на 1 неделю, затем источник этанола удаляли и образцы также брали через 2, 3 и 4 недели. Накопление транскриптов GUS может быть изменено путем варьирования концентрации этанола, используемой для индукции и закупоренной системе. При использовании 8 мл абсолютного спирта в 40-литровом контейнере низкие уровни экспрессии GUS могут быть впервые выявлены на 6-м часу во внешнем 1-3-мм слое картофелины, а на 12-м часу - в 3 мм от поверхности клубня и глубже (см. фиг.29). Максимальные уровни содержания транскрипта были обнаружены на 24-м часу, а затем присутствие транскрипта сохранялось на протяжении 4 недель. Напротив, использование 5%-ного раствора этанола для создания низкой концентрации его паров приводило в выявлению транскриптов только спустя 1 неделю. При поддержании постоянного источника этанола транскрипты GUS выявлялись на высоким уровне на протяжении всего эксперимента (см. фиг.30).
Продолжение этого эксперимента с парами этанола было предпринято с целью оценки работы Alc-переключателя в плодах помидора. С использованием 5%-ного раствора этанола в закрытых 2,6-литровых контейнерах, в которые помещали плоды трансгенного помидора Alc-GUS (CAMV35S-Alc-R-NOS, AlcA-GUS-NOS), существенное маркирование активности GUS было отмечено в стенках перикарпа, происходящих от исследованного плода, через 4 недели после обработки этанолом. Плоды помидора нарезали, быстро промывали в 50 мМ фосфатного буфера (рН 7,0) и инкубировали в окрашивающем буфере (50 мМ фосфатного буфера - рН 7,0; 50 мкМ феррицианида калия, 50 мкМ ферроцианида калия, 2% Тритон Х-100, 20% метанола и 1 мкМ 5-бром-4-хлор-3-индол-(3-0-глюкуронида), если это необходимо. Окрашивание останавливали проведением промывок 100%-ным и 70%-ным этанолом, а срезы плодов сохраняли в 70%-ном этаноле при 4°С.
3.3. Флуорометрическое выявление активности GUS
Флуорометрическое определение активности GUS было осуществлено следующим образом. Срезы клубней, собранные спустя определенное время после этанольной индукции, замораживали на жидком азоте. Затем ткань клубня гомогенизировали в 50 мМ NaHPO4 (pH 7,0), 10 мМ меркаптоэтанола, 10 мМ EDTA, 0,1% лаурилсаркозина натрия, 0,1% Тритона Х=100. Гомогенат центрифугировали в течение 10 минут при 13000 об/мин при 4°С, прозрачный надосадочный слой отбирали и использовали его для определения содержания белка и активности GUS. Для флуорометрического анализа 20 мкл экстракта (разведенного до нужной концентрации) добавляли к 480 мкл "GUS-NTCN-буфера (2 мМ MUS в экстракционном буфере) и инкубировали в течение 30 минут при 37°С. Затем 50 мкл реакционной смеси переносили в 1950 мкл стоп-раствора. Флуорометрический сигнал каждого образца определяли с помощью минифлуорометра модели ТКО-100 (возбуждение при 365 нм, эмиссия при 455 нм). Активность фермента подсчитывали по начальному наклону кривой, полученной путем сопоставления уровня флуоресценции и времени. В качестве контроля использовали инактивированный нагреванием экстракт. Величины активности соотносили с концентрациями белка для каждого экстракта.
3.4. Гистохимическое выявление активности GUS
Для гистохимического выявления активности GUS образцы ткани инкубировали в буфере Х-gluc (25 мМ натрий-фосфатного буфера - рН 7,2; 25 мМ фосфата калия - рН 7,2; 0,1% Тритон Х-100, 1 мМ X-gluc). Быстрая вакуумная пропитка (в течение 30 секунд) была применена для обеспечения проникновения субстрата в растительную ткань. Затем материал инкубировали при 37°С в течение 24 часов и промывали водой с последующим фотографированием. Фотосинтезирующие ткани обесцвечивали этанолом. Микроскопия была осуществлена с использованием микроскопа Wild M420, оснащенного фотонасадкой Wild MPS46.
III. Индуцируемая сафанером экспрессия генов у растений картофеля
4.1. Конструкция плазмиды GST:GUS
Для конструирования плазмидных векторов были применены стандартные технологии рекомбинантной ДНК. Репортерная генная конструкция, включающая 5'-фланкирующий EcoRI/NdeI-участок GST-27 длиной 3800 пар нуклеотидов из состава плазмиды pG1E7, была "затуплена по концам" и лигирована по SmaI-сайту в Ti-плазмидный вектор pBI101 Agrobacterium. NdeI-сайт, расположенный предположительно в области старт-кодона гена GST-27, был разрушен в процессе "затупления концов". В результате образуется стандартный сайт химеризации с геном UidA E.coli, кодирующим β-глюкуронидазу (GUS), в составе плазмиды pBI101. Структура полученной в результате репортерной генной конструкции pGSTTAK была проверена с помощью рестрикционного анализа и прямого секвенирования. Карта плазмиды pGSTTAK показана на фиг.10.
4.2. Трансформация полученной конструкцией и тестирование индуцибельности
С использованием плазмиды pGST::GUS прямая транформация бактерий Agrobacterium tumefaciens C58C1:pGv2260 была осуществлена в соответствии с описанным ранее (Hofgen & Willmitzer, 1988, цит. выше). Трансформация картофеля (Solara) с использованием метода опосредованного Agrobacterium переноса генов была проведена согласно (Rocha-Sosa et al., 1989, цит. выше).
После опосредованного Agrobacterium переноса генов были отобраны 100 резистентных к канамицину регенерированных побега. Индуцируемость сафенером была исследована путем переноса срезов стебля трансформированных растений картофеля GST::GUS на среду MS, содержащую 0; 0,04%; 0,2 и 1% R25788 (конечная концентрация). После культивирования в течение 14 дней полностью развившиеся листья отбирали и проводили определение активности GUS. Как показано на фиг.11, индукция сафенера приводила к увеличению активности GUS в 3-20 раз.
IV. Индуцирумое подавление экспрессии генов-мишеней
5. Индуцирумая ко-супрессия
5.1. Конструирование химерного гена для FNR-индуцируемой ко-супрессии
Для индуцируемой этанолом ко-супрессии НАД-ферред-оксиноксидоредуктазы (FNR) приблизительно 450-нуклеотидный 3'-фрагмент (SEQ 1) кДНК FNR табака был соединен с промотором а1сА в смысловой ориентации с получением в результате плазмиды SQ03. Стратегия клонирования показана на фиг.12.
Прямая трансформация бактерий Agrobacterium tumefaciens штамма С58С1:pGV2260 была осуществлена в соответствии с описанным ранее (Hofgen & Willmitzer, 1988, цит. выше). Трансформация табака (сорта Samsun) с использованием метода опосредованного Agrobacterium переноса генов была проведена согласно (Rosahl et al., 1987, EMBO J., 6, 23-29).
После опосредованного Agrobacterium переноса генов были отобраны 100 независимых трансформированных растений.
SEQ 1: общее число нуклеотидов – 423

V. Индуцибельная антисмысловая репрессия гетерологичных генов
Как было описано в разделе I, экспрессия цитоплазматической инвертазы и неорганической пирофосфатазы может приводить к возникновению фенотипа "без побегов" тогда, когда для контроля экспрессии соответствующего гена применяется подходящий промотор. Для достижения индуцибельной реверсии "безпобегового" фенотипа была применена стратегия индуцибельной антисмысловой репрессии гетерологичного гена.
6. Индуцибельная антисмысловая репрессия экспрессии пирофосфатазы
6.1. Конструирование плазмиды SQ01
Как показано на фиг.5, высокая интенсивность экспрессии неорганической пирофосфатазы E.coli приводит к фенотипу "без побегов", проявляющемуся у собранных клубней картофеля. Для химического контроля экспрессии неорганической пирофосфатазы E.coli была сконструирована плазмида SQ01. Эта плазмида включает три химерных гена: (а) ген alcR, помещенный под контроль промотора 353-CaMV; (b) ген РРА, помещенный под контроль усиленного промотора 353-CaMV, и (с) РРА в антисмысловой ориентации, помещенный под контроль промотора alcA. Конструкция плазмиды SQ01 показана на фиг.13.
6.2. Трансформация растений
Прямая трансформация бактерий Agrobacterium tumefaciens штамма С58С1:pGV2260 была осуществлена в соответствии с описанным ранее (Hofgen & Willmizer, 1988, цит. выше). Трансформация картофеля (сорта Solana) и табака (сорта Samsun) с использованием метода опосредованного Agrobacterium переноса генов была проведена согласно (Rocha-Sosa, 1989, цит. выше) и (Rosahl et al., 1987, цит. выше).
После опосредованного Agrobacterium переноса генов были отобраны 100 независимых трансформированных растений.
6.3. Иммунологическое выявление РРА
Успешная трансформация была протестирована путем иммунологического выявления пирофосфатазы E.coli в экстрактах листьев, взятых от растений, регенерированных из тканевых культур. На основе исходного скрининга могли быть идентифицированы 15 независимых трансгенных растений. После дуплицирования тканевых культур экспрессировавшие пирофосфаты трансгенные растения картофеля переносили в теплицу для образования клубней.
7. Индуцибельная антисмысловая репрессия экспрессии инвертазы
7.1. Конструирование плазмиды SQ02
Как показано на фиг.3, специфичная для флоэмы экспрессия цитоплазматической дрожжевой инвертазы приводит к фенотипу "без побегов", проявляющемуся у собранных клубней картофеля. Для химического контроля экспрессии дрожжевой инвертазы была сформирована плазмида SQ02. Эта плазмида включает три химерных гена: (а) ген alcR, помещенный под контроль промотора 35S-CaMV; (b) укороченный ген Suc2, кодирующий зрелую инвертазу, помещенный под контроль усиленного промотора rо1С, и (с) ген Suc2 в антисмысловой ориентации, помещенный под контроль промотора alcA. Конструкция плазмиды SQ02 показана на фиг.14.
7.2. Трансформация растений
Прямая трансформация растений Agrobacterium tumefaciens штамма С58С1:pGV2260 была осуществлена в соответствии с описанным ранее (Hofgen & Willmizer, 1988, цит. выше). Трансформация картофеля (сорта Solana) и табака (сорта Samsun) с использованием метода опосредованного Agrobacterium переноса генов была проведена согласно (Rocha-Sosa, 1989, цит. выше) и (Rosahl et al., 1987, цит. выше).
После опосредованного Agrobacterium переноса генов были отобраны 100 независимых трансформированных растений.
7.3. Активность инвертазы
Успешная трансформация была протестирована на активность инвертазы с применением электрофореза в SDS-ПААГ в соответствии с описанным ранее (von Schaewen et al., 1990, Embo J., 9, 3033-3044). В этом случае белковые экстракты были приготовлены из срединных жилок листьев растений, регенерированных из тканевых культур. После разделения белковых экстрактов методом электрофореза в 12,5%-ном SDS-ПААГ гель промывали 100 мМ натрий-ацетатного буфера (рН 5,0) в течение 30 минут. После этого гель инкубировали в 100 мМ натрий-ацетатного буфера, содержащего 100 мМ сахарозы при 37°С в течение 1 часа. После короткой промывки дистиллированной водой активность инвертазы визуализировали путем выявления высвобожденных восстановленных углеводов (глюкозы и фруктозы). Гексозы выявляли путем кипячения геля в 0,1%-ном 2,3,5-трифенилтетразолиумхлориде в 0,5 Н NaOH в течение 2-5 минут. Активность инвертазы становилась видимой благодаря образованию интенсивного красного окрашивания. Основываясь на исходном скрининге, удалось идентифицировать 18 независимых трансгенных растений. После дуплицирования тканевых культур экспрессировавшие инвертазу трансгенные растения картофеля переносили в теплицу для образования клубней.
VI. Использование "системы оператор/репрессор" для подавления гетерологичных генов
8. Использование системы оператор/репрессор Lac, включающей промотор rо1С, ген инвертазы дрожжей и Alc-переключатель
8.1. Клонирование гена lacI в Alc-переключающий бифункциональный вектор
Как можно видеть из фиг.22, сегмент lacI-NOS был вырезан из плазмиды 35S-LacI-NOS рестриктазами BamHI/HindIII и клонирован в вектор pMSC2, обработанный рестриктазами BamHI/HindIII. Этот вектор имеет PstI-сайт, расположенный в нескольких нуклеотидах в 5'-сторону от BamHI-сайта: поэтому обработка рестриктазой PstI приводит к удалению кодирующего сегмента lacI. Полученный фрагмент был затем клонирован в вектор pACN, обработанный рестриктазой PstI (AlcA-CAT-NOS) с замещением гена А1сА на ген lacI с получением в результате вектора pALN (AlcA-lacI-NOS). Участок ALN был удален из этой конструкции путем обработки рестриктазой HindIII и клонирован в бифункциональный вектор SRNACN, обработанный рестриктазой HindIII (35S-AlcR-NOS-AlcA-CAT-NOS) с замещением сегмента ACN кассетой ALN.
8.2. Клонирование оператора lacI в систему "rо1С-инвертаза"
Были синтезированы два олигонуклеотида, включающие сайты рестрикции BamHI и Asp718 - SC24 (TTGGTACCAATTGTGAGCGCTC-ACAATTGGATCCTT) и SC25 (AAGGATCCAATTGTGAGTGCTCACAATTGGTACCАА). По 10 мкл каждого олигонуклеотида отжигали путем кипячения в водяной бане в присутствии 20 мМ Трис-НСl (рН 8,4), 50 мМ КС1 и 1,5 мМ MgCl2 в течение 5 минут перед охлаждением до 30°С в течение примерно 1 часа с последующим помещением на лед на 5 минут. Прошедшие отжиг олигонуклеотиды обрабатывали рестриктазами BamHI и Asp718, а затем эти рестриктазы инактивировали путем фенольной экстракции и осаждения этанолом. Полученные фрагменты лигировали в pUCl9, обработанную рестриктазами BamHI и Asp718, с получением плазмиды pUC-1асO. Состав плазмиды подтверждали путем прямого секвенирования. Терминатор JCS удаляли из плазмиды BINAR и клонировали по сайтам рестрикции SalI и HindIII в плазмиду pUC-lacO с получением плазмиды pUC-lacO-OCS. Промотор Rolc был внесен с использованием рестриктаз EcoRI и Asp718 (KpnI) с получением плазмиды pUC-RolC-lacO-OSN. Ген инвертазы дрожжей был внесен по BamHI-сайту плазмиды pUC-RolC-lacO-OSN с получением плазмиды pUC-RolC-lacO-INV-OSN. Стратегия клонирования этой плазмиды изображена на фиг.21.
8.3. Лигирование двух указанных выше компонентов с получением окончательного бифункционального вектора
Кассета Rolc-op-INV-OCS является HindIII-фрагментом (использующим промотор RolC длиной 865 пар нуклеотидов): она была лигирована в бифункциональный вектор SRNAlacI, обработанный рестриктазой HindIII, путем 3-стадийного лигирования с получением окончательной конструкции 353-AlcR-NOC-AlcA-lacI-NOS-RolC-op-INV-OCS.
VII. Дополнительные мишени
Основываясь на известных биохимических стадиях процесса образования побегов у клубней (прорастания картофеля), заявители идентифицировали ряд дополнительных мишеней, которые могут быть использованы для создания трансгенных картофельных клубней с фенотипом "не образующихся побегов". Помимо прочего, перспективными являются дыхательные ферменты или мембранные белки, вовлеченные в митохондриальный транспорт метаболитов. Одним из таких перспективных "кандидатов" является переносчик АТФ/АДФ и второй переносчик малатоксалоглутарата.
9. Гены, вовлеченные в функции митохондрий
9.1. Клонирование АТФ/АДФ (ANT) и конструирование химерного антисмыслового гена
Основываясь на опубликованной аминокислотной последовательности переносчика АТФ/АДФ картофеля (Emmermann et al., 1991, Curr. Genet., 20, 405-410), были сформированы олигонуклеотиды, необходимые для ПЦР-амплификации внутреннего ANT-фрагмента (см. фиг.15). Следующие затравки для ПЦР были использованы - затравка 5'-ANT (5'AACGGATCCATGGCAGATATGAACCAGC-3'), затравка 3'-ANT (5'-TTGGATCCTTACAACACACCCGCCCAGGC-3'). Для целей оптимизации последующего клонирования ANT-фрагмента в растительный экспрессирующий вектор в состав обеих ПЦР-затравок были включены BamHI-сайты. В качестве матрицы была использована мРНК, выделенная из растущих клубней картофеля. Выделение РНК было осуществлено по методу Логманна с соавт. (Logemann et al., 1987, Anal. Biochem., 163, 16-20). Одноцепочечная кДНК была синтезирована с использованием обратной транскриптазы M-MLV Superscript в соответствии с инструкциями производителя (Gibco BRL). Динамика температур при ПЦР (40 циклов) была следующей: 1 минута при 95°С, 1 минута при 45°С и 2 минуты при 72°С. Амплифицированную ДНК клонировали в состав ПЦР-вектора pCR1000TM (Invitrogen, Norwalk, CT). Чтобы исключить мутации в амплифицируемой ДНК в ходе циклов ПЦР, клоны были отсеквенированы с применением метода Сэйнджера. ANT-фрагмент длиной 1120 пар нуклеотидов был затем клонирован в растительную экспрессионную кассету pBINAR (Hufgen & Willmitzer, 1990, Plant Sci., 66, 221-230) в антисмысловой ориентации (фиг.15).
9.2. Клонирование митохондриального переносчика оксалоглутаратов (МОТ)
Фрагмент кДНК, кодирующий МОТ, был выделен с использованием методов, описанных в разделе 9.1. Данные метода Нозерн-блоттинга, приведенные на фиг.17, показывают, что наивысший уровень экспрессии мРНК-МОТ имеется тогда, когда РНК экстрагируется сразу после прорастания клубня. Этот сегмент соответствует высокому уровню метаболической активности. Антисмысловая конструкция для негативной регуляции была сформирована путем амплифицирования фрагмента МОТ, проведенного в целом так же, как это было описано в разделе 8.1 для фрагмента ANT, но с использованием затравок, показанных на фиг.18. BamHI/SalI-ПЦР-фрагмент был клонирован в состав вектора pBluescript-SK, обработанный рестриктазами BamHI/SalI. Для исключения мутаций в амплифицируемой ДНК в ходе циклов ПЦР проводили секвенирование клона с применением метода Сэйнджера. Asp718/BamHI-фрагмент был вырезан из вектора pBluescript и клонирован в вектор pBinAR, обработанный рестриктазами BamHI/Asp718. В результате была получена растительная трансформационная кассета, включающая промотор 35S-CaMV, направляющий ген МОТ, характеризующийся антисмысловой ориентацией.
9.3. Трансформация
Прямая трансформация бактерий Agrobacterium tumefaciens штамма C58C1:GV2260 была осуществлена в соответствии с описанным ранее (Hofgen & Willmitzer, 1988, цит. выше). Трансформация картофеля с использованием метода опосредованного Agrobacterium переноса генов была проведена согласно (Rocha-Sosa et al., 1989, цит. выше).
После опосредованной Agrobacterium переноса генов были отобраны 70 независимых трансформированных растений.
10. Гены, индуцируемые в ходе хранения клубней картофеля
10.1. Выделение генов, индуцируемых в ходе хранения клубней картофеля
10.1.1. Дифференциальное представление
Для выявления молекулярных преобразований, сопровождающих переход от стадии растущего клубня к стадии прорастающего клубня, был применен метод "дифференциального представления". В этом случае тотальная РНК была выделена из растущих и хранящихся картофельных клубней (сорта Desiree). После обработки ДНКазой-I 5 мкг тотальной РНК были подвергнуты обратной транскрипции с использованием обратной транскриптазы M-MLV Superscript (Gibco BRL) с получением одноцепочечных кДНК-матриц. После этого ПЦР-амплификация полученных кДНК-матриц была осуществлена в присутствии α-35S-дАТФ с использованием олигодезокситимидиновой затравки д(Т)11-ХN и 100 различных RAPD-затравок (случайно подбираемых олигонуклеотидов). Использование следующих RAPD-затравок позволило выделить фрагменты кДНК, специфичных для растущих клубней: 5'-AAGCGACCTG-3', 5'-GTTGGTGGCT-3', 5'-ACGGGACCTG-3'.
Динамика температур в ПЦР (40 циклов) была следующей: 30 секунд при 94°С, 1 минута при 42°С и 30 секунд при 72°С. Амплифицированную ДНК денатурировали в течение 5 минут формамидным буфером при 94°С и загружали в полиакриламидный гель (6%-ный акриламид, 0,3% бис-акриламида, 7 М мочевины в буфере ТВЕ). Разделение фрагментов кДНК было осуществлено при напряжении 1,7 кВ, 130 мА в течение 3 часов. После разделения гель высушивали при 80°С и помеченные радиоактивным путем фрагменты кДНК были визуализированы авторадиографически с использованием рентгеновских пленок Kodak X-OMAT. Время экспозиции варьировалось от 2 до 5 дней. Сравнение фрагментов кДНК, амплифицированных на материале растущих и прорастающих клубней, позволило выявить фрагменты кДНК, которые присутствуют исключительно в прорастающих (после хранения) картофелинах. Специфичные для прорастающих клубней картофеля фрагменты кДНК были затем элюированы из геля и повторно амплифицированы с использованием соответствующих ПЦР-затравок. Реамплифицированные фрагменты кДНК были после этого клонированы в состав вектора PGEMT (Promega). Размер амплифицированных фрагментов кДНК варьировался от 200 до 450 пар оснований.
10.1.2. Данные анализа методом Нозерн-блоттинга генов, индуцируемых в ходе хранения клубней
Для проверки того, что выделенные фрагменты кДНК индуцируются в хранящихся картофельных клубнях, была выделена тотальная РНК из растущих клубней и из картофелин, хранившихся перед этим в течение 1, 7, 14, 21, 30, 60, 90, 120, 150 и 180 дней: РНК разгоняли в агарозном геле, содержащем 1,5% формальдегида (15%: объемные проценты), и скринировади зондами для гибридизации на присутствие соответствующих транскриптов после переноса РНК на нейлоновые мембраны. Как показано на фиг.16, транскрипты 4 выделенных клонов (16-3, 10-1, АС4 и 16-8) накапливаются на протяжении хранения клубней картофеля.
10.1.4. Конструирование библиотеки кДНК
Для получения полноразмерных клонов кДНК, кодирующих М-1-1, 16-3, 10-1, АС4 и 16-8, была сконструирована библиотека кДНК, специфичных для хранящихся клубней. В этом отношении пилиаденилирования РНК была выделена из клубней картофеля, хранившегося в течение 5 месяцев при комнатной температуре. Синтез кДНК был проведен с использованием набора соответствующих реактивов фирмы "Pharmacia". После адапторного лигирования (использовали EcoRi/NotI-адапторы) кДНК лигировали в состав векторов лямбда ZAP-II в соответствии с инструкциями производителя (Stratagene). Упаковка in vitro была осуществлена с использованием упаковочного экстракта Gigapack2II (Stratagene).
10.1.5. Выделение клонов кДНК, кодирующих факторы, специфичные для хранящихся клубней.
После амплификации первичной библиотеки кДНК 2×55 pfu (бляшкоформирующих единиц) были проскринированы на присутствие фагов, гибридизующих с ПЦР-фрагментами М-1-1, 16-3, 10-1, АС4 и 16-8. Во всех случаях был выделен ряд независимых фагов, гибридизующих с соответствующими ПЦР-зондами: после этого было проведено in vivo выделенных клонов. В четырех случаях (М-1-1, 16-3, 10-1 и 16-8) могли быть получены полноразмерные клоны кДНК. После определения полных нуклеотидных последовательностей (SEQ 2-6 и фиг.19) были проанализированы их отношения гомологии. Основываясь на уровне гомологичности, клон 16-3 соответствует С-концевой гидролазе убикитина человека, дрозофилы и дрожжей; клон 10-1, как было обнаружено, идентичен фактору-1 АДФ-рибозилирования картофеля (он принадлежит к семейству ГТФ-связывающих белков) и клон 16-8 гомологичен ауксин-репрессирующему белку земляники, функции которого неизвестны. Не было найдено гомологов клону АС4. Дифференциально экспрессирующийся клон М-1-1 кодирует белок, который заявители обозначили как МОТ и который, как было показано, характеризуется гомологичностью с митохондриальным переносчиком 2-окслоглутаратов крупного рогатого скота и человека. Сравнение последовательностей показано на фиг.20.
10.1.6. Нуклеотидные последовательности индуцированных клонов
SEQ 2: 16-3 (имеется гомология с С-концевой гидролазой убикитина человека, дрозофилы и дрожжей)


VIII. Идентификация промоторных сегментов
11. Выделение геномных клонов
11.1. Была скринирована геномная клонотека картофеля Solanum tuberosum сорта Solara на векторах ZAP (Stratagene) (всего были проскринированы 750 тысяч бляшек). Фрагменты кДНК, взятые в методе дифференциального представления, использовали в качестве зондов при скрининге.
11.1.1. UBL (фиг.23)
Три фага были выделены в ходе третьей стадии скрининга: препарирование in vivo показало, что два из них идентичны гену UBL, а третий не содержит лишь 5'-участка гена UBL. Один из двух идентичных фагов был использован для ПЦР-тестирования. Клон был секвенирован с использованием олигонуклеотида GCTTTCCGCCCATGGATTCC, считанного с последовательности промотора. На основе этой последовательности дополнительный олигонуклеотид был расшифрован (добавляющий BamHI-сайт) и использован для осуществления ПЦР с обратной затравкой (Stratagene). Полученный фрагмент клонировали в состав плазмиды PGemT (Promega) и секвенировали. Клонирование в состав pBI101 (Jefferson et al., 1987, EMBO J., 6) было осуществлено в виде BamHI-фрагмента. Трансгенные линии картофеля были сформированы так, чтобы содержать описанную выше конструкцию с геном GUS под контролем промотора UBL. Никакой маркируемой активности GUS не было выявлено в различных тканях, включая стебли и листья. Для собранных в ряде трансгенных линий клубней было обнаружено проявление экспрессии GUS.
11.1.2. МОТ (фиг.24)
Из созданной библиотеки были выделены шесть клонов. Два из них были отсеквенированы с использованием ген-специфичной затравки CCAGGAGATGGGAATGGAGACCG: олигонуклеотиды были расшифрованы с обоих клонов. Фрагменты МОТ3 и МОТ6 были выделены путем комбинирования универсальной затравки (Stratagene) и клонированы в состав pGemT. МОТ3 был клонирован в виде BamHI-фрагмента в состав pBI101, в то время как фрагмент МОТ6 - в виде BamHI/XbaI-фрагмента.
12. Конструирование антисмысловых/смысловых конструкций
12.1. UBL-антисмысловая конструкция
BamHI(внутренний рестрикционный сайт: 301 пара нуклеотидов)/Asp718 (в 3-затравочном конце кДНК в составе вектора pBluescript)-фрагмент был клонирован в вектор pBinAR. Эта плазмида является дериватом плазмиды PBinl9, включающий промотор 35S (Hofgen & Willmitzer, 1990, Plant Sci., 66, 221-230).
12.1.2. МОТ-антисмысловые/смысловые конструкции
Олигонуклеотиды с рестрикционными сайтами 5-затравочных BamHI нуклеотидов 292-315 в составе кДНК и 3-затравочных SalI нуклеотидов 993-969 были использованы для проведения ПЦР. Следующие фрагменты были клонированы в состав pGemT: BamHI/SalI-фрагмент в pBinAR (смысловой) и pBluescript (Stratagene) и ВаmНI/Аsр718-фрагмент из pBluescript в pBinAR (антисмысловой).
12.1.3. 16-8-смысловые/антисмысловые конструкции
Были использованы олигонуклеотиды с рестрикционным сайтом 5-затравочными BamHI нуклеотидами 6-29 и 3-затравочными XbaI (смысловой фрагмент) или Asp718 (антисмысловой) нуклеотидами 682-662 в составе кДНК. Фрагменты были клонированы в состав pGemT, а из этой плазмиды - в вектор pBinAR.
12.1.4. Промоторные последовательности UBL-1, МОТ3 и МОТ6
Последовательности этих промоторов показаны на фиг.25-27.
Другие модификации настоящего изобретения могут быть очевидны для специалистов в данной области техники, притом, что эти модификации не выходят за пределы объема настоящего изобретения.
Реферат
Изобретение относится к генной инженерии растений. Для предотвращения образования побегов у растений и их частей, подлежащих хранению, используют специфичные для мишеней и органов промоторы для экспрессии генов, подавляющих образование побегов. Развитие побегов может быть восстановлено путем переключения экспрессии последовательностей ДНК за счет использования индуцибельных промоторных сегментов, например, индуцируемых внешними химическими стимулами. 12 н. и 24 з.п. ф-лы, 30 ил., 5 табл.
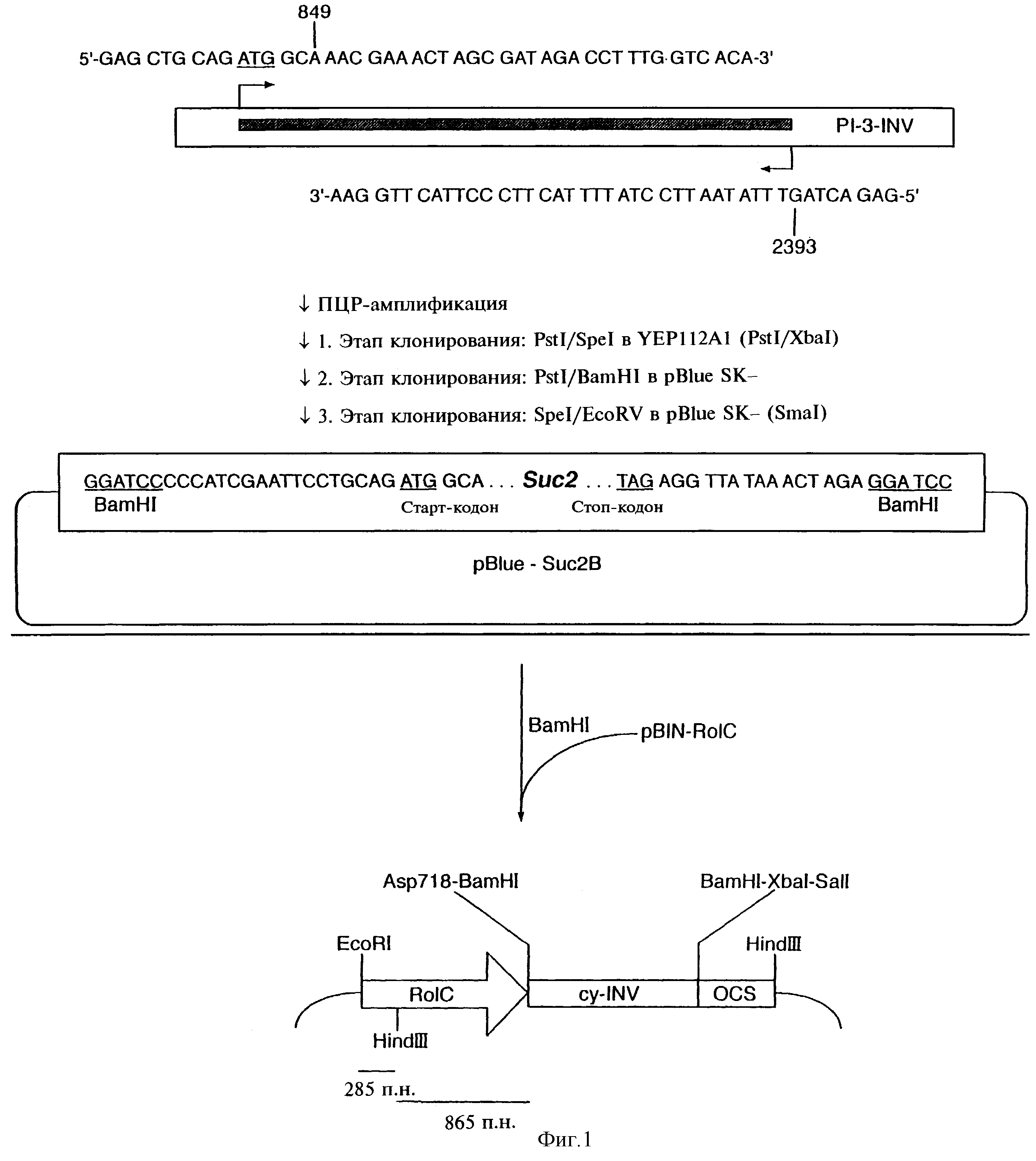

Комментарии