Катионные эмульсии "масло-в-воде" - RU2625546C2
Код документа: RU2625546C2
Чертежи












































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет по предварительной заявке США № 61/361892, поданной 6 июля 2010 года, полное содержание которой включено в настоящее описание путем ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Терапевтические средства на основе нуклеиновых кислот перспективны для лечения заболеваний в диапазоне от наследственных нарушений до приобретенных состояний, таких как рак, инфекционные нарушения (СПИД), заболевания сердца, артрит и нейродегенеративные нарушения (например, болезнь Паркинсона и болезнь Альцгеймера). Функциональные гены можно доставлять не только для восстановления генетического дефекта или индукции экспрессии продуктов экзогенных генов, но также нуклеиновую кислоту можно доставлять для ингибирования экспрессии эндогенного гена для получения терапевтического эффекта. Ингибирование экспрессии гена может быть опосредовано, например, антисмысловыми олигонуклеотидами, двухцепочечными РНК (например, миРНК, мкРНК) или рибозимами.
Ключевым этапом для такой терапии является доставка молекул нуклеиновой кислоты в клетки in vivo. Однако доставка молекул нуклеиновой кислоты in vivo, в частности, молекул РНК, имеет ряд технических затруднений. Во-первых, в результате действия клеточных и сывороточных нуклеаз время полужизни РНК, вводимой in vivo, составляет всего приблизительно 70 секунд (см., например, Kurreck, Eur. J. Bioch. 270: 1628-44 (2003)). Осуществляли попытки повышать стабильность вводимой РНК с помощью химических модификаций; однако существует несколько примеров, когда химические изменения приводят к повышению цитотоксических эффектов или потере или снижению функции. В одном конкретном примере клетки не переносили дозы дуплекса РНКи, в которой каждый второй фосфат заменяли фосфотиоатом (Harborth, et al., Antisense Nucleic Acid Drug Rev. 13(2): 83-105 (2003)). В связи с этим существует необходимость разработки систем доставки, с помощью которых можно доставлять достаточные количества молекул нуклеиновой кислоты (в частности, молекул РНК) in vivo для индукции терапевтического ответа, но они не являются токсичными для хозяина.
Привлекательным подходом вакцинации являются вакцины на основе нуклеиновых кислот. Например, внутримышечная (IM) иммунизация плазмидной ДНК, кодирующей антиген, может вызывать клеточный и гуморальный иммунные ответы и защищать от заражения. ДНК-вакцины представляют определенные преимущества по сравнению с традиционными вакцинами с использованием белковых антигенов или ослабленных патогенов. Например, по сравнению с белковыми вакцинами, ДНК-вакцины могут являться более эффективными в отношении продукции правильно свернутого антигена в его нативной конформации и в стимуляции клеточного иммунного ответа. Кроме того, ДНК-вакцины не имеют некоторых проблем с безопасностью, связанных с убитыми или ослабленными патогенами. Например, препарат убитого вируса может содержать остаточные живые вирусы, и ослабленный вирус может мутировать и возвращаться к патогенному фенотипу.
Другим ограничением вакцин на основе нуклеиновых кислот являются большие дозы нуклеиновых кислот, как правило, необходимые для получения сильных иммунных ответов у не являющихся человеком приматов и людей. Таким образом, системы доставки и адъюванты необходимы для усиления активности вакцин на основе нуклеиновых кислот. Разработаны различные способы встраивания молекул нуклеиновой кислоты в клетки, такие как трансфекция с использованием фосфата кальция, трансфекция с использованием полипрена, слияние протопластов, электропорация, микроинъекция и липофекция.
Катионные липиды общепринято составляют в виде липосом для доставки генов в клетки. Однако даже небольшое количество сыворотки (~10%) может значительно снижать активность трансфекции комплексов липосома/ДНК, т.к. сыворотка содержит анионные материалы. В последнее время разрабатывают катионные липидные эмульсии для доставки молекул ДНК в клетки. См., например, Kim, et al., International Journal of Pharmaceutics, 295, 35-45 (2005).
В патентах США №№ 6753015 и 6855492 описывают способ доставки молекул нуклеиновой кислоты позвоночному с использованием катионных микрочастиц. Микрочастицы содержат полимер, такой как поли(α-гидроксикислота), полигидроксимасляная кислота, поликапролактон, полиортоэфир, полиангидрид и т.п., и образованы с использованием катионных поверхностно-активных веществ. Молекулы нуклеиновой кислоты адсорбируются на поверхностях микрочастиц.
Kim et al. (Pharmaceutical Research, vol. 18, pages 54-60, 2001) и Chung et al. (Journal of Controlled Release, volume 71, pages 339-350, 2001) описывают различные составы эмульсии "масло-в-воде", применяемые для повышения эффективности трансфекции молекул ДНК in vitro и in vivo.
Ott et al. (Journal of Controlled Release, volume 79, pages 1-5, 2002) описывают подход, включающий катионную сверхтонкую эмульсию в качестве системы доставки/адъюванта для ДНК. Подход с использованием сверхтонкой эмульсии основан на MF59, активном сквалене в водном адъюванте, производимом в крупном масштабе и применяемом в коммерческом одобренном продукте (Fluad®). Для облегчения внутриклеточной доставки плазмидной ДНК использовали 1,2-диолеоил-3-триметиламмоний-пропан (DOTAP).
Хотя вакцины на основе ДНК открывают огромные перспективы для профилактики и лечения заболеваний, возникают сильные сомнения относительно их безопасности. Вводимые молекулы ДНК потенциально могут встраиваться в геном хозяина или, в результате их распределения в различных тканях, могут приводить к нежелательной длительной экспрессии антигенов. Кроме того, конкретные ДНК-вирусы также используют в качестве средства для доставки молекул ДНК. Из-за своих инфекционных свойств, такие вирусы достигают очень высокого коэффициента трансфекции. Используемые вирусы генетически модифицированы таким образом, что в трансфицированной клетке не образуются функциональные инфекционные частицы. Однако, несмотря на эти меры предосторожности, невозможно исключить риск неконтролируемой репродукции встраиваемого гена и вирусных генов, например, в результате потенциальных рекомбинационных событий. Это также влечет за собой риск встраивания ДНК в интактный ген в геноме клетки-хозяина, например, посредством рекомбинации, в результате этот ген может мутировать и, таким образом, полностью или частично инактивироваться или может приводить к неправильной передаче информации. Другими словами, синтез продукта гена, жизненно важного для клетки, можно полностью супрессировать, или, альтернативно, экспрессируется модифицированный или неправильный продукт гена. Кроме того, как правило, трудно расширять производство и очистку подходящих для клинического применения вирусных векторов.
Один конкретный риск возникает, если ДНК встраивают в ген, участвующий в регуляции роста клетки. В этом случае клетка-хозяин может дегенерировать и приводить к раку или образованию опухоли. Кроме того, если ДНК, встраиваемая в клетку, подлежит экспрессии, соответствующий ДНК-носительо должен содержать сильный промотор, такой как вирусный промотор CMV. Встраивание таких промоторов в геном подвергаемой обработке клетки может приводить к нежелательным изменениям регуляции экспрессии гена в клетке. Другим риском использования ДНК в качестве средства для стимуляции иммунного ответа (например, в качестве вакцины) является индукция патогенных антител против ДНК у пациента, которому вводили чужеродную ДНК, таким образом, вызывающая нежелательный иммунный ответ.
Молекулы РНК, кодирующие антиген или его производное, также можно использовать в качестве вакцин. РНК-вакцины обладают определенными преимуществами по сравнению с ДНК-вакцинами. Во-первых, РНК не может встраиваться в геном хозяина, таким образом, отсутствует риск развития злокачественных новообразований. Во-вторых, в результате быстрой деградации РНК, экспрессия чужеродного трансгена часто является кратковременной, позволяя избегать неконтролируемой длительной экспрессии антигена. В-третьих, для экспрессии кодируемого антигена молекулам РНК необходима только доставка в цитоплазму, в то время как молекулы ДНК должны проникать через ядерную мембрану.
Тем не менее, по сравнению с вакцинами на основе ДНК, вакцинам на основе РНК уделяют относительно мало внимания. РНК и олигонуклеотиды являются гидрофильными, отрицательно заряженными молекулами, очень восприимчивыми к деградации нуклеазами при введении в качестве терапевтического средства или вакцины. Дополнительно, РНК и олигонуклеотиды не транспортируются активно в клетки. См., например, Vajdy, M., et al., Mucosal adjuvants and delivery systems for protein-, DNA- и RNA-based vaccines, Immunol Cell Biol, 2004. 82(6): p. 617-27.
Ying et al. (Nature Medicine, vol. 5, pages 823-827, 1999) описывают самореплицирующуюся РНК-вакцину, в которой доставляют лишенную оболочки РНК, кодирующую β-галактозидазу, и сообщают об индукции CD8+-клеток.
Montana et al. (Bioconjugate Chem. 2007, 18, pages 302-308) описывают использование катионных твердофазных липидных наночастиц в качестве носителей РНК для переноса гена. Показывали, что твердофазные липидные наночастицы защищали молекулу РНК от деградации, и после микроинъекции комплекса РНК-частица в яйца морского ежа определяли экспрессию репортерного белка (флуоресцеин).
В WO 2010/009277 описывают липидно-пептидные наночастицы (NLPP), содержащие (a) амфипатический пептид, (b) липид и (c) по меньшей мере одну иммуногенную молекулу. В определенных вариантах осуществления NLPP также включают положительно заряженное "средство захвата", такое как катионный липид. Средство захвата используют для заякоривания отрицательно заряженной иммуногенной молекулы (например, молекулы ДНК или молекулы РНК). Для получения NLPP необходимы амфипатические пептиды, используемые для солюбилизации липидного компонента и для образования наночастиц.
Таким образом, существует необходимость предоставления систем доставки молекул нуклеиновой кислоты или других отрицательно заряженных молекул. Системы доставки применимы для вакцин на основе нуклеиновых кислот, в частности, вакцин на основе РНК.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, главным образом, относится к катионным эмульсиям "масло-в-воде", которые можно использовать для доставки в клетки отрицательно заряженных молекул, таких как молекула РНК. Частицы эмульсии содержат масляное ядро и катионный липид. Катионный липид может взаимодействовать с отрицательно заряженной молекулой, таким образом, заякоривая молекулу в частицах эмульсии. Катионные эмульсии, представленные в настоящем описании, в частности, подходят для доставки молекул нуклеиновой кислоты (таких как молекула РНК, кодирующая антиген) в клетки и составления вакцин на основе нуклеиновых кислот.
В одном из аспектов изобретение относится к композиции, содержащей молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро, находящееся в жидкой фазе при 25°C, и (b) катионный липид. Предпочтительно, частица катионной эмульсии "масло-в-воде" не является липидно-пептидной наночастицей (NLPP). Предпочтительно, масляное ядро находится в жидкой фазе при 4°C. Необязательно, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, эмульсию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, эмульсия дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать эмульсию изотонической.
В определенных вариантах осуществления катионная эмульсия "масло-в-воде" дополнительно содержит поверхностно-активное вещество, такое как неионное поверхностно-активное вещество. Примеры неионных поверхностно-активных веществ включают, например, SPAN85 (триолеат сорбитана), Tween 80 (полисорбат 80; моноолеат полиоксиэтиленсорбитана) или их комбинацию. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,01% до приблизительно 2,5% (об./об.) поверхностно-активного вещества. Например, катионная эмульсия "масло-в-воде" может содержать приблизительно 0,08% (об./об.) Tween 80 или, альтернативно, приблизительно 0,5% (об./об.) Tween 80 и приблизительно 0,5% (об./об.) SPAN85. Также можно использовать полиэтиленгликоль (PEG) или PEG-липид, такой как PEG2000PE, PEG5000PE, PEG1000DMG, PEG2000DMG, PEG3000DMG или их комбинация.
Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,005% до приблизительно 1,25% (об./об.) поверхностно-активного вещества. Например, композиция, содержащая комплекс РНК-эмульсия, может содержать приблизительно 0,04% (об./об.) Tween 80 (полисорбата 80; моноолеата полиоксиэтиленсорбитана) или, альтернативно, приблизительно 0,25% (об./об.) Tween 80 и приблизительно 0,25% (об./об.) SPAN85 (триолеата сорбитана).
В определенных вариантах осуществления катионная эмульсия "масло-в-воде" дополнительно содержит фосфолипид. Примеры фосфолипида включают 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин (DOPE), 1,2-дифитаноил-sn-глицеро-3-фосфоэтаноламин (DPyPE) или фосфатидилхолин яйца (PC яйца). Например, катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл (предпочтительн от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл) DOPE или, альтернативно, от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл (предпочтительно от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл) DPyPE или, альтернативно, от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл (предпочтительно от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл) PC яйца.
Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,05 мг/мл до приблизительно 10 мг/мл (предпочтительно от приблизительно 0,05 мг/мл до приблизительно 5 мг/мл) DOPE или, альтернативно, от приблизительно 0,05 мг/мл до приблизительно 10 мг/мл (предпочтительно от приблизительно 0,05 мг/мл до приблизительно 5 мг/мл) DPyPE или, альтернативно, от приблизительно 0,05 мг/мл до приблизительно 10 мг/мл (предпочтительно от приблизительно 0,05 мг/мл до приблизительно 5 мг/мл) PC яйца.
В определенных вариантах осуществления катионная эмульсия "масло-в-воде" дополнительно содержит полимер или поверхностно-активное вещество в водной фазе эмульсии. Примеры полимеров включают полоксамеры, такие как Pluronic® F127 (блок-сополимер этиленоксид/пропиленоксид: H(OCH2CH2)x(OCH3CH(CH3))y(OCH2CH2)zOH). Например, катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,05% до приблизительно 20% (масс./об.) полимера или от приблизительно 0,1% до приблизительно 10% (масс./об.) полимера, например, 0,5% (масс./об.) или 1% (масс./об.) Pluronic® F127. Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,025% до приблизительно 10% (об./об.) полимера или от приблизительно 0,5% до приблизительно 5% (об./об.) полимера, например, 0,25% (масс./об.) или 0,5% (масс./об.) Pluronic® F127.
Эмульсии могут содержать компоненты, которые могут усиливать образование частиц, улучшать образование комплексов между отрицательно заряженными молекулами и катионными частицами, способствовать правильной деформации комплексов/высвобождению отрицательно заряженных молекул (таких как молекула РНК), повышать стабильность отрицательно заряженной молекулы (например, для предотвращения деградации молекулы РНК) или предотвращать агрегацию частиц эмульсии.
В определенных вариантах осуществления масляное ядро может содержать масло, выбранное из следующих: касторовое масло, кокосовое масло, кукурузное масло, хлопковое масло, масло энотеры, рыбий жир, масло жожоба, лярд, льняное масло, оливковое масло, арахисовое масло, сафлоровое масло, сезамовое масло, соевое масло, сквален, подсолнечное масло, масло пшеничных зародышей, минеральное масло или их комбинация. Предпочтительно, масло является соевым маслом, подсолнечным маслом, оливковым маслом, скваленом или их комбинацией. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,2% до приблизительно 20% (об./об.) масла, предпочтительно от приблизительно 0,08% до приблизительно 5% масла, приблизительно 0,08% масла, от приблизительно от 4% до приблизительно 5% масла, приблизительно 4% масла, приблизительно 4,3% масла или приблизительно 5% масла. Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,1% до приблизительно 10% (об./об.) масла, предпочтительно от приблизительно 2% до приблизительно 2,5% (об./об.) масла.
В определенных вариантах осуществления катионный липид выбран из одного из следующих: 1,2-диолеоилокси-3-(триметиламмонио)пропан (DOTAP), 3β-[Ν-(Ν’,Ν’-диметиламиноэтан)карбамоил]холестерол (DC холестерол), диметилдиоктадециламмоний (DDA), 1,2-димиристоил-3-триметиламмоний-пропан (DMTAP), дипальмитоил(C16:0)триметиламмоний-пропан (DPTAP), дистеароилтриметиламмоний-пропан (DSTAP), липиды E0001-E0118 или E0119-E0180, как описано в таблице 6 (стр. 112-139) WO 2011/076807 (включенного в настоящее описание посредством ссылки), или их комбинации. Особенно предпочтительные катионные липиды включают DOTAP, DC холестерол и DDA.
В определенных вариантах осуществления катионный липид выбран из одного из следующих: 1,2-диолеоилокси-3-(триметиламмонио)пропан (DOTAP), 3β-[Ν-(Ν’,Ν’-диметиламиноэтан)карбамоил]холестерол (DC холестерол), диметилдиоктадециламмоний (DDA), 1,2-димиристоил-3-триметиламмоний-пропан (DMTAP), дипальмитоил(C16:0)триметиламмоний-пропан (DPTAP), дистеароилтриметиламмоний-пропан (DSTAP), липиды E0001-E0118 или E0119-E0180, как описано в таблице 6 (стр. 112-139) WO 2011/076807 (включенного в настоящее описание посредством ссылки), N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмоний хлорид (DOTMA), N,N-диолеоил-N,N-диметиламмония хлорид (DODAC), 1,2-диолеоил-sn-глицеро-3-этилфосфохолин (DOEPC), 1,2-диолеоил-3-диметиламмоний-пропан (DODAP), 1,2-дилинолеилокси-3-диметиламинопропан (DLinDMA) или их комбинации. Особенно предпочтительные катионные липиды включают DOTAP, DC холестерол, DDA, DOTMA, DOEPC, DSTAP, DODAC, DODAP и DLinDMA.
В определенных вариантах осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 3 мг/мл, предпочтительно от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTAP.
Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,4 мг/мл до приблизительно 1,5 мг/мл, предпочтительно от приблизительно 0,4 мг/мл до приблизительно 0,8 мг/мл DOTAP. Необязательно, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0 и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В определенных вариантах осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,62 мг/мл до приблизительно 4,92 мг/мл DC холестерола.
Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,31 мг/мл до приблизительно 2,46 мг/мл DC холестерола. Необязательно, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В определенных вариантах осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,73 мг/мл до приблизительно 1,45 мг/мл DDA.
Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,365 мг/мл до приблизительно 0,725 мг/мл DDA. Необязательно, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0; предпочтительно - от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В определенных вариантах осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 3 мг/мл, предпочтительно от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTMA.
Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,4 мг/мл до приблизительно 1,5 мг/мл, предпочтительно от приблизительно 0,4 мг/мл до приблизительно 0,8 мг/мл DOTMA. Необязательно, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0; предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В определенных вариантах осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 3 мг/мл, предпочтительно от приблизительно 0,8 мг/мл до приблизительно 1,8 мг/мл DOEPC.
Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,4 мг/мл до приблизительно 1,5 мг/мл, предпочтительно от приблизительно 0,4 мг/мл до приблизительно 0,9 мг/мл DOEPC. Необязательно, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0; предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В определенных вариантах осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,73 мг/мл до приблизительно 1,45 мг/мл DODAC.
Композиция, содержащая молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", может содержать от приблизительно 0,365 мг/мл до приблизительно 0,725 мг/мл DODAC. Необязательно, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0; предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В одном примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где катионная эмульсия "масло-в-воде" содержит (a) приблизительно 0,5% (об./об.) масла и (b) катионный липид.
В одном примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где композиция содержит (a) приблизительно 0,25% (об./об.) масла и (b) катионный липид.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро, (b) катионный липид и (c) фосфолипид. Предпочтительные фосфолипиды включают, например, DPyPE, DOPE и PC яйца. Предпочтительно, композиция (комплекс отрицательно заряженная молекула-эмульсия) содержит от приблизительно 0,05 мг/мл до приблизительно 10 мг/мл (более предпочтительно от приблизительно 0,05 мг/мл до приблизительно 5 мг/мл) DOPE или, альтернативно, от приблизительно 0,05 мг/мл до приблизительно 10 мг/мл (более предпочтительно от приблизительно 0,05 мг/мл до приблизительно 5 мг/мл) DPyPE или, альтернативно, от приблизительно 0,05 мг/мл до приблизительно 10 мг/мл (более предпочтительно от приблизительно 0,05 мг/мл до приблизительно 5 мг/мл) PC яйца.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро и (b) DOTAP, и где эмульсия "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 3,0 мг/мл DOTAP, предпочтительно от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTAP. В некоторых вариантах осуществления отрицательно заряженная молекула представляет собой РНК, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0 и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро и (b) DOTAP, и где композиция содержит от приблизительно 0,4 мг/мл до приблизительно 1,5 мг/мл DOTAP, например, 0,4 мг/мл, 0,6 мг/мл, 0,7 мг/мл, 0,8 мг/мл и т.д. В некоторых вариантах осуществления отрицательно заряженная молекула представляет собой РНК, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0 предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро и (b) DC холестерол, и где эмульсия "масло-в-воде" содержит от приблизительно 2,46 мг/мл до приблизительно 4,92 мг/мл DC холестерола. В некоторых вариантах осуществления отрицательно заряженная молекула представляет собой РНК, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро и (b) DC холестерол, и где композиция содержит от приблизительно 1,23 мг/мл до приблизительно 2,46 мг/мл DC холестерола, например, 1,23 мг/мл. В некоторых вариантах осуществления отрицательно заряженная молекула представляет собой РНК, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро и (b) DDA, и где эмульсия "масло-в-воде" содержит от приблизительно 0,73 мг/мл до приблизительно 1,45 мг/мл DDA. В некоторых вариантах осуществления отрицательно заряженная молекула представляет собой РНК, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро и (b) DDA, и где композиция содержит от приблизительно 0,365 мг/мл до приблизительно 0,725 мг/мл DDA, например, 0,725 мг/мл. В некоторых вариантах осуществления отрицательно заряженная молекула представляет собой РНК, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро и (b) DOTMA, и где композиция содержит от приблизительно 0,4 мг/мл до приблизительно 1,5 мг/мл, предпочтительно от приблизительно 0,4 мг/мл до приблизительно 0,8 мг/мл DOTMA. В некоторых вариантах осуществления отрицательно заряженная молекула представляет собой РНК, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро и (b) DOEPC, и где композиция содержит от приблизительно 0,4 мг/мл до приблизительно 1,5 мг/мл, предпочтительно от приблизительно 0,4 мг/мл до приблизительно 0,9 мг/мл DOEPC. В некоторых вариантах осуществления отрицательно заряженная молекула представляет собой РНК, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
В другом примере изобретение относится к композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро и (b) DODAC, и где композиция содержит от приблизительно 0,365 мг/мл до приблизительно 0,725 мг/мл DODAC. В некоторых вариантах осуществления отрицательно заряженная молекула представляет собой РНК, средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. Необязательно, композицию буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Необязательно, композиция дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве для того, чтобы сделать композицию изотонической.
Примеры отрицательно заряженных молекул включают отрицательно заряженные антигены, содержащие пептиды, молекулы нуклеиновой кислоты (например, РНК или ДНК), кодирующие один или несколько антигенов, содержащих пептиды, отрицательно заряженные низкомолекулярные соединения и отрицательно заряженные иммунологические адъюванты. Отрицательно заряженные иммунологические адъюванты включают, например, иммуностимулирующие олигонуклеотиды (например, CpG олигонуклеотиды), одноцепочечные РНК, низкомолекулярные иммуностимуляторы (SMIP) и т.д. Отрицательно заряженные низкомолекулярные соединения включают, например, фосфонат, фторфосфонат и т.д.
В определенных вариантах осуществления отрицательно заряженная молекула является молекулой нуклеиновой кислоты, такой как молекула РНК, кодирующей антиген. В определенных вариантах осуществления молекула РНК является самореплицирующейся молекулой РНК, такой как репликон РНК на основе альфавируса.
В другом аспекте изобретение относится к иммуногенной катионной эмульсии "масло-в-воде", содержащей частицы эмульсии, содержащие масляное ядро (предпочтительно находящееся в жидкой фазе при 25°C) и катионный липид, и молекулу нуклеиновой кислоты в комплексе с частицами эмульсии, и где средний диаметр частиц эмульсии составляет от приблизительно 80 нм до приблизительно 180 нм, и N/P эмульсии составляет по меньшей мере 4:1. В определенных вариантах осуществления молекула нуклеиновой кислоты представляет собой РНК, такую как самореплицирующаяся РНК. Предпочтительно, иммуногенную катионную эмульсию "масло-в-воде" буферизуют (например, с использованием цитратного буфера, сукцинатного буфера, ацетатного буфера и т.д.), и она имеет pH от приблизительно 6,0 до приблизительно 8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8, и содержит не более чем 30 мМ неорганическую соль (например, NaCl). Предпочтительно, иммуногенная катионная эмульсия "масло-в-воде" дополнительно содержит неионное модифицирующее тоничность средство, такое как сахар, сахарный спирт или их комбинация, в достаточном количестве, чтобы сделать эмульсию изотонической.
В другом аспекте изобретение относится к способу получения композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", включающему: (A) получение катионной эмульсии "масло-в-воде", где эмульсия содержит: (1) от приблизительно 0,2% до приблизительно 20% (об./об.) масла, (2) от приблизительно 0,01% до приблизительно 2,5% (об./об.) поверхностно-активного вещества и (3) катионный липид, выбранный из группы, состоящей из: (i) от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTAP, (ii) от приблизительно 2,46 мг/мл до приблизительно 4,92 мг/мл DC холестерола и (iii) от приблизительно 0,73 мг/мл до приблизительно 1,45 мг/мл DDA; и (B) добавление отрицательно заряженной молекулы в катионную эмульсию "масло-в-воде" таким образом, что отрицательно заряженная молекула образует комплекс с частицей эмульсии.
В другом аспекте изобретение относится к способу получения композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", включающему: (A) получение катионной эмульсии "масло-в-воде", где эмульсия содержит: (1) от приблизительно 0,2% до приблизительно 20% (об./об.) масла, (2) от приблизительно 0,01% до приблизительно 2,5% (об./об.) поверхностно-активного вещества и (3) катионный липид, выбранный из группы, состоящей из: (i) от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTAP, (ii) от приблизительно 2,46 мг/мл до приблизительно 4,92 мг/мл DC холестерола, (iii) от приблизительно 0,73 мг/мл до приблизительно 1,45 мг/мл DDA, (iv) от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTMA, (v) от приблизительно 0,8 мг/мл до приблизительно 1,8 мг/мл DOEPC и (vi) от приблизительно 0,73 мг/мл до приблизительно 1,45 мг/мл DODAC; и (B) добавление отрицательно заряженной молекулы в катионную эмульсию "масло-в-воде" таким образом, что отрицательно заряженная молекула образует комплекс с частицей эмульсии.
В определенных вариантах осуществления катионную эмульсию "масло-в-воде" получают способом, включающим: (1) объединение масла и катионного липида для образования масляной фазы эмульсии; (2) получение водной фазы (т.е. дисперсионной фазы) эмульсии; и (3) диспергирование масляной фазы в водной фазе посредством гомогенизации. Катионный липид можно растворять непосредственно в масле. Альтернативно, катионный липид можно растворять в любом подходящем растворителе, таком как хлороформ (CHCl3) или дихлорметан (DCM). Также можно использовать изопропиловый спирт. Растворитель можно выпаривать до добавления масляной фазы в водную фазу или после добавления масляной фазы в водную фазу, но до гомогенизации. Альтернативно, в случаях, когда растворимость липида может представлять собой проблему, первичную эмульсию можно получать с использованием растворителя (например, DCM) все еще в масляной фазе. В этом случае растворителю можно позволять выпариваться непосредственно из эмульсии перед вторичной гомогенизацией.
Можно включать дополнительные необязательные этапы для усиления образования частиц, для улучшения образования комплексов между отрицательно заряженными молекулами и катионными частицами, для повышения стабильности отрицательно заряженной молекулы (например, для предотвращения деградации молекулы РНК), для облегчения правильной деформации комплексов/высвобождения отрицательно заряженных молекул (таких как молекула РНК) или для предотвращения агрегации частиц эмульсии. Например, в водную фазу эмульсии можно добавлять полимер (например, Pluronic® F127) или поверхностно-активное вещество. В одном примере варианта осуществления перед образованием комплексов с частицами эмульсии к молекуле РНК добавляют Pluronic® F127. Добавление Pluronic® F127 может повышать стабильность молекулы РНК и дополнительно снижать деградацию РНК. Полоксамерные полимеры также могут усиливать высвобождение молекул РНК и предотвращать агрегацию частиц эмульсии. В конечном итоге, полоксамерные полимеры также оказывают иммуномодуляторный эффект. См., например, Westerink et al., Vaccine. 2001 Dec 12; 20(5-6): 711-23.
Предпочтительно, молекула РНК из комплекса РНК-катионная частица более устойчива к деградации РНКазами по сравнению с несвязанной молекулой РНК.
В другом аспекте изобретение относится к фармацевтической композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", представленной в настоящем описании, и может дополнительно содержать один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. В предпочтительных вариантах осуществления фармацевтическая композиция является вакциной.
В другом аспекте изобретение относится к способу вызывания иммунного ответа у индивидуума, включающему введение нуждающемуся индивидууму композиции, представленной в настоящем описании.
Изобретение также относится к представленной в настоящем описании фармацевтической композиции для применения в терапии и к применению представленной в настоящем описании фармацевтической композиции для производства лекарственного средства для усиления или вызывания иммунного ответа.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показана стабильность РНК из тимуса мыши в присутствии РНКазы после образования комплекса молекулы РНК с частицами катионной наноэмульсии (CNE). Все образцы инкубировали с РНКазой в течение 30 минут. РНКазу инактивировали протеиназой K. Образцы, составленные с CNE, подвергали распаду комплексов и анализировали на целостность РНК с помощью денатурирующего электрофореза в геле. Немеченая дорожка содержит маркеры молекулярной массы. Дорожки 1 и 2: РНК из тимуса мыши до (1) и после (2) расщепления РНКазой; дорожки 3 и 4: РНК из тимуса мыши в комплексе с CNE01 при соотношении N/P 10:1 до (3) и после (4) расщепления РНКазой; дорожки 5 и 6: РНК из тимуса мыши в комплексе с CNE01 при соотношении N/P 4:1 до (5) и после (6) расщепления РНКазой; дорожки 7 и 8: РНК из тимуса мыши в комплексе с CNE17 при соотношении N/P 10:1 до (7) и после (8) расщепления РНКазой; дорожка 9: РНК из тимуса мыши в комплексе с CNE17 при соотношении N/P 4:1 до (9) расщепления РНКазой.
На фигуре 2 показана стабильность РНК из тимуса мыши в присутствии РНКазы после образования комплекса молекулы РНК с частицами CNE. Все образцы инкубировали с РНКазой в течение 30 минут. РНКазу инактивировали протеиназой K. Образцы, составленные с CNE, подвергали распаду комплексов и анализировали на целостность РНК с помощью денатурирующего электрофореза в геле. Немеченая дорожка содержит маркеры молекулярной массы. Дорожка 10: РНК из тимуса мыши в комплексе с CNE17 при соотношении N/P 4:1 после (10) расщепления РНКазой; дорожки 11 и 12: РНК из тимуса мыши до (11) и после (12) расщепления РНКазой; дорожки 13 и 14: РНК из тимуса мыши в комплексе с CNE12 при соотношении N/P 10:1 до (13) и после (14) расщепления РНКазой; дорожки 15 и 16: РНК из тимуса мыши в комплексе с CNE12 при соотношении N/P 4:1 до (15) и после (16) расщепления РНКазой; дорожки 17 и 18: РНК из тимуса мыши в комплексе с CNE13 при соотношении N/P 10:1 до (17) и после (18) расщепления РНКазой; дорожки 19 и 20: РНК из тимуса мыши в комплексе с CNE13 при соотношении N/P 4:1 до (19) и после (20) расщепления РНКазой.
На фигуре 3 показана стабильность РНК из тимуса мыши в присутствии РНКазы после образования комплекса молекулы РНК с частицами CNE. Все образцы инкубировали с РНКазой в течение 30 минут. РНКазу инактивировали протеиназой K. Образцы, составленные с CNE, подвергали распаду комплексов и анализировали на целостность РНК с помощью денатурирующего электрофореза в геле. Немеченая дорожка содержит маркеры молекулярной массы. Дорожки 1 и 2: РНК из тимуса мыши до (1) и после (2) расщепления РНКазой; дорожки 3 и 4: РНК из тимуса мыши в комплексе с CNE01 при соотношении N/P 10:1 до (3) и после (4) расщепления РНКазой; дорожки 5 и 6: РНК из тимуса мыши в комплексе с CNE01 при соотношении N/P 4:1 до (5) и после (6) расщепления РНКазой; дорожки 7 и 8: РНК из тимуса мыши в комплексе с CNE02 при соотношении N/P 10:1 до (7) и после (8) расщепления РНКазой; дорожка 9: РНК из тимуса мыши в комплексе с CNE02 при соотношении N/P 4:1 до (9) расщепления РНКазой.
На фигуре 4 показана стабильность РНК из тимуса мыши в присутствии РНКазы после образования комплекса молекулы РНК с частицами CNE. Все образцы инкубировали с РНКазой в течение 30 минут. РНКазу инактивировали протеиназой K, составленные образцы подвергали распаду комплексов и анализировали на целостность РНК с помощью денатурирующего электрофореза в геле. Немеченая дорожка содержит маркеры молекулярной массы. Дорожки 15 и 16: РНК из тимуса мыши до (15) и после (16) расщепления РНКазой; дорожки 17 и 18: РНК из тимуса мыши в комплексе с CNE04 при соотношении N/P 10:1 до (17) и после (18) расщепления РНКазой; дорожки 19 и 20: РНК из тимуса мыши в комплексе с CNE04 при соотношении N/P 4:1 до (19) и после (20) расщепления РНКазой; дорожки 21 и 22: РНК из тимуса мыши в комплексе с CNE05 при соотношении N/P 10:1 до (21) и после (22) расщепления РНКазой; дорожки 23 и 24: РНК из тимуса мыши в комплексе с CNE05 при соотношении N/P 4:1 до (23) и после (24) расщепления РНКазой.
На фигуре 5 показана стабильность РНК из тимуса мыши в присутствии РНКазы после образования комплекса молекулы РНК с частицами CNE. Все образцы инкубировали с РНКазой в течение 30 минут. РНКазу инактивировали протеиназой K, составленные образцы подвергали распаду комплексов и анализировали на целостность РНК с помощью денатурирующего электрофореза в геле. Немеченые дорожки содержат маркеры молекулярной массы. Дорожки 1 и 2: РНК из тимуса мыши до (1) и после (2) расщепления РНКазой; дорожки 3 и 4: РНК из тимуса мыши в комплексе с CNE17 при соотношении N/P 10:1 до (3) и после (4) расщепления РНКазой; дорожки 5 и 6: РНК из тимуса мыши в комплексе с CNE17 при соотношении N/P 4:1 до (5) и после (6) расщепления РНКазой; дорожки 7 и 8: с CNE27 при соотношении N/P 10:1 до (7) и после (8) расщепления РНКазой; дорожки 9 и 10: РНК из тимуса мыши в комплексе с CNE27 при соотношении N/P 4:1 до (9) и после (10) расщепления РНКазой; дорожки 11 и 12: РНК из тимуса мыши до (11) и после (12) расщепления РНКазой; дорожки 13 и 14: РНК из тимуса мыши в комплексе с CNE32 при соотношении N/P 10:1 до (13) и после (14) расщепления РНКазой; дорожки 15 и 16: РНК из тимуса мыши в комплексе с CNE32 при соотношении N/P 4:1 до (15) и после (16) расщепления РНКазой.
На фигуре 6 показана стабильность РНК из тимуса мыши в присутствии РНКазы после образования комплекса молекулы РНК с частицами CNE. Все образцы инкубировали с РНКазой в течение 30 минут. РНКазу инактивировали протеиназой K, составленные образцы подвергали распаду комплексов и анализировали на целостность РНК с помощью денатурирующего электрофореза в геле. Немеченые дорожки содержат маркеры молекулярной массы. Дорожки 1 и 2: РНК из тимуса мыши до (1) и после (2) расщепления РНКазой; дорожки 3 и 4: РНК из тимуса мыши в комплексе с CNE35 при соотношении N/P 10:1 до (3) и после (4) расщепления РНКазой; дорожки 5 и 6: РНК из тимуса мыши в комплексе с CNE35 при соотношении N/P 4:1 до (5) и после (6) расщепления РНКазой; дорожка 7: РНК из тимуса мыши до расщепления РНКазой.
На фигуре 7 показана последовательность векторов, используемых в примерах. На фигуре 7A показана последовательность плазмиды A317 (SEQ ID NO:1), кодирующей антиген RSV-F. На фигуре 7B показана последовательность плазмиды A306 (SEQ ID NO:2), кодирующей секретируемую плацентарную щелочную фосфатазу (SEAP) человека. На фигуре 7C показана последовательность плазмиды A375 (SEQ ID NO:3), кодирующей антиген RSV-F.
На фигуре 8A показаны результаты анализа SEAP in vivo с использованием 1 мкг репликона РНК A306 в комплексе с CNE17 при соотношении N/P 10:1. На фигуре 8B показаны общие титры IgG у мышей BALB/c в моменты времени 2wp1 и 2wp2 (репликон РНК A317 в комплексе с CNE17 вводили BALB/c).
На фигурах 9A-9C показаны эффекты различных композиций буферов на размер частиц. На фигуре 9A показаны эффекты сахара, соли и полимера F127 на размер частиц эмульсии CNE17 в комплексе с РНК при N/P 10:1. На фигуре 9B показаны эффекты цитратного буфера на размер частиц эмульсии CNE17. На фигуре 9C показан эффект полимеров (F68, F127 и PEG300) на размер частиц.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1. ОБЗОР
Настоящее изобретение, главным образом, относится к катионным эмульсиям "масло-в-воде", которые можно использовать для доставки в клетки отрицательно заряженных молекул, таких как молекула РНК. Частицы эмульсии содержат масляное ядро и катионный липид. Катионный липид может взаимодействовать с отрицательно заряженной молекулой, например, посредством электростатических сил и гидрофобных/гидрофильных взаимодействий, таким образом, заякоривая молекулу в частицы эмульсии. Катионные эмульсии, представленные в настоящем описании, в частности, подходят для доставки молекулы нуклеиновой кислоты, такой как молекулы РНК (например, РНК, кодирующая белок или пептид, малая интерферирующая РНК, самореплицирующаяся РНК и т.п.), в клетки in vivo.
Настоящее изобретение основано на открытии, что катионные эмульсии "масло-в-воде" можно использовать для доставки отрицательно заряженных молекул в клетки. Частицы эмульсии содержат масляное ядро и катионный липид, который может взаимодействовать с отрицательно заряженной молекулой. В предпочтительных вариантах осуществления молекула РНК находится в комплексе с частицей катионной эмульсии "масло-в-воде", например, посредством электростатических сил и гидрофобных/гидрофильных взаимодействий. Находящуюся в комплексе молекулу РНК стабилизируют и защищают от опосредованной РНКазой деградации, и она подвергается более эффективному захвату клетками по сравнению с несвязанной РНК. Кроме того, когда РНК доставляют для индукции экспрессии кодируемого белка, например, в отношении РНК-вакцины, иммуногенность кодируемого белка можно повышать благодаря адъювантным эффектам эмульсии. Таким образом, в дополнение к более эффективной доставке отрицательно заряженной молекулы (например, молекулы РНК, кодирующей антиген) катионные эмульсии также могут повышать иммунный ответ посредством адъювантной активности.
Например, как описано и приведено в качестве примера в настоящем описании, авторы изобретения оценивали эффекты серии катионных эмульсий "масло-в-воде" in vivo с использованием иммунизации респираторно-синцитиальным вирусом (RSV) на модели мыши и модели хлопкового хомяка. Результаты показывают, что составы, в которых молекулы РНК находились в комплексе с катионными эмульсиями, вызывали значительно более высокие иммунные ответы по сравнению с составами несвязанной РНК. В некоторых случаях средние титры антител против кодируемого РНК белка, получаемые после введения 1 мкг РНК в комплексе с катионными эмульсиями "масло-в-воде", являлись сравнимыми с титрами, получаемыми с использованием в 10 раз большего количества несвязанной РНК (доза 10 мкг несвязанной РНК). Другим преимуществом представленных в настоящем описании составов, в дополнение к более высоким иммунным ответам у животного-хозяина, является меньшее колебание иммунных ответов у животных-хозяев между различными исследованиями и различными животными-хозяевами по сравнению с несвязанной (несоставленной) РНК.
Таким образом, в одном из аспектов изобретение относится к композиции, содержащей молекулу РНК в комплексе с частицей катионной эмульсии "масло-в-воде", где частица содержит (a) масляное ядро, находящееся в жидкой фазе при 25°C, и (b) катионный липид. Предпочтительно, частица катионной эмульсии "масло-в-воде" не является липидно-пептидной наночастицей (NLPP). Предпочтительно, масляное ядро находится в жидкой фазе при 4°C.
Частицы катионной эмульсии могут дополнительно содержать поверхностно-активное вещество (например, Tween 80 (полисорбат 80; моноолеат полиоксиэтиленсорбитана), SPAN85 (триолеат сорбитана) или их комбинацию), фосфолипид или их комбинацию. Эмульсия также может содержать полимер (например, Pluronic® F127) в водной фазе (дисперсионной фазе) эмульсии.
В другом аспекте изобретение также относится к нескольким конкретным составам катионных эмульсий "масло-в-воде", которые можно использовать для доставки отрицательно заряженных молекул.
В другом аспекте изобретение относится к способу получения композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде". Одним примером подхода для получения катионных эмульсий, представленных в настоящем описании, является диспергирование масляной фазы в водной фазе посредством гомогенизации. Дополнительные необязательные этапы для усиления образования частиц, для улучшения образования комплексов между отрицательно заряженными молекулами и катионными частицами, для повышения стабильности отрицательно заряженной молекулы (например, для предотвращения деградации молекулы РНК), для облегчения правильной деформации комплексов/высвобождения отрицательно заряженных молекул (таких как молекула РНК) или для предотвращения агрегации частиц эмульсии включают, например, добавление дихлорметана (DCM или метиленхлорида) в масляную фазу и допущение выпаривания DCM до гомогенизации или после нее; смешивание катионного липида с подходящим растворителем для образования липосомной суспензии или добавление полимера (например, Pluronic® F127) или поверхностно-активного вещества в водную фазу эмульсии. Альтернативно, катионный липид можно растворять непосредственно в масле.
Катионные эмульсии по изобретению можно использовать для доставки отрицательно заряженной молекулы, такой как нуклеиновая кислота (например, РНК). Композиции можно вводить нуждающемуся в этом индивидууму для вызывания или усиления иммунного ответа. Композиции также можно доставлять совместно с другой иммуногенной молекулой, иммуногенной композицией или вакциной для усиления эффективности вызываемого иммунного ответа.
2. ОПРЕДЕЛЕНИЯ
Как применяют в настоящем описании, формы в единственном числе включают ссылки на множественное число, если контекст четко не указывает иное.
Как применяют в настоящем описании, термин "приблизительно" относится к +/- 10% значения.
Термин "поверхностно-активное вещество" является техническим термином и, как правило, относится к любой молекуле, имеющей и гидрофильную группу (например, полярную группу), энергетически склонную к сольватации водой, и гидрофобную группу, плохо сольватируемую водой. Термин "неионное поверхностно-активное вещество" является термином, известным в этой области, и, как правило, относится к молекуле поверхностно-активного вещества, гидрофильная группа (например, полярная группа) которого не является электростатически заряженной.
Термин "полимер" относится к молекуле, состоящей из соединенных вместе отдельных химических группировок, которые могут являться одинаковыми или отличаться. Как применяют в настоящем описании, термин "полимер" относится к отдельным химическим группировкам, непрерывно соединенным для образования линейной молекулы, а также отдельным химическим группировкам, соединенным в форме разветвленной (например, "многолопастной" (multi-arm) или "звездчатой") структуры. Примеры полимеров включают, например, полоксамеры. Полоксамеры являются неионными триблок-сополимерами с центральной гидрофобной цепью полиоксипропилена (поли(пропиленоксида)), фланкируемой двумя гидрофильными цепями полиоксиэтилена (поли(этиленоксида)).
"Буфер" относится к водному раствору, устойчивому к изменениям pH раствора.
Как применяют в настоящем описании, "аналог нуклеотида" или "модифицированный нуклеотид" относится к нуклеотиду, содержащему одну или несколько химических модификаций (например, замен) азотного основания в нуклеозиде (например, цитозине (C), тимине (T) или урациле (U)), аденине (A) или гуанине (G)). Аналог нуклеотида может содержать дополнительные химические модификации сахарного остатка в нуклеозиде (например, рибозе, дезоксирибозе, модифицированной рибозе, модифицированной дезоксирибозе, шестичленном аналоге сахара или аналоге сахара с открытой цепью) или фосфате.
Как применяют в настоящем описании, "сахарид" включает моносахариды, олигосахариды или полисахариды с неразветвленной цепью или в форме кольца или их комбинацию для образования сахаридной цепи. Олигосахариды являются сахаридами с двумя или более моносахаридными остатками. Примеры сахаридов включают глюкозу, мальтозу, мальтотриозу, мальтотетрозу, сахарозу и трегалозу.
Термины "самореплицирующаяся РНК", "РНК-репликон" или "РНК-вектор" являются техническими терминами и, как правило, относятся к молекуле РНК, способной направлять свою собственную амплификацию или саморепликацию in vivo, как правило, в клетке-мишени. РНК-репликон используют напрямую без необходимости введения ДНК в клетку и транспорта в ядро, где будет происходить транскрипция. При использовании РНК-вектора для прямой доставки в цитоплазму клетки-хозяина автономная репликация и трансляция гетерологичной последовательности нуклеиновой кислоты происходит эффективно. Самореплицирующаяся РНК на основе альфавируса может содержать следующие элементы в последовательном порядке: вирусные 5’-последовательности, необходимые в цис-положении для репликации (также обозначаемые в этой области как 5’-CSE), последовательности, которые при экспрессии кодируют биологически активные неструктурные белки альфавируса (например, nsP1, nsP2, nsP3, nsP4), вирусные 3’-последовательности, необходимые в цис-положении для репликации (также обозначаемые в этой области как 3’-CSE), и полиаденилатный тракт. Самореплицирующаяся РНК на основе альфавируса также может содержать вирусный субгеномный промотор "области соединения", последовательности из одного или нескольких генов структурных белков или их части, чужеродные молекулы нуклеиновой кислоты достаточного для продукции рекомбинантных альфавирусных частиц размера, а также гетерологичные последовательности, подлежащие экспрессии.
Термин "адъювант" относится к любому веществу, способствующему или модифицирующему действие фармацевтического средства, включая, в качестве неограничивающих примеров, иммунологические адъюванты, повышающие и/или изменяющие иммунный ответ на антиген. Таким образом, иммунологические адъюванты включают соединения, способные усиливать иммунный ответ на антигены. Иммунологические адъюванты могут усиливать гуморальный и/или клеточный иммунитет. Вещества, стимулирующие врожденный иммунный ответ, в настоящем описании включают в определение иммунологических адъювантов. Иммунологические адъюванты также можно обозначать как "иммуностимуляторы".
Как применяют в настоящем описании, термин "антиген" или "иммуноген" относится к молекуле, содержащей один или несколько эпитопов (например, линейные, конформационные или оба), вызывающих иммунный ответ. Как применяют в настоящем описании, "эпитоп" является той частью указанной молекулы (например, антигенной молекулы или антигенного комплекса), определяющей ее иммунологическую специфичность. Эпитоп входит в объем настоящего определения антигена. Как применяют в настоящем описании, термин "антиген" или "иммуноген" включает субъединичные антигены, т.е. антигены, отделенные от целого организма, с которым антиген ассоциирован в природе. Как применяют в настоящем описании, антитела, такие как антиидиотипические антитела или их фрагменты, и синтетические пептидные мимеотопы, которые могут имитировать антиген или антигенную детерминанту, также входят в объем определения антигена.
"Иммунный ответ" представляет собой развитие у индивидуума гуморального и/или клеточного иммунного ответа на антиген или иммунологический адъювант.
Иммунные ответы включают врожденный и адаптивный иммунные ответы. Врожденные иммунные ответы являются быстродействующими ответами, обеспечивающими первую линию защиты для иммунной системы. Наоборот, в адаптивном иммунитете используется селекция и клональная экспансия иммунных клеток с подвергшимися соматической реаранжировке генами рецепторов (например, T- и B-клеточных рецепторов), распознающих антигены указанного патогена или нарушения (например, опухоли), таким образом, обеспечивая специфичность и иммунологическую память. В числе многих своих эффектов врожденные иммунные ответы приводят к быстрому выбросу воспалительных цитокинов и активации антигенпредставляющих клеток (АПК), таких как макрофаги и дендритные клетки. Для распознавания патогенов из собственных компонентов врожденная иммунная система использует множество относительно неизменных рецепторов, определяющих отличительные признаки патогенов, известные как патоген-ассоциированные молекулярные структуры или PAMP. Известно, что добавление микробных компонентов в экспериментальные вакцины приводит к развитию сильных и устойчивых адаптивных иммунных ответов. Как сообщают, в механизм этого усиления иммунных ответов вовлечены рецепторы распознавания паттерна (PRR), по-разному экспрессирующиеся на множестве иммунных клеток, включая нейтрофилы, макрофаги, дендритные клетки, естественные киллеры, B-клетки и некоторые неиммунные клетки, такие как эпителиальные и эндотелиальные клетки. Вовлечение PRR приводит к активации некоторых из этих клеток и секреции ими цитокинов и хемокинов, а также созреванию и миграции других клеток. Одно за другим, они создают воспалительную среду, приводящую к развитию адаптивного иммунного ответа. PRR включают нефагоцитозные рецепторы, такие как Toll-подобные рецепторы (TLR) и белки с нуклеотид-связывающим доменом олигомеризации (NOD), и рецепторы, индуцирующие фагоцитоз, такие как скавенджер-рецепторы, маннозные рецепторы и β-глюкановые рецепторы. Известные TLR (вместе с примерами некоторых известных лигандов, которые можно использовать в качестве иммуногенной молекулы, в различных вариантах осуществления изобретения) включают, помимо прочего, следующие: TLR1 (бактериальные липопротеины из Mycobacteria, Neisseria), TLR2 (зимозановые частицы дрожжей, пептидогликаны, липопротеины, липопептиды, гликолипиды, липополисахарид), TLR3 (вирусная двухцепочечная РНК, поли:IC), TLR4 (бактериальные липополисахариды, растительный продукт таксол), TLR5 (бактериальные флагеллины), TLR6 (зимозановые частицы дрожжей, липотейхоевая кислота, липопептиды микоплазмы), TLR7 (одноцепочечная РНК, имиквимод, резимиквимод и другие синтетические соединения, такие как локсорибин и бропиримин), TLR8 (одноцепочечная РНК, резимиквимод) и TLR9 (CpG-олигонуклеотиды). Дендритные клетки считают одним из наиболее важных типов клеток для инициации примирования наивных CD4+ T-хелперных (TH) клеток и для стимуляции дифференцировки CD8+ T-клеток в киллерные клетки. Сообщают, что передача сигнала TLR играет важную роль в определении качества этих ответов T-хелперных клеток, например, в то время как природа TLR-сигнала определяет конкретный тип наблюдаемого TH-ответа (например, TH1-ответ или TH2-ответ). Комбинация гуморального и клеточного иммунитета возникает как часть ответа TH1-типа, в то время как ответ TH2-типа преимущественно является гуморальным ответом. Показано, что различные лиганды TLR, такие как CpG ДНК (TLR9) и имидазохинолины (TLR7, TLR8) стимулируют продукцию цитокинов иммунными клетками in vitro. Имидазохинолины являются первыми небольшими соединениями, подобными лекарственным средствам, для которых показано, что они являются агонистами TLR. Подробнее см., например, A. Pashine, N. M. Valiante и J. B. Ulmer, Nature Medicine 11, S63-S68 (2005), K. S. Rosenthal и D. H. Zimmerman, Clinical and Vaccine Immunology, 13(8), 821-829 (2006), и цитируемые в них ссылки.
Для целей настоящего изобретения гуморальный иммунный ответ относится к иммунному ответу, опосредуемому молекулами антител, в то время как клеточный иммунный ответ опосредован T-лимфоцитами и/или другими лейкоцитами. Один из важных аспектов клеточного иммунитета включает антиген-специфичный ответ посредством цитотоксических T-клеток (CTL). CTL обладают специфичностью для пептидных антигенов, представляемых связанными с белками, кодируемыми главным комплексом гистосовместимости (MHC) и экспрессируемыми на поверхности клеток. CTL помогают индуцировать и усиливать внутриклеточное разрушение внутриклеточных микробов, или лизис клеток, инфицированных такими микробами. Другой аспект клеточного иммунитета включает антиген-специфичный ответ посредством T-хелперных клеток. T-хелперные клетки действуют, помогая стимулировать функционирование и сфокусировать активность неспецифичных эффекторных клеток против клеток, представляющих пептидные антигены, связанные с молекулами MHC на их поверхности. "Клеточный иммунный ответ" также относится к продукции цитокинов, хемокинов и других таких молекул, продуцируемых активированными T-клетками и/или другими лейкоцитами, включая происходящие из CD4+ и CD8+ T-клеток.
Композиция, такая как иммуногенная композиция или вакцина, вызывающая клеточный иммунный ответ, таким образом, может служить для сенсибилизации позвоночного посредством представления антигена, связанного с молекулами MHC на поверхности клетки. Опосредуемый клетками иммунный ответ направлен на, или почти на, клетки, представляющие антиген на своей поверхности. Кроме того, антиген-специфичные T-лимфоциты могут генерироваться для обеспечения будущей защиты иммунизированного хозяина. Способность конкретного антигена или композиции стимулировать опосредуемый клетками иммунный ответ можно определять посредством ряда анализов, известных в этой области, например, посредством анализов лимфопролиферации (активации лимфоцитов), анализов цитотоксических клеток CTL, анализа T-лимфоцитов, специфичных для антигена, у сенсибилизированного индивидуума, или посредством измерения продукции цитокинов T-клетками в ответ на повторную стимуляцию антигеном. Такие анализы хорошо известны в этой области. См., например, Erickson et al. (1993) J. Immunol 151: 4189-4199; Doe et al. (1994) Eur. J. Immunol 24: 2369-2376. Таким образом, как применяют в настоящем описании, иммунный ответ может являться ответом, стимулирующим продукцию CTL и/или продукцию или активации T-хелперных клеток. Интересующий антиген также может вызывать опосредуемый антителами иммунный ответ. Таким образом, иммунный ответ, помимо прочего, может включать, например, один или несколько следующих эффектов: продукция антител, например, B-клетками; и/или активация супрессорных T-клеток и/или γδ T-клеток, специфически направленных на антиген или антигены, присутствующие в интересующей композиции или вакцине. Эти ответы могут служить, например, для нейтрализации инфицирующей способности и/или опосредовать комплемент-зависимую антительную цитотоксичность или антителозависимую клеточноопосредованную цитотоксичность (ADCC) для обеспечения защиты иммунизированного хозяина. Такие ответы можно определять с использованием стандартных иммунологических анализов и анализов нейтрализации, хорошо известных в этой области.
Композиции по настоящему изобретению демонстрируют "повышенную иммуногенность" для указанного антигена, когда они обладают большей способностью вызывать иммунный ответ, чем иммунный ответ, вызываемый равным количеством антигена в отличающейся композиции (например, где антиген вводят как растворимый белок). Таким образом, композиция может демонстрировать повышенную иммуногенность, например, потому, что композиция вызывает более сильный иммунный ответ, или потому, что более низкая доза или меньше доз антигена необходимо для достижения иммунного ответа у индивидуума, которому ее вводят. Такую повышенную иммуногенность можно определять, например, посредством введения композиции по изобретению и антигенного контроля животным и сравнения результатов анализов двух животных.
3. КАТИОННЫЕ ЭМУЛЬСИИ "МАСЛО-В-ВОДЕ"
Катионные эмульсии "масло-в-воде", представленные в настоящем описании, как правило, описывают общепринятым в этой области способом через концентрации компонентов, используемых для получения эмульсий. В этой области следует понимать, что при получении эмульсии, включая стерилизацию и другие последующие способы, небольшие количества масла (например, сквалена), катионного липида (например, DOTAP) или других компонентов могут утрачиваться, и точные концентрации этих компонентов в конечном продукте (например, упакованной, стерилизованной эмульсии, готовой для введения) могут быть немного меньше, чем исходные количества, иногда приблизительно до 10% или приблизительно до 20%.
Настоящее изобретение, главным образом, относится к катионным эмульсиям "масло-в-воде", которые можно использовать для доставки отрицательно заряженных молекул, таких как молекула РНК. Частицы эмульсии содержат масляное ядро и катионный липид. Катионный липид может взаимодействовать с отрицательно заряженной молекулой, например, посредством электростатических сил и гидрофобных/гидрофильных взаимодействий, таким образом, заякоривая молекулу на частицах эмульсии. Катионные эмульсии, представленные в настоящем описании, в частности, подходят для доставки отрицательно заряженной молекулы, такой как молекула РНК, кодирующая антиген, или малая интерферирующая РНК, в клетки in vivo. Например, катионные эмульсии, представленные в настоящем описании, предоставляют преимущества для доставки РНК, кодирующей антигены, включая самореплицирующуюся РНК, в качестве вакцин.
Частицы эмульсий "масло-в-воде" похожи на мицеллу с центральным ядром из масла. Масляное ядро покрывают катионным липидом, диспергирующим каплю масла в водной (дисперсионной) фазе в виде мицелло-подобных капель. В эмульсии могут присутствовать один или несколько необязательных компонентов, таких как поверхностно-активные вещества и/или фосфолипиды, как описано ниже. Например, одно или несколько поверхностно-активных веществ можно использовать для стимуляции образования частицы и/или стабилизации частиц эмульсии. В этом случае масляное ядро покрывают катионным липидом, а также поверхностно-активными веществами для образования мицелло-подобных капель. Аналогично, один или несколько липидов (например, нейтральных липидов, гликолипидов или фосфолипидов) также могут присутствовать на поверхности частиц эмульсии, если такие липиды используют в качестве эмульгаторов для диспергирования капель масла.
Частицы эмульсий "масло-в-воде" имеют средний диаметр (т.е. среднечисловой диаметр) 1 микрометр или менее. В частности, желательно, чтобы средний размер (т.е. среднечисловой диаметр) частиц катионной эмульсии составлял приблизительно 900 нм или менее, приблизительно 800 нм или менее, приблизительно 700 нм или менее, приблизительно 600 нм или менее, приблизительно 500 нм или менее, приблизительно 400 нм или менее, 300 нм или менее или 200 нм или менее, например, от приблизительно 1 нм до приблизительно 1 мкм, от приблизительно 1 нм до приблизительно 900 нм, от приблизительно 1 нм до приблизительно 800 нм, от приблизительно 1 нм до приблизительно 700 нм, от приблизительно 1 нм до приблизительно 600 нм, от приблизительно 1 нм до приблизительно 500 нм, от приблизительно 1 нм до приблизительно 400 нм, от приблизительно 1 нм до приблизительно 300 нм, от приблизительно 1 нм до приблизительно 200 нм, от приблизительно 1 нм до приблизительно 175 нм, от приблизительно 1 нм до приблизительно 150 нм, от приблизительно 1 нм до приблизительно 125 нм, от приблизительно 1 нм до приблизительно 100 нм, от приблизительно 1 нм до приблизительно 75 нм или от приблизительно 1 нм до приблизительно 50 нм.
В частности, желательно, чтобы средний диаметр частицы катионных эмульсий составлял приблизительно 180 нм или менее, приблизительно 170 нм или менее, приблизительно 160 нм или менее, приблизительно 150 нм или менее, приблизительно 140 нм или менее, приблизительно 130 нм или менее, приблизительно 120 нм или менее, приблизительно 110 нм или менее, или приблизительно 100 нм или менее; например, от приблизительно 80 нм до 180 нм, от приблизительно 80 нм до 170 нм, от приблизительно 80 нм до 160 нм, от приблизительно 80 нм до 150 нм, от приблизительно 80 нм до 140 нм, от приблизительно 80 нм до 130 нм, от приблизительно 80 нм до 120 нм; от приблизительно 80 нм до 110 нм или от приблизительно 80 нм до 100 нм. Особенно предпочтительный средний диаметр частицы составляет приблизительно 100 нм.
Размер частиц эмульсии можно варьировать, изменяя соотношение поверхностно-активного вещества и масла (повышение соотношения снижает размер капли), рабочее давление гомогенизации (повышение рабочего давления гомогенизации, как правило, снижает размер капли), температуру (повышение температуры снижает размер капли), изменяя тип масла и другие параметры способа, как подробно описано ниже. Включение конкретных типов буферов в водную фазу также может влиять на размер частиц.
В некоторых случаях в отношении РНК-вакцины размер частиц эмульсии может влиять на иммуногенность комплекса РНК-эмульсия. Таким образом, предпочтительный диапазон среднего размера частиц эмульсий должен составлять от приблизительно 80 нм до приблизительно 180 нм в диаметре.
Представленные в настоящем описании частицы эмульсии могут находиться в комплексе с отрицательно заряженной молекулой. Перед образованием комплексов с отрицательно заряженной молекулой общий суммарный заряд частиц (как правило, измеряемый как дзета-потенциал) должен являться положительным (катионным). Общий суммарный заряд частиц может варьировать в зависимости от типа катионного липида и количества катионного липида в эмульсии, количества масла в эмульсии (например, более высокая процентная доля масла, как правило, приводит к меньшему заряду на поверхности частиц), и на него также может влиять любой дополнительный компонент (например, поверхностно-активные вещества и/или фосфолипиды), присутствующий в эмульсии. В примерах вариантов осуществления дзета-потенциал частиц до образования комплексов, как правило, составляет больше 10 мВ.
Предпочтительно, дзета-потенциал частиц до образования комплексов составляет не более приблизительно 50 мВ, не более приблизительно 45 мВ, не более приблизительно 40 мВ, не более приблизительно 35 мВ, не более приблизительно 30 мВ, не более приблизительно 25 мВ, не более приблизительно 20 мВ; от приблизительно 5 мВ до приблизительно 50 мВ, от приблизительно 10 мВ до приблизительно 50 мВ, от приблизительно 10 мВ до приблизительно 45 мВ, от приблизительно 10 мВ до приблизительно 40 мВ, от приблизительно 10 мВ до приблизительно 35 мВ, от приблизительно 10 мВ до приблизительно 30 мВ, от приблизительно 10 мВ до приблизительно 25 мВ или от приблизительно 10 мВ до приблизительно 20 мВ. На дзета-потенциал могут влиять (i) pH эмульсии, (ii) проводимость эмульсии (например, минерализация) и (iii) концентрация различных компонентов эмульсии (полимера, неионных поверхностно-активных средств и т.д.). Дзета-потенциал CNE измеряют с использованием Malvern Nanoseries Zetasizer (Westborough, MA). Образец разводят 1:100 в воде (вязкость: 0,8872 сп, RI: 1,330, диэлектрическая постоянная: 78,5) и добавляют в капиллярную кювету из полистирольного латекса (Malvern, Westborough, MA). Дзета-потенциал измеряют при 25°C с временем установления равновесия 2 минуты и анализируют с использованием модели Смолуховского (значение F(Ka)=1,5). Данные представлены в мВ.
Примером катионной эмульсии по изобретению является CNE17. Масляным ядром CNE17 является сквален (4,3% масс./об.), и катионным липидом является DOTAP (1,4 мг/мл). CNE17 также включает поверхностно-активные вещества SPAN85 ((триолеат сорбитана) 0,5% об./об.) и Tween 80 ((полисорбат 80; моноолеат полиоксиэтиленсорбитана) 0,5% об./об.). Таким образом, частицы CNE17 содержат скваленовое ядро, покрытое SPAN85, Tween 80 и DOTAP. Показано, что молекулы РНК эффективно образуют комплекс с частицами CNE17 при соотношении N/P 4:1 и соотношении N/P 10:1. Другие примеры катионных эмульсий включают, например, CNE05 (0,5% масс./об. сквалена, 0,08% Tween 80 и 1,2 мг/мл DOTAP), CNE12 (4,3% сквалена, 0,5% SPAN85, 0,5% Tween 80 и 2,46 мг/мл DC холестерола), CNE13 (4,3% сквалена, 0,5% SPAN85, 0,5% Tween 80 и 1,45 мг/мл DDA) и другие эмульсии, представленные в настоящем описании.
В этой области известны отдельные компоненты эмульсий "масло-в-воде" по настоящему изобретению, хотя такие композиции не комбинировали способом, представленным в настоящем описании. Таким образом, отдельные компоненты, хотя и описаны ниже в общем и подробно для предпочтительных вариантов осуществления, хорошо известны в этой области, и термины, используемые в настоящем описании, такие как масляное ядро, поверхностно-активное вещество, фосфолипиды и т.д., достаточно хорошо известны специалистам в этой области без дополнительного описания. Кроме того, в то время как представлены предпочтительные диапазоны количества отдельных компонентов эмульсий, точные соотношения компонентов конкретной эмульсии необходимо регулировать так, чтобы частицы эмульсии с желаемым размером и физическими свойствами могли образовываться соответствующим образом. Например, если используют конкретное количество масла (например, 5% об./об. масла), то количество поверхностно-активного вещества должно находиться на уровне, достаточном для диспергирования капли масла в водной фазе для образования стабильной эмульсии. Точное количество поверхностно-активного вещества, необходимого для диспергирования капли масла в водной фазе, зависит от типа поверхностно-активного вещества и типа масляного ядра, используемого для эмульсии; и количество масла также может варьироваться в соответствии с размером капли (т.к. это изменяет площадь поверхности между двумя фазами). Точные количества и относительные пропорции компонентов желаемой эмульсии легко могут определять специалисты в этой области.
A. Масляное ядро
Частицы катионных эмульсий "масло-в-воде" содержат масляное ядро. Предпочтительно, масло является метаболизируемым нетоксичным маслом; более предпочтительно, содержащим от приблизительно 6 до приблизительно 30 атомов углерода, включая, в качестве неограничивающих примеров, алканы, алкены, алкины и соответствующие им кислоты и спирты, их простые эфиры и сложные эфиры и их смеси. Масло может являться любым растительным маслом, рыбьим жиром, животным маслом или синтетически получаемым маслом, которое может метаболизироваться организмом индивидуума, которому вводят эмульсию, и не является токсичным для индивидуума. Индивидуум может являться животным, как правило, млекопитающим, и предпочтительно человеком.
В конкретных вариантах осуществления масляное ядро находится в жидкой фазе при 25°C. Масляное ядро находится в жидкой фазе при 25°C, когда оно демонстрирует свойства жидкости (отличаясь от твердого вещества или газа; и имеет определенный объем, но не определенную форму) при хранении при 25°C. Однако эмульсию можно хранить и использовать при любой подходящей температуре. Предпочтительно, масляное ядро находится в жидкой фазе при 4°C.
Масло может являться любым длинноцепочечным алканом, алкеном или алкином, или их производной кислотой или спиртом, например, в форме свободной кислоты, ее соли или сложного эфира, такого как моно- или ди- или триэфир, такой как триглицериды и сложные эфиры 1,2-пропандиола или аналогичные полигидроксиспирты. Спирты можно ацетилировать с использованием моно- или полифункциональной кислоты, например, уксусной кислоты, пропионовой кислоты, лимонной кислоты или т.п. Также можно использовать простые эфиры, производные длинноцепочечных спиртов, являющиеся маслами и соответствующие другим критериям, указанным в настоящем описании.
Отдельный остаток алкана, алкена или алкина и его производное - кислота или спирт, как правило, будет содержать от приблизительно 6 до приблизительно 30 атомов углерода. Остаток может иметь линейную или разветвленную структуру. Они могут являться полностью насыщенными или иметь одну или несколько двойных или тройных связей. Если используют масла на основе сложного моно- или полиэфира или простого эфира, ограничение от приблизительно 6 до приблизительно 30 атомов углерода используют по отношению к остаткам жирной кислоты или жирного спирта, а не к общему количеству атомов углерода.
В частности, желательно, чтобы масло могло метаболизироваться индивидуумом, которому вводят эмульсию.
Можно использовать любые подходящие масла из животного, рыбы или растительного источника. Источники растительных масел включают орехи, семена и зерна, и подходящие масла включают арахисовое масло, соевое масло, кокосовое масло и оливковое масло и т.п. Другие подходящие масла из семян включают сафлоровое масло, хлопковое масло, подсолнечное масло, сезамовое масло и т.п. В группе зерновых также можно использовать кукурузное масло и масло других зерен хлебных злаков, таких как пшеница, овес, рожь, рис, тефа, тритикале и т.п. Технология получения растительных масел хорошо отработана и хорошо известна. Композиции этих и других аналогичных масел можно найти, например, в Merck Index и первоисточниках о пищевых продуктах питании и технологии пищевых продуктов.
Сложные эфиры жирных кислот глицерина и 1,2-пропандиола, содержащие от приблизительно шести до приблизительно десяти атомов углерода, хотя и не существующие в природе в маслах семян, можно получать гидролизом, разделением и этерификацией соответствующих материалов, начиная с масел орехов и семян. Эти продукты коммерчески доступны под названием NEOBEES от PVO International, Inc., Chemical Specialties Division, 416 Division Street, Boongon, N.J. и др.
Животные масла и жиры часто находятся в твердой фазе при физиологических температурах, т.к. они существуют в виде триглицеридов и имеют большие степени насыщения, чем масла из рыбы или растений. Однако жирные кислоты можно получать из животных жиров частичным или полным омылением триглицеридов, приводящим к образованию свободных жирных кислот. Жиры и масла из молока млекопитающих являются метаболизируемыми, и, таким, образом, их можно использовать в практическом осуществлении этого изобретения. Способы разделения, очистки, омыления и другие средства, необходимые для получения чистых масел из животных источников, хорошо известны в этой области.
Большинство рыб содержат метаболизируемые масла, которые можно легко выделять. Например, масло печени трески, масла печени акулы и китовое масло, такое как спермацет, являются примерами некоторых рыбьих жиров, которые можно использовать в настоящем описании. Ряд масел с разветвленной цепью синтезируют биохимически в 5-углеродных изопреновых единицах и, как правило, обозначают как терпеноиды. Сквален (2,6,10,15,19,23-гексаметил-2,6,10,14,18,22-тетракозагексаен), разветвленный ненасыщенный терпеноид, является особенно предпочтительным в настоящем описании. Основным источником сквалена является масло печени акулы, хотя растительные масла, включая масло из семян амаранта, рисовых отрубей, зародышей пшеницы и оливковое масло, также являются подходящими источниками. Сквалан, насыщенный аналог сквалена, также является предпочтительным. Рыбьи жиры, включая сквален и сквалан, легкодоступны в коммерческих источниках, или их можно получать известными в этой области способами.
В определенных вариантах осуществления масляное ядро содержит масло, выбранное из группы, состоящей из касторового масла, кокосового масла, кукурузного масла, хлопкового масла, масла энотеры, рыбьего жира, масла жожоба, лярда, льняного масла, оливкового масла, арахисового масла, сафлорового масла, сезамового масла, соевого масла, сквалена, подсолнечного масла, масла пшеничных зародышей и минерального масла. В иллюстративных вариантах осуществления масляное ядро включает соевое масло, подсолнечное масло, оливковое масло, сквален или их комбинацию. В качестве масла также можно использовать сквалан. В иллюстративных вариантах осуществления масляное ядро содержит сквален, сквалан или их комбинацию.
Масляный компонент эмульсии может присутствовать в количестве от приблизительно 0,2% до приблизительно 20% (об./об.). Например, катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,2% до приблизительно 20% (об./об.) масла, от приблизительно 0,2% до приблизительно 15% (об./об.) масла, от приблизительно 0,2% до приблизительно 10% (об./об.) масла, от приблизительно 0,2% до приблизительно 9% (об./об.) масла, от приблизительно 0,2% до приблизительно 8% (об./об.) масла, от приблизительно 0,2% до приблизительно 7% (об./об.) масла, от приблизительно 0,2% до приблизительно 6% (об./об.) масла, от приблизительно 0,2% до приблизительно 5% (об./об.) масла, от приблизительно 0,2% до приблизительно 4,3% (об./об.) масла, от приблизительно 0,3% до приблизительно 20% (об./об.) масла, от приблизительно 0,4% до приблизительно 20% (об./об.) масла, от приблизительно 0,5% до приблизительно 20% (об./об.) масла, от приблизительно 1% до приблизительно 20% (об./об.) масла, от приблизительно 2% до приблизительно 20% (об./об.) масла, от приблизительно 3% до приблизительно 20% (об./об.) масла, от приблизительно 4% до приблизительно 20% (об./об.) масла, от приблизительно 4,3% до приблизительно 20% (об./об.) масла, от приблизительно 5% до приблизительно 20% (об./об.) масла, приблизительно 0,5% (об./об.) масла, приблизительно 1% (об./об.) масла, приблизительно 1,5% (об./об.) масла, приблизительно 2% (об./об.) масла, приблизительно 2,5% (об./об.) масла, приблизительно 3% (об./об.) масла, приблизительно 3,5% (об./об.) масла, приблизительно 4% (об./об.) масла, приблизительно 4,3% (об./об.) масла, приблизительно 5% (об./об.) масла или приблизительно 10% (об./об.) масла.
Альтернативно, катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,2% до приблизительно 10% (масс./об.) масла, от приблизительно 0,2% до приблизительно 9% (масс./об.) масла, от приблизительно 0,2% до приблизительно 8% (масс./об.) масла, от приблизительно 0,2% до приблизительно 7% (масс./об.) масла, от приблизительно 0,2% до приблизительно 6% (масс./об.) масла, от приблизительно 0,2% до приблизительно 5% (масс./об.) масла, от приблизительно 0,2% до приблизительно 4,3% (масс./об.) масла или приблизительно 4,3% (масс./об.) масла.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит приблизительно 0,5% (об./об.) масла. В другом иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит приблизительно 4,3% (об./об.) масла. В другом иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит приблизительно 5% (об./об.) масла. В другом иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит приблизительно 4,3% (масс./об.) сквалена.
Как указано выше, процентную долю описываемого выше масла определяют на основе исходного количества масла, используемого для получения эмульсий. В этой области следует понимать, что точная концентрация масла в конечном продукте (например, упакованной, стерилизованной эмульсии, готовой для введения) может являться немного меньшей, иногда до приблизительно 10% или приблизительно 20%.
B. Катионные липиды
Частицы эмульсии, представленные в настоящем описании, содержат катионный липид, который может взаимодействовать с отрицательно заряженной молекулой, таким образом, заякоривая молекулу на частицах эмульсии.
Можно использовать любой подходящий катионный липид. Как правило, катионный липид содержит атом азота, положительно заряженный в физиологических условиях. Подходящие катионные липиды включают хлорид бензалкония (BAK), хлорид бензетония, цетримид (содержащий бромид тетрадецилтриметиламмония и, возможно, небольшие количества бромида додецилтриметиламмония и бромида гексадецилтриметиламмония), хлорид цетилпиридиния (CPC), хлорид цетилтриметиламмония (CTAC), первичные амины, вторичные амины, третичные амины, включая, в качестве неограничивающих примеров, 1,3-диаминопропан-Ν,Ν’,Ν’-полиоксиэтилен(10)-N-таллового масла, другие соли четвертичного амина, включая, в качестве неограничивающих примеров, бромид додецилтриметиламмония, бромид гексадецилтриметиламмония, смешанный бромид алкилтриметиламмония, хлорид бензилдиметилдодециламмония, хлорид бензилдиметилгексадециламмония, метоксид бензилтриметиламмония, бромид цетилдиметилэтиламмония, бромид диметилдиоктадециламмония (DDAB), хлорид метилбензетония, хлорид декаметония, хлорид смешанного метилтриалкиламмония, хлорид метилтриоктиламмония), хлорид N,N-диметил-N-[2(2-метил-4-(1,1,3,3-тетраметилбутил)фенокси]этокси)этил]бензолметанаминия (DEBDA), соли диалкилдиметиламмония, хлорид [1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония, 1,2-диацил-3-(триметиламмонио)пропан (ацильная группа = димиристоил, дипальмитоил, дистеароил, диолеоил), 1,2-диацил-3-(диметиламмонио)пропан (ацильная группа = димиристоил, дипальмитоил, дистеароил, диолеоил), 1,2-диолеоил-3-(4’-триметиламмонио)бутаноил-sn-глицерин, сложный эфир 1,2-диолеоил-3-сукцинил-sn-глицеро-холина, холестерил(4’-триметиламмонио)бутаноат), соли N-алкилпиридиния (например, бромид цетилпиридиния и хлорид цетилпиридиния), соли N-алкилпиперидиния, дикатионные болаформные электролиты (C12Me6; C12Bu6), диалкилглицетилфосфорилхолин, лизолецитин, L-α диолеоилфосфатидилэтаноламин, сложный эфир холестерина и гемисукцинатхолина, липополиамины, включая, в качестве неограничивающих примеров, диоктадециламидоглицилспермин (DOGS), дипальмитоил-фосфатидилэтанол-амидоспермин (DPPES), липополи-L- (или D-)лизин (LPLL, LPDL), поли(L- (или D-)-лизин, конъюгированный с N-глутарилфосфатидилэтаноламином, сложный эфир дидодецилглутамата с боковой аминогруппой (C12GluPhCnN+), сложный эфир дитетрадецилглутамата с боковой аминогруппой (C14GluCnN+), катионные производные холестерола, включая, в качестве неограничивающих примеров, соль холестерил-3β- оксисукцинамидоэтилентриметиламмония, холестерил-3β-оксисукцинамидоэтилендиметиламин, соль холестерил-3β-карбоксиамидоэтилентриметиламмония, холестерил-3β-карбоксиамидоэтилендиметиламин и 3γ-[Ν-(Ν’,Ν-диметиламиноэтанкарбомоил]холестерол) (DC-холестерол), 1,2-диолеоилокси-3-(триметиламмонио)пропан (DOTAP), диметилдиоктадециламмоний (DDA), 1,2-димиристоил-3-триметиламмоний-пропан (DMTAP), дипальмитоил(C16:0)триметиламмоний-пропан (DPTAP), дистеароилтриметиламмоний-пропан (DSTAP) и их комбинацию.
Другие катионные липиды, подходящие для использования в изобретении, включают, например, катионные липиды, описываемые в патентных публикациях США 2008/0085870 (опубликованной 10 апреля 2008 года) и 2008/0057080 (опубликованной 6 марта 2008 года).
Другие катионные липиды, подходящие для использования в изобретении включают, например, липиды E0001-E0118 или E0119-E0180, приведенные в таблице 6 (стр. 112-139) WO 2011/076807 (в которой также описывают способы получения и способ применения этих катионных липидов). Дополнительные подходящие катионные липиды включают хлорид N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA), хлорид N,N-диолеоил-N,N-диметиламмония (DODAC), 1,2-диолеоил-sn-глицеро-3-этилфосфохолин (DOEPC), 1,2-диолеоил-3-диметиламмоний-пропан (DODAP), 1,2-дилинолеилокси-3-диметиламинопропан (DLinDMA).
Эмульсия может содержать любую комбинацию двух или более катионных липидов, представленных в настоящем описании.
В предпочтительных вариантах осуществления катионный липид выбран из группы, состоящей из 1,2-диолеоилокси-3-(триметиламмонио)пропана (DOTAP), 3β-[Ν-(Ν’,Ν’-диметиламиноэтан)карбамоил]холестерола (DC холестерола), диметилдиоктадециламмония (DDA), 1,2-димиристоил-3-триметиламмоний-пропана (DMTAP), дипальмитоил(C16:0)триметиламмоний-пропана (DPTAP), дистеароилтриметиламмоний-пропана (DSTAP), липидов E0001-E0118 или E0119-E0180, описываемых в таблице 6 (стр. 112-139) WO 2011/076807, и их комбинаций.
В других предпочтительных вариантах осуществления катионный липид выбран из группы, состоящей из 1,2-диолеоилокси-3-(триметиламмонио)пропана (DOTAP), 3β-[Ν-(Ν’,Ν’-диметиламиноэтан)карбамоил]холестерола (DC холестерола), диметилдиоктадециламмония (DDA), 1,2-димиристоил-3-триметиламмоний-пропана (DMTAP), дипальмитоил(C16:0)триметиламмоний-пропана (DPTAP), дистеароилтриметиламмоний-пропана (DSTAP), хлорида N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA), хлорида N,N-диолеоил-N,N-диметиламмония (DODAC), 1,2-диолеоил-sn-глицеро-3-этилфосфохолина (DOEPC), 1,2-диолеоил-3-диметиламмоний-пропана (DODAP), 1,2-дилинолеилокси-3-диметиламинопропана (DLinDMA), липидов E0001-E0118 или E0119-E0180, описываемых в таблице 6 (стр. 112-139) WO 2011/076807, и их комбинаций.
В определенных вариантах осуществления катионным липидом является DOTAP. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл DOTAP. Например, катионная эмульсия "масло-в-воде" может содержать DOTAP в концентрации от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,1 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,3 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,4 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 24 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 22 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 18 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 12 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,9 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,8 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 21,8 мг/мл, приблизительно 24 мг/мл и т.д.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTAP, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл.
В определенных вариантах осуществления катионным липидом является DC холестерол. Катионная эмульсия "масло-в-воде" может содержать DC холестерол в концентрации от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл DC холестерола. Например, катионная эмульсия "масло-в-воде" может содержать DC холестерол в концентрации от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,2 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,3 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,4 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,62 мг/мл до приблизительно 5 мг/мл, от приблизительно 1 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 2 мг/мл до приблизительно 5 мг/мл, от приблизительно 2,46 мг/мл до приблизительно 5 мг/мл, от приблизительно 3 мг/мл до приблизительно 5 мг/мл, от приблизительно 3,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 4 мг/мл до приблизительно 5 мг/мл, от приблизительно 4,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4,92 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2,46 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 0,62 мг/мл, приблизительно 0,15 мг/мл, приблизительно 0,3 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,62 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,2 мг/мл, приблизительно 2,46 мг/мл, приблизительно 4,92 мг/мл и т.д.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,62 мг/мл до приблизительно 4,92 мг/мл DC холестерола, например, 2,46 мг/мл.
В определенных вариантах осуществления катионным липидом является DDA. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл DDA. Например, катионная эмульсия "масло-в-воде" может содержать DDA в концентрации от приблизительно 0,1 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 1,45 мг/мл, от приблизительно 0,2 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,3 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,4 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,73 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 5 мг/мл, от приблизительно 1,45 мг/мл до приблизительно 5 мг/мл, от приблизительно 2 мг/мл до приблизительно 5 мг/мл, от приблизительно 2,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 3 мг/мл до приблизительно 5 мг/мл, от приблизительно 3,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 4 мг/мл до приблизительно 5 мг/мл, от приблизительно 4,5 мг/мл до приблизительно 5 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,45 мг/мл и т.д. Альтернативно, катионная эмульсия "масло-в-воде" может содержать DDA в концентрации приблизительно 20 мг/мл, приблизительно 21 мг/мл, приблизительно 21,5 мг/мл, приблизительно 21,6 мг/мл, приблизительно 25 мг/мл.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,73 мг/мл до приблизительно 1,45 мг/мл DDA, например, 1,45 мг/мл.
В определенных вариантах осуществления катионным липидом является DOTMA. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл DOTMA. Например, катионная эмульсия "масло-в-воде" может содержать DOTMA в концентрации от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,1 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,3 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,4 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 24 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 22 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 18 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 12 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,9 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,8 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,35 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.д.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DOTMA, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл.
В определенных вариантах осуществления катионным липидом является DOEPC. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл DOEPC. Например, катионная эмульсия "масло-в-воде" может содержать DOEPC в концентрации от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,1 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,3 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,4 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 24 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 22 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 18 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 12 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,9 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,8 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 1,7 мг/мл, приблизительно 1,8 мг/мл, приблизительно 1,9 мг/мл, приблизительно 2,0 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.д.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 1,8 мг/мл DOEPC, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл, 1,6 мг/мл, 1,7 мг/мл, или 1,8 мг/мл.
В определенных вариантах осуществления катионным липидом является DSTAP. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,5 мг/мл до приблизительно 50 мг/мл DSTAP. Например, катионная эмульсия "масло-в-воде" может содержать DSTAP в концентрации от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,1 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,3 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,4 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 24 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 22 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 18 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 12 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,9 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,8 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 1,7 мг/мл, приблизительно 1,8 мг/мл, приблизительно 1,9 мг/мл, приблизительно 2,0 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.д.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DSTAP, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл.
В определенных вариантах осуществления катионным липидом является DODAC. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,5 мг/мл до приблизительно 50 мг/мл DODAC. Например, катионная эмульсия "масло-в-воде" может содержать DODAC в концентрации от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,1 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,3 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,4 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 24 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 22 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 18 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 12 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,9 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,8 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,15 мг/мл, приблизительно 1,16 мг/мл, приблизительно 1,17 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 1,7 мг/мл, приблизительно 1,8 мг/мл, приблизительно 1,9 мг/мл, приблизительно 2,0 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.д.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит от 0,73 мг/мл до приблизительно 1,45 мг/мл DODAC, например, 1,45 мг/мл.
В определенных вариантах осуществления катионным липидом является DODAP. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,5 мг/мл до приблизительно 50 мг/мл DODAP. Например, катионная эмульсия "масло-в-воде" может содержать DODAP в концентрации от приблизительно 0,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,9 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,1 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,2 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,3 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,4 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,6 мг/мл до приблизительно 25 мг/мл, от приблизительно 1,7 мг/мл до приблизительно 25 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 24 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 22 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 20 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 18 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 12 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 4 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,9 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,8 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,6 мг/мл, от приблизительно 0,6 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 1,7 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 3,0 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,6 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1,0 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 1,7 мг/мл, приблизительно 1,8 мг/мл, приблизительно 1,9 мг/мл, приблизительно 2,0 мг/мл, приблизительно 12 мг/мл, приблизительно 18 мг/мл, приблизительно 20 мг/мл, приблизительно 22,5 мг/мл, приблизительно 25 мг/мл и т.д.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит от приблизительно 0,8 мг/мл до приблизительно 1,6 мг/мл DODAP, например, 0,8 мг/мл, 1,2 мг/мл, 1,4 мг/мл или 1,6 мг/мл.
В некоторых случаях желательным может являться использование катионного липида, растворимого в масляном ядре. Например, DOTAP, DOEPC, DODAC и DOTMA растворимы в сквалене или сквалане. В других случаях желательным может являться использование катионного липида, нерастворимого в масляном ядре. Например, DDA и DSTAP нерастворимы в сквалене. В этой области известно, как определять, является ли конкретный липид растворимым или нерастворимым в масле и, таким образом, выбирать соответствующую комбинацию масла и липида. Например, растворимость можно прогнозировать на основе структур липида и масла (например, растворимость липида можно определять по структуре их хвоста). Например, липиды с одной или двумя цепями ненасыщенных жирных кислот (например, олеоиловыми хвостами), такие как DOTAP, DOEPC, DODAC, DOTMA, растворимы в сквалене или сквалане; в то время как липиды с цепями насыщенных жирных кислот (например, стеароиловыми хвостами) нерастворимы в сквалене. Альтернативно, растворимость можно определять по количеству липида, растворяющегося в указанном количестве масла для образования насыщенного раствора.
Как указано выше, концентрацию описываемого выше липида определяют на основе исходного количества липида, используемого для получения эмульсий. В этой области следует понимать, что точная концентрация масла в конечном продукте (например, упакованной, стерилизованной эмульсии, готовой для введения) может быть немного меньше, иногда до приблизительно 20%.
C. Дополнительные компоненты
Катионные эмульсии "масло-в-воде", представленные в настоящем описании, могут дополнительно содержать дополнительные компоненты. Например, эмульсии могут содержать компоненты, которые могут усиливать образование частиц, улучшать образование комплексов между отрицательно заряженными молекулами и катионными частицами или повышать стабильность отрицательно заряженной молекулы (например, для предотвращения деградации молекулы РНК).
Поверхностно-активные вещества
В определенных вариантах осуществления частицы катионной эмульсии "масло-в-воде" дополнительно содержат поверхностно-активное вещество.
В фармации используют большое количество поверхностно-активных веществ. Они включают природные материалы, такие как камеди деревьев, растительные белки, полимеры на основе сахаров, такие как альгинаты и целлюлоза, и т.п. Конкретные оксиполимеры или полимеры с гидроксидом или другим гидрофильным заместителем на углеродном остове обладают активностью поверхностно-активного вещества, например, повидон, поливиниловый спирт и моно- и полифункциональные соединения на основе простого гликолевого эфира. Длинноцепочечные соединения на основе жирных кислот образуют третью важную группу эмульгаторов и суспендирующих средств, которые можно использовать в этом изобретении.
Конкретные примеры подходящих поверхностно-активных веществ включают следующие.
1. Водорастворимые мыла, такие как натриевые, калиевые, аммониевые и алканол-аммониевые соли высших жирных кислот (C10-C22), в частности, натриевые и калиевые талловое и кокосовое мыла.
2. Анионные синтетические немыльные поверхностно-активные вещества, которые могут быть представлены водорастворимыми солями органических продуктов реакции с серной кислотой, содержащими в своей молекулярной структуре алкильный радикал, содержащий от приблизительно 8 до 22 атомов углерода, и радикал, выбранный из группы, состоящей из радикалов сложных эфиров сульфоновой кислоты и серной кислоты. Их примерами являются натриевые или калиевые алкилсульфаты, получаемые из таллового или кокосового масла; натриевые или калиевые алкилбензолсульфонаты; натриевые сульфонаты алкилового простого эфира глицерина; натриевые сульфонаты и сульфаты моноглицеридов жирных кислот кокосового масла; натриевые или калиевые соли серной кислоты сложных эфиров продукта реакции одного моля высшего жирного спирта и от приблизительно 1 до 6 молей этиленоксида; натриевые или калиевые сульфонаты алкилфенольного простого эфира с этиленоксидом с 1-10 единицами этиленоксида на молекулу и в котором алкильные радикалы содержат от 8 до 12 атомов углерода; продукт реакции жирных кислот, этерифицированных с изэтиновой кислотой и нейтрализованных гидроксидом натрия; натриевые или калиевые соли амидов жирных кислот с метилтауридом; и натриевые и калиевые соли SO3-сульфонированных C10-C24 α-олефинов.
3. Неионные синтетические поверхностно-активные вещества, получаемые конденсацией алкиленоксидных групп с органическим гидрофобным соединением. Общепринятые гидрофобные группы включают продукты конденсации пропиленоксида с пропиленгликолем, алкилфенолами, продукт конденсации пропиленоксида и этилендиамина, алифатические спирты с 8-22 атомами углерода и амиды жирных кислот.
4. Неионные поверхностно-активные вещества, такие как аминоксиды, фосфиноксиды и сульфоксиды, с семиполярными характеристиками. Конкретные примеры длинноцепочечных третичных аминоксидов включают диметилдодециламиноксид и бис-(2-гидроксиэтил)додециламин. Конкретные примеры фосфиноксидов приведены в патенте США № 3304263, опубликованном 14 февраля 1967 года, и включают диметилдодецилфосфиноксид и диметил(2-гидроксидодецил)фосфиноксид.
5. Длинноцепочечные сульфоксиды, включая соответствующие формуле R1-SO-R2, где R1 и R2 являются замещенными или незамещенными алкильными радикалами, где первый из них содержит от приблизительно 10 до приблизительно 28 атомов углерода, в то время как R2 содержит от 1 до 3 атомов углерода. Конкретные примеры этих сульфоксидов включают додецилметилсульфоксид и 3-гидрокситридецилметилсульфоксид.
6. Амфолитические синтетические поверхностно-активные вещества, такие как 3-додециламинопропионат натрия и 3-додециламинопропансульфонат натрия.
7. Цвиттерионные синтетические поверхностно-активные вещества, такие как 3-(N,N-диметил-N-гексадециламмонио)пропан-1-сульфонат и 3-(N,N-диметил-N-гексадециламмонио)-2-гидроксипропан-1-сульфонат.
Кроме того, в композиции по настоящему изобретению можно использовать все из следующих типов поверхностно-активных веществ: (a) мыла (т.е. щелочные соли) жирных кислот, смоляные кислоты и талловое масло; (b) алкилареновые сульфонаты; (c) алкилсульфаты, включая поверхностно-активные вещества с разветвленными и неразветвленными гидрофобными группами, а также первичные и вторичные сульфатные группы; (d) сульфаты и сульфонаты, содержащие промежуточную связь между гидрофобными и гидрофильными группами, например, ацилированные метилтауриды жирных кислот и сульфатированные моноглицериды жирных кислот; (e) длинноцепочечные кислые сложные эфиры полиэтиленгликоля, в особенности, сложные эфиры таллового масла; (f) простые эфиры полиэтиленгликоля и алкилфенолов; (g) простые эфиры полиэтиленгликоля длинноцепочечных спиртов и меркаптанов; и (h) ацилдиэтаноламиды жирных кислот. Т.к. поверхностно-активные вещества можно классифицировать несколькими способами, ряд классов поверхностно-активных веществ, приведенных этом параграфе, перекрывается с описываемыми выше классами поверхностно-активных веществ.
Существует ряд специально полученных и общеупотребительных в биологических условиях поверхностно-активных веществ. Такие поверхностно-активные вещества делят на четыре основных типа: анионные, катионные, цвиттерионные (амфотерные) и неионные. Примеры анионных поверхностно-активных веществ включают, например, перфтороктаноат (PFOA или PFO), перфтороктансульфонат (PFOS), алкилсульфатные соли, такие как додецилсульфат натрия (SDS) или лаурилсульфат аммония, лауретсульфат натрия (также известный как лауриловый простой эфир сульфата натрия, SLES), алкилбензолсульфонат и соли жирных кислот. Примеры катионных поверхностно-активных веществ включают, например, соли алкилтриметиламмония, такие как бромид цетилтриметиламмония (CTAB, или бромид гексадецилтриметиламмония), хлорид цетилпиридиния (CPC), полиэтоксилированный талловый амин (POEA), хлорид бензалкония (BAC), хлорид бензетония (BZT). Примеры цвиттерионных (амфотерных) поверхностно-активных веществ включают, например, додецилбетаин, кокамидопропилбетаин и кокоамфоглицинат. Примеры неионных поверхностно-активных веществ включают, например, алкил поли(этиленоксид), алкилфенол поли(этиленоксид), сополимеры поли(этиленоксида) и поли(пропиленоксида) (коммерческое название - полоксамеры или полоксамины), алкиловые полиглюкозиды (например, октилглюкозид или децилмальтозид), жирные спирты (например, цетиловый спирт или олеиловый спирт), кокамид MEA, кокамид DEA, Pluronic® F-68 (блок-сополимер полиоксиэтилен-полиоксипропилен) и полисорбаты, такие как Tween 20 (полисорбат 20), Tween 80 (полисорбат 80; моноолеат полиоксиэтиленсорбитана), додецилдиметиламиноксид и витамин E токоферола пропиленгликоль сукцинат (витамин E TPGS).
Особенно подходящей группой поверхностно-активных веществ являются неионные поверхностно-активные вещества на основе сорбитана. Эти поверхностно-активные вещества получают дегидратацией сорбита для получения 1,4-сорбитана, затем реагирующего с одним или несколькими эквивалентами жирной кислоты. Затем можно проводить реакцию остатка с заместителями-жирными кислотами с этиленоксидом для получения второй группы поверхностно-активных веществ.
Поверхностно-активные вещества с сорбитаном с заместителями-жирными кислотами получают реакцией 1,4-сорбитана с жирной кислотой, такой как лауриновая кислота, пальмитиновая кислота, стеариновая кислота, олеиновая кислота или аналогичная длинноцепочечная жирная кислота, для получения моноэфира 1,4-сорбитана, полуторного эфира 1,4-сорбитана или триэфира 1,4-сорбитана. Общепринятые названия этих поверхностно-активных веществ включают, например, монолаурат сорбитана, монопальмитат сорбитана, моностеарат сорбитана, моноолеат сорбитана, полуторный олеат сорбитана и триолеат сорбитана. Эти поверхностно-активные вещества коммерчески доступны под названием SPAN® или ARLACEL®, как правило, с буквенным или числовым обозначением, позволяющим отличать различные моно-, ди- и триэфирные замещенные сорбитаны.
Поверхностно-активные вещества SPAN® и ARLACEL® являются гидрофильными и, как правило, растворимыми или диспергируемыми в масле. Они также растворимы в большинстве органических растворителей. В воде они, как правило, нерастворимы, но диспергируемы. В основном, эти поверхностно-активные вещества будут иметь значение гидрофильно-липофильного баланса (HLB) от 1,8 до 8,6. Такие поверхностно-активные вещества можно легко получать известными в этой области способами, или они коммерчески доступны.
Родственная группа поверхностно-активных веществ включает моноэфиры полиоксиэтилена сорбитана и триэфиры полиоксиэтилена сорбитана. Эти материалы получают добавлением этиленоксида к моноэфиру или триэфиру 1,4-сорбитана. Добавление полиоксиэтилена превращает липофильное поверхностно-активное вещество моно- или триэфир сорбитана в гидрофильное поверхностно-активное вещество, как правило, растворимое или диспергируемое в воде и растворимое до определенной степени в органических жидкостях.
Эти материалы, коммерчески доступные под маркой TWEEN®, применимы для получения эмульсий "масло-в-воде" и дисперсий, или для солюбилизации масел и получения безводных водорастворимых или размываемых в воде мазей. Поверхностно-активные вещества TWEEN® можно комбинировать с родственными поверхностно-активными веществами моноэфирами или триэфирами сорбитана для повышения стабильности эмульсии. Как правило, поверхностно-активные вещества TWEEN® имеют значение HLB от 9,6 до 16,7. Поверхностно-активные вещества TWEEN® являются коммерчески доступными.
Третьей группой неионных поверхностно-активных средств, которые можно использовать в отдельности или в сочетании с поверхностно-активными веществами SPAN, ARLACEL® и TWEEN, являются полиоксиэтиленовые жирные кислоты, получаемые реакцией этиленоксида с длинноцепочечной жирной кислотой. Наиболее общепринятым доступным поверхностно-активным веществом этого типа является твердое вещество под названием MYRJS, и оно является полиоксиэтиленовым производным стеариновой кислоты. Поверхностно-активные вещества MYRJ® являются гидрофильными и растворимыми или диспергируемыми в воде, как поверхностно-активные вещества TWEEN®. Поверхностно-активные вещества MYRJ® можно смешивать с поверхностно-активными веществами TWEEN® или со смесями поверхностно-активных веществ TWEEN®/SPAN® или ARLACEL® для применения в получении эмульсий. Поверхностно-активные вещества MYRJ® можно получать известными в этой области способами, или они являются коммерчески доступными.
Четвертой группой неионных поверхностно-активных средств на основе полиоксиэтилена являются простые эфиры полиоксиэтилена и жирных кислот, полученные из лаурилового, ацетилового, стеарилового и олеилового спиртов. Эти материалы получают, как указано выше, добавлением этиленоксида к жирному спирту. Коммерческим названием этих поверхностно-активных веществ является BRIJ®. Поверхностно-активные вещества BRIJ® могут являться гидрофильными или липофильными в зависимости от размера остатка полиоксиэтилена в поверхностно-активном веществе. Несмотря на то, что в этой области известно получение этих соединений, они также легкодоступны из коммерческих источников.
Другие неионные поверхностно-активные средства, которые потенциально можно использовать, например, полиоксиэтилен, сложные эфиры жирной кислоты и многоатомного спирта, простой эфир полиоксиэтилена, простые эфиры полиоксипропилена и жирных кислот, производные пчелиного воска, содержащие полиоксиэтилен, производное полиоксиэтилена и ланолина, жирные глицериды полиоксиэтилена, сложные эфиры глицерина и жирных кислот или другие производные длинноцепочечных жирных кислот с 12-22 атомами углерода на основе acid alcohol или простого эфира полиоксиэтилен.
Т.к. эмульсии и составы по изобретению должны являться многофазными системами, предпочтительно выбирать образующее эмульсию неионное поверхностно-активное средство, имеющее значение HLB в диапазоне от приблизительно 7 до 16. Это значение можно получать с использованием одного неионного поверхностно-активного средства, такого как поверхностно-активное вещество TWEEN®, или его можно достигать с использованием смеси поверхностно-активных веществ, например, поверхностно-активного вещества на основе моно-, ди- или триэфира сорбитана; сложного эфира сорбитана, полиоксиэтилена и жирной кислоты; сложного эфира сорбитана в сочетании с поверхностно-активным веществом на основе полиоксиэтиленланолина; поверхностно-активного вещества сложного эфира сорбитана в сочетании с поверхностно-активным веществом простым эфиром полиоксиэтилена и жирной кислоты с высоким HLB; или поверхностно-активного вещества простого эфира полиэтилена и жирной кислоты или полиоксиэтилена, сорбитана и жирной кислоты.
В определенных вариантах осуществления эмульсия содержит одно неионное поверхностно-активное средство, в особенности, поверхностно-активное вещество TWEEN®, в качестве стабилизирующего эмульсию неионного поверхностно-активного вещества. В иллюстративном варианте осуществления эмульсия содержит TWEEN® 80, еще известный как полисорбат 80 или полиоксиэтилен 20 моноолеат сорбитана. В других вариантах осуществления эмульсия содержит два или более неионных поверхностно-активных средства, в частности, поверхностно-активное вещество TWEEN® и поверхностно-активное вещество SPAN®. В иллюстративном варианте осуществления эмульсия содержит TWEEN® 80 и SPAN®85.
Эмульсии "масло-в-воде" могут содержать от приблизительно 0,01% до приблизительно 2,5% поверхностно-активного вещества (об./об. или масс./об.), от приблизительно 0,01% до приблизительно 2% поверхностно-активного вещества, от 0,01% до приблизительно 1,5% поверхностно-активного вещества, от 0,01% до приблизительно 1% поверхностно-активного вещества, от 0,01% до приблизительно 0,5% поверхностно-активного вещества, от 0,05% до приблизительно 0,5% поверхностно-активного вещества, от 0,08% до приблизительно 0,5% поверхностно-активного вещества, приблизительно 0,08% поверхностно-активного вещества, приблизительно 0,1% поверхностно-активного вещества, приблизительно 0,2% поверхностно-активного вещества, приблизительно 0,3% поверхностно-активного вещества, приблизительно 0,4% поверхностно-активного вещества, приблизительно 0,5% поверхностно-активного вещества, приблизительно 0,6% поверхностно-активного вещества, приблизительно 0,7% поверхностно-активного вещества, приблизительно 0,8% поверхностно-активного вещества, приблизительно 0,9% поверхностно-активного вещества или приблизительно 1% поверхностно-активного вещества.
Альтернативно или дополнительно, эмульсии "масло-в-воде" могут содержать от 0,05% до приблизительно 1%, от 0,05% до приблизительно 0,9%, от 0,05% до приблизительно 0,8%, от 0,05% до приблизительно 0,7%, от 0,05% до приблизительно 0,6%, от 0,05% до приблизительно 0,5%, приблизительно 0,08%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, или приблизительно 1% Tween 80 (полисорбата 80; моноолеата полиоксиэтиленсорбитана).
В иллюстративном варианте осуществления эмульсия "масло-в-воде" содержит 0,08% Tween 80.
Альтернативно или дополнительно, эмульсии "масло-в-воде" могут содержать от 0,05% до приблизительно 1%, от 0,05% до приблизительно 0,9%, от 0,05% до приблизительно 0,8%, от 0,05% до приблизительно 0,7%, от 0,05% до приблизительно 0,6%, от 0,05% до приблизительно 0,5%, приблизительно 0,08%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, или приблизительно 1% SPAN85 (триолеата сорбитана).
Альтернативно или дополнительно, эмульсии "масло-в-воде" могут содержать комбинацию поверхностно-активных веществ, представленных в настоящем описании. Например, можно использовать комбинацию Tween 80 (полисорбата 80; моноолеата полиоксиэтиленсорбитана) и SPAN85 (триолеата сорбитана). Эмульсии могут содержать различные количества Tween 80 и SPAN85 (например, приведенные выше в качестве примеров), включая равные количества этих поверхностно-активных веществ. Например, эмульсии "масло-в-воде" могут содержать приблизительно 0,05% Tween 80 и приблизительно 0,05% SPAN85, приблизительно 0,1% Tween 80 и приблизительно 0,1% SPAN85, приблизительно 0,2% Tween 80 и приблизительно 0,2% SPAN85, приблизительно 0,3% Tween 80 и приблизительно 0,3% SPAN85, приблизительно 0,4% Tween 80 и приблизительно 0,4% SPAN85, приблизительно 0,5% Tween 80 и приблизительно 0,5% SPAN85, приблизительно 0,6% Tween 80 и приблизительно 0,6% SPAN85, приблизительно 0,7% Tween 80 и приблизительно 0,7% SPAN85, приблизительно 0,8% Tween 80 и приблизительно 0,8% SPAN85, приблизительно 0,9% Tween 80 и приблизительно 0,9% SPAN85, или приблизительно 1% Tween 80 и приблизительно 1,0% SPAN85.
В качестве поверхностно-активных веществ также можно использовать полиэтиленгликоль (PEG)-липиды, например, PEG, связанный с диалкилоксипропилами (PEG-DAA), PEG, связанный с диацилглицерином (PEG-DAG), PEG, связанный с фосфатидилэтаноламином (PE) (PEG-PE) или некоторыми другими фосфолипидами (PEG-фосфолипиды), PEG, конъюгированный с церамидами (PEG-Cer), или их комбинацию, (см., например, патент США № 5885613; патентные заявки США №№ 2003/0077829, 2005/0175682 и 2006/0025366). Другие подходящие PEG-липиды включают, например, PEG-диалкилоксипропиловые (DAA) липиды или PEG-диацилглицериновые (DAG) липиды. Примеры PEG-DAG липидов включают, например, PEG-дилауроилглицериновые (C12) липиды, PEG-димиристоилглицериновые (C14) липиды, PEG-дипальмитоилглицериновые (C16) липиды или PEG-дистеароилглицериновые (C18) липиды. Примеры PEG-DAA липидов включают, например, PEG-дилаурилоксипропиловые (C12) липиды, PEG-димиристилоксипропиловые (C14) липиды, PEG-дипальмитилоксипропиловые (C16) липиды или PEG-дистеарилоксипропиловые (C18) липиды.
PEG классифицируют по их молекулярным массам; например, PEG2000 имеет среднюю молекулярную массу приблизительно 2000 дальтон, и PEG5000 имеет среднюю молекулярную массу приблизительно 5000 дальтон. PEG являются коммерчески доступными в Sigma Chemicals Co., а также других компаниях и включают, например, следующие: монометоксиполиэтиленгликоль (MePEG-OH), монометоксиполиэтиленгликоль-сукцинат (MePEG-S), монометоксиполиэтиленгликоль-сукцинимидилсукцинат (MePEG-S-NHS), монометоксиполиэтиленгликоль-амин (MePEG-NH2), монометоксиполиэтиленгликоль-трезилат (MePEG-TRES) и монометоксиполиэтиленгликоль-имидазолил-карбонил (MePEG-IM). Кроме того, монометоксиполиэтиленгликоль-уксусная кислота (MePEG-CH2COOH) особенно подходит для получения конъюгатов PEG-липид, включая, например, конъюгаты PEG-DAA.
Предпочтительно, PEG имеет среднюю молекулярную массу от приблизительно 1000 до приблизительно 5000 дальтон (например, PEG1000, PEG2000, PEG3000, PEG4000, PEG5000). Необязательно, PEG можно замещать алкильной, алкокси, ацильной или арильной группой. PEG можно конъюгировать непосредственно с липидом или можно связывать с липидом через линкерный остаток. Можно использовать любой линкерный остаток, подходящий для соединения PEG с липидом, включая, например, не содержащие сложные эфиры линкерные остатки и содержащие сложные эфиры линкерные остатки.
В иллюстративных вариантах осуществления в качестве поверхностно-активного вещества используют PEG2000PE, PEG5000PE, PEG1000DMG, PEG2000DMG, PEG3000DMG или их комбинацию. В конкретных иллюстративных вариантах осуществления эмульсия "масло-в-воде" содержит от приблизительно 1 мг/мл до приблизительно 80 мг/мл PEG2000PE, PEG5000PE, PEG1000DMG, PEG2000DMG или PEG3000DMG.
Фосфолипиды
В определенных вариантах осуществления частицы катионной эмульсии "масло-в-воде" дополнительно содержат фосфолипид.
Фосфолипиды являются сложными эфирами жирных кислот, в которых спиртовой компонент молекулы содержит фосфатную группу. Фосфолипиды включают глицерофосфатиды (содержащие глицерин) и сфингомиелины (содержащие сфингозин). Примеры фосфолипидов включают фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и сфингомиелин; и синтетические фосфолипиды, содержащие димиристоилфосфатидилхолин, дипальмитоилфосфатидилхолин, дистеароилфосфатидилхолин, дистеароилфосфатидилглицерин, дипальмитоилфосфатидилглицерин, димиристоилфосфатидилсерин, дистеароилфосфатидилсерин и дипальмитоилсерин.
Можно использовать следующие примеры фосфолипидов.
В определенных вариантах осуществления предпочтительным может являться использование нейтрального липида. Также предпочтительным может являться использование фосфолипида, включая цвиттерионный фосфолипид, например, фосфолипид, содержащий один или несколько алкильных или алкенильных радикалов от приблизительно 12 до приблизительно 22 атомов углерода в длину (например, от приблизительно 12 до оприблизительно 14, до приблизительно 16, до приблизительно 18, до приблизительно 20, до приблизительно 22 атомов углерода), которые могут содержать, например, от 0 до 1, до 2, до 3 двойных связей. Предпочтительным может являться использование цвиттерионного фосфолипида.
Предпочтительные фосфолипиды включают, например, 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламин (DOPE), фосфатидилхолин яйца (PC яйца), пальмитоилолеилфосфатидилхолин (POPC), димиристоилфосфатидилхолин (DMPC), диолеоилфосфатидилхолин (DOPC), DPPC, дипальмитоилфосфатидилхолин (DPPC), пальмитоиллинолеилфосфатидилхолин (PLPC), DPyPE или их комбинацию.
В определенных вариантах осуществления фосфолипидом является DOPE. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл DOPE. Например, катионная эмульсия "масло-в-воде" может содержать DOPE в концентрации от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл или от приблизительно 1,5 мг/мл до приблизительно 7,5 мг/мл DOPE.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит приблизительно 1,5 мг/мл DOPE.
В определенных вариантах осуществления фосфолипидом является PC яйца. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл PC яйца. Например, катионная эмульсия "масло-в-воде" может содержать PC яйца в концентрации от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 10 мг/мл или от приблизительно 1,5 мг/мл до приблизительно 3,5 мг/мл PC яйца.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит приблизительно 1,55 мг/мл PC яйца.
В определенных вариантах осуществления фосфолипидом является DPyPE. Катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,1 мг/мл до приблизительно 20 мг/мл DPyPE. Например, катионная эмульсия "масло-в-воде" может содержать DPyPE в концентрации от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл, от приблизительно 1,5 мг/мл до приблизительно 10 мг/мл или от приблизительно 1,5 мг/мл до приблизительно 5 мг/мл DPyPE.
В иллюстративном варианте осуществления катионная эмульсия "масло-в-воде" содержит приблизительно 1,6 мг/мл DPyPE.
В определенных вариантах осуществления частицы эмульсии могут содержать комбинацию поверхностно-активного вещества и фосфолипида, представленных в настоящем описании.
D. Водная фаза (дисперсионная фаза)
Водной фазой (дисперсионной фазой) эмульсий "масло-в-воде" является буферизованный солевой раствор (например, физиологический раствор) или вода. Буферизованный солевой раствор является водным раствором, содержащим соль (например, NaCl), буфером (например, цитратным буфером), и может дополнительно содержать корректирующее осмоляльность средство (например, сахарид), полимер, поверхностно-активное вещество или их комбинацию. Если эмульсии составляют для парентерального введения, предпочтительно получать конечные буферизованные растворы таким образом, чтобы тоничность, т.е. осмоляльность по существу являлась той же, что и у нормальных физиологических жидкостей, для предотвращения нежелательных последствий введения, таких как отеки после введения или быстрое всасывание композиции. Также предпочтительно буферизовать водную фазу для поддержания pH, совместимого с нормальными физиологическими условиями. Также в конкретных случаях желательным может являться поддержание pH на конкретном уровне для обеспечения стабильности конкретных компонентов эмульсии.
Например, желательным может являться получение эмульсии, являющейся изотонической (т.е. с той же концентрацией проникающего растворенного вещества (например, соли), что и нормальные клетки организма и крови) и изоосмотической. Для контроля тоничности эмульсия может содержать физиологически приемлемую соль, такую как натриевая соль. Хлорид натрия (NaCl), например, можно использовать в концентрации приблизительно 0,9% (масс./об.) (физиологический раствор). Другие соли, которые могут присутствовать, включают хлорид калия, дигидрофосфат калия, дифосфат натрия, хлорид магния, хлорид кальция и т.д. Для контроля тоничности также можно использовать неионные модифицирующие тоничность средства. Как правило, в этой области известен ряд неионных модифицирующих тоничность средств. Как правило, они являются углеводами различных классификаций (см., например, Voet и Voet (1990) Biochemistry (John Wiley & Sons, New York). В качестве неионных модифицирующих тоничность средств в настоящем изобретении можно использовать моносахариды, классифицированные как альдозы, такие как глюкоза, манноза, арабиноза и рибоза, а также классифицируемые как кетозы, такие как фруктоза, сорбоза и ксилулоза. Также можно использовать дисахариды, такие как сахароза, мальтоза, трегалоза и лактоза. Кроме того, альдиты (ациклические полигидроксиспирты, также обозначаемые как сахарные спирты), такие как глицерин, маннит, ксилит и сорбит, являются неионными модифицирующими тоничность средствами, применимыми в настоящем изобретении. Неионные модифицирующие тоничность средства могут присутствовать в концентрации от приблизительно 0,1% до приблизительно 10% или от приблизительно 1% до приблизительно 10% в зависимости от используемого средства.
Водную фазу можно буферизовать. В настоящем описании можно использовать любой физиологически приемлемый буфер, такой как вода, цитратные буферы, фосфатные буферы, ацетатные буферы, Трис-буферы, бикарбонатные буферы, карбонатные буферы, сукцинатный буфер или т.п. pH водного компонента предпочтительно будет составлять 6,0-8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8. В иллюстративном варианте осуществления буфер является 10 мМ цитратным буфером с pH 6,5. В другом иллюстративном варианте осуществления водная фаза является несодержащей РНКазу водой или обработанной DEPC водой, или буфер получают с использованием такой воды. В некоторых случаях высокое содержание соли в буфере может мешать образованию комплексов отрицательно заряженной молекулы с частицей эмульсии, таким образом, предотвращая его. В других случаях в буфер можно включать определенное количество соли.
В иллюстративном варианте осуществления буфер является 10 мМ цитратным буфером с pH 6,5. В другом иллюстративном варианте осуществления водная фаза является несодержащей РНКазу водой или обработанной DEPC водой, или буфер получают с использованием такой воды.
Водная фаза также может содержать дополнительные компоненты, такие как молекулы, изменяющие осмолярность водной фазы, или молекулы, стабилизирующие отрицательно заряженную молекулу после образования комплексов. Предпочтительно, осмолярность водной фазы корректируют с использованием неионного модифицирующего тоничность средства, такого как сахар (например, трегалоза, сахароза, декстроза, фруктоза, восстановленная палатиноза и т.д.), сахарный спирт (такой как маннит, сорбит, ксилит, эритрит, лактитол, мальтитол, глицерин и т.д.) или их комбинаций. При желании можно использовать неионный полимер (например, поли(алкилгликоль), такой как полиэтиленгликоль, полипропиленгликоль или полибутиленгликоль) или неионное поверхностно-активное вещество.
В некоторых случаях чистая вода может являться предпочтительной в качестве водной фазы эмульсии, если исходно получают эмульсию. Например, повышение концентрации соли может затруднять достижение желаемого размера частиц (например, менее чем приблизительно 200 нм).
В определенных вариантах осуществления водная фаза катионной эмульсии "масло-в-воде" может дополнительно содержать полимер или поверхностно-активное вещество, или их комбинацию. В иллюстративном варианте осуществления эмульсия "масло-в-воде" содержит полоксамер. Полоксамеры являются неионными триблок-сополимерами с центральной гидрофобной цепью полиоксипропилена (поли(пропиленоксида)), фланкированной двумя гидрофильными цепями полиоксиэтилена (поли(этиленоксида)). Полоксамеры также известны под торговым названием полимеры Pluronic®. Полоксамерные полимеры могут приводить к большей стабильности и повышать устойчивость молекулы РНК к РНКазе после образования комплексов РНК.
Альтернативно или дополнительно, катионная эмульсия "масло-в-воде" может содержать от приблизительно 0,1% до приблизительно 20% (масс./об.) полимера или от приблизительно 0,05% до приблизительно 10% (масс./об.) полимера. Например, катионная эмульсия "масло-в-воде" может содержать полимер (например, полоксамер, такой как Pluronic® F127) в концентрации от приблизительно 0,1% до приблизительно 20% (масс./об.), от приблизительно 0,1% до приблизительно 10% (масс./об.), от приблизительно 0,05% до приблизительно 10% (масс./об.) или от приблизительно 0,05% до приблизительно 5% (масс./об.).
В иллюстративном варианте осуществления эмульсия "масло-в-воде" содержит приблизительно 4% (масс./об.) или приблизительно 8% (масс./об.) Pluronic® F127.
Количество водного компонента, используемого в этих композициях, будет являться количеством, необходимым для доведения значения композиции до единицы. Т.е. количество водного компонента, достаточное для получения 100%, будут смешивать с другими указанными выше компонентами для доведения объема композиций.
4. Отрицательно заряженные молекулы
Если доставке подлежит отрицательно заряженная молекула, она может находиться в комплексе с частицами катионных эмульсий "масло-в-воде". Отрицательно заряженная молекула находится в комплексе с частицами эмульсии, например, посредством взаимодействий между отрицательно заряженной молекулой и катионным липидом на поверхности частиц, а также гидрофобных/гидрофильных взаимодействий между отрицательно заряженной молекулой и поверхностью частиц. Хотя, не желая быть связанными какой-либо конкретной теорией, полагают, что отрицательно заряженные молекулы взаимодействуют с катионным липидом посредством нековалентных ионных взаимодействий (электростатических сил), и сила комплекса, а также количество отрицательно заряженного соединения, которое может находиться в комплексе с частицей, относится к количеству катионного липида в частице. Кроме того, в этом также могут играть роль гидрофобные/гидрофильные взаимодействия между отрицательно заряженной молекулой и поверхностью частиц.
Примеры отрицательно заряженных молекул включают отрицательно заряженные пептиды, полипептиды или белки, молекулы нуклеиновой кислоты (например, одноцепочечные или двуцепочечные РНК или ДНК), низкомолекулярные соединения (например, низкомолекулярные иммуностимуляторы (SMIP), фосфонат, фторфосфонат и т.д.) и т.п. В предпочтительных аспектах отрицательно заряженной молекулой является молекула РНК, такая как РНК, кодирующая пептид, полипептид или белок, включая самореплицирующиеся молекулы РНК, или малая интерферирующая РНК.
Комплекс можно получать с использованием известных в этой области способов, примеры которых представлены в настоящем описании. Например, комплекс нуклеиновая кислота-частица можно получать смешиванием катионной эмульсии с молекулой нуклеиновой кислоты, например, перемешиванием на центрифуге типа вортекс. Для обеспечения желаемой силы связывания и связывающей способности можно корректировать или оптимизировать количество отрицательно заряженной молекулы и катионного липида в эмульсиях.
Например, как приведено и представлено в виде примеров в настоящем описании, получали примеры комплексов РНК-частица, варьируя соотношения РНК:катионный липид (измеряемые как "соотношение N/P"). Термин соотношение N/P относится к количеству (в молях) протонируемых атомов азота в катионном липиде, разделенному на количество (в молях) фосфатов в РНК. Предпочтительные соотношения N/P составляют от приблизительно 1:1 до приблизительно 20:1, от приблизительно 2:1 до приблизительно 18:1, от приблизительно 3:1 до 16:1, от приблизительно 4:1 до приблизительно 14:1, от приблизительно 6:1 до приблизительно 12:1, приблизительно 3:1, приблизительно 4:1, приблизительно 5:1, приблизительно 6:1, приблизительно 7:1, приблизительно 8:1, приблизительно 9:1, приблизительно 10:1, приблизительно 11:1, приблизительно 12:1, приблизительно 13:1, приблизительно 14:1, приблизительно 15:1 или приблизительно 16:1. Альтернативно, предпочтительные соотношения N/P составляют по меньшей мере приблизительно 3:1, по меньшей мере приблизительно 4:1, по меньшей мере приблизительно 5:1, по меньшей мере приблизительно 6:1, по меньшей мере приблизительно 7:1, по меньшей мере приблизительно 8:1, по меньшей мере приблизительно 9:1, по меньшей мере приблизительно 10:1, по меньшей мере приблизительно 11:1, по меньшей мере приблизительно 12:1, по меньшей мере приблизительно 13:1, по меньшей мере приблизительно 14:1, по меньшей мере приблизительно 15:1 или по меньшей мере приблизительно 16:1. Более предпочтительное соотношение N/P составляет приблизительно 4:1 или выше.
Для получения желаемых эффектов (например, желаемый уровень экспрессии находящейся в комплексе РНК) каждая эмульсия может иметь свое собственное оптимальное или предпочтительное соотношение N/P, которое можно определять экспериментально (например, с использованием анализов, представленных в настоящем описании, или других способов, известных в этой области, таких как измерение уровня экспрессии белка, кодируемого РНК, или измерение процентной доли молекул РНК, высвобождаемых из комплекса в присутствии гепарина). Как правило, соотношение N/P должно представлять собой такую величину, при которой по меньшей мере приблизительно 5%, приблизительно 10%, приблизительно 15%, приблизительно 20%, приблизительно 25%, приблизительно 30%, приблизительно 35%, приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90% или приблизительно 95% молекул РНК высвобождается из комплексов РНК-частица, когда комплексы РНК-частица подвергаются захвату клетками. Предпочтительным является соотношение N/P по меньшей мере 4:1.
Катионные эмульсии "масло-в-воде", представленные в настоящем описании, в частности, подходят для составления вакцин на основе нуклеиновых кислот (например, ДНК-вакцин, РНК-вакцин). Образование комплекса нуклеиновая кислота-частица эмульсии облегчает захват нуклеиновой кислоты клетками-хозяевами и защищает молекулу нуклеиновой кислоты от деградации нуклеазами. Затем трансфицированные клетки могут экспрессировать антиген, кодируемый молекулой нуклеиновой кислоты, который может вызывать иммунный ответ на антиген. Подобно живым или ослабленным вирусам вакцины на основе нуклеиновых кислот могут эффективно вовлекать пути MHC-I и MHC-II, делая возможной индукцию CD8+ и CD4+ T-клеточных ответов, в то время как антиген, присутствующий в растворимой форме, такой как рекомбинантный белок, как правило, индуцирует только гуморальные ответы.
Последовательность молекулы РНК может являться кодон-оптимизированной или неоптимизированной для экспрессии в желаемом хозяине, таком как клетка человека.
В определенных вариантах осуществления отрицательно заряженная молекула, представленная в настоящем описании, является молекулой РНК. В определенных вариантах осуществления молекула РНК кодирует антиген (пептид, полипептид или белок), и катионная эмульсия "масло-в-воде" подходит для использования в качестве вакцины на основе РНК. Композиция может содержать несколько молекул РНК, кодирующих антиген, например, две, три, пять или десять молекул РНК, находящихся в комплексе с частицами эмульсии. Т.е. композиция может содержать один или несколько различных типов молекул РНК, каждая из которых кодирует различный антиген. Альтернативно или дополнительно, одна молекула РНК также может кодировать несколько антигенов, например, бицистронная или трицистронная молекула РНК, кодирующая различные или идентичные антигены. Таким образом, катионная эмульсия "масло-в-воде" подходит для использования в качестве вакцины на основе РНК, являющейся моновалентной или мультивалентной.
При желании, последовательность молекулы РНК можно модифицировать, например, для повышения эффективности экспрессии или репликации РНК или для обеспечения дополнительной стабильности или устойчивости к деградации. Например, последовательность РНК можно модифицировать в отношении частоты использования кодона, например, для повышения эффективности трансляции и времени полужизни РНК. Поли-A-хвост (например, из приблизительно 30 остатков аденозина или более) можно прикреплять к 3’-концу РНК для повышения ее времени полужизни. 5’-Конец РНК можно кэпировать модифицированным рибонуклеотидом со структурой m7G (5’)ppp(5’)N (структура кэп 0) или его производным, которое можно встраивать при синтезе РНК или его можно ферментативно конструировать после транскрипции РНК (например, с использованием фермента кэпирования вируса Vaccinia (VCE), состоящего из трифосфатазы мРНК, гуанилилтрансферазы и гуанин-7-метилтрансферазы, катализирующих конструирование N7-монометилированной структуры кэп 0). Структура кэп 0 играет важную роль в поддержании стабильности и эффективности трансляции молекулы РНК. 5’-кэп молекулы РНК можно дополнительно модифицировать 2’-O-метилтрансферазой, вызывающей образование структуры кэп 1 (m7Gppp[m2’-Ο]N), которая может дополнительно повышать эффективность трансляции.
При желании, молекула РНК может содержать один или несколько модифицированных нуклеотидов. Они могут дополнять любую структуру 5’-кэпа. Существует более 96 модификаций природных нуклеозидов, обнаруживаемых в РНК млекопитающих. См., например, Limbach et al., Nucleic Acids Research, 22(12): 2183-2196 (1994). Получение нуклеотидов и модифицированных нуклеотидов и нуклеозидов хорошо известны в этой области, например, из патентов США №№ 4373071, 4458066, 4500707, 4668777, 4973679, 5047524, 5132418, 5153319, 5262530, 5700642, все из которых включены в настоящее описание посредством ссылки в полном объеме, и многие модифицированные нуклеозиды и модифицированные нуклеотиды являются коммерчески доступными.
Модифицированные нуклеиновые основания, которые можно встраивать в модифицированные нуклеозиды и нуклеотиды и которые могут присутствовать в молекулах РНК, включают: m5C (5-метилцитидин), m5U (5-метилуридин), m6A (N6-метиладенозин), s2U (2-тиоуридин), Um (2’-О-метилуридин), m1A (1-метиладенозин); m2A (2-метиладенозин); Am (2-1-O-метиладенозин); ms2m6A (2-метилтио-N6-метиладенозин); i6A (N6-изопентениладенозин); ms2i6A (2-метилтио-N6-изопентениладенозин); io6A (N6-(цис-гидроксиизопентенил)аденозин); ms2io6A (2-метилтио-N6-(цис-гидроксиизопентенил)аденозин); g6A (N6-глицинилкарбамоиладенозин); t6A (N6-треонилкарбамоиладенозин); ms2t6A (2-метилтио-N6-треонилкарбамоиладенозин); m6t6A (N6-метил-N6-треонилкарбамоиладенозин); hn6A (N6-гидроксинорвалилкарбамоиладенозин); ms2hn6A (2-метилтио-N6-гидроксинорвалилкарбамоиладенозин); Ar(p) (2’-O-рибозиладенозин (фосфат)); I (инозин); m1I (1-метилинозин); m’Im (1,2’-O-диметилинозин); m3C (3-метилцитидин); Cm (2T-O-метилцитидин); s2C (2-тиоцитидин); ac4C (N4-ацетилцитидин); f5C (5-фоннилцитидин); m5Cm (5,2-O-диметилцитидин); ac4Cm (N4-ацетил-2TO-метилцитидин); k2C (лизидин); m1G (1-метилгуанозин); m2G (N2-метилгуанозин); m7G (7-метилгуанозин); Gm (2’-O-метилгуанозин); m22G (N2,N2-диметилгуанозин); m2Gm (N2,2’-O-диметилгуанозин); m22Gm (N2,N2,2’-O-триметилгуанозин); Gr(p) (2’-O-рибозилгуанозин (фосфат)); yW (вибутозин); o2yW (пероксивибутозин); OHyW (гидроксивибутозин); OHyW* (немодифицированный гидроксивибутозин); imG (виозин); mimG (метилгуанозин); Q (квеуозин); oQ (эпоксиквеуозин); galQ (галактозил-квеуозин); manQ (маннозил-квеуозин); preQo (7-циано-7-деазагуанозин); preQi (7-аминометил-7-деазагуанозин); G* (археозин); D (дигидроуридин); m5Um (5,2’-O-диметилуридин); s4U (4-тиоуридин); m5s2U (5-метил-2-тиоуридин); s2Um (2-тио-2’-O-метилуридин); acp3U (3-(3-амино-3-карбоксипропил)уридин); ho5U (5-гидроксиуридин); mo5U (5-метоксиуридин); cmo5U (уридин-5-оксиуксусная кислота); mcmo5U (метиловый сложный эфир уридин-5-оксиуксусной кислоты); chm5U (5-(карбоксигидроксиметил)уридин)); mchm5U (метиловый сложный эфир 5-(карбоксигидроксиметил)уридина); mcm5U (5-метоксикарбонилметилуридин); mcm5Um (S-метоксикарбонилметил-2-O-метилуридин); mcm5s2U (5-метоксикарбонилметил-2-тиоуридин); nm5s2U (5-аминометил-2-тиоуридин); mnm5U (5-метиламинометилуридин); mnm5s2U (5-метиламинометил-2-тиоуридин); mnm5se2U (5-метиламинометил-2-селеноуридин); ncm5U (5-карбамоилметилуридин); ncm5Um (5-карбамоилметил-2’-O-метилуридин); cmnm5U (5-карбоксиметиламинометилуридин); cnmm5Um (5-карбоксиметиламинометил-2-L-O-метилуридин); cmnm5s2U (5-карбоксиметиламинометил-2-тиоуридин); m62A (N6,N6-диметиладенозин); Tm (2’-O-метилинозин); m4C (N4-метилцитидин); m4Cm (N4,2-O-диметилцитидин); hm5C (5-гидроксиметилцитидин); m3U (3-метилуридин); cm5U (5-карбоксиметилуридин); m6Am (N6,T-O-диметиладенозин); rn62Am (N6,N6,O-2-триметиладенозин); m2’7G (N2,7-диметилгуанозин); m2’2’7G (N2,N2,7-триметилгуанозин); m3Um (3,2T-O-диметилуридин); m5D (5-метилдигидроуридин); f5Cm (5-формил-2’-O-метилцитидин); mlGm (1,2’-O-диметилгуанозин); m’Am (1,2-O-диметиладенозин)иринометилуридин); tm5s2U (S-тауринометил-2-тиоуридин)); imG-14 (4-диметилгуанозин); imG2 (изогуанозин); ac6A (N6-ацетиладенозин), гипоксантин, инозин, 8-оксоаденин, его 7-замещенные производные, дигидроурацил, псевдоурацил, 2-тиоурацил, 4-тиоурацил, 5-аминоурацил, 5-(C1-C6)-алкилурацил, 5-метилурацил, 5-(C2-C6)-алкенилурацил, 5-(C2-C6)-алкинилурацил, 5-(гидроксиметил)урацил, 5-хлорурацил, 5-фторурацил, 5-бромурацил, 5-гидроксицитозин, 5-(C1-C6)-алкилцитозин, 5-метилцитозин, 5-(C2-C6)-алкенилцитозин, 5-(C2-C6)-алкинилцитозин, 5-хлорцитозин, 5-фторцитозин, 5-бромцитозин, N2-диметилгуанин, 7-деазагуанин, 8-азагуанин, 7-деаза-7-замещенный гуанин, 7-деаза-7-(C2-C6)алкинилгуанин, 7-деаза-8-замещенный гуанин, 8-гидроксигуанин, 6-тиогуанин, 8-оксогуанин, 2-аминопурин, 2-амино-6-хлорпурин, 2,4-диаминопурин, 2,6-диаминопурин, 8-азапурин, замещенный 7-деазапурин, 7-деаза-7-замещенный пурин, 7-деаза-8-замещенный пурин, водород (абазический остаток), m5C, m5U, m6A, s2U, W или 2’-O-метил-U. Многие из этих модифицированных нуклеиновых оснований и соответствующие им рибонуклеозиды доступны у коммерческих поставщиков. См., например, WO 2011/005799, включенный в настоящее описание посредством ссылки.
РНК, используемая в изобретении, теоретически включает только фосфодиэфирные связи между нуклеозидами, но в некоторых вариантах осуществления она может содержать фосфоамидатные, фосфотиоатные и/или метилфосфонатные связи.
В некоторых вариантах осуществления молекула РНК не включает модифицированные нуклеотиды, например, не включает модифицированные нуклеиновые основания, и все нуклеотиды в молекуле РНК являются общепринятыми стандартными рибонуклеотидами A, U, G и C, за исключением необязательного 5’-кэпа, который может включать, например, 7-метилгуанозин. В других вариантах осуществления РНК может включать 5’-кэп, содержащий 7’-метилгуанозин, и первые 1, 2 или 3 5’-рибонуклеотидов могут являться метилированными в 2’-положении рибозы.
A. Самореплицирующаяся РНК
В некоторых аспектах катионная эмульсия "масло-в-воде" содержит самореплицирующуюся молекулу РНК. В определенных вариантах осуществления самореплицирующуюся молекулу РНК получают из альфавируса, или она основана на альфавирусе.
Самореплицирующиеся молекулы РНК хорошо известны в этой области, и их можно получать с использованием репликационных элементов, получаемых, например, из альфавирусов и замещающих структурные вирусные белки нуклеотидной последовательностью, кодирующей интересующий белок. Самореплицирующаяся молекула РНК, как правило, является молекулой с (+)-цепью, которая может транслироваться непосредственно после доставки в клетку, и эта трансляция обеспечивает образование РНК-зависимой РНК-полимеразы, которая затем продуцирует антисмысловой и смысловой транскрипты из доставленной РНК. Таким образом, доставленная РНК приводит к продукции многочисленных дочерних РНК. Эти дочерние РНК, а также коллинеарные субгеномные транскрипты могут транслироваться сами по себе для обеспечения экспрессии кодируемого антигена in situ или могут транскрибироваться для получения дополнительных транскриптов того же направления, что и доставляемая РНК, транслируемых для обеспечения экспрессии антигена in situ. Общим результатом этих последовательных транскрипций является обширная амплификация количества встроенного репликона РНК, и, таким образом, кодируемый антиген становится основным полипептидным продуктом клеток. Клетки, трансфицированные самореплицирующейся РНК, быстро продуцируют антиген перед апоптотической гибелью. Эта гибель является вероятным результатом действия необходимых промежуточных двухцепочечных (дц) РНК, которые, как показано, также сверхактивируют дендритные клетки. Таким образом, повышенная иммуногенность самореплицирующейся РНК может являться результатом продукции провоспалительной дцРНК, имитируя инфицирование РНК-вирусом клеток-хозяев.
Преимущественно, самореплицирующиеся молекулы РНК используют аппарат клетки для экспоненциального повышения кодируемых продукты генов, таких как белки или антигены, которые могут накапливаться в клетках или секретироваться из клеток. Сверхэкспрессия белков с помощью самореплицирующихся молекул РНК обладает преимуществом по сравнению с иммуностимулирующими адъювантными эффектами, включая стимуляцию Toll-подобных рецепторов (TLR) 3, 7 и 8 и не-TLR путей (например, RIG-1, MD-5) посредством продуктов репликации и амплификации РНК, и трансляции, индуцирующей апоптоз трансфицированной клетки.
Как правило, самореплицирующаяся РНК содержит по меньшей мере один или несколько генов, выбранных из группы, состоящей из вирусных репликаз, вирусных протеаз, вирусных хеликаз и других неструктурных вирусных белков, а также содержат 5’- и 3’-концевые цис-активные репликационные последовательности и, при желании, гетерологичные последовательности, кодирующие желаемые аминокислотные последовательности (например, интересующий антиген). В самореплицирующуюся РНК можно включать субгеномный промотор, направляющий экспрессию гетерологичной последовательности. При желании, гетерологичную последовательность (например, интересующий антиген) можно подвергать слиянию в рамке считывания с другими кодирующими областями в самореплицирующейся РНК, и/или она может находиться под контролем внутреннего участка связывания рибосомы (IRES).
В определенных вариантах осуществления самореплицирующуюся молекулу РНК не инкапсулируют в вирусоподобную частицу. Самореплицирующиеся молекулы РНК по изобретению можно конструировать таким образом, что самореплицирующаяся молекула РНК не может индуцировать продукцию инфекционных вирусных частиц. Этого можно достигать, например, исключением одного или нескольких вирусных генов, кодирующих структурные белки, необходимые для продукции вирусных частиц в самореплицирующейся РНК. Например, если самореплицирующаяся молекула РНК основана на альфавирусе, таком как вирус Синдбис (SIN), вирус леса Семлики и вирус венесуэльского энцефалита лошадей (VEE), можно исключать один или несколько генов, кодирующих вирусные структурные белки, такие как гликопротеины капсида и/или оболочки.
При желании, самореплицирующиеся молекулы РНК по изобретению также можно конструировать так, чтобы они индуцировали продукцию инфекционных вирусных частиц, ослабленных или вирулентных, или для продукции вирусных частиц, способных к одному раунду последующей инфекции.
Одной подходящей системой для достижения саморепликации таким путем является использование репликона на основе альфавирусов. Альфавирусы содержат набор генетически, структурно и серологически родственных артропонозных вирусов семейства Togaviridae. В роду альфавирус классифицируют двадцать шесть известных вирусов и подтипов вирусов, включая, вирус Синдбис, вирус леса Семлики, вирус реки Росс и вирус венесуэльского энцефалита лошадей. В связи с этим, самореплицирующаяся РНК по изобретению может включать РНК-репликазу, полученную из вируса леса Семлики (SFV), вируса Синдбис (SIN), вируса венесуэльского энцефалита лошадей (VEE), вируса реки Росс (RRV), вируса восточного энцефалита лошадей или других вирусов, принадлежащих семейству альфавирусов.
В изобретении можно использовать "репликонные" экспрессирующие векторы на основе альфавируса. Репликонные векторы можно использовать в нескольких форматах, включая ДНК, РНК и рекомбинантные репликонные частицы. Такие репликонные векторы получают из альфавирусов, включая, например, вирус Синдбис (Xiong et al. (1989) Science 243: 1188-1191; Dubensky et al., (1996) J. Virol. 70: 508-519; Hariharan et al. (1998) J. Virol. 72: 950-958; Polo et al. (1999) PNAS 96: 4598-4603), вирус леса Семлики (Liljestrom (1991) Bio/Technology 9: 1356-1361; Berglund et al. (1998) Nat. Biotech. 16: 562-565) и вирус венесуэльского энцефалита лошадей (Pushko et al. (1997) Virology 239: 389-401). Как правило, репликоны на основе альфавирусов довольно схожи по общим характеристикам (например, структуре, репликации), отдельные альфавирусы могут проявлять некоторые особенные свойства (например, связывание рецептора, чувствительность к интерферону и профиль заболевания), являющиеся уникальными. Таким образом, также применимыми могут являться химерные альфавирусные репликоны, получаемые из разных семейств вирусов.
Как правило, РНК-репликоны на основе альфавируса являются РНК с (+)-цепью, приводящие к трансляции репликазы (или репликазы-транскриптазы) после доставки в клетку. Репликаза транслируется как полипротеин, саморасщепляющийся для получения репликационного комплекса, производящего геномные копии с (-)-цепью доставленной РНК с (+)-цепью. Эти транскрипты с (-)-цепью могут транскрибироваться сами по себе для получения дополнительных копий родительской РНК с (+)-цепью, а также для получения субгеномного транскрипта, кодирующего антиген. Таким образом, трансляция субгеномного транскрипта приводит к экспрессии антигена in situ инфицированной клеткой. Подходящие альфавирусные репликоны могут использовать репликазу вируса Синдбис, вируса леса Семлики, вируса восточного энцефалита лошадей, вируса венесуэльского энцефалита лошадей и т.д.
Предпочтительно, РНК-репликон содержит РНК-геном пикорнавируса, тогавируса, флавивируса, коронавируса, парамиксовируса, вируса желтой лихорадки или альфавируса (например, вируса Синдбис, вируса леса Семлики, вируса венесуэльского энцефалита лошадей или вируса реки Росс), модифицированный посредством замещения одного или нескольких генов структурных белков выбранной гетерологичной последовательностью нуклеиновой кислоты, кодирующей интересующий продукт.
Предпочтительный репликон кодирует (i) РНК-зависимую РНК полимеразу, которая может транскрибировать РНК из репликона, и (ii) антиген. Полимераза может являться альфавирусной репликазой, например, содержащей один или несколько альфавирусных белков nsP1, nsP2, nsP3 и nsP4. В то время как природные геномы альфавирусов кодируют структурные белки вириона в дополнение к неструктурному полипротеину репликазы, предпочтительно, чтобы репликон не кодировал структурные белки альфавирусов. Таким образом, предпочтительный репликон может приводить к продукции копий самой геномной РНК в клетке, но не к продукции РНК-содержащих вирионов. Неспособность продуцировать эти вирионы означает, что, в отличие от альфавируса дикого типа, предпочтительный репликон не может закрепляться в инфекционной форме. Структурные белки альфавирусов, необходимые для закрепления в вирусах дикого типа, отсутствуют в предпочтительном репликоне, и их место занимают гены, кодирующие интересующий антиген таким образом, что субгеномный транскрипт чаще кодирует антиген, чем структурные белки вириона альфавируса.
Применимый в изобретении репликон может иметь две открытые рамки считывания. Первая (5’) открытая рамка считывания кодирует репликазу; вторая (3’) открытая рамка считывания кодирует антиген. В некоторых вариантах осуществления РНК может иметь дополнительные (например, нижележащие) открытые рамки считывания, например, для кодирования дополнительных антигенов или для кодирования акцессорных полипептидов.
Предпочтительный репликон имеет 5’-кэп (например, 7-метилгуанозин), который часто может усиливать трансляцию РНК in vivo. В некоторых вариантах осуществления 5’-последовательность репликона может нуждаться в селекции для обеспечения совместимости с кодируемой репликазой.
Репликон может иметь 3’-поли-A-хвост. Он также может включать распознающую полимеразу поли-A-последовательность (например, AAUAAA) около своего 3’-конца.
Репликоны могут иметь разную длину, но, как правило, они составляют 5000-25000 нуклеотидов в длину, например, 8000-15000 нуклеотидов или 9000-12000 нуклеотидов.
Репликон можно удобно получать транскрипцией in vitro (IVT). В IVT можно использовать матрицу (кДНК), получаемую и накапливаемую в плазмидной форме в бактериях, или получать синтетически (например, способами конструирования с синтезом генов и/или полимеразной цепной реакцией (ПЦР)). Например, для транскрипции репликона с матрицы ДНК можно использовать ДНК-зависимую РНК-полимеразу (такую как РНК полимеразы бактериофага T7, T3 или SP6). При необходимости можно использовать подходящие реакции кэпирования и добавления поли-A-хвоста (хотя, как правило, поли-A-хвост репликона кодируется матрицей ДНК). Эти РНК-полимеразы могут обладать строгими требованиями к транскрибируемым 5’-нуклеотидам, и в некоторых вариантах осуществления эти требования должны совпадать с требованиями кодируемой репликазы для обеспечения того, чтобы IVT-транскрибируемая РНК могла эффективно функционировать в качестве субстрата для своей самокодируемой репликазы. Конкретные примеры включают плазмиды на основе вируса Синдбис (pSIN), такие как pSINCP, описываемые, например, в патентах США №№ 5814482 и 6015686, а также в международных публикациях №№ WO 97/38087, WO 99/18226 и WO 02/26209. Конструирование таких репликонов, в общем, описывают в патентах США №№ 5814482 и 6015686.
В других аспектах самореплицирующуюся молекулу РНК получают из иного, чем альфавирус, вируса, или она является молекулой на основе вируса, иного, чем альфавирус, предпочтительно РНК-вируса с положительной цепью, и более предпочтительно пикорнавируса, флавивируса, рубивируса, пестивируса, гепацивируса, калицивируса или коронавируса. Подходящие последовательности альфавируса дикого типа хорошо известны и доступны в хранилищах последовательностей, таких как American Type Culture Collection, Rockville, Md. Характерные примеры подходящих альфавирусов включают аура-вирус (ATCC VR-368), вирус Бебару (ATCC VR-600, ATCC VR-1240), вирус Кабассу (ATCC VR-922), вирус чикунгунья (ATCC VR-64, ATCC VR-1241), вирус восточного энцефаломиелита лошадей (ATCC VR-65, ATCC VR-1242), вирус Форт Морган (ATCC VR-924), вирус Гета (ATCC VR-369, ATCC VR-1243), вирус Кызылагаш (ATCC VR-927), вирус Маяро (ATCC VR-66), вирус маяро (ATCC VR-1277), вирус Миддлбург (ATCC VR-370), вирус Мукамбо (ATCC VR-580, ATCC VR-1244), вирус ндуму (ATCC VR-371), вирус Пиксуна (ATCC VR-372, ATCC VR-1245), вирус реки Росс (ATCC VR-373, ATCC VR-1246), вирус леса Семлики (ATCC VR-67, ATCC VR-1247), вирус Синдбис (ATCC VR-68, ATCC VR-1248), вирус Тонате (ATCC VR-925), вирус Тринити (ATCC VR-469), вирус Уна (ATCC VR-374), вирус венесуэльского энцефаломиелита лошадей (ATCC VR-69, ATCC VR-923, ATCC VR-1250, ATCC VR-1249, ATCC VR-532), вирус восточного энцефаломиелита лошадей (ATCC VR-70, ATCC VR-1251, ATCC VR-622, ATCC VR-1252), вирус Ватароа (ATCC VR-926) и Y-62-33 (ATCC VR-375).
Самореплицирующиеся молекулы РНК по изобретению больше, чем другие типы РНК (например, мРНК), получаемые с использованием модифицированных нуклеотидов. Как правило, самореплицирующиеся молекулы РНК по изобретению содержат по меньшей мере приблизительно 4 т.п.н. Например, самореплицирующаяся РНК может содержать по меньшей мере приблизительно 5 т.п.н., по меньшей мере приблизительно 6 т.п.н., по меньшей мере приблизительно 7 т.п.н., по меньшей мере приблизительно 8 т.п.н., по меньшей мере приблизительно 9 т.п.н., по меньшей мере приблизительно 10 т.п.н., по меньшей мере приблизительно 11 т.п.н., по меньшей мере приблизительно 12 т.п.н. или больше 12 т.п.н. В конкретных примерах самореплицирующаяся РНК составляет от приблизительно 4 т.п.н. до приблизительно 12 т.п.н., от приблизительно 5 т.п.н. до приблизительно 12 т.п.н., от приблизительно 6 т.п.н. до приблизительно 12 т.п.н., от приблизительно 7 т.п.н. до приблизительно 12 т.п.н., от приблизительно 8 т.п.н. до приблизительно 12 т.п.н., от приблизительно 9 т.п.н. до приблизительно 12 т.п.н., от приблизительно 10 т.п.н. до приблизительно 12 т.п.н., от приблизительно 11 т.п.н. до приблизительно 12 т.п.н., от приблизительно 5 т.п.н. до приблизительно 11 т.п.н., от приблизительно 5 т.п.н. до приблизительно 10 т.п.н., от приблизительно 5 т.п.н. до приблизительно 9 т.п.н., от приблизительно 5 т.п.н. до приблизительно 8 т.п.н., от приблизительно 5 т.п.н. до приблизительно 7 т.п.н., от приблизительно 5 т.п.н. до приблизительно 6 т.п.н., от приблизительно 6 т.п.н. до приблизительно 12 т.п.н., от приблизительно 6 т.п.н. до приблизительно 11 т.п.н., от приблизительно 6 т.п.н. до приблизительно 10 т.п.н., от приблизительно 6 т.п.н. до приблизительно 9 т.п.н., от приблизительно 6 т.п.н. до приблизительно 8 т.п.н., от приблизительно 6 т.п.н. до приблизительно 7 т.п.н., от приблизительно 7 т.п.н. до приблизительно 11 т.п.н., от приблизительно 7 т.п.н. до приблизительно 10 т.п.н., от приблизительно 7 т.п.н. до приблизительно 9 т.п.н., от приблизительно 7 т.п.н. до приблизительно 8 т.п.н., от приблизительно 8 т.п.н. до приблизительно 11 т.п.н., от приблизительно 8 т.п.н. до приблизительно 10 т.п.н., от приблизительно 8 т.п.н. до приблизительно 9 т.п.н., от приблизительно 9 т.п.н. до приблизительно 11 т.п.н., от приблизительно 9 т.п.н. до приблизительно 10 т.п.н. или от приблизительно 10 т.п.н. до приблизительно 11 т.п.н.
Самореплицирующиеся молекулы РНК по изобретению могут содержать один или несколько типов модифицированных нуклеотидов (например, псевдоуридин, N6-метиладенозин, 5-метилцитидин, 5-метилуридин).
Самореплицирующаяся молекула РНК может кодировать один гетерологичный полипептидный антиген или, необязательно, два или более гетерологичных полипептидных антигенов, соединенных вместе таким образом, что каждая из последовательностей сохраняет свою идентичность (например, соединенные в серию) при экспрессии в виде аминокислотной последовательности. Гетерологичные полипептиды, получаемые из самореплицирующейся РНК, затем можно получать как слитый полипептид или конструировать так, чтобы получать отдельный полипептид или пептидные последовательности.
Самореплицирующаяся РНК по изобретению может кодировать один или несколько полипептидных антигенов, содержащих диапазон эпитопов. Предпочтительно, эпитопы способны вызывать ответ T-хелперных клеток или ответ цитотоксических T-клеток, или оба.
Самореплицирующиеся молекулы РНК, представленные в настоящем описании, можно конструировать для экспрессии множества нуклеотидных последовательностей их двух или более открытых рамок считывания, таким образом, делая возможной совместную экспрессию белков, таких как два или более антигена, вместе с цитокинами или другими иммуномодуляторами, которые могут усиливать генерацию иммунного ответа. Такая самореплицирующаяся молекула РНК может являться особенно применимой, например, в одновременной продукции продуктов различных генов (например, белков), например, в качестве бивалентной или мультивалентной вакцины.
Самореплицирующиеся молекулы РНК по изобретению можно получать с использованием любого подходящего способа. В этой области известно несколько подходящих способов получения молекул РНК, содержащих модифицированные нуклеотиды. Например, самореплицирующуюся молекулу РНК, содержащую модифицированные нуклеотиды, можно получать транскрипцией (например, транскрипцией in vitro) ДНК, кодирующей самореплицирующуюся молекулу РНК, с использованием подходящей ДНК-зависимой РНК полимеразы, такой как РНК-полимераза фага T7, РНК-полимераза фага SP6, РНК-полимераза фага T3 и т.п., или мутантов этих полимераз, делающих возможным эффективное встраивание модифицированных нуклеотидов в молекулы РНК. Реакция транскрипции будет включать нуклеотиды и модифицированные нуклеотиды и другие компоненты, поддерживающие активность выбранной полимеразой, такие как подходящий буфер и подходящие соли. Встраивание аналогов нуклеотидов в самореплицирующуюся РНК можно осуществлять, например, для изменения стабильности таких молекул РНК, для повышения устойчивости к РНКазам, для осуществления репликации после встраивания в соответствующие клетки-хозяева ("инфицирующая способность" РНК) и/или для индукции или снижения врожденного и адаптивного иммунных ответов.
Подходящие способы синтеза можно использовать в отдельности или в комбинации с одним или несколькими другими способами (например, технология рекомбинантной ДНК или РНК) для получения самореплицирующейся молекулы РНК по изобретению. Подходящие способы синтеза de novo хорошо известны в этой области, и их можно адаптировать для конкретного применения. Примеры способов включают, например, химический синтез с использованием подходящих защитных групп, такой как CEM (Masuda et al., (2007) Nucleic Acids Symposium Series 57: 3-4), β-цианоэтил фосфорамидитный способ (Beaucage S. L. et al. (1981) Tetrahedron Lett 22: 1859); нуклеозид-H-фосфонатный способ (Garegg P. et al. (1986) Tetrahedron Lett 27: 4051-4; Froehler B. C. et al. (1986) Nucl Acid Res 14: 5399-407; Garegg P. et al. (1986) Tetrahedron Lett 27: 4055-8; Gaffney B. L. et al. (1988) Tetrahedron Lett 29: 2619-22). Эти химические способы можно осуществлять или адаптировать для использования с автоматизированными синтезаторами нуклеиновых кислот, являющимися коммерчески доступными. Дополнительные подходящие способы синтеза описывают в Uhlmann et al. (1990) Chem Rev 90: 544-84, и Goodchild J. (1990) Bioconjugate Chem 1: 165. Синтез нуклеиновых кислот также можно осуществлять с использованием подходящих рекомбинантных способов, хорошо известных и общепринятых в этой области, включая клонирование, процессинг и/или экспрессию полинуклеотидов и продуктов генов, кодируемых такими полинуклеотидами. Перетасовывание ДНК случайной фрагментацией и повторная сборка фрагментов гена и синтетических полинуклеотидов посредством ПЦР являются примерами известных способов, которые можно использовать для конструирования полинуклеотидных последовательностей. Для изменения нуклеиновых кислот и кодируемых белков, например, для встраивания новых участков рестрикции, изменения профилей гликозилирования, изменения предпочтения кодонов, получения вариантов сплайсинга, встраивания мутаций и т.п., можно использовать сайт-специфический мутагенез. Подходящие способы транскрипции, трансляции и экспрессии последовательностей нуклеиновой кислоты известны и общеприняты в этой области (в основном, см.

Наличие и/или количество одного или нескольких модифицированных нуклеотидов в самореплицирующейся молекуле РНК можно определять с использованием любого подходящего способа. Например, самореплицирующуюся РНК можно расщеплять до монофосфатов (например, с использованием нуклеазы P1) и дефосфорилировать (например, с использованием подходящей фосфатазы, такой как CIAP), и анализировать получаемые нуклеозиды обращенно-фазовой ВЭЖХ (например, с использованием колонки YMC Pack ODS-AQ (5 мкм, 4,6×250 мм) и элюировать с использованием градиента, от 30% B (0-5 мин) до 100% B (5-13 мин) и при 100% B (13-40) мин, скорость потока (0,7 мл/мин), УФ-детектирование (длина волны: 260 нм), температура колонки (30°C). Буфер A (20 мМ уксусная кислота-ацетат аммония, pH 3,5), буфер B (20 мМ уксусная кислота-ацетат аммония, pH 3,5/метанол [90/10])).
Необязательно, самореплицирующиеся молекулы РНК по изобретению могут включать один или несколько модифицированных нуклеотидов таким образом, что самореплицирующаяся молекула РНК будет обладать меньшей иммуномодуляторной активностью после встраивания или входа в клетку-хозяина (например, клетку человека) по сравнению с соответствующей самореплицирующейся молекулой РНК, не содержащей модифицированные нуклеотиды.
При желании, самореплицирующиеся молекулы РНК можно подвергать скринингу или анализировать для подтверждения их терапевтических и профилактических свойств с использованием различных способов in vitro или in vivo, известных специалистам в этой области. Например, вакцины, содержащие самореплицирующуюся молекулу РНК, можно тестировать по их эффекту на индукцию пролиферации или эффекторную функцию конкретного интересующего типа лимфоцитов, например, B-клеток, T-клеток, T-клеточных линий и T-клеточных клонов. Например, можно выделять клетки селезенки иммунизированных мышей и оценивать способность цитотоксических T-лимфоцитов лизировать аутологичные клетки-мишени, содержащие самореплицирующуюся молекулу РНК, кодирующую полипептидный антиген. Кроме того, можно измерять дифференцировку T-хелперных клеток посредством измерения пролиферации или продукции TH1- (ИЛ-2 и ИФНγ) и/или TH2- (ИЛ-4 и ИЛ-5) цитокинов с помощью ELISA или непосредственно в CD4+ T-клетках с помощью цитоплазматического окрашивания цитокинов и проточной цитометрии.
Самореплицирующиеся молекулы РНК, кодирующие полипептидный антиген, также можно тестировать на способность индуцировать гуморальные иммунные ответы, о чем свидетельствует, например, индукция B-клеточной продукции антител, специфичных для интересующего антигена. Эти анализы можно проводить с использованием, например, периферических B-лимфоцитов иммунизированных индивидуумов. Такие способы анализа известны специалистам в этой области. Другие анализы, которые можно использовать для определения свойств самореплицирующихся молекул РНК по изобретению, могут включать определение экспрессии кодируемого антигена клетками-мишенями. Например, можно использовать FACS для определения экспрессии антигена на поверхности клеток или внутриклеточно. Другим преимуществом селекции с помощью FACS является то, что можно осуществлять сортировку по различным уровням экспрессии; желательной может являться иногда снижающаяся экспрессия. Другой подходящий способ определения клеток, экспрессирующих конкретный антиген, включают пэннинг на планшете с использованием моноклональных антител или фиксацию с использованием магнитных бус, покрытых моноклональными антителами.
B. Антигены
В определенных вариантах осуществления отрицательно заряженная молекула, представленная в настоящем описании, является молекулой нуклеиновой кислоты (например, молекулой РНК), кодирующей антиген. Подходящие антигены включают, в качестве неограничивающих примеров, бактериальный антиген, вирусный антиген, грибковый антиген, антиген простейших, растительный антиген, антиген рака или их комбинацию.
Подходящие антигены включают белки и пептиды патогена, такого как вирус, бактерии, грибы, простейшие, растение или из опухоли. Вирусные антигены и иммуногены, которые могут кодироваться самореплицирующейся молекулой РНК, включают, в качестве неограничивающих примеров, белки и пептиды ортомиксовирусов, таких как вирусы гриппа A, B и C; вирусы Paramyxoviridae, такие как пневмовирусы (RSV), парамиксовирусы (PIV), метапневмовирусы и морбилливирусы (например, корь); пневмовирусы, такие как респираторно-синцитиальный вирус (RSV), бычий респираторно-синцитиальный вирус, вирус пневмонии мышей и вирус ринотрахеита индеек; парамиксовирусы, такие как вирусы парагриппа типов 1-4 (PIV), вирус эпидемического паротита, вирусы Сендай, вирус обезьян 5, вирус бычьего парагриппа, вирус Нипа, генипавирус и вирус псевдочумы птиц; Poxviridae, включая ортопоксвирус, такой как Variola vera (включая, в качестве неограничивающих примеров, Variola major и Variola minor); метапневмовирус, такой как метапневмовирус человека (hMPV) и метапневмовирус птиц (aMPV); морбилливирусы, такие как корь; пикорнавирус, такой как энтеровирусы, риновирусы, гепатовирус, парэховирус, кардиовирусы и афтовирусы; энтеровирусы, такие как полиовирус типов 1, 2 или 3, вирус Коксаки типов A с 1 по 22 и 24, вирус Коксаки типов B с 1 по 6, эховирус (ECHO) типов с 1 по 9, с 11 по 27 и с 29 по 34 и энтеровирус с 68 по 71, буньявирусы, включая ортобуньявирус, такой как вирус калифорнийского энцефалита; флебовирус, такой как вирус лихорадки долины Рифт; найровирус, такой как вирус геморрагической лихорадки Крым-Конго; гепатовирусы, такие как вирус гепатита A (HAV); тогавирусы (краснуха), такие как рубивирус, альфавирус или артеривирус; флавивирусы, такие как вирус клещевого энцефалита (TBE), вирус денге (типов 1, 2, 3 или 4), вирус желтой лихорадки, вирус японского энцефалита, вирус киасанурской лихорадки, вирус энцефалита Западного Нила, вирус энцефалита Сэнт-Луис, вирус клещевого энцефалита, вирус энцефалита Повассан; пестивирусы, такие как бычья вирусная диарея (BVDV), классическая чума свиней (CSFV) или пограничная болезнь овец (BDV); гепаднавирусы, такие как вирус гепатита B, вирус гепатита C; рабдовирусы, такие как лиссавирус (вирус бешенства) и везикуловирус (VSV), Caliciviridae, такие как Norwalk и Norwalk-подобные вирусы, такие как вирус Гавайи и вирус Снежных Гор; коронавирусы, такие как SARS, респираторный коронавирус человека, инфекционный бронхит птиц (IBV), вирус гепатита мышей (MHV) и вирус трансмиссивного гастроэнтерита свиней (TGEV); ретровирусы, такие как онковирус, лентивирус или спумавирус; реовирусы, такие как ортореовирус, ротавирус, орбивирус или колтивирус; парвовирусы, такие как парвовирус B19; вирус гепатита дельта (HDV); вирус гепатита E (HEV); вирус гепатита G (HGV); герпесвирусы человека, такие как, помимо прочего, вирусы простого герпеса (HSV), вирус ветряной оспы (VZV), вирус Эпштейна-Барр (EBV), цитомегаловирус (CMV), герпесвирус человека 6 (HHV6), герпесвирус человека 7 (HHV7) и герпесвирус человека 8 (HHV8); паповавирусы, такие как папилломавирусы и полиомавирусы, аденовирусы и аренавирусы.
В некоторых вариантах осуществления антиген вызывает иммунный ответ на вирус, инфицирующий рыб, такой как вирус инфекционной анемии лосося (ISAV), вирус болезни поджелудочной железы лосося (SPDV), вирус инфекционного некроза поджелудочной железы (IPNV), вирус американского проточного сома (CCV), вирус лимфоцистоза рыб (FLDV), вирус инфекционного некроза гемопоэтической ткани (IHNV), герпесвирус карпа Кои, пикорна-подобный вирус лососевых (также известный как пикорна-подобный вирус атлантического лосося), вирус пресноводного лосося (LSV), ротавирус атлантического лосося (ASR), trout strawberry disease вирус (TSD), опухолевый вирус кижуча (CSTV) или вирус вирусной геморрагической септицемии (VHSV).
В некоторых вариантах осуществления антиген вызывает иммунный ответ на паразита рода Plasmodium, такого как P. falciparum, P. vivax, P. malariae или P. ovale. Таким образом, изобретение можно использовать для иммунизации против малярии. В некоторых вариантах осуществления антиген вызывает иммунный ответ на паразита семейства Caligidae, в частности, родов Lepeophtheirus и Caligus, например, морскую вошь, такую как Lepeophtheirus salmonis или Caligus rogercresseyi.
Бактериальные антигены и иммуногены, которые могут кодироваться самореплицирующейся молекулой РНК, включают, в качестве неограничивающих примеров, белки и пептиды Neisseria meningitides, Streptococcus pneumoniae, Streptococcus pyogenes, Moraxella catarrhalis, Bordetella pertussis, Burkholderia sp. (например, Burkholderia mallei, Burkholderia pseudomallei и Burkholderia cepacia), Staphylococcus aureus, Staphylococcus epidermis, Haemophilus influenzae, Clostridium tetani (столбняк), Clostridium perfringens, Clostridium botulinums (ботулизм), Cornynebacterium diphtheriae (дифтерия), Pseudomonas aeruginosa, Legionella pneumophila, Coxiella burnetii, Brucella sp. (например, B. abortus, B. canis, B. melitensis, B. neotomae, B. ovis, B. suis и B. pinnipediae), Francisella sp. (например, F. novicida, F. philomiragia и F. tularensis), Streptococcus agalactiae, Neiserria gonorrhoeae, Chlamydia trachomatis, Treponema pallidum (сифилис), Haemophilus ducreyi, Enterococcus faecalis, Enterococcus faecium, Helicobacter pylori, Staphylococcus saprophyticus, Yersinia enterocolitica, E. coli (такая как энтеротоксигенная E. coli (ETEC), энтероагрегативная E. coli (EAggEC), диффузно-адгерентная E. coli (DAEC), энтеропатогенн E. coli (EPEC), внекишечная патогенная E. coli (ExPEC; такая как уропатогенная E. coli (UPEC) и менингит/сепсис-ассоциированные E. coli (MNEC)) и/или энтерогеморрагическая E. coli (EHEC), Bacillus anthracis (сибирская язва), Yersinia pestis (чума), Mycobacterium tuberculosis, Rickettsia, Listeria monocytogenes, Chlamydia pneumoniae, Vibrio cholerae, Salmonella typhi (брюшной тиф), Borrelia burgdorfer, Porphyromonas gingivalis, Klebsiella, Mycoplasma pneumoniae и т.д.
Антигены и иммуногены грибов, которые могут кодироваться самореплицирующейся молекулой РНК, включают, в качестве неограничивающих примеров, белки и пептиды Dermatophytres, включая: Epidermophyton floccusum, Microsporum audouini, Microsporum canis, Microsporum distortum, Microsporum equinum, Microsporum gypsum, Microsporum nanum, Trichophyton concentricum, Trichophyton equinum, Trichophyton gallinae, Trichophyton gypseum, Trichophyton megnini, Trichophyton mentagrophytes, Trichophyton quinckeanum, Trichophyton rubrum, Trichophyton schoenleini, Trichophyton tonsurans, Trichophyton verrucosum, T. verrucosum var. album, var. discoides, var. ochraceum, Trichophyton violaceum и/или Trichophyton faviforme; или Aspergillus fumigatus, Aspergillus flavus, Aspergillus niger, Aspergillus nidulans, Aspergillus terreus, Aspergillus sydowi, Aspergillus flavatus, Aspergillus glaucus, Blastoschizomyces capitatus, Candida albicans, Candida enolase, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis, Candida stellatoidea, Candida kusei, Candida parakwsei, Candida lusitaniae, Candida pseudotropicalis, Candida guilliermondi, Cladosporium carrionii, Coccidioides immitis, Blastomyces dermatidis, Cryptococcus neoformans, Geotrichum clavatum, Histoplasma capsulatum, Klebsiella pneumoniae, Microsporidia, Encephalitozoon spp., Septata intestinalis и Enterocytozoon bieneusi; менее распространенными являются Brachiola spp, Microsporidium spp., Nosema spp., Pleistophora spp., Trachipleistophora spp., Vittaforma spp. Paracoccidioides brasiliensis, Pneumocystis carinii, Pythiumn insidiosum, Pityrosporum ovale, Sacharomyces cerevisae, Saccharomyces boulardii, Saccharomyces pombe, Scedosporium apiosperum, Sporothrix schenckii, Trichosporon beigelii, Toxoplasma gondii, Penicillium marneffei, Malassezia spp., Fonsecaea spp., Wangiella spp., Sporothrix spp., Basidiobolus spp., Conidiobolus spp., Rhizopus spp., Mucor spp., Absidia spp., Mortierella spp., Cunninghamella spp., Saksenaea spp., Alternaria spp., Curvularia spp., Helminthosporium spp., Fusarium spp., Aspergillus spp., Penicillium spp., Monolinia spp., Rhizoctonia spp., Paecilomyces spp., Pithomyces spp. и Cladosporium spp.
Антигены и иммуногены простейших, которые могут кодироваться самореплицирующейся молекулой РНК, включают, в качестве неограничивающих примеров, белки и пептиды Entamoeba histolytica, Giardia lambli, Cryptosporidium parvum, Cyclospora cayatanensis и Toxoplasma.
Антигены и иммуногены растений, которые может кодировать самореплицирующаяся молекула РНК, включают, в качестве неограничивающих примеров, белки и пептиды Ricinus communis.
Подходящие антигены включают белки и пептиды вирусов, таких как, например, вирус иммунодефицита человека (ВИЧ), вирус гепатита A (HAV), вирус гепатита B (HBV), вирус гепатита C (HCV), вирус простого герпеса (HSV), цитомегаловирус (CMV), вирус гриппа (flu), респираторно-синцитиальный вирус (RSV), парвовирус, норовирус, человек вирус папилломы (HPV), риновирус, вирус желтой лихорадки, вирус бешенства, вирус лихорадки Денге, вирус кори, вирус эпидемического паротита, вирус краснухи, вирус ветряной оспы, энтеровирус (например, энтеровирус 71), вирус Эбола и вирус бычьей диареи. Предпочтительно, антигенное вещество выбрано из группы, состоящей из гликопротеина gD HSV, гликопротеина gp120 ВИЧ, гликопротеина gp40 ВИЧ, p55 gag ВИЧ и полипептидов областей pol и tat. В других предпочтительных вариантах осуществления изобретения антиген является белком или пептидом, полученным из бактерии, такой как, например, Helicobacter pylori, Haemophilus influenza, Vibrio cholerae (холера), C. diphtheriae (дифтерия), C. tetani (столбняк), Neisseria meningitidis, B. pertussis, Mycobacterium tuberculosis и т.п.
Антигены ВИЧ, которые могут кодировать самореплицирующиеся молекулы РНК по изобретению, описаны в патентной заявке США № 490858, зарегистрированной 9 марта 1990 года, и опубликованной европейской патентной заявке № 181150 (14 мая 1986 года), а также патентных заявках США №№ 60/168471; 09/475515; 09/475504; и 09/610313, описания которых включены в настоящее описание посредством ссылки в полном объеме.
Антигены цитомегаловируса, которые могут кодировать самореплицирующиеся молекулы РНК по изобретению, описаны в патенте США № 4689225, патентной заявке США № 367363, зарегистрированной 16 июня 1989 года, и публикации PCT WO 89/07143, описания которых включены в настоящее описание посредством ссылки в полном объеме.
Антигены гепатита C, которые могут кодировать самореплицирующиеся молекулы РНК по изобретению, описаны в PCT/US88/04125, опубликованной Европейской патентной заявке № 318216 (31 мая 1989 года), опубликованной патентной заявке Японии № 1-500565, зарегистрированной 18 ноября 1988 года, опубликованной патентной заявке Канады № 583561 и EPO 388232, описания которых включены в настоящее описание посредством ссылки в полном объеме. Другой набор антигенов HCV описан в Европейской патентной заявке № 90/3028660, зарегистрированной 16 марта 1990 года, и патентной заявке США № 456637, зарегистрированной 21 декабря 1989 года, и PCT/US90/01348, описания которых включены в настоящее описание посредством ссылки в полном объеме.
В некоторых вариантах осуществления антиген получают из аллергена, такого как аллергены пыльцы (аллергены пыльцы деревьев и трав); аллергены насекомых или паукообразных (ингаляционные аллергены, аллергены слюны и яда, например, аллергены клещей, аллергены тараканов и мошек, аллергены яда перепончатокрылых); аллергены шерсти и перхоти животных (например, собаки, кошки, лошади, крысы, мыши и т.д.); и пищевые аллергены (например, глиадин). Важные аллергены пыльцы деревьев и трав включают аллергены, происходящие из таксономических порядков Fagales, Oleales, Pinales и Platanaceae, включая, в качестве неограничивающих примеров, березу (Betula), ольху (Alnus), лещину (Corylus), граб (Carpinus) и оливу (Olea), кедр (Cryptomeria и Juniperus), платан (Platanus), порядок Poales, включая травы родов Lolium, Phleum, Poa, Cynodon, Dactylis, Holcus, Phalaris, Secale и Sorghum, порядки Asterales и Urticales, включая травы родов Ambrosia, Artemisia и Parietaria. Другими важными ингаляционными аллергенами являются аллергены клещей домашней пыли рода Dermatophagoides и Euroglyphus, мучного клеща, например, Lepidoglyphys, Glycyphagus и Tyrophagus, тараканов, мошек и блох, например, Blatella, Periplaneta, Chironomus и Ctenocepphalides, и млекопитающих, таких как кошка, собака и лошадь, аллергены яда, включая аллергены, происходящие из жалящих насекомых, таких как насекомые таксономического порядка Hymenoptera, включая пчел (Apidae), ос (Vespidea) и муравьев (Formicoidae).
В определенных вариантах осуществления самореплицирующаяся молекула РНК может кодировать опухолевый иммуноген или антиген или иммуноген или антиген рака. В определенных вариантах осуществления опухолевые иммуногены и антигены являются пептид-содержащими опухолевыми антигенами, такими как полипептидный опухолевый антиген или гликопротеиновые опухолевые антигены.
Опухолевые иммуногены и антигены, подходящие для использования в настоящем описании, включают широкий спектр молекул, таких как (a) полипептид-содержащие опухолевые антигены, включая полипептиды (которые могут составлять, например, 8-20 аминокислот в длину, хотя длины вне этого диапазона также являются общепринятыми), липополипептиды и гликопротеины.
В определенных вариантах осуществления опухолевые иммуногены являются, например, (a) полноразмерными молекулами, ассоциированными со злокачественными клетками, (b) их гомологами и модифицированными формами, включая молекулы с делетированными, добавленными и/или замещенными частями, и (c) их фрагментами. Опухолевые иммуногены включают, например, антигены, рестриктированные классом I, распознаваемые CD8+ лимфоцитами, или антигены, рестриктированные классом II, распознаваемые CD4+ лимфоцитами.
В определенных вариантах осуществления опухолевые иммуногены включают, в качестве неограничивающих примеров, (a) тестикулярно-раковые антигены, такие как NY-ESO-1, SSX2, SCP1, а также полипептиды семейства RAGE, BAGE, GAGE и MAGE, например, GAGE-1, GAGE-2, MAGE-1, MAGE-2, MAGE-3, MAGE-4, MAGE-5, MAGE-6 и MAGE-12 (которые можно использовать, например, для решения проблем, связанных с меланомой, опухолями легких, головы и шеи, немелкоклеточным раком легких (NSCLC), опухолями молочной железы, желудочно-кишечного тракта и мочевого пузыря), (b) мутировавшие антигены, например, p53 (ассоциированный с различными солидными опухолями, например, колоректальным раком, раком легких, раком головы и шеи), p21/Ras (ассоциированный, например, с меланомой, раком поджелудочной железы и колоректальным раком), CDK4 (ассоциированный, например, с меланомой), MUM1 (ассоциированный, например, с меланомой), каспаза-8 (ассоциированная, например, с раком головы и шеи), CIA 0205 (ассоциированный, например, с раком мочевого пузыря), HLA-A2-R1701, бета-катенин (ассоциированный, например, с меланомой), TCR (ассоциированный, например, с T-клеточной неходжкинской лимфомой), BCR-abl (ассоциированный, например, с хроническим миелогенным лейкозом), триозофосфатизомераза, KIA 0205, CDC-27 и LDLR-FUT, (c) гиперэкспрессируемые антигены, например, галектин 4 (ассоциированный, например, с колоректальным раком), галектин 9 (ассоциированный, например, с болезнью Ходжкина), протеиназа 3 (ассоциированная, например, с хроническим миелогенным лейкозом), WT 1 (ассоциированный, например, с различными лейкозами), карбоангидраза (ассоциированная, например, с раком почки), альдолаза A (ассоциированная, например, с раком легких), PRAME (ассоциированный, например, с меланомой), HER-2/neu (ассоциированный, например, с раком молочной железы, толстой кишки, легких и яичников), альфа-фетопротеин (ассоциированный, например, с гепатомой), KSA (ассоциированный, например, с колоректальным раком), гастрин (ассоциированный, например, с раком поджелудочной железы и желудка), каталитическая субъединица теломеразы, MUC-1 (ассоциированный, например, с раком молочной железы и яичников), G-250 (ассоциированный, например, с почечноклеточной карциномой), p53 (ассоциированный, например, с раком молочной железы, толстого кишечника) и карциноэмбриональный антиген (ассоциированный, например, с раком молочной железы, раком легких и раком желудочно-кишечного тракта, таким как колоректальный рак), (d) перекрестно-реагирующие антигены, например, дифференцировочные антигены меланоцитов, такие как MART-1/Melan A, gp100, MC1R, рецептор меланоцитостимулирующего гормона, тирозиназа, тирозиназа-родственный белок-1/TRP1 и тирозиназа-родственный белок-2/TRP2 (ассоциированный, например, с меланомой), (e) антигены, ассоциированные с предстательной железой, такие как PAP, PSA, PSMA, PSH-P1, PSM-P1, PSM-P2, ассоциированные, например, с раком предстательной железы, (f) идиотипы иммуноглобулинов (ассоциированные, например, с миеломой и B-клеточными лимфомами).
В определенных вариантах осуществления опухолевые иммуногены включают, в качестве неограничивающих примеров, p15, Hom/Mel-40, H-Ras, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR, антигены вируса Эпштейн-Барр, EBNA, антигены папилломавируса человека (HPV), включая E6 и E7, антигены вируса гепатита B и C, антигены T-клеточного лимфотропного вируса человека, TSP-180, p185erbB2, p180erbB-3, c-met, mn-23H1, TAG-72-4, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, p16, TAGE, PSCA, CT7, 43-9F, 5T4, 791 Tgp72, beta-HCG, BCA225, BTAA, CA 125, CA 15-3 (CA 27.29\BCAA), CA 195, CA 242, CA-50, CAM43, CD68\KP1, CO-029, FGF-5, Ga733 (EpCAM), HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS1, SDCCAG16, TA-90 (Mac-2-связывающий белок\циклофилин C-ассоциированный белок), TAAL6, TAG72, TLP, TPS и т.п.
C. Водный раствор для отрицательно заряженной молекулы
Как правило, отрицательно заряженную молекулу (такую как РНК) предоставляют в виде водного раствора, или в форме, которую можно быстро растворять в водном растворе (например, лиофилизированными). Водный раствор может являться водой или водным раствором, содержащим соль (например, NaCl), буфер (например, цитратный буфер), корректирующее осмоляльность или тоничность средство (например, сахарид), полимер, поверхностно-активное вещество или их комбинацию. Если состав предназначен для введения in vivo, предпочтительно, чтобы водный раствор являлся физиологически приемлемым буфером, поддерживающим pH, совместимый с нормальными физиологическими условиями. Также, в конкретных случаях, желательным может являться поддержание pH на конкретном уровне для обеспечения стабильности конкретных компонентов состава.
Например, желательным может являться получение водного раствора, являющегося изотоническим и/или изоосмотическим. Гипертонические и гипотонические растворы иногда могут вызывать осложнения и нежелательные эффекты при инъецировании, такие как отеки после введения или быстрое всасывание композиции по причине различной концентрации ионов между композицией и физиологическими жидкостями. Эмульсия может содержать физиологическую соль, такую как натриевая соль, для контроля тоничности. Например, можно использовать хлорид натрия (NaCl) в концентрации приблизительно 0,9% (масс./об.) (физиологический раствор). Другие соли, которые могут присутствовать, включают хлорид калия, дигидрофосфат калия, безводный дифосфат натрия, хлорид магния, хлорид кальция и т.д. В иллюстративном варианте осуществления водный раствор содержит 10 мМ NaCl и другие соли или неионные модифицирующие тоничность средства. Как представлено в настоящем описании, неионные модифицирующие тоничность средства также можно использовать для контроля тоничности.
Водный раствор можно буферизовать. В настоящем описании можно использовать любой физиологически приемлемый буфер, такой как цитратные буферы, фосфатные буферы, ацетатные буферы, сукцинатные буферы, Трис-буферы, бикарбонатные буферы, карбонатные буферы или т.п. Предпочтительно, pH водного раствора будет составлять 6,0-8,0, предпочтительно от приблизительно 6,2 до приблизительно 6,8. В некоторых случаях в буфер можно включать конкретное количество соли. В других случаях соль в буфере может мешать образованию комплексов отрицательно заряженной молекулы с частицами эмульсии, таким образом, предотвращая его.
Водный раствор также может содержать дополнительные компоненты, такие как молекулы, изменяющие осмолярность водного раствора, или молекулы, стабилизирующие отрицательно заряженную молекулу после образование комплексов. Например, осмоляльность можно корректировать с использованием неионных модифицирующих тоничность средств, как правило, являющихся углеводами, но также они могут являться полимерами (см., например, Voet и Voet (1990) Biochemistry (John Wiley & Sons, New York.). Примеры подходящих неионных модифицирующих тоничность средств включают сахара (например, трегалозу, сахарозу, декстрозу, фруктозу, восстановленную палатинозу и т.д.), сахарные спирты (такие как маннит, сорбит, ксилит, эритрит, лактитол, мальтитол, глицерин и т.д.) и их комбинации. При желании, можно использовать неионный полимер (например, поли(алкилгликоль), такой как полиэтиленгликоль, полипропиленгликоль или полибутиленгликоль) или неионное поверхностно-активное вещество. Эти типы средств, в частности, сахар и сахарные спирты, также являются криопротекторами, которые могут защищать РНК и другие отрицательно заряженные молекулы при лиофилизации. В иллюстративных вариантах осуществления буфер содержит от приблизительно 560 нМ до 600 мМ трегалозу, сахарозу, сорбит или декстрозу.
В некоторых случаях предпочтительным может являться получение водного раствора, содержащего отрицательно заряженную молекулу в виде гипертонического раствора, и получение катионной эмульсии с использованием чистой воды или гипотонического буфера. Если комбинируют эмульсию и отрицательно заряженную молекулу, смесь становится изотонической. Например, водный раствор, содержащий РНК, может являться 2-кратным гипертоническим раствором, и катионную эмульсию можно получать с использованием 10 мМ цитратного буфера. Если раствор РНК и эмульсию смешивают при соотношении 1:1 (об./об.), композиция становится изотонической. Основываясь на желаемых относительных количествах эмульсии относительно водного раствора, содержащего отрицательно заряженную молекулу (например, смесь 1:1 (об./об.), смесь 2:1 (об./об.), смесь 1:2 (об./об.) и т.д.), можно легко определять тоничность водного раствора, что необходимо для получения изотонической смеси.
Аналогично, композиции, имеющие физиологическую осмоляльность, могут являться желательными для введения in vivo. Физиологическая осмоляльность составляет от приблизительно 255 мОсм/кг воды до приблизительно 315 мОсм/кг воды. Иногда предпочтительным может являться получение водного раствора, содержащего отрицательно заряженную молекулу, в виде гиперосмолярного раствора, и получение катионной эмульсии с использованием чистой воды или гипоосмолярного буфера. При объединении эмульсии и отрицательно заряженной молекулы достигают физиологической осмоляльности. Основываясь на желаемых относительных количествах эмульсии относительно водного раствора, содержащего отрицательно заряженную молекулу (например, смесь 1:1 (об./об.), смесь 2:1 (об./об.), смесь 1:2 (об./об.) и т.д.), можно легко определять осмоляльность водного раствора, что необходимо для получения изоосмолярной смеси.
В определенных вариантах осуществления водный раствор, содержащий отрицательно заряженную молекулу, может дополнительно содержать полимер, или поверхностно-активное вещество или их комбинацию. В иллюстративном варианте осуществления эмульсия "масло-в-воде" содержит полоксамер. В частности, авторы изобретения наблюдали, что добавление Pluronic® F127 к водному раствору РНК перед образованием комплексов с катионными частицами эмульсии приводит к большей стабильности и повышенной устойчивости молекулы РНК к РНКазам. Также обнаруживали, что добавление Pluronic® F127 к водному раствору РНК повышает размер частиц комплекса RNA/CNE. Полоксамерные полимеры также могут облегчать правильную деформацию комплексов/высвобождение молекулы РНК, предотвращать агрегацию частиц эмульсии и оказывать иммуномодуляторный эффект. Другие полимеры, которые можно использовать, включают, например, Pluronic® F68 или PEG300.
Альтернативно или дополнительно, водный раствор, содержащий отрицательно заряженную молекулу, может содержать от приблизительно 0,05% до приблизительно 20% (масс./об.) полимера. Например, катионная эмульсия "масло-в-воде" может содержать полимер (например, полоксамер, такой как Pluronic® F127, Pluronic® F68 или PEG300) в концентрации от приблизительно 0,05% до приблизительно 10% (масс./об.), например, 0,05%, 0,5%, 1% или 5%.
Буферная система может содержать любую комбинацию двух или более описываемых выше молекул (соль, буфер, сахарид, полимер и т.д.). В предпочтительном варианте осуществления буфер содержит 560 мМ сахарозу, 20 мМ NaCl и 2 мМ цитрат, которые можно смешивать с катионной эмульсией "масло-в-воде", представленной в настоящем описании, для получения конечной водной фазы, содержащей 280 мМ сахарозу, 10 мМ NaCl и 1 мМ цитрат.
5. СПОСОБЫ ПОЛУЧЕНИЯ
В другом аспекте изобретение относится к способу получения композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", включающему: получение катионной эмульсии "масло-в-воде", где эмульсия содержит: (1) от приблизительно 0,2% до приблизительно 20% (об./об.) масла, (2) от приблизительно 0,01% до приблизительно 2,5% (об./об.) поверхностно-активного вещества, и (3) катионный липид; и добавление отрицательно заряженной молекулы к катионной эмульсии "масло-в-воде" таким образом, что отрицательно заряженная молекула образует комплекс с частицей эмульсии.
Одним из примеров подхода для получения катионной эмульсии "масло-в-воде" является способ, включающий: (1) объединение масла и катионного липида для образования масляной фазы эмульсии; (2) получение водного раствора для образования водной фазы эмульсии; и (3) диспергирование масляной фазы в водной фазе, например, посредством гомогенизации. Гомогенизацию можно осуществлять любым подходящим способом, например, с использованием коммерческого гомогенизатора (например, гомогенизатора IKA T25, доступного в VWR International (West Chester, PA).
Катионный липид можно растворять в подходящем растворителе, таком как хлороформ (CHCl3), дихлорметан (DCM), этанол, ацетон, тетрагидрофуран (THF), 2,2,2-трифторэтанол, ацетонитрил, этилацетат, гексан, диметилформамид (DMF), диметилсульфоксид (DMSO) и т.д., и добавлять непосредственно в масляный компонент эмульсии. Альтернативно, катионный липид можно добавлять в подходящий растворитель для образования липосомной суспензии; затем липосомную суспензию можно добавлять в масляный компонент эмульсии. Катионный липид также можно растворять непосредственно в масле.
Желательным может являться нагревание масла до температуры от приблизительно 30°C до приблизительно 65°C для облегчения растворения липида.
Можно измерять желаемое количество катионного липида (например, DOTAP) и растворять его в растворителе, в воде или непосредственно в масле для достижения желаемой конечной концентрации, как описано и представлено в качестве примера в настоящем описании.
Растворители, такие как хлороформ (CHCl3) или дихлорметан (DCM), можно удалять из масляной фазы, например, выпариванием, перед объединением водной фазы и масляной фазы или перед гомогенизацией. Альтернативно, в случаях, когда растворимость липида может представлять собой проблему, можно получать первичную эмульсию с растворителем (например, DCM) все еще в масляной фазе. В таких случаях растворитель можно удалять (например, позволять выпариваться) из первичной эмульсии перед вторичной гомогенизацией.
Если эмульсия содержит одно или несколько поверхностно-активных веществ, поверхностно-активные вещества можно включать в масляную фазу или водную фазу согласно общепринятой практике в этой области. Например, SPAN85 можно растворять в масляной фазе (например, сквалене) и Tween 80 можно растворять в водной фазе (например, в цитратном буфере).
В другом аспекте изобретение относится к способу получения композиции, содержащей отрицательно заряженную молекулу (такую как РНК) в комплексе с частицей катионной эмульсии "масло-в-воде", включающему: (i) получение катионной эмульсии "масло-в-воде", как представлено в настоящем описании; (ii) получение водного раствора, содержащего отрицательно заряженную молекулу (такую как РНК); и (iii) объединение эмульсии "масло-в-воде" по (i) и водного раствора по (iii) таким образом, что отрицательно заряженная молекула образует комплекс с частицей эмульсии. Например, катионную эмульсию "масло-в-воде" можно комбинировать с водным раствором, содержащим отрицательно заряженную молекулу (например, водный раствор РНК), в любых желаемых относительных количествах, например, приблизительно 1:1 (об./об.), приблизительно 1,5:1 (об./об.), приблизительно 2:1 (об./об.), приблизительно 2,5:1 (об./об.), приблизительно 3:1 (об./об.), приблизительно 3,5:1 (об./об.), приблизительно 4:1 (об./об.), приблизительно 5:1 (об./об.), приблизительно 10:1 (об./об.), приблизительно 1:1,5 (об./об.), приблизительно 1:2 (об./об.), приблизительно 1:2,5 (об./об.), приблизительно 1:3 (об./об.), приблизительно 1:3,5 (об./об.), приблизительно 1:4 (об./об.), приблизительно 1:1,5 (об./об.) или приблизительно 1:1,10 (об./об.) и т.д.
Концентрацию каждого компонента композиции после образования комплексов (например, комплексов РНК-эмульсия) можно легко определять по относительным количествам используемых эмульсии "масло-в-воде" до образования комплексов и водного раствора, содержащего отрицательно заряженную молекулу (например, водный раствор РНК). Например, при объединении катионной эмульсии "масло-в-воде" с водным раствором, содержащим отрицательно заряженную молекулу (например, водный раствор РНК) при соотношении 1:1 (об./об.), концентрации масла и катионного липида становятся ½ от концентраций в эмульсии до образования комплексов. Таким образом, если эмульсию, содержащую 4,3% (масс./об.) сквалена, 1,4 мг/мл DOTAP, 0,5% об./об. SPAN85 и 0,5% об./об. Tween 80 (обозначенного в настоящем описании как "CNE17"), объединяют с водным раствором РНК, содержащим 560 мМ сахарозу, 20 мМ NaCl, 2 мМ цитрат и 1% (масс./об.) Pluronic® F127 при соотношении 1:1 (об./об.), композиция после образования комплексов содержит 2,15% (масс./об.) сквалена, 0,7 мг/мл DOTAP, 0,25% об./об. SPAN85, 0,25% об./об. Tween 80, 280 мМ сахарозу, 10 мМ NaCl, 1 мМ цитрат и 0,5% (масс./об.) Pluronic® F127.
Можно включать дополнительные необязательные этапы для усиления образования частиц, для улучшения образования комплексов между отрицательно заряженными молекулами и катионными частицами, для повышения стабильности отрицательно заряженной молекулы (например, для предотвращения деградации молекулы РНК), для облегчения правильной деформации комплексов/высвобождения отрицательно заряженных молекул (таких как молекула РНК) или для предотвращения агрегации частиц эмульсии. Например, в содержащий отрицательно заряженную молекулу (такую как РНК) водный раствор можно добавлять полимер (например, Pluronic® F127) или поверхностно-активное вещество. В одном примере варианта осуществления Pluronic® F127 добавляют к молекуле РНК перед образованием комплексов с частицей эмульсии.
Можно варьировать размер частиц эмульсии, изменяя соотношение поверхностно-активного вещества и масла (повышая соотношение, повышают размер капли), рабочее давление (повышение рабочего давления снижает размер капли), температуру (повышение температуры снижает размер капли) и другие параметры способа. Точный размер частиц также будет варьировать в зависимости от используемого поверхностно-активного вещества, масла и катионного липида и в зависимости от конкретных выбранных рабочих условий. Размер частиц эмульсии можно проверять с использованием инструментов для оценки размера, таких как коммерческий анализатор микронных частиц (модель N4MD), производимый Coulter Corporation, и можно варьировать параметры с использованием указанных выше руководств, пока средний диаметр частиц не составит менее 1 мкм, менее 0,9 мкм, менее 0,8 мкм, менее 0,7 мкм, менее 0,6 мкм, менее 0,5 мкм, менее 0,4 мкм, менее 0,3 мкм, менее 0,2 мкм или менее 0,1 мкм. Предпочтительно, частицы имеют средний диаметр приблизительно 400 нм или менее, приблизительно 300 нм или менее, приблизительно 200 нм или менее, приблизительно 180 нм или менее, приблизительно 150 нм или менее или приблизительно 140 нм или менее, от приблизительно 50 нм до 180 нм, от приблизительно 60 нм до 180 нм, от приблизительно 70 до 180 нм или от приблизительно 80 нм до 180 нм, от приблизительно 80 нм до 170 нм, от приблизительно 80 нм до 160 нм, от приблизительно 80 нм до 150 нм или от приблизительно 80 нм до 140 нм. В некоторых случаях, желательно, чтобы средний размер частиц катионных эмульсий составлял до 200 нм или менее для возможной стерилизации фильтрацией. В других случаях стерилизация фильтрацией не требуется, и средний размер частицы катионных эмульсий может составлять более 200 нм.
Необязательные способы получения катионной эмульсии "масло-в-воде" (до образования комплексов эмульсия) или комплексов отрицательно заряженная молекула-эмульсия, включают, например, стерилизацию, селекцию по размеру частиц (например, удаление больших частиц), наполнение, упаковывание и нанесение маркировки и т.д.
Например, если эмульсию до образования комплексов или комплекс отрицательно заряженная молекула-эмульсия составляют для введения in vivo, ее можно стерилизовать, например, фильтрацией через стерилизующие фильтры (например, через фильтр 0,22 мкм). Другие способы стерилизации включают термический способ, или способ стерилизации радиацией, или использование импульсного излучения для получения стерильной композиции.
Катионную эмульсию "масло-в-воде", представленную в настоящем описании, можно использовать для производства вакцин. Стерильные и/или клинически применимые катионные эмульсии "масло-в-воде" можно получать с использованием способов, аналогичных описываемым для MF59. См., например, Ott et al., Methods in Molecular Medicine, 2000, Volume 42, 211-228, in VACCINE ADJUVANTS (O’Hagan ed.), Humana Press. Например, аналогично способу производства MF59, масляную фазу и водную фазу эмульсии можно комбинировать и обрабатывать на поточном гомогенизаторе для получения грубодисперсных эмульсий. Затем грубодисперсную эмульсию можно нагружать в микрофлюидизатор, где ее можно дополнительно обрабатывать для получения стабильной сверхтонкой эмульсии. Грубодисперсную эмульсию можно повторно пропускать через интерактивную камеру микрофлюидизатора до получения частиц желаемого размера. Затем нерасфасованную эмульсию можно фильтровать (например, через фильтр 0,22 мкм в атмосфере азота) для удаления больших частиц, получая партию эмульсии, которой можно наполнять подходящие контейнеры (например, стеклянные бутыли). В случае антигенов в вакцине, демонстрирующих долговременную стабильность в присутствии эмульсии "масло-в-воде" при хранении, антиген и эмульсию можно объединять и стерилизовать фильтрацией (например, через мембрану фильтра 0,22 мкм). Комбинированной вакциной для одного введения можно наполнять упаковки для однократного введения. В случае антигенов в вакцине, не демонстрирующих долговременную стабильность, эмульсию можно предоставлять в отдельном сосуде. В таких случаях партию эмульсии можно стерилизовать фильтрацией (например, через мембрану фильтра 0,22 мкм), наполнять и упаковывать в конечные сосуды для однократного введения.
Контроль качества необязательно можно осуществлять на небольшой партии эмульсии или вакцины с добавками, и партию или вакцину с добавками будут упаковывать по дозам, только если образец пройдет тест контроля качества.
6. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ВВЕДЕНИЕ
В другом аспекте изобретение относится к фармацевтической композиции, содержащей отрицательно заряженную молекулу в комплексе с частицей катионной эмульсии "масло-в-воде", представленными в настоящем описании, и она может дополнительно содержать один или несколько фармацевтически приемлемых носителей, разбавителей или эксципиентов. В предпочтительных вариантах осуществления фармацевтическая композиция является иммуногенной композицией, которую можно использовать в качестве вакцины.
Альтернативно, композиции, представленные в настоящем описании, можно использовать для доставки отрицательно заряженной молекулы в клетки. Например, молекулы нуклеиновой кислоты (например, ДНК или РНК) можно доставлять в клетки для различных целей, таких как индукция продукции желаемого продукта гена (например, белка), регуляция экспрессии гена, генотерапия и т.п. Композиции, представленные в настоящем описании, также можно использовать для доставки молекулы нуклеиновой кислоты (например, ДНК или РНК) в клетки для терапевтических целей, таких как лечение заболевания, такого как злокачественные новообразования или пролиферативные нарушения, метаболические заболевания, сердечно-сосудистые заболевания, инфекции, аллергии, индукция иммунного ответа и т.п. Например, молекулы нуклеиновой кислоты можно доставлять в клетки для ингибирования экспрессии гена-мишени. Такие молекулы нуклеиновой кислоты включают, например, антисмысловые олигонуклеотиды, двухцепочечные РНК, такие как малые интерферирующие РНК и т.п. Двухцепочечные молекулы РНК, такие как малые интерферирующие РНК, могут запускать РНК-интерференцию, специфически подавляющую соответствующий ген-мишень (нокдаун гена). Антисмысловые олигонуклеотиды являются одноцепочечными ДНК или РНК, комплементарными выбранной последовательности. Как правило, антисмысловая РНК может предотвращать трансляцию белка с цепей конкретной матричной РНК посредством связывания с ними. Для воздействия на конкретную комплементарную (кодирующую или некодирующую) РНК можно использовать антисмысловую ДНК. Таким образом, катионные эмульсии, представленные в настоящем описании, применимы для доставки антисмысловых олигонуклеотидов или двухцепочечных РНК для лечения, например, рака посредством ингибирования продукции онкологической мишени.
Фармацевтические композиции, представленные в настоящем описании, можно вводить в отдельности или в сочетании с одним или несколькими дополнительными терапевтическими средствами. Способ введения включает, в качестве неограничивающих примеров, пероральное введение, ректальное введение, парентеральное введение, подкожное введение, внутривенное введение, интравитреальное введение, внутримышечное введение, ингаляцию, интраназальное введение, местное введение, офтальмологическое введение или введение в уши.
Терапевтически эффективное количество композиций, представленных в настоящем описании, будет варьироваться, помимо прочего, в зависимости от указанного заболевания, тяжести заболевания, возраста и относительного здоровья индивидуума, активности вводимого соединения, способа введения и желаемого лечения.
В других вариантах осуществления фармацевтические композиции, представленные в настоящем описании, можно вводить в сочетании с одним или несколькими дополнительными терапевтическими средствами. Дополнительные терапевтические средства могут включать, в качестве неограничивающих примеров, антибиотики или антибактериальные средства, антиэметические средства, противогрибковые средства, противовоспалительные средства, противовирусные средства, иммуномодулирующие средства, цитокины, антидепрессанты, гормоны, алкилирующие средства, антиметаболиты, противоопухолевые антибиотики, антимитотические средства, ингибиторы топоизомеразы, цитостатические средства, антиинвазивные средства, антиангиогенные средства, ингибиторы факторов роста, ингибиторы вирусной репликации, ингибиторы вирусных ферментов, противораковые средства, α-интерфероны, β-интерфероны, рибавирин, гормоны и другие модуляторы Toll-подобных рецепторов, иммуноглобулины (Ig) и антитела, модулирующие функцию Ig (такие как антитело против IgE (омализумаб)).
В определенных вариантах осуществления фармацевтические композиции, представленные в настоящем описании, используют в лечении инфекционных заболеваний, включая, в качестве неограничивающих примеров, заболевание, вызываемое патогенами, представленными в настоящем описании, включая вирусные заболевания, такие как остроконечная кондилома, обыкновенная бородавка, роговая бородавка, бешенство, респираторно-синцитиальный вирус (RSV), гепатит B, гепатит C, вирус денге, желтая лихорадка, вирус простого герпеса (исключительно в качестве примера, HSV-I, HSV-II, CMV или VZV), контагиозный моллюск, вирус осповакцины, натуральная оспа, лентивирус, вирус иммунодефицита человека (ВИЧ), вирус папилломы человека (HPV), вирус гепатита (вирус гепатита C, вирус гепатита B, вирус гепатита A), цитомегаловирус (CMV), вирус ветряной оспы (VZV), риновирус, энтеровирус (например, EV71), аденовирус, коронавирус (например, SARS), вирус гриппа, вирус парагриппа, вирус эпидемического паротита, вирус кори, вирус краснухи, паповавирус, гепаднавирус, флавивирус, ретровирус, аренавирус (исключительно в качестве примера, LCM, вирус Хунин, вирус Мачупо, вирус гуанарито и лихорадка Ласса) и филовирус (исключительно в качестве примера, вирус Эбола или Марбургский вирус).
В определенных вариантах осуществления фармацевтические композиции, представленные в настоящем описании, используют в лечении бактериальных, грибковых и протозойных инфекций, включая, в качестве неограничивающих примеров, малярию, туберкулез и инфекцию Mycobacterium avium, проказу; инфекцию Pneumocystis carinii, криптоспоридиоз, гистоплазмоз, токсоплазмоз, трипаносомную инфекцию, лейшманиоз, инфекции, вызываемые бактериями родов Escherichia, Enterobacter, Salmonella, Staphylococcus, Klebsiella, Proteus, Pseudomonas, Streptococcus и Chlamydia, и грибковые инфекции, такие как кандидоз, аспергиллез, гистоплазмоз и криптококковый менингит.
В определенных вариантах осуществления фармацевтические композиции, представленные в настоящем описании, используют в лечении респираторных заболеваний и/или нарушения, дерматологических нарушений, заболеваний и/или нарушений глаз, урогенитальных заболеваний и/или нарушений, включая отторжение аллотрансплантата, аутоиммунные и аллергические заболевания, рак или повреждение или старение кожи, например, образование рубцов и морщины.
В другом аспекте изобретение относится к способу вызывания или усиления иммунного ответа у нуждающегося в этом индивидуума, такого как млекопитающее, включающему введение эффективного количества композиции, как представлено в настоящем описании. Иммунный ответ предпочтительно является протективным и предпочтительно вовлекает гуморальный и/или клеточный иммунитет. Способ можно использовать для индукции первичного иммунного ответа и/или для усиления иммунного ответа.
В определенных вариантах осуществления композиции, представленные в настоящем описании, можно использовать в качестве лекарственного средства, например, для применения в вызывании или усилении иммунного ответа у нуждающегося в этом индивидуума, такого как млекопитающее.
В определенных вариантах осуществления композиции, представленные в настоящем описании, можно использовать в производстве лекарственного средства для вызывания или усиления иммунного ответа у нуждающегося в этом индивидуума, такого как млекопитающее.
Изобретение также относится к устройству для доставки, предварительно наполненному композицией или вакциной, представленной в настоящем описании.
Млекопитающее предпочтительно является человеком, но может являться, например, коровой, свиньей, курицей, кошкой или собакой, поскольку патогены, указанные в настоящем описании, могут представлять собой проблему для широкого диапазона видов. Если вакцина предназначена для профилактического применения, человек предпочтительно является ребенком (например, ребенком преддошкольного возраста или младенцем), подростком или взрослым; если вакцина предназначена для терапевтического применения, человек предпочтительно является подростком или взрослым. Вакцину, предназначенную для детей, также можно вводить взрослым, например, для оценки безопасности, дозировки, иммуногенности и т.д.
Один из способов оценки эффективности терапевтического лечения включает мониторинг патогенной инфекции после введения композиций или вакцин, представленных в настоящем описании. Один из способов оценки эффективности профилактического лечения включает мониторинг иммунных ответов на антиген системно (например, мониторинг уровня продукции IgG1 и IgG2a) и/или в слизистых оболочках (например, мониторинг уровня продукции IgA). Как правило, антиген-специфичные гуморальные ответы в сыворотке определяют после иммунизации, но до провокационной пробы, в то время как антиген-специфичные гуморальные ответы в слизистых оболочках определяют после иммунизации и после провокационной пробы.
Другим способом оценки иммуногенности композиций или вакцин, представленных в настоящем описании, где молекула нуклеиновой кислоты (например, РНК) кодирует белковый антиген, является рекомбинантная экспрессия белкового антигена для скрининга сыворотки пациента или секреции в слизистых оболочках посредством иммуноблотинга и/или анализов с использованием микрочипов. Положительная реакция между белком и образцом пациента свидетельствует о том, что у пациента происходит иммунный ответ на изучаемый белок. Этот способ также можно использовать для идентификации иммунодоминантных антигенов и/или эпитопов в белковых антигенах.
Эффективность композиций также можно определять in vivo с помощью провокационных проб соответствующих моделей на животных патогеном интересующей инфекции.
Дозировку можно осуществлять по режиму однократных доз или по режиму многократных доз. Многократные дозы можно использовать при режиме первичной иммунизации и/или режиме повторной иммунизации. При режиме многократных доз различные дозы можно вводить одним и тем же или различными путями, например, парентеральным первичным введением и повторным введением через слизистые оболочки, первичным введением через слизистые оболочки и парентеральным повторным введением и т.д. Многократные дозы, как правило, будут вводить по меньшей мере через 1 неделю (например, через приблизительно 2 недели, приблизительно 3 недели, приблизительно 4 недели, приблизительно 6 недель, приблизительно 8 недель, приблизительно 10 недель, приблизительно 12 недель, приблизительно 16 недель и т.д.).
Композиции, представленные в настоящем описании, включающие один или несколько антигенов или используемые в сочетании с одним или несколькими антигенами, можно использовать для лечения и детей, и взрослых. Таким образом, возраст человека может составлять менее чем 1 год, 1-5 лет, 5-15 лет, 15-55 лет или по меньшей мере 55 лет. Предпочтительными индивидуумами для введения композиций являются пожилые люди (например, >50 лет, >60 лет и предпочтительно >65 лет), молодые люди (например, <5 лет), госпитализированные пациенты, работники сферы здравоохранения, военнослужащие, беременные женщины, хронические больные или пациенты с иммунодефицитом. Однако композиции подходят не только для этих групп, и, как правило, их можно использовать в популяции.
Композиции, представленные в настоящем описании, включающие один или несколько антигенов или используемые в сочетании с одним или несколькими антигенами, можно вводить пациентам по существу в то же время (например, в течение одной медицинской консультации или визита к работнику здравоохранения или в центр вакцинации), что и другие вакцины, например, по существу одновременно с вакциной против кори, вакциной против свинки, вакциной против краснухи, вакциной MMR, вакциной против ветряной оспы, вакциной MMRV, вакциной против дифтерии, вакциной против столбняка, вакциной против коклюша, вакциной DTP, конъюгированной вакциной против H. influenzae типа b, инактивированной вакциной против вируса полиомиелита, вакциной против вируса гепатита B, менингококковой конъюгатной вакциной (такой как тетравалентная вакцина A C W135 Y), вакциной против респираторно-синцитиального вируса и т.д.
В определенных вариантах осуществления композиции, представленные в настоящем описании, включают или необязательно включают одно или несколько иммунорегуляторных средств, таких как адъюванты. Примеры адъювантов включают, в качестве неограничивающих примеров, адъювант TH1 и/или адъювант TH2, дополнительно описываемые ниже. В определенных вариантах осуществления адъюванты, используемые в иммуногенных композициях, представленных в настоящем описании, включают, в качестве неограничивающих примеров:
1) композиции, содержащие минералы;
2) масляные эмульсии;
3) составы сапонина;
4) виросомы и вирусоподобные частицы;
5) бактериальные или микробные производные;
6) биоадгезивные и мукоадгезивные вещества;
7) липосомы;
8) составы простых эфиров полиоксиэтилена и сложных эфиров полиоксиэтилена;
9) полифосфазен (PCPP);
10) мурамилпептиды;
11) соединения имидазохинолона;
12) соединения тиосемикарбазона;
13) соединения триптантрина;
14) иммуномодуляторы человека;
15) липопептиды;
16) бензонафтиридины;
17) микрочастицы;
18) иммуностимулирующий полинуклеотид (такой как РНК или ДНК; например, CpG-содержащие олигонуклеотиды).
ПРИМЕРЫ
Описываемое в целом изобретение будет более понятным с учетом следующих примеров, включенных исключительно в целях иллюстрирования конкретных аспектов и вариантов осуществления настоящего изобретения и не предназначенных для ограничения изобретения.
ПРИМЕР 1: РАЗРАБОТКА КАТИОННЫХ ЭМУЛЬСИЙ "МАСЛО-В-ВОДЕ"
Для доставки самореплицирующейся РНК разрабатывали три типа катионных наноэмульсий (CNE). Эмульсиями типа 1 являются подобные "MF59" эмульсии. Эти эмульсии получали из тех же компонентов, что и MF59, за исключением добавления катионных липидов. Эмульсиями типа 2 являются эмульсии, в которых заменяют SPAN85 и Tween 80 в MF59 фосфолипидами. Эмульсиями типа 3 являются гибридные эмульсии, стабилизируемые липидами или другими поверхностно-активными веществами, и они могут содержать дополнительные полимеры или поверхностно-активные вещества в водной фазе эмульсии.
При получении эмульсий типа 1 использовали три различных липида: 1,2-диолеоил-3-триметиламмоний-пропан (хлорид) (DOTAP), 3β-[N-(N’,N’-диметиламиноэтан)карбамоил]холестерол гидрохлорид (DC холестерол) и диметилдиоктадециламмоний (бромид) (DDA). DOTAP использовали при получении эмульсий типа 2 и типа 3.
Термин соотношение N/P относится к количеству азота в катионном липиде относительно количества фосфатов в РНК. Азот является несущим заряд элементом в тестируемых катионных липидах. Фосфат можно найти в остове РНК. Соотношение заряда N/P 10/1 свидетельствует о том, что присутствуют 10 положительно заряженных атомов азота из катионного липида на каждый отрицательно заряженный фосфат в РНК.
CNE типа 1:
Для этого класса эмульсий не изменяли соотношение Tween 80, SPAN85, сквалена и цитратного буфера. Эти эмульсии получали при тех же концентрациях, что и MF59. Общее количество катионного липида, указанное на дозу, остается постоянным, несмотря на концентрацию липида. Например, для дозы 10 мкг РНК, доставляемой в эмульсии с 0,8 мг/мл DOTAP в эмульсии при соотношении N/P 10/1, будет необходимым разведение в 2 раза. Таким образом, количество доставляемого сквалена будет составлять ½ от вводимого в норме при иммунизации с использованием MF59. Альтернативно, для дозы 10 мкг РНК, доставляемой в эмульсии с 1,6 мг/мл DOTAP при соотношении N/P 10/1, будет необходимым разведение в 4 раза.
В этом примере получали 17 различных составов эмульсий типа 1. Диапазоны катионных липидов, которые можно получать в эмульсии, приведены ниже.
Все составы с концентрациями DOTAP от 0,8 мг/мл до 1,6 мг/мл приводили к получению стабильных эмульсий. Все составы с концентрациями DC холестерола от 0,62 мг/мл до 2,46 мг/мл приводят к получению стабильных эмульсий. Все составы с концентрациями DDA от 0,73 мг/мл до 1,64 мг/мл приводят к получению стабильных эмульсий.
CNE типа 2:
В CNE типа 2 отличалась процентная доля сквалена. Другим отличием от MF59 является то, что эти эмульсии получали с использованием воды, а не цитратного буфера. Эти эмульсии получали с использованием 1,2-диолеоил-sn-глицеро-3-фосфатидилэтаноламина (DOPE) и фосфатидилхолина (PC яйца (Egg PC)) в качестве липидных стабилизаторов. Эмульсии получали с использованием DOPE и PC яйца с DOTAP, DC холестеролом или DDA при оптимизированных концентрациях из исследований эмульсий типа 1.
Отдельную серию эмульсий получали с использованием только DOTAP в качестве стабилизатора. Эти эмульсии содержали различные количества сквалена (от 0,43% масс./масс. до концентрации в MF59 4,3% масс./масс.).
CNE типа 3:
Добавление Pluronic® F127 (полаксомера) к РНК перед образованием комплексов с эмульсией DOTAP/PC яйца приводило к большей стабильности по отношению к действию РНКаз по сравнению с образцом, не содержащим добавленный полоксамер. Это свидетельствует о роли этого полимера в лучшем образовании комплексов РНК с каплей масла.
Добавление небольшого количества Tween 80 (0,08% масс./масс.) на этапе эмульсификации содержащих только DOTAP- эмульсий приводило к меньшему размеру капель.
Способы получения катионных эмульсий:
Сквален, триолеат сорбитана (SPAN85), моноолеат полиоксиэтиленсорбитана (Tween 80) получали из Sigma (St. Louis, MO, USA). Диметилдиоктадециламмоний (DDA), 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE), 3β-[N-(N’,N’-диметиламиноэтан)карбамоил]холестерол гидрохлорид (DC-холестерол HCl) получали из Avanti Lipids. L-α-лизофосфатидилхолин (яйцо, курица) и 1,2-диолеоил-3-триметиламмоний-пропан (DOTAP) получали из Lipoid (Ludwigshafen, Germany).
Катионные наноэмульсии (CNE) получали аналогично заряженной MF59, как описано выше, с небольшими модификациями (Ott, Singh et al. 2002). В кратком изложении, растворимые в масле компоненты (т.е. сквален, SPAN85, катионные липиды, липидные поверхностно-активные вещества) объединяли в стакане, липидные компоненты растворяли в хлороформе (CHCl3) или дихлорметане (DCM). Получаемый липидный раствор добавляли непосредственно в масло и SPAN85. В случае подгруппы эмульсий (CNE01, 02, 17) растворителю позволяли выпариваться при комнатной температуре в течение 2 часов в вытяжном шкафу перед объединением водной фазы и гомогенизации образца. В случае остальных эмульсий (CNE 12, 13, 27, 32, 35) масляную фазу объединяли с водной фазой и сразу гомогенизировали в течение 2 мин с использованием гомогенизатора IKA T25 при 24K об./мин для получения гомогенного материала. CNE05 получали посредством получения липосомного стокового растворы. Липосомы получали выпариванием 10 мг/мл раствора DOTAP и хлороформа с использованием роторного испарителя (модель Buchi № R200) при давлении 300 миллиторр в течение 30 минут при температуре 50°C. Осуществляли выпаривание остаточного хлороформа, помещая образцы в течение ночи в лиофилизатор Labconco. Липидную пленку гидратировали и диспергировали добавлением 1,0 мл фильтрованной деионизированной дистиллированной воды, и помещали при 50°C для полного суспендирования липида. Получаемые липосомы добавляли непосредственно в сквален и незамедлительно эмульгировали в течением 2 мин с использованием гомогенизатора IKA T25 при 24K об./мин. Затем эмульсиям позволяли осаждаться при комнатной температуре на пластине для смешивания в течение 2-3 часов после первичной гомогенизации в вытяжном шкафу. Первичные эмульсии пропускали от трех до пяти раз через гомогенизатор микрофлюидизатор MHOS с охлаждающим змеевиком на льду при давлении гомогенизации приблизительно 15k-20k фунт/дюйм2 (Microfluidics, Newton, MA). Партию образцов 20 мл удаляли из смеси и хранили при 4°C. В таблице 2 описаны компоненты эмульсий.
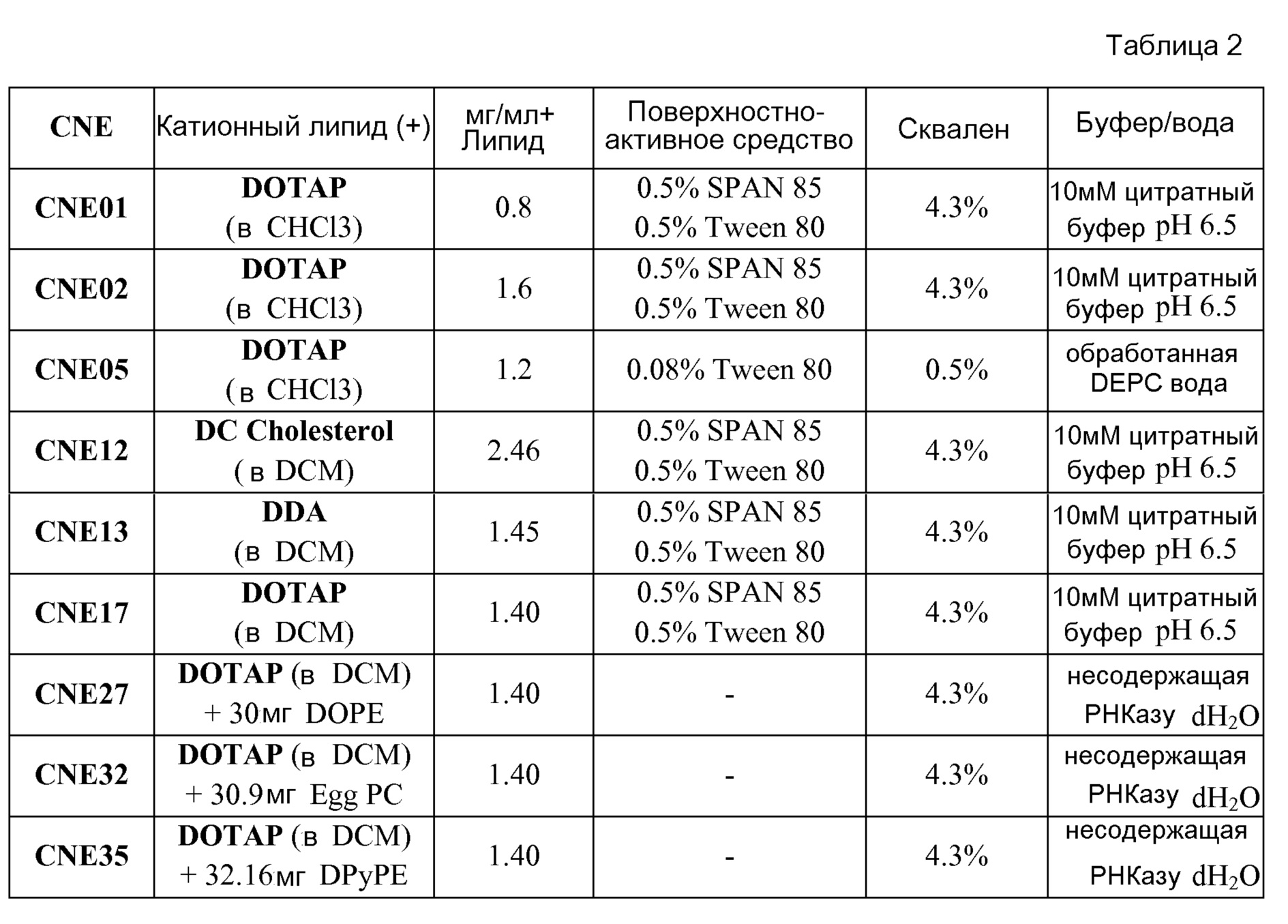
Одним из способов добавления липидов в масляную фазу эмульсий являлось добавление дихлорметана (DCM или метиленхлорида) в масляную фазу. Добавленному DCM можно позволять полностью выпариваться. Затем после выпаривания эмульсию пропускали чрез микрофлюидизатор. Альтернативно, в случаях, когда растворимость липида являлась проблемой, первичную эмульсию можно получать с использованием DCM в органической фазе. В этом случае DCM позволяют выпариваться непосредственно из эмульсии перед вторичной гомогенизацией.
Альтернативным способом для эмульсий, содержащих липиды в качестве стабилизаторов, являлось получение липидной пленки и регидратация пленки таким образом, что липиды образовывали липосомы. Затем липосомы добавляли в масляную фазу и обрабатывали так, как обрабатывали стандартную MF59.
ПРИМЕР 2: ПОЛУЧЕНИЕ КОМПЛЕКСОВ РНК-ЧАСТИЦА
1. Материалы и Способы.
Синтез РНК
В качестве матрицы для синтеза РНК in vitro использовали плазмидную ДНК, кодирующую репликон альфавируса (самореплицирующуюся РНК). Каждый репликон содержит генетические элементы, необходимые для репликации РНК, но не содержит последовательности, кодирующие продукты генов, необходимые для сборки частиц. Структурные гены генома альфавируса заменяли последовательностями, кодирующими гетерологичный белок (экспрессию которого запускает субгеномный промотор альфавируса). После доставки репликонов в эукариотические клетки положительная цепь РНК транслируется для получения четырех неструктурных белков, вместе реплицирующих геномную РНК и транскрибирующих многочисленные субгеномные мРНК, кодирующие гетерологичный белок. По причине отсутствия экспрессии структурных белков альфавируса репликоны неспособны генерировать инфекционные частицы. Промотор бактериофага T7 локализован выше кДНК альфавируса для облегчения синтеза репликона РНК in vitro, и рибозим вируса гепатита дельта (HDV), локализованный непосредственно ниже поли(A)-хвоста, генерирует правильный 3’-конец посредством своей саморасщепляющейся активности. Последовательности четырех плазмид, используемых в примерах, представлены на фигурах 7A-7B.
После линеаризации плазмидной ДНК ниже рибозима HDV с использованием подходящей рестрикционной эндонуклеазы синтезировали run-off транскрипты in vitro с использованием ДНК-зависимой РНК-полимеразы бактериофага T7 или SP6. Транскрипцию осуществляли в течение 2 часов при 37°C в присутствии 7,5 мМ (РНК-полимераза T7) или 5 мМ (РНК-полимераза SP6) конечной концентрации каждого из нуклеозидтрифосфатов (АТФ, ЦТФ, ГТФ и УТФ) по инструкциям производителя (Ambion, Austin, TX). После транскрипции матрицу ДНК расщепляли с использованием ДНКазы TURBO (Ambion, Austin, TX). Репликон РНК осаждали LiCl и растворяли в несодержащей нуклеазу воде. Некэпированную РНК кэпировали посттранскрипционно с использованием фермента кэпирования вируса Vaccinia (VCE) с использованием системы кэпирования ScriptCap m7G (Epicentre Biotechnologies, Madison, WI), как указано в руководстве пользователя. Посттранскрипционно кэпированную РНК осаждали LiCl и разводили в несодержащей нуклеазу воде. Альтернативно, репликоны можно кэпировать добавлением реакций транскрипции с использованием 6 мМ (для РНК-полимеразы T7) или 4 мМ (для РНК-полимеразы SP6) m7G(5’)ppp(5’)G, нереверсивного аналога структуры кэпа (New England Biolabs, Beverly, MA), и сниженной до 1,5 мМ (для РНК-полимеразы T7) или 1 мМ (для РНК-полимеразы SP6) концентрации гуанозинтрифосфата. Затем транскрипты можно очищать с использованием расщепления ДНКазой TURBO (Ambion, Austin, TX) после осаждения LiCL и промывания в 75% этаноле.
Концентрацию образцов РНК определяли измерением оптической плотности при 260 нм. Целостность транскриптов in vitro подтверждали денатурирующим электрофорезом в агарозном геле по наличию полноразмерной конструкции.
Образование комплексов РНК
Количество азота в растворе вычисляли по концентрации катионного липида, например, DOTAP содержит 1 атом азота, который может протонироваться, на молекулу. Концентрацию РНК использовали для вычисления количества фосфата в растворе с использованием возможного количества 3 нмоль фосфата на микрограмм РНК. Варьируя количество РНК:липида, можно модифицировать соотношение N/P. РНК образовывала комплексы с CNE в диапазоне соотношений азот/фосфат (N/P). Вычисление соотношения N/P осуществляли посредством вычисления количества в молях протонируемых атомов азота в эмульсии на миллилитр. Для вычисления количества фосфатов использовали константу 3 нмоля фосфата на микрограмм РНК. После определения значений к РНК добавляли соответствующее соотношение эмульсии. С использованием этих значений РНК разводили до соответствующей концентрации и добавляли непосредственно в равный объем эмульсии, одновременно слегка перемешивая на центрифуге типа вортекс. Раствору позволяли осаждаться при комнатной температуре в течение приблизительно 2 часов. После образования комплексов полученный раствор разводили до соответствующей концентрации и использовали в пределах 1 часа.
Электрофорез в геле
Денатурирующий электрофорез в геле осуществляли для оценки связывания РНК катионными составами и стабильности в присутствии РНКазы A. Гель заливали следующим образом: 2 г агарозы (Bio-Rad, Hercules, CA) добавляли в 180 мл воды и нагревали в микроволновой печи до растворения, а затем охлаждали до 60°C. Затем 20 мл 10-кратного денатурирующего буфера для геля (Ambion, Austin, TX) добавляли в раствор агарозы. Гель застывал, и ему позволяли стоять по меньшей мере 45 минут при комнатной температуре. Затем гель помещали в электрофорезную камеру и добавляли 1-кратный подвижный буфер MOPS (Ambion, Austin, TX) так, чтобы покрывать гель на несколько миллиметров.
Анализ защиты от действия РНКаз
Расщепления РНКазой достигали инкубацией с 6,4 mAu (миллиединиц поглощения) РНКазы A на микрограмм РНК (Ambion, Hercules, CA) в течение 30 минут при комнатной температуре. РНКазу инактивировали протеиназой K (Novagen, Darmstadt, Germany) посредством инкубации образца при 55°C в течение 10 минут. Образцы после инактивации РНКазы подвергали разрушению комплексов с использованием смеси 1:1 образца и 25:24:1 фенол:хлороформ:изоамиловый спирт. Образцы переворачивали несколько раз для смешивания и затем помещали в центрифугу в течение 15 минут при 12k об./мин. Водную фазу удаляли из органической фазы и использовали для анализа РНК. Перед нагрузкой (460 нг на лунку) все образцы инкубировали с формальдегидным красителем для нанесения, подвергали денатурации в течение 10 минут при 65°C и охлаждали до комнатной температуры. Маркеры Ambion Millennium использовали для приблизительного определения молекулярной массы конструкции РНК. Гель подвергали электрофорезу при 130 В. Гель окрашивали с использованием 0,1% SYBR gold по инструкциям производителя (Invitrogen, Carlsbad, CA) в воде посредством встряхивания при комнатной температуре в течение 1 часа. Изображения геля получали с использованием системы визуализации Bio-Rad Chemidoc XRS (Hercules, CA). Во всех исследованиях использовали РНК из тимуса мыши от Clonetech (Mountain View, CA).
Анализ связывания гепарина
РНК образовывала комплексы, как описано выше. Комплекс РНК/CNE инкубировали с различными концентрациями гепаринсульфата (Alfa Aesar, Ward Hill MA) в течение 30 минут при комнатной температуре. Получаемые растворы центрифугировали в течение 15-20 минут. Центрифужные пробирки прокалывали шприцом для введения туберкулина и удаляли субнатант. Затем раствор анализировали на концентрацию РНК с использованием набора Quant-it Ribogreen RNA Assay Kit (Invitrogen, Carlsbad CA) по инструкциям производителя. Образцы анализировали на флуоресцентном спектрофотометре Biotek Synergy 4 (Winooski, VT) для чтения планшетов. Величины РНК вычисляли с использованием стандартной кривой.
Анализ размера частиц
Размер частиц эмульсии измеряли с использованием Zetasizer Nano ZS (Malvern Instruments, Worcestershire, UK) по инструкциям производителя. Размеры частиц обозначали как Z-среднее (ZAve) с индексом полидисперсности (pdi). Перед измерениями все образцы разводили в воде. Дополнительно, размер частиц эмульсии измеряли с использованием измерителя частиц Horiba LA-930 (Horiba Scientific, USA). Перед измерениями все образцы разводили в воде. Дзета-потенциал измеряли с использованием Zetasizer Nano ZS с использованием разведенных образцов по инструкциям производителя.
Анализ секретируемой щелочной фосфатазы (SEAP)
Для оценки кинетики и величины продукции, антиген репликон РНК, кодирующий SEAP, вводили мышам внутримышечно с составом и без него. Группы по 3 или 5 самок мышей Balb/C возрастом 8-10 недель и массой приблизительно 20 г иммунизировали с использованием CNE в комплексе с репликоном РНК, кодирующим SEAP, при указанных соотношениях N/P. РНК без оболочки составляли в несодержащем РНКазу 1-кратном PBS. Дозу 100 мкл вводили каждой мыши (50 мкл на участок) в четырехглавую мышцу бедра. Образцы крови забирали через 1, 3 и 6 дней после инъекции. Сыворотку отделяли от крови непосредственно после забора и хранили при -30°C до использования.
Систему для хемилюминесцентного анализа SEAP Phospha-Light (Applied Biosystems, Bedford, MA) использовали для анализа сыворотки. Сыворотки мышей разводили 1:4 в 1-кратном буфере для разведения Phospha-Light. Образцы помещали на водную баню запаянными с использованием алюминиевой фольги и инактивировали нагреванием в течение 30 минут при 65°C. После охлаждения на льду в течение 3 минут уравновешивали до комнатной температуры, в лунки добавляли 50 мкл аналитического буфера Phospha-Light и образцы оставляли при комнатной температуре в течение 5 минут. Затем добавляли 50 мкл реакционного буфера, содержащего 1:20 субстрат CSPD® (хемилюминесцентный субстрат щелочной фосфат), и измеряли люминесценцию после 20 минут инкубации при комнатной температуре. Люминесценцию измеряли на люминометре Berthold Centra LB 960 (Oak Ridge, TN) со временем считывания 1 секунда на лунку. Активность SEAP в каждом образце измеряли в двух параллелях, и представлено значение этих двух измерений.
Электропорация
Электропорация являлась очень эффективным способом доставки вакцин плазмидной ДНК, и этот способ использовали для доставки самореплицирующейся РНК. Мышей анестезировали с использованием изофлурана, тщательно брили обе задние конечности, чтобы обнажить участок на конечности, подлежащий обработке. Дозу вакцины 30 мкл инъецировали в четырехглавую мышцу бедра с использованием инсулинового шприца ½ cc. Мышцу подвергали электропорации с использованием системы доставки ДНК Elgen® (Inovio, San Diego). Параметры инструмента являлись следующими: 60 В, 2 импульса каждые 60 мсек. Другую дозу аналогично вводили во вторую конечность после электропорации.
Вирусные репликонные частицы (VRP)
Для сравнения РНК-вакцин с традиционными РНК-векторными подходами для достижения экспрессии репортерных генов или антигенов in vivo, авторы использовали вирусные репликонные частицы (VRP), продуцируемые в клетках BHK способами, описываемыми Perri et al. В этой системе репликоны антигена (или репортерного гена), состоящие из химерных репликонов альфавируса (VCR), получаемые из генома вируса венесуэльского энцефалита лошадей (VEEV), сконструированного так, чтобы содержать 3’-концевые последовательности (3’-UTR) вируса Синдбис и сигнала упаковки вируса Синдбис (PS) (см. фиг. 2 в Perri S., et al., J Virol 77: 10394-10403 (2003)). Эти репликоны упаковывали в VRP посредством их совместной электропорации в клетки почки новорожденного хомяка (BHK) вместе с дефектной хелперной РНК, кодирующей капсид вируса Синдбис и гены гликопротеинов (см. фиг. 2 в Perri et al.). Затем собирали VRP, титровали стандартными способами и инокулировали в животных в культуральной жидкости или других изотонических буферах.
2. Анализ размера частиц эмульсий "масло-в-воде".
После производства эмульсии анализировали на размер частиц и дзета-потенциал. В таблицах 3 и 4 приведены данные о размере частиц и данные о дзета-потенциале, получаемые до и после образования комплексов при соотношении N/P 4:1 и 10:1. Размер частиц эмульсий составлял менее 160 нм для всех тестируемых составов при измерении на измерителе частиц Nano ZS. После образования комплексов размеры некоторых частиц значительно повышались, в частности, при соотношении N/P 4:1. Вероятно, это происходит в результате агрегации и сшивания РНК между многочисленными каплями эмульсии. Данные, полученные с помощью Horiba, как правило, хорошо совпадают с измерениями при помощи NanoZS, за исключением нескольких случаев (CNE02 и CNE32), когда, по-видимому, существует скопление больших частиц, которые нельзя проанализировать с использованием nanoZS. Все CNE, за исключением CNE02 и CNE32, составляли менее чем 190 нм по размеру при измерении с помощью измерителя частиц Horiba. Низкая вариабельность размера свидетельствует о надежном способе обработки, независящем от количества или типа добавляемого катионного липида. Особенно желательно, чтобы средний размер частиц составлял менее 200 нм по размеру для возможности стерилизации фильтрацией. Все тестируемые образцы соответствовали этому критерию.

Дзета-потенциал являлся немного более изменчивым, чем размер частиц (таблица 4). Это соответствует ожиданиям, т.к. число, по которому отличаются эти составы, отражает изменение концентрации катионного липида. Например, каждый из CNE01, CNE02 и CNE17 содержит 0,8, 1,6 и 1,2 мг/мл DOTAP, соответственно. Дзета-потенциал для этих партий соответствовал ожиданиям: CNE01 имел наименьший дзета-потенциал 15,9 мВ до образования комплексов, затем CNE17 с дзета-потенциалом до образования комплексов 33,4 мВ и в конце CNE02 с дзета-потенциалом 43 мВ. Дзета-потенциал после образования комплексов, как правило, не изменялся значительно по сравнению с дзета-потенциалом до образования комплексов, вероятно, по причине избыточного заряда в эмульсиях.

3. Анализ стабильности при действии РНКаз
Для оценки способности эмульсий защищать от деградации РНКазами разрабатывали анализ in vitro для скрининга составов. На фигуре 1 показаны результаты анализа защиты от РНКаз CNE01 и CNE17 при соотношениях N/P 10:1 и 4:1. CNE01 защищал РНК лучше при соотношении 10:1 по сравнению с соотношением 4:1. CNE17 демонстрировал хорошую защиту при 10:1. На фигуре 2 показано, что CNE17 также был способен защищать РНК при соотношении N/P 4:1. CNE12 и 13 также защищали РНК (аналогично CNE17) при обоих соотношениях заряда (фигура 2). На фигуре 3 показаны результаты, аналогичные результатам на фигуре 1, где CNE01 не очень хорошо защищал при соотношении N/P 4:1. CNE02 защищал от РНКаз хорошо при обоих тестируемых соотношениях N/P (фигуры 3 и 4). CNE04 не защищал РНК от расщепления РНКазой, но CNE05 был способен защищать РНК при обоих тестируемых соотношениях заряда (фигура 5). CNE27 демонстрировал очень небольшую защиту от РНКаз, в то время как CNE32 демонстрировал немного большую защиту, но, в общем, меньшую, чем указанные выше составы. CNE 35 (фигура 6) был способен незначительно защищать РНК от деградации РНКазами. В общем, 5 различных составов были способны предотвращать деградацию РНК in vitro.
4. Скрининг SEAP in vivo
Репликон A306, экспрессирующий секретируемую щелочную фосфатазу (SEAP), использовали для определения уровня экспрессии белка in vivo после введения альфавирусных векторов. Мышам BALB/c, 5 животным на группу, билатерально внутримышечно вводили вакцину (50 мкл на конечность) в день 0 с VRP, экспрессирующими SEAP (5×105 МЕ), самореплицирующейся РНК без оболочки (A306, 1 мкг), самореплицирующейся РНК, доставляемой с использованием электропорации (A306+EP, 1 и 0,1 мкг, соответственно) и самореплицирующейся РНК, составленной с CNE17, CNE05 и CNE35 при соотношении N/P 10:1, полученной, как описано выше (1 мкг или 0,1 мкг A306). Уровни SEAP в сыворотке (относительные световые единицы, RLU) в день 1, 3 и 6 после внутримышечной вакцинации в день 0 представлены в таблице 5. Данные представлены как среднее арифметическое титров 5 отдельных мышей на группу.

В таблице 5 показано, что уровни SEAP в сыворотке повышались, если РНК составляли в CNE17 относительно контрольной РНК без оболочки при аналогичной дозе. Экспрессия SEAP повышалась, если РНК составляли в CNE относительно контрольных VRP, но кинетика экспрессии сильно отличалась. Доставка электропорацией приводила к повышению экспрессии SEAP относительно контрольной РНК без оболочки, но эти уровни меньше уровней экспрессии SEAP, когда РНК составляли с CNE17. CNE05 и CNE35 снижали уровень экспрессии белка.
5. Эффект соотношения N/P на экспрессию SEAP (CNE17)
Репликон A306, экспрессирующий секретируемую щелочную фосфатазу (SEAP), использовали для определения уровня экспрессии белка in vivo после введения альфавирусных векторов. Мышам BALB/c, 5 животным на группу, билатерально внутримышечно вводили вакцину (50 мкл на конечность) в день 0 с самореплицирующейся РНК без оболочки (A306, 1 мкг), самореплицирующейся РНК, составленной с CNE17, полученной, как описано выше (A306, 1 мкг), при следующих соотношениях N/P 6:1, 7:1, 8:1, 10:1, 12:1, 13:1, 14:1, 16:1.
Уровни SEAP в сыворотке (относительные световые единицы, RLU) в дни 1, 3 и 6 после внутримышечной вакцинации в день 0 представлены в таблице 6. Данные представлены как среднее арифметическое титров 5 отдельных мышей на группу. Корреляция связывания гепаринсульфата по сравнению с экспрессией SEAP в день 6 представлена в таблице 7. Указаны процентные доли РНК, высвобождающейся из комплекса при 6-, 8- и 10-кратном гепаринсульфате, соответственно.


В таблицах 6 и 7 показано, что уровни SEAP в сыворотке повышались, если РНК составляли при соотношении N/P 10:1, относительно контрольной РНК без оболочки при аналогичной дозе. Другое тестируемое соотношение N/P характеризовалось меньшими уровнями экспрессии белка по сравнению с соотношением N/P 10:1, но все из них демонстрировали более высокий ответ, чем РНК без оболочки. Необходимо отметить, что средние величины SEAP для РНК без оболочки значительно колебались, как приведено, в качестве примера, в таблицах 5 и 6, с экспрессией приблизительно 35000 в одном эксперименте и 5000 в другом. Уровень экспрессии белка в день 6 хорошо коррелировал с высвобождением гепарина.
6. Эффект соотношений N/P на экспрессию SEAP (CNE13)
Репликон A306, экспрессирующий секретируемую щелочную фосфатазу (SEAP), использовали для определения уровня экспрессии белка in vivo после введения альфавирусных векторов. Мышам BALB/c, 5 животным на группу, билатерально внутримышечно вводили вакцину (50 мкл на конечность) в день 0 с самореплицирующейся РНК без оболочки (A306, 1 мкг), самореплицирующейся РНК, составленной с CNE13, полученной, как описано выше (1 мкг A306), при следующих соотношениях N/P 6:1, 8:1, 10:1, 12:1, 14:1, 16:1, 18:1.
Уровни SEAP в сыворотке (относительные световые единицы, RLU) в дни 1, 3 и 6 после внутримышечной вакцинации в день 0 представлены в таблице 8. Данные представлены как среднее арифметическое титров 5 отдельных мышей на группу. Корреляция связывания гепаринсульфата по сравнению с экспрессией SEAP в день 6 представлена в таблице 9. Указаны процентные доли РНК, высвобождающейся из комплекса при 6-, 8- и 10-кратном гепаринсульфате, соответственно.


В таблицах 8 и 9 показано, что уровни SEAP в сыворотке повышались, если РНК составляли при тестируемом соотношении N/P относительно контрольной РНК без оболочки при аналогичной дозе. Уровень экспрессии белка в день 6 хорошо коррелировал с высвобождением гепарина.
7. Эффект соотношений N/P на экспрессию SEAP (CNE01)
Репликон A306, экспрессирующий секретируемую щелочную фосфатазу (SEAP), использовали для определения уровня экспрессии белка in vivo после введения альфавирусных векторов. Мышам BALB/c, 5 животным на группу, билатерально внутримышечно вводили вакцину (50 мкл на конечность) в день 0 с самореплицирующейся РНК без оболочки (A306, 1 мкг), самореплицирующейся РНК, составленной с CNE01, полученной, как описано выше (1 мкг A306), при следующих соотношениях N/P 4:1, 10:1, 12:1, 14:1, 16:1, 18:1.
Уровни SEAP в сыворотке (относительные световые единицы, RLU) в дни 1, 3 и 6 после внутримышечной вакцинации в день 0 представлены в таблице 10. D Данные представлены как среднее арифметическое относительных световых единиц (RLU) 5 отдельных мышей на группу. Корреляция связывания гепаринсульфата по сравнению с экспрессией SEAP в день 6 представлена в таблице 11. Указаны процентные доли РНК, высвобождающейся из комплекса при 6-, 8- и 10-кратном гепаринсульфате, соответственно.


В таблицах 10 и 11 показано, что уровни SEAP в сыворотке повышались, если РНК составляли при тестируемом соотношении N/P относительно контрольной РНК без оболочки при аналогичной дозе.
ПРИМЕР 3: ОЦЕНКА УРОВНЕЙ ЭКСПРЕССИИ БЕЛКА С ИСПОЛЬЗОВАНИЕМ РАЗЛИЧНЫХ МАСЕЛ
Серию эмульсий получали с использованием различных масел, но в рамках основного состава CNE17, т.е. 5% масла, 0,5% Tween 80, 0,5% SPAN85 и 1,4 мг/мл DOTAP. В таблице 12 ниже представлены изменения масел для каждой из групп. Классификация масел также представлена в таблице 12.
Эмульсии тестировали при соотношении N/P 10:1 и получали комплексы, как описано выше. Мышам BALB/c, 5 животным на группу, билатерально внутримышечно вводили вакцину (50 мкл на конечность) в день 0 с VRP, экспрессирующими SEAP (5×105 МЕ), самореплицирующейся РНК без оболочки (A306, 1 мкг), самореплицирующейся РНК, доставляемой с использованием электропорации (A306+EP, 1 и 0,1 мкг), и самореплицирующейся РНК, составленной с CNE36, CNE37, CNE38 и CNE41, полученной, как описано выше (1 мкг A306). Уровни сыворотки SEAP (относительные световые единицы, RLU) в дни 1, 3 и 6 после внутримышечной вакцинации в день 0 представлены в таблице 13. Данные представлены как среднее арифметическое RLU 5 отдельных мышей на группу.

Как показано в таблице 13, CNE17 демонстрирует наибольший уровень экспрессии на всем протяжении исследований. Все остальные эмульсии уступали дозе 1 мкг РНК без оболочки. CNE36 приводил in the highest expression of the new oils, вслед за ним CNE41 и CNE38. Доза 1 мкг РНК, добавленная непосредственно в MF59, снижала ответ.
ПРИМЕР 4: ПОВЫШЕННАЯ CNE17 ИММУНОГЕННОСТЬ АНТИГЕНА RSV-F IN НА МОДЕЛИ МЫШИ
1. Способы
Исследования иммуногенности у мышей
Для этого исследования использовали репликон A317, экспрессирующий поверхностный слитый гликопротеин RSV (RSV-F). Мышам BALB/c возрастом 8-10 недель и массой приблизительно 20 г, 10 животных на группу, билатерально внутримышечно вводили вакцину. Всем животным делали инъекцию в четырехглавую мышцу бедра в две задние конечности, одинаковый объем в каждую (50 мкл на конечность) в дни 0 и 21 с VRP, экспрессирующими RSV-F (1×106 МЕ), самореплицирующейся РНК без оболочки (A317, 1 мкг), самореплицирующейся РНК, доставляемой с использованием электропорации (10 мкг A317 + EP), или самореплицирующейся РНК, составленной в CNE17 (0,1 мкг или 1 мкг A317). Сыворотку собирали для анализа антител в дни 14 (2wp1), 35 (2wp2) и 49 (4wp2). Если требовалось измерение T-клеточных ответов, у 5 мышей на группу для T-клеточного анализа забирали селезенки в день 35 или 49.
Анализы функций T-клеток мыши: иммунофлуоресцентный анализ внутриклеточных цитокинов
Забирали от двух до пяти селезенок от идентично вакцинированных мышей BALB/c и получали отдельные клеточные суспензии для культивирования. Две антиген-стимулированные культуры и две нестимулированные культуры анализировали на совокупность спленоцитов в каждой. Антиген-стимулированные культуры содержали 1×106 спленоцитов, пептид RSV F 85-93 (1×106 M), пептид RSV F 249-258 (1×106 M), пептид RSV F 51-66 (1×106 M), mAb против CD28 (1 мкг/мл) и брефелдин A (1:1000). Нестимулированные культуры не содержали пептиды RSV F и в остальном являлись идентичными стимулированным культурам. После культивирования в течение 6 часов при 37°C культуры обрабатывали для иммунофлуоресцентного анализа. Клетки промывали, а затем окрашивали флуоресцентно мечеными моноклональными антителами (mAb) против CD4 и против CD 8. Клетки снова промывали и затем фиксировали с использованием Cytofix/cytoperm в течение 20 минут. Затем фиксированные клетки промывали буфером Perm/Wash, а затем окрашивали с помощью флуоресцентно меченых mAb, специфичных для ИФНγ, ФНО, ИЛ-2 и ИЛ-5. Окрашенные клетки промывали, а затем анализировали с использованием проточного цитометра LSR II. Для анализа полученных данных использовали программное обеспечение Flow Jo. Субпопуляции T-клеток CD4+8 и CD8+4 анализировали раздельно. Для каждой субпопуляции в указанном образце определяли % цитокин-позитивных клеток. % RSV F антиген-специфичных T-клеток вычисляли как разницу между % цитокин-позитивных клеток в стимулированных антигеном культурах и % цитокин-позитивных клеток в нестимулированных культурах. Доверительный интервал 95% для % антиген-специфичных клеток определяли с использованием стандартных способов (Statistical Methods, 7th Edition, G.W. Snedecor and W.G. Cochran).
Анализы функций T-клеток мыши: анализ секретируемых цитокинов
Культуры для анализа секретируемых цитокинов являлись аналогичными культурам для иммунофлуоресцентного анализа внутриклеточных цитокинов, за исключением отсутствия брефелдина A. Супернатанты культур собирали после культивирования в течение ночи при 37°C и анализировали на различные цитокины с использованием наборов для определения Th1/Th2-цитокинов мыши от Meso Scale Discovery. Количество каждого цитокина в культуре определяли по стандартным кривым, полученным с использованием очищенных, рекомбинантных цитокинов, поставляемых производителем.
2. Повышенная CNE17 иммуногенность антигена RSV-F на модели мыши
Титры F-специфичных IgG в сыворотке в день 14, 35 и 49 представлены в таблицах 14, 15 и 16. Титры нейтрализующих RSV антител в сыворотке в день 35 и 49 представлены в таблице 17, а T-клеточные ответы в день 49 представлены в таблице 18 и 19.

Сыворотку собирали для анализа антител в день 14 (2wp1). Данные представлены как значения для отдельных животных и среднее геометрическое титров 10 отдельных мышей на группу. Если отдельное животное имеет титр <25 (предел чувствительности), ему присваивали титр 5.

Сыворотку собирали для анализа антител в день 35 (2wp2). Данные представлены как значения для отдельных животных и среднее геометрическое титров 10 отдельных мышей на группу. Если отдельное животное имеет титр <25 (предел чувствительности), ему присваивали титр 5.

Сыворотку собирали для анализа антител в день 49 (4wp2). Данные представлены как значения для отдельных животных и среднее геометрическое титров 10 отдельных мышей на группу. Если отдельное животное имеет титр <25 (предел чувствительности), ему присваивали титр 5.

Сыворотку собирали для анализа в дни 35 (2wp2) и 49 (4wp2). Данные представлены как 60% титры при нейтрализации реакции бляшкообразования для отдельных мышей и среднее геометрическое титра 10 отдельных мышей на группу. Если отдельное животное имеет титр <40 (предел чувствительности), ему присваивали титр 20. NA=не анализировали.

Представлена общая частота (антиген-специфичных) цитокин-позитивных клеток (%)±95% доверительный полуинтервал. Общие частоты, обозначенные полужирным шрифтом, указывают на стимулированные ответы, которые являлись статистически значимыми >0.

Представлена общая частота (антиген-специфичных) цитокин-позитивных клеток (%)±95% доверительный полуинтервал. Общие частоты, обозначенные полужирным шрифтом, указывают на стимулированные ответы, которые являлись статистически значимыми >0.
Как показано в таблицах 14-19, состав CNE17 повышал иммуногенность, как определяли по повышению титров F-специфичных IgG (5-кратное повышение в 4wp2), титров нейтрализующих антител и CD4 и CD8 T-клеточных ответов относительно контрольной РНК без оболочки. Электропорация РНК повышала иммуногенность относительно контрольной РНК без оболочки, но была меньше, чем при доставке с помощью CNE17. Важно, что иммунные ответы, вызываемые в группах, которым вводили CNE17, колебались намного меньше по сравнению с таковыми для без РНК оболочки. Например, в день 14 образцы из группы, которой вводили 1 мкг самореплицирующейся РНК без оболочки, демонстрировали титры антител от 529 до 5110, в то время как образцы РНК, составленные с CNE17 при дозе 1 мкг, демонстрировали титры антител от 1927 до 5731. Кроме того, все животные в группе, которой вводили CNE17, отвечали с сильным ответом и хорошо отвечали на повторную вакцинацию. Наоборот, некоторые животные из группы, которой вводили РНК без оболочки, незначительно отвечали на повторную вакцинацию.
ПРИМЕР 5: ИММУНОГЕННОСТЬ КОМПЛЕКСОВ РНК-ЧАСТИЦЫ НА МОДЕЛИ КРЫСЫ
1. Способы
Вакцина с субъединицами тримера RSV-F
Тример RSV F является рекомбинантным белком, содержащим эктодомен RSV F с делецией области слитного пептида, предотвращающей ассоциацию с другими тримерами. Получаемая конструкция образует гомотример, наблюдаемый при эксклюзионной хроматографии, и обладает ожидаемым фенотипом, соответствующий конформации F после слияния, наблюдаемой при электронной микроскопии. Белок экспрессировали в клетках насекомых и очищали с помощью полигистидиновой метки, слитой с C-концом конструкции, с последующей эксклюзионной хроматографией с использованием общепринятых способов. Получаемый образец белка демонстрировал чистоту выше 95%. Для оценки вакцины с F-субъединицами in vivo 100 мкг/мл тримерного белка адсорбировали на 2 мг/мл алюминия с использованием 10 мМ гистидинового буфера с pH 6,3 и корректировали изотоничность до 150 мМ с помощью хлорида натрия. Белок F-субъединицы адсорбировали на алюминии в течение ночи при осторожном перемешивании при 2-8°C.
Вакцинация и провокационная проба хлопковых хомяков
Самок хлопкового хомяка (Sigmodon hispidis) получали из Harlan Laboratories. Все исследования являлись одобренными, и их осуществляли согласно требованиям Novartis Animal Care and Use Committee. Группы животных иммунизировали внутримышечно (i.m., 100 мкл) указанными вакцинами в дни 0 и 21. Образцы сыворотки собирали через 3 недели после первой иммунизации и через 2 недели после второй иммунизации. Иммунизированным или невакцинированным контрольным животным интраназально (i.n.) проводили провокационную пробу с 1×105 БОЕ RSV через 4 недели после конечной иммунизации. Забор крови и провокацию RSV осуществляли под анестезией 3% изофлураном с использованием прецизионного ингалятора.
RSV F-специфичная ELISA
Отдельные образцы сыворотки анализировали на наличие RSV F-специфичных IgG с использованием твердофазного иммуноферментного анализа (ELISA). Планшеты для ELISA (96-луночный планшет MaxiSorp, Nunc) покрывали 1 мкг/мл очищенным RSV F (нерасщепленный delp23-furdel-trunc) в PBS в течение ночи при 4°C. После промывания (PBS с 0,1% Tween-20) планшеты блокировали блокирующим буфером Superblock в PBS (Thermo Scientific) в течение по меньшей мере 1,5 часов при 37°C. Затем планшеты промывали серийными разведениями сыворотки, добавляли раствор для разведения (PBS с 0,1% Tween-20 и 5% сывороткой козла) от экспериментальных или контрольных хлопковых хомяков, и планшеты инкубировали в течение 2 часов при 37°C. После промывания, планшеты инкубировали с конъюгированными с пероксидазой хрена (HRP) антителами курицы против IgG хлопкового хомяка (Immunology Consultants Laboratory, Inc, разведенными 1:5000 в растворе для разведения) в течение 1 часа при 37°C. В конечном итоге, планшеты промывали и добавляли 100 мкл раствора субстрата пероксидазы TMB (Kirkegaard & Perry Laboratories, Inc) в каждую лунку. Реакции останавливали добавлением 100 мкл 1M H3PO4 и считывали поглощение при 450 нм с использованием спектрофотометра для чтения планшетов. Для каждого образца сыворотки строили график оптической плотности (OD) относительно логарифма величины, обратной разведению сыворотки, с помощью нелинейной регрессии (GraphPad Prism). Титры определяли как величину, обратную разведению сыворотки, при OD приблизительно 0,5 (нормированной к стандарту, смешанные сыворотки от RSV-инфицированных хлопковых хомяков с определенным титром 1:2500, включенные на каждый планшет).
Анализ микронейтрализации
Образцы сыворотки тестировали на наличие нейтрализующих антител посредством реакции нейтрализации бляшкообразования (PRNT). Двукратные серийные разведения HI-сыворотки (в PBS с 5% HI-FBS) добавляли к равному объему RSV Long, заранее раститрованному для получения приблизительно 115 БОЕ/25 мкл. Смеси сыворотка/вирус инкубировали в течение 2 часов при 37°C и 5% CO2, позволяя происходить нейтрализации вируса, и затем 25 мкл этой смеси (содержащей приблизительно 115 БОЕ) инокулировали на лунки с клетками HEp-2 в двух повторениях на 96-луночных планшетах. Через 2 часа при 37°C и 5% CO2 к клеткам добавляли 0,75% метилцеллюлозу/EMEM 5% HI-FBS и инкубировали в течение 42 часов. Количество инфекционных вирусных частиц определяли детекцией образования синцития посредством иммуноокрашивания с последующим автоматическим подсчетом. Титр нейтрализующих антител определяют как величину, обратную разведению сыворотки, при котором наблюдают по меньшей мере 60% снижения количества синцитиев на лунку относительно контролей (без сыворотки).
Вирусная нагрузка
Вирусную нагрузку в легких определяли анализом бляшкообразования. Конкретно, легкие забирали через 5 дней после инфицирования RSV, одну правую долю помещали в 2,5 мл модифицированной по Дульбекко среды Игла (DMEM, Invitrogen) с 25% сахарозы и разрушали тканевым гомогенизатором. Несодержащие клеток супернатанты из этих образцов хранили при -80°C. Для анализа на инфекционный вирус разведения осветленный гомогенат легких (в PBS с 5% инактивированной нагреванием эмбриональной телячьей сывороткой, HI-FBS) инокулировали на конфлюэнтные монослои клеток HEp-2 в объеме 200 мкл/лунку 12-луночного планшета. Через 2 часа с периодическим осторожным встряхиванием (37°C, 5% CO2) инокулят удаляли, и к клеткам добавляли 1,5 мл 1,25% агарозы SeaPlaque (Lonza) в минимальной эссенциальной среде Игла (EMEM, Lonza), дополненной 5% HI-FBS, глутамином и антибиотиками. Через 3-4 дня инкубации к клеткам снова добавляли 1 мл 1,25% агарозы в EMEM (Sigma), содержащей 0,1% нейтрального красного (Sigma). Бляшки подсчитывали через один день с помощью негатоскопа.
Патологическое исследование легких хлопкового хомяка
Через пять дней после провокационной пробы RSV забирали легкие, собирали 4 доли от каждого животного и фиксировали 10% нейтральным буферизованным формалином (NBF) посредством осторожной интратрахеальной инстилляции с последующей иммерсионной фиксацией. Ткани обрабатывали общепринятым способом для получения срезов, окрашенных гематоксилином и эозином, для микроскопического исследования. Результаты оценивали с использованием модификации опубликованных ранее критериев [Prince G.A., et al., 2001] для следующих параметров: перибронхиолит, альвеолит, бронхит, периваскулярные клеточные инфильтраты и интерстициальный пневмонит. Поражения классифицировали по 4-ступенчатой полуколичественной шкале. Минимальное (+) изменение содержало один или несколько небольших фокусов; умеренное (++) изменение состояло из фокусов от небольшого до среднего размера; среднее (+++) изменение содержало многочисленные фокусы и/или фокусы средних размеров; и заметное (++++) изменение демонстрировало фокусы от обширных до сливающихся, затрагивающие большую часть/всю ткань.
2. RSV-провокационная проба хлопкового хомяка
Для этого исследования использовали репликон A317, экспрессирующий поверхностный слитый гликопротеин RSV (RSV-F). Хлопковым хомякам (Sigmodon hispidus), 8 животным на группу, билатерально внутримышечно вводили вакцину (50 мкл на конечность) в дни 0 и 21 с самореплицирующейся РНК без оболочки (A317, 1 мкг или 10 мкг), самореплицирующейся РНК, составленной с CNE17 (A317, 0,1 мкг или 1 мкг), VRP (5×106 МЕ), экспрессирующими RSV-F, субъединицей F-тримера/алюминия (10 мкг) или инактивированной формалином вакциной RSV (5200 FI-БОЕ). Сыворотку собирали для анализа антител в день 14 (2wp1) и 35 (2wp2). Всем животным проводили провокационную пробу с 1×105 БОЕ RSV интраназально в день 49 и собирали легкие в день 54 (5dpc) для определения вирусной нагрузки и патологического исследования легких.
Титры F-специфичных IgG в сыворотке в день 14 и 35 представлены в таблице 20; титры отдельных антител для 8 животных из выбранных групп в момент времени 2wp2 представлены в таблице 21; титры нейтрализующих RSV антител в сыворотке в дни 14 и 35 представлены в таблице 22; вирусные титры в легких через 5 дней после провокационной пробы RSV представлены в таблице 23; и баллы оценки альвеолита в легких через 5 дней после провокационной пробы RSV представлены в таблице 24.

8 животных на группу после внутримышечной вакцинации в дни 0 и 21. Сыворотку собирали для анализа антител в день 14 (2wp1) и 35 (2wp2), всем животным проводили провокационную пробу с 1×105 БОЕ RSV интраназально в день 49. Легкие собирали в день 54 (5dpc) для определения вирусной нагрузки и патологического исследования легких. Данные представлены как среднее геометрическое титров 8 отдельных хлопковых хомяков на группу. Если отдельное животное имеет титр <25 (предел чувствительности), ему присваивали титр 5.
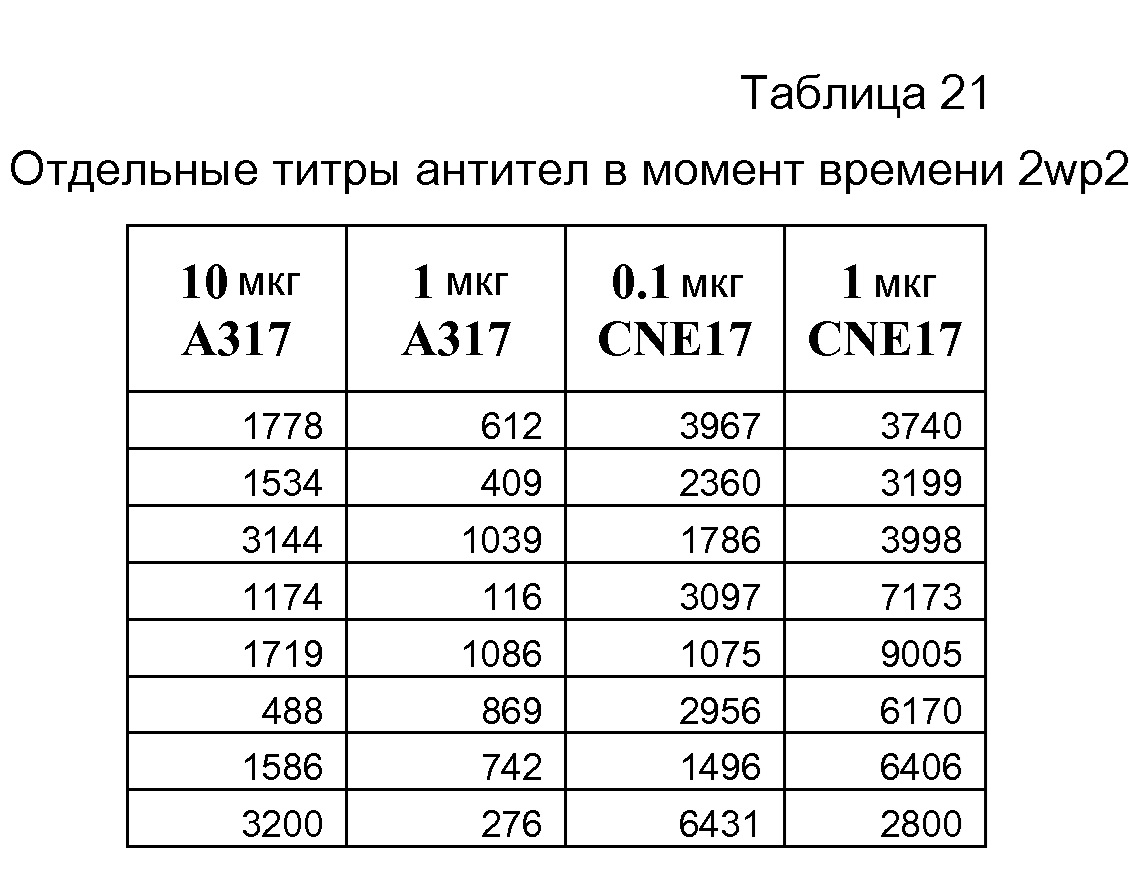
Отдельные титры антител для 8 животных из выбранных групп (РНК без оболочки и РНК, составленная с CNE).

8 животных на группу после внутримышечной вакцинации в дни 0 и 21. Сыворотку собирали для анализа в день 14 (2wp1) и 35 (2wp2). Данные представлены как 60% титры при нейтрализации реакции бляшкообразования. Среднее геометрическое титра 2 совокупностей по 4 хлопковых хомяка на группу. Если отдельное животное имеет титр <25 (предел чувствительности), ему присваивали титр 5.

8 животных на группу после внутримышечной вакцинации в дни 0 и 21. Сыворотку собирали для анализа в дни 14 (2wp1) и 35 (2wp2). Данные представлены как 60% титры при нейтрализации реакции бляшкообразования. Среднее геометрическое титров 2 совокупностей по 4 хлопковых хомяка на группу. Если отдельное животное имеет титр <25 (предел чувствительности), ему присваивали титр 5.

8 животных на группу после внутримышечной вакцинации в дни 0 и 21. Всем животным проводили провокационную пробу с 1×105 БОЕ RSV интраназально в день 49. Легкие собирали в день 54 (5dpc) для определения вирусной нагрузки и патологического исследования легких. Поражения классифицировали по 4-ступенчатой полуколичественной шкале. Минимальное (+) изменение содержало один или несколько небольших фокусов; умеренное (++) изменение состояло из фокусов от небольшого до среднего размера; среднее (+++) изменение содержало многочисленные фокусы и/или фокусы средних размеров; и заметное (++++) изменение демонстрировало фокусы от обширных до сливающихся, затрагивающие большую часть/всю ткань.
Это исследование демонстрирует иммуногенность и защитную способность репликона РНК на модели RSV хлопкового хомяка. Несоставленный репликон РНК индуцировал F-специфичные IgG в сыворотке и нейтрализующие RSV антитела после одной вакцинации, и эти ответы усиливали второй вакцинацией. В этой модели CNE являлись эффективными, повышая титры F-специфичных IgG на 1 мкг репликона РНК приблизительно в 9 раз и титры нейтрализующих антител в 4 раза после второй вакцинации. Дополнительно, CNE17 снижал существенные изменения иммунных ответов, наблюдаемых при использовании РНК без оболочки, независимо от доз (0,1 или 1 мкг), и все животные отвечали на вакцинацию. Все вакцины с репликоном РНК обеспечивали защиту при назальной провокационной пробе RSV, снижая вирусную нагрузку в легких через 5 дней после провокационной пробы RSV больше, чем на 3 порядка 3. Сила и защитная способность иммунного ответа, вызываемого 1 мкг репликона РНК, составленного с CNE, была в 2 раза выше ответа, вызываемого 5×106 VRP.
ПРИМЕР 6: ЭФФЕКТ РАЗМЕРА ЧАСТИЦ НА ИММУНОГЕННОСТЬ
В этом примере показано, что размер частиц влияет на иммуногенность составов CNE/РНК.
Протоколы анализа размера частиц и анализа SEAP in vivo описаны в примере 2. Протоколы исследований иммуногенности у мышей описаны в примере 3.
На фигуре 8A представлены результаты (среднее арифметическое) анализа SEAP in vivo. На фигуре 8B показаны общие титры IgG отдельных животных среди мышей BALB/c в моменты времени 2wp1 и 2wp2.
Образование комплексов РНК с CNE17 повышало размер частиц от приблизительно 220 нм до приблизительно 300 нм (данные не представлены). Как показано на фигурах 8A и 8B, с повышением размера частиц снижались уровни экспрессии SEAP, а также снижались иммунные ответы у животного-хозяина.
ПРИМЕР 7: ОЦЕНКА ЭФФЕКТОВ OF АЛЬТЕРНАТИВНЫХ КАТИОННЫХ ЛИПИДОВ НА ИММУНОГЕННОСТЬ
1. Материалы и Способы.
Получение CNE
Серии эмульсий получали с использованием следующих катионных липидов: DLinDMA, DOTMA, DOEPC, DSTAP, DODAC и DODAP. В таблице 25 описывают компоненты эмульсий.
CNE получали согласно протоколам, описываемым в примере 1. Комплекс РНК/CNE получали согласно протоколам, описываемым в примере 2.

Исследования иммуногенности у мышей
Эмульсии тестировали при соотношениях N/P 10:1, N/P 12:1 или N/P 18:1 (см. таблицу 26). Затем получали комплексы репликона РНК и эмульсий, как описано выше в примере 2. Мышам BALB/c, 5-10 животным на группу, билатерально внутримышечно вводили вакцину (50 мкл на конечность) в день 0 с самореплицирующейся РНК без оболочки (A317, 1 мкг), RV01(15) (1 мкг A317, составленного в липосоме, содержащей 40% DlinDMA, 10% DSPC, 48% Chol, 2% PEG DMG 2000), самореплицирующейся РНК (A317, 1 мкг), составленной с CNE13, CNE17, CMF37, CMF38 или CMF42.
2. РНК, составленная с CNE, повышала иммуногенность антигена RSV-F на модели мыши
Общие титры IgG в сыворотке (среднее геометрическое титров) из групп мышей BALB/c в дни 14 и 35 представлены в таблице 26 (группы 1-8). РНК, составленная с CMF37 (DOTMA), хорошо повышала иммунный ответ у животного хозяина, и титры IgG являлись сравнимыми с таковыми для CNE17 (DOTAP). РНК, составленная с CMF38 (DOEPC), вызывала немного больший титр IgG, чем CNE17, но повышение не являлось статистически значимым. РНК, составленная с DSTAP, не повышало значимо иммунный ответ у животного хозяина, и низкие титры IgG, вероятно, являлись результатом низкой растворимости DSTAP в сквалене. РНК, составленная с CNE13, повышала титры IgG приблизительно в 1,5 раза по сравнению с РНК, составленной в липосоме (DDA). Общие титры антител, индуцируемых РНК, составленной с CMF43 (DODAC), являлись более низкими, чем в случае CNE17 (таблица 28, группы 7 и 8).

В группы 1-8 входило по 5 животных/группу, и в группы 9-12 входило по 10 животных/группу.
ПРИМЕР 8: ОЦЕНКА ЭФФЕКТОВ КОМПОЗИЦИЙ БУФЕРА НА ИММУНОГЕННОСТЬ
В этом примере получали различные эмульсии на основе CNE17, но с различными компонентами буфера. В таблице 27 представлены композиции эмульсии с модифицированными буферами.

Анализ связывания in vitro показал, что снижение концентрации цитратного буфера вызывало более сильное связывание РНК (данные не представлены).
Результаты исследований иммуногенности у мышей показали, что добавление сахара к CNE17 незначительно влияет на иммуногенность РНК, составленной с CNE17 (таблица 26, группы 9-12). При добавлении сорбита и декстрозы наблюдали небольшое повышение титров IgG.
В таблице 28 приведены результаты исследований иммуногенности у мышей, когда РНК, составленную с CNE17, получали, с использованием различных буферных систем.
Различные композиции буфера также влияли на размер частиц. Как показано на фигуре 9, добавление сахара (сахарозы) снижало размер частиц комплекса РНК/CNE (фигура 9A); добавление низких концентраций NaCl (при 10 мМ) также снижало размер частиц комплекса РНК/CNE (фигура 9A). Цитратный буфер не влиял на размер частиц комплекса РНК/CNE (фигура 9B).
Эффекты полимеров на размер частиц представлены на фигуре 9C. В частности, добавление 0,5% Pluronic F127 в буфер для РНК снижало размер частиц комплекса РНК/CNE до размера перед образованием комплексов (частицы CNE без РНК).
Общие титры антител и титры нейтрализующих антител для CNE17 в предпочтительных буферных системах, 280 мМ сахарозе, 10 мМ NaCl и 1 мМ цитрате; или 280 мМ сахарозе, 10 мМ NaCl, 1 мМ цитрате и 0,5% (масс./об.) Pluronic F127, представлены в таблице 28 (группы 4 и 5).
ПРИМЕР 9: ОЦЕНКА ЭФФЕКТОВ PEG-ЛИПИДОВ НА ИММУНОГЕННОСТЬ
В этом примере серию эмульсий получали с использованием PEG-липидов. В таблице 29 представлены композиции этих эмульсий на основе PEG-липидов.

Для всех эмульсий использовали стоковый раствор 10 мг/мл DOTAP в DCM и выпаривали растворитель после 1-ой гомогенизации. Исследования иммуногенности у мышей проводили, как описано выше в примере 7.
В таблице 30 показаны смешанные титры антител в моменты времени 2wp1 и 4wp2. Для группы CNE13 представлены среднее титров у отдельных животных и среднее геометрическое титров. Как показано в таблице 30, эмульсии, получаемые с использованием PEG-липидов, являлись эффективными в индуцировании иммунного ответа на антиген RSV-F, но общие титры антител были на меньшем уровне по сравнению с РНК, составленной с CNE17. Кроме того, повышение концентрации PEG-липидов приводило к снижению титров антител.
Описание будет более понятным с учетом содержания ссылок, процитированных в описании. Варианты осуществления в описании представляют собой иллюстрацию вариантов осуществления изобретения и не предназначены для ограничения объема изобретения. Специалисты в этой области легко поймут, что в изобретение включены многие другие варианты осуществления. Все публикации и патенты, процитированные в этом описании, в полном объеме включены посредством ссылки. В тех случаях, когда материал, включенный в качестве ссылки, противоречит или несовместим с этим описанием, описание заменяет любой такой материал. Цитирование любых ссылок в настоящем описании не является признанием того, что такие ссылки представляют собой известный уровень техники для настоящего изобретения.
Специалистам в этой области будет понятно, или они могут удостовериться с использованием не более чем общепринятых экспериментальных способов, что в настоящем описании представлены многие эквиваленты конкретных вариантов осуществления изобретения. Такие эквиваленты предназначены для включения в следующие варианты осуществления.
Реферат
Предложенная группа изобретений относится к области медицины. Предложена композиция, содержащая самореплицирующуюся молекулу РНК, кодирующую антиген, в комплексе с частицей катионной эмульсии «масло-в-воде», где частица содержит масляное ядро и катионный липид и где средний диаметр частиц эмульсии составляет приблизительно от 80 до 180 нм. Предложены способ получения вышеуказанной композиции, способы вызывания иммунного ответа у индивидуума и применение композиции для вызывания иммунного ответа. Предложенная группа изобретений обеспечивает стабильные композиции, подходящие для доставки молекул РНК, кодирующих антиген, в клетки и составление вакцин на основе таких молекул. 5 н. и 30 з.п. ф-лы, 14 ил., 31 табл., 9 пр.
Формула
Документы, цитированные в отчёте о поиске
Композиции, содержащие катионные микрочастицы и днк hcv е1е2, и способы их применения



Комментарии