Универсальная донорная система для направленного воздействия на гены - RU2687369C2
Код документа: RU2687369C2
Чертежи





































































Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННЫЕ ЗАЯВКИ
[0001] По данной заявке испрашивают приоритет, согласно 35 U.S.C. §119(e), предварительной патентной заявки США № 61/899,543, поданной 4 ноября 2013 года, содержание которой включено в данном документе посредством ссылки в полном объеме в настоящую заявку.
ОТСЫЛКА К СПИСКУ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННОМУ В ЭЛЕКТРОННОМ ВИДЕ
[0002] Официальная копия списка последовательностей подана в электронном виде через EFS-Web в виде ASCII форматированного списка последовательностей в файле с названием «74435_ST25.txt», созданном 3 ноября 2014 года и имеющим размер 100 килобайт, который подан одновременно с описанием. Список последовательностей, содержащийся в ASCII форматированном документе, представляет собой часть описания и включен в настоящий документ посредством ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0003] Раскрытие относится к области точной трансформации растений, направленного воздействия на гены, направленной геномной интеграции и экспрессии белка у растений. В одном из вариантов осуществления в раскрытии описана универсальная донорная полинуклеотидная молекула, которую можно вставлять в целевые местоположения в геномах растений и анализировать высокопроизводительным и эффективным образом.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0004] Введение агрономически значимых признаков в растения можно использовать для того, чтобы улучшать критерии питательной ценности, увеличивать урожай, обеспечивать устойчивость к вредителям или заболеваниям, увеличивать переносимость засухи и стресса, повышать садоводческие качества (например, пигментация и цветение), придавать устойчивость к гербицидам, делать возможным получение промышленно-применимых соединений и/или материалов из растения и/или делать возможным получение фармацевтических средств. Трансгенные растения типично создают путем технологии опосредованной агробактериями трансформации. Другие технологии трансформации, такие как PEG-опосредованный захват ДНК в протопластах, бомбардировка микрочастицами и опосредованная кремниевыми нитевидными кристаллами трансформация, также можно использовать для получения трансгенных растений. Введение клонированных генов в клетки растений и восстановление стабильных плодоносящих трансгенных растений можно использовать для того, чтобы выполнять такие модификации растения и делать возможной генетическую инженерию растений для улучшения культуры. Используя эти способы, чужеродную ДНК случайным образом встраивают в ядерную или пластидную ДНК эукариотической клетки растения, после чего следует выделение клеток, которые содержат чужеродную ДНК, встроенную в ДНК клетки, чтобы получать стабильно трансформированные клетки растений.
[0005] Способы трансформации растений, описанные выше, ведут ко встраиванию трансгенов в случайных местоположениях генома растения и с различными числами копий. Часто происходит встраивание трансгенов в виде повторов или всего трансгена или его частей. Сложные паттерны встраивания могут влиять на уровень экспрессии трансгенов (например, посредством разрушения транскрибированной РНК через механизмы посттранскрипционного сайленсинга генов, или посредством индукции метилирования введенной ДНК), тем самым осуществляя понижающую регуляцию транскрипции трансгена. Кроме того, на уровень экспрессии трансгена может влиять местоположение встраивания (например, эффект положения) в геноме растения. Комбинация этих факторов ведет к широкой вариации уровней экспрессии трансгенов или чужеродной ДНК, представляющей интерес, среди различных трансгенных клеток растений и линий растений. Кроме того, встраивание чужеродной ДНК, представляющей интерес, может оказывать разрушающий эффект на область генома, где происходит встраивание, и может оказывать влияние или нарушать нормальную функцию этой целевой области, что тем самым ведет к часто нежелательным побочным эффектам.
[0006] Приведенное выше неизбежно влечет то, что всякий раз когда исследуют эффект введения конкретной чужеродной ДНК в растение, создают и анализируют большое число трансгенных линий растений для того, чтобы получать значимые результаты. Аналогичным образом, при создании трансгенных сельскохозяйственных культур, когда конкретную ДНК, представляющую интерес, вводят в растения, чтобы предоставлять трансгенное растение с желаемым фенотипом, создают большую популяцию независимо созданных трансгенных линий растений для того, чтобы сделать возможным селекцию линий растений с оптимальной экспрессией трансгенов и с минимальными или нулевыми побочными эффектами, оказываемыми на общий фенотип трансгенного растения. В частности, в этой области желательно иметь более направленные трансгенные подходы, например, ввиду обременительных регуляторных требований и высоких расходов, связанных с повторными полевыми испытаниями, которые необходимы для устранения нежелательных трансгенных событий. Кроме того, ясно, что возможность направленной инсерции ДНК также полезна в процессе стэкинга трансгенов.
[0007] Несколько способов разработано с целью управления инсерцией трансгенов в растениях. См., например, Kumar and Fladung (2001) Trends Plant Sci. 6:155-9. Эти способы опираются на встраивание трансгена, основанное на гомологичной рекомбинации. Эту стратегию успешно применяли у прокариотов и низших эукариотов. Paszkowski et al. (1988) EMBO J. 7:4021-6. Однако, для растений до последнего времени преобладающий механизм встраивания трансгенов основан на неправильной рекомбинации, при которой используют небольшую гомологию между цепями ДНК, участвующими в рекомбинации. Следовательно, основная проблема в этой области состоит в обнаружении редких событий гомологичной рекомбинации, которые скрыты за значительно более эффективным встраиванием введенной чужеродной ДНК через неправильную рекомбинацию.
[0008] Специально разработанные нуклеазы с цинковыми пальцами (ZFN) представляют собой белки, разработанные для того, чтобы специфично создавать двухцепочечных разрыв ДНК в целевом сайте, с последующей рекомбинацией расщепленных концов. ZFN объединяют неспецифичный расщепляющий домен рестрикционной эндонуклеазы, такой как, например, FokI, с ДНК-связывающими белками с цинковыми пальцами. См., например, Huang et al. (1996) J. Protein Chem. 15:481-9; Kim et al. (1997) Proc. Natl. Acad. Sci. USA 94:3616-20; Kim et al. (1996) Proc. Natl. Acad. Sci. USA 93:1156-60; Kim et al. (1994) Proc Natl. Acad. Sci. USA 91:883-7; Kim et al. (1997b) Proc. Natl. Acad. Sci. USA 94:12875-9; Kim et al. (1997c) Gene 203:43-9; Kim et al. (1998) Biol. Chem. 379:489-95; Nahon and Raveh (1998) Nucleic Acids Res. 26:1233-9; Smith et al. (1999) Nucleic Acids Res. 27:674-81. Индивидуальные мотивы цинковых пальцев можно разрабатывать для нацеливания и связывания с широким диапазоном сайтов ДНК. Канонические Cys2His2, а также неканонические Cys3His белки с цинковыми пальцами связывают ДНК, вставляя α-спираль в большую бороздку двойной спирали. Распознавание ДНК цинковыми пальцами происходит модульно: каждый палец контактирует в основном с тремя последовательными парами оснований в мишени, и несколько ключевых остатков в белке опосредуют распознавание. Показано, что рестрикционная эндонуклеаза FokI должна образовать димер через домен нуклеазы для того, чтобы расщеплять ДНК, создавая двухцепочечный разрыв. Аналогичным образом, для ZFN также необходима димеризация домена нуклеазы для того, чтобы резать ДНК. Mani et al. (2005) Biochem. Biophys. Res. Commun. 334:1191-7; Smith et al. (2000) Nucleic Acids Res. 28:3361-9. Димеризации ZFN способствуют два смежных, противоположно ориентированных сайта связывания. id.
[0009] Приведенные выше примеры из связанной области и ограничения, связанные с ними, предназначены в качестве иллюстрации, а не ограничения. Другие ограничения связанной области будут видны специалистам в данной области при прочтении описания.
КРАТКАЯ СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0010] В предпочтительном варианте осуществления раскрытие относится к полинуклеотидной донорной кассете, которая содержит связывающий домен сайт-специфической нуклеазы, аналитический домен и плазмидный домен. В дополнительном варианте осуществления полинуклеотидная донорная кассета содержит отрезок меньше чем 3 т.п.о. Дополнительные варианты осуществления включают трансгенную клетку, которая содержит полинуклеотидную донорную кассету. В некоторых аспектах, трансгенная клетка представляет собой трансгенную клетку растения. В другом варианте осуществления раскрытие относится к трансгенному растению, которое содержит трансгенную клетку растения. Дополнительные аспекты включают трансгенное растение, в которых растение представляет собой односеменодольное растение или двусеменодольное растение. В других вариантах осуществления односеменодольное растение выбирают из группы, состоящей из растения кукурузы, растения пшеницы и растения риса. В других вариантах осуществления двусеменодольное растение выбирают из группы, состоящей из растения соевых бобов, растения хлопка и растения канолы. Кроме того, раскрытие относится к трансгенному семени, полученному от трансгенного растения.
[0011] В еще одном другом варианте осуществления рассматриваемое раскрытие относится к полинуклеотидной донорной кассете, в котором полинуклеотидную донорную кассету выбирают из группы, состоящей из полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 132, полинуклеотидной последовательности с 90% идентичности последовательностей с SEQ ID NO: 133, полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 134, полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 135, полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 136, полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 137, полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 138, полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 139, полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 140 и полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 141.
[0012] В дополнительных вариантах осуществления полинуклеотидная донорная кассета состоит из связывающего домена сайт-специфической нуклеазы, который выполнен из одной или нескольких связывающих последовательностей сайт-специфической нуклеазы. В одном из аспектов связывающий домен сайт-специфической нуклеазы, содержащий одну или несколько связывающих последовательностей сайт-специфической нуклеазы, связывается связывающим белком с цинковыми пальцами, связывающим белком мегануклеазы, CRISPR связывающим белком или TALEN связывающим белком.
[0013] В других вариантах осуществления полинуклеотидная донорная кассета содержит аналитический домен, выбранный из группы, состоящей из полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 142 и полинуклеотидной последовательности с по меньшей мере 90% идентичности последовательностей с SEQ ID NO: 143. В некоторых аспектах аналитический домен содержит одну или несколько последовательностей рестрикционных ферментов. В других аспектах аналитический домен имеет процентную долю пары оснований гуанин и цитозин от 40 до 60%. В дополнительных аспектах аналитический домен содержит полинуклеотид, который не содержит множество повторяющихся последовательностей, в котором повторяющаяся последовательность составляет по меньшей мере 9 п.о. в длину. В дополнительных аспектах аналитический домен содержит полинуклеотид, который не содержит серию последовательностей из идентичных пар оснований больше чем 9 п.о. в длину. В одном из аспектов аналитический домен содержит полинуклеотид со вторичной структурой больше чем -19 ккал/моль свободной энергии (ΔG). В различных других аспектах аналитический домен содержит одну или несколько связывающих праймер последовательностей.
[0014] В одном из вариантов осуществления полинуклеотидная донорная кассета содержит одну или несколько последовательностей гомологичных звеньев. В других аспектах одна или несколько последовательностей гомологичных звеньев составляют между 50 и 100 парами оснований в длину. В другом варианте осуществления аналитический домен не кодирует пептид. В еще одном другом варианте осуществления, аналитический домен кодирует пептид. В одном из аспектов аналитический домен содержит кассету экспрессии гена, которая содержит трансген. В дополнительном аспекте, кассета экспрессии гена содержит промотор. В еще одном аспекте трансген содержит репортерный ген. В дополнительном аспекте, репортерный ген выбирают из группы, состоящей из гена yfp, гена gus, гена rfp, гена gfp, гена устойчивости к канамицину, гена aad-1, гена aad-12, гена pat и гена устойчивости к глифосату. В дополнительном варианте осуществления, плазмидный домен содержит плазмиду pUC19. В одном из аспектов плазмидный домен содержит высококопийный участок начала репликации. В дополнительном аспекте, высококопийный участок начала репликации содержит участок начала репликации cole1. В дополнительном аспекте, плазмидный домен содержит селективный маркер. В дополнительном аспекте, селективный маркер выбирают из группы, состоящей из канамицинового селективного маркера, ампициллинового селективного маркера, спектиномицинового селективного маркера, хлорамфениколового селективного маркера и рифампицинового селективного маркера.
[0015] В одном из вариантов осуществления рассматриваемое раскрытие относится к способу направленного встраивания полинуклеотидной донорной кассеты в геном клетки растения. В одном из аспектов способ относится к экспрессированию сайт-специфической ДНК-связывающей нуклеазы, которая содержит по меньшей мере один ДНК-связывающий домен и по меньшей мере один домен нуклеазы, в котором по меньшей мере один ДНК-связывающий домен связывается с сайтом-мишенью в геноме клетки растения; приведению клетки растения в контакт с полинуклеотидной донорной кассетой; расщеплению сайта-мишени в геноме клетки растения сайт-специфической ДНК-связывающей нуклеазой; и встраиванию полинуклеотидной донорной кассеты в сайт-мишень в геноме клетки растения. В дополнительном аспекте, по меньшей мере один ДНК-связывающий домен выбирают из группы, состоящей из связывающего домена цинкового пальца, связывающего домена мегануклеазы, TALEN связывающего домена, мегануклеазы и CRISPR связывающего домена. В другом аспекте домен нуклеазы происходит из рестрикционной эндонуклеазы IIS типа. В другом аспекте рестрикционную эндонуклеазу IIS типа выбирают из группы, состоящей из FokI и StsI. В дополнительном аспекте, полинуклеотидная донорная кассета экспрессирует полипептид. В еще одном аспекте полинуклеотидная донорная кассета содержит некодирующую последовательность нуклеиновой кислоты. В одном из аспектов полинуклеотидная донорная кассета содержит одну или несколько связывающих последовательностей цинковых пальцев. В другом аспекте полинуклеотидная донорная кассета содержит одну или несколько связывающих праймер последовательностей. В дополнительном аспекте, встраивание полинуклеотидной донорной кассеты происходит через механизм репарации по гомологии. В дополнительном аспекте, встраивание полинуклеотидной донорной кассеты происходит через механизм репарации через соединение негомологичных концов. В одном из вариантов осуществления клетка растения, выбранная для встраивания полинуклеотидной донорной кассеты, представляет собой клетку односеменодольного или двусеменодольного растения. В одном из вариантов осуществления клетка растения представляет собой клетку односеменодольного растения, выбранную из группы, состоящей из клетки растения кукурузы, клетки растения пшеницы и клетки растения риса. В одном из вариантов осуществления клетка растения представляет собой клетку двусеменодольного растения, выбранную из группы, состоящей из клетки растения соевых бобов, клетки растения хлопка и клетки растения канолы.
[0016] В дополнение к образцовым аспектам и вариантам осуществления, описанным выше, дополнительные аспекты и варианты осуществления станут очевидны при изучении следующего описания.
КРАТКОЕ ОПИСАНИЕ ФИГУР
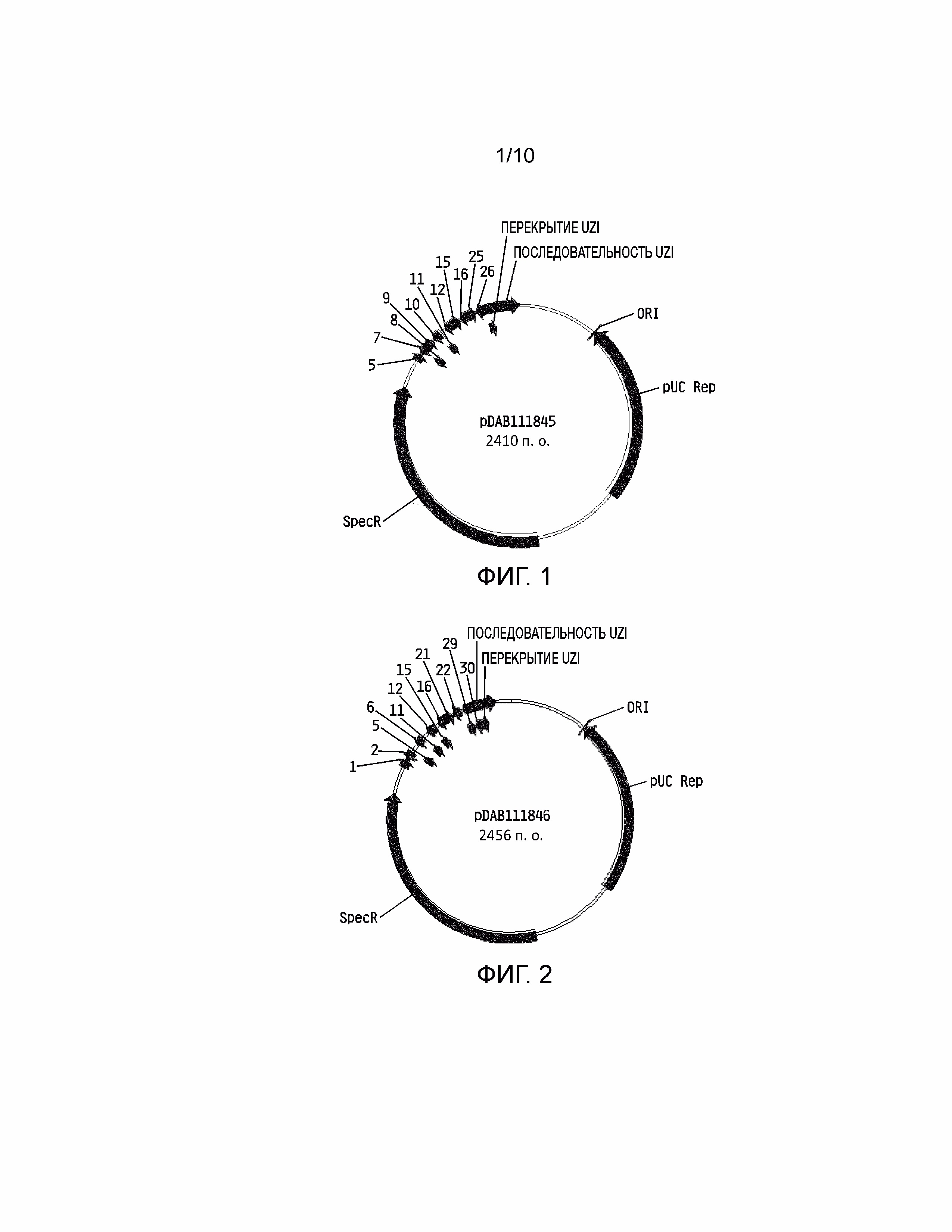
[0017] На фиг. 1 проиллюстрирована плазмидная карта pDAB111845. Пронумерованные элементы (т.е. 5, 7, 8, 9, 10, 11, 12, 15, 16, 25 и 26) соответствуют связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету.
[0018] На фиг. 2 проиллюстрирована плазмидная карта pDAB111846. Пронумерованные элементы (т.е. 1, 2, 5, 6, 11, 12, 15, 16, 21, 22, 29 и 30) соответствуют связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету.
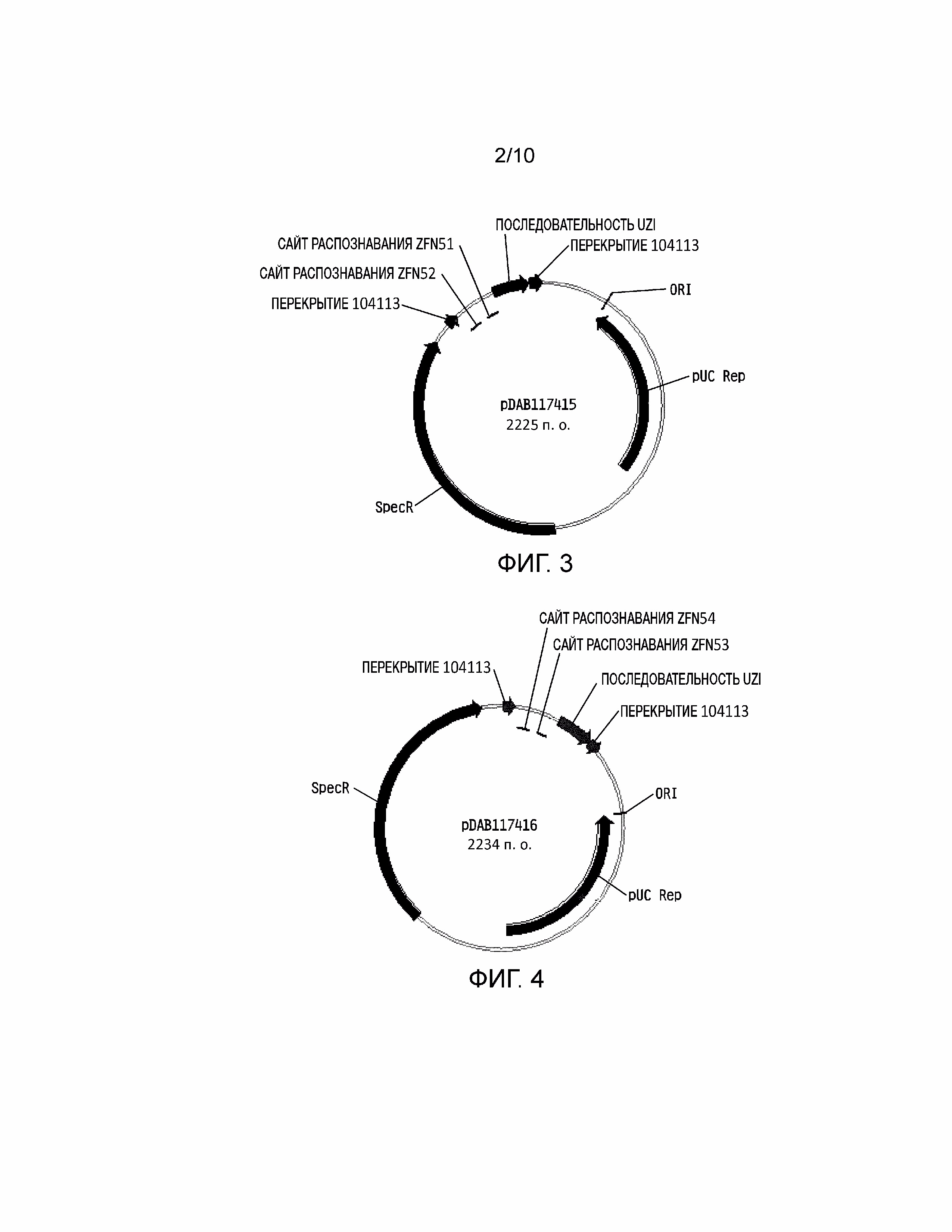
[0019] На фиг, 3 проиллюстрирована плазмидная карта pDAB117415. Пронумерованные элементы (т.е. ZFN51 и ZFN52) соответствуют связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету. Дополнительно в эту конструкцию плазмиды включено «перекрытие 104113», которое представляет собой последовательности, которые обладают гомологией с плазмидным вектором для высокопроизводительной сборки универсальных донорных кассет в плазмидном векторе (т.е. через сборку по Гибсону).
[0020] На фиг. 4 проиллюстрирована плазмидная карта pDAB117416. Пронумерованные элементы (т.е. ZFN54 и ZFN53) соответствуют связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету. Дополнительно в эту конструкцию плазмиды включено «перекрытие 104113», которое представляют собой последовательности, которые имеют гомологию с плазмидным вектором для высокопроизводительной сборки универсальных донорных кассет в плазмидном векторе (т.е. через сборку по Гибсону).
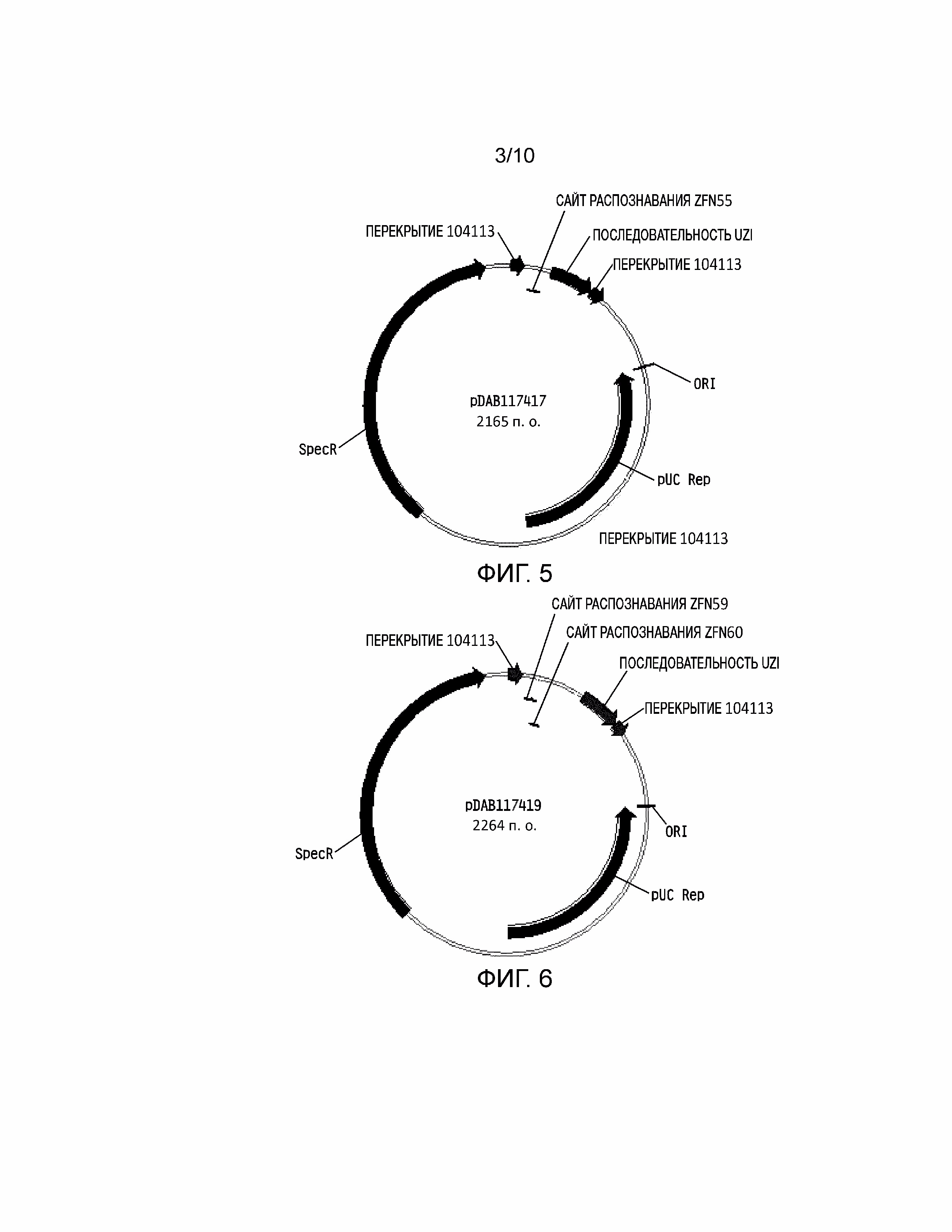
[0021] На фиг. 5 проиллюстрирована плазмидная карта pDAB117417. Пронумерованный элемент (т.е. ZFN55) соответствует связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету. Дополнительно в эту конструкцию плазмиды включено «перекрытие 104113», которое представляет собой последовательности, которые имеют гомологию с плазмидным вектором для высокопроизводительной сборки универсальных донорных кассет в плазмидном векторе (т.е. через сборку по Гибсону).
[0022] На фиг. 6 проиллюстрирована плазмидная карта pDAB117419. Пронумерованные элементы (т.е. ZFN59 и ZFN60) соответствуют связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету. Дополнительно в эту конструкцию плазмиды включено «перекрытие 104113», которое представляет собой последовательности, которые имеют гомологию с плазмидным вектором для высокопроизводительной сборки универсальных донорных кассет в плазмидном векторе (т.е. через сборку по Гибсону).
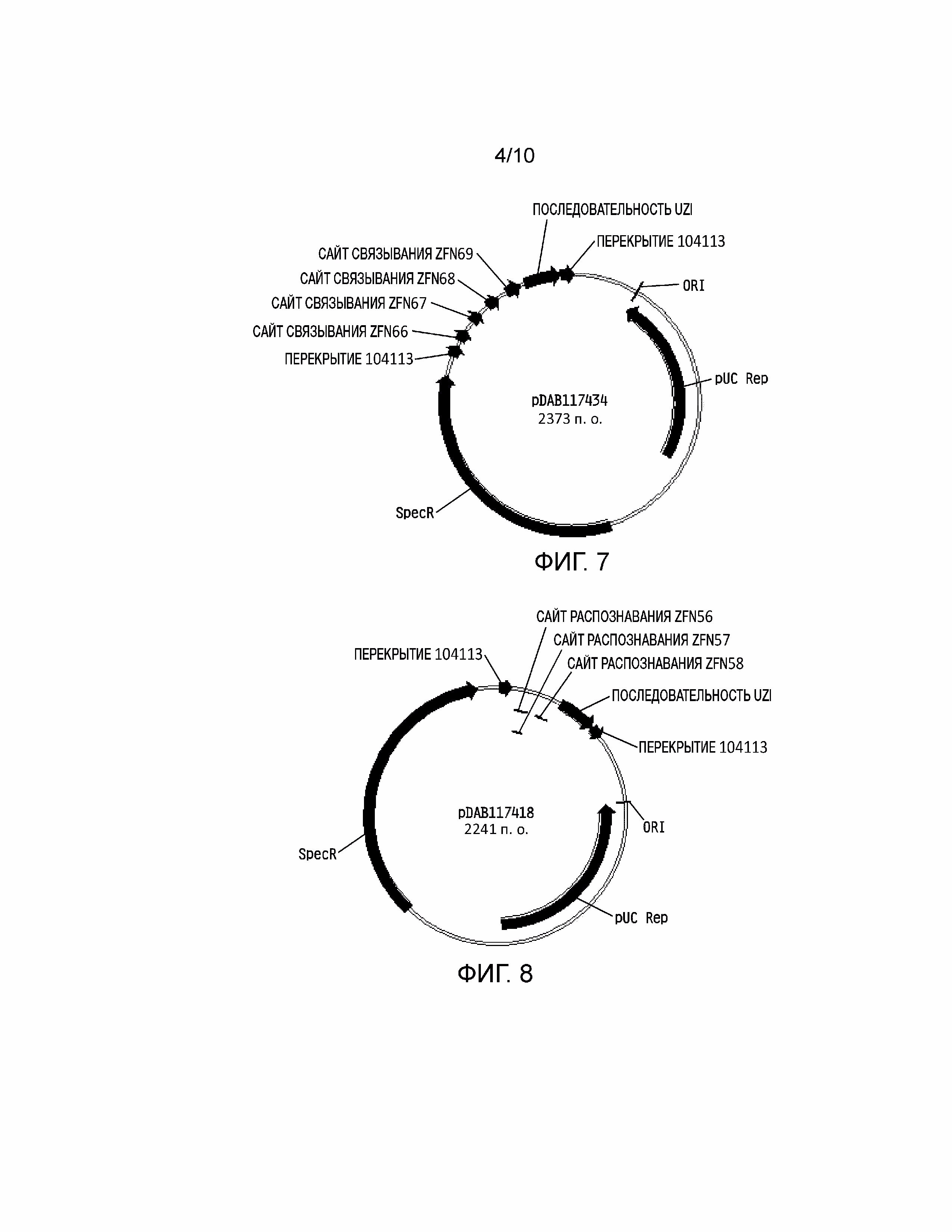
[0023] На фиг. 7 проиллюстрирована плазмидная карта pDAB117434. Пронумерованные элементы (т.е. ZFN66, ZFN67, ZFN68 и ZFN69) соответствуют связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету. Дополнительно в эту конструкцию плазмиды включено «перекрытие 104113», которое представляет собой последовательности, которые имеют гомологию с плазмидным вектором для высокопроизводительной сборки универсальных донорных кассет в плазмидном векторе (т.е. через сборку по Гибсону).
[0024] На фиг. 8 проиллюстрирована плазмидная карта pDAB117418. Пронумерованные элементы (т.е. ZFN56, ZFN57 и ZFN58) соответствуют связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету. Дополнительно в эту конструкцию плазмиды включено «перекрытие 104113», которое представляет собой последовательности, которые имеют гомологию с плазмидным вектором для высокопроизводительной сборки универсальных донорных кассет в плазмидном векторе (т.е. через сборку по Гибсону).
[0025] На фиг. 9 проиллюстрирована плазмидная карта pDAB117420. Пронумерованные элементы (т.е. ZFN61 и ZFN62) соответствуют связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету. Дополнительно в эту конструкцию плазмиды включено «перекрытие 104113», которое представляет собой последовательности, которые имеют гомологию с плазмидным вектором для высокопроизводительной сборки универсальных донорных кассет в плазмидном векторе (т.е. через сборку по Гибсону).
На фиг. 10 проиллюстрирована плазмидная карта pDAB117421. Пронумерованные элементы (т.е. PPL17 пара 3, PPL17 пара 1 и PPL17 пара 2) соответствуют связывающим последовательностям нуклеаз с цинковыми пальцами приблизительно от 20 до 35 пар оснований в длину, которые распознают и расщепляют соответствующие белки нуклеаз с цинковыми пальцами. Эти связывающие последовательности цинковых пальцев и аннотированная «последовательность UZI» (которая представляет собой матричную область 100-150 п.о., содержащую участки рестрикции и ДНК последовательности для разработки праймеров или кодирующие последовательности) содержат универсальную донорную кассету. Дополнительно в эту конструкцию плазмиды включено «перекрытие 104113», которое представляет собой последовательности, которые имеют гомологию с плазмидным вектором для высокопроизводительной сборки универсальных донорных кассет в плазмидном векторе (т.е. через сборку по Гибсону).
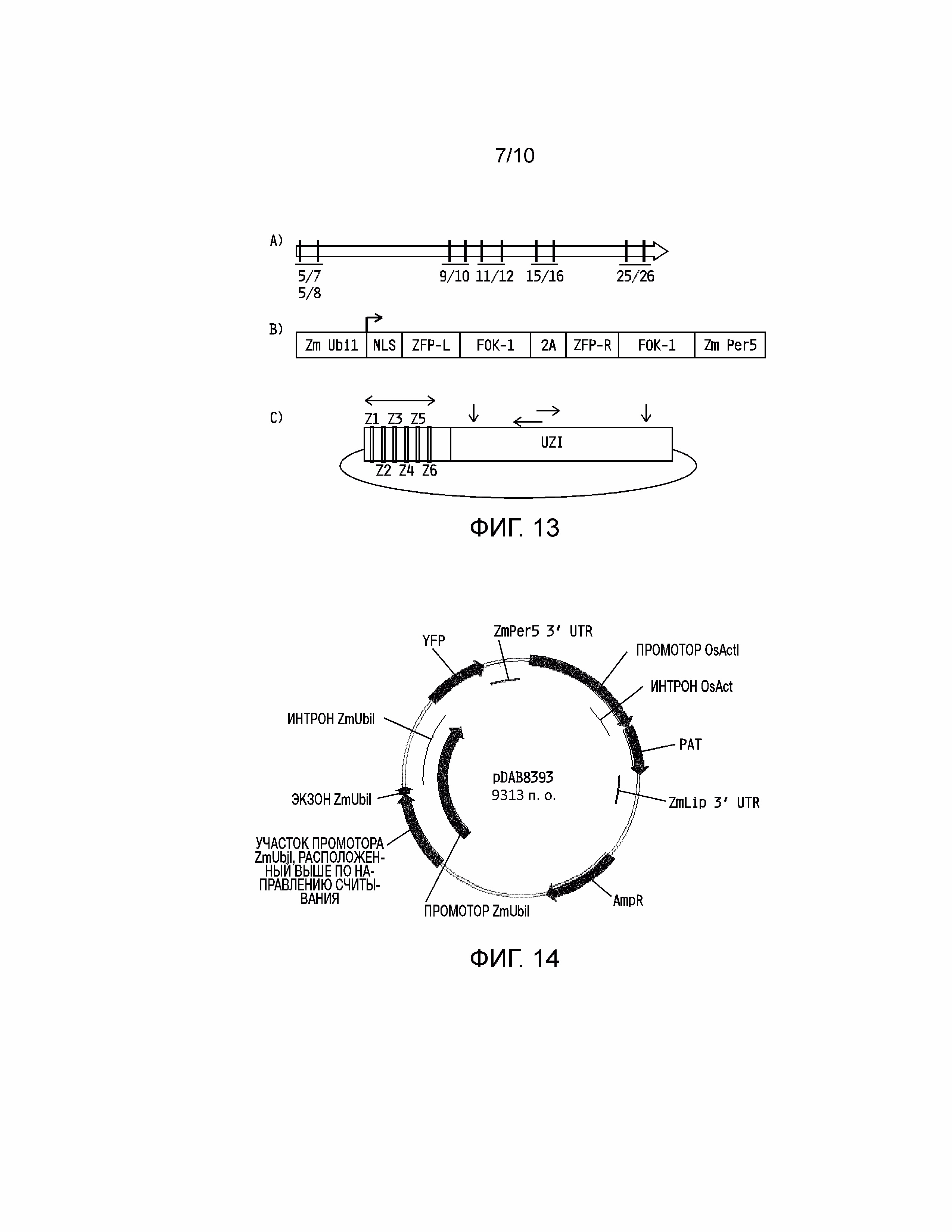
[0026] На фиг. 11 представление универсальной донорной полинуклеотидной последовательности для встраивания через соединение негомологичных концов (NHEJ). Два предложенных вектора предусматривают ДНК, представляющую интерес (ДНК X), которая содержит один или несколько (т.е. «1-N») сайтов связывания цинковых пальцев (ZFN BS) на любом конце ДНК, представляющей интерес. Вертикальные стрелки показывают уникальные участки рестрикции и горизонтальные стрелки представляют потенциальные сайты праймеров для ПЦР.
[0027] На фиг. 12 представление универсальной донорной полинуклеотидной последовательности для встраивания через репарацию по гомологии (HDR). ДНК, представляющая интерес, (ДНК X) содержит две области гомологичных последовательностей (HA), фланкирующих ДНК, представляющую интерес, с сайтами связывания нуклеаз с цинковыми пальцами (ZFN), окружающими ДНК X и HA последовательности. Вертикальные стрелки показывают уникальные участки рестрикции и горизонтальные стрелки представляют потенциальные сайты праймеров для ПЦР.
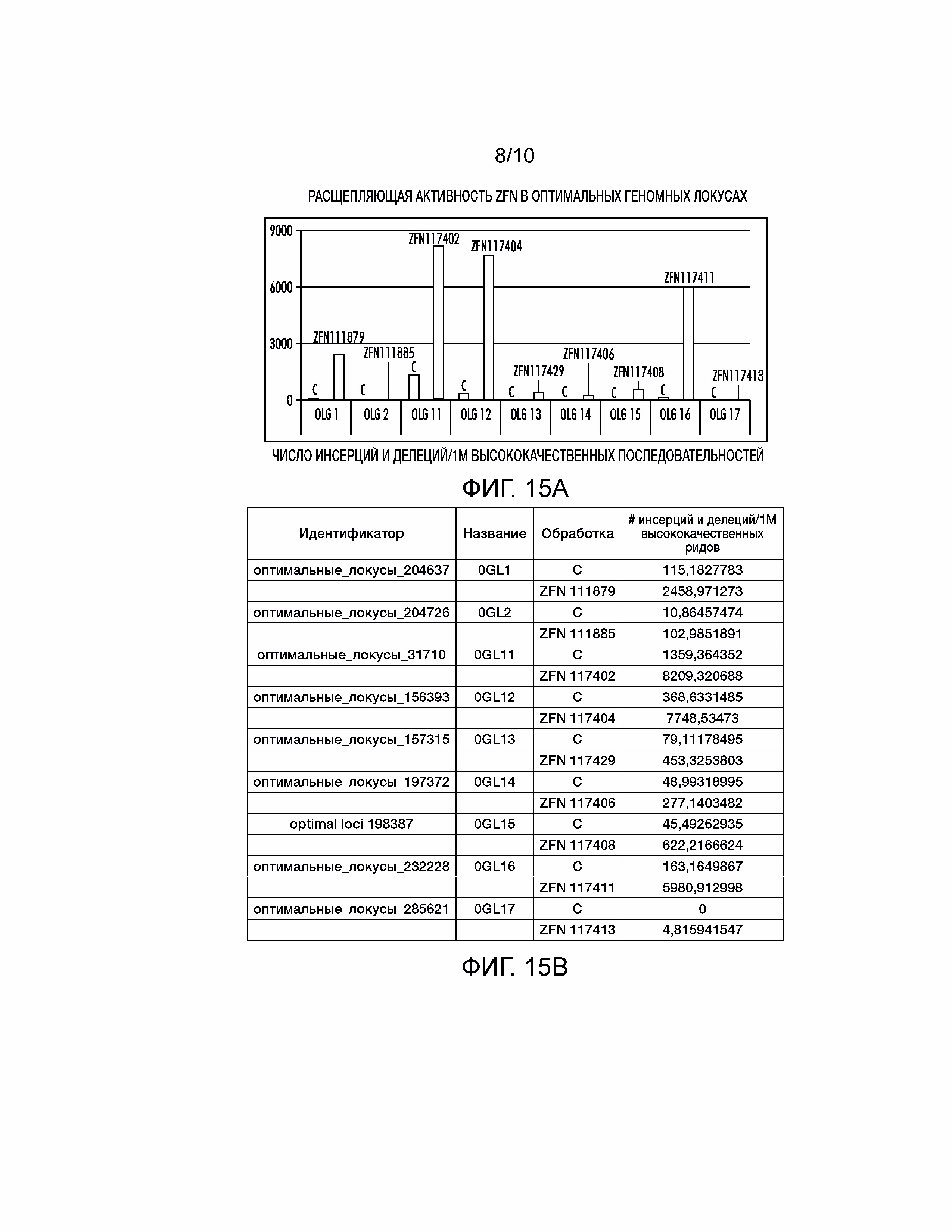
[0028] На фиг. 13A-13C проиллюстрированы конструкции, используемые для направленного воздействия и валидации встраивания универсальной донорной полинуклеотидной системы при направленном воздействии и валидаци для оптимальных геномных локусов Zea mays. Фиг. 13A: пространство разработки ZFN с местоположением пар ZFN, как предварительно показано на pDAB111845 с фиг. 5. Пары ZFN пронумерованы и соответствуют конкретным связывающим ZFN последовательностям, которые специфически распознают ZFN белки для связывания и расщепления. Фиг. 13B: конфигурация конструкции для экспрессии ZFN белка. Конструкция для ZFN экспрессии содержит конститутивный промотор растения (Zm Ubi1), который используют для управления экспрессией ZFN белка. ZFN белок содержит последовательность ядерной локализации (NLS), белки с цинковыми пальцами (ZFP-L и ZFP-R, где L обозначает левый связывающий ZFN белок и R обозначает правый связывающий белок), эндонуклеазу Fok-1 (Fok1) и самостоятельно гидролизующий 2A (2A). Фиг. 13C: универсальный донорный полинуклеотид для NHEJ-опосредованного направленного воздействия на оптимальные геномные локусы Zea mays. Z1-Z6 представляют сайты связывания ZFN, специфичные для направленного воздействия на оптимальные геномные локусы Zea mays. Число ZFN сайтов может варьировать от 3 до 6. Вертикальные стрелки показывают уникальные участки рестрикции и горизонтальные стрелкы представляют потенциальные сайты праймеров для ПЦР. Универсальная донорная полинуклеотидная система представляет собой короткую (110 п.о.) последовательность, которая является общей для доноров, используемых для встраивания в оптимальные геномные локусы Zea mays.
[0029] На фиг. 14 проиллюстрирована плазмидная карта pDAB8393.
[0030] На фиг. 15 проиллюстрирована расщепляющая активность ZFN в выбранных целевых геномных локусах Zea mays. Расщепляющую активность представляют как число последовательностей с инсерциями и делециями в сайте расщепления ZFN на 1 миллион высококачественных ридов.
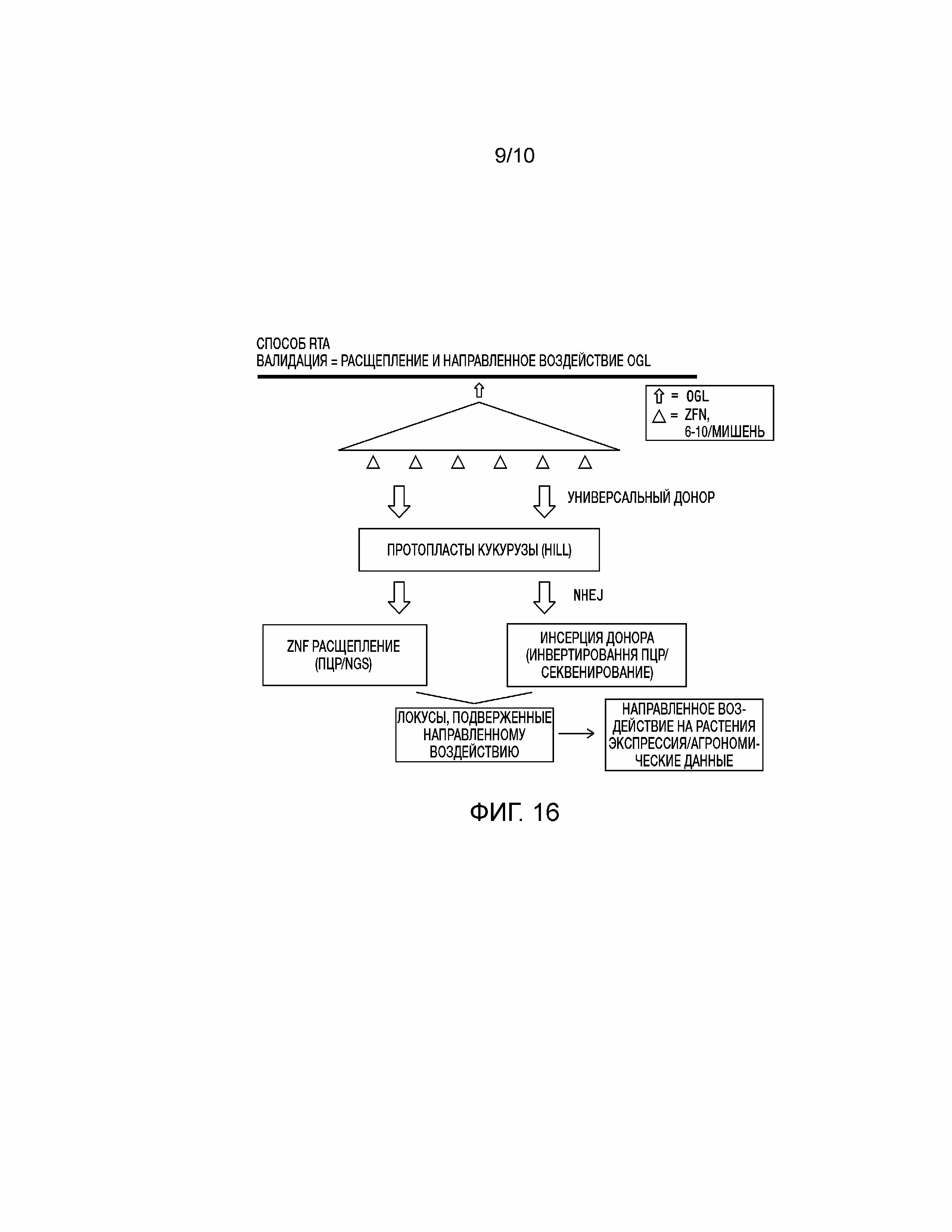
[0031] На фиг. 16 проиллюстрирована валидация выбранных целевых геномных локусов Zea mays с использованием способа быстрого анализа направленного воздействия (RTA) на основе NHEJ.
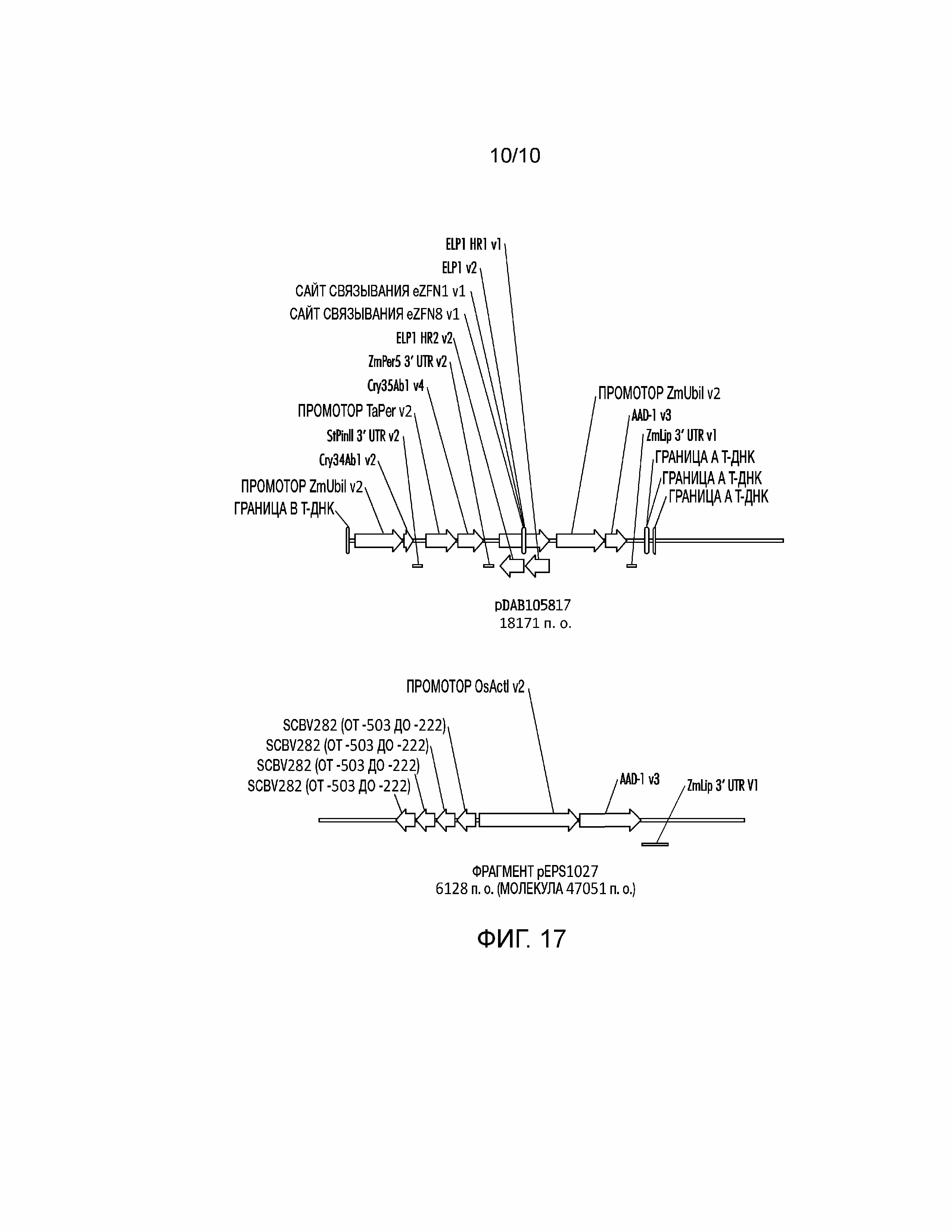
[0032] На фиг. 17 проиллюстрированы плазмидные конструкции, которыми трансформировали Zea mays через случайное встраивание, которое содержит события, используемые для анализа фланкирующих последовательностей и исследования экспрессии трансгенов.
ПОДРОБНОЕ ОПИСАНИЕ
I. Обзор
[0033] Настоящее раскрытие в различных аспектах предусматривает полинуклеотидные донорные кассеты, которые содержат связывающий домен нуклеазы с цинковыми пальцами, аналитический домен и плазмидный домен. В других аспектах, настоящее раскрытие предусматривает способы, которые обеспечивают направленное встраивание полинуклеотидных донорных кассет в геном клетки растения. В соответствии с раскрытыми способами, сайт-специфическую ДНК-связывающую нуклеазу, которая содержит по меньшей мере один ДНК-связывающий домен и по меньшей мере один домен нуклеазы, экспрессируют так, что по меньшей мере один ДНК-связывающий домен связывается с сайтом-мишенью в геноме клетки растения. Кроме того, клетку растения приводят в контакт с полинуклеотидной донорной кассетой. Впоследствии сайт-мишень в геноме клетки растения расщепляют сайт-специфической ДНК-связывающей нуклеазой и интегрируют полинуклеотидную донорную кассету в сайт-мишень в геноме клетки растения.
II. Термины
[0034] Пока не определено иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, в котором их обыкновенно понимает специалист в той области, к которой относится это раскрытие. В случае противоречия, настоящая заявка, содержащая определения, будет иметь определяющее значение. Пока контекст не требует иного, термины в единственном числе включают множественное число и термины во множественном числе включают единственное число. Все публикации, патенты и другие литературные источники, упомянутые в настоящем документе, включены посредством ссылки во всей их полноте для всех целей, как если бы было конкретно и индивидуально указано, что каждая отдельная публикация или патентная заявка включена посредством ссылки, если только не указано, что конкретные разделы патентов или патентных публикаций подлежат включению посредством ссылки.
[0035] Для того чтобы дополнительно разъяснить это раскрытие, приведены следующие термины, сокращения и определения.
[0036] Как используют в настоящем документе, термины «содержит», «содержащий», «включает», «включающий», «имеет» или «имеющий» или какие-либо другие их вариации предназначены для того, чтобы быть неисключающими или открытыми. Например, композиция, смесь, процесс, способ, изделие или аппарат, которые содержат список элементов, не обязательно ограничены только этими элементами, и могут включать другие элементы, в явной форме не перечисленные или присущие такой композиции, смеси, процессу, способу, изделию или аппарату. Кроме того, пока в явной форме не указано иное, «или» относится ко включающему или и не к исключающему или. Например, условие A или B отвечает любому одному из следующего: A является истиной (или присутствует) и B является ложью (или не присутствует), A является ложью (или не присутствует) и B является истиной (или присутствует) и как A, так и B являются истиной (или присутствуют).
[0037] Термин «изобретение» или «настоящее изобретение», как используют в настоящем документе, представляет собой неограничивающий термин, который не предназначен для обозначения какого-либо одного варианта осуществления конкретного изобретения, и охватывает все возможные варианты осуществления, как раскрыто в заявке.
[0038] Как используют в настоящем документе, термин «растение» включает целое растение и любого потомка, клетку, ткань или часть растения. Термин «часть растения» включает любую часть(части) растения, в том числе, например, без ограничения: семя (в том числе созревшее семя, несозревший зародыш без семенной оболочки и несозревшее семя); черенок растения; клетку растения; растительную клеточную культуру; орган растения (например, пыльцу, зародыши, цветки, фрукты, побеги, листья, корни, стебли и связанные эксплантаты). Ткань растения или орган растения может представлять собой семя, каллюс или какую-либо другую группу клеток растений, которая организована в структурную или функциональную единицу. Культура клеток или ткани растения может быть способна к регенерации растения, которое имеет физиологические и морфологические характеристики растения, от которого получали клетку или ткань, и к регенерации растения, которое имеет по существу тот же генотип, что и растение. В отличие от этого, некоторые клетки растений не способны к регенерации, чтобы получать растения. Регенеративные клетки в культуре клеток или ткани растения могут представлять собой зародыши, протопласты, меристематические клетки, каллюс, пыльцу, листя, пыльники, корни, корневые кончики, шелк, цветки, косточки, колосья, початки, кожицу или цветоножки.
[0039] Части растения включают собираемые части и части, которые можно использовать для размножения растений-потомков. Части растения, которые можно использовать для размножения, включают, например, без ограничения: семя; фрукт; черенок; сеянец; клубень; и корневище. Собираемая часть растения может представлять собой какую-либо полезную часть растения, в том числе, например, без ограничения: цветок; пыльцу; сеянец; клубень; лист; стебель; фрукт; семя; и корень.
[0040] Клетка растения представляет собой структурную и физиологическую единицу растения. Клетки растений, как используют в настоящем документе, включают протопласты и протопласты с частичной клеточной стенкой. Клетка растения может быть в форме отдельной изолированной клетки или агрегации клеток (например, рыхлый каллюс и культивированная клетка), и может представлять собой часть более высоко организованной единицы (например, ткань растения, орган растения и растение). Таким образом, клетка растения может представлять собой протопласт, гаметопродуцирующую клетку или клетку или совокупность клеток, которые могут регенировать в целое растение. По существу, семя, которое содержит множество клеток растения и которое способно к регенерации в целое растение, считают «частью растения» в вариантах осуществления в настоящем документе.
[0041] Термин «протопласт», как используют в настоящем документе, относится к клетке растения, у которой ее клеточная стенка полностью или частично удалена, с обнаженной ее липидной бислойной мембраной. Типично, протопласт представляет собой выделенную клетку растения без клеточных стенок, которая имеет способность к регенерации в клеточную культуру или целое растение.
[0042] Как используют в настоящем документе, «эндогенная последовательность» определяет нативную форму полинуклеотида, гена или полипептида в его естественном местоположении в организме или в геноме организма.
[0043] Термин «выделенный», как используют в настоящем документе, обозначает удаление из естественного окружения.
[0044] Термин «очищенный», как используют в настоящем документе, относится к выделению молекулы или соединения в форме, которая по существу не содержит загрязнители, обычно связанные с молекулой или соединением в нативном или естественном окружении, и обозначает увеличение чистоты в результате отделения от других компонентов исходной композиции. Термин «очищенная нуклеиновая кислота» используют в настоящем документе для того, чтобы описывать последовательность нуклеиновой кислоты, которая отделена от других соединений, включая в качестве неограничивающих примеров полипептиды, липиды и углеводы.
[0045] Как используют в настоящем документе, термины «полинуклеотид», «нуклеиновая кислота» и «молекула нуклеиновой кислоты» используют взаимозаменяемо, и они могут охватывать одну нуклеиновую кислоту; множество нуклеиновых кислот; фрагмент нуклеиновой кислоты, ее вариант или производное; и конструкцию из нуклеиновой кислоты (например, информационная РНК (мРНК) и плазмидная ДНК (пДНК)). Полинуклеотид или нуклеиновая кислота может содержать нуклеотидную последовательность полноразмерной кДНК последовательности, или ее фрагмент, в том числе нетранслируемые 5’ и/или 3’ последовательности и кодирующую последовательность(последовательности). Полинуклеотид или нуклеиновая кислота может состоять из любого полирибонуклеотида или полидезоксирибонуклеотида, который может включать немодифицированные рибонуклеотиды или дезоксирибонуклеотиды или модифицированные рибонуклеотиды или дезоксирибонуклеотиды. Например, полинуклеотид или нуклеиновая кислота может состоять из одно- и двухцепочечной ДНК; ДНК, которая представляет собой смесь одно- и двухцепочечных областей; одно- и двухцепочечной РНК; и РНК, которая представляет собой смесь одно- и двухцепочечных областей. Гибридные молекулы, которые содержат ДНК и РНК, могут быть одноцепочечными, двухцепочечными или смесью одно- и двухцепочечных областей. Приведенные выше термины также включают химически, ферментативно и метаболически модифицированные формы полинуклеотида или нуклеиновой кислоты.
[0046] Понятно, что конкретная ДНК также относится к ее комплементарной цепи, последовательность которой определяют согласно правилам образования пар дезоксирибонуклеотидов.
[0047] Как используют в настоящем документе, термин «ген» относится к нуклеиновой кислоте, которая кодирует функциональный продукт (РНК или полипептид/белок). Ген может содержать регуляторные последовательности, предшествующие (5’ некодирующие последовательности) последовательности, кодирующей функциональный продукт и/или следующие за ней (3’ некодирующие последовательности).
[0048] Как используют в настоящем документе, термин «кодирующая последовательность» относится к последовательности нуклеиновой кислоты, которая кодирует конкретную аминокислотную последовательность. «Регуляторная последовательность» относится к нуклеотидной последовательности расположенной выше по направлению считывания (например, 5’ некодирующие последовательности) по относительно кодирующей последовательности, внутри нее или ниже по направлению считывания (например, 3’ некодирующие последовательности), которая влияет на транскрипцию, процессинг или стабильность РНК или трансляцию ассоциированной кодирующей последовательности. Регуляторные последовательности включают, например, без ограничения: промоторы; трансляционные лидерные последовательности; интроны; последовательности распознавания полиаденилирования; сайты процессинга РНК; сайты связывания эффекторов; и структуры «стебель-петля».
[0049] Как используют в настоящем документе, термин «аналитический домен» определяет последовательность нуклеиновой кислоты, которая содержит функциональные элементы, которые способствуют направленной инсерции последовательностей нуклеиновой кислоты. Например, аналитический домен может содержать специально разработанные сайты рестрикционных ферментов, сайты связывания цинковых пальцев, сконструированные посадочные площадки или сконструированные платформы для встраивания трансгенов и могут содержать или не содержать генные регуляторные элементы или открытую рамку считывания. См., например, публикацию патента США № 20110191899, включенную в настоящий документ посредством ссылки в полном объеме.
[0050] Как определено в настоящем документе «связывающий домен сайт-специфической нуклеазы» представляет собой последовательность нуклеиновой кислоты, которая содержит одну или несколько сайт-специфических связывающих последовательностей. Как используют в настоящем документе, сайт-специфическая связывающая последовательность представляет собой последовательность нуклеиновой кислоты, которая связывается с белком при специфическом взаимодействии с последовательностью.
[0051] Как используют в настоящем документе, термин «полипептид» включает один полипептид, множество полипептидов и их фрагменты. Этот термин относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также известными как пептидные связи). Термин «полипептид» относится к какой-либо цепи или цепям двух или более аминокислот и не относится к конкретной длине или размеру продукта. Соответственно, пептиды, дипептиды, трипептиды, олигопептиды, белок, аминокислотная цепь и какой-либо другой термин, используемый для того, чтобы отослать к цепи или цепям из двух или более аминокислот, включены в определение «полипептида», и приведенные выше термины используют в настоящем документе взаимозаменяемо с «полипептидом». Полипептид можно выделять из естественного биологического источника или получать посредством рекомбинантной технологии, но конкретный полипептид не обязательно транслируют с конкретной нуклеиновой кислоты. Полипептид можно создавать любым подходящим образом, в том числе, например, без ограничения, посредством химического синтеза.
[0052] В отличие от этого, термин «гетерологичный» относится к полинуклеотиду, гену или полипептиду, который обычно не находят в его местоположении в эталонном организме (хозяине). Например, гетерологичная нуклеиновая кислота может представлять собой нуклеиновую кислоту, которую обычно находят в эталонном организме в другом геномном местоположении. В качестве дополнительного примера, гетерологичная нуклеиновая кислота может представлять собой нуклеиновую кислоту, которую обычно не находят в эталонном организме. Организм-хозяин, содержащий гетерологичный полинуклеотид, ген или полипептид, можно получать посредством введения гетерологичного полинуклеотида, гена или полипептида в организм-хозяин. В конкретных примерах гетерологичный полинуклеотид содержит нативную кодирующую последовательность или ее часть, которую повторно вводят в организм-источник в форме, которая отличается от соответствующего нативного полинуклеотида. В конкретных примерах гетерологичный ген содержит нативную кодирующую последовательность или ее часть, которую повторно вводят в организм-источник в форме, которая отличается от соответствующего нативного гена. Например, гетерологичный ген может содержать нативную кодирующую последовательность, которая представляет собой часть химерного гена, содержащего ненативные регуляторные области, который повторно вводят нативному хозяину. В конкретных примерах гетерологичный полипептид представляет собой нативный полипептид, который повторно вводят в организм-источник в форме, которая отличается от соответствующего нативного полипептида.
[0053] Гетерологичный ген или полипептид может представлять собой ген или полипептид, который содержит функциональный полипептид или последовательность нуклеиновой кислоты, кодирующую функциональный полипептид, которые сливают с другим геном или полипептидом для того, чтобы получать химерный или слитный полипептид или ген, кодирующий его. Гены и белки в конкретных вариантах осуществления включают конкретно проиллюстрированные полноразмерные последовательности и части, сегменты, фрагменты (в том числе непрерывные фрагменты и внутренние и/или концевые делеции по сравнению с полноразмерными молекулами), варианты, мутанты, химерные и слитные конструкции из этих последовательностей.
[0054] Как используют в настоящем документе, термин «модификация» может относиться к изменению в полинуклеотиде, описанном в настоящем документе, которое ведет к сниженной, по существу устраненной или устраненной активности полипептида, кодируемого полинуклеотидом, а также к изменению в полипептиде, описанном в настоящем документе, которое ведет к сниженной, по существу устраненной или устраненной активности полипептида. Альтернативно, термин «модификация» может относиться к изменению в полинуклеотиде, описанном в настоящем документе, которое ведет к увеличенной или усиленной активности полипептида, кодируемого полинуклеотидом, а также к изменению в полипептиде, описанном в настоящем документе, которое ведет к увеличенной или усиленной активности полипептида. Такие изменения можно выполнять с помощью способов, хорошо известных в данной области, включая в качестве неограничивающих примеров введение делеций, мутаций (например, самопроизвольный мутагенез, случайный мутагенез, мутагенез, обусловленный генами-мутаторами, или транспозонный мутагенез), замен, вставок, понижающую регуляцию, изменение клеточного местоположения, изменение состояния полинуклеотида или полипептида (например, метилирование, фосфорилирование или убиквитинилирование), удаление кофактора, введение антисмысловой РНК/ДНК, введение интерферирующей РНК/ДНК, химической модификации, ковалентной модификации, облучение УФ или рентгеновскими лучами, гомологичную рекомбинацию, митотическую рекомбинацию, способы с заменой промоторов и/или их сочетания. Руководство по определению тех нуклеотидов или аминокислотных остатков, которые можно модифицировать, можно найти посредством сравнения последовательности конкретного полинуклеотида или полипептида с таковыми для гомологичных полинуклеотидов или полипептидов, и максимизации числа модификаций, выполненных в областях высокой гомологии (консервативных областях) или консенсусных последовательностях.
[0055] Термин «производное», как используют в настоящем документе, относится к модификации последовательности, приведенной в настоящем раскрытии. Иллюстрацией таких модификаций будет замена, инсерция и/или делеция одного или нескольких оснований, относящихся к последовательности нуклеиновой кислоты для кодирующей последовательности, описанной в настоящем документе, которые предохраняют, слегка изменяют или увеличивают функцию кодирующей последовательности, описанной в настоящем документе, в сельскохозяйственной культуре. Такие производные может легко определять специалист в данной области, например, с использованием способов предсказания по компьютерным моделям и оптимизации структуры последовательности. Термин «производное», таким образом, также включает последовательности нуклеиновой кислоты, которые обладают такой существенной идентичностью последовательностей с кодирующими последовательностями, раскрытыми в настоящем документе, что они способны обладать раскрытыми функциональностями для использования при получении вариантов осуществления по настоящему раскрытию.
[0056] Термин «промотор» относится к последовательности ДНК, способной управлять экспрессией кодирующей последовательности нуклеиновой кислоты или функциональной РНК. В примерах, управляемая кодирующая последовательность расположена в направлении 3’-конца относительно последовательности промотора. Промотор можно извлекать в полном объеме из нативного гена, промотор может состоять из различных элементов, полученных из различных промоторов, найденных в природе, или промотор даже может содержать рационально разработанные сегменты ДНК. Специалистам в данной области понятно, что различные промоторы могут управлять экспрессией гена в тканях или клетках различных типов или на различных этапах развития или в ответ на различные условия окружающей среды или физиологические условия. Примеры всех приведенных выше промоторов известны и используются в данной области для того, чтобы управлять экспрессией гетерологичных нуклеиновых кислот. Промоторы, которые управляют экспрессией гена в клетках большинства типов наиболее часто, обыкновенно обозначают как «конститутивные промоторы». Кроме того, хотя в данной области предпринимались попытки (во многих случаях неуспешные) определить точные границы регуляторных последовательностей, стало понятно, что фрагменты ДНК различной длины могут иметь идентичную промоторную активность. Промоторную активность конкретной нуклеиновой кислоты можно анализировать с использованием способов, знакомых специалистам в данной области.
[0057] Термин «функционально связанный» относится к связи последовательностей нуклеиновой кислоты в одной нуклеиновой кислоте, в которой на функцию одной из последовательностей нуклеиновой кислоты влияет другая. Например, промотор функционально связан с кодирующей последовательностью, когда промотор способен осуществлять экспрессию этой кодирующей последовательности (например, кодирующая последовательность находится под транскрипционным управлением промотора). Кодирующая последовательность может быть функционально связана с регуляторной последовательностью в смысловой или антисмысловой ориентации.
[0058] Термин «экспрессия», как используют в настоящем документе, может относиться к транскрипции и стабильному накоплению смысловой (мРНК) или антисмысловой РНК, получаемой на основе ДНК. Экспрессия также может относиться к трансляции мРНК в полипептид. Как используют в настоящем документе, термин «сверхэкспрессия» относится к экспрессии, которая выше, чем эндогенная экспрессия того же гена или родственного гена. Таким образом, «сверхэкспрессия» гетерологичного гена имеет место, если его экспрессия выше, чем таковая у сравнимого эндогенного гена.
[0059] Как используют в настоящем документе, термин «трансформация» или «трансформирующий» относится к переносу и встраиванию нуклеиновой кислоты или ее фрагмента в организм-хозяин, что ведет к генетически стабильному наследованию. Организмы-хозяева, содержащие трансформирующую нуклеиновую кислоту, обозначают как «трансгенные», «рекомбинантные» или «трансформированные» организмы. Известны способы трансформации, в том числе, например: трансформация, опосредованная Agrobacterium tumefaciens или A. rhizogenes; трансформация с фосфатом кальция; трансформация с полибреном; слияние протопластов; электропорация; ультразвуковые способы (например, сонопорация); трансформация липосомами; микроинъекции; трансформация с депротеинизированной ДНК; трансформация плазмидными векторами; трансформация вирусными векторами; биолистическая трансформация (бомбардировка микрочастицами); трансформация, опосредованная нитевидными кристаллами карбида кремния; струи аэрозоля; и PEG-опосредованная трансформация.
[0060] Как используют в настоящем документе, термин «введенный» (в контексте введения нуклеиновой кислоты в клетку) включает трансформацию клетки, а также скрещивание растения, которое содержит нуклеиновую кислоту, со вторым растением так, что второе растение содержит нуклеиновую кислоту, что можно осуществлять с использованием стандартных способов селекции растений. Такие способы селекции известны в данной области. Обзор способов селекции растений см. в Poehlman (1995) Breeding Field Crops, 4th Edition, AVI Publication Co., Westport CT.
[0061] Способы обратного скрещивания можно использовать для того, чтобы вводить нуклеиновую кислоту в растение. Этот способ использовали в течение десятилетий для того, чтобы вводить признаки в растения. Пример описания обратного скрещивания (и других способов селекции растений) можно найти, например, в Poelman (1995), выше; и Jensen (1988) Plant Breeding Methodology, Wiley, New York, NY. В образцовом протоколе обратного скрещивания исходное растение, представляющее интерес, («рекурентного родителя») скрещивают со вторым растением («нерекурентным родителем»), которое несет нуклеиновую кислоту для введения. Получаемое от этого скрещивания потомство затем снова скрещивают с рекурентным родителем, и процесс повторяют до тех пор, пока не получают преобразованное растение, где по существу все желаемые морфологические и физиологические характеристики рекурентного родителя восстанавливают в преобразованном растении, в дополнение к нуклеиновой кислоте от нерекурентного родителя.
[0062] «Свазывание» относится к нековалентному взаимодействию со специфичной последовательностью между макромолекулами (например, между белком и нуклеиновой кислотой). Не все компоненты связывающего взаимодействия должны происходить со специфичной последовательностью (например, контакты с остатками фосфата в остове ДНК) до тех пор, пока взаимодействие вцелом происходит со специфичной последовательностью. Такие взаимодействия в целом отличаются константой диссоциации (Kd) 10-6 M-1 или ниже. «Аффинность» относится к прочности связывания: увеличенная аффинность связывания коррелирует с более низкой Kd.
[0063] «Связывающий белок» представляет собой белок, который способен нековалентно связываться с другой молекулой. Связывающий белок может связываться, например, с молекулой ДНК (ДНК-связывающий белок), молекулой РНК (РНК-связывающий белок) и/или белковой молекулой (белок-связывающий белок). В случае белок-связывающего белка, он может связываться с самим собой (для того чтобы формировать гомодимеры, гомотримеры и т.д.) и/или он может связываться с одной или несколькими молекулами другого белка или белков. Связывающий белок может обладать связывающей активностью больше чем одного типа. Например, белки с цинковыми пальцами обладают ДНК-связывающей, РНК-связывающей и белок-связывающей активностью.
[0064] «Рекомбинация» относится к процессу обмена генетической информацией между двумя полинуклеотидами, включая в качестве неограничивающих примеров захват донора посредством соединения негомологичных концов (NHEJ) и гомологичную рекомбинацию. Для целей этого раскрытия «гомологичная рекомбинация (HR)» относится к специализированной форме такого обмена, который имеет место, например, во время репарации двухцепочечных разрывов в клетках через механизмы репарации по гомологии. В этом процессе, требующем гомологии нуклеотидных последовательностей, используется «донорная» молекула для репарации «целевой» молекулы (т.е. той, которая подверглась двухцепочечному разрыву) по матрице, и он различно известен как «конверсия генов без кроссинговера» или «конверсия генов по короткому пути», поскольку он ведет к переносу генетической информации от донора к мишени. Не желая ограничиваться какой-либо конкретной теорией, такой перенос может содержать коррекцию несоответствий в гетеродуплексной ДНК, которая образуется между поврежденной мишенью и донором, и/или «синтез-зависимую ренатурацию цепей», при которой донор используют для того, чтобы повторно синтезировать генетическую информацию, которая станет частью мишени, и/или связанные процессы. Такая специализированная HR часто ведет к изменению последовательности целевой молекулы так, что часть или всю последовательность донорного полинуклеотида вводят в целевой полинуклеотид. Для HR-направленного встраивания донорная молекула содержит по меньшей мере одну область гомологии с геномом («гомологичные звенья») по меньшей мере 50-100 пар оснований в длину. См., например, публикацию патента США № 20110281361.
[0065] В способах по раскрытию одна или несколько направленных нуклеаз, как описано в настоящем документе, создают двухцепочечный разрыв в целевой последовательности (например, клеточном хроматине) в предварительно определяемом сайте, и в клетку можно вводить «донорный» полинуклеотид, который имеет гомологию с нуклеотидной последовательностью в области разрыва. Присутствие двухцепочечного разрыва показано для того, чтобы содействовать встраиванию донорной последовательности. Донорная последовательность может быть физически встроена или, альтернативно, донорный полинуклеотид используют в качестве матрицы для репарации разрыва через гомологичную рекомбинацию, что ведет к введению всей нуклеотидной последовательности или ее части, как в доноре, в клеточный хроматин. Таким образом, можно изменять первую последовательность в клеточном хроматине и, в определенных вариантах осуществления, можно превращать в последовательность, присутствующую в донорном полинуклеотиде. Таким образом, использование терминов «заменять» или «замена» можно понимать как обозначение замены одной нуклеотидной последовательности на другую (т.е. замены последовательности в информационном смысле), которое не обязательно требует физической или химической замены одного полинуклеотида на другой.
[0066] «Расщепление» относится к разрыву ковалентного остова молекулы ДНК. Расщепление можно инициировать различными способами, включая в качестве неограничивающих примеров ферментативный или химический гидролиз фосфодиэфирной связи. Возможно как одноцепочечное расщепление, так и двухцепочечное расщепление, и двухцепочечное расщепление может возникать в результате двух отдельных событий одноцепочечного расщепления. Расщепление ДНК может вести к образованию или тупых концов или ступенчатых концов. В определенных вариантах осуществления слитные полипептиды используют для направленного двухцепочечного расщепления ДНК.
[0067] Термины «плазмида» и «вектор», как используют в настоящем документе, относятся к внехромосомным элементам, которые могут нести один или несколько генов, которые не являются частью центрального метаболизма клетки. Плазмиды и векторы типично представляют собой кольцевые двухцепочечные молекулы ДНК. Однако плазмиды и векторы могут представлять собой линейные или кольцевые нуклеиновые кислоты, из одно- или двухцепочечной ДНК или РНК, и могут нести ДНК, полученную по существу из любого источника, в которой множество нуклеотидных последовательностей соединены или рекомбинированы в уникальную конструкцию, которая способна ко введению промоторного фрагмента и кодирующей последовательности ДНК наряду с любой подходящей 3’ нетранслируемой последовательностью в клетку. В примерах плазмиды и векторы могут содержать автономно реплицирующиеся последовательности для размножения в бактериальных организмах-хозяевах.
[0068] Полипептид и «белок» используют взаимозаменяемо в настоящем документе, и они включают молекулярную цепь из двух или более аминокислот, связанных через пептидные связи. Термины не относятся к продукту конкретной длины. Таким образом, «пептиды» и «олигопептиды» включены в определение полипептида. Термины включают посттрансляционные модификации полипептида, например, гликозилирование, ацетилирование, фосфорилирование и т.п. Кроме того, фрагменты, аналоги, варианты белка или мутировавшие белки, слитные белки и т.п. включены в значение полипептида. Термины также включают молекулы, в которые включены один или несколько аналогов аминокислот или неканонических или неприродных аминокислот, как можно синтезировать или рекомбинантно экспрессировать с использованием известных способов белковой инженерии. Кроме того, можно получать производные патентоспособных слитных белков, как описано в настоящем документе, с помощью общеизвестных способов органической химии.
[0069] Термин «слитный белок» указывает на то, что белок включает полипептидные компоненты, полученные из больше чем одного родительского белка или полипептида. Типично, слитный белок экспрессируют из слитного гена, в котором нуклеотидная последовательность, кодирующая полипептидную последовательность из одного белка, соединена с сохранением рамки считывания с нуклеотидной последовательностью, кодирующей полипептидную последовательность из другого белка, и необязательно отделена от нее линкером. Тогда слитный ген можно экспрессировать с помощью рекомбинантной клетки-хозяина в виде единого белка.
III. Варианты осуществления настоящего изобретения
[0070] В одном из вариантов осуществления по настоящему раскрытию предусмотрена полинуклеотидная донорная кассета, которая содержит связывающий домен нуклеазы с цинковыми пальцами, аналитический домен и плазмидный домен.
[0071] В определенном варианте осуществления полинуклеотидная донорная кассета по п. 1, полинуклеотидная донорная кассета содержит отрезок меньше чем 3 т.п.о. Образцовые длины полинуклеотидных донорных кассет могут составлять приблизительно 3 т.п.о., 2,9 т.п.о., 2,8 т.п.о., 2,7 т.п.о., 2,6 т.п.о., 2,5 т.п.о., 2,4 т.п.о., 2,3 т.п.о., 2,2 т.п.о., 2,1 т.п.о., 2,0 т.п.о., 1,9 т.п.о., 1,8 т.п.о., 1,7 т.п.о., 1,6 т.п.о., 1,5 т.п.о., 1,4 т.п.о., 1,3 т.п.о., 1,2 т.п.о., 1,1 т.п.о., 1,0 т.п.о., 0,9 т.п.о., 0,8 т.п.о., 0,7 т.п.о., 0,6 т.п.о., 0,5 т.п.о., 0,4 т.п.о., 0,3 т.п.о., 0,2 т.п.о. или 0,1 т.п.о. Термин «пара оснований» (также обозначаемый как «п.о.») относится к паре нуклеотидных оснований (нуклеотидов), каждое в отдельной одноцепочечной нуклеиновой кислоте, в которой каждое основание из пары нековалентно связано с другим (например, через водородные связи). Например, пара оснований по Уотсону-Крику обычно содержит один пурин и один пиримидин. Гуанозин может образовывать пару с цитозином (G-C), аденин может образовывать пару с тимином (A-T) и урацил может образовывать пару с аденином (U-A). Два основания в паре оснований являются так называемыми комплементарными друг другу. Пары оснований можно обозначать как тысячи пар оснований (т.п.о.), миллионы пар оснований (млн. п.о.) или миллиарды пар оснований (млрд. п.о.), где тысячу иногда обозначают «кило», миллион обозначают «мега», а миллиард обозначают «гига».
[0072] В других вариантах осуществления клетку трансформируют с использованием полинуклеотидной донорной кассеты, которая содержит связывающий домен сайт-специфической нуклеазы, аналитический домен и плазмидный домен, и полинуклеотидную донорную кассету интегрируют в ДНК клетки-хозяина. Термин «клетка», как обозначают в настоящем документе, включает живой организм, способный к самостоятельной репликации, и может представлять собой эукариотическую или прокариотическую клетку. В некоторых вариантах осуществления трансформированная клетка представляет собой клетку растения. В некоторых вариантах осуществления клетка растения может относиться, но не ограничиваясь этим, к какому-либо высшему растению, включая как двусеменодольные, так и односеменодольные растения, и употребляемые растения, в том числе сельскохозяйственные культуры и растения, используемые ради их масел. Таким образом, растения любого вида или клетку растения можно выбирать для трансформации, как дополнительно описано ниже.
[0073] В некоторых вариантах осуществления клетка растения, трансформированная в соответствии с настоящим раскрытием, включает, но не ограничиваясь этим, какие-либо высшие растения, включая как двусеменодольные, так и односеменодольные растения, и, в частности, употребляемые растения, в том числе сельскохозяйственные культуры. Такие растения могут включать, но не ограничиваясь этим, например: люцерну, соевые бобы, хлопок, семя рапса (также обозначаемого как канола), льняное семя, кукурузу, рис, брахиарию, пшеницу, сафлор, сорго, сахарную свеклу, подсолнечник, табак и газонные травы. Таким образом, можно выбирать любые виды растений или клетку растения. В некоторых вариантах осуществления клетки растений, используемые в настоящем документе, и растения, выраженные или произведенные из них, включают, но не ограничиваясь этим, клетки, получаемые из семени рапса (Brassica napus); индийской горчицы (Brassica juncea); эфиопской горчицы (Brassica carinata); репы (Brassica rapa); капусты (Brassica oleracea); соевых бобов (Glycine max); льняного семени/льна (Linum usitatissimum); кукурузы (также обозначаемой как маис) (Zea mays); сафлора (Carthamus tinctorius); подсолнечника (Helianthus annuus); табака (Nicotiana tabacum); Arabidopsis thaliana; бразильского ореха (Betholettia excelsa); касторовых бобов (Ricinus communis); кокоса (Cocus nucifera); кориандра (Coriandrum sativum); хлопка (Gossypium spp.); арахиса (Arachis hypogaea); жожоба (Simmondsia chinensis); масличной пальмы (Elaeis guineeis); оливы (Olea eurpaea); риса (Oryza sativa); тыквы (Cucurbita maxima); ячменя (Hordeum vulgare); сахарного тростника (Saccharum officinarum); риса (Oryza sativa); пшеницы (Triticum spp., включая Triticum durum и Triticum aestivum); и ряски (Lemnaceae sp.). В некоторых вариантах осуществления генетический фон у вида растения может варьировать.
[0074] В отношении получения генетически модифицированных растений, способы генетической инженерии растений хорошо известны в данной области. Например, разработано множество способов трансформации растений, в том числе протоколы биологической и физической трансформации для двусеменодольных растений, а также односеменодольных растений (например, Goto-Fumiyuki et al., Nature Biotech 17:282-286 (1999); Miki et al., Methods in Plant Molecular Biology and Biotechnology, Glick, B. R. and Thompson, J. E. Eds., CRC Press, Inc., Boca Raton, стр. 67-88 (1993)). Кроме того, доступны векторы и способы культивирования in vitro для трансформации клеток или тканей растения и регенерации растений, например, в Gruber et al., Methods in Plant Molecular Biology and Biotechnology, под редакцией Glick, B. R. and Thompson, J. E., CRC Press, Inc., Boca Raton, стр. 89-119 (1993).
[0075] Доступно большое число способов инсерции ДНК в клетку-хозяина растения. Эти способы включают трансформацию неокогенной Т-ДНК с использованием Agrobacterium tumefaciens или Agrobacterium rhizogenes в качестве трансформирующего агента, трансфекцию с фосфатом кальция, трансформацию с полибреном, слияние протопластов, электропорацию, ультразвуковые способы (например, сонопорацию), трансформацию липосомами, микроинъекции, депротеинизированную ДНК, плазмидные векторы, вирусные векторы, биолистические средства (бомбардировку микрочастицами), трансформацию, опосредованную нитевидными кристаллами карбида кремния, струи аэрозоля или PEG, а также другие возможные способы.
[0076] Например, ДНК-конструкцию можно вводить непосредственно в геномную ДНК клетки растения с использованием таких способов, как электропорация и микроинъекции протопластов клеток растения, или ДНК-конструкции можно вводить непосредственно в ткань растения с использованием биолистических способов, таких как бомбардировка частицами ДНК (см., например, Klein et al. (1987) Nature 327:70 73). Дополнительные способы трансформации клеток растения включают микроинъекции через захват ДНК, опосредованный нитевидными кристаллами карбида кремния (Kaeppler et al. (1990) Plant Cell Reporter 9:415 418). Альтернативно, ДНК-конструкцию можно вводить в клетку растения через трансформацию наночастицами (см., например, патентную заявку США № 12/245,685, включенную в настоящий документ посредством ссылки в полном объеме).
[0077] Другим известным способом трансформации растений является трансформация бомбардировкой микрочастицами, при которой ДНК переносят на поверхности микрочастиц. В этом способе вектор вводят в ткани растения с использованием биолистического устройства, которое ускоряет микрочастицы до скоростей, достаточных для проникновения через клеточные стенки и мембраны растений. Sanford et al., Part. Sci. Technol. 5:27 (1987), Sanford, J. C., Trends Biotech. 6:299 (1988), Sanford, J. C., Physiol. Plant 79:206 (1990), Klein et al., Biotechnology 10:268 (1992).
[0078] Альтернативно, способы переноса генов и трансформации включают, но не ограничиваясь этим, трансформацию протопластов через преципитацию с хлоридом кальция, опосредованный полиэтиленгликолем (PEG) или электропорацией захват депротеинизированной ДНК (см. Paszkowski et al. (1984) EMBO J 3:2717 2722, Potrykus et al. (1985) Molec. Gen. Genet. 199:169 177; Fromm et al. (1985) Proc. Nat. Acad. Sci. USA 82:5824 5828; и Shimamoto (1989) Nature 338:274 276) и электропорацию тканей растения (D’Halluin et al. (1992) Plant Cell 4:1495 1505).
[0079] Широко используемый способ введения экспрессирующего вектора в растения основан на природной системе трансформации агробактерии. Horsch et al., Science 227:1229 (1985). A. tumefaciens и A. rhizogenes представляют собой известные патогенные почвенные бактерии растений, которые можно использовать для генетической трансформации клеток растений. Плазмиды Ti и Ri из A. tumefaciens и A. rhizogenes, соответственно, несут гены, отвечающие за генетическую трансформацию растения. Kado, C. I., Crit. Rev. Plant. Sci. 10:1 (1991). Описания векторных систем агробактерий и способов опосредованного агробактериями переноса генов также доступны, например, в Gruber et al., выше, Miki et al., выше, Moloney et al., Plant Cell Reports 8:238 (1989) и в патентах США №№ 4,940,838 и 5,464,763.
[0080] Если агробактерии используют для трансформации, ДНК, подлежащую инсерции, следует клонировать в специальные плазмиды, а именно или в промежуточный вектор или в бинарный вектор. Промежуточные векторы не способны к самостоятельной репликации в агробактериях. Промежуточный вектор можно переносить в Agrobacterium tumefaciens с использованием плазмиды-помощника (конъюгация). Japan Tobacco Superbinary System представляет собой пример такой системы (рассмотрено у Komari et al., (2006) Methods in Molecular Biology (K. Wang, ed.) № 343: Agrobacterium Protocols (2-е издание, том 1) Humana Press Inc., Totowa, NJ, стр.15-41; и Komori et al., (2007) Plant Physiol. 145:1155-1160). Бинарные векторы способны к самостоятельной репликации как в E. coli, так и в агробактериях. Они содержат селективный маркерный ген и линкер или полилинкер, которые окружены левой и правой граничными областями Т-ДНК. Ими можно непосредственно трансформировать агробактерии (Holsters, 1978). Агробактерии, используемые в качестве клеток-хозяев, должны содержать плазмиду, несущую область vir. Плазмида Ti или Ri также содержит область vir, необходимую для переноса Т-ДНК. Область vir необходима для переноса Т-ДНК в клетку растения. Может содержаться дополнительная Т-ДНК.
[0081] Функции вирулентности хозяина Agrobacterium tumefaciens управляют инсерцией T-нитей, содержащих конструкцию и смежный маркер, в ДНК клетки растения, когда клетку инфицируют бактериями с использованием бинарного T-ДНК вектора (Bevan (1984) Nuc. Acid Res. 12:8711 8721) или процедуры совместного культивирования (Horsch et al. (1985) Science 227:1229 1231). В целом, систему трансформации агробактериями используют для конструирования двусеменодольных растений (Bevan et al. (1982) Ann. Rev. Genet 16:357 384; Rogers et al. (1986) Methods Enzymol. 118:627 641). Систему трансформации агробактериями также можно использовать для трансформации, а также переноса ДНК в односеменодольные растения и клетки растений. См. патент США № 5,591,616; Hernalsteen et al. (1984) EMBO J 3:3039 3041; Hooykass Van Slogteren et al. (1984) Nature 311:763 764; Grimsley et al. (1987) Nature 325:1677 179; Boulton et al. (1989) Plant Mol. Biol. 12:31 40; и Gould et al. (1991) Plant Physiol. 95:426 434. После введения генетической конструкции в конкретные клетки растений, клетки растений можно выращивать и после появления дифференцирующейся ткани, такой как побеги и корни, можно создавать взрослые растения. В некоторых вариантах осуществления можно создавать множество растений. Способы регенерации растений известны специалистам в данной области, и их можно найти, например, в: Plant Cell and Tissue Culture, 1994, под редакцией Vasil и Thorpe. Kluwer Academic Publishers и в: Plant Cell Culture Protocols (Methods in Molecular Biology 111, 1999, под редакцией Hall, Humana Press). Генетически модифицированное растение, описанное в настоящем документе, можно культивировать в ферментационной среде или растить в подходящей среде, такой как почва. В некоторых вариантах осуществления подходящая среда для выращивания высших растений может включать какую-либо среду для выращивания растений, включая в качестве неограничивающих примеров почву, песок, какие-либо другие дискретные среды, которые поддерживают рост корней (например, вермикулит, перлит и т.д.), или гидропоническую культуру, а также подходящие свет, воду и питательные добавки, которые оптимизируют рост высшего растения.
[0082] Трансформированные клетки растений, которые получают посредством какого-либо из приведенных выше способов трансформации, можно культивировать для того, чтобы регенерировать целое растение, которое обладает трансформированным генотипом и, таким образом, желаемым фенотипом. Такие способы регенерации основаны на воздействии определенными фитогормонами в среде для выращивания тканевой культуры, типично с использованием биоцидных и/или гербицидных маркеров, которые введены вместе с желаемыми нуклеотидными последовательностями. Регенерация растений из культивируемых протопластов описана в Evans, et al., «Protoplasts Isolation and Culture» в Handbook of Plant Cell Culture, стр. 124 176, Macmillian Publishing Company, New York, 1983; и Binding, Regeneration of Plants, Plant Protoplasts, стр. 21 73, CRC Press, Boca Raton, 1985. Также можно получать регенерацию из каллюса, эксплантатов, органов, пыльцы, зародышей растений или их частей. Такие способы регенерации в целом описаны в Klee et al. (1987) Ann. Rev. of Plant Phys. 38:467 486.
[0083] В других вариантах осуществления клетки растений, которые трансформируют, не способны к регенерации, чтобы получать растение. Такие клетки называют временно трансформированными. Временно трансформированные клетки можно получать для того, чтобы анализировать экспрессию и/или функциональность конкретного трансгена. Способы временной трансформации известны в данной области, и включают незначительные модификации способов трансформации, которые описаны выше. Специалисты в данной области могут выбирать использование временной трансформации для того, чтобы быстро анализировать экспрессию и/или функциональность конкретных трансгенов, поскольку временная трансформация выполнятся быстро и не требует так много ресурсов (например, культивирования растений для развития целых растений, самостоятельной фертилизации или скрещивания растений для фиксации трансгена в геноме и т.д.), как способы стабильной трансформации.
[0084] В одном из вариантов осуществления универсальный донорный полинуклеотид можно вводить в по существу любое растение. Широкий спектр растений и систем клеток растений можно конструировать для сайт-специфического встраивания универсального донорного полинуклеотида по настоящему раскрытию и различных указанных выше способов трансформации. В одном из вариантов осуществления целевые растения и клетки растений для конструирования включают, но не ограничиваясь этим, односеменодольные и двусеменодольные растения, такие как культуры, включающие зерновые культуры (например, пшеница, кукуруза, рис, просо, ячмень), фруктовые культуры (например, томат, яблоко, груша, клубника, апельсин), кормовые культуры (например, люцерна), корнеплодные культуры (например, морковь, картофель, сахарная свекла, батат), листовые овощные культуры (например, латук, шпинат); цветочные растения (например, петуния, роза, хризантема), иглолистные и хвойные деревья (например, бальзамическая пихта, ель); растения, используемые в фиторекультивации (например, растения, накапливающие тяжелые металлы); масличные культуры (например, подсолнечник, семя рапса) и растения, используемые для экспериментальных целей (например, Arabidopsis). Таким образом, раскрытые способы и композиции имеют применение для широкого диапазона растений, включая в качестве неограничивающих примеров виды из родов Asparagus, Avena, Brassica, Citrus, Citrullus, Capsicum, Cucurbita, Daucus, Erigeron, Glycine, Gossypium, Hordeum, Lactuca, Lolium, Lycopersicon, Malus, Manihot, Nicotiana, Orychophragmus, Oryza, Persea, Phaseolus, Pisum, Pyrus, Prunus, Raphanus, Secale, Solanum, Sorghum, Triticum, Vitis, Vigna и Zea mays.
[0085] В других вариантах осуществления полинуклеотидная донорная кассета содержит конкретную полинуклеотидную последовательность. Примеры конкретных полинуклеотидных последовательностей включают, но не ограничиваясь этим; SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141. В различных вариантах осуществления последовательности с по меньшей мере 90% идентичности последовательностей с конкретными полинуклеотидными последовательностями SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141 описаны в настоящем документе. В других вариантах осуществления последовательности с по меньшей мере 95% идентичности последовательностей с конкретными полинуклеотидными последовательностями SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141 описаны в настоящем документе. В других вариантах осуществления последовательности с по меньшей мере 97% идентичности последовательностей с конкретными полинуклеотидными последовательностями SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141 описаны в настоящем документе. В других вариантах осуществления последовательности с по меньшей мере 99% идентичности последовательностей с конкретными полинуклеотидными последовательностями SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140 и SEQ ID NO: 141 описаны в настоящем документе. В одном из вариантов осуществления полинуклеотидная донорная кассета содержит последовательность, которая имеет по меньшей мере 90, 93, 95, 97 или 99% идентичности последовательностей с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 142 и 143.
[0086] Термин «процент идентичности» (или «% идентичности»), как известно в данной области, представляет собой зависимость между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, как определяют посредством сравнения последовательностей. В данной области, «идентичность» также обозначает степень родства последовательностей между полипептидными или полинуклеотидными последовательностями, в зависимости от случая, как определяют посредством сопоставления между строками таких последовательностей. «Идентичность» и «сходство» можно легко вычислять с помощью известных способов, включая в качестве неограничивающих примеров те, которые раскрыты в: 1.) Computational Molecular Biology (под редакцией Lesk, A. M.) Oxford University: NY (1988); 2.) Biocomputing: Informatics and Genome Projects (под редакцией Smith, D. W.) Academic: NY (1993); 3.) Computer Analysis of Sequence Data, Part I (под редакцией Griffin, A. M., и Griffin, H. G.) Humania: NJ (1994); 4.) Sequence Analysis in Molecular Biology (под редакцией von Heinje, G.) Academic (1987); и 5.) Sequence Analysis Primer (под редакцией Gribskov, M. и Devereux, J.) Stockton: NY (1991).
[0087] Способы определения идентичности последовательностей нуклеиновых кислот и аминокислот известны в данной области. Типично такие способы включают определение нуклеотидной последовательности мРНК для гена и/или определение аминокислотной последовательности, кодируемой им, и сравнение этих последовательностей со второй нуклеотидной или аминокислотной последовательностью. Геномные последовательности также можно определять и сравнивать таким же образом. В целом, идентичность относится к точному соответствию между нуклеотидами или между аминокислотами в двух полинуклеотидных или полипептидных последовательностях, соответственно. Две или более последовательности (полинуклеотидных или аминокислотных) можно сравнивать посредством определения их процента идентичности. Процент идентичности двух последовательностей, будь то последовательности нуклеиновых кислот или аминокислот, представляет собой число точных совпадений между двумя выровненными последовательностями, деленное на длину более короткой последовательности и умноженное на 100. См. Russell, R., and Barton, G., «Structural Features can be Unconserved in Proteins with Similar Folds». J. Mol. Biol. 244, 332-350 (1994), стр. 337, которая включена в настоящий документ посредством ссылки в полном объеме.
[0088] Кроме того, способы определения идентичности и сходства закодированы в общедоступных компьютерных программах. Выравнивание последовательностей и вычисление процента идентичности можно осуществлять, например, с использованием программы AlignX из пакета Vector NTI® (Invitrogen, Carlsbad, CA) или программы MegAlignTM из биоинформационного вычислительного пакета LASERGENE (DNASTAR Inc., Madison, WI). Множественное выравнивание последовательностей осуществляют с использованием способа выравнивания «Clustal», который охватывает несколько разновидностей алгоритма, в том числе «Clustal V method of alignment», соответствующий способу выравнивания, обозначаемому Clustal V (раскрыто у Higgins and Sharp, CABIOS. 5:151-153 (1989); Higgins, D.G. et al., Comput. Appl. Biosci., 8:189-191 (1992)) и найденному в программе MegAlignTM биоинформационного вычислительного пакета LASERGENE (DNASTAR Inc.). Для множественного выравнивания значения по умолчанию соответствуют GAP PENALTY=10 и GAP LENGTH PENALTY=10. Параметры по умолчанию для парного выравнивания и вычисления процента идентичности белковых последовательностей с использованием способа Clustal представляют собой KTUPLE=1, GAP PENALTY=3, WINDOW=5 и DIAGONALS SAVED=5. Для нуклеиновых кислот эти параметры составляют KTUPLE=2, GAP PENALTY=5, WINDOW=4 и DIAGONALS SAVED=4. После выравнивания последовательностей с использованием программы Clustal V можно получать «процент идентичности» посредством просмотра таблицы «расстояний последовательностей» в той же программе. Кроме того, доступен «Clustal W method of alignment», который соответствует способу выравнивания, обозначаемому Clustal W (описано у Higgins and Sharp, CABIOS. 5:151-153 (1989); Higgins, D.G. et al., Comput. Appl. Biosci. 8:189-191(1992)) и найденному в программе MegAlignTM v6.1 из биоинформационного вычислительного пакета LASERGENE (DNASTAR Inc.). Параметры по умолчанию для множественного выравнивания (GAP PENALTY=10, GAP LENGTH PENALTY=0,2, Delay Divergen Seqs(%)=30, DNA Transition Weight=0.5, Protein Weight Matrix=Gonnet Series, DNA Weight Matrix=IUB). После выравнивания последовательностей с использованием программы Clustal W можно получать «процент идентичности» посредством просмотра таблицы «расстояний последовательностей» в той же программе.
[0089] Термин «программное обеспечение для анализа последовательностей» относится к какому-либо компьютерному алгоритму или программе программного обеспечения, которые можно использовать для анализа нуклеотидных или аминокислотных последовательностей. «Программное обеспечение для анализа последовательностей» может быть коммерчески доступным или разрабатываемым независимо. Типичное программное обеспечение для анализа последовательностей будет включать, но не ограничиваясь этим: 1.) пакет программ GCG (Wisconsin Package Version 9.0, Genetics Computer Group (GCG), Madison, WI); 2.) BLASTP, BLASTN, BLASTX (Altschul et al., J. Mol. Biol., 215:403 410 (1990)); 3.) DNASTAR (DNASTAR, Inc. Madison, WI); 4.) Sequencher (Gene Codes Corporation, Ann Arbor, MI); и 5.) программу FASTA, содержащую алгоритм Смита-Ватермана (W. R. Pearson, Comput. Methods Genome Res., [Proc. Int. Symp.] (1994), Meeting Date 1992, 111 20. Под редакцией: Suhai, Sandor. Plenum: New York, NY). В рамках контекста этой заявки понятно, что когда программное обеспечение для анализа последовательностей используют для анализа, эти результаты анализа будут основаны на «значениях по умолчанию» для упомянутых программ, если не указано иное. Как используют в настоящем документе, «значения по умолчанию» обозначают любой набор значений или параметров, которые исходно загружены с программным обеспечением при первой инициализации.
[0090] В отношении способов гибридизации, всю известную нуклеотидную последовательность или ее часть можно использовать в качестве зонда, который избирательно гибридизуется с другими соответствующими нуклеотидными последовательностями, присутствующими в популяции фрагментов клонированной геномной ДНК или фрагментов кДНК (т.е. библиотеки геномной или кДНК) из выбранного организма. Зонды для гибридизации могут представлять собой фрагменты геномной ДНК, фрагменты плазмидной ДНК, фрагменты кДНК, фрагменты РНК, ПЦР-амплифицированные фрагменты ДНК, олигонуклеотиды или другие полинуклеотиды, и их множно метить поддающейся обнаружению группой, такой как32P, или каким-либо другим поддающимся обнаружению маркером. Таким образом, например, зонды для гибридизации можно получать посредством мечения синтетических олигонуклеотидов на основе последовательностей ДНК по вариантам осуществления из раскрытия. Способы получения зондов для гибридизации и для конструирования кДНК и геномных библиотек в целом известны в данной области и раскрыты (Sambrook et al., 1989).
[0091] Зонды и праймеры нуклеиновых кислот по вариантам осуществления из настоящего раскрытия гибридизуются при строгих условиях с целевой последовательностью ДНК. Любой стандартный способ гибридизации или амплификации нуклеиновой кислоты можно использовать для того, чтобы идентифицировать присутствие ДНК от трансгенного события в образце. Молекулы нуклеиновой кислоты или ее фрагменты способны к специфичной гибридизации с другими молекулами нуклеиновой кислоты при определенных условиях. Как используют в настоящем документе, две молекулы нуклеиновой кислоты так сказать способны к специфичной гибридизации друг с другом, если две молекулы способны образовать структуру антипараллельной двухцепочечной нуклеиновой кислоты. Молекула нуклеиновой кислоты представляет собой так называемый «комплемент» другой молекулы нуклеиновой кислоты, если две молекулы нуклеиновой кислоты демонстрируют полную комплементарность. Как используют в настоящем документе, о молекулах говорят, что они демонстрируют «полную комплементарность», когда каждый нуклеотид одной из молекул комплементарен нуклеотиду в другой. Молекулы, которые демонстрируют полную комплементарность, в целом будут образовывать гибрид друг с другом с достаточной стабильностью, чтобы позволять им оставаться ренатурированными друг с другом при стандартных условиях «высокой степени строгости». Стандартные условия высокой степени строгости описаны у Sambrook et al., 1989.
[0092] О двух молекулах говорят, что они демонстрируют «минимальную комплементарность», если они могут образовывать гибрид друг с другом с достаточной стабильностью, чтобы позволять им оставаться ренатурированными друг с другом при по меньшей мере стандартных условиях «низкой степени строгости». Стандартные условия низкой степени строгости описаны у Sambrook et al., 1989. Для того чтобы молекула нуклеиновой кислоты служила в качестве праймера или зонда, она должна демонстрировать только минимальную комплементарность последовательности, чтобы быть способной формировать стабильную двухцепочечную структуру с конкретными используемыми растворителем и концентрациями солей.
[0093] Факторы, которые влияют на степень строгости гибридизации хорошо известны специалистам в данной области и включают, но не ограничиваясь этим, температуру, pH, ионную силу и концентрацию органических растворителей, таких как, например, формамид и диметилсульфоксид. Как известно специалистам в данной области, степень строгости гибридизации возрастает с ростом температуры, снижением ионной силы и снижением концентрации растворителя.
[0094] Термин «строгие условия» или «степень строгости условий» функционально определяют по отношению к гибридизации зонда нуклеиновой кислоты с целевой нуклеиновой кислотой (т.е. с конкретнлй последовательностью нуклеиновой кислоты, представляющей интерес) посредством конкретной процедуры гибридизации, рассмотренной в Sambrook et al., 1989, в 9.52-9.55. См. также Sambrook et al., 1989, в 9.47-9.52 и 9.56-9.58.
[0095] Типично, строгие условия представляют собой те, в которых концентрация соли меньше чем приблизительно концентрация 1,5 М ионов Na+, типично приблизительно от 0,01 до 1,0 M ионов Na+ (или других солей) при pH от 7,0 до 8,3 и температура составляет по меньшей мере приблизительно 30°C для коротких зондов (например, от 10 до 50 нуклеотидов) и по меньшей мере приблизительно 60°C для длинных зондов (например, больше чем 50 нуклеотидов). Строгие условия также можно получать при добавлении дестабилизирующих средств, таких как формамид. Образцовые условия низкой степени строгости включают гибридизацию с буферным раствором из от 30 до 35% формамида, 1,0 М NaCl, 0,1% SDS (додецилсульфат натрия) при 37°C и промывание в от 1× до 2×SSC (20×SSC=3,0 М NaCl/0,3 М трицитрат натрия) при от 50 до 55°C. Образцовые условия умеренной степени строгости включают гибридизацию в 40-45% формамиде, 1,0 М NaCl, 0,1% SDS при 37°C и промывание в от 0,5× до 1×SSC при от 55 до 60°C. Образцовые условия с высокой строгостью включают гибридизацию в 50% формамиде, 1,0 М NaCl, 0,1% SDS при 37°C и промывание в 0,1×SSC при 60-65°C.
[0096] Специфичность типично представляет собой функцию промываний после гибридизации, критическими факторами являются ионная сила и температура конечного промывающего раствора. Для гибридов ДНК-ДНК Tm можно аппроксимировать по уравнению Tm=81,5°C+16,6(logM)+0,41(%GC)-0,61(%форм.)-500/L, где M представляет собой молярность одновалентных катионов, %GC представляет собой процентную долю нуклеотидов гуанозин и цитозин в ДНК, %форм. представляет собой процентную долю формамида в гибридизационном растворе и L представляет собой длину гибрида в парах оснований (Meinkoth and Wahl, 1984). Tm представляет собой температуру (при определенных ионной силе и pH), при которой 50% комплементарной целевой последовательности образует гибрид с полностью совпадающим зондом. Tm снижается приблизительно на 1°C для каждого 1% несовпадения; таким образом, Tm, гибридизацию и/или условия промывания можно корректировать для гибридизации последовательностей желаемой идентичности. Например, если желательны последовательности с 90% идентичности, Tm можно снижать на 10°C. В целом, строгие условия выбирают так, чтобы они были приблизительно на 5°C ниже, чем температура теплового плавления (Tm) для конкретной последовательности и ее комплемента при определенных ионной силе и pH. Однако крайне строгие условия могут использовать гибридизацию и/или промывание при на 1, 2, 3 или 4°C ниже, чем температура теплового плавления (Tm); умеренно строгие условия могут использовать гибридизацию и/или промывание при на 6, 7, 8, 9 или 10°C ниже, чем температура теплового плавления (Tm); условия низкой степени строгости могут использовать гибридизацию и/или промывание при на 11-20°C ниже, чем температура теплового плавления (Tm). Используя уравнение, композиции для гибридизации и промывания и желаемую Tm, средние специалисты поймут, что вариации в степени строгости гибридизации и/или промывающих растворах по существу описаны. Если желаемая степень несовпадения ведет к Tm меньше чем 45°C (водный раствор) или 32°C (раствор формамида), предпочтительно увеличивать концентрацию SSC с тем, чтобы можно было использовать более высокую температуру. Обширное руководство по гибридизации нуклеиновых кислот можно найти в (1997) Ausubel et al, Short Protocols in Molecular Biology, стр. 2-40, 3-е издание, (1997) и в Sambrook et al. (1989).
[0097] В одном из вариантов осуществления полинуклеотидная донорная кассета содержит один или несколько связывающих доменов нуклеазы с цинковыми пальцами. По существу, вариант осуществления полинуклеотидной донорной кассеты содержит 1 связывающий домен нуклеазы с цинковыми пальцами, 2 связывающих домена нуклеазы с цинковыми пальцами, 3 связывающих домена нуклеазы с цинковыми пальцами, 4 связывающих домена нуклеазы с цинковыми пальцами, 5 связывающих доменов нуклеазы с цинковыми пальцами, 6 связывающих доменов нуклеазы с цинковыми пальцами, 7 связывающих доменов нуклеазы с цинковыми пальцами, 8 связывающих доменов нуклеазы с цинковыми пальцами, 9 связывающих доменов нуклеазы с цинковыми пальцами, 10 связывающих доменов нуклеазы с цинковыми пальцами, или больше связывающих доменов цинкового пальца.
[0098] Выбор сайтов-мишеней, ZFP и способов разработки и конструирования слитных белков (и полинуклеотидов, кодирующих их) известны специалистам в данной области и подробно описаны в патентах США №№ 6,140,081; 5,789,538; 6,453,242; 6,534,261; 5,925,523; 6,007,988; 6,013,453; 6,200,759; WO 95/19431; WO 96/06166; WO 98/53057; WO 98/54311; WO 00/27878; WO 01/60970 WO 01/88197; WO 02/099084; WO 98/53058; WO 98/53059; WO 98/53060; WO 02/016536 и WO 03/016496.
[0099] В последующих вариантах осуществления связывающий домен нуклеазы с цинковыми пальцами, содержащий одну или несколько связывающих последовательностей цинковых пальцев, связывается связывающим белком с цинковыми пальцами, связывающим белком мегануклеазы, CRIPSR или TALEN связывающим белком.
[00100] В определенных вариантах осуществления композиция и способы, описанные в настоящем документе, используют связывающий белок мегануклеазы (хоуминг-эндонуклеазы) или ДНК-связывающий домен мегануклеазы для связывания с донорной молекулой и/или связывания с областью, представляющей интерес, в геноме клетки. Встречающиеся в природе мегануклеазы распознают сайты расщепления в 15-40 пар оснований и обыкновенно образуют четыре семейства: семейство LAGLIDADG, семейство GIY-YIG, семейство бокса His-Cys и семейство HNH. Образцовые хоуминг-эндонуклеазы включают I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII. Их последовательности распознавания известны. См. также патент США № 5,420,032; патент США № 6,833,252; Belfort et al. (1997) Nucleic Acids Res. 25:3379-3388; Dujon et al. (1989) Gene 82:115-118; Perler et al. (1994) Nucleic Acids Res. 22, 1125-1127; Jasin (1996) Trends Genet. 12:224-228; Gimble et al. (1996) J. Mol. Biol. 263:163-180; Argast et al. (1998) J. Mol. Biol. 280:345-353 и каталог New England Biolabs.
[0100] В определенных вариантах осуществления способы и композиции, описанные в настоящем документе, используют нуклеазу, которая содержит сконструированную (не встречающуюся в природе) хоуминг-эндонуклеазу (мегануклеазу). Известны последовательности распознавания хоуминг-эндонуклеаз и мегануклеаз, таких как I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII. См. также патент США № 5,420,032; патент США № 6,833,252; Belfort et al. (1997) Nucleic Acids Res. 25:3379-3388; Dujon et al. (1989) Gene 82:115-118; Perler et al. (1994) Nucleic Acids Res. 22, 1125-1127; Jasin (1996) Trends Genet. 12:224-228; Gimble et al. (1996) J. Mol. Biol. 263:163-180; Argast et al. (1998) J. Mol. Biol. 280:345-353 и каталог New England Biolabs. Кроме того, специфичность связывания ДНК хоуминг-эндонуклеазами и мегануклеазами можно конструировать для того, чтобы связывать неприродные сайты-мишени. См., например, Chevalier et al. (2002) Molec. Cell 10:895-905; Epinat et al. (2003) Nucleic Acids Res. 31:2952-2962; Ashworth et al. (2006) Nature 441:656-659; Paques et al. (2007) Current Gene Therapy 7:49-66; публикацию патента США № 20070117128. ДНК-связывающие домены хоуминг-эндонуклеаз и мегануклеаз можно изменять в контексте нуклеазы в целом (т.е. так, что нуклеаза содержит родственный расщепляющий домен) или можно сливать с гетерологичным расщепляющим доменом.
[0101] В других вариантах осуществления ДНК-связывающий домен одной или нескольких из нуклеаз, используемых в способах и композициях, описанных в настоящем документе, содержит встречающийся в природе или сконструированный (не встречающийся в природе) ДНК-связывающий домен TAL эффектора. См., например, публикацию патента США № 20110301073, включенную посредством ссылки в полном объеме в настоящий документ. Известно, что патогенные бактерии растений рода Xanthomonas вызывают многие заболевания у важных сельскохозяйственных культур. Патогенность Xanthomonas зависит от консервативной системы секреции III типа (T3S), которая вводит больше чем 25 различных эффекторных белков в клетку растения. Среди этих введенных белков подобные активатору транскрипции (TAL) эффекторы, которые имитируют транскрипционные активаторы растений и влияют на транскриптом растения (см. Kay et al (2007) Science 318:648-651). Эти белки содержат ДНК-связывающий домен и домен транскрипционной активации. Одним из наиболее хорошо описанных TAL-эффекторов является AvrBs3 из Xanthomonas campestgris pv. Vesicatoria (см. Bonas et al (1989) Mol Gen Genet 218: 127-136 и WO2010079430). TAL-эффекторы содержат центрированный домен из тандемных повторов, каждый повтор содержит приблизительно 34 аминокислоты, которые являются ключевыми для специфичности связывания ДНК у этих белков. Кроме того, они содержат последовательность ядерной локализации и кислый домен транскрипционной активации (обзор см. в Schornack S, et al (2006) J Plant Physiol 163(3): 256-272). Кроме того, в фитопатогенных бактериях Ralstonia solanacearum найдены два гена, обозначаемые brg11 и hpx17, которые гомологичны семейству AvrBs3 из Xanthomonas, в штамме GMI1000 биовара 1 и в штамме RS1000 биовара 4 R. solanacearum (см. Heuer et al (2007) Appl and Envir Micro 73(13): 4379-4384). Эти гены идентичны друг другу на 98,9% по нуклеотидной последовательности, но различаются делецией 1575 п.о. в домене повтора hpx17. Однако, оба продукта гена имеют меньше чем 40% идентичности последовательностей с белками семейства AvrBs3 из Xanthomonas. См., например, публикации патента США №№ 20110239315, 20110145940 и 20110301073, включенные посредством ссылки в полном объеме в настоящий документ.
[0102] Специфичность этих TAL эффекторов зависит от последовательностей, найденных в тандемных повторах. Повторяющаяся последовательность содержит приблизительно 102 п.о., а повторы типично на 91-100% гомологичны друг другу (Bonas et al, там же). Полиморфизм повторов обычно расположен в положениях 12 и 13, и по-видимому имеет место соответствие один-к-одному между отличительными чертами двух гипервариабельных остатков в положениях 12 и 13 и отличительными чертами непрерывных нуклеотидов в целевой последовательности TAL-эффектора (см. Moscou and Bogdanove, (2009) Science 326:1501 и Boch et al (2009) Science 326:1509-1512). В эксперименте определен природный код этих TAL-эффекторов для распознавания ДНК так, что HD последовательность в положениях 12 и 13 ведет к связыванию с цитозином (C), NG связывается с T, NI с A, C, G или T, NN связывается с A или G, а ING связывается с T. Эти ДНК-связывающие повторы собраны в белках с новыми комбинациями и числом повторов, чтобы создавать искусственные факторы транскрипции, которые способны взаимодействовать с новыми последовательностями и активировать экспрессию неэндогенного репортерного гена в клетках растений (Boch et al, там же). Сконструированные TAL белки соединены с расщепляющим полудоменом FokI, чтобы получать слитный белок нуклеазы и TAL эффекторного домена (TALEN), который проявляет активность в репортерном анализе дрожжей (плазмидная мишень). См., например, публикацию патента США № 20110301073; Christian et al ((2010) [0103] В других вариантах осуществления нуклеаза представляет собой систему, которая содержит CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats)/Cas (CRISPR-ассоциированную) нуклеазную систему. CRISPR/Cas представляет собой недавно сконструированную нуклеазную систему на основе бактериальной системы, которую можно использовать для конструирования генома. Она основана на части адаптивного иммунного ответа многих бактерий и архей. Когда вирус или плазмида захватывает бактерию, сегменты ДНК захватчика превращаются в CRISPR РНК (crРНК) с помощью «иммунного» ответа. Затем эта crРНК соединяется, через область частичной комплементарности, с РНК другого типа, называемой tracrРНК, чтобы направлять Cas9 нуклеазу в область, гомологичную crРНК в целевой ДНК рядом со смежным с протоспейсером мотивом (PAM) NGG. Cas9 расщепляет ДНК для того, чтобы генерировать тупые концы в разрыве двухцепочечной ДНК в сайтах, точно определяемых 20-нуклеотидной направляющей последовательностью, содержащейся в транскрипте crРНК. Для Cas9 необходима как crРНК, так и tracrРНК для сайт-специфического распознавания и расщепления ДНК. Эта система сейчас сконструирована так, что crРНК и tracrРНК можно комбинировать в одной молекуле («единой направляющей РНК»), и эквивалентную crРНК часть единой направляющей РНК можно конструировать для того, чтобы направлять нуклеазу Cas9 для направленного воздействия на какую-либо желаемую последовательность, смежную с PAM (см. Jinek et al (2012) Science 337, стр. 816-821, Jinek et al, (2013), eLife 2:e00471, и David Segal, (2013) eLife 2:e00563). Таким образом, систему CRISPR/Cas можно конструировать для того, чтобы создавать разрыв двухцепочечной ДНК в желаемой мишени в геноме, а на репарацию разрыва двухцепочечной ДНК можно влиять с помощью ингибиторов репарации, чтобы вызывать увеличение репарации с внесением ошибок. [0104] В определенных вариантах осуществления ДНК-связывающий домен одной или нескольких из нуклеаз, используемых для расщепления и/или направленного расщепления генома клетки in vivo, содержит белок с цинковым пальцем. Предпочтительно, белок с цинковым пальцем является не встречающимся в природе, поскольку его конструируют для связывания с предпочтительным сайтом-мишенью. См., например, Beerli et al. (2002) Nature Biotechnol. 20:135-141; Pabo et al. (2001) Ann. Rev. Biochem. 70:313-340; Isalan et al. (2001) Nature Biotechnol. 19:656-660; Segal et al. (2001) Curr. Opin. Biotechnol. 12:632-637; Choo et al. (2000) Curr. Opin. Struct. Biol. 10:411-416; патенты США №№ 6,453,242; 6,534,261; 6,599,692; 6,503,717; 6,689,558; 7,030,215; 6,794,136; 7,067,317; 7,262,054; 7,070,934; 7,361,635; 7,253,273; и публикации патентов США №№ 2005/0064474; 2007/0218528; 2005/0267061, все включены в настоящий документ посредством ссылки в полном объеме. [0105] Сконструированный связывающий домен цинкового пальца может иметь новую специфичность связывания по сравнению со встречающимся в природе белком с цинковым пальцем. Способы конструирования включают, но не ограничиваясь этим, рациональную разработку и различные типы отбора. Рациональная разработка включает, например, использование баз данных, которые содержат триплетные (или квадруплетные) нуклеотидные последовательности и индивидуальные аминокислотные последовательности цинковых пальцев, в которых каждая триплетная или квадруплетная нуклеотидная последовательность связана с одной или несколькими аминокислотными последовательностями цинковых пальцев, которые связывают конкретную триплетную или квадруплетную последовательность. См., например, совместно принадлежащие патенты США 6,453,242 и 6,534,261, включенные посредством ссылки в настоящий документ в полном объеме. [0106] Образцовые способы отбора, включая фаговый дисплей и двугибридные системы, раскрыты в патентах США 5,789,538; 5,925,523; 6,007,988; 6,013,453; 6,410,248; 6,140,466; 6,200,759; и 6,242,568; а также WO 98/37186; WO 98/53057; WO 00/27878; WO 01/88197 и GB 2,338,237. Кроме того, улучшение специфичности связывания для связывающих доменов цинковых пальцев описано, например, в совместно принадлежащей WO 02/077227. [0107] Кроме того, как раскрыто в этих и других литературных источниках, домены цинковых пальцев и/или белки с множеством цинковых пальцев могут быть соединены вместе с использованием любых подходящих линкерных последовательностей, включая, например, линкеры из пяти или больше аминокислот в длину. Также образцовые линкерные последовательности 6 или больше аминокислот в длину см. в патентах США №№ 6,479,626; 6,903,185; и 7,153,949. Белки, описанные в настоящем документе, могут содержать какую-либо комбинацию подходящих линкеров между отдельными цинковыми пальцами белка. [0108] В настоящем документе описаны композиции, в частности, нуклеазы, которые можно использовать для расщепления донорной молекулы, несущей трансген, in vivo, и нуклеазы для расщепления генома клетки так, что трансген интегрируют в геном направленным образом. В определенных вариантах осуществления одна или несколько из нуклеаз являются встречающимися в природе. В других вариантах осуществления одна или несколько из нуклеаз являются не встречающимися в природе, т.е., сконструированными в ДНК-связывающем домене и/или расщепляющем домене. Например, ДНК-связывающий домен встречающейся в природе нуклеазы можно изменять для того, чтобы связываться с выбранным сайтом-мишенью (например, мегануклеаза, которую сконструировали для того, чтобы связываться с сайтом, отличающимся от родственного сайта связывания). В других вариантах осуществления нуклеаза содержит гетерологичные ДНК-связывающий и расщепляющий домены (например, нуклеаза с цинковыми пальцами; ДНК связывающие белки с TAL-эффекторным доменом; ДНК-связывающие домены мегануклеазы с гетерологичными расщепляющими доменами). [0109] Любой подходящий расщепляющий домен может быть функционально связан с ДНК-связывающим доменом для того, чтобы формировать нуклеазу. Например, ZFP ДНК-связывающие домены слиты с доменами нуклеазы для того, чтобы создавать ZFN - функциональную единицу, которая способна распознавать предназначенную для нее целевую нуклеиновую кислоту через ее сконструированный (ZFP) ДНК-связывающий домен и вызывать разрезание ДНК около сайта связывания ZFP через нуклеазную активность. См., например, Kim et al. (1996) Proc Natl Acad Sci USA 93(3):1156-1160. Совсем недавно ZFN использованы для модификации генома у различных организмов. См., например, публикации патентов США 20030232410; 20050208489; 20050026157; 20050064474; 20060188987; 20060063231; и международную публикацию WO 07/014275. Аналогичным образом, TALE ДНК-связывающие домены слиты с доменами нуклеазы для того, чтобы создавать TALEN. См., например, публикацию США № 20110301073. [0110] Как указано выше, расщепляющий домен может быть гетерологичным по отношению к ДНК-связывающему домену, например, ДНК-связывающий домен с цинковым пальцем и расщепляющий домен из нуклеазы или TALEN ДНК-связывающий домен и расщепляющий домен или ДНК-связывающий домен мегануклеазы и расщепляющий домен из другой нуклеазы. Гетерологичные расщепляющие домены можно получать из конкретной эндонуклеазы или экзонуклеазы. Образцовые эндонуклеазы, из которых можно получать расщепляющий домен, включают, но не ограничиваясь этим, определенные рестрикционные эндонуклеазы и хоуминг-эндонуклеазы. См., например, каталог New England Biolabs 2002-2003, Beverly, MA; и Belfort et al. (1997) Nucleic Acids Res. 25:3379-3388. Известны дополнительные ферменты, которые расщепляют ДНК (например, S1 нуклеаза; нуклеаза золотистой фасоли; панкреатическая ДНКаза I; микрококковая нуклеаза; HO эндонуклеаза дрожжей; см. также Linn et al. (редакторы), Nucleases, Cold Spring Harbor Laboratory Press, 1993). Один или несколько этих ферментов (или их функциональные фрагменты) можно использовать в качестве источника расщепляющих доменов и расщепляющих полудоменов. [0111] Аналогичным образом, расщепляющий полудомен можно получать из какой-либо нуклеазы или ее части, как изложено выше, для которой нужна димеризация для расщепляющей активности. В целом, для расщепления необходимы два слитных белка, если слитные белки содержат расщепляющие полудомены. Альтернативно, можно использовать один белок, содержащий два расщепляющих полудомена. Два расщепляющих полудомена можно получать из одной и той же эндонуклеазы (или ее функциональных фрагментов), или каждый расщепляющий полудомен можно получать из отличающейся эндонуклеазы (или ее функциональных фрагментов). Кроме того, сайты-мишени для двух слитных белков предпочтительно располагают относительно друг друга так, что связывание двух слитных белков с соответствующими им сайтами-мишенями размещает расщепляющие полудомены в пространственной ориентации относительно друг друга, которая позволяет расщепляющим полудоменам формировать функциональный расщепляющий домен, например, посредством димеризации. Таким образом, в определенных вариантах осуществления соседние края сайтов-мишеней разделяют 5-8 нуклеотидами или 15-18 нуклеотидами. Однако между двумя сайтами-мишенями может находиться какое-либо целое число нуклеотидов или пар нуклеотидов (например, от 2 до 50 пар нуклеотидов или больше). В целом, сайт расщепления лежит между сайтами-мишенями. [0112] Рестрикционные эндонуклеазы (рестрикционные ферменты) присутствуют у многих биологических видов и способны связываться со специфичной последовательностью ДНК (в сайте распознавания) и расщеплять ДНК в сайте связывания или около него. Определенные рестрикционные ферменты (например, IIS типа) расщепляют ДНК в сайтах, удаленных от сайта распознавания, и имеют разделяемые связывающий и расщепляющий домены. Например, фермент FokI IIS типа катализирует расщепление двухцепочечной ДНК в 9 нуклеотидах от его сайта распознавания на одной нити и в 13 нуклеотидах от его сайта распознавания в другой. См., например, патенты США 5,356,802; 5,436,150 и 5,487,994; а также Li et al. (1992) Proc. Natl. Acad. Sci. USA 89:4275-4279; Li et al. (1993) Proc. Natl. Acad. Sci. USA 90:2764-2768; Kim et al. (1994a) Proc. Natl. Acad. Sci. USA 91:883-887; Kim et al. (1994b) J. Biol. Chem. 269:31,978-31,982. Таким образом, в одном из вариантов осуществления слитные белки содержат расщепляющий домен (или расщепляющий полудомен) из по меньшей мере одного рестрикционного фермента IIS типа и один или несколько связывающих доменов цинковых пальцев, которые могут быть сконструированы или не сконструированы. [0113] Образцовым рестрикционным ферментом IIS типа, расщепляющий домен которого можно отделить от связывающего домена, является FokI. Этот конкретный фермент активен в виде димера. Bitinaite et al. (1998) Proc. Natl. Acad. Sci. USA 95: 10,570-10,575. Соответственно, для целей настоящего раскрытия часть фермента FokI, используемую в раскрытых слитных белках, считают расщепляющим полудоменом. Таким образом, для направленного двухцепочечного расщепления и/или направленной замены ДНК последовательностей с использованием слитных белков из цинкового пальца и FokI, два слитных белка, каждый содержит расщепляющий полудомен FokI, можно использовать для восстановления каталитически активного расщепляющего домена. Альтернативно, также можно использовать одну полипептидную молекулу, содержащую связывающий домен цинкового пальца и два расщепляющих полудомена FokI. Параметры для направленного расщепления и направленного изменения последовательности с использованием слитных белков из цинкового пальца и FokI предоставлены в другом месте в этом раскрытии. [0114] Расщепляющий домен или расщепляющий полудомен может представлять собой какую-либо часть белка, которая сохраняет расщепляющую активность, или которая сохраняет способность к мультимеризации (например, димеризации) для того, чтобы формировать функциональный расщепляющий домен. [0115] Образцовые рестрикционные ферменты IIS типа описаны в международной публикации WO 07/014275, включенной в настоящий документ в полном объеме. Дополнительные рестрикционные ферменты также содержат отделяемые связывающие и расщепляющие домены, и они предусмотрены настоящим раскрытием. См., например, Roberts et al. (2003) Nucleic Acids Res. 31:418-420. [0116] В определенных вариантах осуществления расщепляющий домен содержит один или несколько сконструированных расщепляющих полудоменов (также обозначаемых как мутанты димеризующихся доменов), которые минимизируют или предотвращают гомодимеризацию, как описано, например, в публикациях патентов США №№ 20050064474; 20060188987; 20070305346 и 20080131962, все их раскрытия включены в настоящий документ посредством ссылки в полном объеме. Все аминокислотные остатки в положениях 446, 447, 479, 483, 484, 486, 487, 490, 491, 496, 498, 499, 500, 531, 534, 537 и 538 в FokI представляют собой мишени для воздействия на димеризацию расщепляющих полудоменов FokI. [0117] Образцовые сконструированные расщепляющие полудомены FokI, которые формируют необходимые гетеродимеры, включают пару, в которой первый расщепляющий полудомен содержит мутации в аминокислотных остатках в положениях 490 и 538 в FokI, а второй расщепляющий полудомен содержит мутации в аминокислотных остатках 486 и 499. [0118] Таким образом, в одном из вариантов осуществления мутация в 490 заменяет Glu (E) на Lys (K); мутация в 538 заменяет Iso (I) на Lys (K); мутация в 486 заменяет Gln (Q) на Glu (E); и мутация в положении 499 заменяет Iso (I) на Lys (K). В частности, сконструированные расщепляющие полудомены, описанные в настоящем документе, получали посредством введения мутаций в положения 490 (E→K) и 538 (I→K) в одном расщепляющем полудомене для того, чтобы получать сконструированный расщепляющий полудомен, обозначаемый «E490K:I538K», и посредством введения мутаций в положения 486 (Q→E) и 499 (I→L) в другом расщепляющем полудомене для того, чтобы получать сконструированный расщепляющий полудомен, обозначаемый «Q486E:I499L». Сконструированные расщепляющие полудомены, описанные в настоящем документе, представляют собой обязательные гетеродимерные мутанты, у которых аберрантное расщепление минимизировано или устранено. См., например, публикацию патента США № 2008/0131962, раскрытие которого включено посредством ссылки в полном объеме для всех целей. В определенных вариантах осуществления сконструированный расщепляющий полудомен содержит мутации в положениях 486, 499 и 496 (нумерация относительно FokI дикого типа), например, мутации, которые заменяют остаток Gln (Q) дикого типа в положении 486 на остаток Glu (E), остаток Iso (I) дикого типа в положении 499 на остаток Leu (L) и остаток Asn (N) дикого типа в положении 496 на остаток Asp (D) или Glu (E) (также обозначаемые как домены «ELD» и «ELE», соответственно). В других вариантах осуществления сконструированный расщепляющий полудомен содержит мутации в положениях 490, 538 и 537 (нумерация относительно FokI дикого типа), например, мутации, которые заменяют остаток Glu (E) дикого типа в положении 490 на остаток Lys (K), остаток Iso (I) дикого типа в положении 538 на остаток Lys (K) и остаток His (H) дикого типа в положении 537 на остаток Lys (K) или остаток Arg (R) (также обозначаемые как домены «KKK» и «KKR», соответственно). В других вариантах осуществления сконструированный расщепляющий полудомен содержит мутации в положениях 490 и 537 (нумерация относительно FokI дикого типа), например, мутации, которые заменяют остаток Glu (E) дикого типа в положении 490 на остаток Lys (K) и остаток His (H) дикого типа в положении 537 на остаток Lys (K) или остаток Arg (R) (также обозначаемые как домены «KIK» и «KIR», соответственно) (см. публикацию патента США № 20110201055). В других вариантах осуществления сконструированный расщепляющий полудомен содержит мутации «Sharkey» (см. Guo et al, (2010) J. Mol. Biol. 400(1):96-107). [0119] Сконструированные расщепляющие полудомены, описанные в настоящем документе, можно получать с использованием любых подходящих способов, например, посредством сайт-специфического мутагенеза расщепляющих полудоменов дикого типа (FokI) как описано в публикациях патентов США №№ 20050064474; 20080131962; и 20110201055. [0120] Альтернативно, нуклеазы можно собирать in vivo в сайте-мишени нуклеиновой кислоты с использованием так называемой технологии «разделенный фермент» (см., например, публикацию патента США № 20090068164). Компоненты таких разделенных ферментов можно экспрессировать или с отдельных экспрессионных конструкций или можно соединять в одной открытой рамке считывания, где отдельные компоненты разделяют, например, посредством саморасщепления пептида 2A или последовательности IRES. Компоненты могут представлять собой отдельные связывающие домены цинковых пальцев или домены из связывающего нуклеиновые кислоты домена мегануклеазы. [0121] Перед использованием можно осуществлять скрининг нуклеаз на активность, например, в дрожжевой хромосомной системе, как описано в WO 2009/042163 и 20090068164. Экспрессионные конструкции нуклеаз можно легко разрабатывать с использованием известных в данной области способов. См., например, публикации патентов США 20030232410; 20050208489; 20050026157; 20050064474; 20060188987; 20060063231; и международную публикацию WO 07/014275. Экспрессия нуклеазы может быть под управлением конститутивного промотора или индуцибельного промотора, например, промотора галактокиназы, который активируется (происходит устранение репрессии) в присутствии раффинозы и/или галактозы и подвергается репрессии в присутствии глюкозы. [0122] В одном из вариантов осуществления полинуклеотидная донорная кассета содержит аналитический домен. В других вариантах осуществления аналитический домен содержит конкретную полинуклеотидную последовательность. Примеры конкретных полинуклеотидных последовательностей включают, но не ограничиваясь этим, SEQ ID NO: 142 и SEQ ID NO: 143. В различных вариантах осуществления, последовательности с по меньшей мере 90% идентичности последовательностей с конкретными полинуклеотидными последовательностями SEQ ID NO: 142 и SEQ ID NO: 143 описаны в настоящем документе. В других вариантах осуществления последовательности с по меньшей мере 95% идентичности последовательностей с конкретными полинуклеотидными последовательностями SEQ ID NO: 142 и SEQ ID NO: 143 описаны в настоящем документе. В других вариантах осуществления последовательности с по меньшей мере 97% идентичности последовательностей с конкретными полинуклеотидными последовательностями SEQ ID NO: 142 и SEQ ID NO: 143 описаны в настоящем документе. В других вариантах осуществления, последовательности с по меньшей мере 99% идентичности последовательностей с конкретными полинуклеотидными последовательностями SEQ ID NO: 142 и SEQ ID NO: 143 описаны в настоящем документе. [0123] В одном из вариантов осуществления аналитический домен имеет долю гуанина и цитозина от 40 до 60%. В других вариантах осуществления аналитический домен имеет долю гуанина и цитозина от 42,25 до 57,5%. В других вариантах осуществления аналитический домен имеет долю гуанина и цитозина от 45 до 55%. В другом варианте осуществления аналитический домен имеет долю гуанина и цитозина от 47,75 до 52,25%. Долю содержания гуанина и цитозина в области, содержащей определенную полинуклеотидную последовательность, можно вычислять посредством подсчета числа остатков гуанина и цитозина в полинуклеотидной последовательности и деления этого числа на общее число пар оснований во фрагменте полинуклеотидной последовательности и последующего умножения результата на 100 для того, чтобы определять процентную долю гуанина и цитозина для полинуклеотидной последовательности. Праймеры, которые имеют долю гуанина и цитозина 40-60% ведут к более стабильному связыванию с матричной ДНК во время ПЦР амплификации. Однако ДНК молекулы с долей гуанина и цитозина больше чем 60% сложно амплифицировать через ПЦР, поскольку такие последовательности могут формировать стебель-петлю, димер и другие вторичные структуры. [0124] Температуру плавления (Tm) определяют как температуру, при которой половина нитей ДНК находится в состоянии двойной спирали и половина находится в состояниях случайных спиралей. Температура плавления может зависеть от переменных, в том числе длины молекулы, конкретной композиции нуклеотидной последовательности этой молекулы и молярности соли и нуклеиновой кислоты в растворе. Стабильность дуплексов и температура плавления важны при амплификации нуклеиновых кислот, в которой может быть использовано термоциклирование. Во время таких стадий термоциклирования температуру поднимают выше температуры плавления в достаточной мере, чтобы происходила диссоциация дуплексов целевой нуклеиновой кислоты и ее комплемента. На последующих стадиях температуру повторной ренатурации опускают ниже температуры плавления так, что целевая нуклеиновая кислота и праймер(праймеры) и/или зонд(зонды) способны формировать дуплексы, но при этом сохраняя ее достаточно высокой для того, чтобы избегать неспецифичной гибридизации. В данной области тщательно описаны температура плавления и то, как ее измерять. См. например, Nucleinic Acids Research (1990) 18, 6409-6412 и Bioinformatics, V. 12(12), стр. 1226-1227. Теоретические или эмпирические модели, которые связывают стабильность дуплекса с нуклеотидной последовательностью, можно использовать для того, чтобы предсказывать температуру плавления нуклеиновых кислот. Например, в Proc. Natl. Acad. Sci: U.S.A. 1986, 83:3746-3750, Biochemistry 1996, 35:3555-3562; и Proc. Natl. Acad Sci. U.S.A. 1998, 95:1460-1465 описана модель для предсказания температуры плавления, которую широко используют в данной области и которая известна как «модель ближайших соседей». Эта модель учитывает как длину олигонуклеотида, так и последовательность оснований в нем. [0125] Предсказанная температура плавления относится к теоретически вычисленной температуре плавления олигонуклеотида, который не конъюгирован с какими-либо фрагментами. Обычно она представляет собой оценку фактической температуры плавления олигонуклеотида и основана на последовательности олигонуклеотида, типично без учета эффекта каких-либо меток и каких-либо ассоциированных линкеров и т.п. Учитывая точную последовательность олигонуклеотида, температуру плавления олигонуклеотида можно предсказывать, как рассмотрено выше. Предсказанную температуру плавления в соответствии с настоящим изобретением вычисляют в одном из вариантов осуществления с использованием модели ближайших соседей. В дополнительном варианте осуществления предсказанную температуру плавления в соответствии с настоящим изобретением вычисляют с использованием термодинамической теории ближайших соседей с использованием значений SantaLucia (SantaLucia, J., Jr. (1998) Proc. Natl. Acad. Sci. U.S.A. (1998) 95, 1460-1465). Значения SantaLucia содержатся в различных компьютерных программах, которые можно использовать для того, чтобы предсказывать температуру плавления. В одном из вариантов осуществления используют пакет программного обеспечения «Beacon Designer». В одном из вариантов осуществления значения SantaLucia используют при следующих условиях реакции; концентрация нуклеиновой кислоты 0,25 нМ; концентрация одновалентных ионов 50 мМ; концентрация свободных ионов магния 5 мМ; эквивалент общего Na+ 332,84 мМ; и температура для вычисления свободной энергии 25°C. Независимо от выбора конкретных программ программного обеспечения или используемых способов, те же программы программного обеспечения или способы по желанию используют подходящим образом с их настройками по умолчанию для определения предсказанной температуры плавления праймера(праймеров) и зонда(зондов), используемых в настоящем изобретении. [0126] Термины «минимальная свободная энергия» (MFE), «свободная энергия» и «свободная энергия Гиббса» используют в настоящем документе взаимозаменяемо. Свободная энергия Гиббса представляет собой термодинамическое количество, которое является разницей между энтальпией и произведением абсолютной температуры и энтропии системы. Свободная энергия Гиббса представляет собой способность системы выполнять немеханическую работу, а ΔG измеряет немеханическую работу, выполненную в ней. (Perrot, Pierre. A to Z of Thermodynamics. Oxford University Press (1998)). Свободную энергию Гиббса определяют как G=H−TS, где H представляет собой энтальпию, T представляет собой температуру и S представляет собой энтропию (H=U+pV, где p представляет собой давление и V представляет собой объем). [0127] В целом считают, что все системы стремятся достигнуть минимальной свободной энергии. Таким образом, когда изменение свободной энергии Гиббса, ΔG, является отрицательным, тогда реакция предпочтительна, и происходит высвобождение энергии. Количество высвобождаемой энергии равно максимальному количеству работы, которую можно осуществлять в результате этой конкретной химической реакции. Когда условия ведут к изменению свободной энергии Гиббса, ΔG, которая является положительной, тогда в систему следует добавлять энергию, чтобы вызвать протекание реакции. В изотермических изобарических системах свободная энергия Гиббса является репрезентативной мерой конкурирующих эффектов энтальпии и энтропии, которые вовлечены в термодинамический процесс. Таким образом, свободную энергию Гиббса можно рассматривать как динамическое количество. [0128] Следует отметить, что на измерение свободной энергии может влиять длина нуклеотидной последовательности. Более длинные нуклеотидные последовательности имеют больший диапазон свободных энергий, чем короткие нуклеотидные последовательности. Таким образом, нуклеотидные последовательности переменной длины можно сравнивать посредством нормализации вычисления свободной энергии (ккал/моль) путем деления свободной энергии на длину последовательности (т.е. средняя свободная энергия=ΔG/длина нуклеотидной последовательности (ккал/моль/пара оснований)). [0129] Соответственно, как используют в настоящем документе, минимальная свободная энергия (т.е. свободная энергия, свободная энергия Гиббса) определяет значение для структуры, найденной путем термодинамической оптимизации (т.е. реализация алгоритма Зукера (M. Zuker and P. Stiegler, Nucleic Acids Research 9:133-148 (1981)), которая имеет наименьшее значение свободной энергии (т.е. свободная энергия Гиббса; ΔG (ккал/моль); ΔG/длина нуклеотидной последовательности (ккал/моль/пара оснований)). Свободную энергию Гиббса для последовательности можно вычислять, например, с использованием RNAfold™ или PRIMER EXPRESS™ (версии 1.0, Applied Biosystems, Foster City, CA) или программа программного обеспечения mFOLD™ (сейчас UNIFold™) (IDT, San Jose, CA), как известно специалистам в данной области. (См., например, Id., Hofacker et al. Monatshefte f. Chemie 125: 167-188 (1994); McCaskill J S. Biopolymers 29 (6-7):1105-19. (1990); и Hofacker et al. Bioinformatics 22 (10):1172-6 (2006)). [0130] В одном из вариантов осуществления аналитический домен содержит полинуклеотид, который не содержит множества повторяющихся последовательностей, в котором повторяющаяся последовательность по меньшей мере 9 п.о. в длину. В некоторых вариантах осуществления множество повторяющихся последовательностей содержит 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше полинуклеотидных фрагментов по меньшей мере 9 п.о. в длину. В одном из вариантов осуществления первая полинуклеотидная последовательность образует повторяющуюся последовательность, когда вторая полинуклеотидная последовательность, содержащая ту же последовательность, расположена непосредственно ниже по направлению считывания от первой полинуклеотидной последовательности (например, первая полинуклеотидная последовательность содержит 5’-gaaaaataacaa-3’, эта полинуклеотидная последовательность составляет повторяющуюся последовательность, когда вторая полинуклеотидная последовательность (подчеркнутая), содержащая ту же последовательность, расположена непосредственно ниже по направлению считывания от первой полинуклеотидной последовательности 5’-gaaaaataacaagaaaaataacaa-3’). В одном из вариантов осуществления аналитический домен содержит полинуклеотид, который не содержит множества таких повторяющихся последовательностей. [0131] В одном из вариантов осуществления аналитический домен содержит полинуклеотид, который не содержит серию последовательностей из идентичных пар оснований больше чем 9 п.о. в длину. Идентичные пары оснований представляют собой любое число пар оснований, больше чем 9 п.о., из пар одинаковых пуриновых (аденин или гуанин) или пиримидиновых (цитозин или тимин) оснований, которые идут одно за другим в пространственной или временной очередности. Соответственно, такой фрагмент из нуклеотидов, как; 5’-AAAAAAAAA-3’, 5’-GGGGGGGGG-3’, 5’-CCCCCCCCC-3’ или 5’-TTTTTTTTT-3’, содержит серию из девяти идентичных пар оснований. В одном из вариантов осуществления серия последовательностей из идентичных пар оснований может быть больше чем 9 п.о., 10 п.о., 11 п.о., 12 п.о., 13 п.о., 14 п.о., 15 п.о. или больше п.о. в длину. [0132] В других вариантах осуществления аналитический домен полинуклеотидной донорной кассеты содержит одну или несколько последовательностей рестрикционных ферментов. Рестрикционный фермент представляет собой фермент, способный расщеплять ДНК на фрагменты. Расщепление геномной ДНК с большой молекулярной массой рестрикционным ферментом на фрагменты из фрагментов с более низкой молекулярной массой делает возможными более эффективные выделение и манипуляции фрагментами ДНК для последующего анализа. [0133] Расщепление рестрикционными ферментами, также обозначаемое как расщепление рестрикционными эндонуклеазами, осуществляют, когда фермент нуклеазу используют для того, чтобы расщеплять полинуклеотидные последовательности. Существует множество рестрикционных ферментов, доступных специалистам в данной области. Как описано в www.neb.com/nebecomm/tech_reference/restriction_enzymes/overview.asp, используют четыре классификации для определения характеристик рестрикционных ферментов. Эти классификации выполняют на основании композиции субъединиц, положения расщепления, специфичности последовательности и требований к кофакторам. [0134] Ферменты I типа случайно разрезают ДНК в местоположениях, которые удалены (на >1000 п.о.) от распознающей/связывающей последовательности. Сайты распознавания, которые связывает фермент I типа, являются асимметричными. Как результат, эти ферменты не используют для клонирования генов, поскольку эти ферменты не дают дискретных рестрикционных фрагментов или четких паттернов полос на геле. Ферменты I типа являются мультифункциональными, и различные субъединицы, которые содержит рестрикционный фермент I типа, отвечают за различные активности (т.е. субъединица HsdR кодирует рестрикцию, субъединица HsdM кодирует метилирование ДНК, а субъединица HsdS кодирует специфичность последовательности распознавания). [0135] Ферменты II типа расщепляют ДНК в положениях, расположенных в непосредственной близости от последовательностей распознавания. Эти ферменты функционируют как димеры, в которых субъединица связывается со смысловой цепью, а вторая копия субъединицы связывается с антисмысловой цепью в палиндромной последовательности, которая типично составляет 4-8 нуклеотидов в длину. Димер II типа, который связывается с ДНК, может представлять собой или гомодимер, который связывается с симметричными последовательностями ДНК, или гетеродимер, который связывается с асимметричными последовательностями ДНК. Ферменты могут распознавать или непрерывные последовательности или прерывающиеся последовательности. Ферменты II типа коммерчески доступны и широко используются для анализа ДНК и клонирования генов. Широкое использование этих ферментов является результатом четких рестрикционных фрагментов, которые могут быть получены и и разрешены на агарозном геле. [0136] Ферменты II типа представляют собой совокупность неродственных белков, сходство аминокислотных последовательностей которых обладает высокой дивергенцией. Ферменты II типа разделены на подкатегории, которые помечены буквенным суффиксами. Рестрикционные ферменты IIB типа представляют собой мультимеры, которые содержат больше чем одну субъединицу. Эти ферменты разрезают последовательности распознавания с обеих сторон, тем самым приводя к удалению последовательности распознавания. Рестрикционные ферменты IIE типа и IIF типа расщепляют ДНК после взаимодействия с двумя копиями своей последовательности распознавания. Рестрикционные ферменты IIG типа состоят из одной субъединицы. N-концевая часть фермента содержит ДНК расщепляющий домен и ДНК модифицирующий домен. C-концевая часть фермента содержит связывающий последовательность ДНК домен. Эти ферменты осуществляют расщепление за пределами своей последовательности распознавания. Рестрикционные ферменты IIM типа распознают и разрезают метилированную ДНК. Рестрикционные ферменты IIS типа функционируют в качестве димера и расщепляют ДНК в местоположении, которое находится за пределами непалиндромных асимметричных сайтов распознавания. Эти ферменты состоят из двух отдельных доменов, один для связывания ДНК, а другой для расщепления ДНК. [0137] Ферменты III типа представляют собой комбинированные ферменты рестрикции и модификации. Эти ферменты распознают две отдельные непалиндромные последовательности и осуществляют расщепление за пределами своих последовательностей распознавания. Ферментам III типа для выполнения расщепления необходимы две последовательности распознавания в противоположных ориентациях в одной и той же молекуле ДНК. [0138] Ферменты IV типа распознают метилированную ДНК. Примеры включают системы McrBC и Mrr из E. coli. [0139] В одном из вариантов осуществления аналитический домен полинуклеотидной донорной кассеты содержит одну или несколько связывающих праймеры последовательностей. Термин «связывающая праймер последовательность» относится к области аналитического домена или какой-либо другой полинуклеотидной последовательности, типично к последовательности, фланкирующей целевую область и/или ампликон, которые может служить непосредственно или опосредовано через свой комплемент в качестве матрицы, с которой праймер может ренатурировать для любой подходящей реакции достройки праймера или реакции амплификации, известной в данной области, например, но не ограничиваясь этим, ПЦР. Специалисты в данной области примут во внимание, что когда два сайта связывания праймеров присутствуют на одном полинуклеотиде, ориентация двух сайтов связывания праймеров в целом является различной. Например, один праймер из пары праймеров комплементарен первому сайту связывания праймера и может гибридизоваться с ним, тогда как соответствующий праймер из пары праймеров разрабатывают для гибридизации с комплементом второго сайта связывания праймера. Иначе говоря, в некоторых вариантах осуществления первый сайт связывания праймера может находиться в смысловой ориентации, а второй сайт связывания праймера может находиться в антисмысловой ориентации. Сайт связывания праймера ампликона может содержать, но не обязательно содержит ту же последовательность, что и последовательность целевой фланкирующей последовательности или ее комплемента, или по меньшей мере ее часть. [0140] Праймер можно разрабатывать для связывания с аналитическим доменом, который содержит вторичную структуру, для которой вычисленная свободная энергия (ΔG) составляет от -1 до -18 ккал/моль. В одном из вариантов осуществления можно разрабатывать праймер с температурой плавления (Tm) по меньшей мере на 10°C больше чем область аналитического домена, содержащая вторичную структуру со свободной энергией (ΔG) от -1 до -18 ккал/моль, как вычисляют с использованием программного обеспечения для укладки и гибридизации нуклеиновых кислот UNAFold, Markham, N. R. & Zuker, M. (2008). В Bioinformatics, том II, под под редакцией Keith, J. M., Structure, Function and Applications, номер 453 в Methods in Molecular Biology, глава 1, стр. 3-31. Humana Press, Totowa, NJ. ISBN 978-1-60327-428-9. [0141] В одном из вариантов осуществления аналитический домен полинуклеотидной донорной кассеты содержит одну или несколько последовательностей гомологичных звеньев. Последующие варианты осуществления одной или нескольких последовательностей гомологичных звеньев состоят из отрезков от 50 до 100 пар оснований. Гомологичные звеня, состоящие из случайных фрагментов нуклеотидов, можно легко разрабатывать и синтезировать для различных применений. Универсальные полинуклеотидные донорные последовательности могут содержать одно или несколько гомологичных звеньев, которые используют для гомологичного встраивания полинуклеотида в геном организма-хозяина. В некоторых вариантах осуществления на гомологичное звено направленно воздействуют посредством введения двухцепочечного разрыва внутри гомологичного звена или рядом с ним и встраивания второго полинуклеотида, который может содержать кассету экспрессии гена, которая содержит трансген, в область гомологичного звена. Типично, встраивание второго полинуклеотида происходит через репарацию с гомологичной рекомбинацией. [0142] В одном из вариантов осуществления область гомологичного звена имеет по меньшей мере 80, 90, 93, 95, 99 или 100% идентичности последовательностей с оптимальными геномными локусами. В одном из вариантов осуществления, вариант осуществления области гомологичного звена имеет по меньшей мере 80, 90, 93, 95, 99 или 100% идентичности последовательностей с оптимальными геномными локусами клетки растения. В одном из вариантов осуществления оптимальные геномные локусы представляют собой негенную последовательность односеменодольных или двусеменодольный, которая является гипометилированной, экспрессируемой, воплощает свидетельство рекомбинации и расположена в проксимальном местоположении относительно генной области в геноме растения. [0143] В одном из вариантов осуществления оптимальные геномные локусы представляют собой гипометилированную негенную последовательность, которая имеет следующие свойства или характеристики: a) уровень метилирования указанной негенной последовательности составляет 1% или меньше; b) негенная последовательность имеет меньше чем 40% идентичности последовательностей с какой-либо другой последовательностью, содержащейся в геноме; c) негенная последовательность имеет меньше чем 40% идентичности последовательностей с какой-либо другой последовательностью, содержащейся в геноме; d) негенная последовательность расположена в пределах области в 40 т.о. от известной или предсказанной экспрессионной кодирующей последовательности; и, e) негенная последовательность демонстрирует частоту рекомбинаций в геноме больше 0,00041 сМ/млн. о. [0144] В одном из вариантов осуществления оптимальные геномные локусы представляют собой гипометилированную негенную последовательность, которая имеет 1, 2, 3, 4 или 5 из следующих свойств или характеристик: a) имеет известную или предсказанную генную кодирующую последовательность в пределах 40 т.о. от указанной негенной последовательности; b) имеет последовательность, которая содержит на 2 т.о. выше по направлению считывания и/или 1 т.о. ниже по направлению считывания от известного гена в пределах 40 т.о. один конец указанной негенной последовательности; c) не содержит больше чем 1% метилирования ДНК в негенной последовательности; d) не содержит последовательность 1 т.о., которая имеет больше чем 40% идентичности последовательностей с какой-либо другой последовательностью в геноме; и e) воплощает свидетельство рекомбинации с частотой рекомбинации больше чем 0,00041 сМ/млн. о. [0145] В соответствии с один из вариантов осуществления выбранная негенная последовательность содержит 2, 3, 4, 5, 6, 7 или 8 следующих характеристик: a) негенная последовательность не содержит метилированный полинуклеотид; b) негенная последовательность демонстрирует частоту рекомбинации от 0,00041 до 62,42 сМ/млн. о. в геноме; c) негенная последовательность демонстрирует уровень заполнения генома нуклеосомами от 0 до 0,962; d) негенная последовательность имеет меньше чем 40% идентичности последовательностей с какой-либо другой последовательностью 1 т.о., содержащейся в геноме; e) негенная последовательность имеет значение относительного местоположения от 0,00373 до 0,99908, которое представляет долю геномного расстояния от центромеры хромосомы; f) негенная последовательность имеет процентное содержание гуанина/цитозина в диапазоне от 25,17 до 68,3%; g) негенная последовательность расположена проксимально к генной последовательности; и, h) область геномной последовательности в 1 млн. о., содержащая указанную негенную последовательность, содержит одну или несколько негенных последовательностей. [0146] В одном из вариантов осуществления аналитический домен полинуклеотидной донорной кассеты содержит последовательность, которая не кодирует пептид. [0147] В одном из вариантов осуществления аналитический домен полинуклеотидной донорной кассеты содержит последовательность, которая кодирует пептид. Чтобы экспрессировать пептид, нуклеотидные последовательности, кодирующие пептидную последовательность, типично субклонируют в экспрессирующий вектор, который содержит промотор для управления транскрипцией. Подходящие бактериальные и эукариотические промоторы хорошо известны в данной области и описаны, например, в Sambrook et al., Molecular Cloning, A Laboratory Manual (2-е издание. 1989; 3-е издание., 2001); Kriegler, Gene Transfer and Expression: A Laboratory Manual (1990); и Current Protocols in Molecular Biology (Ausubel et al., выше.). Бактериальные экспрессирующие системы для экспрессии пептида доступны, например, у E. coli, Bacillus sp. и Salmonella (Palva et al., Gene 22:229-235 (1983)). Наборы для таких экспрессирующих систем коммерчески доступны. Эукариотические экспрессирующие системы для клеток млекопитающих, дрожжей и клеток насекомых хорошо известны специалистам в данной области и также коммерчески доступны. [0148] В одном из вариантов осуществления полинуклеотидная донорная кассета содержит кассету экспрессии гена, которая содержит трансген. Кассета экспрессии гена типично содержит транскрипционную единицу или экспрессирующую кассету, которая содержит все дополнительные элементы, необходимые для экспрессии нуклеиновой кислоты в клетках-хозяевах, прокариотических или эукариотических. Типичная кассета экспрессии гена, таким образом, содержит промотор, функционально связанный, например, с последовательностью нуклеиновой кислоты, кодирующей белок, и сигналы, которые необходимы, например, для эффективного полиаденилирования транскрипта, терминации транскрипции, участков связывания рибосомы или терминации трансляции. Дополнительные элементы кассеты могут включать, например, энхансеры и гетерологичные сигналы сплайсинга. [0149] В одном из вариантов осуществления кассета экспрессии гена также содержит на 3’-конце гетерологичной нуклеотидной последовательности, представляющей интерес, область терминации транскрипции и трансляции, функциональную у растений. Область терминации может быть нативной для нуклеотидной последовательности промотора из вариантов осуществления по настоящему раскрытию, может быть нативной для последовательности ДНК, представляющей интерес, или может быть получена из другого источника. Удобные области терминации доступны в плазмиде Ti из A. tumefaciens, например, области терминации октопинсинтазы и нопалинсинтазы (nos) (Depicker et al., Mol. и Appl. Genet. 1:561-573 (1982) и Shaw et al. (1984) Nucleic Acids Research, том 12, № 20 стр. 7831-7846 (nos)); см. также Guerineau et al. Mol. Gen. Genet. 262:141-144 (1991); Proudfoot, Cell 64:671-674 (1991); Sanfacon et al. Genes Dev. 5:141-149 (1991); Mogen et al. Plant cell 2:1261-1272 (1990); Munroe et al. Gene 91:151-158 (1990); Ballas et al. Nucleic Acids Res. 17:7891-7903 (1989); Joshi et al. Nucleic Acid Res. 15:9627-9639 (1987). [0150] В других вариантах осуществления кассеты экспрессии генов могут дополнительно содержать 5’ лидерные последовательности. Такие лидерные последовательности могут действовать для того, чтобы усиливать трансляцию. Трансляционные лидерные последовательности известны в данной области и включают в качестве примера лидерные последовательности пикорнавирусов, лидерную последовательность EMCV (5’ некодирующая область вируса энцефаломиокардита), Elroy-Stein et al. Proc. Nat. Acad. Sci. USA 86:6126-6130 (1989); лидерные последовательности потивирусов, например, лидерную последовательность TEV (вирус гравировки табака) Carrington and Freed, Journal of Virology, 64:1590-1597 (1990), лидерную последовательность MDMV (вирус мозаичной карликовости кукурузы), Allison et al., Virology 154:9-20 (1986); белок, связывающий тяжелую цепь иммуноглобулина человека (BiP), Macejak et al. Nature 353:90-94 (1991); нетранслируемую лидерную последовательность из мРНК белка оболочки вируса мозаики люцерны (AMV RNA 4), Jobling et al. Nature 325:622-625 (1987); лидерную последовательность вируса табачной мозаики (TMV), Gallie et al. (1989) Molecular Biology of RNA, стр. 237-256; и лидерную последовательность вируса бледной крапчатости кукурузы (MCMV) Lommel et al. Virology 81:382-385 (1991). См. также Della-Cioppa et al. Plant Physiology 84:965-968 (1987). Конструкция также может содержать последовательности, которые усиливают трансляцию и/или стабильность мРНК, например, интроны. Примером одного такого интрона является первый интрон гена II варианта гистона H3.III из Arabidopsis thaliana. Chaubet et al. Journal of Molecular Biology, 225:569-574 (1992). [0151] В одном из вариантов осуществления кассета экспрессии гена полинуклеотидной донорной последовательности содержит промотор. Промотор, используемый для управления экспрессией нуклеиновой кислотой, кодирующей пептид, зависит от конкретного применения. Например, сильный конститутивный промотор, подходящий для клетки-хозяина, типично используют для экспрессии и очистки белков. Неограничивающие примеры предпочтительных промоторов растений включают последовательности промоторов, полученные из убиквитина-10 (ubi-10) A. thaliana (Callis, et al., 1990, J. Biol. Chem., 265:12486-12493); маннопинсинтазы A. tumefaciens (Δmas) (Petolino et al., патент США № 6,730,824); и/или вируса мозаики прожилок маниоки (CsVMV) (Verdaguer et al., 1996, Plant Molecular Biology 31:1129-1139). [0152] В способах, описанных в настоящем документе, можно использовать несколько промоторов, которые могут управлять экспрессией гена у растения. Такие промоторы можно выбирать из конститутивных, химически регулируемых, индуцибельных, тканеспецифических и предпочтительных промоторов для семени. [0153] Конститутивные промоторы включают, например, 35S промотор кора вируса мозаики цветной капусты (Odell et al. (1985) Nature 313:810-812); промотор актина риса (McElroy et al. (1990) Plant cell 2:163-171); промотор убиквитина кукурузы (патент США № 5,510,474; Christensen et al. (1989) Plant Mol. Biol. 12:619-632 и Christensen et al. (1992) Plant Mol. Biol. 18:675-689); промотор pEMU (Last et al. (1991) Theor. Appl. Genet. 81:581-588); промотор ALS (патент США № 5,659,026); промотор гистона кукурузы (Chabouté et al. Plant Molecular Biology, 8:179-191 (1987)); и т.п. [0154] Спектр доступных промоторов, совместимых с растениями, включает тканеспецифические и индуцибельные промоторы. Индуцибельным регуляторным элементом является тот, которые способен непосредственно или опосредованно активировать транскрипцию одной или нескольких последовательностей ДНК или генов в ответ на индуктор. В отсутствие индуктора не будет происходить транскрипция последовательностей ДНК или генов. Типично белковый фактор, который специфично связывается с индуцибельным регуляторным элементом для того, чтобы активировать транскрипцию, присутствует в неактивной форме, которую затем непосредственно или опосредованно превращают в активную форму с помощью индуктора. Индуктор может представлять собой химическое средство, такое как белок, метаболит, регулятор роста, гербицид или феноловое соединение, или физиологический стресс, вызванный непосредственно теплом, холодом, солью или токсичными элементами или опосредованно через действие патогена или патологического агента такого как вирус. Типично белковый фактор, который специфично связывается с индуцибельным регуляторным элементом для того, чтобы активировать транскрипцию, присутствует в неактивной форме, которую затем непосредственно или опосредованно превращают в активную форму с помощью индуктора. Индуктор может представлять собой химическое средство, такое как белок, метаболит, регулятор роста, гербицид или феноловое соединение, или физиологический стресс, вызванный непосредственно теплом, холодом, солью или токсичными элементами или опосредованно через действие патогена или патологического агента, такого как вирус. На клетку растения, которая содержит индуцибельный регуляторный элемент, можно воздействовать индуктором посредством внешнего применения индуктора к клетке или растению, например, посредством распыления, полива, нагрева или схожих способов. [0155] Любой индуцибельный промотор можно использовать в вариантах осуществления по данному раскрытию. См. Ward et al. Plant Mol. Biol. 22: 361-366 (1993). Образцовые индуцибельные промоторы включают промоторы рецептора экдизона (патент США № 6,504,082); промоторы из системы ACE1, которая реагирует на медь (Mett et al. PNAS 90: 4567-4571 (1993)); ген In2-1 и In2-2 из кукурузы, которые реагируют на бензолсульфонамидные гербицидные антидоты (патент США № 5,364,780; Hershey et al., Mol. Gen. Genetics 227: 229-237 (1991) и Gatz et al., Mol. Gen. Genetics 243: 32-38 (1994)); репрессор Tet из Tn10 (Gatz et al., Mol. Gen. Genet. 227: 229-237 (1991); или промоторы из гена стероидного гормона, транскрипционную активность которого индуцируют глюкокортикостероидным гормоном, Schena et al., Proc. Natl. Acad. Sci. U.S.A. 88: 10421 (1991) и McNellis et al., (1998) Plant J. 14(2):247-257; промотор GST кукурузы, который активируют гидрофобными электрофильными соединениями, которые используют в качестве предвсходовых гербицидов (см. патент США № 5,965,387 и международную патентную заявку, публикацию № WO 93/001294); и промотор PR-1a табака, который активируют салициловой кислотой (см. Ono S, Kusama M, Ogura R, Hiratsuka K., «Evaluation of the Use of the Tobacco PR-1a Promoter to Monitor Defense Gene Expression by the Luciferase Bioluminescence Reporter System», Biosci Biotechnol Biochem. 2011 Sep 23;75(9):1796-800). Другие химически регулируемые промоторы, представляющие интерес, включают тетрациклин-индуцибельные и тетрациклин-репрессируемые промоторы (см., например, Gatz et al., (1991) Mol. Gen. Genet. 227:229-237, и патенты США №№ 5,814,618 и 5,789,156). [0156] Другие регулируемые промоторы, представляющие интерес, включают чувствительный к холоду регуляторный элемент или регуляторный элемент теплового шока, транскрипцию которого можно вызывать в ответ на воздействие холода или тепла, соответственно (Takahashi et al., Plant Physiol. 99:383-390, 1992); промотор гена алкогольдегидрогеназы (Gerlach et al., PNAS USA 79:2981-2985 (1982); Walker et al., PNAS 84(19):6624-6628 (1987)), индуцируемый анаэробными условиями; и индуцируемый светом промотор, полученный из гена rbcS гороха или гена psaDb гороха (Yamamoto et al. (1997) Plant J. 12(2):255-265); индуцируемый светом регуляторный элемент (Feinbaum et al., Mol. Gen. Genet. 226:449, 1991; Lam and Chua, Science 248:471, 1990; Matsuoka et al. (1993) Proc. Natl. Acad. Sci. USA 90(20):9586-9590; Orozco et al. (1993) Plant Mol. Bio. 23(6):1129-1138), индуцибельный регуляторный элемент растительного гормона (Yamaguchi-Shinozaki et al., Plant Mol. Biol. 15:905, 1990; Kares et al., Plant Mol. Biol. 15:225, 1990) и т.п. Индуцибельный регуляторный элемент также может представлять собой промотор гена In2-1 или In2-2 кукурузы, который реагирует на бензолсульфонамидные гербицидные антидоты (Hershey et al., Mol. Gen. Gene. 227:229-237, 1991; Gatz et al., Mol. Gen. Genet. 243:32-38, 1994), и репрессор Tet транспозона Tn10 (Gatz et al., Mol. Gen. Genet. 227:229-237, 1991). Индуцируемые стрессом промоторы включают индуцируемые солевым/водным стрессом промоторы, такие как P5CS (Zang et al. (1997) Plant Sciences 129:81-89); индуцируемые холодом промоторы, такие как cor15a (Hajela et al. (1990) Plant Physiol. 93:1246-1252), cor15b (Wilhelm et al. (1993) Plant Mol Biol 23:1073-1077), wsc120 (Ouellet et al. (1998) FEBS Lett. 423-324-328), ci7 (Kirch et al. (1997) Plant Mol Biol. 33:897-909), ci21A (Schneider et al. (1997) Plant Physiol. 113:335-45); индуцируемые засухой промоторы, такие как Trg-31 (Chaudhary et al (1996) Plant Mol. Biol. 30:1247-57), rd29 (Kasuga et al. (1999) Nature Biotechnology 18:287-291); индуцируемые осмосом промоторы, такие как Rab17 (Vilardell et al. (1991) Plant Mol. Biol. 17:985-93) и осмотин (Raghothama et al. (1993) Plant Mol Biol 23:1117-28); и индуцируемые теплом промоторы, такие как белки теплового шока (Barros et al. (1992) Plant Mol. 19:665-75; Marrs et al. (1993) Dev. Genet. 14:27-41), smHSP (Waters et al. (1996) J. Experimental Botany 47:325-338) и индуцируемый теплом элемент из промотора убиквитина петрушки (WO 03/102198). Другие индуцируемые стрессом промоторы включают rip2 (патент США № 5,332,808 и публикация США № 2003/0217393) и rd29a (Yamaguchi-Shinozaki et al. (1993) Mol. Gen. Genetics 236:331-340). Определенные промоторы можно индуцировать ранением, в том числе промотор pMAS агробактерий (Guevara-Garcia et al. (1993) Plant J. 4(3):495-505) и промотор ORF13 агробактерий (Hansen et al., (1997) Mol. Gen. Genet. 254(3):337-343). [0157] Предпочтительные промоторы для ткани можно использовать для направленного увеличения транскрипции и/или экспрессии в конкретной ткани растения. При упоминании о предпочтительной экспрессии подразумевают экспрессию на более высоком уровне в конкретной ткани растения, чем в другой ткани растения. Примеры промоторов этих типов включают предпочтительную экспрессию в семени, такую как та, которую обеспечивает промотор фазеолина (Bustos et al.1989. Plant cell, том 1, 839-853), и ген глобулина-1 кукурузы, Belanger, et al. 1991 Genetics 129:863-972. Для двусеменодольных предпочтительные семенные промоторы включают, но не ограничиваясь этим, β-фазеолин фасоли, напин, β-конглицинин, лектин соевых бобов, круциферин и т.п. Для односеменодольных предпочтительные семенные промоторы включают, но не ограничиваясь этим, 15 кДа зеин, 22 кДа зеин, 27 кДа зеин, γ-зеин, waxy, shrunken 1, shrunken 2, глобулин 1 кукурузы и т.д. Предпочтительные семенные промоторы также включают те промоторы, которые направляют экспрессию гена преимущественно в конкретных тканях в семени, например, таких как предпочтительный промотор эндосперма из γ-зеина, криптический промотор из табака (Fobert et al. 1994. T-DNA tagging of a seed coat-specific cryptic promoter in tobacco. Plant J. 4: 567-577), промотор гена P из кукурузы (Chopra et al. 1996. Alleles of the maize P gene with distinct tissue specificities encode Myb-homologous proteins with C-terminal replacements. Plant Cell 7:1149-1158, список опечаток в Plant Cell. 1997, 1:109), промотор глобулина-1 из кукурузы (Belenger and Kriz. 1991. Molecular basis for Allelic Polymorphism of the maize Globulin-1 gene. Genetics 129: 863-972), и промоторы, которые управляют экспрессией в семенной оболочке или кожице зерен кукурузы, например, промотор глутаминсинтетазы со специфичностью к перикарпию (Muhitch et al., 2002. Isolation of a Promoter Sequence From the Glutamine Synthetase1-2 Gene Capable of Conferring Tissue-Specific Gene Expression in Transgenic Maize. Plant Science 163:865-872). [0158] Кассета экспрессии гена может содержать 5’ лидерную последовательность. Такие лидерные последовательности могут действовать для усиления трансляции. Трансляционные лидерные последовательности известны в данной области и включают в качестве примера лидерные последовательности пикорнавирусов, лидерную последовательность EMCV (5’ некодирующая область вируса энцефаломиокардита), Elroy-Stein et al. Proc. Nat. Acad. Sci. USA 86:6126-6130 (1989); лидерные последовательности потивируса, например, лидерную последовательность TEV (вирус гравировки табака) Carrington and Freed, Journal of Virology, 64:1590-1597 (1990), лидерную последовательность MDMV (вирус мозаичной карликовости кукурузы), Allison et al., Virology 154:9-20 (1986); белок, связывающий тяжелую цепь иммуноглобулина человека (BiP), Macejak et al. Nature 353:90-94 (1991); нетранслируемую лидерную последовательность из белка оболочки мРНК вируса мозаики люцерны (AMV RNA 4), Jobling et al. Nature 325:622-625 (1987); лидерную последовательность вируса табачной мозаики (TMV), Gallie et al. (1989) Molecular Biology of RNA, стр. 237-256; и лидерную последовательность вируса бледной крапчатости кукурузы (MCMV) Lommel et al. Virology 81:382-385 (1991). См. также Della-Cioppa et al. Plant Physiology 84:965-968 (1987). [0001] Конструкция также может содержать последовательности, которые усиливают трансляцию и/или стабильность мРНК, например, интроны. Примером одного такого интрона является первый интрон гена II варианта гистона H3.III из Arabidopsis thaliana. Chaubet et al. Journal of Molecular Biology, 225:569-574 (1992). [0002] В тех случаях, когда желательно иметь экспрессированный продукт гетерологичной нуклеотидной последовательности, направленный в конкретную органеллу, в частности, пластид, амилопласт или эндоплазматический ретикулум, или секретированный на поверхности клетки или внеклеточно, экспрессирующая кассета дополнительно может содержать кодирующую последовательность для транзитного пептида. Такие транзитные пептиды хорошо известны в данной области и включают, но не ограничиваясь этим, транзитный пептид ацилового белка-переносчика, малую субъединицу из RUBISCO, EPSP синтазу растений и Helianthus annuus (см. Lebrun et al., патент США 5,510,417), транзитный пептид хлоропласта Brittle-1 из Zea mays (Nelson et al. Plant Physiol 117(4):1235-1252 (1998); Sullivan et al. Plant cell 3(12):1337-48; Sullivan et al., Planta (1995) 196(3):477-84; Sullivan et al., J. Biol. Chem. (1992) 267(26):18999-9004) и т.п. Кроме того, химерные транзитные пептиды хлоропластов известны в данной области, такие как оптимизированный транзитный пептид (см., патент США № 5,510,471). Дополнительные транзитные пептиды хлоропластов описаны ранее в патентах США №№ 5,717,084; 5,728,925. Специалист в данной области без труда примет во внимание многие возможности, доступные при экспрессировании продукта в конкретной органелле. Например, последовательность α-амилазы ячменя часто используют для того, чтобы управлять экспрессией в эндоплазматическом ретикулуме. Rogers, J. Biol. Chem. 260:3731-3738 (1985). [0159] В одном из вариантов осуществления полинуклеотидная донорная кассета содержит трансген. Некоторые варианты осуществления в настоящем документе предусматривают трансген, который кодирует полипептид, содержащий кассету экспрессии гена. Такой трансген можно использовать в любом из широкого спектра применений для того, чтобы получать трансгенные растения. Конкретные примеры кассеты экспрессии гена, содержащей трансген, приведены в настоящем документе в иллюстративных целях и включают экспрессию гена, содержащего ген признака, ген RNAi или репортерный ген/ген селективного маркера. [0160] При конструировании гена для экспрессии у растений, предпочтение кодонов предполагаемого растения-хозяина можно определять, например, через использование общедоступных баз данных о последовательностях ДНК, чтобы находить информацию относительно распределения кодонов в геномах растений или кодирующих белки областях в различных генах растений. После разработки оптимизированной (например, оптимизированной к определенному растению) ДНК последовательности на бумаге или in silico, фактические молекулы ДНК можно синтезировать в лаборатории так, чтобы последовательность точно соответствовали разработанной последовательности. Такие синтетические молекулы нуклеиновой кислоты можно клонировать и иным образом манипулировать с ними точно так же, как если бы они были получены из природных или нативных источников. [0161] В одном из вариантов осуществления трансген, подлежащий экспрессии, раскрыт в данной заявке. Кассета экспрессии гена может содержать репортерный ген/ген селективного маркера, ген признака или ген RNAi. Примеры гена селективного маркера, гена признака и гена RNAi дополнительно предоставлены далее. Способы, раскрытые в настоящей заявке, благоприятны в том отношении, что они предоставляют способ отбора трансформантов зародышевой линии, который не зависит от конкретной функции белкового продукта или другой функции трансгена. [0162] Трансгены или кодирующие последовательности, которые придают устойчивость к вредителям или заболеваниям (A) Гены устойчивости к заболеваниям растений. Активация защиты растения часто происходит посредством специфичного взаимодействия между продуктом гена устойчивости к заболеванию (R) у растения и продуктом соответствующего гена невирулентности (Avr) у патогена. Различные растения можно трансформировать клонированным геном устойчивости для того, чтобы конструировать растения, которые устойчивы к конкретным патогенным штаммам. Примеры таких генов включают ген Cf-9 томата для устойчивости к Cladosporium fulvum (Jones et al., 1994 Science 266:789), ген Pto томата, который кодирует протеинкиназу, для устойчивости к Pseudomonas syringae pv. tomato (Martin et al., 1993 Science 262:1432), и ген RSSP2 Arabidopsis для устойчивости к Pseudomonas syringae (Mindrinos et al., 1994 Cell 78:1089). (B) Белок Bacillus thuringiensis, его производное или синтетический полипептид, смоделированный из него, например, нуклеотидная последовательность гена Bt δ-эндотоксина (Geiser et al., 1986, Gene 48:109), и вегетативный инсектицидный (VIP) ген (см., например, Estruch et al. (1996) Proc. Natl. Acad. Sci. 93:5389-94). Кроме того, молекулы ДНК, кодирующие гены δ-эндотоксина, можно приобретать в American Type Culture Collection (Rockville, Md.), под номерами доступа ATCC 40098, 67136, 31995 и 31998. (C) Лектин, например, нуклеотидные последовательности нескольких генов маннозу-связывающих лектинов Clivia miniata (Van Damme et al., 1994 Plant Molec. Biol. 24:825). (D) Витамин-связывающий белок, такой как авидин и гомологи авидина, которые можно использовать в качестве ларвицидов против насекомых вредителей. См. патент США № 5,659,026. (E) Ферментативный ингибитор, например, ингибитор протеазы или ингибитор амилазы. Примеры таких генов включают ингибитор цистеинпротеиназы риса (Abe et al., 1987 J. Biol. Chem. 262:16793), ингибитор I протеиназы табака (Huub et al., 1993 Plant Molec. Biol. 21:985) и ингибитор α-амилазы (Sumitani et al., 1993 Biosci. Biotech. Biochem. 57:1243). (F) Специфичный для насекомых гормон или феромон, такой как экдистероид и ювенильный гормон его вариант, миметик на его основе или его антагонист или агонист, например, бакуловирусная экспрессия клонированного ювенильного гормона эстеразы, инактиватор ювенильного гормона (Hammock et al., 1990 Nature 344:458). (G) Специфичный для насекомых пептид или нейропептид, который, при экспрессии, нарушает физиологию пораженного вредителя (J. Biol. Chem. 269:9). Примеры таких генов включают рецептор диуретического гормона насекомых (Regan, 1994), аллостатин, идентифицированный у Diploptera punctata (Pratt, 1989), и специфичные для насекомых паралитические нейротоксины (патент США № 5,266,361). (H) Специфичный для насекомых яд, образуемый в природе змеей, осой и т.д., такой как инсектотоксичный пептид скорпиона (Pang, 1992, Gene 116:165). (I) Фермент, отвечающий за гипернакопление монотерпена, сесквитерпена, стероида, гидроксамовой кислоты, производного фенилпропаноида или другой небелковой молекулы с инсектицидной активностью. (J) Фермент, участвующий в модификации, в том числе посттрансляционной модификации, биологически активной молекулы; например, гликолитического фермента, протеолитического фермента, липолитического фермента, нуклеазы, циклазы, трансаминазы, эстеразы, гидролазы, фосфатазы, киназы, фосфорилазы, полимеразы, эластазы, хитиназы и глюканазы, природной или синтетической. Примеры таких генов включают ген callas (опубликованная заявка PCT WO93/02197), кодирующие хитиназу последовательности (которые можно получать, например, из ATCC под номерами доступа 3999637 и 67152), хитиназу анкилостомы табака (Kramer et al., 1993 Insect Molec. Biol. 23:691) и ген полиубиквитина ubi4-2 петрушки (Kawalleck et al., 1993 Plant Molec. Biol. 21:673). (K) Молекула, которая стимулирует сигнальную трансдукцию. Примеры таких молекул включают нуклеотидные последовательности для клонов кДНК кальмодулина золотистой фасоли (Botella et al., 1994 Plant Molec. Biol. 24:757) и нуклеотидную последовательность клона кДНК кальмодулина кукурузы (Griess et al., 1994 Plant Physiol. 104:1467). (L) Пептид с гидрофобным моментом. См. патенты США №№ 5,659,026 и 5,607,914; последний повествует о синтетических противомикробных пептидах, которые придают устойчивость к заболеваниям. (M) Мембранная пермеаза, формирователь каналов или блокатор каналов, такой как литический пептидный аналог цекропина-β (Jaynes et al., 1993 Plant Sci. 89:43), который делает трансгенные растения табака устойчивыми к Pseudomonas solanacearum. (N) Вирусный инвазивный белок или комплексный токсин, полученный из него. Например, накопление белков вирусной оболочки в трансформированных клетках растений придает устойчивость к вирусной инфекции и/или развитию заболевания, вызываемого вирусом, из которого извлекают ген белка оболочки, а также родственными вирусами. Трансформированным растениям придавали опосредованную белками оболочки устойчивость к вирусу мозаики люцерны, вирусу мозаики огурца, вирусу полосы табака, вирусу X картофеля, вирусу Y картофеля, вирусу гравировки табака, вирусу погремковости табака и вирусу табачной мозаики. См., например, Beachy et al. (1990) Ann. Rev. Phytopathol. 28:451. (O) Специфичное для насекомых антитело или полученный из него иммунотоксин. Таким образом, антитело, направленное на критическую метаболическую функцию в кишечнике насекомого, будет инактивировать пораженный фермент, убивая насекомое. Например, Taylor et al. (1994) Abstract #497, Seventh Int’l. Symposium on Molecular Plant-Microbe Interactions shows enzymatic inactivation in transgenic tobacco via production of single-chain antibody fragments. (P) Специфичное к вирусу антитело. См., например, Tavladoraki et al. (1993) Nature 266:469, которые показали, что трансгенные растения, экспрессирующие гены рекомбинантных антител, защищены от вирусной атаки. (Q) Тормозящий развитие белок, образуемый в природе патогеном или паразитом. Таким образом, грибковые эндо-α-1,4-D полигалактуроназы содействуют грибковой колонизации и высвобождению питательных веществ растения посредством растворения гомо-α-1,4-D-галактуроназы клеточной стенки растения (Lamb et al., 1992) Bio/Technology 10:1436. Клонирование и определение характеристик гена, который кодирует ингибирующий эндополигалактуроназу белок фасоли, описано у Toubart et al. (1992 Plant J. 2:367). (R) Тормозящий развитие белок, образуемый в природе растением, такой как инактивирующий рибосому ген ячменя, который обеспечивает повышенную устойчивость к заболеванию грибком (Longemann et al., 1992). Bio/Technology 10:3305. (S) РНК-интерференция, при которой молекулу РНК используют для того, чтобы ингибировать экспрессию целевого гена. Молекула РНК в одном из примеров является частично или полностью двухцепочечной, что запускает сайленсинг-реакцию, что ведет к расщеплению дцРНК на малые интерферирующие РНК, которые затем встраиваются в направляющий комплекс, который разрушает гомологичную мРНК. См., например, Fire et al., патент США 6,506,559; Graham et al.6,573,099. [0163] Гены, которые придают устойчивость к гербицидам (A) Гены, кодирующие устойчивость или переносимость гербицидов, которые ингибируют точку роста или меристему, таких как гербициды имидазалинон, сульфонанилид или сульфонилмочевина. Образцовые гены в этой категории кодируют мутантный фермент ALS (Lee et al., 1988 EMBOJ. 7:1241), который также известен как фермент AHAS (Miki et al., 1990 Theor. Appl. Genet. 80:449). (B) Один или несколько дополнительных генов, кодирующих устойчивость или переносимость глифосата, придаваемую мутантной синтазой EPSP и генами aroA, или через метаболическую инактивацию с помощью таких генов, как GAT (глифосатацетилтрансфераза) или GOX (глифосатоксидаза), и других фосфоно-соединений, таких как глюфосинат (гены pat и bar; DSM-2), и арилоксифеноксипропановых кислот и циклогександионов (гены, кодирующие ингибиторы ацетил-КоА карбоксилазы). См., например, патент США № 4,940,835, в котором раскрыта нуклеотидная последовательность формы EPSP, которая может придавать устойчивость к глифосату. Молекулу ДНК, кодирующую мутантный ген aroA, можно получать по померу доступа ATCC 39256, а нуклеотидная последовательность мутантного гена раскрыта в патенте США № 4,769,061. В европейской патентной заявке № 0 333 033 и патенте США № 4,975,374 раскрыты нуклеотидные последовательности генов глутаминсинтетаз, которые придают устойчивость к гербицидам, таким как L-фосфинотрицин. Нуклеотидная последовательность гена фосфинотрицинацетил-трансферазы предоставлена в европейской заявке № 0 242 246. De Greef et al. (1989) Bio/Technology 7:61 описывают получение трансгенных растений, которые экспрессируют химерные гены bar, кодирующие фосфинотрицинацетилтрансферазную активность. Образцовые гены, придающие устойчивость к арилоксифеноксипропановым кислотам и циклогександионам, таким как сетоксидим и галоксифоп, представляют собой гены Accl-S1, Accl-S2 и Accl-S3, описанные Marshall et al. (1992) Theor. Appl. Genet. 83:435. (C) Гены, кодирующие устойчивость или переносимость гербицида, который ингибирует фотосинтез, такого как триазин (гены psbA и gs+) и бензонитрил (ген нитрилазы). Przibilla et al. (1991) Plant cell 3:169 описывают использование плазмид, кодирующих мутантные гены psbA, для трансформации Chlamydomonas. Нуклеотидные последовательности для генов нитрилаз раскрыты в патенте США № 4,810,648, а молекулы ДНК, содержащие эти гены, доступны по номерам доступа ATCC 53435, 67441 и 67442. Клонирование и экспрессия ДНК, кодирующей глутатион S-трансферазы, описано у Hayes et al. (1992) Biochem. J. 285:173. (D) Гены, кодирующие устойчивость или переносимость гербицида, который связывается с гидроксифенилпируватдиоксигеназамиами (HPPD), ферментами, которые катализируют реакцию, в которой п-гидроксифенилпируват (HPP) превращают в гомогентисат. Это включает такие гербициды, как изоксазолы (EP418175, EP470856, EP487352, EP527036, EP560482, EP682659, патент США № 5,424,276), в частности изоксафлутол, который представляет собой селективный гербицид для кукурузы, дикетонитрилы (EP496630, EP496631), в частности 2-циано-3-циклопропил-1-(2-SO2CH3-4-CF3 фенил)пропан-1,3-дион и 2-циано-3-циклопропил-1-(2-SO2CH3-4-2,3Cl2фенил)пропан-1,3-дион, трикетоны (EP625505, EP625508, патент США № 5,506,195), в частности сулкотрион, и пиразолинаты. Ген, который создает чрезмерное относительное содержание HPPD в растениях, может обеспечивать переносимость или устойчивость к таким гербицидам, в том числе, например, гены, описанные в патентах США №№ 6,268,549 и 6,245,968 и публикации патентной заявки США № 20030066102. (E) Гены, кодирующие устойчивость или переносимость феноксиауксиновых гербицидов, таких как 2,4-дихлорфеноксиуксусная кислота (2,4-D), и которые также могут придавать устойчивость или переносимость арилоксифеноксипропионатных (AOPP) гербицидов. Примеры таких генов включают ген фермента α-кетоглутарат-зависимая диоксигеназа (aad-1), описанный в патенте США № 7,838,733. (F) Гены, кодирующие устойчивость или переносимость феноксиауксиновых гербицидов, таких как 2,4-дихлорфеноксиуксусная кислота (2,4-D), и которые также могут придавать устойчивость или переносимость пиридилоксиауксиновых гербицидов, таких как флуроксипир или триклопир. Примеры таких генов включают ген фермента α-кетоглутарат-зависимая диоксигеназа (aad-12), описанный в WO 2007/053482 A2. (G) Гены, кодирующие устойчивость или переносимость дикамбы (см., например, публикацию патента США № 20030135879). (H) Гены, обеспечивающие устойчивость или переносимость гербицидов, которые ингибируют фотопорфириногеноксидазу (PPO) (см. патент США № 5,767,373). (I) Гены, обеспечивающие устойчивость или переносимость триазиновых гербицидов (таких как атразин) и гербицидных производных мочевины (таких как диурон), которые связываются с ядерными белками реакционных центров фотосистемы II (PS II) (см. Brussian et al., (1989) EMBO J. 1989, 8(4): 1237-1245. [0164] Гены, которые придают признак добавленной стоимости или вносят вклад в него (A) Модифицированный метаболизм жирных кислот, например, посредством трансформации кукурузы или капусты антисмысловым геном или десатуразы стеароил-ацилпереносящего белка, чтобы увеличивать содержание стеариновой кислоты в растении (Knultzon et al., 1992) Proc. Nat. Acad. Sci. USA 89:2624. (B) Сниженное содержание фитата (1) Введение гена, кодирующего фитазу, такого как ген фитазы Aspergillus niger (Van Hartingsveldt et al., 1993, Gene 127:87), усиливает расщепление фитата, добавляя больше свободного фосфата в трансформированное растение. (2) Можно вводить ген, который снижает содержание фитата. У кукурузы это можно выполнять, например, посредством клонирования и последующего повторного введения ДНК, ассоциированной с одним аллелем, который отвечает за мутанты кукурузы, отличающиеся низкими уровнями фитиновой кислоты (Raboy et al., 1990 Maydica 35:383). (C) Модифицированная композиция углеводов, которую получают, например, посредством трансформации растений геном, кодирующим фермент, который изменяет паттерн ветвления крахмала. Примеры таких ферментов включают ген фруктозилтрансферазы Streptococcus mucus (Shiroza et al., 1988) J. Bacteriol. 170:810, ген левансахаразы Bacillus subtilis (Steinmetz et al., 1985 Mol. Gen. Genel. 200:220), α-амилазу Bacillus licheniformis (Pen et al., 1992 Bio/Technology 10:292), гены инвертазы томата (Elliot et al., 1993), ген амилазы ячменя (Sogaard et al., 1993 J. Biol. Chem. 268:22480) и крахмал-ветвящий фермент II эндосперма кукурузы (Fisher et al., 1993 Plant Physiol. 102:10450). [0165] В следующем варианте осуществления трансген содержит репортерный ген. В различных вариантах осуществления репортерный ген выбирают из группы, состоящей из гена yfp, гена gus, гена rfp, гена gfp, гена устойчивости к канамицину, гена aad-1, гена aad-12, гена pat и гена устойчивости к глифосату. Репортерные или маркерные гены для отбора трансформированных клеток или тканей или частей растения или растении можно включать в трансформирующие векторы. Примеры селективных маркеров включают те, которые придают устойчивость к антиметаболитам, таким как гербициды или антибиотики, например, дигидрофолатредуктазу, которая придает устойчивость к метотрексату (Reiss, Plant Physiol. (Life Sci. Adv.) 13:143-149, 1994; см. также Herrera Estrella et al., Nature 303:209-213, 1983; Meijer et al., Plant Mol. Biol. 16:807-820, 1991); неомицинфосфотрансферазу, которая придает устойчивость к аминогликозиду неомицину, канамицину и паромицину (Herrera-Estrella, EMBO J. 2:987-995, 1983 и Fraley et al. Proc. Natl. Acad. Sci USA 80:4803 (1983)); гигромицинфосфотрансферазу, которая придает устойчивость к гигромицину (Marsh, Gene 32:481-485, 1984; см. также Waldron et al., Plant Mol. Biol. 5:103-108, 1985; Zhijian et al., Plant Science 108:219-227, 1995); trpB, который позволяет клеткам использовать индол вместо триптофана; hisD, который позволяет клеткам использовать гистинол вместо гистидина (Hartman, Proc. Natl. Acad. Sci., USA 85:8047, 1988); манноза-6-фосфатизомеразу, которая позволяет клеткам использовать маннозу (WO 94/20627); орнитиндекарбоксилазу, которая придает устойчивость к ингибитору орнитиндекарбоксилазы, 2(дифторметил)-DL-орнитину (DFMO; McConlogue, 1987, в: Current Communications in Molecular Biology, Cold Spring Harbor Laboratory ed.); и дезаминазу из Aspergillus terreus, которая придает устойчивость к бластицидину S (Tamura, Biosci. Biotechnol. Biochem. 59:2336-2338, 1995). [0166] Дополнительные селективные маркеры включают, например, мутантную ацетолактатсинтазу, которая придает устойчивость к имидазолинону или сульфонилмочевине (Lee et al., EMBO J. 7:1241-1248, 1988), мутантный psbA, который придает устойчивость к атразину (Smeda et al., Plant Physiol. 103:911-917, 1993), или a мутантную протопорфириногеноксидазу (см. патент США № 5,767,373) или другие маркеры, придающие устойчивость к гербициду, такому как глюфосинат. Примеры подходящих генов селективных маркеров включают, но не ограничиваясь этим, гены, кодирующие устойчивость к хлорамфениколу (Herrera Estrella et al., EMBO J. 2:987-992, 1983); стрептомицину (Jones et al., Mol. Gen. Genet. 210:86-91, 1987); спектиномицину (Bretagne-Sagnard et al., Transgenic Res. 5:131-137, 1996); блеомицину (Hille et al., Plant Mol. Biol. 7:171-176, 1990); сульфонамиду (Guerineau et al., Plant Mol. Biol. 15:127-136, 1990); бромоксинилу (Stalker et al., Science 242:419-423, 1988); глифосату (Shaw et al., Science 233:478-481, 1986); фосфинотрицину (DeBlock et al., EMBO J. 6:2513-2518, 1987) и т.п. [0167] Одна возможность использования селективного гена представляет собой ДНК, кодирующую устойчивость к глюфосинату, и в одном из вариантов осуществления может представлять собой фосфинотрицинацетилтрансферазу (pat), оптимизированный для кукурузы ген pat или ген bar под управлением промотора вируса мозаики прожилок маниоки. Эти гены придают устойчивость к биалафосу. См. Wohlleben et al., (1988) Gene 70: 25-37); Gordon-Kamm et al., Plant cell 2:603; 1990; Uchimiya et al., BioTechnology 11:835, 1993; White et al., Nucl. Acids Res. 18:1062, 1990; Spencer et al., Theor. Appl. Genet. 79:625-631, 1990; и Anzai et al., Mol. Gen. Gen. 219:492, 1989). Версия гена pat представляет собой оптимизированный для кукурузы ген pat, описанный в патенте США № 6,096,947. [0168] Кроме того, можно использовать маркеры, которые облегчают идентификацию клетки растения, содержащей полинуклеотид, кодирующий маркер. Можно использовать маркеры, поддающиеся оценке или скринингу, где присутствие последовательности создает поддающийся измерению продукт и может создавать продукт без разрушения клетки растения. Примеры включают β-глюкуронидазу или ген uidA (GUS), который кодирует фермент, для которого известны различные хромогенные субстраты (например, патенты США 5,268,463 и 5,599,670); хлорамфениколацетилтрансферазу (Jefferson et al. The EMBO Journal, том 6, № 13, стр. 3901-3907); и щелочную фосфатазу. В предпочтительном варианте осуществления используемый маркер представляет собой β-каротин или провитамин A (Ye et al, Science 287:303-305 (2000)). Ген использовали для того, чтобы улучшать питание риса, но в этом случае его используют взамен маркера, поддающегося скринингу, и присутствие гена, связанного с геном, представляющим интерес, обнаруживают посредством обеспечения золотой окраски. в отличие от ситуации, где ген используют за его питательный вклад в растение, меньшее количество белка является достаточным для маркерных целей. Другие поддающиеся скринингу маркеры в целом включают гены антоцианина/флавоноидов (см. обсуждение у Taylor and Briggs, Plant cell (1990)2:115-127), в том числе, например, среди прочих, ген R-локуса, который кодирует продукт, который регулирует образование антоцианиновых пигментов (красная окраска) в тканях растений (Dellaporta et al., in Chromosome Structure and Function, Kluwer Academic Publishers, Appels and Gustafson eds., стр. 263-282 (1988)); гены, которые управляют биосинтезов флавоноидных пигментов, такие как ген C1 кукурузы (Kao et al., Plant cell (1996) 8: 1171-1179; Scheffler et al. Mol. Gen. Genet. (1994) 242:40-48) и ген C2 кукурузы (Wienand et al., Mol. Gen. Genet. (1986) 203:202-207); ген B (Chandler et al., Plant cell (1989) 1:1175-1183), ген p1 (Grotewold et al, Proc. Natl. Acad. Sci USA (1991) 88:4587-4591; Grotewold et al., Cell (1994) 76:543-553; Sidorenko et al., Plant Mol. Biol. (1999)39:11-19); гены локуса bronze (Ralston et al., Genetics (1988) 119:185-197; Nash et al., Plant cell (1990) 2(11): 1039-1049). [0169] Дополнительные примеры подходящих маркеров включают ген голубого флуоресцентного белка (CYP) (Bolte et al. (2004) J. Cell Science 117: 943-54 и Kato et al. (2002) Plant Physiol 129: 913-42), ген желтого флуоресцентного белка (PHIYFPTM из Evrogen; см. Bolte et al. (2004) J. Cell Science 117: 943-54); ген lux, который кодирует люциферазу, присутствие которой можно обнаруживать, например, с использованием рентгеновской пленки, подсчета сцинтилляции, флуоресцентной спектрофотометрии, видеокамеры с высокой светочувствительностью, камер счета фотонов или многолуночной люминометрии (Teeri et al. (1989) EMBO J. 8:343); ген зеленого флуоресцентного белка (GFP) (Sheen et al., Plant J. (1995) 8(5):777-84); и DsRed2, где клетки растений, трансформированных маркерным геном, имеют красный цвет, и таким образом доступны для визуального отбора (Dietrich et al. (2002) Biomethods 2(2):286-293). Дополнительные примеры включают ген β-лактамазы (Sutcliffe, Proc. Nat’l. Acad. Sci. U.S.A. (1978) 75:3737), который кодирует фермент, для которого известны различные хромогенные субстраты (например, PADAC, хромогенный цефалоспорин); ген xylE (Zukowsky et al., Proc. Nat’l. Acad. Sci. U.S.A. (1983) 80:1101), который кодирует катехолдиоксигеназу, которая может преобразовывать хромогенные катехолы; ген α-амилазы (Ikuta et al., Biotech. (1990) 8:241); и ген тирозиназы (Katz et al., J. Gen. Microbiol. (1983) 129:2703), который кодирует фермент, способный окислять тирозин до DOPA и допахинона, который в свою очередь конденсируется с образованием легко поддающегося обнаружению соединения меланина. Ясно, что многие такие маркеры доступны и известны специалисту в данной области. [0170] В следующем варианте осуществления аналитический домен полинуклеотидного донора содержит SEQ ID NO: 142 или SEQ ID NO: 143. Модификации и производные SEQ ID NO: 142 или SEQ ID NO: 143 рассматривают в сфере применения рассматриваемого раскрытия. Такие модификации и производные SEQ ID NO: 142 или SEQ ID NO: 143 могут вести к последовательностям, которые имеют конкретные уровни идентичности последовательностей. В различных вариантах осуществления, последовательности с модификациями 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 п.о. относительно SEQ ID NO: 142 описаны в настоящем документе. В других вариантах осуществления последовательности с модификациями 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 п.о. относительно SEQ ID NO: 143 описаны в настоящем документе. [0171] В других вариантах осуществления плазмидный домен универсальной полинуклеотидной донорной кассеты содержит плазмидные последовательности. Плазмиду или вектор можно описывать или обозначать как прокариотические векторы, челночные векторы, векторы насекомых или эукариотические векторы. Типично, плазмиды представляют собой внехромосомные элементы, часто круглую ДНК, которые состоят из участка начала репликации и гена селективного маркера. Иногда может быть предпочтительно иметь плазмиду, которая функциональна в E. coli (например, анализ последовательности ДНК, конструкция вставок, получение определенных количеств нуклеиновых кислот). Конкретную плазмиду, используемую для универсального полинуклеотидного донора, можно выбирать с учетом предполагаемого использования (например, экспрессия у растений, животных, бактерий, грибов или простейших). Стандартные экспрессирующие плазмиды для бактерий и животных известны в данной области и описаны подробно, например, в публикации патента США 20050064474A1 и публикациях международных патентов WO 05/084190, WO05/014791 и WO03/080809. [0172] В других вариантах осуществления плазмидный домен полинуклеотидной донорной кассеты содержит последовательности плазмиды pUC19. pUC19 представляет собой небольшое кольцо двухцепочечной ДНК. Плазмида содержит высококопийный участок начала репликации, который допускает бактериальную репликацию и содержит множество сайтов клонирования. См. Yanisch-Perron, C., Vieira, J. and Messing, J. (1985). Gene. 33, 103-119. В данной области известны и широко используются другие плазмиды. Например, pUC18, pBR322, pBR325, pBR328, pACYC184, pAT153, pUC118 и pUC119 представляют собой плазмиды, которые общеизвестны в данной области. [0173] В других вариантах осуществления плазмидный домен полинуклеотидной донорной кассеты содержит высококопийный участок начала репликации. Следующие варианты осуществления высококопийных участков начала репликации включают участок начала репликации cole1. Термин «участок начала репликации» или «ORI», как используют в настоящем документе, предназначен для того, чтобы охватывать области нуклеотидов, которые необходимы для репликации плазмиды. Некоторые примеры участков начала репликации: нуклеотиды 1766-3148 в pBR322; нуклеотиды 1667-2892 в ColE1; и нуклеотиды 580-1407 в pACC184. В одном из вариантов осуществления плазмидный домен полинуклеотидной донорной кассеты может содержать два или более различных участка начала репликации. [0174] В определенных вариантах осуществления плазмидный домен содержит селективный маркер. В следующих вариантах осуществления плазмидного домена селективные маркеры выбирают из группы, состоящей из канамицинового селективного маркера, ампициллинового селективного маркера, спектиномицинового селективного маркера, хлорамфениколового селективного маркера и рифампицинового селективного маркера. Подходящие селективные маркеры представляют собой гены устойчивости к антибиотикам. Другие селективные маркеры могут включать маркерные гены, поддающиеся оценке, например β-глюкуронидазу (GUS) (Kononov, et al., Plant J. 11, 945-957, 1997), могут обеспечивать средство обнаружения присутствия остова ДНК, но не предоставлять средство отбора клеток, которые содержат их, и анализ является разрушительным для ткани. В остове ДНК также можно использовать гены негативных селективных маркеров, которые являются условно-летальными. Репрезентативные примеры других условно-летальных продуктов генов включают: гуанинфосфорибозилтрансферазу E. coli, которая превращает тиоксантин в токсичный тиоксантинмонофосфат (Besnard et al., Mol. Cell. Biol. 7:4139-4141, 1987); щелочную фосфатазу, которая превращает неактивные фосфорилированные соединения, такие как митомицин-фосфат и доксорубицин-фосфат, в токсичные дефосфорилированные соединения; грибковую (например, Fusarium oxysporum) или бактериальную цитозиндезаминазу (codA), которая превращает 5-фторцитозин в токсичное соединение 5-фторурацил (Mullen, PNAS 89:33, 1992); карбоксипептидазу G2, которая отщепляет глутаминовую кислоту от п-N-бис(2-хлорэтил)аминобензоилглутаминовой кислоты, тем самым создавая токсичный иприт бензойной кислоты; и амидазу пенициллина-V, которая превращает феноксиацетамидные производные доксорубицина и мелфалана в токсичные соединения (в целом см. Vrudhula et al., J. of Med. Chem. 36(7):919-923, 1993; Kern et al., Canc. Immun. Immunother. 31(4):202-206, 1990); и гидролазу сложных фосфонатмоноэфиров, pehA (патент США № 5,254,801). Однако следует добавлять экзогенные субстраты, чтобы предоставлять токсичный продукт, который летален для клетки, содержащей остов ДНК. Настоящее изобретение не требует добавления дополнительных субстратов в среды для культивирования или экзогенной обработки культуры клеток растения субстратом, который необходим для условно-летального продукта гена. [0175] В другом варианте осуществления по настоящему раскрытию раскрыт способ направленного встраивания универсальной полинуклеотидной донорной кассеты в геном клетки растения. В определенных вариантах осуществления экспрессируют сайт-специфическую ДНК-связывающую нуклеазу, содержащую по меньшей мере один ДНК-связывающий домен и по меньшей мере один домен нуклеазы, в которой по меньшей мере один ДНК-связывающий домен связывается с сайтом-мишенью в геноме клетки растения. В других вариантах осуществления клетку растения приводят в контакт с универсальной полинуклеотидной донорной кассетой. В дополнительных вариантах осуществления сайт-мишень в геноме клетки растения расщепляют сайт-специфической ДНК-связывающей нуклеазой. В еще одном другом варианте осуществления универсальную полинуклеотидную донорную кассету интегрируют в сайт-мишень в геноме клетки растения. [0176] В одном из вариантов осуществления раскрыто направленное встраивание универсальной полинуклеотидной донорной кассеты в геном клетки растения через механизм репарации по гомологии. В другом варианте осуществления раскрыто направленное встраивание универсальной полинуклеотидной донорной кассеты в геном клетки растения через механизм репарации через соединение негомологичных концов. [0177] Донорные молекулы, описанные в настоящем документе, встраивают в геном клетки через направленные, не зависящие от гомологии способы. Для такого направленного встраивания геном расщепляют в желаемом местоположении (или местоположениях) с использованием нуклеазы, например, слитого белка из ДНК-связывающего домена (например, связывающий домен цинкового пальца или домен TAL эффектора конструируют, чтобы связывать сайт-мишень в предварительно определяемом сайте расщепления или около него) и домена нуклеазы (например, расщепляющий домен или расщепляющий полудомен). В определенных вариантах осуществления в клетке экспрессируют два слитных белка, каждый содержит ДНК-связывающий домен и расщепляющий полудомен, которые связываются с сайтами-мишенями, которые расположены рядом таким образом, что вблизи от сайтов-мишеней происходит воссоздание функционального расщепляющего домена и расщепление ДНК. В одном из вариантов осуществления расщепление происходит между сайтами-мишенями двух ДНК-связывающих доменов. Один или оба ДНК-связывающих домена могут быть сконструированными. Также см. патент США № 7,888,121; публикацию патента США 20050064474 и публикации международных патентов WO05/084190, WO05/014791 и WO 03/080809. [0178] Нуклеазы, как описано в настоящем документе, можно вводить в виде полипептидов и/или полинуклеотидов. Например, два полинуклеотиды, каждый содержит последовательности, кодирующие один из указанных выше полипептидов, можно вводить в клетку, и, когда происходит экспрессия полипептидов и связывание каждого с его целевой последовательностью, в целевой последовательности или около нее происходит расщепление. Альтернативно, один полинуклеотид, содержащий последовательности, кодирующие оба слитных полипептида, вводят в клетку. Полинуклеотиды могут представлять собой ДНК, РНК или какие-либо модифицированные формы или аналоги ДНК и/или РНК. [0179] После введения двухцепочечного разрыва в область, представляющую интерес, трансген интегрируют в область, представляющую интерес, направленным образом с помощью способов, не зависящих от гомологии (например, соединение негомологичных концов (NHEJ)), после линеаризации двухцепочечной донорной молекулы, как описано в настоящем документе. Двухцепочечный донор предпочтительно линеаризуют in vivo с использованием нуклеазы, например, одной или нескольких из одинаковых или различных нуклеаз, которые используют для того, чтобы вводить двухцепочечный разрыв в геном. Синхронное расщепление хромосомы и донора в клетке может ограничивать разрушение донорной ДНК (по сравнению с линеаризацией донорной молекулы перед введением в клетку). Сайты-мишени нуклеаз, используемых для линеаризации донора, предпочтительно не нарушают последовательность(последовательности) трансгена(трансгенов). [0180] Трансген можно встраивать в геном в направлении, предполагаемом простым лигированием нуклеазных липких концов (обозначаемом как «прямая» или «AB» ориентация), или в альтернативном направлении (обозначаемом как «обратная» или «BA» ориентация). В определенных вариантах осуществления трансген интегрируют после точного лигирования липких концов донора и хромосомы. В других вариантах осуществления встраивание трансгена в ориентации BA или AB ведет к делеции нескольких нуклеотидов. IV. Анализы для обнаружения универсального донорного полинуклеотида [0181] Различные анализы можно использовать для того, чтобы обнаруживать универсальный донорный полинуклеотид, описанный в определенных вариантах осуществления по раскрытию. Следующие способы можно использовать в различных ситуациях, и в одном из вариантов осуществления можно использовать при обнаружении присутствия молекулы нуклеиновой кислоты и/или трансгена, кодирующего полипептид, в клетке растения. Например, присутствие молекулы можно определять различными способами, в том числе с использованием праймера или зонда последовательности, анализа ELISA для того, чтобы обнаруживать кодируемый белок, вестерн-блоттинг для того, чтобы обнаруживать белок, или нозерн- или саузерн-блоттинг для того, чтобы обнаруживать РНК или ДНК. Можно использовать ферментативные анализы для обнаружения универсального донорного полинуклеотида. Кроме того, антитело, которое может обнаруживать присутствие белка универсального донорного полинуклеотида, можно создавать с использованием принятых в данной области процедур. Дополнительные способы, такие как гибридизация in situ, ферментативное окрашивание и иммуноокрашивание, также можно использовать для того, чтобы обнаруживать присутствие или экспрессию рекомбинантной конструкции в конкретных органах и тканях растения. Трансген, содержащийся в универсальном донорном полинуклеотиде, можно избирательно экспрессировать в некоторых тканях растения или на некоторых этапах развития, или трансген, содержащийся в универсальном донорном полинуклеотиде, можно экспрессировать по существу во всех тканях растения, по существу весь его жизненный цикл. Однако также можно применять любой режим комбинаторной экспрессии. [0182] Саузерн-анализ представляет собой широко используемый способ обнаружения, в котором ДНК режут рестрикционными эндонуклеазами и фракционируют на агарозном геле, чтобы разделять ДНК по молекулярной массе и затем переносить на нейлоновые мембраны. Затем их гибридизуют с фрагментом зонда, который радиоактивно мечен32P (или другими метками зондов) и промывают в растворе SDS. [0183] Аналогичным образом, в нозерн-анализе используют схожий протокол, в котором РНК режут рестрикционными эндонуклеазами и фракционируют на агарозном геле, чтобы разделять РНК по молекулярной массе и затем переносить на нейлоновые мембраны. Затем ее гибридизуют с фрагментом зонда, который радиоактивно мечен32P (или другими метками зондов) и промывают в растворе SDS. Анализ РНК (например, мРНК), выделенной из тканей, представляющих интерес, может показывать относительные уровни экспрессии. Типично, если мРНК присутствует или количество мРНК увеличено, можно делать предположение о том, что имеет место экспрессия соответствующего трансгена. Нозерн-анализ или другие протоколы анализа мРНК можно использовать для того, чтобы определять уровни экспрессии введенного трансгена или нативного гена. [0184] В вестерн-анализе вместо выделения ДНК/РНК, извлекают белок, представляющий интерес, и помещают его на акриламидный гель. Затем белок переносят на мембрану и приводят в контакт с метящим веществом. См., например, Hood et al., «Commercial Production of Avidin from Transgenic Maize; Characterization of Transformants, Production, Processing, Extraction and Purification» Molecular Breeding 3:291-306 (1997); Towbin et al, (1979) «Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications» Proc Natl Acad Sci USA 76(9): 4350-4354; Renart et al. «Transfer of proteins from gels to diazobenzyloxymethyl-paper and detection with antisera: a method for studying antibody specificity and antigen structure» Proc Natl Acad Sci USA 76(7): 3116-3120. [0185] Универсальный донорный полинуклеотид или его сегменты можно использовать в качестве праймеров для ПЦР амплификации. При выполнении ПЦР амплификации между праймером и матрицей может быть допустима определенная степень несовпадения. Следовательно, мутации, делеции и инсерции (в частности, добавления нуклеотидов на 5’-конец) в образцовых праймерах входят в объем рассматриваемого раскрытия. Мутации, инсерции и делеции можно получать в данном праймере способами, которые известны среднему специалисту в данной области. [0186] Другим примером способа обнаружения является способ пиросеквенирования, как описано у Winge (Innov. Pharma. Tech. 00:18-24, 2000). В этом способе разрабатывают олигонуклеотид, который перекрывает сочленение смежной геномной ДНК и ДНК вставки. Олигонуклеотид гибридизуют с одноцепочечным продуктом ПЦР из области, представляющей интерес, (один праймер во вставленной последовательности и один во фланкирующей геномной последовательности) и инкубируют в присутствии ДНК полимеразы, АТФ, сульфурилазы, люциферазы, апиразы, аденозин-5’-фосфосульфата и люциферина. dNTP добавляют индивидуально и встраивание ведет к световому сигналу, который измеряют. Световой сигнал указывает на присутствие трансгенной вставки/фланкирующей последовательности благодаря успешной амплификации, гибридизации и удлинения на одно или несколько оснований (этот способ используют для начального секвенирования, не для обнаружения конкретного гена, когда он известен). [0187] Описаны молекулярные маяки для использования при обнаружении последовательностей. В кратком изложении, разработан олигонуклеотидный зонд FRET, который перекрывает сочленение фланкирующей геномной ДНК и ДНК вставки. Уникальная структура зонда FRET ведет к тому, что он содержит вторичную структуру, которая содержит флуоресцентные и гасящие фрагменты в непосредственной близости. Зонд FRET и ПЦР праймеры (один праймер в последовательности ДНК вставки и один во фланкирующей геномной последовательности) циклируют в присутствии термостабильной полимеразы и dNTP. После успешной ПЦР амплификации гибридизация зонда(зондов) FRET с целевой последовательностью ведет к удалению вторичной структуры зонда и пространственному разделению флуоресцентных и гасящих фрагментов. Флуоресцентный сигнал указывает на присутствие фланкирующей геномной последовательности/последовательности трансгенной вставки благодаря успешной амплификации и гибридизации. [0188] Гидролитический анализ зондов, иначе известный как TAQMAN® (Life Technologies, Foster City, Calif.), представляет собой способ обнаружения и количественного определения присутствия последовательности ДНК. В кратком изложении, разрабатывают олигонуклеотидный зонд FRET с одним олигонуклеотидом в трансгене и одним во фланкирующей геномной последовательности обнаружения конкретного события. Зонд FRET и ПЦР праймеры (один праймер в последовательности ДНК вставки и один во фланкирующей геномной последовательности) циклируют в присутствии термостабильной полимеразы и dNTP. Гибридизация зонда FRET ведет к расщеплению и освобождению флуоресцентного фрагмента от гасящего фрагмента зонда FRET. Флуоресцентный сигнал указывает на присутствие фланкирующей последовательности/последовательности трансгенной вставки благодаря успешной амплификации и гибридизации. [0189] ELISA или иммуноферментный анализ известен с 1971 года. В целом, антигенами, солюбилизированными в буфере, покрывают поверхность пластмассы. Когда добавляют сыворотку, антитела могут прикрепляться к антигену на твердой фазе. Присутствие или отсутствие этих антител можно демонстрировать при конъюгации с ферментов. Добавление подходящего субстрата обнаруживает количество связанного конъюгата, по которому можно определять количество. В обыкновенном анализе ELISA используют конъюгат биотинилированных поликлональных антител против белка и щелочной фосфатазы. Например, в ELISA, используемом для количественного определения уровней лакказы, можно использовать сэндвич-анализ антител, в котором применяют поликлональные антитела кролика, полученные на коммерческой основе. Для обнаружения антитело конъюгируют с щелочными фосфатазами. В другом примере в анализе ELISA для того, чтобы обнаруживать трипсин или трипсиноген, используют биотинилированные поликлональные антитела против трипсина или против трипсиногена и конъюгат стрептавидина и щелочной фосфатазы. [0190] Варианты осуществления по рассматриваемому раскрытию дополнительно проиллюстрированы в следующих примерах. Следует понимать, что эти примеры приведены только в качестве иллюстрации. Из приведенных выше вариантов осуществления и следующих примеров специалист в данной области может установить главные характеристики этого раскрытия и, не отступая от его сущности и объема, может создавать различные изменения и модификации вариантов осуществления по раскрытию для того, чтобы адаптировать их к различным использованиям и условиям. Таким образом, различные модификации вариантов осуществления по раскрытию, в дополнение к тем, что показаны и описаны в настоящем документе, будут видны специалистам в данной области из приведенного выше описания. Подразумевают, что такие модификации также включены в объем приложенной формулы изобретения. Следующее приведено в качестве иллюстрации и не предназначено для того, чтобы ограничивать объем изобретения. ПРИМЕРЫ Пример 1: разработка цинковых пальцев для связывания геномных локусов в Zea mays [0191] Белки с цинковыми пальцами, направленные против идентифицированных последовательностей ДНК геномных локусов Zea mays, подверженных направленному воздействию, разрабатывали как описано ранее. См., например, Urnov et al., (2005) Nature 435:646-551. Образцовые целевые последовательности и распознающие спирали представлены в таблице 1 (конструкции областей распознающей спирали) и таблице 2 (сайты-мишени). В таблице 2 нуклеотиды в сайте-мишени, с которыми контактируют распознающие спирали ZFP, показаны заглавными буквами, а те нуклеотиды, с которыми не контактируют, показаны строчными буквами. Сайты-мишени нуклеаз с цинковыми пальцами (ZFN) разрабатывали для всех 72 выбранных геномных локусов в Zea mays. Разработано и протестировано множество конструкций ZFP, чтобы идентифицировать пальцы, которые связываются с наивысшим уровнем эффективности в промежуточной дрожжевой системе с 72 различными репрезентативными сайтами-мишенями геномных локусов, которые идентифицировали и отбирали в Zea mays. Конкретные распознающие спирали ZFP (таблица 1), которые связываются с наивысшим уровнем эффективности с последовательностями распознавания цинковых пальцев, использовали для направленного воздействия и встраивания донорной последовательности в геном Zea mays.
Конструкции цинковых пальцев для отобранных геномных локусов Zea mays
(N/A обозначает «не применимо»).
[0194] Конструкции цинковых пальцев репрезентативных геномных локусов Zea mays встраивали в экспрессирующие векторы цинковых пальцев, кодирующие белок, который имеет по меньшей мере один палец со структурой CCHC. См. публикацию патента США № 2008/0182332. В частности, последний палец в каждом белке имел CCHC остов для распознающей спирали. Неканонические последовательности, кодирующие цинковые пальцы, сливали с нуклеазным доменом рестрикционного фермента FokI IIS типа (аминокислоты 384-579 из последовательности Wah et al., (1998) Proc. Natl. Acad. Sci. USA 95:10564-10569) через линкер из четырех аминокислот и сигналом ядерной локализации opaque-2, полученным из Zea mays для того, чтобы формировать нуклеазы с цинковыми пальцами (ZFN). См. патент США № 7,888,121. Цинковые пальцы для различных функциональных доменов выбирали для использования in vivo. Среди множества ZFN, которые разрабатывали, получали и тестировали на связывание с предполагаемым геномным сайтом-мишенью, ZFN, описанные выше в таблице 2, идентифицировали как обладающие активностью in vivo и охарактеризовали как способные к эффективному связыванию и расщеплению уникальных геномных полинуклеотидных сайтов-мишеней Zea mays in planta.
[0195] Сборка конструкции ZFN
[0196] Плазмидные векторы, содержащие конструкции экспрессии генов ZFN, которые идентифицировали, как описано ранее, разрабатывали и выполняли с использованием навыков и способов, обыкновенно известных в данной области (см., например, Ausubel или Maniatis). Каждую кодирующую ZFN последовательность сливали с последовательностью, кодирующей сигнал ядерной локализации opaque-2 (Maddaloni et al., (1989) Nuc. Acids Res. 17:7532), который располагали выше по направлению считывания от нуклеазы с цинковыми пальцами. Неканонические последовательности, кодирующие цинковые пальцы, сливали с доменом нуклеазного рестрикционного фермента IIS типа FokI (аминокислоты 384-579 из последовательности Wah et al. (1998) Proc. Natl. Acad. Sci. USA 95:10564-10569). Экспрессией слитных белков управлял сильный конститутивный промотор из гена убиквитина Zea mays (который содержит 5’-нетранслируемую область (UTR) (Toki et al., (1992) Plant Physiology 100;1503-07). Экспрессирующая кассета также содержала 3’ UTR (содержащий терминатор транскрипции и сайт полиаденилирования) из гена пероксидазы 5 (Per5) Zea mays (публикация патента США № 2004/0158887). Самостоятельно гидролизующую 2A, кодирующую нуклеотидную последовательность из вируса Thosea asigna (Szymczak et al., (2004) Nat Biotechnol. 22:760-760), добавляли между двумя слитными белками нуклеаз с цинковыми пальцами, которые клонировали в конструкцию.
[0197] Плазмидные векторы собирали с использованием IN-FUSION™ Advantage Technology (Clontech, Mountain View, CA). Рестрикционные эндонуклеазы получали из New England BioLabs (Ipswich, MA) и для лигирования ДНК использовали ДНК лигазу T4 (Invitrogen, Carlsbad, CA). Препараты плазмид получали с использованием NUCLEOSPIN® Plasmid Kit (Macherey-Nagel Inc., Bethlehem, PA) или Plasmid Midi Kit (Qiagen), следуя инструкциям поставщиков. Фрагменты ДНК выделяли с использованием QIAQUICK GEL EXTRACTION KIT™ (Qiagen) после электрофореза в агарозном геле с трис-ацетатом. Сначала проводили скрининг колоний из всех реакций лигирования посредством рестрикционного расщепления минипрепаратов ДНК. Плазмидную ДНК выбранных клонов секвенировали с помощью коммерческого поставщика секвенирования (Eurofins MWG Operon, Huntsville, AL). Данные о последовательностях собирали и анализировали с использованием программного обеспечения SEQUENCHER™ (Gene Codes Corp., Ann Arbor, MI).
[0198] Плазмиды конструировали и подтверждали через расщепление рестрикционными ферментами и через секвенирование ДНК.
[0199] Сборка универсальной донорной конструкции
[0200] Чтобы поддерживать быстрое тестирование большого числа целевых локусов, разрабатывали и конструировали последовательность новой гибкой универсальной донорной системы. Универсальная донорная полинуклеотидная последовательность совместима со способами и анализом для высокопроизводительных векторных конструкций. Универсальная донорная система состояла по меньшей мере из трех модульных доменов: невариабельный связывающий домен ZFN, аналитический домен и домен определяемых пользователем признаков, а также простой плазмидный остов для воспроизведения вектора. Невариабельная универсальная донорная полинуклеотидная последовательность является общей для всех доноров и делает возможной разработку конечного набора анализов, которые можно использовать для всех сайтов-мишеней Zea mays, таким образом обеспечивая однородность оценки направленного воздействия и уменьшая число циклов анализа. Модульная природа этих доменов допускает высокопроизводительную сборку донора. Дополнительно, универсальная донорная полинуклеотидная последовательность имеет другие уникальные признаки, направленные на упрощение последующего анализа и расширение интерпретации результатов. Она содержит асимметричную последовательность участка рестрикции, что делает возможным расщепление продуктов ПЦР диагностических предсказуемых размеров. Удаляли последовательности, содержащие вторичные структуры, которые предположительно могли вызывать проблемы при ПЦР амплификации. Универсальная донорная полинуклеотидная последовательность имеет небольшой размер (меньше чем 3,0 т.о.). Наконец, универсальную донорную полинуклеотидную последовательность строили в высококопийном остове pUC19, который позволяет своевременно создавать большое количество тестовой ДНК.
[0201] В качестве варианта осуществления, образцовая плазмида, которая содержит последовательность универсальной полинуклеотидной донорной кассеты, предоставлена в виде SEQ ID NO: 132 и фиг. 1. В дополнительном варианте осуществления последовательность полинуклеотидной донорной кассеты предоставлена в виде: pDAB111846, SEQ ID NO: 133, фиг. 2; pDAB117415, SEQ ID NO: 134, фиг. 3; pDAB117416, SEQ ID NO: 135, фиг. 4; pDAB117417, SEQ ID NO: 136, фиг. 5; pDAB117419, SEQ ID NO: 137, фиг. 6; pDAB117434 SEQ ID NO: 138, фиг. 7; pDAB117418, SEQ ID NO: 139, фиг. 8; pDAB117420, SEQ ID NO: 140, фиг. 9; и pDAB117421, SEQ ID NO: 141, фиг. 10. В другом варианте осуществления можно конструировать дополнительные последовательности, которые содержат универсальную донорную полинуклеотидную последовательность с функциональной экспрессируемой кодирующей последовательностью или нефункциональными (без промотора) экспрессируемыми кодирующими последовательностями. Различные домены (невариабельный связывающий домен ZFN, аналитический домен и домен определяемых пользователем признаков, а также простой плазмидный остов), которые составляют универсальную донорную систему, аннотированы для конструкций, как описано выше, в таблице 3.
[0203] В другом варианте осуществления универсальная донорная полинуклеотидная последовательность представляет собой небольшую модульную донорную систему 2-3 т.о., доставляемую в виде плазмиды. Это минимальный донор, который содержит любое число сайтов связывания ZFN, короткую матричную область 100-150 п.о., обозначаемую как «ДНК X» или «последовательность UZI» или «аналитический домен» (SEQ ID NO: 142 и SEQ ID NO: 143), который несет участки рестрикции и последовательности ДНК для разработки праймеров (праймеры разрабатывают для Tm на 10°C больше, чем любые вычисленные вторичные структуры) или кодирующие последовательности, и простой плазмидный остов (фиг. 11). В одном из вариантов осуществления разрабатывают аналитический домен, который: имеет процентную долю пары оснований гуанин и цитозин от 40 до 60%; не содержит повторяющиеся последовательности больше чем 9 п.о. (например, 5’-gtatttcatgtatttcat-3’); не содержит серию идентичных пар оснований больше чем 9 п.о.; и не имеет вторичной структуры, где вторичная структура меньше чем -18 ккал/моль свободной энергии, как вычисляют с использованием программного обеспечения для укладки и гибридизации нуклеиновых кислот UNAFold, Markham, N. R. & Zuker, M. (2008). В Bioinformatics, том II. Structure, Function and Applications, № 453, под редакцией Keith, J. M., в Methods in Molecular Biology, глава 1, стр. 3-31, Humana Press, Totowa, NJ. ISBN 978-1-60327-428-9. См. таблицу 4. Всю плазмиду вставляют через NHEJ после двухцепочечного разрыва ДНК в подходящем сайте связывания ZFN; сайты связывания ZFN можно встраивать тандемно. Этот вариант осуществления универсальной донорной полинуклеотидной последовательности является наиболее подходящим для быстрого скрининга сайтов-мишеней и ZFN, а также в доноре минимизируют последовательности, которые сложно амплифицировать.
[0205] В дополнительном варианте осуществления универсальные донорные полинуклеотидные последовательности выполняют по меньшей мере из четырех модулей, и они несут частичные сайты связывания ZFN, гомологичные звенья, ДНК X с аналитическим фрагментом приблизительно 100 п.о. или кодирующие последовательности. Этот вариант осуществления универсальной донорной полинуклеотидной последовательности подходит для попыток NHEJ-опосредованной инсерции генов в различные сайты-мишени полинуклеотида, с использованием нескольких ZFN (фиг. 12).
[0206] Универсальную донорную полинуклеотидную последовательность можно использовать со всеми направленными молекулами с определенными ДНК-связывающими доменами, с двумя режимами направленной инсерции донора (NHEJ/HDR). По существу, когда универсальную донорную полинуклеотидную последовательность доставляют совместно с подходящей конструкцией для ZFN экспрессии, и донорный вектор и геном кукурузы расщепляют в одном конкретном местоположении, определяемом связыванием конкретной ZFN. После линеаризации донор можно встраивать в геном посредством NHEJ или HDR. Тогда различные аналитические соображения при разработке вектора можно использовать для того, чтобы определять цинковый палец, который максимизирует эффективную доставку направленного встраивания (фиг. 13).
Пример 2: процедуры трансформации Zea mays
[0207] Перед доставкой в протопласты культурного сорта Hi-II Zea mays, плазмидную ДНК для каждой ZFN конструкции получали из культур E. coli с использованием PURE YIELD PLASMID MAXIPREP SYSTEM® (Promega Corporation, Madison, WI) или PLASMID MAXI KIT® (Qiagen, Valencia, CA), следуя инструкциям поставщиков.
[0208] Выделение протопластов
[0209] Суспензии клеток культурного сорта Hi-II Zea mays поддерживали согласно 3,5-суточному протоколу поддержания, объем осажденных клеток (PCV) 4 мл собирали и переносили в 50 мл стерильные конические пробирки (Fisher Scientific), содержащие 20 мл раствора фермента (0,6% PECTOLYASE™, 6% ЦЕЛЛЮЛАЗА™ («Onozuka» R10; Yakult Pharmaceuticals, Japan), 4 мМ MES (pH 5,7), 0,6 M маннит, 15 мМ MgCl2). Культуры закрывали крышками и оборачивали PARAFILM™ и помещали на платформенную качалку (платформенная качалка Thermo Scientific, Vari Mix), устанавливали скорость на 10 для инкубации в течение 16-18 часов при комнатной температуре до высвобождения протопластов. После инкубации микроскопически оценивали качество расщепления клеток. Расщепленные клетки фильтровали через 100 мкм клеточный фильтр, промывали 10 мл среды W5 [2 мМ MES (pH5,7), 205 мМ NaCl, 167 мМ CaCl2, 6,7 мМ KCl], после чего следовало фильтрование через 70 мкм и 40 мкм клеточные фильтры. 100 мкм и 40 мкм фильтры промывали 10 мл среды W5. Отфильтрованные протопласты вместе с промывной средой собирали в 50 мл пробирке для центрифуги, конечный объем составлял приблизительно 40 мл. Затем 8 мл «Heavy Gradient solution» [500 мМ сахароза, 1 мМ CaCl2, 5 мМ MES (pH6,0)] медленно добавляли в нижнюю часть раствора протопластов/ферментов, центрифугировали на центрифуге с ротором со стаканами на качающемся кронштейне в течение 15 минут на 300-350×g. После центрифугирования приблизительно 7-8 мл полосы протопластов удаляли, промывали в 25 мл W5 и центрифугировали в течение 15 минут на 180-200×g. Затем протопласты ресуспендировали в 10 мл раствора MMG [4 мМ MES (pH 5,7), 0,6 M маннит, 15 мМ MgCl2]. Протопласты считали с использованием гемоцитометра или проточного цитометра и разбавляли до 1,67 миллиона на мл с использованием MMG.
[0210] Трансформация протопластов, полученных из суспензионной культуры культурного сорта Hi-II Zea mays, с использованием PEG
[0211] Приблизительно 0,5 миллиона протопластов (300 мкл в растворе MMG) переносили в 2 мл пробирки, смешивали с 40 мкл ДНК и инкубировали при комнатной температуре в течение 5-10 минут. Затем добавляли 300 мкл свежеполученного раствора PEG (36% PEG 4000, 0,3 M маннит, 0,4M CaCl2) и смесь инкубировали при комнатной температуре 15-20 минут при периодическом перемешивании переворачиванием. После инкубации медленно добавляли 1 мл промывочной W5, клетки мягко перемешивали и осаждали протопласты посредством центрифугирования на 180-200×g в течение 15 минут. Осадок ресуспендировали в 1 мл среды WI [4 мМ MES (pH 5,7), 0,6 M маннит, 20 мМ KCl], пробирку оборачивали алюминиевой фольгой и инкубировали при комнатной температуре в течение ночи в течение приблизительно 16 часов.
[0212] Трансформация ZFN и донора
[0213] Для каждого из выбранных геномных локусов протопласты Zea mays трансфицировали с использованием контроля экспрессии гена yfp, только ZFN, только донора и смеси ZFN и донора в соотношении 1:10 (по массе). Общее количество ДНК для трансфекции 0,5 миллиона протопластов составляло 80 мкг. Все воздействия проводили повторно, три или шесть раз. Использованный контроль экспрессии гена yfp представлял собой pDAB8393 (фиг. 14), которая содержит кассеты экспрессии генов с промотором убиквитина 1 Zea mays -кодирующей последовательностью желтого флуоресцентного белка - Per5 3’UTR Zea mays и промотором актина 1 риса - кодирующей последовательностью pat - 3’UTR липазы Zea mays. В типичном эксперименте по направленному воздействию совместно трансфицировали 4 мкг только ZFN или с 36 мкг донора, 40 мкг репортерной генной конструкции yfp добавляли к каждой обработке. Включение подходящих количеств экспрессирующей плазмиды гена yfp в качестве наполнителя делает возможной оценку качества трансфекции среди множества локусов и повторных обработок. Кроме того, использование подходящих количеств экспрессирующих плазмид гена yfp делает возможным быстрое решение проблем любого технического характера в быстром анализе направленного воздействия инсерции донора.
Пример 3: расщепление геномных локусов у Zea mays с помощью нуклеазы с цинковыми пальцами
[0214] Трансфицированные ZFN протопласты культурного сорта Hi-II Zea mays собирали через 24 часа после трансфекции посредством центрифугирования на 1600 об./мин в 2 мл пробирках EPPENDORF™ и удаляли супернатант. Геномную ДНК экстрагировали из осадка протопластов с использованием QIAGEN PLANT DNA EXTRACTION KIT™ (Qiagen, Valencia, CA). Выделенную ДНК ресуспендировали в 50 мкл воды и определяли концентрацию посредством NANODROPTM (Invitrogen, Grand Island, NY). Целостность ДНК оценивали посредством электрофореза образцов в 0,8% агарозном геле. Все образцы нормализовали (20-25 нг/мкл) для ПЦР амплификации для того, чтобы создавать ампликоны для секвенирования (Illumina, Inc., San Diego, CA). ПЦР праймеры со штриховыми кодами для амплификации областей, окружающих каждую тестовую последовательность распознавания ZFN из обработанных и контрольных образцов, разрабатывали и приобретали в IDT (Coralville, IA, очищенные ВЭЖХ). Оптимальные условия амплификации идентифицировали посредством градиентной ПЦР с использованием 0,2 мкМ подходящих праймеров со штриховыми кодами, ACCUPRIME PFX SUPERMIX™ (Invitrogen, Carlsbad, CA) и 100 нг матричной геномной ДНК в реакции 23,5 мкл. Параметры циклирования: начальная денатурация при 95°C (5 мин), после чего следует 35 циклов денатурации (95°C, 15 с), ренатурации (55-72°C, 30 с), элонгации (68°C, 1 мин), и конечная элонгация (68°C, 7 мин). Продукты амплификации анализировали на 3,5% TAE агарозных гелях, а подходящую температуру ренатурации для каждой комбинации праймеров определяли и использовали для амплификации ампликонов из контрольных и обработанных ZFN образцов, как описано выше. Все ампликоны очищали на 3,5% агарозных гелях, элюировали водой и определяли концентрации с помощью NANODROP™. Для секвенирования следующего поколения приблизительно 100 нг ПЦР ампликона из обработанных ZFN и соответствующих контрольных протопластов кукурузы объединяли вместе и секвенировали с использованием секвенирования следующего поколения Illumina (NGS).
[0215] Анализировали расщепляющую активность подходящих ZFN в каждом из выбранных геномных локусов Zea mays. Короткие ампликоны, окружающие сайты расщепления ZFN, амплифицировали из геномной ДНК из обработанных ZFN и контрольных протопластов и подвергали Illumina NGS. Вызванное ZFN расщепление или двухцепочечный разрыв ДНК разрешали с помощью клеточного пути NHEJ репарации посредством инсерции или делеции нуклеотидов (инсерции и делеции) в сайте расщепления, присутствие инсерций и делеций в сайте расщепления, таким образом, представляет собой меру ZFN активности, и определяли посредством NGS. Расщепляющую активность целевых конкретных ZFN оценивали как число последовательностей с инсерциями и делециями на один миллион высококачественных последовательностей с использованием программного обеспечения для NGS анализа (публикация патента 2012-0173,153, data Analysis of DNA sequences) (фиг. 15). Для выбранных целевых геномных локусов Zea mays наблюдали активности в диапазоне от 5 до 100 раз выше контролей, которые дополнительно подтверждали посредством выравнивания последовательностей, которое демонстрировало отпечаток разнообразия от инсерций и делеций в каждом сайте расщепления ZFN. Эти данные показывают, что выбранные геномные локусы Zea mays подвержены расщеплению с помощью ZFN. Дифференциальная активность в каждой мишени отражает ее состояние хроматина и подверженность расщеплению, а также эффективность экспрессии каждой ZFN.
Пример 4: быстрый анализ направленного воздействия для встраивания полинуклеотидного донора
[0216] Последовательность в геномных локусах Zea mays с использованием нуклеазы с цинковыми пальцами
[0217] Валидацию направленного воздействия универсальной донорной полинуклеотидной последовательностью в выбранных целевых геномных локусах Zea mays через инсерцию донора, опосредованную соединением негомологичных концов (NHEJ), осуществляли с использованием полупропускного способа быстрого анализа направленного воздействия на основе протопластов. Для каждого выбранного целевого геномного локуса Zea mays тестировали от трех до шести конструкций ZFN и оценивали направленное воздействие путем измерения опосредованного ZFN расщепления с помощью способов секвенирования следующего поколения (фиг. 15) и инсерцию донора посредством инвертированной ПЦР сочленения (фиг. 16). Выбранные геномные локусы Zea mays, которые были положительными в обоих анализах, идентифицировали как локус, подверженный направленному воздействию.
[0218] Быстрый анализ направленного воздействия для инсерции ZFN донора
[0219] Для того чтобы определять, если на выбранные целевые геномные локусы Zea mays можно направленно воздействовать для инсерции донора, конструкцию ZFN и конструкцию универсального донорного полинуклеотида совместно доставляли в протопласты кукурузы, которые инкубировали в течение 24 часов прежде, чем экстрагировали геномную ДНК для анализа. Если экспрессируемые ZFN могли резать сайт-мишень связывания как в выбранных целевых геномных локусах Zea mays, так и в доноре, то линеаризованный донор можно было вставлять в расщепленный сайт-мишень в геноме кукурузы через путь соединения негомологичных концов (NHEJ). Подтверждение направленного встраивания в выбранных целевых геномных локусах Zea mays выполняли на основании стратегии инвертированной ПЦР, где внешний праймер распознает последовательность в нативных геномных локусах, а внутренний праймер связывается с последовательностью внутри донорной ДНК. Праймеры разрабатывают таким образом, что только когда донорную ДНК вставляют в выбранные целевые геномные локусы Zea mays, анализ ПЦР будет давать продукт амплификации ожидаемого размера. Анализ инвертированной ПЦР осуществляют как на 5’-, так и на 3’-концах инсерционного сочленения. Праймеры, используемые для анализа встроенных полинуклеотидных донорных последовательностей, приведены в таблице 5.
[0220] Инсерция ZFN донора в целевые локусы с использованием вложенной инвертированной ПЦР
[0221] Все ПЦР амплификации проводили с использованием набора TAKARA EX TAQ HS™ (Clonetech, Mountain View, CA). Первую инвертированную ПЦР осуществляли в конечном объеме реакции 20 мкл, который содержал 1× буфер TAKARA EX TAQ HS™, 0,2 мМ dNTP, 0,2 мкМ внешнего праймера (таблица 5), 0,05 мкМ внутреннего праймера (разработанного из универсальной донорной кассеты, которая описана выше), 0,75 единицы полимеразы TAKARA EX TAQ HS™ и 10 нг экстрагированной ДНК протопластов кукурузы. Затем осуществляли реакцию с использованием программы ПЦР, которая состояла из 94°C в течение 2 мин, 20 циклов из 98°C в течение 12 с и 68°C в течение 2 мин, после чего следовало 72°C в течение 10 мин и удержание на 4°C. Конечные ПЦР продукты прогоняли на агарозном геле вместе с 1KB PLUS DNA LADDER™ (Life Technologies, Grand Island, NY) для визуализации.
[0222] Вложенную инвертированную ПЦР проводили в конечном объеме реакции 20 мкл, который содержал 1× буфер TAKARA EX TAQ HS™, 0,2 мМ dNTP, 0,2 мкМ внешнего праймера (таблица 5), 0,1 мкМ внутреннего праймера (разработанного из универсальной донорной кассеты, которая описана выше, таблица 6), 0,75 единицы полимеразы TAKARA EX TAQ HS™ и 1 мкл первого ПЦР продукта. После этого осуществляли реакцию с использованием программы ПЦР, которая состояла из 94°C в течение 2 мин, 31 цикла из 98°C в течение 12 с, 66°C в течение 30 с и 68°C в течение 45 с, после чего следовало 72°C в течение 10 мин и удержание на 4°C. Конечные ПЦР продукты прогоняли на агарозном геле вместе с 1KB PLUS DNA LADDER™ (Life Technologies, Grand Island, NY) для визуализации.
[0226] Применение анализа инвертированной ПЦР в системе направленного воздействия на протопласты было особенно сложным, поскольку для трансфекции использовали большие количества плазмидной ДНК, и большое количество плазмидной ДНК оставляли в системе направленного воздействия на протопласты и впоследствии извлекали вместе с клеточной геномной ДНК. Остаточная плазмидная ДНК может снижать относительную концентрацию геномной ДНК и снижать общую чувствительность обнаружения, а также может представлять собой значимую причину неспецифичных аберрантных реакций ПЦР. Индуцированная ZFN инсерция донора на основе NHEJ типично происходит в прямой или обратной ориентации. Анализ инвертированной ПЦР ДНК для инсерции в прямой ориентации часто демонстрирует ложноположительные полосы, возможно из-за общих областей гомологии около сайта связывания ZFN в мишени и доноре, которые могут вести к посадке праймера и достройке невстроенной донорной ДНК во время процесса амплификации. Ложноположительные результаты не наблюдали в анализах, в которых исследовали продукты инсерции в обратной ориентации, и, следовательно, весь анализ направленного встраивания донора осуществляли для изучения обратной инсерции донора в быстром анализе направленного воздействия. Для того чтобы дополнительно повышать специфичность и ослаблять фон, также использовали стратегию гнездовой ПЦР. В стратегии гнездовой ПЦР использовали вторую реакцию ПЦР амплификации, в которой амплифицировали более короткую область в первом продукте амплификации из первой ПЦР реакции. Использование асимметричных количеств внутренних и внешних праймеров дополнительно оптимизировало ПЦР сочленения для быстрого анализа направленного воздействия в выбранных геномных локусах.
[0227] Результаты анализа инвертированной ПЦР визуализировали на агарозном геле. Для всех выбранных геномных локусов Zea mays «обработка ZFN + донор» давала полосу размера, близкого к ожидаемому, на 5’- и 3’-концах. Обработка только контрольной ZFN или донором была в ПЦР отрицательной, что подсказывает, что способ специфично оценивал встраивание донора в сайт-мишень. Все обработки проводили повторно от трех до шести раз, и присутствие предполагаемого ПЦР продукта в нескольких повторениях (≥ 2 на обоих концах) использовали для того, чтобы подтверждать направленное воздействие. Инсерция донора через NHEJ часто дает низкоинтенсивные побочные продукты, которые образуются из-за обработки линеаризованных концов на сайтах ZFN мишени и/или донора. Кроме того, наблюдали, что различные ZFN давали различные уровни эффективности направленного встраивания, причем некоторые из ZFN дают сообразно высокие уровни встраивания донора, некоторые ZFN дают менее сообразные уровни встраивания донора и другие ZFN не дают встраивания. В целом, для каждого из выбранных целевых геномных локусов Zea mays, которые тестировали, направленное встраивание демонстрировали в репрезентативных целевых геномных локусах Zea mays с помощью одной или нескольких ZFN, что подтверждает, что каждый из этих локусов был подвержен направленному воздействию. Кроме того, каждый из выбранных целевых геномных локусов Zea mays подходит для точной генной трансформации. Валидацию этих выбранных целевых геномных локусов Zea mays повторяли множество раз, каждый раз со схожими результатами, таким образом подтверждая воспроизводимость процесса валидации, который включает разработку и конструирование плазмиды, трансформацию протопласта, обработку образца и анализ образца.
[0228] Заключение
[0229] Донорную плазмиду и одну ZFN, разработанную для специфичного расщепления выбранных целевых геномных локусов Zea mays, трансфицировали в протопласты культурного сорта Hi-II Zea mays и клетки собирали через 24 часа. Анализ геномной ДНК, выделенной из контрольных протопластов, протопластов, обработанных ZFN и ZFN с донором, посредством инвертированной ПЦР сочленений демонстрировал направленную инсерцию универсального донорного полинуклеотида в результате расщепления геномной ДНК с помощью ZFN (таблица 8). Эти исследования показывают, что универсальную донорную полинуклеотидную систему можно использовать для того, чтобы оценивать направленное воздействие на эндогенные сайты и осуществлять скрининг возможных ZFN. Наконец, быстрый анализ направленного воздействия на основе протопластов и новые системы универсальных донорных полинуклеотидных последовательностей предоставляют усовершенствованную систему для скрининга геномных мишеней и ZFN для точных работ по конструированию геномов растений. Способы можно распространять на оценку сайт-специфического расщепления и инсерции донора в геномные мишени в любой системе, представляющей интерес, с использованием любой нуклеазы, которая вводит двух- или одноцепочечные разрывы ДНК.
[0231] Хотя аспекты данного изобретения описаны в определенных вариантах осуществления, их дополнительно можно модифицировать в пределах сущности и объема этого раскрытия. Следовательно, эта заявка предназначена для того, чтобы покрывать любые вариации, использования или адаптации вариантов осуществления изобретения с использованием его основных принципов. Кроме того, эта заявка предназначена для того, чтобы покрывать такие отклонения от настоящего раскрытия в качестве входящих в известную или принятую практику в той области, к которой относятся эти варианты осуществления, которые попадают в пределы приложенной формулы изобретения.
Реферат
Группа изобретений относится к биотехнологии, а именно к области точной трансформации растений, направленной геномной интеграции и экспрессии белка у растений. Предложена полинуклеотидная донорная кассета для трансформации растения, которая содержит связывающий домен сайт-специфической нуклеазы, аналитический домен, включающий полинуклеотидную последовательность с по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 142, и плазмидный домен. Полинуклеотидную донорную кассету используют для получения трансгенной клетки для трансформации растения. Изобретения обеспечивают направленное встраивание универсальной полинуклеотидной донорной кассеты в геном клетки растения, быстрый скрининг сайтов-мишеней и нуклеаз, а также минимизируют последовательности, которые сложно амплифицировать. 3 н. и 12 з.п. ф-лы, 17 ил., 8 табл., 4 пр.

Комментарии