Устойчивые к бактериям трансгенные растения - RU2640246C2
Код документа: RU2640246C2
Чертежи



































































Описание
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение в некоторых вариантах своего осуществления связано с растениями, устойчивыми к бактериям, и способами создания таких растений.
УРОВЕНЬ ТЕХНИКИ
Ralstonia solanacearum (Rs), широко распространенная грамотрицательная почвенная патогенная бактерия, относящаяся протеобактериям β-класса, вызывает заболевания и приводит к гибели более чем 200 видов растений, в том числе экономически важных сельскохозяйственных культур, таких как томат, картофель и банан. Бактерия проникает через раны на корнях растения, внедряется в сосуды ксилемы и быстро распространяется по надземным органам растения посредством сосудистого транспорта. Вскоре обнаруживаются популяции более чем из 1010 бактериальных клеток на растение. Основной фактор вирулентности Rs - это экзополисахарид (ЭПС), длинный (более 106 Да) углеводный полимер, который закупоривает сосуды ксилемы, вызывает симптомы увядания и приводит в конечном итоге к гибели растения.
Rs демонстрируют удивительную способность секретировать более чем 100 белков. Например, система секреции II типа (T2SS) выделяет факторы, которые включают пектиназы, эндоглюканазы, разрушающие клеточную стенку растений, а позднее и вирулентный ЭПС (Фиг.1А-С). Система секреции III типа (T3SS) выделяет вызывающие инфекцию эффекторные белки (ТЗЕ) в клетки хозяина, чтобы изменить внутреннюю среду хозяина и подавить защитный ответ при заражении (Фиг.1А-С).
Система секреции III типа (T3SS) - это сложная молекулярная машина грамотрицательных бактерий, используемая для того, чтобы «впрыскивать» (переносить) бактериальные белки (эффекторы) в эукариотические клетки. Для этого T3SS должна собраться в мультибелковый комплекс, который состоит из различных частей: базальной части, соединяющей две бактериальные мембраны, связанной с цитоплазматическим пространством; закрепленной игольчатой структуры, сравнимой с молекулярным шприцем (инжектисома/пили); и дистального наконечника игольчатой структуры, преобразующегося затем в «транслокон», белковый комплекс, который вводится в мембрану клетки хозяина. Пили построены из белковых субъединиц только одного типа. Многочисленные субъединицы олигомеризуются в структуру пил ей. Такая игольчатая структура обеспечивает транспорт бактериальных белков по внутреннему каналу, «трубопроводу» инжектисомы на пути в клетку хозяина (Фиг.1А-С).
Таким образом, самым большим внеклеточным компонентом T3SS является инжектисома, которая тянется от участка молекулярной машины, расположенного на внешней мембране, а внутри нее проходит канал диаметром 25 Å, образующий секреторный «трубопровод» (параметры спирали инжектисомы: 5,5 субъединиц на оборот, увеличение длины спирали составляет 4,6 Å на субъединицу). Инжектисома формируется как спиральный комплекс из множества (порядка 100-150) копий единственного небольшого (9 кДа) белка. Несмотря на то, что между первичными последовательностями строительных блоков пилей большинства грамотрицательных бактерий наблюдается низкая степень гомологии, предполагается, что они имеют высокую степень структурной гомологии. У бактерий, патогенных для растений, T3SS кодируется генами hrp (hypersensitive response and pathogenicity, реакции гиперчувствительности и патогенности), которые получили такое название в связи с тем, что они необходимы бактериям, чтобы индуцировать заболевания у чувствительных к ним растений и вызывать реакцию гиперчувствительности у резистентных растений. Hrp гены были обнаружены почти во всех основных грамотрицательных патогенных для растений бактериях (например, Pseudomonas syringae, Xanthomonas spp., Ralstonia solanacearum и Erwinia spp.), что подтверждает ключевую роль T3SS как посредника во взаимодействии различных бактерий и растений. Таким образом, обычно внеклеточная игольчатая структура T3SS собирается в ходе пошаговой полимеризации основного компонента (например, HrpY у R. solanacearum, HrpA у P. syringae и Е. amylovora, HrpE у Xanthomonas campestris, MxiH у Shigella, PrgI у Salmonella и YscF у Yersinia).
Как упоминалось ранее, несмотря на то, что основная функция эффекторов III типа заключается в стимулировании чувствительности растений, некоторые эффекторы распознаются белками устойчивости растений, которые, в свою очередь, запускают защитные ответные реакции, в том числе, реакцию гиперчувствительности. Один из способов предлагает возможность борьбы со смертельными растительными инфекциями с помощью грамотрицательных бактерий, несущих в своем составе факторы, усиливающие иммунитет растений к таким патогенам.
В патентной заявке США №20090258825 (Не et al.) раскрыты композиции и способы для усиления защиты растений против патогенов, например, бактериальных патогенов. В соответствии с их методиками, усиление устойчивости растений к вирулентному белку HopM1 Pseudomonas syringae обеспечивается повышением активности ATMIN-ассоциированного защитного белка растений, такого как ATMIN7.
В патентной заявке США №20090044296 (Веег et al.) описываются способы усиления роста растений или передачи устойчивости растений к болезням посредством использования молекул нуклеиновых кислот, направленных на повышение или понижение экспрессии молекул нуклеиновых кислот, кодирующих Невзаимодействующий белок (например, HIPM). Способом делеционного анализа было показано, что 198-аминокислотный N-концевой участок HrpN (harpin) Erwinia amylovora, первый бесклеточный индуктор реакции гиперчувствительности, играющий решающую роль для вирулентности этого патогена, необходим для взаимодействия с HIPM.
Кроме того, увядание, вызванное бактериями, трудно контролировать из-за почвенного происхождения возбудителей. В растениях, инфицированных Rs, развитие заболевания зависит от активности систем секреции типов II и III, и мутации в одной из этих систем приводит к отсутствию патогенности у бактерий [Poueymiro et al., Curr. Opin. Microbiol. (2009) 12:44-52].
Roine и соавторы [Roine et al., FEBS Letters (1997) 417(2): 168-172] показали, что очищенный HrpA, структурный белок пилей Pseudomonas syringae pv. tomato DC3000, уже сам по себе достаточен для образования нитчатых структур путем самосборки.
Taira и соавторы [Taira et al., Mol Microbiol. (1999) 34(4):737-44] произвели мутации путем вставки в гене hrpA (например, пентапептидные вставки) и создали мутантные бактерии, экспрессирующие такие гены. Согласно их исследованиям, С-концевой участок hrpA является ключевым для сборки пилей и для бактериального взаимодействия с поражаемым растением. Кроме того, Wei и соавторы [Wei et al., PNAS (2000) 97(5):2247-2252] определили три единичные аминокислотные мутации в С-концевом участке HrpA, которые влияют на секрецию или регуляторную функцию белка HrpA. Эти результаты демонстрируют важнейшую роль гена структурного белка пилей Hrp в белковой секреции и согласованной регуляции системы секреции III типа Pseudomonas syringae. Более того, Lee и соавторы [Lee et al., J. Bio. Chem. (2005) 280: 21409-17] обнаружили, что некоторые пентапептид-содержащие нефункциональные белки HrpA при экспрессии в бактериях оказывают сильный доминантно негативный эффект на функцию HrpA дикого типа, блокируя способность Pseudomonas syringae вызывать ответ растения-хозяина и болезнь in vivo. Доминантные негативные мутанты HrpA также были способны препятствовать самосборке пилей из HrpA дикого типа in vitro.
Weber и соавторы [Weber and Koebnik, J. Bacteriology (2005) 187(17): 6175-6186] провели анализ гидрофобности нескольких белков пилей Hrp, таких как HrpE и HrpA из Xanthomonas campestris pv. Vesicatoria и HrpY из R. Solanacearum, и обнаружили общий структурный домен. Учитывая эти данные, можно предположить, что патогенные для растений бактерии создавали структурно схожие белки для преодоления барьера клеточной стенки независимо друг от друга. Weber и соавторы далее сообщают, что мутанты HrpE с пентапептидными вставками в С-концевом участке ингибируют сборку пилей из Hrp у X. campestris pv. Vesicatoria. Морфологические исследования обнаружили, что мутанты со вставкой имеют укороченные Hrp-пили. Этот доминантно негативный эффект наводит на мысль, что мутантные варианты могут препятствовать сборке Hrp-пилей. Патентная заявка США №20100249234 (Yang et al.) описывает способы снижения вирулентности бактерий, такие как системы HrpX/HrpY-типа или T3SS-THna. Данный способ предполагает взаимодействие бактерии с эффективным количеством ингибитора фенилпропаноидного типа.
Патентная заявка США №20100099674 (Elofsson et al.) раскрывает способы снижения бактериальной вирулентности в растениях посредством ингибирования системы секреции III типа N-замещенным 7-хинолилметиламином и, особенно, производным этого вещества, замещенным по 5-му и 8-му положениям хинольного кольца.
Дополнительно уровень техники включает патентную заявку США №20050076406.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен экспрессионный вектор, содержащий нуклеотидную последовательность, кодирующую доминантно негативный T3SS белок и цис-регуляторный элемент, который способен запускать транскрипцию нуклеотидной последовательности в растительной клетке; где доминантно негативный T3SS белок обеспечивает сборку нефункционального комплекса иглы.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен выделенный полинуклеотид, содержащий нуклеотидную последовательность, кодирующую SEQ ID NO:2, 4, 6, 8, 10 или 12.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен экспрессионный вектор, содержащий полинуклеотид, который содержит нуклеотидную последовательность, кодирующую SEQ ID NO:2, 4, 6, 8, 10 или 12.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения предусмотрены клетки-хозяева, содержащие экспрессионный вектор.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения предусмотрено генетически модифицированное растение, содержащее экспрессионный вектор.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения предусмотрено генетически модифицированное растение, экспрессирующее экзогенный полинуклеотид, кодирующий доминантно негативный T3SS белок, приведенный в SEQ ID NO:2, 4, 6, 8, 10 или 12.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения предусмотрен способ получения растений, имеющих повышенную устойчивость к бактериальным патогенам в сравнении с немодифицированными растениями; этот способ подразумевает введение в растение или растительную клетку экспрессионного вектора, создавая, таким образом растение, имеющее повышенную устойчивость к бактериальным патогенам в сравнении с немодифицированным растением.
Предусмотрен способ оценки устойчивости растения к бактериальным патогенам, где способ подразумевает: (а) экспрессию в растении экзогенной нуклеотидной последовательности, кодирующей доминантно негативный T3SS белок и цис-регуляторный элемент, позволяющий запускать транскрипцию нуклеотидной последовательности в растительной клетке; (б) воздействие на растение бактериальных патогенов; (в) сравнение течения заболевания в полученном растении и растении дикого типа при заражении бактериальными патогенами в одних и тех же условиях, что позволяет оценивать, таким образом, устойчивость данного растения к бактериальным патогенам.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения нуклеотидная последовательность содержит SEQ ID NO:1, 3, 5, 7, 9 или 11.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения нуклеотидная последовательность содержит SEQ ID NO:20-65.В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения нуклеотидная последовательность кодирует полипептид, приведенный в SEQ ID NO:2, 4, 6, 8, 10 или 12.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения экспрессионный вектор, кроме того, содержит перед началом последовательности целевого гена дополнительную нуклеотидную последовательность, кодирующую сигнальный пептид эндоплазматического ретикулума.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения цис-регуляторный элемент содержит последовательность промотора.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения промоторная последовательность является конститутивным промотором.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения конститутивным промотором является CaMV 35S промотор.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения доминантно негативный белок T3SS получают путем введения мутации, выбранной из группы, состоящей из вставки, делеции и замены.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения мутация вставкой включает интеркалирующий блокирующий элемент.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения под белком T3SS подразумевается структурный белок T3SS.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения структурный белок T3SS является белком HRP.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения белок T3SS выбран из группы, состоящей из белков HrpY Ralstonia solanacearum, HrpA Pseudomonas syringae, HrpA Erwinia amylovora, HrpE Xanthomonas campestris, HrpA Erwinia pyrifoliae и HrpE Xanthomonas oryzae.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения белок T3SS представляет собой белок транслокона Ralstonia solanacearum.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения белок транслокона Ralstonia solanacearum выбран из группы, состоящей из PopF1 и PopF2.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения клетка-хозяин относится к растительным клеткам.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения растение, имеющее повышенную устойчивость к бактериальным патогенам, сравнивают с немодифицированным растением.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения бактериальным патогеном являются грамотрицательные бактерии. В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения грамотрицательные бактерии выбраны из группы, состоящей из Ralstonia solanacearum, Pseudomonas syringae, Erwinia amylovora, Xanthomonas campestris и Xanthomonas oryzae.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения грамотрицательные бактерии представляют собой Proteobacteria species. В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения Proteobacteria представляют собой Ralstonia solanacearum. В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения растение выбрано из группы сельскохозяйственных растений, декоративных растений и деревьев.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения выбранное растение принадлежит семейству Solanaceae.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения растение выбрано из группы, включающей томат, картофель, баклажан, банан, сладкий перец, маслину, яблоню, грушу, пираканту, цветущую дикую яблоню, боярышник, кизильник, айву, рябину, арабидопсис, герань, имбирь, табак и эвкалипт.
В соответствии с одним аспектом некоторых вариантов осуществления настоящего изобретения выбранным растением является томат.
Если не оговорено иное, то все технические и/или научные термины, используемые в настоящем документе, имеют то же значение, которое они обычно имеют в той области техники, к которой относится данное изобретение. Несмотря на то, что при практическом применении и тестировании вариантов осуществления этого изобретения могут использоваться способы и материалы, подобные или эквивалентные описанным в настоящем документе способам и материалам, примеры способов и/или материалов описаны ниже. В случае конфликтных ситуаций должно быть учтено описание патента, включая определения. Кроме того, материалы, способы и примеры приведены исключительно в иллюстративных целях и не предназначены для обязательного ограничения изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Некоторые варианты осуществления настоящего изобретения описаны только в качестве примеров со ссылкой на прилагаемые Фигуры. Что касается непосредственно Фигур, следует подчеркнуть, что они приведены в качестве примера и с целью пояснительного обсуждения вариантов осуществления настоящего изобретения. Вследствие этого, описание изобретения вместе с Фигурами делает очевидным для специалиста в этой области, как варианты осуществления настоящего изобретения могут быть осуществлены на практике.
Фиг.1А представляет собой изображение, иллюстрирующее системы секреции II типа (T2SS), III типа (T3SS) и пили IV типа грамотрицательных бактерий. Источник: Donnenberg M.S., Nature (2000) 406: 768-774, с изменениями.
Фиг.1В-С представляет собой изображения с изменениями из Buttner and Не, Plant Physiology (2009) 150: 1656-64, иллюстрирующие T3SS комплекс растительных (Фиг.1В) и животных (Фиг.1С) патогенных бактерий. Секреторный аппарат соединяет обе бактериальные мембраны и сопрягается с цитоплазматической АТФазой. Патогенные бактерии растений используют пили, которые, вероятно, пробивают растительную клеточную стенку. Патогенные бактерии животных имеют короткую игольчатую структуру, которая соединяется с транслоконом посредством так называемого верхушечного комплекса (отсутствует у патогенов растений). Этот транслокон формирует канал в плазматической мембране и обеспечивает транспорт эффекторных белков в цитоплазму клетки хозяина.
Фиг.2A-F представляет собой изображения, иллюстрирующие выравнивание белка HrpY Ralstonia solanacearum (Rs) с мономером MxiH инжектисомы T3SS Shigella (SEQ ID NO:15, Фиг.2A), структурные модели белка MxiH Shigella (Фиг.2B-E) и полную структуру инжектисомы (Фиг.2F). Изображения MxiH и инжектисомы взяты с изменениями из Deane et al., PNAS 2006 103: 12529-33.
Фиг.3А-Е иллюстрируют интеркалирующие блокирующие элементы (IBE) 1 (Фиг.3А, SEQ ID NO:2) и 2 (Фиг.3С, SEQ ID NO:4) доминантных негативных белков T3SS, предполагаемую модель структуры IBE1 и 2 T3SS (Фиг.3В и 3D, соответственно), модель взаимодействия с инжектисомой и ее каналом (Фиг.3Е) и растительные сигналы секреции из sp|Q56YT0|LAC3_At лакказы или tr|Q6TDS6|Q6TDS6_GOSAR секреторной лакказы Gossypium arboreum (SEQ ID NO:16 и 17, соответственно). Фиг.3В, 3D, и 3Е взяты с изменениями из Deane et al., PNAS 2006 103: 12529-33.
Фиг.4А-С являются изображениями интеркалирующего блокирующего элемента 3 (IBE3) доминантного негативного белка T3SS (Фиг.4А, SEQ ID NO:6), предполагаемой модели структуры IBE3 T3SS (Фиг.4В) и модели взаимодействия с инжектисомой (Фиг.4С). Фиг.4В и 4С взяты с изменениями из Deane et al., PNAS 2006 103: 12529-33.
Фиг.5A-C представляет собой это изображения, иллюстрирующие интеркалирующий блокирующий элемент 4 доминантного негативного белка T3SS (Фиг.5А, SEQ ID NO:8), предполагаемую модель блокирующего элемента (Фиг.5С) и инжектисому (Фиг.5В). Фиг.5В и 5С взяты с изменениями из Deane et al., PNAS 2006 103: 12529-33. Известно, что дуплицированные концевые участки могут взаимодействовать с различными мономерами, разрушая и блокируя канал инжектисомы.
Фиг.6A-D иллюстрируют интеркалирующие блокирующие элементы 5 (Фиг.6А, SEQ ID NO:10) и 6 (Фиг.6С, SEQ ID NO:12) доминантного негативного белка T3SS и, предполагаемую модель структуры IBE5 и 6 T3SS (Фиг.6 В и 6D, соответственно). Известно, что «головка» и концевая α-спираль белка HrpY деструктурируются пролинами, и такие деформации могут блокировать канал и нарушать функциональность инжектисомы. Фиг.6 В и 6D взяты с изменениями из Deane et al., PNAS 2006 103: 12529-33.
Фиг.7A-C представляет различные доминантные негативные белки HrpY Ralstonia solanacearum (Rs). На Фиг.7А изображена карта клонирования T-DNA. Каждый IBE был заклонирован между промотором CaMV 35S и терминатором NOS по сайтам Xbal и Sacl. На Фиг.7В представлена модель взаимодействия с инжектисомой, а на Фиг.7С - различные мутантные варианты HrpY (SEQ ID NO:2, 4, 6, 8, 10 и 12). Фиг.7 В взята с изменениями из Deane et al., PNAS 2006 103: 12529-33.
Фиг.8 взята с изменениями из Taira et al., Mol Microbiol. (1999) 34(4):737-44; на ней изображены интеркалирующие мутации и их положение в гене hrpA (SEQ ID NO:2). Кратко, положение вставок во фрагменте из 496 пар оснований BamHI±EcoRI, кодирующем HrpA пилей, отмечено кружками с номерами мутаций над ними. Каждая вставка состоит из 10 пар оснований из транспозона и дуплицированной 5-нуклеотидной последовательности идентичной последовательности, расположенной до вставки, вставленной после 10 пар оснований. Аминокислотная последовательность (SEQ ID NO:19) приведена под нуклеотидной последовательностью. Hrp-боксы в промоторе помещены в рамку; предполагаемый участок связывания рибосомы подчеркнут. N-концевой сайт процессинга белка помечен стрелками ниже аминокислотной последовательности. Помещенные в рамку номера мутаций со стрелками указывают начальную и конечную точки четырех делеционных мутаций.
Фиг.9 представляет собой выравнивание вариантов полипептида HrpY Ralstonia solanacearum (то есть небольшие отличия в последовательностях различных штаммов, SEQ ID NO:14 и 70-86).
Фиг.10А-С иллюстрируют анализ методом ПЦР и полуколичественной ОТ-ПЦР растений томата, экспрессирующих мутант 6 белка HrpY, обеспечивающий устойчивость к увяданию (WiltR). Растения томата были трансформированы конструкциями, содержащими мутант 6 HrpY, а затем растения были проанализированы методом геномной ПЦР и полу количественной ОТ-ПЦР. Были детектированы случаи экспрессии этих мутантов HrpY.
Фиг.11А-С представляют собой результаты анализа методом ПЦР и полуколичественной ОТ-ПЦР растений томата, экспрессирующих мутант 1 HrpY, обеспечивающий устойчивость к увяданию (WiltR). Растения томата были трансформированы конструкциями, содержащими мутант 1 HrpY, а затем растения были проанализированы методом геномной ПЦР и полу количественной ОТ-ПЦР. Были детектированы случаи экспрессии этих мутантов HrpY.
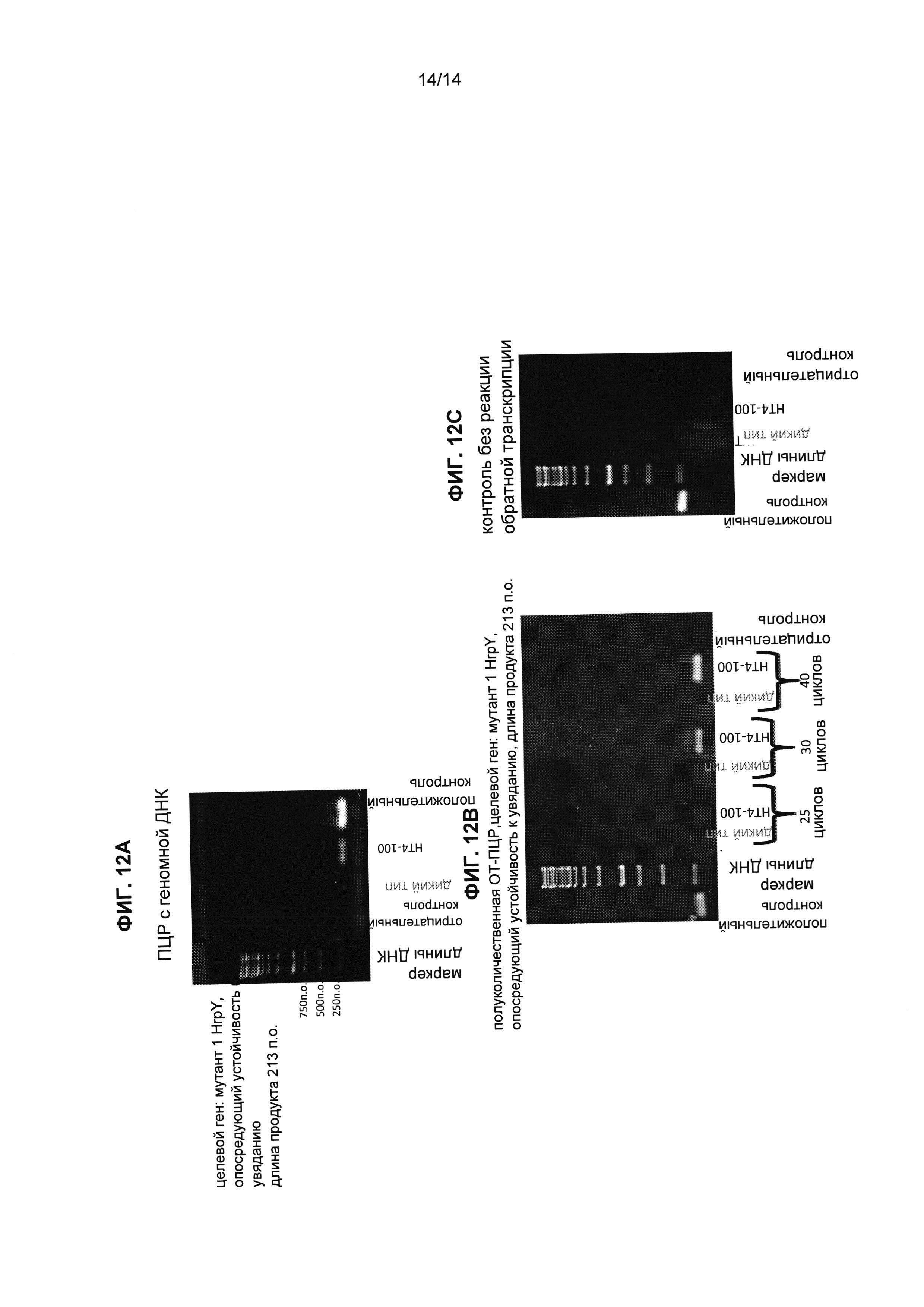
Фиг.12А-С представляют собой результаты анализа методом ПЦР и полуколичественной ОТ-ПЦР растений томата, экспрессирующих мутант 2 HrpY, обеспечивающий устойчивость к увяданию (WiltR). Растения томата были трансформированы конструкциями, содержащими мутант 2 HrpY, а затем растения были проанализированы методом геномной ПЦР и полу количественной ОТ-ПЦР. Были детектированы случаи экспрессии этих мутантов HrpY.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение в некоторых вариантах своего осуществления относится к растениям, устойчивым к бактериям, и способам создания таких растения.
Принципы и действие настоящего изобретения могут быть лучше поняты с помощью Фигур и прилагаемого описания.
Прежде чем описывать в деталях хотя бы один вариант осуществления настоящего изобретения, должно быть понятно, что это изобретение не обязательно ограничено своим применением в деталях, приведенных в последующем описании, или приведенных в качестве Фиг. в разделе «Примеры». Данное изобретение может быть исполнено в других вариантах или осуществляться на практике или выполняться различными способами. Также должно быть ясно, что формулировки и терминология, используемая в настоящем документе, приведена с целью описания, и их не следует толковать с точки зрения ограничения изобретения.
Приводя некоторые варианты настоящего изобретения к практическому применению, изобретатели сконструировали бактериальные доминантные негативные белки системы секреции III типа (T3SS), которые экспрессируются в растительных клетках и секретируются из них. Новые доминантные негативные белки T3SS настоящего изобретения включаются в структуру инжектисомы T3SS во время ее сборки и блокируют канал бактериальной инжектисомы, защищая, таким образом, растения от бактериальной инфекции.
Конструкция доминантных негативных белков T3SS настоящего изобретения основывается на сохранении и использовании нативных сайтов взаимодействия между субъединицами белков T3SS (например, HrpY), и одновременном встраивании слитых во время трансляции блокирующих канал полипептидов или деформирующих структур в белок T3SS (например, в α-спирали HrpY), которые препятствуют процессу секреции бактериальных эффекторов из бактерий в растительные клетки. Растительные сигналы секреции, добавленные для этой цели, запускают экспрессию доминантных негативных белков в растительных клетках, секрецию из них и доступность доминантных негативных белков T3SS во время сборки бактериальных пилей в пространственной близости к растительной клеточной стенке. Таким образом, например, и, как это указано в разделе «Примеры», следует, что авторы настоящего изобретения производят интеркалирующие блокирующие элементы канала инжектисомы T3SS (IBE-T3SS) грамотрицательных бактерий. IBE-T3SS Ralstonia solanacearum (SEQ ID NO:2, 4, 6, 8, 10 и 12) были сконструированы с применением структурных модификаций мономера белка HrpY (SEQ ID NO:14), строительного блока инжектисомы Rs. Изобретатели далее для трансформации растительных клеток создали экспрессионные векторы, содержащие эти IBE-T3SS. Кроме того, изобретатели проиллюстрировали трансформацию растений томата мутантами 1, 2, и 6 белка HrpY Ralstonia solanacearum и их экспрессию (см. Фиг.11А-С, 12А-С и 10А-С, соответственно). Дополнительно изобретатели провели сверхэкспрессию модифицированных белков транслокона Rs (PopF1) в трансгенных растениях. Сверхэкспрессия этих белков приводит к остановке сборки T3SS из-за взаимодействий с «незрелой» иглой и, следовательно, прекращению этого процесса. Таким образом, модифицированные белки PopF1 встраиваются в ворота транслокона и блокируют его. Просуммировав вышесказанное, можно считать данное изобретение мощным средством в области сельскохозяйственных трансгенных технологий для создания растений, устойчивых к бактериям.
Таким образом, согласно одному аспекту настоящего изобретения обеспечивается способ получения растения, имеющего повышенную устойчивость к бактериальным патогенам в сравнении с немодифицированным растением; этот способ включает введение в растение или растительную клетку экспрессионного вектора, в результате чего получают растение с повышенной устойчивостью к бактериальным патогенам в сравнении с немодифицированным растением.
Понятие «растение», используемое в этом документе, подразумевает растения целиком, их родительские поколения и потомство, а также части растения, включая семена, побеги, стебли, корни (в том числе, клубни) и растительные клетки, ткани и органы. Этим растением может быть любая форма, в том числе суспензионные культуры, эмбрионы, меристемные области, ткани каллуса, листья, гаметофиты, спорофиты, пыльца и микроспоры. Растения, которые особенно применимы в способах настоящего изобретения, включают все растения, принадлежащие надсемейству Viridiplantae (Зеленые растения), в особенности однодольные и двудольные растения, в том числе фуражные культуры и кормовые бобовые, декоративные растения, сельскохозяйственные культуры, деревья или кустарники, выбранные из следующего списка: Acacia spp., Acer spp., Actinidia spp., Aesculus spp., Agathis australis, Albizia amara, Alsophila tricolor, Andropogon spp., Arachis spp., Areca catechu, Astelia fragrans, Astragalus cicer, Baikiaea plurijuga, Betula spp., Brassica spp., Bruguiera gymnorrhiza, Burkea africana, Butea frondosa, Cadaba farinosa, Calliandra spp., Camellia sinensis, Canna indica, Capsicum spp., Cassia spp., Centroema pubescens, Chacoomeles spp., Cinnamomum cassia, Coffea arabica, Colophospermum mopane, Coronillia varia, Cotoneaster serotina, Crataegus spp., Cucumis spp., Cupressus spp., Cyathea dealbata, Cydonia oblonga, Cryptomeria japónica, Cymbopogon spp., Cynthea dealbata, Cydonia oblonga, Dalbergia monetaria, Davallia divaricata, Desmodium spp., Dicksonia squarosa, Dibeteropogon amplectens, Dioclea spp., Dolichos spp., Dorycnium rectum, Echinochloa pyramidalis, Ehraffia spp., Eleusine coracana, Eragrestis spp., Erythrina spp., Eucalyptus spp., Euclea schimperi, Eulalia vilosa, Pagopyrum spp., Feijoa sellowlana, Fragaria spp., Flemingia spp., Freycinetia banksli, Geranium thunbergii, GinAgo biloba, Glycine javanica, Gliricidia spp., Gossypium hirsutum, Grevillea spp., Guibourtia coleosperma, Hedysarum spp., Hemaffhia altissima, Heteropogon contoffus, Hordeum vulgare, Hyparrhenia rufa, Hypericum erectum, Hypeffhelia dissolute, Indigo incamata, Iris spp., Leptarrhena pyrolifolia, Lespediza spp., Lettuca spp., Leucaena leucocephala, Loudetia simplex, Lotonus bainesli, Lotus spp., Macrotyloma axillare, Malus spp., Manihot esculenta, Medicago saliva, Metasequoia glyptostroboides, Musa sapientum, Nicotianum spp., Onobrychis spp., Ornithopus spp., Oryza spp., Peltophorum africanum, Pennisetum spp., Persea gratissima, Petunia spp., Phaseolus spp., Phoenix canadensis, Phormium cookianum, Photinia spp., Picea glauca, Pinus spp., Pisum sativam, Podocarpus totara, Pogonarthria fleckii, Pogonaffhria squarrosa, Populus spp., Prosopis cineraria, Pseudotsuga menziesii, Pterolobium stellatum, Pyrus communis, Quercus spp., Rhaphiolepsis umbellata, Rhopalostylis sápida, Rhus natalensis, Ribes grossularia, Ribes spp., Robinia pseudoacacia, Rosa spp., Rubus spp., Salix spp., Schyzachyrium sanguineum, Sciadopitys vefficillata, Sequoia sempervirens, Sequoiadendron giganteum, Sorghum bicolor, Spinacia spp., Sporobolus fimbriatus, Stiburus alopecuroides, Stylosanthos humilis, Tadehagi spp., Taxodium distichum, Themeda triandra, Trifolium spp., Triticum spp., Tsuga heterophylla, Vaccinium spp., Vicia spp., Vitis vinifera, Watsonia pyramidata, Zantedeschia aethiopica, Zea mays, амарант, артишок, спаржа, брокколи, брюссельская капуста, капуста, канола, морковь, цветная капуста, сельдерей, листовая капуста, лен, кале, чечевица, рапс, окра, лук, картофель, рис, соевые бобы, культуры для соломы, сахарная свекла, сахарный тростник, подсолнечник, томат, тыква, чай, деревья. В качестве альтернативы для данных способов настоящего изобретения могут быть использованы водоросли и другие растения, не относящиеся к над семейству Viridiplantae (Зеленые растения).
В соответствии с определенными вариантами осуществления выбранное растение относится к семейству Пасленовые.
В соответствии с определенными вариантами осуществления выбранное растение относится к роду Паслен.
В соответствии с другими определенными вариантами осуществления выбранное растение - это томат (Lycopersicum esculentum).
В соответствии с другими определенными вариантами осуществления выбранное растение включает картофель (Solanum tuberosum); томат (Lycopersicum esculentum); баклажан (Solanum melongena); банан (Musa spp.); герань (Pelargonium); имбирь (Zingiber officinale); табак (Nicotiana tabacum); сладкий перец (Capsicum spp.); маслину (Olea europea), арабидопсис, эвкалипт, яблоню, цветущую дикую яблоню, грушу, пираканту, боярышник, кизильник, айву или рябину.
Поскольку используемое в настоящем документе понятие «бактериальный патоген» относится к любому типу вирулентных бактерий, то бактериальные виды или штаммы, которые инфицируют растение, включают, но не ограничиваются, Pseudomonas spp., Erwinia-related strains, Ralstonia solanacearum и Xanthomonas campestris. Этой бактерией могут быть Pseudomonas spp., включая P. aureofaciens, P. chlororaphis, P. fluorescens, P. marginalis, Pseudomonas syringae, P. tolaasii, P. agarici и P. viridiflava. Этой бактерией могут быть родственные Erwinia штаммы, в том числе Dickeya dadantii (Erwinia chrysanthemi), Erwinia carotovora, Erwinia atroseptica и Erwinia amylovora. Этой бактерией могут быть родственные Xanthomonas campestris штаммы, в том числе Xanthomonas campestris pv. campestris (Xcc) and Xanthomonas oryzae.
Согласно одному варианту осуществления настоящего изобретения под бактериями подразумеваются грамотрицательные бактерии.
Согласно определенному варианту осуществления грамотрицательные бактерии представляют собой Proteobacteria species.
Согласно другому определенному варианту осуществления Proteobacteria представляют собой Ralstonia solanacearum.
Согласно другому определенному варианту осуществления грамотрицательные бактерии выбраны из группы, состоящей из Ralstonia solanacearum, Pseudomonas syringae, Erwinia amylovora, Erwinia Psidii, Erwinia pyrifoliae, Xanthomonas campestris и Xanthomonas oryzae.
Так как используемое в настоящем документе понятие «повышенная устойчивость» имеет отношение к понижению вирулентности бактерий и, следовательно, понижению чувствительности растения-хозяина, то эффект сравнивается с немодифицированным растением, зараженным тем же бактериальным патогеном. Согласно сути настоящего изобретения понижение бактериальной вирулентности обеспечивается экспрессией доминантных негативных белков, связанных с бактериальной вирулентностью (например, комплексом иглы, что детально описано ниже), и может влиять на любой этап жизненного цикла бактерии во время ее ассоциации с хозяином, включая (но не ограничиваясь) адгезию, инвазию, репликацию, уклонение от защитных механизмов и передачу новому хозяину.
Повышенная устойчивость к бактериальным патогенам может проявляться в виде уменьшения симптомов у зараженного растения и, таким образом, может быть детектирована в процессе наблюдения за сниженной реакцией растения на соответствующие бактерии. Повышение устойчивости может проявляться как снижение симптомов, связанных с бактериальными патогенами, по меньшей мере, на 1%, 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100%, что измеряется любым способом анализа, известным в этой области техники, и это измерение проводят против подходящего контроля (например, немодифицированного растения, выращиваемого в тех же условиях).
Способы настоящего исследования осуществляют при введении в растение экспрессионного вектора, кодирующего доминантно негативный белок T3SS и цис-регуляторный элемент, способный управлять транскрипцией нуклеотидной последовательности в растительной клетке; где доминантно негативный белок T3SS обеспечивает сборку нефункциональной инжектисомы.
Понятие «T3SS», используемое в настоящем документе, подразумевает под собой систему секреции III типа бактерий (например, грамотрицательных), которая обычно функционирует как игольчатая структура для выделения белков непосредственно из бактериальной клетки. Игольчатая структура T3SS обычно берет начало в цитоплазме бактерии, пересекает две мембраны и выступает из клетки (Фиг.1А). Та часть, что закреплена в мембране, является основанием, или базальным телом, T3SS. Внеклеточная часть представляет собой игольчатую структуру (пили). Конечная структура, выполняющая функцию «ворот» в клетку хозяина, является транслоконом (Фиг.1В-С). Так называемый внутренний стержень соединяет игольчатую структуру с основанием.
Используемое в настоящем документе понятие «белок T3SS» подразумевает под собой белок, который составляет комплекс T3SS. Это понятие включает структурные белки, то есть те, из которых строится основание, внутренний стержень, игольчатая структура, наконечник и транслокон. Игольчатая структура сама по себе обычно состоит из множества субъединиц единственного белка T3SS. Таким образом, большинство разнообразных белков T3SS представляют собой белки, из которых состоит основание, и белки, которые секретируются в клетку хозяина.
В соответствии с одним вариантом осуществления настоящего изобретения белок T3SS представляет собой такой белок, как HRP (белок реакции гиперчувствительности и патогенности), из которого состоит игольчатая структура T3SS. Типичные белки HRP включают (но не ограничиваются) белки HrpY Ralstonia solanacearum, HrpA Pseudomonas syringe, HrpA Erwinia amylovora, HrpA Erwinia pyrifoliae и HrpE Xanthomonas campestris (Таблица 1, Buttner and Не, Plant Physiology (2009) 150:1656-1664).
Согласно определенному варианту осуществления полипептид белка HrpY дикого типа Ralstonia solanacearum соответствует SEQ ID NO:14.
Согласно другому варианту осуществления полипептид белка HrpY Ralstonia solanacearum включает варианты, приведенные в SEQ ID NO:70-86.
Согласно определенному варианту осуществления полипептид белка HrpA дикого типа Pseudomonas syringae соответствует SEQ ID NO:19.
Согласно определенному варианту осуществления полипептид белка HrpA дикого типа Erwinia amylovora соответствует SEQ ID NO:88.
Согласно определенному варианту осуществления полипептид белка HrpE дикого типа Xanthomonas campestris соответствует SEQ ID NO:90.
Согласно определенному варианту осуществления полипептид белка HrpE дикого типа Xanthomonas oryzae соответствует SEQ ID NO:92.
Согласно другому варианту осуществления белок T3SS представляет собой белок транслокона, такой как белки PopF1 и PopF2 Ralstonia solanacearum (SEQ ID NO:67 и 69, соответственно).
Согласно определенному варианту осуществления полипептид белка HrpA дикого типа Erwinia pyrifoliae соответствует SEQ ID NO:100.Сочетание «доминантно негативный белок T3SS», используемое в настоящем документе, подразумевает белок T3SS, являющийся продуктом структурно измененного гена, который взаимодействует с секретируемым бактериями белком дикого типа T3SS, но приводит к формированию нефункциональных комплексов иглы (например, таких, которые не способны проникать в клетку-хозяина или транспортировать эффекторные белки в клетку-хозяина или имеют сниженную в сравнении с белками дикого типа способность проникать в клетку-хозяина или транспортировать эффекторные белки в клетку-хозяина). Такой бактериальный нефункциональный комплекс иглы может быть структурно деформирован (например, частично или полностью блокирован или искривлен таким образом, что проявляет меньшую способность к переносу эффекторных белков в клетку-хозяина) или может собираться частично или не собираться вообще. Обычно доминантно негативный белок T3SS настоящего изобретения понижает инфекционность и патогенность бактерий. Способы измерения инфекционности хорошо известны в соответствующей области техники.
Таким образом, доминантно негативный белок T3SS ухудшает сборку и функциональность комплекса иглы и, следовательно, патогенность бактерий примерно на 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 100% в сравнении с бактериями, имеющими игольчатую структуру, состоящую из белка T3SS дикого типа. Согласно определенному варианту осуществления, доминантно негативный белок экспрессируется экзогенно растительной клеткой для бактериальной клетки.
Обычно доминантно негативный белок T3SS кодируется геном, содержащим одну или несколько мутаций в кодирующей последовательности белка дикого типа, таких как вставка, делеция или замена. Эти мутации могут включать единственное изменение в нуклеотидной последовательности белка дикого типа T3SS (например, включение аминокислоты, нарушающей β-структуру, такой как пролин или синтетический аналог такового) или, в других случаях, мутации могут в включать 2, 3, 4, 5, 6, 7, 8, 9,10, 15, 20, 25 или более изменений нуклеотидной последовательности. В других случаях мутация может включать вставку единственного пептида (3, 4, 5, 10 аминокислот) или нескольких пептидов (например, пентапептидную вставку) в белке T3SS.
Типичные единичные аминокислотные мутации, которые могут быть введены в пептиды в настоящем изобретении, включают замены в гене hrpA: лейцина в 23-й позиции на аланин, аланина в 54-й позиции на глутаминовую кислоту, лизина в 93-й позиции на изолейцин, аспарагиновой кислоты в 95-й позиции на серии, изолейцина в 101-й позиции на треонин, изолейцина в 111-й позиции на пролин.
Типичные пентапептидные вставки, которые могут быть добавлены в пептиды настоящего изобретения, соответствуют SEQ ID NO:20-65 (Таблица 2).
Необходимо отметить, что мутации можно вводить в любое положение в гене T3SS, которое приводят к образованию доминантного негативного белка. Типичные положения нуклеотидных вставок и делеций для гена HrpA отражены на Фиг.8 и в Таблице 2 [Taira et al., Mol Microbiol. (1999) 34(4):737-44].
Как указывалось ранее и в соответствии с определенным вариантом осуществления, доминантно негативный белок T3SS настоящего изобретения обладает свойствами поддерживать белок-белковые взаимодействия, которые позволяют ему связываться с высокой аффинностью с родственным бактериальным белком дикого типа и формировать игольчатую структуру, являющуюся, однако, нефункциональной из-за мутаций в доминантных негативных белках.
Таким образом, настоящее изобретение предполагает любую мутацию в T3SS гене, которая делает комплекс иглы нефункциональным.
В соответствии с одним вариантом осуществления настоящего изобретения мутация вставки включает интеркалирующий блокирующий элемент (IBE). Доминантные негативные белки T3SS, содержащие IBE, обычно участвуют в межсубъединичных взаимодействиях с родственными белками, в то время как трансляционно слитые интеркалирующие элементы, блокирующие канал (например, пептиды) или деформирующие структуры белка T3SS (например, α-спирали HrpY), не позволяют бактериальным эффекторам секретироваться из бактерий в растительные клетки (Пример 1 в разделе «Примеры»).
Согласно одному варианту осуществления этого аспекта настоящего изобретения нуклеотидная последовательность кодирует пептид, соответствующий SEQ ID NO:2, 4, 6, 8, 10 или 12.
Согласно другому варианту осуществления эти доминантные негативные белки T3SS обладают способностью останавливать сборку T3SS за счет взаимодействий с незрелой игольчатой структурой (например, доминантные негативные белки транслокона взаимодействуют с игольчатой структурой раньше времени, мешая, таким образом, сборке T3SS и инактивируя ее (Пример 3 в разделе «Примеры»)).
Нуклеотидные последовательности в соответствии с этим свойством настоящего изобретения могут быть комплементарными нуклеотидными последовательностями (кДНК), геномными полинуклеотидными последовательностями и/или смешанными полинуклеотидными последовательностями (например, комбинация из представленных выше).
Используемое в настоящем документе сочетание «комплементарная нуклеотидная последовательность» означает такую последовательность, которая получена в результате обратной транскрипции информационной РНК с использованием обратной транскриптазы или любой другой РНК-зависимой ДНК-полимеразы. Такая последовательность может быть затем амплифицирована in vivo или in vitro с использованием ДНК-зависимой ДНК-полимеразы.
Используемое в настоящем документе сочетание «геномная полинуклеотидная последовательность» означает такую последовательность, которая получена (выделена) из хромосомы и, таким образом, представляет собой непрерывный участок хромосомы.
Используемое в настоящем документе сочетание «смешанная полинуклеотидная последовательность» означает такую последовательность, которая, по меньшей мере, частично является комплементарной и, по меньшей мере, частично является геномной. Смешанная последовательность может включать некоторые последовательности экзонов, необходимые для кодирования полипептида настоящего изобретения, а также некоторые последовательности интронов, находящиеся между экзонами. Последовательности интронов могут быть любого происхождения, включая другие гены, и обычно содержат консервативные последовательности сигналов сплайсинга. Такие интронные последовательности могут, кроме того, содержать цис-регуляторные экспрессионные элементы, что детально описано ниже.
Согласно определенному варианту осуществления нуклеотидная последовательность содержит вставку, такую как указано в SEQ ID NO:1, 3, 5, 7, 9 и 11.
Конструкции, применяемые в соответствующих настоящему изобретению способах, могут быть созданы с использованием технологии рекомбинантной ДНК, широко известной специалистам в данной области техники. Генетические конструкции могут быть вставлены в векторы, которые, в свою очередь, могут быть коммерчески доступными, пригодными для трансформации растений и экспрессии целевых генов в трансформированных клетках. Генетическая конструкция может быть экспрессионным вектором, в котором гетерологичная нуклеотидная последовательность функционально связана с цис-регуляторным элементом, обеспечивающим экспрессию в растительных клетках.
Используемое в настоящем документе сочетание «цис-регуляторный элемент» соответствует полинуклеотидной последовательности, предпочтительно промотору, которая связывает trans-регулятор и регулирует транскрипцию кодирующей последовательности, расположенной ниже.
Используемое в настоящем документе сочетание «функционально связанный» соответствует функциональному расположению цис-регуляторного элемента (например, промотора), так как он позволяет регулировать экспрессию выбранной нуклеотидной последовательности. Например, промоторная последовательность может быть расположена перед выбранной нуклеотидной последовательностью относительно направления транскрипции и трансляции.
Предпочтительно промотором в конструкции нуклеиновой кислоты в рамках настоящего изобретения является растительный промотор, который обеспечивает экспрессию чужеродной молекулы нуклеиновой кислоты в клетках растений.
Следует заметить, что новые нуклеотидные последовательности, кодирующие интеркалирующие элементы, такие как приведенные в SEQ ID NO:2, 4, 6, 8, 10 или 12, предусмотрены самостоятельно или как часть вектора экспрессии нуклеиновой кислоты, предназначенного для экспрессии в бактериальных клетках или клетках растений.
Используемый в настоящем документе термин «растительный промотор» обозначает промоторную последовательность, включая любые регуляторные элементы, добавленные или уже содержащиеся в последовательности, способную активировать, поддерживать и усиливать экспрессию в растительной клетке, ткани или органе, предпочтительно в клетке, ткани или органе однодольного или двудольного растения. Данный промотор может быть растительного, бактериального, вирусного, грибного или животного происхождения. Данный промотор может быть конститутивным, т.е. способным поддерживать высокий уровень экспрессии генов во множестве растительных тканей, тканеспецифичным, т.е. способным поддерживать экспрессию генов в конкретной растительной ткани или тканях, индуцибельным, т.е. способным поддерживать экспрессию генов под воздействием стимула, или химерным, т.е. включать в себя части, по меньшей мере, двух разных промоторов.
Примерами конститутивных промоторов являются CaMV35S и CaMV19S промоторы, FMV34S промотор, промотор баднавируса палочковидности сахарного тростника, CsVMV промотор, промотор актина АСТ2/АСТ8 Арабидопсиса, промотор убиквитина UBQ1 Арабидопсиса, промотор тионина ВТН6 из листьев ячменя, промотор актина риса и др.
При осуществлении конкретных вариантов термин «промотор» обозначает конститутивный промотор, такой, как CaMV 35S.
Другие примеры промоторов, полезные для способов по некоторым вариантам настоящего изобретения, представлены в Таблицах 3, 4, 5 и 6.
Конструкция нуклеиновой кислоты, описанная в настоящем документе, может включать дополнительные последовательности нуклеиновых кислот, кодирующие сигнальный пептид эндоплазматического ретикулума, наличие которого позволяет транспортировать доминантный негативный пропептид T3SS в эндоплазматический ретикулум и направить его через секреторный путь. Данный сигнальный пептид обычно слит в рамке с N-концом полипептида (т.е. располагается до полипептида) и направляет закодированный полипептид по секреторному пути клетки, конечной точкой которого является секреция (например, в апопласт).
Примерами сигнальных последовательностей для секреции, которые направляют полипептиды через ЭР во внеклеточное пространство являются растительный лидерный секреторный пептид из sp|Q56YT0|LAC3_At лакказы (SEQ ID NO:16) и растительный лидерный секреторный пептид из tr|Q6TDS6|Q6TDS6_GOSAR (SEQ ID NO:17).
Кроме представленных ранее сигнальных последовательностей могут быть использованы сигнальная последовательность родственного белка патогенеза табака (PR-S) (Sijmons et al, 1990, Bio/technology, 8:217-221), сигнальная последовательность лектина (Boehn et al., 2000, Transgenic Res, 9(6):477-86), сигнальная последовательность из гидроксипролин-богатого гликопротеина из Phaseolus vulgaris (Yan et al, 1997, Plant Phyiol. 115(3):915-24 and Corbin et al, 1987, Mol Cell Biol 7(12):4337-44), сигнальная последовательность пататина картофеля (Iturriaga, G et al, 1989, Plant Cell 1:381-390 и Bevan et al, 1986, Nue. Acids Res. 41:4625-4638.) и сигнальная последовательность альфа-амилазы ячменя (Rasmussen and Johansson, 1992, Plant Mol. Biol. 18(2):423-7).
В соответствии с одним вариантом настоящего изобретения, конструкция нуклеиновой кислоты может включать трансляционный энхансер, такой как трансляционный энхансер омега.
Последовательности нуклеиновых кислот, кодирующих полипептиды согласно вариантам настоящего изобретения, могут быть оптимизированы для экспрессии в растениях. Примерами таких модификаций последовательностей являются изменение G/C-состава, приближая его к часто встречающемуся в интересующих нас видах растений, а также удаление кодонов, не характерных для видов растений, обычно обозначаемое как оптимизация кодонов.
Термин «оптимизация кодонов» обозначает выбор конкретных нуклеотидов в ДНК для использования в структурном гене или его фрагменте, который согласуется с частотой встречаемости кодонов в интересующем растении. Оптимизированным геном или последовательностью нуклеиновой кислоты называется ген в растении, нуклеотидная последовательность которого была преобразована с использованием статистически-предпочтительных ко донов. Нуклеотидную последовательность обычно исследуют на уровне ДНК, и кодирующий фрагмент оптимизируют для экспрессии в конкретных видах растений с использованием методик, например, описанных Sardana et al. (1996, Plant Cell Reports 15:677-681). В данной методике стандартное отклонение использования ко донов, мера «использования ко донов», может быть рассчитано как квадрат пропорционального отклонения использования каждого кодона в нативном гене по отношению к высокоэкспрессирующимся растительным генам, а затем рассчитывается общее среднеквадратическое отклонение. Используемая формула: 1 SDCU=n=1Ν[(Χn-Υn)/Υn]2/Ν, где Xn - это частота использования кодона n в высокоэкспрессируемых растительных генах, Υn - частота использования кодона n в целевом гене, N - общее число кодонов в целевом гене. Таблица использования кодонов из высокоэкспрессируемых генов двудольных растений составлена с использованием данных Murray et al. (1989, Nuc Acids Res. 17:477-498). Другой способ оптимизации нуклеотидной последовательности в соответствии с использованием конкретных выбранных кодонов в каждом отдельном типе растительных клеток основан на прямом использовании, без каких-либо статистических расчетов, таблиц для оптимизации кодонов, таких как он-лайн таблица в базе данных Codon Usage Database банка ДНК-последовательностей NIAS (Национальный институт агробиологических наук), Япония (vvrww.kazusa.or.jp/codon/). База данных по использованию кодонов содержит таблицы по использованию кодонов для множества различных видов, причем каждая таблица создается на основе данных, содержащихся в базе данных Genbank.
Применяя описанные таблицы, содержащие кодоны для каждой аминокислоты, предпочтительно используемые в конкретных видах растений (например, рисе), ученые могут оптимизировать кодоны в целевых природных кодирующих белок последовательностях конкретных видов растений. Это может достигаться путем замены кодонов, статистически редко встречающихся в геномах конкретных видов организмов, на статистически более предпочтительные кодоны. Тем не менее, один или несколько менее предпочтительных кодонов могут быть выбраны для удаления существующих рестриктных сайтов, создания новых сайтов для потенциально полезных соединений (на 5'- и 3'-концах, чтобы добавить сигнальный пептид или терминирующие кассеты, внутренние сайты, которые могут быть использованы для разрезания и соединения фрагментов для создания правильной полноразмерной последовательности) или для элиминирования нуклеотидных последовательностей, наличие которых может негативно сказаться на стабильности или экспрессии мРНК. Природная кодирующая белок последовательность может изначально до всякой модификации содержать некоторое число кодонов, которые являются статистически предпочтительными в данных видах растений. Таким образом, оптимизация кодонов в нативной нуклеотидной последовательности может включать определение того, какие кодоны в нативной нуклеотидной последовательности не являются статистически предпочтительными в данном растении, и изменение таких кодонов в соответствии с таблицей использования кодонов в конкретном растении для создания производного с оптимизированным набором кодонов. Измененная нуклеотидная последовательность может быть полностью или частично оптимизирована для использования кодонов в растениях, таким образом, что продукция белка, кодируемого модифицированной нуклеотидной последовательностью, может быть выше продукции белка, кодируемого соответствующей нативной последовательностью. Создание синтетических генов с помощью изменения использования кодонов описано, например, в патентной заявке РСТ 93/07278.
Настоящее изобретение охватывает нуклеотидные последовательности, описанные выше, их фрагменты, последовательности, гибридизуемые с описанными последовательностями, гомологичные им последовательности, ортологи описанных последовательностей, последовательности, кодирующие сходные полипептиды с различным использованием кодонов, последовательности, измененные посредством мутаций, таких, как делеций, вставки или замены одного или более нуклеотидов, природных или индуцированных, в том числе случайных или направленных. Клетки растений могут быть трансформированы стабильно или временно конструкциями нуклеиновых кислот согласно способам, описанным в рамках настоящего изобретения. При стабильной трансформации молекула нуклеиновой кислоты настоящего изобретения встраивается в растительный геном и, как следствие, становится стабильной и наследуемой. При временной трансформации молекула нуклеиновой кислоты экспрессируется в трансформированной клетке, но не интегрирована в геном и представляет собой временный компонент.
Существуют различные методы введения чужеродных генов в однодольные и двудольные растения (Potrykus, I., Annu. Rev. Plant. Physiol., Plant. Mol. Biol. (1991) 42:205-225; Shimamoto et al., Nature (1989) 338:274-276). Среди методов стабильного внедрения экзогенной ДНК в растительную геномную ДНК выделяют два основных подхода:
(i) Перенос генов с использованием агробактерий: Klee et al. (1987) Annu. Rev. Plant Physiol. 38:467-486; Klee and Rogers в Cell Culture and Somatic Cell Genetics of Plants, Vol.6, Molecular Biology of Plant Nuclear Genes, ред. Schell, J., и Vasil, L. K., Academic Publishers, San Diego, Calif. (1989) c. 2-25; Gatenby, в Plant Biotechnology, ред. Kung, S. и Arntzen, C. J., Butterworth Publishers, Boston, Mass. (1989) c. 93-112.
(ii) прямое поглощение ДНК: Paszkowski et al., в Cell Culture and Somatic Cell Genetics of Plants, Vol.6, Molecular Biology of Plant Nuclear Genes ред. Schell, J., и Vasil, L. K., Academic Publishers, San Diego, Calif. (1989) c. 52-68; включая методы прямого внедрения ДНК в протопласты, Toriyama, К. et al. (1988) Bio/Technology 6:1072-1074. ДНК внедряется при помощи краткого электрического шока растительных клеток: Zhang et al. Plant Cell Rep.(1988) 7:379-384. Fromm et al. Nature (1986) 319:791-793. Внедрение ДНК в растительные клетки при помощи бомбардировки частицами, Klein et al. Bio/Technology (1988) 6:559-563; McCabe et al. Bio/Technology (1988) 6:923-926; Sanford, Physiol. Plant. (1990) 79:206-209; с использованием микропипеток: Neuhaus et al., Theor. Appl. Genet. (1987) 75:30-36; Neuhaus and Spangenberg, Physiol. Plant. (1990) 79:213-217; трансформация культур клеток, эмбрионов или каллусной ткани с помощью стеклянных нитей или нитей из карбида кремния, патент США №5,464,765 или с помощью прямой инкубации ДНК с прорастающей пыльцой, De Wet et al. in Experimental Manipulation of Ovule Tissue, ред. Chapman, G. P. и Mantell, S. H. и Daniels, W. Longman, London, (1985) c. 197-209; и Ohta, Proc. Natl. Acad. Sci. USA (1986) 83:715-719.
Агробактериальные системы включают использование плазмидных векторов, содержащих определенные сегменты ДНК, которые интегрируют в растительную геномную ДНК. Методы работы с растительными тканями варьируют в зависимости от видов растений и агробактериальной системы доставки. Широко используемый подход - метод листовых дисков, который может быть применен к любому эксплантату растительной ткани и способствует началу дифференцировки целого растения (Horsch et al. в Plant Molecular Biology Manual A5, Kluwer Academic Publishers, Dordrecht (1988) c.1-9). Дополнительный подход состоит в использовании агробактериальной системы доставки в сочетании с вакуумной инфильтрацией. Агробактериальную систему особенно часто используют для создания трансгенных двудольных растений. Существуют разнообразные методы внедрения ДНК в растительные клетки. При электропорации протопласты помещают в сильное электрическое поле на короткое время. При микроинъекции ДНК механически внедряют в клетки с помощью очень тонких микропипеток. При бомбардировке микрочастицами ДНК абсорбируется на мелкие частицы, например, на кристаллы сульфата магния или частицы вольфрама, которые физически попадают в клетки и ткани растений.
За стабильной трансформацией следует размножение. В основном растения размножают семенами. Недостатком семенного размножения является то, что вследствие гетерозиготности наблюдается отсутствие единообразия в потомстве, так как семена образуются растениями с генетическими вариациями, определяемыми правилами Менделя. В основном, все семена генетически различны и каждое семя вырастет в индивидуальное растение со своими определенными чертами. Желательно, чтобы трансформированное растение было получено таким образом, чтобы регенерированное растение обладало идентичными чертами и характеристиками родительских трансгенных растений. Таким образом, предпочтительно размножение трансформированных растений путем микроразмножения, что обеспечивает быструю и единообразную репродукцию трансформированных растений.
Микроразмножение - это процесс выращивания нового поколения растений из кусочка ткани, взятого из конкретного, выбранного родительского растения или растения нужного сорта. Этот процесс позволяет массовую репродукцию растений, обладающих нужными исследователю тканями и экспрессирующих слитый белок. Новое поколение растений генетически идентично и обладает всеми характеристиками родительского растения. Микроразмножение дает возможность массовой продукции качественного растительного материала в короткий период времени и способствует быстрой амплификации выбранных сортов, обладающих характеристиками исходного трансгенного или трансформированного растения. Преимуществами клонирования растений являются скорость размножения, а также качество и единообразность полученных потомков.
Микроразмножение представляет собой многоступенчатый процесс, требующий изменение состава культуральной среды или условий роста между стадиями. Процесс вегетативного размножения включает четыре основных стадии: стадия первая - первичное культивирование ткани, стадия вторая - размножение культуры ткани, стадия третья - дифференцировка и формирование растения, и стадия четвертая - тепличное культивирование и закаливание. Во время первой стадии, первичного культивирования ткани, создается культура ткани и гарантируется отсутствие контаминации. Во время второй стадии первичную культуру ткани размножают до нужного для целей производства количества образцов ткани. Во время третьей стадии образцы ткани, полученные на стадии два, разделяют и выращивают в отдельные ростки. На четвертой стадии трансформированные ростки переносят в теплицу для закалки, где выносливость растения постепенно возрастает таким образом, что оно становится способным к существованию в естественной среде.
Хотя в настоящее время предпочтительной является стабильная трансформация, временная трансформация клеток листа, клеток меристемы или целого растения также может применяться в некоторых вариантах изобретения.
Временная трансформация может быть осуществлена любым из описанных методов прямого переноса ДНК или с помощью вирусной инфекции с использованием модифицированных вирусов растений.
Показано, что для трансформации растительных хозяев могут быть использованы вирусы, включая CaMV, TMV и BV. Трансформация растений с использованием вирусов растений описана в патенте США №4,855,237 (BGV), ЕР-А 67,553 (TMV), опубликованной заявке Японии №63-14693 (TMV), ЕРА 194,809 (BV), ЕРА 278,667 (BV); и Gluzman, Y. et al., Communications in Molecular Biology: Viral Vectors, Cold Spring Harbor Laboratory, New York, cc. 172-189 (1988). Использование частиц псевдовируса для экспрессии чужеродной ДНК в различных хозяевах, включая растения, описано в WO 87/06261.
Использование РНК-вирусов растений для внедрения и экспрессии невирусных экзогенных нуклеотидных последовательностей в растениях показано в приведенных выше ссылках, а также, например, в Dawson, W. О. et al., Virology (1989) 172:285-292; Takamatsu et al. EMBO J. (1987) 6:307-311; French et al. Science (1986) 231:1294-1297; и Takamatsu et al. FEBS Letters (1990) 269:73-76.
Если вирус является ДНК-вирусом, то нужные модификации могут быть внесены непосредственно в вирус. В противном случае, вирус может быть сначала клонирован в бактериальную плазмиду для облегчения конструирования требуемого вирусного вектора, содержащего чужеродную ДНК. Вирус может быть затем выделен из плазмиды. Если вирус является ДНК-вирусом, то к вирусной ДНК может быть присоединен бактериальный ориджин репликации, после чего она сможет реплицироваться в бактериях. Транскрипция и трансляция данной ДНК будет обеспечивать синтез белка оболочки, который, в свою очередь, будет инкапсидировать вирусную ДНК. Если вирус является РНК-вирусом, то с его нуклеиновой кислоты синтезируют кДНК, которую далее клонируют в плазмиду. Плазмиду затем используют для всех дальнейших манипуляций. Вирусная последовательность с плазмиды транскрибируется и транслируется, синтезируется белок (белки) оболочки, который инкапсидирует вирусную РНК, формируя новые вирусные часицы. Использование РНК-вирусов растений для введения и экспрессии в растениях экзогенных невирусных нуклеотидных последовательностей, таких, как последовательности, включенные конструкции по некоторым вариантам изобретения проиллюстрировано примеденными выше ссылками, а также патентом США №5,316,931.
В некоторых случаях используют нуклеотидную последовательность вируса растений, в которой нативная последовательность, кодирующая белок оболочки, заменена на ненативную последовательность, кодирующую белок оболочки вируса растений, и ненативный промотор, обычно субгеномный промотор ненативной последовательности, кодирующей белок оболочки, способной экспрессироваться в растении-хозяине, обеспечивать упаковку рекомбинантных вирусных частиц в растении-хозяине и поддерживать системную инфекцию в хозяине рекомбинантными вирусными нуклеиновыми кислотами. Ген белка оболочки может быть инактивирован путем вставки в него ненативной нуклеотидной последовательности. Рекомбинантные нуклеотидные последовательности вирусов растений могут содержать один или более добавочных субгеномных промоторов. Все ненативные субгеномные промоторы способны обеспечивать транскрипцию и экспрессию соседних генов или нуклеотидных последовательностей в растении-хозяине, но не способны к рекомбинации друг с другом и с нативными субгеномными промоторами. Ненативные (чужеродные) нуклеотидные последовательности могут быть введены вблизи нативных субгеномных промоторов вирусов растений или вюлизи нативных и ненативных субгеномных промоторов вирусов растений, если вводят более одной нуклеотидной последовательности. Ненативные нуклеотидные последовательности транскрибируются или экспрессируются с образованием нужных продуктов в растении-хозяине под контролем субгеномного промотора. Второй вариант предусматривает рекомбинантные нуклеиновые кислоты вирусов растений, такие же, как в первом варианте, за исключением того, что вместо ненативной нуклеотидной последовательности, кодирующей белок оболочки, вблизи от одного из ненативных субгеномных промоторов белка оболочки помещают нативную последовательность, кодирующую белок оболочки вируса.
Третий вариант предусматривает рекомбинантные нуклеиновые кислоты вирусов растений, в которых нативный ген белка оболочки расположен вблизи его субгеномного промотора, и в которые были вставлены один или более ненативных субгеномных промоторов. Внедренные ненативные субгеномные промоторы способны вызывать транскрипцию и экспрессию соседних генов в растении-хозяине, но не способны к рекомбинации друг с другом, а также с нативными субгеномными промоторами. Ненативные нуклеотидные последовательности могут быть внедрены вблизи ненативных субгеномных промоторов вирусов растений, тогда данные последовательности будут транскрибироваться или экспрессироваться с образованием целевого белкового продукта в растении-хозяине под контролем субгеномных промоторов.
Четвертый вариант предусматривает рекомбинантные нуклеиновые кислоты вирусов растений, такие же, как в третьем варианте, за исключением того, что нативная последовательность, кодирующая белок оболочки, заменена на ненативную последовательность, кодирующую белок оболочки.
Вирусные вектора инкапсидируются белками оболочки, кодируемыми рекомбинантной нуклеотидной последовательностью вируса растения, образуя рекомбинантные вирусы растений. Рекомбинантные нуклеиновые кислоты вирусов растений или рекомбинантные вирусы растений используют для заражения соответствующих растений-хозяев. Рекомбинантная нуклеиновая кислота вируса растения способна к репликации в хозяине, системному распространению в хозяине, транскрипции или экспрессии чужеродных генов (выделенных нуклеиновых кислот), приводящей к синтезу нужных белков.
В добавление к описанному выше, молекулы нуклеиновых кислот согласно некоторым вариантам настоящего изобретения, могут быть введены в геном хлоропластов, способствуя экспрессии в хлоропластах.
Методика внедрения чужеродных нуклеотидных последовательностей в геном хлоропластов известна. Она включает в себя следующие процедуры. Во-первых, растительные клетки обрабатывают химическими реагентами для уменьшения количества хлоропластов на клетку до примерно одного. Затем экзогенные нуклеиновые кислоты внедряют в клетки при помощи бомбардировки микрочастицами с целью внедрения хотя бы одной молекулы экзогенной нуклеиновой кислоты внутрь хлоропласта. Экзогенную нуклеиновую кислоту подбирают таким образом, чтобы она могла быть внедрена в геном хлоропластов с помощью гомологичной рекомбинации, которая довольно эффективно идет в хлоропластах при помощи специальных ферментов. Для этой цели экзогенная нуклеиновая кислота включает, помимо целевого гена, по меньшей мере, один нуклеотидный фрагмент, выделенный из геномной ДНК хлоропластов. Кроме того, экзогенная нуклеиновая кислота должна содержать селективный маркер, который используют для отбора последовательностей, чтобы убедиться, что все или почти все копии хлоропластных геномов после такого отбора несут экзогенную нуклеиновую кислоту. Прочие детали, касающиеся данной методики, можно найти в патентах США №№4,945,050 и 5,693,507, которые включены в данный документ посредством ссылки. Полипептид может синтезироваться при помощи хлоропластной системы экспрессии и интегрироваться во внутреннюю мембрану хлоропласта.
Согласно дополнительному аспекту изобретения предусмотрена клетка-хозяин, содержащая вектор экспрессии нуклеиновой кислоты по настоящему изобретению. «Клетка-хозяин» по настоящему изобретению относится к новой индивидуальной клетке, полученной в результате внедрения в клетку экспрессионного вектора, содержащего нуклеотидную последовательность, кодирующую доминантно негативный белок T3SS. В конкретном варианте клетка-хозяин представляет собой растительную клетку. Клетка-хозяин может содержать конструкции нуклеиновых кислот в виде внехромосомной (эписомной) реплицирующейся молекулы или может включать химерный ген, интегрированный в ядерный или пластидный геном клетки-хозяина.
В соответствии с еще одним аспектом настоящего изобретения предусмотрено генетически модифицированное растение, содержащее экспрессионные векторы по настоящему изобретению.
В соответствии с еще одним аспектом настоящего изобретения предусмотрено генетически модифицированное растение, экспрессирующее экзогенный полинуклеотид, кодирующий доминантный негативный белок T3SS, приведенный в SEQ ID NO:2, 4, 6, 8, 10 или 12.
В некоторых вариантах генетически модифицированные растения, экспрессирующие доминантный негативный белок T3SS, обладают повышенной устойчивостью к бактериальным патогенам по сравнению с модифицированными растениями (как описано в деталях в настоящем документе выше).
Следует учитывать, что когда речь идет о генетически модифицированных растениях или клетках растений, авторы настоящего изобретения также имеют в виду и потомство, полученное от этих растений и клеток.
Потомство, полученное при скрещивании или трансформации растенийможет быть отобрано по содержанию экзогенной мРНК и/или полипептида путем использования белковых проб (т.е. антител) или проб нуклеиновых кислот.
Еще одним способом проверки экспрессии доминантно негативных белков T3SS настоящего изобретения является измерение повышенной устойчивости к бактериальным патогенам с помощью инфицирования генетически модифицированных растений и растений дикого типа (т.е. немодифицированных растений того же сорта) и сравнения протекания заболевания в растениях (например, наблюдение увядания растений).
Настоящее изобретение также предусматривает способы увеличения устойчивости растений к бактериальным патогенам. Способ включает в себя: а) экспрессию в растении экзогенной нуклеотидной последовательности, кодирующей доминантно негативный белок T3SS и содержащей цис-регуляторный элемент, способный вызывать транскрипцию нуклеотидной последовательности в клетке растения; б) обработку растения бактериальным патогенном и в) сравнение протекания заболевания в трансгенных растениях с протеканием заболевания в растениях дикого типа, выращенных и обработанных бактериальным патогеном в тех же условиях.
Бактериальные патогены, описанные в настоящем документе, могут обуславливать множество заболеваний растений. Так, например, R. solanacearum может приводить к увяданию, P. agarici обуславливает болезнь слабых гимениальных пластинок(например, в культивируемых грибах), P. tolaasii может привести к бактериальной пятнистости (например, в культивируемых грибах), X. Campestris обуславливает появление черной гнили (например, в крестоцветных, таких, как капуста и арабидопсис), X. oryzae может привести к бактериальному ожогу (например, в рисе), Е. amylovora может привести к бактериальному ожогу (например, яблок и груш), Е. carotovora может привести к возникновению бактериальной мягкой гнили.
Так, например, при увядании симптомы оценивают ежедневно на протяжении двух-четырех недель (в слепом исследовании) с использованием шкалы заболеваемости от 0 до 4, где 0 обозначает отсутствие болезни, 1 обозначает увядание от 1% до 25% листьев, 2 обозначает увядание от 25% до 50% листьев, 3 обозначает увядание от 51% до 75% листьев и 4 обозначает увядание от 76% до 100% листьев.
Используемый в настоящем документе термин «примерно» обозначает ±10%.
Термины «включает», «включающий», «содержит», «содержащий» обозначают«содержит какой-то элемент, но может включать и другие элементы».
Термин «состоящий из» обозначает «включает только перечисленные элементы». Термин «состоящий главным образом из» обозначает, чтокомпозиция, способ или структура могут включать дополнительные элементы, стадии и/или части, но только если добавочные элементы, стадии и/или части не оказывают существенного влияния на основные и новые характеристики заявленной композиции, способа или структуры. При использовании единственного числа подразумевается также использование множественного числа, за исключением случаев, когда в контексте ясно указано иное. Например, термин «соединение» или «по меньшей мере, одно соединение» может обозначать множество соединений, включая смеси их друг с другом.
В настоящем документе различные варианты изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона представлено для удобства и краткости, и не должно восприниматься как жесткие ограничения настоящего изобретения. Соответственно, представление в виде диапазона должно рассматриваться как включающее все возможные поддиапазоны, а также все отдельные численные значения внутри диапазона. Например, описание диапазона от 1 до 6 должносчитаться включающим поддиапазоны, такие, как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., так же как и отдельные числа, например, 1, 2, 3, 4, 5, и 6. Это применяется независимо от ширины диапазона.
Когда в настоящем документе указан числовой диапазон, он предназначен для включения всех указанных чисел (дробных или целых) в пределах указанного диапазона. Фразы «в пределах/в диапазоне между» первым указанным числом и вторым указанным числом и «начиная с/от» первого указанного числа «до» второго указанного числа используют в настоящем документе взаимозаменяемо для включения первого и второго указанных чисел, а также всех дробных и целых значений внутри интервала.
Используемый в настоящем документе термин «способ» обозначает способы, средства, методики и процедуры для осуществления конкретной задачи, включая те способы, средства, методики и процедуры, которые либо известны, либо могут быть разработаны из известных способов, средств, методик и процедур, используемых специалистами химиками, фармакологами, биологами, биохимиками, медиками.
Следует понимать, что отдельные черты изобретения, описанные для ясности в контексте отдельных вариантов, могут также сочетаться друг с другом. И наоборот, различные признаки изобретения, описанные для краткости в рамках одного варианта изобретения, могут быть представлены раздельно в любой возможной подкомбинации и в любом другом возможном варианте изобретения. Конкретные черты, описанные в рамках различных вариантов изобретения, не должны восприниматься как существенные признаки этих вариантов, если только вариант изобретения не является нефункциональным без описанных элементов.
Различные варианты осуществления и аспекты настоящего изобретения, как это описано выше, и, как заявлено в формуле изобретения, находят экспериментальное подтверждение в следующих Примерах.
ПРИМЕРЫ
В данном разделе приводятся ссылки на следующие примеры, которые вместе с описанием изобретения выше иллюстрируют изобретение, не ограничивая его.
В целом номенклатура, использованная в настоящем документе и в лабораторных процедурах, проведенных для настоящего изобретения, включает молекулярные, биохимические, микробиологические техники и техники рекомбинантных ДНК. Эти методы подробно описаны в литературе. См., например, «Molecular Cloning: А laboratory Manual» Sambrook и др., (1989); «Current Protocols in Molecular Biology» книги I-III под ред. Ausubel, R.M., (1994); Ausubel et al., «Current Protocols in Molecular Biology», John Wiley and Sons, Baltimore, Maryland (1989); Perbal, «A Practical Guide to Molecular Cloning», John Wiley & Sons, New York (1988); Watson и др., «Recombinant DNA», Scientific American Books, New York; Birren и др. (ред.) «Génome Analysis: A Laboratory Manual Series», кн. 1-4, Cold Spring Harbor Laboratory Press, New York (1998); методики как указано в патентах США NO 4,666,828; 4,683,202; 4,801,531; 5,192,659 и 5,272,057; «Cell Biology: A Laboratory Handbook)), книги I-III Cellis, J. Ε., ред. (1994); «Current Protocols in Immunology» книги I-III Coligan J. Ε., ред. (1994); Stites et al. (eds), «Basic and Clinical Immunology» (8e издание), Appleton & Lange, Norwalk, CT (1994); Mishell и Shiigi (ред.), «Selected Methods in Cellular Immunology», W.H. Freeman and Co., New York (1980); доступные иммунологические анализы подробно описаны в патентах и научной литературе, см., например, патенты США NO 3,791,932; 3,839,153; 3,850,752; 3,850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771 и 5,281,521; «Oligonucleotide Synthesis» Gait, M.J., ред. (1984); "Nucleic Acid Hybridization)) Hames, B. D., и Higgins S. J., ред. (1985); «Transcription and Translation» Hames, В. D., и Higgins S. J., ред. (1984); «Animal Cell Culture» Freshney, R. I., ред. (1986); «Immobilized Cells and Enzymes» IRL Press, (1986); «A Practical Guide to Molecular Cloning» Perbal, В., (1984) и «Methods in Enzymology» тома 1-317, Academic Press; «PCR Protocols: A Guide To Methods And Applications», Academic Press, San Diego, CA (1990); Marshak и др., «Stratégies for Protein Purification and Characterization - A Laboratory Course Manual» CSHL Press (1996); которые все включены в настоящий документ в качестве ссылок в полном объеме. Прочие ссылки представлены в тексте документа. Методики, рассмотренные в этом документе, предполагаются известными для всех специалистов, работающих в данной области, и представлены для удобства читателя. Вся информация, содержащаяся здесь, включена в настоящий документ посредством ссылок во всей своей полноте.
ПРИМЕР 1
Получение и экспрессия интеркалирующих блокирующих элементов каналов иглы секреторной системы типа III (T3SS) Ralstonia solanacearum в растениях
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ ПРОЦЕДУРЫ
Синтез генов, экспрессия с использованием предпочтительных кодонов
Варианты системы T3SS-IBE были сконструированы на основании трехмерной модели иглы T3SS от Shigela flexneri (MxiH), описанной ранее [Deane et al., PNAS 2006 103:12529-33], представляющей гипотетическую модель природной структуры HrpY (Фиг.2A-F).
Гены интеркалирующего блокирующего элемента HrpY Ralstonia solanacearum (Rs) (hY-IBE) были синтезированы искусственным путем и кодоны были оптимизированы для использования в целевых растениях. Лидерные специфические пептиды секреции растений были слиты с 5'-концом каждого hY-IBE, чтобы транспортировать и локализовать зрелые белки в апопласте или клеточной стенке.
Клонирование в бинарном векторе и трансформация:
Синтетические фрагменты, состоящие из кодирующих областей IBE 1-6 с 5'-концевым нетранслируемым энхансером, были клонированы после 35S конститутивного промотора CaMV и перед терминатором NOS в вектор трансформации растений, основанный на плазмиде pBI121 (NCBI genebank ID# AF485783) с использованием сайтов рестрикции XbaI и SacI (Фиг.7А).
Протокол агротрансформации был использован для растений томата, арабидопсиса и эвкалипта так же, как было описано ранее для растений табака [см., например, Svab, Ζ., P. Hajdukiewicz and P. Maliga. (1975) Transgenic tobacco plants by co-cultivation of leaf disks with pPZP Agrobacterium binary vectors. "Methods in Plant Molecular Biology-A Laboratory Manual", P. Maliga, D. Klessig, A. Cashmore, W. Gruissem and J. Varner, eds. Cold Spring Harbor Press: 55- 77] и для растений эв калипта [Spokevicius AV., Van Beveren K., Leitch MA and Bossinger G. (2005) Agrobacterium-mediated in vitro transformation of wood-producing stem segments in eucalypts. Plant Cell Reports, Volume 23(9), 617-624].
Трансформация растений томата
Растения томата были трансформированы, как описано ранее [Qiu et al., Scientia Horticulturae 112 (2007) 172-175]. Кратко:
Растительный материал
Семена томата L. esculentum cv М82 были поверхностно простерилизованы в течение 30 с в 70% спирте, промыты стерилизованной водой в течение 10 с и затем простерилизованы в течение 10 мин в 1% растворе гипохлорита и дважды промыты стерилизованной водой на протяжении 30 мин перед высеванием в Среду А (как описано в Таблице 7 ниже). Семена были высажены в вегетационный контейнер Magenta и их проращивали при температуре 24°С при 16-часовом световом и 8-часовом темновом периоде. Семядоли наполовину выпрямившихся саженцев были использованы на 4Й-5Й день вегетации.
Среда, антибиотики и гормоны
Среду MSB5 (М0404) приобретали в виде порошка от Sigma Chemical Со. и хранили при 2-8°С. Сахарозу и глюкозу хранили при комнатной температуре. Канамицин, карбенциллин, цефотаксим, рифамицин, ZR, IAA, IBA были в дальнейшем использованы в питательных средах (как описано в Таблице 7 ниже)
Бактериальные штаммы и плазмиды
Для экспериментов по трансформации были использованы агробактерии, содержащие целевой ген. Бинарным вектором, использованным в данном исследовании, был рВН21, который содержал ген nptII как маркер селекции; штаммы агробактерий, применявшиеся в данной работе, содержали маркер для селекции на рифампицине. Бактерии выращивали в течение ночи на лизогенном бульоне с антибиотиками (рифампицин 30 мг/л, канамицин 100 мг/л), затем разводили до оптической плотности OD600=0,2 и доводили до ожидаемого показателя оптической плотности OD600 на лизогенном бульоне без антибиотиков. Бактериальные суспензии центрифугировали при 4000 об/мин в течение 15 минут в 50-миллилитровой пробирке Falcon. Бактерии ресуспендировали в среде с витамином В1 и использовали для экспериментов по кокультивации.
Протокол трансформации
Семядоли были приготовлены следующим образом: отрезание семядолей от саженцев было проделано с максимальной осторожностью для предотвращения повреждения тканей. Изолированные семядоли были разрезаны только на базальной и латеральной сторонах и помещены верхней стороной наверх в Среду В (описана в Таблице 7 выше). Примерно 50 эксплантатов были помещены в одну чашку Петри и поставлены на инкубацию на ночь. На следующий день эксплантаты были аккуратно погружены в культуру Agrobacterium inoculum на чашке Петри на 20 минут. Они были просушены на стерильной бумаге и перенесены в новую Среду В. Через 72 часа эксплантаты были перенесены на чашки Петри, содержащие Среду С (описана в Таблице 7 выше). После инкубации в течение следующих 72 часов эксплантаты были перенесены на селективную Среду D (описана в Таблице 7 выше). Каждые 3 недели эксплантаты пересевали на такую же среду. По прошествии примерно 6-8 недель проростки были вырезаны из питательной среды и перенесены на Среду Ε (описана в Таблице 7 выше). Частота трансформации была выражена как процентное соотношение числа семядолей, проростки от которых восстановились, к общему количеству инкубированных эксплантатов.
Экспрессия и подтверждение клонирования:
Интеграция T3SS-IBE в растительный геном и экспрессия этих генов была проанализирована с использованием стандартных методов молекулярной биологии, таких как ПЦР, ОТ-ПЦР [как описано ранее, см., например, Sambrook J. and Russell DW., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; 3rd edition (January 15, 2001)] со специфичными IBE праймерами 1-6 и вестерн-анализом с поликлональным антителом анти-IBE. В частности, праймерами для ПЦР, использованными для мутанта 1 HrpY, были прямой праймер TCTCTTTGCTCTCCTTTATAGCCCTAC и обратный праймер TCGCAGCGTCTAACATATCTTGTTGTC (SEQ ID NO:95-96, соответственно); праймерами для ПЦР, использованными для мутанта 2 HrpY, были прямой праймер GTCACATGGTTCGTTGGTGTACTCTTC и обратный праймер CATCTGGGTTCTATTCAGCGCATTTTG (SEQ ID NO:97-98, соответственно); а праймерами для ПЦР, использованными для мутанта 6 HrpY, были прямой праймер GTCTTGTTCCTGTCTACCTTGCTCC и обратный праймер GAGATTAGGTCTTTCGCAGCTTTGG (SEQ ID NO:93-94, соответственно).
Биотестирование:
Трансгенные растения были подвергнуты биотестированию для оценки уровня устойчивости каждой трансгенной линии по сравнению с диким типом (т.е. не экспрессирующим ген IBE). Применяли три метода биологического тестирования:
1. Пропитанная почва. Неповрежденные растения возрастом 19-21 день заражали путем полива почвы бактериальной суспензией до финальной плотности примерно 1×108 КОЕ/г почвы с последующей инкубацией при 28°С.Контрольные растения подвергли ложному заражению стерильной водой. Проявление симптомов заражения регистрировали ежедневно оценщиком, не осведомленным о принадлежности растения к контрольной или экспериментальной группе, по шкале заболевания от 0 до 4, где 0 указывает на отсутствие болезни, 1 соответствует 1-25% увядания листьев, 2 соответствует 25-50% увядания листьев, 3 соответствует 51-75% увядания листьев, 4 соответствует 76-100% увядания листьев. Каждый опыт включал 16 растений на экспериментальную группу, и опыты были повторены, по меньшей мере, 3 раза.
2. Заражение черешков. Нижние листья неповрежденных растений возрастом 19-21 день отрезали и 2 мкл бактериальной суспензии с финальной концентрацией 1×108 КОЕ/мл капали на срез черешка. Контрольные растения подвергли ложному заражению стерильной водой. Проявление симптомов заражения регистрировали ежедневно оценщиком, не осведомленным о принадлежности растения к контрольной или экспериментальной группе, по шкале заболевания от 0 до 4, где 0 указывает на отсутствие болезни, 1 соответствует 1-25% увядания листьев, 2 соответствует 25-50% увядания листьев, 3 соответствует 51-75%) увядания листьев, 4 соответствует 76-100%) увядания листьев. Каждый опыт включал 16 растений на экспериментальную группу, и опыты были повторены, по меньшей мере, 3 раза.
3. Заражение стебля. Неповрежденные растения возрастом 19-21 день заражали вертикальным надрезанием стебля стерильным ножом. В надрез длиной 1 см и глубиной 0,5 см инъецировали 100 мкл бактериальной суспензии с финальной плотностью примерно 1×108 КОЕ/мл. Контрольные растения подвергли ложному заражению стерильной водой. Проявление симптомов заражения регистрировали ежедневно оценщиком, не осведомленным о принадлежности растения к контрольной или экспериментальной группе, по шкале заболевания от 0 до 4, где 0 указывает на отсутствие болезни, 1 соответствует 1-25% увядания листьев, 2 соответствует 25-50% увядания листьев, 3 соответствует 51-75% увядания листьев, 4 соответствует 76-100% увядания листьев. Каждый опыт включал 16 растений на экспериментальную группу, и опыты были повторены, по меньшей мере, 3 раза.
Результаты
Изобретатели сконструировали экспрессируемые растением блокирующие элементы канала иглы секреторной системы типа III (T3SS) Ralstonia solanacearum (Rs) (интеркалирующие блокирующие элементы T3SS или T3SS-IBE) для защиты растений от увядания, используя структурные модификации белка HrpY, формообразующего мономера иглы. Структурно модифицированный HrpY (SEQ ID NO:2, 4, 6, 8, 10 и 12, также изображенный в деталях на Фиг.2A-F, 3A-D, 4А-С, 5А-С и 6A-D), экспрессированный в трансгенных растениях (сельскохозяйственных и древесных), внедряется в нативные пили Rs, дезактивируя их функционально и предотвращая либо снижая заражение бактериями Rs у трансгенных растений по сравнению с растениями дикого типа. Предполагается, что трансгенное растение, которое экспрессирует T3SS-IBE, выделяет T3SS-IBE наружу из клетки, где T3SS-IBE собирается в пилях атакующих Rs, приводя пили в нефункциональное или нефункциональное состояние. У бактерий со структурно модифицированными белками растительного происхождения интеркалировавшими в пили, T3SS перейдут в нефункциональное состояние и таким образом не будут способны преодолеть природную защиту растения. Такие трансгенные устойчивые растения могут противостоять инфицированию Rs.
Варианты T3SS-IBE были сконструированы на основании трехмерной модели T3SS иглы бактерии Shigela flexneri (MxiH), как описано ранее [Deane et al., PNAS 2006 103: 12529-33]. На основании этой модели были спланированы структурные модификации HrpY Ralstonia, приводящие к модифицированным мономерам T3SS иглы, которые интеркалируют в структуру иглы и блокируют канал этой иглы, через который пектиназы, разрушающие растительную клеточную стенку, эндоглюканазы, вирулентные экзополисахариды и эффекторные белки перемещаются внутрь клеточной стенки хозяина или сквозь нее (Фиг.1А-С). Таким образом, структурно модифицированные пили включают в себя белковые домены, которые расположены в канале пили и предположительно вследствие этого способны функционально и физически блокировать канал. Такие структурно нестабильные пили также заканчивают свою сборку раньше, что приводит к относительно коротким пилям, что усугубляет нарушение их функциональности и способности переносить белки в растение. Эта рациональная модель основана на сохранении и использовании нативных сайтов взаимодействий между субъединицами HrpY при включении трансляции гибридного белка, блокирующего канал, и/или деформирующего структур альфа-спиралей. Растительные сигналы секреции были включены в T3SS-IBE, чтобы сделать возможным выделение из растительных клеток в межклеточное пространство. Как описано в разделе «Материалы и экспериментальные процедуры» выше, устойчивые к увяданию (WiltR) растения томата были сконструированы путем трансформации растений томата конструктами, несущими мутанты HrpY 1, 2 или 6 Ralstonia solanacearum (SEQ ID NO:1, 3 и 11 соответственно). Эти растения были в дальнейшем проанализированы геномной ПЦР и полуколичественной ОТ-ПЦР с использованием специфических праймеров для мутанта 1 HrpY (SEQ ID NO:95-96), мутанта 2 HrpY (SEQ ID NO:97-98) или мутанта 6 HrpY (SEQ ID NO:93-94). Была определена экспрессия мутантов 1, 2 или 6 HrpY в трансформированных растениях томата (см. Фиг.11А-С, 12А-С и 10А-С соответственно).
ПРИМЕР 2
Получение и экспрессия T3SS-IBE различных бактерий в растениях В добавление к IBE, описанным в Примере 1 выше, с использованием описанных выше методов для других грамотрицательных бактерий были разработаны и идентифицированы другие IBE. Например, IBE были разработаны картированием областей связывания структурообразующих белков пилей, определением пептидов-кандидатов, которые связываются с нативными пилями и интегрируют в них во время образования последних in vivo, модифицированием пептида-кандидата для перевода канала в состояние неспособности к выделению эффекторных белков и получением модифицированные IBE кандидатов.
Модификации могут включать в себя модификации, основанные на любом из следующих принципов:
1. Нативные белки могут быть модифицированы на основании одного или более из нескольких различных подходов, включая следующие:
2. Добавление траснлируемой слитой последовательности к N-концевой области нативного белка как в IBE 1, 2 и 3 с (IBE 1&3) или без (IBE 2) и перед (IBE 1) или после (IBE 3) нативного N-концевого домена (см. Фиг.3A-D, 4А-С и 7С).Добавление траснлируемой слитой последовательности к С-концевой области нативного белка как в IBE 4 с аминокислотным мостиком, разрешающим вращательное движение транслируемого слитого фрагмента, или без него (см. Фиг.5А-С и 7С). Подобный мостик может состоять, например, из одного или нескольких остатков глицина или аланина.
3. Добавление аминокислоты пролина в случайно выбранные точки по всей длине последовательности структурообразующего блока, как в IBE 5 или 6 (см. Фиг.6A-D и 7С).
4. Пентапептидные вставки.
ПРИМЕР 3
Получение и экспрессия модифицированных белков транслоконов Ralstonia solanacearum (PopF1) в растениях
Другой подход, примененный изобретателями, состоит в сверхэкспрессии модифицированных белков и белков дикого типа (wt) транслокона Rs (например, PopF1 или PopF2) в трансгенных растениях. PopF1 и PopF2 являются структурообразующими элементами ворот иглы и играют важную роль в вирулентности и реакции гиперчувствительности у растений дикого типа Wt, а модифицированные белки PopF1/F2 останавливают сборку T3SS вследствие взаимодействия с незрелой иглой. Контролируемое удлинение иглы бактерий и белки транслокона в норме выделяются на завершающей стадии процесса. Трансгенные белки транслокона, которые взаимодействуют с иглой преждевременно, вмешиваются в контролируемую последовательную сборку T3SS и дезактивируют ее. Таким образом, модифицированные белки PopF1/F2 включаются в ворота транслокона и блокируют последние, либо деформируют их структуру, вызывая их нефункциональность. Вместе взятые, настоящие сведения обусловливают экспорт белков дикого типа и модифицированных белков PopF1 в апопласт/клеточную стенку трансгенными растениями.
Хотя изобретение было описано с конкретными вариантами его осуществления, очевидно, что многочисленные альтернативы, модификации и вариации будут очевидны специалистам в данной области. Соответственно существует намерение охватить все возможные альтернативы, модификации и вариации, которые соответствуют сущности и объему настоящей заявки.
Все публикации, патенты и заявки на патенты, упомянутые в этом описании и включены во всей своей полноте в настоящее описание в той же степени, как если бы каждая отдельная публикация, патент или заявка на патент была специфично и индивидуально отмечена как включенная в настоящее описание посредством ссылки. В добавление к этому цитирование или идентификация любого источника в данной заявке не должно быть истолковано как допущение, что такой источник был доступен в качестве предшествующего уровня техники относительно настоящей заявки. До той степени, в какой использованы заголовки разделов, они не должны быть истолкованы как ограничивающие изобретение.
Реферат
Изобретение относится к области биохимии, в частности к вектору экспрессии нуклеиновой кислоты, содержащему нуклеотидную последовательность, кодирующую секретируемый доминантно негативный белок HrpY. Также раскрыты выделенный полинуклеотид, содержащий последовательность, кодирующую указанный белок, растительная клетка, которая экспрессирует указанный белок, генетически модифицированное растение, содержащее заявленный вектор экспрессии. Раскрыты способы получения указанного растения, оценки устойчивости указанного растения. Изобретение позволяет получить модифицированное растение, обладающее устойчивостью к Ralstonia solanacearum. 9 н. и 6 з.п. ф-лы, 12 ил., 7 табл., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Патоген-индуцируемый синтетический промотор

Комментарии