Системы экспрессии белка - RU2539793C2
Код документа: RU2539793C2
Чертежи







































Описание
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в целом относится к способам и материалам, и в частности, к последовательностям вирусного происхождения, для повышения экспрессии генов в растениях и других эукариотических клетках, например, гетерологичных генов, которые кодируют представляющие интерес белки.
УРОВЕНЬ ТЕХНИКИ
Комовирусы (comoviruses) (CPMV)
Комовирусы представляют собой РНК-вирусы с геномом, состоящим из двух частей. Сегменты РНК-генома комовируса называются RNA-1 и RNA-2. RNA-1 кодирует VPg, белки репликазу и протеазу (Lomonossoff & Shanks, 1983). Репликаза необходима вирусу для репликации генома вируса. RNA-2 комовируса, вируса мозаики коровьего гороха (CPMV, cowpea mosaic virus), кодирует белки 58К и 48К, а также два белка оболочки вируса, L и S.
Инициация трансляции RNA-2 всех комовирусов происходит в двух разных сайтах инициации, расположенных в одной и той же триплетной рамке считывания, что приводит к синтезу двух белков с совпадающими карбоксильными концами. Данное явление двойной инициации возникает вследствие «пропускающего сканирования» ("leaky scanning") рибосомами во время трансляции.
5'-концевые инициирующие кодоны (старт-кодоны) (AUG) в RNA-2 CPMV находятся в положениях 115, 161, 512 и 524. Старт-кодоны в положениях 161 и 512 находятся в одной триплетной рамке считывания. Инициация в старт-кодоне в положении 161 приводит к синтезу полипротеина 105K, а инициация в старт-кодоне в положении 512 обеспечивает синтез полипротеина 95K. Поскольку синтез обоих полипротеинов заканчивается в одном и том же терминирующем кодоне (стоп-кодоне) в положении 3299, белки 105K и 95K являются белками с совпадающими карбокси-концами. Кодон AUG в положении 524 может выступать в качестве инициатора, в случае если AUG в положении 512 делегирован. Однако в присутствии AUG 512 он не выполняет данную функцию, а только кодирует аминокислоту метионин (Holness et al., 1989; Wellink et al., 1993). Старт-кодон в положении 115 не является необходимым для репликации вируса (Wellink et al., 1993). Белки 105K и 95K, кодируемые сегментом генома RNA-2 CPMV, представляют собой основные продукты трансляции, впоследствии расщепляемые в результате кодируемой RNA-1 протеолитической активности с образованием либо белка 58K, либо белка 48K в зависимости от того, какой полипротеин, 105K или 95K, подвергается процессингу, и двух белков оболочки вируса, L и S. Инициация трансляции в старт-кодоне в положении 512 в CPMV более эффективна, чем инициация в положении 161 и приводит к образованию большего количества полипротеина 95K, чем полипротеина 105K.
Старт-кодон в положении 115 в RNA-2 CPMV лежит в 3'-5' направлении («выше», upstream) от сайтов инициации в положениях 161 и 512 и находится в другой рамке считывания. Поскольку данный старт-кодон находится «в фазе» с терминирующим кодоном в положении 175, инициация в данном сайте может привести к образованию пептида, содержащего 20 аминокислот. Однако на сегодняшний день образование указанного пептида не было обнаружено.
Необходимость сохранения рамки между кодонами AUG
Эксперименты с мутагенезом продемонстрировали, что сохранение рамки между сайтами инициации в положениях 161 и 512 в RNA-2 CPMV необходимо для эффективной репликации RNA-2, осуществляемой кодируемой RNA-1 репликазой (Holness et al., 1989; van Bokhoven et al., 1993; Rohll et al., 1993; Wellink et ql., 1993). Данная необходимость ограничивает длину последовательностей, которые могут быть встроены выше инициирующего кодона 512 в векторы экспрессии на основании RNA-2 CPMV (см. ниже), что затрудняет клонирование чужеродных генов в указанные векторы. Например, она препятствует применению полилинкеров, т.к. их использование обычно изменяет открытую рамку считывания (OPC, ORF) между данными сайтами инициации.
Векторы CPMV
CPMV послужил основой для создания векторных систем, подходящих для получения гетерологичных полипептидов в растениях (Liu et al., 2005; Sainsbury et al., 2007). Данные системы основаны на модификации RNA-2, но различаются в зависимости от того, используются ли полноразмерные варианты или варианты, содержащие делеции. Однако в обоих случаях репликацию модифицированной RNA-2 осуществляют путем совместной инокуляции с RNA-1. Системы экспрессии на основе полноразмерного варианта RNA-2 включают слияние чужеродного белка с С-концом полученных из RNA-2 полипротеинов. Высвобождение N-концевого полипептида опосредуется действием каталитической пептидной последовательности 2А из вируса ящура (Gopinath et al., 2000). Полученные молекулы RNA-2 способны распространяться как внутри растения, так и между растениями. Данная стратегия была использована для экспрессии ряда рекомбинантных белков, таких как коровий антиген вируса гепатита В (HBcAg) и малые иммунные белки (SIP), в растениях коровьего гороха (Mechtcheriakova et al., 2006; Monger et al., 2006; Alamillo et al., 2006). Несмотря на успешный результат, использование полноразмерного вирусного вектора обладает недостатками, связанными с ограничениями по размеру встраиваемых последовательностей и вопросами биобезопасности.
Для решения указанных проблем недавно была разработана система, основанная на содержащем делеции варианте RNA-2 CPMV (Canizares et al., 2006). В данной системе удалена область RNA-2, кодирующая двигательный белок и оба белка оболочки. Однако молекулы, содержащие делеции, сохраняют цис-действующие последовательности, необходимые для репликации, осуществляемой кодируемой RNA-1 репликазой, что обеспечивает поддержание высоких уровней амплификации гена при отсутствии сопутствующей вероятности заражения окружающей среды модифицированным вирусом. В случае включения в инокулят в дополнение к RNA-1 супрессора сайленсинга генов, такого как HcPro из вируса картофеля Y (PVY, Brigneti et al., 1998), вектор CPMV, содержащий делеции, может быть использован в качестве системы временной (транзиентной) экспрессии (WO/2007/135480 Bipartite System, Method And Composition For The Constitutive And Inducible Expression Of High Levels Of Foreign Proteins In Plants; также Sainsbury et al., 2009). Однако в отличие от ситуации с вектором на основе полноразмерной RNA-2, репликация ограничена инокулированными листьями. Описанные векторы CPMV используют для экспрессии многоцепочечных комплексов, состоящих из одного вида полипептида.
Также было показано, что множественные копии векторов на основе полноразмерных или содержащих делеции вариантов RNA-2 CPMV подходят для получения гетеромерных белков в растениях (Sainsbury et al., 2008). Путем совместной инфильтрации двух полноразмерных конструкций РНК-2, содержащих разные маркерные гены, в Nicotiana benthamiana в присутствии RNA-1 было показано, что два чужеродных белка могут быть эффективно экспрессированы в пределах одной клетки в инокулированной ткани. Кроме того, указанные белки могут быть одновременно локализованы в одних и тех же субклеточных компартментах, что является обязательным условием для образования гетеромеров.
Также была исследована пригодность различных векторов RNA-2 CPMV для экспрессии гетеромерных белков в растениях. Встраивание тяжелых и легких цепей IgG в полноразмерные и содержащие делеции варианты RNA-2 показало, что оба подхода приводили к накоплению полноразмерных молекул IgG в инокулированной ткани, но уровни были значительно выше при использовании содержащих делеции векторов RNA-2. Соответственно, способность полноразмерных конструкций RNA-2 к системному распространению, по-видимому, не характерна для получения гетеромерных белков, и использование содержащих делеции вариантов RNA-2 очевидно является предпочтительным, в частности, поскольку они также обладают преимуществами с точки зрения биобезопасности.
Таким образом, известные основанные на CPMV векторные системы представляют собой подходящие инструменты для экспрессии гетерологичного гена, который кодирует представляющий интерес белок в растениях. Однако в данной области техники по-прежнему существует необходимость в разработке оптимизированных векторных систем, которые улучшают, например, выход экспрессированных гетерологичных белков и удобство применения указанного вектора.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения неожиданно обнаружили, что мутация старт-кодона в положении 161 в векторе RNA-2 CPMV существенно повышает уровни экспрессии белка, кодируемого геном, встроенным после старт-кодона в положении 512. Указанные уровни экспрессии белка повышались примерно в 20-30 раз по сравнению с экспрессией этого же белка из вектора RNA-2 CPMV, отличающегося только тем, что старт-кодон в положении 161 был интактным (Sainsbury and Lomonossoff, 2008). Настоящее изобретение позволяет получать высокие уровни чужеродных белков при отсутствии необходимости репликации вируса.
Авторы настоящего изобретения также обнаружили, что мутация старт-кодона в положении 161 устраняет необходимость сохранения рамки между положением мутированного старт-кодона в положении 161 и старт-кодоном в положении 512, что позволяет встраивать последовательности любой длины после мутированного старт-кодона в положении 161. Это обеспечивает особенные преимущества, поскольку позволяет встраивать полилинкеры любой длины в векторы RNA-2 после мутированного старт-кодона, которые затем могут быть использованы для облегчения клонирования представляющего интерес гена в вектор.
Кроме того, авторы настоящего изобретения обнаружили, что несмотря на увеличение экспрессии белка, растения, трансформированные вектором RNA-2 CPMV, содержащим мутированный старт-кодон в положении 161, выглядели более здоровыми, т.е. демонстрировали менее значительный некроз по сравнению с растениями, трансформированными известными векторами RNA-2 CPMV. Здоровье растений представляет собой фактор, имеющий большое значение в экспрессии белков из растений, поскольку здоровые растения живут в течение более длительных периодов времени. Кроме того, здоровье растений также имеет большое значение в очистке белков из растений, поскольку таннины, вырабатываемые вследствие некроза, могут затруднять очистку белка (Sainsbury and Lomonossoff, 2008).
Соответственно, настоящее изобретение относится к улучшенным системам получения белка и к способам, основанным на модифицированных последовательностях двухкомпонентного вируса.
Таким образом, в соответствии с различными аспектами настоящего изобретения предложена или использована последовательность энхансера экспрессии, являющаяся производной (или обладающая гомологией с) сегмента генома RNA-2 двухкомпонентного РНК-вируса, такого как комовирус, в которой целевой сайт инициации был подвергнут мутации.
Согласно настоящему изобретению также предложены способы повышения экспрессии или активности повышения трансляции последовательности, полученной из сегмента генома RNA-2 двухкомпонентного вируса, включающие осуществление мутации расположенного в указанной последовательности целевого сайта инициации.
Некоторые конкретные определения и варианты осуществления настоящего изобретения будут описаны более подробно.
В настоящем описании последовательности энхансера экспрессии («энхансерные» последовательности или энхансерные элементы) представляют собой последовательности, являющиеся производными (или обладающие гомологией с) сегмента генома RNA-2 двухкомпонентного РНК-вируса, такого как комовирус, в которых целевой сайт инициации был подвергнут мутации. Указанные последовательности могут усиливать экспрессию в прямом направлении (downstream) гетерологичной ОРС, к которой они присоединены. Без ограничения, считают, что указанные последовательности в случае их присутствия в транскрибируемой РНК могут усиливать трансляцию гетерологичной ОРС, к которой они присоединены.
В настоящем описании «целевой сайт инициации» представляет собой сайт инициации (старт-кодон) в сегменте RNA-2 генома двухкомпонентного вируса дикого типа (например, комовируса), из которого получают рассматриваемую последовательность энхансера, при этом указанный сайт инициации выступает в качестве сайта инициации для получения (трансляции) более длинного из двух белков с совпадающими карбокси-концами, кодируемых сегментом генома RNA-2 дикого типа.
Как описано выше, образование более длинного из двух белков с совпадающими карбокси-концами, кодируемых RNA-2 CPMV, белка 105K, инициируется в сайте инициации в положении 161 в сегменте генома RNA-2 CPMV дикого типа. Таким образом, целевой сайт инициации в последовательностях энхансеров, полученных из сегмента генома RNA-2 CPMV, представляет собой сайт инициации в положении 161 в RNA-2 CPMV дикого типа.
Мутации вокруг старт-кодона в положении 161 могут оказывать тот же (или близкий) эффект, что и мутация самого старт-кодона в положении 161, например нарушение окружения данного старт-кодона может означать, что указанный старт-кодон «пропускается» чаще.
Соответственно, согласно одному из аспектов настоящего изобретения целевой сайт инициации может быть опосредованно «подвергнут мутации» путем осуществления мутации одного или более нуклеотидов, расположенных выше и/или ниже указанного целевого сайта инициации, но с сохранением целевого сайта инициации дикого типа, при этом эффект мутации данных нуклеотидов совпадает с или близок эффекту, наблюдаемому при мутировании самого целевого сайта инициации.
Поскольку целевые сайты инициации выступают в качестве сайта инициации для получения более длинного из двух белков с совпадающими карбокси-концами, кодируемых сегментом генома RNA-2 дикого типа, следовательно, указанные целевые сайты инициации находятся в рамке (в фазе) со вторым сайтом инициации в том же сегменте генома RNA-2 дикого типа, который служит сайтом инициации для получения более короткого из двух белков с совпадающими карбокси-концами, кодируемых RNA-2 дикого типа. Два сайта инициации находятся в рамке в том случае, если они находятся в одной и той же триплетной рамке считывания.
Целевой сайт инициации в последовательностях энхансеров, полученных из сегмента генома RNA-2 CPMV дикого типа, т.е. сайт инициации в положении 161, находится в рамке с сайтом инициации в положении 512, выполняющим функцию сайта инициации для получения более короткого из двух белков с совпадающими карбокси-концами, кодируемых RNA-2 CPMV (белок 95K) в сегменте генома RNA-2 CPMV дикого типа.
Таким образом, целевой сайт инициации расположен выше (5') второго сайта инициации в сегменте генома RNA-2 дикого типа, из которого получают последовательность энхансера, выполняющую функцию сайта инициации для получения более короткого из двух полипротеинов с совпадающими карбокси-концами, кодируемых сегментом генома RNA-2 дикого типа. Кроме того, целевой сайт инициации также может быть расположен ниже (3') третьего сайта инициации в геноме RNA-2 дикого типа, из которого получают последовательность энхансера. В CPMV указанный целевой сайт инициации, т.е. сайт инициации в положении 161, расположен выше второго сайта инициации в положении 512, выполняющего функцию сайта инициации для получения белка 95К, и ниже третьего сайта инициации в положении 115.
Соответственно, целевой сайт инициации в последовательности энхансера, полученной из сегмента генома RNA-2 двухкомпонентного вируса, представляет собой первый из двух сайтов инициации для получения двух белков с совпадающими карбокси-концами, кодируемых RNA-2 дикого типа. Термин «первый» в данном контексте относится к сайту инициации, расположенному ближе к 5'-концу сегмента генома RNA-2 дикого типа.
Если это желательно, мутации может быть подвергнуто несколько сайтов инициации в последовательности. Например, «третий» сайт инициации в положении 115 (или соответствующий положению 115) также может быть удален или изменен. Было показано, что удаление AUG 115 в дополнение к удалению AUG 161 дополнительно усиливает экспрессию (Sainsbury and Lomonossoff, 2008).
Последовательности энхансеров согласно настоящему изобретению основаны на модифицированных последовательностях из сегментов генома RNA-2 двухкомпонентных РНК-вирусов.
В настоящем описании двухкомпонентный вирус или вирус с геномом, состоящим из двух частей, может являться членом семейства Comoviridae. Все виды семейства Comoviridae, видимо, кодируют белки с совпадающими карбокси-концами. Виды семейства Comoviridae включают Комовирусы (Comovirus), Nepovirus, Fabavirus, Cheravirus и Sadwavirus. Комовирусы включают Cowpea mosaic virus (CPMV, вирус мозаики коровьего гороха), Cowpea severe mosaic virus (CPSMV, вирус тяжелой мозаики коровьего гороха). Squash mosaic virus (SqMV, вирус мозаики тыквы), Red clover mottle virus (RCMV, вирус крапчатости красного клевера). Bean pod mottle virus (BPMV, вирус пятнистости стручков бобовых). Предпочтительно двухкомпонентный вирус (или комовирус) представляет собой CPMV.
Последовательности сегментов генома RNA-2 данных комовирусов и некоторых конкретных штаммов доступны из базы данных NCBI (Национального Центра Биотехнологической Информации) под входящими номерами, указанными в скобках: RNA-2 вируса мозаики коровьего гороха (NC_003550), RNA-2 вируса тяжелой мозаики коровьего гороха (NC_003544), RNA-2 вируса мозаики тыквы (NC_003800), RNA-2 штамма Kimble вируса мозаики тыквы (AF059533), RNA-2 штамма Arizona вируса мозаики тыквы (AF059532), RNA-2 вируса крапчатости красного клевера (NC_003738), RNA-2 вируса пятнистости стручков бобовых (NC_003495), RNA-2 штамма K-Hopkins1 вируса пятнистости стручков бобовых (AF394609), RNA-2 штамма K-Hancock1 вируса пятнистости стручков бобовых (AF394607), андийского вируса крапчатости картофеля (APMoV: L16239) и вируса мозаики редиса (RaMV; АВ295644). Существуют также частичные последовательности RNA-2, полученные из bean rugose mosaic virus (вирус крапчатой мозаики бобовых) (BRMV; AF263548) и предполагаемого члена вида Комовируса, turnip ringspot virus (вирус кольцевой пятнистости репы) (EF 191015). Также доступны многочисленные последовательности из других видов семейства Comoviridae.
На сегодняшний день у всех исследованных комовирусов обнаружили наличие двух альтернативных старт-кодонов для экспрессии полипротеинов с совпадающими карбокси-концами из сегментов генома РНК. В частности, известно, что сегменты RNA-2 генома CPMV, CPSMV, BPMV, SqMV и RCMV содержат два альтернативных инициирующих кодона для экспрессии полипротеинов с совпадающими карбокси-концами.
Соответственно, целевые сайты инициации в других комовирусах, эквивалентные сайту инициации в положении 161 в сегменте RNA-2 дикого типа CPMV (т.е. соответствуют ему), могут быть идентифицированы способами, известными в данной области техники. Например, целевые сайты инициации могут быть идентифицированы путем совмещения последовательностей между последовательностью сегмента генома RNA-2 дикого типа CPMV и последовательностью сегмента генома RNA-2 другого комовируса. Указанные совмещения последовательностей могут быть использованы для идентификации целевого сайта инициации в последовательности сегмента RNA-2 генома комовируса путем идентификации сайта инициации, который по меньшей мере при совмещении расположен рядом или в том же положении, что и целевой сайт инициации в положении 161 в RNA-2 CPMV дикого типа.
Целевые сайты инициации в других комовирусах также могут быть идентифицированы путем определения старт-кодона, выполняющего функцию сайта инициации для синтеза более длинного из двух белков с совпадающими карбокси-концами, кодируемых сегментом RNA-2 генома комовируса дикого типа. Данный подход также может быть использован в комбинации с совмещением, как описано выше, т.е. данный подход может быть использован для подтверждения того, что сайт инициации комовируса, идентифицированный посредством совмещения с RNA-2 CPMV, представляет собой целевой сайт инициации.
Конечно, указанные выше способы также могут быть использованы для идентификации сайтов инициации в сегментах RNA-2 геномов других комовирусов, эквивалентных сайту инициации в положении 512 в сегменте RNA-2 генома CPMV дикого типа. Однако вместо идентификации старт-кодона, выполняющего функцию сайта инициации для синтеза более длинного из двух белков с совпадающими карбокси-концами, кодируемых сегментом RNA-2 генома комовируса дикого типа, идентифицируют старт-кодон, выполняющий функцию сайта инициации для синтеза более короткого из двух белков с совпадающими карбокси-концами, кодируемых сегментом генома RNA-2 комовируса дикого типа.
После идентификации двух сайтов инициации RNA-2 комовируса, вероятно эквивалентных сайтам инициации в положениях 161 и 512 в RNA-2 CPMV, идентификация целевого сайта инициации может быть подтверждена путем проверки того, что указанные два сайта инициации расположены в одной и той же рамке, т.е. в одной и той же триплетной рамке считывания, т.к. только в этом случае они могут выполнять функцию сайтов инициации для получения двух белков с совпадающими карбокси-концами.
В одном из вариантов реализации настоящего изобретения последовательность энхансера содержит нуклеотиды 1-512 сегмента генома RNA-2 CPMV (см. Таблицу 1), в которой целевой сайт инициации в положении 161 был подвергнут мутации. В другом варианте реализации настоящего изобретения последовательность энхансера содержит эквивалентную последовательность другого комовируса, в которой целевой сайт инициации, эквивалентный старт-кодону в положении 161 CPMV, был подвергнут мутации. Целевой сайт инициации может быть подвергнут мутации путем замены, делеции или встраивания. Предпочтительно, целевой сайт инициации подвергают мутации путем точечной мутации.
В альтернативных вариантах реализации настоящего изобретения последовательность энхансера содержит нуклеотиды 10-512, 20-512, 30-512, 40-512, 50-512, 100-512, 150-512, 1-514, 10-514, 20-514, 30-514, 40-514, 50-514, 100-514, 150-514, 1-511, 10-511, 20-511, 30-511, 40-511, 50-511, 100-511, 150-511, 1-509, 10-509, 20-509, 30-509, 40-509, 50-509, 100-509, 150-509, 1-507, 10-507, 20-507, 30-507, 40-507, 50-507, 100-507 или 150-507 последовательности сегмента RNA-2 генома комовируса, содержащей мутированный целевой сайт инициации. В других вариантах реализации настоящего изобретения последовательность энхансера содержит нуклеотиды 10-512, 20-512, 30-512, 40-512, 50-512, 100-512, 150-512, 1-514, 10-514, 20-514, 30-514, 40-514, 50-514, 100-514, 150-514, 1-511, 10-511, 20-511, 30-511, 40-511, 50-511, 100-511, 150-511, 1-509, 10-509, 20-509, 30-509, 40-509, 50-509, 100-509, 150-509, 1-507, 10-507, 20-507, 30-507, 40-507, 50-507, 100-507 или 150-507 последовательности сегмента RNA-2 генома CPMV, приведенной в Таблице 1, в которой целевой сайт инициации в положении 161 в сегменте RNA-2 генома CPMV дикого типа был подвергнут мутации.
В других вариантах реализации настоящего изобретения последовательность энхансера содержит нуклеотиды 1-500, 1-490, 1-480, 1-470, 1-460, 1-450, 1-400, 1-350, 1-300, 1-250, 1-200 или 1-100 последовательности сегмента RNA-2 генома комовируса, содержащего мутированный целевой сайт инициации.
В альтернативных вариантах реализации настоящего изобретения последовательность энхансера содержит нуклеотиды 1-500, 1-490, 1-480, 1-470, 1-460, 1-450, 1-400, 1-350, 1-300, 1-250, 1-200 или 1-100 последовательности сегмента RNA-2 генома CPMV, приведенной в Таблице 1, в которой целевой сайт инициации в положении 161 в сегменте RNA-2 генома CPMV дикого типа был подвергнут мутации.
Последовательности энхансеров, содержащие по меньшей мере 100 или 200, по меньшей мере 300, по меньшей мере 350, по меньшей мере 400, по меньшей мере 450, по меньшей мере 460, по меньшей мере 470, по меньшей мере 480, по меньшей мере 490 или по меньшей мере 500 нуклеотидов последовательности сегмента RNA-2 генома комовируса с мутированным целевым сайтом инициации, также представляют собой варианты реализации настоящего изобретения.
Кроме того, последовательности энхансеров, содержащие по меньшей мере 100 или 200, по меньшей мере 300, по меньшей мере 350, по меньшей мере 400, по меньшей мере 450, по меньшей мере 460, по меньшей мере 470, по меньшей мере 480, по меньшей мере 490 или по меньшей мере 500 нуклеотидов последовательности сегмента генома RNA-2 CPMV, приведенной в Таблице 1, в которых целевой сайт инициации в положении 161 в сегменте RNA-2 генома CPMV дикого типа был подвергнут мутации, также представляют собой варианты реализации настоящего изобретения.
Альтернативные варианты реализации настоящего изобретения представляют собой последовательности энхансеров, обладающие по меньшей мере 99%, 98%, 97%, 96%, 95%, 90%, 85%, 80%, 75%, 70%, 65%, 60%, 55% или 50% идентичностью с последовательностью сегмента RNA-2 генома CPMV, представленной в Таблице 1, в которых целевой сайт инициации в положении 161 в сегменте RNA-2 генома CPMV дикого типа был подвергнут мутации.
Термины «процентное сходство», «процентная идентичность» и «процентная гомология» применительно к конкретной последовательности используются, как указано в программе GCG Университета Висконсина. Таким образом, последовательности энхансеров могут специфично гибридизоваться с комплементарной последовательностью последовательности сегмента RNA-2 генома CPMV, приведенной в Таблице 1, при условии, что целевой сайт инициации, соответствующий положению 161 в сегменте RNA-2 генома CPMV дикого типа, был подвергнут мутации.
Термин «специфично гибридизоваться» относится к ассоциации двух одноцепочечных молекул нуклеиновой кислоты, имеющих последовательность, достаточно комплементарную для обеспечения указанной гибридизации в заранее определенных условиях, как правило используемых в данной области техники (иногда называемая «по существу комплементарной»). В частности, указанный термин относится к гибридизации олигонуклеотида с по существу комплементарной последовательностью, содержащейся в молекуле одноцепочечной ДНК или РНК согласно настоящему изобретению, за исключением гибридизации олигонуклеотида с одноцепочечными нуклеиновыми кислотами некомплементарной последовательности. Термин «комплементарный» относится к естественной ассоциации последовательностей нуклеиновых кислот путем спаривания оснований (A-G-T спаривается с комплементарной последовательностью Т-С-А). Комплементарность двух одноцепочечных молекул может быть частичной в случае, если только некоторые из пар нуклеиновых кислот комплементарны; или полной в случае, если все пары оснований комплементарны. Степень комплементарности влияет на эффективность и силу реакций гибридизации и амплификации.
Целевой сайт инициации в последовательности энхансера согласно настоящему изобретению может быть подвергнут мутации путем делеции, встраивания или замены, в результате чего он не сможет функционировать в качестве сайта инициации трансляции. Например, может быть осуществлена точечная мутация в положении целевого сайта инициации в последовательности энхансера. В качестве альтернативы, целевой сайт инициации в последовательности энхансера может быть удален либо частично, либо полностью. Например, может быть осуществлена делеция, «охватывающая» целевой сайт инициации в последовательности энхансера. Делеции, «охватывающие» сайт инициации, могут иметь длину до (включительно) 5, до 10, до 15, до 20, до 25, до 30, до 35, до 40, до 45, или до 50 нуклеотидов по сравнению с последовательностью сегмента генома RNA-2 дикого типа, из которого получена последовательность энхансера.
Без конкретного теоретического обоснования считают, что мутация старт-кодона в положении 161 в CPMV приводит к инактивации супрессора трансляции, следствием которой является усиленная инициация трансляции со старт-кодонов, расположенных ниже инактивированного супрессора трансляции.
Таким образом, согласно настоящему изобретению также предложена последовательность энхансера, полученная из сегмента RNA-2 генома двухкомпонентного вируса, при этом указанная последовательность энхансера содержит инактивированную последовательность супрессора трансляции.
Согласно настоящему изобретению также предложен способ повышения экспрессии или активности повышения трансляции последовательности, полученной из сегмента RNA-2 генома двухкомпонентного вируса, включающий инактивацию расположенной в ней последовательности супрессора трансляции.
Как уже указывалось выше, считают, что мутация сайта инициации в положении 161 в сегменте RNA-2 генома CPMV приводит к инактивации супрессора трансляции, обычно присутствующего в RNA-2 CPMV.
В настоящем описании последовательность супрессора трансляции представляет собой последовательность в сегменте RNA-2 дикого типа генома двухкомпонентного вируса (например, комовируса), из которого получают рассматриваемую последовательность энхансера, содержащую или состоящую из сайта инициации для образования (трансляции) более длинного из двух белков с совпадающими карбокси-концами, кодируемых сегментом генома RNA-2 дикого типа.
Последовательности супрессора трансляции в последовательностях энхансеров, полученных из сегмента RNA-2 генома CPMV, представляют собой последовательности, содержащие или состоящие из целевого сайта инициации, описанного выше. Таким образом, последовательности супрессора трансляции содержат или состоят из целевого сайта инициации, как определено выше, и могут быть инактивированы путем мутагенеза, как описано выше.
Вышеопределенные последовательности энхансеров могут быть использованы в различных аспектах и вариантах реализации настоящего изобретения следующим образом.
Таким образом, в соответствии с одним из аспектов настоящего изобретения предложена или применена выделенная нуклеиновая кислота, состоящая или по существу состоящая из последовательности энхансера экспрессии, как описано выше.
В настоящем описании термин «нуклеиновая кислота» или «молекула нуклеиновой кислоты» относится к любой молекуле ДНК или РНК, либо одно-, либо двухцепочечной, и в случае одноцепочечной - к молекуле комплементарной ей последовательности либо в линейной, либо в кольцевой форме. В рассматриваемых молекулах нуклеиновых кислот последовательность или структура молекулы конкретной нуклеиновой кислоты может быть описана в настоящей заявке согласно стандартному представлению последовательности в направлении 5'-3'. В отношении нуклеиновых кислот согласно настоящему изобретению иногда используют термин «выделенная нуклеиновая кислота». Применительно к ДНК данный термин относится к молекуле ДНК, отделенной от последовательностей, с которыми она непосредственно контактирует во встречающемся в природе геноме организма, из которого она происходит.
Например, термин «выделенная нуклеиновая кислота» может включать молекулу ДНК, встроенную в вектор, такой как плазмида или вирусный вектор, или интегрированную в геномную ДНК прокариотической или эукариотической клетки, или организма-хозяина.
Применительно к РНК термин «выделенная нуклеиновая кислота» относится в первую очередь к молекуле РНК, кодируемой выделенной молекулой ДНК, как определено выше. В качестве альтернативы, указанный термин может относиться к молекуле РНК, которая была в достаточной степени отделена от других нуклеиновых кислот, с которыми она связана в естественном состоянии (т.е. в клетках или тканях). Термин «выделенная нуклеиновая кислота» (либо ДНК, либо РНК) может также означать молекулу, полученную непосредственно биологическими или синтетическими способами и отделенную от других компонентов, присутствующих во время ее образования.
Таким образом, нуклеиновая кислота может состоять или по существу состоять из части или фрагмента сегмента генома RNA-2 двухкомпонентного РНК-вируса, из которого получают энхансер. Например, в одном из вариантов реализации нуклеиновая кислота не содержит по меньшей мере части кодирующей области сегмента генома RNA-2, из которого она получена. Кодирующая область может представлять собой область сегмента генома RNA-2, кодирующую более короткий из двух белков с совпадающими карбокси-концами. Нуклеиновая кислота может состоять или по существу состоять из части сегмента генома RNA-2 двухкомпонентного РНК-вируса, продолжающейся от 5'-конца сегмента генома RNA-2 дикого типа до сайта инициации, в котором происходит инициация образования (трансляции) более короткого из двух белков с совпадающими карбокси-концами, кодируемых сегментом генома RNA-2 дикого типа.
Термин «по существу состоящий из» применительно к конкретному нуклеотиду или аминокислоте означает последовательность, обладающую свойствами данной SEQ ID NO. Например, применительно к аминокислотной последовательности указанный термин включает последовательность per se и молекулярные модификации, которые не влияют на основные и новые характеристики данной последовательности. Например, применительно к нуклеиновой кислоте указанный термин включает последовательность per se и незначительные изменения и/или присоединенные участки, которые не повлияют на энхансерную функцию данной последовательности или придадут дополнительную функциональность.
Настоящее изобретение также относится к системам экспрессии генов, содержащим последовательность энхансера согласно настоящему изобретению.
Таким образом, в соответствии с другим аспектом настоящего изобретения предложена система экспрессии генов, содержащая последовательность энхансера, как описано выше.
Система экспрессии генов может также содержать ген, который кодирует представляющий интерес белок, встроенный ниже последовательности энхансера. Встроенные последовательности, которые кодируют представляющий интерес белок, могут быть любого размера.
Соответственно, согласно другому аспекту настоящего изобретения предложена система экспрессии генов, содержащая:
(а) последовательность энхансера, описанную выше; и (b) ген, который кодирует представляющий интерес белок, при этом указанный ген расположен ниже последовательности энхансера.
Указанные ген и представляющий интерес белок могут быть гетерологичными, т.е. не кодируемыми двухкомпонентным РНК-вирусом дикого типа, из которого получают последовательность энхансера.
Системы экспрессии генов могут быть использованы для экспрессии представляющего интерес белка в организме-хозяине. В данном случае представляющий интерес белок также может быть гетерологичным по отношению к рассматриваемому организму-хозяину, т.е. может быть введен в рассматриваемые клетки (например, растения или его предшественника) с использованием методов генной инженерии, т.е. с участием человека. Гетерологичный ген в организме может заменять эквивалентный эндогенный ген, т.е. ген, который обычно выполняет ту же или схожую функцию, или встроенная последовательность может являться дополнительной к указанному эндогенному гену или другой последовательности.
Для специалистов в данной области техники очевидно, что для экспрессии представляющего интерес гена необходимо наличие сайта инициации (AUG), расположенного выше экспрессируемого гена. Указанные сайты инициации могут быть представлены либо в виде части последовательности энхансера, либо в виде части гена, который кодирует представляющий интерес белок.
Организм-хозяин может представлять собой растение. Однако поскольку механизмы трансляции у эукариот очень консервативны, системы экспрессии генов могут также быть использованы для экспрессии представляющего интерес белка в эукариотических организмах-хозяевах, отличных от растений, например, в клетках насекомых, в виде модифицированных бакуловирусных векторов, или в клетках дрожжей или млекопитающих.
Системы экспрессии генов могут быть функционально связаны с последовательностями промоторов и терминаторов.
Таким образом, системы экспрессии генов могут дополнительно содержать последовательность терминатора и ген, который кодирует представляющий интерес белок, может быть расположен между последовательность энхансера и последовательностью терминатора, т.е. ниже (3') последовательности энхансера и выше (5') последовательности терминатора.
Таким образом, согласно настоящему изобретению также предложена кассета экспрессии, содержащая:
(i) промотор, функционально связанный с
(ii) последовательность энхансера, описанную выше,
(iii) представляющий интерес ген, который необходимо экспрессировать
(iv) последовательность терминатора.
В предпочтительном варианте промотор, используемый для управления представляющим интерес геном, является сильным промотором. Примеры сильных промоторов для использования в растениях включают:
(1) p35S: Odell et al., 1985;
(2) промотор вируса мозаики маниоки (Cassava Vein Mosaic Virus), pCAS, Verdaguer et al., 1996;
(3) промотор малой субъединицы рибулозобифосфаткарбоксилазы, pRbcS: Outchkourov et al., 2003.
Другие сильные промоторы включают pUbi (для однодольных и двудольных растений) и pActin.
В предпочтительном варианте реализации промотор представляет собой индуцибельный промотор.
Термин «индуцибельный» применительно к промотору хорошо понятен специалистам в данной области техники. По существу, экспрессия под контролем индуцируемого промотора «включается» или усиливается в ответ на прилагаемый стимул. Природа указанного стимула для различных промоторов различна. Некоторые индуцибельные промоторы могут обеспечивать незначительные или недетектируемые уровни экспрессии (или не вызывают экспрессию) в отсутствие подходящего стимула. Другие индуцибельные промоторы вызывают детектируемую конститутивную экспрессию в отсутствие стимула. Каким бы ни был уровень экспрессии в отсутствие стимула, экспрессия с любого индуцибельного промотора увеличивается в присутствии подходящего стимула.
Терминирующая последовательность (последовательность терминатора, терминатор) может представлять собой последовательность терминатора, полученную из сегмента генома RNA-2 двухкомпонентного РНК-вируса, например комовируса. В одном из вариантов реализации терминирующая последовательность может быть получена из того же двухкомпонентного РНК-вируса, из которого получают последовательность энхансера. Терминирующая последовательность может содержать стоп-кодон. За последовательностью терминатора могут также следовать сигналы полиаденилирования.
Кассеты экспрессии генов, конструкции экспрессии генов и системы экспрессии генов согласно настоящему изобретению также могут содержать нетранслируемую область (НТО, UTR). НТО может быть расположена выше последовательности терминатора, присутствующей в кассете экспрессии генов, конструкции экспрессии генов или системе экспрессии генов. В случае, когда кассеты экспрессии генов, конструкции экспрессии генов или системы экспрессии генов содержат ген, который кодирует представляющий интерес белок, НТО может быть расположена ниже указанного гена. Таким образом, НТО может быть расположена между геном, который кодирует представляющий интерес белок, и терминаторной последовательностью. НТО может быть получена из двухкомпонентного РНК-вируса, например из сегмента генома RNA-2 двухкомпонентного РНК-вируса. НТО может представлять собой 3' НТО того же сегмента генома RNA-2, из которого получают последовательность энхансера, присутствующую в кассете экспрессии генов, конструкции экспрессии генов или системе экспрессии генов. Предпочтительно НТО представляет собой 3' НТО сегмента генома RNA-2 комовируса, например 3'-НТО сегмента генома RNA-2 CPMV.
Как описано выше, ранее было показано, что для эффективной репликации RNA-2 CPMV под действием кодируемой RNA-1 CPMV репликазы необходимо сохранение рамки между сайтами инициации в положениях 161 и 512 в RNA-2, т.е. чтобы два сайта инициации оставались в одной и той же триплетной рамке считывания (Holness et al., 1989; van Bokhoven et al., 1993; Rohll et al., 1993). Данное необходимое условие ограничивало длину последовательностей, которые могут быть встроены выше сайта инициации в положении 512 в векторы экспрессии на основе CPMV. В частности, оно исключало применение полилинкеров, т.к. их использование обычно изменяло открытую рамку считывания (ОРС) между двумя сайтами инициации.
Авторы настоящего изобретения показали, что сохранение рамки считывания между сайтами инициации в положениях 161 и 512 в RNA-2 CPMV также необходимо для эффективной инициации трансляции в сайте инициации в положении 512, т.е. оно необходимо для эффективной экспрессии более короткого из двух белков с совпадающими карбокси-концами, кодируемых CPMV (белка 95K).
Однако авторы настоящего изобретения также продемонстрировали, что мутация сайта инициации в положении 161 в RNA-2 CPMV позволяет встраивать выше сайта инициации в положении 512 последовательности, изменяющие рамку между мутированным старт-кодоном и сайтом инициации в положении 512, при этом не оказывая какого-либо негативного эффекта на уровень экспрессии белка 95K. Соответственно, мутация сайта инициации в положении 161 означает, что больше не существует какого-либо ограничения длины последовательностей, которые могут быть встроены выше сайта инициации в положении 512.
В случае, когда сохранение рамки считывания между сайтами инициации, кодирующими два белка с совпадающими карбокси-концами, также необходимо в других двухкомпонентных вирусах, данное необходимое условие можно также обойти путем осуществления мутации AUG, выполняющего функцию сайта инициации для образования более длинного из двух белков с совпадающими карбокси-концами, кодируемых сегментом генома RNA-2 вируса. Таким образом, в соответствии с другим аспектом настоящего изобретения предложена конструкция экспрессии генов, содержащая:
(a) последовательность энхансера, описанная выше;
(b) гетерологичную последовательность для облегчения встраивания гена, который кодирует представляющий интерес белок, в систему экспрессии генов, при этом указанная гетерологичная последовательность расположена ниже мутированного целевого сайта инициации в указанной последовательности энхансера.
Гетерологичная последовательность может быть расположена выше старт-кодона, с которого происходит инициация получения более короткого из двух белков с совпадающими карбокси-концами в сегменте генома RNA-2 дикого типа, из которого получают последовательность энхансера системы экспрессии генов. В качестве альтернативы гетерологичная последовательность может быть расположена вокруг сайта старт-кодона или может замещать старт-кодон, с которого происходит инициация получения более короткого из двух белков с совпадающими карбокси-концами в сегменте генома RNA-2 дикого типа, из которого получают последовательность энхансера системы экспрессии генов. В системе экспрессии генов, содержащей последовательность энхансера, полученную из RNA-2 CPMV, гетерологичная последовательность может быть расположена выше, вокруг сайта старт-кодона или может замещать старт-кодон, находящийся в положении 512 в сегменте генома RNA-2 CPMV дикого типа.
Гетерологичная последовательность может представлять собой полилинкер или сайт множественного клонирования, т.е. последовательность, облегчающую клонирование гена, который кодирует представляющий интерес белок, в систему экспрессии.
Например, как описано далее, авторы настоящего изобретения предложили конструкции, содержащие полилинкер между 5'-лидерной последовательностью и 3'-НТО кассеты экспрессии, основанной на CPMV. Как описано ниже, любой полилинкер может кодировать один или более наборов множественных остатков гистидина для обеспечения слияния N- или C-концевых His-меток для облегчения очистки белка.
В предпочтительном варианте указанные конструкции экспрессии присутствуют в векторе, и предпочтительно он содержит пограничные последовательности, обеспечивающие перенос и интеграцию кассеты экспрессии в геном организма.
В предпочтительном варианте указанная конструкция представляет собой растительный бинарный вектор. Предпочтительно бинарный вектор для трансформации основан на pPZP (Hajdukiewicz, et al. 1994). Другие примеры конструкций включают pBin19 (см. Frisch, D. A., L. W. Harris-Haller, et al. (1995). "Complete Sequence of the binary vector Bin 19." Plant Molecular Biology 27:405-409).
Как указано в настоящем описании, настоящее изобретение может быть реализовано путем переноса кассеты экспрессии, содержащей необходимые компоненты, в существующие кассеты экспрессии pBin; или, в других вариантах реализации, может быть использован вектор экспрессии pBin для прямого клонирования.
Например, как описано далее, авторы настоящего изобретения обладают модульными бинарными векторами, созданными для (без ограничения) использования с последовательностями энхансеров, описанными в настоящем тексте. Они основаны на усовершенствованиях вектора pBINPLUS, благодаря которым было показано, что можно существенно уменьшить размер вектора, при этом не нарушая эффективность в отношении репликации и переноса Т-ДНК. Кроме того, элементы энхансерной системы (как представлено на примере так называемой системы «CPMV-HT») были введены в полученный вектор в модульном виде, что позволило экспрессировать многочисленные белки с одной Т-ДНК. Данные усовершенствования привели к созданию универсального вектора, обеспечивающего высокие уровни экспрессии, позволяющего эффективно напрямую клонировать чужеродные гены.
Данные примеры представляют собой предпочтительные растительные бинарные векторы. Они предпочтительно содержат точку начала (ориджин) репликации ColEI, но плазмиды, содержащие другие точки начала репликации, которые также позволяют получать высокое число копий (такие как плазмиды на основе pRi, Lee and Gelvin, 2008), также могут быть предпочтительными, в частности для систем временной экспрессии.
При необходимости в указанную конструкцию могут быть включены селектируемые генетические маркеры, как например, маркеры, придающие селектируемые фенотипы, такие как резистентность к антибиотикам или гербицидам (например, канамицину (kanamycin), фосфинотрицину (phosphmotricin), гигромицину (hygromycin), хлорсульфурону (chlorsulfuron), метотрексату (methotrexate), гентамицину (gentamycin), спектиномицину (spectinomycin), имидазолинонам и глифосату (glyphosate)).
Наиболее предпочтительные векторы представляют собой описанные ниже векторы рЕАО, допускающие вариант прямого клонирования с использованием полилинкера между 5'-лидером и 3'-НТО кассеты экспрессии, содержащей энхансер трансляции согласно настоящему изобретению, расположенный в Т-ДНК, которая также содержит супрессор сайленсинга гена и кассеты NPTII. Указанный полилинкер также кодирует один или два набора 6 x остатков гистидина для обеспечения слияния N- или C-концевых His-меток для облегчения очистки белка.
Преимущество получаемых из pEAQ векторов заключается в том, что каждый компонент многоцепочечного белка, такого как IgG, может быть автоматически доставлен в каждую инфицированную клетку.
Согласно настоящему изобретению также предложены способы экспрессии белков, например гетерологичных белков, в организмах-хозяевах, таких как растения, клетки дрожжей, насекомых или млекопитающих, с использованием системы экспрессии согласно настоящему изобретению.
Согласно настоящему изобретению также предложен способ усиления трансляции представляющего интерес гетерологичного белка с гена или ОРС, кодирующей указанный белок, функционально связанной с полученной из RNA-2 последовательностью, описанной выше, при этом указанный способ включает осуществление мутации целевого сайта инициации в полученной из RNA-2 последовательности.
Последовательности энхансеров, указанные в настоящем описании, также могут быть использованы с двухкомпонентными системами экспрессии, описанными в WO/2007/135480. Соответственно, настоящее изобретение также относится к системам экспрессии генов на основе укороченных сегментов гена RNA-2, возможно дополнительно содержащим вторую генную конструкцию, кодирующую супрессор сайленсинга гена, функционально связанный с последовательностями промотора и терминатора.
Соответственно, в соответствии с другим аспектом настоящее изобретение относится к системе экспрессии генов, содержащей:
(a) первую генную конструкцию, содержащую укороченную RNA-2 генома двухкомпонентного вируса, несущую по меньшей мере один чужеродный ген, который кодирует представляющий интерес гетерологичный белок, функционально связанный с последовательностями промотора и терминатора, при этом указанная генная конструкция содержит мутированный целевой сайт инициации, расположенный выше чужеродного гена; и возможно
(b) вторую генную конструкцию, содержащую RNA-1 генома указанного двухкомпонентного вируса, функционально связанную с последовательностями промотора и терминатора; и возможно
(c) третью генную конструкцию, возможно встроенную в указанную первую генную конструкцию, указанную вторую генную конструкцию или в обе, содержащую супрессор сайленсинга гена, функционально связанный с последовательностями промотора и терминатора.
Присутствие супрессора сайленсинга гена в системе экспрессии генов (включая любую из описанных выше) согласно настоящему изобретению является предпочтительным, но не обязательным. Таким образом, система экспрессии генов, определенная выше, предпочтительно содержит третью генную конструкцию, возможно встроенную в указанную первую генную конструкцию, указанную вторую генную конструкцию или в обе, содержащую супрессор сайленсинга гена, функционально связанный с последовательностями промотора и терминатора.
Таким образом, в соответствии с другим аспектом настоящего изобретения предложен способ экспрессии белка в растении, включающий следующие этапы:
(a) введение конструкции экспрессии генов согласно настоящему изобретению в клетку растения; и возможно
(b) введение в клетку растения второй генной конструкции, содержащей RNA-1 генома указанного двухкомпонентного вируса, функционально связанную с последовательностями промотора и терминатора; и возможно
(c) введение в клетку растения третьей генной конструкции, возможно встроенной в указанную первую генную конструкцию, указанную вторую генную конструкцию или обе, содержащей супрессор сайленсинга гена, функционально связанный с последовательностями промотора и терминатора.
Предпочтительно способ экспрессии белка в растении, определенный выше, включает этап введения в клетку растения третьей генной конструкции, возможно встроенной в указанную первую генную конструкцию, указанную вторую генную конструкцию или в обе, содержащей супрессор сайленсинга гена, функционально связанный с последовательностями промотора и терминатора.
Согласно настоящему изобретению также предложены способы, включающие введение указанной конструкции в клетку растения.
Авторы настоящего изобретения продемонстрировали очень высокие уровни экспрессии, обеспечиваемые путем введения представляющего интерес гена и супрессора сайленсинга в одну Т-ДНК в качестве энхансера трансляции. Соответственно, в предпочтительных вариантах реализации могут быть использованы все данные компоненты, присутствующие в одной Т-ДНК.
Кроме того, следует понимать, что RNA-1 не является необходимой для обеспечения высокого уровня экспрессии в системах, указанных в настоящем описании, и в действительности система «CPMV-HT», указанная в настоящем описании, работает за счет действия RNA-1.
В соответствии с другим аспектом настоящее изобретение относится к системе экспрессии генов, содержащей:
(а) первую генную конструкцию, содержащую укороченную RNA-2 генома двухкомпонентного вируса, несущую по меньшей мере один чужеродный ген, который кодирует представляющий интерес гетерологичный белок, функционально связанный с последовательностями промотора и терминатора, при этом указанная генная конструкция содержит мутированный целевой сайт инициации, расположенный выше чужеродного гена; и возможно
(b) вторую генную конструкцию, возможно встроенную в указанную первую генную конструкцию, супрессор сайленсинга гена, функционально связанный с последовательностями промотора и терминатора.
В соответствии с другим аспектом настоящего изобретения предложен способ экспрессии белка в растении, включающий следующие этапы:
(a) введение конструкции экспрессии генов согласно настоящему изобретению в клетку растения; и возможно
(b) введение в клетку растения второй генной конструкции, возможно встроенной в указанную первую генную конструкцию, содержащей супрессор сайленсинга гена, функционально связанный с последовательностями промотора и терминатора.
Супрессоры сайленсинга гена, которые можно использовать в соответствии с данными аспектами, известны в данной области техники и описаны в WO/2007/135480. Указанные супрессоры включают HcPro из вируса Y картофеля, He-Pro из TEV, P19 из TBSV, rgsCam, белок В2 из FHV, малый белок оболочки вируса CPMV и белок оболочки из TCV. Наиболее предпочтительно, RNA-2 указанной системы укорачивают так, что инфекционный вирус не образуется.
Предпочтительный супрессор при получении стабильных трансгенных растений представляет собой супрессор P19, содержащий мутацию R43W.
В соответствии с другим аспектом настоящего изобретения предложена клетка-хозяин, содержащая гетерологичную конструкцию согласно настоящему изобретению.
Векторы экспрессии генов согласно настоящему изобретению могут быть временно или стабильно внедрены в клетки растений.
Для мелкомасштабного производства производится механическая агроинфильтрация листьев конструкциями согласно настоящему изобретению. Увеличения масштаба достигают, например, посредством применения вакуумной инфильтрации.
В других вариантах реализации вектор экспрессии согласно настоящему изобретению может быть стабильно внедрен в геном трансгенного растения или клетки растения.
В соответствии с одним из аспектов настоящее изобретение может дополнительно включать этап регенерации растения из трансформированной клетки растения.
Конкретные процедуры и векторы, которые ранее с огромным успехом применяли в растениях, описаны Guerineau and Mullineaux (1993) (Plant transformation and expression vectors. In: Plant Molecular Biology Labfax (Croy RRD ed) Oxford, BIOS Scientific Publishers, страницы 121-148). Подходящие векторы могут включать векторы на основе вирусов растений (см., например, ЕР-А-194809). При необходимости в конструкцию могут быть включены селектируемые генетические маркеры, например маркеры, придающие селектируемые фенотипы, такие как резистентность к антибиотикам или гербицидам (например, канамицину, гигромицину, фосфинотрицину, хлорсульфурону, метотрексату, гентамицину, спектиномицину, имидазолинонам и глифосату).
Нуклеиновая кислота может быть введена в клетки растений с использованием любой подходящей технологии, такой как «обезоруженный» вектор на основе Ti-плазмид агробактерией (Agrobacterium), использующей природную способность данной плазмиды к переносу генов (ЕР-А-270355, ЕР-А-0116718, NAR 12(22) 8711-87215 1984; способ «floral dip» (обмакивания цветков) Clough and Bent, 1998), бомбардировка частицами или микрочастицами (US 5100792, ЕР-А-444882, ЕР-А-434616), микроинъекция (WO 92/09696, WO 94/00583, ЕР 331083, ЕР 175966, Green et al. (1987) Plant Tissue and Cell Culture, Academic Press), электропорация (ЕР 290395, WO 8706614 Gelvin Debeyser), другие формы прямого поглощения ДНК (DE 4005152, WO 9012096, US 4684611), опосредуемое липосомами поглощение ДНК (например, Freeman et al. Plant Cell Physiol. 29:1353 (1984)) или способ интенсивного перемешивания (например, Kindle, PNAS U.S.A. 87:1228 (1990d). Физические способы трансформации клеток растений рассмотрены в Oard, 1991, Biotech. Adv. 9:1-11. Ti-плазмиды, в частности бинарные векторы, более подробно описаны ниже.
Специалисты в данной области техники широко используют трансформацию агробактериями для трансформации двудольных растений. Однако, значительный успех достигнут также в рутинном получении стабильных, фертильных трансгенных растений практически во всех экономически важных однодольных растениях (см., например, Hiei et al. (1994) The Plant Journal 6, 271-282). Бомбардировка микрочастицами, электропорация и прямое поглощение ДНК являются предпочтительными в случае, когда использование только агробактерии недостаточно или неэффективно. В качестве альтернативы, для повышения эффективности указанного способа трансформации может быть использована комбинация различных технологий, например бомбардировка покрытыми агробактериями микрочастицами (ЕР-А-486234) или бомбардировка микрочастицами с индуцированной скарификацией с последующим совместным культивированием с агробактерией (ЕР-А-486233).
Выбор конкретной технологии трансформации будет осуществлен по конкретной методике выбора с учетом ее эффективности в отношении трансформации определенных видов растений, а также опытом и предпочтением специалиста, реализующего настоящее изобретение.
Для специалиста очевидно, что конкретный выбор системы трансформации для введения нуклеиновой кислоты в клетки растений не является существенным и не ограничивает настоящее изобретение, равно как и выбор технологии регенерации растений. В проведенных авторами настоящего изобретения экспериментах эффект усиленной экспрессии наблюдают во множестве схем интеграции Т-ДНК.
Таким образом, в соответствии с различными аспектами настоящего изобретения предложен способ трансформации клетки растения, включающий введение конструкции согласно настоящему изобретению в ткань растения (например, клетку растения) и обеспечение начала или создание условий для рекомбинации между вектором и геномом клетки растения, что обеспечивает встраивание нуклеиновой кислоты согласно настоящему изобретению в указанный геном. Это может быть выполнено для обеспечения временной экспрессии.
В качестве альтернативы после трансформации ткани растения растение может быть регенерировано, например, из отдельных клеток, ткани каллуса или дисков листьев стандартными методами. Практически любое растение может быть полностью регенерировано из клеток, тканей и органов растения. Доступные технологии рассмотрены в Vasil et al., Cell Culture and Somatic Cell Genetics of Plants, Vol I, II and III, Laboratory Procedures and Their Applications, Academic Press, 1984, и Weissbach and Weissbach, Methods for Plant Molecular Biology, Academic Press, 1989.
Получение фертильных трансгенных растений было осуществлено в зерновых, таких как рис, кукуруза, пшеница, ячмень, и многих других видах растений (рассмотрено в Shimamoto, K. (1994) Current Opinion in Biotechnology 5, 158-162.; Vasil, et al. (1992) Bio/Technology 10, 667-674; Vain et al., 1995, Biotechnology Advances 13 (4):653-671; Vasil, 1996, Nature Biotechnology 14 страница 702).
Регенерированные растения или части растений могут быть использованы для получения клонов, семян, самоопыленного или гибридного потомства и потомков (например, потомства F1 и F2), черенков (например, съедобные части), побегов и т.д.
Согласно настоящему изобретению также предложен трансгенный организм (например, полученный или который может быть получен способом, указанным в настоящем описании), в который был введен вектор экспрессии или кассета экспрессии, и при этом гетерологичный ген в указанной кассете экспрессируется на повышенном уровне.
Согласно настоящему изобретению также предложен способ получения представляющего интерес белка, включающий этапы осуществления способа (или использования организма), описанного выше, и возможно сбора по меньшей мере ткани, в которой был экспрессирован представляющий интерес белок, и выделения представляющего интерес белка из указанной ткани.
Согласно настоящему изобретению, в частности, предложено трансгенное растение или клетка растения, временно трансфецированная вектором экспрессии согласно настоящему изобретению.
В соответствии с другим аспектом настоящего изобретения также предложено трансгенное растение или клетка растения, постоянно трансформированная вектором экспрессии согласно настоящему изобретению.
Согласно настоящему изобретению также предложена часть указанного растения для вегетативного размножения, побег указанного растения, представляющий собой любую часть, которую можно использовать в репродукции или размножении, половом или бесполом, включая черенки, семя и т.д. Также предложена любая часть указанного растения, содержащая клетки растений или гетерологичную ДНК, описанные выше.
Таким образом, в соответствии с различными аспектами (и без ограничения) настоящего изобретения предложены:
- Нуклеиновые кислоты, состоящие или по существу состоящие из последовательности энхансера согласно настоящему изобретению (которая может (например) состоять из нуклеотидов 1-512 сегмента генома RNA-2 CPMV или может быть получена из него, или из другого сегмента генома RNA-2 двухкомпонентного РНК-вируса, при этом в каждом случае в указанной последовательности целевой сайт инициации, соответствующий положению 161 RNA-2 CPMV, мутирован).
- Системы экспрессии генов, содержащие указанные последовательности энхансеров, например, расположенные выше ОРС, которая кодирует представляющий интерес белок, или полилинкер и возможно терминатор.
- Двухкомпонентные системы экспрессии, описанные в WO/2007/135480, модифицированные согласно настоящему изобретению, для использования последовательностей энхансеров согласно настоящему изобретению.
- Кассеты экспрессии, содержащие: (i) промотор, функционально связанный с (ii) последовательностью энхансера, описанной выше, (iii) полилинкер или представляющий интерес ген, который необходимо экспрессировать, (iv) когнатную 3'-НТО (т.е. из 3' НТО сегмента генома RNA-2 CPMV), (v) последовательность терминатора.
- Способы экспрессии белков, например, гетерологичных белков, в организмах-хозяевах, таких как растения, с использованием систем экспрессии генов или векторов согласно настоящему изобретению.
- Клетки- и организмы-хозяева (например, растении или дрожжи), экспрессирующие белки с систем экспрессии генов или векторов согласно настоящему изобретению, и способы их получения.
Термин «ген», если контекст не указывает на иное, относится к любой нуклеиновой кислоте, кодирующей генетическую информацию для трансляции в пептид, полипептид или белок. Таким образом, если в контексте не указано иное, указанный термин является равнозначным термину «ОРС».
Гены, которые может быть необходимо экспрессировать, могут представлять собой трансгены или эндогены.
Представляющие интерес гены включают гены, кодирующие агрономические признаки, устойчивость к воздействию насекомых, устойчивость к заболеваниям, устойчивость к действию гербицидов, стерильность, характеристики зерен и т.п. Указанные гены могут быть вовлечены в метаболизм масла, крахмала, углеводов, питательных веществ и т.д. Таким образом, представляющие интерес гены или признаки включают, но не ограничены перечисленными: связанные с окружающей средой или стрессом признаки, связанные с заболеванием признаки и признаки, влияющие на агрономическую производительность. Целевые последовательности также включают гены, ответственные за синтез белков, пептидов, жирных кислот, липидов, восков, масел, крахмалов, сахаров, углеводов, вкусовых веществ, ароматических веществ, токсинов, каротиноидов, гормонов, полимеров, флавоноидов, запасных белков, фенольных кислот, алкалоидов, лигнинов, таннинов, целлюлоз, гликопротеинов, гликолипидов и т.д.
В наиболее предпочтительном случае целевые гены в однодольных и/или двудольных растениях могут включать гены, кодирующие ферменты, ответственные за образование масла в растениях, таких как рапс, подсолнечник, соя культурная и кукуруза; ферменты, включенные в синтез крахмала в растениях, таких как картофель, кукуруза, зерновые; ферменты синтеза белков, или сами белки, натуральные лекарственные вещества, такие как фармацевтические вещества или ветеринарные продукты.
Гетерологичные нуклеиновые кислоты могут кодировать, среди прочих, гены бактериального, грибкового, растительного или животного происхождения. Полипептиды могут быть использованы in planta (для изменения характеристик растения, например, в отношении подверженности воздействию вредителей, стойкости, дифференцировки тканей, фертильности, питательной ценности и т.д.), или указанное растение может представлять собой средство для получения полипептидов, которые могут быть выделены от него для использования. Указанные белки включают, но не ограничены перечисленными, белок ретинобластомы, р53, ангиостатин и лептин. Подобным образом способы согласно настоящему изобретению могут быть использованы для получения регуляторных белков млекопитающих. Другие представляющие интерес последовательности включают белки, гормоны, факторы роста, цитокины, сывороточный альбумин, гемоглобин, коллаген и т.д.
Таким образом, целевой ген или нуклеотидная последовательность предпочтительно кодирует представляющий интерес белок, который представляет собой: белок устойчивости к воздействию насекомых; белок устойчивости к заболеваниям; белок устойчивости к воздействию гербицидов; белок млекопитающих.
Термин «вектор» включает, в частности, любую плазмиду, космиду, фаг, вирусный бинарный вектор или бинарный вектор агробактерий в двух- или одноцепочечной линейной или кольцевой форме, который может являться или не являться самопередающимся или мобилизуемым, и который может трансформировать прокариотического или эукариотического хозяина либо путем интеграции в геном клетки, либо существуя внехромосомно (например, автономно реплицирующаяся плазмида, содержащая точку начала репликации). Используемые конструкции будут полностью или частично синтетическими. В частности, они являются рекомбинантными в том смысле, что последовательности нуклеиновых кислот, которые нельзя обнаружить вместе в природе (которые не являются смежными), лигированы или иным образом искусственно объединены. Если не указано иное, вектор согласно настоящему изобретению не обязательно должен содержать промоторную или другую регуляторную последовательность, в частности, если указанный вектор должен быть использован для введения нуклеиновой кислоты в клетки для рекомбинации в геном.
«Бинарный вектор»: как хорошо известно специалистам, бинарная векторная система содержит (а) пограничные последовательности, обеспечивающие перенос необходимой нуклеотидной последовательности в геном клетки растения; (b) саму целевую нуклеотидную последовательность, которая в целом содержит кассеты экспрессии (i) активный растительный промотор, функционально связанный с (ii) целевой последовательностью и/или энхансером, при необходимости. Необходимую нуклеотидную последовательность помещают между пограничными последовательностями и ее можно встраивать в геном растения в подходящих условиях. Для осуществления интеграции бинарной векторной системе обычно необходима другая последовательность (полученная из A. tumefaciens). В целом, это можно обеспечить путем использования так называемой «агроинфильтрации», при которой используют опосредуемую агробактериями временную трансформацию. Вкратце: данная технология основана на свойстве Agrobacterium tumefaciens (опухолеобразующей агробактерии) переносить часть своей ДНК («Т-ДНК») в клетку-хозяина, где она может быть интегрирована в ядерную ДНК. Т-ДНК определена левыми и правыми пограничными последовательностями, длина которых составляет примерно 21-23 нуклеотида. Инфильтрация может быть осуществлена, например, с использованием шприца (в листья) или вакуума (целые растения). Согласно настоящему изобретению пограничные последовательности в целом введены вокруг целевой нуклеотидной последовательности (Т-ДНК) при помощи одного или более векторов, введенных в растительный материал путем агроинфильтрации.
Термин «кассета экспрессии» относится к ситуации, в которой нуклеиновая кислота находится под контролем или функционально связана с подходящим промотором или другими регуляторными элементами для транскрипции в клетке-хозяине, такой как клетка микроорганизма или клетка растения.
«Промотор» представляет собой последовательность нуклеотидов, с которой может быть инициирована транскрипция функционально связанной ДНК в прямом направлении (т.е. в 3'-направлении смысловой цепи двухцепочечной ДНК).
Термин «функционально связанный» обозначает присоединенный в качестве части той же молекулы нуклеиновой кислоты, подходящим образом расположенный и ориентированный для инициации транскрипции с промотора.
Представляющие интерес виды «растений» включают, но не ограничены, следующими: кукуруза (Zea mays), виды капусты (например, В. napus, В. rapa, В. juncea), в частности те виды капусты, которые подходят в качестве источников масла семян, люцерна (Medicago sativa), рис (Oryza sativa), рожь (Secale cereale), сорго (Sorghum bicolor, Sorghum vulgare), просо (например, просо африканское (Pennisetum glaucum), просо обыкновенное (Panicum miliaceum), просо итальянское (Setaria italica), просо пальчатое (Eleusine coracana)), подсолнечник (Helianthus animus), сафлор (Carthamus tinctorius), пшеница (Triticum aestivum), соя (Glycine max), табак (Nicotiana tabacum), Nicotiana benthamiana, картофель (Solanum tuberosum), арахис (Arachis hypogaea), хлопчатник (Gossypium barbadense, Gossypium hirsutum), сладкий картофель (Ipomoea batatus), маниока (Manihot esculenta), кофейное дерево (Coffea spp.), кокосовая пальма (Cocos nucifera), ананас (Ananas comosus), цитрусовые деревья (Citrus spp.), дерево какао (Theobroma cacao), чайное растение (Camellia sinensis), банан (Musa spp.), авокадо (Persea americana), фиговое дерево (Ficus casica), гуава (Psidium guajava), манговое дерево (Mangifera indica), олива (Olea europaea), папайя (Carica papaya), анакард (Anacardium occidentale), макадамия (Macadamia integrifolia), миндальное дерево (Prunus amygdalus), сахарная свекла (Beta vulgaris), сахарный тростник (Saccharum spp.), овес, ячмень, овощи, декоративные растения и хвойные деревья. Для специалиста очевидно, что тропизм вирусных векторов, указанных в настоящем описании, варьирует. Однако определение чувствительности к указанным вирусам находится в рамках компетенции специалиста. Более того, можно изменять указанную специфичность путем рекомбинантной экспрессии рецепторов, облегчающих попадание вируса в клетку растения.
Далее настоящее изобретение будет дополнительно описано со ссылкой на неограничивающие Фигуры и Примеры. Другие варианты реализации настоящего изобретения станут очевидны специалистам в данной области техники на основании нижеприведенного.
Поскольку описание всех источников, указанных в настоящем описании, может быть использовано специалистами в данной области техники для реализации настоящего изобретения, оно специально включено в настоящее описание посредством перекрестной ссылки.
КРАТКОЕ ОПИСАНИЕ ФИГУР
На Фиг.1 показано схематическое изображение векторов экспрессии CPMV 00, 10, 01 и 11. В векторах экспрессии 00 сайты инициации в положениях 115 и 161 являются интактными. В векторах экспрессии 10 сайт инициации в положении 115 был подвергнут мутации, а сайт инициации в положении 161 является интактным. В векторах экспрессии 01 сайт инициации в положении 161 был подвергнут мутации, а сайт инициации в положении 115 является интактным. В векторах экспрессии 11 оба сайта инициации в положениях 115 и 161 подвергнуты мутации. Векторы экспрессии CPMV 00, 10, 01 и 11 также содержат сайт инициации либо в положении 512 (ESC2-152), 513 (FSC2-513), либо 514 (FSC2-514). Прямоугольники обозначают сайты инициации, с которых происходит экспрессия белка.
На Фиг.2 показан уровень растворимого зеленого флуоресцентного белка (GFP), экспрессированного в растениях, трансфецированных векторами экспрессии CPMV, схематически изображенными на Фиг.1. В векторах экспрессии FSC2-512, FSC2-513 и FSC2-514 ген, кодирующий GFP, встраивали после старт-кодона в положении 512, 513 и 514 соответственно. Полосы гелей SDS-ПААГ (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) обозначены 00, 10, 01 и 11 в зависимости от того, какие сайты инициации в векторе CPMV, в положениях 115 и 161, являются интактными или мутированными. Полоса, обозначенная «500 нг», показывает положение полосы, соответствующее 500 нг белка GFP, и таким образом означает предполагаемое положение белка GFP, экспрессированного из векторов экспрессии CPMV. Левая полоса каждого геля SDS-ПААГ демонстрирует положение маркеров размера белка.
На Фиг.3 показан уровень экспрессии GFP в листьях Nicotiana benthamiana, трансфецированных теми же векторами экспрессии CPMV, использованными в эксперименте, проиллюстрированном на Фиг.2. Светлые области на кончиках листьев соответствуют областям экспрессии GFP. Также обозначены мутации, осуществленные для инактивации сайтов инициации в положениях 115 и/или 161 в векторах экспрессии 10, 01 и 11.
На Фиг.4 показано сравнение Del-RNA-2 (вектор экспрессии 00 [FSC2-512] на Фиг.1) и НТ (вектор экспрессии 01 [FSC2-512] на Фиг.1) в отношении временной экспрессии зеленого флуоресцентного белка (GFP), красного флуоресцентного белка Discosoma (DsRed) и коровьего антигена вируса гепатита В (HBcAg). Клоны delRNA-2 или HT для каждого белка инфильтрировали супрессором сайленсинга Р19. (А) Через 7 дней после инфильтрации конструкциями delRNA-2 ткань становится некротической, когда экспрессирован DsRed или HBcAg, тогда как этого не происходит в случае управляемой НТ экспрессии. В действительности ткань, экспрессирующая DsRed посредством НТ выглядит заметно красной в условиях дневного света. (В) Анализ экспрессии белка методом электрофореза в полиакриламидном геле с додецилсульфатом натрия с окрашиванием Кумасси. Выделенные полосы, соответствующие рекомбинантным белкам, как указано, подтверждали путем вестерн-блоттинга. 1 - маркер, 2 - не инфильтрованная ткань, 3 - конструкция delRNAT2, 4 - конструкция НТ, 5 - коммерческий стандарт в тех случаях, когда таковой доступен. Неочищенные экстракты из приблизительно 5 мг инфильтрованной ткани помещали на линию, как и 2 мкг стандарта GFP и 2 мкг стандарта HBcAg. На тот момент стандарт для DsRed был недоступен.
На Фиг.5 показано первичное сравнение Del-RNA-2 (вектор экспрессии 00 [FSC2-512] на Фиг.1) и НТ (вектор экспрессии 01 [FSC2-512] на Фиг.1) в отношении временной экспрессии антитела 2G12 к вирусу иммунодефицита человека. Тяжелая цепь IgG была либо в природном виде (HL), либо ER-фиксированцой (HEL) и инфильтрованная легкой цепью и Р19. (А) Экспрессия 2G12-HEL посредством delRNA-2 приводит к некрозу инфильтрованной ткани, тогда как это не происходит в случае экспрессии НТ. (В) Анализ SDS-ПААГ неочищенных экстрактов ткани, инфильтрованной тяжелыми цепями указанного антитела (delRNA-2 или НТ) плюс Р19. Для каждого образца загружали неочищенный экстракт из 5 мг инфильтрованной ткани и 1 мкг стандартного IgG человека. Полоса, соответствующая 2G12, отчетливо видна после окрашивания Кумасси. (С) Накопление антитела 2G12 через 5 дней измеряли путем фиксации белком А и поверхностной плазменной резонансной спектроскопии и оно представляет собой концентрацию после экстракции в 2 объемах буфера (ФСБ, 5 мМ EDTA). Соответственно, можно получать свежие массовые концентрации, приближающиеся к 150 мг/кг (для НТ HEL) без какой-либо оптимизации инкубации растений или экстракции. Для каждой обработки измеряли три образца.
На Фиг.6 показан полученный с помощью электронного микроскопа снимок «собранных» частиц HBcAg, которые экспрессировали с использованием системы экспрессии НТ (вектор экспрессии 01 [FSC2-512] на Фиг.1), указанной в настоящем описании. «Собранные» частицы HBcAg предстают в виде полых сфер, примерно 30 нм в диаметре. Сок, содержащий частицы HBcAg, не концентрировали перед получением снимка с помощью электронного микроскопа, несмотря на то, что нежелательные соли удаляли. Соответственно, полученный с помощью электронного микроскопа снимок представляет собой концентрацию частиц HBcAg в указанном соке.
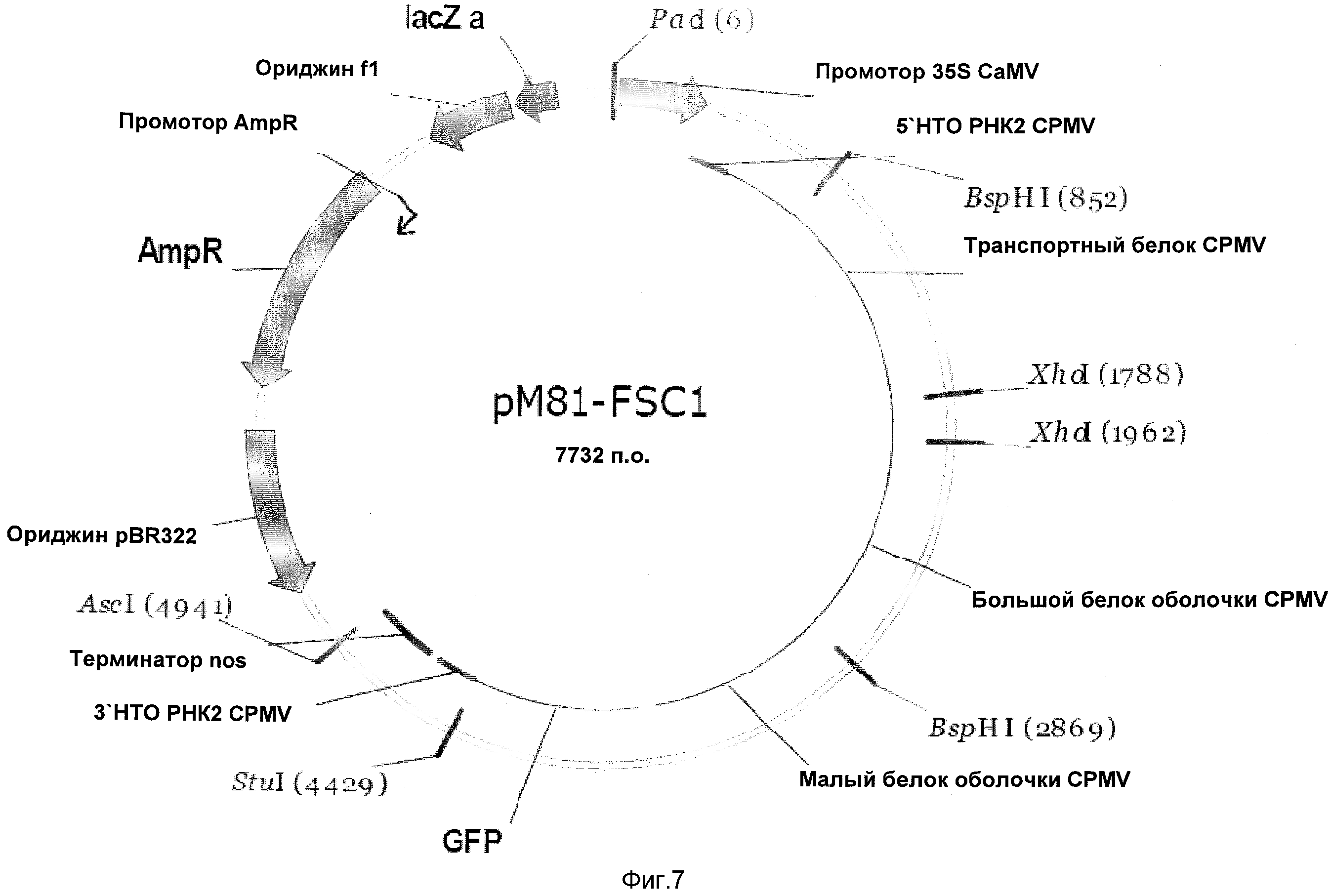
На Фиг.7 показан вектор pM81-FSC1.
На Фиг.8 показан вектор pM81-FSC2.
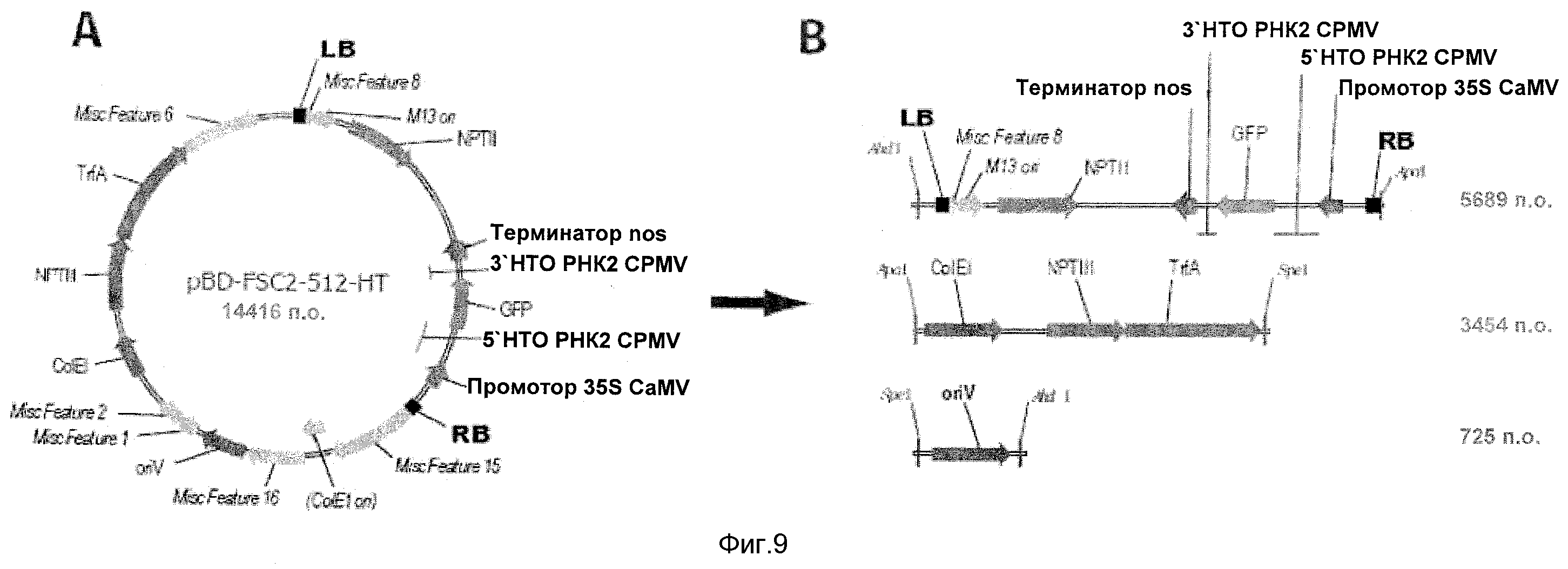
На Фиг.9 показано схематичное изображение конструкции pEAQ. (А) исходная плазмида на основе pBINPLUS с чужеродной последовательностью, показанной серым цветом. (В) Продукты ПЦР, содержащие необходимые элементы бинарного вектора. (C) Промежуточная плазмида после 3-частного лигирования конечных продуктов ПЦР. (D) Конечная плазмида после амплификации и последующего лигирования двух фрагментов промежуточного элемента.
На Фиг.10 показано схематичное изображение Т-ДНК основных производных pEAQ. Указанные Т-ДНК содержат любую из двух или обе кассеты Р19 и NPTII, как указано, при этом возможно клонирование в сайты рестрикции, как показано.
На Фиг.11 показаны уровни экспрессии GFP, полученные с использованием векторов pEAQ, по сравнению с исходной плазмидой pBB-FSC2-512-HT. Ткань анализировали через 6 дней после инфильтрации Р19 и обозначенным вектором за исключением pEAQexpress, который инфильтрировали отдельно при стандартной ОП или в двукратном разведении. (А) Листья, визуализированные при УФ-излучении, (В) 12% SDS-ПААГ с окрашиванием Кумасси и (С) спектрофлуорометрический анализ.
На Фиг.12 показана способность P19(R43W) усиливать экспрессию GFP по сравнению с Р19 дикого типа. Ткань анализировали через 6 дней после инфильтрации pEAQselectK в двукратном разведении (selK -Р19), pEAQselectK и Р19 (selK), pEAQspecialK (spK), pEAQspecialK в двукратном разведении (spK 1:2), pEAQspecialKm (spKm), pEAQspecialKm в двукратном разведении (spKm 1:2), pEAQexpress (ex) и pEAQexpress в двукратном разведении (ex 1:2). (А) Листья, визуализированные при УФ-излучении и (В) спектрофлуорометрический анализ.
На Фиг.13 показана экспрессия полноразмерного IgG, 2G12 с помощью одной плазмиды pEAQ. (А) Схематическое изображение двух полученных из pEAQexpress плазмид, сконструированных для экспрессии 2G12. (В) Схема инфильтрации, показывающая разбавления и их соответствующие ОП для каждой комбинации плазмид и концентрацию белковых экстрактов, полученную после инфильтраций при каждой ОП (±SD). (С) анализ 12-4% SDS-ПААГ с окрашиванием Кумасси и (D) и иммунологическое детектирование тяжелой цепи (γ) 2G12 и (Е) иммунологическое детектирование цепи области Fab (Fab) 2G12 через 8 дней после инфильтрации. М, маркер с указанными размерами; С, контрольный экстракт; Std, образованный СНО 2G12. Для окрашивания Кумасси белок из эквивалента 3 мг инфильтрованной ткани помещают на каждую линию с 1 мкг CHO2G12 и для вестерн-блоттинга эквивалент 0.75 мг ткани - на каждую линию с 250 нг CHO2G12. Указаны определенные продукты соединения/распада.
На Фиг.14 показано клонирование и экспрессия GFP из pEAQ-HT в нативных и His-меченых вариантах. (А) Схематическое изображение Т-ДНК pEAQ-HT с фрагментом полилинкера. (В) Спектрофлуорометрический анализ экспрессии GFP. spK = pEAQspecialK-GFP-HT, GFP, HisGFP и GFPHis = клоны pEAQ-HT. (С) 12% SDS-ПААГ и анализ методом вестерн-блоттинга экспрессии GFP. C = контрольный экстракт.
На Фиг.15 показана нуклеиновая конструкция согласно настоящему изобретению, подходящая для использования в клетках насекомых в виде части бакуловирусного вектора.
ПРИМЕРЫ
Пример 1
1.1 МЕТОДЫ
Создание вектора экспрессии FSC2 и его производных
Подходящий клонирующий вектор для экспрессии чужеродных белков из плазмиды на основе pBinP-1-GFP (Canizares et al., 2006) получали путем вырезания полной последовательности RNA-2, фланкированной промотором 35S вируса мозаики цветной капусты (Cauliflower mosaic virus, CaMV) и терминатором нопалин-синтазы (nos) из pBinP-S2NT (Liu and Lomonossoff, 2002), и путем встраивания ее в плазмиду для мутагенеза pM81W (Liu and Lomonossoff, 2006) в виде фрагмента AscI/PacI. Полученную плазмиду, pM81W-S2NT, подвергали одному циклу мутагенеза, который обеспечивал единовременное внесение четырех изменений (см. способ в Liu and Lomonossoff, 2006), с получением pM81B-S2NT-1. В результате мутагенеза происходило удаление двух сайтов BspHI из остова вектора и введение сайта BspHI (T/CATGA) вокруг AUG 512 и сайта StuI (AGG/CCT) после UAA 3299, терминирующего кодона для кодируемого RNA-2 полипротеина. Затем вырезали фрагмент BamHI/AscI из pBinP-NS-1 (Liu et al., 2005) и дотировали в подобным образом расщепленный pM81B-S2NT-1 с получением pM81-FSC-1. Данный вектор позволяет вырезать всю OPC RNA-2, расположенную ниже AUG 512, путем расщепления с помощью BspHI и StuI и заменить на любую последовательность с (тупыми)-совместимыми концами BspHI и StuI. Использование сайта BspHI имеет важное значение, поскольку он сохраняет AUG в положении 512, и данный инициатор используют для запуска трансляции встроенного гена. Для экспрессии чужеродного гена в растениях полученную из pM81-FSC-1 плазмиду расщепляют с помощью AscI и PacI и фрагмент, содержащий кассеты экспрессии, включающие чужеродные последовательности, переносят в описанным образом расщепленный pBINPLUS, после чего полученные плазмиды трансформируют в A. tumefaciens.
Для повышения удобства клонирования, расширения выбора подходящих рестрикционных ферментов и исследования влияния рамки считывания на экспрессию чужеродных генов всю OPC RNA-2 заменяли на короткий полилинкер. Комбинация встраивания олигонуклеотида и сайт-направленного мутагенеза приводила к получению pM81-FSC-2, позволяющему клонировать, с NruI (TCG/CGA) и либо XhoI (C/TCGAG), либо StuI. Терминальный аденин сайта NruI расположен в положении 512, что позволяет сохранять находящийся здесь AUG. Указанные модификации изменяли нуклеотиды непосредственно 5' до AUG в положении 512, однако сохраняли подходящее окружение. Клонирование GFP в pM81-FSC-2 так, что его трансляцию инициировали с AUG в положении 512, 513, 514 или 515, приводило к образованию полученных из pM81-FSC-1 конструкций pM81-FSC2-512, pM81-FSC2-513, pM81-FSC2-514 и pM81-FSC2-515. Данные, основанные на рМ81 плазмиды, представляют собой клонирующие векторы, содержащие кассеты экспрессии, которые затем переносили в бинарный вектор с получением векторов экспрессии FSC2-512, FSC2-513 и FSC2-514, используемых в экспериментах, показанных на Фиг.2 и 3. Различия между последовательностью сегмента генома RNA-2 дикого типа CPMV и векторами рМ81-FSC1 и pM81-FSC2 показаны в Таблице 3. Нуклеотиды, измененные в указанных векторах по сравнению с последовательностью CPMV дикого типа, показаны заглавными буквами.
Опосредуемая агробактериями временная трансформация после мобилизации в pBINPLUS (как указано выше для pM81-FSC-1) продемонстрировала, что более низкие уровни белка получают, если непрерывность рамки между AUG 161 и расположенным ниже AUG не сохраняется. Происходило значительное снижение количества GFP, транслируемого из положений +1 и +2, относительно AUG 161 и 512, тогда как трансляция с положения +3 (т.е. из положения 515 и обратно в рамке) была такой же эффективной, как и трансляция с AUG в положении 512. Для того чтобы показать, что это происходило не по причине ослабленных окружений AUGs в положении 513 и (в меньшей степени) 514, создавали FSC2-515+ с инициацией из положения +3, но с тем же «бедным» окружением, что и FSC2-513. Экспрессия из FSC2-515+ была такой же высокой, как и экспрессии из FSC2-512 или 515, тем самым означая, что расположенное ниже окружение не объясняет уменьшение экспрессии из FSC2-513 и 514.
В связи с тем, что неизвестно, что для известных механизмов, посредством которых трансляция может избежать правила первого-AUG, необходима целостность рамки, интересно, что эффективная трансляция с подвергнутого делеции вектора, основанного на RNA-2, зависит от целостности рамки между AUG 161 и расположенным ниже AUG. Для понимания и успешного преодоления данного явления создавали серии мутантов с модификациями 5'-последовательности RNA-2. Комплементарные пары олигонуклеотидов (см. Таблицу 2) использовали в сайт-направленном мутагенезе рМ81-FSC2-512, 513 и 514. В результате мутаций происходило удаление либо AUG 115 (старт-кодон для uOPC (вышележащая открытая рамка считывания)), AUG 161 (без изменения аминокислотной последовательности uOPC), либо обоих указанных вышерасположенных сайтов инициации. Двойные мутации получали путем мутагенеза мутантов A115G с олигонуклеотидами U162C (Таблица 2).
Временную экспрессию с данных мутантных транскриптов осуществляли, как описано для предыдущих конструкций pM81-FSC-2. Анализ экспрессии GFP с данных мутантов с использованием SDS-ПААГ с окрашиванием Кумасси (Фиг.2) или УФ-излучения для визуализации целых листьев (Фиг.3) показывает сильное увеличение экспрессии в отсутствие AUG в положении 161. Кроме того, удаление одного AUG 161 или обоих AUG 115 и 161 уменьшает зависимость от целостности рамки между AUG 161 и расположенным ниже AUG. В отличие от этого, удаление только AUG 115, видимо, усиливает данную зависимость, а также в целом ингибирует трансляцию. В заключение, uOPC, видимо, функционирует путем подавления трансляции с AUG 161, который одновременно является ингибирующим и придает зависимость от целостности рамки.
Электронная микроскопия сока, содержащего частицы HBcAg
Сок, используемый для получения снимка с помощью электронного микроскопа собранных частиц HBcAg, показанных на Фиг.6, получали следующим образом. Ткань листа экстрагировали в 2 объемах буфера Tris/NaCl и заменяли на ТЕ без концентрирования на колонке 100 кДа MWCO (молекулярно-массовое отсекание). Конечная концентрация HBcAg составляла приблизительно 0.2 мг/мл, исходя из сравнения со стандартом на геле SDS-ПААГ с окрашиваем Кумасси.
1.2 РЕЗУЛЬТАТЫ
(1) Влияние изменения относительных фаз сайтов инициации в положении 161 (AUG161) и 512 (AUG512)
Для достижения этого дополнительные нуклеотиды встраивали непосредственно выше AUG512 (FSC2-512) со сдвигом AUG в положение 513, 514 и 515 (FSC2-513, FSC2-514 и FSC2-515) (Фиг.1). Помещение AUG512 не в фазе с AUG161 (FSC2-513 и FSC2-514) приводило к меньшей экспрессии GFP, исходя из флуоресценции (Фиг.3) и окрашенных Кумасси гелей (Фиг.2). Восстановление фазы (FSC2-515) обеспечивало уровни экспрессии, наблюдаемые в естественной ситуации. Вывод: в случае присутствия AUG161, инициация в расположенном ниже AUG является наиболее эффективной, когда он находится в фазе с AUG в положении 161.
(2) Удаление сайта инициации в положении 115 (AUG 115) в сочетании с изменением относительных фаз сайтов инициации в положении 161 (AUG161) и 512 (AUG512)
Удаление AUG115 дает небольшой эффект и не дает эффекта, когда экспрессию GFP запускают из AUG512, т.е. когда второй AUG находится в фазе с AUG161 (см. полосы, обозначенные 10, на Фиг.2 и 3). Однако делеция AUG115, когда второй AUG находится не в фазе с AUG161 (513, 514), приводит практически к отсутствию экспрессии GFP (см. полосы, обозначенные 10, на Фиг.2 и 3). Вывод: AUG 115 некоторым образом включен в способность рибосом пропускать AUG161 и достигать AUG512. Однако для этого необходимо, чтобы расположенный ниже AUG находился в соответствующей фазе.
(3) Влияние удаления сайта инициации в положении 161 (AUG161)
Влияние данной мутации на уровни экспрессии GFP является невероятно значительным. Уровни экспрессии GFP в 20-30 раз превышают количество, обнаруживаемое в присутствии AUG161 (см. полосы, обозначенные 01, на Фиг.2 и 3). Кроме того, очевидно больше не имеет значения AUG512 какой фазы присутствует, несмотря на то, что в отсутствие AUG161 идея фазы не играет значительной роли. Кроме того, присутствие или отсутствие AUG115 не имеет значения (см. полосы, обозначенные 11, на Фиг.2 и 3).
При использовании конструкций delRNA-2 (вектор экспрессии 00 [FSC2-512] на Фиг.1) для экспрессии DsRed и HBcAg, в течение 5 дней инфильтрованные участки потеряли тургорное давление и стали хлоротическими (бледными). Через 7 дней ткань становится серой и полностью мертвой. При использовании НТ (вектор экспрессии 01 [FSC2-512] на Фиг.1) ткань остается тургесцентной через 7 дней и единственным признаком стресса является легкий хлороз экспрессирующей HBcAg ткани. Когда тяжелую цепь 2G12 IgG экспрессируют посредством delRNA-2 и сохраняют в ER, хлороз заметен через 7 дней, тогда как для НТ его не наблюдают. Таким образом, уровень некроза, наблюдаемый у растений при использовании НТ для экспрессии гетерологичного белка, гораздо ниже несмотря на более высокий уровень экспрессии гетерологичного белка, чем при использовании delRNA-2 для экспрессии гетерологичного белка.
ОБСУЖДЕНИЕ
Очень высокие уровни экспрессии чужеродных генов могут быть получены с использованием конструкций delRNA-2 путем делеции AUG161. На данный момент по результатам для GFP авторы настоящего изобретения оценивают указанные уровни как 25-30% общего растворимого белка (TSP) или приблизительно 1 грамм экспрессированного белка на кг листьев. Это огромный уровень и используемый авторами настоящего изобретения подход является очень простым. Тот факт, что сохранение рамки считывания больше не является необходимым, означает, что могут быть получены удобные для применения векторы с полилинкерами.
Пример 2
2.1 ПРЕДПОСЫЛКИ
Как описано в Примере 1 для исследования характеристик, необходимых 5'-нетранслируемой области (НТО) RNA-2 СРМС для эффективной экспрессии, авторы настоящего изобретения изучали роль двух кодонов AUG, обнаруживаемых в 5'-лидерной последовательности выше основного сайта инициации. Авторы настоящего изобретения продемонстрировали, что делеция старт-кодона (161) в рамке выше основного сайта инициации трансляции (512) приводила к огромному увеличению накопления чужеродного белка.
С использованием данной системы авторы настоящего изобретения показали, что к 6 дню после инфильтрации экспрессировался ряд несвязанных белков, включая полноразмерный IgG и самоорганизующуюся вирусоподобную частицу, до >10% и 20% общего экстрагируемого белка соответственно. Таким образом, данная система обеспечивает оптимальное средство для эффективной экспрессии, не основанное на вирусной репликации транскриптов.
Данная новая система (на примере вектора экспрессии 01 [FSC-512] на Фиг.1) была названа «CPMV-HT» для гипертранслируемой системы экспрессии белка вируса мозаики коровьего гороха.
Система HT-CPMV демонстрирует значительные увеличения уровней белка и, таким образом, представляет собой отличный способ быстрой эффективной экспрессии чужеродных белков в растениях.
За последние 25 лет был разработан ряд бинарных векторов для трансформации растений, который продолжает пополняться (Hellens et al., 2000b; Veluthambi et al., 2003; Lee and Gelvin, 2008). Таким образом, основная цель данных разработок состояла в улучшении устойчивой интеграции, например, путем расширения круга хозяев для агробактерий (Hiei et al., 1994), создания серии векторов, позволяющих выбирать селектируемые маркеры, кассеты экспрессии и гибридные белки (на примере диапазона pCAMBIA общедоступных бинарных векторов; http://www.cambia.org/daisy/bioforge_legacy/3725.html) или путем разработки систем для минимизации интеграции инородной ДНК и безмаркерной трансформации (например, pCLEAN; Thole et al., 2007).
Также были созданы бинарные векторы для репликации при низком числе копий для снижения частоты явлений многократной интеграции одно и того же трансгена, т.к. это может привести к сайленсингу генов (Johansen and Carrington, 2001).
Однако для временной экспрессии обеспечение эффективной интеграции в ядро хозяина и присутствие маркера для отбора in planta не являются строго необходимыми. Кроме того, при агроинфильтрации каждую клетку заполняют молекулами Т-ДНК, которые, как считают, являются транскрипционно компетентными в ядре даже без интеграции в геном (Janssen and Gardner, 1989; Narasimhulu et al., 1996). Это дает основание полагать, что более высокое число копий бинарных плазмид может быть полезным для временной экспрессии.
Другое направление улучшения бинарных векторов представляло собой уменьшение размера остова вектора. Два важных примера, дополнительно демонстрирующие преимущества более мелких плазмид, представляют собой pPZP (Hajdukiewicz et al., 1994) и pGREEN (Helens et al., 2000a). Помимо повышения эффективности процедур клонирования и бактериальной трансформации данные векторы обеспечили матрицы для систем экспрессии на основе многочисленных кассет, присутствующих в одной Т-ДНК (Tzfira et al., 2005; Thole et al., 2007).
Настоящий пример описывает неочевидные улучшения данного вектора, облегчающие его практическое применение, которые позволяют осуществлять клонирование в один этап вместо необходимости субклонирования кассет экспрессии между клонирующим вектором (например, pM81-FSC2) и системами экспрессии (например, PBINPLUS). Более конкретно, указанные в настоящем описании результаты демонстрируют, что можно было существенно уменьшить размер pBINPLUS без ухудшения эффективности репликации и переноса Т-ДНК. Кроме того, элементы системы CPMV-HT были включены в полученный вектор в модульном виде, благодаря чему с одной Т-ДНК можно экспрессировать многочисленные белки. Данные улучшения привели к созданию универсального вектора высокоуровневой экспрессии, позволяющего эффективно напрямую клонировать чужеродные гены.
2.2 МАТЕРИАЛЫ И МЕТОДЫ
PBD-FSC2-512-U162C (НТ) содержит кассету FSC2-512-U162C (см. Пример 1), встроенную в сайты PacI/AscI pBINPLUS (van Engelen et al., 1995). Необходимые сегменты данной плазмиды (см. ниже) амплифицировали высокоточной полимеразой, PHUSION (New England Biolabs), с использованием олигонуклеотидов, кодирующих уникальные сайты ферментов рестрикции для повторного лигирования (Таблица 4.1). Область Т-ДНК амплифицировали смысловым праймером, гомологичным последовательности выше уникального сайта AhdI (pBD-LB-F), и антисмысловым праймером, содержащим сайт ApaI (pBD-RB-ApaI-R). Область, содержащую точку начала репликации ColEI, ген NPTIII и локус TrfA, амплифицировали смысловым праймером, содержащим сайт ApaI (pBD-ColEI-ApaI-F), и антисмысловым праймером, содержащим сайт SpeI (pBD-TrfA-SpeI-R). Точку начала репликации RK2 (OriV) амплифицировали смысловым праймером, содержащим сайт SpeI (pBD-oriVSpeI-F), и антисмысловым праймером, содержащим сайт AhdI (pBD-oriV-AhdI-R). После очистки продукты расщепляли по уникальным сайтам рестрикции, кодируемым в концевых областях, и смешивали для трехточечного лигирования. В результате получали плазмиду pEAQbeta, для которой места лигирования подтверждали путем секвенирования. Детектировали делецию приблизительно 1.2 кб из Т-ДНК, в результате которой происходило удаление части терминатора nos кассеты CPMV-GFP-НТ. Соответственно, часть терминатора, включая правую границу из pBD-FSC2-GFP-НТ, повторно амплифицировали праймерами pMini>pMicroBIN-F2 и pBD-RB-ApaI-R, так же как и остов pEAQbeta, включая правую границу, с использованием праймеров pBD-ColEI-ApaI-F и pMini>pMicroBIN-R (Таблица 4.1). Очищенные продукты расщепляли с помощью ApaI и FseI и лигировали с получением pEAQ (Фиг.9).
Ген Р19, фланкированный промотором 35S и терминатором 35S, амплифицировали из pBIN61-P19 (Voinnet et al., 2003) с использованием в качестве праймеров либо 35SP19-PacI-F и 35SP19-AscIR, либо 35SP19-FseI-F и 35S-P19-FseI-R (Таблица 4.1). Ген NPTII, фланкированный промотором nos и терминатором, амплифицировали из pBD-FSC2-GFPHT с использованием праймеров pBD-NPTII-FseI-F и pBD-NPTII-FseI-R (Таблица 4.1). После А-наращивания амплифицированные кассеты лигировали в pGEM-T easy (Promega). Кассету Р19, вырезанную из pGEM-T easy с помощью FseI, лигировали в расщепленный FseI pEAQ-GFP-HT с получением pEAQexpress-GFP-HT. Кассету NPTII, вырезанную с помощью FseI, лигировали в расщепленный FseI pEAQ-GFP-HT в обоих направлениях с получением pEAQselectK-GFP-HT и pEAQselectK(rev)-GFP-HT. Кассету NPTII также вырезали с помощью PacI/AscI и лигировали в сайты AsiSI/MluI pEAQselectK-GFP-HT с получением pEAQspecialK-GFP-HT. Р19 в pGEM-T подвергали сайт-направленному мутагенезу способом QUICKCHANGE (Stratagene) с превращением Аргинина 43 в остаток триптофана с использованием праймеров P19-R43W-F и P19-R43W-R. Мутантную кассету высвобождали путем расщепления PacI/AscI и встраивали в сайты AsiSI/MluI pEAQselectK-GFP-HT с получением pEAQspecialKm-GFP-HT.
Олигонуклеотиды, кодирующие смысловую и антисмысловую цепи короткого полилинкера (Таблица 4.1), соединяли, оставляя расположенную ниже половину сайта NruI в 5'-конце и липкий конец, соответствующий сайту XhoI в 3'-конце. Соединенные олигонуклеотиды лигировали расщепленным NruI/XhoI pM81-FSC2-A115G-U162C (см. выше) с получением pM81-FSC2-POW. Сайт NruI удаляли из кассеты Р19 в pGEM-T путем сайт-направленного мутагенеза (QUICKCHANGE; Stratagene) с помощью праймеров P19-ΔNruI-F и P19-ΔNruI-R, и повторно встраивали в сайты AsiSI/MluI pEAQselectK-GFP-HT с получением pEAQspecialKΔNruI-GFP-HT, не демонстрирующего уменьшения экспрессии по сравнению с pEAQspecialK-GFP-HT (данные не представлены). Затем фрагмент PacI/AscI высвобождали из pM81-FSC2-POW и встраивали в подобным образом расщепленный pEAQspecialKΔNruI-GFP-HT, что приводило к удалению кассеты экспрессии GFP НТ и получению pEAQ-HT. GFP амплифицировали из pBD-FSC2-GFP-HT набором из четырех праймеров (Таблица 4.1) в трех комбинациях для встраивания pEAQ-HT: GFP-AgeI-F и GFP-XhoI-R; GFP-AgeI-F и GFP-XmaI-R; и GFP-XmaI-F и GFP-XhoI-R. Очищенные продукты ПЦР расщепляли ферментами, указанными в праймерах, и встраивали в подходящим образом расщепленный pEAQ-HT с получением pEAQ-HT-GFP, pEAQ-HT-GFPHis и pEAQ-HT-HisGFP.
2.3 РЕЗУЛЬТАТЫ
2.3.1 pBINPLUS содержит по меньшей мере 7.4 кб инородной последовательности
Экспрессия с CPMV-HT позволяет получать чрезвычайно высокие уровни рекомбинантных белков. Тем не менее было необходимо дополнительно улучшить указанную систему и ее использование для временной трансформации.
Первое направление улучшения относится к тому факту, что небольшие плазмиды эффективнее более крупных плазмид в реакциях лигирования и процедурах бактериальной трансформации. Сравнения со структурами более мелких бинарных векторов показывали, что pBINPLUS вероятно содержит значительные количества инородной последовательности. Определяли четыре элемента pBINPLUS, которые необходимы для подходящего функционирования в качестве бинарного вектора: Т-ДНК, точка начала репликации RK2 (OriV) широкого круга хозяев, придающий резистентность к канамицину ген NPTIII (Trieu-Cuot and Courvalin, 1983) и TrfA из RK2, способствующий репликации (Фиг.9). Биоинформационный анализ оставшихся участков остова показывает, что они являются артефактами конструкции pBIN19, основанной на присутствии подходящих сайтов рестрикции в исходных плазмидах (Bevan, 1984). Данные наблюдения подтверждаются сообщением о полном секвенировании pBIN19 (Frisch et al., 1995). pBINPLUS содержит не являющуюся необходимой точку начала репликации ColEI для более высокого числа копий в Е.coli. В Т-ДНК может быть обнаружено приблизительно 2.6 кб лишней ДНК. Это включает селектируемый маркер NPTII для трансформации растений, не являющийся необходимым для временной экспрессии. Суммарное общее количество инородной последовательности в pBINPLUS очевидно составляет больше 7.2 кб
2.3.2 Создание серии pEAQ
Для мониторинга влияния на экспрессию, являющегося следствием модификаций вектора, авторы настоящего изобретения начинали с полученной из pBINPLUS плазмидой, pBD-FSC2-512-U162C(HT). Три области, состоящие из Т-ДНК, точки начала репликации RK2 (OriV) и сегмента, содержащего точку начала репликации ColEI, NPTIII, и TrfA, амплифицировали путем ПЦР из pBD-FSC2-GFP-HT. Лигирование данных трех фрагментов приводило к получению плазмиды pEAQbeta (Фиг.9), которая на 4584 п.о. меньше исходной плазмиды. В результате последующего цикла амплификации pEAQbeta путем ПЦР удаляли 2639 п.о. не являющейся необходимой последовательности из области Т-ДНК и встраивали три уникальных сайта рестрикции, AsiSI, MluI и FseI. Расщепление AsiSI/MluI совместимо со встраиванием фрагментов PacI/AscI, соответственно, очень подходит для клонирования многочисленных кассет из всех предшествующих клонирующих векторов CPMV. FseI обеспечивает уникальный сайт узнавания из 8 оснований, подходящий для взаимной замены различных маркеров селекции или кассет супрессора сайленсинга. Полученная плазмида pEAQGFP-HT в два раза меньше по размеру, чем pBINPLUS, и без кассеты экспрессии CPMVHT составляла бы всего 5137 п.о., что делает ее одним из самых маленьких известных бинарных векторов (Фиг.9). Плазмиду pEAQ секвенировали полностью и было обнаружено, что точка начала репликации RK2 находилась в ориентации, обратной той, о которой сообщали ранее (Frisch et al., 1995) и, соответственно, обозначена в правильной ориентации в pEAQ-GFP-HT.
pEAQ-GFP-HT использовали в качестве исходной точки для включения различных дополнительных элементов в Т-ДНК (Фиг.10). Кассету NPTII из pBINPLUS повторно встраивали в сайт FseI в pEAQ как в прямой, так и обратной ориентации относительно кассеты GFP-HT с получением pEAQselectK-GFP-HT и pEAQselectK(rev)-GFP-HT. Кассету 35S-P19 встраивали в сайт FseI с получением pEAQexpress-GFP-HT. Наконец, кассету 35S-P19 встраивали в сайты Mlu/AsiSI pEAQselectK-GFP-HT с получением pEAQspecialK-GFP-HT. Таким образом, создавали серии небольших бинарных векторов для легкой и быстрой временной экспрессии.
2.3.3 Уменьшение размера не нарушает временную экспрессию из pEAQ
Агроинфильтрация серии векторов pEAQ показывает, что значительное уменьшение размера не приводит к существенному ухудшению уровней экспрессии в анализах временной экспрессии. Ко-инфильтрация pEAQ-GFP-HT и pEAQselectK(rev)-GFP-HT с Р19, обусловленная pBIN61-P19, приводила к уровням экспрессии, существенно не отличающимся от ко-инфильтрации pBD-FSC2-512-HT и Р19. Это можно наблюдать при УФ-освещении (Фиг.11А), SDS-ПААГ (Фиг.11В) и измерениях спектрофлуоресценции GFP в белковых экстрактах (Фиг.11С). Интересно, что ориентация кассеты NPTII в Т-ДНК очевидно влияет на уровень экспрессии. pEAQselectK демонстрирует заметное улучшение по сравнению с иным образом идентичным pEAQselectK(rev), приводящее к снижению накопления GFP.
Теоретически введение супрессора молчащей кассеты в pEAQ не должно влиять на его способность улучшать уровень временной экспрессии с чужеродного гена, экспрессируемого с той же Т-ДНК. В самом деле, инфильтрация одного pEAQexpress-GFP-HT также приводила к уровням экспрессии, близким к или лучшим, чем обеспечиваемые pBD-FSC2-GFP-HT (Фиг.7.3). Кроме того, для тестирования эффективности pEAQexpress культуру агробактерии двукратно разводили таким образом, что конечная оптическая плотность (ОП) была равна оптической плотности каждой отдельной культуры, подвергнутой ко-инфильтрации.
Как и ожидали, это обеспечивало близкие высокие уровни экспрессии и, соответственно, демонстрировало, что введение и представляющего интерес гена и супрессора сайленсинга в одну Т-ДНК позволяет использовать половинное количество агробактерий (Фиг.11). Соответственно, CPMV-HT можно использовать для эффективной экспрессии чужеродного белка, если все компоненты присутствуют в одной Т-ДНК.
2.3.4 Мутантная Р19 может подавлять сайленсинг трансгена в анализе временной экспрессии
Для того чтобы воспользоваться преимуществом повышения экспрессии, обусловленным прямой ориентацией кассеты NPTII в Т-ДНК, кассету Р19 встраивали между сайтами AsiSI и MluI в pEAQselectK-GFP-HT с получением pEAQspecialK-GFP-НТ (Фиг.10). Присутствие Р19 в той же Т-ДНК, что и последовательность GFP, приводит к уровням экспрессии, схожим с pEAQselectK-GFPHT, ко-инфильтрованным с Р19 (Фиг.12). Это больше, чем экспрессия, получаемая посредством pEAQexpress-GFP-HT, и очевидно обусловлено присутствием кассеты NPTII (Фиг.12). С другой стороны, более низкая экспрессии из pEAQexpress может быть обусловлена другим положением и ориентацией кассеты Р19 в Т-ДНК. Тем не менее, как и в случае pEAQexpress, векторы pEAQspecialK обеспечивают эффективную экспрессию с суспензиями агробактерии при половине конечной ОП, используемой, когда должны быть ко-инфильтрованы две культуры.
Комбинирование кассеты экспрессии чужеродных генов с кассетой Р19 и селектируемым маркером позволяет тестировать эффективность CPMV-HT в трансгенных растениях. Однако конститутивная экспрессия супрессоров сайленсинга, таких как Р19, может приводить к нежелательным фенотипам вследствие нарушения эндогенного сайленсинга генов, связанного с процессами развития (Silhavy and Burgyan, 2004). Было сделано предположение, что охарактеризованная недавно мутации Р19 (R43W) обладает сниженной активностью в отношении эндогенного сайленсинга генов и, следовательно, может являться лучшим кандидатом для подавления сайленсинга трансгенов в стабильных трансформантах (Scholthof, 2007). Для исследования возможности стабильной трансформации системой CPMV-HT и Р19 дикого типа, и мутантную Р19 встраивали в Т-ДНК pEAQselectK-GFP-HT, после чего проводили анализ временной экспрессии указанных вариантов. Как показано, путем УФ-освещения инфильтрованных листьев, электрофореза в SDS-ПААГ белковых экстрактов и путем спектрофлуорометрических измерений уровней GFP мутантная Р19 в pEAQspecialKm приблизительно в два раза менее эффективна в улучшении экспрессии чужеродных генов, чем Р19 дикого типа в pEAQspecialK (Фиг.12). Это - первое исследование влияния мутации R43W в Р19 на способность подавлять сайленсинг трансгена.
Пример 3
Эффективная экспрессия IgG с единственной плазмиды
Для того чтобы воспользоваться преимуществом модульной природы серии pEAQ, кассеты экспрессии CPMV-HT, содержащие ER-фиксированную тяжелую цепь (НЕ) и легкую цепь (L) анти-HIV IgG человека, 2G12, встраивали в сайты PacI/AscI и AsiSI/MluI pEAQexpress. Для определения того, влияет ли сайт встраивания на уровни экспрессии, цепи L и НЕ встраивали в оба положения с получением pEAQex-2G12HEL и pEAQex-2G12LHE (Фиг.13А). Инфильтрация N. Benthamiana одиночными культурами агробактерии, содержащими указанные выше плазмиды, приводила к получению полностью «собранных» антител 2G12, идентичных по размеру 2G12, полученных путем смешивания трех культур агробактерий, каждая из которых экспрессировала индивидуальные компоненты L, НЕ и Р19 (Фиг.13С). Белок, загруженный на каждую дорожку, представляет собой 1/30 экстракта, полученного из 90 мг инфильтрованной ткани, или 1/333 белка, который можно получить из 1 г ткани. Максимальное количество «собранного» IgG, полученного из смеси 3 штаммов, соответствует 1 мкг образованного СНО 2G12 на невосстановленном геле SDS-ПААГ с окрашиванием Кумасси. Это указывает на уровень экспрессии 2G12 выше 325 мг/кг массы сырой ткани, что соответствует концентрациям, измеренным путем ППР. Использование pEAQex-2G12HEL очевидно превосходит данный уже высокий уровень накопления антител.
Преимуществом полученных из pEAQ векторов является то, что каждый компонент многоцепочечного белка, такого как IgG, может быть автоматически доставлен в каждую инфицированную клетку. Соответственно, при более высоких разведениях суспензий агробактерий будут сохранятся более высокие уровни экспрессии, чем в случае, если нужно использовать многочисленные культуры. Чтобы определить, так ли это на практике, культуры, которые вначале ресуспендировали до ОП 1.2 и, в случае необходимости, смешивали, подвергали двум последовательным 3x разведениям (Фиг.13В). Это давало конечные ОП каждой индивидуальной культуры в смеси трех культур, равные 0.4, 0.13 и 0.04. Отдельные культуры, содержащие конструкции pEAQexpress, инфильтрировали при ОП, равных 1.2, 0.4 и 0.13. Когда использовали три отдельные культуры уровень «собранных» 2G12 заметно снижался при серийных разведениях. В отличие от этого, экспрессия 2G12 с pEAQex-2G12HEL и pEAQex-2G12LHE сохранялась на стабильно высоком уровне, при этом снижение при разведении было очень умеренным (Фиг.13С-Е). Отсутствие чувствительности к разведению подтверждает повышенную эффективность, достигаемую благодаря размещению всех трех кассет экспрессии в одной Т-ДНК. Интересно, что общее количество белка, экстрагированного из инфильтрованной ткани, уменьшалось почти в два раза, при снижении ОП инфильтрата с 1.2 до 0.4. Это указывает на то, что значительная часть указанного белка в экстрактах из ткани, в которую инфильтрована суспензия с большей ОП, может содержать белок агробактерий или растительные белки, продуцируемые в ответ на более высокие концентрации агробактерий.
Рассмотрение Фиг.13С указывает на то, что относительное положение кассеты в Т-ДНК может влиять на уровни экспрессии. Общая экспрессия с pEAQex-2G12LHE была несколько ниже, чем с pEAQex-2G12HEL. Это подтверждали путем вестерн-блоттинга невосстановленных образцов, который также указывал на некоторые различия в содержании продуктов распада и невнедреных цепей иммуноглобулина (Фиг.13С-Е). Оказалось, что в ткани, инфильтрованной pEAQex-2G12LHE, отсутствует специфический для тяжелой цепи продукт распада приблизительно 70-80 кДа (Фиг.13D). Также оказалось, что присутствует гораздо меньше собранного промежуточного HL2, а также больше свободной легкой цепи (Фиг.13Е). Поскольку тяжелая цепь ограничивает сборку 2G12 в растениях (Markus Sack, pers. comm., RWTH, Aachen, Германия), что подтверждено отсутствием распознаваемой свободной тяжелой цепи во всех образцах, данные результаты означают, что pEAQex-2G12LHE образует меньше тяжелой цепи, чем pEAQex-2G12HEL. Это может быть обусловлено пониженной экспрессией с кассеты CPMV-HT, расположенной ближе к левой границе Т-ДНК.
В других экспериментах (данные не представлены) указанную систему CPMV-HT также успешно использовали во временном формате в N. Benthamiana для экспрессии:
- Вируса синего языка овец (Bluetongue virus) (серотип 10) VP2, VP3, VP5, VP7 и NS1.
- Ротавируса NSP5.
- Кальмодулина из Medicago truncatula (который затем очищали).
- Трудного для экспрессии эктодомена гамма-рецептора 1 Fc человека (CD64), который был очищен и который, как показано, является функциональным в исследованиях связывания антител.
- Малые (S) и большие (L) белки оболочки CPMV экспрессировали совместно и, как показано, они соединяются в вирусоподобные частицы (данные не представлены).
Пример 4
Прямое клонирование в вектор экспрессии CPMV-HT
Несмотря на объединение элементов системы в одной плазмиде, для векторов, указанных выше в настоящем описании, по-прежнему была необходима процедура двухэтапного клонирования для введения экспрессируемой последовательности в бинарную плазмиду. Согласно настоящему примеру предложена бинарная плазмида, в которую может быть напрямую встроен представляющий интерес ген. Указанная плазмида содержит полилинкер, который не только обеспечивает возможность прямого встраивания в плазмиду на основе pEAQ, но также обеспечивает слияние С- или N-концевой гистидиновой метки при необходимости (pEAQ-HT; Фиг.14А). Указанный полилинкер сначала встраивали в виде соединенных олигонуклеотидов в pM81-FSC2-512(A115G)(U162C) с получением pM81-FSC-POW. Данная конструкция по-прежнему может быть использована для стандартной двухэтапной процедуры клонирования для получения конструкций на основе pEAQ для экспрессии многочисленных полипептидов. Кроме того, использование дважды мутированной 5'-лидерной последовательности может позволить получать даже более высокие уровни экспрессии, чем это возможно с использованием однократной мутации. Затем кассету CPMV-HT переносили в pEAQspecialK с использованием сайтов PacI/AscI, в результате чего получали pEAQ-HT. Встраивание GFP во все три положения в пределах полилинкера pEAQ-HT обеспечивало получение немеченого GFP и гибридов 5' (HisGFP) и 3' (GFPHis) His-меток.
Как и ожидали, уровень экспрессии немеченого GFP был даже выше уровня, полученного с использованием pEAQspecialK-GFP-HT, и составил больше 1.6 г/кг массы сырой ткани (Фиг.14В). Вероятно, это является следствием того факта, что 5'-лидерная последовательность CPMV pEAQ-HT содержит дополнительную мутацию, которая приводит к удалению AUG 115, который при удалении в дополнение к AUG 161, дополнительно усиливает экспрессию.
Присутствие His-метки, детектированное методом вестерн-блоттинга, подтверждало подходящее слияние и на N-, и на С-конце аминокислотных остатков, кодируемых полилинкером. Все три варианта GFP можно было детектировать анти-GFP антителами, на HisGFP и GFPHis удавалось детектировать анти-His антителами (Фиг.14С), и присутствие His-метки уменьшало подвижность полосы GFP в SDS-ПААГ на ожидаемую величину. Указанная метка также снижала количество GFP, детектируемое при анализе флуоресценции (Фиг.14В). Данный эффект был более выражен для N-концевой His-метки. Интенсивность окрашенных Кумасси полос показывает, что она отражает уменьшение накопления меченого GFP (Фиг.14С), а не нарушение флуорогенных свойств GFP. Тем не менее, уровни меченых His белков по-прежнему были очень высокими, образуя более 0.6 и 1.0 г GFP на кг массы сырой ткани.
Обсуждение Примеров 2-4
Для повышения удобства использования и эффективности системы экспрессии CPMV-HT был создан модульный набор векторов для легкой и быстрой экспрессии в растениях.
Удаление более половины остова плазмиды из бинарного вектора, pBINPLUS, и некоторой части области Т-ДНК, не являющейся необходимой для временной экспрессии, приводило к получению одной из самых маленьких бинарных плазмид Ti, которая, как известно, не ухудшает уровень экспрессии.
Близкая часть остова была ранее удалена из pBIN19 без потери эффективности (Xiang et al., 1999). Однако pBINPLUS обладает двумя значительными преимуществами по сравнению с pBIN19 (van Engelen et al., 1995): увеличенное число копий в Е.Coli вследствие добавления точки начала репликации ColEI и переориентированная Т-ДНК, благодаря которой представляющий интерес ген находится дальше от левой границы, которая может претерпевать обширные делеции in planta (Rossi et al., 1996). В то время как меньший размер плазмид pEAQ не оказывал существенного влияния на число копий, они давали существенно улучшенные выходы во время процедур клонирования с использованием коммерческих наборов для экстракции плазмид, т.к. они наиболее эффективны для плазмид менее 10 кб (данные не представлены).
Модульная природа бинарного вектора pEAQ увеличивает функциональность экспрессии CPMV-HT, обеспечивая при необходимости совместную экспрессию любого супрессора сайленсинга и/или маркерного гена с одной или двумя кассетами CPMV-HT. Например, встраивание второй кассеты НТ, содержащей гетерологичную последовательность, в сайты AsiSI/MluI pEAQexpress-GFP-HT позволяет следить за экспрессией по флуоресценции GFP.
Кроме того, пластичность векторов упрощает систему для временной экспрессии, поскольку требует инфильтрации только одной конструкции агробактерии и повышает эффективность путем уменьшения количества инфильтрата, необходимого на число кассет экспрессии, присутствующих в Т-ДНК. С Р19, занимающей сайт FseI, присутствие двух сайтов клонирования для приема кассет НТ из клонирующих векторов (таких как pM81-FSC2-U162C) также обеспечивает даже более эффективную экспрессию состоящих из многочисленных субъединиц белков, таких как полноразмерные антитела.
Влияние Р19 на повышение уровней экспрессии трансгенов хорошо описано (Voinnet et al., 2003). Однако данное исследование впервые продемонстрировало ее эффективность при совместной доставке в каждую клетку в одной Т-ДНК. В более ранних исследованиях сообщали о совместной доставке Р19 из раздельных Т-ДНК в одной агробактерии в виде содержащей трансген Т-ДНК (Hellens et al., 2005). Однако эффекта Р19 не наблюдали до 6 дней после инфильтрации, что указывает на неэффективный перенос Т-ДНК. Настоящее исследование также впервые демонстрирует использование мутанта R43W Р19 для усиления экспрессии трансгена. То, что указанный мутант был примерно в два раза менее эффективен в усилении экспрессии GFP, чем Р19 дикого типа, согласуется с известным уменьшением его активности, снижающим как инфекционность TBSV (Chu et al., 2000), так и способность белка связываться с классом более мелких (21-22 nts) коротких интерферирующих РНК (Omarov et al., 2006). Однако возможно, что данная особенность делает мутант R43W более подходящим для применения, включая стабильную трансформацию. МикроРНК, связанные с развитием, также относятся к классу более мелких (Vaucheret, 2006; Zhang et al., 2006) и, следовательно, на процессы развития присутствие мутантной Р19 может влиять не так сильно, как присутствие варианта дикого типа (Scholthof, 2007). Кроме того, указанный мутант может обеспечить способ контроля временной экспрессии потенциально цитотоксических чужеродных белков.
Экспрессия 2G12 с одной плазмиды отражает самый высокий из зафиксированных выходов антитела из растительной ткани, инфильтрованной одной культурой агробактерии. Помимо использования трех культур агробактерий для экспрессии CPMV-HT единственный способ достижения близких уровней с использованием другой системы включал инфильтрацию 6 отдельных культур и подход с использованием вирусного вектора (Giritch et al., 2006). Кроме того, использование одной плазмиды позволяет уменьшить количество бактерий, необходимое для обеспечения совместной доставки многочисленных кассет экспрессии, что позволит значительно снизить расходы на уровне промышленного производства. Процесс инфильтрации также физически легче осуществлять с использованием более разведенных культур вследствие меньшей закупорки межклеточных пространств ткани листа. Кроме того, разведение до общей ОП, равной 0.4, уменьшало количество получаемых вследствие инфильтрации белковых загрязнителей. Анализ девяти отдельных инфильтраций при каждой ОП демонстрировал уменьшение белковых концентраций экстрактов от 2.7±0.2 до 1.5±0.1 мг/мл, когда ОП культур уменьшали от 1.2 до 0.4. Т.к. использование pEAQexpress позволяет получать столько же 2G12 при ОП, равной 0.4, сколько и с использованием трехкультурной системы при ОП инфильтрата, равной 1.2, рекомбинантный целевой белок должен быть очищен только от половины загрязняющего белка с использованием pEAQexpress. Это дает подходящее и неожиданное преимущество в отношении последующего процессинга. Экспрессия 2G12 из pEAQexpress также демонстрирует влияние положения кассеты экспрессии в Т-ДНК векторов pEAQ на уровень достигаемой экспрессии. Увеличение накопления свободных легких цепей из pEAQex-2G12LHE показывает, что с помощью данной конструкции экспрессируют меньше тяжелой цепи, что очевидно приводит меньшему количеству собранного антитела. Это может быть следствием расположения кассет экспрессии в Т-ДНК. Либо часть Т-ДНК чувствительна к нуклеотидному распаду в левой границе (Rossi et al., 1996). Оказалось, что повторное встраивание кассеты NPTII в Т-ДНК заметно влияет на экспрессию, зависящую от ее ориентации. Во время процедур клонирования стало очевидным, что pEAQselectK-GFP-HT достигает числа копий плазмиды в Е.Coli приблизительно в 1.5 раза большего, чем pEAQselectK(rev)- GFP-HT (определено исходя из измерений выхода трех отдельных препаратов плазмид, проведенных с использованием набора QIAprep, QIAGEN). Это приблизительно коррелирует с различием в уровнях экспрессии, наблюдаемым между двумя векторами. Неизвестно, что обеспечивает увеличение числа копий, и существует ли это различие, когда плазмиды переносят в агробактерии. Однако данные наблюдения показывают, что число копий плазмид может иметь важное значение для эффективной опосредуемой агробактерией временной экспрессии. В связи с этим, использование точки начала репликации RK2 (oriV на Фиг.9) pBIN19 и его производными является правильным выбором для временной экспрессии, поскольку известно, что плазмиды RK2 накапливают до 7-10 копий в агробактерии (Veluthambi et al., 1987). Это аналогично точке начала репликации pVS1, используемой pPZP, и примерно в 2-5 раз выше, чем получают при использовании точки начала репликации pSa (Lee arid Gelvin, 2008), присутствующей в широко используемом бинарном векторе pGREEN (Helens et al., 2000). Плазмиды, содержащие точки начала репликации, дающие более высокое число копий, такие как плазмиды на основе pRi (Lee and Gelvin, 2008), могут даже лучше подходить для временной экспрессии.
Для того чтобы сделать эффективную экспрессию с использованием векторов pEAQ легкодоступной для лабораторий, не имеющих предшествующего опыта экспрессии с использование CPMV или экспрессии на основе растений, создали вариант pEAQ прямого клонирования. Его получили путем встраивания полилинкера между 5'-лидерной последовательностью и 3'-НТО кассеты экспрессии CPMVHT, расположенной в Т-ДНК, также содержащей кассеты Р19 и NPTII. Кассету NPTII включали, поскольку оказалось, что ее присутствие значительно усиливало экспрессию (см. выше). Указанный полилинкер также кодирует два набора 6 x остатков гистидина, что обеспечивает слияние N- или C-концевых His-меток и таким образом облегчает очистку белка. Вторая мутация в 5'лидерной последовательности, усиливающая экспрессию относительно НТ, также полезна для полученных конструкций.
Данные кассеты повышенной экспрессии также могут быть субклонированы из клонирующего вектора pM81-FSC-POW в любую плазмиду pEAQ. Использование pEAQHT приводило к увеличенной экспрессии GFP по сравнению с pEAQspecialK, содержащей только одну мутацию (U162C). Кроме того, создание полилинкера также позволяло экспрессировать His-меченые варианты с использованием одноэтапной процедуры клонирования. Модульные бинарные векторы, предложенные в настоящем описании, предназначены для (без ограничения) использования с экспрессией CPMV-НТ. Чрезвычайно эффективная экспрессия сочеталась с повышенной эффективностью клонирования и удобством использования. Указанная система обеспечивает наиболее эффективный и простой способ временной экспрессии белков с дополнительными характеристиками в растениях без сложностей вирусной амплификации. Он позволяет получать миллиграммовые количества рекомбинантного белка в течение двух недель идентификации последовательностей в любой микробиологической лаборатории с возможностью выращивания растений. Соответственно, ожидается, что он обеспечит крайне ценный инструмент для академических и промышленных целей.
Пример 5
Стабильная интеграция плазмидами pEAQ и трансгенные растения
Несмотря на то что серию векторов pEAQ создавали для временной экспрессии, повторное встраивание кассеты NPTII в Т-ДНК обеспечивает селектируемый маркер для интеграции генома. Это дает возможность использовать данные более мелкие и более подходящие векторы для стабильной трансформации растений и культуры клеток растений. При использовании для трансформации дисков листьев N. benthamiana векторы pEAQ, содержащие кассету NPTII в Т-ДНК, обладали способностью индуцировать каллусообразование, по которому ведется отбор, с той же эффективностью, что и конструкции на основе pBINPLUS. Кроме того, экспрессию GFP можно было детектировать в данных тканях с использованием УФ-излучения (данные не представлены). Это показывает, что мультикассетные молекулы Т-ДНК из векторов pEAQ могут стабильно интегрироваться в геном растений и управлять экспрессией чужеродных генов.
Флуоресцентные растения также были регенерированы. Листья первичных трансформантов (Т0) флуоресцировали под действием УФ-излучения, указывая на высокие уровни экспрессии GFP. Семя самооплодотворенных растений Т0 было жизнеспособным и полученные всходы T1, содержащие трансген, также являются флуоресцентными (результаты не представлены).
Пример 6
Использование основанной на CPMV системы НТ с бакуловирусными векторами
На Фиг.15 показана конструкция, подходящая для использования основанной на CPMV системы НТ с бакуловирусными векторами в клетках насекомых. Под контролем промотора р10, НТО RNA-2 CPMV HyperTrans также усиливают экспрессию GFP в клетках насекомых с использованием системы экспрессии на основе бакуловируса. Получали приблизительно 5-кратное усиление уровней флуоресценции в инфицированных бакуловирусом клетках sf21, согласно измерению путем проточной цитометрии, по сравнению с конструкцией, не содержащей кассету CPMV-HT.
ССЫЛКИ
Alamillo, J. M., Monger, W., Sola, I., Garcia, В., Perrin, Y., Bestagno, M., Burrone, O.R., Plana-Duran, J., Enjuanes, L., Lomonossoff, P.G. and Garcia, J.A. (2006) Use of virus vectors for the expression in plants of active full-length and single chain anticoronavirus antibodies. Biotechnol. J. 1, 1103-1111.
Brigneti, G., Voinnet, O., Li, W.X, Ji, LH, Ding, S.W and Baulcombe, D.C. (1998) Viral pathogenicity determinants are suppressors of transgene silencing in Nicotiana benthamiana. EMBO Journal 17:6739-6746.
Caηizares, M. C, Liu, L., Perrin, Y., Tsakiris, E. and Lomonossoff, GP. (2006). A bipartite system for the constitutive and inducible expression of high levels of foreign proteins in plants. Plant Biotechnol. J. 4, 183-193.
Gopinath, K., Wellink, J., Porta, C, Taylor, K.M., Lomonossoff, G. P. and van Kammen, A. (2000) Engineering cowpea mosaic virus RNA-2 into a vector to express heterologous proteins in plants. Virology 267:159-173.
Holness, С.L., Lomonossoff, G. P., Evans, D. and Maule, AJ. (1989). Identification of the initiation codons for translation of cowpea mosaic virus middle component RNA using site directed mutagenesis of an infectious cDNA clone. Virology 172, 311 320.
Liu, L. and Lomonossoff, G.P. (2002) Agroinfection as a rapid method for propagating Cowpea mosaic virus-based constructs. J. Virol. Methods 105, 343-348.
Liu, L. and Lomonossoff, G.P. (2006) A site-directed mutagenesis method utilising large double-stranded DNA templates for the simultaneous introduction of multiple changes and sequential multiple rounds of mutation: Application to the study of whole viral genomes. J. Virol. Methods 137, 63-71.
Liu, L., Canizares, M.C., Monger, W., Perrin, Y., Tsakiris, E., Porta, C, Shariat, N., Nicholson, L. and Lomonossoff, G.P. (2005). Cowpea mosaic virus-based systems for the production of antigens and antibodies in plants. Vaccine 23, 1788-1792.
Lomonossoff, G. P. & Shanks, M. (1983). The nucleotide sequence of cowpea mosaic virus В RNA. EMBO Journal 2, 2253-2258.
Mechtcheriakova, IA, Eldarov, MA, Nicholson, L., Shanks, M., Skryabin, K.G. and Lomonossoff, GP. (2006) The use of viral vectors to produce hepatitis В virus core particles in plants. J. Virol. Methods 131, 10-15.
Monger, W., Alamillo, J. M., Sola, I., Perrin, Y., Bestagno, M., Burrone, O.R., Sabella, P., Plana-Duran, J., Enjuanes, L., Garcia, J.A. and Lomonossoff, G.P. (2006) An antibody derivative expressed from viral vectors passively immunizes pigs against transmissible gastroenteritis virus infection when supplied orally in crude plant extracts. Plant Biotechnol. J. 4, 623-631.
Rohll, J. В., Holness, C.L., Lomonossoff, G.P. and Maule, A.J. (1993). 31 terminal nucleotide sequences important for the accumulation of cowpea mosaic virus M-RNA. Virology 193, 672-679.
Sainsbury, F., Lavoie, P-O., D'Aoust, M-A., Vezina, L-P. and Lomonossoff, G.P. (2008). Expression of Multiple Proteins Using Full-Length and Deleted Versions of Cowpea Mosaic Virus RNA-2. Plant Biotechnology Journal, 6:82-92.
Sainsbury, F., Canizares, M. C. and Lomonossoff, G.P. (2007) Cowpea mosaic virus-based expression vectors. In: Virus Expression Vectors (Hefferon, K. ed), pp.339-555. Kerala, India: Transworld Research Network.
Sainsbury, F. and Lomonossoff, G.P. (2008). Extremely high-level and rapid transient protein production in plants without the use of viral replication. Plant Physiology 148, 1212-1218.
Sainsbury, F., Liu, L. and Lomonossoff G.P. (2009) Cowpea mosaic virus-based expression of antigens and antibodies in plants. In: Methods in Molecular Biology Vol. 483: Recombinant Pharmaceutical Proteins from Plants (Faye, L. and Gomord, V. eds), pp25-39, NY: Humana Press.
van Bokhoven, H., Le Gall, O, Kasteel, D., Verver, J., Wellink, J. and van Kammen, A. (1993). Cis- and Trans-acting Elements in Cowpea Mosaic Virus RNA Replication. Virology 195, 377-386.
Wellink J, Verver J, van Kammen A. (1993). Mutational analysis of AUG codons of cowpea mosaic virus M RNA. Biochimie. 75(8):741-7.
Дополнительные ссылки:
Lee LY1 Gelvin SB (2008) T-DNA binary vectors and systems. Plant Physiology 146:325-332.
Hajdukiewicz P, Svab Z, Maliga P (1994) The small, versatile pPZP family of Agrobacterium binary vectors for plant transformation. Plant Molecular Biology 25:989-994.
Hellens R, Mullineaux P, Klee H (2000b) A guide to Agrobacterium binary Ti vectors. Trends in Plant Science 5:446-451.
Hiei Y, Ohta S, Komari T, Kumashiro Т (1994) Efficient transformation of rice (Oryza- sativa L) mediated by Agrobacterium and sequence-analysis of the boundaries of the T-DNA. Plant Journal 6:271-282.
Veluthambi K, Jayaswal RK, Gelvin SB (1987) Virulence genes-a, gene-G, and gene-D mediate the double-stranded border cleavage of T-DNA from the Agrobacterium Ti plasmid. Proceedings of the National Academy of Sciences of the United States of America 84:1881-1885.
Thole V, Worland B, Snape JW, Vain P (2007) The pCLEAN dual binary vector system for Agrobacterium-Mediated plant transformation. Plant Physiology 145:1211-1219.
Johansen LK, Carrington JC (2001) Silencing on the spot. Induction and suppression of RNA silencing in the Agrobacterium-mediated transient expression system. Plant Physiology 126:930-938.
Janssen BJ, Gardner RC (1989) Localized transient expression of Gus in leaf-disks following cocultivation with Agrobacterium. Plant Molecular Biology 14:61-72.
Narasimhulu SB, Deng X, Sarria R, Gelvin SB (1996) Early transcription of Agrobacterium T-DNA genes in tobacco and maize. Plant Cell 8:873-886.
Hellens RP, Edwards EA, Leyland NR1 Bean S, Mullineaux PM (2000a) pGreen: a versatile and flexible binary Ti vector for Agrobacterium-mediated plant transformation. Plant Molecular Biology 42:819-832.
Tzfira T, Tian GW, Lacroix B, Vyas S, Li JX, Leitner-Dagan Y, Krichevsky A, Taylor T, Vainstein A, Citovsky V (2005) pSAT vectors: a modular series of plasmids for autofluorescent protein tagging and expression of multiple genes in plants. Plant Molecular Biology 57:503-516.
Voinnet O, Rivas S, Mestre P, Baulcombe D (2003) An enhanced transient expression system in plants based on suppression of gene silencing by the p19 protein of tomato bushy stunt virus. Plant Journal 33:949-956.
Frisch DA, Harrishaller LW, Yokubaitis NT, Thomas TL, Hardin SH, Hall TC (1995) Complete sequence of the binary vector BIN-19. Plant Molecular Biology 27:405-409.
Trieu-cuot P, Courvalin P (1983) Nucleotide-sequence of the Streptococcus-faecalis plasmid gene encoding the 3'5"-Aminoglycoside phosphotransferase type-III. Gene 23:331-341.
Bevan M (1984) Binary Agrobacterium vectors for plant transformation. Nucleic Acids Research 12:8711-8721.
Silhavy D, Burgyan J (2004) Effects and side-effects of viral RNA silencing suppressors on short RNAs. Trends in Plant Science 9:76-83.
Scholthof HB (2007) Heterologous expression of viral RNA interference suppressors: RISC management. Plant Physiology 145:1110-1117.
van Engelen FA, Molthoff JW, Conner AJ, Nap JP, Pereira A, Stiekema WJ (1995) pBINPLUS - an improved plant transformation vector based on pBIN19. Transgenic Research 4:288-290.
Rossi L, Hohn B, Tinland В (1996) Integration of complete transferred DNA units is dependent on the activity of virulence E2 protein of Agrobacterium tumefaciens.
Proceedings of the National Academy of Sciences of the United States of America 93:126-130
Xiang CB, Han P, Lutziger I1 Wang K, Oliver DJ (1999) A mini binary vector series for plant transformation. Plant Molecular Biology 40:711-717.
Hellens RP1 Allan AC, Friel EN, Bolitho K, Grafton K, Templeton MD, Karunairetnam S, Gleave AP, Laing WA (2005) Transient expression vectors for functional genomics, quantification of promoter activity and RNA silencing in plants. Plant Methods 1:13.
Chu M, Desvoyes B, Turina M, Noad R, Scholthof HB (2000) Genetic dissection of tomato bushy stunt virus p19-protein-mediated host-dependent symptom induction and systemic invasion. Virology 266:79-87.
Omarov R1 Sparks K, Smith L, Zindovic J, Scholthof HB (2006) Biological relevance of a stable biochemical interaction between the tombusvirus-encoded P19 and short interfering RNAs. Journal of Virology 80:3000-3008.
Vaucheret H (2006) Post-transcriptional small RNA pathways in plants: mechanisms and regulations. Genes & Development 20:759-771
Zhang BH, Pan XP, Cobb GP, Anderson ТА (2006) Plant microRNA: A small regulatory molecule with big impact. Developmental Biology 289:3-16.
Giritch A, Marillonnet S, Engler C, van Eldik G, Botterman J, Klimyuk V, Gleba Y (2006) Rapid high-yield expression of full-size IgG antibodies in plants coinfected with noncompeting viral vectors. Proceedings of the National Academy of Sciences of the United States of America 103:14701-14706.


Старт-кодоны в положениях 115, 161, 512 и 524 сегмента генома RNA-2 CPMV выделены жирным шрифтом и подчеркнуты.
Мутантный нуклеотид в олигонуклеотидах, используемых в мугагенезе 5'-области клонов pM81-FSC-2, выделен жирным шрифтом.

Отличия в нуклеотидах между последовательностью векторов pM81-FSC-1 и pM81-FSC-2 и последовательностью CPMV дикого типа из Таблицы 1 показаны заглавными буквами.
Реферат
Изобретение относится к области биохимии, в частности к конструкции для экспрессии генов, содержащей: (a) последовательность энхансера экспрессии, полученную из сегмента генома RNA-2 двухкомпонентного РНК-вируса семейства Comoviridae, b) полилинкер для облегчения встраивания гена в систему для экспрессии генов. Раскрыт вектор для экспрессии генов, содержащий указанную конструкцию и гетерологичный ген. Также описан вектор для экспрессии генов, содержащий: (a) последовательность энхансера экспрессии, полученную из сегмента генома RNA-2 двухкомпонентного РНК-вируса семейства Comoviridae, (b) гетерологичный ген, который кодирует представляющий интерес белок, а также способ экспрессии представляющего интерес белка с его использованием. Раскрыт способ повышения активности усиления трансляции представляющего интерес гетерологичного белка с гетерологичного гена, кодирующего указанный белок, способ усиления трансляции представляющего интерес гетерологичного белка с гетерологичного гена или гетерологичной открытой рамки считывания, кодирующей указанный белок. Также описан организм-хозяин, трансформированный вышеуказанным вектором, а также способ получения представляющего интерес белка, включающий сбор ткани указанного организма-хозяина. Изобретение позволяет эффективно усиливать трансляцию представляющего интерес гетерологичного белка с гетерологичного гена. 8 н. и 18 з.п. ф-лы, 15 ил., 4 табл., 6 пр.
Формула
(a) последовательность энхансера экспрессии, полученную из сегмента генома RNA-2 двухкомпонентного РНК-вируса семейства Comoviridae, в которой сайт инициации в сегменте генома RNA-2 мутирован по сравнению с сайтом инициации сегмента генома RNA-2 двухкомпонентного РНК-вируса семейства Comoviridae дикого типа таким образом, что мутированный сайт инициации утрачивает функцию сайта инициации трансляции,
где указанный сегмент генома RNA-2 вируса семейства Comoviridae дикого типа кодирует два белка с совпадающими карбоксильными концами за счет двух различных сайтов инициации трансляции, расположенных в одной триплетной рамке считывания,
причем указанный мутированный сайт инициации является первым из этих двух сайтов инициации и соответствует сайту инициации в положении 161 в сегменте RNA-2 дикого типа вируса мозаики коровьего гороха (CPMV),
причем последовательность энхансера экспрессии:
(i) содержит последовательность длиной по меньшей мере 100 нуклеотидов сегмента генома RNA-2 комовируса, которая содержит мутированный целевой сайт инициации, или
(ii) характеризуется по меньшей мере 70% идентичностью с нуклеотидами 1-507 следующей последовательности SEQ ID NO: 1:
и при этом сайт инициации в положении 161 сегмента генома RNA-2 вируса CPMV дикого типа мутирован; и
(b) полилинкер для облегчения встраивания гена, который кодирует представляющий интерес белок, в систему для экспрессии генов, при этом указанный полилинкер расположен ниже мутированного сайта инициации в последовательности энхансера; и возможно
(c) 3′-нетранслируемую область (НТО).
(a) последовательность энхансера экспрессии, полученную из сегмента генома RNA-2 двухкомпонентного РНК-вируса семейства Comoviridae, в которой сайт инициации в сегменте генома RNA-2 мутирован по сравнению с сайтом инициации сегмента генома RNA-2 дикого типа двухкомпонентного РНК-вируса семейства Comoviridae таким образом, что указанный сайт инициации утрачивает функцию сайта инициации трансляции,
где указанный сегмент генома RNA-2 дикого типа вируса семейства Comoviridae кодирует два белка с совпадающими карбоксильными концами за счет двух различных сайтов инициации трансляции, расположенных в одной триплетной рамке считывания,
причем указанный мутированный сайт инициации является первым из этих двух сайтов инициации и соответствует сайту инициации в положении 161 в сегменте RNA-2 дикого типа CPMV,
причем последовательность энхансера экспрессии:
(i) содержит последовательность длиной по меньшей мере 100 нуклеотидов сегмента генома RNA-2 комовируса, которая содержит мутированный целевой сайт инициации, или
(ii) характеризуется по меньшей мере 70% идентичностью с нуклеотидами 1-507 SEQ ID NO: 1, и при этом сайт инициации в положении 161 в последовательности сегмента RNA-2 генома CPMV дикого типа мутирован; и
(b) гетерологичный ген, который кодирует представляющий интерес белок, причем указанный ген, который кодирует представляющий интерес белок, расположен ниже последовательности энхансера, и при этом ген, кодирующий представляющий интерес белок, функционально связан с последовательностями промотора и терминатора.
(a) промотор;
(b) последовательность энхансера экспрессии, обладающую по меньшей мере 70% идентичностью с нуклеотидами 1-507 последовательности SEQ ID NO: 1, в которой AUG в положении 161 мутирован по сравнению с сегментом генома RNA-2 дикого типа, расположенную ниже промотора;
(c) гетерологичный ген, который кодирует представляющий интерес белок, расположенный ниже последовательности, определенной в (b);
(d) нуклеотиды 3302-3481 последовательности сегмента генома RNA-2 вируса мозаики коровьего гороха в последовательности SEQ ID NO: 1, расположенные ниже гена, который кодирует представляющий интерес белок; и
(e) терминатор нопалин-синтазы, расположенный ниже последовательности, определенной в (d).
(а) первую генную конструкцию, содержащую последовательность, полученную из укороченного RNA-2 двухкомпонентного вируса семейства Comoviridae, несущую по меньшей мере один гетерологичный ген, который кодирует представляющий интерес гетерологичный белок, функционально связанный с последовательностями промотора и терминатора,
при этом указанная генная конструкция содержит мутированный сайт инициации выше чужеродного гена,
где указанный сегмент генома RNA-2 вируса семейства Comoviridae дикого типа кодирует два белка с совпадающими карбоксильными концами за счет двух различных сайтов инициации трансляции, расположенных в одной триплетной рамке считывания,
причем указанный мутированный сайт инициации является первым из этих двух сайтов инициации и соответствует сайту инициации в положении 161 сегмента RNA-2 дикого типа вируса CPMV; и
(b) вторую генную конструкцию, возможно встроенную в указанную первую генную конструкцию, содержащую гетерологичный супрессор сайленсинга генов, функционально связанный с последовательностями промотора и терминатора.
где указанный сегмент генома RNA-2 вируса семейства Comoviridae дикого типа кодирует два белка с совпадающими карбоксильными концами за счет двух различных сайтов инициации трансляции, расположенных в одной триплетной рамке считывания,
причем указанный мутированный сайт инициации является первым из этих двух сайтов инициации и соответствует сайту инициации в положении 161 сегмента RNA-2 дикого типа CPMV, где мутированный сайт инициации утрачивает функцию сайта инициации трансляции;
причем указанная мутация осуществлена одним из путей:
(i) точечная мутация сайта инициации, или
(ii) делеция участка вплоть до 50 нуклеотидов в длину, включающего указанный сайт инициации,
причем указанная мутация усиливает экспрессию гетерологичной рамки считывания, к которой присоединена данная последовательность.
(a) введение в клетку растения первой конструкции для экспрессии генов, содержащей последовательность, полученную из укороченного RNA-2 генома двухкомпонентного вируса семейства Comoviridae, несущую по меньшей мере один гетерологичный ген, который кодирует представляющий интерес гетерологичный белок, функционально связанный с последовательностями промотора и терминатора,
при этом указанная генная конструкция содержит мутированный сайт инициации выше чужеродного гена,
где указанный сегмент генома RNA-2 вируса семейства Comoviridae дикого типа кодирует два белка с совпадающими карбоксильными концами за счет двух различных сайтов инициации трансляции, расположенных в одной триплетной рамке считывания,
причем мутированный сайт инициации является первым из двух указанных сайтов инициации и соответствует сайту инициации в положении 161 сегмента RNA-2 дикого типа CPMV; и возможно
(b) введение в клетку растения второй генной конструкции, возможно встроенной в первую генную конструкцию, содержащей супрессор сайленсинга генов, функционально связанный с последовательностями промотора и терминатора.
где указанный сегмент генома RNA-2 вируса семейства Comoviridae дикого типа кодирует два белка с совпадающими карбоксильными концами за счет двух различных сайтов инициации трансляции, расположенных в одной триплетной рамке считывания,
включающий осуществление мутации первого из этих двух сайтов инициации в последовательности, полученной из RNA-2,
причем указанный подвергающийся мутации сайт инициации соответствует сайту инициации в положении 161 сегмента RNA-2 дикого типа CPMV,
где указанный сайт инициации утрачивает функцию сайта инициации трансляции,
причем указанная мутация осуществлена одним из путей:
(i) точечная мутация сайта инициации, или
(ii) делеция участка вплоть до 50 нуклеотидов в длину, включающего указанный сайт инициации.

Комментарии