Гены бутиробетаин/кротонобетаин-l-карнитин-метаболизма и их применение для микробиологического получения l-карнитина - RU2133773C1
Код документа: RU2133773C1
Чертежи






Описание
Настоящее изобретение относится к рекомбинантному генетическому материалу для экспрессии генов пути бутиробетаин-/кротонобетаин-L-карнитин-метаболизма, микроорганизмам, которые содержат этот рекомбинантный генетический материал, и применению таких микроорганизмов в биотехнологическом способе для получения L-карнитина.
L-карнитин представляет собой природное, витаминообразное вещество, имеющее большое значение в метаболизме (обмене веществ) человека. L-карнитин является существенным при использовании кислот жирного ряда в качестве вещества-медиатора митохондриальной мембраны и таким образом в качестве переносчика метаболической энергии. Если L-карнитин синтезируется организмом в недостаточном количестве, то для избежания явлений дефицита его необходимо вводить с пищей. Особенно при вскармливании маленьких детей, у которых еще не обеспечен собственный биосинтез L-карнитина, L-карнитин представляет собой существенное питательное вещество.
Содержащие L-карнитин препараты используют в качестве активных составных частей фармацевтических продуктов. Указывается на добавление L-карнитина при недостатке карнитина и других терапевтических показаниях, особенно при заболеваниях сердца и т.д.
Биосинтез L-карнитина в высших организмах известен, другие функции в метаболизме и значение для метаболизма составляют предметы интенсивной исследовательской работы. Наряду с путями метаболизма, который описывается для микроорганизмов особенно рода Pseudomonas (γ-бутиробетаин-гидроксилаза - катализ; Lindstedt и др., Biochemistry, 16, 2181-2188 /1977/), L-карнитин продуцируется в качестве промежуточного продукта метаболизма известными микроорганизмами, например, Agrobacterium/Rhizobium sp.
Из европейского патента A-0158194 известен способ микробиологического получения L-карнитина исходя, например, из γ- бутиробетаина, с помощью которого путем традиционного микробиологического способа селекции получается не содержащий L-карнитил-дегидрогеназы продуцированный мутант с уже относительно хорошими в течение времени превращения 20-30 часов выходами L-карнитина. Дальнейшая оптимизация этого способа относительно выходов во времени и по объему, однако с помощью этого классического микробиологического метода невозможна.
Задачей настоящего изобретения поэтому является разработка более рентабельного биотехнологического способа получения L-карнитина, причем L-карнитин получается по существу за более короткое время превращения с еще более высокими выходами.
Исследования в отношении γ
-бутиробетаин-/кротонобетаин-метаболизма привели к идентификации пяти генов - bcoA/B, bcoC, bcoD, bcoE и bcoT, которые кодируют ферменты пути γ-бутиробетаин-/кротонобетаин-метаболизма и, в
общем, содержатся в опероне, так называемом бутиробетаин-L-карнитин опероне (bco). При этом:
bcoA/B обозначает ген γ-бутиробетаин-CoA-синтетазы (bcoA)/кротонобетаин-CoA-синтетазы
(bcoB), т. е. единственный ген, который кодирует ферментный продукт, обладающий как γ-бутиробетаин-CoA-синтетазной активностью, так и кротонобетаин-CoA-синтетазной активностью;
bcoC
обозначает ген γ-бутиробетаин-CoA-дегидрогеназы;
bcoD обозначает ген кротонобетаин-CoA-гидролазы;
bcoE обозначает ген L-карнитин-дегидрогеназы; и
bcoT обозначает
потенциальный ген транспортной системы.
Найдено, что продукты вырабатываемые генами bcoA/B, bcoC, и bcoD, ответственны за биосинтез L-карнитина, в то время как bcoE кодирует карнитин-дегидрогеназу, которая вызывает разрушение промежуточного продукта метаболизма L-карнитин-CoA до бетаина. В случае bcoT речь идет по всей вероятности о гене, который кодирует транспортный протеин подчиненной метаболизму бутиробетаина транспортной системы. Этот ген не является существенным для биосинтеза L-карнитина.
Предметом настоящего изобретения соответственно этому являются ДНК-фрагменты и векторы, которые охватывают один или несколько генов bcoC, bcoA/B и bcoD, кодирующих в γ-бутиробетаин-/кротонобетаин-метаболизме ферменты биосинтеза L-карнитина, и, в случае необходимости, дополнительно потенциальный транспортный ген bcoT.
Предметом изобретения далее являются микроорганизмы, которые содержат эти ДНК-фрагменты, соответственно, векторы. Следующим предметом изобретения является биотехнологический способ получения L-карнитина при применении предлагаемых согласно изобретению микроорганизмов.
Обозначения bcoA/B, bcoC, bcoD и bcoT, которые применяют здесь в описании и в формуле изобретения, охватывают согласно определению как гены организмов дикого типа, которые кодируют ферменты γ -бутиробетаин-/кротонобетаин-L-карнитин-метаболизма с вышеуказанными активностями ферментов, в особенности гены бутиробетаин-L-карнитин-(bco)-оперона, так и их функционально эквивалентные генетические варианты и мутанты, т.е. гены, которые производятся от генов организмов дикого типа и вырабатываемые генами, продукты которых по существу являются неизмененными в своей биологической функции. Функционально эквивалентные генетические варианты и мутанты, таким образом, охватывают, например, обмены оснований в рамках известной вырожденности генетического кода, которые, например, можно получать искусственно, чтобы последовательность гена адаптировать к предпочтительному применению кодона определенного микроорганизма, в котором должна осуществляться экспрессия. Варианты и мутанты далее охватывают делеции, инсерции и замещения оснований или кодона, поскольку они оставляют по существу неизмененными продукты, вырабатываемые такого рода измененными генами в их биологической функции. Таким образом, охватываются, например, последовательности гена, которые имеют высокую гомологию с последовательностями дикого типа, например, выше чем 70% и при строгих условиях гибридизации, например, при температурах 50-70oC и при содержании соли 0,5-1,5 моля, способны к гибридизации с комплементарными последовательностями дикого типа.
Под термином "транскрипционная единица", который здесь применяют, понимают ДНК-последовательность, в которых гены расположены в направлении транскрипции и под общим контролем транскрипции вписываются в транзитный транскрипт, причем ДНК-последовательности наряду с генами дополнительно включают необходимые для экспрессии гена генетические контролирующие элементы, как промоторы и сайты связывания рибосом.
Изобретение подробнее поясняется нижеследующими иллюстрациями:
На фиг. 1 показаны ферменты метаболизма γ- бутиробетаин-L-карнитина, соответственно кротобетаин-L-карнитина.
На фиг. 2 представлена карта рестрикции ДНК-фрагмента длиной 10 кб из Rhizobium/Agrobacterium с bco-опероном.
На фиг. 3 и 4 представлена плазмида pVK 1011, соответственно, плазмида pAZ 101; стрелки указывают положение и ориентацию bco-генов и beu-генов (использующие бетаин гены; европейский патент A-0543344). Вставочная часть плазмиды выделена жирной чертой.
На фиг. 5 представлена плазмида pCC49 в качестве возможного исходного материала для получения recA--штамма-хозяина.
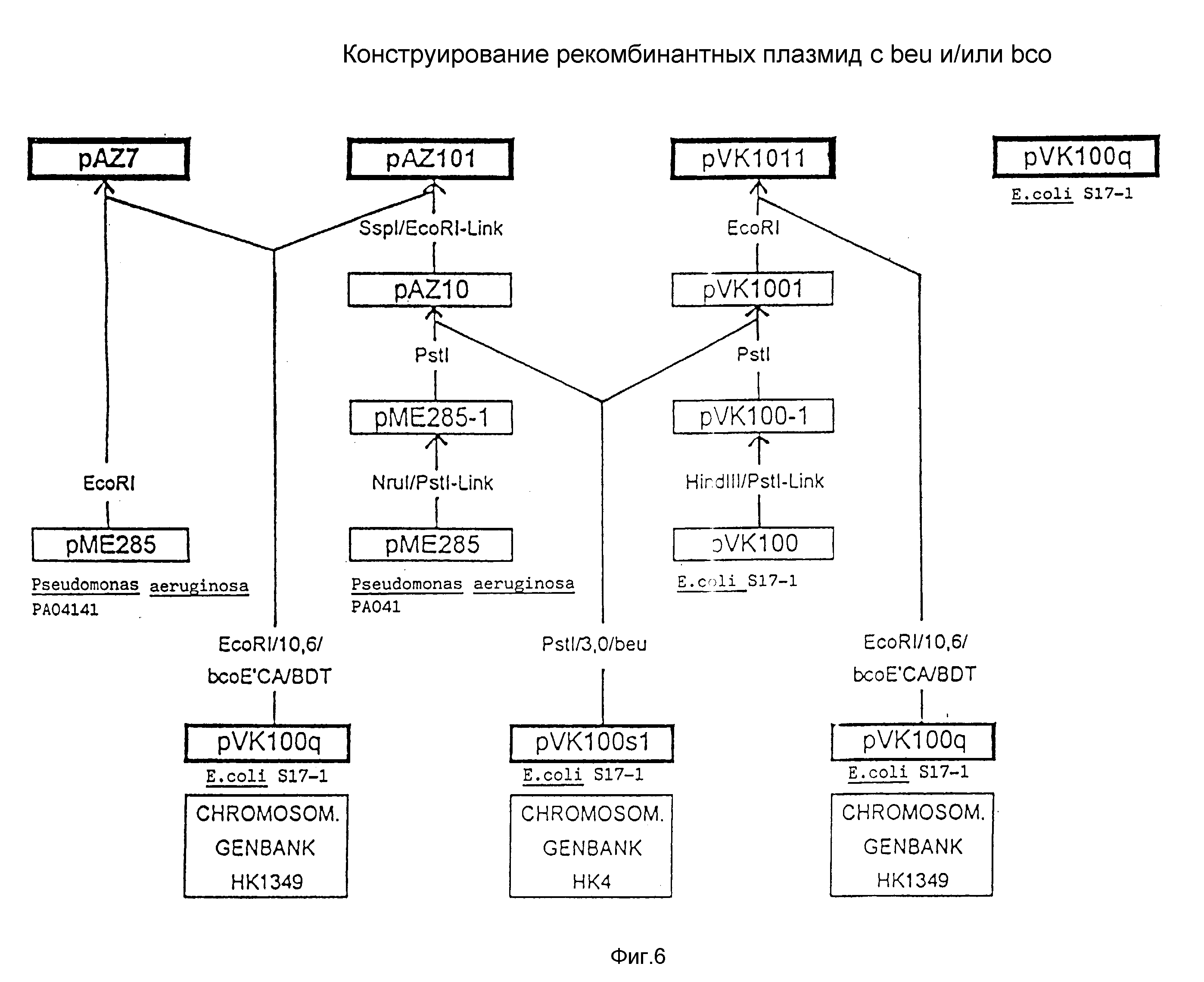
На фиг. 6 представлена схема конструкции плазмид pVK 1011, pAZ 101, pVK 100q и pAZ 7.
На фиг. 7 представлена схема конструкции recA--штамма-хозяина.
В качестве исходного материала для выделения генов bcoA/B, bcoC, bcoD и bcoT γ-бутиробетаин-/кротобетаин-L-карнитин-метаболизма могут служить любые микроорганизмы, которые обменивают бутиробетаин и/или кротонобетаин согласно фиг. 1. Примерами пригодных штаммов являются микроорганизмы родов Escherichia, Pseudomonas, Agrobacterium, Rhizobium и Agrobacterium/Rhizobium, причем предпочтительны последние. Примером предпочтительного микроорганизма рода Agrobacterium/Rhizobium является микроорганизм вида Agrobacterium/Rhizobium sp. HK4 (DSM (немецкая коллекция микроорганизмов) 2938), который уже описан в европейском патенте A-0158194. Особенно предпочтительно применяют микроорганизмы, которые уже содержат карнитин-дегидрогеназы, следовательно, например, не содержат никакого или содержат только дефектный bcoE-ген (в дальнейшем также обозначается как bcoE'). Примерами не содержащих карнитин-дегидрогеназы предпочтительных микроорганизмов являются микроорганизмы вила Agrobacterium/Rhizobium sp. HK13 (DSM 2903) и HK1331b (DSM 3225), которые уже описаны в европейском патенте A-O 158 194, или вида Agrobacterium/Rhizobium sp. HK1349 (DSM 3944), который описан в европейском патенте A-O 543 344.
Гены bcoA/B, bcoC, bcoD и bcoT γ-бутиробетаин-/кротонобетаин-L-карнитин-метаболизма могут локализоваться в хромосоме микроорганизма, тем, что микроорганизмы, например, подвергают транспозон-инсерционному мутагенезу и благодаря этому маркируют гены γ-бутиробетаин-/кротонобетаин-L-карнитин-метаболизма с помощью пригодного маркера, например, резистентности к канамицину (Km). Затем можно изолировать такого рода маркированные мутанты, которые более не могут использовать промежуточные продукты метаболизма бутиробетаина. Таким образом можно идентифицировать гены γ -бутиробетаин-/кротонобетаин-L-карнитин-метаболизма и соотнести по их функции. Маркированные гены затем можно клонировать и подробнее охарактеризовать с помощью пригодных рестрикционных ферментов. Выделение интактных генов, соответственно, предлагаемых в изобретении ДНК-фрагментов, можно осуществлять затем исходя из банка генов соответствующего, не подвергнутого мутации микроорганизма, из которого известным образом можно выделять и идентифицировать bco-гены или их фрагменты путем гибридизации с полученными, как указано выше, клонированными генами мутагенизированного штамма. Полученные гены затем клонируют в желательных векторах и составляют карту с помощью рестрикционных ферментов.
Для биосинтеза L-карнитина ответственными являются только гены bcoA/B, bcoC и bcoD. Соответственно этому, для продуцирования L-карнитина также необходимо только наличие этих генов. В зависимости от выбранных исходных условий, например, выбранного исходного материала или выбранного продуцирующего штамма, используемые при продуцировании L-карнитина ДНК-фрагменты и векторы могут содержать один или несколько генов биосинтеза L-карнитина.
Наряду с генами bcoA/B, bcoC и bcoD, предлагаемые согласно изобретению ДНК-фрагменты и векторы, если желательно, могут также включать потенциальный транспортный ген bcoT.
Наличие гена L-карнитил-дегидрогеназы, следовательно, bcoE-гена, нежелательно, так как в его присутствии происходит деструкция L-карнитина. Присутствие дефектного bcoE-гена (bcoE'), однако безвредно.
Целесообразно гены для биосинтеза L-карнитина, а именно bcoC, bcoA/B и bcoD и в случае необходимости потенциальный транспортный ген bcoT, для применения при продуцировании L-карнитина, находятся вместе в ДНК-фрагменте или молекуле вектора, а именно предпочтительно в обычном 5'-3'-направлении, вниз по ходу от ген-регуляторных элементов, в последовательности bcoC, bcoA/B и bcoD, соответственно, bcoC, bcoA/B, bcoD и bcoT и в одной-единственной, как определено выше, транскрипционной единице, соответственно расположению во встречающемся в природе бутиробетаин-L-карнитин-опероне. Гены bcoC, bcoA/B, bcoD и bcoT такой транскрипционной единицы могут быть охарактеризованы, например, благодаря соответствующим участкам карты рестрикции фиг. 2.
Транскрипцию, соответственно, экспрессию, bco-генов целесообразно осуществлять под контролем предпочтительно сильного пригодного промотора. Выбор промотора зависит от желательных условий экспрессии, например, от того, желательна ли конструктивная или индуцированная экспрессия, или от микроорганизма, в котором должна протекать экспрессия. Пригодным промотором является, например, промотор Pbco природного бутиробетаин-L-карнитин-оперона. Если осуществляют выделение ответственных за биосинтез L-карнитина bco-генов, например, из микроорганизма с дефектным bco-геном (bcoE'), то, например, предпочтительно весь bco-оперон вместе с bcoE'-геном и относящимися к нему ген-регуляторными элементами можно выделять из этих организмов и клонировать и затем использовать для продуцирования L-карнитина в пригодных микроорганизмах. Такого рода транскрипционную единицу с подвергнутым мутации bcoE-геном, которую, например, можно изолировать из Rhizobium/Agrobacterium HK1349, в случае необходимости также можно охарактеризовать с помощью воспроизведенной на фиг. 1 карты рестрикции, когда дефект в bcoE сводится, например, лишь к точечной мутации и не касается никакого сайта рестрикции. Другими пригодными для экспрессии промоторами являются, например, промоторы PNm, PS1 (M. Labes и др. , Gene, 89, 37-46 /1190/), trp-промотор (Amann и др., Gene, 25, 167-178 /1983/), lac-промотор (Amann и др., Gene, 25, 167-178 /1983/) и tac-промотор, гибрид из указанных trp- и lac-промоторов, который может использовать в качестве конструктивного или индуцируемого промотора (Russel и Bennett, Gene, 20, 231-243 /1982/).
Для применения при продуцировании L-карнитина в пригодном продуцирующем штамме предлагаемые согласно изобретению ДНК-фрагменты, которые охватывают указанные bco-гены, предпочтительно все вместе в одной-единственной транскрипционной единице, целесообразно с помощью известных способов встраивают в известные пригодные векторы, в особенности векторы экспрессии, например, фаги и плазмиды. В качестве векторов можно применять автономные или самореплицирующиеся векторы или также так называемые интеграционные векторы. Под интеграционным вектором при этом понимают вектор, например, плазмиду, который по меньшей мере имеет одну последовательность, гомологичную геномной последовательности реципиентного штамма, и благодаря гомологичной рекомбинации с этой последовательностью позволяет блокировать попадание чужеродных генов в геном штамма реципиента. Предпочтительно применяют автономные и самореплицирующиеся векторы.
В зависимости от рода выбранных векторов гены ферментов биосинтеза L-карнитина можно экспрессировать в различных организмах. В качестве векторов пригодны как векторы со специфическим спектром хозяев, так и векторы с широким спектром хозяев ("широкий круг хозяев") и вышеописанные интеграционные векторы.
В качестве векторов "широкого круга хозяев" можно использовать любые векторы, которые пригодны для грамотрицательных бактерий. Примерами таких векторов "широкого круга хозяев" являются pVK100 (Knauf и Nester, Plasmid, 8, 45-54 /1982/), pME282 (Haas и Iton, Gene, 36, /1985/) и pKT240 (Bagdasarian и др., Gene, 26, 273-282 /1983/) или их производные. В качестве производного pVK100 можно применять, например, pVK1001, в качестве производного pME285 можно применять, например, pAZ10 и в качестве производного pKT240 можно применять, например, pLO32 (как уже описано в европейском патенте A-O 543 344).
В качестве интеграционных векторов в случае Rhizobium/Agrobacterium можно применять векторы на основе pACYC184 или pBR322 (Comi и др., Plasmid, 10, 21-30 /1983/).
Таким образом, например, можно получать плазмиды pVK100q, pVK1011 (фиг. 3), pAZ7, pAZ::beu, pAZ101 (рис. 4), и pLO41. Плазмида pVK100q с 16.11.93 г. хранится в немецкой коллекции микроорганизмов и культур клеток GmbH, D-38124, Braunschweig, Mascheroderweg 1b, в Rhizobium/Agrobacterium HK1349 под номером DSM 8726.
Для получения продуцирующих штаммов для ферментации, т.е. штаммов для продуцирования L-карнитина, предлагаемые согласно изобретению ДНК-фрагменты, соответственно, векторы, нужно вносить в желательные и пригодные для экспрессии штаммы-хозяева. Для этого микроорганизмы обычным и само по себе известным образом трансформируют с помощью предлагаемых согласно изобретению ДНК-фрагментов. Микроорганизмы тогда могут содержать предлагаемый согласно изобретению ДНК-фрагмент либо в молекуле вектора, либо интегрированным в его хромосоме.
В качестве продуцирующих штаммов пригодны любые микроорганизмы, которые способны продуцировать из кротонобетаина и/или γ-бутиробетаина L-карнитин и способноссть которых к декструкции (катаболизм) L-карнитина полностью или частично подавлена. Микроорганизмы, которые ингибированы в своем L-карнитин-катаболизме, представляют собой, например, штаммы, которые не содержат карнитин-дегидрогеназы, т. е. штаммы, в которых карнитин-дегидрогеназа-ген bcoE исключен, например, за счет мутации или делеции, и/или штаммы, которые не содержат L,D-карнитин-рацемазы и L-карнитин-дегидратазы.
Пригодными штаммами-хозяевами, предпочтительно штаммами с высокой толерантностью к субстрату и эдукту, являются, например, микроорганизмы родов Escherichia, Pseudomonas, Agrobacterium, Rhizobium, Comamonas и Rhizobium/Agrobacterium, причем предпочтительны последние. Особенно предпочтительны микроорганизмы уже описанного выше вида Rhizobium/Agrobacterium sp. HK13, HK1331b и HK1349, а также вида HK1349 (как описанный в европейском патенте A-0 543 344).
Кроме того, найдено, что выход L-карнитина можно повышать еще далее, когда снижена способность штамма-хозяина к рекомбинации, следовательно, его тенденция к рекомбинации и частота рекомбинаций. Благодаря этому рекомбинация с вектором ограничивается на основании хромосомной гомологии. Способность к рекомбинации штамма-хозяина можно снижать, например, известным образом путем целевой мутации его recA-гена (recA-мутация). Особенно предпочтительными, ухудшенными в отношении их способности к рекомбинации, микроорганизмами являются микроорганизмы вида Rhizobium/Agrobacterium sp., например, получаемые согласно изобретению, как описывается ниже, штаммы вида Rhizobium/Agrobacterium HK1349.49.
Пригодными продуцирующими штаммами, таким образом, являются, например, микроорганизмы вида Rhizobium/Agrobacterium HK1349, HK1349.4 и HK1349.49, смотря по обстоятельствам, содержащие плазмиды pVK100q, pVK1001, pAZ7, pAZ7: :beu, pAZ101 или pL041.
Выделение трансформированного штамма-хозяина (продуцирующий штамм) можно осуществлять из селективной питательной среды, к которой добавляют антибиотик, по отношению к которому штамм резистентен за счет находящегося в векторе или ДНК-фрагменте маркерного гена. Если в качестве продуцирующего штамма применяют микроорганизмы согласно европейскому патенту A-0 543 344, т.е. микроорганизмы, которые подвергнуты мутации в своем хромосомном, кодирующем использование бетаина гене и трансформированы с помощью плазмиды, которая содержит кодирующий использование бетина ген, то их можно также селектировать относительно использования бетаина. Примерами селектируемых относительно использования бетаина микроорганизмов являются уже упомянутые HK1349.4 и HK1349.49, которые содержат, например, плазмиды pL041, pAZ101, pAZ7::beu или pVK1011.
Биотехнологическое получение L-карнитина осуществляют при применении микроорганизмов, которые содержат предлагаемые в изобретении ДНК-фрагменты, соответственно, векторы. Способ получения L-карнитина осуществляют согласно известным методам, например, как описывается в европейском патенте A-0 158 194, исходя, например, из γ-бутиробетаина, в присутствии пригодного источника углерода и азота. В качестве источника углерода и азота можно использовать, например, глутамат, ацетат и бетаин, или глицерин и бетаин. Если биотехнологическое получение осуществляют с помощью селектируемых относительно использования бетаина микроорганизмов, то в качестве единственного источника азота применяют бетаин.
Ферментацию и последующее выделение L-карнитина можно осуществлять аналогично описанному в европейском патенте A-0 158 194 способу.
Благодаря вариации питательных веществ в среде и путем адаптации условий ферментации к соответствующему микроорганизму обычным образом можно далее повышать выход L-карнитина.
Пример 1
Получение транспозон-инсерционных мутантов (Tn5) и их фенотипическая идентификация
Штамм дикого типа
Rhizobium/Agrobacterium HK4 (DSM 2938; европейский патент B-0 158 194) за счет давления отбора доводят до проявления спонтанной резистентности по отношению к стрептомицину (Sm; 1000 мкг/мл). Эта
резистентность, по достоверным сведениям, стабильна в течение 50 генераций без селекции и ее применяют в качестве селекционного маркера.
0,2 мл Культуры-донора Tn5, из E.coli S17-1/pSUP2021 (R. Simon и др., Biotechnology, 1983, 1, 784-790), смешивают с 2 мл культуры-реципиента HK4 и центрифугируют. Клетки промывают в 0,9%-ном рассоле (раствор NaCl) и снова суспендируют в 100 мкл 0,9%-ного рассола. Конъюгацию штамма-реципиента со штаммом-донором осуществляют в течение ночи при 30oC на сухом питательном агаре. Собранные клетки при разбавлениях культивируют на селекционной среде для реципиента (SmR) и транспозона (резистентность к неомицину /NmR/).
Tn5 - Мутанты получают на питательном агаре с Sm (1000 мкг/мл) и Nm (100 мкг/мл). Фенотипическую идентификацию мутантов осуществляют через обнаружение неиспользованных промежуточных продуктов метаболизма бутиробетаина согласно фиг. 1 в виде источника углерода (C-источника) в минимальной среде.
Пример 2
Клонирование Tn5-маркированных ДНК-фрагментов из HK4 генома
Изолированную геномную ДНК Tn5-мутированного HK4 (5 мкг) полностью
переваривают с помощью EcoRI (4 ед./мкг). После полного переваривания за счет EcoRI, pBR325 (2,5 мкг) (Gene, 1977, 2, 95-113) обрабатывают щелочной фосфатазой. Рекомбинантные гибридные плазмиды
получают после смешения геномной ДНК и pBR325 с T4-ДНК-лигазой (0,2 ед./мкг ДНК) в 400 мкл буфера для лигирования (20 ммоль Трис-HCl, pH = 7,2; 10 ммоль ДТТ /дитиотреитол/; 10 ммоль MgCl2;
0,6 ммоль АТФ) и инкубации в течение ночи при 12oC.
Аликвоты смеси после лигирования используют для трансформации (Cohen и др. , 1972, PNAS 69, 2110-2114) E. coli ED 8654 (Barek и др., Mol. Gen. Genet., 146, 199-207 /1976/). Трансформанты селектируют в питательной среде по их резистентности к ампициллину (Ap; 100 мкг/мл) и канамицину (Km; 25 мкг/мл). Все селектированные гибридные плазмиды содержат HK4-вставку, которая маркирована с помощью Tn5. Вставки для различных рестрикционных ферментов картируют соответственно карте рестрикции на фиг. 2. Сравнение карт рестрикции доказывает инсерцию транспозона в одинаковый геномный фрагмент в случае ряда Tn5-мутантов с различным генотипом.
Подтверждение этого наблюдения можно получить путем гибридизации за счет саузерн-блотинга ("Ген-технологические методы", изданные под реакцией S.Bertram и H.G.Gassen, издательство G.Fischer, 1991, с. 219 и последующие) идентично разрезанных плазмидных ДНК и последующего электрофоретического разделения. В качестве зондов служат субфрагменты этой клонированной ДНК из транспозоновых мутантов.
Пример 3
Составление
геномного банка генов HK4 в лямбда-фагах
Для того чтобы можно было "упаковать" ДНК в лямбда-фаги, она должна иметь величину 40-52 кб и "cos-сайт". Для составления геномного банка генов HK4 в
лямбда-фагах применяют космидный вектор pVK100 (Knauf и Nester, 1982, Plasmid, 8, 45-54), который имеет величину 23 кб и таким образом допускает клонирование ДНК-фрагментов между 17-29 кб.
pVK100 переваривают с помощью EcoRI, дефосфорилируют и лигируют с HK4-ДНК, которая частично расщеплена EcoRI. Идеальную концентрацию EcoRI для частичного расщепления HK4-ДНК определяют через тест-расщепление как 0,58 ед. /мкг ДНК, соответственно, 0,02 ед./мкл реакционной смеси, причем в реакционной смеси используют 8,5 мкг HK4-ДНК. ДНК-фрагменты в области величин более чем 17 кб изолируют из гелей электрофореза на агарозе. Лигирование осуществляют в объеме 10 мкл с содержанием 100 нг космидного и 400 нг "пассажира" (Passenger) - ДНК. Затем осуществляют "ин витро упаковывание", соответственно Протоколу изготовителя, в миксере (Mix) фирмы Promega Biotec в течение 2 часов при 25oC. После трансфекции E.coli S 17-1 селектируют на Km-резистентность космидного вектора. С помощью реакционной смеси получают примерно 5500 колоний (индивидуальные клоны). Колонии банка генов хранят в 5 "пачках", примерно по 1000 клонов в каждой, в замораживаемой среде (питательная среда из дрожжевого бульона, NYB, Оксоида и 50% глицерина) при -70oC. Амплификацию банка генов осуществляют с помощью взятых по 50 мкл из каждой из этих "пачек" смесей в 10 мл выдержанной в течение ночи NYB-культуры и порционирования.
Пример 4.
Скрининг НК4-космида-банка генов, идентификация несущих bco-гены космидных клонов путем гибридизации колоний,
дот-блотинг-гибридизация или прямое комплементирование с HK-мутантами
В качестве зондов гибридизации можно использовать непосредственно клонированные Tn5-маркированные ДНК-фрагменты.
Клоны с соответствующими ДНК-последовательностями обладают признаками гибридизации и приводят к комплементации соответствующего дефектного гена в НК4-мутанте. Перекрестные гибридизации ДНК из различных мутантов подтверждают "образование кластеров" нескольких генов метаболизма бутиробетаина на ДНК-фрагменте величиной 10,6 кб (фиг.2).
Гибридизацию колоний осуществляют обычным образом (S.Bertram и H.G.Gassen, 1991, см. выше, с. 221 и последующие). Дот-блотинг также осуществляют известным образом (S.Bertram и H.G.Gessan, 1991, см.выше, с. 217 и последующие).
Пример 5.
Комплементирование НК-мутантов
После точной локализации отдельных генов метаболизма бутиробетаина при учете молекулярных величин на основании
идентифицированных пептидных цепей можно достигать комплементирования отдельных мутантов за счет соответствующих сайтов генов.
Соответствующую плазмиду экспрессии pVR100::HK-ДНК через конъюгацию из E.coli S 17-1 вносят в штаммы Rhizobium/Agrobacterium sp. HK4 согласно примеру 1, которые обладают мутациями в отношении различных стадий метаболизма (см. фиг. 1). Селекцию осуществляют по отношению к пролин (pro)-ауксотрофии донора и на основании резистентности к антибиотику (KmRTc/тетрациклин/R).
Пример 6
6.1 Клонирование bco-фрагмента
из штамма HK1349 (DSM 3944) и дериваты (потомки)
Для достижения эффектов дозы гена и повышений продуктивности в случае продуцирующего штамма клонируют bco-оперон из HK1349 (DSM 3944;
европейский патент A-O 543344). В этом штамме содержится полностью весь bco-оперон, однако первый ген, bcoE, для карнитин-CoA-дегидрогезаназы, мутирован. Полученный из этого штамма ДНК-фрагмент с
bco-опероном таким образом является идеальным для повышения продуктивности на основании высокого числа копий векторов экспрессии.
Клонирование осуществляют известным образом в E.coli S 17-1, соответственно примеру 3 европейского патента A-O 543344. Для этой цели изолируют длиной 10,6 кб bco-оперон из банка HK-1349-генов и лигируют в pVK100. Получают плазмиду pVK100g (см. схему конструкции согласно фиг. 6). Селектируют в E. coli S 17-1 на NYB с Km (25 мкг/мл). Идентификацию правильной вставки осуществляют согласно описанному в примере 5 методу на НК-мутантах. Разрезанную с помощью EcoRI ДНК из HK1349 отделяют с помощью электрофореза и фрагменты в области величин 10,6 кб изолируют из геля. Изолированные фрагменты лигируют в разрезанном EcoRI pVR100. С помощью этой смеси гибридных плазмид трансформируют E.coli S 17-1 (ауксотроф пролина) и селектируют на питательном агаре с Km (25 мкг/мл). Идентификацию правильного клона гибридной плазмиды из вектора и несущего bco-оперон ДНК-фрагмента длиной 10,6 кб осуществляют через "пэтч-скрещивание" с не содержащим бутиробетаин-CoA-синтетазу мутантом (NK4V4) в минимальной среде с 0,2% (вес/объем) бутиробетаина в качестве C- и N-источника. Правильный клон после такого рода конъюгативного переноса в мутант, может комплементировать клетки при использовании этого C-источника. Таким образом идентифицированный клон pVK100q служит непосредственно в качестве продуцирующей плазмиды или в качестве "резервуара" для ДНК-фрагмента с bco-опероном для последующих субклонирований.
6.2 Конструирование
pAV101, pAZ7, pVK1011 и pVK100g, pL041 и pAZ7::beu
Конструирование pAV101, pAZ7, pVK1011 и pVK100q осуществляют согласно конструкционной схеме на фиг. 6. Конструирование pL041 осуществляют
исходя из pL032 (европейский патент A-O 543344) путем инверсии bco-генов (фрагмент EcoRI/EcoRI величиной 10,6 кб), а конструирование плазмиды pAZ7::beu осуществляют исходя из pAZ7 (фиг. 6) путем
инсерции beu-генов (величиной 3 кб PstI/PstI-фрагмент; европейский патент A-O 543344). Используют соответствующие рестрикционные ферменты с 3-5 ед/мкг ДНК согласно данным изготовителя. Плазмиду
pVK100q получают путем инсерции bco-генов в pVK100 (Knauf и Nester; см. выше). Исходную плазмиду pVK100si (конструкционная схема фиг. 6) получают путем
Eco-RI-деления - клонирования плазмиды pVK100s
(европейский патент A-O 543344).
Пример 7.
Введение recA-мутации в HK1349.4
7.1. Идентификация клона банка генов, кодирующего recA
С помощью
гибридизации колоний (S.Bertram и H.G.Gassen, 1991, см. выше, с. 221 и последующие) исследуют геномный HK4-космида-банк генов на кодирующие recA-клоны. В качестве зондов для гибридизации служит
клонированный rec-ген из Rhizobium lequminosarum (W.Selbitschka и др., Mol. Gen. Genet., 299, 1991, 86-95). Маркированный космидный клон изолируют, а полученные после расщепления EcoRI вставочные
фрагменты EcoRI-ДНК исследуют путем саузерн-блотинг-гибридизации по отношению к recA-зонду (S.Bertram и H.G.Gassen, 1991, см. выше, с. 219 и последующие) на rec-гомологичные последовательности. Таким
образом маркированный EcoRI-фрагмент лигируют в одинаковым образом разрезанном векторе pVK100. С помощью полученной гибридной плазмиды pVK100r1 трансформируют для ДНК-размножения E.coli S
17-1-клетки.
7.2. Введение резистентного к канамицину гена HK1349.4 для инактивации хромосомного recA-гена
Фрагмент EcoRI величиной 11,0 кб переклонируют из pVK100ri в
pACYC184 (A. C.Y.Chang и S.N.Cohen, J.Bacteriol., 134, 1978, 1141-1156), который разрезан с помощью EcoRI.
Соответственно установленной карте рестрикции разрезанный BglII-NruI, размером 3,1 кб, субфрагмент, который маркирован при саузерн-блотинг-гибридизации по отношению к recА-зонду, клонируют в векторе pWS233, разрезанном Bam-HI-HindIII. pWS233 представляет собой вектор "гена замещения" и описывается W.Selbitschka и др., Appl. Microbiol. Biotechnol. 38, 1993, 615-618.
В место разреза XhoI результирующей плазмиды pCC45 вводят путем клонирования XhoI-ДНК-фрагмент из Th5 (pSUP2021; R.Simon и др., Biotechnology, 1, 1983, см.выше), который кодирует резистентность к Km. Отсюда получают pCC49. Аналогично методике W.Selbitschka и др., 1993, см.выше, получают "ген замещения" следующим образом.
3 мл экспоненциальной HK1349.4-культуры смешивают с 1 мл экспоненциальной культуры-донора (S 17-1/pCC49), центрифугируют и промывают с помощью 0,9%-ного раствора NaCl. Клетки инкубируют в течение ночи при 30oC в 50 мкл NYB на питательном агаре, затем снова суспендированные в 0,9%-ном растворе NaCl клетки в пригодном разбавлении наносят на селективные среды. Трансконъюгаты резистентного к Sm репициента HK1349.4 получают на питательном агаре с Sm (1000 мкг/мл) и Nm (150 мкг/мл) и, соответственно, гены sacRB в векторе "замещения" показывают чувствительность по отношению к 5% сахарозы в комплексной среде.
Двойные рекомбинации получают при культивировании селектированных трансконъюгатов без давления селекции на питательном агаре при незначительной частоте (10-8): спустя примерно 1 неделю можно изолировать клетки, которые перенесли 5% сахарозы в среде, остались Nm-резистентными, однако снова стали чувствительными к гентамицину (Gm) (векторный маркер).
Этот генотип подтверждает маркерный обмен и указывает на recA-мутацию в HK1349.4. Наблюдают типичный фенотип (например, УФ-чувствительность и т.д.) recA-мутантов.
В полученном таким образом штамме HK1349.49 отчетливо снижена тенденция хромосомной интеграции плазмид с гомологичной последовательностью (гомологичная рекомбинация). Поэтому штамм является хорошо пригодным хозяином для представленной в примере 6.2 гибридной плазмиды.
Пример 8.
Биотрансформация
Биотрансформацию осуществляют во встряхиваемых колбах (100 мл) с минимальной средой без азота (ММ; Kulla и др., Arch.Microbiol., 1983, c.1-7), содержащей 0,2% (вес/объем)
γ-бутиробетаина (эдукт) и в качестве C-источника 0,4% (вес/объем) глицерина. В качестве N- и дополнительного C-источника добавляют 0,2% (вес/объем) L-глутамата (в случае не использующих бетаин
штаммов) или 0,2% (вес/объем) бетаина.
В качестве продуцирующих штаммов используют предлагаемые согласно изобретению штаммы HK1349.4/pL041; HK1349.4/pVK1011; HK1349.4/pAZ7: : beu; HK1349.4/pAZ101; HK1349/pVK100q и HK1349/pAZ7.
Результаты представлены в таблице по сравнению с известными из европейского патента А-О 543344 HK13-дериватами (потомками) HK1349 (DSM 3944) и HK1349.4.
Образование L-карнитина из γ-бутиробетаина определяют согласно описанному Bergmeyer DTNB (5-5'-дитио-бис-(2-нитробензоат))-методу (H.K.Bergmeyer, 1974, Methoden der enzymatischen Analyse, изд. Chemie, Weinheim, c. 1810 и последующие).
Реферат
Изобретение относится к генной инженерии и микробиологии. Фрагмент ДНК выбран из EcoRI-фрагмента величиной 10,6 т.п.о, включает гены, кодирующие ферменты биосинтеза L-карнитина в гамма-бутиробетаин/кротонобетаин метаболизме или варианты таких генов. Гены присутствуют в виде одной транскрипционной единицы. Располагаются в последовательности bсо С, кодирующий γ-бутиробетаин-СоА-дигидрогеназу, bсо А/В, кодирующий γ-бутиробетаин/кротонобетаин-СоА-синтетазу, bсо D, кодирующий кротонобетаин-СоА-гидролазу. Фрагмент может включать ген bсо Т, кодирующий потенциальный транспортный протеин. Векторы экспрессии р VK 100q, р VK 101 PAZ 101, pAZ 7, pAZ 7: :beu, pL 041. Рекомбинантные штаммы Rhizobium/Agrobacterium HK 1349, трансформированные соответствующими векторами экспрессии, продуценты L-карнитина. Разработан рентабельный способ получения L-карнитина с более высоким выходом. 14 с. и 2 з.п.ф-лы, 7 ил., 1 табл.

Формула
EcoRI - EcoRI фрагмент ДНК (10,6 kb) Rhizobium/Agrobacterium HK 1349;
PstI-PstI фрагмент ДНК (3,0 kb) содержащий ген beu;
ген Tc - устойчивости.
EcoRI - EcoRI фрагмент ДНК (10,6 kb) Rhizobium/Agrobacterium HK 1349;
PstI-PstI фрагмент ДНК (3,0 kb), содержащий ген beu;
ген Hg - устойчивости.
08.10.93 - по пп.1 - 3, 16;
06.01.94 - по пп.4 - 15.

Комментарии