Новая термостабильная фруктозо-6-фосфат-3-эпимераза и способ получения аллюлозы с ее использованием - RU2733427C2
Код документа: RU2733427C2
Чертежи


Описание
Область изобретения
Настоящее изобретение относится к фруктозо-6-фосфат-3-эпимеразе и способу получения аллюлозы с ее использованием.
Предшествующий уровень техники
D-псикозо-3-эпимераза (ЕС 5.1.3.30) и D-тагатозо-3-эпимераза (ЕС 5.1.3.31) известны, как ферменты, способные продуцировать аллюлозу посредством 3-эпимеризации (С3-эпимеризации) D-фруктозы. Когда аллюлозу получают из фруктозы с помощью единственной ферментативной реакции с использованием вышеуказанных ферментов, существует определенный уровень равновесия между фруктозой (то есть субстратом) и аллюлозой (то есть продуктом) (продукт/субстрат = примерно 20%-35%). Поэтому в случае получения аллюлозы высокой чистоты с использованием единственной ферментативной реакции, требуется дополнительный процесс очистки для выделения и удаления высокой концентрации фруктозы из продукта реакции.
С другой стороны Chan et а/. (2008. Biochemistry. 47:9608-9617) сообщили о D-рибулозо-5-фосфат-3-эпимеразе (ЕС 5.1.3.1), полученной из Streptococcus pyogenes, и D-аллюлозо-6-фосфат-3-эпимеразе (ЕС 5.1.3.-), полученной из Е. coli, которые способны осуществлять 3-эпимеризацию D-фруктозо-6-фосфата и D-аллюлозо-6-фосфата; однако эти ферменты не являются термостабильными и, следовательно, не могут использоваться в промышленности.
Техническая задача
Авторы настоящего изобретения предприняли попытку разработать способ, который может экономически и в промышленном масштабе увеличивать скорость превращения в аллюлозу. В результате этого, когда аллюлозо-6-фосфат получают посредством превращения сахарозы, крахмала или мальтодекстрина, которые являются дешевым сырьем, в глюкозу или в глюкозо-1-фосфат, глюкозо-6-фосфат и фруктозо-6-фосфат, было обнаружено, что аллюлоза может быть получена с использованием аллюлозо-6-фосфатфосфатазы, участвующей в необратимой реакции. Следовательно, учитывая, что можно производить аллюлозу с помощью однореакторных ферментативных превращений, в которых можно одновременно использовать множество ферментов, участвующих в производстве аллюлозы, и при этом скорость превращения в аллюлозу может быть значительно увеличена, авторы настоящего изобретения завершили настоящее изобретение открытием нового термостабильного фермента, который может быть применен к способу превращения фруктозо-6-фосфата в аллюлозо-6-фосфат.
Техническое решение
Целью настоящего изобретения является обеспечение фруктозо-6-фосфат-3-эпимеразы, состоящей из аминокислотной последовательности SEQ ID NO:1.
Другой целью настоящего изобретения является обеспечение нуклеиновой кислоты, кодирующей фруктозо-6-фосфат-3-эпимеразу по настоящему изобретению.
Еще одной задачей настоящего изобретения является обеспечение трансформанта, содержащего нуклеиновую кислоту, кодирующую фруктозо-6-фосфат-3-эпимеразу по настоящему изобретению.
Еще одной задачей настоящего изобретения является обеспечение композиции для получения аллюлозы, которая содержит фруктозо-6-фосфат-3-эпимеразу по настоящему изобретению, микроорганизм, экспрессирующий фруктозо-6-фосфат-3-эпимеразу, или культуру указанного микроорганизма.
Еще одной задачей настоящего изобретения является обеспечение способа получения аллюлозы с использованием фруктозо-6-фосфат-3-эпимеразы по настоящему изобретению.
Полезные эффекты
Так как термостабильная фруктозо-6-фосфат-3-эпимераза по настоящему изобретению является термостабильной, она может быть использована для промышленного способа превращения фруктозо-6-фосфата в аллюлозо-6-фосфат, можно продолжить использование этого способа для синтеза аллюлозы благодаря использованию дешевого сырья, и производство аллюлозы является возможным благодаря дефосфорилированию аллюлозо-6-фосфата, которое представляет собой необратимую реакцию; таким образом, скорость превращения в аллюлозу может быть значительно увеличена.
Кроме того, в способе получения аллюлозы с использованием фруктозо-6-фосфат-3-эпимеразы по настоящему изобретению, процесс выделения/очистки может быть упрощен или исключен, поскольку продукт реакции включает высокую концентрацию аллюлозы благодаря увеличению скорости превращения в аллюлозу и, таким образом, способ производства является выгодным благодаря простоте и экономичности.
Краткое описание графических материалов
На Фиг. 1 показана реакция, при которой возможно получение аллюлозы из крахмала (например, мальтодекстрина), сахарозы или глюкозы.
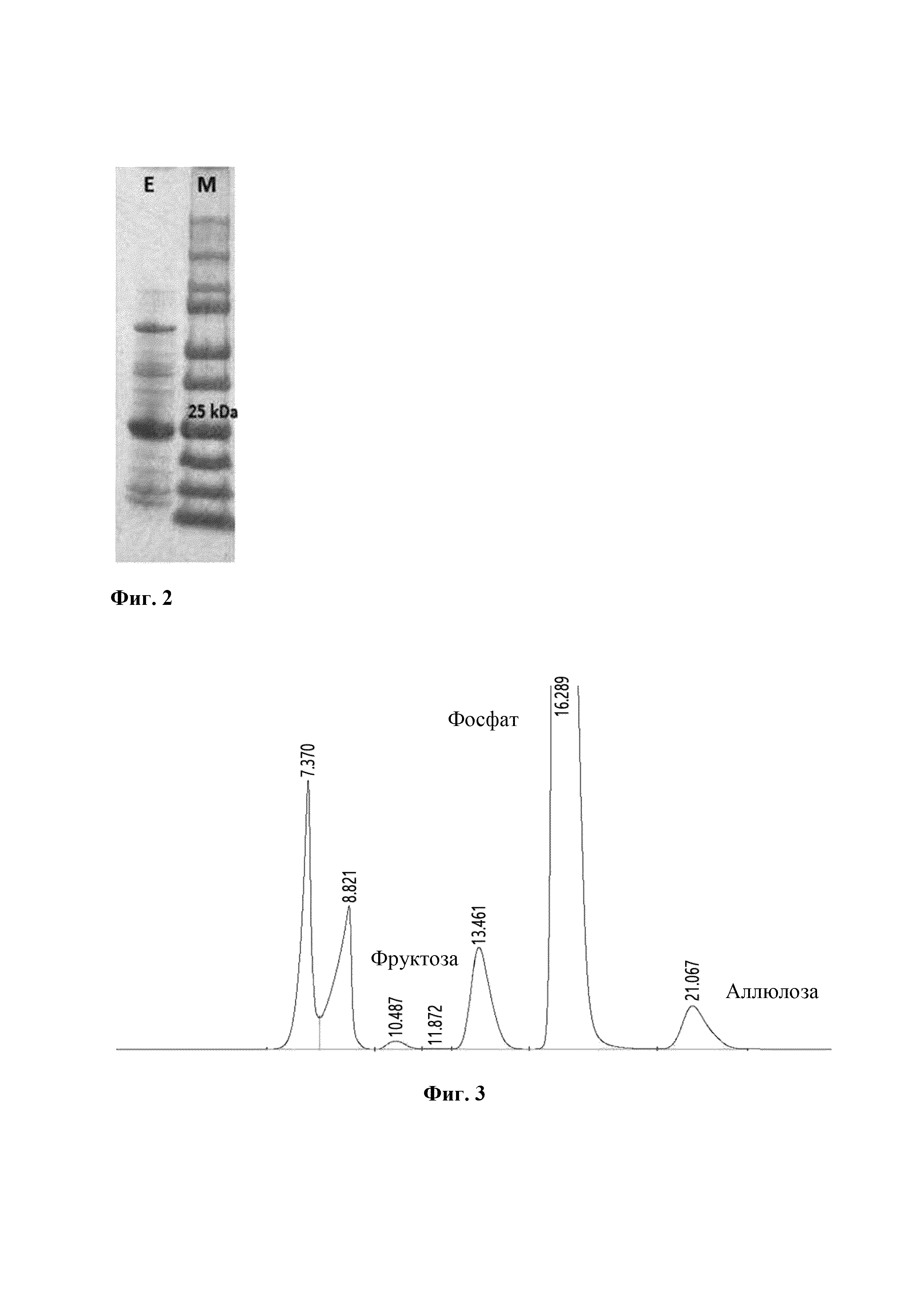
На Фиг. 2 приведены результаты анализа молекулярной массы фруктозо-6-фосфат-3-эпимеразы (Е: FP3E) по настоящему изобретению посредством электрофореза белка (SDS-PAGE (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия)). "М" представляет маркер размера белка.
На Фиг. 3 представлен график, показывающий конверсионную эффективность фруктозо-6-фосфат-3-эпимеразы по настоящему изобретению при превращении фруктозо-6-фосфата в аллюлозо-6-фосфат.
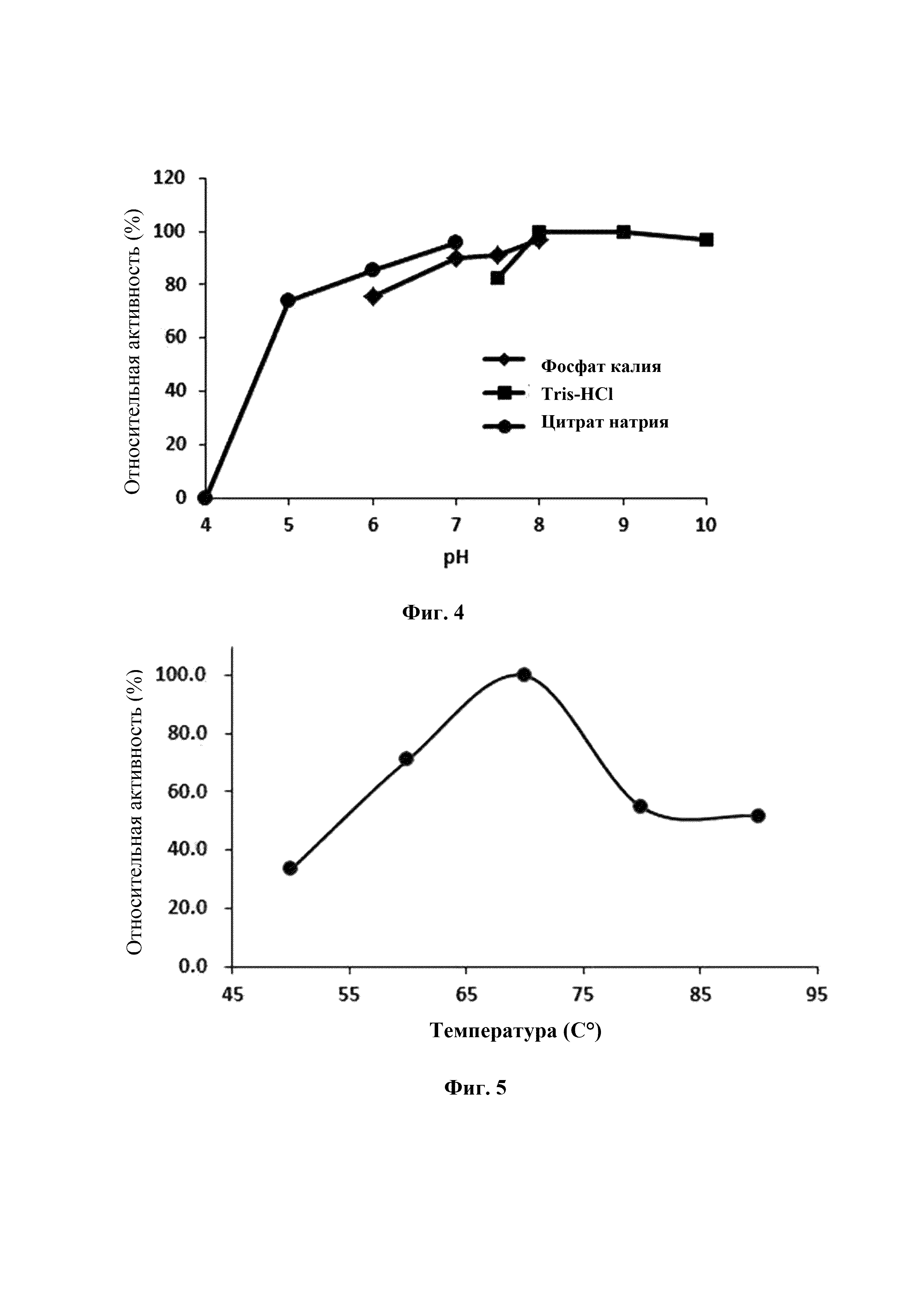
На Фиг. 4 представлен график, показывающий активность фруктозо-6-фосфат-3-эпимеразы по настоящему изобретению, в зависимости от буферного раствора и диапазона рН.
На Фиг. 5 представлен график, показывающий активность фруктозо-6-фосфат-3-эпимеразы по настоящему изобретению, в зависимости от температуры.
На Фиг. 6 представлен график, показывающий активность фруктозо-6-фосфат-3-эпимеразы по настоящему изобретению при добавлении иона металла.
Лучший вариант осуществления изобретения
Далее подробно описано настоящее изобретение. При этом каждое из объяснений и примерных воплощений, раскрытых здесь, можно применять к другим объяснениям и примерным воплощениям. То есть все комбинации различных факторов, раскрытых здесь, относятся к объему настоящего изобретения. Кроме того, объем настоящего изобретения не должен быть ограничен конкретным раскрытием, представленным здесь.
Для решения задачи настоящего изобретения, в одном аспекте настоящего описания предложена фруктозо-6-фосфат-3-эпимераза, состоящая из аминокислотной последовательности SEQ ID NO: 1.
Кроме того, фруктозо-6-фосфат-3-эпимераза по настоящему изобретению может содержать полипептид, имеющий гомологию с аминокислотной последовательностью SEQ ID NO: 1, составляющую по меньшей мере 80%, 90%, 95%, 97% или 99%. Например, очевидно, что белок, имеющий аминокислотную последовательность, содержащий делецию, модификацию, замену или добавление некоторых последовательностей, попадает в объем настоящего изобретения при условии наличия гомологии и эффективности, соответствующей гомологии и эффективности белка, состоящего из аминокислотной последовательности SEQ ID NO: 1.
Кроме того, при условии, что белок обладает эффективностью, соответствующей эффективности фруктозо-6-фосфат-3-эпимеразы по настоящему изобретению, которая состоит из аминокислотной последовательности SEQ ID NO:1, он может иметь мутации, которые происходят путем добавления бессмысленной последовательности выше или ниже аминокислотной последовательности SEQ ID N0: 1, природные мутации или молчащие мутации. Кроме того, белок, включающий аминокислотную последовательность SEQ ID NO: 1, также входит в объем настоящего изобретения.
Кроме того, фруктозо-6-фосфат-3-эпимераза может кодироваться нуклеотидной последовательностью SEQ ID NO: 2, или фруктозо-6-фосфат-3-эпимераза может кодироваться нуклеотидной последовательностью, имеющей гомологию с нуклеотидной последовательностью SEQ ID NO: 2, составляющей по меньшей мере 80%, 90%, 95%, 97% или 99%, но не ограниченной этим. Учитывая вырожденность кода, очевидно, что белки, которые состоят из аминокислотной последовательности SEQ ID NO: 1, или полинуклеотиды, которые можно транслировать в белки, имеющие гомологию с вышеуказанными белками, также могут быть включены в объем настоящего изобретения.
Используемый здесь термин "гомология" относится к степени соответствия с данной аминокислотной последовательностью или нуклеотидной последовательностью, и гомология может быть выражена в виде процента. В настоящем описании гомологичная последовательность, имеющая активность, которая идентична или подобна активности данной аминокислотной последовательности или нуклеотидной последовательности, выражается как "% гомологии". Гомологичная последовательность может быть определена посредством, например, стандартного программного обеспечения, в частности, программы BLAST 2.0, которая вычисляет такие параметры, как балл, идентичность, сходство и т.д., или посредством сравнения последовательностей с помощью Саузерн-гибридизации при определенных жестких условиях, и определение соответствующих условий гибридизации в пределах знаний специалиста в данной области техники, и могут быть определены с помощью метода, хорошо известного специалистам в данной области техники (например, J. Sambrook et al., Molecular Cloning, A Laboratory Manual, 2nd Edition, Cold Spring Harbor Laboratory press, Cold Spring Harbor, New York, 1989; F.M. Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., New York). Используемый здесь термин "жесткие условия" относится к условиям, которые предназначены для обеспечения специфичной гибридизации между полинуклеотидами. Например, эти условия конкретно описаны в литературе (например, J. Sambrook et al., выше).
В настоящем описании жесткие условия могут быть адаптированы для определения гомологии. Для подтверждения гомологии между полинуклеотидами могут быть использованы условия гибридизации низкой жесткости, соответствующие значению Tm, равному 55°С. Например, могут быть использованы условия 5Х SSC, 0,1% SDS, 0,25% молока и отсутствие формамида; или могут быть использованы условия 30% формамида, 5Х SSC и 0,5% SDS. Могут быть использованы условия гибридизации средней жесткости, которые соответствуют высоким значениям Tm; например, 40% формамида и 5Х или 6Х SSC. Могут быть использованы условия гибридизации высокой жесткости, которые соответствуют высоким значениям Tm; например, 50% формамида и 5Х или 6Х SSC, но условия гибридизации не ограничиваются приведенными выше примерами.
Для гибридизации требуется, чтобы две нуклеиновые кислоты имели комплементарные последовательности, хотя возможны несоответствия между основаниями в зависимости от жесткости гибридизации. Термин "комплементарный" используется для описания соотношения между нуклеотидными основаниями, которые способны к гибридизации друг с другом. Например, что касается ДНК, аденозин является комплементарным тимину, и цитозин является комплементарным гуанину. Следовательно, настоящее изобретение может также включать по существу сходные последовательности нуклеиновых кислот, а также выделенные фрагменты нуклеиновой кислоты, комплементарные всей последовательности.
Более конкретно, полинуклеотид, имеющий гомологию, может быть определен с использованием условий гибридизации, включающих стадию гибридизации при значении Tm 55°С и использовании вышеописанных условий. Кроме того, значение Tm может составлять 60°С, 63°С или 65°С, но не ограничивается ими. Специалисты в данной области могут соответствующим образом подобрать значение Tm в соответствии с задачей.
Соответствующая жесткость гибридизации полинуклеотидов зависит от длины и степени комплементарности полинуклеотидов, при этом вариабельные области хорошо известны в данной области техники. Чем больше сходство или гомология между двумя нуклеотидами, тем больше значение Tm для гибридов полинуклеотидов, имеющих такую последовательность. Относительная стабильность для гибридизации полинуклеотидов (соответствует более высокому значению Tm) уменьшается в следующем порядке: РНК:РНК, ДНК:РНК, ДНК:ДНК. Формула расчета значений Tm для гибридов, длина которых превышает 100 нуклеотидов, опубликована в области техники (Sambrook et аl., выше, 9.50-9.51). Для гибридизации более коротких полинуклеотидов, например, олигонуклеотидов, положение несоответствия может быть более важным, и длина олигонуклеотидов может определять их специфичность (Sambrook et аl., выше, 11.7-11.8).
В частности, полинуклеотиды могут быть определены с использованием следующих условий гибридизации: 1) стадия гибридизации с концентрацией соли ниже 500 мМ и при температуре по меньшей мере 37°С; и стадия промывки при температуре по меньшей мере 63°С с 2Х SSPE; 2) стадия гибридизации с концентрацией соли ниже 200 мМ и при температуре по меньшей мере 37°С; или 3) обе стадии гибридизации и промывки при 63°С с 2Х SSPE.
Длина гибридизации нуклеиновой кислоты может составлять, например, по меньшей мере, 10 нуклеотидов, 15 нуклеотидов, 20 нуклеотидов или, по меньшей мере, 30 нуклеотидов. Кроме того, специалисты в данной области техники могут подобрать необходимую температуру и концентрацию соли для промывающего раствора в зависимости от таких факторов, как длина зонда.
Фруктозо-6-фосфат-3-эпимераза по настоящему изобретению может представлять собой фермент, полученный из Thermotoga sp., и, в частности, может представлять собой фермент, полученный из Thermotoga neapolitana, но не ограничивается ими.
В другом аспект настоящего изобретения предложена нуклеиновая кислота, кодирующая фруктозо-6-фосфат-3-эпимеразу по настоящему изобретению.
В еще одном аспекте настоящего изобретения предложен трансформант, содержащий нуклеиновую кислоту, кодирующую фруктозо-6-фосфат-3-эпимеразу по настоящему изобретению.
Используемый здесь термин "трансформация" относится к процессу введения в клетку-хозяина вектора, включающего нуклеиновую кислоту, кодирующую белок-мишень, благодаря чему обеспечивается возможность экспрессии белка, кодируемого нуклеиновой кислотой, в клетке-хозяине. Для трансформированной нуклеиновой кислоты не имеет значения, вставлена ли нуклеиновая кислота в хромосому клетки-хозяина и расположена в ней или находится вне хромосомы, при условии, что она экспрессируется в клетке-хозяине, и поэтому включены оба случая. Кроме того, в состав нуклеиновой кислоты входят ДНК и РНК, которые кодируют целевой белок. Нуклеиновая кислота может быть вставлена в любой форме при условии, что она может быть введена в клетку-хозяина и экспрессирована в ней. Например, нуклеиновая кислота может быть введена в клетку-хозяина в форме экспрессионной кассеты, которая представляет собой генную конструкцию, включающую все необходимые элементы, необходимые для экспрессии. Экспрессионная кассета может, как правило, включать промотор, функционально связанный с нуклеиновой кислотой, сигнал терминации транскрипции, домен, связывающий рибосому и сигнал терминации трансляции. Экспрессионная кассета может быть в форме экспрессионного вектора, способного к саморепликации. Кроме того, нуклеиновая кислота может быть введена в клетку-хозяина как таковая и быть функционально связанной с последовательностью, необходимой для ее экспрессии в клетке-хозяине, но нуклеиновая кислота не ограничена этим.
Кроме того, используемый здесь термин "функционально связанный", относится к функциональной связи между последовательностью промотора, который инициирует и содействует осуществлению транскрипции нуклеиновой кислоты, кодирующей целевой белок по настоящему изобретению, и вышеупомянутой последовательностью гена.
Способ по настоящему изобретению для трансформации вектора включает любой способ введения нуклеиновой кислоты в клетку и может быть осуществлен путем выбора подходящей стандартной методики, известной в данной области техники, в соответствии с клеткой-хозяином. Примеры способа могут включать электропорацию, осаждение фосфатом кальция (CaPO4), осаждение хлоридом кальция (CaCl2), микроинъекции, метод с использованием полиэтиленгликоля (PEG), метод с использованием ДЭАЭ-декстрана, метод с использованием катионных липосом, метод литий ацетат-ДМСО и т.д., но не ограничиваются этим.
В качестве клетки-хозяина предпочтительно использовать клетку, обладающую высокой эффективностью введения ДНК и высокой эффективностью экспрессии введенной ДНК. Например, это может быть Е, coli, но не ограничивается этим.
Еще в одном аспекте настоящего изобретения предложена композиция для получения аллюлозы, содержащая фруктозо-6-фосфат-3-эпимеразу по настоящему изобретению, микроорганизм, экспрессирующий фруктозо-6-фосфат-3-эпимеразу по настоящему изобретению, или культуру указанного микроорганизма, экспрессирующего фруктозо-6-фосфат-3-эпимеразу по настоящему изобретению.
Композиция по настоящему изобретению для получения аллюлозы может дополнительно содержать фермент, вовлеченный в путь продуцирования аллюлозы (см. Фиг. 1) по настоящему изобретению, микроорганизм, экспрессирующий указанный фермент, вовлеченный в путь продуцирования аллюлозы по настоящему изобретению, или культуру указанного микроорганизма, экспрессирующего указанный фермент, вовлеченный в путь продуцирования аллюлозы по настоящему изобретению. Однако это всего лишь пример; то есть нет ограничения фермента, который должен содержаться в композиции по настоящему изобретению для получения аллюлозы, и субстрата, используемого для получения аллюлозы, при условии, что аллюлоза может быть получена с использованием фруктозо-6-фосфат-3-эпимеразы по настоящему изобретению.
Композиция по настоящему изобретению для получения аллюлозы может, кроме того, содержать аллюлозо-6-фосфатфосфатазу, микроорганизм, экспрессирующий аллюлозо-6-фосфатфосфатазу или культуру микроорганизма, экспрессирующего аллюлозо-6-фосфат фосфатазу.
Кроме того, композиция по настоящему изобретению для получения аллюлозы может дополнительно содержать: (а) (1) крахмал, мальтодекстрин, сахарозу или их комбинацию, глюкозу, глюкозо-1-фосфат, глюкозо-6-фосфат или фруктозо-6-фосфат; (2) фосфат; (3) аллюлоо-6-фосфатфосфатазу; (4) глюкозо-6-фосфатизомеразу; (5) фосфоглюкомутазу или глюкокиназу; и/или (6) α-глюканфосфорилазу, фосфорилазу крахмала, фосфорилазу мальтодекстрина, фосфорилазу сахарозы, α-амилазу, пуллуланазу, изоамилазу, глюкоамилазу или сахаразу; или (б) микроорганизм, экспрессирующий любой из указанных указанных ферментов, но не ограничивается ими.
В частности, фосфорилаза крахмала/мальтодекстрина (ЕС 2.4.1.1) и α-глюканфосфорилаза по настоящему изобретению могут включать любые белки при условии, что они представляют собой белки, которые осуществляют перенос фосфорила от фосфата к глюкозе, таким образом, обладают активностью продуцирования глюкозо-1-фосфата из крахмала или мальтодекстрина. Фосфорилаза сахарозы (ЕС 2.4.1.7) по настоящему изобретению может включать любой белок при условии, что этот белок осуществляет перенос фосфорила от фосфата к глюкозе, таким образом, обладая активностью продуцирования глюкозо-1-фосфата из сахарозы. α-Амилаза (ЕС 3.2.1.1), пуллуланаза (ЕС 3.2.1.41), глюкоамилаза (ЕС 3.2.1.3) и изоамилаза по настоящему изобретению, которые представляют собой ферменты для превращения крахмала в сахар, могут включать любые белки, если они являются белками, имеющими активность превращения крахмала или мальтодекстрина в глюкозу. Сахараза (ЕС 3.2.1.26) по настоящему изобретению может включать любой белок, если этот белок обладает активностью превращения сахарозы в глюкозу. Фосфоглюкомутаза (ЕС 5.4.2.2) по настоящему изобретению может включать любой белок, если он является белком, обладающим активностью превращения глюкозо-1-фосфата в глюкозо-6-фосфат. Глюкокиназа может включать любой белок, если он является белком, способным переносить фосфат на глюкозу, тем самым обладая активностью превращения в глюкозо-6-фосфат. В частности, глюкокиназа может быть полифосфат-зависимой глюкокиназой и более конкретно может быть полифосфат-зависимой глюкокиназой, полученной из Deinococcus geothermalis и состоящей из аминокислотной последовательности SEQ ID NO :5, которая кодируется нуклеотидной последовательностью SEQ ID NO: 7, или может быть полифосфат-зависимой глюкокиназой, полученной из Anaerolinea thermophila, состоящей из аминокислотной последовательности SEQ ID NO: 6, которая кодируется нуклеотидной последовательностью SEQ ID NO: 8. Изомераза глюкозо-6-фосфата по настоящему изобретению может включать любой белок, если этот белок имеет активность превращения глюкозо-6-фосфат во фруктозо-6-фосфат.Аллюлозо-6-фосфатфосфатаза по настоящему изобретению может включать любой белок, если этот белок имеет активность превращения аллюлозо-6-фосфата в аллюлозу. Более конкретно, аллюлозо-6-фосфатфосфатаза может представлять собой белок, обладающий активностью необратимого превращения аллюлозо-6-фосфата в аллюлозу.
В еще одном аспекте настоящего изобретения предложен способ получения аллюлозы, включающий: превращение фруктозо-6-фосфата в аллюлозо-6-фосфат путем взаимодействия фруктозо-6-фосфата с фруктозо-6-фосфат-3-эпимеразой, состоящей из аминокислотной последовательности SEQ ID NO: 1, микроорганизмом, экспрессирующим фруктозо-6-фосфат-3-эпимеразу, или культурой указанного микроорганизма, экспрессирующего фруктозо-6-фосфат-3-эпимеразу.
Способ получения по настоящему изобретению может дополнительно включать превращение аллюлозо-6-фосфата в аллюлозу путем взаимодействия аллюлозо-6-фосфата с аллюлозо-6-фосфатфосфатазой, микроорганизмом, экспрессирующим аллюлозо-6-фосфат фосфатазу, или культурой указанного микроорганизма, экспрессирующего аллюлозо-6-фосфатфосфатазу, после превращения фруктозо-6-фосфата по настоящему изобретению в аллюлозо-6-фосфат.
Кроме того, способ получения по настоящему изобретения может дополнительно включать превращение глюкозо-6-фосфата во фруктозо-6-фосфат путем взаимодействия глюкозо-6-фосфата с глюкозо-6-фосфатизомеразой, микроорганизмом, экспрессирующим глюкозо-6-фосфатизомеразу, или культурой указанного микроорганизма, экспрессирующего глюкозо-6-фосфатизомеразу, перед превращением фруктозо-6-фосфата по настоящему изобретению в аллюлозо-6-фосфат.
Кроме того, способ получения по настоящему изобретения может дополнительно включать превращение глюкозо-1-фосфат в глюкозо-6-фосфат путем взаимодействия глюкозо-1-фосфат с фосфоглюкомутазой, микроорганизмом, экспрессирующим фосфоглюкомутазу, или культурой указанного микроорганизма, экспрессирующего фосфоглюкомутазу, перед превращением глюкозо-6-фосфат по настоящему изобретению в фруктозо-6-фосфат.
Кроме того, способ получения по настоящему изобретения может дополнительно включать превращение глюкозы в глюкозо-6-фосфат путем взаимодействия глюкозы с глюкокиназой, микроорганизмом, экспрессирующим глюкокиназу, или культурой указанного микроорганизма, экспрессирующего глюкокиназу, и фосфатом, перед превращением глюкозо-6-фосфата по настоящему изобретению во фруктозо-6-фосфат.
Кроме того, способ получения по настоящему изобретения может дополнительно включать превращение крахмала, мальтодекстрина, сахарозы или их комбинации в глюкозо-1-фосфат путем взаимодействия крахмала, мальтодекстрина, сахарозы или их комбинации с фосфатом и α-глюканфосфорилазой, фосфорилазой крахмала, фосфорилазой мальтодекстрина или фосфорилазой сахарозы; микроорганизмом, экспрессирующим указанную фосфорилазу; или культурой указанного микроорганизма, экспрессирующего фосфорилазу, перед превращением глюкозо-1-фосфат по настоящему изобретению в глюкозо-6-фосфат.
Кроме того, способ получения по настоящему изобретения может дополнительно включать превращение крахмала, мальтодекстрина, сахарозы или их комбинации в глюкозу путем взаимодействия крахмала, мальтодекстрина, сахарозы или их комбинации с α-амилазой, пуллуланазой, глюкоамилазой, сахаразой или изоамилазой; микроорганизмом, экспрессирующим амилазу, пуллуланазу или сахаразу; или культурой указанного микроорганизма, экспрессирующего амилазу, пуллуланазу или сахаразу, перед превращением глюкозы по настоящему изобретению в глюкозо-6-фосфат.
Способ получения по настоящему изобретения может дополнительно включать превращение глюкозы в крахмал, мальтодекстрин или сахарозу путем взаимодействия глюкозы с 4-α-глюканотрансферазой, микроорганизмом, экспрессирующим 4-α-глюканотрансферазу, или культурой указанного микроорганизма, экспрессирующего 4-α-глюканотрансферазу.
В способе получения по настоящему изобретению "взаимодействие" можно осуществлять при рН от 5,0 до 10,0, при температуре от 50°С до 90°С и/или в течение от 1 минуты до 24 часов. В частности, взаимодействие по настоящему изобретению может проводиться при рН от 5,0 до 9,0, рН от 5,0 до 8,0, рН от 5,0 до 7,0, рН от 5,0 до 6,0, рН от 6,0 до 10,0, рН от 6,0 до 9,0, рН от 6,0 до 8,0, рН от 6,0 до 7,0, рН от 7,0 до 10,0, рН от 7,0 до 9,0, рН от 7,0 до 8,0, рН от 8,0 до 10,0, рН от 8,0 до 9,0 или рН от 9,0 до 10,0. Кроме того, взаимодействие по настоящему изобретению можно проводить при температуре от 55°С до 90°С, от 60°С до 90°С, от 60°С до 75°С, от 65°С до 75°С или от 60°С до 70°С. Кроме того, взаимодействие по настоящему изобретению можно проводить в течение от 1 минуты до 12 часов, от 1 минуты до 6 часов, от 1 минуты до 3 часов, от 1 минуты до 1 часа, от 5 минут до 24 часов, от 5 минут до 12 часов, от 5 минут до 6 часов, от 5 минут до 3 часов, от 5 минут до 1 часа, от 10 минут до 24 часов, от 10 минут до 12 часов, от 10 минут до 6 часов, от 10 минут до 3 часов или 10 минут до 1 часа.
В еще одном аспекте настоящего изобретения предложен способ получения аллюлозы, включающий взаимодействие крахмала, мальтодекстрина, сахарозы или их комбинации и фосфата с (а) аллюлозо-6-фосфатфосфатазой; фруктозо-6-фосфат-3-эпимеразой, состоящей из аминокислотной последовательности SEQ ID NO: 1; глюкозо-6-фосфатизомеразой; фосфоглюкомутазой или глюкокиназой; и α-глюканфосфорилазой, фосфорилазой крахмала, фосфорилазой мальтодекстрина, фосфорилазой сахарозы, α-амилазой, пуллуланазой, изоамилазой, глюкоамилазой, или сахаразой; или (б) микроорганизмом, экспрессирующим любой из указанных ферментов или культурой указанного микроорганизма.
Способ осуществления изобретения
Ниже настоящее изобретение подробно описано со ссылкой на типичные воплощения. Однако раскрытые здесь типичные воплощения предназначены только для иллюстративных целей и не должны рассматриваться как ограничивающие объем настоящего изобретения.
Пример 1: Получение рекомбинантного экспрессирующего вектора, содержащего ген фруктозо-6-фосфат-3-эпимеразы и трансформированного микроорганизма
Для получения новой термостабильной фруктозо-6-фосфат-3-эпимеразы, был выделен ген из Thermotoga neapolitana, термофильного микроорганизма, а затем были получены рекомбинантный экспрессирующий вектор и трансформированный микроорганизм.
В частности, на основе последовательностей гена из Thermotoga neapolitana, зарегистрированных в Genbank, был выбран ген fp3e, который, как предполагается, кодирует фруктозо-6-фосфат-3-эпимеразу. После этого, на основании информации о аминокислотной последовательности (SEQ ID NO: 1) и нуклеотидной последовательности (SEQ ID NO: 2), были разработаны и синтезированы прямой праймер (SEQ ID NO: 3) и обратный праймер (SEQ ID NO: 4). Полимеразную цепную реакцию (ПЦР) проводили с синтезированными праймерами, используя в качестве матрицы хромосомную ДНК Thermotoga neapolitana (геномную ДНК). Конкретно, при проведении ПЦР выполняли 25 циклов при следующих условиях: денатурацию при 95°С в течение 30 секунд, отжиг при 55°С в течение 30 секунд и полимеризацию при 68°С в течение 2 минут. Полученный продукт встраивали в рЕТ21а (Novagen Inc.), который представляет собой плазмидный вектор для экспрессии в Е. coli, с использованием рестрикционных ферментов Nde и Xho, а затем сконструированный рекомбинантный экспрессирующий вектор и названный как CJ_tn_fp3e. CJ_tn_fp3e трансформировали в штамм E. coli BL21 (DE3) посредством обычного метода трансформации (Sambrook et аl. 1989) для получения микроорганизма, трансформированного рекомбинантным вектором, включающим нуклеотидную последовательность SEQ ID NO: 2, который назван как Е. coli BL21 (DE3)/CJ_tn_fp3e.
Штамм E.coli BL21(DE3)/CJ_tn_fp3e был депонирован в Корейский центр культур микроорганизмов (КССМ), который является международным депозитарным органом в соответствии с Будапештским договором, 23 июня 2016 года, и ему был присвоен номер доступа КССМ11848Р.
Пример 2: Получение рекомбинантного фермента
С целью получения рекомбинантного фермента (далее называемый FP3E), Е. coli BL21 (DE3)/CJ_tn_fp3e инокулировали в культуральную пробирку, содержащую 5 мл жидкой среды LB, а затем инициировали культуру для посева в инкубаторе для встряхивания при 37°С вплоть до достижения значения поглощения 2,0 при 600 нм. Раствор культуры для посева инокулировали в культуральную колбу, содержащую жидкую среду LB и получали основную культуру. Когда поглощение при 600 нм достигало 2,0, добавляли 1 мМ IPTG (изопропилтиогалактозид) для индукции экспрессии/продукции FP3E. Культивирование посевной культуры и основной культуры проводили при скорости перемешивания 200 об/мин при температуре 37°С. После завершения получения основной культуры культуральный раствор центрифугировали при 4°С при 8,000×g в течение 20 минут и затем извлекали клетки. Полученные клетки дважды промывали 50 мМ трис-HCl-буфером (рН 7,0), суспендировали в том же буфере и затем клетки разрушали с использованием ультразвукового разрушителя клеток. Клеточный дебрис центрифугировали при 4°С при 13000 × g в течение 20 минут, а затем получали только супернатант.FP3E выделяли из супернатанта с использованием His-tag аффинной хроматографии. Очищенный раствор рекомбинантного фермента подвергали диализу с использованием 50 мМ трис-HCl-буфера (рН 7,0), и затем полученные продукты использовали для анализа свойств фермента.
Молекулярную массу подвергали SDS-PAGE анализу, и в результате было обнаружено, что молекулярная масса очищенного FP3E составляла примерно 25 кДа (обозначенная, как "Е" на Фиг. 2).
Пример 3: Определение активности FP3E
Для анализа активности превращения FP3E из фруктозо-6-фосфата в аллюлозо-6-фосфат, фруктозо-6-фосфат (50 мМ) суспендировали в 50 мМ Tris-HCI буфера (рН 7,0) и к нему добавляли очищенный FP3E (0,1 ед./мл). После этого полученные продукты подвергали взаимодействию при 70°С в течение 1 часа.
Из-за отсутствия референсного материала аллюлозо-6-фосфата, в настоящее время невозможно определить, продуцируется ли аллюлозо-6-фосфат.Следовательно, после превращения аллюлозо-6-фосфата в аллюлозу с использованием фитазы, которая представляет собой аллюлозо-6-фосфатфосфатазу, измеряли активность превращения в соответствии с продукцией аллюлозы. В частности, после завершения реакции добавляли фитазу (10 ед./мл) и затем подвергали взаимодействию при 37°С в течение 1 часа для дефосфорилирования как субстрата, например, фруктозо-6-фосфата, так и продукта, например, аллюлозо-6-фосфата. После этого фруктозу и аллюлозу анализировали методом ВЭЖХ. Анализ ВЭЖХ осуществляли с использованием колонки Aminex НРХ-87С (Bio-rad Inc.), при пропускании продукта реакции в мобильной фазе при скорости потока 0,5 мл/мин при 80°С.Фруктозу и аллюлозу обнаруживали с помощью детектора показателя преломления.
В результате фруктоза и аллюлоза были обнаружены в продукте реакции FP3E (Фиг. 3), и, таким образом, было подтверждено, что FP3E обладает способностью продуцировать аллюлозо-6-фосфат путем 3-эпимеризации фруктозо-6-фосфата (Фиг. 3).
Пример 4: Определение активности FP3E в зависимости от рН, температуры и добавления иона металла
4-1. Определение активности в зависимости от рН
Для определения влияния рН на FP3E, очищенный FP3E (0,1 ед./мл) добавляли к фруктозо-6-фосфату (50 мМ), суспендированному в 50 мМ буфере с различными pHs (рН 4,0-7,0, цитрат натрия; рН 6,0-8,0, фосфат калия: рН 7,0-9,0, Tris-HCl), и затем подвергали реакции при 70°С в течение 10 минут. После этого полученные продукты реагировали с фитазой при тех же условиях, что и в Примере 3 и аллюлозу количественно анализировали с помощью ВЭЖХ.
В результате было подтверждено, что FP3E проявляет максимальную активность при рН 7,0-8,0, и что FP3E сохраняет 70% или более активности в очень широком диапазоне рН (5,0-10,0) по сравнению с максимальной активностью (Фиг. 4).
4-3. Определение активности в зависимости от добавления иона металла
Чтобы исследовать влияние добавления иона металла на активность FP3E, каждый из ионов металла (например, NiSO4, CuSO4, MnSO4, CaCl2, ZnSO4, MgSO4, MgCl2, FeSO4, NaCl, LiCl и KCl) добавляли к фруктозо-6-фосфату (50 мМ), суспендированному в 50 мМ трис-HCl-буфере (рН 7,0) до конечной концентрации 0,5 мМ. Для удаления ионов металлов к нему добавляли FP3E (0,1 ед./мл), который подвергали диализу путем обработки 10 мМ EDTA, и затем полученные продукты подвергали взаимодействию при 70°С в течение 10 минут. После этого полученные продукты подвергали взаимодействию с фитазой при тех же условиях, что и в Примере 3, и аллюлозу количественно анализировали с помощью ВЭЖХ.
В результате активность FP3E была слегка увеличена при добавлении ионов Са и Cu, но при добавлении ионов других металлов изменения активности фермента практически не наблюдалось. Таким образом, было подтверждено, что FP3E не является металлоферментом (Фиг. 6).
Хотя настоящее изобретение было описано со ссылкой на конкретные иллюстративные воплощения, специалистам в данной области техники, к которой относится настоящее изобретение, будет понятно, что настоящее изобретение может быть воплощено в других конкретных формах, не отступая от технического характера или существенных признаков настоящего изобретения. Следовательно, вышеописанные воплощения считаются иллюстративными, а не ограничивающими. Кроме того, объем настоящего изобретения определяется прилагаемой формулой изобретения, а не подробным описанием, и следует понимать, что все модификации или вариации, полученные из значения и объема настоящего изобретения и его эквивалентов, включены в объем прилагаемой формулы изобретения.
Реферат
Изобретение относится к применению фруктозо-6-фосфат-3-эпимеразы, состоящей из аминокислотной последовательности SEQ ID NO: 1, для получения аллюлозы. Кроме того, настоящее изобретение относится к композиции для получения аллюлозы, содержащей фруктозо-6-фосфат-3-эпимеразу по настоящему изобретению, и к способу получения аллюлозы с использованием фруктозо-6-фосфат-3-эпимеразы по настоящему изобретению. Изобретение позволяет получать аллюлозу с высокой степенью эффективности. 4 н. и 8 з.п. ф-лы, 6 ил., 4 пр.

Комментарии