Способ получения 7-аминодезацетоксицефалоспорановой кислоты (7-adca) - RU2178808C2
Код документа: RU2178808C2
Чертежи







Описание
Изобретение относится к синтетическим способам получения коммерческих цефалоспориновых антибиотиков, которых в настоящее время существует достаточное число, причем сейчас эти терапевтические средства представляют четвертое поколение. Признано, что большое разнообразие боковых цепей в коммерческих цефалоспоринах и существенная экономическая роль цефалоспоринов увеличивают значение разработки более экономичных и эффективных способов получения ключевых промежуточных соединений, которые позволяют легко синтезировать различные цефалоспорины.
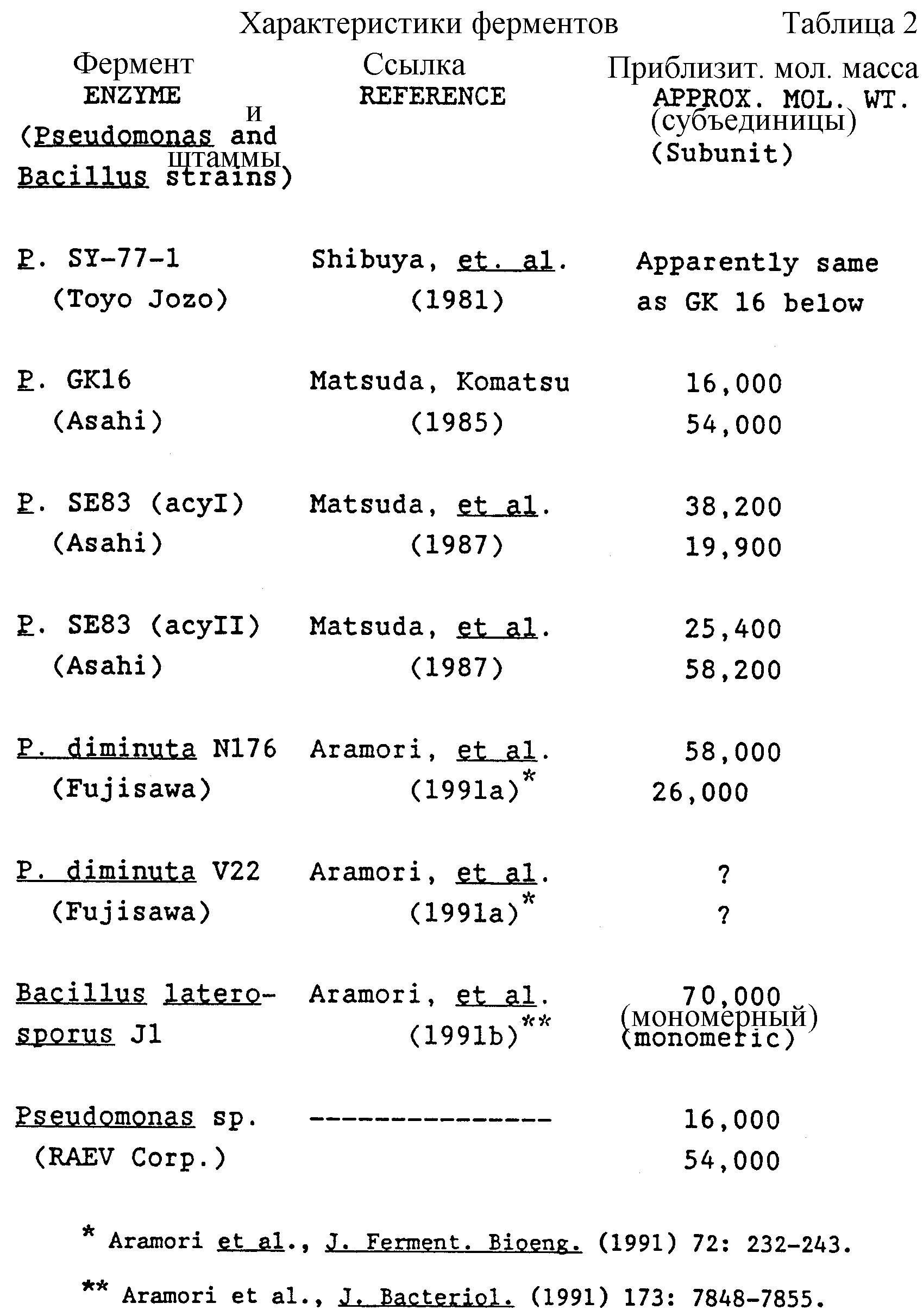
Одним из таких ключевых промежуточных соединений является 7-аминодезацетоксицефалоспорановая кислота /7-ADCA/, которая может быть изображена следующей формулой:
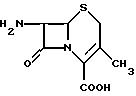
Обычно 7-ADCA получают из пенициллина С, и требуется четыре или пять химических стадий, чтобы расширить систему пенициллинового кольца от 5-членного до 6-членного кольца, которое характеризует цефалоспорины. Как типично для полностью химического синтеза, этот способ имеет серьезные недостатки. К их числу относятся необходимость многостадийного и комплексного процесса, и высокая стоимость реагентов, проблемы обработки вод, содержащих значительные количества побочных продуктов, образующихся в результате процесса, и очистка исходного материала перед началом химической обработки. Поэтому продолжаются поиски микробиологического или ферментативного процесса, который обеспечил бы осуществление расширения ферментного кольца и отщепление боковой цепи с образованием 7-ADCA на более экономичной основе, чем химический способ, который используется сейчас.
Соответственно, настоящее изобретение касается, в особенности, области получения ключевого промежуточного соединения цефалоспорина 7-ADCA и более конкретно к области биопроцесса для получения 7-ADCA.
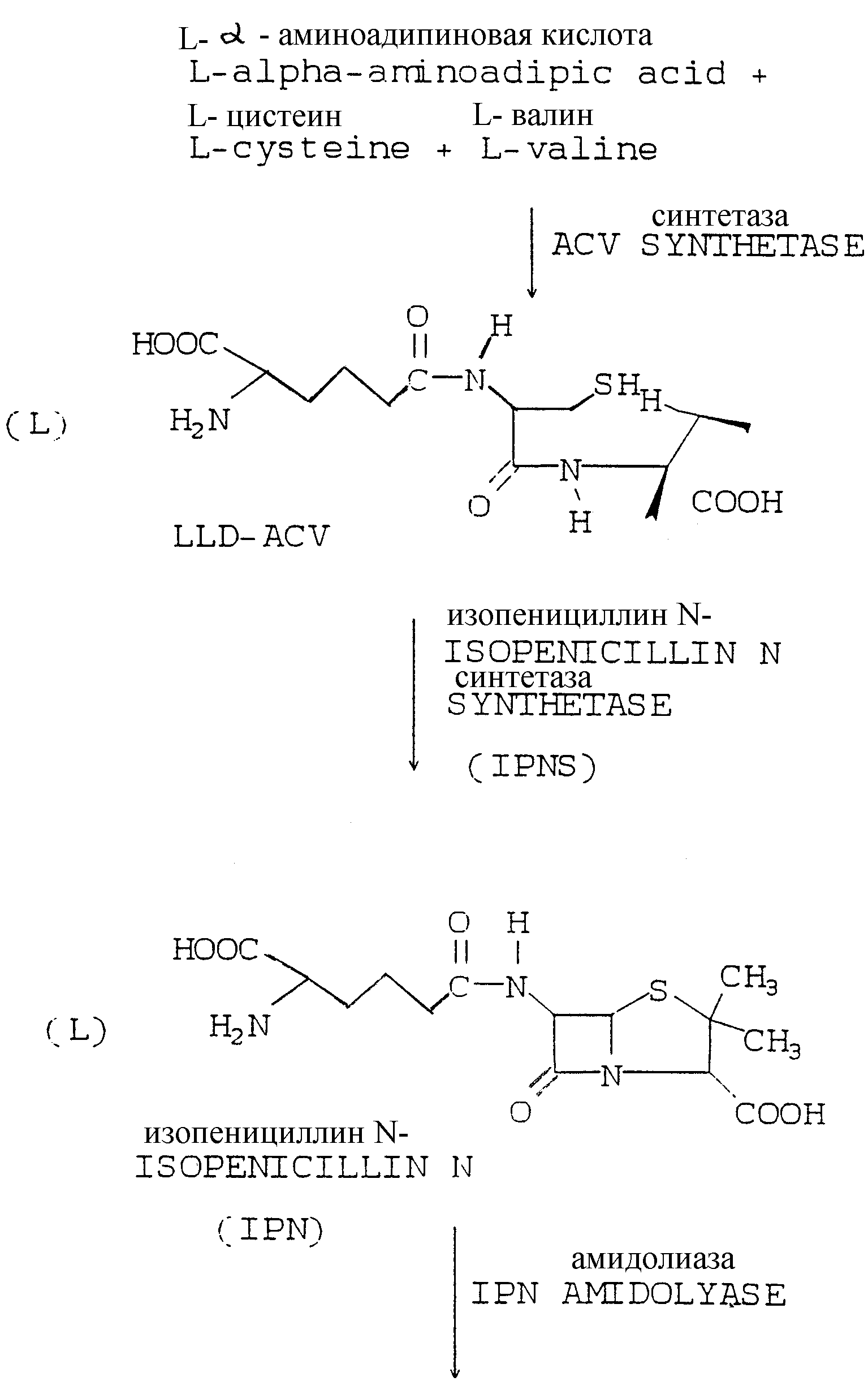
Сначала поиски удачного биопроцесса для получения 7-ADCA были безуспешны, особенно с точки зрения коммерческого масштаба. Например, хотя возможно получить 6-аминопенициллановую кислоту /6-АРА/ прямой ферментацией и/или ферментативной обработкой пенициллина G, после чего остается только необходимость расширения кольца, чтобы получить 7-ADCA, найдено, что, к несчастью, ферменты Cephalosporium или Streptomyces, которые осуществляют расширение кольца при обычном обмене в этих микроорганизмах, не приемлют 6-АРА в качестве субстрата. Эти ферменты, которые все вместе относят в технике к DAOCS или экспандазе, определяются как ферменты, которые катализируют расширение кольцевых структур пенама, обнаружненных в молекулах типа пенициллина, до цеф-3-ем-колец, найденных в цефалоспоринах. Далее здесь такие ферменты будут упоминаться как "фермент экспандаза".
Субстратом, на котором фермент экспандаза проявляет активность, является пенициллин N, который при расширении кольца дает дезацетоксицефалоспорин С /DAOC/. В таком случае, чтобы получить 7-ADCA, необходимо только отщепить боковую (D)-α-аминоадипоиловую цепь, но эта боковая цепь оказывает упорное сопротивление ферментативному отщеплению, давая только неприемлемо низкие выходы.
В соответствии с настоящим изобретением возможно осуществить эффективный биопроцесс, в котором образуется соединение пенициллина /имеющее боковую адипоильную цепь/ посредством нового способа ферментации с высокими титрами, причем упомянутое соединение пенициллина является приемлемым субстратом для ферментной системы экспандазы, которая образуется in situ тем же микроорганизмом, который образует соединение пенициллина, которое трансформируется для экспрессии упомянутой системы фермента экспандазы. Экспандаза затем с высоким выходом расширяет кольцо соединения пенициллина до соединения цефалоспорина. И, что важно для второго критического момента, боковая цепь соединения пенициллина, теперь - соединения цефалоспорина, способна удаляться при действии другой ферментной системы с удивительно высоким выходом. Неожиданным результатом этого уникального биопроцесса, который составляет суть настоящего изобретения, является производство 7-ADCA с удивительно высоким выходом.
Cantwell et al. , Curr, Genet. /1990/ 17: 213-221, предложили биопроцесс для получения 7-ADCA посредством расширения кольца пенициллина V с последующим ферментативным гидролизом получающегося в результате дезацетоксицефалоспорина V с образованием 7-ADCA. Такое предложение основано на наличии клонированного пенициллином N гена экспандазы /СеfE/ из S. clavuligerus, Kovacevic et al. , J. Ваcteriol. /1989/ 171: 754-760 и патент США 5070020. Однако, так как экспандаза проявляет активность на пенициллине N, своем природном субстрате, но не на пенициллине V, предложение требует приемов генной инженерии для получения модифицированного гена экспандазы, который может расширять кольцо пенициллина. Однако Сantwell et al. не добились требуемой модификации, и они только преуспели в трансформации Penicillium chvysogenum с cef-E-геном из Streptomyces clavuligerus и экспрессии низкого уровня фермента DAOCS /экспандазы/.
Фермент экспандаза хорошо изучен в технике как с точки зрения его активности, так и его последовательности. Например, в патентах США 4510246 и 4536476, Wolfe, циклаза, эпимераза и ферменты расширения кольца выделены только из бесклеточного экстракта прокариотных продуцирующих β-лактам организмов, включая Streptomyces clavuligerus. чтобы дать устойчивые ферментные реагенты. Заявка на Европейский патент ЕР-А-0366354 описывает очищенный фермент экспандазу, выделенный из S. clavuligerus, который отличается концевой группой и аминокислотным составом, и упоминается, что его молекулярная масса составляет около 34600 дальтон. Это, однако, находится в противоречии с молекулярной массой, равной 29000, приписываемой этому же ферменту в патенте США 4536476. Заявка на Европейский патент ЕР-А-0233715 раскрывает выделение и создание карты эндонуклеазного ограничения фермента экспандазы, полученной из S. clavuligerus, трансформацию и экспрессию в хозяине упомянутого фермента, и примеры расширения кольца субстрата пенициллина N с использованием упомянутого фермента. Патент США 5070020 раскрывает последовательность ДНК, кодирующую фермент экспандазу, полученную из S. clavuligerus, и описывает трансформацию штамма P. chrysogenum с вектором экспрессии, содержащим упомянутую последовательность ДНК, за счет чего получают экспрессию фермента экспандазы. Хотя предполагается, что этот фермент пригоден для экспансии субстратов и иных, чем пенициллин N, примеров такой экспансии не приводится.
Описанная выше работа сосредоточивает внимание на ферменте экспандазе, полученной из прокариотного S. clavuligerus. Этот же фермент или по крайней мере фермент, явно имеющий ту же активность по расширению кольца, также подвергается экспрессии штаммами эукариотного Cephalasporium acremonium /также называемого Аcremonium chrysogenum/. Однако таких штаммах активность экспандазы экспрессируется бифункциональным геном /cefE-F/, который также экспрессирует активность DACS /гидроксилазы/, естественной функцией которой является конверсия дезацетоксицефалоспориновой кислоты /DAOC/ - продукта фермента экспандазы в дезацетилцефалоспорин С /DAC/. Результатом является один, но бифункциональный фермент - экспандаза /гидроксилаза. Хотя предприняты усилия по разделению активностей этих двугенных продуктов, успех пока не достигнут. Например, заявка на Европейский патент ЕР-А-0281391 раскрывает выделение и идентификацию ДНК последовательности гена DAOCS/DACS, полученного из С. acremonium AТСС 11550, вместе с соответствующими аминокислотными последовательностями ферментов. Penicillium трансформируется и экспрессирует ферменты, однако попытки конверсии пенициллинов G и V в соответствующие цефалоспорины нигде не демонстрируется. Кроме того, несмотря на предложение, что техника генной инженерии дает легкий способ разделения генетической информации, кодирующей DAOCS, и DACS, и их раздельного выражения, фактических примеров такого разделения не приводится.
Фермент DAOCS/DACS (экспандаза/гидроксилаза) из С. асremonium также хорошо изучен в технике как в отношении его активности, так и в отношении его свойств и генетической последовательности. Например, в патентах США 4178210, 4248966 и 4307192, Demain, различные исходные материалы типа пенициллина обрабатывают бесклеточным экстрактом С. аcremonium, который эпимеризует и экспандирует кольцо с образованием антибиотика типа цефалоспорина. Wu-Kuang Yeh в патенте США 4753881 описывает фермент С. acremonium с точки зрения его свойств, таких как изоэлектрическая точка, молекулярная масса, аминокислотные остатки, соотношение активностей гидроксилазы и экспандазы и пептидные ферменты.
Прототипы, описанные выше, имеют дело только с одним аспектом настоящего изобретения, т. е. с трансформацией штамма Р. chrysogenum геном, экспрессирующим фермент экспандазу, и получением экспрессии этого фермента. В технике, однако, используют экспрессированный фермент только для расширения кольца пенициллина N, но не пенициллинов G и V. Даже в этом случае пенициллин N имеет боковую цепь в положении 7, которая не может быть отщеплена ферментативно с образованием 7-ADCA, как по способу настоящего изобретения. Настоящее изобретение основывается на поразительном открытии, что адипоильная боковая цепь может быть эффективно присоединена штаммом P. сhrusogenum, и что фермент экспандазы, экспрессированный in situ, может эффективно использовать это соединение в качестве субстрата для расширения кольца до адипоил-7-АDCA, и что адипоильная боковая цепь затем может быть эффективно удалена с помощью еще одного фермента с образованием 7-ADCA. Хотя отдельные выделенные фрагменты настоящего изобретения могут быть найдены в прототипах, нельзя предположить, что их можно соединить и получить непредвиденные результаты, которые получают по способу настоящего изобретения.
Например, в технике известен способ получения 6-адипоилпенициллановой кислоты, см. Ballio, А. et al. , Nature /1960/, 185, 97-99. Ферментативное расширение 6-адипоилпенициллановой кислоты in vitro также известно в технике, см. Baldwin et al. , Tetrahedron /1987/ 43, 3009-3014; и ЕР-А-0268343. Также известно и ферментивное отщепление боковых адипоильных цепей: см. Matsufa et al. , J. Bact. /1987/ 169, 5815-5820.
Адипоильная боковая цепь имеет строение СООН (СН2)4-СО-, в то время как ближайшая родственная боковая цепь представляет собой глутарил и имеет строение СООН-(СН2)3-СО-. Ферментативное отщепление боковых глутариловых цепей известно в технике, см. , например, Shibuya et al. , Agric. Biol. Chem. /1981/ 45, 1561-1567; Matsuda and Komatsu, J. Bact. /1985/ 163, 1222-1228; Matsuda et al. , J. Bact. /1987/ 169, 5815-5820; Jap. 53-086084 /1987 - Banyu Pharmaceutical Co. , Ltd. /; и Jap. 52-128293 /1977 - Banyu Pharmaceutical Co. Ltd. /.
Также, заявка ЕРА-А-0453048 описывает способы улучшения отщепляющей адипоил активности глутарилацилазы, полученной с помощью Pseudomonas SY-77-1. При замещении различных аминокислот в некоторых местоположениях в пределах альфасубъединицы наблюдают увеличение степени отщепления адипоила /из адипоилсерина/ в три-пять раз. Следует отметить, что хотя заявка ЕР-А-0453048 приводит примеры ацилазы с улучшенной активностью по отношению к адипоильным боковым цепям, в ней не описаны какие-либо пути /ни химические, ни какие-либо биопроцессы, аналогичные описанным в настоящем описании/, в соответствии с которыми на первой стадии можно генерировать адипоилцефалоспорин.
В технике известно, что когда присутствует боковая (D)-α -аминоадипоильная цепь, в первую очередь (D)-аминоацидоксидазой удаляют аминогруппу и укорачивают боковую цепь, оставляя боковую глутариловую /GL-7/ цепь, и глутариловую боковую цепь удаляют другим ферментом /глутарилацилазой/. Такое двустадийное отщепление раскрывается в патенте США 3960662, Matsuda, в заявке на Европейский патент ЕР-А-0275901; Jap. 6-218057 /1988 - Komatsu, Asahi Chemical Industry Co. /; ВОИС 90/12110/ 1990 - Wong, Biopure Corp. /; и Isogai et al. , Bio/Technology /1991/ 9, 188-191.
Делается ссылка на заявку, находящуюся в процессе одновременного рассмотрения /Attorney Docket 185721 А/, которая раскрывает биопроцесс для приготовления 7-АСА, основанный на экспрессии активности фермента экспандазы в трансформанте Р. chrysogenum по тому же способу, что и в биопроцессе для получения 7-АDCA, описанном здесь. Однако в биопроцессе для 7-АСА требуются дополнительные трансформации для экспрессии дополнительной ферментной активности, для того чтобы достичь полностью отличного пути рекомбинантного метаболизма для разного конечного продукта, ни об одном из которых не говорится в настоящем описании.
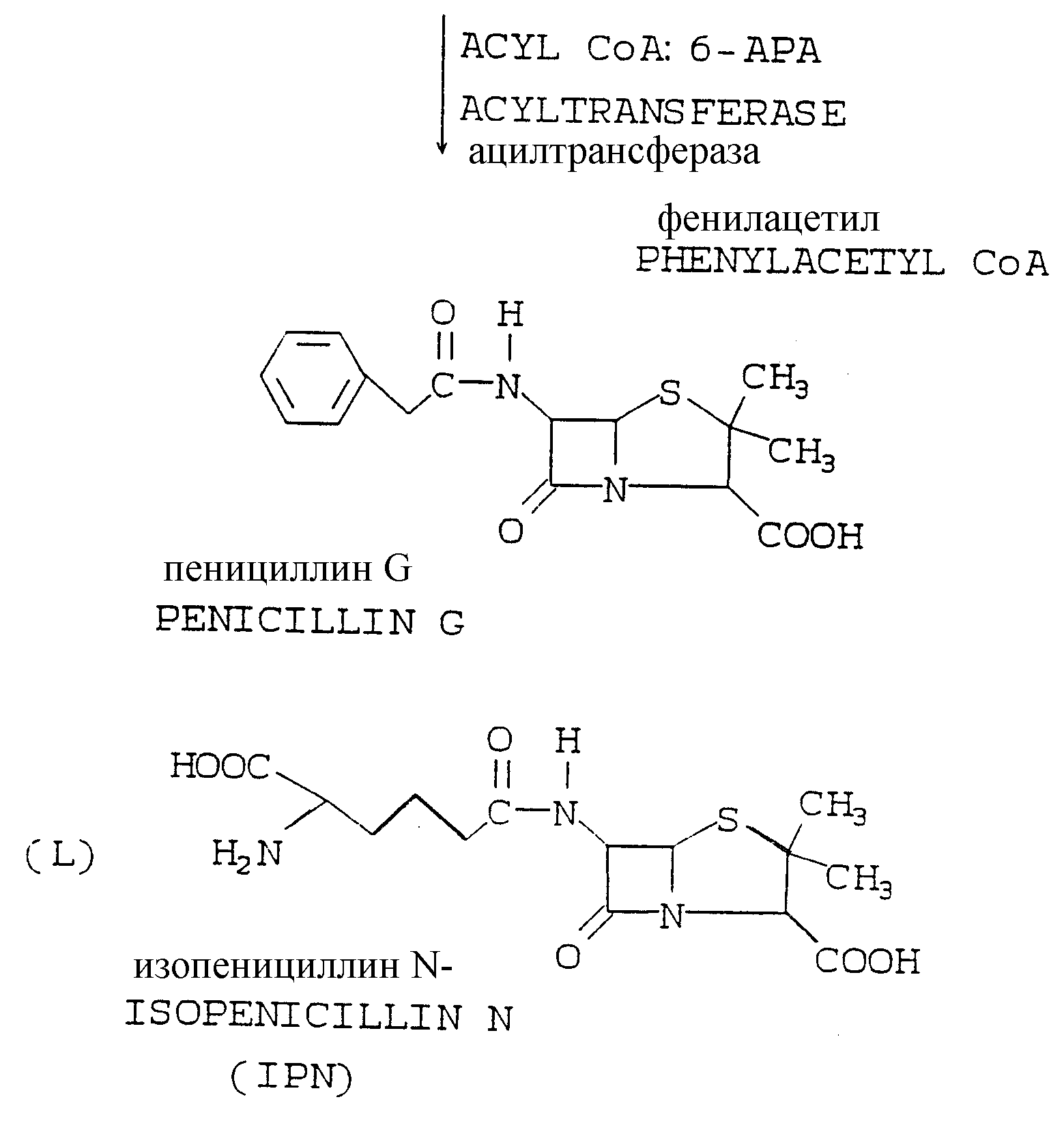
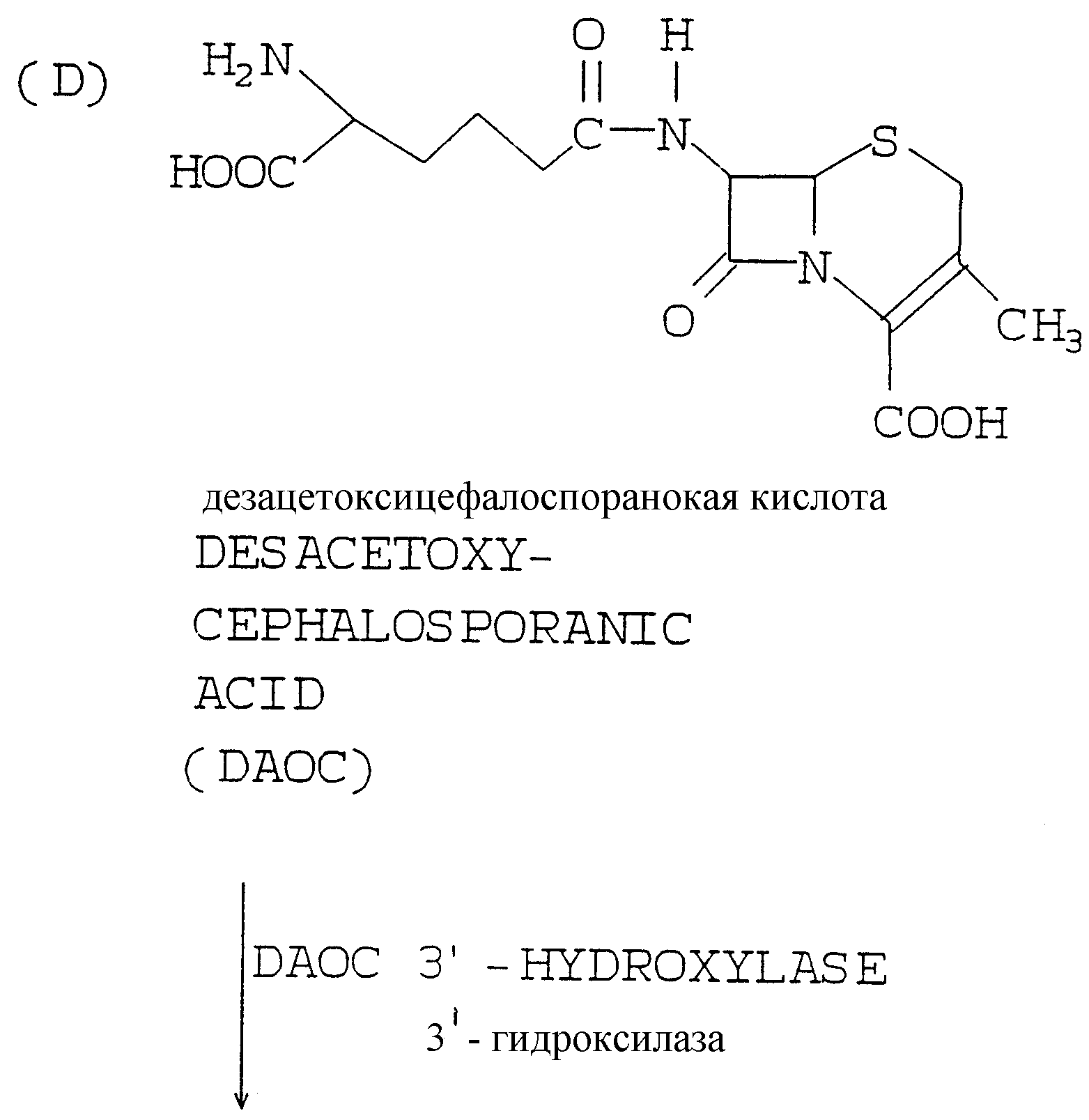
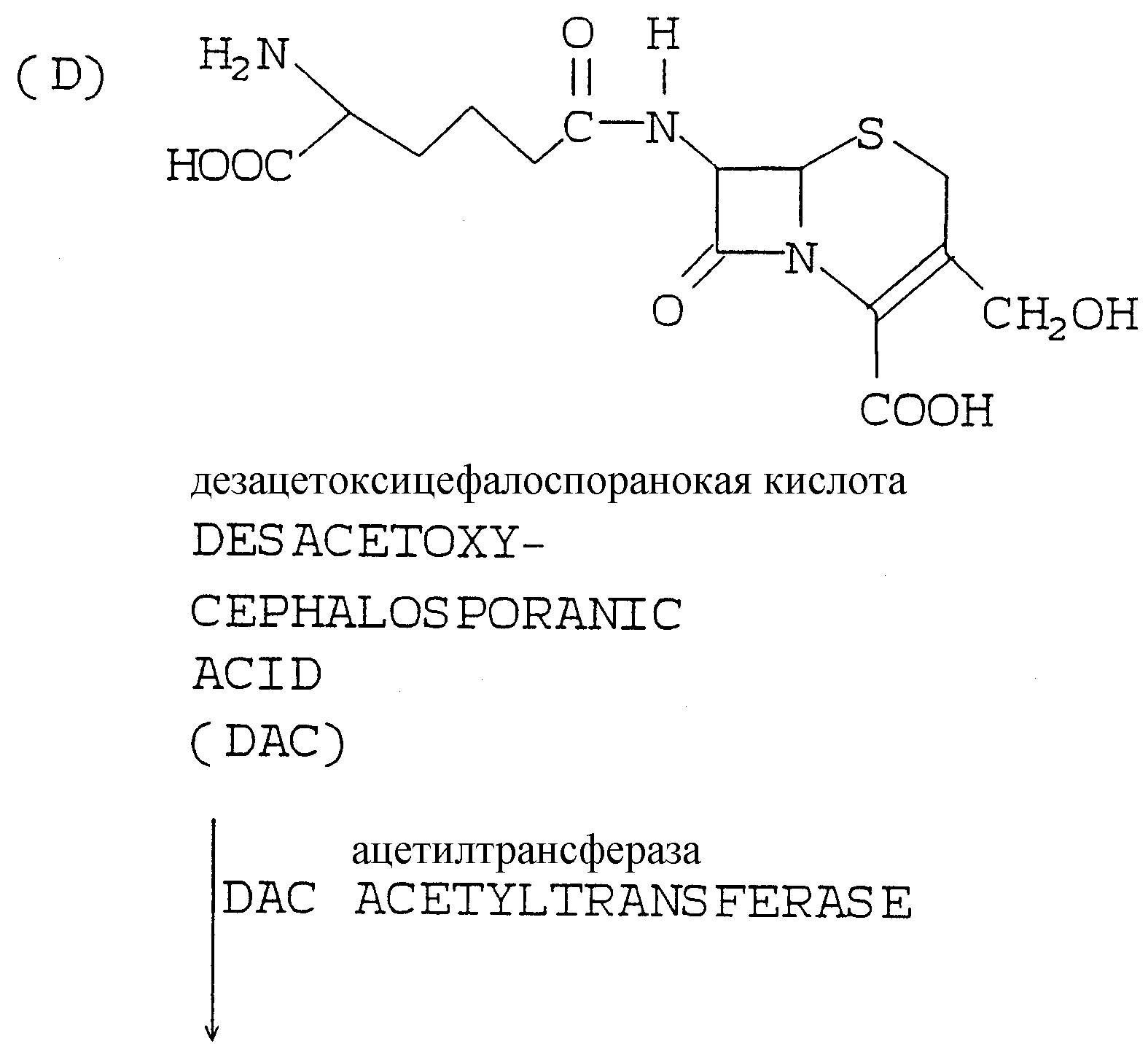
Для того чтобы облегчить лучшее понимание способа настоящего изобретения и изучение прототипов, которые обсуждались выше, в конце описания представлены различные стадии путей метаболизма, ведущие к пенициллину G и цефалоспорину С, промежуточным продуктам и ферментам, которые осуществляют трансформации.
Настоящее изобретение относится к новому биопроцессу для получения
7-аминодезацетоксицефалоспорановой кислоты /7-ADCA/, который включает стадии:
1) выдержки в культуральной среде, способной поддерживать его рост, штамма Penicillium chrysogenum, который
продуцирует изопенициллин N, и добавления к упомянутой культуральной среде адипинатного сырья (питания), содержащего адипиновую кислоту или одну, или большее число, ее солей и эфиров, которые способны
ассимилироваться и быть использованными упомянутым штаммом Penicillium chrysogenum для продуцирования адипоил-6-аминопенициллановой кислоты /адипоил-6-АРА/, в результате чего продуцируется упомянутая
адипоил-6-АРА;
на этой стадии штамм Penicillium chrysogenum трансформируется ДНК, кодирующей фермент экспандазу, использующую адипоил-6-АРА в качестве субстрата, после чего продуцированная
этим штаммом адипоил-6-АРА in situ расширяет кольцо с образованием адипоил-7-ADCA; и
2) приведения в контакт упомянутой адипоил-7-ADCA с адипоилацилазой, посредством чего удаляется боковая
адипоильная цепь и образуется продукт 7-ADCA; и упомянутый продукт затем выделяют.
Здесь используются термины, имеющие указанные далее значения.
"Адипоил-6-АРА"
означает [2S-(2α,5α,6β)]-3,3-диметил-7-оксо-6-[(гексан-1,6-диоил)амино] -4-тиа-1-азабицикло-[3.2.0] гептан-2-карбоновую кислоту; и
"адипоил-7-ADCA" означает 7-[(гексан-1,
6-диоил)амино] -3-метил-8-оксо-5-тиа-1-азабицикло-(4.2.0)-окт-2-ен-2-карбоновую кислоту.
В частности, настоящее изобретение относится к новому биопроцессу для получения 7-аминодезацетоксицефалоспарановой кислоты /7-АDCA/, изложенному выше, в котором адипинатное сырье представляет собой динатрийадипинат, ДНК, кодирующая фермент экспандазу, получена из Streptomyces clavuligerus АТСС 27064, и для которого адипоилацелаза получена из вида Pseudomonas.
Настоящее изобретение относится также к вектору экспрессии рекомбинантной ДНК, содержащему ДНК, кодирующую фермент экспандазу, происходящую из Streptomyces clavuligerus АТСС 27064, и промотор, который стимулирует экспрессию этой ДНК, кодирующей экспандазу, включая плазмиду рРеn-FTSO, как описано далее.
Настоящее изобретение, кроме того, относится к клетке хозяину Penicillium chrysogenum, трансформированного вектором экспрессии, содержащим рекомбинантную ДНК, кодирующую фермент экспандазу, происходящую из Streptomyces clavuligerus АТСС 27064, и промотор, который стимулирует экспрессию этой ДНК, кодирующей экспандазу, и содержащий промотор гена IPNS Рenicillium chrysogenum. В частности, настоящее изобретение относится к клетке-хозяину Рenicillium chrysogenum, трансформированного вектором экспрессии рекомбинантной ДНК, содержащим плазмиду рPenFTSO, как описано далее.
Настоящее изобретение относится еще к способу, включающему стадию выращивания клетки-хозяина рекомбинантного Рenicillium chrysogenum в условиях, подходящих для генной экспрессии, при этом упомянутая клетка-хозяин содержит вектор экспрессии, содержащий ДНК, кодирующую экспандазный фермент, происходящий из Streptomyces clavuligerus АТСС 27064, и промотор, который стимулирует экспрессию этой ДНК, кодирующей экспандазу, и содержащий промотор гена IPNS Рenicillium chrysogenum. В частности, настоящее изобретение относится к способу выращивания клетки-хозяина рекомбинантного Рenicillium chrysogenum в условиях, подходящих для экспрессии гена, при этом упомянутая клетка рекомбинантного хозяина включает вектор экспрессии рекомбинантной ДНК, содержащей плазмиду рРеnFTSO, как описано далее.
Первым аспектом настоящего изобретения является новый биопроцесс для получения 7-аминодезацетоксицефалоспарановой кислоты /7-АDCA/, ключевого промежуточного соединения при
получении синтетических коммерческих цефалоспоринов, которая может быть представлена следующей структурной формулой:
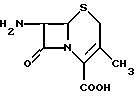
Помимо цефалоспоринового ядра отличительными чертами 7-ADCA являются группа 7-амино и 3-метилгруппа. Группа 7-амино является такой группой, которая может быть превращена в любые производные, которые образуют боковые цепи, и, таким образом, является основанием для синтеза различных коммерческих цефалоспоринов. 3-Метильная группа обычно, но не всегда - как в случае цефалексина - должна быть превращена в некоторую другую боковую цепь, чтобы синтезировать коммерческий цефалоспорин.
7-ADCA - продукт способа настоящего изобретения может быть
сопоставлена с цефалоспорином С - еще одним ключевым промежуточным соединением цефалоспорина, который может быть изображен структурной формулой
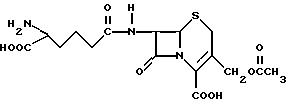
Для такого промежуточного соединения для коммерческих цефалоспоринов может быть приемлема 3-ацетилоксиметильная боковая цепь. Однако 7-(D)-α-аминоадипоильная боковая цепь неприемлема для дальнейшего синтеза и должна быть отщеплена, чтобы дать приемлемую 7-аминогруппу. К несчастью, 7-(D)-α-аминоадипоильная боковая цепь всегда отщепляется с большим трудом как химическими, так и биохимическими способами.
Определения:
7-ADCA - 7-аминодезацетоксицефалоспорановая кислота;
6-АРА
- 6-аминопенициллановая кислота;
DAOC - дезацетоксицефалоспарановая кислота;
DAOCS - DAOC синтетаза;
DAC - дезацетилцефалоспорин С;
DACS - ДАС синтетаза;
IPNS - синтетаза изопенициллина N;
Трис - Ттис[гидроксиметил] аминометан;
ЭДта - этилендиаминтетрауксусная кислота;
DEPC - Диэтилпирокарбонат;
ТЕ - буфер Трис/ЭДТА;
SSC - буфер соль (хлорид натрия)/ цитрат натрия;
SDS - Дддецилсульфат натрия;
ПЭГ - полиэтиленгликоль.
Культура Penicillium chrysogenum
Первая
стадия способа настоящего изобретения представляет собой стадию выдержки в культуральной среде, способной поддерживать его рост, штамма Penicillium chrysogenum, который продуцирует изопенициллин N, и
добавления к упомянутой культуральной среде адипинатного сырья, содержащего адипиновую кислоту или ее соли и эфиры. Адипинатное сырье может быть добавлено к культуральной среде после инокуляции P.
chrysogenum, но предпочтительно, чтобы оно уже присутствовало в культуральной среде в то время, когда происходит инокуляция. Адипиновая кислота или ее соли и эфиры имеют свойство ассимилироваться и
использоваться упомянутым штаммом P. chrysogenum для образования адипоил-6-АРА; при этом упомянутый штамм P. chrysogenum трансформирован ДНК, кодирующей активность экспандазного фермента, после чего,
в результате ее экспрессии, упомянутая адипоил-6-АРА in situ является расширяющей кольцо и образует адипоил-7-ADCA.
Другие виды рода Penicillium, кроме вида chrysogenum, продуцируют изопенициллин N. Однако исторически все штаммы самого высокого продуцирования изопенициллина N разрабатывались с помощью хорошо известных технических приемов улучшения штамма, из вида chrysogenum. При существующей практике настоящее изобретение ограничено штаммами Penicillium chrysogenum, хотя его применимость к другим видам очевидна. Любой депозитный штамм Penicillium chrysogenum или из другого доступного источника такого штамма является подходящим отправным моментом для осуществления способа настоящего изобретения.
Культуральная среда, способная поддерживать рост штамма Penicillium chrysogenum, который продуцирует изопенициллин N, имеет тип, который был бы удобен в обращении для специалиста. Например, выращивание может выполняться по способу глубинной аэробной ферментации, и используемая среда будет выбираться из числа доступных подходящих сред. Типичная среда использует источники углерода, такие как сахароза, глюкоза и крахмал; источники азота, такие как соевая мука и овсяная мука, хлопковое масло, арахисовая мука и различные аминокислоты, их смеси и пептоны. Требования производства придают особое значение выходу и легкости выделения, и, таким образом, предпочтительными средами в такой ситуации могут быть меласса как источник углерода и соевая мука и аминокислоты в качестве источника азота.
К культуральной среде обычно добавляются питательные неорганические соли, и такие соли включают соли, способные дать следующие ионные компоненты: натрий, калий, аммоний, кальций, фосфат, сульфат, хлор-ион, бром-ион, нитрат, карбонат, железо двухвалентное, железо трехвалентное, магний, марганец и т. п. Микроэлементы обычно также существенны для роста, развития и метаболизма Penicillium chrysogenum, и могут быть добавлены непосредственно в культуральную среду, если они не введены уже в качестве примесей, по существу, с другими ингредиентами культуральной среды.
Штаммы Penicillium chrysogenum могут быть получены в оборудовании небольшого объема, таком как встряхиваемые колбы емкостью 1 л, в таком оборудовании желательно получать только небольшие количества 7-ADCA. Когда нужно получить большие количества адипоил-7-ADCA, тогда будут использоваться ферментеры большого размера в условиях глубинной аэробной ферментации.
При осуществлении крупномасштабного получения адипоил-7-ADCA споры Penicillium chrysogenum хранят на "косяках" агара. Споры с агара используют для инокулирования вегетационной среды небольшого объема. Вегетационную среду инкубируют, и получают обильную, свежую, активно растущую культуру микроорганизма. Эту вегетативную поросль затем используют в качестве инокулянта для ферментационной среды большого масштаба. В некоторых случаях может быть желательно включить еще одну, следующую, вегетационную среду в качестве инокулянта для ферментационной среды. Такую вегетационную среду второй фазы обычно используют тогда, когда объем ферментационной среды значительно больше объема первой вегетационной среды. В таком случае споры микроорганизма сначала выращивают в небольшом объеме вегетационной среды, чтобы получить инокулянт для вегетационной среды большего объема. В вегетационной среде большего объема концентрация микроорганизмов становится достаточной, чтобы инициировать быстрое начало ферментации в ферментере большого размера. Вегетационная среда может иметь тот же состав, что и ферментационная среда, или она может содержать дополнительные ингредиенты для стимулирования роста и развития микроорганизма в небольшом объеме.
Штаммы Penicillium chrysogenum, используемые в способе настоящего изобретения, наиболее эффективно выращиваются при 20 - 30oС, но оптимальный выход будет получен при 22 - 28oС, предпочтительно при 25oС.
Максимальное образование адипоил-7-ADCA имеет место тогда, когда штамм Penicillium chrysogenum выращивают в больших резервуарах в течение 10-30 суток, предпочтительно в течение 15-25 суток. Однако, когда выращивание осуществляют в небольшой аппаратуре, такой как встряхиваемые колбы емкостью 250 мл, рост микроорганизма происходит быстрее, и он образует адипоил-7-ADCA за более короткое время, например за 4-15 суток, чаще 5-7 суток.
Если конечная величина рН в ферментерах большого объема достигает 8,0 или выше, это может неблагоприятно воздействовать на выход адипоил-7-ADCA. В таких случаях желательно контролировать величину рН в процессе ферментации. Оказывается, что рН достигает такого уровня раньше времени максимального образования адипоил-7-ADCA, и рН может быть снижена добавлением в ферментационную среду подходящей кислоты или буферного вещества.
Образование адипоил-7-ADCA может быть отслежено хроматографической проверкой образцов ферментационной среды.
При осуществлении глубинной аэробной ферментации через культуральную среду пропускают стерильный воздух, чтобы получить более эффективный рост штамма Penicillium chrysogenum и увеличенное образование адипоил-7-ADCA. Объем воздуха, пропускаемого через культуральную среду, обычно составляет по крайней мере приблизительно 0,2 объема в минуту на объем культуральной среды. Однако увеличение скорости пропускания воздуха часто может оказать благоприятное влияние на получение адипоил-7-ADCA.
Штамм Penicillium chrysogenum, как правило, помимо адипоил-7-ADCA, будет продуцировать много побочных продуктов и метаболитов. Так как некоторые из них являются неустойчивыми кислотами, желательно при извлечении адипоил-7-ADCA из ферментационной среды обрабатывать весь ферментационный бульон до кислой рН на короткое время, чтобы разрушить некоторые из образовавшихся примесей. Адипоил-7-ADCA - продукт ферментации - извлекают из фильтрованного обработанного таким образом ферментационного бульона и затем необязательно отделяют от других компонентов ферментационной среды хроматографией на ионообменной смоле, и далее возможна хроматографическая очистка, если необходимо, перед следующей стадией ферментного отщепления адипоильной боковой цепи. Также возможно осуществить такое ионообменное хроматографическое разделение после того, как осуществят отщепление боковой цепи. Одним из наиболее важных побочных продуктов, который создает проблему при разделении, является адипоил-6-АРА, и, чтобы сделать разделение более легким, возможно разрушить этот побочный продукт химически или ферментативно. Сначала отфильтрованный ферментационный бульон подвергают предварительной очистке, которая может включать экстракцию сначала несмешивающимся с водой органическим растворителем, таким как н-бутанол или амилацетат, чтобы удалить примеси. Экстрагированный бульон затем может быть очищен далее, предварительно, хроматографией над активированным углем.
Добавление адипинатного сырья
Предпочтительно во время ферментативного выращивания Penicillium chrysogenum, как
описано выше, т. е. перед инокуляцией добавлять к другим ингредиентам ферментативной среды для выращивания адипинатное сырье. Необязательно, адипинатное сырье может быть добавлено в течение некоторого
времени после инокуляции, например в 1, 2 и/или 3 день после инокуляции. Адипинатное сырье представляет собой адипиновую кислоту или одну или большее число солей или эфиров адипиновой кислоты, которые
способны ассимилироваться и использоваться штаммом Penicillium chrysogenum, который выращивают для продуцирования адипоил-7-АРА. Адипиновая кислота, соли и эфиры могут использоваться по одному или в
любом сочетании. Предпочтительна динатриевая соль, хотя походящими являются также соли калия и смешанные соли натрия. Может быть использован метиловый эфир, но этиловый эфир является
водо-нерастворимым. Соль или эфир адипиновой кислоты должны быть такими, чтобы они могли быть ассимилированы и утилизованы штаммом Penicillium chrysogenum для получения адипоил-6-АРА. Например, сама
адипиновая кислота может быть подходящей, даже хотя она не растворяется в воде, если при подходящей величине рН образуется способная ассимилироваться соль.
Подходящие ферменты
экспандазы
Штамм Penicillium chrysogenum, который выращен и обеспечен адипинатным сырьем, как описано выше, так что он продуцирует адипоил-6-АРА, является также штаммом, который
трансформирован ДНК, кодирующей активность фермента экспандазы, после чего, как результат экспрессии, упомянутая адипоил-6-АРА in situ расширяет кольцо с образованием адипоил-7-ADCA.
Адипоил-6-АРА продуцируется внутриклеточно выращенным с адипинатным сырьем Penicillium chrysogenum. В таком внутриклеточном состоянии, т. е. in situ, трансформированный Penicillium chrysogenum также экспрессирует ДНК, кодирующую активность фермента экспандазы, после чего фермент действует на адипоил-6-АРА как субстрат, и расширяет ее кольцо с образованием адипоил-7-ADCA.
Новый биопроцесс настоящего изобретения включает в свой объем трансформацию штамма Penicillium chrysogenum описанного выше типа с любой ДНК, кодирующей активность фермента экспандазы, после чего, как результат экспрессии, адипоил-6-АРА in situ расширяет кольцо с образованием адипоил-7-ADCA. Таким образом, ДНК, с которой трансформируется Penicillium chrysogenum должна выражать фермент, обладающий не только активностью фермента экспандазы, как это понимается в технике, т. е. способностью расширять кольцо изопенициллина N до DAOC, но способностью расширять кольцо адипоил-6-АРА до адипоил-7-ADCA. Однако на основании подобия боковых цепей ожидается, что любой фермент экспандазы будет способен работать в новом биопроцессе настоящего изобретения.
В разделе описания прототипов уже отмечалось, что фермент экспандазы, происходящий из Streptomyces clavuligerus АТСС 27064, имеет полностью известную последовательность, как и карту эндонуклеазной рестрикции. Однако, как оказалось, тот же фермент, полученный из S. clavuligerus NRRL 3585, как сообщается, имеет другую молекулярную массу, но последовательность не представлена.
Эти ферменты экспандазы, уже идентифицированные в технике, являются пригодными для нового биопроцесса настоящего изобретения. Другие, еще не идентифицированные ферменты экспандазы, происходящие из других штаммов S. clavuligerus, или даже из микроорганизмов других родов, также могут оказаться подходящими для осуществления нового биопроцесса настоящего изобретения. Процедуры идентификации таких новых штаммов и родов пригодных микроорганизмов, как и выделения предполагаемых ферментов экспандазы, и подтверждения, что они являются подходящими для применения в способе настоящего изобретения, являются простыми и доступными для специалистов. Скрининг бесклеточных экстрактов кандидатов в новые штаммы и родов пригодных микроорганизмов может быть сделан надежным и воспроизводимым способом путем добавления упомянутых экстрактов к субстрату адипоил-6-АРА в присутствии известных кофакторов DAOCS, которые включают ионы железа /Fe2+/, аскорбат, α-категлутарат и аденозинтрифосфат /АТФ/. Субстрат адипоил-6-АРА может быть получен в достаточных количествах при питании адипинатным сырьем нетрансформированного Penicillium chrysogenum по способу, аналогичному способу, подробно описанному далее. Нужный экспандазный фермент присутствует, если образуется адипоил 7-ADCA, присутствие которой может быть установлено методом хроматографии.
Также возможно, используя хорошо известные приемы рекомбинантной техники, генерировать пробы ДНК, основанных на последовательности экспандазы S. clavuligerus и С. acremonium, например, чтобы выделить ДНК-содержимое предполагаемых для применения микроорганизмов, подходящих для продуцирования экспандазы, подходящей для использования в способе настоящего изобретения.
Потенциальные источники ферментов экспандазы
Ферменты
экспандазы, как уже отмечалось, представляют собой ферменты, которые катализируют расширение пенамного кольца /обнаруженного в молекулах типа пенициллина/ до цеф-3-ем-колец /которые обнаружены в
цефалоспоринах/. Любой организм, продуцирующий метаболиты, которые содержат цефемное кольцо, является, следовательно, потенциальным источником ДНК, кодирующей экспандазу. Примеры таких организмов
приведены в конце описания, но этот список представлен только для примера и не должен рассматриваться как исчерпывающий.
Экспандазы продуцирующих метаболиты организмов, перечисленные в конце описания, являются только кандидатами для дальнейших исследований, и может оказаться, что не все они будут подходящими для нового способа настоящего изобретения. Например, применение таких ферментов, которые обладают как активностью экспандазы, так и активностью гидроксилазы, таких как ферменты из С. acremonium, могут в результате синтеза дать гидроксилированную адипоил-7-ADCA, т. е. DAC с адипоильной боковой цепью.
Выделение фрагментов ДНК, кодирующих активность экспандазы
Сразу же, как только установлено присутствие нужного фермента экспандазы по способу,
описанному выше, выясняется, какие методики - простые и хорошо известные в технике - нужны для выделения ДНК, кодирующей активность фермента экспандазы. Конструируют пробы ДНК на основе известных
последовательностей и неполных последовательностей генов, кодирующих ферменты экспандазы, которые будут гидридизироваться с низкой кодирующей фермент ДНК, которую выделяют. Составление таких проб
основано на знании последовательности аминокислот и нуклеотидных оснований, кодирующей фермент экспандазы, так же, как и предпочтительных кодонов конкретного микроорганизма. Подробное описание
типичной процедуры такого типа, используемой для геномной ДНК Streptomyces clavuligerus АТСС 27064, представлено далее.
Выделение ДНК, кодирующей активность фермента экспандазы, сопровождается применением методик рестрикции и лигирования, хорошо известных в технологии рекомбинантной ДНК. Необходимо иметь карту эндонуклеазной рестрикции генома микроорганизма, чтобы можно было получить и выделить подходящий рестрикционный фрагмент. Рестрикционные карты для S. сlavuligerus и С. аcremonium уже доступны, так, в первом случае используют рестрикционные ферменты Bam HI и Sal I, и электрофорез обеспечивает фрагменты нужного размера 1,8-2,2 кb.
Трансформация штамма Penicillium chrysogenum
Как только получены фрагменты ДНК, кодирующие активность
экспандазы, они могут быть вставлены /лигированы/ в плазмиду или в другой вектор экспрессии, вместе с фрагментами ДНК, включающими промоторы, трансляционные активирующие последовательности, маркеры
устойчивости, регуляторные последовательности, элементы космид и любые другие последовательности ДНК, которые делают возможной или способствуют трансформации, стимулируют экспрессию генного продукта и
облегчают выделение трансформантов. Вектор экспрессии, который составлен таким образом, затем используют для достижения трансформации штамма Penicillium chrysogenum и внутримолекулярной экспрессии
активности фермента экспандазы. Технические приемы для достижения трансформации и экспрессии хорошо известны в технике, и подробное описание таких типичных процедур приводится далее.
Как уже подробно отмечалось выше, штамм трансформированного Penicillium chrysogenum экспрессирует фермент экспандазу внутриклеточно, который затем действует in situ на адипоил-6-АРА-субстрат и расширяет ее кольцо до адипоил-7-ADCA.
Новый трансформант
Специфический трансформант Penicillium chrysogenum, экспрессирующий ген экспандазы, который представляет собой
предпочтительный вариант осуществления настоящего изобретения, является новым относительно таких конструкций, существующих в технике, как конструкция, описанная в Саntwell et al. /1990/ Current
Genetic, 17, 213-221. В обоих конструкциях для связывания промотора с геном экспандазы используют мутагенез in vitro. В конструкции Cantwell манипуляция вводит сайт Ndel в АТG гена экспандазы, который
лигируют в сайт Хbal в окончании 3' промотора IPNS линкером Xbal/Ndel. В конструкции настоящего изобретения сайт Ncol cоздается в АТG гена экспандазы и легируется в сайт Ncol в окончании 3' линкера
IPNS. Это создает в таких конструкциях в местах соединения промотора и гена приведенные в таблице 1 последовательности.
Конструкция Cantwell замещает С на Т, в то время как в конструкции настоящего изобретения С сохраняется; таким образом, последовательность промотора IPNS, непосредственно примыкающая к исходному кодону АТG, точно подходит под пару к той, которая встречается с геном IPNS естественного происхождения. Возможно, что промотор прототипа, хотя он отличается только одним нуклеотидным основанием, может привести к более низкой эффективности трансляции и в результате к более низкому уровню экспрессии гена экспандазы.
Другие отличия заключаются в участках промотора или гена, включенных в конструкции. Конструкция Cantwell содержит участок промотора IPNS 5' BamНI-Xbal 3', в то время как вектор настоящего изобретения содержит участок промотора 5' Ncol-Ncol 3' (Dies, et al. , /1990/, J. Biol. Chem. 265, 16358-16365). Это дает в результате дополнительные 250 bps на окончании 5' промотора IPNS в конструкции Cantwell. Однако этот участок находится в открытом считываемом остове гена синтетазы АСV (в направлении 3'-5') выше гена IPNS.
Конструкция Cаntwell также содержит ген Streptomynes от АТG до сайта 3' BamHI гена, в то время как вектор настоящего изобретения содержит АТG до сайта SalI 3' гена (Kovacevis et al. /1989/, J. Bacteriol. , 171, 754-760). Это дает в результате приблизительно 1000 bps, дополняющих окончание 3' в конструкции Cantwell. Конструкция настоящего изобретения содержит еще участок гена экспандазы, расположенный выше, до сайта BamHI 5' ATG; однако он отделяется от считываемого остова гена экспандазы промотором IPNS.
Еще одно отличие построения настоящего изобретения от описанного в прототипе относится к избирательной способности маркера, который используется. Применение слияния промотора Penicillium IPNS с флеомицином в конструкции настоящего изобретения ведет к выбору в пользу интеграции размножающихся копий или в пользу интеграции в локусах, что обеспечивает высокий уровень экспрессии и, таким образом, потенциально может дать более высокий процент трансформантов, которые экспрессируют ген экспандазы на высоком уровне.
Новый трансформант описанного выше типа представляет собой Penicillium chrysogenum, идентифицированный как РС100. Его таксономические характеристики обычно включают продуцирование широко разрастающихся колоний, от сине-зеленого до зеленого цвета, однородной бархатистости с желтыми вкраплениями; обратную диффузию желтого в агар; конидиальные головки, ветвящиеся по всем частям гладкой поверхности; эллиптические конидии длиной 3-4 мм. Приемлемые условия выращивания для P. chrysogenum предполагают использование твердой среды, содержащей моногидрат лактозы 1,5% (вес/объем); экстракт замоченной кукурузы 0,5% (о/о); пептон 0,5% (вес/объем); NaCl 0,4% (вес/объем); MgSO4•7H2O 0,55% (вес/объем); КН2РО4 0,06% (вес/объем); FeCl3•6H2O 0,0005% (вес/объем); СuSO4•5H2O 0,0002% (вес/объем); агар 0,3% (вес/объем), в одном литре дистилированной воды, рН 4,8. P. chrysogenum, только что описанный и обозначенный PC100, депонирован American Type Culture Collection /АТСС/, 12301 Parklawn Drive, Rockville, Maryland 20852, под регистрационным номером АТСС 74182 /дата депозита: получен 21 августа 1992, и жизнеспособность проверена 27 августа 1992/.
Отщепление адипоильной боковой
цепи
Следующая стадия нового биопроцесса настоящего изобретения заключается в отщеплении адипоильной боковой цепи адипоил-7-ADCA, что требует обработки продукта предшествующей стадии системой
с ферментом адипоилацилазой. Как уже отмечалось выше, одним из существенных преимуществ настоящего изобретения является способность выполнять все стадии, ведущие к образованию адипоил-7-ADCA, в одном
процессе ферментации. Это достижение дает исключительно возросшую эффективность ввиду отсутствия выделения и частичной очистки промежуточных продуктов при переходе от одной к другой стадии процесса.
Однако на этой последней стадии не присутствует фермент адипоилацелазы, т. е. не генерируется in situ в первоначальной ферментативной культуре.
Если новый биопроцесс настоящего изобретения выполняют по периодической схеме, тогда будет необходимо выделять и частично очищать продукт первой стадии, и предварительные процедуры для этого уже описаны выше.
Тем не менее, способ настоящего изобретения может быть осуществлен любым путем, который эффективно дает контакт адипоилацилазы и адипоил-7-ADCA таким образом, чтобы могла произойти ферментативная конверсия этого соединения до 7-ADCA. Таково определение термина "контакт" в его широком смысле. Возможно использовать бесклеточный бульон сырой адипоил-7-ADCA в качестве загрузки и обрабатывать его по периодическому способу бульоном сырой адипоилацилазы. Такое приближение обеспечивает некоторую эффективность, поскольку не требует какой-либо существенной первоначальной очистки реагентов. Конечно, возможны модификации. Например, реагенты могут быть очищены до любой желательной степени прежде, чем будут приведены в контакт друг с другом. Также лучше было бы осуществлять процесс непрерывным способом, а не периодическим. Контактирование самих реагентов может быть модифицировано различными путями при сохранении улучшений в технологическом процессе. Так, может быть использован неподвижный фермент, например, в виде колонки, содержащей адипоилацилазу, причем адипоил-7-ADCA пропускают через колонку. Неподвижный фермент также может быть добавлен к раствору адипоил-7-ADCA в виде суспензии. Такие неподвижные ферментные системы дают преимущества, заключающиеся в легкости удаления фермента и многократном использовании. Другим примером такого технологического процесса является процесс, имеющий отношение к мембранным реакторам. Предпочтительным способом приведения реагентов в контакт является способ с применением колонок с ферментом.
Ферменты адипоилацилазы, пригодные
для стадии отщепления
Существует ряд ферментов с известной специфичностью к адипоильным боковым цепям. Результаты, полученные с адипоилацилазой, доступной коммерчески от RAEV Coгр. , подобно
описаны далее в рабочих примерах. В литературе сообщается о семи других ферментах, которые удаляются адипоильные боковые цепи из молекул типа цефалоспорина. Шесть из этих семи ферментов представляют
собой вид Pseudomonas, и седьмой является видом Bacillus. Между определенными ферментами Pseudomonad существует некоторое подобие, но все семь различаются до некоторой степени по своим
физико-биологическим свойствам. Некоторые характеристики этих ферментов приведены в таблице 2.
Все вышеупомянутые ферменты адипоилацилазы являются применимыми в новом биологическом процессе настоящего изобретения. Другие адипоилацилазы, пригодные для способа настоящего изобретения, могут быть легко обнаружены при испытании предполагаемых подходящих ферментов против адипоил-7-ADCA, фактического субстрата, на котором они должны работать. Положительный результат является надежным и воспроизводимым способом определения того, что фермент-кандидат пригоден для способа настоящего изобретения. Субстрат может быть получен простым способом при реакции ангидрида адипиновой кислоты с 7-ADCA, для чего используется модификация методики, изложенной в Szewcsuk and Wellman-Bednawska, Clin. Chim. Acta /1978/ 84, 19-26. Ангидрид адипиновой кислоты может быть получен в соответствии со способом Аlbertson and Lundmark, описанным в J. Nacromol. Sci. Chem. /1990/ А27, 397-412. 7-ADCA доступна из некоторых коммерческих источников, включая E. R. Squibb & Sons, Ltd. , NJ и Interchem Corp. , NJ.
Если желательно выполнить грубый скрининг ферментов-кандидатов с использованием экспресс-колориметрии, субстрат адипоил-7-ADCA можно заменить колориметрическим субстратом, таким как адипоил-РАВА /п-аминобензойная кислота/ или адипоил-PNA /п-нитроанилин/. Отщепление боковой цепи дает вид, генерирующий окраску, и присутствие такого вида и концентрация легко определяются колориметром. Более подробная информация об этих и других подходящих колориметрических способах дается в Marelli, L. P. /1968/ J. Pharm. Sci. 57: 2172-2173; Szasz, G. /1969/ Clin. Chem. 15: 124-136; Szewczuk, A. , et al. /1980/ Anal. Biochem. 103: 166-169; и в Reyes, F. , et al. /1989/ J. Pharma. Pharmacol. 41: 136-137.
Сравнивают N-концевые аминокислотные последовательности фермента RAEV с большими субъединицами асyII и GK16 ферментов,
приведенных в таблице 2. Результаты сравнения /круглые скобки указывают меньшую, чем окончательная, принадлежность/:
RAEV - SEQ ID NO: 5
S N (S) (G) A V A P G K T A N G N A K (L) L Q
N (P)
GK16 - SEQ ID NO: 6
S N S W A V A P G K T A N G N A L L L Q N P
acyII - SEQ ID NO: 7
S N N W A V A P G R T A T G R P I L A G D P
Из представленных
последовательностей очевидно, что все три пептида являются родственными. Однако, белок, имеющий N-концевую последовательность, подобную показанным выше, не обязательно обладает адипоилацилазной
активностью, как в случае ацилазы пенициллина G, продуцированной штаммом Arthrobacter. С другой стороны, существуют адипоилацилазы, пригодные для способа настоящего изобретения, которые не показывают
достаточной гомологии к вышеупомянутой N-концевой последовательности. Например, показано, что фермент Asahiacyl и ацилаза Fujisawa B. laterosporus J1, упомянутые в приведенной выше таблице, которые
обладают некоторой активностью адипоил-7-ADCA-ацилазы, не являются частью гомологии последовательностей других ферментов, упомянутых выше. Поэтому объем настоящего изобретения в отношении
адипоилацилаз, пригодных для второй стадии нового биопроцесса, определяется тем, способен или нет кандидат-фермент отщеплять боковую адипоильную цепь от адипоил-7-ADCA, свойство, которое может быть
легко и надежно определено, как подробно описано выше.
Возможны другие подходы к поиску подходящих адипоилацилаз. Например, заявка на Европейский патент ЕРА-А-0453048 описывает способы улучшения активности отщепления адипоила глутарилацилазы, продуцированной Pseudomonas SY-77-1. При замещении различных аминокислот в некоторых местах в переделах альфа-субъeдиницы наблюдают увеличение скорости отщепления адипоила /от адипоилсерина/ в три-пять раз. Такие улучшенные ферменты также были бы подходящими для применения в настоящем изобретении. Следует отметить, что хотя заявка ЕР-А-0453048 очевидно демонстрирует ацилазу с улучшенной активностью по отношению к адипоильным боковым цепям, в ней не описано каких-либо путей /ни химических, ни биопроцесса, в чем-либо аналогичного настоящему описанию/, которыми можно, в первую очередь, генерировать адипоилцефалоспорин.
Далее приводится подробное описание некоторых предпочтительных вариантов осуществления настоящего изобретения, но эти варианты представляют только иллюстрации и никоим образом не являются ограничениями настоящего изобретения.
Пример 1. Условия выращивания Penicillium
chrysogenum
Штамм Penicillium chrysogenum, применяемый в этих методиках, хранят на пластинах, содержащих среду LCSB, составленную из моногидрата лактозы 1,5% (вес/объем); экстракта вымоченной
кукурузы 0,5% (объемн. ); пептона 0,5% (вес/объем); NaCl 0,4% (вес/объем); MgSO4•7H2O 0,05% (вес/объем); КН2РО4 0,06% (вес/объем); FeCl3
•6H2O 0,0005% (вес/объем); CuSO4•5H2O 0,0002% (вес/объем); агара 3,0% (вес/объем); в одном литре дистиллированной воды, рН 4,8. После выдержки в течение
12 суток при 25oС и относительной влажности 65% единичные колонии удаляют и помещают в 2 мл стерилизованной воды в пробирки с винтовой верхней частью, содержащие стеклянные шарики. После
мацерации поросли культуры путем вращательных движений суспензию используют для инокуляции в склянки с рисом. Склянки с рисом содержат в 250 мл своего объема 25 г конвертированного риса Uncle Ben's,
натуральное длинное зерно которого промыто тремя-четырьмя объемами дистиллированной воды в течение семи минут, при перемешивании каждые 30 секунд, и затем высушено до содержания воды в рисе
приблизительно 25%. После 12-дневной выдержки при 25oС и относительной влажности 65% споры вымывают из риса 50 мл стерильной воды. Суспензию спор используют для инокуляции культуры в жидкую
среду, и также для заготовки лиофилов культуры, хранящихся при 4oС. Споры добавляют в равный объем 5% сливок и лиофилизуют в стерильных ампулах.
Используют двухстадийную ферментацию во встряхиваемых колбах для получения пенициллинов или для продуцирования мицелия, как источников РНК или ДНК. Стадию посева начинают добавлением 1•108 спор в 50 мл колбу с 50 мл среды, составленной из глюкозы 3,0% (вес/объем); pharmamedia 1,0% (вес/объем); экстракта замоченной кукурузы 3,0% (объемн. ); сульфата аммония 0,2% (вес/объем); СаСО3 0,5% (вес/объем); безводного монокалийфосфата 0,05% (вес/объем); лактозы 1% (вес/объем); первичных сухих дрожжей 1,0% (вес/объем); в одном литре дистиллированной воды. Инкубацию осуществляют при 25oС и относительной влажности 65% на круговой качалке с диаметром размаха 70 мм при 220 об/мин. После 48-часовой инкубации начинают стадию продуцирования путем переноса 2 мл вегетационного посевного материала в 500 мл колбу с 35 мл среды следующего состава: KH2PO4 0,05% (вес/объем); К2SO4 0,5% (вес/объем); (NH4)2SO4 1,0% (вес/объем); лактоза 12,0% (вес/объем); pharmamedia 2,75% (вес/объем); СаСО3 /осажденный/ 1,0% (вес/объем); свиное сало 1,0% (объемн. ), содержатся в одном литре дистиллированной воды, рН 6,6. После обработки в автоклаве, но до инокуляции, добавляют стерильный 25% адипинат натрия /рН 6,6/, и получают окончательную концентрацию адипината натрия 2,5%. Инкубацию, а затем инокуляцию проводят в тех же условиях, что и на стадии посева, в течение 5-7 дней.
Пример 2. Выделение геномной ДНК Penicillium и общей ДНК
Вегетационную мицелиальную
поросль из 48-чой культуры, полученной как описано выше, собирают фильтрацией через марлю, замораживают в жидком азоте и лиофилизуют в течение ночи. Высушенный мицелий измельчают с песком пестиком в
ступке, и снова суспендируют в 25 мл 100 мМ LiCl, 50 мМ ЭДТА, 10 мМ Трис - рН 8,0, 4% SDS. После нагревания суспензии до 50-55oС на водяной бане /60oС/ смесь экстрагируют сначала
1 М Трис /рН 8/, насыщенным фенолом, затем смесью фенола с хлороформом /1: 1 по объему/ насыщенной трис, и затем хлороформом. РНК осаждают из водной фазы добавлением равного объема холодного 6 М LiCl,
и затем оставляют смесь на два-три часа при -20oС. После центрифугирования при 12000•g в течение 20 минут при 4oС суспернатант делают 66% (объемн. ) этанолом и охлаждают
до -20oС в течение 15 минут, чтобы осадить ДНК. После центрифугирования, описанного выше, осадок ДНК промывают 70% этанолом, сушат и снова суспендируют в буфере ТЕ /10 мМ трис-НСl, рН 7,5,
1 мМ ЭДТА/. Концентрацию ДНК оценивают путем сравнения с известными ДНК-стандартами при окрашивании бромэтилом при электрофорезе в агарозном студне.
Культуры Penicillium chrysogenum, описанные выше в примере 1, выращивают в течение 96 ч в 35 мл ферментативной среды /условия ферментации описаны ранее/, при 25oС на круговой качалке при 220 об/мин. Мицелий собирают фильтрацией через фильтр Whatman # 1 при пониженном давлении и промывают приблизительно 50 мл воды. Мицелий сразу же соскабливают с фильтра, снова суспендируют в 5 мл "расслаивающего буфера" /"breaking buffer"/ /50 мМ Трис-НСl рН 7,4, 150 мМ NaCl, 5 мМ ЭДТА рН 8,0, 5% SDS/, замораживают в жидком азоте и лиофилизуют. После лиофилизации в течение ночи добавляют 5 мл воды, содержащей 0,1% DEPC, и 5 мл 1 М Трис /рН 8/ насыщенного смесью фенол: хлороформ: (изоамиловый спирт) /50: 50: 1/, и смесь оставляют таять при 37oС в течение 20 минут при встряхивании. Смесь центрифугируют при 1200•g в течение десяти минут при 4oС, водный слой удаляют, и вновь экстрагируют сначала 1 М Трис /рН 8/, насыщенным смесью фенол: хлороформ: (изоамиловый спирт) /50: 50: 1/, и затем 1 М Трис /рН 8/, насыщенным фенолом, и в третью очередь - хлороформом. С конечным водным слоем соединяют равный объем 6 М LiCl, и раствор оставляют при - 20oС минимум на четыре часа. Общую РНК осаждают центрифугированием при 1200•g в течение 20 минут при 4oС, осадок растворяют в 0,3 мл ТЕ буфера с 0,03 мл 3 М ацетата натрия, и добавляют 2,5 объема этанола, чтобы снова осадить РНК. Конечный осадок растворяют в 0,1 мл буфера ТЕ, и концентрацию РНК определяют спектрофотометрически, используя поглощение при 260 нм.
Пример 3. Условия выращивания
Streptomyces clavuligerus
Здесь используют штамм Streptomyces clavuligerus АТСС 27064. Штамм хранят на пластинах, состоящих из дрожжевого экстракта - 4 г; солодового экстракта - 10 г; глюкозы
- 4 г; агара - 20 г; в одном литре дистиллированной воды, рН 7,2. После 5-дневного выращивания при 30oС добавляют в чашки 2 мл стерильной воды, и выращенную культуру соскабливают с
поверхности агара. Полученную в результате суспензию переносят в стерильную пробирку с завинчивающейся пробкой /Screwtop/, содержащую стеклянные шарики. После мацерации поросли культуры круговыми
движениями суспензию используют для инокуляции культуры в жидкую среду. Суспензию также используют для длительного хранения культуры при - 70oС после добавления глицерина до 15% конечного
объема.
Когда мицелий требуется для генерации протопласта для трансформации или для источника ДНК, штаммы выращивают в 1 л колбе с 200 мл УЕМЕ среды, составленной из дрожжевого экстракта - 3 г; пептона - 5 г; солодового экстракта - 3 г; глюкозы - 10 г; сахарозы - 340 г ; MgCl2•6H2O - 1,02 г; глицина - 5 г; агара - 18 г; в одном литре дистиллированной воды. Инкубацию осуществляют на круговой качалке при 220 об/мин при 28oС.
Пример 4. Выделение геномной ДНК Streptomyces.
Вегетационную поросль 48-часовой культуры, полученную так, как описано выше, собирают центрифугированием при 22100•g в течение 10 минут. Клетки снова суспендируют в 10 мл буфера ТЕ, добавляют 10 мг лизоцима, и смесь инкубируют при 30oС в течение 15 минут. Затем добавляют один мл ТЕ /рН 8/, насыщенного фенолом, и 1,5 мл 5 М NaCl, и смесь осторожно инвертируют в течение 20 минут. Фазы разделяют при 12000•g в течение 10 минут, после чего водный слой удаляют и переносят в свежую пробирку. Добавляют равный объем хлороформа, и смесь осторожно инвертируют в течение 10 минут. Фазы снова разделяют центрифугированием при 12000•g в течение 10 минут, водный слой удаляют и снова переносят в свежую пробирку. Осторожно добавляют два объема изопропанола, выпавшую ДНК извлекают и снова растворяют в минимальном объеме буфера ТЕ. Добавляют РНК А (RNASe А) до конечной концентрации 20 мг/мл, и раствор инкубируют при 50oC в течение одного часа. Затем добавляют протеазу К до конечной концентрации 100 мг/мл, вместе со 100 мМ NaCl и 0,4% SDS, и смесь инкубируют при 37oС в течение одного часа. Раствор снова экстрагируют равным объемом ТЕ /рН 8/, насыщенным фенолом, и затем еще один раз хлороформом, ДНК после конечной экстракции извлекают после добавления двух объемов изопропанола, и концентрацию определяют спектрофотометрически, используя поглощение при 260 нм.
Пример 5. Создание генной библиотеки, и выделение фрагмента ДНК, содержащего ген экспандазы Streptomyces clavuligerus
Геномная ДНК Streptomyces clavuligerus, полученная по
ранее описанной методике, переваривается с ферментами рестрикции Ваm НI и Sal I. Переваренную ДНК подвергают электрофорезу на 0,8% геле агарозы, и фрагменты 1,8-2,2 kb элюируют и лигируют в ДНК pUC18,
которая предварительно переварена с Bam HI и Sal I. Используют разбавление лигирующей смеси, чтобы трансформировать компетентные клетки IМ109, используя электропорацию /Gene Pulser, Bio-Rad, Richmond,
CA/. Получение компетентных клеток и условия электропорации выдерживают в соответствии с рекомендациями изготовителей. Преобразующую смесь высевают на пластины LB, содержащие 100 мг/мл ампициллина и
75 мл 2% Х-Gal. После инкубации в течение ночи при 37oС рекомбинантные колонии идентифицируют по их обесцвечиванию вследствие инактивации плазмидного вектора активности гена
бета-галактозидазы. Бесцветные колонии пикируют в свежие пластины LВ, содержащие 100 мг/мл ампициллина. После выращивания в течение ночи при 37oС колонии переносят на нитроцеллюлозу и
гидридизируют с пробой, продуцированной полимеразной ценной реакцией, которая соответствует опубликованной последовательности гена экспандазы Streptomyces clavuligerus из оснований 52-918 (Kovacevic
et al. /1989/ J. Bacteriol/ 171: 754-760; и патент США 5070020). Мечение продукта цепной реакции полимеразы выполняют в ходе реакции случайно выбранным праймером с (32Р) dСТР и
Oligolabelling Kit, по рекомендации изготовителей /Phatmacia, Piscataway, New Jersey/. Реакцию гибридизации выполняют в присутствии 106 СРМ радиоактивно помеченной пробы, 30% формамида,
5ХSSC /0,15 М NaCl, 0,015 М цитрата натрия рН 7/, 0,1% SDS 5Х Denhardt's /5 г фиколла, 5 г поливинилпирролидона и 5 г BSA на 500 мл штамма 50 Х/ и 100 мг/мл ДНК тимуса теленка, в течение ночи при
37oС. Некоторые трансформанты сильно гибридизуют к пробе. В одной колонии подтверждают содержание вектора, несущего ген экспандазы, путем анализа рестрикции фермента, и эта плазмида
обозначается рFTSO-1.
Пример 6. Выделение плазмидной ДНК
Культуры Е. coli, содержащие плазмиду, выращивают в 500 мл бульона LB [20 г/л основы бульона LB (Gibco, Paisley,
Шотландия)] , с 15 мг/мл тетрациклина в течение 12-16 ч при 37oС на круговой качалке при 220 об/мин. Клетки осаждают центрифугированием при 4000•g в течение десяти минут при 4oС. Клеточный осадок снова суспендируют в 18 мл глюкозного буфера /50 мМ глюкозы, 25 мМ Трис рН 8,0, 10 Мм ЭДТА/, и добавляют 2 мл 40 мг/мл лизоцима /Sigma, St. Louis MO/ в глюкозном буфере,
перемешивают, и смесь инкубируют при комнатной температуре в течение 15 минут. Добавляют 40 мл свежеприготовленного раствора 0,2 N NaOH, 1% SDS, и смесь осторожно вращают и помещают на лед на десять
минут. Затем добавляют 30 мл 5 М ацетата калия, рН 4,8, хорошо перемешивают, и образовавшуюся смесь помещают на лед еще на десять минут. Клеточные осколки осаждают центрифугированием при 4000•g
в течение десяти минут при 4oС, и полученный в результате супернатант фильтруют через фильтр из марли. К осветленному супернатанту добавляют изопропанол /0,6 объемов/, чтобы осадить
плазмидную ДНК, и осадок формируют в процессе инкубации при комнатной температуре в течение 20 минут. Плазмидную ДНК осаждают при 4000•g в течение 20 минут при 4oС, и затем промывают
70% этанолом и сушат короткое время. Осадок снова суспендируют в 9 мл буфера ТЕ, затем добавляют 10 г CsCl и 0,387 мл раствора бромэтида - 10 мг/мл. Этот раствор центрифугируют при 313100•g в
течение 24 ч. Полученную в результате плазмидную полосу в хлористом цезии визуализуют ультрафиолетовым светом, выделяют и затем удаляют бромэтид, используя для экстракции воду, насыщенную бутанолом.
CsCl затем удаляют из препарата плазмиды путем диализа против ТЕ буфера, и наконец, концентрируют ДНК, используя ПЭГ /MW 8000/. Концентрацию ДНК определяют спектрометрически, используя поглощение при
260 нм.
Пример 7. Построение вектора трансформации Penicillium pPenFTSO.
Вектор трансформации Penicillium конструктируют с резистантным геном флеомицина в качестве доминантного избирательного маркера. Это осуществляют, выделяя сначала фрагмент 660 bp, содержащий резистантный ген флеомицина /причем флеомицин связывает ген протеина Streptoalloteichus hindustanus/, и к тому же, присоединенный к терминатору Cl цитохрома дрожжей, из Ваm HI/Bgl II провара плазмиды pUT713/CAYLA, Toulouse Cedex, Франция/ путем электрофореза и элюирования из агарозных студней. Выделенный фрагмент лигируют в сайт Bam HI вектора pSELECT* I /Promega Corporation/, и ориентацию гена определяют анализом фермента рестрикции. Далее, вставляют фрагмент 550 bd Pst I, содержащий сайт лямбда cos, который дает возможность использовать вектор для образования космиды, когда включаются вставки соответствующего размера. Затем из провара Ncol/Bam HI геномного клона, содержащего ген IPNS, выделяют фрагмент 1,5 kb Ncol/Bam HI, содержащий участок промотора гена синтетазы /Penicillium chrysogenum изопенициллина N/IPNS/ /методом электрофореза и элюирования из агарозных студней/. Выделенный фрагмент промотора IPNS лигируют в переваренный вектор Bam HI/Ncol. Сайт Ncol находится в исходном кодоне АТG гена резистантного флеомицина. Этот вектор обозначается pUTZ-2.
Фрагмент
1,645 kb, содержащий ген экспандазы Streptomyces clavuligerus, очищают от провара Bam HI и Sal I pFTSO-l /вектор, описанный ранее/ посредством электрофореза и элюирования из 0,8% геля агарозы.
Выделенный фрагмент лигируют в вектор pSELECT /Promega Corporation/, также проваренный с Bam HI и Sal I. Этот вектор переваривается pFTSO-8. Новый сайт Ncol создается в начальном кодоне ATG гена
экспандазы путем сайтнаправленного мутагенеза pFTSO-8 при использовании in vitro мутагенезной системы, меняющей сайты /Аltered Sites*/ /Promega Corporation/. Мутагенез выполняют по инструкции
производителя. Строят олигонуклеотид для комплемента кодирующей последовательности участка ДНК в исходном кодоне АTG из опубликованной последовательности гена экспандазы /Kovacevic et al. ,
/1990/ Journal of Bacteriology, 171, р. 3952-3958/. Олигонуклеотид синтезируют приемами химии цианоэтилфосфорамидитирования /Pharmacia Gene Assembler приборы/, и олигопоследовательность выглядит
следующим образом: последов. ID 8
3' CGAGACGATCAGTGAGAGTCCAT GGACACGACGG 5'.
Мутагенез подтверждается анализом фермента рестрикции. Далее, фрагмент 1,2 kb Ncol, содержащий участок промотора гена синтетазы изопенициллина N Penicillium chrysogenum, выделяют /электрофорезом и элюированием из гелей агарозы/ из провара Ncol геномного клона, содержащего ген IPNS. Участок промотока IPNS лигируют в вектор рFTSO-8 в новый сайт Ncol, созданный мутагенезом в начальном кодоне АТG гена экспандазы. Ориентацию промотора относительно гена экспандазы устанавливают анализом фермента рестрикции. Это сочетание /cassette/ - промотор IPNS: ген экспандазы - затем перемещают в виде фермента Bam HI/Sal I в разрезанный Bam HI/Sal I вектор трансформации pUTZ-2 Penicillium, описанный выше. Конечная конструкция обозначается pPenFTSO.
Пример 8. Клонирование промотора β-тубулина Penicillium
Ген β-тубулина Penicillium клонируют из
геномной библиотеки Penicillium, используя ген β-тубулина Aspergillus niger в качестве пробы гибридизации. Последовательность этого клона и сравнение с известной аминокислотной
последовательностью гена β-тубулина из Aspergillus niger идентифицирует участок с 91% гомологии, начиная с начального кодона АТG. Последовательности, содержащие функциональный промотор,
выделяют между начальным кодоном и сайтом Bam HI на 1,4 kb.
Построение вектора трансформации, несущего промотор β-тубулина Penicillium
Фрагмент 2,0 kb Xbal/Hind III,
содержащий промотор β-тубулина Penicillium, лигируют в вектор pSELECT /Promega Corporatiom/, также переваренный с Xbal/Hind III. Новый сайт Ncol создают в начальном кодоне ATG сайт-направленным
мутагенезом, используя in vitro мутагенезную систему, меняющую сайты /Promega Corporation/. Мутагенез выполняют по инструкции изготовителя. Конструируют олигонуклеотид, комплементарно к сайтовому
участку исходного ATG, но который содержит некоторые изменения для создания сайта Ncol, и используют для мутагенеза. Синтезируют олигонуклеотид приемами химии цианоэтилфосфорамидитирования /Pharmacia
Gene Assembler аппаратура/, и олигопоследовательность имеет следующий вид: последов. ID 9
5' ATCTCTTTTCTAATACCTTCACCATGG GTGAGATTGTACGTGATCCC 3'.
Мутагенез подтверждается анализом фермента рестрикции. Далее, фрагмент 1,4 kb Bam HI/Ncol, содержащий промотор β-тубулина Penicillium, лигируют в выстроенный сайт Ncol в ATG гена экспандазы в Bam HI/Ncol переваренного вектора pFTSO-8 /вектор описан ранее в примере 7/. Этот вектор обозначают btFTSO-8. Фрагмент 1,4 kb Bam HI/Ncol, содержащий промотор β-тубулина, также лигируют в Bam HI/Ncol переваренного вектора pUTZ-2 /вектор описан ранее в примере 7/. Такое лигирование располагает промотор β-тубулина прямо перед резистантным геном флеомицина. Этот вектор обозначают pCl-6. Далее, фрагмент 2,4 kb Bam HI/Hind III из вектора btFTSO-8, который содержит кассету β-тубулинового промотора гена экспандазы, лигируют в Bam HI/Hind III переваренного вектора pCl-6, чтобы получить конечный вектор трансформации Penicillium, в котором ген эксандазы Streptomyces и резистантного маркера флеомицина экспрессируют из промотора β-тубулина. Этот вектор обозначают pTS-2.
Пример 9.
Клонирование промотора Penicillium /GAP/
Ген глицеральдегид-3-фосфатдегидрогеназы /GAP/ Penicillium клонируют из лямбда-геномной библиотеки, используя ген GAP из Aspergillus niger в качестве
пробы гибридизации. Четыре потенциальных позитива исследуют далее с PCR продуктом, генерированным из праймеров для участка 5' гена GAP Cephalosporium /Kimura, H. , et al. , /1991/, J. Ferm. and
Bioeng. , 71, 145-150/. Олигонуклеотиды для праймеров цепной реакции полимеразы /PCR/ синтезируют приемами химии цианоэтилфосфорамидитирования /Pharmacia Gene Assembler приборы/, и
олигопоследовательности являются следующими: последов. ID 10
5' CGCGGATCCCGGCATCAACG GCTTCGGTCGTAT 3';
последов. ID 11
5' CGCGGATCCGGGCACGCGCATG GACATGCCAGTG 3'.
Один из четырех предполагаемых позитивов кросс-гидридизируют в продукт PCR. Фрагмент 4 kb Bam HI из этого геномного клона лигируют в Bam HI расщепленного вектора pSELECT /Promega Corporation/ для секвенирования. Этот вектор обозначают pTS-0. Секвенирование этого фрагмента идентифицирует кодон инициатора ATG путем сравнения с известной последовательностью гена GAP цефалоспорина.
Построение вектора трансформации, несущего промотор GAP Penicillium
Для построения промотора GAP Penicillium с геном экспандазы Penicillium создают новый сайт
Ncol и ATG гена GAP Penicillium путем сайт-направленного мутагенеза in vitro, используя вектор pTS-0. Мутагенез осуществляют по инструкции изготовителя. Конструируют олигонуклеотид, который
комплементарен кодирующей последовательности участка ДНК в начальном кодоне ATG гена GAP, но сочетая с изменением оснований, чтобы создать сайт Ncol. Олигонуклеотид синтезируют приемами химии
цианоэтилфосфорамидитирования /оборудование Pharmacia Gene Assembler/, и олигопоследовательность имеет следующий вид: последов. ID 12
5' CAGTAAACGCAACCAATG GTTGTCCAG 3'.
Мутагенез подтверждается анализом фермента рестрикции. Далее, фрагмент 1,9 kb Ncol/Bam HI из pTS-0, который содержит промотор GAP, лигируют в Ncol/Bam HI переваренного вектора pFTSO-8 /вектор описан ранее в примере 7/ для позиционирования промотора GAP с геном экспандазы Streptomуces. Этот вектор обозначает pTS-0-1. Далее, фрагмент 3,0kb Bam HI/ Hind III из вектора pTS-0-1, который содержит кассету (промотор GAP): (экспандаза), лигируют в Bam HI/Hind III переваренного вектора рС1-6 /вектор описан ранее в примере 8/, и получают конечный вектор трансформации Penicillium pSD-1, в котором ген экспандазы Streptomуces экспрессирован из промотора GAP.
Пример 10. Трансформация Penicillium chrysogenum.
Протопласты из описанного выше штамма Penicillium chrysogenus генерируют путем инокуляции 50 мл бульона СМ 1•107 спорами в течение 67 ч при 25oС на круговой качалке при 220 об/мин. Мицелий собирают фильтрацией на марлевых фильтрах, переносят в 500 мл колбы и снова суспендируют в 25 мл КМР /0,7 М КСl, 0,8 М маннита, 0,02 М КН2РО4, рН 6,3/, содержащий 100 мг новоцима 234 /Novo Biolabs, Bagsvaerd, Дания/ и ставят для инкубации при 30oС и 100 об/мин. Сферопласты отделяют фильтрацией через марлевые фильтры и фильтры из стекловолокна и осаждают центрифугированием при 350•g в течение 10 минут. Сферопласты затем промывают три раза 10 мл буфера КМР, и затем снова суспендируют в КМРС/КМР с 50 мл СаСl2/ до концентрации 5•107 клеток/мл, и оставляют при комнатной температуре на 20 минут. Для трансформации Penicillium 200 мл суспензии сферопласта добавляют к ДНК /5 мг вектор ДНК в 6,2 мл КМРС с 5 мг/мл гепарина/ вместе с 50 мл РРС /40% ПЭГ, МW3500, 20 мМ КН2РО4, рН 6,3, 5% СаСl2; добавляют непосредственно перед применением/ и трансформационную смесь инкубируют на льду в течение 30 минут. Добавляют 1 мл свежеприготовленного РРС, и смесь переносят в 50 мл расплавленного /50oС/ регенерационного агара /СМ плюс 1,3 М маннита и 3% агара/. Трансформационную смесь затем распределяют в две чашки Петри. После регенерации в течение 24 ч при 25oС пластины накрывают ОL /1% пентона в 1% агаре/, содержащим 100 мг флюомицина на 50 мл OL. Количество покрывающего материала равно количеству регенерационного агара. Пластины инкубируют при 25oС в течение 7-14 дней, и наблюдают генерацию колоний трансформанта.
Пример 11. ВЭЖХ-анализ продуктов ферментации
адипоил-6-АРА и адипоил-7-ADCA
Используют высокоэффективную жидкостную хроматографию /ВЭЖХ/, чтобы проконтролировать образование адипоил-6-АРА в нетрансформированном штамме P. chrysogenum,
который используют, и образование адипоил-7-ADCA в штамме трансформированного P. chrysogenum, который используют. Анализ проводят на системе Waters с 625 системой подачи растворителя, детектор 490Е с
переменной длиной волны, установленный на 220 нм и 254 нм, с системой данных 825 Maxima, и колонкой Novo-С18 в качестве неподвижной фазы. Подвижная фаза /при скорости потока 1 мл/мин/ состоит из 2%
метанола и 98% 0,010 М КН2РО4, изократно рН 7,0 - 5 минут, и метанола в 0,010 М КН2РО4 с линейным градиентом 2-40% - 15 минут. Количество адипоил-6-АРА
определяют, используя стандартную кривую поглощения стандарта пенициллина N при 220 нм, и количество адипоил-7-ADCA определяют, используя стандартную кривую стандарта дезацетоксицефалоспорина С при
254 нм.
Анализ чувствительности адипоил-6-АРА и адипоил-7-ADCA к обработке пенициллиназой осуществляют, добавляя к фильтрам 1 единицу пенициллиназы I или пенициллиназы III на мл, и инкубируя при комнатной температуре в течение 10-30 минут. Эти образцы пропускают при идентичных условиях ВЭЖХ, описанных выше.
Анализ УФ-спектров продуктов адипоил-6-АРА и адипоил-7-ADCA осуществляют, используя систему Waters с системой 510 подачи растворителя, фотодиодным детектором, с системой данных 990 и колонкой Novo-С18 в качестве неподвижной фазы. Используя подвижную фазу, идентичную описанной выше.
Выделение большого количества продукта адипоил-7-ADCA из цельного ферментационного бульона делают, используя систему Waters с 510 системой подачи растворителя, фотодиодным детектором 990, системой данных 990 и препаративной колонкой mBondapak С18 в качестве неподвижной фазы. Подвижная фаза /при скорости потока 5 мл/мин/ изократная 0,010 М КН2РО4, рН 7,0, в течение 35 минут. Пик поглощения, соответствующий времени удержания адипоил-7-ADCA - продукта, собирают, используя коллектор фракций.
Пример 12. Проверка биоактивности.
Антибиотическую активность продуктов ферментации адипоил-6-АРА и адипоил-7-ADCA, выделенных ВЭЖХ, определяют, используя диффузионную биопробу на агаре /agar diffusion bioassay/. Двадцать мл выделенного продукта наносят на 5 мм диски на пластинах агара LB /20 г на л основного бульона LB с 3% агара (Cibco, Paisley, Шотландия/, засеянные Bacillus subtilus АТСС 33677, или суперчувствительным штаммом. Е. coli /поставляемого проф. Arnold L. Demain, МIТ/. Bacillus subtilus используют в качестве индикаторного штамма для проверки продукта адипоил-6-АРА, и суперчувствительный штамм Е. соli используют в качестве индикаторного штамма для проверки адипоил-7-ADCA. После 15-часового инкубирования при 37oС гало подавленной поросли индикаторной бактерии вокруг диска указывает, что продукты проявляют биоактивность. Контрольные образцы в этом эксперименте включают дезацетоксицефалоспорин С, цефалоспорин С, пенициллин V, и в качестве контрольного образца для подтверждения β-лактамных структур - агар, содержащий пенициллиназу или не содержащий пенициллиназу.
Пример 13. Проверка фермента RAEV.
Очищенный продукт адипоил-7-ADCA из цельного ферментационного бульона используют в качестве субстрата для определения специфической активности фермента RAEV /доступен коммерчески от RAEV Corp. /. Реакционную смесь, содержащую 10 мМ субстрата, 1 мг фермента RAEV, 5% глицерина в 0,16 М КН2РО4 в общем объеме 50 мл, инкубируют при 37oС. Отбирают 5 мл аликвоты во временных точках 0, 1, 3, 5, 10, 20 и 30 минут, разбавляют 35 мл 0,010 М КН2РО4, рН 3,5, и замораживают при -70oС, перед анализом методом ВЭЖХ при условиях, описанных ранее.
Активность фермента RAEV по отношению к колориметрированному субстрату адипоил-n-аминобензойной кислоты проверяют, используя 5 мМ субстрата, 8,25 мг фермента RAEV, 10% глицерина в 0,065 М КН2РО4, рН 7,0, в общем объеме 50 мл в течение 30 минут при 37oС. Реакцию выполняют в 96-ячеичной чашке микротитратора. Пятьдесят мл 1 М NaNO2, разбавленного 0,25 М уксусной кислотой в соотношении 1: 100, добавляют, чтобы закончить реакцию, и реакционную смесь оставляют при комнатной температуре на 3 минуты. Добавляют 100 мл раствора в воде гидрата мононатриевой соли 4-амино-5-гидрокси-2,7-нафталиндисульфоновой кислоты (10 мг/мл), разбавленного 0,5 М NaHCO3 в соотношении 1: 100, и немедленно определяют окраску при 515 нм, используя ЕL 312 Bio-kinetic Plate Reader /приборы BioTek/.
Пример 14. ВЭЖХ-анализ продукта реакции фермента RAEV.
Все проверки фермента RAEV /коммерчески доступного от RAEY Corp. /, в которых используют субстрат адипоил-7-ADCA, при контроле методом ВЭЖХ работают с системой Waters с системой подачи растворителя 625, детектором 490 Е с переменной длиной волны на 203 нм, и 254 нм, системой данных 825 Маха и колонкой Novo-С18 в качестве неподвижной фазы. Подвижная фаза /при скорости потока 1 мл/мин/ состоит из 2% метанола и 98% 0,010 М КН2РО4, рН 3,5 - 5 минут изократно, и метанола в 0,010 М КН2РО4, рН 3,6 с линейным градиентом 2-40% - 15 минут. Используют стандарт 7-ADCA, чтобы контролировать время удержания продукта реакции. Количество продукта реакции вычисляют, используя стандартную кривую стандарта 7-ADCA при 254 нм.
Пример 15.13С-ЯМР-анализ продукта ферментации адипоил-7-ADCA.
Спектры13С-ЯМР /широкополосный протонный сдвиг/ получают при 75,4 МГц /7,1 Т/ на спектрометре IBM-AF-350 /в Fourier Transform mode/. Образцы состоят из 50 мг продукта адипоил-7-ADCA из ферментационого бульона в 0,5 мл D20 (99,8% D, Aldrich), или в 0,5 мл DNCO-d6 (99,0% D, Aldrich), трубки 5 мм, 350 К. Данные ЯМР подтверждают определение продукта как адипоил-7-ADCA.
Пример 16. Оценка альтернативных ферментов адипоилацилазы.
В дополнение к исследованиям, использующим фермент RAEУ, демонстрируется удаление боковой адипоильной цепи из адипоил-7-ADCA /и других соединений с адипоилом/ с помощью ферментов, полученных из ряда микробных источников. На начальной стадии штамма Pseudomonas SE-83 и SE-495/ депонированные в Fermentation Research Institute под регистрационным номером FERM ВР-817 и FERM BP-818 соответственно/ и штамм Pseudomonas SУ-77-1 /депонированный Northern Regional Research Laboratory под регистрационным номером NNRL В 8070/ выращивают в течение 72 ч в среде, содержащей HyCase-SF - 2,0% (вес/объем); мононатрийглутамат - 0,5% (вес/объем); дрожжевой экстракт - 0,5% (вес/объем); порошок вымоченной кукурузы - 0,2% (вес/объем); хлопковое масло - 0,5% (вес/объем); и глутаровую кислоту - 0,1% (вес/объем). Клетки собирают центрифугированием и промывают 50 мМ фосфатным буфером, рН 8,0; затем их снова суспендируют в буфере, и делают проницаемыми внешние мембраны путем добавления небольшого объема хлороформа. Аликвоты суспензии клеток затем смешивают с адипоил-n-нитроанилином /ad-PNA/ и инкубируют при 30oС в течение 2-18 ч. После инкубации смеси подкисляют путем добавления 10% (объемн. ) уксусной кислоты. Затем колориметрическим способом определяют освободившийся n-нитроанилин после его конверсии в диазосоединение, используя реагенты, предложенные в форме комплекта Sigma Chemical Company для испытаний гамма-глутамилтрансферазы /Sigma product number 545-А/. Относительные активности трех штаммов составляют 100%, 85,5% и 48% для SE-495, SE-83 и SY-77-1 соответственно. Используя способы, подобные описанным выше для фермента RAEV, демонстрируют также активность SE-83 и SE-495 на адипоил-7-ADCA. Продуцирование β-лактамазы SY-77-1 предотвращает проявление дезацилирующей активности этого штамма относительно адипоил-7-ADCA.
Подобным способом также демонстрируют продуцирование адипоилацилазы для двухгрибных штаммов /Altemaria Sp. MA-133, ATCC 20492 и Aspergillus Sp. MA-13, ATCC 20491, ссылка - патент США 4141790 Meiji Seika Kaisha Lts. / и штаммов трехбактериальных /Brevibacterium, ATCC 14649; Achromobacterium, ATCC 14648 и Flavobacterium, АТСС 16650/, которые описаны как продуценты ацилазы цефалоспорина С в патенте США 3239394, Merk & Co. , Inc.
Список последовательностей приведен в конце описания.
Реферат
Изобретение относится к области генетической инженерии и может быть использовано в производстве цефалоспориновых антибиотиков. Штамм Penicillium chrysogenum, способный ассимилировать и утилизировать адипиновую кислоту или ее соли и эфиры с образованием адипоил-6-аминопенициллиновой кислоты (адипоил-6-АРА), трансформируют вектором экспрессии, содержащим ген фермента экспандазы, в частности из Streptomyces clavuligerus, которая преобразует адипоил-6-АРА в адипоил-7-аминодезацетоксицефалоспорановую кислоту (адипоил-7-ADCA). Рекомбинантный штамм культивируют в присутствии адипинатного питания, в частности динатрийадипината, а полученную in situ адипоил-7-ADCA затем обрабатывают ферментом адипоилацилазой с получением конечного продукта - 7-ADCA. Изобретение обеспечивает возможность быстрого (в 2 стадии) получения ключевого промежуточного соединения для синтеза цефалоспоринов в промышленном масштабе. 4 з. п. ф-лы, 2 табл.

Комментарии