Новые гидротропы на основе полимера для доставки гидрофобного лекарственного средства - RU2676680C2
Код документа: RU2676680C2
Чертежи




Описание
Область изобретения
В настоящей заявке раскрываются композиции и способы, относящиеся к области органической химии, фармацевтической химии, биохимии, молекулярной биологии и медицине. В частности, варианты выполнения настоящего изобретения, раскрытые в настоящей заявке, относятся к конъюгатам полимеров для получения инкапсулирующих лекарственное средство полимерных гидротропов, композициям и способам для доставки лекарственного средства в клетки, и к применению композиций для лечения и облегчения заболеваний и нарушений, таких как рак.
Уровень техники
Полимерные мицеллы являются одной из широко применяемых систем доставки лекарственного средства (DDS) для солюбилизации различных плохо растворимых лекарственных средств, таких как большая часть противораковых лекарственных средств, а также для доставки лекарственного средства в целевой сайт. Как правило, блок-сополимеры, состоящие из растворимого в воде полиэтиленгликоля (ПЭГ) и не растворимого в воде полимера, применяются для образования полимерных мицелл, обеспечивая гидрофильную внешнюю оболочку и гидрофобное внутреннее ядро. Плохо растворимые лекарственные средства инкапсулируются в последнее посредством гидрофобного взаимодействия с гидрофобной частью сополимера и остаются внутри гидрофильной внешней оболочки. Что касается блок-сополимерных мицелл на основе ПЭГ, поли(аминокислотные) комплексы сополимеров на основе ПЭГ, такие как ПЭГ-блок-поли(альфа, бета-аспарагиновая кислота) и ПЭГ-блок-поли(L-лизин) сообщаются как заметные функциональные вещества для DDS.
Недавно, гидротропные соединения привлекли внимание как полезные соединения для улучшения растворимости гидрофобных лекарственных средств. Ранее сообщалось, что диэтилникотинамид был идентифицирован как самый лучший для улучшения растворимости паклитаксела доза-зависимым образом на основании скрининга более 60 коммерчески доступных гидротропов (Kinam et al., Pharmaceutical Research, Vol. 20, 2003, 1022-1030). После этого сообщения, тот же автор далее сообщил, что сополимеры на основе ПЭГ, несущие диэтилникотинамид (DENA) и диметилбензамид (DMBA) составляющие, были способны инкапсулировать паклитаксел (Kinam et al., Journal of Controlled Release, Vol. 152, 2011, 13-20). Кроме того, сообщалось, что DENA был отличным гидротропным агентом для паклитаксела и улучшал профиль высвобождения паклитаксела в матрицах на основе поли(сополимере молочной и гликолевой кислоты) (PLGA) (Baek et al., J. Biomater. Sci. Polymer Edn, Vol. 15, No. 4, pp. 527-542 (2004)).
Перечень литературы
Непатентная литература
[NPL1] Kinam et al., Pharmaceutical Research, Vol. 20, 2003, 1022-1030
[NPL2] Kinam et al., Journal of Controlled Release, Vol. 152, 2011, 13-20
[NPL3] Baek et al., J. Biomater. Sci. Polymer Edn, Vol. 15, No. 4, pp. 527-542 (2004)
Сущность изобретения
Одним объектом настоящего изобретения является конъюгат полимера, отличающийся тем, что основной цепью полимера является анионный полимер, и гидрофобные составляющие ковалентно присоединяются к основной цепи полимера.
Некоторые варианты выполнения настоящего изобретения относятся к конъюгату полимера, описанному в настоящей заявке, который состоит из мономерных единиц, представленных формулой (I) и необязательно формулой (II):
[Схема 1]

[Схема 2]

где М независимо выбирается из группы, состоящей из гидрофобной составляющей или катиона; где гидрофобная составляющая составляет 20-50 мол. % от общего количества М, и катион независимо выбирается из водорода, аммиака или щелочного металла; X выбирается из группы, состоящей из О, S и NR; R выбирается из группы, состоящей из Н, С1-4 алкила, С2-4 алкенила, С2-4 алкинила, арила и гетероарила.
Некоторые варианты выполнения настоящего изобретения относятся к конъюгату полимера, описанному в настоящей заявке, который представлен формулой (III);
[Схема 3]

где, m и n оба представляют собой целое число, где m равно 0 или определяется так, что отношение m:n составляет от 1:9 до 5:5.
Некоторые варианты выполнения настоящего изобретения относятся к конъюгату полимера, описанному в настоящей заявке, в котором гидрофобная составляющая представлена формулой (VI);
[Схема 4]

где a и b независимо представляют собой целое число от 0 до 4; Ar независимо представляет собой арил или гетероарил; Z независимо выбирается из группы, состоящей из О, S, SO, SO2, NR, CR2; Y представляет собой СН или N; As представляет собой от одного до трех заместителей, независимо выбранных из группы, состоящей из галидов, OR, NR2, COOR, CONR2 или CN; и R независимо выбирается из группы, как описано в настоящей заявке.
Некоторые варианты выполнения настоящего изобретения относятся к конъюгату полимера, описанному в настоящей заявке, в котором As представляет собой один заместитель CONR2.
Некоторые варианты выполнения настоящего изобретения относятся к конъюгату полимера, описанному в настоящей заявке, в котором R выбирается из этила или метила.
Некоторые варианты выполнения настоящего изобретения относятся к конъюгату полимера, описанному в настоящей заявке, в котором а и b оба представляют собой 1.
Некоторые варианты выполнения настоящего изобретения относятся к конъюгату полимера, описанному в настоящей заявке, в котором Ar представляет собой арил.
Некоторые варианты выполнения настоящего изобретения относятся к конъюгату полимера, описанному в настоящей заявке, в котором Z представляет собой О.
Некоторые варианты выполнения настоящего изобретения относятся к конъюгату полимера, описанному в настоящей заявке, в котором гидрофобная составляющая независимо выбирается из
[Схема 5]


Другим объектом настоящего изобретения является полимерная мицелла, полученная из конъюгата полимера, описанного в настоящей заявке.
Другим объектом настоящего изобретения является композиция, состоящая из носителя на основе конъюгата полимера, описанного в настоящей заявке, и гидрофобного соединения, функционально связанного с носителем.
Другим объектом настоящего изобретения является терапевтическая композиция, состоящая из носителя на основе конъюгата полимера, описанного в настоящей заявке, и гидрофобного лекарственного средства, функционально связанного с носителем.
Некоторые варианты выполнения настоящего изобретения относятся к терапевтической композиции, описанной в настоящей заявке, в которой гидрофобным лекарственным средством является противораковое лекарственное средство.
Некоторые варианты выполнения настоящего изобретения относятся к терапевтической композиции, описанной в настоящей заявке, в которой лекарственное средство выбирается из группы, состоящей из паклитаксела, доцетаксела, танеспимицина, гризеофульвина, нифедипина, прогестерона и пробукола.
Некоторые варианты выполнения настоящего изобретения относятся к терапевтической композиции, описанной в настоящей заявке, в которой лекарственное средство выбирается из группы, состоящей из паклитаксела, доцетаксела и танеспимицина.
Некоторые варианты выполнения настоящего изобретения относятся к терапевтической композиции, описанной в настоящей заявке, в которой конъюгат полимера образует полимерную мицеллу, и гидрофобное терапевтическое средство инкапсулируется в полимерную мицеллу.
Другим объектом настоящего изобретения является способ лечения заболевания или состояния путем введения субъекту, нуждающемуся в этом, эффективного количества терапевтической композиции, описанной в настоящей заявке, для лечения заболевания или состояния.
Некоторые варианты выполнения настоящего изобретения относятся к способу, описанному в настоящей заявке, где заболевание или состояние выбирается из группы, состоящей из рака, инфекционных заболеваний, гипертензии, стенокардии, гинекологических заболеваний и гиперлипемии.
Некоторые варианты выполнения настоящего изобретения относятся к способу, описанному в настоящей заявке, где заболеванием или состоянием является рак.
Эти и другие варианты выполнения настоящего изобретения описываются более подробно далее.
Краткое описание чертежей
На Фиг. 1 показаны кривые роста опухоли для рака легких (верхняя) и рака поджелудочной железы (нижняя), соответственно. PTX-PGGA-Гидротроп III (Nitto X), как было продемонстрировано, способен подавлять рост опухоли доза-зависимым образом.
На Фиг. 2 приводится сравнение PTX-PGGA-Гидротропа III с обычной лекарственной формой Паклитаксела (Abraxane®) на модели рака легких, эффективность (верхняя) и масса опухоли на день 21 после введения (нижняя).
На Фиг. 3 показаны профили опухоли PK PTX-PGGA-Гидротропа III по сравнению с Abraxane® у животных, несущих NCI-H460 ксенотрансплантат.
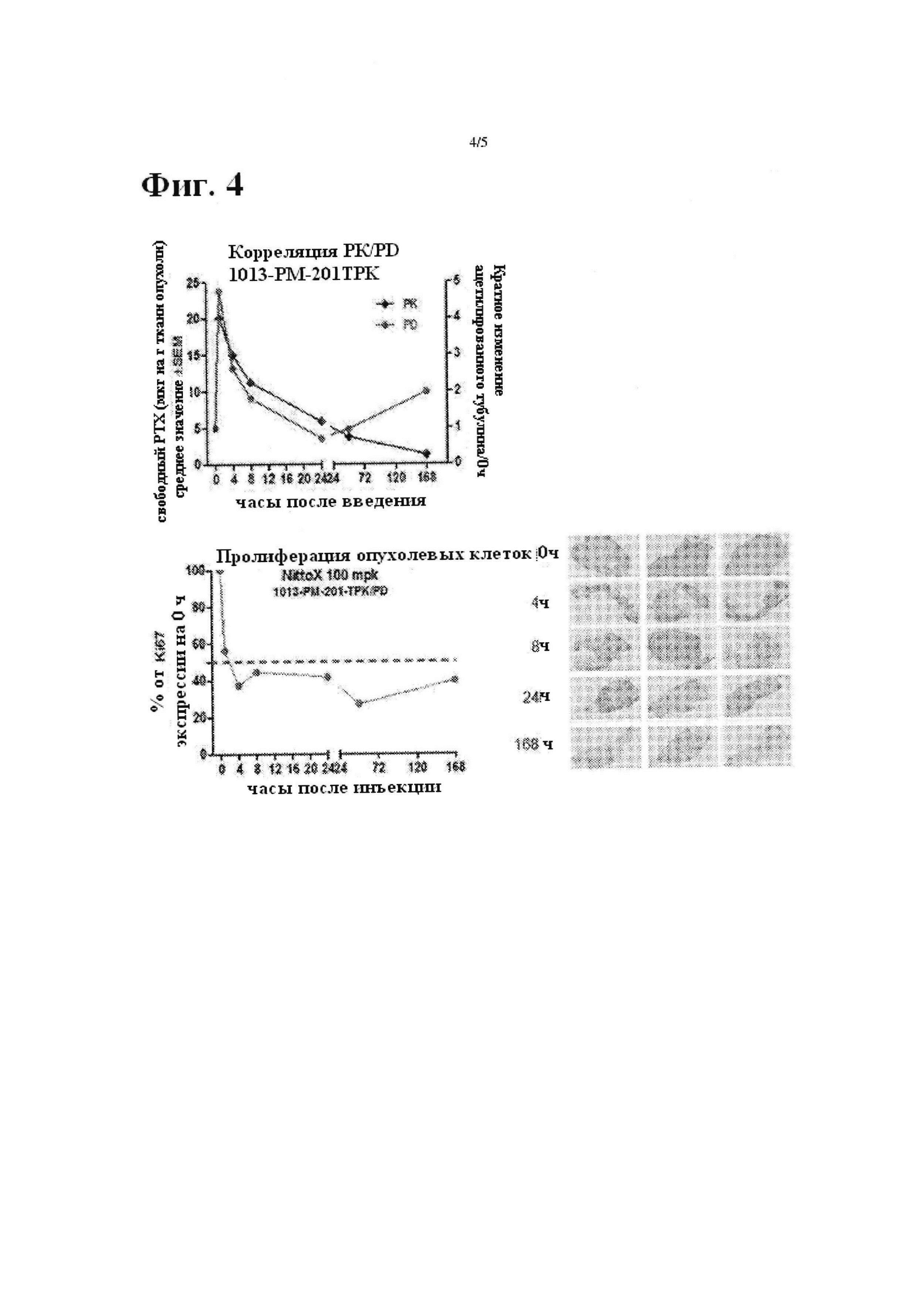
На Фиг. 4 приводится PK/PD корреляция PTX-PGGA-Гидротропа III у животных, несущих NCI-H460 ксенотрансплантат, где ацетилированный тубулин применялся в качестве PD биомаркера (верхний). Экспрессия Ki67 также применялась в качестве второго биомаркера для подтверждения PD данных, IHC окрашивание Ki67 ткани опухоли (нижняя правая) и соответствующее графическое представление количественных данных (нижняя левая).
На Фиг. 5 перечисляются результаты оценки токсичности PTX-PGGA-Гидротропа III.
На Фиг. 6 приводится схематическая диаграмма образования инкапсулирующих лекарственное средство полимерных мицелл согласно настоящему изобретению, описанных в настоящей заявке.
Описание вариантов выполнения настоящего изобретения
Подробное описание изобретения
Если иного не указано, все технические и научные термины, применяемые в настоящей заявке, имеют такое же значение как в общепринятом понимании специалиста в данной области техники. Все патенты, заявки, опубликованные заявки и другие публикации, на которые приводятся ссылки в настоящей заявке, включены в настоящую заявку посредством ссылки в полном объеме. Если есть множество определения для термина, преобладают указанные в этой части, если не указано иное.
Конъюгат полимера
Одним объектом настоящего изобретения является конъюгат полимера, в котором основная цепь представляет собой анионный полимер, и гидрофобные составляющие ковалентно присоединяются к полимерной основной цепи. Конъюгат полимера согласно настоящему изобретению может содержать полимерную основную цепь с анионной, гидрофильной боковой цепью, как например, поли-(L-гамма-глутамилглутамин) (PGGA, смотрите, например, WO 2007/067417, WO 2010/014117 и Sang Van et al., Int J Nanomedicine. 2010; 5: 825-837, которые включены в настоящую заявку в полном объеме посредством ссылки), а также гидрофобные составляющие, например, диэтилникотинамид (DENA) и диметилбензамид (DMBA). Последние ковалентно присоединяются к основной цепи как часть боковых цепей. На основе сильного взаимодействия между гидрофобными соединениями и гидрофобной составляющей, присоединенной к основной цепи, в водной среде, образование может быть легко инкапсулировано конъюгатом полимера с получением растворимых в воде полимерных мицелл, применяя общий способ быстрого смешивания. Так как основная цепь конъюгата полимера является анионной, т.е., отрицательно заряженной, полимерные мицеллы, полученные из конъюгата полимера согласно настоящему изобретению, не должны связываться с белками плазмы или клеточными мембранами, которые также главным образом являются сильно отрицательно заряженными. Это не только усиливает их подвижность, но также пролонгирует время циркуляции в плазме для доставки в сайты опухоли. Кроме того, взаимодействие между гидрофобным лекарственным средством и полимерными мицеллами, описанными в настоящей заявке, меньше, чем взаимодействие в традиционных полимерных мицеллах на основе ПЭГ-сополимера, что отражено образованием, имеющим более низкую критическую концентрацию мицеллообразования (CMC). Это означает, что инкапсулирующие лекарственное средство полимерные мицеллы согласно настоящему изобретению, описанные в настоящей заявке, относительно более легко высвобождают это лекарственное средство и усиливают терапевтическую эффективность в сайтах опухоли.
Как упомянуто выше, сополимеры на основе ПЭГ обычно применяются для конъюгатов полимерных мицелл в настоящее время. Одним недостатком сополимеров на основе ПЭГ является небиодеградируемая природа ПЭГ. Поэтому, в некоторых предпочтительных вариантах выполнения настоящего изобретения, описанных в настоящей заявке, конъюгат полимера является биодеградируемым. Биодеградируемые полимеры, применяемые для получения конъюгатов полимеров согласно настоящему изобретению, описанных в настоящей заявке, являются не ограниченными, при условии, что не оказывают отрицательного воздействия на взаимодействие между гидрофобным соединением и конъюгатом полимера. Примеры биодеградируемых полимеров включают, но без ограничения к этому, поли-(L-гамма-глутамилглутамин) (PGGA), поли-L-глутаминовую кислоту (PGA), поли-(гамма-L-аспартилглутамин) (PGAA), поли-(сополимер молочной и гликолевой кислоты) (PLGA) и их смеси.
Некоторые варианты выполнения настоящего изобретения, описанные в настоящей заявке, обеспечивают конъюгат полимера, который состоит из мономерных единиц, представленных формулой (I) и необязательно формулой (II), приведенными далее:
[Схема 6]

[Схема 7]

где
М независимо выбирается из группы, состоящей из гидрофобной составляющей или катиона; где гидрофобная составляющая составляет 20-50 мол. % от общего количества М; и катион независимо выбирается из водорода, аммиака или щелочного металла;
X выбирается из группы, состоящей из О, S и NR;
R выбирается из группы, состоящей из Н, С1-4 алкила, С2-4 алкенила, С2-4 алкинила, арила и гетероарила.
Как применяется в настоящей заявке термин "арил" относится к карбоциклической (все углероды) моноциклической или мультициклической ароматической кольцевой системе, которая имеет полностью делокализованную пи-электронную систему. Примеры арильных групп включают, но без ограничения к этому, бензол, нафталин и азулен. Как применяется в настоящей заявке термин "гетероарил" относится к моноциклической или мультициклической ароматической кольцевой системе (кольцевая система с полностью делокализованной пи-электронной системой), которая содержит один или более гетероатомов, то есть, элемент, отличный от углерода, включая, но без ограничения к этому, азот, кислород и серу.
Как применяется в настоящей заявке термин "алкил" относится к неразветвленной или разветвленной углеводородной цепи, полностью насыщенной (без двойных или тройных связей) углеводородной группе. "С1-4 алкил" означает, что существует от одного до четырех атомов углерода в алкильной цепи, т.е., алкильная цепь выбирается из группы, состоящей из метила, этила, пропила, изопропила, бутила, изобутила, втор-бутила и трет-бутила. Типичные алкильные группы включают, но без ограничения к этому, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил и тому подобное. Как применяется в настоящей заявке термин "алкенил" относится к алкильной группе, которая содержит в неразветвленной или разветвленной углеводородной цепи одну или более двойных связей. Как применяется в настоящей заявке термин "алкинил" относится к алкильной группе, которая содержит в неразветвленной или разветвленной углеводородной цепи одну или более тройных связей.
Как применяется в настоящей заявке термин «гидрофобная составляющая» относится к составляющей, которая присоединяется к полимерной боковой цепи и взаимодействует с другой гидрофобной составляющей или гидрофобными лекарственными средствами. Любая гидрофобная составляющая, известная в данной области техники, могла бы применяться для изобретения, при условии, что она не указывает отрицательного воздействия на свойства конъюгата полимера. В одном варианте выполнения настоящего изобретения гидрофобная составляющая выбирается из группы, состоящей из DENA и DMBA.
Как применяется в настоящей заявке термин "катион" относится к противоиону анионной группы, например, карбоксильной группе на боковой цепи полимерной основной цепи. Примеры катиона могут включать, но без ограничения к этому, водород, аммиак, щелочной металл и щелочноземельный металл. В одном варианте выполнения изобретения катионом является натрий.
Молекулярная масса основной цепи полимера может варьироваться. В некоторых вариантах выполнения настоящего изобретения, молекулярная масса основной цепи полимера может находиться в интервале от около 15 кДа до около 80 кДа.
В некоторых вариантах выполнения настоящего изобретения, описанных в настоящей заявке, обеспечивается полимер, представленный приведенной ниже формулой:
[Схема 8]

где
m и n оба представляют собой целое число, где m равно 0 или определяется таким образом, что отношение m:n составляет от 1:9 до 5:5.
В некоторых вариантах выполнения настоящего изобретения, гидрофобная составляющая представлена формулой (VI);
[Схема 9]

где
а и b независимо представляют собой целое число от 0 до 4, предпочтительно оба равны 1;
Ar независимо представляет собой арил или гетероарил, предпочтительно арил;
Z независимо выбирается из группы, состоящей из О, S, SO, SO2, NR, CR2, предпочтительно О;
Y представляет собой СН или N;
As представляет собой от одного до трех заместителей, независимо выбранных из группы, состоящей из галидов, OR, NR2, COOR, CONR2, или CN, предпочтительно CONR2; и
R независимо выбирается из группы, как определено выше, предпочтительно этила или метила.
В некоторых предпочтительных вариантах выполнения настоящего изобретения, гидрофобная составляющая независимо выбирается из
[Схема 10]


Конъюгат полимера, описанный выше, способен к агрегации и образованию полимерной мицеллы. Таким образом, одним объектом настоящего изобретения является полимерная мицелла, которая образована конъюгатом полимера, описанным в настоящей заявке.
Конъюгат полимера, описанный в настоящей заявке, мог бы быть получен обычной методикой, такой как конденсация с дегидротацией гидрофобной составляющей с карбоксильным остатком основной цепи полимера. Неограничивающие примеры получения конъюгатов полимеров согласно настоящему изобретению описаны далее.
Конъюгат полимера, описанный в настоящей заявке, может применяться в качестве носителя для транспортировки соединения, в частности гидрофобного соединения (такого как гидрофобное лекарственное средство), в организм. Конъюгат полимера, описанный в настоящей заявке, может применяться для образования полимерной мицеллы, как например наночастичный носитель, которая может применяться для транспортировки инкапсулированного соединения в сайт опухоли в организме.
Композиция
Другим объектом настоящего изобретения, описанным в настоящей заявке, является композиция, содержащая носитель на основе конъюгата полимера, описанный выше, и гидрофобное соединение, функционально связанное с гидрофобной составляющей конъюгата полимера, с образованием гидрофобного ядра. В некоторых вариантах выполнения настоящего изобретения гидрофобным соединением может быть терапевтическое лекарственное средство, вносящее метку соединение и т.д. В одном варианте выполнения настоящего изобретения, композицией является терапевтическая композиция, содержащая носитель на основе конъюгата полимера, как описано выше, и гидрофобное лекарственное средство, функционально связанное с носителем.
Как применяется в настоящей заявке термин "носитель" может применяться со ссылкой на различные виды веществ, включая полимерный носитель или мицеллярный носитель. Носитель может быть функционально связан с одним или более соединениями, например, терапевтическим лекарственным средством и/или нацеливающим агентом. В этом контексте, «функционально связанный» относится к электронному взаимодействию между носителем и средством (средствами). Такое взаимодействие может иметь форму химической связи, включая, но без ограничения к этому, ковалентную связь, полярную ковалентную связь, ионную связь, электростатическое связывание, ковалентно-координационную связь, ароматическую связь, водородную связь, диполь или Ван-дер-Ваальсово взаимодействие. Специалистам в данной области техники понятно, что относительные силы таких взаимодействий могут широко варьироваться.
Термин "терапевтическое" относится к облегчению, профилактике или подавлению любых признаков или симптомов заболевания или состояния до какой-либо степени. Такие нежелательные признаки могут включать те, которые ухудшают общее хорошее самочувствие и внешний вид субъекта. Этот термин не обязательно указывает на полное излечение или устранения заболевания или состояния. «Терапевтическое лекарственное средство» представляет собой соединение, которое, при введение млекопитающему в терапевтически эффективном количестве, обеспечивает терапевтическую пользу млекопитающему. В определенном варианте выполнения настоящего изобретения терапевтическим средством может быть гидрофобное лекарственное средство. Специалистам в данной области техники очевидно, что термин «терапевтическое лекарственное средство» не ограничивается до лекарственных средств, которые имеют полученное одобрение контролирующего органа. «Терапевтическое лекарственное средство" может быть функционально связано с по меньшей мере одним носителем и/или другим средством.
В некотором предпочтительном варианте выполнения настоящего изобретения полимерные гидротропы согласно настоящему изобретению, описанные в настоящей заявке, содержат полимерные мицеллы на основе модифицированного PGGA. Так как PGGA, как доказано, является весьма растворимым в воде, биосовместимым, биодеградируемым, неиммуногенным, негемолитическим и универсальным при получении как конъюгатов полимер-лекарственное средство, так и составов на основе полимерных мицелл, полимерные мицеллы на основе PGGA будут иметь следующие преимущества: i) высокий коэффициент вместимости лекарственного средства; ii) исключение применения неприродных небиодеградируемых ПЭГ или других весьма токсичных солюбилизирующих эксципиентов; iii) усиленная опухолевая аккумуляция; iv) уменьшение системной токсичности и v) усиление терапевтической эффективности.
Носитель может связываться с некоторыми соединениями, отличными от гидрофобных соединений, инкапсулированных в полимерные мицеллы. Примеры соединений, отличных от гидрофобного соединения, инкапсулированного в полимерные мицеллы, включают, но без ограничения к этому, вносящие метку, нацеливающие агентов и дополнительные терапевтические лекарственные средства. Дополнительные терапевтические лекарственные средства могут быть или могут не быть гидрофобными. Неограничивающие примеры нацеливающих агентов и т.д., можно найти, например, в Xu et al., Adv Drug Deliv Rev. 2013; 65 (1): 121-38; Yu et al., Mol Membr Biol. 2010; 27 (7): 286-98 и Kamaly et al., Chem Soc Rev. 2012; 41 (7): 2971-3010.
В варианте выполнения изобретения, описанного в настоящей заявке, терапевтическое лекарственное средство не ограничено, при условии, что оно является гидрофобным. Примеры терапевтических лекарственных средств могут включать, но без ограничения к этому, семейства таксанов, макроциклические поликетиды и резорцинильные изоксазольные амиды. В некоторых вариантах выполнения настоящего изобретения, терапевтические лекарственные средства могут включать, но без ограничения к этому, паклитиаксел, доцетаксел, танеспимицин, гризеофульвин, нифедипин, прогестерон, пробукол, клофибрат, коэнзим Q10, глибенкламид, фелодипин, фенофибрат, итраконазол, антрацен и дигидроантрацен. В некоторых вариантах выполнения настоящего изобретения терапевтическим лекарственным средством может быть противораковое лекарственное средство. Примеры противоракового лекарственного средства могут включать, но без ограничения к этому, паклитаксел, доцетаксел и танеспимицин. В другом варианте выполнения настоящего изобретения терапевтическим лекарственным средством могут быть антибиотики, гормоны и тому подобное.
В некоторых вариантах выполнения настоящего изобретения, композиция согласно настоящему изобретению представляет собой композицию для применения для лечения заболеваний или, другими словами, фармацевтические композиции, где композиция содержит конъюгат полимера, описанный в настоящей заявке, и гидрофобное лекарственное средство, описанное в настоящей заявке. В некоторых предпочтительных вариантах выполнения настоящего изобретения, заболевания включают, но без ограничения к этому, рак, инфекционные заболевания, гипертензию, стенокардию, гинекологические заболевания, эндокринные заболевания и гиперлипемию.
Фармацевтические композиции, описанные в настоящей заявке, могут вводиться пациенту человеку сами по себе, или в фармацевтических композициях, где они смешиваются с другими активными ингредиентами, как при комбинированной терапии, или подходящими фармацевтическими носителями или эксципиентом (эксципиентами). Способы получения композиции и введения соединений согласно настоящему изобретению можно найти в "Remington's Pharmaceutical Sciences," Mack Publishing Co., Easton, PA, 18th edition, 1990.
Подходящие пути введения могут, например, включать пероральное, ректальное, трансмукозальное, местное или интестинальное введение; парентеральную доставку, включая внутримышечные, подкожные, внутривенные, костномозговые инъекции, а также интратекальные, прямые внутрижелудочковые, интраперитонеальные, интраназальные или внутриглазные инъекции. Композиции также могут вводиться в лекарственных формах для замедленного или контролируемого высвобождения, включая инъекции замедленного всасывания, осмотические насосы, пилюли, трансдермальные (включая электроперенос) пластыри, и тому подобное, для пролонгированного и/или в определенный период времени, импульсного введения при заданной скорости.
Фармацевтические композиции могут быть получены любым известным образом, применяя один или более физиологически приемлемых фармацевтических носителей, содержащих эксципиенты и вспомогательные средства, которые облегчают получение фармацевтических препаратов из активных соединений. Подходящий состав зависит от выбранного пути введения. Любые хорошо известные методики, фармацевтические носители и эксципиенты могут применяться в качестве подходящих, и как известно в данной области техники; например, в Remington's Pharmaceutical Sciences, выше.
Фармацевтические композиции, подходящие для введения, включают композиции, в которых активные ингредиенты содержатся в количестве, эффективном для достижения поставленной им задачи. Терапевтически эффективное количество соединений, раскрытых в настоящей заявке, предусмотренное в качестве дозы, будет зависеть от пути введения, вида животного, включая человека, подлежащего лечению, и физических характеристик конкретного рассматриваемого животного. Доза может быть оптимизирована для достижения желаемого эффекта, но будет зависеть от таких факторов как масса, питание, сопутствующая лекарственная терапия и другие факторы, которые известны специалистам в области медицины. Более конкретно, терапевтически эффективное количество означает количество соединения, эффективное либо для предупреждения, облегчения или облегчения симптомов заболевания, либо для увеличения продолжительности жизни субъекта, подлежащего лечению. Определение терапевтически эффективного количества находится в компетенции специалиста в данной области техники, особенно в свете описания, подробно приведенного в настоящей заявке.
Как очевидно специалисту в данной области техники полезная in vivo дозировка, подлежащая введению, и конкретный способ введение будет завесить от возврата, массы и видом млекопитающих, подлежащих введению, конкретных применяемых соединений и конкретного применения, для которого эти соединения применяются. Определение эффективных уровней доз, то есть уровней доз, необходимых для достижения желаемого результата, может осуществляться специалистом в данной области техники, применяя стандартные фармакологические способы. Как правило, клинические применения продуктов человеком начинаются при низких уровнях дозы, причем доза увеличивается до тех пор, пока не будет достигнут желаемый эффект. Альтернативно, приемлемые in vitro исследования могут применяться для установления полезных доз и путей введения композиций, определенных данными способами, применяя установленные фармакологические методы.
Точный состав, путь введения и доза для фармацевтических композиций могут быть выбраны конкретным врачом на основании состояния пациента. (Смотрите, например, Fingl et al. 1975, in "The Pharmacological Basis of Therapeutics", который включен в настоящую заявку в полном объеме, с конкретной ссылкой на Ch. 1, р. 1). Как правило, интервал дозы композиции, вводимой пациенту, может составлять от около 0.5 до около 1000 мг/кг массы тела пациента. Доза может быть однократной или в виде ряда двух или более, вводимых в ходе одного или более дней, как это требуется пациенту. В случаях, когда дозировки соединений для человека были установлены для по меньшей мере некоторого состояния, дозировки будут примерно такими же, или дозировки будут составлять от около 0.1% до около 500%, более предпочтительно от около 25% до около 250% от установленной дозировки для человека. Когда никакой дозы для человека не установлено, как в случае вновь открытых фармацевтических композиций, подходящую для человека дозу можно получить на основе значений ED50 или ID50, или других подходящих значений, полученных на основании in vitro или in vivo исследований, таких как исследования токсичности и исследования эффективности на животных.
Хотя точная доза будет определена в зависимости от конкретного лекарственного средства, в большинстве случаев, некоторые обобщения в отношении дозы могут быть сделаны. Ежедневным режимом дозирования для взрослого пациента может быть, например, пероральная доза от около 0.1 мг до 2000 мг каждого активного ингредиента, предпочтительно от около 1 мг до около 500 мг, например, от 5 до 200 мг. В других вариантах выполнения настоящего изобретения, применяется внутривенная, подкожная или внутримышечная доза каждого активного ингредиента от около 0.01 мг до около 100 мг, предпочтительно от около 0.1 мг до около 60 мг, например, от около 1 до около 40 мг. В случаях введения фармацевтически приемлемой соли, дозы могут быть вычислены в виде свободного основания. В некоторых вариантах выполнения настоящего изобретения, композиция вводится от 1 до 4 раз в день. Альтернативно, композиции могут вводиться путем непрерывного внутривенного вливания, предпочтительно при дозе каждого активного ингредиента до около 1000 мг в день. Как понятно специалисту в данной области техники, в некоторых случаях может быть необходимо вводить соединения, раскрытые в настоящей заявке, в количествах, которые превышают, или даже сильно превышают, указанные выше, предпочтительные диапазоны зон, для того чтобы эффективно и сильно лечить конкретные сильные заболевания или инфекции. В некоторых вариантах выполнения настоящего изобретения, соединения вводятся в течение текущей терапии, например в течение недели или более, или в течение месяцев или лет.
Способ
Изобретение, описанное в настоящей заявке, охватывает способ лечения заболевания или состояния путем введения терапевтической композиции согласно настоящему изобретению субъекту, нуждающемуся в этом, в эффективном количестве для достижения поставленной задачи. Заболевание, которое можно лечить, не ограничено, при условии, что терапевтическое лекарственное средство является гидрофобным, и лекарственное средство может улучшить состояние заболевания. Примеры заболевания могут включать, но без ограничения к этому, рак, инфекционные заболевания, гипертензию, стенокардию, гинекологические заболевания и гиперлипемию. В одном варианте выполнения настоящего изобретения заболеванием является рак.
Настоящее изобретение охватывает вариант введения терапевтической композиции, описанной выше. Поэтому все примеры, описанные выше для варианта выполнения терапевтической композиции, как например примеры способа введения, лекарственных форм, количеств для субъекта и тому подобное, также относятся к способу лечения заболеваний, описанному в настоящей заявке,.
Примеры
Следующие примеры приводятся с целью дальнейшего описания вариантов выполнения настоящего изобретения, описанных в настоящей заявке, и не ограничивают объем настоящего изобретения.
Синтез полимерных гидротропов
Пример 1: pGG-DENA полимерные гидротропы
[Схема 11]

N,N-Диэтил-2-гидроксиникотинамид (2)
2-гидроксиникотиновую кислоту (1, 20 г, 143.8 ммоль) ввели в реакцию с 1,1'-карбонилдиимидазолом (CDI, 25.6 г, 158.2 ммоль) в 900 мл безводного THF при 70°С. Через 24 часа 400 мл THF добавили в неочищенный раствор, и 30 мл диэтиламина (DEA, 299.0 ммоль) затем добавили по каплям. Реакционную смесь затем нагревали при 70оС в течение еще 18 часов. Белый кристалл N,N-диэтил-2-гидроксиникотинамида (2) получили посредством повторной перекристаллизации в 50 мл THF (25.2 г, 90% выход).
LC-MS m/z=195.2 [М+Н]+; 1НЯМР (400 МГц, DMSO-d6) delta 1.00 (т, 3Н, J=6.96 Гц), 1.08 (т, 3Н, J=6.96 Гц), 3.12 (кв, 2Н, J=6.96 Гц), 3.35 (кв, 2Н, J=6.96 Гц), 6.21 (т, 1Н, J=6.60 Гц), 7.42 (м, 2Н), 7.65 (с, 1H).
[Схема 12]

N,N-Диэтил-2-((4-(гидроксиметил)бензил)окси)никотинамид (4)
К раствору N,N-диэтил-2-гидроксиникотинамида (2) (5 г, 25.7 ммоль) в 150 мл безводного ацетона с K2СО3 (7.12 г, 51.5 ммоль) по каплям добавили (4-(хлорметил)фенил)метанол (3) при 60°С, и реакционную смесь перемешивали в атмосфере азота в течение 20 часов. Неочищенную реакционную смесь затем отфильтровали, и продукт очистили посредством колоночной флеш-хроматографии, применяя 1:1/THF:Hex на силикагеле. Дальнейшую очистку осуществили посредством перекристаллизации из EtOAc/Hex с получением 7.31 г N,N-диэтил-2-((4-(гидроксиметил)бензил)окси)никотинамида (4) в виде кристаллического белого твердого вещества (90.3% выход).
LC-MS m/z=315.4 [М+Н]+, 1НЯМР (400 Гц, CDCl3) delta 1.09 (м, 3Н), 1.21 (м, 3Н), 2.29 (расш. с, 1H), 3.23 (м, 2Н), 3.50 (м, 2Н), 4.64 (д, 2Н, J=5.48 Гц), 5.10 (расш. с, 2Н), 6.17 (т, 1Н, J=6.96 Гц), 7.28 (м, 6Н).
[Схема 13]

pGG-40 мол. % DENA-Na
К раствору 100 мл безводного DMF в круглодонной колбе, объемом 250 мл, добавили 5.0 г PGGA, и смесь перемешали при комнатной температуре в течение 10 минут до растворения всего твердого вещества с получением прозрачного раствора. 5.57 г 1-этил-3-(3-диметиламинопропил)карбодиимида (EDC) и 1.18 г N,N-4-диметиламинопиридина (DMAP) затем последовательно добавили. После перемешивания при комнатной температуре в течение 15 минут, 4.87 г соединения 4 добавили в виде одной части, и полученный раствор перемешивали при температуре окружающей среды в течение 28 часов. Реакционную смесь затем медленно перелили в 600 мл 0.2 N раствор HCl, перемешиваемый магнитной мешалкой. После перемешивания в течение 10 минут, неочищенный продукт белого цвета выделили путем центрифугирования. Неочищенный продукт, после промывки 0.2 N HCl и MilliQ последовательно, растворили в 500 мл 0.3N растворе NaHCO3, при перемешивании, пока не будет получен прозрачный раствор. Раствор сначала отфильтровали, и фильтрат затем очистили посредством системы TFF (3 кДа, mPES колонка) до тех пор, пока проводимость раствора фильтрата не станет меньше 0.05 мС/см. Наконец ретентат полностью лиофилизировали с получением 10.5 г конъюгата рGG-40 мол. % DENA-Na (94% выход).
GPC-MALS: 83.2 кДа, PDI: 1.558, УФ-загрузка: 38%, Zave: 24 нм.
Другие конъюгаты pGG-DENA-Na также были получены с применением того же протокола с различными количествами соединения 4.
Пример 2: pGG-DMBA полимерные гидротропы
[Схема 14]

2-Гидрокси-N,N-диметилбензамид (6)
2-Гидроксибензойную кислоту (7, 20 г, 144.8 ммоль) ввели в реакцию с 1,1'-карбонилдиимидазолом (CDI, 23 г, 159.3 ммоль) в 900 мл безводного THF при 70°С. Через 20 часов, 145 мл диметиламина (DMA, 2.0М раствор в THF, 290 ммоль) затем добавили по каплям. Реакционную смесь затем нагревали при 70°С в течение дополнительных 20 часов. После охлаждения до комнатной температуры и удаления растворителя при пониженном давлении, остаток разбавили с помощью EtOAc (1000 мл), и промыли с помощью 0.2N HCl (2×800 мл) и соляного раствора (500 мл). Наконец органический слой высушили над безводным Na2SO4, отфильтровали и концентрировали с получением неочищенного твердого вещества. Белый кристалл 2-гидрокси-N,N-диметилбензамида (6) получили посредством перекристаллизации, применяя EtOAc/гексан (20 г, 84% выход).
LC-MS m/z=166.2[М+Н]+; 1НЯМР (400 МГц, CDCl3) delta 3.13 (с, 6Н), 6.82 (т, 1Н, J=5.56 Гц), 6.98 (д, 1Н, J=5.56 Гц), 7.29 (м, 2Н).
[Схема 15]

2-((4-(Гидроксиметил)бензил)окси)-N,N-диметилбензамид (7)
К раствору 2-гидрокси-N,N-диметилбензамида (6) (5 г, 30.3 ммоль) в 100 мл безводного ацетона с K2СО3 (8.37 г, 60.5 ммоль), (4-(хлорметил)фенил)метанол (3) (7.11 г, 45.4 ммоль) добавили по каплям при 60°С, и реакционную смесь перемешивали при 65оС в атмосфере азота в течение 20 часов. Неочищенную реакционную смесь затем отфильтровали, и продукт очистили посредством колоночной флеш-хроматографии, применяя 1:1/EtOAc:Нех на силикагеле с получением 8.5 г 2-((4-(гидроксиметил)бензил)окси)-N,N-диметилбензамида (7) в виде кристаллического твердого вещества белого цвета (92% выход).
LC-MS m/z=286.3 [М+Н]+, 1НЯМР (400 Гц, CDCl3) delta 2.37 (расш. с, 1H), 2.83 (с, 3Н), 3.078 (с, 3Н), 4.64 (с, 2Н), 5.08 (с, 2Н), 6.93 (м, 2Н), 7.30 (м, 6Н).
[Схема 16]

pGG-30мол.%DMBA-Na
К раствору 100 мл безводного DMF в круглодонной колбе, объемом 250 мл, добавили 5.0 г PGGA, и смесь перемешивали при комнатной температуре в течение 10 минут, до тех пор, пока твердый материал не растворится, с получением прозрачного раствора. 4.83 г 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC) и 0.71 г N,N-4-диметиламинопиридин (DMAP) затем последовательно добавили. После перемешивания при комнатной температуре в течение 15 минут, 3.32 г 7 добавили в виде одной части, и полученный раствор перемешивали при температуре окружающей среды в течение 28 часов. Реакционную смесь затем медленно перелили в 600 мл 0.2 N раствор HCl, перемешиваемый магнитной мешалкой. После перемешивания в течение 10 минут, неочищенный продукт белого цвета выделили посредством центрифугирования. Неочищенный продукт, после промывки 0.2 N HCl и MilliQ последовательно, растворили в 500 мл 0.3 N раствора NaHCO3 при перемешивании до тех пор, пока не будет получен прозрачный раствор. Раствор сначала отфильтровали, и фильтрат очистили с помощью системы TFF (3 кДа, mPES колонка) до тех пор, пока проводимость раствора фильтрата не станет меньше 0.05 мС/см. Наконец ретентат полностью лиофилизировали с получением 9.1 г соединения, указанного в названии (97% выход).
GPC-MALS: 69.7 кДа, PDI: 1.417, УФ-загрузка: 29%, Zave: 20 нм.
Другие конъюгаты pGG-DMBA-Na также были получены с применением того же протокола с различными количествами соединения 7.
Получение полимерных мицелл pGG-гидротропа, инкапсулирующих лекарственное средство
Пример 3: Получение полимерных мицелл pGG-гидротропа, инкапсулирующих лекарственное средство
Все полимерные мицеллы pGG-гидротропа, инкапсулирующие лекарственное средство, были получены согласно стандартному промышленному способу быстрого смешивания. Кратко, раствор лекарственного средства в этаноле и раствор pGG-гидротропа в PBS буфере при заданном массовом отношении быстро смешали при Т-соединении с помощью одного перистальтического насоса, и смесь затем быстро разбавили буфером, полученным с помощью другого насоса. Систему диафильтрации затем применяли для удаления этанола, а также концентрата неочищенных композиций. Конечную готовую к применению лекарственную форму (RTU) получили после фильтрации через 0.2 мкм мембрану ля фильтрации. Примеры гидрофобных лекарственных средств, которые могли бы быть инкапсулированы pGG-гидротропами, включают паклитиаксел, доцетаксел и танеспимицин.
[Схема 17]



Полимерные гидротропы согласно настоящему изобретению, описанные выше, как было продемонстрировано, способны взаимодействовать с гидрофобными лекарственными средствами и образовывать стабильные полимерные мицеллы. Из этих полимерных гидротропов, паклитиаксел, инкапсулированный в pGG-30мол.%DENA полимерные мицеллы (PTX-PGGA-Гидротроп III, также обозначается как Nitto X), применялся для дальнейших исследований. Физические свойства PTX-PGGA-Гидротропа III показаны в приведенной далее таблице.

In vivo анализ эффективности
Пример 4: Установление Mia-Paca-2 опухолевой модели рака поджелудочной железы с ксенотрансплантатом
Mia-Paca-2 клеточную линию приобрели у компании АТСС и поддерживали в RPMI-1640 с добавкой 10% фетальной бычьей сыворотки, 100 ед/мл пеницилина и 100 мкг/мл стрептомицина. Клетки собрали в ходе фазы логарифмического роста из культуры ткани после легкой обработки трипсином с помощью трипсин-EDTA. Число жизнеспособных клеток посчитали и определили в гемоцитометре в присутствии трипанового синего (считали только жизнеспособные клетки). Каждую мышь инокулировали подкожно в правую боковую поверхность с помощью 0.1 мл инокулята 2×106 Mia-Paca-2 клеток, применяя 25 G иглу и мышь, (один инокулят на мышь). Объем опухоли контролировали дважды в неделю. Также производили измерения массы тела. Объем опухоли вычисляли, применяя формулу: объем опухоли = (длина×(ширина)2)/2.
Пример 5: эффект ответа на дозу
Как только опухоли, установленные в Примере 4, достигли около 200-220 мм3 (средний объем опухоли - 209 мм3), мышей поделили на в контрольную группу со средой и различные группы обработки, так что средние объемы опухоли в обрабатываемых группах находились в пределах 10% от среднего объема опухоли в контрольной группе со средой, и CV% объема опухоли было меньше 25%. В тот же день получили свежие протестированные изделия (например РТХ-икапсулирующие PGGA-гидротропные III PMs, NittoX), и вводили контрольной группе со средой через хвостовую вену при 40, 60 и 80 мг (РТХ экв.)/кг при объеме дозы 10 мл/кг. Объем опухоли контролировали дважды в неделю. Измерения массы тела также проводили. Объем опухоли затем вычисляли, применяя приведенную выше формулу. Как только отдельный объем опухоли достигал 3,000 мм3, или опухоль покрывалась язвами, животных умерщвляли согласно правилам IACUC.
Результат показан на Фиг. 1. Как ясно из Фиг. 1, рост опухоли был полностью подавлен при различных дозах, среди которых самая низкая доза составляла 40 мг/кг. Результаты показали, что РТХ-инкапсулирующие PGGA-гидротропные III PMs имеют отличную противораковую эффективность. Ответ на дозу не был очевиден из-за полного подавления.
Пример 6: Эффект инкапсулирующей лекарственное средство PGGA-гидротропной полимерной мицеллы по сравнению с обычным лекарственным средством
Мышей, несущие ксенотрансплантат рака легких, полученный из клеточных линий NCI-H460 (приобретенных у компании АТСС), получили также, как описано в Примере 4. Мышей поделили на в контрольную группу со средой и различные группы обработки, также как описано в Примере 5. Для анализа тест осуществляли подобным образом, но с небольшой модификацией, так что Abraxane® (альбумин-связанный паклитиаксел) вводили при дозе 80 мг/кг, по сравнению с такой же дозой PTX-PGGA-Гидротропа III.
Результат показан на Фиг. 2. Как ясно из Фиг. 2, эффект подавления опухоли PTX-PGGA-Гидротропа III лучше такой же дозы FDA-одобренного лекарственного средства Abraxane®.
Пример 7. Исследование PK/PD опухоли
Мышей, несущие ксенотрансплантат рака легких получили так же, как описано в Примере 6. Кратко, клетки собрали в ходе фазы логарифмического роста из культуры ткани после легкой обработки трипсином с помощью трипсин-EDTA. Число жизнеспособных клеток посчитали и определили в гемоцитометре в присутствии трипанового синего (считали только жизнеспособные клетки). Каждую мышь инокулировали подкожно в правую боковую поверхность с помощью 0.1 мл инокулята 2×106 Mia-Paca-2 клеток, применяя 25 G иглу и мышь, (один инокулят на мышь). Объем опухоли контролировали дважды в неделю. Также производили измерения массы тела. Объем опухоли вычисляли, применяя формулу: объем опухоли = (длина×(ширина)2)/2.
Как только размер опухоли достиг 500-600 мм3, животным ввели PTX-PGGA-Гидротроп III при 100 мг/кг (IV, qd ×1). Плазму, опухоль и печень собрали в указанные моменты времени. Опухоль разрезали на две части, одну для измерения концентрации паклитиаксела при анализе фармакокинетики (PK), и другую для измерения биомеркера PD (фармакодинамики), включающего ацетилированный тубулин и Ki67. Один срез печени удалили из правой дозы печени для PK анализа. РТХ вычислили с помощью LC/MS/MS для анализа PK. Для анализа PD, ацетилированный тубулин оценили с применением способа ELISA. Кратко, образцы опухолей разрушают, применяя лизисный буфер для ткани (Cat: FNN0071, Life Technology) согласно инструкциям производителя, и далее определяется количество рассматриваемого белка. Экспрессия ацетилированного тобулина исследовалась с применением способа ELISA (Cat: 7204, Cell Signaling). Для PD биомаркеа Ki67, получение образца является таким же, как описано выше. Экспрессию Ki67 измерили с применением способа ELISA (#CSB-E 16294).
Результаты показаны на Фиг. 3 и 4. Так как для PK профиля опухоли PTX-PGGA-Гидротроп III продемонстрироавл трехкратное увеличение Сmax и AUC (0-168 ч) по сравнению с Abraxane® в опухоли, показывая, что более желаемая аккумуляция опухоли достигается PTX-PGGA-Гидротропом III. Однако никакого существенного различия не достигалось для PK профилей в плазме и печени между PTX-PGGA-Гидротропом III и Abraxane®. Так как для PD уровень ацетилированного тубулина сначала увеличился, но затем вернулся назад в течение 24 часов. Это очень хорошо согласуется с PK данными. Кроме того, экспрессию Ki67 также контролировали в качестве второго биомаркера для подтверждения PD данных. Уровень Ki67 падает до ниже 40% в течение 4 часов и составляет около 40% в ходе оставшейся части эксперимента. Это также отлично соответствует PK данным.
Пример 8: Оценка токсичности
Голых мышей Balb/C как женского, так и мужского пола в возрасте 7-8 недель приобрели у Charles River. Животных содержали и поддерживали в контролируемой среде, и все процедуры осуществляли в соответствии с Nitto NDT и UCSD IACUC правилами. После алиматизации в течение 5 дней животным ввели PTX-PGGA-Гидротроп III при 20, 30 и 40 мг на кг, (IV, qd ×5). Клинические наблюдения у клетки производили дважды в день, и ежедневно измеряли массу тела. Через 48 ч после введения дозы, взяли образцы крови и применяли для анализа гематологических параметров, включая развернутый анализ крови (СВС), определение лейкоцитарной формулы, а также подсчет количества тромбоцитов и ретикулоцита. Данные обработали с помощью Prism Graphpad.
Результат показан на Фиг. 5. PTX-PGGA-Гидротроп III показал слегка более хорошую переносимость, чем Abraxane®, с точки зрения токсичности при одном и том же уровне дозы. Разницы в токсичности не наблюдалось.
Результаты, описанные в Примерах, показывают следующее:
(i) Композиция, описанная в настоящей заявке, статистически является значительно более эффективной, чем Abraxane® в NCI-H460 ксенотрансплантат рака легкого при таком же уровне дозы. Дозы хорошо переносились животными с точки зрения потери массы тела и смертности. В дополнение к NCI-H460, композиция, описанная в настоящей заявке, также показывает значительную эффективность в различных моделях опухоли, включая рак поджелудочной железы и рак молочной железы.
(ii) Улучшенная эффективность вероятно объясняется ее превосходным фармакокинетическим профилем в плазме и опухоли. Композиция, описанная в настоящей заявке, не только усиливает стабильность циркуляции по сравнению с Abraxane®, но также предпочтительно доставляет паклитиаксел при трехкратном увеличении Cmax и AUC (0-168 ч) по сравнению с Abraxane®. Необходимо отметить, что эти результаты также находятся в соответствии с полученными из фармакодинамических анализов изменения полимеризации тубулина и результатом ингибирования пролиферации опухолевых клеток. Наблюдается сильная корреляция между PK и PD опухоли.
(iii) Композиция, описанная в настоящей заявке, также показала слегка более хорошую гематологическую токсичность, чем Abraxane®.
(iv) Взятые вместе, эти преклинические данные несомненно показывают, что композиция, описанная в настоящей заявке, имеют патенциал для более эффективной наномедицины на основе таксана, лучше, чем у Abraxane®.
Специалисту в данной области техники очевидно, что многочисленные и различные модификации могут быть сделаны, не выходя за рамки настоящего изобретения. Поэтому, совершенно ясно, что формы настоящего изобретения только проиллюстрированы и не ограничивают объем настоящего изобретения.
Реферат
Изобретение относится к конъюгату полимера, к полимерной мицелле, образованной конъюгатом полимера, к терапевтической композиции, предназначенной для лечения рака, а также к способу лечения заболевания или состояния, которым является рак. Конъюгат полимера содержит основную цепь, представляющую собой анионный полимер, и гидрофобные составляющие, ковалентно присоединенные к основной цепи полимера. Конъюгат полимера имеет следующую формулу (I):,где М независимо выбирается из группы, состоящей из гидрофобной составляющей и катиона; гидрофобная составляющая независимо выбирается из:илиГидрофобная составляющая составляет 20-50 мол. % от общего количества М; катион независимо выбирается из водорода, аммиака или щелочного металла; X представляет собой О. Терапевтическая композиция для лечения рака содержит носитель, состоящий из вышеуказанного конъюгата полимера, и гидрофобное соединение, функционально связанное с носителем. Гидрофобным лекарственным средством является противораковое лекарственное средство. Способ лечения рака заключается в том, что субъекту вводят эффективное количество вышеуказанной терапевтической композиции. Изобретение позволяет получить стабильные полимерные мицеллы, повысить терапевтический эффект и улучшить состояние больного. 4 н. и 2 з.п. ф-лы, 6 ил., 2 табл., 8 пр.
Формула




Комментарии