Направляемый олигонуклеотидами и отслеживаемый комбинаторный синтез кодируемых молекул-зондов - RU2769571C9
Код документа: RU2769571C9
Чертежи


Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА
Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №62/351,046, поданной 16 июня 2017 года, которая полностью включена в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0001] В рамках настоящего изобретения предложены мультифункциональные молекулы и способы получения и применения таких мультифункциональных молекул. В настоящем изобретении также предложены способы применения указанных мультифункциональных молекул для идентификации кодируемых молекул, способных к связыванию с молекулами-мишенями или обладающих другими желательными свойствами, такими как селективность в отношении молекулы-мишени или способность проникать в клетки.
УРОВЕНЬ ТЕХНИКИ
[0002] По сути, существует три пути, с помощью которых обнаруживают молекулы с желаемыми функциями, такие как, например, лекарственные препараты. Такие молекулы обнаруживают в природе, создают посредством рационального дизайна и находят методом проб и ошибок. Во многих случаях метод проб и ошибок, вероятно, является наиболее многообещающим, однако он может быть чрезвычайно неэффективным. Главное условие для того, чтобы метод проб и ошибок стал более эффективным, заключается в создании комбинаторных библиотек молекул, которые можно синтезировать в огромном количестве и исследовать в отношении наличия желаемых свойств. Потребность в эффективном обнаружении новых молекул посредством проб и ошибок дала начало области комбинаторной химии.
[0003] При синтезе и исследовании комбинаторных библиотек существует три основные проблемы. Во-первых, множество способов получения молекул-зондов из комбинаторных библиотек ограничено типами и числом последовательных химических субъединиц или структурных блоков, которые могут быть собраны. Во-вторых, множество способов сборки последовательных структурных блоков ограничено эффективностью реакций каждой стадии. В-третьих, следует понимать, что для сохранения эффективности огромное количество молекул-зондов должно быть проанализировано одновременно в отношении наличия желаемых свойств. Также следует понимать, что библиотеки с достаточным разнообразием молекулярных форм могут содержать лишь несколько копий любой отдельно взятой молекулы. Низкое число копий делает невозможной идентификацию молекул-зондов, обладающих желаемыми свойствами. Вследствие этого каждая молекула-зонд должна быть помечена уникальным идентификатором, чтобы исследователи могли идентифицировать желаемые молекулы-зонды.
[0004] Для решения некоторых из данных проблем исследователи разработали кодируемые ДНК молекулы-зонды. Некоторые исследователи применяли олигонуклеотиды ДНК в качестве матриц для того, чтобы направить одну или несколько стадий комбинаторного синтеза. Другие применяли олигонуклеотиды ДНК для отслеживания комбинаторного синтеза и для уникального мечения молекул-зондов, чтобы молекулярные зонды, которые остаются связанными с молекулой-мишенью, можно было идентифицировать, применив амплификацию методом ПЦР (полимеразной цепной реакции). Третьи исследователи применяли олигонуклеотиды ДНК чтобы направлять одну или несколько стадий комбинаторного синтеза и для мечения молекулы-зонда уникальным идентификатором.
[0005] Несмотря на успехи, достигнутые путем применения многих из указанных подходов, все еще сохраняются некоторые проблемы. Существующие способы все еще страдают от низкой эффективности последовательных стадий реакции для синтеза молекул-зондов. В рамках существующих способов также с трудом поддаются обнаружению молекулы-зонды, которые прочно связываются с молекулами-мишенями, но присутствуют в малых количествах. Данная трудность может привести к ложноотрицательным результатам. Существует потребность в способе получения олигонуклеотидных молекул-зондов, который увеличивал бы реакционную эффективность последовательных стадий реакции. Также существует потребность в возможности идентифицировать молекулы-зонды, которые связываются с молекулами-мишенями, даже если данные молекулы-зонды могут присутствовать в малых количествах.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0006] В рамках настоящего изобретения предложены кодируемые молекулы. Согласно определенным вариантам реализации кодируемые молекулы представляют собой молекулы согласно формуле (I),
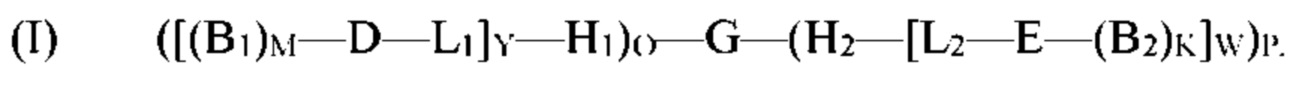
где
G представляет собой олигонуклеотид, причем указанный олигонуклеотид содержит по меньшей мере два кодирующих участка и по меньшей мере один концевой кодирующий участок, причем по меньшей мере два кодирующих участка являются одноцепочечными, и по меньшей мере один концевой кодирующий участок является одно- или двухцепочечным;
H1 представляет собой шпилечную структуру, содержащую олигонуклеотиды, причем H1 заканчивается на 5'-конце и присоединен к концу олигонуклеотида G;
H2 представляет собой шпилечную структуру, содержащую олигонуклеотиды, причем H2 заканчивается на 3'-конце и присоединен к концу олигонуклеотида G;
D представляет собой первый структурный блок;
Е представляет собой второй структурный блок, причем D и Е являются одинаковыми или различными;
B1 представляет собой позиционный структурный блок, и М представляет собой целое число от 1 до 20;
B2 представляет собой позиционный структурный блок, и K представляет собой целое число от 1 до 20, причем B1 и B2 являются одинаковыми или различными, причем М и K являются одинаковыми или различными;
L1 представляет собой линкер, который функционально связывает H1 с D;
L2 представляет собой линкер, который функционально связывает H2 с Е;
О представляет собой целое число от ноля до 1;
Р представляет собой целое число от ноля до 1;
при условии, что по меньшей мере один из О и Р представляет собой 1;
Y представляет собой целое число от 1 до 5;
W представляет собой целое число от 1 до 5; и
причем по меньшей мере один из каждого позиционного структурного блока B1 в положении М и B2 в положении K определен одним из кодирующих участков, и причем по меньшей мере один из первого структурного блока D и второго структурного блока Е определен по меньшей мере одним концевым кодирующим участком.
[0007] Согласно определенным вариантам реализации молекулы формулы (I) G содержит последовательность, представленную формулой (CN-(ZN-CN+1)A), где С представляет собой кодирующий участок, Z представляет собой некодирующий участок, N представляет собой целое число от 1 до 20, и А представляет собой целое число от 1 до 20; причем каждый некодирующий участок содержит от 4 до 50 нуклеотидов и необязательно является двухцепочечным. Согласно определенным вариантам реализации молекулы формулы (I) один из О или Р представляет собой ноль. Согласно определенным вариантам реализации молекулы формулы (I) по меньшей мере один из Y и W представляет собой целое число от 1 до 2. Согласно определенным вариантам реализации молекулы формулы (I) каждый кодирующий участок содержит от 6 до 50 нуклеотидов. Согласно определенным вариантам реализации молекулы формулы (I) по меньшей мере один из H1 и H2 содержит от 20 до 90 нуклеотидов. Согласно определенным вариантам реализации молекулы формулы (I) каждый кодирующий участок содержит от 12 до 40 нуклеотидов. Согласно определенным вариантам реализации молекулы формулы (I) Р представляет собой ноль, Y представляет собой целое число от 1 до 2, и каждый кодирующий участок содержит от 12 до 40 нуклеотидов. Согласно определенным вариантам реализации молекулы формулы (I) О представляет собой ноль, W представляет собой целое число от 1 до 2, и каждый кодирующий участок содержит от 12 до 40 нуклеотидов.
[0008] Настоящее изобретение относится к способу идентификации молекул-зондов, способных к связыванию или отбору молекулы-мишени, причем указанный способ включает осуществление взаимодействия молекулы-мишени с пулом молекул-зондов, причем молекулы-зонды соответствуют формуле (I) выше, удаление по меньшей мере одной молекулы-зонда, которая не связывается с молекулой-мишенью, амплификацию по меньшей мере одного олигонуклеотида G из по меньшей мере одной молекулы-зонда, которая не была удалена от молекулы-мишени, для образования копии последовательности, секвенирование по меньшей мере одного олигонуклеотида G копии последовательности для идентификации по меньшей мере двух кодирующих участков молекулы-зонда с целью последующей идентификации по меньшей мере одного из каждого позиционного структурного блока B1 в положении М и B2 в положении K, и для идентификации по меньшей мере одного концевого кодирующего участка молекулы-копии с целью последующей идентификации по меньшей мере одного из первого структурного блока D и второго структурного блока Е молекулы-зонда.
[0009] В рамках настоящего изобретения предложен способ получения молекулы формулы (I). Согласно определенным вариантам реализации способ получения молекулы формулы (I) включает:
обеспечение по меньшей мере одной гибридизационной матрицы, причем по меньшей мере одна гибридизационная матрица содержит по меньшей мере один одноцепочечный олигомер-антикодон, иммобилизированный на по меньшей мере одной гибридизационной матрице, причем по меньшей мере один одноцепочечный олигомер-антикодон, иммобилизированный на по меньшей мере одной гибридизационной матрице, способен к гибридизации с кодирующим участком молекулы формулы (II):
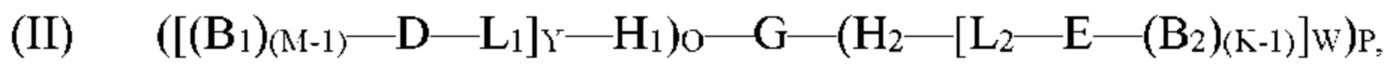
где
G представляет собой олигонуклеотид, причем указанный олигонуклеотид содержит по меньшей мере два кодирующих участка и по меньшей мере один концевой кодирующий участок, причем по меньшей мере два кодирующих участка являются одноцепочечными, и по меньшей мере один концевой кодирующий участок является одно- или двухцепочечным;
H1 представляет собой шпилечную структуру, содержащую олигонуклеотиды, причем H1 заканчивается на 5'-конце и присоединен к концу олигонуклеотида G;
H2 представляет собой шпилечную структуру, содержащую олигонуклеотиды, причем H2 заканчивается на 3'-конце и присоединен к концу олигонуклеотида G;
D представляет собой первый структурный блок;
Е представляет собой второй структурный блок, причем D и Е являются одинаковыми или различными;
B1 представляет собой позиционный структурный блок, и М представляет собой целое число от 1 до 20;
B2 представляет собой позиционный структурный блок, и K представляет собой целое число от 1 до 20, причем B1 и B2 являются одинаковыми или различными, причем М и K являются одинаковыми или различными;
L1 представляет собой линкер, который функционально связывает H1 с D;
L2 представляет собой линкер, который функционально связывает H2 с Е;
О представляет собой целое число от ноля до 1;
Р представляет собой целое число от ноля до 1;
при условии, что по меньшей мере один из О и Р представляет собой 1;
Y представляет собой целое число от 1 до 5;
W представляет собой целое число от 1 до 5; и
причем по меньшей мере один из каждого позиционного структурного блока B1 в положении М и B2 в положении K определен одним из кодирующих участков, и причем по меньшей мере один из первого структурного блока D и второго структурного блока Е определен по меньшей мере одним концевым кодирующим участком;
сортировку пула молекул формулы (II) на подпулы посредством гибридизации кодирующего участка подпула молекул формулы (II) с по меньшей мере одним одноцепочечным олигомером-антикодоном, иммобилизированным на по меньшей мере одной гибридизационной матрице;
стадию необязательного высвобождения подпула молекул формулы (II) с по меньшей мере одной гибридизационной матрицы в отдельные контейнеры;
обеспечение по меньшей мере одного из структурного блока B1 и B2; и
осуществление реакции по меньшей мере одного из структурного блока B1 и B2 с молекулой формулы (II) для образования подпула молекул формулы (I):
(I) ([(B1)M-D-L1]Y-H1)O-G-(H2-[L2-E-(B2)K]W)P,
где
G представляет собой олигонуклеотид, причем указанный олигонуклеотид содержит по меньшей мере два кодирующих участка и по меньшей мере один концевой кодирующий участок, причем каждый кодирующий участок является одноцепочечным, и по меньшей мере один концевой кодирующий участок является одно- или двухцепочечным;
H1 представляет собой шпилечную структуру, содержащую олигонуклеотиды, причем H1 заканчивается на 5'-конце и присоединен к концу олигонуклеотида G;
H2 представляет собой шпилечную структуру, содержащую олигонуклеотиды, причем H2 заканчивается на 3'-конце и присоединен к концу олигонуклеотида G;
D представляет собой первый структурный блок;
Е представляет собой второй структурный блок, причем D и Е являются одинаковыми или различными;
B1 представляет собой позиционный структурный блок, и М представляет собой целое число от 1 до 20;
B2 представляет собой позиционный структурный блок, и K представляет собой целое число от 1 до 20, причем B1 и В2 являются одинаковыми или различными, причем М и K являются одинаковыми или различными;
L1 представляет собой линкер, который функционально связывает H1 с D;
L2 представляет собой линкер, который функционально связывает H2 с Е;
О представляет собой целое число от ноля до 1;
Р представляет собой целое число от ноля до 1;
при условии, что по меньшей мере один из О и Р представляет собой 1;
Y представляет собой целое число от 1 до 5;
W представляет собой целое число от 1 до 5; и
причем по меньшей мере один из каждого позиционного структурного блока В1 в положении М и B2 в положении K определен одним из кодирующих участков, и причем по меньшей мере один из первого структурного блока D и второго структурного блока Е определен по меньшей мере одним концевым кодирующим участком.
[0010] Согласно определенным вариантам реализации способа получения молекулы формулы (I) молекулу формулы (II) получают посредством:
обеспечения пула олигонуклеотидов, причем олигонуклеотиды G' содержат по меньшей мере два кодирующих участка и по меньшей мере один концевой кодирующий участок, причем по меньшей мере два кодирующих участка являются одноцепочечными, по меньшей мере один концевой кодирующий участок является одноцепочечным, и по меньшей мере один концевой кодирующий участок на 5'- и/или 3'-конце олигонуклеотидов G' является отличным;
обеспечения по меньшей мере одного нагруженного антикодона-носителя, причем по меньшей мере один нагруженный антикодон-носитель соответствует формуле ([(B1)(M-1)-D-L1]Y-H1) и/или (Н2-[L2-Е-(B2)(K-1)]W);
объединения пула олигонуклеотидов G' и по меньшей мере одного нагруженного антикодона-носителя;
образования связи 5'-конца по меньшей мере одного олигонуклеотида G' с 3'-концом H1 и/или образования связи 3'-конца по меньшей мере одного олигонуклеотида G' с 5'-концом H2 для получения пула молекул формулы (II):
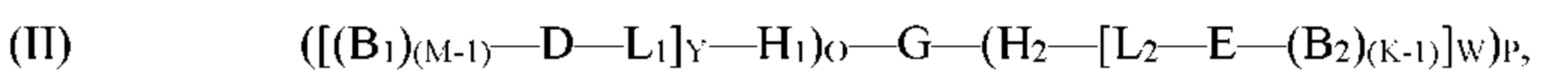
где G, H1, H2, D, Е, B1, B2, L1, L2, О, Р, Y и W являются такими, как определено в формуле (I) выше, и М и K представляют собой единицу.
[0011] Согласно определенным вариантам реализации способа получения молекулы формулы (I) способ также включает удаление части олигонуклеотида из по меньшей мере одного концевого кодирующего участка молекулы формулы (I) или (II). Согласно определенным вариантам реализации способа получения молекулы формулы (I) способ также включает лигирование по меньшей мере одного из H1 с G и H2 с G. Согласно определенным вариантам реализации способа получения молекулы формулы (I) G содержит последовательность, представленную формулой (CN-(ZN-CN+1)A), где С представляет собой кодирующий участок, Z представляет собой некодирующий участок, N представляет собой целое число от 1 до 20, и А представляет собой целое число от 1 до 20; причем каждый некодирующий участок содержит от 4 до 50 нуклеотидов и необязательно является двухцепочечным. Согласно определенным вариантам реализации способа получения молекулы формулы (I) один из О или Р представляет собой ноль. Согласно определенным вариантам реализации способа получения молекулы формулы (I) по меньшей мере один из Y и W представляет собой целое число от 1 до 2. Согласно определенным вариантам реализации способа получения молекулы формулы (I) по меньшей мере один из H1 и H2 содержит от 20 до 90 нуклеотидов. Согласно определенным вариантам реализации способа получения молекулы формулы (I) Р представляет собой ноль, Y представляет собой целое число от 1 до 2, и каждый кодирующий участок содержит от 12 до 40 нуклеотидов; или О представляет собой ноль, W представляет собой целое число от 1 до 2, и каждый кодирующий участок содержит от 12 до 40 нуклеотидов.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0012] Приведенное выше краткое описание, а также последующее подробное описание вариантов реализации, легче понять при прочтении в сочетании с прилагаемыми чертежами. С целью иллюстрации на чертежах представлены некоторые варианты реализации, которые могут являться предпочтительными. Следует понимать, что описываемые варианты реализации не ограничены представленными конкретными деталями.
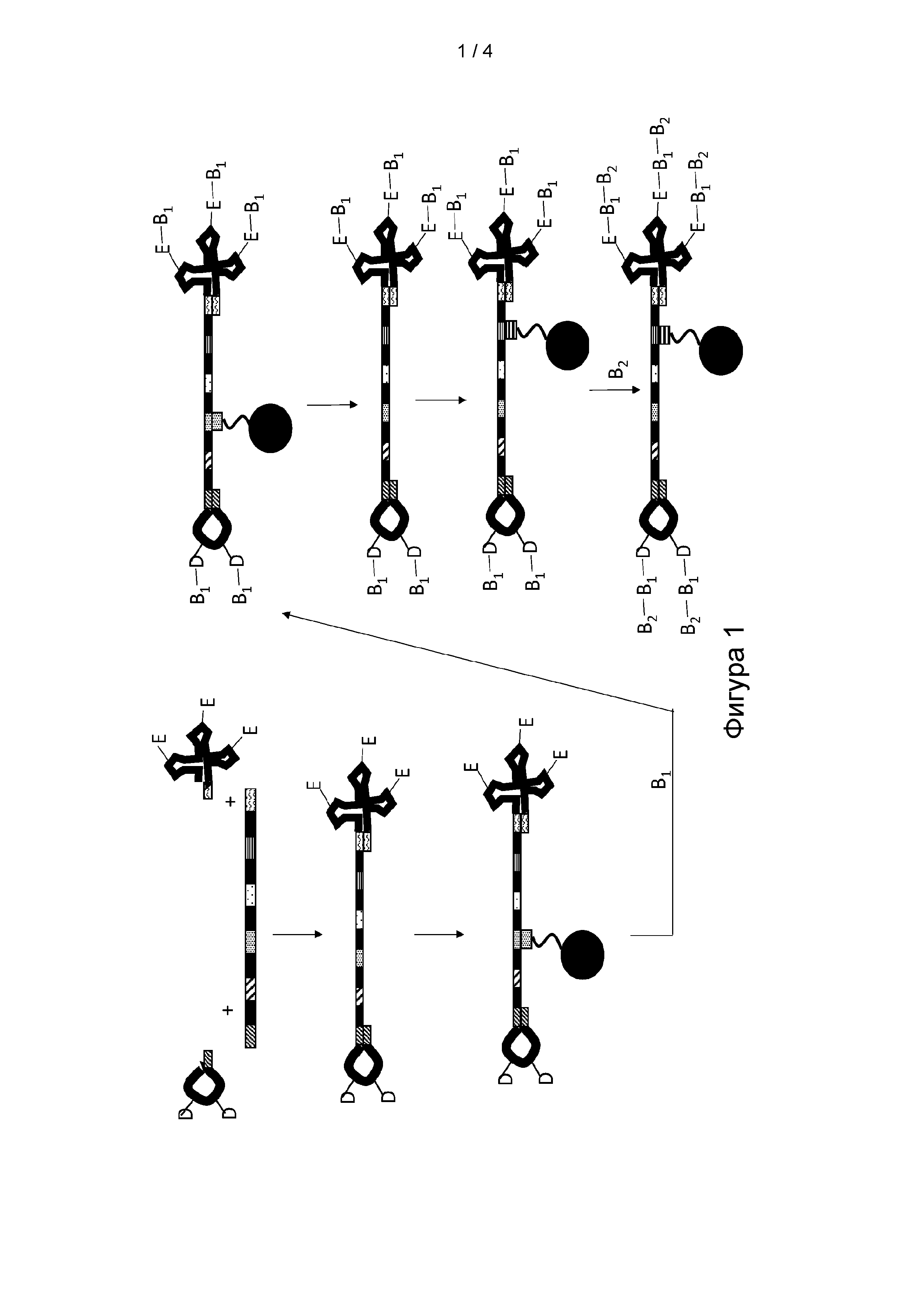
[0013] ФИГ. 1 представляет собой иллюстрацию варианта реализации способа получения мультифункциональной молекулы.
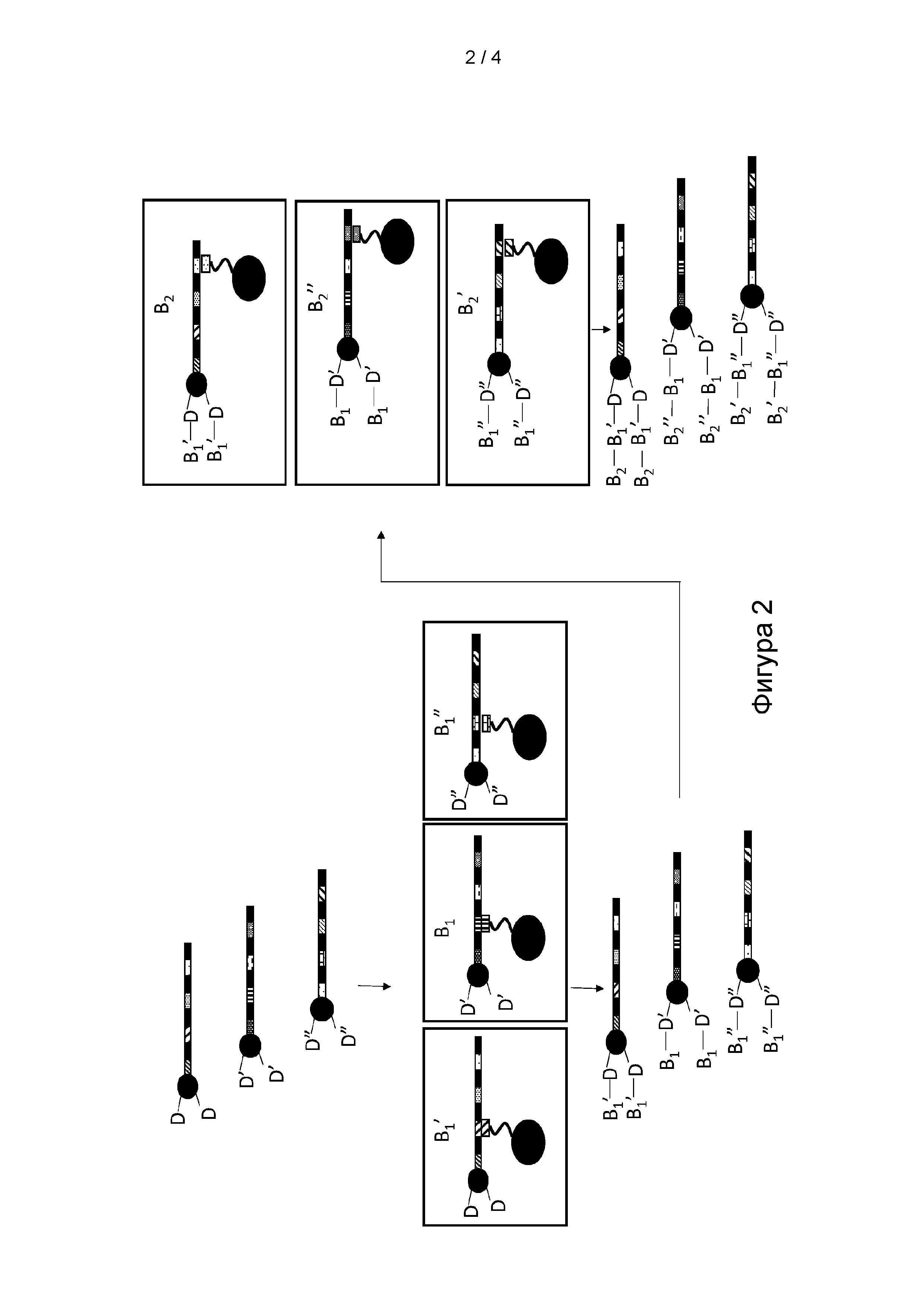
[0014] ФИГ. 2 представляет собой иллюстрацию варианта реализации способа получения множества мультифункциональных молекул.
[0015] ФИГ. 3 представляет собой блок-схему, которая иллюстрирует вариант реализации способа получения молекулы формулы (I).
[0016] ФИГ. 4 представляет собой блок-схему, которая иллюстрирует вариант реализации способа получения молекулы формулы (I).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0017] Если не указано обратное, все результаты измерений приведены в стандартных метрических единицах.
[0018] Если не указано обратное, все случаи упоминания объектов в единственном числе могут относиться к одному или более чем одному из указанных объектов.
[0019] Если не указано обратное, фраза «по меньшей мере один из» означает один или более одного из объектов. Например, «по меньшей мере один из H1 и H2» означает H1, H2 или как H1, так и H2.
[0020] Если не указано обратное, термин «приблизительно» означает ±10% от приведенного непроцентного числа и округляется до ближайшего целого числа. Например, «приблизительно 100 мм» будет включать от 90 до 110 мм. Если не указано обратное, термин «приблизительно» означает ±5% от процентного числа. Например, «приблизительно 20%» будет включать от 15 до 25%. Когда термин «приблизительно» используется применительно к диапазону, тогда данный термин означает соответствующее количество, меньшее, чем нижняя граница, и большее, чем верхняя граница. Например, «от приблизительно 100 до приблизительно 200 мм» будет включать от 90 до 220 мм.
[0021] Если не указано обратное, термин «гибридизировать», «гибридизация» и «гибридизированный» включает спаривание оснований согласно принципу Уотсона-Крика, которое включает спаривание гуанин-цитозин и аденин-тимин (G-C и А-Т) для ДНК и спаривание гуанин-цитозин и аденин-урацил (G-C и A-U) для РНК. Данные термины используют в контексте селективного распознавания цепи нуклеотидов в отношении комплементарной цепи нуклеотидов, называемой антикодоном или антикодирующим участком.
[0022] Фразы «селективно гибридизировать», «селективная гибридизация» и «селективный сортинг» означают селективность, составляющую от 5:1 до 100:1 или более комплементарной цепи относительно некомплементарной цепи.
[0023] Термин «мультифункциональная молекула» означает молекулу согласно настоящему изобретению, которая содержит олигонуклеотид и по меньшей мере одну кодируемую часть.
[0024] Термин «кодируемая часть» означает одну или несколько частей мультифункциональной молекулы, которые содержат исключительно структурные блоки, такие как первый структурный блок, второй структурный блок и позиционные структурные блоки B1 и B2. Термин «кодируемая часть» не включает шпилечную структуру или линкер даже несмотря на то, что данные структуры могут быть добавлены как часть процесса синтеза кодируемой части.
[0025] Термин «кодируемая молекула» означает молекулу, которая может быть получена или которая была получена, когда кодируемая часть мультифункциональной молекулы была удалена или отделена от оставшейся мультифункциональной молекулы.
[0026] Термин «молекула-зонд» означает молекулу, которую применяют для определения того, какая кодируемая часть мультифункциональной молекулы или кодируемая молекула способна к связыванию с молекулой-мишенью или к отбору желаемых свойств, таких как селективность в отношении молекулы-мишени или способность проникать в клетки.
[0027] Термин «молекула-мишень» означает молекулу или структуру. Например, структуры включают мультимакромолекулярные комплексы, такие как рибосомы и липосомы.
[0028] Термин «молекула-зонд» может включать мультифункциональную молекулу.
[0029] Термин «кодируемая молекула-зонд» используется взаимозаменяемо с термином «мультифункциональная молекула».
[0030] Термин «полидисплей» означает мультифункциональную молекулу, содержащую по меньшей мере две кодируемые части.
[0031] В настоящем изобретении дефис или тире в молекулярной формуле показывают, что части формулы напрямую соединены друг с другом посредством ковалентной связи или гибридизации.
[0032] Если не указано обратное, все диапазоны нуклеотидов и целочисленные значения включают все промежуточные целые числа, а также конечные точки. Например, диапазон от 5 до 10 олигонуклеотидов следует понимать как включающий 5, 6, 7, 8, 9 и 10 нуклеотидов.
[0033] Согласно определенным вариантам реализации настоящее изобретение относится к мультифункциональным молекулам, которые содержат по меньшей мере одну олигонуклеотидную часть и по меньшей мере одну кодируемую часть, причем часть олигонуклеотида направляет или кодирует синтез по меньшей мере одной кодируемой части с применением комбинаторной химии. Согласно определенным вариантам реализации часть олигонуклеотида мультифункциональной молекулы может определять по меньшей мере одну кодируемую часть мультифункциональной молекулы. Согласно определенным вариантам реализации мультифункциональные молекулы содержат шпилечные структуры, присоединенные к по меньшей мере одному концу мультифункциональной молекулы, причем шпилечная структура обеспечивает полидисплей множества кодируемых частей мультифункциональной молекулы. Не опираясь на какую-либо теорию, считают, что полидисплей множества кодируемых частей позволяет более эффективно проводить отбор мультифункциональной молекулы согласно настоящему изобретению как обладающей желаемым свойством, даже если мультифункциональная молекула может присутствовать в низком количестве, низкой концентрации, низкой относительной концентрации относительно других молекул-зондов или характеризуется меньшими степенями желаемого свойства. Согласно определенным вариантам реализации мультифункциональная молекула согласно настоящему изобретению содержит по меньшей мере один олигонуклеотид или часть олигонуклеотида, которые содержат по меньшей мере два кодирующих участка и по меньшей мере один концевой кодирующий участок, причем по меньшей мере два кодирующих участка и по меньшей мере один концевой кодирующий участок соответствуют и могут быть использованы для идентификации последовательности структурных блоков в кодируемой части. Согласно определенным вариантам реализации по меньшей мере один олигонуклеотид или часть олигонуклеотида можно амплифицировать методом ПЦР для получения копий по меньшей мере одного олигонуклеотида или части олигонуклеотида, и оригинал или копии можно секвенировать для определения идентичности по меньшей мере двух кодирующих участков и по меньшей мере одного концевого кодирующего участка мультифункциональной молекулы. Согласно определенным вариантам реализации идентичность по меньшей мере двух кодирующих участков и по меньшей мере одного концевого кодирующего участка можно соотнести с серией стадий комбинаторной химии, применяемых для синтеза кодируемой части мультифункциональной молекулы, которой соответствует ПЦР-копия.
[0034] Согласно определенным вариантам реализации настоящее изобретение также относится к способам получения мультифункциональных молекул и к способам осуществления воздействия на молекулы-мишени мультифункциональных молекул для определения того, какая кодируемая часть и вследствие этого - какая кодируемая молекула демонстрируют желаемое свойство, включая, без ограничения, способность к связыванию с молекулой- или молекулами-мишенями, к не связыванию с другими нецелевыми молекулами, способность являться устойчивыми к химическим изменениям, осуществляемым ферментами, способность с легкостью химически изменяться под действием ферментов, способность характеризоваться степенями растворимости в воде и обладать способностью проникать в клетки.
[0035] Согласно определенным вариантам реализации молекула формулы (I) представляет собой мультифункциональную молекулу. Согласно определенным вариантам реализации молекулы формулы (I) G представляет собой олигонуклеотид, который направлен или отобран для синтеза кодируемой части. Согласно определенным вариантам реализации молекулы формулы (I) каждый из (B1)M-D и Е-(B2)K представляет собой кодируемую часть. Согласно определенным вариантам реализации молекулы формулы (I) молекула содержит олигонуклеотидную часть и по меньшей мере одну кодируемую часть. Подразумевается, что множество из структурных свойств олигонуклеотида G обсуждаются в настоящем документе применительно к их способности направлять или кодировать синтез по меньшей мере одной кодируемой части молекулы формулы (I). Подразумевается, что множество из структурных свойств олигонуклеотида G молекулы формулы (I) обсуждаются в настоящем документе применительно к способности олигонуклеотида G или его ПЦР-копии определять стадии синтеза, применяемые для получения молекулы формулы (I), и вследствие этого последовательности и/или идентичность структурных блоков и химических реакций, применяемых для получения кодируемых частей молекулы формулы (I).
[0036] Согласно определенным вариантам реализации молекулы формулы (I) G включает или представляет собой олигонуклеотид. Согласно определенным вариантам реализации олигонуклеотид содержит по меньшей мере два кодирующих участка, причем от приблизительно 1% до приблизительно 100%, включая от приблизительно 50% до приблизительно 100%, включая от приблизительно 90% до приблизительно 100% кодирующих участков, являются одноцепочечными. Согласно определенным вариантам реализации олигонуклеотид G содержит по меньшей мере один концевой кодирующий участок, причем один или два из концевых кодирующих участков являются одноцепочечными. Согласно определенным вариантам реализации олигонуклеотид G содержит по меньшей мере один концевой кодирующий участок, причем один или два из концевых кодирующих участков являются двухцепочечными.
[0037] Согласно определенным вариантам реализации молекулы формулы (I) олигонуклеотид G содержит по меньшей мере два кодирующих участка, включая от 2 до приблизительно 21 кодирующих участков, включая от 3 до 10 кодирующих участков, включая от 3 до 5 кодирующих участков. Согласно определенным вариантам реализации, если число кодирующих участков опускается ниже 2, тогда число возможных кодируемых частей, которые могут быть синтезированы, становится слишком маленьким, чтобы применяться на практике. Согласно определенным вариантам реализации, если число кодирующих участков превышает 20, тогда синтетическая неэффективность препятствует точному синтезу.
[0038] Согласно определенным вариантам реализации молекулы формулы (I) по меньшей мере два кодирующих участка содержат от приблизительно 6 до приблизительно 50 нуклеотидов, включая от приблизительно 12 до приблизительно 40 нуклеотидов, включая от приблизительно 8 до приблизительно 30 нуклеотидов. Согласно определенным вариантам реализации, если кодирующий участок содержит менее приблизительно 6 нуклеотидов, тогда кодирующий участок не может точно направлять синтез кодируемой части. Согласно определенным вариантам реализации, если кодирующий участок содержит более приблизительно 50 нуклеотидов, тогда кодирующий участок может стать перекрестно-реактивным. Такая перекрестная реактивность будет препятствовать способности кодирующих участков точно направлять и определять стадии синтеза, применяемые для синтеза кодируемой части молекулы формулы (I).
[0039] Согласно определенным вариантам реализации молекулы формулы (I) функция олигонуклеотида G заключается в направлении синтеза по меньшей мере одной кодируемой части молекулы формулы (I) посредством селективной гибридизации с комплементарной антикодирующей цепью. Согласно определенным вариантам реализации кодирующие участки являются одноцепочечными для способствования гибридизации с комплементарной цепью. Согласно определенным вариантам реализации от 70% до 100%, включая от 80% до 99%, включая от 80 до 95%, кодирующих участков являются одноцепочечными. Подразумевается, что комплементарная цепь для кодирующего участка, в случае наличия, может быть добавлена после стадий кодирования кодируемой части молекулы формулы (I) в течение синтеза.
[0040] Согласно определенным вариантам реализации олигонуклеотид может содержать природные и неприродные нуклеотиды. Подходящие нуклеотиды включают природные нуклеотиды ДНК (дезоксирибонуклеиновой кислоты), включая аденин (А), гуанин (G), цитозин (С) и тимин (Т), и природные нуклеотиды РНК (рибонуклеиновой кислоты): аденин (А), урацил (U), гуанин (G) и цитозин (С). Другие подходящие основания включают природные основания, такие как дезоксиаденозин, дезокситимидин, дезоксигуанозин, дезоксицитидин, инозин, диаминопурин; аналоги оснований, такие как 2-аминоаденозин, 2-тиотимидин, инозин, пирроло-пиримидин, 3-метиладенозин, С5-пропинилцитидин, С5-пропинилуридин, С5-бромуридин, С5-фторуридин, С5-иодуридин, С5-метилцитидин, 7-деазааденозин, 7-деазагуанозин, 8-оксоаденозин, 8-оксогуанозин, O(6)-метилгуанин, 4-((3-(2-(2-(3-аминопропокси)этокси)этокси)пропил)амино)пиримидин-2(1Н)-он, 4-амино-5-(гепта-1,5-диин-1-ил)пиримидин-2(1Н)-он, 6-метил-3,7-дигидро-2Н-пирроло[2,3-d]пиримидин-2-он, 3H-бензо[b]пиримидо[4,5-е][1,4]оксазин-2(10Н)-он и 2-тиоцитидин; модифицированные нуклеотиды, такие как 2'-замещенные нуклеотиды, включая 2'-O-метилированные основания и 2'-фтор-основания; и модифицированные сахара, такие как 2'-фторрибоза, рибоза, 2'-дезоксирибоза, арабиноза и гексоза; и/или модифицированные фосфатные группы, такие как фосфотиоатные и 5'-N-фосфорамидитные связи. Подразумевается, что олигонуклеотид представляет собой полимер нуклеотидов. Термины «полимер» и «олигомер» используются в настоящем документе взаимозаменяемо. Согласно определенным вариантам реализации олигонуклеотид не должен содержать непрерывные основания. Согласно определенным вариантам реализации олигонуклеотид может перемежаться линкерными фрагментами или ненуклеотидными молекулами.
[0041] Согласно определенным вариантам реализации молекулы формулы (I) олигонуклеотид G содержит от приблизительно 60% до 100%, включая от приблизительно 80% до 99%, включая от приблизительно 80% до 95%, нуклеотидов ДНК. Согласно определенным вариантам реализации олигонуклеотид содержит от приблизительно 60% до 100%, включая от приблизительно 80% до 99%, включая от приблизительно 80% до 95%, нуклеотидов РНК.
[0042] Согласно определенным вариантам реализации молекулы формулы (I) олигонуклеотид G содержит по меньшей мере два кодирующих участка, причем по меньшей мере два из кодирующих участков перекрываются, чтобы быть одинаковыми по протяженности, при условии, что перекрывающиеся кодирующие участки характеризуются лишь приблизительно от 30% до 1% одинаковых нуклеотидов, включая приблизительно от 20% до 1%, включая приблизительно от 10% до 2%. Согласно определенным вариантам реализации молекулы формулы (I), исключая концевые кодирующие участки, олигонуклеотид G является на приблизительно от 40% до 100%, включая приблизительно от 60% до 100%, включая приблизительно от 80% до 100%, одноцепочечным. Согласно определенным вариантам реализации молекулы формулы (I) олигонуклеотид G содержит по меньшей мере два кодирующих участка, причем по меньшей мере два из кодирующих участков являются смежными. Согласно определенным вариантам реализации молекулы формулы (I) олигонуклеотид G содержит по меньшей мере два кодирующих участка, причем по меньшей мере два кодирующих участка разделены участками нуклеотидов, которые не направляют или записывают синтез кодируемой части молекулы формулы (I).
[0043] Термин «некодирующий участок», в случае наличия, означает участок олигонуклеотида, который либо не может гибридизироваться с комплементарной цепью нуклеотидов для направления синтеза кодируемой части молекулы формулы (I), либо не соответствует любому антикодирующему олигонуклеотиду, применяемому для сортировки молекул формулы (I) в течение синтеза. Согласно определенным вариантам реализации некодирующие участки являются необязательными. Согласно определенным вариантам реализации олигонуклеотид содержит от 1 до приблизительно 20 некодирующих участков, включая от 2 до приблизительно 9 некодирующих участков, включая от 2 до приблизительно 4 некодирующих участков. Согласно определенным вариантам реализации некодирующие участки содержат от приблизительно 4 до приблизительно 50 нуклеотидов, включая от приблизительно 12 до приблизительно 40 нуклеотидов и включая от приблизительно 8 до приблизительно 30 нуклеотидов.
[0044] Согласно определенным вариантам реализации молекулы формулы (I) одна из функций некодирующих участков заключается в разделении кодирующих участков во избежание или для снижения перекрестной гибридизации, поскольку перекрестная гибридизация будет препятствовать точному кодированию кодируемой части молекулы формулы (I). Согласно определенным вариантам реализации одна из функций некодирующих участков заключается в добавлении функциональности, помимо только гибридизации или кодирования, молекуле формулы (I). Согласно определенным вариантам реализации один или несколько из некодирующих участков могут представлять собой участок олигонуклеотида, модифицированный меткой, такой как флуоресцентная метка или радиоактивная метка. Такие метки могут способствовать визуализации или количественному определению молекул формулы (I). Согласно определенным вариантам реализации один или несколько из некодирующих участков модифицированы функциональной группой или присоединением, которые способствуют обработке. Согласно определенным вариантам реализации один или несколько из некодирующих участков являются двухцепочечными, что снижает перекрестную гибридизацию. Согласно определенным вариантам реализации подразумевается, что некодирующие участки являются необязательными. Согласно определенным вариантам реализации подходящие некодирующие участки не препятствуют ПЦР-амплификации олигонуклеотида.
[0045] Согласно определенным вариантам реализации один или несколько из кодирующих участков или концевых кодирующих участков могут представлять собой участок олигонуклеотида G, который модифицирован меткой, такой как флуоресцентная метка или радиоактивная метка. Такие метки могут способствовать визуализации или количественному определению молекул формулы (I). Согласно определенным вариантам реализации один или несколько кодирующих участков или концевых кодирующих участков модифицированы функциональной группой или присоединением, которые способствуют обработке.
[0046] Согласно определенным вариантам реализации молекулы формулы (I) G включает последовательность, представленную формулой (CN-(ZN-CN+1)A), где С представляет собой кодирующий участок, Z представляет собой некодирующий участок, N представляет собой целое число от 1 до 20, и А представляет собой целое число от 1 до 20. Согласно определенным вариантам реализации приблизительно от 70% до 100%, включая приблизительно от 80% до 99%, включая приблизительно от 80 до 95%, некодирующих участков содержат от 4 до 50 нуклеотидов. Согласно определенным вариантам реализации G включает приблизительно от 70% до 100%, включая приблизительно от 80% до 99%, включая приблизительно от 80% до 95%, некодирующих участков, которые являются двухцепочечными.
[0047] Согласно определенным вариантам реализации молекулы формулы (I) олигонуклеотид содержит по меньшей мере один, включая от одного до двух, концевых кодирующих участков. Согласно определенным вариантам реализации концевой кодирующий участок представляет собой последовательность нуклеотидов, которая не связана напрямую со шпилечной структурой и заканчивается на 5'-конце или 3'-конце. Согласно определенным вариантам реализации концевой кодирующий участок представляет собой последовательность нуклеотидов, которая связана напрямую со шпилечной структурой. Подразумевается, что олигонуклеотид будет иметь 5'- и 3'-направления, исходя из лежащей в основе ориентации нуклеотидов, даже если оба конца олигонуклеотида связаны шпилечными структурами.
[0048] Согласно определенным вариантам реализации одна из функций концевого кодирующего участка заключается в способствовании селективной гибридизации шпилечной структуры, содержащей комплементарную последовательность, с концом олигонуклеотида в течение синтеза молекулы формулы (I). Согласно определенным вариантам реализации концевой кодирующий участок содержит от приблизительно 6 до приблизительно 50 нуклеотидов, включая от приблизительно 12 до приблизительно 40 нуклеотидов и включая от приблизительно 8 до приблизительно 30 нуклеотидов. Согласно определенным вариантам реализации, если концевой кодирующий участок содержит менее приблизительно 6 нуклеотидов, тогда число доступных не перекрестно-реактивных последовательностей будет слишком низким, что будет препятствовать точному кодированию кодируемой части молекулы формулы (I). Согласно определенным вариантам реализации, если концевой кодирующий участок содержит более приблизительно 50 нуклеотидов, тогда концевой кодирующий участок может стать перекрестно-реактивным и утратить значительную часть специфичности для селективной гибридизации с исключительно одной шпилечной структурой. Такая перекрестная реактивность будет препятствовать способности кодирующих участков точно кодировать добавление первого структурного блока D и/или второго структурного блока Е. Согласно определенным вариантам реализации молекулы формулы (I) концевой кодирующий участок является одно- или двухцепочечным.
[0049] Согласно определенным вариантам реализации молекулы формулы (I) H1 и H2 каждый независимо представляет собой шпилечные структуры. Термин «шпилечная структура» в настоящем изобретении означает молекулярную структуру, которая содержит от 60% до 100% массовых процентов нуклеотидов и может гибридизироваться с концевым кодирующим участком олигонуклеотида G. Согласно определенным вариантам реализации шпилечной структуры шпилечная структура образует одну непрерывную полимерную цепь и содержит по меньшей мере одну перекрывающуюся часть (обычно называемую «стеблем»), причем перекрывающаяся часть содержит последовательность нуклеотидов, которая гибридизируется с комплементарной последовательностью той же шпилечной структуры. Согласно определенным вариантам реализации шпилечной структуры мостиковая структура соединяет две отдельные олигонуклеотидные цепи; указанная мостиковая структура может состоять из полимера полиэтиленгликоля (ПЭГ), содержащего от 2 до 20 единиц ПЭГ, включая от 3 до 15 единиц ПЭГ, включая от 6 до 12 единиц ПЭГ. Согласно определенным вариантам реализации шпилечной структуры мостиковая структура может состоять из алкановой цепи, содержащей вплоть до 30 углеродов, или полиглициновой цепи, содержащей вплоть до 20 единиц, или состоять из некоторой другой цепи, которая несет реактивную функциональную группу. Согласно определенным вариантам реализации молекулы формулы (I) перекрывающаяся часть H1 и/или H2 связана с концевым кодирующим участком олигонуклеотида G или присоединена к нему. Согласно определенным вариантам реализации H1 и H2 каждый независимо содержат одну, две, три или четыре петли.
[0050] Согласно определенным вариантам реализации молекулы формулы (I) H1 и H2 каждый независимо содержит от приблизительно 20 до приблизительно 90 нуклеотидов, включая от приблизительно 32 до приблизительно 80 нуклеотидов, включая от приблизительно 45 до приблизительно 80 нуклеотидов. Согласно определенным вариантам реализации H1 и H2 каждый независимо содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10, включая от 1 до 5, включая от 2 до 4, включая от 2 до 3, нуклеотидов, модифицированных подходящими функциональными группами для способствования осуществлению реакции с линкерной молекулой или необязательно со структурным блоком, включая случаи, когда H1 и H2 каждый независимо были синтезированы с применением оснований, таких как, без ограничения, 5'-диметокситритил-5-этинил-2'-дезоксиуридин, 3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (также называемый 5-этинил-dU-СЕ фосфорамидит, который заказывают в компании Glen Research, Стерлинг, Вирджиния). Согласно определенным вариантам реализации H1 и H2 каждый независимо содержат ненуклеотидные компоненты, содержащие подходящие функциональные группы для способствования осуществлению реакции с линкерной молекулой или необязательно со структурным блоком, включая, без ограничения, 3-диметокситритилокси-2-(3-(5-гексинамидо)пропанамидо)пропил-1-O-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (также называемый алкиновый модификатор серинольный фосфорамидит, от компании Glen Research, Стерлинг, Вирджиния) и безосновный алкин СЕР (от компании IBA GmbH, Геттинген, Германия). Согласно определенным вариантам реализации H1 и H2 каждый независимо содержат нуклеотиды с модифицированными основаниями, которые уже несут линкер, например H1 и H2 каждый независимо могут быть синтезированы с применением основания, такого как, без ограничения, 5'-диметокситритил-N6-бензоил-N8-[6-(трифторацетиламино)-гекс-1-ил]-8-амино-2'-дезоксиаденозин-3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (также называемый аминомодификатор С6 dA, который заказывают в компании Glen Research, Стерлинг, Вирджиния), 5'-диметокситритил-N2-[6-(трифторацетиламино)-гекс-1-ил]-2'-дезоксигуанозин-3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (также называемый аминомодификатор С6 dG, который заказывают в компании Glen Research, Стерлинг, Вирджиния), 5'-диметокситритил-5-[3-метил-акрилат]-2'-дезоксиуридин, 3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (также называемый карбокси-dT, который заказывают в компании Glen Research, Стерлинг, Вирджиния), 5'-диметокситритил-5-[N-((9-фторэнилметоксикарбонил)-аминогексил)-3-акрилимидо]-2'-дезоксиуридин, 3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (также называемый Fmoc-аминомодификатор С6 dT, Glen Research, Стерлинг, Вирджиния), 5'-диметокситритил-5-(окта-1,7-диинил)-2'-дезоксиуридин, 3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (также называемый С8 алкин dT, Glen Research, Стерлинг, Вирджиния), 5'-(4,4'-диметокситритил)-5-[N-(6-(3-бензоилтиопропаноил)-аминогексил)-3-акриламидо]-2'дезоксиуридин, 3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит (также называемый S-Bz-тиоспиртовой модификатор C6-dT, Glen Research, Стерлинг, Вирджиния) и 5-карбокси dC СЕР (от компании IB A GmbH, Геттинген, Германия), N4-TriGl-амино 2'дезоксицитидин (от компании IBA GmbH, Геттинген, Германия). Подходящие функциональные группы для модифицированных нуклеотидов и ненуклеотидных компонентов в H1 и H2 включают, без ограничения, первичный амин, вторичный амин, карбоновую кислоту, первичный спирт, сложный эфир, тиоспирт, изоцианат, хлорформиат, сульфонилхлорид, тиокарбонат, гетероарилгалогенид, альдегид, хлорацетат, арилгалогенид, галогенид, бороновую кислоту, алкин, азид и алкен.
[0051] Согласно определенным вариантам реализации одна или несколько из шпилечных структур H1 и H2 могут быть модифицированы меткой, такой как флуоресцентная метка или радиоактивная метка. Такие метки могут способствовать визуализации или количественному определению молекул формулы (I). Согласно определенным вариантам реализации одна или несколько из шпилечных структур H1 и H2 модифицированы функциональной группой или присоединением, которые способствуют обработке.
[0052] Согласно определенным вариантам реализации молекулы формулы (I) преимущество шпилечной структуры H1 и H2 заключается в том, что одна или обе из шпилечных структур могут обеспечить полидисплей множества кодируемых частей на одном или обоих концах молекулы формулы (I). Не опираясь на какую-либо теорию, считают, что полидисплей множества кодируемых частей на одном или обоих концах мультифункциональной молекулы согласно настоящему изобретению обеспечивает улучшенные характеристики отбора при определенных условиях.
[0053] Согласно определенным вариантам реализации молекулы формулы (I) Y и W каждый независимо представляют собой 1, 2, 3, 4 или 5. Согласно определенным вариантам реализации, если О представляет собой ноль, тогда W представляет собой целое число от 2 до 5, включая 2, 3, 4 или 5. Согласно определенным вариантам реализации, если Р представляет собой ноль, тогда Y представляет собой целое число от 2 до 5, включая 2, 3, 4 или 5. Согласно определенным вариантам реализации, если О и Р каждый представляют собой 1, тогда W и Y каждый независимо представляют собой целое число от 1 до 5, включая 1, 2, 3, 4 или 5. Согласно определенным вариантам реализации W и Y каждый независимо представляют собой степень или показатель полидисплея кодируемой части молекулы формулы (I), причем подразумевают, что кодируемые части представляют собой единицу (B1)M-D и Е-(B2)K. В целом, чем выше суммарное значение Y и W, тем выше полидисплей молекулы формулы (I).
[0054] Согласно определенным вариантам реализации молекулы формулы (I) D представляет собой первый структурный блок. Согласно определенным вариантам реализации, когда D присутствует, D кодируется или отбирается концевым кодирующим участком G, который напрямую присоединен к H1. Согласно определенным вариантам реализации концевой кодирующий участок G, расположенный наиболее близко к D, соответствует для идентификации, и его можно применять для идентификации первого структурного блока D.
[0055] Согласно определенным вариантам реализации молекулы формулы (I) Е представляет собой второй структурный блок. Согласно определенным вариантам реализации, когда Е присутствует, Е кодируется или отбирается концевым кодирующим участком G, который напрямую присоединен к H2. Согласно определенным вариантам реализации концевой кодирующий участок G, расположенный наиболее близко к Е, соответствует для идентификации, и его можно применять для идентификации первого структурного блока Е. Согласно определенным вариантам реализации первый структурный блок D и второй структурный блок Е могут быть одинаковыми или различными. Подразумевается, что первый структурный блок и второй структурный блок оба являются структурными блоками.
[0056] Согласно определенным вариантам реализации молекулы формулы (I) В представляет собой позиционный структурный блок. Фраза «позиционный структурный блок» в настоящем изобретении означает одну единицу в серии индивидуальных единиц структурных блоков, связанных в качестве субъединиц с образованием большей молекулы. Согласно определенным вариантам реализации (B1)M и (В2)K каждый независимо представляет собой серию индивидуальных единиц структурных блоков, связанных с образованием полимерной цепи, содержащей число единиц М и K, соответственно. Например, когда М представляет собой 10, тогда (В)10 означает цепь единиц структурных блоков: В10-В9-В8-В7-В6-В5-В4-В3-В2-B1. Например, когда М представляет собой 3, и K представляет собой 2, тогда формулу (I) можно с точностью представить следующей формулой:
[0057] ([((B1)3-(B1)2-(B1)1-D-L1]Y-H1)O-G-(H2-[L2-E-(B2)1-(B2)2]W)P.
[0058] Подразумевается, что M и K каждый независимо выступает в качестве позиционного идентификатора для каждой индивидуальной единицы В.
[0059] Точное определение термина «структурный блок» в настоящем изобретении зависит от контекста. «Структурный блок» представляет собой химическую структурную единицу, способную быть связанной химическим способом с другими химическими структурными единицами. Согласно определенным вариантам реализации структурный блок содержит одну, две или более реактивных химических групп, которые позволяют структурному блоку участвовать в химической реакции, которая присоединяет структурный блок к другим химическим структурным единицам. Подразумевается, что часть или вся реактивная химическая группа структурного блока может быть утрачена, когда структурный блок участвует в реакции с образованием химической связи. Например, структурный блок в растворе может содержать две реактивные химические группы. В данном примере структурный блок в растворе может участвовать в реакции с реактивной химической группой структурного блока, который является частью цепи структурных блоков, для увеличения длины цепи или для образования ответвления от цепи. Когда структурный блок упоминают в контексте раствора или в качестве реагирующего вещества, тогда подразумевают, что структурный блок содержит по меньшей мере одну реактивную химическую группу, но может содержать две или более реактивных химических групп. Когда структурный блок упоминают в контексте полимера, олигомера или молекулы, большей, чем структурный блок сам по себе, тогда подразумевают, что структурный блок содержит структуру структурного блока в качестве (мономерной) единицы большей молекулы, даже если в реакции участвовали одна или несколько химических реактивных групп.
[0060] Типы молекулы или соединения, которые можно применять в качестве структурного блока, как правило, не ограничены, при условии, что один структурный блок способен участвовать в реакции вместе с другим структурным блоком с образованием ковалентной связи. Согласно определенным вариантам реализации структурный блок содержит одну химическую реактивную группу, выступающую в качестве концевой единицы. Согласно определенным вариантам реализации структурный блок содержит 1, 2, 3, 4, 5 или 6 подходящих реактивных химических групп. Согласно определенным вариантам реализации первый структурный блок D, второй структурный блок Е и позиционные структурные блоки В каждый независимо содержат 1, 2, 3, 4, 5 или 6 подходящих реактивных химических групп. Подходящие реактивные химические группы для структурных блоков включают первичный амин, вторичный амин, карбоновую кислоту, первичный спирт, сложный эфир, тиоспирт, изоцианат, хлорформиат, сульфонилхлорид, тиокарбонат, гетероарилгалогенид, альдегид, галогенацетат, арилгалогенид, азид, галогенид, трифлат, диен, диенофил, бороновую кислоту, алкин и алкен.
[0061] Для присоединения структурных блоков можно применять любой химический способ сочетания при условии, что химический способ сочетания совместим с присутствием олигонуклеотида. Иллюстративные химические способы сочетания включают образование амидов в результате реакции амина, такого как ДНК-связанный амин, с защищенной Fmoc аминокислотой или другими различным образом замещенными карбоновыми кислотами; образование мочевин в результате реакции амина, включая ДНК-связанный амин, с изоцианатом и другим амином (уреирование); образование карбамата в результате реакции амина, включая ДНК-связанный амин, с хлорформиатом (карбамоилирование) и спиртом; образование сульфонамида в результате реакции амина, включая ДНК-связанный амин, с сульфонилхлоридом; образование тиомочевины в результате реакции амина, включая ДНК-связанный амин, с тиокарбонатом и другим амином (тиоуреирование); образование анилина в результате реакции амина, включая ДНК связанный амин, с гетероарилгалогенидом (SNAr); образование вторичного амина в результате реакции амина, включая ДНК-связанный амин, с альдегидом с последующим восстановлением (восстановительное аминирование); образование пептоида в результате ацилирования амина, включая ДНК-связанный амин, с хлорацетатом с последующим вытеснением хлорида другим амином (реакция SN2); образование алкин-содержащего соединения посредством ацилирования амина, включая ДНК-связанный амин, карбоновой кислотой, замещенной арилгалогенидом, с последующим вытеснением галогенида замещенным алкином (реакция Соногашира); образование биарильного соединения посредством ацилирования амина, включая ДНК-связанный амин, карбоновой кислотой, замещенной арилгалогенидом, с последующим вытеснением галогенида замещенной бороновой кислотой (реакция Сузуки); образование замещенного триазина в результате реакции амина, включая ДНК-связанный амин, с цианурхлоридом с последующей реакцией с другим амином, фенолом или тиоспиртом (цианурилирование, ароматическое замещение); образование вторичных аминов посредством ацилирования амина, включая ДНК-связанный амин, карбоновой кислотой, замещенной соответствующей уходящей группой, такой как галогенид или трифлат, с последующим вытеснением уходящей группы другим амином (реакция SN2/SN1); и образование циклических соединений посредством замещения амина соединением, несущим алкен или алкин, и осуществления реакции продукта с азидом или алкеном (реакции Дильса-Альдера и Хьюсгена). Согласно определенным вариантам реализации реакций молекула, вступающая в реакцию с аминогруппой, включая первичный амин, вторичный амин, карбоновую кислоту, первичный спирт, сложный эфир, тиоспирт, изоцианат, хлорформиат, сульфонилхлорид, тиокарбонат, гетероарилгалогенид, альдегид, хлорацетат, арилгалогенид, алкен, галогениды, бороновую кислоту, алкин и алкен, характеризуется молекулярной массой от приблизительно 30 до приблизительно 330 Дальтон.
[0062] Согласно определенным вариантам реализации реакции сочетания первый структурный блок может быть добавлен посредством замещения амина, включая ДНК-связанный амин, с применением любого из химических способов, описанных выше, молекулами, несущими вторичные реактивные группы, такие как амины, тиоспирты, галогениды, бороновые кислоты, алкины или алкены. Затем можно провести реакцию вторичных реактивных групп со структурными блоками, несущими соответствующие реактивные группы. Иллюстративные способы химического сочетания вторичных реактивных групп включают ацилирование амина, включая ДНК-связанный амин, Fmoc-аминокислотой с последующим удалением защитной группы и восстановительным аминированием амина с вновь снятой защитой альдегидом и борогидридом; восстановительное аминирование амина, включая ДНК-связанный амин, альдегидом и борогидридом с последующей реакцией вновь замещенного амина с цианурхлоридом, с последующим вытеснением другого хлорида из триазина тиоспиртом, фенолом или другим амином; ацилирование амина, включая ДНК-связанный амин, карбоновой кислотой, замещенной гетероарилгалогенидом, с последующей реакцией SNAr с другим амином или тиоспиртом для вытеснения галогенида и образования анилина или тиоэфира; и ацилирование амина, включая ДНК-связанный амин, карбоновой кислотой, замещенной галоароматической группой, с последующим замещением галогенида алкином в реакции Соногашира; или замещением галогенида арильной группой в опосредованной сложным эфиром бороновой кислоты реакции Сузуки.
[0063] Согласно определенным вариантам реализации способы химического сочетания основаны на подходящих образующих связи реакциях, известных в данной области техники. См., например, руководства March, Advanced Organic Chemistry, fourth edition, New York: John Wiley and Sons (1992), главы 10-16; Carey and Sundberg, Advanced Organic Chemistry, Part B, Plenum (1990), главы 1-11; и Coltman et al., Principles and Applications of Organotransition Metal Chemistry, University Science Books, Mill Valley, Calif. (1987), главы 13-20; каждое из которых полностью включено в настоящий документ посредством ссылки.
[0064] Согласно определенным вариантам реализации структурный блок может содержать одну или несколько функциональных групп помимо реактивной группы или групп, применяемых для присоединения структурного блока. Одна или несколько из данных дополнительных функциональных групп могут быть защищены для предотвращения нежелательных реакций данных функциональных групп. Подходящие защитные группы для множества функциональных групп известны в данной области техники (см. руководство Greene and Wuts, Protective Groups in Organic Synthesis, second edition, New York: John Wiley and Sons (1991), которое полностью включено в настоящий документ посредством ссылки). В особенности подходящие защитные группы включают сложные и простые трет-бутиловые эфиры, ацетали, сложные трифенилметиловые эфиры и амины, сложные ацетиловые эфиры, сложные триметилсилиловые эфиры, простые и сложные трихлорэтиловые эфиры и карбаматы.
[0065] Тип структурного блока, как правило, не ограничен, при условии, что структурный блок является совместимым с одной или несколькими реактивными группами, способными к образованию ковалентной связи с другими структурными блоками. Подходящие структурные блоки включают, без ограничения, пептид, сахарид, гликолипид, липид, протеогликан, гликопептид, сульфонамид, нуклеопротеин, мочевину, карбамат, винилогичный полипептид, амид, винилогичный сульфонамидный пептид, сложный эфир, сахарид, карбонат, пептидилфосфонат, азатиды, пептоид (олиго N-замещенный глицин), эфир, этоксиформацетальный олигомер, тиоэфир, этилен, этиленгликоль, дисульфид, ариленсульфид, нуклеотид, морфолино, имин, пирролинон, этиленимин, ацетат, стирол, ацетилен, винил, фосфолипид, силоксан, изоцианид, изоцианат и метакрилат. Согласно определенным вариантам реализации (B1)M или (B2)K формулы (I) каждый независимо представляет собой полимер из данных структурных блоков, содержащий М или K единиц, соответственно, включая полипептид, полисахарид, полигликолипид, полилипид, полипротеогликан, полигликопептид, полисульфонамид, полинуклеопротеин, полимочевину, поликарбамат, винилогичный полипептид, полиамид, винилогичный сульфонамидный полипептид, сложный полиэфир, полисахарид, поликарбонат, полипептидилфосфонат, полиазатиды, полипептоид (олиго N-замещенный глицин), простые полиэфиры, полиэтоксиформацетальный олигомер, политиоэфир, полиэтилен, полиэтиленгликоль, полидисульфид, полиариленсульфид, полинуклеотид, полиморфолино, полиимин, полипирролинон, полиэтиленимин, полиацетаты, полистирол, полиацетилен, поливинил, полифосфолипиды, полисилоксан, полиизоцианид, полиизоцианат и полиметакрилат. Согласно определенным вариантам реализации молекулы формулы (I) от приблизительно 50 до приблизительно 100, включая от приблизительно 60 до приблизительно 95 и включая от приблизительно 70 до приблизительно 90%, структурных блоков характеризуются молекулярной массой от приблизительно 30 до приблизительно 500 Дальтон, включая от приблизительно 40 до приблизительно 350 Дальтон, включая от приблизительно 50 до приблизительно 200 Дальтон.
[0066] Подразумевается, что структурные блоки, содержащие две реактивные группы, будут образовывать линейную олигомерную или полимерную структуру или линейную неполимерную молекулу, содержащую в качестве единицы каждый структурный блок. Также подразумевается, что структурные блоки, содержащие три или более реактивных групп, могут образовывать молекулы с разветвлениями на каждом структурном блоке, содержащем три или более реактивных групп.
[0067] Согласно определенным вариантам реализации молекулы формулы (I) L1 и L2 каждый независимо представляет собой линкер. Термин «линкерная молекула» означает молекулу, содержащую две или более реактивных групп, которая способна участвовать в реакции с образованием линкера. Термин «линкер» означает часть молекулы, которая функционально связывает или ковалентно соединяет шпилечную структуру со структурным блоком. Термин «функционально связанные» означает, что две или более химических структур присоединены или ковалентно связаны таким образом, чтобы оставаться соединенными в течение различных манипуляций, которые, как ожидается, будут проводить с мультифункциональными молекулами, включая ПЦР-амплификацию.
[0068] Согласно определенным вариантам реализации молекулы формулы (I) L1 представляет собой линкер, который функционально связывает H1 с D. Согласно определенным вариантам реализации молекулы формулы (I) L2 представляет собой линкер, который функционально связывает H2 с Е. Согласно определенным вариантам реализации L1 и L2 каждый независимо представляют собой бифункциональные молекулы, связывающие H1 с D посредством осуществления реакции одной из реактивных функциональных групп L1 с реактивной группой H1 и другой реактивной функциональной группы L1 с реактивной функциональной группой D, и связывающие H2 с Е посредством осуществления реакции одной из реактивных функциональных групп L2 с реактивной группой H2 и другой реактивной функциональной группы L2 с реактивной функциональной группой Е. Согласно определенным вариантам реализации молекулы формулы (I) L1 и L2 каждый независимо представляют собой линкеры, полученные в результате осуществления реакции химических реактивных групп H1 и D или H2 и Е с коммерчески доступными линкерными молекулами, включая ПЭГ (например, азидо-ПЭГ-NHS, или азидо-ПЭГ-амин, или ди-азидо-ПЭГ) или фрагмент цепи алкановой кислоты (например, 5-азидопентановая кислота, (S)-2-(азидометил)-1-Вос-пирролидин, 4-азидоанилин или N-гидроксисукцинимидовый сложный эфир4-азидо-бутан-1-овой кислоты); тиоспирт-реактивные линкеры, такие как таковые, представляющие собой ПЭГ (например, SM(ПЭГ)n NHS-ПЭГ-малеимид), алкановые цепи (например, 3-(пиридин-2-илдисульфанил)-пропионовая кислота-Osu или сульфосукцинимидил 6-(3'-[2-пиридилдитио]-пропионамидо)гексаноат)); и амидиты для синтеза олигонуклеотидов, такие как аминомодификаторы (например, 6-(трифторацетиламино)-гексил-(2-цианоэтил)-(N,N-диизопропил)-фосфорамидит), тиоспиртовые модификаторы (например, 5-тритил-6-меркаптогексил-1-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидит, или химически сореактивные парные модификаторы (например, 6-гексин-1-ил-(2-цианоэтил)-(N,N-диизопропил)-фосфорамидит, 3-диметокситритилокси-2-(3-(3-пропаргилоксипропанамидо)пропанамидо)пропил-1-О-сукциноил, длинноцепочечные алкиламино CPG или N-гидроксисукцинимидовый сложный эфир 4-азидо-бутан-1-овой кислоты)); и совместимые комбинации указанных соединений.
[0069] Согласно определенным вариантам реализации мультифункциональная молекула представляет собой молекулу формулы (I-A), которая представляет собой подвид молекулы формулы (I):
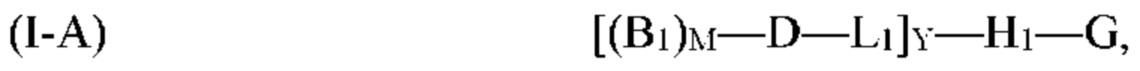
где G, H1, D, B1, М, L1 и Y, являются такими, как определено выше для формулы (I). Согласно определенным вариантам реализации мультифункциональная молекула представляет собой молекулу формулы (I-B), которая представляет собой подвид молекулы формулы (I):
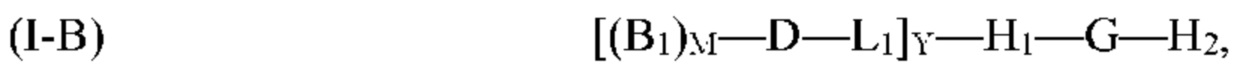
где G, H1, H2, D, B1, М, L1 и Y являются такими, как определено выше для формулы (I). Согласно определенным вариантам реализации мультифункциональная молекула представляет собой молекулу формулы (I-C), которая представляет собой подвид молекулы формулы (I):
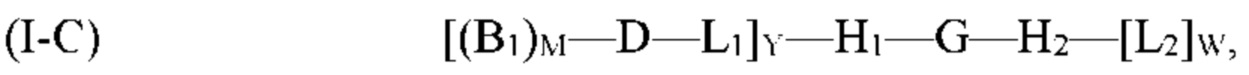
где G, H1, H2, D, B1, М, L1, L2, W и Y являются такими, как определено выше для формулы (I). Согласно определенным вариантам реализации мультифункциональная молекула представляет собой молекулу формулы (I-D), которая представляет собой подвид молекулы формулы (I):
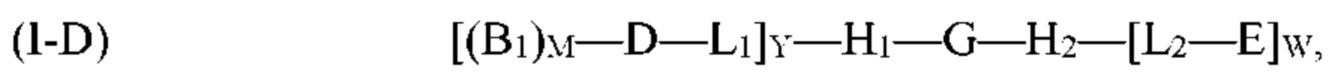
где G, H1, H2, D, B1, E, M, L1, L2, W и Y являются такими, как определено выше для формулы (I). Согласно определенным вариантам реализации мультифункциональная молекула представляет собой молекулу формулы (I-Е), которая представляет собой подвид молекулы формулы (I):
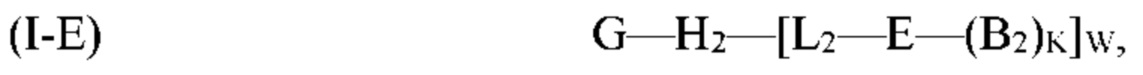
где G, Н2, Е, B2, K, L2 и W являются такими, как определено выше для формулы (I). Согласно определенным вариантам реализации мультифункциональная молекула представляет собой молекулу формулы (I-F), которая представляет собой подвид молекулы формулы (I):
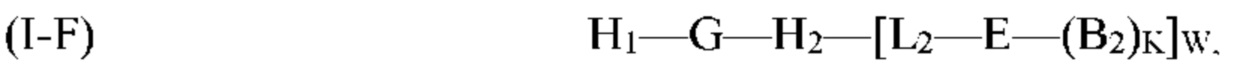
G, H1, Н2, Е, B2, K, L2, Р и W являются такими, как определено выше для формулы (I). Согласно определенным вариантам реализации мультифункциональная молекула представляет собой молекулу формулы (I-G), которая представляет собой подвид молекулы формулы (I):
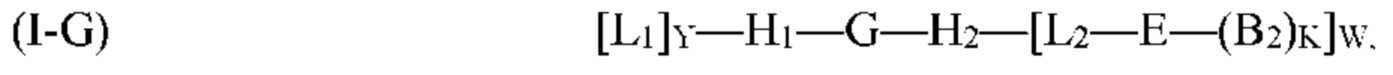
где G, H1, Н2, Е, B2, K, L1, L2, Y и W являются такими, как определено выше для формулы (I). Согласно определенным вариантам реализации мультифункциональная молекула представляет собой молекулу формулы (I-H), которая представляет собой подвид молекулы формулы (I):
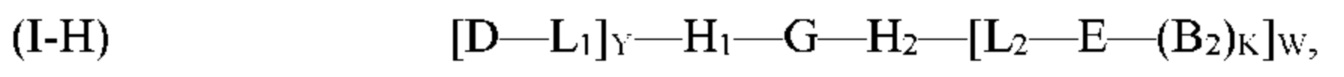
где G, H1, Н2, D, Е, В, М, L1, L2, Р, Y и W являются такими, как определено выше для формулы (I).
[0070] Настоящее изобретение относится к способам синтеза мультифункциональных молекул, включая молекулу формулы (I). Согласно определенным вариантам реализации способа по меньшей мере один концевой кодирующий участок на олигонуклеотиде, таком как G', способен к гибридизации с по меньшей мере одним нагруженным антикодоном-носителем, включая:
[(B1)(M-1)-D-L1]Y-H1 и/или Н2-[L2-Е-(B2)(K-1)]W,
с образованием молекулы формулы (II):
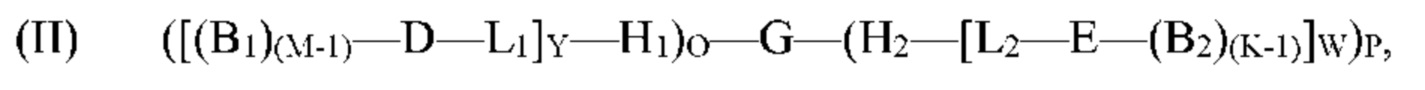
где B1, М, D, L1, Y, H1, О, H2, L2, E, B2, K, W и P являются такими, как определено выше для формулы (I), и G' представляет собой или содержит олигонуклеотид, содержащий по меньшей мере два кодирующих участка и по меньшей мере один концевой кодирующий участок, причем по меньшей мере два кодирующих участка являются одноцепочечными, по меньшей мере один концевой кодирующий участок является одноцепочечным, и по меньшей мере один концевой кодирующий участок на 5'- и/или 3'-конце олигонуклеотидов G' является отличным.
[0071] Подразумевается, что [(B1)(M-1)-D-L1]Y-H1 представляет собой (D-L1)Y-H1, где М представляет собой единицу. Подразумевается, что Н2-[L2-Е-(B2)(K-1)]W представляет собой H2-(L2-E)W, где K представляет собой единицу.
[0072] Как представлено на Фигурах 1 и 3, согласно определенным вариантам реализации преимущество данного способа получения молекулы формулы (II) заключается в том, что концевой кодирующий участок G' может кодировать или направлять добавление первой части кодируемой части молекулы, включая первый структурный блок D и/или второй структурный блок Е. Например, каждый концевой кодирующий участок в молекуле формулы (I) будет уникальным образом определять первый структурный блок D и/или второй структурный блок Е, поскольку будет известна идентичность первого структурного блока D и/или второго структурного блока Е нагруженного антикодона-носителя, способного к селективной гибридизации с концевым кодирующим участком.
[0073] Как представлено на Фигуре 2, согласно определенным вариантам реализации способа синтеза молекулы формулы (I) в способе применяют серию стадий «сортировки и реакции», на которых смесь мультифункциональных молекул, содержащую различные комбинации кодирующих участков, сортируют на подпулы посредством селективной гибридизации одного или нескольких кодирующих участков мультифункциональной молекулы с антикодирующим олигомером, иммобилизированным на гибридизационной матрице. Согласно определенным вариантам реализации способа преимущество сортировки мультифункциональных молекул на подпулы заключается в том, что данное разделение позволяет каждому подпулу вступать в реакцию с позиционным структурным блоком В, включая B1 и/или B2, при отдельных условиях реакции до того, как подпулы мультифункциональных молекул объединяют или смешивают для последующей химической обработки. Согласно определенным вариантам реализации способа процесс сортировки и реакции можно повторять для добавления серии позиционных структурных блоков. Согласно определенным вариантам реализации способа преимущество добавления структурных блоков с применением способа сортировки и реакции заключается в том, что идентичность каждого позиционного структурного блока кодируемой части молекулы можно соотнести с кодирующим участком, и это применяют для селективного разделения или сортировки мультифункциональных молекул перед добавлением структурного блока. Согласно определенным вариантам реализации каждый кодирующий участок уникальным образом определяет структурный блок в соответствии с его положением, поскольку идентичность кодирующего участка можно соотнести с идентичностью процесса реакции, который применяют для добавления структурного блока, который будет включать идентичность добавленного позиционного структурного блока. Согласно определенным вариантам реализации способ может позволить синтезировать мультифункциональную молекулу, включая молекулу формулы (I), в которой по меньшей мере один из по меньшей мере одного из первого структурного блока D и второго структурного блока Е определен по меньшей мере одним концевым кодирующим участком или соответствует по меньшей мере одному концевому кодирующему участку, и по меньшей мере один из каждого позиционного структурного блока В1 в положении М и B2 в положении K определен одним из кодирующих участков или соответствует одному из кодирующих участков. Подразумевается, что молекулы формул (I) и (II) могут содержать один или несколько кодирующих участков и концевых кодирующих участков, которые являются идентичными между или среди молекул в пуле, но также подразумевается, что подавляющее большинство, если не все молекулы в пуле, будут содержать различную комбинацию кодирующих участков и концевых кодирующих участков. Согласно определенным вариантам реализации способа преимущество пула молекул, содержащих различную комбинацию кодирующих участков и концевых кодирующих участков, заключается в том, что различные комбинации могут кодировать мультифункциональные молекулы, содержащие множество различных кодируемых частей.
[0074] Согласно определенным вариантам реализации способа синтеза молекулы формулы (I) способ включает стадию обеспечения по меньшей мере одного нагруженного антикодона-носителя, причем по меньшей мере один нагруженный антикодон-носитель соответствует формуле:
([(B1)(M-1)-D-L1]Y-H1) и/или (H2-[L2-E-(B2)(K-1)]W),
где B1, M, D, L1, Y, H1, H2, L2, E, B2, K и W являются такими, как определено для молекулы формулы (I). Термин «обеспечение», как правило, не ограничен, и может включать синтез или коммерческое приобретение таких молекул. Термин «нагруженный антикодон-носитель» означает шпилечную структуру, которая функционально связана с первым структурным блоком или вторым структурным блоком посредством линкера и содержит антикодирующий участок олигонуклеотида, который способен к селективному связыванию с по меньшей мере одним концевым кодирующим участком олигонуклеотида G' или G. Согласно определенным вариантам реализации способа функция нагруженного антикодона-носителя заключается в обеспечении того, что концевой кодирующий участок кодирует, направляет или позволяет отбирать добавление первого структурного блока и/или второго структурного блока. Согласно определенным вариантам реализации способа функция нагруженного антикодона-носителя заключается в связывании или присоединении структурного блока, включая первый или второй структурный блок, к по меньшей мере одному концу олигонуклеотида G' с образованием молекулы формулы (II), что позволяет олигонуклеотиду G кодировать или направлять синтез позиционных структурных блоков B1 и/или В2.
[0075] Согласно определенным вариантам реализации способа синтеза молекулы формулы (I) стадия объединения, как правило, не ограничена при условии, что пулу олигонуклеотидов G' и по меньшей мере одному нагруженному антикодону-носителю позволяют взаимодействовать или смешиваться в условиях, которые обеспечивают селективную гибридизацию.
[0076] Согласно определенным вариантам реализации способа синтеза молекулы формулы (I) стадия образования связи 5'-конца по меньшей мере одного из олигонуклеотидов G' с 3'-концом H1 включает селективную гибридизацию концевого кодирующего участка на 5'-конце G' с антикодоном H1. Согласно определенным вариантам реализации способа синтеза молекулы формулы (I) стадия образования связи 3'-конца по меньшей мере одного олигонуклеотида G' с 5'-концом Н2 включает селективную гибридизацию концевого кодирующего участка на 3'-конце G' с антикодоном Н2.
[0077] Согласно определенным вариантам реализации способа синтеза молекулы формулы (I) способ включает лигирование 5'-конца по меньшей мере одного олигонуклеотида G с 3'-концом H1 с образованием ковалентной связи и/или лигирование 3'-конца по меньшей мере одного олигонуклеотида G с 5'-концом H2. Данная стадия лигирования может происходить в течение или после образования молекулы формулы (II). Согласно определенным вариантам реализации способа преимущество образования ковалентной связи в течение или после стадии образования связи включает улучшенное манипулирование в течение других стадий химической обработки.
[0078] Согласно определенным вариантам реализации способа синтеза молекулы формулы (I) способ может дополнительно включать стадию удаления всей части олигонуклеотида от по меньшей мере одного концевого кодирующего участка молекулы формулы (I) или (II) в течение или после образования молекулы формулы (II). Согласно определенным вариантам реализации способа синтеза молекулы формулы (I) способ может дополнительно включать стадию удаления всей части олигонуклеотида от по меньшей мере одного концевого кодирующего участка молекулы формулы (I) или (II), причем по меньшей мере один концевой кодирующий участок является двухцепочечным, и олигонуклеотид может быть удален от шпилечной структуры H1 и/или H2, включая от антикодона шпилечной структуры H1 и/или H2, или от концевого кодирующего участка G или G'. Согласно одному определенному варианту реализации преимущество удаления всего или части олигонуклеотида от по меньшей мере одного концевого кодирующего участка молекулы формулы (I) или (II) может включать улучшенное химическое манипулирование в течение более поздних стадий.
[0079] Как схематично представлено на Фигурах 3 и 4, согласно определенным вариантам реализации способа получения молекулы формулы (I) молекулу формулы (I) можно синтезировать посредством множества синтетических путей, варьируя порядок стадий обработки. Например, на Фигуре 3 два нагруженных антикодона-носителя можно добавить в течение одной стадии. Затем можно осуществить последующие стадии сортировки и реакции для добавления структурных блоков B1 и B2 в тех же условиях реакции. Согласно данному варианту реализации кодируемые участки (B1)M и (B2)K, вероятно, будут идентичными, где B1=B2 и М=K.
[0080] В качестве альтернативы, на Фигуре 4 один нагруженный антикодон-носитель, ([(B1)(M-1)-D-L1]Y-H1), можно объединить и связать с G' с образованием молекулы формулы (I), где Р представляет собой ноль. Затем можно осуществить последующие стадии сортировки и реакции для добавления структурных блоков B1. После завершения образования кодируемой части (B1)M второй нагруженный антикодон-носитель, (H2-[L2-Е-(B2)(K-1)]W), можно объединить и связать с G с образованием отличной молекулы формулы (I), где Р представляет собой 1. Затем можно осуществить последующие стадии сортировки и реакции для добавления структурных блоков B2 с применением одинаковых или различных позиционных структурных блоков и условий реакции. Согласно определенным вариантам реализации (B1)M и (B2)K являются различными, поскольку тип и порядок реакции, применяемой для отбора и сортировки пула молекул формулы (II) и (I), соответственно, являлись различными. Подразумевается, что согласно определенным вариантам реализации нагруженный антикодон-носитель (H2-[L2-Е-(B2)(K-1)]W) можно добавить сначала для образования (B2)K перед добавлением ([(B1)(M-1)-D-L1]Y-H1) для образования (B1)M.
[0081] Также подразумевается, что добавление нагруженного антикодона-носителя, добавленного последним, не обязательно необходимо осуществлять после завершения образования или кодирования (B1)M или (B2)K. Напротив, последнее добавление нагруженного антикодона-носителя может происходить после добавления по меньшей мере одного из B1 или B2 к ранее добавленному нагруженному антикодону-носителю. После добавления второго нагруженного антикодона-носителя можно осуществить последующие стадии сортировки и реакции для добавления структурных блоков B1 и B2 с целью образования (B1)M или (B2)K. В данных вариантах реализации по меньшей мере часть первой кодируемой части будут соответствовать добавленной последней кодируемой части, но две кодируемые части (B1)M или (B2)K будут отличаться по меньшей мере позиционными структурными блоками, добавленными до связывания добавленного последним нагруженного антикодона-носителя.
[0082] Согласно определенным вариантам реализации способ получения молекулы формулы (I) включает осуществление реакции молекулы формулы (II):
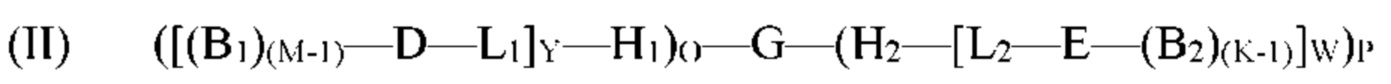
с одним или несколькими позиционными структурными блоками B1 и/или B2 с образованием молекулы формулы (I):
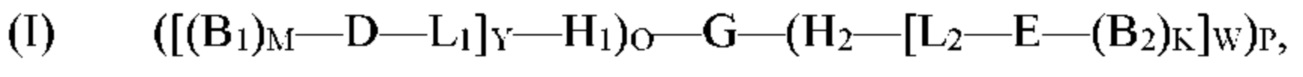
где H1, H2, D, Е, B1, М, B2, K, L1, L2, О, Р, Y и W являются такими, как определено для формулы (I).
[0083] Согласно определенным вариантам реализации способ включает обеспечение по меньшей мере одной гибридизационной матрицы. Стадия обеспечения гибридизационной матрицы, как правило, не ограничена и включает получение гибридизационной матрицы с применением методик, известных в данной области техники, или коммерческое приобретение гибридизационной матрицы. Согласно определенным вариантам реализации способа гибридизационная матрица включает субстрат из по меньшей мере двух отдельных областей, на поверхности которых расположены иммобилизированные олигомеры-антикодоны. Согласно определенным вариантам реализации каждая область гибридизационной матрицы содержит отличный иммобилизированный олигомер-антикодон, причем олигомер-антикодон представляет собой олигонуклеотидную последовательность, которая способна к гибридизации с одним или несколькими кодирующими участками молекулы формулы (I) или (II). Согласно определенным вариантам реализации способа в гибридизационной матрице применяют две или более камер. Согласно определенным вариантам реализации способа камеры гибридизационной матрицы содержат частицы, такие как частицы, на поверхности которых находятся иммобилизированные олигомеры-антикодоны. Согласно определенным вариантам реализации способа преимущество иммобилизации молекулы формулы (I) или (II) на матрице заключается в том, что данная стадия позволяет сортировать или селективно разделять молекулы на подпулы молекул в зависимости от конкретной олигонуклеотидной последовательности каждого кодирующего участка. Согласно определенным вариантам реализации разделенные подпулы молекул затем можно по отдельности высвободить или удалить от матрицы в реакционные камеры для последующей химической обработки. Согласно определенным вариантам реализации стадия высвобождения является необязательной, как правило, не ограниченной, и может включать дегибридизацию молекул посредством нагревания, с применением денатурирующих средств или посредством воздействия на молекулы буфера с pH≥12. Согласно определенным вариантам реализации камеры или области матрицы, содержащие различные иммобилизированные олигонуклеотиды, могут быть расположены так, чтобы позволить содержимому каждой камеры или области протекать в матрицу лунок для последующей химической обработки.
[0084] Согласно определенным вариантам реализации способ включает осуществление реакции по меньшей мере одного структурного блока В, включая B1 и/или B2, с молекулой формулы (II) для образования подпула молекул формулы (I) или (II), причем B1 и/или B2 являются такими, как определено выше для формулы (I). Согласно определенным вариантам реализации структурный блок B1 и/или B2 можно добавить в контейнер до, одновременно с или после молекулы формулы (I) или (II). Подразумевается, что контейнер может содержать растворители и сопутствующие компоненты реакции в кислых, щелочных или нейтральных условиях в зависимости от способа химического сочетания, который применяют для осуществления реакции структурного блока B1 и/или B2 с молекулой формулы (II) или (I).
[0085] Раскрыт способ идентификации молекул-зондов, способных к связыванию или отбору молекулы-мишени. Согласно определенным вариантам реализации способ включает осуществление воздействия на молекулы-мишени пула мультифункциональных молекул, таких как молекула формулы (I), для определения того, способна ли одна из мультифункциональных молекул к связыванию с молекулой-мишенью. Согласно определенным вариантам реализации термин «осуществление воздействия (контакта)» включает любой способ приведения молекулы-мишени в контакт с молекулой-зондом, включая молекулу формулы (I). Согласно определенным вариантам реализации молекулы-зонды, которые не связываются с молекулой-мишенью, удаляют посредством способа удаления, включая смывание несвязанных молекул-зондов от молекулы-мишени с применением избытка растворителя. Согласно определенным вариантам реализации молекула-мишень является иммобилизированной на поверхности. Согласно определенным вариантам реализации молекула-мишень включает белки, ферменты, липиды, олигосахариды и нуклеиновые кислоты с третичной структурой.
[0086] Согласно определенным вариантам реализации способа стадия амплификации включает применение методик ПЦР, известных в данной области техники, для получения копии последовательности олигонуклеотида G формулы (I). Согласно определенным вариантам реализации способа копия последовательности содержит копию по меньшей мере двух кодирующих участков формулы (I) и по меньшей мере одного концевого кодирующего участка (I). Согласно определенным вариантам реализации преимущество амплификации олигонуклеотида G от по меньшей мере одной молекулы зонда включает способность обнаружить, какие кодируемые части мультифункциональной молекулы способны к связыванию с молекулой-мишенью, даже если мультифункциональную молекулу невозможно с легкостью удалить от молекулы-мишени. Согласно определенным вариантам реализации преимущество амплификации заключается в том, что данный подход позволяет получить библиотеки молекул с огромным разнообразием. Данное огромное разнообразие обходится дорогой ценой низких количеств любой данной молекулы формулы (I). Амплификация методом ПЦР позволяет проводить идентификацию олигонуклеотидных последовательностей, присутствующих в чрезвычайно низких количествах, посредством увеличения их количества до тех пор, пока не будет достигнуто с легкостью обнаруживаемое количество. Затем секвенирование ДНК и анализ копии последовательности может позволить идентифицировать кодируемую часть, или его результаты можно соотнести с кодируемой частью мультифункциональной молекулы формулы (I), которая была способна к связыванию с мишенью.
[0087] Более подробное описание имеющихся проблем
[0088] Высокая стоимость разработки лекарственных средств и растущая потребность обнаружения молекул с уникальными и желаемыми свойствами для применения в медицине, исследованиях, биотехнологии, сельском хозяйстве, производстве продуктов питания и в пищевой промышленности дали начало области комбинаторной химии.
[0089] Обнаружение молекулы с в высокой степени желаемыми свойствами для конкретного желаемого применения не всегда может быть простым. Например, молекулы, которые связываются с белком-мишенью, или биологической макромолекулой-мишенью, или полимолекулярной структурой-мишенью, может быть чрезвычайно сложно сконструировать посредством рационального дизайна. При столкновении с задачей обнаружить молекулу, для которой структурный дизайн, установленный на основании первых принципов, является невозможным или неэффективным, комбинаторная химия зарекомендовала себя ценным инструментом. Комбинаторная химия делает обнаружение возможным посредством следующего общего процесса: (а) исследователь выдвигает наилучшую доступную гипотезу относительно наиболее общих свойств и структуры молекулы, которыми она может характеризоваться для соответствия критериям с целью желаемого применения, (b) исследователь конструирует и синтезирует очень большое количество молекул, называемых библиотекой, которые характеризуются предполагаемыми общими свойствами или структурой, (с) библиотеку анализируют для определения того, обладает ли какой-либо из членов библиотеки характеристиками для желаемого применения.
[0090] Когда информация ограничена, те гипотезы, которые могут быть выдвинуты относительно структуры желаемой молекулы, будут более слабыми и менее определенными, чем в случаях, когда существует большой объем знаний для снабжения данных гипотез информацией. Когда информацию для структурных гипотез обеспечивает большее число данных, более успешными могут быть библиотеки с меньшей сложностью или разнообразием, например, содержащие 1е4-1е7 уникальных членов, которые плотно фокусируются на участках пространства химической формы, согласно предположению, обогащенных желаемыми структурами. В случаях, когда существует немного данных или данные отсутствуют, для достижения успеха могут требоваться библиотеки с гораздо большей сложностью, которые проводят выборку больших участков пространства формы и проводят выборку более глубоко, например, содержащие 1е5-1е14 уникальных членов.
[0091] Комбинаторная химия позволяет проводить синтез библиотек соединений в данном масштабе с помощью способов химического синтеза разделения и объединения или сортировки и реакции. Создание обычных библиотек разделения и объединения начинается с функциональной группы, которую вводят в цепь полимерной твердой подложки, такой как полистирольная частица. Группу, состоящую из от нескольких тысяч до нескольких миллионов частиц, разделяют на серии сосудов, и частицы в каждом сосуде вступают в реакцию с отличной химической субъединицей или структурным блоком. Когда реакция заканчивается, все частицы объединяют, тщательно перемешивают и снова разделяют на новые серии реакционных сосудов для второй стадии химического синтеза с тем же или отличным набором структурных блоков. Процесс реакции разделения и объединения повторяют до тех пор, пока синтез не завершится. Число соединений, полученных данным способом, ограничено исключительно числом частиц, с которыми можно манипулировать в процессе, и числом структурных блоков, применяемых на каждой стадии. Данные два параметра будут определять сложность такой библиотеки. Например, если на каждой из 4 стадий существует 5 химических субъединиц, 54=625 членов составят библиотеку. Аналогично, если существует 52 структурных блока на первой стадии, 3 - на второй, 384 - на третьей и 96 - на четвертой, тогда будут получены 52×5×384×96=3833856 членов библиотеки.
[0092] Библиотеку молекул затем можно проанализировать, чтобы установить, какие из членов обладают желаемыми характеристиками для выбранного применения. Идентификация таких молекул может быть проблематичной, поскольку количество молекул, полученных на одной частице, может быть совсем небольшим, и вследствие этого трудным для идентификации. В сообществе комбинаторной химии, как правило, подразумевают, что в случае библиотек, соответствующим образом созданных с учетом количества доступных структурных данных для направления дизайна библиотеки, большие библиотеки, как ожидают, характеризуются большей вероятностью содержать в высокой степени желаемые члены. Однако для любого данного количества полученной библиотеки, чем выше сложность или чем больше число уникальных молекул в библиотеке, тем ниже в ней будет число копий или число копий каждого члена. Вследствие этого по мере того как увеличивается сложность библиотеки и вероятность содержания в ней успешного члена, общее количество такого успешного члена снижается наряду со способностью комбинаторного химика правильно его идентифицировать.
[0093] Вынужденная оптимизация, с которой комбинаторный химик затем сталкивается, заключается в получении библиотеки с достаточной сложностью, чтобы она содержала желаемые члены, а также в получении достаточного числа копий каждого члена библиотеки для обеспечения того, что желаемые члены являются точно идентифицированными. В целом, по мере того как увеличивается сложность библиотеки, размер твердой подложки должен также уменьшаться; по мере того как данный размер подложки уменьшается, снижается и количество образца, доступное для анализа и идентификации.
[0094] В целом, при наличии достаточных ресурсов можно синтезировать очень большую комбинаторную библиотеку из 1010 уникальных членов на полистирольных частицах в библиотеке «одна частица - одно соединение». Но если каждая полистирольная частица является сферой объемом 0,1 микролитра, тогда объем библиотеки, содержащей 1010 членов, составит >1 кубического метра - этого достаточно, чтобы заполнить обычную ванну или гидромассажную ванну, возможно, через край. И в то время как промышленные химические процессы часто проводят в таком масштабе, процессы данной сложности очень редко проводят в данном масштабе. Библиотека в таком масштабе также порождает вопрос анализа такой библиотеки и получения молекулярной мишени для таких анализов. Для такого анализа вполне может требоваться килограмм очищенного белка, и стоимость получения такого большого количества белков-мишеней лекарственных средств будет астрономической для множества белков-мишеней лекарственных средств.
[0095] Кодируемые ДНК библиотеки комбинаторной химии направлены на улучшение данной ситуации. Тот факт, что ПЦР может в значительной степени амплифицировать единичную цепь-матрицу ДНК с высокой точностью, и тот факт, что амплифицированные цепи можно с легкостью секвенировать, делает возможным снижение размера твердой подложки до одной молекулы ДНК. Таким образом, можно обеспечить возможность создавать чрезвычайно обширные библиотеки (например, содержащие 106-1014 уникальных членов), а также идентифицировать успешные молекулы из данной популяции посредством привязки члена библиотеки комбинаторной химии к цепи ДНК способом, который устанавливает соответствие между последовательностью ДНК и идентичностью члена библиотеки. Затем проводят эксперимент по отбору. «Отбор» представляет собой эксперимент, который физически изолирует тех членов популяции библиотеки, которые обладают желаемыми свойствами, от тех членов, которые ими не обладают. ДНК, кодирующую положительные в отношении свойства члены библиотеки, затем амплифицируют методом ПЦР, и секвенирование ДНК позволяет идентифицировать положительный в отношении свойства член библиотеки. Таким образом можно синтезировать библиотеки чрезвычайно высокой сложности, и положительные в отношении свойства индивидуальные образцы можно идентифицировать из ничтожно малых размеров образца.
[0096] Новые технологии секвенирования ДНК, способные восстанавливать 106-108 уникальных последовательностей, значительно облегчают улучшенный анализ кодируемой ДНК библиотеки. Данные «глубокого секвенирования» делают возможным надежный статистический анализ очень сложных химических библиотек. Данные виды анализа не только позволяют идентифицировать конкретные индивидуальные члены библиотеки, соответствующие выбранному применению, но могут также выявить ранее не известные общие свойства, которые обеспечивают «пригодность» членов библиотеки для применения. Обычно библиотеку ДНК подвергают глубокому секвенированию перед экспериментом по отбору, разработанному для того, чтобы физически отделить индивидуальные образцы, которые больше соответствуют для рассматриваемого применения, от индивидуальных образцов, которые соответствуют меньше. Популяцию после эксперимента подвергают глубокому секвенированию, и сравнение двух наборов данных демонстрирует, какие индивидуальные образцы больше соответствуют, поскольку их относительная частота в популяции увеличивается. Те индивидуальные образцы, которые соответствуют меньше, будут идентифицированы, поскольку их относительная частота в популяции уменьшается. Однако способы кодируемой ДНК комбинаторной химии могут позволить получить библиотеки, степень сложности которых значительно опережает наиболее мощные из имеющихся на сегодняшний день технологий глубокого секвенирования. Несмотря на то, что глубокое секвенирование делает возможным значительное улучшение применимости и успешности кодируемых ДНК комбинаторных библиотек, данный подход все еще обеспечивает только статистически неполную выборку данных, которые теоретически доступны.
[0097] Проблема данной неполной выборки данных усугубляется тем фактом, что не каждая стадия в процессе комбинаторной химии проходит с совершенной эффективностью. Наблюдается снижение точности, поскольку некоторые реакции не идут до завершения, а в некоторых реакциях образуются побочные продукты. Вследствие этого не всегда присутствует полная ясность, что последовательность ДНК, восстановленная методом глубокого секвенирования, представляет собой фактическую молекулу, которую она кодирует, но может иногда подставлять собой продукт усечения или продукт, измененный побочной реакций.
[0098] Усугублением проблемы неполной выборки является проблема синтетической точности. Не каждая реакция, применяемая для получения комбинаторной библиотеки, будет абсолютно эффективной. Это означает, что некоторые ДНК в кодируемой ДНК библиотеке не привязаны к молекуле, которую они кодируют, но вместо этого привязаны к продуктам усечения, образовавшимся в результате неполного встраивания одного или нескольких структурных блоков, или привязаны к аналогичным соединениям, образовавшимся в результате встраивания побочного продукта или побочной реакции. Таким образом, страдает анализ данных, поскольку некоторые из генотипов, которые, как наблюдают, прошли отбор, представляют собой молекулы, отличные от таковых, которые они кодируют.
[0099] Направленная эволюция
[00100] Целью настоящего изобретения является идентификация молекул, подходящих для желаемых вариантов применения, посредством получения кодируемых ДНК библиотек со значительной сложностью и высокой точностью, с целью максимизации имеющихся на сегодняшний день технологий секвенирования и с целью преодоления проблем неполной выборки с помощью отборов нескольких поколений. Другой целью настоящего изобретения является обеспечение более точного синтеза посредством обеспечения очищенной первой стадии синтеза библиотеки.
[00101] В общем виде способ согласно настоящему изобретению функционирует следующим образом. Популяция молекул кодируется в пуле генов ДНК (олигонуклеотиды G или G'). Затем последовательности ДНК (олигонуклеотиды G или их копии) выступают матрицей для синтеза, или трансляции, низкомолекулярных членов библиотеки (кодируемых частей), обеспечивая ковалентное привязывание (линкер) между генотипами ДНК и их соответствующими низкомолекулярными фенотипами. Затем популяцию слияний генотип-фенотип (библиотеку молекул формулы (I)) можно подвергнуть давлению отбора, и ДНК (по меньшей мере два кодирующих участка и по меньшей мере два концевых кодирующих участка) индивидуальных образцов, прошедших отбор, амплифицировать методом ПЦР. Данную популяцию второго поколения, прошедшую отбор (копию последовательности), можно (а) подвергнуть глубокому секвенированию и анализу для идентификации подходящих индивидуальных образцов (кодируемых частей с желаемыми свойствами), и/или (b) популяцию можно повторно транслировать и подвергнуть второму раунду более строгого отбора в отношении того же свойства или в отношении отличного свойства. Прошедших отбор из второго поколения отбора затем (а) подвергают глубокому секвенированию и анализируют для идентификации подходящих индивидуальных образцов и/или (b) повторно транслируют и подвергают большему количеству раундов отбора, секвенирования и анализа до тех пор, пока не будет получена молекула подходящего соответствия.
[00102] Способность способа согласно настоящему изобретению получать библиотеку молекул формулы (I), которую можно повторно транслировать и подвергнуть повторному отбору во множестве поколений, является заметным преимуществом, поскольку данная способность обеспечивает направленную «эволюцию» с множеством поколений. Несмотря на то, что исходная популяция достаточной сложности и популяция прошедших отбор после первого раунда отбора может представлять собой неполную выборку согласно наилучшим существующим доступным способам глубокого секвенирования, и несмотря на то, что статистический анализ данных секвенирования для идентификации соответствующих индивидуальных образцов может страдать от данной неполной выборки, отборы с множеством поколений могут позволить проводить полный анализ популяции. Поскольку при каждом успешном раунде отбора из популяции будет устранено множество уникальных, менее соответствующих индивидуальных образцов, фактическая сложность популяции будет снижаться по мере того, как она будет обогащаться более соответствующими индивидуальными образами. Вследствие этого каждый раунд секвенирования позволит получить чрезвычайно значимую выборку и сделает возможным проведение в высокой степени надежного компьютерного анализа. Способность осуществлять отбор с множеством поколений значительно улучшает данный тип анализа.
[00103] «Гены» ДНК или олигонуклеотиды G, содержащиеся в библиотеке, характеризуются в некоторой степени близкой архитектурой. Подобно генам в клетке, информация упорядочена вдоль линейной последовательности. Однако в отличие от обычного гена в данной синтетической биологической системе «кодоны» или кодирующие участки обычно составляют приблизительно 20 оснований в длину. В природной системе кодоны считываются в линейном порядке, начиная с одного конца гена и продвигаясь к другому. Согласно варианту реализации настоящего изобретения кодирующие участки, содержащие ген, могут считываться в любом порядке при условии, что (а) порядок начинается с концевого кодона, (b) является заранее определенным и (с) заранее определенный порядок поддерживается во всех последующих поколениях данной кампании отбора. Кроме того, гены между каждым кодирующим участком также необязательно содержат некодирующие участки. Данные некодирующие участки способствуют точной трансляции библиотеки и мутагенезу или перетасовке генов библиотеки, если некодирующие участки содержат уникальные сайты рестрикции. Все олигонуклеотиды G в данной библиотеке, как правило, будут содержать одно число кодонов в аналогичной компоновке.
[00104] Согласно определенным вариантам реализации для данной библиотеки олигонуклеотидов G, как правило, будет существовать заранее определенный набор и число последовательностей, применяемых на каждом кодирующем участке. Согласно определенным вариантам реализации ни одна из кодирующих последовательностей, применяемых на одном кодирующем участке, не используется на любом другом кодирующем участке. Согласно некоторым вариантам реализации кодирующие последовательности собраны в гены комбинаторным способом, в результате чего представлены все возможные комбинации кодирующих последовательностей. Согласно другим вариантам реализации число комбинаций кодирующих последовательностей будет значительно уменьшено в исходной библиотеке генов, и после событий отбора часть популяции подвергнут процедуре перетасовки генов или кроссинговера для обеспечения эволюции и отбора новых фенотипов.
[00105] Согласно определенным вариантам реализации данным событиям «кроссинговера» способствуют посредством размещения в пределах некодирующих участков уникальных сайтов рестрикции. Частичное расщепление популяции в одном или нескольких из некодирующих участков с последующим повторным лигированием обеспечит комбинаторную реассортацию кодирующих последовательностей между двумя кодирующими участками, в которых были осуществлены расщепления. Данное событие перетасовки или кроссинговера можно осуществить между единичными парами кодирующих участков или между несколькими парами кодирующих участков либо библиотеку можно разделить на пулы, и каждый пул подвергнуть событиям кроссинговера между различными комбинациями кодирующих участков. Согласно определенным вариантам реализации данная способность в действительности позволяет генетически рекомбинировать два индивидуальных образца, которые продемонстрировали соответствие в результате прохождения отбора, для кодирования фенотипа потомства, отличного от любого родителя. Как правило, посредством рекомбинации соответствующих генотипов получают новые, более соответствующие фенотипы для отбора.
[00106] Идентификация кодируемых частей
[00107] Согласно некоторым вариантам реализации в настоящем изобретении предложены мультифункциональные молекулы, представляющие собой молекулярные зонды, которые характеризуются соответствием между последовательностью ДНК гена в олигонуклеотиде G и идентичностью кодируемой части или молекулы, которую кодирует ген.
[00108] Согласно некоторым вариантам реализации соответствие устанавливают следующим образом. Библиотеку генов получают способом, в результате которого кодирующие участки становятся одноцепочечными, а любые некодирующие участки - двухцепочечными.
[00109] Отдельно готовят адаптер реакционного центра. Адаптеры реакционного центра (шпилечные структуры) будут описаны более подробно ниже. Вкратце, согласно определенным вариантам реализации адаптеры реакционного центра обычно представляют собой шпильки ДНК, функционализированные реактивной функциональной группой и содержащие участок стебля и антикодирующий участок. Согласно определенным вариантам реализации будет обеспечено и получено столько же адаптеров реакционного центра со столькими же различными антикодирующими последовательностями, сколько существует концевых кодирующих участков в библиотеке. Согласно определенным вариантам реализации адаптер реакционного центра будет получен с антикодирующей последовательностью, комплементарной каждой из последовательностей концевого кодирующего участка. Согласно определенным вариантам реализации реакционный центр реактивной функциональной группы на каждом адаптере реакционного центра со своей собственной последовательностью будет вступать в реакцию с первым структурным блоком с образованием нагруженного адаптера реакционного центра (нагруженного антикодона-носителя) и будет необязательно очищен для удаления не вступивших в реакцию адаптеров реакционного центра, что обеспечивает заметное преимущество точности трансляции. Антикодирующая последовательность адаптера реакционного центра будет, таким образом, соответствовать конкретному структурному блоку. Данный химический подход будет описан более подробно ниже. Пул нагруженных адаптеров реакционного центра можно инкубировать с библиотекой генов, чтобы позволить нагруженным адаптерам реакционного центра (нагруженным антикодонам-носителям) специфично отжечься с концевыми кодирующими последовательностями, которым они комплементарны. Затем комплекс отожженный адаптер/библиотека можно лигировать, например, с применением ДНК-лигазы Т4. Таким способом концевой кодирующий участок гена будет соответствовать конкретному структурному блоку.
[00110] Согласно определенным вариантам реализации установление соответствия между следующими выбранными последовательностями кодирующего участка и следующими структурными блоками будет осуществлено посредством сортировки библиотеки на подпулы на основании кодирующих последовательностей в выбранном кодирующем участке. Согласно определенным вариантам реализации данную сортировку осуществляют посредством последовательность-специфичной гибридизации одноцепочечных кодирующих последовательностей с комплементарными олигонуклеотидами, иммобилизированными на матрице твердых подложек, называемой гибридизационной матрицей.
[00111] Конструирование гибридизационных матриц описано ниже. Вкратце, согласно определенным вариантам реализации гибридизационная матрица представляет собой матрицу пространственно разделенных элементов, содержащих твердые подложки. Согласно определенным вариантам реализации на данных подложках ковалентно привязаны олигонуклеотиды оцДНК (одноцепочечной ДНК) с последовательностями, комплементарными последовательностям кодирующего участка, сортировку которого проводят. Согласно определенным вариантам реализации посредством пропускания библиотеки молекул формулы (I) или формулы (II), несущей множество кодирующих последовательностей, над твердой подложкой, несущей данную антикодирующую последовательность, или через нее, члены библиотеки, содержащие комплементарную кодирующую последовательность, могут быть специфично иммобилизированы. Согласно определенным вариантам реализации пропускание библиотеки над матрицей твердых подложек, каждая из которых несет отличную иммобилизированную антикодирующую последовательность, или через нее отсортирует библиотеку на подпулы на основании кодирующей последовательности. Согласно определенным вариантам реализации затем можно независимо провести реакцию каждого последовательность-специфичного подпула со специфичным структурным блоком (позиционным структурным блоком) для установления соответствия последовательности со структурным блоком. Данный синтез будет описан более подробно ниже, и его можно осуществить на гибридизационной матрице или после того, как подпулы были элюированы с матрицы в подходящее окружение, такое как отдельные контейнеры, для проведения реакции.
[00112] Установление соответствия кодирующей последовательности со структурным блоком для всех других внутренних неконцевых кодирующих участков можно осуществить тем же способом, единственным отличием будет то, что в качестве подходящей будут применять отличную гибридизационную матрицу, несущую отличный набор антикодирующих последовательностей.
[00113] Кодирующие участки в олигонуклеотидах G могут также кодировать другую информацию. Согласно определенным вариантам реализации после завершения трансляции библиотеки может быть желательно отсортировать библиотеку на основании индексных последовательностей кодирующего участка. Согласно определенным вариантам реализации индексные последовательности кодирующего участка могут кодировать предполагаемое назначение или историю отбора его соответствующего подпула библиотеки. Например, библиотеки для множества мишеней можно транслировать одновременно и совместно, а затем отсортировать на основании индексного кодирующего участка на подпулы. Подпулы, предназначенные для различных мишеней и/или для проведения отбора при различных условиях, таким образом, можно отделить друг от друга и сделать готовыми для применения в их соответствующих вариантах применения. Историю отбора члена библиотеки, который подвергают множеству раундов отбора в отношении различных свойств, можно, таким образом, записать в индексном участке.
[00114] Одна из предусмотренных функций адаптеров реакционного центра заключается в установлении соответствия между последовательностью в библиотеке генов олигонуклеотидов G и конкретным структурным блоком. В широком смысле это осуществляют так, как описано выше. В целом, ключевыми элементами адаптера реакционного центра являются антикодирующая последовательность, которая позволяет адаптеру гибридизироваться со специфичным кодирующим участком олигонуклеотида G, реактивная функциональная группа, к которой могут быть ковалентно присоединены первый или второй структурный блок D или Е, линкер, который ковалентно привязывает такие структурные блоки к адаптеру реакционного центра, и средства для ковалентного присоединения нагруженного структурным блоком адаптера реакционного центра, или нагруженного адаптера реакционного центра, напрямую или опосредованно к гену (олигонуклеотиду G). Согласно некоторым вариантам реализации адаптер реакционного центра представляет собой шпильку ДНК, содержащую стебель, петлю и 3'- или 5'-липкий конец, который, собственно, содержит антикодирующую последовательность. Согласно некоторым вариантам реализации стебель может содержать один или несколько уникальных сайтов рестрикции, которые после расщепления рестрикционными ферментами могут облегчить высвобождение очень плотно связавшихся молекул от мишени, или содержат надлежащую инициирующую последовательность для обеспечения более точной амплификации гена методом ПЦР.
[00115] Согласно определенным вариантам реализации участок петли выполняет функцию создания изменения направленности цепи адаптера реакционного центра для соответствия таковой цепи олигонуклеотида G с тем, чтобы его можно было лигировать с концом олигонуклеотида G. В связи с природой ДНК кодирующая последовательность в олигонуклеотиде G будет иметь противоположную направленность антикодирующей последовательности в адаптере реакционного центра. Лигирование ДНК возникает исключительно между двумя концами цепи нуклеиновых кислот с одной направленностью. То есть, цепь, ориентированную от 5'- к 3'-концу, можно лигировать с другой цепью, ориентированной от 5'- к 3'-концу. Участок петли выполняет функцию создания изменения направленности цепи адаптера реакционного центра для соответствия таковой цепи олигонуклеотида G с тем, чтобы его можно было лигировать с концом олигонуклеотида G. Согласно некоторым вариантам реализации петля шпилечной структуры H1 и/или Н2 содержит от 3 до 12 оснований ДНК. Согласно некоторым вариантам реализации она представляет собой полиэтиленгликолевый линкер, состоящий из 6-12 единиц ПЭГ. Согласно некоторым вариантам реализации адаптер реакционного центра будет лигирован с олигонуклеотидом G ферментативным способом. Согласно некоторым вариантам реализации конец олигонуклеотида G будет функционализирован азидом или алкином, и конец адаптера реакционного центра будет функционализирован алкином или азидом, а лигирование будет обеспечено посредством опосредованного медью способа «клик»-химии. Специалисты в данной области техники понимают, что множество эквивалентных химических подходов являются подходящими для ковалентного привязывания адаптера реакционного центра к олигонуклеотиду G.
[00116] Согласно некоторым вариантам реализации реакционный центр содержит свободный амин, привязанный к модифицированному нуклеооснованию посредством линкера ПЭГ или линкера на основе алкильной цепи либо посредством линкера на основе гомополимерной или гетерополимерной цепи. Реакционный центр может являться функциональным при присоединении в любой точке к шпильке адаптера реакционного центра. Согласно некоторым вариантам реализации реакционный центр присоединен на стебле в расположении, которое представляет собой 5' петли. Согласно некоторым вариантам реализации реакционный центр присоединен к 3' петли. Согласно некоторым вариантам реализации реакционный центр присоединен на той же стороне петли, что и антикодирующая последовательность, и возле начального основания антикодирующей последовательности. Согласно некоторым вариантам реализации реакционный центр присоединен на противоположной от антикодирующей последовательности стороне петли и на отдалении от нее вдоль стебля. Согласно некоторым вариантам реализации на адаптер присоединено более одного реакционного центра. Одно из преимуществ наличия более одного реакционного центра заключается в том, что вероятность правильного синтеза кодируемой части увеличивается. Другое преимущество наличия более одного реакционного центра заключается в том, что в течение отбора множественность кодируемых частей может привести к авидности, которая позволит обнаружить в ходе отбора молекулы, связывающиеся более слабо. Согласно некоторым вариантам реализации с двумя или более реакционными центрами реакционные центры будут присоединены на одной стороне петли и возле противоположных концов стебля. Согласно некоторым вариантам реализации реакционные центры будут расположены на противоположных сторонах петли и возле противоположных концов стебля. Согласно некоторым вариантам реализации с более чем одним реакционным центром оба реакционных центра будут находиться в участке петли. Согласно некоторым вариантам реализации адаптер реакционного центра будет содержать более одного стебля и более одной петли. Согласно таким вариантам реализации несколько реакционных центров могут быть присоединены вдоль стеблей или на петлях либо в комбинации обоих расположений. Согласно некоторым вариантам реализации компоновка и позиционирование реакционных центров будет разработана для способствования лучшим результатам в отборах посредством приспособления расстояния между реакционными центрами для содействия лучшей авидности в зависимости от размера мишеней, о которых идет речь.
[00117] Согласно некоторым вариантам реализации адаптер реакционного центра будет обладать способностью с легкостью расщепляться на меньшие фрагменты. Такая фрагментация может способствовать лучшей последующей обработке библиотеки, например, присутствие лигированной шпильки на одном или обоих концах матричной цепи библиотеки может усложнить ПЦР-амплификацию, препятствуя способности праймеров правильно отжигаться с молекулами формулы (I). В другом примере фрагментация нагруженного адаптера реакционного центра после лигирования может снизить стерический объем возле реакционных центров и улучшить химические свойства или улучшить выход в течение гибридизации. Способы фрагментации включают, без ограничения, рестрикционное расщепление в уникальном рестрикционном сайте в участке стебля или встраивание оснований dU при синтезе адаптера реакционного центра с последующей обработкой урацил-ДНК-гликозилазой для создания апиримидинового сайта и последующего щелочного гидролиза цепи. Способы фрагментации могут оставить реакционный центр привязанным напрямую или опосредованно к матричной цепи или могут удалить его от матричной цепи.
[00118] Согласно некоторым вариантам реализации нагруженные адаптеры реакционного центра будут специфично гибридизировать и лигировать с концевыми кодирующими участками на обоих концах матричной цепи. В случае, когда концевые кодирующие участки кодируют первый и второй структурные блоки, которые являются одинаковыми, данные варианты реализации характеризуются преимуществами обеспечения множества возможностей для синтеза правильной кодируемой части. Кроме того, данные варианты реализации могут обеспечить возможность возникновения авидности множества кодируемых частей и улучшения эффективности отбора, в особенности для молекул, которые связываются более слабо. В случае, когда первый и второй структурные блоки являются различными, данные варианты реализации позволяют синтезировать вдвое больше уникальных кодируемых частей для того же числа матричных цепей гена. В случаях, когда первый и второй структурные блоки являются одинаковыми для некоторых молекул формулы (I) и различными для других молекул формулы (I), это позволяет проводить анализ относительного вклада общего соответствия двух различных структурных блоков, которые несет кодируемая часть в целом.
[00119] Множество типов химических способов доступны для применения в настоящем изобретении. Теоретически можно применять любую химическую реакцию, которая химически не изменяет ДНК. Реакции, которые, как известно, являются совместимыми с ДНК, включают, без ограничения: реакции Виттига, реакции Хека, реакции Хорнера-Вадсворта-Эммонса, реакции Генри, сочетания Сузуки, сочетания Соногашира, реакции Хьюсгена, восстановительное аминирование, восстановительное алкилирование, реакции пептидной связи, реакции образования пептоидной связи, ацилирование, реакции SN2, реакции SNAr, сульфонилирование, уреирование, тиоуреирование, карбамоилирование, образование бензимидазолов, имидазолидинонов, хиназолинонов, изоиндолинонов, тиазолов, имидазопиридинов, расщепление диолов с образованием глиоксалей, реакции Дильса-Альдера, сочетания индол-стирол, присоединения по Михаэлю, окислительные сочетания алкен-алкин, альдольные реакции, снятие Fmoc-защиты, снятие трифторацетамидовой защиты, снятие Alloc-защиты, снятие Nvoc-защиты и снятие Вос-защиты. (См. руководства Handbook for DNA-Encoded Chemistry (Goodnow R.A., Jr., Ed.) pp 319-347, 2014 Wiley, New York. March, Advanced Organic Chemistry, fourth edition, New York: John Wiley and Sons (1992), главы 10-16; Carey and Sundberg, Advanced Organic Chemistry, Part B, Plenum (1990), главы 1-11; и Coltman et al., Principles and Applications of Organotransition Metal Chemistry, University Science Books, Mill Valley, Calif. (1987), главы 13-20; каждое из которых полностью включено в настоящий документ посредством ссылки).
[00120] Специалист в данной области техники понимает, что в мультифункциональные молекулы согласно настоящему изобретению можно встроить огромный ассортимент различных комбинаторных остовов. Примеры типов общих классов остовов включают, без ограничения, следующие: (а) цепи бифункциональных структурных блоков, соединенные конец к концу; пептиды и пептоиды являются двумя примерами данного типа остова; следует понимать, что не каждый бифункциональный структурный блок в цепи будет содержать одну и ту же пару функциональных групп, и что некоторые структурные блоки могут содержать исключительно одну функциональную группу, например, концевые структурные блоки, (b) разветвленные цепи бифункциональных структурных блоков, которые включают некоторые трифункциональные структурные блоки и могут содержать или могут не содержать монофункциональные структурные блоки, (с) молекулы, состоящие из одного полифункционального структурного блока и набора монофункциональных структурных блоков; согласно одному варианту реализации такая молекула может содержать полифункциональный структурный блок, который выступает в качестве центрального ядра, к которому в качестве элементов разнообразия присоединяют другие монофункциональные структурные блоки, (d) молекулы, состоящие из двух или более полифункциональных структурных блоков, к которым в качестве элементов разнообразия присоединяют набор монофункциональных или бифункциональных структурных блоков, (е) любой из вышеупомянутых остовов, который включает образование кольца в результате осуществления реакции фрагмента на линкере или структурном блоке, введенного на более ранней стадии, с фрагментом на структурном блоке или линкере, введенном на более поздней стадии. Также могут быть встроены другие остовы или химические структурные типы, и данные общие структурные остовы ограничены исключительно изобретательностью практикующего специалиста при разработке химических путей для их синтеза.
[00121] Согласно определенным вариантам реализации ионообменная хроматография способствует химическим реакциям, проводимым на субстратах, привязанных к ДНК, двумя способами. В случае реакций, проводимых в водном растворителе, очистку можно с легкостью провести посредством пропускания реакционной смеси над ионообменной смолой, такой как DEAE-SEPHAROSE® или TOYOPEARL® SuperQ 650М. Согласно определенным вариантам реализации ДНК свяжется со смолой в результате ионообмена, а неиспользованные реактивы, побочные продукты и другие компоненты реакции можно смыть водными буферами, органическими растворителями или их смесями. В случае реакций, которые наилучшим образом проходят в органическом растворителе, существует настоящая проблема: ДНК характеризуется очень низкой растворимостью в органических растворителях, и такие реакции страдают от низкого выхода. В данных случаях библиотеку ДНК можно иммобилизировать на ионообменной смоле, остаточную воду смыть водорастворимым органическим растворителем, и провести реакцию в органическом растворителе, который может являться или может не являться водорастворимым. См., например, публикацию R.M. Franzini, et. al. Bioconjugate Chemistry 2014 25 (8), 1453-1461 и источники, ссылки на которые приводятся в данном документе. Существует множество типов и видов ионообменной среды, все из которых характеризуются различными свойствами, которые могут более или менее подходить для различных химических подходов или применений и которые являются коммерчески доступными от множества компаний, таких как, среди прочих, THERMOFISHER®, SIGMA ALDRICH®, DOW®, DIAION® и TOYOPEARL®. Следует понимать, что существует множество возможных способов и сред, посредством которых библиотеку ДНК можно иммобилизировать или солюбилизировать с целью проведения химической реакции для введения структурного блока, или удаления защитной группы, или активации фрагмента для последующей модификации, которые не перечислены в настоящем документе.
[00122] Согласно определенным вариантам реализации гибридизационная матрица содержит устройство для сортировки гетерогенной смеси последовательностей оцДНК посредством последовательность-специфичной гибридизации данных последовательностей с комплементарными олигонуклеотидами, иммобилизированными в формате с заданным положении. См., например, патент США №5,759,779. Следует понимать, что гибридизационные матрицы могут принимать множество физических форм. Согласно определенным вариантам реализации гибридизационные матрицы характеризуются способностью приводить гетерогенный образец или оцДНК (т.е. библиотеку соединений формулы (I)) в контакт с комплементарными олигонуклеотидами, которые были иммобилизированы на поверхность матрицы. Комплементарные олигонуклеотиды будут иммобилизированы на поверхность матрицы способом, который делает возможным, обеспечивает или способствует последовательность-специфичной гибридизации оцДНК с иммобилизированными олигонуклеотидами, тем самым иммобилизируя также оцДНК. Согласно определенным вариантам реализации оцДНК, которые были иммобилизированы посредством общей последовательности, можно независимо удалить из матрицы для образования подпула.
[00123] Согласно некоторым вариантам реализации гибридизационная матрица будет представлять собой заготовку, содержащую прямоугольный лист пластика от 0,1 до 100 мм толщиной, в котором были проделаны серии отверстий, называемые «элементами». Согласно определенным вариантам реализации на нижней и верхней сторонах листа будут приклеены фильтрующие мембраны. Согласно определенным вариантам реализации в элементах, захваченных между фильтрующими мембранами, будет находиться твердая поверхность или совокупность твердых поверхностей, называемая «твердая подложка». Согласно определенным вариантам реализации в любом данном элементе на твердой подложке будет иммобилизирована одна последовательность олигонуклеотидов.
[00124] Согласно определенным вариантам реализации библиотеку молекул формулы (I или II) можно отсортировать на матрице, позволяя водному раствору библиотеки протекать над элементами и через них. Согласно определенным вариантам реализации по мере того как члены библиотеки приводятся в контакт с олигонуклеотидами в элементах, несущих комплементарные последовательности, они становятся иммобилизированными в пределах элемента. Согласно определенным вариантам реализации после завершения гибридизации элементы матрицы можно расположить над принимающим сосудом, таким как 96-луночный планшет или 384-луночный планшет. Согласно определенным вариантам реализации к каждому элементу можно добавить щелочной раствор, который вызывает дегибридизацию ДНК, и раствор перенесет библиотеку, теперь подвижную, в принимающий сосуд. Также возможны другие способы дегибридизации, такие как применение горячего буфера или денатурирующих средств. Таким образом, согласно определенным вариантам реализации библиотеку молекул можно сортировать на подпулы последовательность-специфичным способом.
[00125] Следует понимать, что заготовка, описанная выше, может быть изготовлена из пластика, керамики, стекла, полимера или металла. Следует понимать, что твердые подложки могут быть изготовлены из смолы, стекла, металла, пластика, полимера или керамики, и что подложки могут являться пористыми или непористыми. Следует понимать, что большие площади поверхности на твердых подложках позволяют иммобилизировать большие количества комплементарных олигонуклеотидов, и в элементе могут быть захвачены большие количества подпулов библиотеки. Следует понимать, что твердые подложки могут удерживаться в их соответствующих элементах фильтрующими мембранами, изготовленными из полиамида, пластика, ткани, полимера, стекла, керамики или металла. Следует понимать, что твердые подложки могут удерживаться в их соответствующих элементах средствами, отличными от фильтрующих мембран, такими как клей, связывающие вещества или образование ковалентной связи подложки с заготовкой и/или с другими подложками. Следует понимать, что элементы могут представлять собой отверстия в заготовке или могут представлять собой не отверстия в заготовке, а независимые конструкции, которые можно вынуть из заготовки или поместить в нее. Следует понимать, что форма заготовки не обязательно должна быть прямоугольной с элементами, упорядоченными в 2-х измерениях, но она может быть цилиндрической или может представлять собой прямоугольную призму с элементами, упорядоченными в одном измерении или 3-х измерениях. См., например, патент США №5,759,779.
[00126] Библиотеки молекул формулы (I) можно представить в виде популяций фенотипов, привязанных к их соответствующим генотипам. Такую популяцию можно подвергнуть давлению отбора, которое удаляет менее соответствующие индивидуальные образцы из популяции и позволяет более соответствующим членам пройти отбор. Генотипы олигонуклеотида G популяции второго поколения - те, которые прошли отбор, - можно амплифицировать методом ПЦР, повторно транслировать и подвергнуть другому, более строгому отбору в отношении того же свойства или отбору в отношении некоторого ортогонального свойства. Субпопуляцию, прошедшую отбор, можно также секвенировать, как правило, с применением методик глубокого секвенирования или секвенирования нового поколения, и данные секвенирования можно проанализировать для идентификации кодируемых частей (фенотипов), которые соответствуют наилучшим образом.
[00127] Можно провести множество типов отбора. Наиболее обычный отбор проводят для обнаружения индивидуальных образцов в популяции, способных к связыванию с белком-мишенью. Согласно определенным вариантам реализации способ проведения такого отбора заключается в иммобилизации белка-мишени на твердой подложке, такой как поверхность лунки на планшете NUNC MAXISORP®, или посредством биотинилирования мишени и иммобилизации на покрытых стрептавидином магнитных частицах. Согласно определенным вариантам реализации после иммобилизации мишени популяцию молекул формулы (I) инкубируют с мишенью на подложке. Все индивидуальные образцы, способные к связыванию с мишенью, будут связываться и станут иммобилизированными. Промывка твердой подложки соответствующим буфером удаляет несвязавшиеся молекулы. Согласно определенным вариантам реализации ДНК, кодирующую связывающиеся молекулы, можно амплифицировать методом ПЦР и направить на секвенирование для повторной трансляции и подвергнуть другому раунду отбора.
[00128] Согласно определенным вариантам реализации отбор можно проводить способом, который отбирает индивидуальные образцы, которые связываются с одним белком-мишенью, для исключения отличного, нецелевого белка или ряда нецелевых белков. В данном случае для одного способа отбора требуется, чтобы как мишень, так и нецелевая молекула или нецелевые молекулы были иммобилизированы на твердые подложки в отдельных сосудах. Согласно определенным вариантам реализации библиотеку сначала инкубируют с нецелевой молекулой, и индивидуальные образцы, которые могут связываться с нецелевой молекулой, связываются. Согласно определенным вариантам реализации несвязавшиеся образцы аккуратно удаляют из сосуда и переносят в сосуд, содержащий мишень. Таким способом популяцию, в которой проводят отбор в отношении способности связываться с мишенью, сначала истощают в отношении индивидуальных образцов, способных к связыванию с нецелевой молекулой, и отбор позволяет получить индивидуальные образцы, соответствие которых характеризуется как способность связываться с мишенью или как исключение связывания с нецелевой молекулой.
[00129] Согласно определенным вариантам реализации второй способ идентификации кодируемых частей, селективно связывающих одну мишень по сравнению с другой, заключается в осуществлении параллельных отборов в отношении обеих мишеней, а затем в устранении кодируемых частей, демонстрирующих аффинность в отношении обеих мишеней, в течение анализа данных секвенирования.
[00130] Согласно определенным вариантам реализации также можно проводить отбор, в котором проводят отбор в отношении связывающихся образцов с длительными скоростями диссоциации с применением смеси иммобилизированной мишени и свободной мишени. Согласно определенным вариантам реализации библиотеку инкубируют с иммобилизированной мишенью, позволяя связывающимся образцам связываться. Затем добавляют избыток свободной мишени и инкубируют в течение заранее определенного периода времени. В течение данного времени какие-либо связывающиеся образцы, которые высвобождаются от иммобилизированной мишени, а затем снова связываются, с высокой вероятностью снова свяжутся со свободной мишенью. После смывания не связавшихся образцов свободная мишень и что-либо, связанное с ней, также будут смыты. Единственными связывающимися образцами, которые останутся на свободной мишени, будут такие связывающиеся образцы, скорости диссоциации которых являются более длительными, чем заранее определенное время инкубации свободной мишени.
[00131] Способы отбора, описанные в предшествующих абзацах, можно найти в литературе по фаговому дисплею, рибосомному дисплею и мРНК-дисплею. См., например, руководство Amstutz, Patrick, et al., Cell biology: a laboratory handbook, 3rd ed. ELSEVIER, Amsterdam (2006): 497-509, и источники, ссылки на которые приводятся в данном документе.
[00132] В принципе, отбор можно проводить в отношении любого свойства при условии, что могут быть сконструированы средства, которые селективно амплифицируют те индивидуальные образцы в популяции, которые характеризуются свойством, по сравнению с теми индивидуальными образцами, которые им не характеризуются. В принципе, возможен отбор в отношении фармакологически значимых свойств, отличных от связывания с мишенью, и примеры включают, без ограничения, отбор в отношении растворимости в воде, проникновения через клеточные мембраны и нетоксичности.
[00133] Также следует понимать, что синтез библиотеки в достаточных количествах может позволить проводить более одного отбора в данном раунде. Согласно определенным вариантам реализации субпопуляцию прошедших отбор в отношении аффинности к мишени можно выделить, необязательно очистить и подвергнуть второму отбору в отношении аффинности к той же или отличным мишеням или отбору в отношении ортогонального свойства. Согласно определенным вариантам реализации затем подпул прошедших отбор амплифицируют методом ПЦР и секвенируют или амплифицируют и повторно транслируют для проведения последующих отборов.
[00134] Согласно определенным вариантам реализации данные секвенирования анализируют посредством сравнения представительства члена библиотеки в популяции до и после отбора. Согласно определенным вариантам реализации члены, в меньшей степени представленные после отбора, как правило, считаются менее соответствующими, а в большей степени представленные после отбора считаются более соответствующими. Кроме того, данные необязательно анализируют, чтобы определить, какие индивидуальные структурные блоки обеспечивают соответствие, какие пары структурных блоков обеспечивают соответствие, и какие триплеты структурных блоков обеспечивают соответствие при сочетании в одной кодируемой части. Согласно определенным вариантам реализации данные необязательно анализируют, чтобы определить, какие структурные элементы в пределах различных структурных блоков и в пределах различных кодируемых частей обеспечивают соответствие на выбранных членах библиотеки. Согласно определенным вариантам реализации данные анализы обеспечивают информацию, какие члены необходимо синтезировать для независимого анализа, и обеспечивают рекомендации об аналогичных молекулах, которые следует получить и проанализировать, которые могут не являться нативными членами библиотеки. Согласно определенным вариантам реализации алгоритмы трехмерного докинга также позволяют получить информацию о данных процессах.
[00135] Согласно определенным вариантам реализации члены библиотеки, идентифицированные в анализе данных, можно синтезировать с олигонуклеотидной частью или без нее, как правило, с применением тех же или аналогичных условий синтеза, которые применяли при получении библиотеки. Согласно определенным вариантам реализации данные независимо синтезированные образцы затем подвергают различным анализам, которые характеризуют их физические и химические свойства и позволяют высказать предположение об их общем соответствии желаемой задаче. Согласно определенным вариантам реализации данные свойства включают, без ограничения, константу диссоциации, или KD, которая является показателем прочности связывания члена библиотеки с его мишенью, его растворимость в воде, которую измеряют посредством распределения вода/октанол, и его способность проникать в клетки, которую измеряют в клетках СаСо.
[00136] Согласно определенным вариантам реализации идентифицированные члены библиотеки, которые связываются с биомолекулами, можно применять для выяснения биологической функции данной биомолекулы. Согласно определенным вариантам реализации функции множества белков неизвестны, и способ согласно настоящему изобретению обеспечивает готовый путь для обнаружения молекул-зондов, чтобы способствовать установлению данных функций. Согласно определенным вариантам реализации члены библиотеки, идентифицированные способом согласно настоящему изобретению, можно применять для способствования определению, является ли биомолекула специфично пригодной для обнаружения малых молекул и для нацеливания с целью лекарственной интервенции.
[00137] Согласно определенным вариантам реализации эффект в отношении функции биомолекулы, обеспечивающей связывание с ней члена библиотеки, можно проанализировать в анализах in vitro или анализах in vivo, анализах на клетках или бесклеточных анализах. В случае биомолекул с известной функцией можно оценить эффект идентифицированного члена библиотеки в отношении данной функции. Если биомолекула представляет собой фермент, можно оценить эффекты в отношении показателей его активности. Если биомолекула представляет собой сигнальный белок, можно оценить эффекты в отношении клеточной функции, включая жизнеспособность клеток, экспрессию генов клетки или экспрессию клеточного фенотипа. Если мишень представляет собой вирусный белок, можно оценить эффект члена библиотеки в отношении пролиферации и жизнеспособности вируса.
[00138] Согласно определенным вариантам реализации члены библиотеки, идентифицированные посредством отборов, можно также оценить применительно к их эффектам в отношении здоровья животных и человека и растений в экспериментах in vivo.
[00139] Согласно определенным вариантам реализации члены библиотеки, идентифицированные посредством отборов, можно также применять в качестве аффинных реактивов для очистки биомолекулы-мишени. Согласно определенным вариантам реализации идентифицированную кодируемую часть можно иммобилизировать на твердой подложке, и над твердой подложкой можно пропустить гетерогенный раствор, содержащий мишень. Согласно определенным вариантам реализации мишень будет связываться с кодируемой частью и станет иммобилизированной. Согласно определенным вариантам реализации все другие компоненты смеси можно смыть, оставив очищенный образец мишени.
[00140] Настоящее изобретение проиллюстрировано, но не ограничено, следующими примерами. Специалистам в данной области техники понятно, что существует множество эквивалентных методик для осуществления стадий или частей стадий, перечисленных в настоящем документе.
ПРИМЕРЫ
[00141] Вариант реализации молекулы формулы (I) конструируют следующим образом.
[00142] Пример 1: Конструирование библиотеки генов, содержащей 8×109 членов
[00143] Подготовка кодонов для библиотеки генов. 96 двухцепочечных последовательностей ДНК («дцДНК») обеспечивали или заказывали в компании, синтезирующей гены, такой как, среди прочих, Genscript из г. Пискатавэй, Нью-Джерси, Synbio Technologies из г. Монмут-Джанкшн, Нью-Джерси, Biomatik из г. Уилмингтон, Делавер, Epoch Life Sciences из г. Шугар-Лэнд, Техас. Данные последовательности содержали 5 кодирующих участков, состоящих из 20 оснований каждый. Каждый кодирующий участок был фланкирован некодирующим участком, состоящим из 20 оснований (что составляло всего 6 некодирующих участков). Все последовательности кодирующего участка являлись уникальными и были выбраны так, чтобы они не являлись перекрестно-реактивными с другими кодирующими участками и с некодирующими участками. 5 некодирующих участков в молекуле ДНК содержали различные последовательности, но последовательность в каждом положении являлась консервативной среди всех ДНК. Все кодирующие и некодирующие участки были сконструированы так, чтобы характеризоваться аналогичными температурами плавления (между 58°С и 62°С). Кодирующие и некодирующие участки были сконструированы in silico следующим образом. Последовательности ДНК были получены случайным образом in silico.
[00144] После получения рассчитывали температуру плавления и термодинамические свойства (дельта Н, дельта S и дельта G плавления) последовательности с применением метода ближайших соседей. Если рассчитанная Tm и другие термодинамические свойства не попадали в заранее определенный диапазон, желаемый для библиотеки, последовательности отклоняли. Проводили анализ подходящих последовательностей с помощью алгоритмов подобия последовательностей. Последовательности, которые, как было предсказано алгоритмом, являлись в достаточной степени негомологичными, считали не перекрестно-реактивными и сохраняли. Другие последовательности отклоняли. Кодирующие и некодирующие участки иногда выбирали из эмпирических перечней олигонуклеотидов, которые, как было показано, не являются перекрестно-гибридизирующимися. См. публикацию Giaever G, Chu A, Ni L, Connelly С, Riles L, et al. (2002) Functional profiling of the Saccharomyces cerevisiae genome. Nature 418: 387-391. В данной публикации приведены 10000 не перекрестно-реактивных олигонуклеотидов. Рассчитывали Tm каждого олигонуклеотида, и те олигонуклеотиды, которые попадали в заранее определенный диапазон, анализировали с помощью алгоритмов гомологии последовательностей. Те олигонуклеотиды, которые являлись в достаточной степени негомологичными, оставляли.
[00145] Каждый некодирующий участок содержал уникальный сайт рестрикции. Некодирующий участок на 5'-конце матричной цепи содержал сайт распознавания SacI на основаниях 13-18 от 5'-конца. Некодирующий участок на 3'-конце кодирующей цепи содержал сайт рестрикции EcoRI на основаниях 14-19 от 3'-конца матричной цепи. Второй, третий, четвертый и пятый некодирующие участки от 5'-конца матричной цепи содержали сайты распознавания HindIII, NcoI, NsiI и SphI, соответственно, на основаниях 8-13.
[00146] ДНК расщепляли рестрикционным способом для отделения всех кодонов друг от друга. Последовательности ДНК объединяли и растворяли в буфере CUTSMART® от компании New England Biolabs (NEB, Массачусетс) в концентрации приблизительно 20 мкг/мл. Добавляли внутренние рестрикционные ферменты, HINDIII-HF®, NCOI-HF®, NSII-HF® и SPHI-HF® от компании NEB, и проводили расщепление в течение 1 часа при температуре 37°С согласно протоколу производителя фермента. Ферменты инактивировали нагреванием при температуре 80°С в течение 20 минут. После инактивации реакционную смесь выдерживали при температуре 60°С в течение 30 минут, затем охлаждали до температуры 45°С и выдерживали в течение 30 минут, после чего охлаждали до температуры 16°С.
[00147] Проводили комбинаторную реассортацию кодонов для получения библиотеки генов. Для повторной сборки индивидуальных кодонов, полученных в реакции расщепления, в полноразмерные гены, к реакционной смеси добавляли ДНК-лигазу Т4 от компании NEB до концентрации 50 Ед./мл, добавляли дитиотреитол (DTT, Thermo Fisher Scientific, Массачусетс) до концентрации 10 мМ и добавляли аденозин 5'-трифосфат (АТФ, от компании NEB) до концентрации 1 мМ согласно протоколу производителя. Реакцию лигирования проводили в течение 2 часов, и продукт очищали методом электрофореза в агарозном геле. Поскольку липкие концы, образовавшиеся в результате расщепления в одном сайте представленного гена, отжигались с липкими концами всех других продуктов расщепления в том же сайте, произошла полная комбинаторная реассортация. Таким образом, 96 обеспеченных генов, состоящих из 5 кодонов каждый, позволили получить 965 генов. Поскольку в каждом из 5 кодирующих положений присутствовало 96 кодирующих последовательностей, было получено 965=8×109 комбинаций или членов библиотеки.
[00148] Библиотеку генов готовили к трансляции.
[00149] Амплификация библиотеки генов методом ПЦР. На 5'-конце нематричной цепи методом ПЦР с перекрывающимися праймерами присоединяли промотор Т7 с применением следующих компонентов для реакции объемом 50 мкл: 5-кратная высокоточная ДНК-полимераза PHUSION® («полимераза PHUSION®», NEB), 10 мкл; раствор смеси дезоксинуклеотидов (дНТФ), конечная концентрация 200 мкМ; прямой праймер, конечная концентрация 750 нМ; обратный праймер, конечная концентрация, 750 нМ; матрица (следует применять достаточное количество матрицы, чтобы создать в библиотеке выборку с достаточным запасом); диметилсульфоксид (DMSO), 2,5 мкл; «полимераза PHUSION®», 2 мкл. Проводили ПЦР с применением температуры отжига 57°С и температуры элонгации 72°С. Проводили отжиг в течение 5 секунд каждого цикла; проводили элонгацию в течение 5 секунд каждого цикла. Анализировали продукт методом электрофореза в агарозном геле.
[00150] Транскрипция ДНК в РНК. Не очищая продукт ПЦР, проводили реакцию транскрипции в объеме 250 мкл со следующими компонентами реакции: продукт ПЦР, 25 мкл; не содержащая РНКазу вода, 90 мкл; нуклеозидтрифосфаты (НТФ), конечная концентрация каждого 6 мМ; 5-кратный буфер Т7, 50 мкл; РНК-полимераза Т7 NEB, 250 единиц; необязательно можно добавить ингибиторы рибонуклеазы RNasin® (Promega Corporation, Висконсин) до концентрации 200 Ед./мл; необязательно можно добавить пирофосфатазу до концентрации 10 мкг/мл. 5-кратный буфер Т7 содержит: 1 М HEPES-KOH (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), рН 7,5; 150 мМ ацетата магния; 10 мМ спермидина; 200 мМ DTT. Реакцию проводили при температуре 37°С в течение 4 часов. РНК очищали с помощью преципитации с хлоридом лития. Реакцию транскрипции разводили 1 объемом воды. Добавляли LiCl до концентрации 3 М. Центрифугировали при максимальном g при температуре 4°С в течение по меньшей мере 1 ч. Супернатант сцеживали и сохраняли. Чистый осадок представлял собой прозрачный стекловидный гель, который может быть сложно растворить. Чередование мягкого нагревания (минута при температуре 70°С) и осторожного встряхивания на вортексе позволяло ресуспендировать осадок. Анализировали методом электрофореза в агарозном геле, проводили количественное определение и замораживали как можно быстрее во избежание деградации. См., например, публикации Analytical Biochemistry 195, р 207-213. (1991) и Analytical Biochemistry 220, р 420-423, (1994).
[00151] Обратная транскрипция РНК в ДНК. Проводили обратную транскрипцию одноцепочечной РНК («оцРНК») в ходе 2-х этапной процедуры с применением обратной транскриптазы SUPERSCRIPT® III от компании Thermo Fisher Scientific и поставляемого в комплекте буфера для синтеза первой цепи. Первый этап проводили с указанными конечными концентрациями следующих компонентов: дНТФ, 660 мкМ каждого; матрица РНК, ~5 мкМ; праймер, 5,25 мкМ. Компоненты этапа 1 нагревали до температуры 65°С в течение 5 минут, затем выдерживали на льду в течение по меньшей мере 2 мин. Конечные концентрации компонентов этапа 2 являлись следующими: буфер для синтеза первой цепи, 1-кратный; DTT, 5 мМ; ингибитор РНКазы (NEB), 0,01 Ед./мкл, обратная транскриптаза III SUPERSCRIPT®, 0,2 Ед./мкл. Компоненты этапа 2 объединяли, нагревали до температуры 37°С, и после того, как компоненты этапа 1 выдерживали на льду в течение 2 минут, смесь этапа 2 добавляли к смеси этапа 1. Проводили реакцию объединенных частей при температуре 37°С в течение 12 часов. Прохождение реакции контролировали методом электрофореза в агарозном геле. Отбирали образцы реакционной смеси, известного исходного материала РНК и известного продукта или аналога известного продукта, такого как ПЦР-продукт библиотеки. Ко всем образцам добавляли этилендиаминтетрауксусную кислоту («EDTA»), нагревали до температуры 65°С в течение 2 минут, мгновенно охлаждали, а затем анализировали в агарозном геле. оцРНК должна была освободиться от продукта комплементарной ДНК («кДНК»). Продукт кДНК очищали добавлением 1,5 объемов изопропанола и ацетата аммония до концентрации 2,5 М с последующим центрифугированием при 48000 g в течение 1 часа. Осадок кДНК ресуспендировали в дистиллированной воде («dH2O»), и цепь РНК гидролизовали добавлением LiOH до рН 13. Раствор нагревали до температуры 95°С в течение 10 минут. Добавляли 1,05 эквивалента праймеров, специфичных в отношении некодирующих участков, доводили рН до нейтрального с помощью трис(гидроксиметил)аминометана («Трис») и уксусной кислоты, и реакционной смеси позволяли медленно охладиться до комнатной температуры, после чего ее концентрировали и проводили замену буфера на буфер CUTSMART® NEB.
[00152] Удаление концевых некодирующих участков. Продукт оцДНК обратной транскрипции с комплементарными олигонуклеотидами, благодаря которым некодирующие участки становились двухцепочечными, суспендировали в буфере CUTSMART® NEB в концентрации 100 мкг/мл. Добавляли рестрикционные ферменты, SACI-HF® и ECORI-HF® от компании NEB, до концентрации 1 Ед./мкг ДНК. Реакцию расщепления инкубировали в течение 1 часа при температуре 37°С, а затем ферменты инактивировали нагреванием при температуре 65°С в течение 20 минут.
[00153] Адаптеры реакционного центра готовили для трансляции.
[00154] Подготовка адаптеров реакционного центра. Предложены две панели по 96 адаптеров реакционного центра, каждый из которых содержал петлю шпильки, стебель и липкий конец, содержащий антикодирующую последовательность. Одна панель содержала антикодирующую последовательность на 3'-липком конце, которая специфично гибридизировалась с 3'-концевым кодирующим участком матричной цепи, появлявшимся после удаления 3'-концевого некодирующего участка; другая панель содержала антикодирующую последовательность на 5'-липком конце, которая специфично гибридизировалась с 5'-концевым кодирующим участком матричной цепи, появлявшимся после удаления 5'-концевого некодирующего участка. Панель, несущая 3'-липкие концы, содержала 5'-фосфорильную группу. В данном примере участок стебля каждой панели характеризовался той же последовательностью соответствующего концевого некодирующего участка, удаленного ранее в результате рестрикционного расщепления. Участки петли каждой панели несли основание, модифицированное присоединенным реакционным центром, N4-TriGl-амино 2'дезоксицитидин (от компании IBA, Геттинген, Германия). Адаптеры, описанные в настоящем документе, можно заказать в компаниях, синтезирующих олигонуклеотиды ДНК, таких как Sigma Aldrich, Integrated DNA Technologies из г. Коралвилл, Айова, или Eurofins MWG из г. Луисвилл, Кентукки.
[00155] Загрузка адаптеров реакционного центра. Две панели из 96 адаптеров реакционного центра обеспечивали в отдельных лунках и растворяли в буфере ТЕ (Promega, Массачусетс). В каждую лунку фильтровального планшета помещали 15 мкл ионообменной смолы TOYOPEARL® SuperQ-650M (Sigma-Aldrich, Сент-Льюис, Миссури) и промывали 100 мкл 10 мМ НОАс. В отдельные лунки фильтровального планшета переносили аликвоты каждого адаптера реакционного центра, пропорциональные количеству матричной цепи, где их иммобилизировали на смоле. Адаптеры, иммобилизированные на смоле, промывали dH2O, затем пиперидином, а затем диметилформамидом («DMF»). Отдельно готовили 96 реакционных растворов, каждый из которых содержал: 50 мкл DMF, защищенную Fmoc аминокислоту в концентрации 75 мМ, 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метил морфолин тетрафторборат в концентрации 75 мМ, N-метилморфолин в концентрации 90 мМ. Данным смесям позволяли активировать кислоту в течение десяти минут при комнатной температуре, затем добавляли к смоле и проводили реакцию в течение 30 минут. После этого смолу промывали 4 раза по 100 мкл DMF, и стадию сочетания повторяли со свежеприготовленной реакционной смесью, снова промывали DMF, и удаляли защитную группу Fmoc посредством добавления в каждую лунку 50 мкл 20% пиперидина в DMF и инкубации в течение 2 часов при комнатной температуре. Смолу снова промывали 4 раза по 100 мкл DMF, затем 3 раза по 100 мкл dH2O. Нагруженные адаптеры реакционного центра элюировали со смолы 1,5 М NaCl, 50 мМ KOH, 0,01% TRITON™ Х-100. Раствор нейтрализовали посредством добавления Трис до концентрации 15 мМ и НОАс до рН 7,4. Затем нагруженные адаптеры реакционного центра объединяли и обессоливали посредством пропускания над обессоливающим картриджем ZEBA™ НОММ 7K (с номинальным отсечением по молекулярной массе 7K) (Thermo Fisher Scientific, Массачусетс).
[00156] Трансляция библиотеки
[00157] Лигирование нагруженных адаптеров реакционного центра с библиотекой. Проводили замену буфера в расщепленной рестрикционным способом библиотеке матриц с применением центрифужных концентраторов ZEBA™ с НОММ 30K (Thermo Fisher Scientific, Массачусетс) на 50 мМ Трис-HCl, 10 мМ MgCl2, 25 мМ NaCl, рН 7,5 при температуре 25°С. Добавляли 1,1 эквивалента нагруженных адаптеров реакционного центра, специфичных в отношении 3'-конца матричной цепи; добавляли 1,1 эквивалента нагруженных адаптеров реакционного центра, специфичных в отношении 5'-конца матричной цепи, и смесь разводили тем же буфером до концентрации матричной цепи 1 мкМ. Реакционную смесь нагревали до температуры 65°С в течение 10 мин., позволяли охладиться до температуры 45°С в течение 1 ч, и выдерживали при температуре 45°С в течение 4 часов. После охлаждения до комнатной температуры добавляли DTT до концентрации 10 мМ, добавляли АТФ до концентрации 1 мМ и добавляли ДНК-лигазу Т4 до концентрации 50 Ед./мл. Реакцию лигирования проводили при комнатной температуре в течение 12 часов, затем фермент инактивировали нагреванием при температуре 65°С в течение 10 мин., и реакционную смесь медленно охлаждали до комнатной температуры. Проводили замену буфера реакционной смеси и концентрировали на центрифужном концентраторе с номинальным отсечением по молекулярной массе (НОММ) 30K в 150 мМ NaCl, 20 мМ цитрате, 15 мМ Трис, 0,02% додецилсульфате натрия («SDS»), 0,05% Tween 20 (от компании Sigma-Aldrich), рН 7,5.
[00158] Получение гибридизационной матрицы. Гибридизационные матрицы конструировали из заготовок TECAFORM™ (Acetal Copolymer) толщиной ~2 мм с отверстиями, вырезанными станком с числовым программным управлением. На дно заготовки приклеивали нейлоновую сетку 40 микрон от компании ELKO FILTERING с применением двухсторонней клейкой ленты NP200 от компании Nitto Denko. Затем отверстия наполняли твердой подложкой - смолой CM SEPHAROSE® (Sigma Aldrich), которую функционализировали азидогруппой. Смолу функционализировали с применением азидо-ПЭГ-амина с 8 единицами ПЭГ, который заказывали в компании Broadpharm (Сан-Диего, Калифорния). 45 мл упакованной CM SEPHAROSE® загружали на пористую воронку и промывали DMF. Затем смолу суспендировали в 90 мл DMF и проводили реакцию с 4,5 мМ азидо-ПЭГ-амина, 75 мМ EDC, 7,5 мМ HOAt в течение 12 часов при комнатной температуре. Смолу промывали DMF, водой, изопропанолом и хранили в 20% этаноле при температуре 4°С. После этого на верхнюю часть заготовки приклеивали нейлоновую сетку 40 микрон. Азидогруппа позволяет привязывать алкин-связанные олигонуклеотиды к твердой подложке с применением «клик»-химии. Размещение матрицы в адаптер от матрицы к луночному планшету и установка адаптера над лункой планшета обеспечивали захват олигонуклеотидов, «зафиксированных» на азидо-SEPHAROSE®, в регистрирующем устройстве. В каждую лунку адаптера от матрицы к луночному планшету добавляли 30 мкл раствора, содержащего 1 нмоль алкинилолигонуклеотидов, сульфат меди, 625 мкМ трис(3-гидрокси-пропил-триазолил-метил)амина («ТНРТА») (лиганд), 3,1 мМ амино-гуанидина, 12,5 мМ аскорбата, 12,5 мМ фосфатного буфера, рН 7, 100 мМ, и позволяли адсорбироваться на подложке SEPHAROSE®. Через 10 минут раствор центрифугировали из матрицы в планшет, после чего его повторно пипетировали в регистрирующем устройстве обратно в матрицу для второго пути реакции. После второй реакции в течение 10 минут реакционные растворы центрифугировали в луночный планшет, и луночный планшет откладывали в сторону. Матрицу тщательно промывали 1 мМ EDTA и хранили в фосфатном буферном растворе («ФБР») с 0,05% азидом натрия. Каждый реакционный раствор разводили до объема 100 мкл dH2O, загружали на ионообменную смолу из диэтиламиноэтила (DEAE), промывали dH2O для удаления всех реактивов и побочных продуктов реакции за исключением каких-либо невстроенных олигонуклеотидов. Данные растворы анализировали методом высокоэффективной жидкостной хроматографии (ВЭЖХ) для выяснения степени встраивания на основании исчезновения исходного материала. Одна матрица несла олигонуклеотиды, комплементарные одному кодирующему положению в библиотеке матриц. Для каждого кодирующего положения получали отдельную матрицу.
[00159] Сортировка библиотеки посредством последовательность-специфичной гибридизации. Готовую к гибридизации библиотеку разводили до объема 13 мл в 1-кратном буфере для гибридизации (2-кратный солевой раствор цитрата натрия (SSC) + 15 мМ Трис, рН 7,4+0,005% TRITON® X100, 0,02% SDS, 0,05% азид натрия). Для блокирования неспецифичных сайтов связывания нуклеиновой кислоты добавляли 10 мкг транспортной РНК («тРНК»). Выбирали матрицу, соответствующую желаемому кодирующему положению в библиотеке матриц. Матрицу помещали в камеру, которая обеспечивала промежуток 1-2 мм с каждой стороны, и наливали 13 мл раствора библиотеки. Камеру запечатывали и осторожно покачивали в течение 48 часов при температуре 37°С. Матрицу необязательно помещали в устройство, которое обеспечивало нагнетание раствора, содержащего библиотеку, направленным способом через различные элементы в предварительно структурированном пути для более быстрой сортировки библиотеки на матрице.
[00160] Элюирование отсортированной библиотеки с гибридизационной матрицы. Матрицу промывали посредством распечатывания камеры и замены раствора для гибридизации на свежий 1-кратный буфер для гибридизации с последующим покачиванием при температуре 37°С в течение 30 минут. Промывку повторяли 3 раза буфером для гибридизации, затем 2 раза
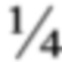
[00161] Проведение химической стадии пептоидного сочетания на отсортированной библиотеке. В каждую лунку фильтровального планшета добавляли аликвоты смолы SuperQ 650М объемом 15 мкл и промывали 100 мкл 10 мМ НОАс. Отсортированную библиотеку переносили в регистрирующее устройство из луночного планшета, в который ее центрифугировали в течение элюирования с гибридизационной матрицы в луночный планшет, несущее ионообменную смолу. Смолу и библиотеку промывали 1 раз 90 мкл 10 мМ НОАс, 2 раза по 90 мкл dH2O, 2 раза по 90 мкл DMF, 1 раз 90 мкл пиперидина. Отдельно готовили раствор, содержащий 100 мМ хлорацетата натрия и 150 мМ 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метил морфолин хлорида в метаноле. В каждую лунку смолы добавляли 40 мкл данного раствора и проводили реакцию при комнатной температуре в течение 30 минут. Промывали смолу 3 раза по 90 мкл метанола, затем повторяли сочетание и промывали 3 раза по 90 мкл метанола, 3 раза по 90 мкл DMSO. Отдельно готовили 2 М (или насыщенные, при необходимости) растворы первичных аминов в DMSO. В каждую лунку смолы добавляли 40 мкл одного раствора первичного амина и проводили реакцию при температуре 37°С в течение 12 ч. Промывали смолу 3 раза по 90 мкл DMSO, 3 раза по 90 мкл 10 мМ уксусной кислоты (НОАс), 3 раза по 90 мкл dH2O. Элюировали библиотеку ДНК с ионообменной смолы 1,5 М NaCl, 50 мМ NaOH, 0,005% TRITON® Х-100 тремя частями по 30 мкл. Все реакционные смеси объединяли и нейтрализовали раствор добавлением Трис до концентрации 15 мМ и НОАс до рН 7,4. Концентрировали и проводили замену буфера на 1-кратный буфер для гибридизации.
[00162] Завершение синтеза библиотеки. С применением протоколов, описанных выше, для сортировки библиотеки на гибридизационных матрицах и с применением протоколов, описанных выше, для проведения пептидной или пептоидной химии либо таковых, описанных ниже в примерах 10-32 для проведения других химических стадий, проводили еще три стадии сортировки и синтеза, и библиотеку полностью транслировали.
[00163] Подготовка библиотеки для отбора. После завершения трансляции библиотеки одноцепочечные участки необязательно преобразовывали в двухцепочечные посредством объединения библиотеки в качестве матрицы в dH2O в концентрации, меньшей или равной 1,0 мкМ, в 1-кратном буфере DREAMTAQ™, с 1000-кратными дНТФ [матрица], с полимеразой DREAMTAQ™ в концентрации 0,2 Ед./мкл и с добавлением эквимолярного количества MgCl2 для каждого дНТФ. Отметим, что адаптер реакционного центра на 3'-конце будет выступать в качестве праймера для данной реакции. Нагревали смесь до температуры 95°С в течение 2 минут, затем проводили отжиг при температуре 57°С в течение 10 секунд и проводили элонгацию при температуре 72°С в течение 10 минут. Реакционную смесь очищали преципитацией этанолом.
[00164] Отбор лигандов, которые связываются с белком-мишенью, представляющим интерес. 5 мкг стрептавидина в 100 мкл ФБР иммобилизировали в 4 лунках планшета MAXISORP™ при покачивании при температуре 4°С в течение ночи. Лунки промывали ФБРТ (ФБР с Tween 20) 4 раза по 340 мкл. Две лунки блокировали 200 мкл казеина, а 2 другие - БСА (бычьим сывороточным альбумином) в концентрации 5 мг/мл в течение 2 часов при комнатной температуре. Лунки промывали ФБРТ 4 раза по 340 мкл. В лунку, блокированную казеином, и в лунку, блокированную БСА, добавляли 5 мкг биотинилированного белка-мишени в 100 мкл ФБР и инкубировали с покачиванием при комнатной температуре в течение 1 часа (протокол биотинилирования белков см. в публикации Elia, G. 2010. Protein Biotinylation. Current Protocols in Protein Science. 60:3.6:3.6.1-3.6.21). В каждую лунку, в которую НЕ вносили белок-мишень, добавляли аликвоту транслированной библиотеки объемом 100 мкл в ФБР с Tween 20 (ФБРТ), в две лунки, в которые вносили белок-мишень, добавляли 100 мкл ФБРТ. Образцы инкубировали с покачиванием при комнатной температуре в течение 1 часа. Буфер аккуратно отсасывали из лунки, содержащей иммобилизированный белок-мишень и исключительно ФБРТ. Буфер, содержащий библиотеку, в лунках без мишени аккуратно переносили в лунки, содержащие мишень. В лунки без мишени добавляли 100 мкл ФБРТ. Все лунки инкубировали в течение 4 часов с покачиванием при комнатной температуре. Библиотеку аккуратно отбирали пипеткой и хранили. Лунки промывали 4 раза по 340 мкл ФБРТ. Для элюирования членов библиотеки, прочно связанных с белком-мишенью, к лункам добавляли избыток биотина в 100 мкл ФБРТ и инкубировали в течение 1 часа при температуре 37°С. Буфер аккуратно отсасывали и применяли в качестве матрицы для реакции ПЦР.
[00165] Анализ результатов отбора. Продукты ПЦР из библиотеки до и после отбора направляли на глубокое секвенирование с применением праймеров и протоколов согласно требованиям поставщиков услуг по секвенированию ДНК. Поставщики включают компании Seqmatic из г. Фримонт, Калифорния и Elim BioPharm из г. Хейворд, Калифорния. Анализировали кодирующие последовательности на концевых и внутренних кодирующих участках каждой секвенированной цепи, чтобы установить структурные блоки, которые применяли при синтезе кодируемой части. Относительная частота идентифицированных членов библиотеки до и после отбора позволяет высказать предположение о степени, в которой популяция становится обогащенной членом библиотеки в результате отбора. Анализ различных химических подгрупп, которые содержат члены библиотеки, прошедшие отбор, демонстрирует степень, в которой такие фрагменты обеспечивают соответствие члена библиотеки, и результаты данного анализа применяли для получения более соответствующих молекул или для предсказания аналогичных молекул с целью независимого синтеза и анализа.
[00166] Пример 2: Получение и трансляция библиотеки с одним адаптером реакционного центра.
[00167] Библиотеку с одним адаптером реакционного центра получали точно так же, как описано в примере 1, за исключением того, что опускали стадии (а) удаления одного из концевых некодирующих участков и (b) лигирования соответствующего адаптера реакционного центра.
[00168] Пример 2а: Получение и трансляция библиотеки с одним адаптером реакционного центра на 5'-конце G. Для получения библиотеки с одним адаптером реакционного центра на 5'-конце кодирующей цепи G библиотеку можно получить точно так же, как описано в примере 1, за исключением того, что на стадии «удаление концевых некодирующих участков» единственной добавленной рестрикционной эндонуклеазой должна быть SacI. Данный подход позволяет удалить 5'-концевой некодирующий участок, в результате чего 5'-нагруженные адаптеры реакционного центра можно соответствующим образом гибридизировать и лигировать с матричной цепью. Применение исключительно рестрикционной эндонуклеазы, специфичной в отношении сайта распознавания на 5'-концевом некодирующем участке, и исключение рестрикционной эндонуклеазы, специфичной в отношении сайта распознавания на 3'-концевом некодирующем участке, позволит оставить 3'-концевой некодирующий участок на месте, препятствуя лигированию 3'-адаптеров реакционного центра с данным концом. Добавление 5'-нагруженных адаптеров реакционного центра на стадии «лигирование нагруженных адаптеров реакционного центра с библиотекой» проводили, как описано в примере 1. Добавление 3'-нагруженных адаптеров реакционного центра на данной стадии опускали. Адаптер реакционного центра в данном примере может содержать более одного стебля, более одной петли и более одного линкера, как описано в примере 3, примере 4а и примере 4b. Специалист в данной области техники понимает, что удаление 5'-концевого некодирующего участка, как описано выше, можно осуществить с применением способа, описанного в примерах 6а и 6b. Специалист в данной области техники понимает, что в 5'-концевом кодирующем участке можно сконструировать другие сайты рестрикции, и что для данной цели можно применять различные рестрикционные ферменты.
[00169] Пример 2b: Получение и трансляция библиотеки с одним адаптером реакционного центра на 3'-конце G. Для получения библиотеки с одним адаптером реакционного центра на 3'-конце кодирующей цепи G библиотеку можно получить точно так же, как описано в примере 1, за исключением того, что на стадии «удаление концевых некодирующих участков» единственной добавленной рестрикционной эндонуклеазой должна быть EcoRI. Данный подход позволяет удалить 3'-концевой некодирующий участок, в результате чего 3'-нагруженные адаптеры реакционного центра можно соответствующим образом гибридизировать и лигировать с матричной цепью. Применение исключительно рестрикционной эндонуклеазы, специфичной в отношении сайта распознавания на 3'-концевом некодирующем участке, и исключение рестрикционной эндонуклеазы, специфичной в отношении сайта распознавания на 5'-концевом некодирующем участке, позволяет оставить 5'-концевой некодирующий участок на месте, препятствуя лигированию 5'-адаптеров реакционного центра к данному концу. Добавление 3'-нагруженных адаптеров реакционного центра на стадии «лигирование нагруженных адаптеров реакционного центра с библиотекой» проводили, как описано в примере 1. Добавление 5'-нагруженных адаптеров реакционного центра на данной стадии опускали. Адаптер реакционного центра в данном примере может содержать более одного стебля, более одной петли и более одного линкера, как описано в примере 3, примере 4а и примере 4b. Специалист в данной области техники понимает, что удаление 3'-концевого некодирующего участка, как описано выше, можно осуществить с применением способа, описанного в примере 6b. Специалист в данной области техники понимает, что в 3'-концевом кодирующем участке можно сконструировать другие сайты рестрикции, и что для данной цели можно применять различные рестрикционные ферменты.
[00170] Пример 2с. Получение и трансляция библиотеки с адаптерами реакционного центра, лигированными в различных точках в течение синтеза. Можно получить библиотеку с 2 адаптерами реакционного центра, в которой один адаптер реакционного центра лигирован с матричным олигонуклеотидом G, на него введены некоторые позиционные структурные блоки, а затем второй адаптер реакционного центра лигирован с G. Данный подход осуществляли на первом этапе посредством применения способа примера 2а или примера 2b. Затем на втором этапе вводили 1 или несколько позиционных структурных блоков с применением стадий примера 1 «Сортировка библиотеки посредством последовательность-специфичной гибридизации» и «Элюирование отсортированной библиотеки с гибридизационной матрицы» и любых химических стадий для введения позиционных структурных блоков, как описано в примере 1, таких как пептидное сочетание или пептоидное сочетание, или любых стадий химических способов, описанных в примерах 10-32. Затем на третьем этапе второй адаптер реакционного центра лигировали с G. Специалист в данной области техники понимает, что удаление второго концевого некодирующего участка можно осуществить непосредственно перед лигированием второго адаптера реакционного центра, или что химические стадии для введения позиционных структурных блоков можно осуществить между удалением второго концевого некодирующего участка и лигированием второго адаптера реакционного центра.
[00171] Пример 3: Получение и трансляция библиотеки с 2 или более реакционными центрами на адаптер реакционного центра.
[00172] Библиотеку с множеством реакционных центров на одном адаптере можно получить точно так же, как описано в примере 1 или примере 4а, за исключением того, что будут обеспечены шпильки адаптера реакционного центра, которые несут 2 (или более) оснований, модифицированных реакционными центрами, таких как таковые, описанные в примере 1 или 4а. Возможно несколько вариантов расположения модифицированных оснований реакционного центра, включая расположение реакционных центров, несущих основания, возле любого конца стебля или расположение обоих реакционных центров в участке петли. Когда применяют только один адаптер или когда применяют два адаптера, на адаптер можно поместить множество реакционных центров. Такие адаптеры реакционного центра синтезируют или заказывают в компаниях, синтезирующих олигонуклеотиды ДНК, таких как Sigma Aldrich, Integrated DNA Technologies из г. Коралвилл, Айова или Eurofins MWG из г. Луисвилл, Кентукки.
[00173] Пример 4а: Получение и трансляция библиотеки с альтернативными шпильками в адаптере реакционного центра.
[00174] Множество версий шпилек можно получить и применять в различных контекстах с помощью протоколов, описанных в примере 1. В случаях, когда предпочтительной является более маленькая шпилька, стебель может содержать всего лишь 5 пар оснований. Также большую петлю ДНК могут заменить шпильки, состоящие из линкера из 6 ПЭГ между комплементарными последовательностями стебля. См. публикацию Durand, М., et al. "Circular dichroism studies of an oligodeoxyribonucleotide containing a hairpin loop made of a hexaethylene glycol chain: conformation and stability." Nucleic acids research 18.21 (1990): 6353-6359). В случаях, когда предпочтительным является полидисплей, может быть важным расстояние между несколькими кодируемыми частями на данной шпильке и расположение данных кодируемых частей
[00175] Расстояние между кодируемыми частями варьируют и подстраивают под потребности конкретного проекта. Посредством введения одного линкера в участок петли шпильки или возле него и второго линкера в антикодирующую последовательность или возле нее, или возле антикодирующей последовательности в любой цепи двухцепочечного участка стебля, расстояние между кодируемыми частями увеличивают или уменьшают в результате увеличения или уменьшения числа оснований, составляющих стебель. Аналогично, расстояние между кодируемыми частями увеличивают или уменьшают посредством размещения одного линкера в участок петли или возле него, сохраняя число нуклеотидов в стебле постоянным, но варьируя расположение второго линкера вдоль длины стебля. Необязательно, если оба линкера помещены в участок стебля, число нуклеотидов, разделяющих их, варьируют для соответствия потребностям проекта. Оба линкера можно необязательно поместить в участок петли, и число оснований между ними можно варьировать для соответствия потребностям проекта.
[00176] Когда расположение кодируемой части на шпильке является важным, например, в случаях, когда кодируемая часть, помещенная вдоль стебля, характеризуется отличной доступностью для молекулы-мишени, чем кодируемая часть, помещенная в петлю, применяют шпильки с множеством петель и стеблей. Согласно одному варианту реализации шпилька может содержать 2 или 3 петли и 2 стебля. Данная шпилька может содержать антикодирующий участок, присоединенный к первой цепи первого участка стебля, который присоединен к первому участку петли, присоединенному к первой цепи второго участка стебля, который присоединен ко второму участку петли, присоединенному ко второй цепи второго участка стебля, который необязательно присоединен к третьему участку петли, а затем - ко второй цепи первого участка стебля или напрямую ко второй цепи первого участка стебля. Один или несколько линкеров помещают в одну или несколько петель и в один или несколько участков стебля, в зависимости от требований для конкретного проекта.
[00177] Специалист в данной области техники понимает, что возможно множество вариантов третичной структуры шпильки, которые содержат множество вторичных структур, включая, без ограничения, внутренние петли, выпячивания и крестообразные структуры, как описано в публикациях Svoboda, P. et al. Cellular and Molecular Life Sciences CMLS, April 2006, Volume 63, Issue 7, pp 901-908, and in Bikard, et al., Microbiology And Molecular Biology Reviews, Dec. 2010, p. 570-588, and in Kari, et al., DNA Computing Volume 3892 of the series Lecture Notes in Computer Science pp 158-170 и Domaratzki, Theory Comput Syst (2009) 44: 432-454, Brazda, et al, BMC Molecular Biology 2011 12:33. Специалист в данной области техники понимает, что олигонуклеотидные последовательности шпильки, содержащие такие вторичные и третичные структуры, синтезируют множество компаний, синтезирующих ДНК, таких как Sigma-Aldrich, Integrated DNA Technologies (Коралвилл, Айова), Eurofins MWG (Луисвилл, Кентукки). Следует понимать, что модифицированное основание, несущее реакционный центр для введения линкера, или несущее линкер и реакционный центр, в течение процесса синтеза можно поместить в любые желаемые расположения в шпильке. Специалист в данной области техники понимает, что шпильки, которые содержат большее число вторичных структур и/или большее количество информации, будут иметь тенденцию состоять из более длинных нуклеотидных последовательностей.
[00178] Пример 4b: Получение и трансляция библиотеки с альтернативными шпильками в адаптере реакционного центра.
[00179] Множество версий шпилек можно получить и применять в различных контекстах с теми же протоколами, описанными в примере 1. Последовательность участка стебля адаптера реакционного центра может содержать один или несколько сайтов рестрикции, чтобы обеспечить расщепление в участке стебля или возле него. Рестрикционное расщепление в данных сайтах может сделать возможным высвобождение связывающихся образцов, очень плотно связавшихся с иммобилизированными мишенями, и способствовать ПЦР-амплификации в результате удаления участка петли, что сделает возможным надлежащий отжиг праймеров. В адаптере реакционного центра шпильки ДНК также может быть закодирована другая информация. Один пример представляет собой серию разнообразных оснований, включенных в участок петли. При амплификации после отбора данные разнообразные основания помогут идентифицировать членов библиотеки, которые были обогащены при отборе в связи с ошибками амплификации или как артефакты. Другой пример представляет собой специфичную последовательность, содержащую информацию относительно истории отбора или синтеза молекулы, которая подобна индексной последовательности, описанной в примере 7. Шпильки могут также содержать флуоресцентно меченные основания или аналоги оснований, меченные радиоактивным изотопом основания или аналоги оснований для количественного определения и анализа различных аспектов библиотеки и ее синтеза или рабочих характеристик. Шпильки могут также содержать основания или модифицированные основания, несущие функциональные группы, которые способствуют обработке, такие как биотин. Такие шпильки можно заказать в компаниях, являющихся признанными поставщиками изготовляемых на заказ олигонуклеотидов ДНК, таких как IDT из г. Коралвилл, Айова, Sigma Aldrich или Eurofins MWG из г. Луисвилл, Кентукки.
[00180] Пример 4с. Лигирование адаптера реакционного центра с матричной цепью с помощью других химических способов. Адаптер реакционного центра отжигали на концевом кодирующем участке матричного гена и лигировали ДНК-лигазой Т4, как в примере 1. Можно применять другие способы ковалентного привязывания адаптера реакционного центра, включая химические или ферментативные способы. Нагруженные адаптеры реакционного центра лигировали химическими способами с применением реактивов, таких как растворимый в воде карбодиимид и бромистый цианоген, согласно публикациям Shabarova, et al. (1991) Nucleic Acids Research, 19, 4247-4251), Fed-erova, et al. (1996) Nucleosides and Nucleotides, 15, 1137-1147, GryaZnov, Sergei M. et al. J. Am. Chem. Soc., vol. 115:3808-3809 (1993) и Carriero and Darnlia (2003) Journal of Organic Chemistry, 68, 8328-8338. Химическое лигирование необязательно проводили с применением 5 М бромистого цианогена в ацетонитриле при соотношении 1:10 об./об. с 5'-фосфорилированной ДНК в буфере, содержащем 1 М MES и 20 мМ MgCl2 при рН 7,6, реакцию проводили при температуре 0 градусов в течение 5 минут. Лигирование также можно проводить с помощью топоизомераз, полимераз и лигаз с применением протоколов производителя.
[00181] Пример 5: Получение и трансляция библиотеки с одноцепочечными концевыми кодирующими участками.
[00182] Библиотеку меньшего стерического объема получали посредством удаления олигонуклеотида с концевого кодирующего участка адаптера реакционного центра, чтобы концевой кодирующий участок и необязательно весь участок стебля или его часть стали одноцепочечными. Процесс проводили точно так же, как описано в примере 1, за следующим исключением. Дезоксиуридин встраивали в предложенные адаптеры реакционного центра в расположениях в антикодирующей последовательности и в стебле между концом антикодирующего участка и ближайшим линкером. После последовательность-специфичной гибридизации и лигирования нагруженных адаптеров реакционного центра с матричной цепью проводили замену буфера библиотеки на 1-кратный реакционный буфер UDG от компании NEB, добавляли урацил-ДНК-гликозилазу («UDG») в концентрации 20 Ед./мл и инкубировали в течение 30 минут при температуре 37°С согласно протоколу производителя. Последующее нагревание до температуры 95°С при рН 12 в течение 20 минут гидролизовало апиримидиновые сайты в шпильке. Полученные небольшие фрагменты оцДНК удаляли методом эксклюзионной хроматографии с применением буфера, температуру которого поддерживали на 65°С.
[00183] Пример 5а. Удаление олигонуклеотида с концевого кодирующего участка адаптера реакционного центра необязательно проводили в нескольких точках в течение выполнения примера 1. Олигонуклеотид можно необязательно удалить точно так же, как описано в примере 1, за исключением того, что процедуру в примере 5 проводили после лигирования нагруженного адаптера реакционного центра, но до добавления первого позиционного структурного блока. Олигонуклеотид можно необязательно удалить точно так же, как описано в примере 1, за исключением того, что процедуру в примере 5 проводили после добавления первого позиционного структурного блока, но до добавления любого последующего позиционного структурного блока. Олигонуклеотид можно необязательно удалить точно так же, как описано в примере 1, за исключением того, что процедуру в примере 5 проводили после добавления всех позиционных структурных блоков. Специалист в данной области техники понимает, что задачу расщепления цепи ДНК в желаемом расположении можно выполнить множеством способов, и что существует множество коммерчески доступных ферментов и опубликованных протоколов, облегчающих данную задачу; например, компания New England Biolabs продает по меньшей мере 10 никующих эндонуклеаз и публикует протоколы для их применения. Конкретные примеры, приведенные в настоящем документе, являются иллюстративными и не исключают другие способы выполнения задачи по преобразованию концевого кодирующего участка и необязательно части шпильки в одноцепочечные.
[00184] Пример 6а: Удаление 5'-концевого некодирующего участка с применением UDG.
[00185] Рестрикционное расщепление, применяемое для удаления 5'-концевого некодирующего участка в примере 1, не применяли и заменяли обработкой UDG и последующим щелочным гидролизом апиримидинового сайта. Библиотеку получали точно так же, как описано в примере 1, но в данном случае в инициирующие олигонуклеотиды в ходе обратной транскрипции встраивали основание dU на 3'-конец праймера или возле него. После обратной транскрипции и гидролиза оснований цепи РНК UDG может удалить урацил, создавая апиримидиновый сайт, который затем расщепляли под действием температуры и щелочи (см. информацию о применении UDG и условиях реакции в примере 5), получая концевой кодирующий участок, готовый к лигированию с нагруженным адаптером реакционного центра. Специалист в данной области техники понимает, что существует множество способов расщепления одноцепочечной или двухцепочечной ДНК в желаемом положении, и что существует множество коммерчески доступных ферментов и опубликованных протоколов, облегчающих данную задачу. Конкретные примеры, приведенные в настоящем документе, являются иллюстративными и не исключают другие способы выполнения задачи удаления 5'-концевого некодирующего участка.
[00186] Пример 6b: Удаление 5'-концевого некодирующего участка или 3'-концевого некодирующего участка с применением рестрикционного фермента NdeI.
[00187] Рестрикционное расщепление, применяемое для удаления 5'-концевого кодирующего участка или 3'-концевого кодирующего участка или обоих данных участков, осуществляли посредством включения сайта распознавания NdeI в концевой некодирующий участок и осуществления рестрикционного расщепления после стадии обратной транскрипции. NdeI обладает способностью разрезать гибриды РНК/ДНК, а также разрезать одноцепочечную ДНК. Таким образом, NdeI применяли для разрезания оснований цепи РНК до или после гидролиза или как до, так и после гидролиза.
[00188] Пример 6с: Удаление 5'-концевого некодирующего участка с применением оснований РНК в праймере для обратной транскрипции. 5'-концевой некодирующий участок удаляли с применением протокола примера 1, за исключением того, что праймер, применявшийся на стадии «обратная транскрипция РНК в ДНК», содержал основание РНК. После гидролиза цепи РНК продукта обратной транскрипции, как описано в примере 1, основание РНК в праймере ДНК также было гидролизовано, благодаря чему была удалена часть праймера ДНК, которая является 5'-концевой от основания РНК.
[00189] Пример 7: Индексные молекулы формулы (I).
[00190] Кодирующий участок откладывали в сторону или добавляли для применения в качестве участка индексирования. После получения и трансляции библиотеки, как описано в примере 1, библиотеку отсортировали на гибридизационной матрице с помощью кодирующего участка, отложенного для индексирования. Подпулы, полученные в результате такой сортировки, применяли для различных целей, проводили отбор в отношении различных свойств, в отношении различных мишеней или в отношении одной мишени при различных условиях. Продукты различных отборов необязательно независимо амплифицировали методом ПЦР, повторно объединяли с другими подпулами и повторно транслировали, как описано в примере 1.
[00191] Пример 8а: Получение библиотеки генов альтернативным способом.
[00192] В примере 1 описана одновременная комбинаторная реассортация всех кодонов посредством рестрикционного расщепления во всех внутренних некодирующих участках предложенных последовательностей генов библиотеки с последующим лигированием. Данный процесс необязательно выполняли последовательно, а не одновременно. Использовали те же условия реакции, представленные в примере 1 на стадии «ДНК расщепляли рестрикционным способом для отделения всех кодонов друг от друга», за исключением того, что добавляли одну рестрикционную эндонуклеазу вместо всех эндонуклеаз. Затем с применением тех же условий реакции, представленных в примере 1 на стадии «проводили комбинаторную реассортацию кодонов для получения библиотеки генов», продукты рестрикционного расщепления повторно лигировали друг с другом. Продукт лигирования очищали методом электрофореза в агарозном геле, амплифицировали методом ПЦР, а затем разрезали следующим рестрикционным ферментом. Процесс повторяли до тех пор, пока библиотека генов не была завершена.
[00193] Пример 8b: Получение библиотеки генов альтернативным способом.
[00194] В примерах 1 и 8а описана комбинаторная реассортация всех кодонов посредством рестрикционного расщепления во всех внутренних некодирующих участках с последующим лигированием. Согласно некоторым вариантам реализации предпочтительной является неполная комбинаторная реассортация кодонов для получения популяции с заметно более низкой сложностью. Такую библиотеку генов получали посредством разделения смеси из 96 последовательностей генов, описанных в примере 1, на несколько аликвот. Затем каждую аликвоту расщепляли рестрикционным способом с помощью различных комбинаций 1-3 рестрикционных ферментов с применением условий реакции, представленных в примере 1 на стадии «ДНК расщепляли рестрикционным способом для отделения всех кодонов друг от друга», или в примере 8а. После инактивации рестрикционных ферментов нагреванием независимые продукты расщепления повторно лигировали, как в протоколе примера 1 на стадии «проводили комбинаторную реассортацию кодонов для получения библиотеки генов». Продукты объединяли и очищали методом электрофореза в агарозном геле, амплифицировали методом ПЦР, и остальные процедуры получения библиотеки и трансляции и отбора проводили, как описано в примере 1.
[00195] Пример 8с: Осуществление перетасовки генов или реакции кроссинговера на библиотеке. После трансляции и отбора библиотеки, такой как библиотека, описанная в примере 1, или в примере 8а, или в примере 8b, проведение перетасовки генов позволит получить новые фенотипы потомства, ранее не присутствующие в библиотеке, или позволит получить фенотипы потомства, которые представляют собой перевыборку фенотипов, прошедших отбор. Библиотеку после проведения отбора амплифицировали методом ПЦР. Продукт ПЦР разрезали на некоторое количество аликвот, и с каждой аликвотой проводили манипуляции согласно протоколу, описанному в примере 8, или необязательно согласно протоколу, описанному в примере 1 на стадиях «ДНК расщепляли рестрикционным способом для отделения всех кодонов друг от друга» и «проводили комбинаторную реассортацию кодонов для получения библиотеки генов». Продукты расщепления/повторного лигирования объединяли, очищали и амплифицировали, как описано в примере 1 или 8b, и проводили последующие раунды получения библиотеки, трансляции и отбора, как описано в примере 1.
[00196] Пример 9: Получение и трансляция библиотеки с альтернативными функциональными группами реакционного центра и линкерами.
[00197] Библиотеку с применением отличного исходного реакционного центра из свободного амина получали несколькими способами. Один способ заключается в кэпировании существующего исходного реакционного центра функциональной группой с бифункциональной молекулой, несущей желаемую функциональную группу исходного реакционного центра. Библиотеку получали точно так же, как описано в примере 1, за исключением того, что на стадии «загрузка адаптеров реакционного центра» для каждого адаптера реакционного центра, на котором являлся желательным отличный исходный реакционный центр, образовывалась пептидная связь между амином функциональной группы исходного реакционного центра с бифункциональным соединением, несущим карбоновую кислоту, и желаемой функциональной группой исходного реакционного центра с применением условий реакции пептидного сочетания, перечисленных на данной стадии. Например, можно провести реакцию 5-гидроксипентановой кислоты со свободным амином с образованием пептидной связи и создать гидроксильную функциональную группу в качестве исходного реакционного центра для синтеза библиотеки.
[00198] Второй способ заключается во встраивании отличного основания, модифицированного отличным реакционным центром, что делает возможным или способствует введению других функциональных групп желаемого исходного реакционного центра. Одно такое основание представляет собой 5-этинил-dU-СЕ фосфорамидит («этинил-dU»), поставляемый компанией Glen Research в Вирджинии. Его необязательно модифицируют бифункциональным линкерным соединением, несущим азид и желаемую функциональную группу исходного реакционного центра. Например, можно провести реакцию 5-азидопентановой кислоты с алкинильным фрагментом в «клик»-реакции (реакции Хьюсгена) в условиях, представленных в примере 25, обеспечивая карбоновую кислоту в качестве функциональной группы исходного реакционного центра. В качестве другого репрезентативного, но не исключающего примера, можно провести реакцию 5-азидо 1-пентаналя с алкинильным фрагментом в «клик»-реакции (реакции Хьюсгена), обеспечивая альдегид в качестве функциональной группы исходного реакционного центра. В качестве другого репрезентативного примера можно провести реакцию 4-азидо, 1-бромметилбензена с алкинильным фрагментом в «клик»-реакции (реакции Хьюсгена), обеспечивая бензилгалогенид в качестве функциональной группы исходного реакционного центра. Данное основание необязательно применяют в качестве алкинильного исходного реакционного центра для синтеза библиотеки с применением химических способов, соответствующих выбранным алкинам из примеров 10-33. Желательные исходные реакционные центры включают, без ограничения, амины, азиды, карбоновые кислоты, альдегиды, алкены, акрилоильные группы, бензилгалогениды, альфа-галогениды карбонильных групп и 1,3-диены.
[00199] Третий способ заключается во встраивании основания, модифицированного линкером и функциональной группой исходного реакционного центра, в течение синтеза шпилек адаптера реакционного центра. Например, встраивание 5'-диметокситритил-N6-бензоил-N8-[6-(трифторацетиламино)-гекс-1-ил]-8-амино-2'-дезоксиаденозин-3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидита (также называемый амином одификатор С6 dA, который заказывают в компании Glen Research, Стерлинг, Вирджиния) в стратегических положениях в течение синтеза шпильки позволит обеспечить свободный амин в качестве функциональной группы исходного реакционного центра и алкильную цепь из 6 углеродов в качестве линкера, как и встраивание 5'-диметокситритил-N2-[6-(трифторацетиламино)- гекс-1-ил]-2'-дезоксигуанозин-3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидита (также называемый аминомодификатор С6 dG, который заказывают в компании Glen Research, Стерлинг, Вирджиния). Встраивание 5'-диметокситритил-5-[3-метил-акрилат]-2'-дезоксиуридин,3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидита (также называемый карбокси dT, который заказывают в компании Glen Research, Стерлинг, Вирджиния) в стратегических положениях в течение синтеза шпильки позволит обеспечить карбоновую кислоту в качестве функциональной группы исходного реакционного центра и цепь из 2 углеродов в качестве линкера. Встраивание 5'-диметокситритил-5-[N-((9-фторенилметоксикарбонил)-аминогексил)-3-акрилимидо]-2'-дезоксиуридин,3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидита (также называемый Fmoc-аминомодификатор С6 dT, Glen Research, Стерлинг, Вирджиния) в стратегических положениях в течение синтеза шпильки позволит обеспечить защищенный Fmoc амин в качестве функциональной группы исходного реакционного центра и алкильную цепь из 6 углеродов в качестве линкера. Встраивание 5'-диметокситритил-5-(окта-1,7-диинил)-2'-дезоксиуридин, 3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидита (также называемый С8 алкин dT, Glen Research, Стерлинг, Вирджиния) в стратегических положениях в течение синтеза шпильки позволит обеспечить алкин в качестве функциональной группы исходного реакционного центра и цепь из 8 углеродов в качестве линкера. Встраивание 5'-(4,4'-диметокситритил)-5-[N-(6-(3-бензоилтиопропаноил)-аминогексил)-3-акриламидо]-2' дезоксиуридин, 3'-[(2-цианоэтил)-(N,N-диизопропил)]-фосфорамидита (также называемый S-Bz-тиоспиртовой модификатор C6-dT, Glen Research, Стерлинг, Вирджиния) в стратегических положениях в течение синтеза шпильки позволит обеспечить тиоспирт в качестве функциональной группы исходного реакционного центра и цепь из 14 атомов в качестве линкера. Встраивание N4-TriGl-амино 2'дезоксицитидина (от компании IBA GmbH, Геттинген, Германия) в стратегических положениях в течение синтеза шпильки позволит обеспечить амин в качестве функциональной группы исходного реакционного центра и цепь из 3 единиц этиленгликоля в качестве линкера.
[00200] Подходящие линкеры выполняют две важные функции: (i) они ковалентно привязывают шпильку к структурному блоку, и (ii) они не препятствуют другим важным функциям при синтезе или применении молекул формулы (I). Таким образом, согласно некоторым вариантам реализации линкеры представляют собой алкильные цепи или цепи ПЭГ, поскольку (а) они являются в высокой степени гибкими, обеспечивают соответствующее и свободное представление кодируемых частей молекул-мишеней в процессе отбора, и (b) поскольку они являются относительно химически инертными и, как правило, не вступают в побочные реакции в течение синтеза молекул формулы (I). Для надлежащего выполнения большинства, но не всех функций, общая длина линкеров не должна превышать приблизительно 8 единиц ПЭГ. Специалист в данной области техники понимает, что при проведении отбора, при котором библиотеку ДНК следует держать как можно дальше от молекулы-мишени, или структуры-мишени, или поверхности-мишени, подходящими и предпочтительными будут значительно более длинные линкеры и/или значительно более жесткие линкеры, такие как пептидная альфа-спираль. Другие желаемые линкеры могут включать полиглицин, полиаланин или полипептиды. Также применяют линкеры, которые содержат флуорофор, радиоактивную метку или функциональный фрагмент, используемые для связывания молекулы формулы (I) способом, который является ортогональным по отношению к связыванию с кодируемой частью или который является комплементарным по отношению к связыванию с кодируемой частью. Например, при некоторых обстоятельствах может быть необходимо встроить в линкер биотин для иммобилизации библиотеки. Также может являться подходящим встраивание известного лиганда в один карман связывания молекулы-мишени в качестве способа для проведения отбора кодируемой части, которая может связываться со вторым карманом связывания той же молекулы-мишени.
[00201] Библиотеки можно необязательно получить с применением различных линкеров и различных химических способов на различных адаптерах реакционного центра. Линкер или линкеры на 5'-адаптере реакционного центра могут нести один тип линкера и один тип функциональной группы реакционного центра, тогда как 3'-адаптер реакционного центра несет отличный линкер и ту же функциональную группу реакционного центра или отличный линкер и отличную функциональную группу реакционного центра. Любые из линкеров и функциональных групп, упомянутых в настоящем документе, являются подходящими для применения в данном примере при условии, что химические способы, необходимые для последующего введения позиционных структурных блоков, являются совместимыми с функциональными группами на первом структурном блоке, D, и втором структурном блоке Е, которые вступают в реакцию с функциональными группами реакционного центра на их соответствующих шпильках.
[00202] Данная совместимость включает два пути. В первом пути для загрузки адаптеров реакционного центра применяют различные химические способы, но как первый структурный блок D, так и второй структурный блок Е способны подвергаться одинаковой химической трансформации на следующей или последующей нижестоящей стадии. Во втором пути для загрузки адаптеров реакционного центра применяют различные химические способы, и для последующей нижестоящей стадии необходимы различные химические способы. Для данного второго пути требуется, чтобы функциональные группы на образующейся 5'-кодируемой части, функциональные группы на поступающем позиционном структурном блоке для 5'-конца, и химические вещества, применяемые для данного сочетания, не вступали в реакцию с функциональными группами, присутствующими на образующейся 3'-кодируемой части. Аналогично, для данного второго пути требуется, чтобы функциональные группы на образующейся 3'-кодируемой части, функциональные группы на поступающем позиционном структурном блоке для 3'-конца и химические вещества, применяемые для данного сочетания, не вступали в реакцию с функциональными группами, присутствующими на образующейся 5'-кодируемой части. Стадии введения структурных блоков с применением ортогональных химических способов на 3'- и 5'-адаптерах реакционного центра можно осуществить в любом порядке. Кроме того, специалист в данной области техники понимает, что среди разнообразия структурных блоков, введенных на данной стадии синтеза, отсутствие введения какого-либо структурного блока является важным элементом разнообразия. Соответствующие химические способы для данных стадий включают, без ограничения, химические способы, описанные в примерах 10-32 и в примере 1.
[00203] Пример 10: Синтезирование кодируемой части с применением химического способа сочетания Сузуки.
[00204] Библиотеку ДНК, несущую арилиодид в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в воде в концентрации 1 мМ. Добавляли 50 эквивалентов бороновой кислоты в виде 200 мМ исходного раствора в диметилацетамиде, 300 эквивалентов карбоната натрия в виде 200 мМ водного раствора, 0,8 эквивалента ацетата палладия в виде 10 мМ исходного раствора в диметилацетамиде, предварительно смешанного с 20 эквивалентами трехнатриевой соли 3,3',3'' фосфанэтриилтрис (бензолсульфоновой кислоты) в виде 100 мМ водного раствора. Проводили реакцию в смеси при температуре 65°С в течение 1 часа, затем очищали продукт преципитацией этанолом. Библиотеку ДНК растворяли в буфере до концентрации 1 мМ, добавляли 120 эквивалентов сульфида натрия в виде 400 мМ водного раствора, затем проводили реакцию при температуре 65°С в течение 1 часа. Продукт разводили до объема 200 мкл dH2O и очищали методом ионообменной хроматографии. (См. публикацию Gouliaev, A.H., Franch, Т.Р.О., Godskesen, M.A., and Jensen. K.В. (2012) Bi-functional Complexes and methods for making and using such complexes. Заявка на патент WO 2011/127933 A1)
[00205] Пример 11: Синтезирование кодируемой части с применением химического способа сочетания Соногашира.
[00206] Библиотеку ДНК, несущую арилиодид в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в воде до концентрации 1 мМ. Добавляли 100 эквивалентов алкина в виде 200 мМ исходного раствора в диметилацетамиде, 300 эквивалентов пирролидина в виде 200 мМ исходного раствора в диметилацетамиде, 0,4 эквивалента ацетата палладия в виде 10 мМ исходного раствора в диметилацетамиде, 2 эквивалента трехнатриевой соли 3,3',3'' фосфанэтриилтрис (бензолсульфоновой кислоты) в виде 100 мМ водного раствора. Реакцию проводили в течение 2 часов при температуре 65°С, затем продукт очищали преципитацией этанолом или методом ионообменной хроматографии. (См. публикации (1) Liang, В., Dai, M., Chen, J., and Yang, Z. (2005) Cooper-free sonogashira coupling reaction with PdCl2 in water under aerobic conditions. J. Org. Chem. 70, 391-393; (2) Li, N., Lim, R.K.V., Edwardraja, S., and Lin, Q. (2011) Copper-free Sonogashira cross-coupling for functionalization of alkyne encoded proteins in aqueous medium and in bacterial cells. J. Am. Chem. Soc. 133, 15316-15319; (3) Marziale, A.N.,
[00207] Пример 12: Синтезирование кодируемой части с применением карбамилирования.
[00208] Библиотеку ДНК, несущую амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в воде в концентрации 1 мМ. Добавляли триэтиламин в соотношении 1:4 об./об. и 50 эквивалентов ди-2-пиридилкарбоната в виде 200 мМ исходного раствора в диметилацетамиде. Реакцию проводили в течение 2 часов при комнатной температуре, затем в течение 2 часов при комнатной температуре добавляли 40 эквивалентов амина в виде 200 мМ исходного раствора в диметилацетамиде. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикации (1) Artuso, E., Degani, I., and Fochi, R. (2007) Preparation of mono-, di-, and trisubstituted ureas by carbonylation of aliphatic amines with S,S-dimethyl dithiocarbonate. Synthesis 22, 3497-3506; (2) Franch, Т., Lundorf, M.D., Jacobsen, S.N., Olsen, E.K., Andersen, A.L., Holtmann, A., Hansen, A.H., Sorensen, A.M., Goldbech, A., De Leon, D., et al. Enzymatic encoding methods for efficient synthesis of large libraries. WIPO WO 2007/062664 A2, 2007.)
[00209] Пример 13: Синтезирование кодируемой части с применением тиоуреирования.
[00210] Библиотеку ДНК, несущую амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в воде в концентрации 1 мМ. В течение 30 минут при комнатной температуре добавляли 20 эквивалентов 2-пиридилтиокарбоната в виде 200 мМ исходного раствора в диметилацетамиде. Затем при комнатной температуре добавляли 40 эквивалентов амина в виде 200 мМ исходного раствора в диметилацетамиде, медленно нагревали смесь до температуры 60 μC и проводили реакцию в течение 18 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Deprez-Poulain, R.F., Charton, J., Leroux, V., and Deprez, B.P. (2007) Convenient synthesis of 4H-1,2,4-triazole-3-thiols using di-2-pyridylthionocarbonate. Tetrahedron Lett. 48, 8157-8162.)
[00211] Пример 14: Синтезирование кодируемой части с применением восстановительного моноалкилирования амина.
[00212] Библиотеку ДНК, несущую амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в воде в концентрации 1 мМ. Добавляли 40 эквивалентов альдегида в виде 200 мМ исходного раствора в диметилацетамиде и проводили реакцию при комнатной температуре в течение 1 часа. Затем добавляли 40 эквивалентов борогидрида натрия в виде 200 мМ исходного раствора в ацетонитриле и проводили реакцию при комнатной температуре в течение 1 часа. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Abdel-Magid, A.F., Carson, K.G., Harris, В.D., Maryanoff, С.A., and Shah, R.D. (1996) Reductive amination of aldehydes and ketones with sodium triacetoxyborohydride. J. Org. Chem. 61, 3849-3862.)
[00213] Пример 15: Синтезирование кодируемой части с применением SNAr с гетероарильными соединениями.
[00214] Библиотеку ДНК, несущую амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в воде в концентрации 1 мМ. Добавляли 60 эквивалентов гетероарилгалогенида в виде 200 мМ исходного раствора в диметилацетамиде и проводили реакцию при температуре 60°С в течение 12 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Franch, Т., Lundorf, M.D., Jacobsen, S.N., Olsen, E.K., Andersen, A.L., Holtmann, A., Hansen, A.H., Sorensen, A.M., Goldbech, A., De Leon, D., et al. Enzymatic encoding methods for efficient synthesis of large libraries. WIPO WO 2007/062664 A2, 2007.)
[00215] Пример 16: Синтезирование кодируемой части с применением химического способа Хорнера-Вадсворта-Эммонса.
[00216] Библиотеку ДНК, несущую альдегид в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 50 эквивалентов этил 2-(диэтоксифосфорил)ацетата в виде 200 мМ исходного раствора в диметилацетамиде, 50 эквивалентов карбоната цезия в виде 200 мМ водного раствора и проводили реакцию при комнатной температуре в течение 16 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Manocci, L., Leimbacher, M., Wichert, M., Scheuermann, J., and Neri, D. (2011) 20 years of DNA-encoded chemical libraries. Chem. Commun. 47, 12747-12753.)
[00217] Пример 17: Синтезирование кодируемой части с применением сульфонилирования.
[00218] Библиотеку ДНК, несущую амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 40 эквивалентов сульфонилхлорида в виде 200 мМ исходного раствора в диметилацетамиде и проводили реакцию при комнатной температуре в течение 16 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Franch, Т., Lundorf, M.D., Jacobsen, S.N., Olsen, E.K., Andersen, A.L., Holtmann, A., Hansen, A.H., Sorensen, A.M., Goldbech, A., De Leon, D., et al. Enzymatic encoding methods for efficient synthesis of large libraries. WIPO WO 2007/062664 A2, 2007.)
[00219] Пример 18: Синтезирование кодируемой части с применением трихлорнитропиримидина.
[00220] Библиотеку ДНК, несущую амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 20 эквивалентов трихлорнитропиримидина (TCNP) в виде 200 мМ исходного раствора в диметилацетамиде при температуре 5°С. Реакционную смесь нагревали до комнатной температуры в течение часа и очищали преципитацией этанолом. Библиотеку ДНК растворяли в концентрации 1 мМ в боратном буфере, рН 9,4, и добавляли 40 эквивалентов амина в виде 200 мМ исходного раствора в диметилацетамиде и 100 эквивалентов беспримесного триэтиламина и проводили реакцию при комнатной температуре в течение 2 часов. Библиотеку очищали преципитацией этанолом. Библиотеку ДНК немедленно растворяли в боратном буфере для немедленного проведения реакции или объединяли, повторно сортировали на матрице, а затем растворяли в боратном буфере, после чего проводили ее реакцию с 50 эквивалентами амина в виде 200 мМ исходного раствора в диметилацетамиде и 100 эквивалентами триэтиламина и проводили реакцию при комнатной температуре в течение 24 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Roughley, S.D., and Jordan, A.M. (2011) The medicinal chemist's toolbox: an analysis of reactions used in the pursuit of drug candidates. J. Med. Chem. 54, 3451-3479.)
[00221] Пример 19: Синтезирование кодируемой части с применением трихлорпиримидина.
[00222] Библиотеку ДНК, несущую амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 50 эквивалентов 2,4,6 трихлорпиримидина в виде 200 мМ исходного раствора в DMA и проводили реакцию при комнатной температуре в течение 3,5 часов. ДНК преципитировали в этаноле, а затем повторно растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 40 эквивалентов амина в виде 200 мМ исходного раствора в ацетонитриле и проводили реакцию при температуре 60-80°С в течение 16 ч. Продукт очищали преципитацией этанолом, а затем библиотеку ДНК немедленно растворяли в боратном буфере для немедленного проведения реакции или объединяли, повторно сортировали на матрице и затем растворяли в боратном буфере, после чего проводили ее реакцию с 60 эквивалентами бороновой кислоты в виде 200 мМ исходного раствора в диметилацетамиде (DMA) и 200 эквивалентами гидроксида натрия в виде 500 мМ водного раствора, 2 эквивалентами ацетата палладия в виде 10 мМ исходного раствора в DMA и 20 эквивалентами трехнатриевой соли трис(3-сульфофенил)фосфина (TPPTS) в виде 100 мМ водного раствора, и проводили реакцию при температуре 75°С в течение 3 часов. ДНК преципитировали в этаноле, затем растворяли в воде в концентрации 1 мМ и проводили реакцию с 120 эквивалентами сульфида натрия в виде 400 мМ исходного раствора в воде при температуре 65°С в течение 1 часа. Продукт очищали преципитацией этанолом или ионообменной хроматографией.
[00223] Пример 20: Синтезирование кодируемой части с применением снятия Boc-защиты.
[00224] Библиотеку ДНК, несущую защищенный Воc амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 0,5 мМ, и нагревали до температуры 90°С в течение 16 часов. Продукт очищали преципитацией этанолом, эксклюзионной хроматографией или ионообменной хроматографией. (См. публикацию Franch, Т., Lundorf, М.D., Jacobsen, S.N., Olsen, Е.K., Andersen, A.L., Holtmann, A., Hansen, A.H., Sorensen, A.М., Goldbech, A., De Leon, D., et al. Enzymatic encoding methods for efficient synthesis of large libraries. WIPO WO 2007/062664 A2, 2007.)
[00225] Пример 21: Синтезирование кодируемой части с применением гидролиза трет-бутилового сложного эфира.
[00226] Библиотеку ДНК, несущую трет-бутиловый сложный эфир в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере в концентрации 1 мМ и проводили реакцию при температуре 80°С в течение 2 часов. Продукт очищали преципитацией этанолом, эксклюзионной хроматографией или ионообменной хроматографией. (См. публикацию Franch, Т., Lundorf, M.D., Jacobsen, S.N., Olsen, Е.K., Andersen, A.L., Holtmann, A., Hansen, А.Н., Sorensen, A.M., Goldbech, A., De Leon, D., et al. Enzymatic encoding methods for efficient synthesis of large libraries. WIPO WO 2007/062664 A2, 2007.)
[00227] Пример 22: Синтезирование кодируемой части с применением снятия Alloc-защиты.
[00228] Библиотеку ДНК, несущую защищенный Alloc амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 10 эквивалентов тетракис-трифенилфосфина палладия в виде 10 мМ исходного раствора в DMA и 10 эквивалентов борогидрида натрия в виде 200 мМ исходного раствора в ацетонитриле и проводили реакцию при комнатной температуре в течение 2 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Beugelmans, R., Neuville, M. В.-С., Chastanet, J., and Zhu, J. (1995) PalladiμM catalyzed reductive deprotection of Alloc: Transprotection and peptide bond formation. Tetrahedron Lett. 36, 3129.)
[00229] Пример 23: Синтезирование кодируемой части с применением гидролиза метилового/этилового сложного эфира.
[00230] Библиотеку ДНК, несущую метиловый или этиловый сложный эфир в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере в концентрации 1 мМ и проводили реакцию со 100 эквивалентами NaOH при температуре 60°С в течение 2 часов. Продукт очищали преципитацией этанолом, эксклюзионной хроматографией или ионообменной хроматографией. (См. публикацию Franch, Т., Lundorf, M.D., Jacobsen, S.N., Olsen, Е.K., Andersen, A.L., Holtmann, A., Hansen, A.Н., Sorensen, A.M., Goldbech, A., De Leon, D., et al. Enzymatic encoding methods for efficient synthesis of large libraries. WIPO WO 2007/062664 A2, 2007.)
[00231] Пример 24: Синтезирование кодируемой части с применением восстановления нитрогруппы.
[00232] Библиотеку ДНК, несущую нитрогруппу в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в воде в концентрации 1 мМ. Добавляли 10% объемных эквивалентов суспензии никеля Ренея, 10% объемных эквивалентов гидразина в виде 400 мМ водного раствора и проводили реакцию при комнатной температуре в течение 2-24 ч при встряхивании. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Balcom, D., and Furst, A. (1953) Reductions with hydrazine hydrate catalyzed by Raney nickel. J. Am. Chem. Soc. 76, 4334-4334.)
[00233] Пример 25: Синтезирование кодируемой части с применением «клик»-химии.
[00234] Библиотеку ДНК, несущую алкиновую или азидную группу в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в 100 мМ фосфатном буфере в концентрации 1 мМ. Добавляли сульфат меди до концентрации 625 мкМ, ТНРТА (лиганд) до концентрации 3,1 мМ, амино-гуанидин до концентрации 12,5 мМ, аскорбат до концентрации 12,5 мМ и азид до концентрации 1 мМ (если ДНК несла алкин) или алкин до концентрации 1 мМ (если ДНК несла азид). Реакцию проводили при комнатной температуре в течение 4 часов. Продукт очищали преципитацией этанолом, эксклюзионной хроматографией или ионообменной хроматографией. (См. публикацию Hong, V., Presolski, Stanislav I., Ma, С. and Finn, M.G. (2009), Analysis and Optimization of Copper-Catalyzed Azide-Alkyne Cycloaddition for Bioconjugation. Angewandte Chemie International Edition, 48: 9879-9883.)
[00235] Пример 26: Синтезирование кодируемой части, содержащей бензимидазол.
[00236] Библиотеку ДНК, несущую арил-вицинальный диамин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 60 эквивалентов альдегида в виде 200 мМ исходного раствора в DMA и проводили реакцию при температуре 60°С в течение 18 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикации (1) Mandal, P., Berger, S.В., Pillay, S., Moriwaki, K., Huang, С., Guo, H., Lich, J.D., Finger, J., Kasparcova, V., Votta, В., et al. (2014) RIP3 induces apoptosis independent of pronecrotic kinase activity. Mol. Cell 56, 481-495; (2) Gouliaev, A.H., Franch, T. P.-O., Godskesen, M.A., and Jensen, K.B. (2012) Bi-functional Complexes and methods for making and using such complexes. Заявка на патент WO 2011/127933 A1; (3) Mukhopadhyay, С., and Tapaswi, P.K. (2008) Dowex 50W: A highly efficient and recyclable green catalyst for the construction of the 2-substituted benzimidazole moiety in aqueous medium. Catal. Commun. 9, 2392-2394.)
[00237] Пример 27: Синтезирование кодируемой части, содержащей имидазолидинон.
[00238] Библиотеку ДНК, несущую альфа-аминоамид в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в буфере метанол-борат (в соотношении 1:3), рН 9,4, в концентрации 1 мМ. Добавляли 60 эквивалентов альдегида в виде 200 мМ исходного раствора в DMA и проводили реакцию при температуре 60°С в течение 18 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикации Barrow, J.С., Rittle, K.Е., Ngo, P.L., Selnick, H.G., Graham, S.L., Pitzenberger, S.M., McGaughey, G.В., Colussi, D., Lai, M.-T., Huang, Q., et al. (2007) Design and synthesis of 2,3,5-substituted imidazolidin-4-one inhibitors of BACE-1. Chem. Med. Chem. 2, 995-999; (2) Wang, X.-J., Frutos, R.P., Zhang, L., Sun, X., Xu, Y., Wirth, Т., Nicola, Т., Nummy, L.J., Krishnamurthy, D., Busacca, C.A., Yee, N., and Senanayake, C.H. (2011) Asymmetric synthesis of LFA-1 inhibitor BIRT2584 on metric ton scale. Org. Process Res. Dev. 15, 1185-1191; (3) Blass, В.Е., Janusz, J.M., Wu, S., Ridgeway, J.M.II, Coburn, K., Lee, W., Fluxe, A.J., White, R.Е., Jackson, С.М., and Fairweather, N. 4-Imidazolidinones as KV1.5 Potassium channel inhibitors. WIPO WO 2009/079624 A1, 2009.)
[00239] Пример 28: Синтезирование кодируемой части, содержащей хиназолинон.
[00240] Библиотеку ДНК, несущую 2-анилино-1-бензамид в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 200 эквивалентов NaOH в виде 1 М раствора в воде и альдегид в виде 200 мМ исходного раствора в DMA и проводили реакцию при температуре 90°С в течение 14 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Witt, A., and Bergmann, J. (2000) Synthesis and reactions of some 2-vinyl-3H-quinazolin-4-ones. Tetrahedron 56, 7245-7253.)
[00241] Пример 29: Синтезирование кодируемой части, содержащей изоиндолинон.
[00242] Библиотеку ДНК, несущую амин в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 4-бром, 2-ен метиловый сложный эфир в виде 200 мМ исходного раствора в DMA и проводили реакцию в течение 2 часов при температуре 60°С. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Chauleta, С., Croixa, С., Alagillea, D., Normand, S., Delwailb, A., Favotb, L., Lecronb, J.-C., and Viaud-Massuarda, M.C. (2011) Design, synthesis and biological evaluation of new thalidomide analogues as TNF-α and IL-6 production inhibitors. Bioorg. Med. Chem. Lett. 21, 1019-1022.)
[00243] Пример 30: Синтезирование кодируемой части, содержащей тиазол.
[00244] Библиотеку ДНК, несущую тиомочевину в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 50 эквивалентов бромкетона в виде 200 мМ исходного раствора в DMA и проводили реакцию при комнатной температуре в течение 24 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикацию Potewar, Т.М., Ingale, S.A., and Srinivasan, K.V. (2008) Catalyst-free efficient synthesis of 2-aminothiazoles in water at ambient temperature. Tetrahedron 64, 5019-5022.)
[00245] Пример 31: Синтезирование кодируемой части, содержащей имидазопиридин.
[00246] Библиотеку ДНК, несущую арилальдегид в качестве реакционного центра на адаптере реакционного центра, в качестве структурного блока на нагруженном адаптере реакционного центра или в качестве частично транслированной молекулы, растворяли в боратном буфере, рН 9,4, в концентрации 1 мМ. Добавляли 50 эквивалентов 2-аминопиридина в виде 200 мМ исходного раствора в DMA и 2500 эквивалентов NaCN в виде 1 М водного раствора и проводили реакцию при температуре 90°С в течение 10 часов. Продукт очищали преципитацией этанолом или ионообменной хроматографией. (См. публикации (1) Alexander Lee Satz, Jianping Cai, Yi Chen, Robert Goodnow, Felix Gruber, Agnieszka Kowalczyk, Ann Petersen, Goli Naderi-Oboodi, Lucja Orzechowski, and Quentin Strebel. DNA Compatible Multistep Synthesis and Applications to DNA Encoded Libraries Bioconjugate Chemistry 2015 26 (8), 1623-1632; (2) Beatch, G N., Liu, Y., and Plouvier, В.М.C. PCT Int. Appl. 2001096335, Dec 20, 2001; (3) Inglis, S.R., Jones, R.K., Booker, G.W., and Pyke, S.М. (2006) Synthesis of N-benzylated-2-aminoquinolines as ligands for the Tec SH3 domain. Bioorg. Med. Chem. Lett. 16, 387-390.)
[00247] Пример 32: Синтезирование кодируемой части с применением различных других химических способов.
[00248] В руководстве Handbook for DNA-Encoded Chemistry (Goodnow R.A., Jr., Ed.) pp 319-347, 2014 Wiley, New York перечислен тридцать один тип совместимых химических реакций со ссылками. Данные реакции включают реакции SNAr трихлортриазинов, оксидацию диолов до глиоксальных соединений, снятие Msec-защиты, снятие Ns-защиты, снятие Nvoc-защиты, снятие пентеноильной защиты, сочетания индол-стирол, реакцию Дильса-Альдера, реакцию Виттига, присоединение по Михаэлю, реакцию Хека, реакцию Генри, нитрон 1,3-диполярное присоединение с активированными алкенами, образование оксазолидинов, снятие трифторацетамидовой защиты, окислительное сочетание алкен-алкин, реакцию обмена метатезиса с замыканием цикла и альдольную реакцию. В данном источнике опубликованы другие реакции, которые потенциально могут протекать в присутствии ДНК и являются соответствующими для применения.
[00249] Пример 33: Применение различных рестрикционных ферментов при получении библиотеки. Следует понимать, что рестрикционные ферменты, упомянутые в других примерах, являются репрезентативными, и что другие рестрикционные ферменты можно применять для тех же целей равноценно или предпочтительно.
[00250] Пример 34. Альтернативный способ получения библиотеки генов. Получали библиотеку с кодирующими участками, содержащими от приблизительно 4 до приблизительно 40 нуклеотидов. Библиотеку получали и транслировали, как описано в примере 1, за следующими исключениями. Библиотеку конструировали посредством приобретения двух групп олигонуклеотидов, группы кодирующей цепи олигонуклеотидов и группы антикодирующей цепи олигонуклеотидов. Каждая группа содержала столько же подгрупп, сколько и кодирующих участков, и столько же различных последовательностей присутствовали в каждой подгруппе, сколько существовало различных кодирующих последовательностей в кодирующем участке. Каждый олигонуклеотид в каждой подгруппе олигонуклеотидов кодирующей цепи содержал кодирующую последовательность и необязательно 5'-некодирующий участок. Каждый олигонуклеотид в каждой подгруппе олигонуклеотидов антикодирующей цепи содержал антикодирующую последовательность и необязательно комплементарный 5'-некодирующий участок. Для способствования нижестоящему лигированию в процессе все олигонуклеотиды, за исключением таковых для 5'-конца кодирующей и антикодирующей цепи, приобретали с 5'-фосфорилированием или фосфорилировали с помощью PNK T4 от компании NEB согласно протоколу производителя. Подгруппу олигонуклеотидов, содержащих кодирующую цепь 5'-концевых кодирующих последовательностей, объединяли в буфере для ДНК-лигазы Т4 от компании NEB с подгруппой, содержащей 3'-концевые антикодирующие последовательности, и двум группам позволяли гибридизироваться. Данный подход позволяет получить продукт, содержащий одноцепочечный 5'-некодирующий участок с липким концом на кодирующей цепи, двухцепочечный кодирующий участок и необязательный одноцепочечный 5' некодирующий участок с липким концом на антикодирующей цепи. Данную процедуру гибридизации проводили отдельно для каждой кодирующей/антикодирующей пары подгрупп олигонуклеотидов. Например, подгруппу последовательностей, кодирующих второй кодирующий участок от 5'-конца, гибридизировали с ее комплементарной антикодирующей подгруппой, подгруппу, кодирующую третий кодирующий участок от 5'-конца, с ее комплементарной подгруппой, и т.д. Гибридизированные пары подгрупп объединяли и необязательно очищали методом электрофореза в агарозном геле. Если гены в библиотеке содержали некодирующие участки длиной 1 основание или более и если некодирующие участки между кодирующими участками являлись уникальными, тогда в один сосуд добавляли эквимолярные количества каждой гибридизированной пары подгрупп. Одноцепочечные некодирующие участки гибридизировались, и их лигировали друг с другом с помощью ДНК-лигазы Т4 от компании NEB с применением протокола производителя. Если некодирующие участки составляли в длину 1 основание или более, но не являлись уникальными, тогда в один сосуд добавляли две смежные гибридизированные подгруппы, и одноцепочечные некодирующие участки отжигали и лигировали ДНК-лигазой Т4. После окончания реакции продукт необязательно очищали методом электрофореза в агарозном геле, и третью гибридизированную подгруппу, смежную с одним из концов лигированного продукта, добавляли, отжигали и лигировали. Данный процесс повторяли до тех пор, пока не было завершено конструирование библиотеки. Следует понимать, что библиотеки, состоящие из произвольного числа кодирующих участков, конструируют данным способом. Для настоящих целей библиотеки, состоящие из более 20 кодирующих участков, могут являться нецелесообразными по причинам, не связанным с конструированием библиотек. Следует понимать, что специалисты в данной области техники часто проводят лигирование тупых концов, и что кодирующие участки можно лигировать без участия некодирующих участков, но что для гибридизированных подгрупп, которые не содержат некодирующие участки на каком-либо конце, лигирование приведет к получению смысловых и антисмысловых продуктов. Продукты, содержащие правильную смысловую последовательность, отделяют от продуктов, содержащих анти смысловую последовательность, посредством создания библиотеки и ее сортировки на всех гибридизационных матрицах последовательно. Часть библиотеки, которая захватывается на матрице на каждой стадии гибридизации, содержит правильную смысловую последовательность. Следует понимать, что некодирующий участок, состоящий исключительно из последовательности уникальных сайтов рестрикции, представляет собой привлекательный вариант данного способа.
[00251] Пример 34. Конструирование библиотеки генов с соответствующими концевыми кодирующими участками. Конструировали библиотеку, в которой 5'-концевой кодирующий участок и 3'-концевой кодирующий участок кодировали один и тот же структурный блок или одну и ту же пару различных структурных блоков. Это происходит, если каждый член библиотеки генов, содержащий данную 5'-концевую кодирующую последовательность, содержит исключительно одну 3'-концевую кодирующую последовательность. Такую библиотеку конструировали с применением способа примера 33 за исключением того, что гибридизированные пары подгрупп для 5'-концевого кодирующего участка не объединяли, и 3'-концевые кодирующие участки не объединяли. Все внутренние кодирующие участки объединяли и лигировали, как описано в примере 33. Продукт лигирования всех внутренних кодирующих участков разрезали на аликвоты, и одну аликвоту добавляли к последовательности каждой 5'-концевой гибридизированной подгруппы и лигировали. Продукты лигирования в каждой лунке содержали единичную 5'-концевую кодирующую последовательность и комбинаторную смесь всех последовательностей на всех внутренних кодирующих участках. Данные продукты лигирования с единичной 5'-концевой кодирующей последовательностью независимо переносили в лунки, содержащие единичную последовательность 3'-концевой гибридизированной подгруппы, и лигировали. Продукт в каждой лунке представлял собой ген, содержащий единичную 5'-концевую кодирующую последовательность, единичную 3'-концевую кодирующую последовательность и комбинаторную смесь всех последовательностей на всех внутренних кодирующих участках. Следует понимать, что существуют другие способы получения той же результирующей библиотеки.
[00252] Пример 35. Проведение отбора в отношении связывания с молекулой-мишенью с применением альтернативных способов. Отбор для идентификации членов библиотеки, способных к связыванию с молекулой-мишенью, проводили, как описано в примере 1, за исключением того, что молекулы-мишени были иммобилизированы на поверхности пластиковых планшетов, таких как планшеты IMMULON®, планшеты MAXISORP® или другие планшеты, обычно применяемые для иммобилизации биологических макромолекул для ELISA, или молекулы-мишени были биотинилированы и иммобилизированы на покрытых стрептавидином поверхностях или покрытых нейтравидином поверхностях, или покрытых авидином поверхностях, включая магнитные частицы, частицы, изготовленные из синтетических полимеров, частицы, изготовленные из полисахаридов или модифицированных полисахаридов, лунки планшета, пробирки и смолы. Следует понимать, что отбор для идентификации членов библиотеки, содержащих желаемое свойство, будут проводить в буферах, которые являются совместимыми с ДНК, совместимыми с поддержанием любых молекул-мишеней в нативной конформации, совместимыми с любыми ферментами, применяемыми в процессе отбора или амплификации, и совместимыми с идентификацией положительных в отношении свойства членов библиотеки. Такие буферы включают, без ограничения, буферы, изготовленные из фосфата, цитрата и ТРИС. Такие буферы могут также включать, без ограничения, соли калия, натрия, аммония, кальция, магния и других катионов и хлорид, иодид, ацетат, фосфат, цитрат и другие анионы. Такие буферы могут включать, без ограничения, поверхностно-активные вещества, такие как TWEEN®, TRITON™ и Chaps (3-[(3-холамидопропил)диметиламмонио]-1-пропансульфонат).
[00253] Пример 36. Отбор в отношении связывающих молекул с длительными скоростями диссоциации. Проводили отбор для идентификации индивидуальных образцов в популяции библиотеки, обладающих способностью связываться с молекулой-мишенью, как описано в примере 1. Индивидуальные образцы, которые связываются с молекулой-мишенью с более длительными скоростями диссоциации, отбирали следующим образом. Молекулы-мишени иммобилизировали посредством биотинилирования и инкубировали с покрытой стрептавидином поверхностью или необязательно иммобилизировали без биотинилирования на пластиковой поверхности, такой как планшет MAXISORP® или какой-либо другой планшет, подходящий для связывания белков для анализов наподобие ELISA, или посредством способа, описанного в примере 35, или посредством другого способа. Популяцию библиотеки инкубировали с иммобилизированной мишенью в течение 0,1-8 часов в соответствующем буфере. Продолжительность инкубации зависит от предполагаемого числа копий каждого индивидуального члена библиотеки в образце и от числа иммобилизированных молекул-мишеней. При наличии более высокого числа копий индивидуальных образцов и более высоких нагрузок молекулы-мишени продолжительность можно уменьшить. При более низком числе копий и/или более низких нагрузках молекулы-мишени продолжительность можно увеличить. Цель заключается в обеспечении того, что каждый индивидуальный образец в популяции имеет возможность полностью провзаимодействовать с мишенью. После данной инкубации библиотеки с иммобилизированной мишенью считают, что связывающиеся образцы в библиотеке связались с мишенью. В данный момент в систему добавляют избыток неиммобилизированной мишени и инкубацию продолжат в течение от приблизительно 1 до приблизительно 24 часов. Любые индивидуальные образцы, связывающиеся с иммобилизированной мишенью, которые характеризуются короткими скоростями диссоциации, могут высвободиться от иммобилизированной мишени и после повторного связывания разделятся на связывание со свободной мишенью и неподвижной мишенью. Индивидуальные образцы, связывающиеся с длительными скоростями диссоциации, останутся связанными с иммобилизированной мишенью. Промывка поверхности иммобилизации предпочтительно удаляет не связавшиеся образцы и связывающиеся образцы с быстрыми скоростями диссоциации, таким образом, будет проведен отбор индивидуальных образцов с длительными скоростями диссоциации. Амплификацию ДНК, кодирующей связывающиеся образцы с длительными скоростями диссоциации, проводили, как описано в примере 1.
[00254] Пример 37. Отбор с подвижными мишенями Проводили отбор, в котором молекулы-мишени биотинилировали, а затем инкубировали с библиотекой в течение соответствующего периода времени. Затем смесь иммобилизировали, например, на покрытой стрептавидином поверхности, после чего мишень становилась иммобилизированной, и любые члены библиотеки, связавшиеся с мишенью, также становились иммобилизированными. Промывка поверхности удаляла не связавшиеся образцы. Амплификацию ДНК, кодирующей связывающиеся образцы, проводили, как описано в примере 1.
[00255] Пример 38. Отбор в отношении специфичности к мишени. Проводили отбор для идентификации индивидуальных образцов в популяции библиотеки, которые связываются с желаемой молекулой-мишенью, для исключения других нецелевых молекул. Нецелевую молекулу (или молекулы, в случае присутствия более одной молекулы) биотинилировали и иммобилизировали на покрытой стрептавидином поверхности или необязательно иммобилизировали на пластиковой поверхности, такой как планшет MAXISORP® или какой-либо другой планшет, подходящий для связывания белков для анализов наподобие ELISA. В отдельном контейнере молекулы-мишени иммобилизировали посредством биотинилирования и инкубировали с покрытой стрептавидином поверхностью или необязательно иммобилизировали на пластиковой поверхности, такой как планшет MAXISORP® или какой-либо другой планшет, подходящий для связывания белков для анализов наподобие ELISA. Библиотеку сначала инкубировали с нецелевыми молекулами. Это истощало популяцию индивидуальных образцов, которые связываются с нецелевой молекулой или молекулами. После данной инкубации с нецелевыми молекулами библиотеку переносили в контейнер с желаемой мишенью и инкубировали в течение соответствующего периода времени. Промывка удаляла не связавшиеся образцы. Амплификацию ДНК, кодирующей связывающиеся образцы с длительными скоростями диссоциации, проводили, как описано в примере 1. Идентифицированные образцы, связывающиеся с мишенью, будут характеризоваться улучшенной вероятностью селективно связываться с мишенью по сравнению с нецелевой молекулой или молекулами. Необязательно, отбор в отношении аффинности к мишени проводили посредством иммобилизации мишени, добавления избытка свободной подвижной нецелевой молекулы, а затем добавления библиотеки и инкубации в течение соответствующего периода времени. В данных условиях индивидуальные образцы с аффинностью в отношении нецелевой молекулы будут преимущественно связаны нецелевой молекулой, поскольку она присутствует в избытке, и могут быть, таким образом, удалены в течение промывки поверхности. Амплификацию ДНК, кодирующей связывающиеся образцы, проводили, как описано в примере 1.
[00256] Пример 39. Отбор на основании дифференциальной подвижности. Проводили отбор на основании способности индивидуального образца в популяции библиотеки взаимодействовать с молекулой-мишенью или полимакромолекулярной структурой на основании различия подвижности члена библиотеки в комплексе, образованном, когда молекула-мишень или полимакромолекулярная структура взаимодействуют с членом библиотеки. В результате создания условий для взаимодействия молекул- или структур-мишеней и членов библиотеки, а затем пропускания смеси через эксклюзионную среду, члены библиотеки, которые не взаимодействуют с молекулой- или структурой-мишенью, становятся физически отделенными от членов библиотеки, которые с ней взаимодействуют, поскольку комплекс взаимодействующего члена библиотеки и молекулы- или структуры-мишени будет большим, чем не взаимодействующий член библиотеки, и вследствие этого будет проходить через среду с отличной подвижностью. Следует понимать, что различие подвижности может являться функцией диффузии при отсутствии эксклюзионной среды, что подвижность может быть вызвана различными средствами, включая, без ограничения, подачу самотеком, электрофорез и диффузию.
[00257] Пример 40. Общие стратегии для других типов отбора. Специалист в данной области техники понимает, что отбор проводят в отношении практически любого свойства при условии, что разработан анализ, который (а) физически отделяет индивидуальные образцы в популяции библиотеки, которые обладают желаемым свойством, от индивидуальных образцов, которые им не обладают, или (b) позволяет предпочтительно амплифицировать ДНК, кодирующую индивидуальные образцы в популяции библиотеки, которые обладают желаемым свойством, по сравнению с ДНК, кодирующей члены библиотеки, которые не обладают свойством. В данной области техники известно множество способов иммобилизации молекул-мишеней, включая мечение молекул-мишеней His-метками и иммобилизацию на никелевых поверхностях, мечение молекул-мишеней метками flag и иммобилизацию с помощью антител против flag, или мечение молекул-мишеней линкером и его ковалентную иммобилизацию на поверхности. Следует понимать, что порядок событий, которые позволяют членам библиотеки связываться с мишенями и которые позволяют мишеням быть иммобилизированными, является различным, поскольку он обусловлен или обеспечен применяемым способом иммобилизации. Следует понимать, что проводят отбор, в котором иммобилизация или физическое отделение положительных в отношении свойства индивидуальных образцов от отрицательных в отношении свойства индивидуальных образцов не требуется. Например, положительные в отношении свойства индивидуальные образцы рекрутируют факторы, способствующие амплификации их ДНК, тогда как отрицательные в отношении свойства члены не рекрутируют такие факторы. Положительные в отношении свойства индивидуальные образцы становятся меченными ПЦР-праймером, тогда как отрицательные в отношении свойства индивидуальные образцы - нет. Любой процесс дифференциальной амплификации положительных в отношении свойства индивидуальных образцов является подходящим для применения.
[00258] Пример 41а. Химические способы для загрузки адаптеров реакционного центра. Подразумевается, что любой из химических способов, описанных в примерах 10-32, является подходящим для применения при загрузке адаптера реакционного центра. Адаптеры реакционного центра загружают структурным блоком в водном растворе, в водных/органических смесях или при иммобилизации на твердой подложке. Химические способы, применяемые для загрузки адаптера реакционного центра структурным блоком, не ограничены реакциями, проводимыми, когда адаптер реакционного центра иммобилизирован на твердой подложке, такой как DEAE или Super Q650M; и не ограничены реакциями, проводимыми в жидкой фазе.
[00259] Пример 41b. Отсутствие структурного блока представляет собой кодируемый элемент разнообразия. В течение синтеза библиотеки разнообразие возникает, когда множество структурных блоков вводятся независимо на различных подпулах библиотеки, содержащих различные последовательности. Отсутствие структурного блока представляет собой необязательный элемент разнообразия. Отсутствие структурного блока кодируется точно так же, как описано в примере 1, за исключением того, что на желаемой химической стадии один или несколько последовательность-специфичных подпулов библиотеки не обрабатывают каким-либо химическим способом для введения структурного блока. В таком случае последовательность таких подпулов вследствие этого будет кодировать отсутствие структурного блока.
[00260] Пример 42. Гибридизационные матрицы, состоящие из других материалов. Гибридизационные матрицы могут выполнять 2 важные функции: (а) они могут сортировать гетерогенную смесь по меньшей мере частично одноцепочечных ДНК посредством последовательность-специфичной гибридизации, и (b) матрицы могут обеспечивать или позволять проводить независимое удаление отсортированных подпулов от матрицы. Элементы матрицы, в которых иммобилизированы антикодирующие олигонуклеотиды, могут быть организованы в любой трехмерной ориентации, которая соответствует приведенным выше критериям, однако матрица на основе 2-мерной прямоугольной сетки является на сегодняшний день наиболее предпочтительной, поскольку в данном формате массово производится множество коммерчески доступного лабораторного оборудования (например, 96-лун очные планшеты, 384-луночные планшеты).
[00261] Твердые подложки в элементах матрицы, на которые иммобилизированы антикодирующие олигонуклеотиды, могут выполнять 4 функции: (а) они могут постоянно прикреплять антикодирующие олигонуклеотиды, (b) они могут обеспечивать или позволять проводить захват ДНК библиотеки посредством последовательность-специфичной гибридизации с иммобилизированными олигонуклеотидами, (с) они могут характеризоваться низким фоновым или неспецифичным связыванием с ДНК библиотеки и (d) они могут являться химически стабильными в условиях обработки, включая стадию, которую проводят при высоком рН. CM SEPHAROSE® функционализировали азидо-ПЭГ-амином (с 9 единицами ПЭГ) посредством образования пептидной связи между амином азидо-ПЭГ-амина и карбоксильной группой на поверхности смолы CM SEPHAROSE®. Антикодирующие олигонуклеотиды, несущие алкинил-модификатор, «фиксировали» к азиду в процессе опосредованного медью 1,3-диполярного присоединения (Хьюсгена).
[00262] Другие подходящие твердые подложки включают гидрофильные частицы или полистирольные частицы с гидрофильными покрытиями поверхности, полиметилметакрилатные частицы с гидрофильными покрытиями поверхности и другие частицы с гидрофильными поверхностями, которые также несут реактивную функциональную группу, такую как карбоксилат, амин или эпоксид, на которые иммобилизируют соответствующим образом функционализированные антикодирующие олигонуклеотиды. Другие подходящие подложки включают сплошные подложки и гидрогели. См., например, публикации J Chromatogr А. 2002 Jun 14; 959(1-2): 121-9, J Chromatogr A. 2011 Apr 29; 1218 (17): 2362-7, J Chromatogr A. 2011 Dec 9; 1218(49):8897-902, Trends in Microbiology, Volume 16, Issue 11, 543-551, J. Polym. Sci. A Polym. Chem., 35: 1013-1021, J. Mol. Recogmt. 2006; 19: 305-312, J. Sep. Sci. 2004, 27, 828-836. Как правило, твердые подложки с большей площадью поверхности захватывают большее количество ДНК библиотеки, а частицы с меньшим диаметром вызывают значительно большее обратное давление и сопротивление потоку. Данные ограничения частично были преодолены посредством применения пористых подложек или гидрогелей, которые характеризуются очень большими площадями поверхности, но меньшим обратным давлением. Как правило, частицы с положительными зарядами вызывают большие степени неспецифичного связывания ДНК.
[00263] Заготовка гибридизационной матрицы может выполнять 3 функции: (а) она должна поддерживать физическое разделение между элементами, (b) обеспечивать или позволять библиотеке протекать над элементами или через них, и (с) обеспечивать или позволять проводить независимое удаление отсортированной библиотеки ДНК с различных элементов. Заготовка состоит из любого материала, который является в достаточной степени прочным, химически стабильным в условиях обработки и совместимым с любыми способами, необходимыми для иммобилизации подложек в пределах элементов. Обычные материалы для заготовок включают пластик, такой как DELRIN®, TECAFROM® или полиэфирэфиркетон (PEEK), керамику и металлы, такие как алюминий или нержавеющая сталь.
[00264] Пример 43. Параметры библиотеки генов. Библиотеки генов могут содержать от 2 до 20 кодирующих участков. Число применяемых кодирующих последовательностей в каждом внутреннем кодирующем участке ограничено исключительно числом доступных элементов, несущих иммобилизированные антикодирующие последовательности. Поскольку существует очень много промышленного стандартного годного к употреблению лабораторного оборудования в 24-луночном, 96-лун очном и 384-луночном форматах, удобно применять данные количества кодирующих последовательностей в кодирующем участке, однако кодирующие участки, содержащие, например, 768 или 1536 кодирующих последовательностей, также представляются возможными. Концевые кодирующие последовательности не сортируют на матрице, поэтому число последовательностей, применяемых в концевых кодирующих участках, в меньшей степени должно соответствовать числу лунок в промышленных стандартных планшетах и лабораторном оборудовании. В принципе, представляется возможными применение в концевых кодирующих участках 96, или 960, или большего числа различных кодирующих последовательностей.
Реферат
Изобретение относится к области биотехнологии, конкретно к области комбинаторной химии. Изобретение позволяет получить мультифункциональную молекулу-зонд, которая в дальнейшем может быть использована для идентификации кодируемых молекул, способных к связыванию с представляющими интерес молекулами-мишенями. В сравнении с известными аналогами предложенные молекулы-зонды позволяют эффективно обнаруживать детектируемые молекулы, присутствуя в пробе даже в малых количествах. 3 н. и 19 з.п. ф-лы, 4 ил., 43 пр.
Формула
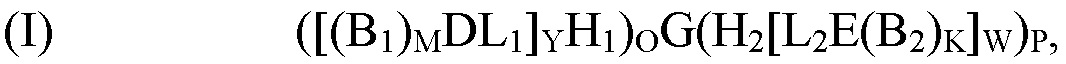
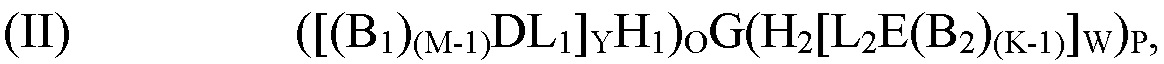
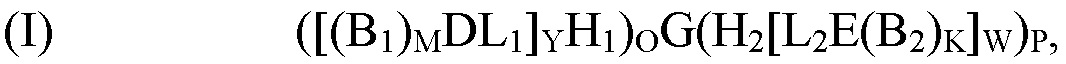
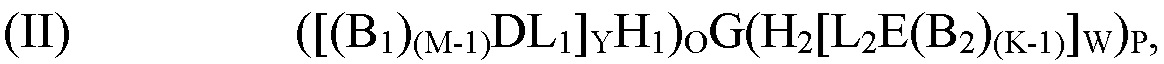

Комментарии