Магнитные наночастицы, функционализированные пирокатехином, их получение и применение - RU2687497C2
Код документа: RU2687497C2
Чертежи







Описание
Область техники, к которой относится изобретение
Данное изобретение относится к области функционализированных наночастиц, их получению и применению.
Уровень техники
Магнетит - это, как известно, минерал, обладающий ферромагнитными свойствами и описываемый химической формулой Fe3O4 (которую иногда представляют в виде FeO⋅Fe2O3).
Хорошо известно также, что магнетит в форме наночастиц, то есть частиц с размерами от нескольких нанометров до нескольких десятков нанометров, находясь в переменном магнитном поле в радиочастотном диапазоне, взаимодействует с электромагнитным полем, в результате чего выделяется тепловая энергия, обусловливающая гипертермический эффект, или магнитную гипертермию.
В онкологии гипертермия используется для повышения эффективности химио- или лучевой терапии; в случае солидных опухолей повышение температуры в интервале 41-45°С вызывает апоптоз опухолевых клеток; как правило, это достигается путем орошения жидкостью, доведенной до нужной температуры, области вблизи участков, пораженных опухолевой массой.
Недавно разработаны антенны, которые вводятся непосредственно в опухоль, испускают излучение в микроволновом диапазоне, взаимодействующее с обладающими дипольным моментом молекулами воды, что создает эффект гипертермии.
Такое лечение, как правило, является весьма инвазивным, малодейственным (в первом случае) и не лишено негативных побочных эффектов, например риска метастазирования и некроза тканей и т.п. во втором случае.
Используя магнитные наночастицы, которые попадают в непосредственную близость от опухолевой ткани или предпочтительно проникают в раковые клетки, можно преодолеть описанные выше недостатки и добиться высокой эффективности лечения путем гипертермии, локализовав гипертермический эффект на клеточном уровне.
Таким образом, путем внедрения наноструктур в клетки солидных опухолей или в патологически измененные ткани или участки, например в амилоидные бляшки при болезни Альцгеймера или в пораженные ткани при рассеянном склерозе, можно обеспечить эффективное и не сопровождающееся побочными эффектами комплексное лечение, такое как гипертермию и фармакологическое лечение.
В литературе имеется немало примеров гибридных наночастиц, включающих неорганический компонент и полимеры или белки и содержащих биологически совместимое ядро из магнетита и полимерную или белковую оболочку, которые могут быть нагружены лекарственными агентами или иметь поверхность, функционализированную подходящими прицельно действующими агентами.
Такие наночастицы могут служить лечебно-диагностическими агентами в силу своей способности генерировать тепловую энергию при воздействии электромагнитного поля (гипертермический эффект), синергетическим образом объединяя возможность доставки лекарственного вещества в нужное место организма (DD, от англ. «drug delivery») и возможность выявления действия данного агента средствами визуализации (MRI или МРТ).
В Международной заявке на патент WO 2004/071386 описываются агенты, состоящие из одно- или двухслойных липосомных микрокапсул, содержащих магнитные наночастицы, и биологически активного вещества, предназначенного для достижения и лечения опухолей печени.
В Европейском патенте ЕР 1979365 заявитель описывает конструкции, состоящие из магнитных частиц с размерами порядка нанометров, функционализированных бифункциональными агентами, в которых один конец молекулы связан с поверхностью магнитной частицы, а другой свободен и может взаимодействовать с такими сложными структурами, как биологические полимеры, циклодекстрины, антитела и лекарственные агенты, предназначенных для использования в фармацевтических и диагностических целях, и при этом открывается возможность получения комплексов наночастиц со связующим агентом, в которых наночастица покрыта сплошной компактной оболочкой, не влияющей существенно на ее свойства (например, на оптические или магнитные свойства).
В другом Европейском патенте, ЕР 2117600, описываются конструкции, в которых функционализированные частицы, сходные с описанными в ЕР 1979365, имеют оболочку из полимеров, в которой, возможно, диспергированы молекулы фармакологического агента.
Также в заявке на Европейский патент ЕР 2512992 (того же заявителя) описывается способ синтеза многоатомных спиртов, позволяющий относительно легко получить магнетитовые наночастицы однородного и контролируемого размера (которые, как следствие, обладают высокой эффективностью в смысле гипертермического действия).
Итак, как можно видеть, в литературе предложено немало решений проблемы селективного направленного попадания в нужное место организма частиц, способных осуществлять терапевтическое воздействие за счет гипертермического эффекта самого по себе либо в сочетании с традиционными лекарственными агентами; однако известные на сегодняшний день продукты такого рода из-за различных не преодоленных трудностей не вполне удовлетворяют практические потребности в достижении эффективного лечения опухолей и других заболеваний при помощи наноструктур.
Первая трудность - это проблема специфичности наноструктур. Действительно, из литературы известно, что гибридные частицы из неорганических веществ и полимеров или белков при системном введении быстро элиминируются из ретикулоэндотелиальной системы (ретикулярные клетки, макрофаги, Купферовы клетки).
Таким образом, неэффективность системного терапевтического применения лечебно-диагностических наноагентов обусловлена их выведением из организма. Было предпринято множество попыток преодолеть эту трудность. В числе прочего, полимерную/белковую поверхность наночастиц функционализировали агентами, предназначенными для того, чтобы частицы попадали в нужное место организма, включая моноклональные антитела, пептиды и активные соединения (например, сахара), но и в этих случаях большая часть частиц элиминировалась ретикулоэндотелиальной системой, и лишь очень малое их количество достигало нужного места - опухолевой ткани и раковых клеток.
Вторая трудность, являющаяся следствием первой, состоит в том, что количество магнитных частиц, достигающих опухоли или патологически измененной ткани, может оказаться недостаточным для того, чтобы произвести эффективное гипертермическое действие.
Наконец, существующие на сегодняшний день лечебно-диагностические наносистемы не обладают достаточной стабильностью в биологических жидкостях и поэтому склонны к образованию крупных (до 500-1000 нм) агрегатов, которые едва ли способны проникнуть в опухолевую массу или преодолеть интактный гематоэнцефалический барьер; из-за этого ухудшается специфичность нацеленности этих наносистем на соответствующие клеточные мишени, что еще более ограничивает эффективность лечения.
Из литературы известно, что в иммунной системе основной действующей силой противоопухолевых реакций являются Т-лимфоциты.
Эти клетки обладают специфичными рецепторами (TCR), с помощью которых они способны избирательно распознавать опухолевые клетки. Активация Т-лимфоцитов соответствующим опухолевым антигенным пептидом возможна только тогда, когда этот антиген представлен (презентирован) определенными клетками, представителями которых являются моноциты, макрофаги, дендритные клетки, клетки Лангерганса, микроглиальные клетки, а также В-лимфоциты.
Для того, чтобы произошла эффективная активация Т-лимфоцитов, помимо антигена также требуются определенные мембранные и растворимые сигнальные факторы. В числе растворимых сигнальных факторов наиболее мощным является интерлейкин-2 (IL-2), а среди мембранных сигнальных факторов наиболее действенными являются белки семейства В7.
Когда опухоль идентифицирована иммунной системой, ее разрушают лимфоциты, которые действуют несколькими различными путями, среди которых основными являются цитотоксические механизмы, связанные с перфорином, и цитотоксические механизмы, связанные с лигандом Fas.
Одной из первых опухолей, для которых была установлена связь с интенсивным локальным иммунным ответом с участием Т-лимфоцитов, была меланома; спустя годы удалось доказать, что чем интенсивнее Т-клеточный ответ, тем благоприятнее прогноз заболевания.
Применение наночастиц открывает возможность разработки противораковой стратегии нового типа, основанной на использовании специализированных на уничтожении опухолей Т-лимфоцитов, «вооруженных» наночастицами, способными поразить опухоль после активации лазерным излучением/электромагнитным полем.
Также в литературе широко освещается роль иммунной системы, в частности лимфоцитов и клеток, участвующих в воспалении, в развитии таких заболеваний нервной системы, как рассеянный склероз и болезнь Альцгеймера.
Рассеянный склероз - типичное аутоиммунное заболевание, в патогенезе которого критическую роль играют Т-лимфоциты (Elliot М. Frohman, M.D., Michael K. Racke, M.D., и Cedric S. Raine, N Engl J Med 2006; 354: 942-955). В частности, очень важны Т-хелперы, способные производить необходимые для воспаления цитокины, например гамма-интерферон и лимфотоксин, т.е. клетки, называемые Т-хелперными типа 1 (Thl), а также Т-лимфоциты CD8, В-лимфоциты и клетки иммунной системы линии моноцитов. В патогенезе болезни Альцгеймера важная роль также принадлежит механизмам воспаления, связанным с образованием интерлейкина-1 (IL-1), интерлейкина-6 (IL-6), фактора некроза опухолей α (TNF-α), микроглиальными клетками и астроцитами, ввиду связи с белками амилоида (Henry W. Querfurth, и Frank М. LaFerla, N Engl J Med 2010; 362: 329-344). Наночастицы по настоящему изобретению могут, таким образом, играть важную роль в лечении этих заболеваний.
Краткое описание чертежей
Фиг. 1 демонстрирует изображение, полученное с помощью сканирующего электронного микроскопа с автоэлектронной эмиссионной пушкой в режиме просвечивания (STEM), на котором видно образование типичного кластера наночастицами по данному изобретению в полимерном матриксе
Фиг. 2 представляет собой изображение смешанной конструкции из магнитных частиц и золотых наностержней.
Фиг. 3 представляет собой схематическое изображение модели конструкции, состоящей из магнетитовых наночастиц или наночастиц из магнетита и золотых наностержней, покрытых блок-полимерами PLGA-b-PEG-COOH.
Фиг. 4 представляет собой поэтапную схему способа получения наноструктурных конструкций по данному изобретению.
Фиг. 5 представляет собой схему способа очистки и отбора лимфоцитов.
Фиг. 6 представляет собой изображение, полученное с помощью оптического микроскопа, моноцитов/макрофагов с включенными внутрь этих клеток наночастицами по данному изобретению.
Фиг. 7 и 8 представляют данные 1Н-ЯМР для полимера PLGA-NHS, конъюгированного с NH2-PEG-COOH.
Фиг. 9 представляет спектр продукта по данному изобретению в видимом и ультрафиолетовом диапазонах.
Фиг. 10 представляет результаты определения бежа с бицинхиноновой кислотой (ВСА) для продукта по данному изобретению.
Краткое описание сути изобретения
В настоящем документе описываются магнитные наночастицы, поверхность которых функционализирована пирокатехином, и конструкции, содержащие множество указанных наночастиц, заключенных в матрикс из биологически совместимого полимера, в котором необязательно диспергированы молекулы, обладающие терапевтическим действием, причем указанный полимерный матрикс необязательно дополнительно функционализирован. Обнаружено, что указанные полимерные конструкции можно ввести в клетки иммунной системы, что дает начало инженерии иммунной системы.
Подробное описание изобретения
Обнаружено, что с указанными выше трудностями позволяют справиться конструкции, содержащие множество магнитных наночастиц, функционализированных пирокатехином (катехолом) и заключенных (инкапсулированных) в биологически совместимом полимерном матриксе, обеспечивая необходимую стабильность в физиологических средах и в человеческой крови.
Также структурные свойства этих конструкций помогают обеспечить гипертермический эффект, сравнимый с таковым, создаваемым монодисперсными неорганическими основами, описанными в упомянутых выше патентных документах; это преимущество обусловлено так называемой кластерной структурой (см. фиг. 1) магнитных частиц, которые склонны объединяться в структурные центры из множества частиц в полимерном матриксе, что дает синергический эффект в плане гипотермического действия.
Для формирования этой кластерной структуры существенна функционализация магнитных частиц пирокатехином согласно настоящему изобретению; эта функционализация позволяет получить конструкции, намного превосходящие по своим показателям в плане гипертермического эффекта и стабильности во времени те, которые известны в уровне техники.
В числе магнитных частиц особенно предпочтительны магнетитовые. При необходимости конструкции по данному изобретению могут включать, помимо описанных выше магнитных наночастиц, множество золотых наностержней (см. фиг. 2).
Присутствие наностержней позволяет получить значительный гипертермический эффект при воздействии лазерного инфракрасного излучения, например генерируемого CO2-лазерами, что еще более увеличивает гипертермический эффект, обеспечиваемый кластерными магнетитовыми структурами.
Это позволяет объединить лазерные и радиоволновые системы, в которых лазер служит для поверхностных областей или областей, достигаемых с помощью зонда, а радиоволновое излучение - для глубоко расположенных областей.
Магнитные наночастицы могут быть получены путем известного метода с многоатомными спиртами, представленного, например, в упомянутой выше заявке на Европейский патент ЕР 2512992, в которой описывается способ, включающий:
i) получение раствора FeIII в многоатомном спирте, исходя из Fe0;
ii) получение магнетитовых наночастиц путем синтеза в присутствии многоатомного спирта.
Указанный выше этап (i) - это хорошо известная и описанная в литературе реакция кислоты (а также слабых кислот, например уксусной кислоты) и железа согласно уравнению:
Fe0+2H+→Fe2++1/2H2↑
Затем можно полностью окислить растворенный в многоатомном спирте FeII в FeIII (например, ацетат) путем продувания воздуха и добавления Н2О2 в реакционную среду при температуре менее 100°С.
Золотые наностержни получают известным образом путем синтеза под воздействием СВЧ-излучения, начиная с золота в ионной форме в присутствии различных добавок: алкилтриметиламмония бромида, CnTAB n=10-16, цетилпиридиния хлорида, С16 PC и PVP [в этой связи см. М. Tsuji, K. Matsumoto, Т. Tsuji, Н. Kawazumid, Mater. Lett. 59 (2005) 3856] или путем восстановления HAuCl4; аскорбиновой кислотой в присутствии СТАВ и AgNO3 (в этой связи см. Ratio F. et al. J NANOPARTICLE RESEARCH 2010 и [Ratto F. et al. J NANOPARTICLE RESEARCH 2012).
Поверхность частиц с магнитными и/или магнитно-оптическими свойствами, полученных, как описано выше, функционализируют пирокатехином (бифункциональный агент), используя сродство полярных ОН групп к поверхности частиц, причем концевая часть не связывается с поверхностью частиц, так что сохраняется способность к гидрофобным взаимодействиям, нужная для последующего включения в полимерный/белковый матрикс.
Полимерный матрикс по данному изобретению состоит из сополимеров, поддающихся биологической деградации, и таким образом возможно высвобождение из него лекарственного вещества, происходящее постепенно по мере деградации матрикса в физиологической среде.
Примерами сополимеров, пригодных для целей данного изобретения, являются поддающиеся биологической деградации наномицеллы, сложные полиэфиры, сложные полиэфиры, полиуретаны, поликарбонаты и полиглутаминовая кислота, простой полиэфирамин и полибензилглутамат.
Особенно предпочтительны поддающиеся биологической деградации наномицеллы, состоящие из блок-сополимеров поли(молочной-со-гликолевой) кислоты и полиэтиленгликолькарбоксилата (PLGA-b-PEG-COOH, MnPLGA диапазон = 44-10 кДа, MnPEG = 2-3 кДа), описываемые формулой (I)

где m = [117-330]; n = [117-330]; p = [60-100].
Этот продукт известен в данной области техники и уже применялся в различных других работах, связанных с доставкой лекарственных агентов в нужное место организма, а также на уровне фазы I клинических испытаний по проверке противораковых агентов (см. X. Shuai et al, 2004 и X. Shuai, Н. Ai, N. Nasonkla, S. Kim, J. Geo, J. Controlled Release, 2004, 98, 415).
Этот полимер обладает свойствами, делающими возможной сборку наносфер с гидрофобной внутренней областью, создаваемой остатками PLGA, и гидрофильной наружной областью, формируемой концевыми участками PEG-COOH (см. фиг. 3).
Благодаря такой двоякой природе эти наносферы могут захватывать органические активные ингредиенты в свою гидрофобную часть и в то же время благодаря гидрофильной части они способны распределяться в водном растворе.
При желании с таким полимером можно смешивать вещества, обладающие терапевтическим действием, которые диспергируют в полимерном матриксе известными способами, что иллюстрируется приведенными ниже примерами.
Примерами веществ, обладающих терапевтическим действием, согласно данному изобретению являются, например, противораковые агенты (таксаны, гемцитабин, винкристин и др.); агенты, нейтрализующие пероксинитрит (скэвенджеры); ингибиторы супероксиддисмутазы; ретиноиды (бексаротен); цитокины, например интерлейкин-10; лиганды рецепторов, подобных белку Toll (TLR-лиганды), например хеликобактерный белок, активирующий нейтрофилы (HP-NAP), способный активировать TLR2; аспирин.
Кроме того, функциональные карбоксильные группы фрагмента PEG-COOH мицелл обеспечивают химически стабильную связь с моноклональными антителами, белками, пептидами или иными активными веществами, представляющими интерес в контексте данного изобретения (например, и/или флуоресцентные красители) для специфичного распознавания по усиленной экспрессии в клетках.
В числе антител, которые можно использовать для функционализации согласно данному изобретению, можно упомянуть hERG, hEGFR, IgG, moAb и др.
В примерах (см. Пример 10) описывается функционализация согласно данному изобретению, в частности с использованием специфичных моноклональных антител hERG1, описанных и заявленных в патенте Италии IT 1,367,861.
В частности, речь идет о специфичных моноклональных антителах против внеклеточной части сегмента S5 белка калиевого канала HERG1, продуцируемых гибридомами, являющимися продуктом слияния иммортализованных клеток, принадлежащих линии NS0 мышиных неопластических клеток, и лимфоцитов, полученных в результате иммунизации мышей пептидом с аминокислотной последовательностью EQPHMDSRIGWLHN.
Конструкцию по данному изобретению (далее называемую «нанобиореактором», сокращенно «NBR»), содержащую магнитные наночастицы, функционализированные пирокатехином, получают путем поверхностного нанесения (нанопреципитации), смешивая две жидкости:
- раствор полимера в органическом растворителе, смешанный с суспензией наночастиц, покрытых органическим связующим агентом (в том же растворителе),
- водный раствор Na2HPO4 (1 мМ)
смешивают в режиме постоянного потока в смесителе реактора непрерывного или периодического действия.
При синтезе в периодическом (batch) режиме суспензия в органическом растворителе, содержащая полимер и частицы, вводится в водный раствор с помощью шприца в один прием, без магнитного перемешивания.
При синтезе в непрерывном (continuous) режиме используется перистальтический (шланговый) насос с двумя шлангами для осуществления добавления раствора органической фазы в поток водного раствора (соотношение объемов органической и водной фазы 1/10). По соответствующим шлангам раствор отводится непосредственно из цилиндров, содержащих суспензию в органическом растворителе (с функционализированными частицами и полимером) и раствор Na2HPO3 (1 мМ; рН 7,4).
Когда получена дисперсия гибридных частиц (состоящих из магнитных наночастиц, функционализированных пирокатехином и включенных в полимер), часть органического растворителя удаляют при помощи роторного испарителя, чтобы уменьшить количество органической фазы на последующих этапах производства.
Полученную суспензию затем подвергают диализу против водного раствора Na2HPO3 для удаления органической фазы и концентрируют до минимально возможного объема, чтобы достичь концентрации от 0,1% до 1% (мас./мас.).
Второе концентрирование может дать гораздо более концентрированный продукт, путем мембранного диализа с теоретическим коэффициентом концентрирования от 5х до 20х в зависимости от применения. Затем продукт фильтруют, используя фильтр с порами диаметром 0,22 мкм, для удаления бактерий. Полученный продукт после воздействия в течение 30 минут переменного электромагнитного поля с напряженностью 21-24 кА/м и частотой 160-190 кГц обладает превосходной эффективностью в смысле гипертермического действия: его температура увеличивается по меньшей мере на 5°С.
Описанный здесь способ позволяет получить конструкции с распределением частиц по размерам, сосредоточенным в диапазоне от 30 до 60 нм.
У полученного продукта определяли дзета-потенциал при помощи системы для исследования наночастиц Zetasizer nano-S (Malvern), чтобы охарактеризовать стабильность полученной суспензии в электрическом поле и ее ионную силу; дзета-потенциал оказался ниже -30 мВ; это означает, что частицы испытывают электростатическое отталкивание отрицательно заряженной поверхностью, производимое карбоксильными группами, которые при физиологическом значении рН 7,4 частично депротонированы.
В описанных выше экспериментальных условиях можно получить суспензию, обладающую хорошей стабильностью, после разведения в культуральной среде, обычно используемой при культивировании клеток (DMEM, RPMI); при этом наблюдается слабая тенденция к агрегации и осаждению после явного изменения ионной силы в результате разбавления.
Чтобы получить продукт, функционализированный по поверхности моноклональными антителами и/или флуоресцентными красителями (например, Cyanine®, Dylight® и др.) для целенаправленной доставки в нужное место организма и для визуализации, перед второй стадией концентрирования (см. выше) требуется использование нанобиореакторов (NBR) в качестве предшественника.
Как правило, на этой стадии концентрация неорганического вещества в продукте составляет 0,05-0,1% (мас./мас.).
Подготовительный этап способа по данному изобретению обеспечивает активацию концевых карбоксильных групп полимера, обращенных в сторону наружной части наночастицы, при контактировании с полярной фазой; активаторами служат 1-этил-3-(-3-диметиламинопропил)карбодиимида гидрохлорид (EDAC), взятый в молярном соотношении EDAC/COOH = 10/1, и N-гидроксисульфосукцинимид (сульфо-NHS) с молярным соотношением NHS/COOH = 1/1, чтобы способствовать последующему воздействию путем этерификации концевых аминогрупп моноклональных антител и/или флуоресцентного красителя.
В случае флуоресцентных красителей с испусканием при длинах волн 600-800 нм (что подходит для визуализации в ближнем инфракрасном диапазоне in vivo), поскольку в продаже имеются только соединения с NHS-этерифицированными концевыми группами, необходим промежуточный этап, на котором добавляется линкерная структура с двумя концевыми аминогруппами, чтобы создать мостик между, с одной стороны, флуоресцентным красителем и, с другой стороны, карбоксильными группами активированного полимера.
Когда поверхность наночастиц активирована, прибавляют антитела и/или краситель с концевой аминогруппой и смесь выдерживают.
Затем суспензию концентрируют и проводят диализ против водного раствора Na2HPO3 и концентрируют до содержания неорганической фазы 0,2%-1,0% (мас./мас.) в зависимости от применения.
Затем продукт фильтруют, используя фильтр с порами диаметром 0,22 мкм для удаления бактерий.
Описанный в настоящем документе способ позволяет получить конструкции с распределением частиц по размерам с центром в диапазоне 40-70 нм.
У полученного таким образом продукта дзета-потенциал, определенный при помощи системы для исследования наночастиц Zetasizer nano-S (Malvern), чтобы охарактеризовать стабильность полученной суспензии в электрическом поле и ее ионную силу, был меньше -30 мВ, но больше, чем у NBR-продукта; это означает, что отрицательный заряд, обусловленный карбоксильными группами неочищенного продукта, частично нейтрализован связанным антителом/красителем.
Количество антител, связанных с частицами, определяли с использованием ВСА-теста: после добавления нужных реагентов к раствору, содержащему белковый аналит, образуется комплекс с медью и измеряют обусловленную им оптическую плотность при длине волны 562 нм; для построения калибровочной кривой используют линейную регрессию.
Описанным в настоящем документе способом можно, например, получить наночастицы, функционализированные моноклональными антителами, причем количество связавшихся моноклональных антител составляет от 5% до 30% (мас./мас.) по сравнению с содержанием неорганической фазы.
Получение систем нанобиореактор/липофильный агент (далее обозначается NBR_PTX) и нанобиореактор/антитело/липофильный агент (далее обозначается NBR_hERG_PTX), в которых липофильным агентом служит, например, паклитаксел (Paclitaxel), осуществляется точно так же, как синтез нанобиореакторов, описанный выше; в результате обеспечивается включение неорганических наночастиц, предварительно функционализированных пирокатехином, в полимерный матрикс на основе PLGA-b-PEG-СООН. Единственное изменение в описанном способе касается растворения конкретных количеств веществ в полимере и суспензии функционализированных наночастиц.
Затем получают нанобиореакторы, нагруженные паклитакселом (NBR_PTX), применяя метод нанопреципитации, при котором указанный выше раствор органической фазы резко добавляют в смесителе к водному раствору Na2HPO4 (1 мМ). Между синтезом в непрерывном режим и в периодическом не наблюдалось разницы в морфологических свойствах получаемой суспензии. Процессы очистки, фильтрации и концентрирования проводятся так же, как описано выше.
Для характеристики получаемого продукта, помимо определения среднего диаметра частиц, их дзета-потенциала и концентрации неорганической фазы, методом высокоэффективной жидкостной хроматографии (HPLC) определяли количество активного ингредиента, включенного в полимер.
Полученный и охарактеризованный указанным образом продукт может быть далее функционализирован по поверхности нацеливающими структурами, например hEGR, hEGFR, IgG и др.
Осуществляемый таким образом способ в точности следует описанному выше нацеливанию системы нанобиореактор-моноклональные антитела (NBR_moAb).
Собственно, в нем предполагается предварительный этап активации карбоксильных групп, имеющихся на полимере, с использованием таких активаторов, как EDAC и сульфо-NHS, и этап взаимодействия с моноклональными антителами, согласно тем соотношениям, которые представлены в ранее описанном способе для NBR_moAb.
Затем проводят обычную очистку и определяют свойства продукта. Получаемые таким образом суспензии наночастиц характеризуются средним гидродинамическим диаметром от 45 нм до 55 нм при дзета-потенциале существенно ниже -30 мВ.
В другом варианте воплощения данного изобретения описанные выше конструкции по данному изобретению могут, в качестве альтернативы аналогичному использованию белков или антител, быть введены внутрь клеток иммунной системы.
Было неожиданно обнаружено, что конструкции, содержащие кластеры магнетитовых частиц, функционализированных пирокатехином и покрытых блок-сополимерами поли(молочной-со-гликолевой) кислоты и полиэтиленгликолькарбоксилата (PLGA-b-PEG-COOH, MnPLGA диапазон = 44-10 кДа, MnPEG = 2-3 кДа), как описано выше, легко включаются в клетки иммунной системы, не влияя негативно на их функционирование и жизнеспособность.
Клетки иммунной системы, в которые внедрены конструкции по данному изобретению, можно использовать для диагностирования опухолевых заболеваний, дегенеративных заболеваний центральной нервной системы (например, болезни Альцгеймера), сердечнососудистых заболеваний головного мозга и инфекционных заболеваний, аутоиммунных заболеваний и состояний, связанных с трансплантацией, а также для лечения опухолей, сердечнососудистых заболеваний головного мозга, дегенеративных заболеваний (например, болезни Альцгеймера), инфекционных заболеваний, состояний, связанных с трансплантацией, цирроза печени и других состояний, сопровождающихся образованием и прорастанием соединительной ткани, расстройств, сопровождающихся повторными выкидышами, внутриутробной гибели плода, неонатальных заболеваний, врожденных и приобретенных расстройств свертывания крови, генетически обусловленных заболеваний, аутоиммунных заболеваний и, наконец, для облегчения боли.
Вызвать высвобождение можно различными способами, например с использованием специфичных антигенов (например, антигена MAGE-3 в случае лечения меланомы; миелинового олигодендроцитного гликопротеина (MOG) или других миелиновых антигенов при лечении рассеянного склероза и др.) или с использованием подходящих иммуномодулирующих агентов, например интерлейкина-2 (IL-2), лиганда рецепторного бежа CD40, агонистов рецепторов, подобных бежу Toll (TLR), липосом, иммуностимулирующих комплексов (ISCOM).
Следует отметить, что важным свойством клеток иммунной системы является их способность добираться практически до любого места в организме, благодаря которой их можно использовать в качестве носителя для достижения определенных участков, доставляющего с помощью конструкций по данному изобретению определенный продукт к его мишени; при этом преодолевается важное ограничение применения лечебно-диагностических наноструктур, состоящее в низкой специфичности лечения.
Клетки иммунной системы, которые можно использовать для указанной выше цели, выбирают, например, из: Т-лимфоцитов, моноцитов, макрофагов, дендритных клеток, натуральных киллеров (NK-клеток), В-лимфоцитов, нейтрофильных гранулоцитов, эозинофильных гранулоцитов, базофильных гранулоцитов, гамма-дельта Т-лимфоцитов.
У больного берут эти клетки и нагружают их нужными наночастицами, чтобы затем ввести (местно или системно) тому же индивиду.
Клетки иммунной системы подвергают очистке, как описано ниже, и, чтобы ускорить избирательное/предпочтительное нацеливание на пораженные данным заболеванием места в организме, эти клетки обрабатывают ex vivo соответствующими антигенами (или аллергенами), иммуномодулирующими агентами или снабжают иммунопотен1щруюшими либо иммуносупрессорными веществами.
Одним из способом отбора Т-клеток для диагностических или терапевтических целей является обогащение популяции Т-лимфоцитов, специфичных к определенному антигену, например какому-либо из упомянутых выше опухолевых антигенов.
Лимфоциты, надлежащим образом снабженные конструкциями по данному изобретению, оказавшись в нужном месте организма, высвобождают принесенные частицы под действием соответствующих химических стимуляторов, и эти частицы при воздействии электромагнитного поля в радиоволновом диапазоне дают гипертермический эффект или выделяют активные ингредиенты, например противоопухолевые лекарственные вещества, агенты, нейтрализующие активные вещества при окислительном стрессе в тканях мозга (скэвенджеры), противовоспалительные агенты и проч. Наночастицы могут выполнять свою роль, даже если они остаются внутри лимфоцитов.
Магнитные наночастицы могут также служить для магнитно-резонансной визуализации, поскольку обеспечивают превосходный контраст Т2 Т2*-изображений (см. упомянутые выше патенты). Наночастицы, содержащие золотые наностержни, можно использовать при лазерной противоопухолевой терапии, идентифицируя их методами типа фотоакустической спектроскопии.
Очистка и отбор лимфоцитов
Т-лимфоциты, предназначенные для использования в противоопухолевой терапии, выделяют в чистом виде из периферической крови или лимфатических узлов пациента, или из того места его организма, где находится опухоль, после предварительного введения соответствующих антигенов, или из других участков организма, представляющихся подходящими для этого в данном конкретном случае; для выделения Т-клеток применяются стандартные методы и/или используются избирательные методики иммуномагнитной сортировки клеток (MACS®); см. Current Protocols in Immunology 2013; D'Elios et al J Immunol 1997; 158: 962-967.
Чтобы отобрать Т-лимфоциты, специфичные в отношении данной опухоли, их культивируют в присутствии соответствующего опухолевого антигена (например, в случае меланомы это антиген MAGE-3 в концентрации 10 мкг/мл) в полной среде RPMI в течение 5 суток. Затем раз в трое суток добавляют рекомбинантный человеческий IL-2, после чего клетки нагружают наночастицами, промывают и вводят больному местно и/или системно.
Т-клетки для использования при диагностировании, например рассеянного склероза, магнитно-резонансными методами отбирают по специфичности к MOG или другим миелиновым антигенам (10 мкг/мл) или к иным антигенам, предпочтительно способным попадать в структуры центральной нервной системы.
В таком случае Т-клетки культивируют с одним или более антигенами в течение пяти суток, затем стимулируют их размножение интерлейкином-2, после чего нагружают наночастицами.
Такой же подход применяют в случае других неврологических заболеваний, например, болезни Альцгеймера, болезни Паркинсона, при инсульте и иных заболеваниях с поражением сосудов сердца и головного мозга, используя соответствующие антигены.
Дендритные клетки (которые высокоэффективны в смысле представления антигена Т-лимфоцитам и таким образом могут их успешно активировать) получают с помощью обычно применяемых для этой цели стандартных методов и/или используют избирательные методики иммуномагнитной сортировки клеток (MACS®); см. Current Protocols in Immunology 2013; Codolo et al. Arthr. Rheum. 2008; 58: 3609-17. Дендритные клетки инкубируют в течение 36-44 часов с нужным антигеном, затем нагружают наночастицами, промывают и вводят тому же больному, у которого брали клетки для отбора, путем инфузии в диагностических или терапевтических целях (см. схему на фиг. 5).
Натуральные киллеры (NK-клетки) и/или гамма-дельта Т-лимфоциты с высокой цитотоксической активностью, получают с помощью обычно применяемых для этой цели стандартных методов и/или используют избирательные методики иммуномагнитной сортировки клеток (MACS®); см. Current Protocols in Immunology 2013). Выделенные клетки нагружают нужными наночастицами, а также, возможно, другими иммуномодулирующими агентами, промывают и вводят больному в целях терапии (например, противоопухолевой) или диагностики.
Нейтрофильные гранулоциты получают с помощью обычно применяемых для этой цели стандартных методов и/или используют избирательные методики иммуномагнитной сортировки клеток (MACS®); см. Current Protocols in Immunology 2013). Выделенные клетки нагружают нужными наночастицами, а также, возможно, другими иммуномодулирующими агентами, промывают и вводят больному в целях диагностики (например, для идентификации наличия очага инфекции в организме, который не удается выявить другими способами) или лечения.
Также для диагностического и/или терапевтического (например, в качестве эффекторных клеток для использования при лечении опухолевых, аутоиммунных, инфекционных, дегенеративных заболеваний) применения можно отобрать клетки других типов, например В-лимфоциты, эозинофилы, базофилы; их получают с помощью обычно применяемых для этой цели стандартных методов и/или используют избирательные методики иммуномагнитной сортировки клеток (MACS®); см. Current Protocols in Immunology 2013).
Выделенные клетки нагружают нужными наночастицами или, возможно, другими иммуномодулирующими агентами, промывают и вводят тому же больному, у которого брали клетки для отбора.
Клетки иммунной системы, нагруженные теми или иными наночастицам, можно использовать для рассмотрения с помощью методов визуализации того участка организма, который поражен данным заболеванием.
Для наполнения наночастицами Т-лимфоцитов и клеток линии Jurlcat оптимальное время - через 4 часа.
В моноциты/макрофаги, дендритные клетки, клетки линии J774A.1 (макрофаги) наночастицы включаются способом по данному изобретению, согласно которому моноциты/макрофаги, дендритные клетки, клетки линии J774A.1 нагружают наночастицами в концентрации 0,05% в подходящей культуральной среде (среда mm). Для получения среды mm, содержащей наночастицы, сначала отмеряют наночастицы, а затем - определенную культуральную среду.
Среда mm состоит из:
Полная среда DMEM 10% FBS
Полная среда DMEM:
- DMEM с высоким содержанием глюкозы (DME/HIGH). (EUROCLONE) (код ECB7501L)
- L-глутамин, раствор 200 мМ (100х). (EUROCLONE) (код ЕСВ 3000D)
- Пенициллин-стрептомицин раствор (100х). (АТСС) (код 30-2300)

При необходимости вместо эмбриональной телячьей сыворотки можно использовать аутологичную сыворотку крови пациента или бессывороточную среду.
В моноциты/макрофаги, дендритные клетки, клетки линии J774A.1 наночастицы включаются оптимально через 2 часа, но процесс включения начинается через 15 минут и продолжается до 24 часов.
На фиг. 6 представлено изображение, полученное с помощью оптического микроскопа, моноцитов/макрофагов, нагруженных наночастицами.
Данное изобретение станет понятнее в свете приведенных ниже примеров, а также, в частности, фиг. 4 и 5, схематически представляющих различные этапы получения предлагаемых конструкций и манипуляций с клетками иммунной системы.
Пример 1. Получение ацетата железа в диэтиленгликоле
Реагенты
40 г Fe (Fe<99%<212 мм), что дает 0,716 моль; 800 г воды; 800 г СН3СООН (80%), что дает 10,67 моль; 46,64 г оксигенированной воды (30%), что дает 0,41 моль; 0,12 г концентрированной HCl; диэтиленгликоль (DEG) 3850 г.
Синтез
Железо, уксусную кислоту, водный раствор и соляную кислоту загружают в потоке азота в четырехгорлую колбу емкостью 5000 мл, нагревают до температуры 90°С и держат при этой температуре 6 часов. Реакционную смесь оставляют остывать в атмосфере азота и раствор фильтруют, чтобы удалить не растворившееся железо. К прозрачному раствору, помещенному в колбу, прибавляют по каплям (с помощью капельницы) оксигенированную воду; при этом в течение 1 часа поддерживают температуру 35°С. В результате получают прозрачный раствор (1628,3 г) с титром железа 2,40% (мас./мас.), Для удаления избытка кислот делают вакуумную перегонку (первую) при температуре 40°С, разводят сухой материал водой, перегоняют два раза (два последовательных промывания) и окончательно отгоняют при температуре около 50°С. К сухому материалу прибавляют 3850 г DEG, так чтобы расчетный титр железа достиг значения 1,01% (мас./мас.) Fe.
Пример 2. Получение наночастиц Fe3O4 в диэтиленгликоле
Реагенты
1,50 г Fe0 (Fe0<99%, <212 мм) Fe0=0,179 моль; 150 г DEG; 1,2 г раствора в DEG 1/10 концентрированной HCl (концентрация 37%); 300,00 г FeAc3 в DEG (1,01% (мас./мас.) FeIII).
Металлическое железо и DEG помещали в атмосфере азота в четырехгорлую колбу емкостью 500 мл и нагревали до 150°С. Затем прибавляли раствор соляной кислоты в DEG и оставляли перемешиваться в течение 5 минут. Затем прибавляли с помощью шприца ацетат железа аликвотами по 10 эквивалентов, что обеспечивало должный рост частиц; при этом температуру поднимали до 170°С; реакция завершалась за 24-36 часов.
Полученный продукт оставляли охлаждаться до 60°С и сливали в химический стакан, с помощью магнита задерживая не прореагировавшее металлическое железо, после чего фильтровали через стекловолоконный фильтр с порами диаметром 0,45 мкм.
450 г наносуспензии магнетита в диэтиленгликоле с титром ионного железа 0,91%+/-0,05, что в форме Fe3O4 соответствует 1,253%+/-0,05. С этим образцом определяли гипертермический эффект; полученные значения представлены в следующей таблице:

Пример 3. Получение органического связующего агента
N-(3,4-дигидроксифенэтил)додеканамида (DDA)

Молекулярная масса 335,48 г/моль
Реагенты
25 г дофамина гидрохлорида, что дает 0,1318 моль; 1 л тетрагидрофурана (THF); 45 мл триэтиламина (0,32 моль); 31,20 мл лауроилхлорида (0,135 моль);
Очистка и кристаллизация
400 мл тетрагидрофуран (Aldrich 401757-2L-Lot STBC4923V)
935 мл этилацетат (ALdrich 34972-2,5L-Lot 57ВС011AV)
315 мл петролейный эфир (ALdrich 77379-2,5L-Lot BCBG7367V)
Синтез
В четырехгорлую колбу емкостью 5 л в атмосфере азота помещают дофамина гидрохлорид и затем тетрагидрофуран (1 л); затем прибавляют триэтиламин и реакционную смесь перемешивают в течение около 20 минут. В результате получают суспензию белого цвета.
В плоскодонную колбу емкостью 3 л помещают тетрагидрофуран (1 л) и ацилирующий агент. Этот раствор перемешивают и с помощью перистальтического (шлангового) насоса прибавляют его к реагентам, находящимся в 5-литровой колбе, со скоростью приблизительно 2 мл/мин на протяжении 9 часов. В результате получают раствор желто-оранжевого цвета с некоторым количеством белого твердого материала на дне колбы.
Очистка
Органическую фазу, содержащую продукт синтеза, подвергают очистке и отделяют желаемый продукт от побочных продуктов, образовавшихся в ходе реакции. Очистка осуществляется путем удаления растворителя с помощью роторного испарителя в два приема (2×200 мл). Твердый остаток и то, что осталось в колбах, в которых проходил синтез, экстрагируют водой и обрабатывают этилацетатом; это осуществляется с помощью разделительной воронки. Все органические фазы объединяют, высушивают сначала над Na2SO4, потом окончательно - с помощью роторного испарителя. В итоге получают 57 г маслянистого продукта оранжевого цвета.
Кристаллизация
К полученному продукту прибавляют 450 мл смеси петролейного эфира и этилацетата в соотношении 7:3. Эту суспензию ставят под холодную воду, так что начинает образовываться белый твердый материал, и оставляют на сутки.
Твердый материал отфильтровывают с помощью бюхнеровской воронки, промывают маточным раствором и высушивают в разреженной атмосфере, создаваемой масляным насосом. В результате получают 39 г продукта (теоретический выход 44 г, 88,6%).
Маточный раствор, полученный при кристаллизации (2,45 г твердого вещества оранжево-коричневого цвета) и при промываниях, высушивают (PRIME 27,13 г твердого вещества темно-коричневого цвета).
Пример 4. Функционализация поверхности наночастиц из Fe3O4 в тетрагидрофуране
Реагенты
Дисперсия 40,0 г Fe3O4, что дает 2,164⋅10-3 моль; 1089 мг N-(3,4-дигидроксифенэтил)додеканамида (DDA), что дает 3,247⋅10-3 моль; 120 мл этилового спирта; 80,0 г тетрагидрофурана.
Растворяют 1089 мг DDA в 120 мл этилового спирта в колбе емкостью 250 мл; приготовленный таким образом раствор добавляют к магнетиту с помощью шприца емкостью 60 мл. Затем раствор подвергают воздействию ультразвука с помощью ультразвуковой бани в течение 1 часа. Образец отставляют на несколько минут, а потом добавляют 60 мл воды и наночастицы собираются на неодимовый магнит; супернатант отделяют и наночастицы диспергируют в 80,0 г тетрагидрофурана. К дисперсии прибавляют 4 капли триэтиламина (частицы диспергируются через около 10 минут).
Свойства
Динамическое светорассеяние

Пример 5. Функционализация поверхности наночастиц из Fe3O4 в ацетоне
Реагенты
Дисперсия 4,0 г Fe3O4, что дает 0,2⋅10-3 моль; 108,0 мг N-(3,4-дигидроксифенэтил)додеканамида (DDA), что дает 0,3⋅10-3 моль; 12,0 мл этилового спирта; 13,6 мл ацетона.
Суспензию магнетита подвергают воздействию ультразвука с помощью ультразвуковой бани в течение 1 часа, затем прибавляют ее к раствору 108 мг DDA в 12,0 мл этилового спирта с помощью шприца емкостью 25 мл. Затем помещают в ультразвуковую баню на 30 минут. Образец отставляют на несколько минут. Прибавляют 6 мл воды и наночастицы собираются на неодимовый магнит; супернатант отделяют и наночастицы диспергируют в 13,6 мл ацетона. К дисперсии прибавляют 2 капли триэтиламина (частицы диспергируются сразу).
Свойства
Динамическое светорассеяние

Пример 6. Синтез полимера (блок-сополимера поли(молочной-со-гликолевой) кислоты и полиэтиленгликолькарбоксилата, PLGA-b-PEG-COOH) с молекулярной массой 43-3 кДа
Для синтеза блок-сополимера поли(молочной-со-гликолевой) кислоты и полиэтиленгликолькарбоксилата (PLGA-b-PEG-COOH) предшественник PLGA-COOH (молекулярная масса 44-10 kDa) активируют N-гидроксисукцинимидом (NHS), используя сшивающий агент дициклогексилкарбодиимид (DCC), и затем объединяя продукт присоединения с несущей аминогруппу частью PEG-NH2 (молекулярная масса 2-3 кДа) в дихлорметане, как описано далее.
Этап 1. Активация карбоксильной группы N-гидроксисукцинимидом
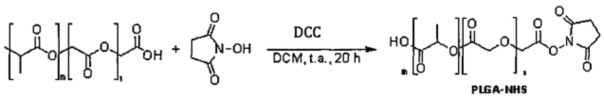
Реагенты
98 г PLGA-COOH (50:50 Поли(DL-лактид-со-гликолид), концевая карбоксильная группа
Методика
Помещают в четырехгорлую колбу объемом 5 л PLGA-COOH и 600 дихлорметана в атмосфере азота. После растворения полимера добавляют N-гидроксисукцинимид (NHS) и затем N,N-дициклогексилкарбодиимид (DCC - около 0,25 г за один раз); реакционную смесь оставляют при перемешивании на около 40 часов в инертной атмосфере. Для смывания твердого материала с воронки использовали 120 мл дихлорметана.
Полученную суспензию желтого цвета фильтровали в 2-литровую колбу с насадкой, чтобы удалить дициклогексилмочевину. Колбу емкостью 5 л промывали 250 мл (х3) и 190 мл CH2Cl2.
Полученный продукт концентрировали с помощью роторного испарителя до объема приблизительно 400 мл; это делалось в колбе емкостью 1 л (промывание - 50 мл безводного дихлорметана). В результате получалась густая желтоватая суспензия.
Осаждали PLGA-NHS, используя 400 мл (х4) холодного диэтилового эфира. При каждом промывании с белого твердого материала сливали жидкость и отбрасывали ее. Затем полученный твердый материал высушивали в течение около 2 часов 30 минут, используя разрежение, создаваемое масляным насосом.
Этап 2. Соединение PLGA-NHS с NH2-PEG-COOH
PLGA-NHS

CHCl3
CH2Cl2-РМ=119,38
DIPEA N-Этилдиизопропиламин [(CH3)2CH]2NC2H5-РМ=129,24
COOH-PEG-NH2 HClxNH2-PEG-O-C3H6-COOH-РМ PEG=3000 Да
Реагенты
PLGA-NHS (интермедиат)
Методика
В 2-литровой трехгорлой колбе, снабженной механической мешалкой, в потоке азота растворяли полученный интермедиат в 1 л хлороформа. В реакционную смесь прибавляли с помощью шприца 1,2 мл DIPEA и затем 7 г COOH-PEG-NH2 (небольшими порциями). Реакционную смесь оставляли при перемешивании в потоке инертного газа на около 90 часов. Желтый раствор из трехгорлой колбы переливали в 2-литровую одногорлую колбу и промывали 100 мл хлороформа.
Полученный продукт концентрировали до объема около 550 мл (объем дистиллята CHCl3=650 мл) с помощью роторного испарителя. Полученный продукт переносили из 2-литровой колбы в 1-литровую одногорлую колбу (промывание 250 мл CHCl3).
Сополимер осаждали и промывали 250 мл (х5) холодного диэтилового эфира; при этом вначале суспензию следует добавлять медленно и перемешивать стеклянной палочкой, чтобы предотвратить перенасыщение. При каждом промывании реакционную смесь держали на ледяной бане, после чего удаляли супернатант (опалесцирующую суспензию, содержащую четвертичные соли и не прореагировавшие органические примеси).
Твердый резиноподобный материал белого цвета промывали 250 мл (х5) деионизованной воды, чтобы удалить следы не прореагировавшего COOH-PEG-NH2.
Продукт помещали в вакуум (сперва использовали жидкостно-кольцевой насос, а затем масляный), чередуя высушивание в вакууме (с помощью масляного насоса при температуре -30°С), дезинтеграцию полимера для ускорения высушивания и выдерживание в морозильной камере в течение ночи. Процедуру повторяли до тех пор, пока не прекращалась потеря массы.
Полученный продукт хранили в морозильной камере.
Было получено 86,80 г полимера (выход около 83%).
Пример 7. Синтез (PLGA-b-PEG-COOH 12-3 кДа)
Этап 1. Активация карбоксильных групп NHS

Техническая характеристика реагентов
Реагенты
7 г PLGA-COOH 7000-17000 (50:50 поли(DL-лактид-со-гликолид), концевая карбоксильная группа)→0,582 ммоль
150 мл CH2Cl2 (Дихлорметан >99%) для растворения PLGA-COOH
0.27 г NHS (N-гидроксисукцинимид 98%), промытый 30 мл CH2Cl2→2,34 ммоль 0.51 g DCC (N,N-дициклогексижарбодиимид 99%), промытый 50 мл CH2Cl2→2,493 ммоль
70 мл CH2Cl2 (дихлорметан >99,9% для промывания 500-миллилитровой колбы перед фильтрованием на бюхнеровской воронке)
550 мл диэтиловый эфир (Aldrich ≥99,8%)
В 500-миллилитровую колбу в атмосфере азота помещали PLGA-COOH и 150 мл дихлорметана. После растворения полимера прибавляли NHS (30 мл СН2Cl г для промывания воронки) и затем прибавляли DCC - последовательные добавления - 50 мл CH2Cl2 для промывания воронки).
Реакционную смесь оставляли при перемешивании на около 24 часов в инертной атмосфере.
Полученный бесцветный раствор (с взвешенным твердым материалом белого цвета) фильтровали на бюхнеровской воронке в 1-литровую колбу с насадкой, чтобы удалить дициклогексилмочевину. Промывали 500-миллилитровую колбу 70 мл CH2Cl2.
Полученный продукт переносили в грушевидную одногорлую колбу и концентрировали с помощью роторного испарителя (Buchi); спустя около 1 часа получалась густая суспензия белого цвета.
Этап 2. Соединение PLGA-NHS с NH2-PEG-COOH

Реагенты
PLGA-NHS (интермедиат) густая суспензия
Методика
В 500-миллилитровой колбе в атмосфере азота растворяли интермедиат 100 (х2) и 60 мл CHCl3. Прибавляли с помощью шприца 0,35 мл DIPEA и затем 1,82 г COOH-PEG-NH2 с 20 мл CHCl3, которым промывали воронку. Реакционную смесь оставляли при перемешивании в потоке инертного газа на 96 часов.
Из четырехгорлой колбы суспензию, которую фильтровали на бюхнеровской воронке для отделения остатка коричневого и белого цвета, переносили в 500-миллилитровую одногорлую колбу, промывая несколькими миллилитрами хлороформа.
Полученный продукт концентрировали (объем дистиллята CHCl3=170 мл) с помощью роторного испарителя. К раствору желтого цвета прибавляли холодный диэтиловый эфир в количествах: 120 мл (суспензия белого цвета - перемешивание стеклянной палочкой - ледяная баня), 60 мл (суспензия белого цвета - ледяная баня), 80 мл (начинается осаждение - ледяная баня), 60 мл (морозильная камера в течение около 1 часа). Полученный продукт промывали 100 мл (х2) холодного диэтилового эфира. При каждом промывании реакционную смесь ставили в морозильную камеру и затем удаляли супернатант (опалесцирующую суспензию, содержащую четвертичные соли и не прореагировавшие органические примеси). Три фракции в эфире высушивали (1,20 г).
Твердый резиноподобный материал белого цвета промывали 100 мл (х3) деионизованной воды (ледяная баня), чтобы удалить следы не прореагировавшего СООН-PEG-NH2.
Сополимер (18,10 г) помещали в вакууме в роторный испаритель (Buchi) и подсоединяли к масляному насосу (этиловый спирт - сухой лед) на около 4 часов (7,78 г - высушивание чередовали с дезинтеграцией). Полученный продукт подвергали дезинтеграции и помещали в вакуум, чередуя высушивание, дезинтеграцию и содержание в морозильной камере. Процедуру повторяли до тех пор, пока не прекращалась потеря массы.
Полученный продукт хранили в морозильной камере.
Было получено 7,52 г полимера (выход 88-86%).
(2 г) Р.М. - 11300 г/mol - 0,1769 ммоль
(5 г) Р.М. - 15400 г/mol - 0,3246 ммоль
ммоль PLGA СООН - 0,5015 г PLGA PEG СООН (моль2г*Р.М.2г)+(моль5г*Р.М.5г)=2,529+5,972=8,5 г
В расчетах использовали РМ=12000. Ожидаемое количество PLGA PEG СООН 8,74 г.
Пример 8. Получение нанобиореакторов (NBR)
Реагенты
40,0 г Fe3О4-DDA, что дает 9,5е-04 моль Fe3О4; 220,0 мг PLGA-b-PEG-COOH, что дает 5е-06 моль полимера; 400 мл фосфатного буферного раствора (1 мМ).
После растворения 220,0 мг полимера в 5 мл тетрагидрофурана, в органический раствор вводят 40,0 г Fe3O4-DDA с помощью 60-миллилитрового шприца. Полученный продукт концентрируют с помощью роторного испарителя, чтобы удалить присутствующий тетрагидрофуран. Процедуру прекращают, когда больше не происходит образования и конденсации паров органических веществ.
Затем продукт концентрируют и проводят диализ, используя систему для фильтрации Cogent М с мембраной Pellicon 2mini 100 кДа следующим образом:
В высушенную систему для фильтрации вводят суспензию нанобиореакторов, концентрированную с теоретическим коэффициентом 1,5 и затем диализованную с 2000 мл забуференной (10-3 М) ультрачистой воды.
Ее далее концентрируют до объема 100 мл в системе Pellicon XL с мембраной, рассчитанной на 500 кДа (предварительно держат в NaOCl 1:10 в течение 30 минут).
Процедуру прекращают, когда достигается теоретический коэффициент концентрирования 20х (теоретическая концентрация неорганических веществ 1,0%).
Затем фильтруют, используя фильтр из полиэфирсульфона (PES; Millipore Sterivex) с порами диаметром 0,22 мкм. Продукт хранят в холодильнике.
Свойства
Динамическое светорассеяние

Дзета-потенциал

Индуктивно-связанная плазма (ICP)

Стабильность в культуральной среде
Образец, разведенный 1:20 (неорганическая фаза - 0,05% мас./мас.) в среде DMEM + 10% FBS + глутамин + антибиотик, был прозрачным и не содержал агрегатов.
Динамическое светорассеяние

Пример 9. Получение нанобиореакторов в непрерывном режиме
Реагенты
200 мг PLGA-b-PEG-COOH, что дает 4,4е-06 моль полимера; 52,6 г тетрагидрофурана (THF); 36,4 г Fe3O4-DDA, что дает 8,6е-04 моль Fe3O4; 1000 мл Н2О (MilliQ) с фосфатным буферным раствором (рН 7,4)=10-3 М.
В колбу Эрленмейера емкостью 100 мл помещали 0,2 г полимера PLGA-b-PEG-СООН и 52,6 г тетрагидрофурана, перемешивая до полного растворения (несколько минут). Затем прибавляли 36,4 г Fe3O4-DDA.
Синтез
Для добавления органического раствора в поток водного раствора установили после калибровки систему перистальтического (шлангового) насоса с двумя шлангами [тетрагидрофуран/вода (объем/объем)=1/10]. Соответствующие шланги подавали раствор непосредственно из цилиндров, содержащих тетрагидрофурановый раствор (с PLGA-b-PEG-COOH и частицами) и фосфатный буферный раствор, приготовленный в бутыли емкостью 2,5 л.
Полученный продукт вначале подавали в роторный испаритель, чтобы удалить тетрагидрофуран, а затем высушивали; когда все летучие компоненты испарились, остается целевой продукт. Полученный продукт концентрируют и проводят диализ, используя систему для фильтрации Cogent М с мембраной Pellicon 2mini 100 кДа.
Из указанной системы извлекают 254,5 г продукта.
Теоретический коэффициент концентрирования 4,7х
Теоретическая концентрация 0,078%
Время, необходимое для концентрирования и диализа, - 20 минут.
Продукт далее концентрируют в системе Pellicon XL с мембраной, рассчитанной на 500 кДа. Время, необходимое для окончательного концентрирования -1 час.
Получено 11,51 г за вычетом мертвого объема мембраны около 1-2 мл.
Теоретическая концентрация (в расчете на Vмертв 1,5 мл) 14%
Свойства
Динамическое светорассеяние

Масс-спектрометрия с индуктивно-связанной плазмой (ICP)

Пример 10. Получение нацеленных на мишень нанобиореакторов с моноклональными антителами (NBR_hERG)
Реагенты
40,38 мл нанобиореакторов, что дает 0,533 мкмоль -СООН; 2,32 мл раствора Сульфо-NHS (0,23 мМ), что дает 0,533 мкмоль; 190 мкл раствора EDAC*HCl (28 мМ), что дает 0,053 ммоль; 2,64 мл раствора hERG (1,52 мг/мл), что дает 4,0 мг hERG (2,7е-08 моль); 1500 мл водного раствора Na2HPO3=10-3 М.
В стерильный флакон емкостью 250 мл помещали 40,38 мл нанобиореакторов и затем 0,19 мл EDAC (0,028 М) и 2,32 мл Сульфо-NHS. Спустя 40 минут (без воздействий) разбавляли 2,64 мл раствора hERG1 (1,52 мг/мл=4,0 мг) фосфатным буферным раствором (15,52 мл; 1 мМ) и добавляли полученный раствор антител к 42,89 мл активированных нанобиореакторов (Vконечный=61,05 мл; Fe3O4=0,056%). Эту смесь оставляли (без воздействий) на ночь.
Проводили диализ в системе Pellicon XL с мембранным фильтром (порог отсечения по молекулярной массе 500 кДа) из полиэфирсульфона (PES). Систему промывали 300 мл Н2O (MilliQ), затем стерилизовали в течение 30 минут, используя 400 мл 0,5%-ного раствора гипохлорита натрия. Затем промывали буферным раствором (400 мл; 1 мМ).
Полученный продукт концентрировали до объема 22 мл при скорости потока насоса около 15 мл/мин (давление 0,27 бар). Полученный в результате диализа пермеат анализировали колориметрическим методом с использованием бицинхиноновой кислоты (ВСА®).
Полученный продукт подвергали диализу с 100 мл (4 объема) буферного раствора (1 мМ) при скорости потока 15 мл/мин (давление 0,27 бар) и концентрировали до объема 4,7 мл.
Наконец, продукт фильтровали, используя полиэфирсульфоновые фильтры с порами диаметром 0,22 мкм. Полученный материал хранили в холодильнике. Полученный таким образом продукт обладал хорошей стабильностью после разведения культуральной средой в концентрации 0,05% (мас./мас.); не наблюдалось флокуляции каких-либо агрегатов или твердых структур, заметной невооруженным глазом.
Свойства
Динамическое светорассеяние

Дзета-потенциал

Индуктивно-связанная плазма (ICP)

Стабильность
Динамическое светорассеяние

Определение белка с бицинхиноновой кислотой (ВСА-тест)
Для проведения ВСА-теста концентрацию NBR_hERG нормализовали относительно концентрации нанобиореакторов без антител (NBR), образец которых служил для сравнения окрашивания. Когда в результате добавления соответствующих реагентов развивалась окраска, образцы анализировали с помощью спектрофотометра, работающего в ультрафиолетовом и видимом диапазонах длин волн. Полученные значения поглощения интерполировали на предварительно построенную калибровочную кривую (с использованием бычьего сывороточного альбумина в качестве стандарта) и экстраполировали эквивалентные концентрации моноклональных антител. Количество антител, присутствующих в NBR_hERG, рассчитывали, вычитая из значений, полученных для образца NBR_hERG, значения для моноклональных антител, присутствующих в элюате и в контрольном образце (NBR). См. уравнение ниже.
СmoAb(NBR_moAb)net=CmoAb(NBR_moAb)-CmoAb(NBR)-CmoAb(элюат),
где moAb - моноклональные антитела, NBR - нанобиореактор,
В эксперименте были получены следующие значения:
mAb Элюат = 45 мкг/мл
mAb NBR = 435 мкг/мл
mAb NBR_hERG = 863 мкг/мл
Истинное содержание mAb (mAb NBR_hERG-mAb NBR) = 428 мкг/мл
Отношение mAb/Fe3O4=0,14
Пример 11. Получение нацеленных на мишень нанобиореакторов с флуоресцентными красителями (NBR_Fluo)
Техническая характеристика реагентов
Фосфатный буферный раствор на ультрачистой воде (Н2О UP) С=1М; рН 7,4
Реагенты
1500 мл Н2О (MilliQ) с фосфатным буферным раствором (10-3 М; рН=7,4)
Получение раствора Fluo-NH2
Флуорофор растворяли в 770 мкл диметилсульфоксида (DMSO), так что получался раствор концентрацией 1 нмоль/мкл. Во флакон емкостью 12 мл помещали 4950 мкл фосфатного буферного раствора (1 мМ) и 50 мкл полученного раствора флуорофора Alexa Fluor 750 (50 нмоль). Смесь ставили на магнитную мешалку и добавляли 100 мкл раствора 1,4-диаминобутана концентрацией 132 мкг/мл (что дает 150 нмоль=13,2 г). Этот раствор оставляли для протекания реакции на 24 часа в темноте в потоке азота. Полученный таким образом NH2-концевой флуорофор использовали без дальнейшей очистки для последующего синтеза.
Получение раствора Сульфо-NHS (0,23 мМ)
Отвешивали ровно 5,0 мг Сульфо-NHS и растворяли в фосфатном буферном растворе (1 мМ) в колбе емкостью 100 мл.
Получение раствора EDAC (0,028 мМ)
Во флакон емкостью 4 мл помещали 2,7 мг EDAC и 0,5 мл буферного раствора (1 мМ). Закрывали крышечкой и встряхивали, чтобы ускорить перемешивание. Этот раствор следует готовить непосредственно перед использованием для реакции.
Синтез
В сосуд емкостью 100 мл помещают 30,00 мл NBR DF, 0,14 мл EDAC (0,028 М) и 1,72 мл Сульфо-NHS (0,23 мМ).
Суммарный объем 30,00 мл + 0,14 мл + 1,72 мл=31,86 мл
Отставляют на 40 минут (без воздействий), после чего прибавляют 2,64 мл раствора Alexa Fluor 750 (10 нмоль/мл). Оставляют на 4 часа (без воздействий).
Проводят контрольное определение методом динамического светорассеяния (NBR_Fluo TQ),
Очистка
Проводили диализ в системе Pellicon XL с мембранным фильтром (порог отсечения по молекулярной массе 500 кДа) из полиэфирсульфона (PES), используя перистальтический (шланговый) насос Masterflex L/S с головкой Easy-Load II. Систему стерилизовали, заполняя раствором гипохлорита натрия (0,5%) и оставляя на около 30 минут. Промывали стерильной водой (MilliQ) и заливали в систему фосфатный буферный раствор (1 мМ; стерильный). Полученный продукт концентрировали до объема 10 мл (собирали 23 мл пермеата) при скорости потока насоса 12 мл/мин (давление 0,25 мбар). Скорость потока первого пермеата сохраняли для анализа в ультрафиолетовой и видимой части спектра. Затем проводили диализ с 40 мл (4 объема) буферного раствора (1 мМ) при скорости потока 12 мл/мин (давление 0,25 мбар). На этом этапе продукт концентрировали до объема 6 мл.
Было получено 5,00 г продукта
Теоретический коэффициент концентрирования 5,8х
Теоретический коэффициент концентрирования по сравнению с NBR 5х
Фильтрование
Продукт фильтровали, используя полиэфирсульфоновый фильтр с порами диаметром 0,22 мкМ (Millex). Чтобы очистить весь полученный продукт, достаточно одного фильтра. Продукт хранят в холодильнике.
Получено NBR_27_Fluo_01 DF 4,49 г
Свойства
Динамическое светорассеяние R0366/2013; R0368/2013

Дзета-потенциал R0368/2013

Индуктивно-связанная плазма (ICP) R0368/2013

Спектрофотометрия при длинах волн ультрафиолетового и видимого диапазонов R0368/2013

Пример 12. Получение нацеленных на мишень нанобиореакторов с флуоресцентными красителями (NBR_Fluo)
Техническая характеристика реагентов
Фосфатный буферный раствор на ультрачистой воде (Н2О UP) С = 1М; рН 7,4
Реагенты
50,00 нмоль (цианин 5)-1,4-диаминобутан (в 5,0 мл →[10 мкМ])
1500 мл Н2О (MilliQ) с фосфатным буферным раствором (10-3 М; рН=7,4)
Получение раствора Fluo-NH2
Во флакон емкостью 12 мл помещали 5 мл фосфатного буферного раствора (1 мМ), 50 нмоль (1 бутылочка) NHS-эфира цианина-5 и затем 150 нмоль (13,2 г) 1,4-диаминобутана. Этот раствор оставляли для протекания реакции на 24 часа на магнитной мешалке в темноте в потоке азота, полученный таким образом NH2-концевой флуорофор использовали без дальнейшей очистки для последующего синтеза.
Получение раствора Сульфо-NHS (0,23 мМ)
Отвешивали ровно 5,0 мг Сульфо-NHS и растворяли в фосфатном буферном растворе (1 мМ) в колбе емкостью 100 мл.
Получение раствора EDAC (0,028 мМ)
Во флакон емкостью 4 мл помещали 2,7 мг EDAC и 0,5 мл буферного раствора (1 мМ). Закрывали крышечкой и встряхивали, чтобы ускорить перемешивание. Этот раствор следует готовить непосредственно перед использованием для реакции.
Синтез
В стерильный сосуд емкостью 50 мл помещают 30,00 мл NBR и добавляют 0,14 мл EDAC (0,028 М) и 1,72 мл Сульфо-NHS (0,23 мМ).
Суммарный объем 30,00 мл + 0,14 мл + 1,72 мл=31,86 мл
Отставляют на 40 минут (без воздействий), после чего прибавляют 2,64 мл раствора цианина-5-NH2 (10 нмоль/мл). Оставляют на 4 часа (без воздействий).
Очистка
Проводили диализ в системе Pellicon XL с мембранным фильтром (порог отсечения по молекулярной массе 500 кДа) из полиэфирсульфона (PES). Полученный продукт концентрировали до объема 10 мл (собирали 23 мл пермеата) при скорости потока насоса около 12 мл/мин (давление 0,25 мбар); продолжительность 4 мин. Скорость потока первого пермеата сохраняли для анализа в ультрафиолетовом и видимом диапазонах длин волн. Затем проводили диализ с 40 мл (4 объема) буферного раствора (1 мМ) при скорости потока 12 мл/мин (давление 0,25 мбар); продолжительность 11 мин.
На этом этапе продукт концентрировали до объема 6 мл; продолжительность 5 мин.
Было получено 4,29 г продукта
Теоретический коэффициент концентрирования при синтезе 5,5х
Теоретический коэффициент концентрирования по сравнению с NBR 4,8х
Фильтрование
Продукт фильтровали, используя полиэфирсульфоновый фильтр с порами диаметром 0,22 мкм (Millex). Чтобы очистить весь полученный продукт, достаточно одного фильтра. Продукт хранят в холодильнике.
Получено NBR_Fluo 4,11 г
Пример 13. Получение нацеленных на мишень нанобиореакторов с моноклональными антителами и флуоресцентными красителями (NBR_hERG-Fluo)
Техническая характеристика реагентов
NHS-эфир цианина-5 (650 нм)
Фосфатный буферный раствор, приготовленный на ультрачистой воде (Н2О UP) С = 1М; рН 7,4
Реагенты
25 нмоль NHS-эфира цианина-5 (в 2,5 мл →[10 мкМ])
2.7 мг EDAC
5,0 мг Сульфо-NHS
1500 мл Н2О (MilliQ) с фосфатным буферным раствором (10-3 М; рН=7,4)
Получение раствора Fluo-NH2
Во флакон емкостью 12 мл помещали 5 мл фосфатного буферного раствора (1 мМ), 50 нмоль (1 бутылочка) NHS-эфира цианина-5 и помещали на магнитную мешалку, после чего прибавляли 100 мкл раствора 1,4-диаминобутана (13,2 мг/100 мл) (что соответствует 150 нмоль=13,2 мкг). Этот раствор оставляли для протекания реакции на 24 часа в темноте в потоке азота. Полученный таким образом NH2-концевой флуорофор использовали без дальнейшей очистки для последующего синтеза.
Получение раствора Сульфо-NHS (0,23 мМ)
Отвешивали ровно 5,0 мг Сульфо-NHS и растворяли в фосфатном буферном растворе (1 мМ) в колбе емкостью 100 мл.
Получение раствора EDAC (0,028 мМ)
Во флакон емкостью 4 мл помещали 2,7 мг EDAC и 0,5 мл буферного раствора (1 мМ). Закрывали крышечкой и встряхивали, чтобы ускорить перемешивание. Этот раствор следует готовить непосредственно перед использованием для реакции.
Синтез
В стерильный сосуд емкостью 100 мл помещают 7,95 мл буферного раствора (1 мМ) и затем 4,79 мл NBR. Смесь осторожно перемешивают и затем добавляют 2,29 мл EDAC (0,028 М) и 2,79 мл Сульфо-NHS (0,23 мМ).
Суммарный объем 7,95 мл + 4,79 мл + 2,29 мл + 2,79 мл=17,83 мл
Отставляют на 40 минут (без воздействий), после чего прибавляют 2,5 мл раствора NHS-эфира цианина-5 (10 нмоль/мл). После этого 3,2 мл раствора hERG1 (1,5 мг/мл=4,8 мг) разводят в 52,32 мл фосфатного буферного раствора (1 мМ) и прибавляют к суспензии, содержащей активированные NBR и флуорофор. Оставляют на ночь (без воздействий).
Очистка
Проводили диализ в системе Pellicon XL с мембранным фильтром 500 кДа из полиэфирсульфона (PES), которую уже использовали для NBR_19. Промывали 300 мл воды (MilliQ), затем заливали 400 мл раствора гипохлорита натрия (0,5%) и оставляли в нем на около 30 минут. Промывали систему 400 мл буферного раствора (1 мМ).
Полученный продукт концентрировали до объема 20 мл (собирали 50 мл пермеата) при скорости потока насоса около 14 мл/мин (давление 0,2 мбар); продолжительность 15 мин. Скорость потока первого пермеата сохраняли для анализа с бицинхиноновой кислотой. Затем проводили диализ с 80 мл (4 объема) буферного раствора (1 мМ) при скорости потока 14 мл/мин (давление 0,2 мбар); продолжительность 16 мин. На этом этапе продукт концентрировали до объема 10 мл; продолжительность 4 мин.
Было получено 6,46 г продукта
Теоретический коэффициент разбавления по сравнению с NBR 1,3х
Фильтрование
Продукт фильтровали, используя полиэфирсульфоновый фильтр с порами диаметром 0,22 мкм (Millex). Чтобы очистить весь полученный продукт, достаточно одного фильтра. Продукт хранят в холодильнике. Получено NBR_hERG-Fluo 7,79 г
Свойства
Динамическое светорассеяние

Дзета-потенциал

Индуктивно-связанная плазма (ICP)

Пример 14. Получение нанобиореакторов, несущих активный ингредиент (NBR_PTX и NBR_hERG_PTX)
Техническая характеристика реагентов
Паклитаксел (РТХ) Производство Discovery Fine Chemicals
Реагенты
35,6 г Fe3O4-DDA (40,0 мл) (195,8 мг Fe3O4) 490 мг/л (в воде)
21,2 мг паклитаксел (РТХ)
400 мл фосфатного буферного раствора (1 мМ) (фактически 440 мл)
60-миллилитровый шприц с иглой калибра 25 G
Получение тетрагидрофуранового раствора, содержащего PLGA-PEG (5,5 мг/г), паклитаксел (РТХ; 0,55 мг/г) и Fe2O4 (5,5 мг/г)]
212,6 мг PPGC43-3.1 растворяли в 4 мл (флакон емкостью 4 мл) тетрагидрофурана (THF) и 21,2 мг паклитаксела (РТХ) в 2,12 мл тетрагидрофурана (THF) (флакон емкостью 4 мл); полученные растворы прибавляли к 35,6 г Fe3O4-DDA в колбе емкостью 100 мл.
Синтез
Тетрагидрофурановый раствор вводили в 400 мл фосфатного буферного раствора (1 мМ) с помощью 60-миллилитрового шприца с иглой калибра 25 G.
Получено NBR_PTX 455,8 г
Сбор продукта
Полученный продукт помещали в роторный испаритель, чтобы удалить присутствующий тетрагидрофуран. Для этого продукт переносили в колбу емкостью 1000 мл и устанавливали следующие условия:
Температура бани 40°С
Давление 154 мбар
Скорость вращения 80 об/мин
Спустя 1 час, когда испарение летучих компонентов завершилось, продукт извлекали и взвешивали.
Было получено 418,22 г NBR PTX (удалено 37,58 г тетрагидрофурана).
Диализ и концентрирование
Для концентрирования и диализа продукта использовали систему AMICON с мембранным фильтром, рассчитанным на 50 кДа; при этом действовали следующим образом:
1) промывают осмотической водой (50 мл) для удаления примесей в мембране
2) промывают раствором с фосфатным буферным раствором (50 мл; 10-3 М), приготовленным на ультрачистой воде (Н2О UP).
После высыхания системы прибавляют NBR_PTX и концентрируют до объема около 100 мл.
Затем промывают четыре раза по 150 мл буферного раствора (1 мМ). Наконец, концентрируют до объема 75 мл, отбрасывая 45 мл элюата.
Опорожняя систему, получают 59,40 г продукта (NBR_PTX).
Теоретический коэффициент концентрирования 7,7х
Фильтрование
Продукт фильтруют, используя полиэфирсульфоновый (PES) цилиндрический фильтр с порами диаметром 0,22 мкм (Millipore Sterivex).
Свойства
Динамическое светорассеяние

Масс-спектрометрия с индуктивно-связанной плазмой (ICP)

Стабильность
Концентрированный образец разводили в соотношении 1:8 средой DMEM + 10% FBS + глутамин + антибиотик; раствор был прозрачным, без агрегатов.
Динамическое светорассеяние
R0211/2013

PDI - индекс полидисперсности
Определение паклитаксела

Пример 15. Получение нанобиореакторов, несущих активный ингредиент (NBR_PT-X и NBR_hERG_PTX)
Техническая характеристика реагентов
Фосфатный буферный раствор на ультрачистой воде (Н2О UP) С=1М; рН 7,4
Реагенты
1500 мл фосфатный буферный раствор 10-3 М; рН 7,4
Получение раствора Сульфо-NHS (0,23 мМ)
Отвешивали 5,0 мг Сульфо-NHS и растворяли в фосфатном буферном растворе (1 мМ) в колбе емкостью 100 мл.
Получение раствора EDAC (0,028 мМ)
Во флакон емкостью 4 мл помещали 2,7 мг EDAC и 0,5 мл буферного раствора (1 мМ). Закрывали крышечкой и встряхивали, чтобы ускорить перемешивание. Этот раствор следует готовить непосредственно перед использованием для реакции.
Синтез
В стерильный сосуд емкостью 40 мл наливают 2,36 мл буферного раствора (1 мМ) и затем добавляют 4,26 мл NBR_PTX. Смесь осторожно перемешивают и добавляют 1,19 мл EDAC (0,028 М) и 1,45 мл Сульфо-NHS.
Суммарный объем 2,36 мл + 4,26 мл + 1,19 мл + 1,45 мл=9,26 мл
Отставляют смесь на 40 минут (без воздействий), после чего добавляют раствор HERG1, полученный путем разведения 0,833 мл раствора hERG1 (3 мг/мл) буферным раствором (1 мМ; 27,25 мл). (Vконеч.=37,34 мл; Fe3O4=0,056%),
Оставляют на ночь (без воздействий).
Очистка
Проводили диализ в системе Pellicon XL с мембранным фильтром 500 кДа из полиэфирсульфона (PES). Промывали 300 мл воды (MilliQ), затем заливали 400 мл раствора гипохлорита натрия (0,5%) и оставляли в нем на около 30 минут. Промывали систему 400 мл буферного раствора (1 мМ).
Полученный продукт концентрировали до объема 13 мл (собирали 25 мл пермеата) при скорости потока насоса около 13 мл/мин (давление 0,2 мбар); продолжительность 5 мин. Скорость потока первого пермеата сохраняли для анализа с бицинхиноновой кислотой. Затем гфоводили диализ с 60 мл (4 объема) буферного раствора (1 мМ) при скорости потока 13 мл/мин (давление 0,2 мбар); продолжительность 14 мин. На этом этапе продукт концентрировали до объема 10 мл; продолжительность 10 мин.
Было получено 7,40 г продукта
Теоретический коэффициент концентрирования 5,5х
Теоретический коэффициент разбавления по сравнению с NBR_PTX 2,8х
Фильтрование
Продукт фильтровали, используя полиэфирсульфоновый фильтр с порами диаметром 0,22 мкм (Sterivex). Чтобы очистить весь полученный продукт, достаточно одного фильтра. Продукт хранят в холодильнике. Получено 6,88 г NBR_PTX.
Свойства
Динамическое светорассеяние

Дзета-потенциал

Индуктивно-связанная плазма (ICP)

Реальный выход 94,5%.
Пример 16. Включение нанобиореакторов в лимфоциты
Способ, разработанный авторами изобретения, позволяет включать нанобиореакторы в Т-лимфоциты и клетки линии Jurkat. Т-лимфоциты и клетки Jurkat нагружают наночастицами в концентрации 0,05% в подходящей культуральной среде. Для получения среды, содержащей наночастицы, отмеряют нужное их количество и добавляют определенную культуральную среду. Эта среда содержит:
- Среда RPMI 1640, +2,0 г/л NaHCO3 - без L-Глутамина (BIOCHROM) (код: F1215); к 500 мл добавляют
- Раствор L-глутамина (200 мМ) (100х). (EUROCLONE) (код: ЕСВ 3000D) 5,5 мл, не разбавленный
- Раствор пирувата натрия (100 мМ) (100х). (Gibco) (код: 11360-039) 5,5 мл, не разбавленный
- MEM NEAA Минимальная поддерживающая среда, заменимые аминокислоты (100х). (Gibco) (код: 11140-035) 5,5 мл, не разбавленная
- GENTOMIL (гентамицин) 80 мг/2 мл (АТС N° 029314059) - флакон емкостью 12 мл
- 2-Меркаптоэтанол (Merck) (код: 444203) - используют 5,5 мл 2-меркаптоэтанола следующими образом: 37 мкл 2-меркаптоэтанла в 99,963 мл стерильной воды (конечный объем 100 мл)
- Эмбриональная телячья сыворотка (FBS) сертифицированная (Sigma-Aldrich) (код: F6178)
При необходимости вместо эмбриональной телячьей сыворотки используют аутологичную сыворотку данного пациента или бессывороточную среду.
Реферат
Описаны магнитные наночастицы, поверхность которых функционализирована пирокатехином, и конструкции, содержащие множество указанных наночастиц, инкапсулированных в биологически совместимом полимерном матриксе, в котором необязательно диспергированы молекулы вещества, обладающего терапевтическим действием, причем указанный полимерный матрикс, в свою очередь, необязательно дополнительно функционализирован. Также описаны клетки иммунной системы, несущие указанные полимерные конструкции, открывающие возможность для их инженерии. 8 н. и 9 з.п. ф-лы, 10 ил., 16 пр.
Формула


Комментарии