Способ синтеза 2'-о-(2-метоксиэтил) тиофосфатного олигонуклеотида - RU2738093C1
Код документа: RU2738093C1
Чертежи







Описание
Изобретение относится к области химии и медицины и касается нового способа получения антисмысловых соединений, которые могли бы быть использованы в качестве фармацевтических субстанций препаратов для облегчения симптомов спинальной мышечной атрофии.
Спинальная мышечная атрофия (СМА) или проксимальная спинальная амиотрофия - это наследственное заболевание, при котором происходит нарушение функции нервных клеток спинного мозга, приводящее к прогрессивному развитию слабости мышц, их атрофии, и в итоге, обездвиживанию пациента. До недавнего времени практически отсутствовали средства, способные вылечить эту болезнь или изменить ее течение. Спинальная мышечная атрофия развивается только при условии, что ребенок унаследовал дефектные копии гена SMN1 от обоих родителей, являющихся здоровыми гетерозиготными носителями заболевания. В результате ряда мутаций нарушается синтез функционально-активного белка SMN (survival of motor neuron protein, белок, способствующий выживанию моторных нейронов), защищающего двигательные нейроны. Отсутствие белка SMN приводит к гибели моторных нейронов спинного мозга и постепенному блокированию жизненно важных двигательных функций (в частности, способности к дыханию и глотанию).
В настоящее время в медицине используется новый подход к терапии- с помощью антисмысловых нуклеотидов. Антисмысловые (antisense) олигонуклеотиды имеют нуклеотидную последовательность, которая комплементарна смысловому (т.е. кодирующему белок) участку цепи мРНК, что позволяет блокировать синтез белка после образования комплекса олигонуклеотид-мРНК. Синтетические и природные олигонуклеотиды быстро деградируют под действием эндогенных нуклеаз, поэтому терапевтические олигонуклеотиды должны быть химически модифицированы для увеличения стабильности и пролонгирования действия.
Модификации олигонуклеотидов являются объектом ряда изобретений уровня техники.
В частности, патент US 6007995 (А) - 1999-12-28 раскрывает способ получения антисмыслового соединения, длиной от 8 до 30 нуклеотидов, нацеленного на молекулу нуклеиновой кислоты, кодирующую белок человека TNFR1, где указанное антисмысловое соединение ингибирует экспрессию белка человека TNFR1. Антисмысловые соединения получают с помощью метода твердофазного синтеза с использованием амидофосфитных производных защищенных нуклеозидов на автоматическом синтезаторе. Природные фосфодиэфирные производные получают путем окисления фосфитов раствором иода в пиридине в присутствии воды. Тиофосфатные производные получают с использованием растворов ряда тиолирующих реагентов, в том числе 3,Н-1,2-бензодитиол-3-она-1,1-диоксида (реагент Beaucage) в безводном ацетонитриле.
Международная заявка WO 2010091308 - 12.08.2010 раскрывает способ синтеза антисмысловых соединений, которые позволяют получить субстраты для РНКазы Н. В предложенном способе используют твердофазный синтез и очистку методом хроматографии.
Патент US 6210892 В1 - 2001.04.03 раскрывает получение антисмыслового соединения, имеющего, по меньшей мере, один 2'-метоксиэтокси, 2'-диметиламинооксиэтокси, 2'-диметиламиноэтоксиэтокси, 2'-ацетамид, модификацию морфолино или пептидной нуклеиновой кислоты, которое специфически гибридизуется с указанной мишенью мРНК и не вызывает расщепления мишени мРНК при связывании, так что процессинг указанной мишени мРНК модулируется. Описаны полные 2'-метоксиэтокси фосфоротиоатные олигонуклеотиды.
Известные способы обеспечивают получение олигонуклеотидов для медицинских и исследовательских целей, в основном в области онкологии.
В декабре 2016 в США было одобрено первое лекарство - олигонуклеотид для лечения спинальной мышечной атрофии - нусинерсен.
Нусинерсен - это антисмысловой олигонуклеотид (ASO), созданный для изменения сплайсинга SMN2, гена, почти идентичного SMN1, для увеличения продукции полностью функционального белка SMN (https://www.accessdata.fda.gov/dragsatfda_docs/label/2016/209531 lbl.pdf).
Известен патент US 8980853 (В2) - 2015-03-17, касающийся антисмыслового олигонуклеотида, комплементарного интрону 7 нуклеиновой кислоты, кодирующей пре-мРНК SMN2 человека, такого как нусинерсен. Данный патент может быть указан в качестве ближайшего аналога. Известное решение не ставит целью получения высокоочищенной субстанции антисмыслового олигонуклеотида.
Задачей изобретения является разработка и оптимизация синтеза антисмыслового нуклеотида.
Задача решается новым способом получения модифицированного тиофосфатного олигонуклеотида (Nus-1), содержащего 2'-O-(2-метоксиэтил)рибонуклеотиды структуры UCACUUUCAUAAUGCUGG, где каждый нуклеозид содержит 2'-O-(2-метоксиэтил) (синоним - 2'-О-(метоксиэтил)) модифицированный остаток сахара, в котором осуществлен подбор оптимальных реактивов для химического синтеза олигонуклеотида, подбор оптимальных условий проведения очистки олигонуклеотида с оптимизацией последовательности очистки и оптимизацией условий хроматографии.
Олигонуклеотид был синтезирован с использованием амидофосфитного метода на автоматическом синтезаторе MERMAID 12 (Bioautomation). Для синтеза использовали коммерчески доступные защищенные амидофосфиты 2'-O-(2-метоксиэтил)рибонуклеотидов и стекло с контролируемым размером пор

Деблокирование олигонуклеотида и удаление защитных групп производили при помощи насыщенного раствора аммиака с добавлением нескольких кристаллов этилендиаминтетрауксусной кислоты динатриевой соли (ЭДТА). В случае деблокирования олигонуклеотида с 5'-диметокситрильной защитой перед упариванием в раствор добавляли несколько кристаллов Трис для минимизации потерь защитной группы.
В способе использована комплексная очистка:
- Очистка олигонуклеотидов методом ионно-обменной хроматографии;
- Очистка олигонуклеотида методом обращенно-фазовой хроматографии;
- Очистка олигонуклеотидов методом гель-фильтрации.
Целевой продукт высушивают методом лиофилизации.
Условия хромато масс-спектрометрического контроля: Колонка Xbridge Peptide ВЕН С18, 2.1×50 mm 5 um (Waters). Буфер A: 20 mM HFIPA, 20 mM DIPA водный раствор. Буфер В: 20 mM HFIPA, 20 mM DIPA, ACN:H20 (8/2, v/v). Градиентная элюция 0-100% буфером В (1-3 мин) при 45°С (скорость потока 0.3 мл/мин). Детектирование: DAD детектор при длинах волн 260, 280 нм; ESI-MS детектирование в отрицательном диапазоне ионизации при настройках детектора, указанных выше.
Подбор условий постсинтетического деблокирования и удаления защитных групп
Сегодня для деблокирования олигонуклеотида с твердофазного носителя и удаления защитных групп чаще всего используется газообразный метиламин или смесь насыщенных водных растворов метиламина и аммиака. Это позволяет быстро и селективно удалять защитные группы - известны протоколы длительностью всего 15-30 минут при нагревании. Однако такая обработка возможна только для олигонуклеотидов при синтезе которых используются производные с ацетильными (в том числе замещенными, например, феноксиацетильные) защитными группами для экзоциклической аминогруппы цитидина. В случае бензоильных защит происходит побочная реакция с образованием N-метилцитидина (Схема 1). Из-за недостаточной растворимости ацетильного производного 2'-O-(2-метоксиэтил)-5-метилцитидина в ацетонитриле, он доступен только в виде бензоильного производного. Поэтому деблокирование метиламином может приводить к образованию побочного продукта.

Схема 1. Образование побочного продукта при деблокировании олигонуклеотида nus-1 смесью насыщенных водных растворов аммиак-метиламин (1:1, v/v) (АМА).
Для того чтобы избежать этого был использовали метод деблокирования с использованием насыщенного водного раствора аммиака. Для оптимизации изучен процесс при разных температурах и разной длительности: а) 65°С, 48 часов; б) 65°С, 24 часа; в) 45°С, 48 часов; г) комнатная температура, 72 часа. Результаты масс-спетрометрического анализа реакционной смеси представлены на Фиг. 1.
Следует отметить, что с уменьшением температуры деблокирования уменьшается количество побочных продуктов. Во-первых, при нагревании наблюдается реакция десульфирования (превращение тиофосфата в фосфат - массы -16, -32, -48 Da). Во-вторых, при меньшей температуре, но больше продолжительности деблокирования наблюдается меньше аддуктов с большей массой, то есть более полно удаляются защитные группы. Из литературы известно, что следовые количества переходных металлов способны катализировать реакцию десульфирования в основной среде (Схема 2), поэтому в дальнейшем мы проводили деблокирование олигонуклеотида Nus-1 водным раствором аммиака при комнатной температуре в течение 3 дней с добавлением небольшого количества ЭДТА. Это позволило практически полностью подавить десульфирование.

Схема 2. Образование продукта десульфирования олигонуклеотида nus-1 при деблокировании насыщенным раствором аммиака.
Подбор условий очистки олигонуклеотида Nus-1 методами ионообменной и обращенно-фазовой ВЭЖХ
Для оптимизации очистки олигонуклеотида Nus-1 методом анионо-обменной хроматографии было проведено сравнение трех колонок ВЭЖХ разных производителей с использованием нескольких буферных систем с разным рН. Данные колонки рекомендованы производителями для очистки олигонуклеотидов, в том числе тиофосфатных. Буферные системы традиционны для очистки олигонуклеотидов, однако оптимальную систему для определенного олигонуклеотида можно подобрать только экспериментально. Перхлорат, бромид и хлорид обладают разной хаотропностью, что важно для очистки олигонуклеотидов, способных к внутри- и межмолекулярным взаимодействиям с образованием различных вторичных и третичных структур. Ацетонитрил необходим для минимизации неспецифических гидрофобных взаимодействий олигонуклеотида с сорбентом. Уже первые эксперименты показали, что рН=7 предпочтительно, поэтому далее использовали буферы с рН 7.
Колонки: Tosoh Tskgel superQ-5pw 10 um 7.5×75 mm; Thermo DNAPac PA-100 Analytical 4×250 mm; GE MonoQ 4,6×100 mm.

Составы буферных систем для ионо-обменной ВЭЖХ представлены в Таблице 1.
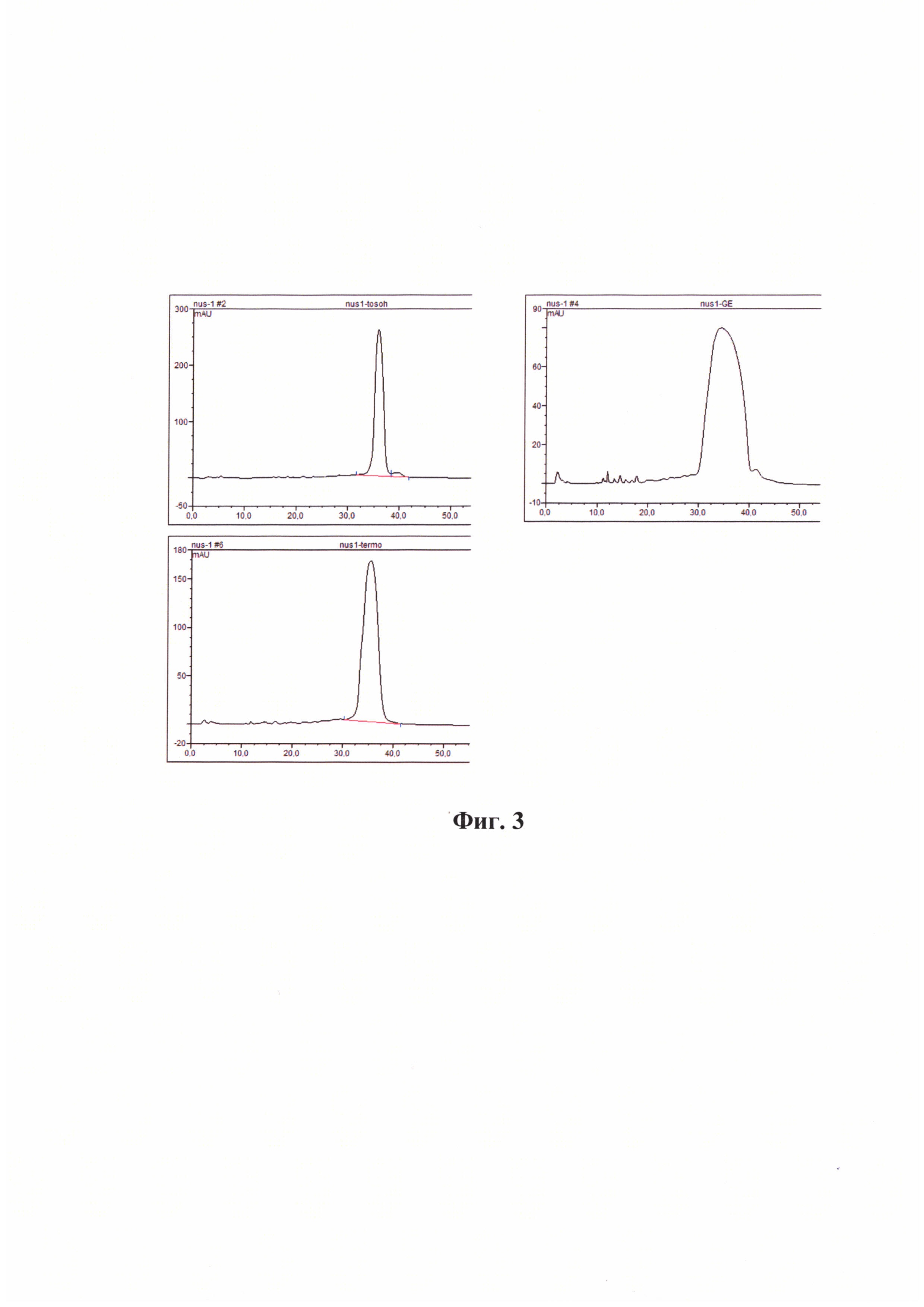
Каждый пик был собран в виде нескольких фракций объемом 1 мл, и каждая фракция была проанализирована методом масс-спектрометрии. Все фракции, содержащие >90% целевого олигонуклеотида, были объединены и обессолены методом высаживания ацетоном и этанолом. Результаты анализа показали, что наиболее высокий сигнал и симметричный пик на хроматограмме наблюдается при очистке олигонуклеотида nus-1 с использованием колонки TOSOH, при этом различия между буферными системами 2 и 3 отсутствуют. Во всех случаях чистота продукта составила 91-93%, причем примеси, которые можно отделить методом ионного обмена не детектировались. Результаты масс-спектрометрического анализа олигонуклеотидов после очистки методом ионообменной хроматографии представлены на Фиг. 5.

Для дальнейшей работы была выбрана колонка TOSOH, так как при ее применении эффективно отделяются примеси олигонуклеотида Nus-1, наблюдаются минимальные потери вещества (Таблица 2), и эта колонка обладает максимальной емкостью среди представленных. Это важно для масштабирования очистки олигонуклеотида, так как при максимальной емкости требуется меньше сорбента и буферных растворов. Как следствие, снижается стоимость процесса и уменьшается время очистки.
Для оптимизации условий обращенно-фазовой хроматографии было проведено сравнение трех колонок и двух буферных систем.
Колонки: Waters Xbdrige Peptide ВЕН C18 180А 4.6×250; Agilent InfinityLab Poroshell 120 EC-C18 4.6×100 270A; Phenomenex Jupiter 5u C18 300A 250×4.6.

Составы буферных систем для обращенно-фазовой ВЭЖХ представлены в Таблице 3.
Результаты очистки приведены на Фиг. 6-8.
Очистка методом ОФ ВЭЖХ в буферной системе 2 с использованием колонки Waters обеспечивала минимальное количество примесей и максимальный выход продукта (Таблица 4).

Полученные олигонуклеотиды были упарены при вакууме, а после высажены последовательно ацетоном и этиловым спиртом, для удаления ацетата аммония или триэтиламмония.
Краткое описание фигур чертежей, иллюстрирующих заявляемое изобретение, представлено следующим образом.
Фиг. 1 демонстрирует данные масс-спектрометрического анализа олигонуклеотида nus-1 после деблокирования насыщенным раствором аммиака при различных условиях: а) 65°С, 48 часов; б) 65°С, 24 часа; в) 45°С, 48 часов; г) комнатная температура, 72 часа.
Фиг. 2 отображает результаты хроматографического разделения реакционных смесей олигонуклеотида nus-1 методом ионообменной ВЭЖХ. Буферная система 1. рН 7. А) Колонка Tosoh, Б) Колонка Thermo, В) Колонка GE.
На Фиг. 3 представлены результаты хроматографического разделения реакционных смесей олигонуклеотида nus-1 методом ионообменной ВЭЖХ. Буферная система 2. рН 7. А) Колонка Tosoh, Б) Колонка Thermo, В) Колонка GE.
Фиг. 4 демонстрирует результаты хроматографического разделения реакционных смесей олигонуклеотида nus-1 методом ионообменной ВЭЖХ. Буферная система 3. рН 7. А) Колонка Tosoh, Б) Колонка Thermo, В) Колонка GE.
Фиг.5 отображает масс-спектры объединенных чистых фракций, содержащих олигонуклеотид nus-1 после очистки методом ионообменной хроматографии на колонке a) Tosoh, б) GE, в) Thermo (Целевая масса Nus-1 7125.0 Da).
На Фиг. 6. представлены результаты хроматографического разделения реакционных смесей олигонуклеотида nus-1 методом обращенно-фазовой ВЭЖХ в буферной системе 1 на колонках: a) Waters, б) Phenomenex, в) Agilent.
Фиг. 7 демонстрирует результаты хроматографического разделения реакционных смесей олигонуклеотида nus-1 методом обращенно-фазовой ВЭЖХ в буферной системе 2 на колонках: a) Waters, б) Phenomenex, в) Agilent.
Фиг. 8. Показывает масс-спектры объединенных чистых фракций, содержащих олигонуклеотид nus-1 после очистки методом обращенно-фазовой хроматографии на колонках: A) Waters, Б) Phenomenex, В) Agilent.
Возможность осуществления изобретения может быть продемонстрирована ниже представленными примерами.
Пример 1.
Синтез олигонуклеотида Nus-1
Олигонуклеотид nus (nus-1 UsCsAsCsUsUsUsCsAsUsAsAsUsGsCsUsGsG) был синтезирован на твердофазном носителе с использованием автоматизированного олигонуклеотидного синтезатора Mermade 6/12 (Биоаутомейшн, Инк) по амидофосфитной схеме. А - 2'-МОЕ-аденозин, С - 2'-МОЕ -5-метилцитидин, G - 2'-МОЕ -гуанозин, U - 2'-МОЕ -5-метилуридин.
МОЕ -Метоксиэтил.
А. Синтез олигонуклеотида
Объем колонки - 20 мл.
Твердофазный носитель: 4-(((3aS,4S,5R,6R,7R,7aR)-6-гидрокси-2-метил-1,3-диоксооктагидро-1Н-4,7-эпоксиизоиндол-5-ил)окси)-4-оксобутаноиламид, присоединенный к стеклу с контролиуемым размером пор

Масса твердофазного носителя - стекла с контролируемым размером пор с иммобилизованным первым звеном (Unprotected USS; Labile N-Me Linker-CPG), загрузка 45-50 мкмоль/г - 2 г
Всего было проведено 17 полных синтетических цикла: МОЕ -А=4,: МОЕ -С=4,: МОЕ -G=3,: МОЕ -U=6, все с тиооксилением.
Синтез nus-1 осуществлялся по следующему циклу для присоединения каждого мономера:

По окончании синтеза проводилась постобработка по следующему циклу.


В процессе каждой процедуры Deblock происходит 4 подачи реагента по 6,00 мл
В процессе каждой процедуры Coupling происходит 1 подача 2,00 мл 0.05 М раствора соответствующего амидофосфита и 1 подача 2,25 мл раствора активатора реакции. В процессе каждой процедуры Capping происходит 1 подача 3,00 мл реактива Сар А и 1 подача 3,00 мл реактива СарВ.
В процессе каждой процедуры Oxidize происходят 2 подачи по 6,00 мл реагента.
В процессе процедуры Acn Wash происходят 2 подачи по 8,00 мл ацетонитрила качества для DNA/RNA синтеза.
В процессе процедуры Altwash1 происходит 1 подача 10 мл 10% раствора диэтиламина в ацетонитриле качества Gradient Grade.
В процессе процедуры Altwash2 происходит 1 подача 8,00 мл ацетонитрила качества Gradient Grade.
1. Удаление тритильной защиты - 17 циклов по 8 подач по 6,00 мл плюс две подачи по 5,00 мл после окончания синтеза.
Общий объем реагента Deblock=17*8*6 мл+2*5 мл=136+10=146 мл.
Состав реагента: 3% трихлоруксусная кислота в дихлорметане.
Трихлоруксусной кислоты: 0.03*282=4,38 г.
Дихлорметана: 146 мл.
2. Промывка ацетонитрилом качества For DNA/RNA synthesis- 17 циклов по 2 подачи по 8,00 мл.
Общий объем ацетонитрила качества For DNA/RNA synthesis 17*2*8,00 мл = 272 мл
3. Промывка Altwash1 - 2 подачи по 10,00 мл после окончания синтеза.
Общий объем промывки Altwash1 20 мл.
Состав промывки: 10% диэтиламин в ацетонитриле качества Gradient Grade.
Диэтиламина: 0,1*20 мл=2 мл.
Ацетонитрила качества Gradient Grade = 20-2=18,0 мл.
4. Промывка Altwash2 - 17 циклов по 7 подач по 8,00 мл плюс 3 подачи по 8,00 мл после окончания синтеза.
Общий объем промывки Altwash1=17*7*8,00 мл+3*8,00 мл=976 мл.
Состав реагента: ацетонитрил качества PS.
Ацетонитрила качества PS 976 мл.
5. Блокирование непрореагировавших 5'-гидроксилов.
Реагент СарА - 17 циклов по 3 подачи по 3,00 мл.
Общий объем реагента: 17*3*3,00 мл=153 мл.
Состав реагента: Ацетонитрил качества Gradient Grade: пропионовый ангидрид:пиридин перегнанный (76:14:10).
Ацетонитрила качества Gradient Grade: 153 мл*0,76=116,3 мл.
Пропионового ангидрида: 153 мл*0,14=21,4 мл.
Пиридина перегнанного: 153 мл*0,10=15,3 мл.
Реагент СарВ -17 циклов по 3 подачи по 3,00 мл.
Общий объем реагента: 17*3*3,00 мл=153 мл.
Состав реагента: Ацетонитрил качества Gradient Grade:N-метилимидазол (84:16).
Ацетонитрила качества Gradient Grade: 153 мл*0,84=128,52 мл.
N-метилимидазола: 153 мл*0,16=24,48 мл.
6. Тиоокисление - 17 циклов по 2 подачи по 6,00 мл.
Общий объем реагента: 17*2*6,00 мл=204 мл.
Состав реагента: 0,02М 3 - [(Диметиламинометилен) амино] -3Н-1,2,4-дитиазол-5-тион (DDTT) (концентрация 4 г/л) в 30% растворе пиридина в ацетонитриле качества Gradient Grade.
DDTT: 0,204 л*4 г/л=0,816 г.
Пиридина перегнанного: 204 мл * 0,3=61,2 мл.
Ацетонитрила качества Gradient Grade: 204 мл *0,7=142,8 мл
7. Реакция конденсации МОЕ -А
Мономер: 3'-O-((2-цианоэтил)-N,N-диизопропиламидофосфит N6-бензоил-5'-O-(4,4'-диметокситритил)-2'-O-(2-метоксиэтил)аденозина- FW=932.01.
Состав реагента: 0,05 М раствор мономера в ацетонитриле качества для DNA/RNA синтеза.
Расход на цикл: 4 подач по 2,00 мл=8,00 мл.
Общий расход: 4*8,00 мл=32,00 мл.
Ацетонитрила качества для DNA/RNA синтеза: 32,0 мл
3'-O-((2-цианоэтил)-N,N-диизопропиламидофосфит N6-бензоил-5'-O-(4,4'-диметокситритил)-2'-O-(2-метоксиэтил)аденозина: 932,01 г/М*0,05М*0,032=1,49 г
8. Реакция конденсации метоксиэтил (МОЕ)-С
Мономер: 3'-O-((2-цианоэтил)-N,N-диизопропиламидофосфит N4-бензоил-5'-O-(4,4'-диметокситритил)-2'-O-(2-метоксиэтил)цитидина FW=922.01
Состав реагента: 0,05 М раствор мономера в ацетонитриле качества для DNA/RNA синтеза.
Расход на цикл: 4 подач по 2,00 мл=8,00 мл.
Общий расход: 4*8,00 мл=32,00 мл.
Ацетонитрила качества для DNA/RNA синтеза: 32,0 мл.
3'-O-((2-цианоэтил)-N,N-диизопропиламидофосфит N4-бензоил-5'-O-(4,4'-диметокситритил)-2'-O-(2-метоксиэтил)цитидина 922,01 г/М*0,05М*0,032=1,48 г.
9. Реакция конденсации МОЕ -G
Мономер: 3'-O-((2-цианоэтил)-N,N-диизопропиламидофосфит N2-изобутирил-5'-O-(4,4'-диметокситритил)-2'-O-(2-метоксиэтил)гуанозина FW=913,99.
Состав реагента: 0,05 М раствор мономера в ацетонитриле качества для DNA/RNA синтеза.
Расход на цикл: 4 подач по 2,00 мл=8,00 мл. Общий расход: 3*8,00 мл=24,00 мл.
Ацетонитрила качества для DNA/RNA синтеза: 24,0 мл.
3'-O-((2-цианоэтил)-N,N-диизопропиламидофосфит N2-изобутирил-5'-O-(4,4'-диметокситритил)-2'-O-(2-метоксиэтил)гуанозина 913,99*0,05*0,024=1,10 г.
10. Реакция конденсации МОЕ -U
Мономер: 3'-O-((2-цианоэтил)-N,N-диизопропиламидофосфит 5'-O-(4,4'-диметокситритил)-5-метил-2'-O-(2-метоксиэтил)уридина FW=818.89.
Состав реагента: 0,05 М раствор мономера в ацетонитриле качества для DNA/RNA синтеза.
Расход на цикл: 4 подач по 2,00 мл=8,00 мл.
Общий расход: 6*8,00 мл=48,00 мл.
Ацетонитрила качества для DNA/RNA синтеза: 48,0 мл
3'-O-((2-цианоэтил)-N,N-диизопропиламидофосфит 5'-O-(4,4'-диметокситритил)-5-метил-2'-O-(2-метоксиэтил)уридина: 818,89*0,05*0,048=1,97 г.
11. Активация реакции конденсации.
Активатор: 5-этилтиотетразол FW=130.17 - 0,25М раствор в ацетонитриле качества для DNA/RNA синтеза.
Расход на цикл: 4 подачи по 2,25 мл=10,00 мл.
Общий расход: 17*10,00 мл=170,00 мл.
Ацетонитрила качества для DNA/RNA синтеза: 170,0 мл
5-этилтиотетразол: 130,17*0,25*0,17=5,53 г.
Б. Деблокирование олигонуклеотида
После окончания синтеза твердофазный носитель переносили в пробирки объемом 15 мл с завинчивающимися крышками, добавляли 10 мл насыщенного раствора аммиака (25-27% водный раствор), добавляли несколько кристаллов этилендиаминтетрауксусной кислоты динатриевой соли -ЭДТА и помешивали 3 суток при комнатной температуре. После окончания деблокирования пробирки охлаждали в течение 30 минут при -20°С, отфильтровывали осадок и промывали его водой качества MilliQ (3*7 мл). Далее объединенные растворы разбавляли водой качества milliQ (12 мл) и упаривали досуха с использованием центрифужного испарителя Labconco Centrivap. Полученный сухой осадок растворяли в 5 мл воды качества milliQ и центрифугировали при 13400 об/мин в течение 10 минут (Eppendorf Centrifuge 5804), затем раствор nus-1 перенесли в чистую пробирку и хранили до очистки на ВЭЖХ при -20°С.
Состав реагента деблокирования: насыщенный водный раствор аммиака,
Общий объем реагента: 10 мл
Количество воды качества milliQ:
Общий объем 3*7+12 мл=33 мл
В. Хроматографическая очистка олигонуклеотидов методом ионообменной ВЭЖХ
Очистку олигонуклеотидов проводили с использованием системы ВЭЖХ Dionex Ultimate 3000 с колонками Tosoh Super-Q 5PW 21,5 мм × 150 мм в соответствии с рекомендациями производителя. Для этого раствор олигонуклеотида в воде (5 мл) наносили на колонку. За один раз на колонку загружалось не более 50% вещества. Для элюции олигонуклеотида использовался градиент 5-50% буфера Б (Буфер А - 20 мМ Трис-HCl (рН 7.0), 10% ацетонитрила в воде, буфер Б -20 мМ Трис-HCl (рН 7.0), 600 мМ перхлорат натрия, 10% ацетонитрила в воде) в течение 300 минут со скоростью потока 1 мл/мин. Были собраны все фракции с поглощением выше 200 mAu при 260 нм, чистота олигонуклеотида в каждой была проверена методом масс-спектрометрии. Далее все фракции, в которых содержание олигонуклеотида превышало 90%, были объединены и упарены примерно в 10 раз. Далее к раствору nus-1 добавляли десятикратный объем ацетона, смесь тщательно перемешивали и охлаждали при -20°С в течение 1 часа. Далее олигонуклеотид выделяли центрифугированием в течение 10 мин при 13000 g, осадок высушивали от остатков ацетона с использованием центрифужного упаривателя и растворяли в воде качества milliQ (1 мл).
На одну очистку требуется 300*2,5=750 мл буфера (550 мл буфера А и 200 мл буфера В):
Ацетонитрила 75 мл, воды качества milliQ = 750-75=675 мл,
Трис = 121,14 г/М*0,02М*0,75=1,82 г
HCl = 69 мл*0,02М*0,75=1,03 мл
Перхлорат натрия 122,45 г/М*0,8М*0,2 л = 19,52 г
Ацетон = 100 мл
Общий расход:
Ацетонитрила качества HPLC: 75 мл*2=150 мл
Воды качества milliQ: 675 мл*2=1350 мл
Трис: 1,82 г*2=3,64 г
HCl: 1,03 мл*2=2,06 мл
Перхлорат натрия: 19,52 г*2=39,04 г
Ацетон: 100 мл*2=200 мл
Г. Хроматографическая очистка олигонуклеотидов методом обращенно-фазовой ВЭЖХ
Очистку олигонуклеотида nus-1 проводили с использованием системы ВЭЖХ Agilent Infinity 1260 с колонкой Waters xBridge ВЕН С18 10 мм × 250 мм в соответствии с рекомендациями производителя. Для этого раствор олигонуклеотида в воде (1 мл) наносили на колонку. Для элюции олигонуклеотида использовался градиент 0-100 буфера Б (Буфер А - 0.05 М раствор ацетата аммония в воде (рН 7.0), Буфер Б - 0.05 М раствор ацетата аммония в 80% водном растворе ацетонитрила (рН 7.0) в течение 60 минут со скоростью потока 2,5 мл/минуту. Были собраны все фракции с поглощением выше 500 mAu при 260 нм, чистота олигонуклеотида в каждой была проверена методом масс-спектрометрии. Далее все фракции, в которых чистота олигонуклеотида превышала 95%, были объединены и упарены до объема 10 мл. Далее к раствору олигонуклеотида добавляли десятикратный объем этанола (100 мл), смесь тщательно перемешивали и охлаждали при -20°С в течение 1 часа. Далее nus-1 выделяли центрифугированием в течение 10 мин при 13000 g, осадок высушивали от остатков этанола с использованием центрифужного упаривателя и растворяли в воде качества milliQ (1 мл).
На одну очистку методом ОФ ВЭЖХ требуется 60*2,5=150 мл буфера (75 мл буфера А и 75 мл буфера В):
Ацетонитрила качества HPLC 60 мл, воды качества milliQ 90 мл, ацетата аммония 0,5 г, этанола 100 мл.
Общий расход:
Ацетонитрила качества HPLC 60 мл*2=120 мл
воды качества milliQ 90 мл*2=180 мл
ацетата аммония 0.5 г*2=1 г
этанола 100 мл*2=200 мл
Е. Гель-фильтрационное обессолевание олигонуклеотида
Очистку олигонуклеотидов проводили с использованием системы ВЭЖХ Dionex Ultimate 3000 с колонкой GE Healthcare HiPrep 26/10 Desalting 10 см × 26 мм. Гель-фильтрацию проводили в воде качества milliQ. Наносилось 15 мл на скорости 5 мл/мин. Элюция проводилась водой, контролируя выходящий сигнал по диодно-матричному детектору на длине волны 260 нм и по кондуктометрическому детектору. Были собраны все фракции с поглощением выше 200 mAu и проводимостью не больше 30 mS/cm, чистота олигонуклеотида в каждой фракции была проверена методом масс-спектрометрии. Далее все фракции, в которых содержание олигонуклеотида превышало 95%, были объединены, упарены на центрифужном испарителе и перерастворены в 10 мл воды для замера концентрации олигонуклеотида.
На одну очистку требуется 60 мл воды качества milliQ.
Ж. Определение количества nus-1
Концентрацию олигонуклеотида определяли спектрофотометрически. Для этого из раствора, полученного на предыдущей стадии, отбирали аликвоту (2 мкл), растворяли в воде качества milliQ (1 мл) и измеряли концентрацию при помощи прибора Nanodrop 2000 (Термо Сайентифик).
Пример 2.
Терапевтическая эффективность и безопасность использования описываемого соединения, полученного по Примеру 1
Эффективность была изучена на модели спинальной мышечной атрофии у животных.
Исследования проводились на модели т.н. СМА-мыши (СМА - спинальная мышечная атрофия), в качестве контрольной группы брали обычные гетерозиготные мыши без СМА. СМА-мыши - это мыши имеющие ген, кодирующий белок SMN (survival motor neuron - белок выживаемости моторных нейронов), подобный гену SMN1. SMN-ген кодирует белок, необходимый для работы двигательных (моторных) нейронов. Отсутствие этого гена и/или некорректная работа ведет к гибели спинальных моторных нейронов. Очень похожая структура SMN1-гена, называемая SMN2, имеется у человека и отвечает за тяжесть заболевания. Молекулярно-биологической основой СМА, (по аутосомно-рецессивному типу), и есть гомозиготная потеря гена SMN1. Мышиные модели имеют только один ген (SMN), эквивалентный гену SMN1. Гомозиготная потеря этого гена критична для эмбрионов и провоцирует массированную гибель моторных нейронов, что указывает на то, что экспрессия гена SMN и важна для выживания и функционирования клеток.
Мышам с СМА (по жесткому типу) сразу после рождения, полученное соединение в течение 5-ти дней вводили ежедневно интратекальными инъекциями в дозах, 0,5 мг-экв/кг, 1 мг-экв/кг или 1,5 мг-экв\кг или физиологический раствор каждый день, или контрольная группа без СМА физраствор интратекально (5 СМА, 6 СМА контроль, 5) (6 СМА, 5 контроль, 4) и (5 СМА, 5 СМА контроль, 6) в экспериментальном исследовании для оценки выживаемости. Доза 0,5 мг/кг оказывала, но несколько ниже, чем две другие дозы, влияние на выживаемость мышей с моделью СМА. Мыши с СМА, получавшие физ. раствор, погибали к 12-му дню после рождения. Воздействие изучаемым соединением значительно увеличивало продолжительность жизни в 1,6 раза, это при том, что изменение медианы выживаемости мышей с СМА (15,9 против 11,4 дней; критерий Мантеля-Кокса, р=0,0003). Единственная мышь СМА прожила более месяца и через полный 31 день и была подвергнута умерщвлению. Эти данные показывают, что изучаемое соединение, статистически оказывает влияние на выживаемость на мышиной модели СМА.
Наблюдались отличительные изменения в структуре массы тела у мышей СМА, получавшие исследуемое вещество; Мыши с СМА, при введении исследуемого вещества демонстрировали умеренный устойчивый прирост массы тела, достигая плато к 18дню. В то время, как мыши с СМА получавшие физраствор значимо медленно набирали массу, после рождения, а после 5-го дня могли и терять вес. На 8-й день эксперимента, проводили рефлекторный рефлекс и тест подвески задних лап и обнаружили улучшения моторного поведения животных с СМА, ежедневно получавших 1 и 1,5 мг-экв/кг, по сравнению с мышами СМА, получавшими физиологический раствор. Тесты в открытом поле проводили, также начиная с 8-го дня эксперимента, для оценки мышечной силы передних конечностей. Мыши СМА, получавшие 1 и 1,5 мг-экв/мг, действовали приближенно к интактной группе в анализе антигравитационного зависания (двухфакторная дисперсия ANOVA по Тюки, была незначительной).
Все группы мышей демонстрировали в той или иной степени подвижность в тесте «открытое поле», который проводился между 8-м и 10-м днями от начала эксперимента. На 12-й день, т.н. день автономной ходьбы, группы которым вводили исследуемое вещество и контрольные мыши, показали повышенную активность, перемещаясь и, пересекая большее число квадратов. Группа мышей с СМА демонстрировали небольшие амбулаторные движения. Исследуемое вещество явно улучшало подвижность мышей СМА, о чем свидетельствует увеличенное число, о чем свидетельствует увеличенное число пересечений, аналогичное контролю до 22 дня эксперимента. Эти данные указывают на то, что исследуемое вещество оказывает влияние на сниженную активность мышей СМА.
После окончания эксперимента, были сделаны гистологические срезу нейронов поясничного отдела и использованием иммуннофлуоресцентной метки.
Таким образом, пытались определить влияние исследуемого вещества на локализацию белка SMN (survival motor neuron - белок выживаемости моторных нейронов) в ядерных телах мотонейронов спинного мозга мышей. Иммунофлуоресцентное мечение гистологических препаратов поперечных срезов поясничного отдела спинного мозга антителами к коилину в тельцах Кахаля и к SMN приводило к тому, что у леченных физ. раствором мышей СМА, было меньше SMN-положительных телец Кахаля, чем у контрольных. Леченные исследуемым веществом мыши СМА демонстрировали увеличение SMN-положительных телец Кахаля в 1,7 раза в двигательных нейронах. SMN также присутствует в других ядерных телах, которые лишены коилина. Результаты наблюдения за экспериментом, демонстрируют, что исследуемое вещество фиксирует SMN в ядерных телах мотонейронов у мышей СМА.
Затем с помощью ОТ-ПЦР-РВ мы оценили уровни сплайсосомной snRNA в срезах из головного и спинного мозга мышей, получавших исследуемое вещество и физ.раствор. Снижение уровней snRNA наблюдалось у мышей SMA, включая минорный сплайсосомный U12, который был уменьшен до 1/3 в процентном отношении в головном и спинном мозге по сравнению с соответствующим контролем. Введение исследуемого вещества положительно влияло на уровни U2, U4, U5 и U6 в спинном мозге и snRNA U1 в головном и спинном мозге мышей SMA. Данные этих экспериментов показывают, что исследуемое вещество может регулировать и относительное соотношение между snRNAs.
Реферат
Изобретение относится к биотехнологии, в частности к новому способу получения антисмысловых соединений, которые могли бы быть использованы в качестве фармацевтических субстанций препаратов для облегчения симптомов спинальной мышечной атрофии. Предложенный способ получения модифицированного тиофосфатного олигонуклеотида, содержащего 2'-O-(2-метоксиэтил)рибонуклеотиды структуры UCACUUUCAUAAUGCUGG, где каждый нуклеозид содержит 2'-O-(2-метоксиэтил) модифицированный остаток сахара, предусматривает синтез олигонуклеотида на твердофазном носителе с использованием амидофосфитного метода. Для получения тиофосфатных групп используют 3-[(диметиламинометилен) амино]-3Н-1,2,4-дитиазол-5-тион (DDTT) в 30% растворе пиридина в ацетонитриле, проводят деблокирование добавлением насыщенного раствора аммиака в присутствии этилендиаминтетрауксусной кислоты динатриевой соли в течение 3 суток при комнатной температуре. Затем проводят последовательно очистку олигонуклеотидов методом ионно-обменной хроматографии на колонке Tosoh Super-Q 5PW с использованием Трис-HCl буфера, рН 7.0, с добавлением 10% раствора ацетонитрила в воде, и затем Трис-HCl буфера, рН 7.0, с добавлением перхлората натрия и 10% раствора ацетонитрила в воде, методом обращенно-фазовой хроматографии на колонке Waters xBridge ВЕН С18 с использованием буфера, представляющего собой раствор ацетата триэтиламмония в воде, рН 7.0, и затем буфера, представляющего собой раствор ацетата триэтиламмония в 80% водном растворе ацетонитрила, рН 7.0, и методом гель-фильтрации с последующим выделением целевого продукта при высушивании лиофилизацией. Изобретение позволяет получить продукт более высокой степени очистки. 8 ил., 4 табл., 2 пр.
Формула
Документы, цитированные в отчёте о поиске
Модифицированные олигонуклеотиды и способ их получения

Комментарии