Тагментация с применением иммобилизованных транспосом с линкерами - RU2783536C2
Код документа: RU2783536C2
Чертежи








Описание
ВКЛЮЧЕНИЕ ЛЮБЫХ ПРИОРИТЕТНЫХ ЗАЯВОК ПОСРЕДСТВОМ ССЫЛОК
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США №62/461620, поданной 21 февраля 2017 г., которая включена в настоящий документ полностью посредством ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] Настоящее описание включает перечень последовательностей в электронном формате. Указанный перечень последовательностей представлен файлом, имеющим название ILLINC-398WO_Sequence_Listing.txt, созданным 20 февраля 2017 г., который имеет размер приблизительно 7 кБ. Информация в электронном формате из указанного перечня последовательностей включена в настоящий документ полностью посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0003] Настоящее изобретение относится к способам, композициям и наборам для обработки нуклеиновых кислот, в том числе способам и композициям для фрагментации и мечения нуклеиновых кислот (например, ДНК) с применением комплексов транспосом, иммобилизованных на твердой подложке.
[0004] В современных протоколах секвенирования нового поколения («next-generation sequencing)), NGS) образцов нуклеиновой кислоты обычно задействован способ получения образцов, преобразующий ДНК или РНК в библиотеку фрагментированных секвенируемых матриц. Для осуществления способов получения образцов часто требуются несколько этапов и неоднократное перенесение материала, а также дорогие инструменты для проведения фрагментации, и, соответственно, такие способы часто бывают сложными, трудоемкими, дорогими и неэффективными.
[0005] Согласно одному подходу библиотеки фрагментов нуклеиновых кислот могут быть получены с применением способа на основе транспосом, когда две концевые последовательности транспозона, одна из которых соединена с последовательностью метки, и транспозаза образуют комплекс транспосомы. Комплексы транспосом используют для фрагментации и мечения целевых нуклеиновых кислот в растворе с получением готовой для использования в секвенаторе тагментированной библиотеки. Комплексы транспосом могут быть иммобилизованы на твердой поверхности, например, через биотин, добавленный на 5'-конце одной из двух концевых последовательностей. Применение иммобилизованных транспосом обеспечивает значимые преимущества относительно основанных на растворенной фазе способов за счет уменьшения затрачиваемого трудового и общего времени получения библиотек, стоимости и требований к реагентам, снижения затрат на получение образцов, а также возможности использования неочищенных или разложившихся образцов в качестве стартового материала для получения библиотек. Примеры процедур транспозиции и систем для иммобилизации транспосом на твердой поверхности для обеспечения однородного размера фрагментов и выхода библиотеки подробно описаны в источниках: WO 2014/108810 и WO 2016/189331, каждый из которых включен в настоящий документ полностью посредством ссылки.
[0006] Согласно определенным способам тагментации на основе гранул, описанным в РСТ-публикации WO 2016/189331 и US 2014/093916 А1, транспосомы связывают с магнитными гранулами с применением биотин-стрептавидиновых взаимодействий. Во время проведения последующего ПЦР-этапа амплификации указанного протокола, связи биотина со стрептавидином разрушают путем термической денатурации, высвобождая таким образом биотинилированный продукт тагментации в раствор. Ампликоны с представляющими интерес последовательностями, или целевые ампликоны, при необходимости могут быть обогащены, например, путем захвата с помощью гибридизации, и секвенированы.
[0007] Однако при обогащении полученных путем тагментации библиотек с применением иммобилизованных транспосом по определенным областям генома с применением общих способов захвата с помощью гибридизации, для определенных областей в геноме может быть достигнуто более низкое обогащение по ридам по сравнению, например, с обогащением библиотек, полученных с применением транспосомных способов в растворе.
[0008] Кроме того, стабильность связанных с подложкой комплексов транспосом варьирует в зависимости от конструкции линкера, используемого для соединения комплекса транспосомы с подложкой. В тех случаях, когда комплексы разъединяют с подложкой при хранении или во время получения библиотек, это влияет на качество и эффективность итоговой библиотеки. Соответственно, имеется потребность в комплексах иммобилизованных транспосом с улучшенной стабильностью и в ассоциированных способах, демонстрирующих улучшенную эффективность при получении тагментированных библиотек, что, в свою очередь, обеспечивает увеличение обогащения по ридам в итоговых библиотеках. Имеется также потребность в композициях и способах для усовершенствования обогащения по ридам итоговых библиотек.
[0009] Настоящее изобретение относится к связанным с подложкой комплексам транспосом с модифицированными линкерами и размещением компонентов. Согласно настоящему изобретению предложены способы и композиции для получения готовых для секвенирования библиотек нуклеиновых кислот с применением таких модифицированных комплексов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0010] Настоящее изобретение относится к способам, композициям и наборам для обработки нуклеиновых кислот, в том числе способам и композициям для фрагментации и мечения ДНК с применением комплексов транспосом на твердой подложке.
[0011] Согласно настоящему изобретению предложен комплекс транспосомы, содержащий транспозазу, первый транспозон и второй транспозон, при этом первый транспозон содержит (а) 3'-часть, содержащую концевую последовательность указанного первого транспозона и (b) первую адапторную последовательность на 5'-конце концевой последовательности указанного первого транспозона, а второй транспозон содержит концевую последовательность второго транспозона, комплементарную по меньшей мере части концевой последовательности первого транспозона. Как правило, концевую последовательность первого транспозона и концевую последовательность второго транспозона аннелируют с формированием двухцепочечной концевой последовательности транспозона, распознаваемой транспозазой, комбинации, которая образует функциональный комплекс транспосомы.
[0012] Согласно некоторым аспектам указанный комплекс транспосомы содержит расщепляемый линкер, способный соединять первый транспозон (и соответственно указанный комплекс) с твердой подложкой. Согласно таким аспектам первый конец расщепляемого линкера присоединен к 5'-концу указанной первой адапторной последовательности, и согласно некоторым аспектам второй конец указанного расщепляемого линкера присоединен к аффинному элементу. Указанный аффинный элемент способен к связыванию (ковалентному или нековалентному) с партнером для аффинного связывания на твердой подложке. Согласно некоторым аспектам указанный аффинный элемент связывают (ковалентно или нековалентно) с партнером для аффинного связывания на твердой подложке, с получением связанного с твердой подложкой комплекса транспосомы. Указанные комплексы представляют собой комплексы транспосом с 5'-линкерами и связанные с твердой подложкой комплексы транспосом с 5'-линкерами.
[0013] Согласно другим аспектам комплекс транспосомы содержит 3'-линкер, способный соединять второй транспозон (и, соответственно, указанный комплекс) с твердой подложкой. Согласно таким аспектам первый конец указанного линкера присоединен к 3'-концу указанного второго транспозона, а второй конец указанного линкера присоединен к аффинному элементу. Указанный аффинный элемент способен к связыванию (ковалентно или нековалентно) с партнером для аффинного связывания на твердой подложке. Согласно некоторым аспектам указанный аффинный элемент связывают (ковалентно или нековалентно) с партнером для аффинного связывания на твердой подложке, с получением связанного с твердой подложкой комплекса транспосомы. Согласно некоторым аспектам указанный линкер представляет собой расщепляемый линкер. Указанные комплексы представляют собой комплексы транспосом с 3'-линкерами и связанные с твердой подложкой комплексы транспосом с 3'-линкерами.
[0014] Согласно некоторым аспектам настоящее изобретение относится к модифицированным олигонуклеотидам. Согласно некоторым аспектам указанный модифицированный олигонуклеотид содержит первый транспозон и второй транспозон, при этом указанный первый транспозон содержит (а) 3'-часть, содержащую концевую последовательность первого транспозона и (b) первую адапторную последовательность на 5'-конце концевой последовательности первого транспозона, а указанный второй транспозон содержит концевую последовательность второго транспозона, комплементарную по меньшей мере части концевой последовательности первого транспозона и аннелированную с ней; при этом первый конец расщепляемого линкера присоединен к 5'-концу указанной первой адапторной последовательности; и, согласно некоторым аспектам, второй конец указанного расщепляемого линкера присоединен к аффинному элементу.
[0015] Согласно другим аспектам указанный модифицированный олигонуклеотид содержит первый транспозон и второй транспозон, при этом указанный первый транспозон содержит (а) 3'-часть, содержащую концевую последовательность первого транспозона и (b) первую адапторную последовательность на 5'-конце концевой последовательности первого транспозона, а указанный второй транспозон содержит концевую последовательность второго транспозона, комплементарную по меньшей мере части указанной первой концевой последовательности и аннелированную с ней, при этом первый конец линкера присоединен к 3'-концу указанного второго транспозона, а второй конец линкера присоединен к аффинному элементу. Согласно некоторым аспектам указанный линкер представляет собой расщепляемый линкер.
[0016] Согласно некоторым вариантам реализации комплекса транспосомы с 3 '-линкером аффинный элемент и линкер имеют структуру формулы (I), (I'), (Ia), (Ib), (Ic), (I(a)), (I(b)) или (I(c)) согласно описанию в настоящем документе. Согласно некоторым аспектам аффинный элемент ковалентно связан с 3'-концом второго транспозона, при этом указанный аффинный элемент и линкер имеют структуру формулы (I):

где:
АЭ представляет собой аффинный элемент;
Y представляет собой алкилен С2-6,
X1 представляет собой О, NR1 или S;
где R1 представляет собой Н или алкил C1-10;
n представляет собой целое число, выбранное из группы, состоящей из 1, 2, 3, 4, 5 и 6;
X2 представляет собой О, СH2 или S;
Ra представляет собой Н или -ОН; и
Z отсутствует, если Ra представляет собой Н, или представляет собой СH2, если Raпредставляет собой Н или ОН;
при этом символом

[0017] Согласно некоторым аспектам линкер, описанный в настоящем документе, представляет собой 5'-линкер, при этом фосфатная группа в формуле (I) представляет собой концевую фосфатную группу в 5'-положении концевого нуклеотида первого транспозона. Согласно некоторым аспектам линкер, описанный в настоящем документе, представляет собой 3'-линкер, при этом фосфатная группа в формуле (I) соединена с 3'-гидроксилом олигонуклеотида второго транспозона, таким как 3'-концевой нуклеотид.
[0018] Согласно другим аспектам настоящего изобретения предложены способы получения библиотеки меченых фрагментов нуклеиновых кислот из двухцепочечной целевой нуклеиновой кислоты, включающие инкубацию мишени с комплексом транспосомы, связанным с твердой подложкой, согласно описанию в настоящем документе. Согласно некоторым аспектам указанные способы включают обработку мишени иммобилизованным комплексом транспосомы в условиях, отличающихся тем, что указанная мишень фрагментирована, а 3'-конец первого транспозона присоединен к 5'-концам целевых фрагментов с получением множества 5'-меченых целевых фрагментов. Согласно некоторым вариантам реализации используют множество комплексов транспосом.
[0019] Согласно некоторым вариантам реализации указанные способы дополнительно включают амплификацию одного или более из 5'-меченых целевых фрагментов. Согласно некоторым вариантам реализации указанные способы дополнительно включают секвенирование одного или более из 5'-меченых целевых фрагментов или продуктов их амплификации.
[0020] Соответственно, некоторые дополнительные варианты реализации настоящего изобретения относятся к способу получения библиотеки меченых фрагментов нуклеиновых кислот, включающему:
получение твердой подложки, содержащей иммобилизованный на ней комплекс транспосомы согласно описанию в настоящем документе; и
приведение указанной твердой подложки в контакт с двухцепочечной целевой нуклеиновой кислотой в условиях, достаточных для фрагментации указанной целевой нуклеиновой кислоты на множество целевых фрагментов, и для присоединения 3'-конца указанного первого транспозона к 5'-концам целевых фрагментов с получением множества 5'-меченых целевых фрагментов.
[0021] Согласно некоторым аспектам указанный способ дополнительно включает амплификацию указанных 5'-меченых целевых фрагментов.
[0022] Согласно некоторым аспектам настоящего изобретения предложена библиотека 5'-меченых целевых фрагментов, полученных с применением способов, описанных в настоящем документе.
[0023] Согласно настоящему изобретению также предложены способы получения модифицированных олигонуклеотид о в, комплексов транспосом и связанных с твердой подложкой комплексов транспосом согласно описанию в настоящем документе. Согласно некоторым аспектам такие способы включают обработку транспозазы первым и вторым транспозонами согласно описанию в настоящем документе в условиях, подходящих для образования указанного комплекса. Способы получения связанного с твердой подложкой комплекса транспосомы включают инкубацию комплекса транспосомы согласно описанию в настоящем документе с твердой подложкой, содержащей партнер для аффинного связывания, в условиях, достаточных для того, чтобы аффинный элемент связался (ковалентно или нековалентно) с указанным партнером для аффинного связывания.
[0024] Согласно некоторым вариантам реализации композиций и способов, описанных в настоящем документе, комплексы транспосом содержат две популяции, отличающиеся тем, что первые адапторные последовательности в каждой популяции различаются.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0025] На фиг. 1 приведены примеры этапов способа закрепления варианта реализации комплекса транспосомы на поверхности гранул.
[0026] На фиг. 2 приведена схематическая диаграмма примера процесса тагментации на поверхности гранул путем образования кластеров на проточной ячейке.
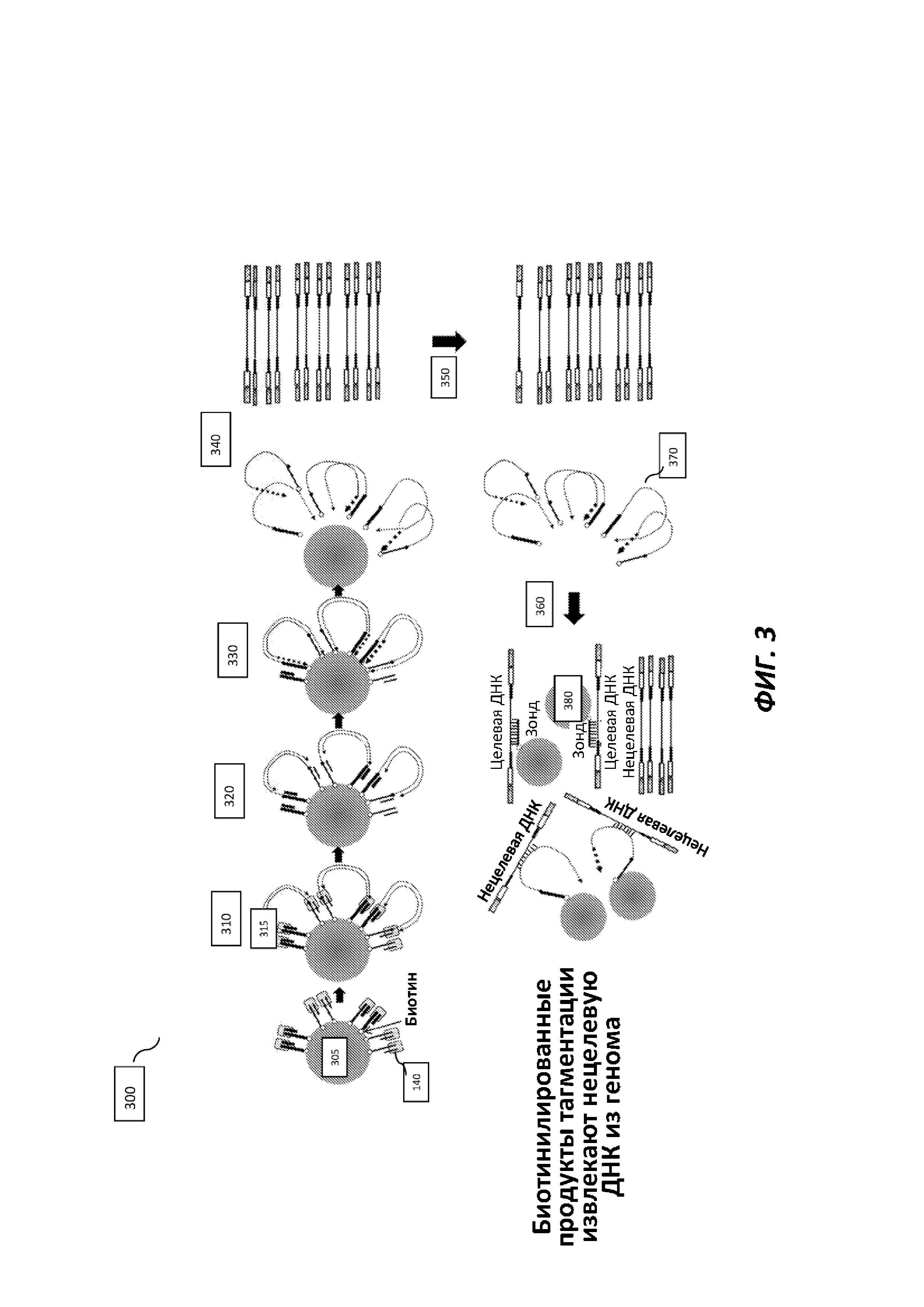
[0027] На фиг. 3 представлены примеры этапов способа фрагментации и мечения ДНК с применением комплексов транспосом, иммобилизованных на поверхности гранул, с последующим целевым обогащением, приводящим к загрязнению нецелевыми ридами.
[0028] На фиг. 4 представлены примеры этапов способа фрагментации и мечения ДНК с применением комплексов транспосом, иммобилизованных на поверхности гранул посредством расщепляемого ферментативным путем линкера, с последующим целевым обогащением.
[0029] На фиг. 5А представлен пример биотинилированного 5'-конца последовательности транспозона, присоединенного к твердой поверхности для тагментации и последующей амплификации.
[0030] На фиг. 5В представлен пример биотинилированного 3'-конца последовательности транспозона, присоединенного к твердой поверхности для тагментации и последующей амплификации.
[0031] На фиг. 6А представлено сравнение выхода библиотеки при твердофазной тагментации на основе гранул со стрептавидином с применением комплексов транспосом, содержащих два разных 3'-биотинилированных линкера.
[0032] На фиг. 6В приведены данные исследования стабильности при ускоренном старении для библиотеки образцов, полученной путем твердофазной тагментации на основе гранул со стрептавидином с применением комплекса транспосомы, содержащего 3'-биотинилированный линкер формулы (I(a)), после старения в течение 4 месяцев, со сравнением с библиотекой образцов, полученной из не подвергавшейся старению партии того же комплекса (контроль).
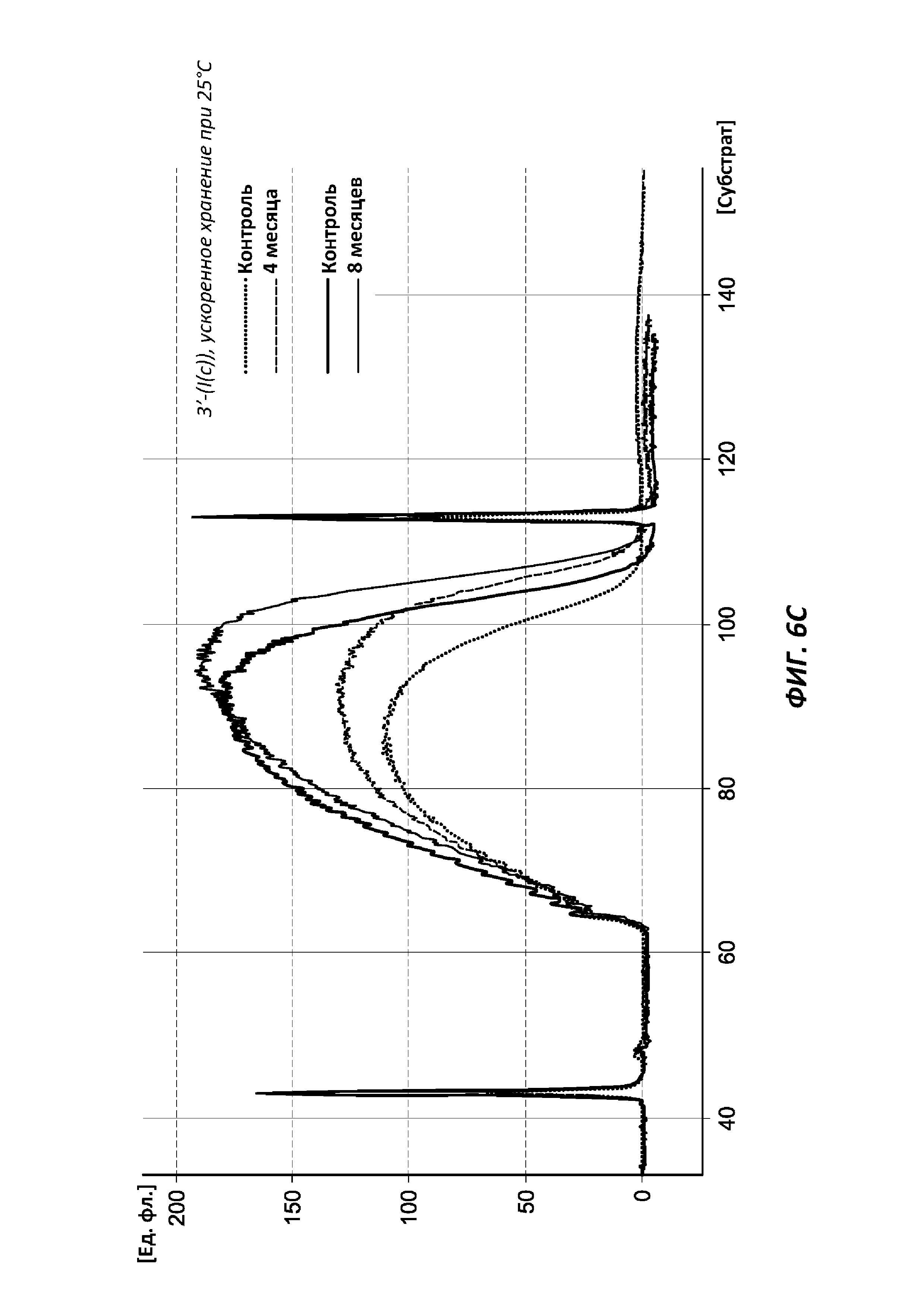
[0033] На фиг. 6С продемонстрированы данные исследования стабильности с ускоренным старением библиотеки образцов, полученной из комплекса транспосомы, содержащего 3'-биотинилированный линкер формулы (I(c)), после старения в течение 4 месяцев и 8 месяцев, со сравнением с библиотеками образцов, полученных из не подвергавшейся старению комплексов (контролей).
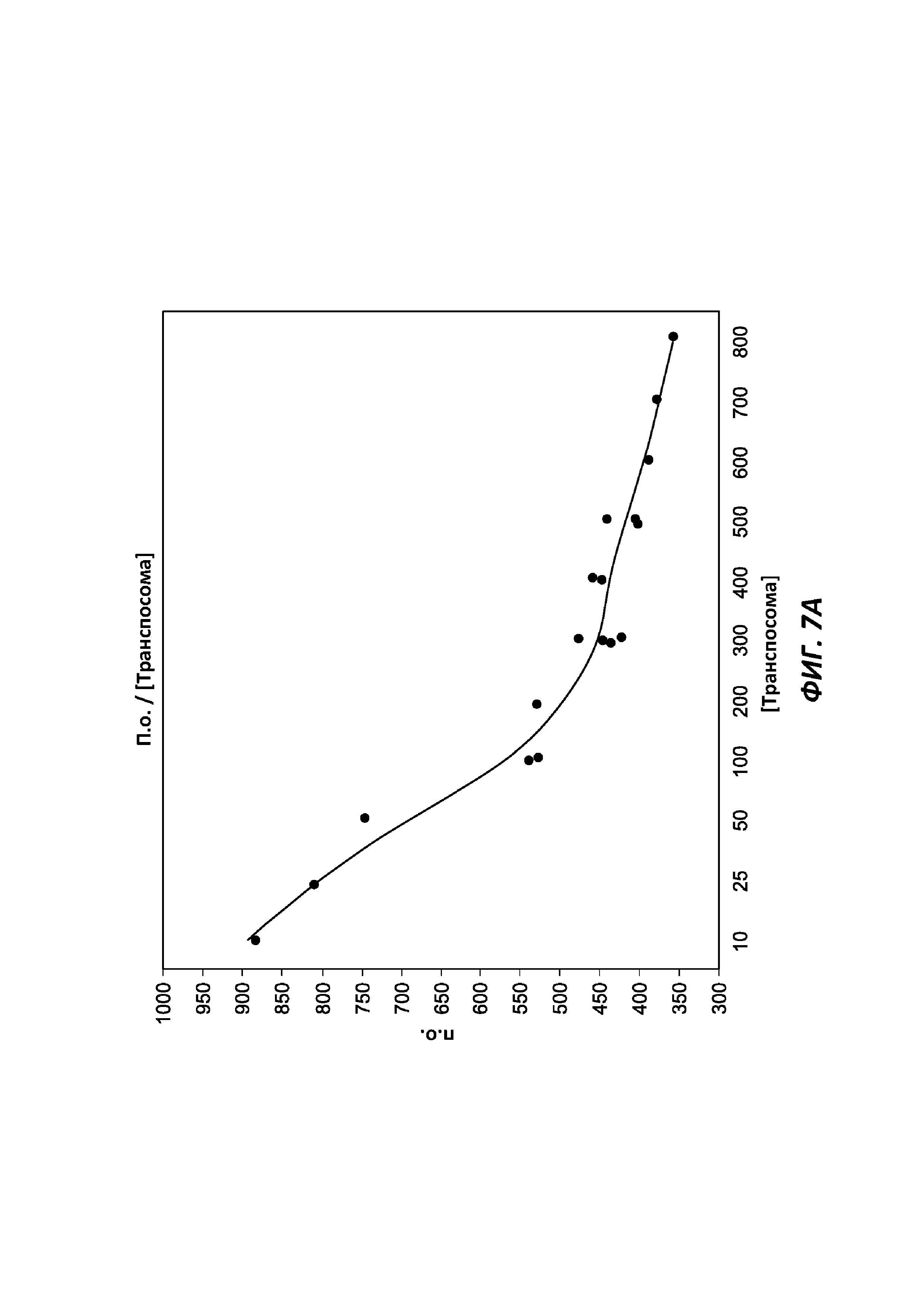
[0034] На фиг. 7А продемонстрирован целевой размер инсерций молекул ДНК как функция от плотности указанного комплекса при получении библиотеки с применением твердофазного способа на основе гранул со стрептавидином, когда указанные гранулы содержат иммобилизованный комплекс транспосомы, связанный с ними 3'-биотинилированным линкером.
[0035] На фиг. 7В представлен линейный график, отражающий целевой размер инсерций молекул ДНК как функции от условий SPRI (твердофазной обратимой иммобилизации, «solid phase reversible immobilization))) при применении гранул со стрептавидином с иммобилизованным комплексом транспосомы, содержащим гиперактивную транспозазу Tn5 и 3'биотинилированный линкер, при плотности комплекса 100 нМ.
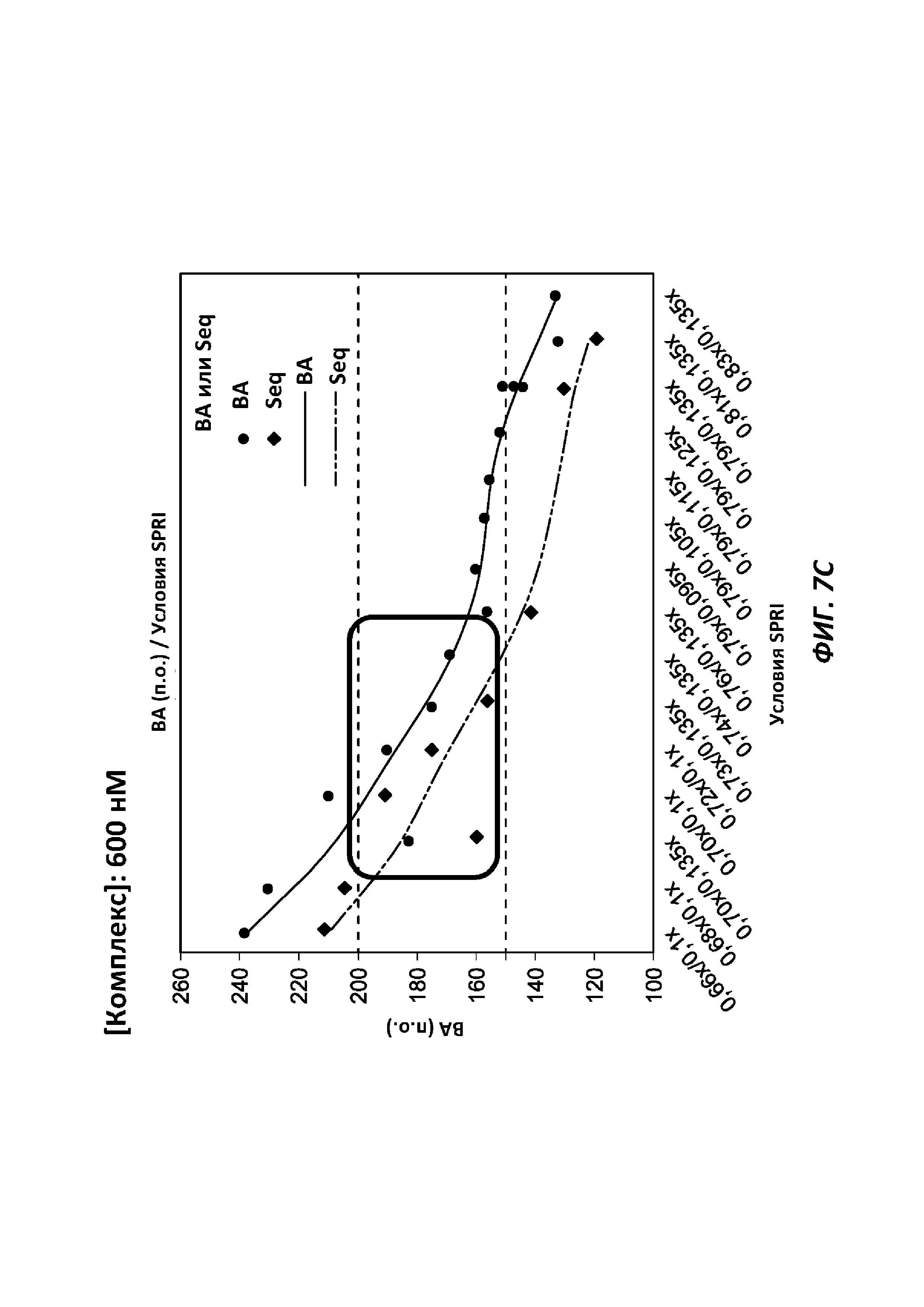
[0036] На фиг. 7С представлен линейный график, отражающий целевой размер инсерций молекул ДНК как функции от условий SPRI при применении гранул со стрептавидином с иммобилизованным комплексом транспосомы, содержащим гиперактивную транспозазу Tn5 и 3'-биотинилированный линкер, при плотности комплекса 600 нМ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0037] Библиотеки фрагментированных нуклеиновых кислот часто получают из геномных нуклеиновых кислот для применения при секвенировании нового поколения (NGS). Согласно настоящему изобретению предложены способы, композиции и наборы для применения в способе получения иммобилизованных транспозиционных библиотек. Указанный способ получения иммобилизованных транспозиционных библиотек представляет собой быстрый способ относительно других способов получения библиотек и эффективен для получения библиотек как из первичных или неочищенных образцов (таких как кровь, мокрота, клеточные экстракты и т.п.), так и очищенных образцов (таких как очищенные геномные нуклеиновые кислоты). Обычно транспосому иммобилизуют на субстрате, таком как предметное стекло (слайд) или гранула, с применением партнеров для ковалентного или не ковалентно го связывания, например, аффинного элемента и партнера для аффинного связывания (фиг. 1). Например, комплекс транспосомы иммобилизуют на покрытой стрептавидином грануле посредством биотинилированного линкера, присоединенного к комплексу транспосомы. Целевые нуклеиновые кислоты захватывают иммобилизованным комплексом транспосомы, фрагментируют и метят («тагментация»). Меченые фрагменты амплифицируют, представляющие интерес ампликоны необязательно захватывают (например, посредством зондов для гибридизации); и меченые фрагменты секвенируют.
[0038] При использовании соединенных с твердой подложкой комплексов транспосом для получения библиотек уменьшается необходимость в нормировании образцов, вводимых в процесс получения библиотеки, и в нормировании результатов получения библиотеки до этапов обогащения или секвенирования. Применение указанных комплексов также позволяет получать библиотеки с более стабильными размерами инсерций по сравнению со способами, осуществляемыми в фазе раствора, даже при использовании варьирующих концентраций вводимых образцов. Однако, согласно наблюдениям, определенные комплексы транспосом с биотинилированными линкерами отличаются пониженной стабильностью. Кроме того, определенные конфигурации связанных на подложке комплексов обуславливают получение нецелевых продуктов; в частности, при гибридизации и захвате ампликонов 5'-меченых целевых фрагментов может происходить загрязнение фрагментами нуклеиновых кислот, все еще гибридизованных с иммобилизованными нуклеиновыми кислотами (фиг. 3). Указанная неэффективность может приводить к потерям реагентов и пространства в инструменте для секвенирования или проточной ячейке, потраченных на нецелевые фрагменты, и данных секвенирования. Согласно настоящему изобретению предложены различные варианты дизайна комплекса транспосомы для решения проблем, связанных с качеством библиотек и снижения нецелевого захвата, и комплексы с модифицированными линкерами, которые демонстрируют улучшенную химическую стабильность.
[0039] Согласно некоторым вариантам реализации библиотеки нуклеиновых кислот, полученные с применением способов согласно описанию в настоящем документе, могут быть секвенированы с применением любой подходящей платформы для секвенирования нуклеиновых кислот для определения последовательности нуклеиновой кислоты целевой последовательности. До некоторой степени представляющие интерес последовательности коррелируют или ассоциированы с одним или более врожденными или наследственными расстройствами, патогенностью, устойчивостью к антибиотикам или генетическими модификациями. Секвенирование может применяться для определения последовательности нуклеиновых кислот короткого тандемного повтора, однонуклеотидного полиморфизма, гена, экзона, кодирующей области, экзома или частей перечисленного. Соответственно, способы и композиции, описанные в настоящем документе, относятся к созданию секвенируемых библиотек, подходящих, не ограничиваясь перечисленным, для диагностики, прогнозирования и терапии рака и заболеваний, применения для «фингерпринтинга» ДНК (например, работы с базами данных ДНК, работы с материалами уголовных дел), метагеномных исследований и поиска, применения в агрогеномике, а также для идентификации и мониторинга патогенов.
[0040] Количество этапов, необходимых для трансформации целевой нуклеиновой кислоты, такой как ДНК, в модифицированные адапторами матрицы, готовые для использования при секвенировании нового поколения, может быть минимизировано за счет применения опосредованных транспозазой фрагментации и мечения. Указанный процесс, называемый в настоящем документе «тагментацией», часто включает модификацию целевой нуклеиновой кислоты комплексом транспосомы, содержащим фермент транспозазу в комплексе с парой транспозонов, включающих одноцепочечную адапторную последовательность и двухцепочечную концевую область последовательности транспозона, наряду с необязательными дополнительными последовательностями, разработанными с конкретной целью. Тагментация приводит к одновременной фрагментации целевой нуклеиновой кислоты и лигированию адаптеров с 5'-концами обоих цепей дуплексных фрагментов нуклеиновых кислот. При связывании комплексов транспосом с подложкой итоговые фрагменты связываются с твердой подложкой после реакции тагментации (либо прямо, в случае 5'-связанных комплексов транспосом, либо путем гибридизации в случае 3'-связанных комплексов транспосом).
[0041] Если не указано иное, все технические и научные термины в настоящем документе имеют общепринятые среди специалистов в соответствующей области техники значения. Все патенты, заявки, опубликованные заявки и другие публикации, упоминаемые в настоящем документе, полностью включены посредством ссылок, если не указано иное. В тех случаях, когда в настоящем документе использовано несколько определений термина, определения в настоящем разделе имеют решающее значение, если не указано иное. В настоящем описании и прилагаемой формуле изобретения термины в единственном числе, включая предваряемые дополнением «указанный» или «указанные», включают соответствующие термины во множественном числе, если иное явным образом не следует из контекста. Если не указано иное, используются стандартные методы масс-спектроскопии, ЯМР, ВЭЖХ, химии белков, биохимии, методики рекомбинантной ДНК и фармакологии. При применении терминов «или» или «и» подразумевается «и/или», если не указано иное. Кроме того, использование термина «включающий», а также других его форм, таких как «включают», «включает» и «включенный», является неограничивающим. При использовании в настоящем описании, в переходном выражении или в основной части пункта, термины «содержать», «содержит» и «содержащий» должны быть истолкованы как включающие открытое значение, то есть указанные термины должны быть истолкованы синонимичным выражениям «содержащий по меньшей мере» или «включающий по меньшей мере» образом. В контексте способа термин «содержащий»/«включающий» означает, что указанный способ включает по меньшей мере упоминаемые этапы, однако может включать и дополнительные этапы. При использовании в контексте соединения, композиции или устройства термин «содержащий» означает, что указанное соединение, указанная композиция или указанное устройство включает по меньшей мере упомянутые признаки или компоненты, однако может также включать дополнительные признаки или компоненты.
[0042] Названия разделов в настоящем документе служат исключительно организационным целям и не должны быть истолкованы как ограничивающие описываемый предмет изобретения.
Химическая терминология
[0043] В настоящем документе «алкил» относится к прямой или разветвленной углеводородной цепи, которая полностью насыщена (т.е. не содержит двойных или тройных связей). Указанная алкильная группа может содержать от 1 до 20 атомов углерода (в любом разделе настоящего документа указанный диапазон числовых значений, такой как «от 1 до 20», относится к любому целому числу в заданном диапазоне; например, «от 1 до 20 атомов углерода» означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода и так далее, до 20 атомов углерода включительно, хотя настоящим определением также охвачено употребление термина «алкил» без указания диапазона числовых значений). Указанная алкильная группа может также представлять собой алкил среднего размера, содержащий от 1 до 9 атомов углерода. Указанная алкильная группа может также представлять собой низший алкил, содержащий от 1 до 6 атомов углерода. Указанная алкильная группа может быть обозначена как «алкил C1-4» или аналогичным образом. Например, «алкил C1-6» означает наличие от одного до шести атомов углерода в алкильной цепи, т.е. указанная алкильная цепь выбрана из группы, состоящей из метила, этила, пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила. Типичные алкильные группы включают метил, этил, пропил, изопропил, бутил, изобутил, третичный бутил, пентил, гексил и т.п., однако никоим образом не ограничиваются перечисленными группами.
[0044] В настоящем документе «алкокси» относится к формуле -OR, где R представляет собой алкил согласно определению выше, такой как «алкокси С1-9», в том числе, но не ограничиваясь перечисленными, метокси, этокси, н-пропокси, 1-метилэтокси (изопропокси), н-бутокси, изобутокси, втор-бутокси и трет-бутокси; и т.п.
[0045] В настоящем документе «арил» относится к ароматическому кольцу или кольцевой системе (т.е. двум или более слитым кольцам с двумя общими смежными атомами углерода), содержащими только углерод в остове кольца. В тех случаях, когда арил представляет собой кольцевую систему, каждое кольцо в указанной системе является ароматическим. Указанная ар ильная группа может содержать от 6 до 18 атомов углерода, хотя настоящим определением также охвачено употребление термина «арил» без указания диапазона числовых значений. Согласно некоторым вариантам реализации указанная ар ильная группа содержит от 6 до 10 атомов углерода. Указанная ар ильная группа может быть обозначена как «арил С6-10», «арил С6 или С10», или аналогичным образом. Примеры арильных групп включают, не ограничиваясь перечисленными, фенил, нафтил, азуленил и антраценил.
[0046] «Аралкил» или «арилалкил» представляет собой арильную группу, соединенную, в качестве заместителя, алкиленовой группой, например, «аралкил С7-14» и т.п., в том числе, но не ограничиваясь перечисленными, бензил, 2-фенилэтил, 3-фенилпропил и нафтилалкил. В некоторых случаях алкиленовая группа представляет собой низшую алкиленовую группу (т.е. алкиленовую С1-6 группу).
[0047] В настоящем документе «карбоциклил» означает неароматическое циклическое кольцо или кольцевую систему, содержащую только атомы углерода в остове указанной кольцевой системы. В тех случаях, когда карбоциклил представляет собой кольцевую систему, два или более колец могут быть объединены путем слияния, мостиковой связи или спироконденсации. Карбоциклилы могут отличаться любой степенью насыщенности, при условии, что по меньшей мере одно кольцо в кольцевой системе не является ароматическим. Соответственно, карбоциклилы включают циклоалкилы, циклоалкенилы и циклоалкинилы. Указанная карбоциклильная группа может содержать от 3 до 20 атомов углерода, хотя настоящим определением также охвачено употребление термина «карбоциклил» без указания диапазона числовых значений. Указанная карбоциклильная группа может также представлять собой карбоциклил среднего размера, содержащий от 3 до 10 атомов углерода. Указанная карбоциклильная группа может также представлять собой карбоциклил, содержащий от 3 до 6 атомов углерода. Указанная карбоциклильная группа может быть обозначена как «карбоциклил С3-6» или аналогичным образом. Примеры карбоциклильных колец включают, не ограничиваясь перечисленными, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, 2,3-дигидро-инден, бицикло[2.2.2]октанил, адамантил и спиро[4.4]нонанил.
[0048] В настоящем документе «Са-Сb», или «Са-b», где «а» и «b» представляют собой целые числа, относятся к числу атомов углерода в указанной группе, то есть указанная группа может содержать от «а» до «b», включительно, атомов углерода. Соответственно, например, «алкил С1-С4» или «алкильная С1-4» группа относится ко всем алкильным группам, содержащим от 1 до 4 атомов углерода, то есть СH3-, CH3CH2-, CH3CH2CH2-, (СН3)2СН-, CH3CH2CH2CH2-, CH3CH2СH(CH3)- и (СН3)3С-.
[0049] В настоящем документе термин «ковалентно присоединенный» или «ковалентно связанный» относится к образованию химической связи, которая характеризуется общими для атомов парами электронов. Например, ковалентно присоединенное полимерное покрытие относится к полимерному покрытию, которое образует химические связи с функционализированной поверхностью субстрата, в отличие от прикрепления к поверхности другими способами, например, посредством адгезионного или электростатического взаимодействия. Следует понимать, что полимеры, ковалентно прикрепленные к поверхности, могут также быть связаны с применением других способов помимо ковалентного прикрепления, например, путем физической адсорбции.
[0050] Термин «галоген» или «гало» в настоящем документе означает любой из радиостабильных атомов из 7 столбца периодической таблицы элементов, например, фтор, хлор, бром или йод, при этом фтор и хлор являются предпочтительными.
[0051] В настоящем документе «гетероарил» относится к ароматическому кольцу или кольцевой системе (т.е. двум или более слитым кольцам с двумя общими смежными атомами), которые содержат один или более гетероатомов, то есть элемент, отличный от углерода, в том числе, но не ограничиваясь перечисленными, азот, кислород и серу, в остове кольца. В тех случаях, когда указанный гетероарил представляет собой кольцевую систему, каждое кольцо в системе является ароматическим. Гетероарильная группа может содержать 5-18 членов в кольце (т.е. атомов, образующих остов кольца, в том числе атомов углерода и гетероатомов), хотя настоящим определением также охвачено употребление термина «гетероарил» без указания диапазона числовых значений. Согласно некоторым вариантам реализации гетероарильная группа содержит 5-10 членов в кольце или 5-7 членов в кольце. Указанная гетероарильная группа может быть обозначена как «5- 7-членный гетероарил», «5 10-членный гетероарил»; или аналогичным образом. Примеры гетероарильных колец включают, не ограничиваясь перечисленными, фурил, тиенил, фталазинил, пирролил, оксазолил, тиазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, триазолил, тиадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил, хинолинил, изохинолинил, бензимидазолил, бензоксазолил, бензотиазолил, индолил, изоиндолил и бензотиенил.
[0052] В настоящем документе «гетероциклил» означает неароматическое циклическое кольцо или кольцевую систему, содержащие по меньшей мере один гетероатом в остове кольца. Гетероциклилы могут быть объединены путем слияния, мостиковой связи или спироконденсации. Гетероциклилы могут отличаться любой степенью насыщенности, при условии, что по меньшей мере одно кольцо в кольцевой системе не является ароматическим. Гетероатом(ы) могут присутствовать как в неароматическом, так и в ароматическом кольце в кольцевой системе. Гетероциклильная группа может содержать от 3 до 20 членов в кольце (т.е. атомов, образующих остов кольца, в том числе атомы углерода и гетероатомы), хотя настоящим определением также охвачено употребление термина «гетероциклил» без указания диапазона числовых значений. Гетероциклильная группа может также представлять собой гетероциклил среднего размера, содержащий от 3 до 10 членов в кольце. Гетероциклильная группа может также представлять собой гетероциклил, содержащий от 3 до 6 членов в кольце. Указанная гетероциклильная группа может быть обозначена как «3-6-членный гетероциклил» или аналогичным образом. В предпочтительных шестичленных моноциклических гетероциклилах гетероатом(ы) выбраны из чего-либо одного или более, или всех трех из О, N или S, а в предпочтительных пятичленных моноциклических гетероциклилах гетероатом(ы) выбраны из одного или двух гетероатомов, выбранных из О, N или S. Примеры гетероциклильных колец включают, не ограничиваясь перечисленными, азепинил, акридинил, карбазолил, циннолинил, диоксоланил, имидазолинил, имидазолидинил, морфолинил, оксиранил, оксепанил, тиепанил, пиперидинил, пиперазинил, диоксопиперазинил, пирролидинил, пирролидонил, пирролидионил, 4-пиперидонил, пиразолинил, пиразол ид инил, 1,3-диоксинил, 1,3-диоксанил, 1,4-диоксинил, 1,4-диоксанил, 1,3-оксатианил, 1,4-оксатиинил, 1,4-оксатианил, 2H-1,2-оксазинил, триоксанил, гексагидро-1,3,5-триазинил, 1,3-диоксолил, 1,3-диоксоланил, 1,3-дитиолил, 1,3-дитиоланил, изоксазолинил, изоксазолидинил, оксазолинил, оксазолидинил, оксазолидинонил, тиазолинил, тиазолидинил, 1,3-оксатиоланил, индолинил, изоиндолинил, тетрагидрофуранил, тетрагидропиранил, тетрагидротиофенил, тетрагидротиопиранил, тетрагидро-1,4-тиазинил, тиаморфолинил, дигидробензофуранил, бензимидазолидинил и тетрагидрохинолин.
[0053] В настоящем документе замещенная группа происходит из незамещенной исходной группы, в которой произошла замена одного или более атомов водород на другой атом или группу. Если не указано иное, когда группу считают «замещенной», это означает, что указанная группа замещена одним или более заместителями, независимо выбранными из алкила C1-C6, алкенила C1-C6, алкинила C1-С6, гетероалкила C1-C6, карбоциклила С3-C7 (необязательно замещенного галогеном, алкилом C1-С6, алкокси C1-С6, галогеналкилом C1-C6 и галогеналкокси C1-C6), С3-С7-карбоциклил-С1-С6-алкила (необязательно замещенного галогеном, алкилом C1-С6, алкокси C1-С6, галогеналкилом C1-C6 и галогеналкокси C1-С6), 3-10-членного гетероциклила (необязательно замещенного галогеном, алкилом C1-C6, алкокси C1-С6, галогеналкилом C1-С6 и галогеналкокси C1-С6), 3-10-членного гетероциклила-С1-C6-алкил (необязательно замещенного галогеном, алкилом C1-C6, алкокси C1-С6, галогеналкилом C1-C6 и галогеналкокси C1-C6), арила (необязательно замещенного галогеном, алкилом C1-С6, алкокси C1-С6, галогеналкилом C1-C6 и галогеналкокси C1-С6), арил(С1-С6)алкила (необязательно замещенного галогеном, алкилом C1-C6, алкокси C1-С6, галогеналкилом C1-С6 и галогеналкокси C1-С6), 5-10-членного гетероарила (необязательно замещенного галогеном, алкилом C1-C6, алкокси C1-C6, галогеналкилом C1-С6 и галогеналкокси C1-С6), 5-10-членного гетероарил(С1-С6)алкила (необязательно замещенный галогеном, алкилом C1-C6, алкокси C1-C6, галогеналкилом C1-C6 и галогеналкокси C1-С6), галогено, циано, гидрокси, алкокси C1-C6, алкокси C1-C6 (С1-С6)алкила (т.е. простого эфира), арилокси, сульфгидрил(меркапто), галоген(С1-С6)алкила (например, -CF3), галоген(С1-С6)алкокси (например, -OCF3), алкилтио C1-C6, арилтио, амино, амино(С1-С6)алкила, нитро, О-карбамила, N-карбамила, О-тиокарбамила, N-тиокарбамила, С-амидо, N-амидо, S-сульфонамидо, N-сульфонамидо, С-карбокси, О-карбокси, ацила, цианато, изоцианато, тиоцианато, изотиоцианато, сульфинила, сульфонила, сульфо, сульфино, сульфоната и оксо (=O). В тех случаях, когда группа описана где-либо как «необязательно замещенная», указанная группа может быть замещена вышеперечисленными заместителями.
[0054] Согласно некоторым вариантам реализации указанные комплексы транспосом иммобилизуют на подложке посредством одного или более полинуклеотидов (например, олигонуклеотидов), таких как полинуклеотид (олигонуклеотид), содержащий концевую последовательность транспозона. Согласно некоторым вариантам реализации указанный комплекс транспосомы может быть иммобилизован посредством линкера, добавленного к концу последовательности транспозона, например, сопрягающего фермент транспозазу с твердой подложкой. Согласно некоторым вариантам реализации как фермент транспозазу, так и полинуклеотид транспозона (например, олигонуклеотид) иммобилизуют на твердой подложке. В отношении иммобилизации молекул (например, нуклеиновых кислот, ферментов) на твердой подложке термины «иммобилизованный», «закрепленный» и «прикрепленный» используются в настоящем документе взаимозаменяемо; предполагается, что оба термина охватывают прямое или непрямое, ковалентное или нековалентное прикрепление, если иное не указано явным образом или не следует из контекста. Согласно определенным вариантам реализации настоящего изобретения ковалентное прикрепление может быть предпочтительным, однако обычно требуется только то, чтобы молекулы (например, нуклеиновые кислоты, ферменты) оставались в иммобилизованном или присоединенном к подложке состоянии в условиях, в которых предполагается использование указанной подложки, например, во вариантах применения, требующих амплификации и/или секвенирования нуклеиновых кислот. В некоторых случаях при тагментации на основе гранул транспосомы могут быть связаны с поверхностью гранул парой лигандов, например, аффинным элементом и партнером для аффинного связывания.
Транспосомы и транспозазы
[0055] Технология на основе транспозонов может быть использована для фрагментации ДНК, например, согласно иллюстративному описанию технологического процесса для наборов для получения образцов NEXTERA™ XT и FLEX DNA (Illumina, Inc.), когда целевые нуклеиновые кислоты, такие как геномная ДНК, обрабатывают комплексами транспосом для одновременной фрагментации и мечения («тагментации») мишени, с получением таким образом популяции фрагментированных молекул нуклеиновой кислоты, меченых уникальными адапторными последовательностями на концах указанных фрагментов.
[0056] Реакция транспозиции представляет собой реакцию, отличающуюся тем, что один или более транспозонов инсертированы в целевые нуклеиновые кислоты в случайных сайтах или почти случайных сайтах. Компоненты в реакции транспозиции включают транспозазу (или другой фермент, способный к фрагментации и мечению нуклеиновой кислоты согласно описанию в настоящем документе, такой как интеграза) и элемент транспозона, который включает двухцепочечную концевую последовательность транспозона, которая связывается с ферментом, и адапторную последовательность, присоединенную к одной из двух концевых последовательностей транспозона. Одна цепь двухцепочечной концевой последовательности транспозона переносится в одну цепь целевой нуклеиновой кислоты, тогда как комплементарная цепь концевой последовательности транспозона не переносится (т.е. является не переносимой последовательностью транспозона). Указанная адапторная последовательность может содержать одну или более функциональных последовательностей (например, последовательностей праймеров), если это необходимо или требуется.
[0057] «Комплекс транспосомы» состоит из по меньшей мере одного фермента транспозазы и последовательности распознавания транспозона. В некоторых таких системах транспозаза связывается с последовательностью распознавания транспозона с образованием функционального комплекса, который способен катализировать реакцию транспозиции. Согласно некоторым аспектам последовательность распознавания транспозона представляет собой двухцепочечную концевую последовательность транспозона. Транспозаза, или интеграза, связывается с сайтом распознавания транспозазы в целевой нуклеиновой кислоте и инсертирует последовательность распознавания транспозона в целевую нуклеиновую кислоту. В ходе некоторых таких инсерций одна цепь последовательности распознавания транспозона (или концевая последовательность) переносится в целевую нуклеиновую кислоту, что приводит также к расщеплению. Примеры процедур транспозиции и систем, которые могут быть легко адаптированы для применения с транспозазами согласно настоящему изобретению описаны, например, в РСТ-публикации WO10/048605, патентной публикации США №2012/0301925, патентной публикации США №2012/13470087 или патентной публикации США №2013/0143774, каждая из которых включена в настоящий документ полностью посредством ссылки.
[0058] Примеры транспозаз (или кодирующих их последовательностей), которые могут применяться в определенных вариантах реализации, предложенных согласно настоящему изобретению, включают: транспозазу Tn5 (см. ReznikofF et al., Biochem. Biophys. Res. Commun. 2000, 266, 729-734), Vibrio harveyi (транспозаза, охарактеризованная Agilent и используемая в продукте SureSelect QXT), транспозазу MuA и сайт распознавания транспозазы Ми, содержащий концевые последовательности RT и R2 (Mizuuchi, K., Cell, 35: 785, 1983; Savilahti, Н, et al., EMBO J., 14:4893, 1995), Staphylococcus aureus Tn552 (Colegio, O. etal., J. Bacteriol., 183:2384-8, 2001; Kirby, C. et al., Mol. Microbiol., 43:173-86, 2002), Tyl (Devine & Boeke, Nucleic Acids Res., 22:3765-72, 1994 и PCT-публикация №W095/23875), транспозон Tn7 (Craig, N.L., Science, 271:1512, 1996; Craig, N.L., Curr. Top.Microbiol. Immunol., 204:27-48, 1996), Tn/O и IS 10 (Kleckner N. et al., Curr. Top. Microbiol. Immunol., 204:49-82, 1996), транспозазу Mariner (Lampe, D.J. et al., EMBO J., 15:5470-9, 1996), Tel (Plasterk, R.H., Curr. Top. Microbiol. Immunol., 204:125-43, 1996), элемент P (Gloor, G.B., Methods Mol. Biol., 260:97-114, 2004), Tn3 (Ichikawa & Ohtsubo, J. Biol. Chem., 265:18829-32, 1990), бактериальные инсерционные последовательности (Ohtsubo & Sekine, Curr. Top.Microbiol. Immunol. 204:1-26, 1996), ретровирусы (Brown et al., Proc. Natl. Acad. Sci. USA, 86:2525-9, 1989) и ретротранспозон дрожжей (Boeke & Corces, Ann. Rev. Microbiol. 43:403-34, 1989). Дополнительные примеры включают IS5, Tn10, Tn903, IS911; и сконструированные варианты ферментов семейства транспозаз (Zhang et al., (2009) PLoS Genet. 5:e 1000689. Epub Oct. 16; Wilson C. et al. (2007) J. Microbiol. Methods 71:332-5). Способы, описанные в настоящем документе, могут также включать комбинации транспозаз, а не только одну транспозазу.
[0059] Согласно некоторым вариантам реализации указанная транспозаза представляет собой транспозазу Tn5, МиА или Vibrio harveyi, или ее активный мутант.Согласно другим вариантам реализации указанная транспозаза представляет собой транспозазу Tn5 или ее активный мутант.Согласно некоторым вариантам реализации указанная транспозаза Tn5 представляет собой гиперактивную транспозазу Tn5 (см., например, Reznikoffet al., РСТ-публикация №WO2001/009363, патенты США №5925545, №5965443, №7083980 и №7608434; Goryshin and Reznikoff, J. Biol. Chem. 273:7367, 1998), или ее активный мутант. Согласно некоторым аспектам указанная транспозаза Tn5 представляет собой транспозазу Tn5 согласно описанию в РСТ-публикации WO2015/160895, которая включена в настоящий документ посредством ссылки. Согласно некоторым вариантам реализации указанная транспозаза Tn5 представляет собой слитый белок. Согласно некоторым вариантам реализации указанный слитый белок транспозазы Tn5 содержит метку - слитый фактор элонгации Ts (Tsf). Согласно некоторым вариантам реализации указанная транспозаза Tn5 представляет собой гиперактивную транспозазу Tn5, содержащую мутации аминокислот в положениях 54, 56 и 372 по сравнению с последовательностью дикого типа. Согласно некоторым вариантам реализации указанная гиперактивная транспозаза Tn5 представляет собой слитый белок, необязательно слитый с белком - фактором элонгации Ts (Tsf). Согласно некоторым вариантам реализации указанный сайт распознавания представляет собой сайт распознавания транспозазы Tn5-типа (Goryshin and Reznikoff, J. Biol. Chem., 273:7367, 1998). Согласно одному варианту реализации применяют сайт распознавания транспозазы, который образует комплекс с гиперактивной транспозазой Tn5 (например, транспозазой EZ-Tn5™, Epicentre Biotechnologies, Мэдисон, Висконсин).
[0060] Согласно некоторым вариантам реализации указанный комплекс транспосомы представляет собой димер двух молекул транспозазы. Согласно некоторым вариантам реализации указанный комплекс транспосомы представляет собой гомодимер, отличающийся тем, что каждая из двух молекул транспозазы связана с первым и вторым транспозонами одного типа (например, последовательности двух транспозонов, связанные с каждым мономером, являются одинаковыми, образуя «гомодимер»). Согласно некоторым вариантам реализации в композициях и способах, описанных в настоящем документе, задействованы две популяции комплексов транспосом. Согласно некоторым вариантам реализации транспозазы в каждой популяции одинаковы. Согласно некоторым вариантам реализации комплексы транспосом в каждой популяции представляют собой гомодимеры, при этом первая популяция содержит первую адапторную последовательность в каждом мономере, а вторая популяция содержит другую адапторную последовательность в каждом мономере.
[0061] Согласно некоторым вариантам реализации указанная транспозаза представляет собой транспозазу Tn5. Согласно некоторым вариантам реализации комплекс транспозазы содержит димер транспозазы (например, транспозазы Tn5), содержащий первый и второй мономер. Каждый мономер содержит первый транспозон и второй транспозон, при этом указанный первый транспозон содержит концевую последовательность первого транспозона на 3'-конце и первую адапторную последовательность (при этом адапторные последовательности в каждом мономере димера являются одинаковыми или отличаются), а второй транспозон содержит концевую последовательность второго транспозона, по меньшей мере частично комплементарную концевой последовательности первого транспозона. Согласно некоторым вариантам реализации расщепляемого 5'-линкера первый транспозон содержит на 5'-конце расщепляемый линкер, соединенный с аффинным элементом. Согласно некоторым вариантам реализации 3'-линкера второй транспозон содержит на 3'-конце линкер (необязательно расщепляемый), соединенный с аффинным элементом. Соответственно, согласно предпочтительным вариантам реализации один транспозон из каждого мономера содержит аффинный элемент.Однако согласно некоторым вариантам реализации только один из двух мономеров включает аффинный элемент.
Адапторные последовательности
[0062] Согласно любому из вариантов реализации способа, описанного в настоящем документе, первый транспозон содержит первую адапторную последовательность. Согласно некоторым вариантам реализации вторичный адаптор добавляют к меченому фрагменту согласно описанию в настоящем документе с применением носителя вторичного адаптера, который содержит последовательность праймера и вторичную адапторную последовательность. Адапторные последовательности могут содержать одну или более функциональных последовательностей, выбранных из группы, состоящей из универсальных последовательностей, последовательностей праймеров, индексных последовательностей, последовательностей для захвата, штрихкодирующих последовательностей (используемых, например, для подсчета или коррекции ошибок), последовательностей для расщепления, связанных с секвенированием последовательностей и комбинаций перечисленного. Согласно некоторым вариантам реализации адапторная последовательность содержит последовательность праймера. Согласно другим вариантам реализации адапторная последовательность содержит последовательность праймера и индексная или «штрихкодирующую» последовательность. Последовательность праймера может также представлять собой универсальную последовательность. Настоящее изобретение не ограничено конкретным типом адапторных последовательностей, подходящих для применения; специалисту известны дополнительные последовательности, которые могут подходить для применения для получения библиотек и секвенирования нового поколения.
[0063] Адапторные последовательности, которые переносятся на 5'-концы фрагмента нуклеиновой кислоты при реакции тагментации (например, первая адапторная последовательность (последовательности)) могут содержать, например, универсальную последовательность. Универсальная последовательность представляет собой область последовательности нуклеотидов, общую для двух или более фрагментов нуклеиновых кислот. Необязательно, указанные два или более фрагментов нуклеиновых кислот также содержат области с различиями в последовательности. Универсальная последовательность, которая может присутствовать в разных фрагментах из множества фрагментов нуклеиновых кислот, может обеспечивать репликацию или амплификацию нескольких разных последовательностей при применении одного универсального праймера, комплементарного указанной универсальной последовательности.
[0064] Согласно некоторым вариантам реализации в композициях и способах, описанных в настоящем документе, задействованы две популяции комплексов транспосом. Согласно некоторым вариантам реализации каждая популяция содержит адапторную последовательность с отличающейся последовательностью праймера. Согласно некоторым вариантам реализации первая популяция содержит последовательность праймера А14, а вторая популяция содержит последовательность праймера В15.
Аффинный элемент и партнер для аффинного связывания
[0065] Аффинный элемент в настоящем документе представляет собой фрагмент, который может быть использован для ковалентного или нековалентного связывания с партнером для аффинного связывания. Согласно некоторым аспектам указанный аффинный элемент расположен на комплексе транспосомы, а партнер для аффинного связывания расположен на твердой подложке.
[0066] Согласно некоторым вариантам реализации указанный аффинный элемент может связываться или связан нековалентным образом с партнером для аффинного связывания на твердой подложке, с нековалентным присоединением таким образом указанного комплекса транспосомы к твердой подложке. Согласно таким вариантам реализации аффинный элемент содержит или представляет собой, например, биотин, а партнер для аффинного связывания содержит или представляет собой авидин или стрептавидин. Согласно другим вариантам реализации указанная комбинация аффинного элемента/партнера для связывания содержит или представляет собой ФИТЦ/анти-ФИТЦ, дигоксигенин/ антитело к дигоксигенину, или гаптен/антитело. Дополнительные подходящие аффинные пары включают, не ограничиваясь перечисленными, дитиобиотин-авидин, иминобиотин-авидин, биотин-авидин, дитиобиотин-сукцинилированный авидин, иминобиотин-сукцинилированный авидин, биотин-стрептавидин и биотин-сукцинилированный авидин.
[0067] Согласно некоторым вариантам реализации аффинный элемент может связываться с партнером для аффинного связывания посредством химической реакции, или ковалентно путем проведения реакции с партнером для аффинного связывания на твердой подложке, с ковалентным прикреплением таким образом комплекса транспосомы к твердой подложке. Согласно некоторым аспектам указанная комбинация аффинного элемента/партнера для связывания содержит или представляет собой амин/карбоновую кислоту (например, связывающиеся посредством стандартной реакции сочетания пептидов в условиях, известных специалисту в данной области техники, например, ЭДК- или NHS-опосредованного сочетания). В результате реакции указанных двух компонентов аффинный элемент и партнер для связывания соединяются за счет амидной связи. Как вариант, аффинный элемент и партнер для связывания могут представлять собой два партнера «клик-химии» (например, азид/алкин, которые вступают в реакцию с образованием триазольной связи).
Расщепляемые линкеры
[0068] Способность расщеплять связи, соединяющие два молекулярных объекта может быть эффективным инструментом для снижения захвата нецелевых продуктов гибридизации, устраняющим возможность полногеномного нецелевого захвата при первой гибридизации. Согласно определению в настоящем документе расщепляемый линкер представляет собой молекулу с двумя функциональными концевыми группами, объединенными расщепляемой связью. Указанные две функциональные концевые группы служат для прикрепления линкера к другим фрагментам; в указанном случае расщепляемый линкер соединяет 5'-конец последовательности первого транспозона с аффинном элементе. Обзор расщепляемых линкеров, классифицируемых в соответствии с условиями их расщепления и биологическим применением, приведен в источнике: Wagner et al., Bioorg. Med. Chem. 20, 571-582 (2012), который включен в настоящий документ посредством ссылки.
[0069] Расщепляемый линкер в настоящем документе представляет собой линкер, который может быть расщеплен с помощью химических или физических способов, таких как, например, фотолиз, химическое расщепление, термальное расщепление или ферментативное расщепление. Согласно некоторым вариантам реализации указанное расщепление может осуществляться с применением биохимического, химического, ферментативного, нуклеофильного, чувствительного к восстановлению агента или других способов.
[0070] Согласно некоторым вариантам реализации расщепляемый линкер может включать нуклеотид или последовательность нуклеотидов, который(ая) может быть фрагментирован(а) различными способами. Например, расщепляемый линкер может содержать сайт расщепления рестрикционной эндонуклеазой; по меньшей мере один рибонуклеотид, расщепляемый РНКазой; аналоги нуклеотидов, расщепляемые в присутствии определенного химического агента (агентов); диольную связь, расщепляемую при обработке периодатом (например); дисульфидную группу, расщепляемую химическим восстанавливающим агентом; расщепляемый фрагмент, который может подвергаться фотохимическому расщеплению; и пептид, расщепляемый ферментом пептидазой, или другие подходящие средства. См., например, источники: патентные публикации США №2012/0208705 и №2012/0208724, и РСТ-публикацию №WO 2012/061832, каждый из которых полностью включен посредством ссылки.
[0071] Фоторасщепляемые (ФР) линкеры использовали в различных вариантах применения такие как индуцируемое фоторасщеплением очищение, конструирование белков, фотоактивация соединений и биомолекул а также мечение фоторасщепляемыми массовыми метками для мультиплексных анализов. ФР-линкеры могут содержать фотолабильную функциональную группу, расщепляемую УФ-светом со специфической длиной волны (300-350 нм). ФР-линкер может включать, например, 10-атомную единицу, которая может быть расщеплена при воздействии УФ-света в подходящем спектральном диапазоне. Такие фоторасщепляемые линкеры и фосфорамидитные реагенты коммерчески доступны от Integrated DNA Technologies (IDT)), Ambergen и Glen Research. Применение композиций фоторасщепляемых нуклеотидов подробно описано в патентах США №7057031, №7547530, №7897737, №7964352 и №8361727, которые включены в настоящий документ полностью посредством ссылки.
[0072] Согласно некоторым вариантам реализации расщепление ферментативно опосредовано за счет включения расщепляемого нуклеотида или нуклеооснования в расщепляемый линкер. Примеры таких фрагментов из нуклеооснований или нуклеотидов включают, не ограничиваясь перечисленными, урацил, уридин, 8-оксо-гуанин, ксантин, гипоксантин, 5,6-дигидроурацил, 5-метилцитозин, тиминовый димер, 7-метилгуанозин, 8-оксо-дезоксигуанозин, ксантозин, инозин, дезоксиинозин, дигидроуридин, бромдезоксиуридин, уридин, 5-метилцитидин, дезоксиуридин, 5,6-дигидрокситимин, тимингликоль, 5-гидрокси-5-метилгидантоин, урацилгликоль, 6-гидрокси-5,6-дигидротимин, метилтартронилмочевину (1,2) или сайт, лишенный азотистых оснований.
[0073] Согласно некоторым вариантам реализации указанный расщепляемый линкер включает достаточное количество расщепляемых нуклеотидов, чтобы обеспечивать полное расщепление. Согласно некоторым вариантам реализации указанный линкер включает от 1 до 10 расщепляемых нуклеотидов. Согласно некоторым вариантам реализации указанный расщепляемый линкер включает по меньшей мере один расщепляемый нуклеотид. Согласно некоторым вариантам реализации указанный линкер включает по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 расщепляемых нуклеотидов. Согласно предпочтительному варианту реализации указанный расщепляемый линкер содержит один или более урациловых нуклеотидов и, необязательно, другие стандартные основания ДНК. Согласно некоторым вариантам реализации в ходе дополнительного ферментативного этапа после ПЦР расщепляет указанный расщепляемый линкер по расщепляемому положению нуклеотида или нуклеозида. Примеры таких ферментов включают, не ограничиваясь перечисленными, урацил-ДНК-гликозилазу (UDG, также называемую урацил-N-гликозилазой, или UNG), формамидопиримидин-ДНК-гликозилазу (Fpg), РНКазу Н, эндонуклеазу III (Endo III), Endo IV, Endo V, Endo VIII, фермент Кленова или апиразу. Согласно некоторым вариантам реализации используют смесь ферментов, содержащую фермент, который расщепляет урациловые основания в нуклеиновых кислотах, и АП-нуклеазу. Эффективная концентрация ферментов может варьировать от 0,025 Ед/мкл до 10 Ед/мкл. Согласно предпочтительному варианту реализации указанная смесь ферментов представлена урацил-ДНК-гликозилазой и Endo IV. Коммерческие смеси ферментов для применения в способах, описанных в настоящем документе, включают UDEM (Epicentre Biotechnologies). Согласно еще одному варианту реализации указанная смесь ферментов представлена урацил-ДНК-гликозилазой и Endo VIII, коммерчески доступными под наименованиями USER (New England Biolabs) или Uracil Cleavage System (Sigma Aldrich). При расщеплении 5' аффинный элемент (например, фрагмент биотина) остается на коротком олигонуклеотиде, который может быть удален различными способами, известными специалисту, например, при очищении нуклеиновой кислоты, таком как извлечение целевых нуклеиновых кислот с применением методологии на основе гранул, когда олигонуклеотиды небольших размеров остаются незахвачеиными. При указанном расщеплении разрывается связь между аффинным элементом (например, биотином) и 5'-меченым целевым фрагментом. Согласно предпочтительным вариантам реализации указанные расщепляемые линкеры смежны с 5'-концом концевой последовательности транспозона дуплексного транспозона и присоединены к нему. Согласно некоторым вариантам реализации указанный расщепляемый линкер соединен с биотином. Согласно другим вариантам реализации биотин закреплен на покрытой стрептавидином грануле.
Комплексы транспосом и транспозоны с 3'-линкерами
[0074] Согласно другим аспектам линкер соединен с 3'-концом второго транспозона, причем указанный линкер способен соединять указанный второй транспозон с твердой подложкой. В тех случаях, когда указанные первый и второй транспозоны являются частью комплекса транспосомы, линкер служит для соединения указанного комплекса с твердой подложкой. Согласно таким аспектам первый конец указанного линкера присоединен к 3'-концу указанного второго транспозона, а второй конец указанного линкера присоединен к аффинному элементу. Указанный аффинный элемент способен к связыванию (ковалентному или нековалентному) с партнером для аффинного связывания на твердой подложке. Согласно некоторым аспектам указанный аффинный элемент связывают (ковалентно или нековалентно) с партнером для аффинного связывания на твердой подложке, с получением связанного с твердой подложкой комплекса транспосомы. Согласно некоторым аспектам указанный линкер представляет собой расщепляемый линкер. Указанные комплексы представляют собой комплексы транспосом с 3'-линкерами и связанные с подложкой комплексы транспосом с 3'-линкерами. Согласно некоторым вариантам реализации указанный аффинный элемент представляет собой биотин, а партнер для аффинного связывания представляет собой стрептавидин.
[0075] Согласно одному варианту реализации указанный линкер ковалентно присоединен к 3'-концу указанного второго транспозона. Согласно некоторым вариантам реализации указанный линкер ковалентно присоединен к 3'-концу концевой последовательности второго транспозона. Например, линкер, описанный в настоящем документе, может быть ковалентно и прямо прикреплен к 3'-концу гидроксильной группы указанного второго транспозона, с образованием, соответственно, -О-связи, или может быть ковалентно присоединен посредством другой группы, такой как фосфат или сложный эфир. Как вариант, описанный в настоящем документе линкер может быть ковалентно присоединен к фосфатной группе указанного второго транспозона или концевой последовательность второго транспозона, например, ковалентно присоединенные к 3'-гидроксилу посредством фосфатной группы, с образованием, соответственно, -O-Р(O)3-связи.
[0076] Согласно некоторым вариантам реализации указанный комплекс транспосомы описанные в настоящем документе иммобилизуют на твердой подложке посредством линкера. Согласно некоторым таким вариантам реализации аффинный элемент представляет собой биотин, а твердая подложка содержит стрептавидин. Согласно некоторым дополнительным вариантам реализации указанная твердая подложка содержит или представляет собой гранулу. Согласно одному варианту реализации указанная гранула представляет собой парамагнитную гранулу.
[0077] Согласно некоторым вариантам реализации указанный линкер и аффинный элемент имеют структуру формулы (I):

где:
АЭ представляет собой аффинный элемент;
Y представляет собой алкилен С2-6;
X1 представляет собой О, NR1 или S;
где R1 представляет собой Н или алкил C1-10;
n представляет собой целое число из группы, состоящей из 1, 2, 3, 4, 5 и 6;
X2 представляет собой О, СH2 или S;
Ra представляет собой Н или -ОН; и
Z отсутствует, если Ra представляет собой Н, или представляет собой CH2, если Raпредставляет собой Н или ОН;
при этом символом

[0078] Согласно некоторым вариантам реализации формулы (I) АЭ представляет собой необязательно замещенный биотин или аминогруппу. Согласно другим вариантам реализации АЭ представляет собой необязательно замещенный биотин. Согласно таким вариантам реализации биотин необязательно замещен алкилом C1-4. Согласно другим вариантам реализации АЭ представляет собой биотин.
[0079] Согласно некоторым вариантам реализации формулы (I) Y представляет собой алкилен С2-6. Согласно другим вариантам реализации Y представляет собой алкилен С2-5. Согласно другим вариантам реализации Y представляет собой алкилен С2-4. Согласно другим вариантам реализации Y представляет собой алкилен С2-3. Согласно другим вариантам реализации Y представляет собой неразветвленный алкилен. Согласно другим вариантам реализации Y представляет собой алкилен С2. Согласно другим вариантам реализации Y представляет собой алкилен С3. Согласно другим вариантам реализации Y представляет собой алкилен С4. Согласно другим вариантам реализации Y представляет собой этилен. Согласно другим вариантам реализации Y представляет собой пропилен. Согласно другим вариантам реализации Y представляет собой бутилен.
[0080] Согласно некоторым вариантам реализации формулы (I) X1 представляет собой NR1, где R1 представляет собой Н или алкил C1-10 Согласно некоторым таким вариантам реализации R1 представляет собой Н. Согласно некоторым вариантам реализации R1 представляет собой алкил C1-3. Согласно другим вариантам реализации X1представляет собой О. Согласно другим вариантам реализации X1 представляет собой S.
[0081] Согласно некоторым вариантам реализации формулы (I) n=1. Согласно другим вариантам реализации n=2. Согласно другим вариантам реализации n=3. Согласно другим вариантам реализации n=4.
[0082] Согласно некоторым вариантам реализации формулы (I) X2 представляет собой СH2. Согласно некоторым другим вариантам реализации, X2 представляет собой О. Согласно другим вариантам реализации X2 представляет собой S.
[0083] Согласно некоторым вариантам реализации формулы (I) Ra представляет собой Н. Согласно другим вариантам реализации Ra представляет собой ОН.
[0084] Согласно некоторым вариантам реализации формулы (I) Z отсутствует, и Ra представляет собой Н. Согласно некоторым вариантам реализации Z представляет собой СH2, и Ra представляет собой Н. Согласно некоторым вариантам реализации Z представляет собой СH2, и Ra представляет собой ОН.
[0085] Согласно некоторым вариантам реализации указанный линкер и аффинный элемент имеют структуру формулы (1'):

где АЭ, Y, X1, n, X2 определены согласно описанию в настоящем документе для формулы (I), a Z отсутствует или представляет собой СH2.
[0086] Согласно некоторым вариантам реализации указанный линкер и аффинный элемент имеют структуру формулы (Iа):
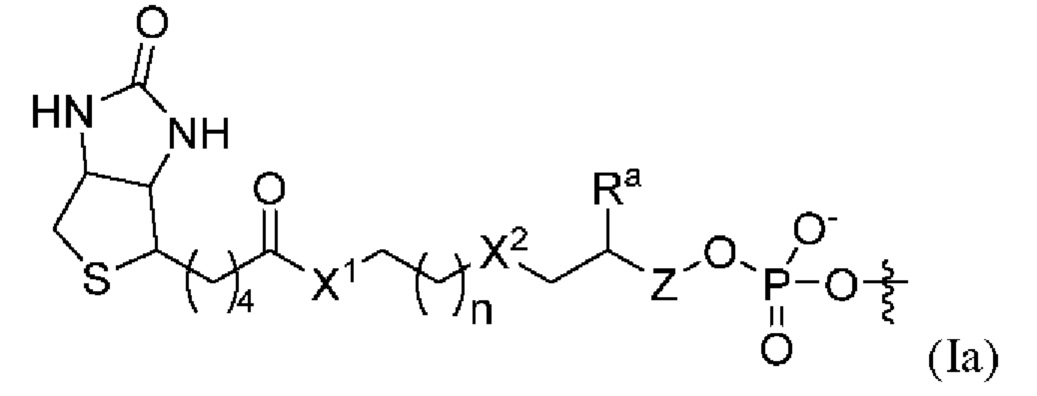
отличающийся тем, что X1, n, X2, Ra и Z определены согласно описанию в настоящем документе для формулы (I). Согласно некоторым вариантам реализации Ra представляет собой Н.
[0087] Согласно некоторым вариантам реализации указанный линкер и аффинный элемент имеют структуру формулы (Ib):

где АЭ соответствует определению для формулы (I) в настоящем документе; и n=1 или 2.
[0088] Согласно некоторым аспектам формулы (Ib) АЭ необязательно замещен биотином или аминогруппой. Согласно некоторым вариантам реализации АЭ представляет собой биотин.
[0089] Согласно некоторым вариантам реализации указанный линкер и аффинный элемент имеют структуру формулы (Iс):

где АЭ соответствует определению для формулы (I) в настоящем документе; X2представляет собой О или СH2; n=1 или 2; и Z отсутствует или представляет собой СH2.
[0090] Согласно некоторым вариантам реализации формулы (1 с), АЭ необязательно замещен биотином или аминогруппой. Согласно некоторым вариантам реализации АЭ представляет собой биотин. Согласно некоторым вариантам реализации X2представляет собой О. Согласно некоторым вариантам реализации X2 представляет собой СH2. Согласно некоторым вариантам реализации n=1. Согласно некоторым вариантам реализации n=2. Согласно некоторым вариантам реализации Z отсутствует. Согласно некоторым вариантам реализации Z представляет собой СH2. Согласно некоторым вариантам реализации n=1, X2 представляет собой О, и Z отсутствует. Согласно некоторым вариантам реализации n=1, X2 представляет собой СH2, a Z представляет собой СH2.
[0091] Согласно некоторым вариантам реализации указанный линкер и аффинный элемент имеют структуру, выбранную из группы, состоящей из:
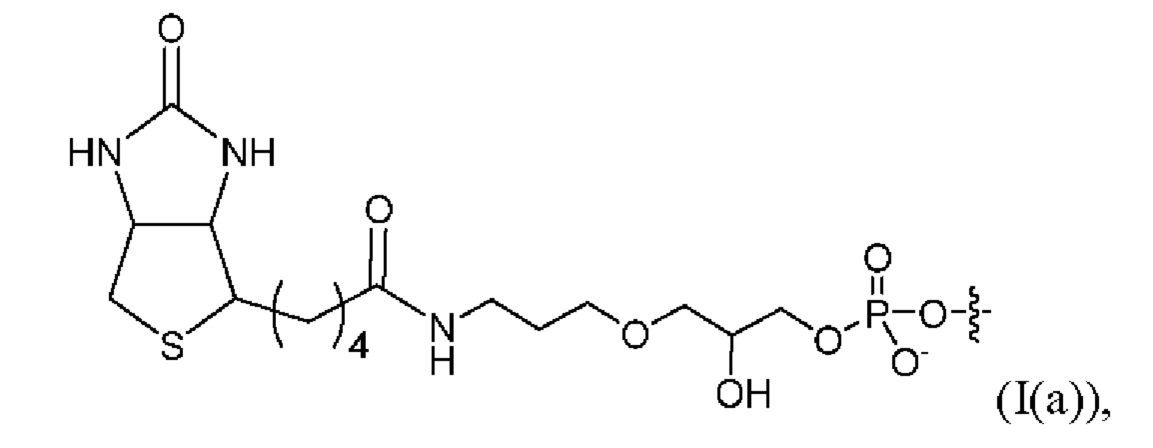
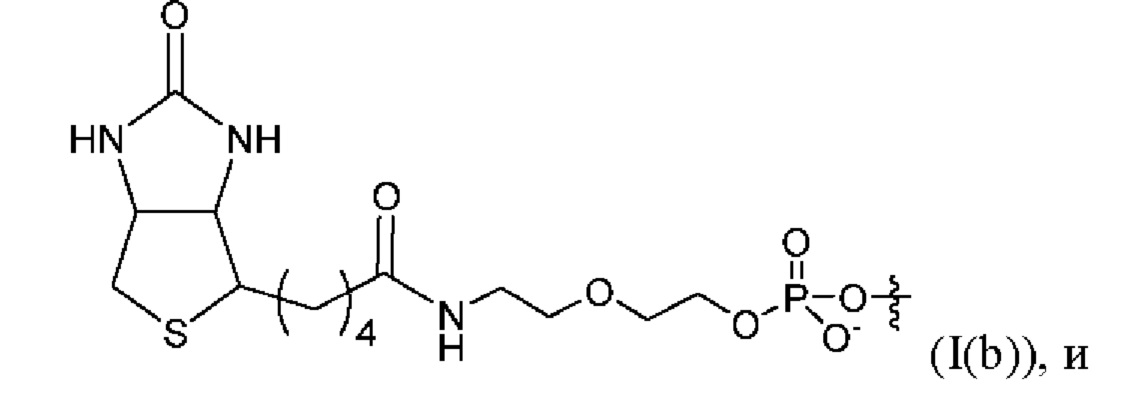
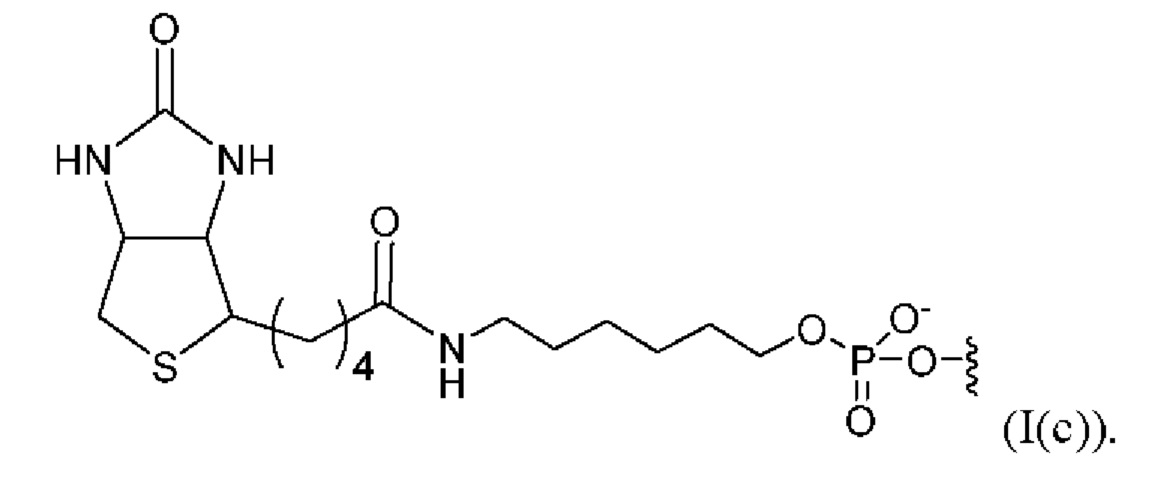
[0092] Согласно некоторым вариантам реализации указанный линкер и аффинный элемент имеют структуру (I(c)).
[0093] Согласно некоторым вариантам реализации указанная адапторная последовательность содержит последовательность праймера. Согласно некоторым вариантам реализации указанный последовательность праймера представляет собой последовательность праймера А14 или В15. Согласно некоторым вариантам реализации указанный последовательность праймера представляет собой последовательность праймера Р5 или последовательность праймера Р7. Согласно некоторым вариантам реализации указанная транспозаза представляет собой димер, каждый мономер связан с дуплексным транспозоном адапторной последовательностью согласно описанию в настоящем документе, при этом адапторная последовательность в каждом мономере одинакова. Согласно вариантам реализации, в которых транспозаза представляет собой димер, один или оба мономера включают линкер, соединяющий комплекс транспосомы с твердой подложкой. Каждый мономер включает первый транспозон с адапторной последовательностью.
Твердая подложка
[0094] Термины «твердая поверхность», «твердая подложка» и другие грамматические эквиваленты относятся к любому материалу, подходящему или модифицируемому таким образом, чтобы подходить для прикрепления комплексов транспосом. Как будет понятно специалистам в данной области техники, существуют многочисленные возможные субстраты. Возможные субстраты включают, не ограничиваясь перечисленными, стекло и модифицированное или функционализированное стекло, пластики (в том числе акрилы, полистиролы и сополимеры стирола и других материалов, полипропилен, полиэтилен, полибутилен, полиуретаны, тефлон и т.п.), полисахариды, нейлон или нитроцеллюлозу, керамику, смолы, кремнезем или материалы на основе кремнезема, включая кремний и модифицированный кремний, углерод, металлы, неорганическое стекло, пластики, оптоволоконные световоды, гранулы, парамагнитные гранулы и множество других полимеров.
[0095] Согласно некоторым таким вариантам реализации комплекс транспосомы иммобилизуют на твердой подложке с помощью линкера согласно описанию в настоящем документе. Согласно некоторым дополнительным вариантам реализации указанная твердая подложка содержит или представляет собой пробирку, лунку планшета, предметное стекло, гранулу или проточную ячейку, или их комбинацию. Согласно некоторым дополнительным вариантам реализации указанная твердая подложка содержит или представляет собой гранулу. Согласно одному варианту реализации указанная гранула представляет собой парамагнитную гранулу.
[0096] В способах и композициях, представленных в настоящем документе, комплексы транспосом иммобилизуют на твердой подложке. Согласно одному варианту реализации указанная твердая подложка представляет собой гранулу. Подходящие композиции для гранул включают, не ограничиваясь перечисленными, пластики, керамику, стекло, полистирол, метилстирол, акриловые полимеры, парамагнитные материалы, ториевый золь, угольный графит, диоксид титана, латекс или перекрестно-сшитые декстраны, такие как сефароза, целлюлоза, нейлон, перекрестно-сшитые мицеллы и тефлон, а также любые другие материалы для твердых подложек, перечисленные в настоящем документе. Согласно некоторым вариантам реализации микросферы представляют собой магнитные микросферы или гранулы, например, парамагнитные частицы, сферы или гранулы. Гранулы не обязательно должны быть сферическими; могут быть использованы частицы неправильной формы. Согласно альтернативным или дополнительным вариантам указанные гранулы могут быть пористыми. Размеры гранул варьируют от нанометров, например, 100 нм, до миллиметров, например, 1 мм, при этом предпочтительными являются размеры гранул от приблизительно 0,2 мкм до приблизительно 200 мкм; особенно предпочтительными являются размеры от приблизительно 0,5 до приблизительно 5 мкм, хотя согласно некоторым вариантам реализации могут применяться гранулы меньшего или большего размера. На гранулу может быть нанесено покрытие с партнером для аффинного связывания, например, указанная гранула может быть покрыта стрептавидином. Согласно некоторым вариантам реализации указанные гранулы представляют собой покрытые стрептавидином парамагнитные гранулы, например, гранулы Dynabeads MyOne Streptavidin C1 (Thermo Scientific, кат. №65601), частицы Streptavidin MagneSphere Paramagnetic Particles (Promega, кат. №Z5481), гранулы Streptavidin Magnetic Beads (NEB, кат. №S1420S) и MaxBead Streptavidin (Abnova, кат. №U0087). Твердая подложка может также представлять собой предметное стекло, например, проточную ячейку или другой слайд, модифицированный таким образом, чтобы на нем можно было иммобилизовать комплекс транспосомы.
[0097] Согласно некоторым вариантам реализации плотность партнера для аффинного связывания на твердой подложке или грануле составляет от 1000 до приблизительно 6000 пмоль/мг, или от приблизительно 2000 до приблизительно 5000 пмоль/мг, или от приблизительно 3000 до приблизительно 5000 пмоль/мг, или от приблизительно 3500 до приблизительно 4500 пмоль/мг.
[0098] Согласно одному варианту реализации указанная твердая поверхность представляет собой внутреннюю поверхность пробирки для образца. Согласно одному примеру указанная пробирка для образца представляет собой пробирку для ПЦР. Согласно другому варианту реализации указанная твердая поверхность представляет собой мембрану для захвата. Согласно одному примеру указанная мембрана для захвата представляет собой мембрану для захвата с биотином (например, доступную от Promega Corporation). Согласно другому примеру указанная мембрана для захвата представляет собой фильтровальную бумагу. Согласно некоторым вариантам реализации настоящего изобретения твердые подложки состояли из инертного субстрата или матрицы (например, стеклянных слайдов, полимерных гранул и т.п.), который(ая) был(а) функционализирован(а), например, путем нанесения слоя или покрытия из промежуточного материала, содержащего реакционноспособные группы, которые позволяют осуществить ковалентное прикрепление к таким молекулам, как полинуклеотиды. Примеры таких подложек включают, не ограничиваясь перечисленными, полиакриламидные гидрогели на подложке из инертного субстрата, такого как стекло, в частности, полиакриламидные гидрогели согласно описанию в WO 2005/065814 и US 2008/0280773, содержание которых включено в настоящий документ полностью посредством ссылки. Способы тагментации (фрагментации и мечения) ДНК на твердой поверхности для конструирования тагментированной библиотеки ДНК описан в WO 2016/189331 и US 2014/0093916 A1, которые включены в настоящий документ полностью посредством ссылки.
[0099] Некоторые дополнительные варианты реализации настоящего изобретения относятся к твердой подложке, содержащие иммобилизованный на ней комплекс транспосомы согласно описанию в настоящем документе, где линкер и аффинный элемент имеют структуру формулы (I), (I'), (Ia), (Ib), (Ic), (I(a)), (I(b)) или (I(c)) согласно описанию в настоящем документе. Согласно некоторым вариантам реализации комплекс транспосомы, описанный в настоящем документе, иммобилизуют на твердой подложке с помощью аффинного элемента. Согласно некоторым таким вариантам реализации твердая подложка содержит стрептавидин в качестве партнера для аффинного связывания, а аффинный элемент представляет собой биотин. Согласно некоторым дополнительным вариантам реализации указанная твердая подложка содержит или представляет собой гранулу. Согласно одному варианту реализации указанная гранула представляет собой парамагнитную гранулу.
[0100] Согласно некоторым вариантам реализации комплексы транспосом иммобилизуют на твердой подложке, такой как гранула, с конкретной плотностью или конкретным диапазоном плотности. Плотность комплексов на гранулах в настоящем документе относится к концентрации комплексов транспосом в растворе во время реакции иммобилизации. Плотность комплекса предполагает, что указанная реакция иммобилизации является количественно оцениваемой. После того как произошло образование комплексов с конкретной плотностью, указанная плотность остается постоянной для данной партии связанных с поверхностью комплексов транспосом. Полученные гранулы могут быть разбавлены, и итоговая концентрация комплексов в разбавленном растворе представляет собой полученную плотность гранул, разделенную на коэффициент разбавления. Разбавленные основные растворы гранул при приготовлении сохраняют указанную плотность комплексов, однако в разбавленном растворе указанные комплексы присутствуют в более низкой концентрации. На этапе разбавления плотность комплексов на гранулах не изменяется; таким образом, разбавление оказывает влияние на выход библиотеки, но не на размер инсерций (фрагментов). Согласно некоторым вариантам реализации указанная плотность составляет от приблизительно 5 нМ до приблизительно 1000 нМ, или от приблизительно 5 до 150 нМ, или от приблизительно 10 нМ до 800 нМ. Согласно другим вариантам реализации указанная плотность составляет приблизительно 10 нМ, или приблизительно 25 нМ, или приблизительно 50 нМ, или приблизительно 100 нМ, или приблизительно 200 нМ, или приблизительно 300 нМ, или приблизительно 400 нМ, или приблизительно 500 нМ, или приблизительно 600 нМ, или приблизительно 700 нМ, или приблизительно 800 нМ, или приблизительно 900 нМ, или приблизительно 1000 нМ. Согласно некоторым вариантам реализации указанная плотность составляет приблизительно 100 нМ. Согласно некоторым вариантам реализации указанная плотность составляет приблизительно 300 нМ. Согласно некоторым вариантам реализации указанная плотность составляет приблизительно 600 нМ. Согласно некоторым вариантам реализации указанная плотность составляет приблизительно 800 нМ. Согласно некоторым вариантам реализации указанная плотность составляет приблизительно 100 нМ. Согласно некоторым вариантам реализации указанная плотность составляет приблизительно 1000 нМ.
[0101] Согласно некоторым вариантам реализации указанная твердая подложка представляет собой гранулу или парамагнитную гранулу, и с каждой гранулой связано более 10000, 20000, 30000, 40000, 50000 или 60000 комплексов транспосом.
[0102] Разные плотности связанных с твердой подложкой комплексов транспосом дают фрагменты разной длины (например, разные размеры инсерций). Например, как показано на фиг. 7А, 7В и 7С, варьирующая плотность комплекса приводит к варьирующим размерам инсерций. Размеры инсерций могут составлять от приблизительно 50 п.о. до приблизительно 1000 п.о., или от приблизительно 100 до приблизительно 600 п.о., или от приблизительно 175 до приблизительно 200 п.о., или приблизительно 500 п.о.
Способы получения модифицированных олигонуклеотидов и комплексов иммобилизованных транспосом
[0103] Согласно настоящему изобретению также предложены способы получения модифицированных олигонуклеотидов, комплексов транспосом и связанных с твердой подложкой комплексов транспосом согласно описанию в настоящем документе. Согласно некоторым аспектам такие способы включают обработку транспозазы первым и вторым транспозонами согласно описанию в настоящем документе в условиях, подходящих для образования указанного комплекса. Способы получения связанного с твердой подложкой комплекса транспосомы включают инкубацию комплекса транспосомы согласно описанию в настоящем документе с твердой подложкой, содержащей партнер для аффинного связывания, в условиях, достаточных для того, чтобы аффинный элемент связался (ковалентно или нековалентно) с указанным партнером для аффинного связывания.
[0104] Согласно некоторым вариантам реализации предложен способ получения модифицированных олигонуклеотидов. Некоторые аспекты способов получения модифицированных олигонуклеотидов с линкером, соединенным с аффинным элементом, известны в данной области техники. Определенные способы, предусмотренные настоящим изобретением в настоящем документе включают проведение реакции линкерного реагента (или расщепляемого линкерного реагента), содержащего первую реакционноспособную функциональную группу (L-FG1), с нуклеотидом, содержащим вторую реакционноспособную функциональную группу (N-FG2), где первая и вторая реакционноспособные функциональные группы вступают в реакцию с образованием продукта линкер-нуклеотид с ковалентной связью (КС) между линкером и нуклеотидом (L-(КC)-N). Согласно некоторым вариантам реализации указанный линкер реагент включает АЭ-фрагмент (АЭ-Линкер-FG1). Согласно другим вариантам реализации указанный линкерный реагент содержит часть структуры указанного линкера, а АЭ размещают с помощью второй реакции сочетания с получением полной структуры АЭ-линкер.
[0105] Первая реакционноспособная функциональная группа может представлять собой, например, карбоксил, активированный карбоксил (такой как сложный эфир, сложный NHS-эфир, ацилгалид, ангидрид или т.п.), азидо, алкин, формил или амино. Согласно некоторым вариантам реализации указанная первая реакционноспособная функциональная группа представляет собой активированный карбоксил, предпочтительно сложный NHS-эфир.
[0106] Вторая реакционноспособная функциональная группа может находиться в любом подходящем положении на нуклеотиде. Согласно некоторым вариантам реализации указанная вторая реакционноспособная функциональная группа находится в положении 3' гидроксила или положении 5' фосфата нуклеотида, либо вместо естественного заместителя, либо дополнительно посредством связывающей группы, такой как алкиленовая или гетероалкиленовая группа, или фосфатная группа в случае гидроксила нуклеотида. Согласно некоторым вариантам реализации указанная вторая реакционноспособная функциональная группа содержит С2-10-алкиламиногруппу. Согласно некоторым вариантам реализации указанная вторая реакционноспособная функциональная группа содержит гексиламиногруппу. Согласно некоторым вариантам реализации указанная вторая реакционноспособная функциональная группа представляет собой OP(O)3-(CH2)6-NH2. Согласно некоторым вариантам реализации указанная вторая реакционноспособная функциональная группа соединена с нуклеотидом через 3'-гидроксил указанного нуклеотида посредством фосфатной связывающей группы.
[0107] Указанный модифицированный нуклеотид может представлять собой часть олигонуклеотида до прикрепления линкера, в этом случае указанный нуклеотид может находиться, например, на 3'-конце или 5'-конце указанного олигонуклеотида. Как вариант, сначала к нуклеотиду присоединяют линкер, и модифицированный нуклеотид используют в качестве стартового материала для синтеза олигонуклеотида стандартными способами.
[0108] Согласно некоторым вариантам реализации линкер формулы (I) соединен с 3'положением нуклеотида, таким как цитидин. Согласно некоторым вариантам реализации указанный способ получения модифицированного нуклеотида включает проведение реакции соединения формулы (II) с соединением формулы (III):
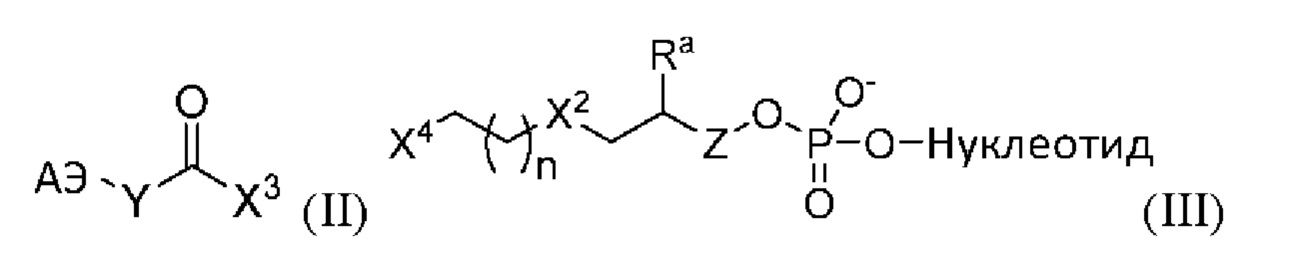
где АЭ, Y, n, X2, Ra и Z соответствуют определению в настоящем документе;
-С(O)Х3 представляет собой активированный сложный эфир, такой как сложный эфир, ацилгалид, ангидрид сложного эфира или сложный NHS-эфир; и
X4 представляет собой группу -ОН или -NH2;
с образованием соединения [формула (I)]-нуклеотид.
[0109] Согласно некоторым вариантам реализации соединение формулы (II) представляет собой AЭ-(CH2)4C(O)-O-NHS, а соединение формулы (III) представляет собой Н2N(CH2)6-ОР(O)(O-)O-нуклеотид, и продукт представляет собой АЭ-(СН2)4С(O)-NH-(CH2)6-OP(O)(O-)O-нуклеотид. Согласно некоторым вариантам реализации фосфат присоединен к 3'гидроксильной группе нуклеотида, такой как цитидин. Согласно некоторым вариантам реализации соединение [формула (I)]-нуклеотид (или АЭ-(CH2)4С(O)-NН-(CH2)6-ОР(O)(O-)O-нуклеотид) вступает в реакцию с дополнительными нуклеотидами с образованием [формулы (I)]-олигонуклеотида (или AЭ-(CH2)4C(O)-NH-(CH2)6-ОР(O)(O-)O-олигонуклеотида). Согласно некоторым вариантам реализации второй транспозон представляет собой [формулу (I)]-олигонуклеотид (или AЭ-(CH2)4C(O)-NH-(CH2)6-ОР(O)(O-)O-олигонуклеотид).
[0110] Настоящее изобретение также относится к способам получения комплексом транспосом с применением модифицированных олигонуклеотидов, описанных в настоящем документе. Такие способы включают смешивание транспозазы, первого транспозона и второго транспозона согласно определениям в настоящем документе, отличающееся тем, что первый и второй концевые последовательности транспозона аннелируют друг с другом с образованием комплекса транспосомы. Согласно описанию в настоящем документе один из указанных первого и второго транспозонов содержит аффинный элемент (на 5'-конце в случае первого транспозона; на 3'-конце в случае второго транспозона). Согласно некоторым вариантам реализации указанный способ дополнительно включает связывание аффинного элемента с твердой подложкой, содержащей партнер для аффинного связывания. Указанное связывание может быть выполнено до или после образования комплекса транспосомы.
Получение фрагментов для секвенирования - Амплификация меченых фрагментов
[0111] Согласно некоторым аспектам предложены способы получения фрагментов для секвенирования из целевой нуклеиновой кислоты, при этом указанный способ включает получение твердой подложки, содержащей иммобилизованный на ней согласно описанию в настоящем документе комплекс транспосомы, описанный в настоящем документе; приведение твердой подложки в контакт с целевой нуклеиновой кислотой в условиях фрагментации целевой нуклеиновой кислоты и лигирования первого транспозона с 5'-концом указанных фрагментов, за счет чего происходит иммобилизация указанного фрагмента на твердой подложке. Согласно некоторым аспектам указанный способ дополнительно включает амплификацию фрагментированных нуклеиновых кислот. Согласно определенному варианту реализации условие фрагментации представляет собой условие, подходящее для тагментации с применением комплекса транспосомы, для фрагментации и мечения целевой нуклеиновой кислоты.
[0112] Согласно некоторым вариантам реализации способов, описанных в настоящем документе, указанные способы дополнительно включают удаление, после фрагментации и мечения, транспозазы с 5'-меченых целевых фрагментов для получения не входящих в комплекс 5'-меченых целевых фрагментов. Удаление транспозазы может осуществляться в химических условиях, таких как обработка денатурирующим агентом, таким как додецилсульфат натрия (ДСН). Такие способы могут дополнительно включать получение полностью дуплексных вариантов из 5'-меченых целевых фрагментов. Получение полного дуплекса может включать удаление аннелированного (но не лигированного) второго транспозона (АЭ-линкер-второй транспозон) из 5'-меченых целевых фрагментов и удлинение 5'-меченых целевых фрагментов с получением полностью дуплексных 5'-меченых целевых фрагментов. Получение может осуществляться, например, путем нагревания не входящих в комплекс 5'-меченых целевых фрагментов до температуры, достаточной для селективной денатурации второго транспозона, тогда как остальную дуплексную область фрагмента оставляют интактной. Удлинение может осуществляться в присутствии dNTP и подходящей полимеразы. Как вариант, получение может осуществляться в ходе одной реакции путем инкубации не входящих в комплекс 5'-меченых целевых фрагментов в присутствии одиночных нуклеотидов (dNTP) и полимеразы. Согласно некоторым вариантам реализации инкубация включает нагревание при одной или более температурах, достаточных для денатурации аннелированного второго транспозона и удлинения остальных дуплексов. Согласно другим вариантам реализации указанная полимераза представляет собой полимеразу для вытеснения цепей, которая служит для удаления второго транспозона и удлинения остального дуплекса с получением полностью дуплексных 5'-меченых целевых фрагментов. Подходящие полимеразы включают KAPA HiFi, Pfu и аналогичные ферменты. Подходящие полимеразы включают полимеразы для вытеснения цепей, такие как Bst, Bsu Vent, фермент Кленова и аналогичные ферменты.
[0113] Согласно некоторым аспектам указанные способы дополнительно включают амплификацию полностью дуплексных 5'-меченых целевых фрагментов. Амплификация может осуществляться любым подходящим для амплификации способом, таким как полимеразная цепная реакция (ПЦР), амплификация по типу катящегося кольца (RCA) или амплификация с множественным вытеснением цепи (MDA). Согласно некоторым вариантам реализации амплификацию осуществляют с применением ПЦР. Согласно некоторым вариантам реализации амплификацию и удлинение осуществляют в ходе одного реакционного этапа путем проведения реакции с dNTP в присутствии полимеразы.
[0114] Согласно некоторым вариантам реализации амплификация служит для добавления одной или более вторичных адапторных последовательностей к полностью дуплексным 5'-меченым целевым фрагментам с образованием фрагментов для секвенирования. Амплификацию осуществляют путем инкубации полностью дуплексного 5'-меченого целевого фрагмента, содержащего последовательность праймера на каждом конце, с носителем вторичного адаптера, одиночными нуклеотидами и полимеразой в условиях, достаточных для амплификации целевых фрагментов и инсерций носителя вторичного адаптера (или комплементарной ему последовательности), причем указанный носитель вторичного адаптера содержит последовательность, комплементарную последовательности праймера, и вторичную адапторную последовательность.
[0115] Согласно некоторым вариантам реализации указанный носитель вторичного адаптера содержит последовательность праймера, индексную последовательность, «штрихкодирующую» последовательность, метку очистки или комбинацию перечисленного. Согласно некоторым вариантам реализации указанный носитель вторичного адаптера содержит последовательность праймера. Согласно некоторым вариантам реализации указанный носитель вторичного адаптера содержит индексную последовательность. Согласно некоторым вариантам реализации указанный носитель вторичного адаптера содержит индексную последовательность и последовательность праймера.
[0116] Согласно некоторым вариантам реализации указанные полностью дуплексные 5'-меченые целевые фрагменты содержат разные последовательности праймера на каждом конце. Согласно таким вариантам реализации каждый носитель вторичного адаптера содержит последовательность, комплементарную одной из двух последовательностей праймеров. Согласно некоторым вариантам реализации два последовательности праймеров представляют собой последовательность праймера А14 и последовательность праймера В15.
[0117] Согласно некоторым вариантам реализации добавляют множество вторичных адаптеров посредством амплификации. Согласно некоторым вариантам реализации каждый из носителей вторичного адаптера содержит одну из двух последовательностей праймеров. Согласно некоторым вариантам реализации каждый из носителей вторичного адаптера содержит одну из множества индексных последовательностей. Согласно некоторым вариантам реализации указанные носители вторичного адаптера содержат вторичные адаптеры с последовательностью праймера Р5 и вторичные адаптеры с последовательностью праймера Р7.
[0118] Согласно некоторым вариантам реализации фрагменты для секвенирования наносят на проточную ячейку. Согласно некоторым вариантам реализации указанные фрагменты для секвенирования гибридизуют с комплементарными праймерами, привитыми на проточную ячейку или поверхность. Согласно некоторым вариантам реализации последовательности указанных фрагментов для секвенирования детектируют с применением секвенирования на основе микромассивов или способов секвенирования нового поколения, таких как секвенирование путем синтеза.
[0119] Праймеры Р5 и Р7 используют на поверхности коммерческих проточных ячеек, продаваемых Illumina, Inc., для секвенирования на различных платформах Illumina. Последовательности указанных праймеров описаны в патентной публикации США №2011/0059865 А1, которая включена в настоящий документ полностью посредством ссылки. Примеры праймеров Р5 и Р7, которые могут содержать терминальный алкин на 5'-конце, включают представленные ниже:

[0120] и их производные. Согласно некоторым примерам последовательность Р7 включает модифицированный гуанин в положении G*, например, 8-оксо-гуанин. Согласно другим примерам * показывает, что связь между G* и смежным 3'А представляет собой фосфотиоатную связь. Согласно некоторым примерам праймеры Р5 и/или Р7 включают не встречающиеся в природе линкеры. Необязательно, один или оба из праймеров Р5 и Р7 может или могут включать концевой поли-Т фрагмент.Указанный концевой поли-Т фрагмент обычно расположен на 5'-конце последовательности, приведенной выше, например, между 5'-основанием и концевым алкиновым элементом, однако в некоторых случаях может быть расположен на 3'конце. Последовательность поли-Т может включать любое число Т-нуклеотидов, например, от 2 до 20. Хотя в качестве примеров приведены праймеры Р5 и Р7, следует понимать, что любые подходящие праймеры для амплификации могут применяться в примерах, представленных в настоящем документе.
[0121] Согласно некоторым вариантам реализации этап амплификации указанного способа включает ПЦР или изотермическую амплификацию. Согласно некоторым вариантам реализации этап амплификации указанного способа включает ПЦР.
Краткое описание чертежей
[0122] Фиг. 1 иллюстрирует примеры этапов способа получения комплексов транспосом и их закрепления на твердой поверхности (такой как гранула) посредством аффинного элемента, присоединенного к 5'-концу первого транспозона. В указанном примере две популяции (130а и 130b) аннелированных первого и второго транспозонов (олигонуклеотидов, содержащих аннелированную двухцепочечную область, содержащую концевую последовательность транспозона и однонитевую область), при этом в каждой популяции первый транспозон включает одну из двух адапторных последовательностей и аффинный элемент (110, где * указывает на аффинный элемент), такие как биотин, на 3'конце. Например, получают множество биотинилированных первых и вторых транспозонов, содержащих две адапторные последовательности (например, последовательности праймеров, такие как А14 и В15). Как видно на фигуре, цепь дуплексной последовательности транспозона, которая будет перенесена в матричные нуклеиновые кислоты, представляет собой первый транспозон, который содержит аффинный элемент (например, биотин). На этапе 115 получают комплекс каждой популяции олигонуклеотидов (130а и 130b) с мономерами транспозазы, такой как Tn5 (135), как правило, в отдельных реакциях, с получением двух дискретных популяций комплексов транспосом (140), каждая из которых содержит отличную адапторную последовательность (например, последовательности праймеров, такие как А14 и В15). После образования двух популяций комплексов их иммобилизуют на субстрате, в указанном примере на гранулах (120). Согласно некоторым вариантам реализации указанные две популяции комбинируют до иммобилизации, получая твердую поверхность или гранулу, которая содержит комплексы из каждой популяции. Согласно другим вариантам реализации указанные две популяции иммобилизуют по отдельности, получая две твердые поверхности или гранулы, каждая из которых содержит один из двух типов комплексов. После образования транспосомного комплекса транспосомы 140 связываются с поверхностью 145, покрытой партнером для аффинного связывания, таким как стрептавидин.
[0123] На фиг. 2 приведен пример способа тагментации и получения библиотеки 200 на поверхности гранул после иммобилизации транспосомы с применением стратегии 5'-линкера, описанной в настоящем документе. Показана гранула 205 в способе 200 со связанными на ней транспосомами 140. ДНК 210 добавляют в образец гранул. При контакте ДНК 210 с транспосомами 140 указанная ДНК подвергается тагментации (фрагментации и мечению) и связывается с гранулами 205 через транспосомы 140. Связанная и тагментированная ДНК может быть ПЦР-амплифицирована с получением пула не связанных с гранулами ампликонов 215. ПЦР-этап может применяться для инсерций вторичных адапторных последовательностей, таких как последовательности праймеров (например, Р5 и Р7). Ампликоны 215 могут быть перенесены на поверхность проточной ячейки 220, например, путем прививки на поверхность или гибридизации с комплементарными праймерами на поверхности проточной ячейки. Может применяться протокол для получения кластеров (например, протокол для мостиковой амплификации или любой другой протокол амплификации, который может применяться для получения кластеров) с получением множества кластеров 225 на поверхности проточной ячейки. Кластеры представляют собой продукты клональной амплификации тагментированной ДНК. Кластеры, таким образом, готовы для применения на следующем этапе протокола секвенирования. Пример способа тагментации на поверхности гранул подробно описан в РСТ-публикации WO 2016/189331, которая включена в настоящий документ полностью посредством ссылки.
[0124] Фиг. 3 иллюстрирует проблемы, которые могут возникать при применении 5'-связанных комплексов транспосом. Этап 300 наглядно иллюстрирует способ тагментации комплексов транспосом 140, иммобилизованных на грануле 305 с геномной ДНК 315, с последующими амплификацией и целевым обогащением, включающим захват нецелевых нуклеиновых кислот. Иммобилизованная библиотека тагментированной геномной ДНК изображена под обозначением 310. Покрытые стрептавидином гранулы для захвата, содержащие на поверхности тагментированную ДНК, могут быть промыты (320) с применением промывочного буфера, содержащего, например, 5% ДСН, 100 мМ Tris-HCl с рН 7,5, 100 мМ NaCl и 0,1% Tween 20, с денатурацией и отсоединением таким образом транспозазы от комплекса транспосомы. Затем супернатант может быть удален после этапа промывания, путем магнитного захвата покрытых стрептавидином парамагнитных частиц (например, гранул), и гранулы для захвата, содержащие иммобилизованные тагментированные библиотеки, могут быть удержаны, и дополнительно промыты с применением 100 мМ Tris-HCl с рН 7,5, 100 мМ NaCl, 0,1% Tween 20. Связанные олигонуклеотиды удлиняют (330) с получением связанных дуплексов с полной комплементарностью.
[0125] На этапе 340 целевая амплификация продолжается посредством термоциклирования для амплификации тагментированной ДНК, с применением способов, известных специалисту в данной области техники. Например, раствор ПЦР-реагентов (например, смесь, содержащая, как минимум, ПЦР-буфер, дезоксинуклеотиды, дивалентный катион и ДНК-полимеразу) и добавки, необходимые для эффективной амплификации, могут быть добавлены в содержащий гранулы раствор; тагментированная ДНК, связанная с гранулой для захвата, может быть амплифицирована с помощью термоциклирования (например, 10 термических циклов): методология, известная специалисту в данной области техники. На этапе 350 амплифицированная тагментированная ДНК может быть необязательно очищена с применением, например, колонки для очищения (например, спин-колонки Zymo) и элюирована. Указанная амплифицированная тагментированная ДНК может также необязательно быть очищена с применением гранул SPRI или Ampure ХР (Beckman Coulter), способ очищения согласно настоящему изобретению не является ограничивающим.
[0126] На этапе 360 тагментированные библиотеки могут быть обогащены с применением протокола, соответствующего описанию протокола обогащения NEXTERA Rapid Capture (Illumina), или любого другого способа целевого захвата. В смеси после амплификации (370) присутствуют биотинилированные геномные фрагменты из начала полученной библиотеки, способные конкурировать с биотинилированными целевыми зондами (380), служащими в качестве полногеномных зондов для гибридизации во время целевого обогащения. Присутствие указанных биотинилированных геномных фрагментов на данной стадии может снижать эффективность обогащения. Кроме того, биотинилированные геномные фрагменты могут возникать в ходе ПЦР-амплификации при первичной обработке полимеразой и удлинении свободных биотинилированных адаптеров, не использованных в ходе реакции тагментации, с добавлением таким образом дополнительных нецелевых зондов для захвата на этапе целевого обогащения.
[0127] Согласно настоящему изобретению предложен ряд решений указанной проблемы. Согласно одному способу, описанному в настоящем документе, один или более расщепляемых линкеров включены между аффинным элементом и адапторной последовательностью первого транспозона. После того как тагментация завершена, а тагментированная нуклеиновая кислота амплифицирована, указанный расщепляемый линкер может быть расщеплен с высвобождением биотинилированной части и минимизацией или элиминацией нецелевого захвата. Указанная модификация неожиданным образом и резко снижает нецелевой захват и улучшает обогащение относительно других методик тагментации на основе гранул. Далее, аффинный элемент переносят к 3'-концу второго транспозона и присоединяют необязательно расщепляемым линкером.
[0128] На фиг. 4 наглядно проиллюстрированы этапы способа 400 фрагментации и мечения ДНК с применением комплексов транспосом, иммобилизованных на твердой поверхности посредством расщепляемого линкера. На фиг. 4 этапы 410, 420, 430, 440 и 450 соответствуют описанию для фиг. 3 (310, 320, 330, 340 и 350, соответственно), за исключением того, что биотинилированные геномные фрагменты, присутствующие в смеси после амплификации (470), содержат расщепляемый линкер (например, линкер, содержащий один или более урацилов). На этапе 460 биотин отщепляют от геномных фрагментов, расщепляя линкер с применением подходящего агента для расщепления. В примере с урацилом расщепление осуществляется расщепляющим урацил ферментом (например, Uracil DNA Excision Mix от Epicentre). В ходе этапа обогащения 480 нецелевые геномные фрагменты уже не биотинилированы и, соответственно, не захватываются как биотинилированные целевые зонды (490). Таким образом, указанный способ снижает нецелевой захват и увеличивает эффективность целевого обогащения по сравнению с 5'-связанным способом без расщепляемого линкера.
[0129] Способ тагментации на основе гранул с применением адапторных последовательностей, которые включают аффинный элемент, такой как биотин, на 5'-конце, представлен на фиг. 5А. Вкратце, аффинный элемент на 5'-конце двух типов адапторных олигонуклеотидов 501 и 502 применяют для прикрепления двух популяций транспосом к поверхности (например, одной при помощи адапторной последовательности А14, и другой при помощи адапторной последовательности В15). ME и ME' представляют собой концевые последовательности транспозона. При тагментации образуются 5'-меченые фрагменты из целевой нуклеиновой кислоты, такой как геномная ДНК. Некоторые из указанных фрагментов включают А14 на 5'-конце одной цепи и В15 на 5'-конце другой цепи фрагмента, как видно на фигуре. Фрагменты удлиняют и/или проводят реакцию путем амплификации, например, ПЦР, необязательно в присутствии носителей вторичного адаптора, для получения полных дуплексов или ампликонов, необязательно содержащих вторичные адаптеры (например, последовательности праймеров, такие как Р5 и Р7, и/или индексные последовательности, которые показаны на нижнем изображении). При использовании биотина/стрептавидина аффинные связи разрываются в ходе ПЦР, при этом ампликоны биотинилированных фрагментов остаются в растворе, что может осложнять последующее обогащение. Как вариант, на фиг. 5В место прикрепления аффинного элемента и линкера изменяют на 3'-положение на втором транспозоне. В указанном случае указанные аффинный элемент и линкер присоединены к 3'-концу комплементарной концевой последовательности транспозона 503 (ME' последовательность). В указанной конфигурации первые транспозоны 501 и 502 не включают аффинный элемент.В указанном способе при тагментации образуется немеченая фрагментированная геномная ДНК, когда в указанный фрагмент переносят первый транспозон (в котором отсутствует аффинный элемент), и аффинный элемент присоединяется исключительно ввиду гибридизации второго транспозона с первым транспозоном. Адапторные последовательности А14-МЕ, ME, В15-МЕ, ME', А14, В15 и ME приведены ниже:

Целевая нуклеиновая кислота
[0130] Целевая нуклеиновая кислота может относиться к любому типу, включая ДНК, РНК, кДНК или т.п. Например, целевая нуклеиновая кислота может находиться на различных стадиях очищения, в том числе представлять собой очищенную нуклеиновую кислоту. Однако указанная нуклеиновая кислота не обязательно должна быть очищенной полностью или очищенной вообще в какой-либо степени, и может представлять собой часть биологического образца, например, лизата сырого образца, биологической жидкости, крови, плазмы или сыворотки, или может быть иным образом смешана с белком, другими видами нуклеиновых кислот, другими клеточными компонентами и/или любыми другими загрязняющими примесями. Согласно некоторым вариантам реализации указанный биологический образец содержит смесь нуклеиновых кислот (таких как ДНК), белка, другие виды нуклеиновых кислот, другие клеточные компоненты и/или любую другую загрязняющую примесь, присутствующие в приблизительно в той же пропорции, что и in vivo. Например, согласно некоторым вариантам реализации указанные компоненты обнаруживаются в той же пропорции, что и в интактной клетке. Поскольку предложенные согласно настоящему изобретению способы позволяют обеспечить связывание нуклеиновой кислоты или ДНК с твердой подложкой путем процесса тагментации, другие загрязняющие примеси могут быть удалены путем промывания указанной твердой подложки после проведения тагментации. Указанный биологический образец может содержать, например, неочищенный клеточный лизат или целые клетки. Например, неочищенный клеточный лизат, который наносят на твердую подложку в способе, представленном в настоящем документе, не обязательно подвергать одному или более этапам разделения, традиционно используемым для выделения нуклеиновых кислот из других клеточных компонентов.
[0131] Соответственно, согласно некоторым вариантам реализации указанный биологический образец может содержать не только очищенные нуклеиновые кислоты из любого источника, но также, например, неочищенные нуклеиновые кислоты, обнаруживаемые в крови, плазме, сыворотке, лимфе, слизи, мокроте, моче, семенной жидкости, спинномозговой жидкости, бронхиальном аспирате, экскрементах и мацерированной ткани, или их лизатах, или любой другой биологический препарат, содержащий нуклеиновую кислоту или ДНК-материал. Целевая нуклеиновая кислота может происходить из образца ткани, образца опухоли, раковых клеток или образца биопсии.
[0132] Целевая нуклеиновая кислота может происходить из любого вида, или смеси видов. Например, целевая нуклеиновая кислота может происходить от млекопитающего (такого как человек, собака, кошка, корова, свинья, овца или другое одомашненное животное) или из другого вида, например, рыб, бактерий, вируса, гриба или археи. Нуклеиновая кислота может происходить из образцов окружающей среды, например, почвы или воды.
[0133] Согласно некоторым вариантам реализации целевая нуклеиновая кислота представляет собой ДНК. Согласно одному такому варианту реализации указанная ДНК является двухцепочечной. Согласно некоторым дополнительным вариантам реализации указанная двухцепочечная ДНК содержит геномную ДНК. Согласно некоторым другим вариантам реализации целевая нуклеиновая кислота представляет собой РНК или ее производное, или кДНК.
[0134] Согласно некоторым вариантам реализации биологический образец (сырой образец или экстракт) обрабатывают для очищения целевой нуклеиновой кислоты до осуществления способов тагментации, описанных в настоящем документе. Согласно некоторым вариантам реализации указанный биологический образец представляет собой сырой образец или лизат сырого образца (например, крови или слюны). Согласно некоторым вариантам реализации указанный способ обработки включает получение сырого образца, лизата сырого образца или предварительно обработанного образца (например, образца крови или слюны), смешивание указанного образца с буфером для лизиса и протеиназой K, инкубацию указанной смеси для лизиса клеток в образце и высвобождения ДНК из клеток, с получением таким образом целевой нуклеиновой кислоты или кислот для применения в способах тагментации, описанных в настоящем документе.
[0135] Компоненты сырых образцов или лизатов сырых образцов, таких как кровь, или добавки в предварительно обработанных образцах, например, слюне, собранной в пробирку для сбора образцов Oragene (агенты для стабилизации в пробирках для сбора образцов), могут ингибировать реакции тагментации. Соответственно, согласно настоящему изобретению предложен способ обработки сырого образца, лизата сырого образца или предварительно обработанного образца для решения указанной проблемы. Согласно некоторым вариантам реализации указанный способ включает получение сырого образца, лизата сырого образца или предварительно обработанного образца (например, образца крови или слюны), смешивание указанного образца с буфером для лизиса, протеиназой K и гранулами очищения ДНК (например, гранулами SPRI, гранулами, содержащими карбоксильные группы, при этом указанные необязательно представляют собой магнитные гранулы), инкубацию указанной смеси для лизиса клеток в образце и высвобождения ДНК из клеток, с захватом таким образом ДНК на гранулах для очищения ДНК или гранулах для SPRI, и отделение указанных гранул, содержащих захваченную ДНК, от смеси. Указанное отделение служит для удаления потенциальных ингибиторов тагментации, присутствующих в супернатанте. Указанный способ дополнительно включает необязательное промывание гранул, содержащих захваченную ДНК, и элюирование ДНК с гранул с получением целевой нуклеиновой кислоты или кислот.
Способы секвенирования
[0136] Некоторые из способов, предложенных согласно настоящему изобретению, включают способы анализа нуклеиновых кислот. Такие способы включают получение библиотеки матричных нуклеиновых кислот для целевой нуклеиновой кислоты, получение данных о последовательностях из библиотеки матричных нуклеиновых кислот, и сборку модельной последовательности целевой нуклеиновой кислоты. Согласно некоторым вариантам реализации способы, описанные в настоящем документе, могут применяться в процессах секвенирования нового поколения, в том числе, но не ограничиваясь указанным, при секвенировании путем синтеза (SBS). Примеры процедур SBS, струйных систем и платформ для детекции, которые могут быть легко адаптированы для применения с библиотеками нуклеиновых кислот, полученными с помощью способов согласно настоящему изобретению, описаны, например, в источниках: Bentley et al., Nature 456:53-59 (2008), WO 04/018497; US 7,057,026; WO 91/06678; WO 07/123744; US 7329492; US 7211414; US 7315019; US 7405281 и US 2008/0108082, каждый из которых включен в настоящий документ посредством ссылки.
[0137] Некоторые варианты реализации SBS включают детекцию протона, высвобождаемого при включении нуклеотида в продукт удлинения. Например, при секвенировании, основанном на детекции высвобождаемых протонов, может быть использован электрический детектор и ассоциированные с ним методики, коммерчески доступные от Ion Torrent (Гилфорд, Коннектикут, подконтрольная компания Life Technologies); или способы и системы секвенирования, описанные в источниках: US 2009/0026082 A1; US 2009/0127589 A1; US 2010/0137143 A1; или US 2010/0282617 A1, каждый из которых включен в настоящий документ посредством ссылки.
[0138] Другая полезная техника секвенирования представлена секвенированием в нанопорах (см., например, источники: Deamer et al. Trends Biotechnol. 18, 147-151 (2000); Deamer et al. Acc. Chem. Res. 35:817-825 (2002); Li et al. Nat. Mater. 2:611-615 (2003), содержание которых включено в настоящий документ посредством ссылок). Описанные в настоящем документе способы не ограничены использованием какого-либо конкретного типа инструментов для секвенирования.
ПРИМЕРЫ
[0139] Приведенные ниже примеры служат для описания, а не для ограничения объема настоящего изобретения.
Пример 1: Тагментация на твердой поверхности с применением линкера с расщепляемыми ферментативным путем нуклеотидами
[0140] Транспозоны получали путем аннелирования двух наборов олигонуклеотидов (представленных любыми из последовательностей SEQ ID NO: 9-11 (модифицированные А14-МЕ) и любыми из последовательностей SEQ ID NO: 12-14 (модифицированные В15-МЕ)), обе из которых спариваются на протяжении мозаичной концевой последовательности (ME) длиной 19 оснований (SEQ ID NO: 8, показан строчными буквами) с комплементарной мозаичной концевой последовательностью (ME'; SEQ ID NO: 5). Олигонуклеотиды, представленные в последовательностях SEQ ID NO: 9 -SEQ ID NO: 14, 5'-биотинилировали для обеспечения последующего поверхностного связывания с покрытыми стрептавидином парамагнитными гранулами. Аннелированные транспозоны получали, комбинируя 50 мкМ каждого биотинилированного олигонуклеотида с 50 мкМ ME' (SEQ ID NO: 5) в присутствии 10 мМ Tris-HCl (рН 8,0), 1 мМ ЭДТК и 25 мМ NaCl и нагревали при 95°С в течение 10 мин, охлаждая до комнатной температуры в течение 2 часов. Затем аннелированные транспозоны смешивали с ферментом транспозазой в конечной концентрации 2 мкМ и инкубировали при 37°С в течение ночи.
[0141] Примеры последовательностей расщепляемого линкера с расщепляемыми нуклеотидными фрагментами представлены последовательностями SEQ ID NO: 9-14. Указанные подписанные как SEQ ID NO: 9 14 последовательности содержат мозаичную концевую (ME) последовательность длиной 19 оснований (обозначена строчными буквами) и последовательности рида 1 и рида 2 А14 и В15 (выделены курсивом). Последовательности, подписанные как SEQ ID NO: 9 и SEQ ID NO: 12, содержат три урациловых нуклеотида (подчеркнуты) после нескольких остатков тимина (выделены жирным шрифтом). Аналогичным образом, последовательности, подписанные как SEQ ID NO: 10 и SEQ ID NO: 13, содержат три урациловых нуклеотида в 3'-направлении от нескольких остатков тимина. Последовательности SEQ ID NO: 11 и SEQ ID NO: 14 содержат один урациловый нуклеотид после нескольких остатков тимина. Как отмечено в настоящем документе, остатки тимина входят в состав указанного расщепляемого линкера, и служат для соединения биотина с расщепляемыми фрагментами, расположенными в 5'-направлении от транспозона и/или адапторных последовательностей. Согласно некоторым вариантам реализации указанный расщепляемый линкер включает 1-10 расщепляемых урациловых нуклеотидов. Согласно некоторым вариантам реализации указанный расщепляемый линкер включает по меньшей мере один расщепляемый урациловый нуклеотид. Согласно определенному варианту реализации указанный расщепляемый линкер включает 2, 3, 4, 5, 6, 7, 8, 9 или 10 расщепляемых урациловых нуклеотидов. SEQ ID NO: 8 представляет собой мозаичную концевую (ME) последовательность длиной 19 оснований, a SEQ ID NO: 5 представляет собой комплементарную ей последовательность.
SEQ ID NO: 9 (модифицированный А14-МЕ #1)

SEQ ID NO: 10 (модифицированный A14-ME #2)

SEQ ID NO: 11 (модифицированный A14-ME #3)

SEQ ID NO: 12 (модифицированный B15-ME #1)

SEQ ID NO: 13 (модифицированный B15-ME #2)

SEQ ID NO: 14 (модифицированный B15-ME #3)

[0142] После образования транспосом их закрепляли на покрытых стрептавидином гранулах. Затем гранулы промывали разбавленным раствором транспосом в буфере НТ1 (Illumina). НТ1 содержит соли в высокой концентрации, необходимой для связывания биотина со стрептавидином на гранулах. Гранулы и транспосомы инкубировали при смешивании с помощью миксера в течение 1 часа. После смешивания гранулы ресуспендировали в буфере для хранения, содержащем 15% глицерина и другие буферные агенты (например, Tris).
[0143] Затем проводили тагментацию. Например, раствор для тагментации добавляли в образец, содержащий иммобилизованные транспосомы, и инкубировали при 55°С в течение приблизительно 15 минут. Реакция тагментации включала ДНК (например, приблизительно от 50 пг до 5 мкг ДНК) и буфер для тагментации. Согласно одному примеру указанный буфер для тагментации содержит компоненты, необходимые для протекания реакции тагментации, например, представляет собой буфер, содержащий 10 мМ Tris-ацетат (рН 7,6), 5 мМ ацетат магния и 10% диметилформамида, согласно описанию в патентах США №9080211, №9085801 и №9115396, каждый из которых включен посредством ссылки. Получали иммобилизованную библиотеку меченых фрагментов ДНК.
Пример 2: ПЦР-амплификация тагментированной ДНК и ферментативное расщепление
[0144] Покрытые стрептавидином гранулы для захвата, содержащие тагментированную ДНК согласно описанию в примере 1, промывали (например, троекратно) промывочным буфером, содержащим 5% ДСН, 100 мМ Tris-HCl (рН 7,5), 100 мМ NaCl и 0,1% Tween 20, с денатурацией и отсоединением таким образом фермента транспозазы от комплекса транспосомы. После этапа промывания супернатант удаляли с помощью магнитного захвата покрытых стрептавидином парамагнитных частиц (например, гранул); гранулы, содержащие иммобилизованные тагментированные библиотеки, сохраняли и дополнительно промывали с применением 100 мМ Tris-HCl (рН 7,5), 100 мМ NaCl и 0,1% Tween 20.
[0145] Заполнение пропусков во фрагментах ДНК (для заполнения пропусков между 5'-концами последовательностей ME' и 3'-концами указанных фрагментов (см., например, фиг. 5 В) осуществляли путем добавления, например, смеси NEM (NEXTERA Rapid Capture Kit, Illumina) и инкубации при 72°С в течение 3 минут.
[0146] Проводили целевую амплификацию посредством термоциклирования для амплификации тагментированной ДНК с применением способов, известных специалисту в данной области техники. Согласно некоторым примерам к гранулам добавляли раствор реагентов для ПЦР (например, мастер-микс (например, смесь NEM (NEXTERA Rapid Capture Kit, Illumina) содержащий, как минимум, ПЦР-буфер, дезоксинуклеотиды, дивалентный катион, ДНК-полимеразу) и добавки, необходимые для эффективной амплификации; тагментированную ДНК, связанную с гранулами, амплифицировали с применением термоциклирования (например, 10 термических циклов).
[0147] Супернатант, содержащий амплифицированную тагментированную ДНК, извлекали из реакционной камеры и переносили в новую реакционную камеру (например, пробирку, лунку и т.п.). Смесь амплифицированных фрагментов обрабатывали одним или более ферментами, расщепляющими основания в расщепляемом линкере. Любой из ряда известных ферментов, разрушающих нуклеотидный остов, может применяться для расщепления нецелевых продуктов для предотвращения нецелевой гибридизации с геномом. Примеры подходящих ферментов включают, не ограничиваясь перечисленными, урацил-ДНК-гликозилазу (UDG, также называемую UNG), формамидо-пиримидин-ДНК-гликозилазу (Fpg), РНКазу Н, Endo IV, Endo VIII, фермент Кленова или апиразу.
[0148] Амплифицированную тагментированную ДНК очищали с применением гранул SPRI или Ampure ХР (Beckman Coulter), при этом способ очищения не ограничен описанными в настоящем документе. Тагментированные библиотеки могут быть обогащены с применением протокола обогащения, описанного для NEXTERA Rapid Capture (Illumina) или любого другого способа целевого захвата. После этого обогащенная библиотека ДНК готова для секвенирования.
Пример 3: Обогащение по ридам с применением ферментативного расщепления расщепляемого линкера, содержащего урацил
[0149] Вкратце, для каждого протестированного условия использовали 50 нг геномной ДНК NA12878 (Coriell Institute). В качестве контрольной реакции тагментировали ДНК, получали и обогащали библиотеки после выполнения протокола NEXTERA Rapid Capture Enrichment (Illumina) в соответствии с рекомендациями производителя. Использовали урацил-содержащие расщепляемые линкеры SEQ ID NO: 9 и SEQ ID NO: 13.
[0150] Вкратце, каждый реакционный объем 50 мкл содержал 5Х буфер для тагментации, 50 нг ДНК, 5 мкл 250 нМ конъюгированных с транспосомами парамагнитных гранул Dynal (Life Technologies) с расщепляемыми урациловыми линкерами, представленными в последовательностях SEQ ID NO: 9 и SEQ ID NO: 13. Реакцию инкубировали при 55°С в течение 15 минут с последующим добавлением 15 мкл буфера Stop Tagment Buffer (ST), а затем инкубировали при комнатной температуре в течение дополнительных 5 минут. Образцы помещали на магнит и удаляли супернатант. Гранулы ресуспендировали в 50 мкл NEM (Illumina) и инкубировали при 72°С в течение 5 минут с последующим охлаждением до 10°С. Образцы помещали на магнит, удаляли супернатант и промывали в промывочном буфере НТ2 (Illumina).
[0151] ПЦР-реакции проводили путем добавления 40 мкл ЕРМ, по 10 мкл каждого из индексных праймеров (например, Р5'-индекс-А14' и Р7'-индекс-В15') и воды. ПЦР-амплификацию выполняли следующим образом: 72°С в течение 3 минут; 98°С в течение 30 секунд с последующими 10 циклами при 98°С в течение 10 секунд; 65°С в течение 30 секунд; 72°С в течение 60 секунд. ПЦР-продукты обрабатывали 5 мкл смеси ферментов USER (1 Ед/мкл - артикульный номер NEB M5505L) и инкубировали при 37°С в течение 30 минут с последующим отбором по размеру, с применением парамагнитных гранул AMPure ХР (Beckman Coulter, кат. №А63880) на основе SPRI (твердофазной обратимой иммобилизации) в соответствии с рекомендациями производителя. Сначала 100 мкл обработанного USER ПНР-продукта смешивали с 55 мкл воды и 105 мкл парамагнитных гранул. Образец выдерживали при выключенном магнитном поле в течение 5 минут, при включенном магнитном поле в течение 5 минут, затем извлекали супернатант для второго отбора по размеру (250 мкл супернатанта + 30 мкл парамагнитных гранул). Гранулы промывали в 80% этаноле, высушивали воздухом и элюировали в 25 мкл RSB (Illumina).
[0152] Обогащение обработанных ферментами USER прошедших отбор по размерам образцов проводили с применением панели зондов TruSight One (Illumina) в соответствии с протоколом для набора NEXTERA Rapid Capture Enrichment согласно рекомендациям производителя (Illumina). Образцы секвенировали на HiSeq 2500 согласно рекомендациям производителя (Illumina).
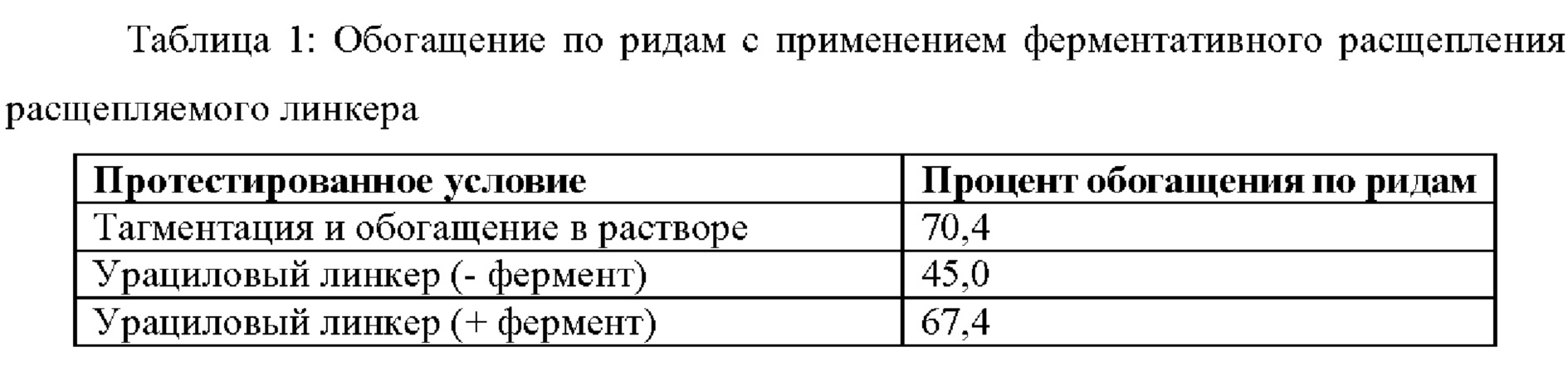
[0153] Как видно из таблицы 1, реализация тагментации и обогащения в растворе (например, NEXTERA Rapid Capture) приводила к 70% обогащению по ридам. При применении транспосом, закрепленных на гранулах урацил-содержащим линкером, но без обработки с ферментативным расщеплением, % обогащения по ридам был значимо ниже и составлял 45%. Однако при расщеплении урацилов в линкере посредством ферментативной обработки обогащение повышалось до 67%, с возвращением таким образом обогащения до уровня при тагментации и обогащения без иммобилизации, или в растворе.
Пример 4: 6-плексное и 12-плексное обогащение экзома при ферментативном расщеплении и без ферментативного расщепления урацилового линкера
[0154] В приведенном ниже примере продемонстрирован эксперимент по обогащению экзома с применением линкера из 5 тиминов (5Т) или линкера из двух тиминов и 3 урацилов (2T3U), без ферментативного расщепления и с ферментативным расщеплением (2T3U+ENZ), со сравнением с набором TruSeq Rapid Exome Kit (Illumina).
[0155] Экспериментальная процедура соответствовала описанию в примере 3 за исключением того, что использовали 7,5 мкл гранул с иммобилизованными транспосомами и исключали этап заполнения пропусков. Обогащение выполняли с применением набора TruSeq Rapid Exome Kit (Illumina). Секвенирование выполняли на HiSeq 2500 в соответствии с рекомендациями производителя (Illumina).

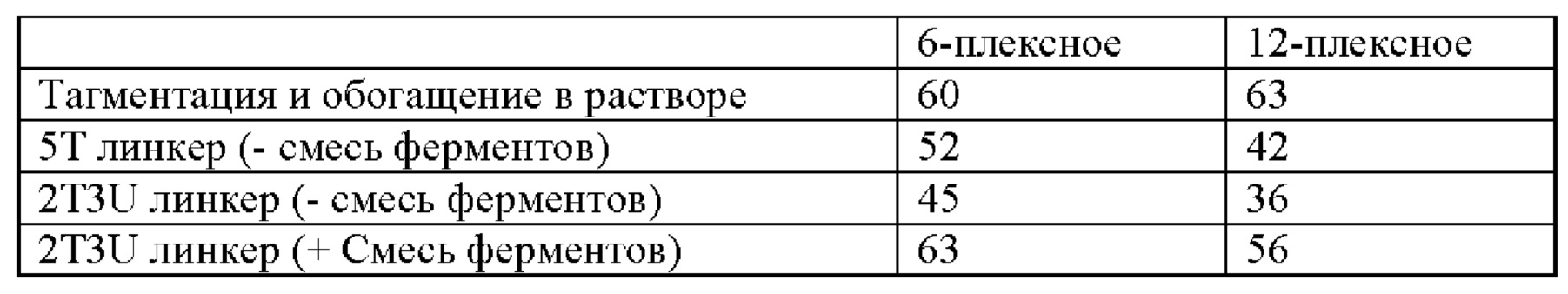
[0156] Как видно из таблицы 2, только линкер 2T3U при ферментативном расщеплении продемонстрировал показатели обогащения, сопоставимые с NEXTERA в растворе, при использовании TruSeq Rapid Exome Kit (Illumina) или стандартной тагментации на поверхности с остатками тимина 5Т.
Пример 5: Сравнение способов с 5'- и 3'-биотинилированными адапторными олиго нуклеотидами
[0157] В определенных способах тагментации на основе гранул используются адапторные последовательности, биотинилированные по 5'-концу, как показано на фиг. 5А. Вкратце, 5'-биотинилированные адапторные олигонуклеотиды 501 и 502 прикрепляют транспосомы к поверхности. При тагментации образуется 5'-биотинилированная фрагментированная полногеномная ДНК, которая может быть загрязнителем на последующем этапе обогащения. Согласно одному варианту реализации место прикрепления биотина меняют на 3'-положение на комплементарной цепи (второй транспозон) для прикрепления транспосом к поверхности, как показано на фиг. 5 В. Вкратце, олигонуклеотиды 501 и 502 не содержат биотина. В указанном примере биотин присоединен к концевой последовательности транспозона 503 на комплементарной цепи (последовательность ME'). В указанной конфигурации при тагментации образуются не содержащие биотина фрагменты геномной ДНК.
[0158] Согласно еще одному варианту реализации между 3'-олигонуклеотидом 503 и биотином располагается линкер. Это может способствовать уменьшению каких-либо стерических затруднений при осуществлении транспозиционной активности, которые могут возникать на твердой поверхности.
[0159] В приведенном ниже примере продемонстрировано применение 3'-биотинилированного олигонуклеотида с линкером формулы (I(a)) (линкер типа глицерина) при получении библиотек для секвенирования. В качестве контрольной реакции ДНК тагментировали, получали и обогащали библиотеки после выполнения протокола обогащения NEXTERA Rapid Capture Enrichment в соответствии с рекомендациями производителя (Illumina). Следовали экспериментальному протоколу, описанному в примере 3, за исключением того, что тагментированные амплифицированные ДНК обогащали в соответствии с протоколом набора для захвата с гибридизацией Xgen Lockdown (Integrated DNA Technologies, IDT), используя панель для экзома и следуя рекомендованному производителем протоколу. В основном, наблюдалась менее чем оптимальное общее обогащение, поскольку для замены рекомендованных универсальных блокирующих олигонуклеотидов, поставляемых с набором Xgen Lockdown, использовали субоптимальные блокирующие олигонуклеотиды. Однако предмет внимания в данном эксперименте требовал не применения оптимальных блокирующих зондов, а исключительно возможности наблюдать измеримое изменение указанного предмета эксперимента. Субоптимальные блокирующие олигонуклеотиды, как ожидается, не влияют на предмет эксперимента.

[0160] Как видно из таблицы 3, для 5'-биотина с урациловым линкером и ферментным расщеплением наблюдалось значимо более низкий уровень обогащения по сравнению с контролем и 3'-биотином (с линкером или без линкера). Указанный более низкий уровень обогащения по ридам для способа, задействующего 5'-биотин с урациловым линкером и ферментное расщепление может быть результатом неполного расщепления смесью ферментов. В экспериментах с 3'-соединением продемонстрировано достижение уровней обогащения по ридам, сопоставимых с уровнями для контроля в растворе.
Пример 6: Получение Р-биотинилированных гранул для инсерций небольшого размера (150-200 п.о.)
Этап 1. Аннелирование транспозонов
[0161] Каждый из А14-МЕ и В15-МЕ аннелировали с олигонуклеотидом МЕ'-линкер-биотин (состав описан ниже) с получением двух двухцепочечных комплексов, оба из которых содержат мозаичный концевой фрагмент (ME), специфически распознаваемый транспозазой, и последовательность А14 или В15, используемую при ПЦР для добавления вторичных адапторов. Олигонуклеотиды А14-МЕ, В15-МЕ, и ME' ресуспендировали до концентрации 200 нМ. В 2 лунки 96-луночного планшета для ПЦР добавляли составы, приведенные в таблице 4 ниже (1 лунка для А14:МЕ' и 1 лунка для В15-МЕ'). Планшет помещали в термоциклер на 10 мин при 95°С, затем вынимали из термоциклера и выставляли на стол при комнатной температуре на два часа.

Этап 2. Образование транспосом
[0162] К описанным выше аннелированным транспозонам добавляли транспозазу Tn5 с образованием комплекса транспосомы, содержащего комплексы А14-МЕ/МЕ'-линкер-биотин и В15-МЕ/МЕ'-линкер-биотин. Аннелированные олигонуклеотиды, полученные на предыдущем этапе, использовали для проведения описанных ниже реакций в 96-луночном планшете для ПЦР. Одну лунку отводили для А14-МЕ и одну - для В15-МЕ. Каждую лунку инкубировали в термоциклере в течение ночи при 37°С, с получением двух популяций комплексов транспосом; затем содержимое двух лунок смешивали. После этапа смешивания приблизительно 220 мкл извлекали и добавляли в другую лунку. Добавляли приблизительно 220 мкл стандартного буфера для хранения (общий объем 440 мкл).

[0163] Полученные описанным выше способом комплексы транспосом, связанные с биотином, добавляли к гранулам со стрептавидином. Плотность комплексов на гранулах может быть скорректирована для контроля размеров инсерций в продуктах тагментации. Гранулы со стрептавидином тщательно перемешивали. Приблизительно 200 мкл гранул со стрептавидином помещали в пробирку объемом 1,5 мл и помещали на магнит для пробирок. Гранулы двукратно промывали 1 мл НТ1, а затем ресуспендировали и осаждали центрифугированием между промываниями. После второго промывания гранулы полностью ресуспендировали в 600 мкл НТ1. 400 мкл полученного описанным выше способом комплекса транспосомы добавляли в пробирку с НТ1. Указанную смесь перемешивали на ротационной мешалке в течение 1 часа, помещали на магнит и удаляли супернатант. Смесь ресуспендировали в 500 мкл 15% стандартного буфера для хранения. Гранулы нагружали в присутствии 1000 нМ комплексов транспосом; комплексы с итоговой плотностью 1000 нМ разбавляли и хранили при концентрации 400 нМ в растворе. Соответственно, основной раствор содержал гранулы с плотностью комплекса 1000 нМ, разбавленного до концентрации 400 нМ. На этапе разбавления изменялась не плотность комплексов на гранулах, а только итоговая концентрация комплексов в основном растворе.
Этап 4. Тагментация
[0164] Образец ДНК тагментировали для получения фрагментов с применением нагруженных на гранулы транспосом для разрезания и добавления последовательности транспозона в образцы ДНК. В 96-луночном планшете для ПЦР комбинировали 5х Mg-буфер для тагментации (10 мкл), ДНК (>50 нг; 10 мкл), dH2О (20 мкл) и гранулы с транспосомами (полученные согласно этапу 3; 10 мкл). Смесь тщательно перемешивали и инкубировали при 55°С в течение 5 минут, а затем в течение 2 минут при 20°С. Процесс тагментации останавливали путем инактивации фермента транспозазы обработкой ДСН. Добавляли 10 мкл ДСН и тщательно перемешивали с реакционной смесью, полученной на описанном выше этапе. Затем указанную смесь инкубировали при комнатной температуре на столе в течение 5 минут и помещали на магнитную мешалку. После осветления раствора супернатант удаляли.
Этап 5. Промывание после остановки тагментации
[0165] Для получения образца для ПЦР ДСН отмывали с гранул. Реакционную смесь после остановки тагментации снимали с магнита и добавляли 100 мкл промывочного буфера. Образец перемешивали на вортексе в течение 20 секунд при 1600 об/мин. Затем его снова помещали на магнитную мешалку и после осветления раствора удаляли супернатант. Этап промывания повторяли в общей сложности три раза. После завершения промывания супернатант полностью удаляли и образец снимали с магнитной мешалки.
Этап 6. ПНР
[0166] Полученный на этапе 5 образец ПЦР-амплифицировали с праймерами, которые распознают А14 и В15, и добавляли вторичные адаптеры. Праймеры также включают индексные последовательности и праймеры для секвенирования (Р5 и Р7). Описанный в таблице 6 мастер-микс добавляли в каждую лунку с образцом. Гранулы ресуспендировали в мастер-миксе и помещали в термоциклер, используя программу, описанную в таблице 7. Указанный этап служил для удаления неперенесенной /биотинилированной цепи, удлинения и амплификации для введения Р5 и Р7 одновременно в ходе одного процесса.


[0167] Образец вынимали из термоциклера и помещали на магнитную мешалку. Затем 45 мкл образца переносили из планшета для ПЦР в планшет MIDI. К образцам в планшете MIDI добавляли 77 мкл воды, и в каждый образец с водой добавляли по 88 мкл гранул для SPRI Ampure. Смесь тщательно перемешивали, инкубировали при комнатной температуре в течение 5 минут, а затем помещали на магнитную мешалку. После осветления раствора 200 мкл образца добавляли в новую лунку того же планшета MIDI. Добавляли 20 мкл гранул для SPRI Ampure, образец тщательно перемешивали и оставляли при комнатной температуре на 5 минут. Затем его опять помещали на магнитную мешалку.
[0168] После осветления раствора супернатант удаляли и утилизировали. Планшет оставляли на магнитной мешалке и добавляли 200 мкл 80% этанола, не затрагивая осадок. Впоследствии этанол удаляли. Этап этанолом промывания повторяли в общей сложности еще два раза. После завершения промывания весь избыток этанола удаляли пипеткой из установленного на мешалке планшета. Образец сушили при комнатной температуре в течение 5 минут. Добавляли 27 мкл воды и тщательно перемешивали. Образец оставляли при комнатной температуре на 2 минуты и возвращали на магнитную мешалку. 25 мкл образца переносили в чистый планшет и хранили при -20°С.
Пример 7. Транспозоны А14-МЕ и В15-МЕ
[0169] Каждый из транспозонов А14-МЕ и В15-МЕ аннелировали с ME', содержащей 3'биотин. 3'биотин сопрягали с ME' с образованием линкеров 3'-(I(а)) и 3'-(I(c)). Реакцию аннелирования проводили в объеме 25 мкл с применением буфера NaCl. Получали комплексы каждого из итоговых двухцепочечных транспозонов с транспозазой путем проведения реакций в течение ночи при 37°С. После образования комплексов транспосом указанные комплексы транспосом А14 и В15 смешивали в равных объемах и нагружали ими гранулы со стрептавидином в концентрации 300 нМ с получением связанных комплексов с плотностью, составлявшей 300 нМ. После присоединения к гранулам смеси (I(a)) и (I(c)) с плотностью 300 нМ дополнительно разбавляли до концентрации 120 нМ. Соответственно, в разбавленном растворе гранулы по-прежнему имели плотность 300 нМ, однако комплексы присутствовали в концентрации 120 нМ. На этапе разбавления плотность комплексов на гранулах не изменяется; таким образом, разбавление оказывает влияние на выход библиотеки, но не на размер инсерций.
[0170] Полученные два типа соединенных с гранулами транспосом, 3'-(I(a)) и 3'-(I(c)), хранили при 25°С в течение 28 и 56 дней. При помощи уравнений Аррениуса установлено, что указанная продолжительность соответствует ускоренному хранению для 4 месяцев (28 дней) и 8 (56 дней) месяцев. По завершении ускоренного старения указанные два типа соединенных с гранулами транспосом использовали для проведения этапов тагментация и получения библиотек согласно обсуждению выше для оценки активности транспосом.
[0171] Соединенные с гранулами комплексы транспосом добавляли к гДНК вместе с магниевым буфером и выдерживали при 55°С в течение 5 минут. После завершения в реакцию добавляли ДСН-буфер и смесь оставляли для инкубации при комнатной температуре на 5 минут. Затем смесь помещали на магнитную мешалку и троекратно промывали NaCl и Tris-буфером. После промывания к гранулам добавляли мастер-микс для ПЦР с носителями вторичного адаптера, содержащими индексные последовательности, и полностью ресуспендировали. Затем образец ПЦР-амплифицировали для получения дополнительных ампликонов. После проведения ПЦР выполняли SPRI-постобработку для удаления избытка носителей. Образцы проводили через BioAnalyzer для измерения активности (выхода, обеспечиваемого способом получения библиотеки). Как показано на фиг. 6А, сравнивали выход библиотек при твердофазной тагментации на основе гранул со стрептавидином с комплексами транспосом, содержащих 3'биотинилированный линкер формулы (I(a)) (3'-(I(а)); глицериновый линкер) и формулы (I(c)) (3'-(I(с)); гексиловый линкер). Линкер 3'-(I(с)) обеспечивал существенный выход библиотеки. Линкер 3'-(I(а)) обеспечивал более низкий выход, но, тем не менее, пригодный для секвенирования. Линия НПС на графике представляет собой произвольный нижний предел спецификации.
[0172] На фиг. 6В представлены данные исследования стабильности при ускоренном старении библиотеки образцов, полученной при твердофазной тагментации на основе гранул со стрептавидином с применением комплекса транспосомы, содержащего линкер 3'-(I(а)), после старения в течение 4 месяцев (в условиях ускоренного хранения при 25°С в течение 28 дней), по сравнению с библиотекой образцов, полученной из не подвергавшегося старению контроля с тем же линкером, хранившегося при 4°С в течение 28 дней. На фиг. 6С приведены данные исследования стабильности при ускоренном старении библиотеки образцов, полученной с применением комплекса транспосомы, содержащего линкер 3'-(I(с)), после старения в течение 4 месяцев и 8 месяцев (в условиях ускоренного хранения при 25°С в течение 28 дней и 56 дней), по сравнению с библиотеками образцов, полученных из не подвергавшихся старению контролей с тем же линкером, хранившихся при 4°С в течение 28 дней и 56 дней, соответственно.
Пример 8. Транспозоны А14-МЕ и В15-МЕ
[0173] Каждый из транспозонов А14-МЕ и В15-МЕ аннелировали с ME', содержащей 3'-биотин. 3'-биотин сопрягали с ME' посредством линкера 3'-(I(с)). Реакцию аннелирования проводили в объеме 25 мкл с применением NaCl-буфера. Каждый из итоговых двухцепочечных транспозонов присоединяли к транспозазе путем проведения реакций в течение ночи при 37°С. После образования транспосом комплексы транспосом А14 и В15 смешивали в равных объемах и нагружали ими гранулы со стрептавидином с различной плотностью (от 10 нМ до 800 нМ).
[0174] Соединенные с гранулами транспосомы с различной плотностью добавляли к гДНК вместе с магниевым буфером и выдерживали при 55°С в течение 5 минут. После завершения в реакцию добавляли ДСН-буфер и инкубировали при комнатной температуре в течение 5 минут. Затем смесь помещали на магнитную мешалку и троекратно промывали NaCl и Tris-буфером. После промываний к гранулам добавляли мастер-микс для ПЦР с носителями вторичного адаптера, содержащими индексные последовательности, и полностью ресуспендировали. Затем проводили реакцию ПЦР на образцах для амплификации фрагментов. После ПЦР проводили SPRI-отбор по размеру при различных соотношениях с SPRI, что приводило к получению инсерций разного размера. Образцы проводили через ВА и HiSeq 2500 Rapid Output для измерения активности.
[0175] На фиг. 7А представлен целевой размер инсерций молекул ДНК как функция от плотности гранул при твердофазном получении библиотек на основе гранул со стрептавидином, где гранулы содержат иммобилизованный комплекс транспосомы, связанный с ними через 3'-(I(с)). На фиг. 7В представлен целевой размер инсерций молекул ДНК как функция от условий SPRI при применении гранул со стрептавидином с иммобилизованным комплексом транспосомы, содержащим гиперактивную транспозазу Tn5 и линкер 3'-(I(с)), при плотности комплекса 100 нМ; и на фиг. 7С представлен целевой размер инсерций молекул ДНК как функция от условий SPRI при применении гранул со стрептавидином с иммобилизованным комплексом транспосомы, содержащим гиперактивную транспозазу Tn5 и линкер 3'-(I(с)), при плотности комплекса 600 нМ.
Пример 9. Интегрированный протокол экстракции для крови и слюны
[0176] Свежую цельную кровь обрабатывали с применением набора реагентов для лизиса Flex Lysis Reagent Kit (Illumina, кат.№20015884). Свежую цельную кровь собирали в пробирки для сбора образцов с ЭДТК и хранили при 4°С до обработки. Мастер-микс для лизиса получали путем смешивания следующих объемов для каждого образца: 7 мкл буфера для лизиса крови, 2 мкл протеиназы K и 31 мкл не содержащей нуклеаз воды. Для каждого образца в одну лунку 96-луночного планшета для ПЦР добавляли 10 мкл крови, 40 мкл мастер-микса для лизиса и 20 мкл гранул SPRI и перемешивали раствор 10-кратным пипетированием. Планшет запечатывали и инкубировали в течение 10 минут при 56°С в термоциклере с нагреваемой крышкой. Затем планшет помещали на магнит для планшетов на 5 минут, супернатант утилизировали и добавляли 150 мкл 80% этанола. После инкубации в течение 30 секунд на магните этанол утилизировали, и планшет снимали с магнита. Гранулы ресуспендировали в 30 мкл воды, после чего они были готовы для получения библиотеки.
[0177] Слюну собирали в пробирки для сбора слюны Oragene DNA (DNA Genotek, кат. №OGR-500, №OGD-510), которые инкубировали по меньшей мере 1 час при 50°С для лизиса клеток, после чего тщательно перемешивали на вортексе. Для каждого образца в одну лунку 96-луночного планшета для ПЦР добавляли 20 мкл воды и 30 мкл слюны и медленно перемешивали пипетированием. Затем в лунку с образцом добавляли 20 мкл гранул SPRI, и гранулы тщательно перемешивали 10-кратным пипетированием раствора. Планшет инкубировали в течение 5 минут при комнатной температуре, после чего помещали на магнит для планшетов на 5 минут. Удаляли супернатант и добавляли 150 мкл 80% этанола к осадку с гранулами. Затем планшет оставляли на магните на 30 секунд, после чего удаляли этанол и снимали планшет с магнита. Гранулы ресуспендировали в 30 мкл воды, после чего они были готовы для получения библиотеки.
[0178] Был описан ряд вариантов реализации. Тем не менее, следует понимать, что могут быть внесены различные модификации. Таким образом, в объем приведенной ниже формулы изобретения входят и другие варианты реализации.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ILLUMNA, INC. / ИЛЛУМИНА, ИНК.
ILLUMINA CAMBRIDGE LIMITED / ИЛЛУМИНА КЕМБРИДЖ ЛИМИТЕД
DeSantis, Grace / ДеСантис, Грейс
Gross, Stephen M. / Гросс, Стивен М.
Li, Jian-Sen / Ли, Чян-Сен
Morrell, Natalie / Моррелл, Натали
Slatter, Andrew / Слэттер, Эндрю
Shen, Kevin / Шен, Кевин
Snow, Samantha / Сноу, Саманта
<120> ТАГМЕНТАЦИЯ С ПРИМЕНЕНИЕМ ИММОБИЛИЗОВАННЫХ ТРАНСПОСОМ С ЛИНКЕРАМИ
<130> ILLINC.398WO
<150> 62/461620
<151> 2017-02-21
<160> 14
<170> FastSEQ для Windows, версия 4.0
<210> 1
<211> 29
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> праймер P5
<400> 1
aatgatacgg cgaccaccga gauctacac 29
<210> 2
<211> 24
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> праймер P7
<400> 2
caagcagaag acggcatacg agat 24
<210> 3
<211> 33
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> адапторная последовательность A14-ME
<400> 3
tcgtcggcag cgtcagatgt gtataagaga cag 33
<210> 4
<211> 34
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> адапторная последовательность B15-ME
<400> 4
gtctcgtggg ctcggagatg tgtataagag acag 34
<210> 5
<211> 19
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> адапторная последовательность ME'
<400> 5
ctgtctctta tacacatct 19
<210> 6
<211> 14
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> A14 адапторная последовательность
<400> 6
tcgtcggcag cgtc 14
<210> 7
<211> 15
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> адапторная последовательность B15
<400> 7
gtctcgtggg ctcgg 15
<210> 8
<211> 19
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> адапторная последовательность ME
<400> 8
agatgtgtat aagagacag 19
<210> 9
<211> 50
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная A14-ME №1
<400> 9
tttttttttt uuuacactcg tcggcagcgt cagatgtgta taagagacag 50
<210> 10
<211> 38
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная A14-ME №2
<400> 10
ttuuutcgtc ggcagcgtca gatgtgtata agagacag 38
<210> 11
<211> 38
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная A14-ME №3
<400> 11
ttttutcgtc ggcagcgtca gatgtgtata agagacag 38
<210> 12
<211> 47
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная B15-ME №1
<400> 12
tttttttttt uuugtctcgt gggctcggag atgtgtataa gagacag 47
<210> 13
<211> 39
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная B15-ME №2
<400> 13
ttuuugtctc gtgggctcgg agatgtgtat aagagacag 39
<210> 14
<211> 39
<212> DNA / ДНК
<213> Искусственная последовательность
<220>
<223> Модифицированная B15-ME №3
<400> 14
ttttugtctc gtgggctcgg agatgtgtat aagagacag 39
<---
Реферат
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая комплекс транспосомы для тагментации, композицию для тагментации, модифицированный олигонуклеотид для тагментации, способ получения библиотеки меченых фрагментов нуклеиновых кислот из двухцепочечной целевой нуклеиновой кислоты, способ получения связанного с твердой подложкой комплекса транспосомы, способ получения образца для секвенирования. В одном из вариантов реализации комплекс транспосомы для тагментации содержит транспозазу, первый и второй транспозоны ДНК и расщепляемый линкер. Изобретение расширяет арсенал средств для тагментации. 6 н. и 29 з.п. ф-лы, 12 ил., 7 табл., 9 пр.

Комментарии