Препараты, содержащие циклоспорин, в виде капсул с мягким покрытием - RU2181055C2
Код документа: RU2181055C2
Чертежи


Описание
Изобретение относится к препарату, например, в виде капсулы с мягким покрытием, содержащему в качестве активного ингредиента циклоспорин. В частности настоящее изобретение относится к препарату в виде капсулы с мягким покрытием, содержащему стабильную композицию на основе циклоспорина, заключенную в капсулу с желатиновым покрытием, в состав которого входит определенный пластификатор, и к способу его изготовления.
Циклоспорин представляет собой известное макромолекулярное (молекулярная масса 1202,64) циклическое пептидное соединение, состоящее из 11 аминокислот и обладающее широким спектром полезных фармакологических свойств, в частности иммуносупрессивной активностью и противовоспалительным действием. Вследствие этого циклоспорин применяется для подавления врожденных иммунологических реакций живого организма, причиной которых является трансплантация тканей и органов, например трансплантация сердца, легкого, печени, почки, поджелудочной железы, костного мозга, кожи и роговицы, и прежде всего трансплантация чужеродных тканей и органов. Кроме того, циклоспорин используют при лечении гематологических нарушений, таких как анемия, различных аутоиммунных заболеваний, таких как системная красная волчанка, идиопатический синдром мальабсорбции и т.д., и воспалительных заболеваний, таких как артрит, ревматоидные расстройства и т.д. Циклоспорин используют при лечении заболеваний, вызванных простейшими, таких как малярия, шистосомоз и т.д., и, кроме того, в настоящее время он также применяется в химиотерапии.
Циклоспорин является высоколипофильным и гидрофобным соединением. Поэтому циклоспорин слаборастворим в воде и в то же время хорошо растворим в органических растворителях, таких как метанол, этанол, ацетон, простой эфир, хлороформ и т. п. Поскольку, как указано выше, циклоспорин обладает слабой растворимостью в воде, то в том случае, когда циклоспорин вводят оральным путем, его биологическая доступность оказывается чрезвычайно низкой, и она может в значительной степени зависеть от особенностей каждого конкретного пациента. Вследствие этого оказывается очень трудным сохранить эффективную в терапевтическом отношении концентрацию. Более того, циклоспорин может оказывать выраженные побочные воздействия, такие как нефротоксичность. Вследствие низкой растворимости циклоспорина в воде очень трудно изготавливать на его основе препараты для орального введения. Поэтому были проведены обширные, многочисленные исследования, направленные на разработку препарата, который был бы пригоден для эффективного введения циклоспорина оральным путем и который мог бы обеспечить приемлемую стандартную дозу и соответствующую биологическую доступность.
Известные препараты, пригодные для орального введения слаборастворимого в воде циклоспорина, обычно изготавливали в форме предварительно приготовленного эмульсионного концентрата.
Один из обычных способов применения такого состава описан в патенте США 4388307, выданном 14 июня 1983 г. В этом патенте описана жидкая композиция на основе циклоспорина с использованием этанола. В соответствии со способом согласно этому патенту США для получения жидкой композиции циклоспорин объединяют с носителем, состоящим из этанола в качестве вторичного поверхностно-активного вещества; оливкового масла в качестве растительного масла и продукта переэтерификации триглицерида природного растительного масла и полиалкиленполиоля в качестве поверхностно-активного вещества.
Однако полученную жидкую композицию вводят в виде водного раствора, что очень затрудняет адаптацию пациента к ее введению и создание стандартной дозы для орального введения.
С целью уменьшить неудобство, связанное с растворением жидкой композиции на основе циклоспорина в воде перед оральным введением, жидкую композицию в форме предварительно приготовленного эмульсионного концентрата вносили в препарат в виде капсулы с мягким покрытием, который в настоящее время имеется в продаже и известен как Sandimmune (зарегистрированный товарный знак). В этом случае в состав содержащей циклоспорин капсулы с мягким покрытием входит этанол, что обусловлено требованиями, связанными с растворимостью циклоспорина. Однако, поскольку этанол вследствие своей летучести может проникать через желатиновую оболочку капсулы даже при нормальной температуре, для предотвращения испарения этанола из препаратов в виде капсул с мягким покрытием при хранении и продаже препараты в виде капсул с мягким покрытием могут быть заключены в оболочку из специального упаковочного материала, например в блистерную упаковку алюминий-алюминий.
Недавно стало возможным создать препарат на основе циклоспорина, который является стабильным в течение всего предусмотренного срока хранения и в дальнейшем практически сохраняет свою биологическую доступность, которая не зависит от индивидуальных особенностей конкретных пациентов, поэтому биологическое действие циклоспорина может поддерживаться на одинаковом уровне. Один из препаратов, разработанных для этой цели, описан в опубликованном выложенном корейском патенте 93-113. Этот препарат поступает в продажу под товарным знаком Sandimmun Neoral. Однако, поскольку в этом препарате также используется этанол, он может иметь некоторые недостатки в отношении стабильности при хранении, связанные с изменением содержания этанола и характерные для известных препаратов, содержащих этанол.
Поэтому при создании настоящего изобретения было изучено большое количество комбинаций различных поверхностно-активных веществ, замасливателей, вторичных поверхностно-активных веществ и т.п. с той целью, чтобы найти композицию на основе циклоспорина, которая является стабильной, с точки зрения своих фармакокинетических характеристик обладает более высокой биологической доступностью и по уровню содержания в крови в меньшей степени зависит от индивидуальных особенностей отдельных пациентов по сравнению с известными препаратами на основе циклоспорина. В результате было обнаружено, что определенная композиция на основе циклоспорина, состоящая из указанных ниже компонентов, может удовлетворять вышеуказанным требованиям, что и явилось объектом настоящего изобретения.
Следовательно, в основу настоящего изобретения была положена задача создать пригодную для введения в капсулы с мягким покрытием композицию, которая содержит циклоспорин в качестве активного ингредиента, гидрофильное вещество полиэтиленгликоль или негидрофильное вещество пропиленкарбонат или их смесь, замасливатель, как он определен ниже, и поверхностно-активное вещество.
Еще одной задачей изобретения является разработка препарата в виде капсулы с мягким покрытием, содержащей композицию, которая включает циклоспорин в качестве активного ингредиента, гидрофильное вещество полиэтиленгликоль или негидрофильное вещество пропиленкарбонат или их смесь, смесь этерифицированного соединения жирной кислоты и первичного спирта, триглицерида жирной кислоты со средней длиной цепи (при необходимости) и моноглицерида жирной кислоты в качестве замасливателя и поверхностно-активное вещество, значение HLB (гидрофильно-липофильный баланс) которого составляет от 8 до 17.
Задачей настоящего изобретения является далее разработка способа изготовления указанного выше препарата в виде капсулы с мягким желатиновым покрытием, как определено выше.
Хотя в настоящем изобретении описаны капсулы с мягким желатиновым покрытием, очевидно, что изобретение включает композицию как таковую, которая может применяться, например, в виде раствора для питья, например, как Sandimmun Neoral, или в виде других стандартных дозируемых форм.
Согласно настоящему изобретению предлагается содержащая циклоспорин капсула, которая обладает высокой стабильностью при хранении, т.е. для нее характерно незначительное изменение состава композиции в течение времени, и которая обладает повышенной биологической доступностью и содержит композицию, включающую циклоспорин в качестве активного ингредиента, гидрофильное вещество полиэтиленгликоль или негидрофильное вещество пропиленкарбонат или их смесь в качестве второго компонента, замасливатель, как он определен ниже, и поверхностно-активное вещество.
Для изготовления такого препарата в виде капсулы с мягким покрытием, содержащей композицию на основе циклоспорина, необходимо использовать желатиновую оболочку. Однако, если капсулу с мягким покрытием изготавливают с использованием обычной капсульной оболочки, содержащей в качестве пластификатора глицерин, препарат в виде капсулы с мягким покрытием имеет определенные недостатки, связанные с тем, что стабильность предварительно приготовленного эмульсионного концентрата может изменяться вследствие проникновения глицерина в эмульсию, что приводит к существенному снижению растворимости циклоспорина и, как следствие этого, к осаждению циклоспорина из эмульсии.
Поэтому в настоящем изобретении для оболочки капсулы с мягким покрытием предпочтительно выбирают желатиновую оболочку, в которой в качестве пластификатора используют смесь полипропиленгликоля и полиэтиленгликоля, а не глицерин, что позволяет решить проблему, связанную с проникновением глицерина.
Однако, если ленту оболочек капсул, содержащую в соответствии с настоящим изобретением пропиленгликоль и полиэтиленгликоль, изготавливают с помощью метода водяного охлаждения, который обычно используют для барабанных холодильников, то ее трудно извлечь из барабана. Такая характеристика извлекаемости ленты оболочек капсул из барабанного холодильника может быть улучшена путем переохлаждения барабанного холодильника с помощью непрерывной циркуляции охлаждающей воды для снижения температуры ленты приблизительно до 17oС. Однако лента оболочек капсул, охлажденная до более низкой температуры, может обладать пониженной способностью к герметичному запечатыванию в процессе капсулирования, что может привести к снижению производительности.
Таким образом, в способе изготовления ленты желатиновых оболочек, не содержащей в качестве пластификатора глицерин, вместо ранее применявшегося известного метода водяного охлаждения в соответствии с настоящим изобретением используется метод воздушного охлаждения, согласно которому лента оболочек капсул может быть охлаждена до оптимальной температуры с помощью потока воздуха от вентилятора и вследствие этого может быть легко извлечена из барабанного холодильника с последующим выдерживанием ленты при оптимальной температуре приблизительно 21oС для улучшения способности герметично запечатываться в процессе капсулирования, что обеспечивает высокую производительность.
Как указывалось выше, продукты по настоящему изобретению могут быть изготовлены с использованием не содержащей глицерина желатиновой оболочки капсулы и с применением метода воздушного охлаждения композиции, которая не содержит этанол, являющийся растворителем с низкой температурой кипения, и, следовательно, обладает высокой стабильностью при хранении, т.е. композиция мало изменяется с течением времени и характеризуется повышенной биологической доступностью.
В частности согласно изобретению
предлагается препарат на основе циклоспорина, содержащий композицию, которая включает
1) циклоспорин в качестве активного ингредиента,
2) полиэтиленгликоль или пропиленкарбонат или
их смесь,
3) смесь этерифицированного соединения жирной кислоты и первичного спирта и моноглицерида жирной кислоты и необязательно триглицерида жирной кислоты со средней длиной цепи в
качестве замасливателя и
4) поверхностно-активное вещество, значение HLB (гидрофильно-липофильный баланс) которого составляет от 8 до 17,
и которая, например, заключена в желатиновую
оболочку, содержащую в качестве пластификатора полиэтиленгликоль и пропиленгликоль. Далее, согласно изобретению предлагается препарат на основе циклоспорина, содержащий композицию, которая включает
1) циклоспорин в качестве активного ингредиента и
2) пропиленкарбонат.
Такая композиция, которая также является композицией по изобретению, при необходимости может необязательно дополнительно содержать любой другой компонент, представленный в настоящем описании, в количествах, указанных в настоящем описании.
Циклоспорин, применяемый в качестве фармацевтически активного ингредиента предлагаемой композиции, представляет собой циклическое пептидное соединение, обладающее иммуносупрессивной активностью и противовоспалительным действием, как описано выше. Хотя в качестве циклоспоринового компонента по настоящему изобретению может применяться циклоспорин А, В, С, D, G и т.п., циклоспорин А является наиболее предпочтительным вследствие своей клинической эффективности и фармакологических свойств, хорошо известных в данной области.
В качестве гидрофильного вещества, являющегося вторым компонентом в предлагаемой композиции, можно использовать полиэтиленгликоль, который может выполнять функцию вторичного поверхностно-активного вещества, имеет высокую температуру кипения, является нелетучим, не проникает сквозь желатиновую оболочку капсулы с мягким покрытием и в котором хорошо растворяется циклоспорин. Хотя в композиции по настоящему изобретению может применяться любой полиэтиленгликоль, который может быть разжижен, предпочтительно применять полиэтиленгликоль (ПЭГ), имеющий молекулярную массу от 200 до 600, в частности ПЭГ 200.
В альтернативном варианте в качестве негидрофильного компонента также может применяться пропиленкарбонат (tкип приблизительно 242oС). Согласно изобретению также может применяться смесь негидрофильного вещества и гидрофильного вещества, как определено выше. Когда в качестве компонента по настоящему изобретению применяют смесь полиэтиленгликоля и пропиленкарбоната, они обычно могут быть объединены в массовом соотношении 1:0, 1-5, предпочтительно 1:0,1-3, наиболее предпочтительно 1:0,2-2.
Применение полиэтиленгликоля и пропиленкарбоната согласно настоящему изобретению обеспечивает достижение определенных преимуществ. Так, например, улучшается стабильность при хранении композиции, содержащей циклоспорин, и, следовательно, практически на постоянном уровне поддерживается содержание входящих в нее компонентов. Кроме того, применение пропиленкарбоната может даже увеличить растворимость активного ингредиента - циклоспорина - и ингибировать проникновение воды из желатиновой оболочки капсул в композицию, что делает композицию более стабильной.
В композиции по настоящему изобретению второй компонент предпочтительно применяют в соотношении от 0,1 до 10 массовых частей, более предпочтительно от 0,5 до 8 массовых частей и наиболее предпочтительно от 1 до 5 массовых частей на 1 массовую часть циклоспорина.
Третьим компонентом, применяемым в предварительно приготовленном эмульсионном концентрате по настоящему изобретению, является замасливатель. В качестве замасливателя согласно изобретению может применяться смесь этерифицированных соединений жирной кислоты и первичного спирта, триглицеридов (когда они присутствуют) жирных кислот со средней длиной цепи и моноглицеридов жирных кислот. Этерифицированное соединение жирной кислоты и первичного спирта, которое может применяться согласно изобретению, может представлять собой этерифицированное соединение жирной кислоты, имеющей 8-20 атомов углерода, и первичного спирта, имеющего 2-3 атома углерода, например изопропилмиристат, изопропилпальмитат, этиллинолеат, этилолеат и т.д., причем особенно предпочтительным является этерифицированное соединение линолевой кислоты и этанола. Кроме того, в качестве триглицерида (когда он присутствует) жирной кислоты со средней длиной цепи может применяться триглицерид насыщенной жирной кислоты, имеющей 8-10 атомов углерода, причем наиболее предпочтительным триглицеридом насыщенной жирной кислоты из входящих в состав растительного масла является триглицерид каприловой/каприновой кислоты. Моноглицерид жирной кислоты, который также может применяться в качестве замасливателя по настоящему изобретению, включает моноглицерид жирной кислоты, имеющей 18-20 атомов углерода, в частности моноглицерид олеиновой кислоты.
В предварительно приготовленном микроэмульсионном концентрате по настоящему изобретению замасливатель может применяться в соотношении от 1 до 10 массовых частей, предпочтительно от 2 до 6 массовых частей на 1 массовую часть циклоспорина.
Предпочтительно в качестве замасливателя присутствуют моноглицерид жирной кислоты и эфир жирной кислоты, например, в соотношении от 1:1 до 1:2, в частности от 1:1 до 1:1,2.
Необязательно могут также присутствовать триглицерид каприловой/каприновой кислоты, например, в соотношении с этиллинолеатом от 1:0,1 до 1:0,2.
В смеси масел, применяемой в качестве замасливателя по настоящему изобретению, массовое соотношение моноглицерид жирной кислоты/этерифицированное соединение жирной кислоты и первичного спирта/триглицерид (когда он присутствует) жирной кислоты со средней длиной цепи обычно может находиться в интервале от 1:0,1 до 5:0,1-10, предпочтительно от 1:0,1 до 3,0:0,1-3,0.
Четвертым компонентом, применяемым в композиции по настоящему изобретению, является поверхностно-активное вещество. Приемлемые для применения по настоящему изобретению поверхностно-активные вещества представляют собой любые фармацевтически приемлемые поверхностно-активные вещества, значение HLB (гидрофильно-липофильный баланс) которых составляет от 8 до 17 и которые способны стабильно эмульгировать липофильную часть композиции, включающую замасливатель, содержащий циклоспорин, и гидрофильную часть, включающую вторичное поверхностно-активное вещество в воде, что приводит к образованию стабильной микроэмульсии. Примеры предпочтительного поверхностно-активного вещества по настоящему изобретению включают полиоксиэтилированные продукты гидрированных растительных масел, полиоксиэтилированные эфиры ангидросорбита и жирных кислот и т. п. , например, NIKKOL HCO-50, NIKKOL НСО-40, NIKKOL HCO-60, TWEEN 20, TWEEN 21, TWEEN 40, TWEEN 60, TWEEN 80, TWEEN 81 и т.д. В частности, предпочтительно могут применяться полиоксиэтилированное гидрированное касторовое масло, содержащее 50 молей этиленоксидных звеньев, которое поступает в продажу под торговым названием NIKKOL HCO-50 (фирма NIKKO Chemical Co. , Ltd.) и полиоксиэтилированный сорбитанмонолаурат, содержащий 20 молей этиленоксидных звеньев, который поступает в продажу под торговым названием TWEEN 20 (фирма ICI Chemicals), имеющие кислотное число ниже 1, число омыления приблизительно 48-56, гидроксильное число приблизительно 45-55 и значение рН (5%-ного раствора) 4,5-7,0.
Поверхностно-активное вещество может представлять собой либо одно любое из вышеуказанных поверхностно-активных веществ, либо предпочтительно комбинацию двух или более поверхностно-активных веществ, выбранных из вышеуказанных поверхностно-активных веществ. В композиции по настоящему изобретению поверхностно-активные вещества могут применяться в соотношении от 1 до 10 массовых частей, предпочтительно в соотношении от 2 до 8 массовых частей на 1 массовую часть циклоспорина.
Кроме того, когда в композиции по настоящему изобретению применяют смесь двух поверхностно-активных веществ, т.е. полиоксиэтилированного гидрированного касторового масла, содержащего 50 молей этиленоксидных звеньев, и полиоксиэтилированного сорбитанмонолаурата, содержащего 20 молей этиленоксидных звеньев, принятое массовое соотношение полиоксиэтилированного гидрированного касторового масла, содержащего 50 молей этиленоксидных звеньев, и полиоксиэтилированного сорбитанмонолаурата, содержащего 20 молей этиленоксидных звеньев, предпочтительно составляет 1:0,1-5, более предпочтительно 1:0,5-4.
В композиции по настоящему изобретению четыре компонента циклоспорин/ второй компонент/ замасливатель/ поверхностно-активное вещество предпочтительно присутствуют в массовом соотношении 1:0,1-10:1-10:1-10, более предпочтительно в соотношении 1:0, 5-8:2-6:2-8.
Помимо этой композиции в качестве дополнительных предпочтительных композиций по настоящему изобретению можно отметить композиции, приведенные в следующих примерах.
Для орального введения композиция по настоящему изобретению, содержащая вышеуказанные компоненты, может быть изготовлена в виде капсулы с мягким покрытием. Поскольку в препарате в виде капсулы с мягким покрытием в соответствии с настоящим изобретением не используется этанол в качестве летучего растворителя с низкой температурой кипения, этот препарат является фармацевтически стабильным и может удовлетворять необходимым требованиям по улучшению характеристик, включая улучшение биологической доступности. Однако может оказаться, что этой цели трудно достичь при использовании обычной оболочки капсулы с мягким покрытием, применяя обычный метод изготовления капсул с мягким покрытием. Когда изготавливают капсулу с мягким покрытием с использованием обычной капсульной оболочки, содержащей в качестве пластификатора глицерин, изготовленная таким образом капсула с мягким покрытием может иметь ряд недостатков, состоящих в том, что стабильность предварительно приготовленного эмульсионного концентрата может изменяться вследствие проникновения глицерина в эмульсию и происходящего в результате этого существенного понижения растворимости циклоспорина, что может привести к осаждению циклоспорина из эмульсии.
Таким образом, было обнаружено, что, когда оболочку капсулы изготавливают, используя в качестве пластификатора смесь полиэтиленгликоля и пропиленгликоля, а не глицерин, то полученный препарат в виде капсулы с мягким покрытием сохраняет стабильность в течение длительного периода времени, что в свою очередь также является еще одним объектом настоящего изобретения. Хотя в качестве пластификатора может применяться любой полиэтиленгликоль, который может быть разжижен, предпочтительно применять полиэтиленгликоль, имеющий молекулярную массу от 200 до 600.
В частности, предпочтительно использовать полиэтиленгликоль 200. В оболочке капсулы с мягким покрытием в соответствии с настоящим изобретением используют смесь полиэтиленгликоля и пропиленгликоля предпочтительно в соотношении от 0,1 до 0,5 массовых частей, более предпочтительно от 0,1 до 0,4 массовых частей и наиболее предпочтительно от 0,2 до 0,3 массовых частей на одну массовую часть желатина, применяемого для изготовления оболочки капсулы. В используемой в качестве пластификатора смеси полиэтиленгликоля и пропиленгликоля последний входит предпочтительно в соотношении от 1 до 10 массовых частей, более предпочтительно от 3 до 8 массовых частей и наиболее предпочтительно от 3 до 6 массовых частей на одну массовую часть полиэтиленгликоля.
С целью улучшить извлекаемость ленты оболочек капсул с мягким покрытием из барабанного холодильника в способе изготовления такой ленты оболочек желатиновых капсул по настоящему изобретению применяют метод воздушного охлаждения вместо метода водяного охлаждения. При применении указанного метода воздушного охлаждения, поскольку лента оболочек капсул не перегревается и легко извлекается из барабанного холодильника, в котором поддерживается оптимальная температура приблизительно 21oС, способность герметично запечатываться в процессе капсулирования является достаточно высокой, что обеспечивает высокую производительность и, следовательно, эффективную реализацию способа.
При изготовлении капсул с мягким покрытием в соответствии с настоящим изобретением приемлемый объемный расход воздуха в баранном холодильнике для охлаждения оболочек капсул предпочтительно составляет от 5 до 15 м3/мин, наиболее предпочтительно приблизительно 10 м3/мин.
При изготовлении композиции по настоящему изобретению, заключенной в капсулы с мягким покрытием, препарат в виде капсулы дополнительно может содержать при необходимости фармацевтически приемлемые добавки, которые обычно используются для таких препаратов в виде капсул с мягким покрытием. Такие добавки включают, например, лецитин, регулятор вязкости, отдушку (например, масло мяты перечной и т.д.), антиоксидант (например, токоферол, витамин Е и т.д.), консервант (например, парабен и т.д.), краситель, аминокислоты и т.д.
Препарат в виде капсулы с мягким покрытием по настоящему изобретению может быть изготовлен путем однородного смешения вторичного поверхностно-активного вещества, замасливателя и поверхностно-активного вещества, растворения при перемешивании в них циклоспорина и осторожного нагревания до температуры приблизительно 60oС с последующим включением полученного концентрата с вышеуказанными фармацевтически приемлемыми добавками, обычно применяемыми в препаратах в виде капсул с мягким покрытием, или без них в желатиновую оболочку, содержащую в качестве пластификатора полиэтиленгликоль и пропиленгликоль, в машине для изготовления капсул с мягким покрытием с использованием метода воздушного охлаждения.
Композиции и препараты по настоящему изобретению пригодны при таких же показаниях и могут применяться таким же способом и в таком же диапазоне доз, что и известные композиции на основе циклоспорина с применением при необходимости регулировки дозы на основе стандартных опытов по изучению биологической доступности на животных, например, собаках или людях, в частности, согласно настоящему описанию.
Хотя составы любых эксципиентов или компонентов не представлены конкретно в настоящем описании, они известны из литературы, см., например, Н.Р. Fiedler, Lexikon der Hilfsstoffe, Edito Cantor Verlag, Aulendorf, Германия, 4-е издание, 1996, Handbook of Pharmaceutical Excipients, American Pharmaceutical Association, Washington, и The Pharmaceutical Society, London, 2-е издание, 1994, а также заявку на корейский патент 94-29208, поданную 9.11.94.
Настоящее изобретение более подробно проиллюстрировано на следующих примерах. Однако очевидно, что изобретение не ограничено этими примерами.
Пример 1
Компонент
- Содержание (мг/капсула)
Циклоспорин - 25
Полиэтиленгликоль 200 - 45
Пропиленкарбонат - 25
Полиоксиэтилированное гидрированное касторовое масло, содержащее 50
молей этиленоксидных звеньев - 35
Полиоксиэтилированный сорбитанмонолаурат, содержащий 20 молей этиленоксидных звеньев - 85
Этиллинолеат - 40
Триглицерид
каприловой/каприновой кислоты - 5
Моноглицерид олеиновой кислоты - 35
Всего - 295 мг
Пример 2
Компонент - Содержание (мг/капсула)
Циклоспорин - 25
Полиэтиленгликоль 200 - 70
Полиоксиэтилированное гидрированное касторовое масло, содержащее 50 молей этиленоксидных звеньев - 35
Полиоксиэтилированный сорбитанмонолаурат, содержащий
20 молей этиленоксидных звеньев - 85
Этиллинолеат - 40
Триглицерид каприловой/каприновой кислоты - 5
Моноглицерид олеиновой кислоты - 35
Всего - 295 мг
Пример 3
Компонент - Содержание (мг/капсула)
Циклоспорин - 25
Полиэтиленгликоль 200 - 100
Пропиленкарбонат - 50
Полиоксиэтилированное гидрированное
касторовое масло, содержащее 50 молей этиленоксидных звеньев - 35
Полиоксиэтилированный сорбитанмонолаурат, содержащий 20 молей этиленоксидных звеньев - 85
Этиллинолеат - 40
Триглицерид каприловой/каприновой кислоты - 5
Моноглицерид олеиновой кислоты - 35
Всего - 375 мг
Пример 4
Компонент - Содержание (мг/капсула)
Циклоспорин
- 25
Полиэтиленгликоль 200 - 45
Пропиленкарбонат - 25
Полиоксиэтилированное гидрированное касторовое масло, содержащее 50 молей этиленоксидных звеньев - 50
Полиоксиэтилированный сорбитанмонолаурат, содержащий 20 молей этиленоксидных звеньев - 100
Этиллинолеат - 40
Триглицерид каприловой/каприновой кислоты - 5
Моноглицерид
олеиновой кислоты - 35
Всего - 325 мг
Пример 5
Компонент - Содержание (мг/капсула)
Циклоспорин - 25
Полиэтиленгликоль 200 - 45
Пропиленкарбонат
- 25
Полиоксиэтилированное гидрированное касторовое масло, содержащее 50 молей этиленоксидных звеньев - 35
Полиоксиэтилированный сорбитанмонолаурат, содержащий 20 молей
этиленоксидных звеньев - 85
Этиллинолеат - 80
Триглицерид каприловой/каприновой кислоты - 10
Моноглицерид олеиновой кислоты - 70
Всего - 375 мг
Пример 6
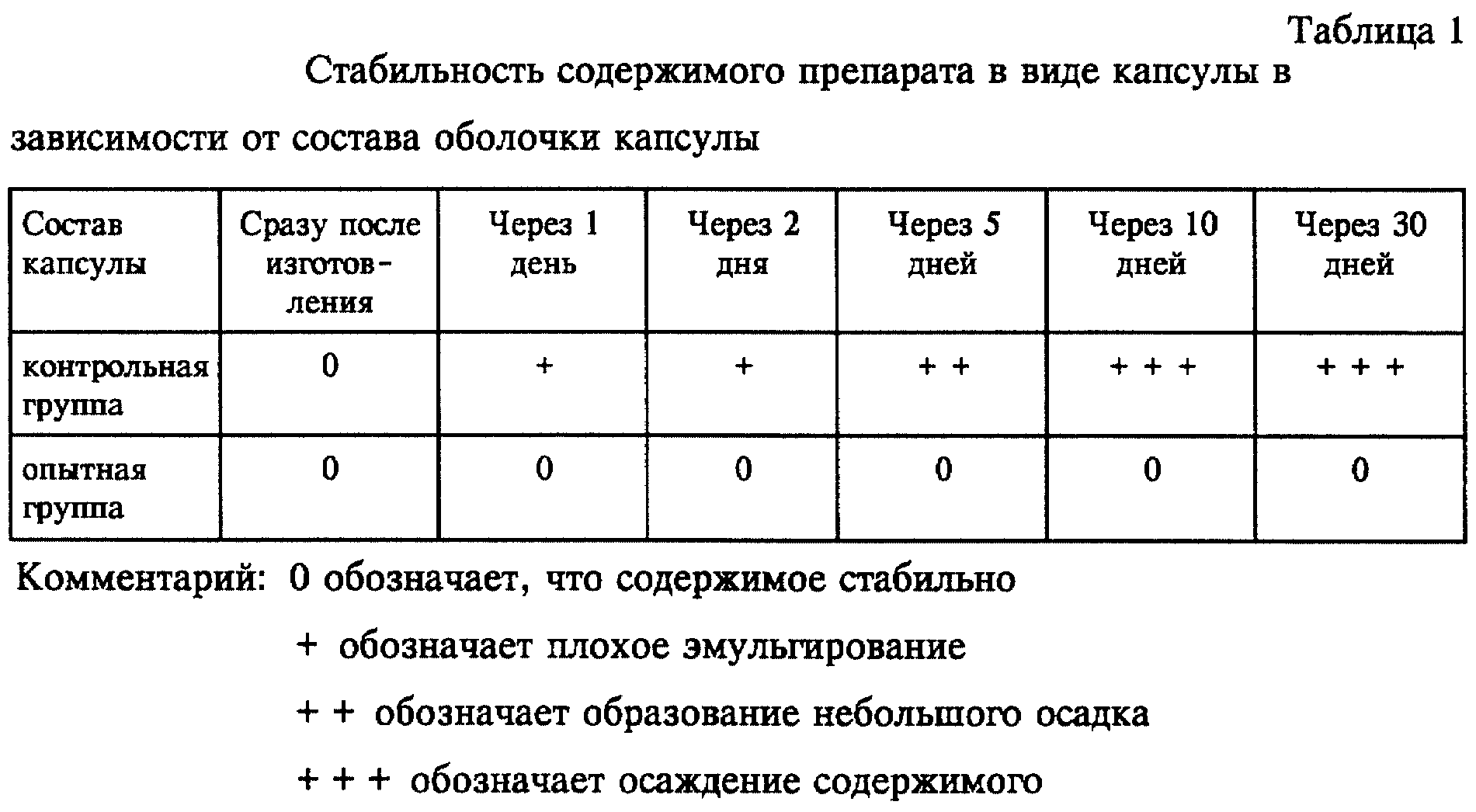
Препарат в виде капсулы с мягким покрытием изготавливали на основе композиции из примера 1, используя нижеприведенный состав для оболочки капсулы, и затем визуально наблюдали за изменением
свойства и состояния содержимого в результате проникновения глицерина.
6.1 (контрольная группа)
Компонент - Массовое соотношение
Желатин - 20
Очищенная вода
- 16
Глицерин - 9
6.2 (опытная группа)
Компонент - Массовое соотношение
Желатин - 20
Очищенная вода -
16
Пропиленгликоль - 4
Полиэтиленгликоль 200 - 1
Полученные результаты представлены ниже в таблице 1.
Как можно увидеть из результатов, представленных в таблице 1, препарат в виде капсулы, изготовленный с использованием композиции 6.1 (контрольная группа), содержащей в качестве пластификатора глицерин, имеет некоторые недостатки, включающие образование осадка в результате проникновения глицерина, тогда как препарат в виде капсулы, изготовленный с использованием композиции 6.2 (опытная группа), содержащей в качестве пластификатора полиэтиленгликоль и пропиленгликоль, сохраняет стабильное состояние.
Пример 7
Препарат в виде капсулы с мягким покрытием, содержащий композицию из примера 1, получали с использованием состава для оболочки капсулы,
указанного выше в разделе 6.2 (опытная группа) примера 6, применяя соответственно метод водяного охлаждения (температура воды приблизительно 12oС) и метод воздушного охлаждения (объемный
расход воздуха приблизительно 10 м3/мин).
В каждом случае оценивали и сравнивали извлекаемость ленты оболочек капсул из барабанного холодильника. Полученные результаты представлены ниже в таблице 2.
Как видно из результатов, представленных выше в таблице 2, препарат в виде капсулы с мягким покрытием, полученный с использованием метода воздушного охлаждения в соответствии с настоящим изобретением, обладает существенно лучшей извлекаемостью из барабанного холодильника по сравнению с таковым, полученным с использованием метода водяного охлаждения. В частности, обычно считается, что если величина угла, необходимая для извлечения ленты желатиновых оболочек из барабанного холодильника, составляет приблизительно 70o или выше, то извлекаемость является плохой, а если величина угла, необходимая для извлечения ленты оболочек из барабанного холодильника меньше, приблизительно 70o, то извлекаемость является хорошей. Препарат в виде капсулы с мягким покрытием, полученный с использованием метода водяного охлаждения, неудовлетворительно извлекался из барабанного холодильника даже в том случае, когда ленту извлекали под углом 100o или более.
В отличие от этого препарат в виде капсулы с мягким покрытием, полученный с использованием метода воздушного охлаждения в соответствии с настоящим изобретением, может быть легко извлечен из барабанного холодильника под углом 50o и меньше, что в результате позволяет обеспечить хорошую прочность герметичного запечатывания и высокую производительность.
Пример 8
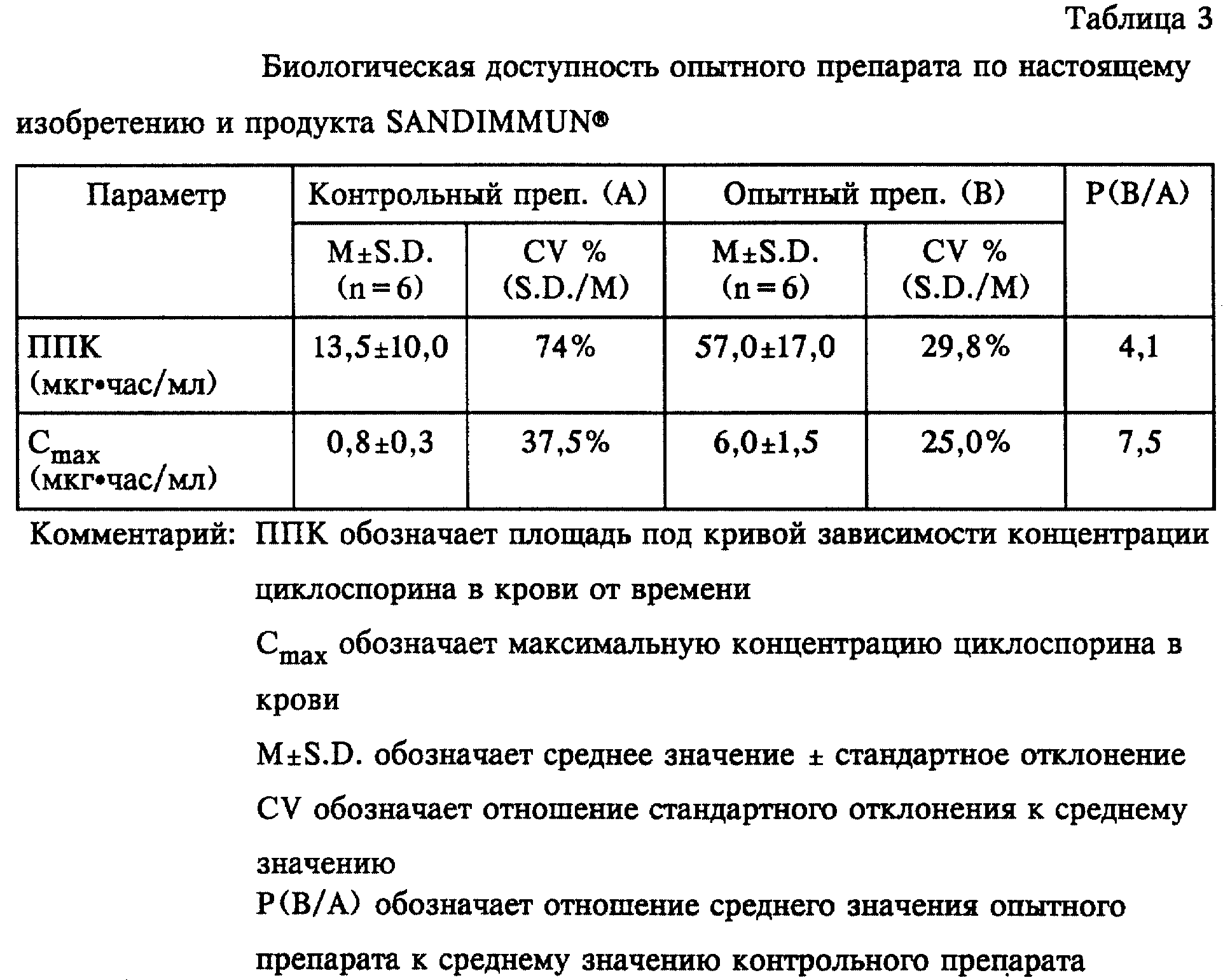
Биологическая доступность препарата, полученного путем капсулирования композиции из примера 1 в желатиновую оболочку, имеющую указанный в разделе
6.2 примера 6 (опытная группа) состав, сравнивали с биологической доступностью имеющегося в продаже содержащего этанол продукта SANDIMMUN Capsule, который использовали в качестве контрольного
препарата для оценки влияния препарата на основе циклоспорина по настоящему изобретению на биологическую доступность циклоспорина и на изменение этого параметра у разных пациентов.
В этом эксперименте как опытный препарат, так и контрольный препарат вводили из расчета 300 мг циклоспорина на кг веса кролика.
Кроликов содержали в течение 4 дней или более в одинаковых условиях в проволочных клетках на одинаковом корме, состоящем из твердой питательной композиции для кроликов. Для проведения опытов по оральному введению препарата кроликов закрепляли на 48 часов в ограничивающей движение клетке, выполненной из стали, и в течение этого периода времени кролики имели свободный доступ к воде.
Назогастральный зонд диаметром 5 мм, поверхность которого была предварительно смазана вазелином для уменьшения трения, вводили на глубину 30 см через пищевод. Каждый из опытных препаратов и контрольный препарат эмульгировали с помощью 50 мл воды и затем вводили в шприц, присоединенный к назограстральному зонду. Ушные вены кролика расширяли с помощью ксилола и затем брали образцы крови из каждой вены кролика до опыта и через 0,5, 1, 1,5, 2, 3, 4, 6, 10 и 24 часа с помощью одноразового шприца, обработанного гепарином. К 1 мл полученной таким образом крови добавляли 0,5 мл водного насыщенного раствора хлорида натрия и 2 мл простого эфира, затем смесь встряхивали в течение 5 минут и центрифугировали при 5000 об/мин в течение 10 минут для отделения супернатанта (эфирного слоя). Отбирали 1 мл супернатанта и подвергали обработке с использованием активированной двуокиси кремния на sep-pak® (фирма Waters). Обработанный sep-pak промывали 5 мл н-гексана и элюировали 2 мл метанола. Элюат упаривали досуха в атмосфере азота при пониженном давлении. Остаток анализировали с помощью ЖХВР (жидкостная хроматография высокого разрешения) [условия ЖХВР: колонка типа μ-Bondapak® C18 (фирма Waters), подвижная фаза СН3CN:МеОН:H2О в соотношении 55:15:30, обнаружение при 210 нм, скорость потока 1,0 мл/мин, температура колонки 70oС, чувствительность метода 0,01 Aufs., объем инъекции 100 мкл].
Результаты, полученные при использовании опытного препарата и контрольного препарата, приведены в таблице 3.
Как можно видеть из таблицы 3, для опытного препарата обнаружено увеличение значений ППК и Сmax, которые соответственно приблизительно в 4 раза или более и приблизительно в 7 раз или более превышают таковые для контрольного препарата. Таким образом, можно заключить, что биологическая доступность опытного препарата существенно выше, чем у контрольного препарата. Кроме того, опытный препарат по настоящему изобретению характеризуется способностью снижать различие между соответствующими показателями (CV %) для опытных животных. Так, например, разница значений ППК снижается приблизительно в 2 раза или более, а разница значений Сmax снижается приблизительно в 1,5 раза по сравнению с контрольным препаратом.
Следовательно, при использовании препарата в виде капсулы с мягким покрытием в соответствии с настоящим изобретением, который вводят пероральным путем, биологическая доступность циклоспорина повышается приблизительно в 4 раза по сравнению с известным продуктом, содержащим этанол, SANDIMMUN® Capsule, а также снижается различие между биологической доступностью циклоспорина для различных особей и в то же время сохраняется стабильность без какого-либо изменения в течение продолжительного периода хранения. Таким образом, очевидно, что препарат в виде капсулы с мягким покрытием в соответствии с настоящим изобретением обладает значительным преимуществом среди известных в данной области препаратов на основе циклоспорина в виде капсул с мягким покрытием.
Пример 9
Изготавливают препараты в виде капсул с мягким
гелевым покрытием, содержание которых представлено в таблице 4.
Реферат
Изобретение может быть использовано в фармации и медицине для подавления врожденных иммунологических реакций живого организма, причиной которых является трансплантация тканей и органов. Предложен препарат в виде желатиновой капсулы с мягким покрытием. Капсула содержит фармацевтическую композицию, включающую: I - циклоспорин, II - пропиленкарбонат, III - смесь триглицерида жирной кислоты со средней длиной цепи и моноглицерида жирной кислоты в качестве замасливателя и IV - поверхностно-активное вещество, значение гидрофильно-липофильного баланса (НLB) которого составляет от 8 до 17. Изобретение позволяет создать лекарственную форму, имеющую стандартную дозу циклоспорина, удобную для введения пациенту. Фармацевтическая композиция в капсуле является стабильной и обладает высокой биологической доступностью независимо от особенности отдельных пациентов. 15 з.п. ф-лы, 4 табл.
Формула
(I) циклоспорин в качестве активного ингредиента,
(II) пропиленкарбонат,
(III) смесь триглицерида жирной кислоты со средней длиной цепи и моноглицерида жирной кислоты в качестве замасливателя и
(IV) поверхностно-активное вещество, значение гидрофильно-липофильного баланса (НLB) которого составляет от 8 до 17, предпочтительно полиоксиэтилированный продукт гидрированного растительного масла.
19.06.1996 по пп. 1-13,15-17;
14.03.1997 по пп. 6 и 7.

Комментарии