Иммуносупрессорная композиция, содержащая циклоспорин, и способ ее получения - RU2119351C1
Код документа: RU2119351C1
Чертежи
Описание
Данное изобретение относится к композиции, содержащей циклоспорин, и к способу ее получения.
Описание предшествующего уровня
Циклоспорины, группа циклических
полипептидов, включающих II аминокислот и имеющих структурную формулу (I), полезны в качестве иммуносупрессоров, подавляющих отторжение алогенного трансплантата, которое может иметь место при
трансплантации органов животных, включая человеческие особи.
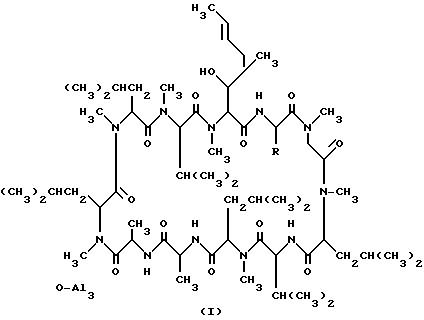
Циклоспорин A : R = CH2CH3;
Циклоспорин B : R = CH3;
Циклоспорин C : R = CH(OH)-CH3;
Циклоспорин D : R = CH(CH3)2; и
Циклоспорин G : R = CH2CH2CH3.
Однако, несмотря на полезность этих соединений, фармацевтические рецептуры, содержащие циклоспорины, имеют ограниченную применимость ввиду их экстремально низкой растворимости в воде (20-30 мкг/мл).
Ближайшим аналогом заявляемой композиции являются описанные в публикации международной заявки WO94/05312 фармацевтические композиции, содержащие N-метилированные циклические ундекапептиды, главным образом для внутреннего применения, в которых присутствует от 0,1 до 20 частей по массе соединения из группы циклоспоринов (A), от 0,3 до 60 частей по массе эмульгатора (B), содержащего ангидроманит олеиновый эфир и/или лактоглицерид и/или цитроглицерид, от 0,1 до 10 по массе эмульсионного стабилизатора (C), содержащего алюминиево-магниевый гидроксистеарат в виде липогеля и от 0,2 до 40 частей по массе растворителя (D), состоящего из 1,4:3,6-диангидро-2,5-0-метил-D-глюцита и/или 1, 3-диметил-2-имидазолидона и/или этанола, в соотношении A:B, равном 1:0,5-1:30.
В патенте США N 4388307 описываются фармацевтические композиции, содержащие циклоспорины (SANDIMMUN или SANDIMMUNE) в форме раствора для инъекции или для перорального введения или в форме мягких капсул, наполненных этим раствором. Раствор получают диспергированием циклоспорина в растительном масле при использовании этоксилированного касторового масла (полученного при взаимодействии натурального или гидрированного касторового масла и окиси этилена) или продукта переэтерификации триглицерида натурального растительного масла и полиалкиленполиола в качестве эмульгатора и этанола в качестве солюбилизирующего вещества. Однако этот способ имеет некоторые недостатки. Например, когда маслянистая композиция контактирует с водным раствором во рту или кишечнике, компонент лекарства часто выделяется в виде твердого вещества, в результате чего его биологическая доступность снижается до уровня, например, менее 30%. Кроме того, при длительном хранении циклоспорины имеют склонность к кристаллизации при уменьшении содержания этанола в результате испарения; и пациенты страдают из-за неприятного запаха этоксилированного касторового масла.
В связи с этим было предпринято много попыток разработать циклоспоринсодержащую рецептуру с улучшенной стабильностью и биологической доступностью. Например, в патенте Японии N 89-38029 описывается способ растворения циклоспорина в органическом растворителе с поверхностно-активным веществом с последующей сушкой продукта; в патентах Германия NN 295765 и 295766 заявляется способ растворения циклоспоринов в этаноле с поверхностно-активным веществом с лиофилизацией полученного продукта; в Международной заявке PCT N WO 90-00389 раскрывается способ солюбилизации циклоспоринов с помощью липосом с лиофилизацией полученного продукта; в патенте Германии N 293499 описывается способ растворения циклоспоринов в пропиленгликоле, суспендирование раствора полимерным полисахаридом и нанесение суспензии на твердый носитель.
Но несмотря на то, что с помощью указанных выше способов можно достичь некоторого улучшения стабильности рецептуры при минимальном содержании в ней этанола, они обладают некоторыми недостатками. Например, применение поверхностно-активных веществ, имеющих сложное строение, не является практически приемлемым или необходимым для получения рецептуры; липосома усложняет процесс в целом, и воспроизводимость размера частицы или скорость включения трудно контролировать; применение полимерного полисахарида может привести к тому, что общий объем рецептуры станет слишком большим для введения. Кроме того, разработанные ранее способы не приводят к получению циклоспоринсодержащих композиций, обладающих удовлетворительной скоростью растворения в водном растворе.
Краткое описание изобретения
В связи с вышеизложенным целью
данного изобретения является
циклоспорин-содержащая композиция, которая обладает улучшенной стабильностью, а также высокой скоростью растворения и высокой концентрацией циклоспорина в крови.
Другой целью данного изобретения является способ получения композиции данного изобретения.
В соответствии с одним аспектом данного изобретения предлагается композиция, включающая от 1,0 до 40 вес.% циклоспорина A, от 0,1 до 30% вес. эмульгатора и от 5 до 80% вес. пористого декстрина - из расчета на общий вес композиции.
В соответствии с другим аспектом данного изобретения предлагается способ получения циклоспоринсодержащей композиции, который включает следующие стадии: растворение циклоспорина A в этаноле с эмульгатором, добавление в раствор пористого декстрина для получения смеси и сушка смеси.
Краткое пояснение рисунка
На рисунке 1 показано изменение концентрации в крови циклоспорина композиции данного
изобретения (0) и препарата
SANDIMMUN (0) во времени.
Подробное описание изобретения
Пористый декстрин, который может преимущественно использоваться в композиции данного
изобретения, обладает высокой
пористостью. Он растворим в воде, но нерастворим в этаноле. Когда пористый декстрин добавляют в этанольный раствор, содержащий циклоспорин и эмульгатор, раствор
абсорбируется в поры пористого
декстрина, диспергируя таким образом циклоспорин и эмульгатор в пористый декстрин. В том случае, когда смесь пористого декстрина и этанольного раствора, содержащего
циклоспорин и эмульгатор,
разбавляют большим количеством воды, она микроэмульгируется с образованием эмульсии, которую применяют в том случае, когда смесь вводят в организм, содержащий водную среду.
Такой пористый декстрин
можно также добавлять в виде его водного раствора в этанольный раствор, содержащий циклоспорин и эмульгатор, затем смесь микроэмульгируется в результате действия эмульгатора с
образованием гомогенного
раствора. То есть композиция данного изобретения, содержащая циклоспорин, микроэмульгируется, что повышает способность лекарства к распределению, препятствует от его
кристаллизации in vivo и таким
образом ускоряет растворение циклоспорина. Кроме того, композиция данного изобретения может быть получена в твердой форме, которая обладает повышенной стабильностью и
высокой скоростью растворения.
Циклоспоринсодержащая композиция данного изобретения может быть получена в соответствии с методикой, подробно описанной ниже.
Сначала циклоспорин A растворяют в этаноле вместе с эмульгатором. В качестве эмульгатора можно использовать различные фармацевтически приемлемые поверхностно-активные вещества, предпочтительно Тилоксапол (Tyloxapol), Полоксамер (Poloxamer), Твин (Tween), Лабрафил (Labrafil) и Кремофор (Cremopfor). Эмульгатор можно применять в количестве от 0,1 до 30% вес., предпочтительно от 1 до 15% вес., из расчета на общий вес композиции. Количество циклоспорина A может заключаться в интервале от 1,0 до 40% вес., предпочтительно от 8 до 15% вес. - из расчета на общий вес композиции. Этанол можно применять в количестве, достаточном для растворения циклоспорина A и эмульгатора.
Затем в этанольный раствор циклоспорина A и эмульгатора добавляют пористый декстрин в количестве от 5 до 80% вес. из расчета на общий вес композиции. Пористый декстрин можно добавлять в форме водного раствора. Концентрация циклоспорина A в водном растворе заключается предпочтительно в интервале от 20 до 50% (вес./вес.).
После этого полученную смесь сушат для получения циклоспоринсодержащей композиции данного изобретения, например в форме тонкоизмельченного порошка или мелкозернистых гранул. Сушку можно проводит с помощью общепринятого способа, предпочтительно распылительной сушкой или сушкой под пониженным давлением. Например, композиция данного изобретения в форме тонкоизмельченного порошка может быть получена с хорошим выходом при применении водного раствора пористого декстрина с последующим удалением воды и этанола посредством распылительной сушки.
С другой стороны, композиция данного изобретения в форме гранул может быть получена при применении порошка пористого декстрина с последующей сушкой продукта под пониженным давлением.
Циклоспоринсодержащая композиция данного изобретения при необходимости может быть получена общеизвестным способом в форме таблеток или капсул с другими фармацевтическими носителями. Фармацевтически приемлемые носители могут представлять собой: дезинтегрирующее вещество, такое как крахмалы, альгиновая кислота, микрокристаллическая целлюлоза и т.д.; связующее вещество, такое как крахмальная паста (от 10 до 80%), желатиновый раствор (от 10 до 20%), метилцеллюлоза, этилцеллюлоза, карбоксиметилцеллюлоза, полиэтиленгликоль 4000, полиэтиленгликоль 6000, поливинилпиролидон и т.д.; смазывающее вещество, такое как стеарат магния, стеарат кальция, стеариновая кислота и т.д.; наполнитель, такой как лактоза, сахар, хлорид натрия, сульфат натрия, карбонат кальция, маннит, сорбит, тальк, минеральное масло и т.д.; и другие фармацевтически приемлемые красители, корригенты, вкусовые добавки, покрытия и консерванты.
Как описано выше, композиция данного изобретения, содержащая циклоспорин, при введении в организм может микроэмульгироваться; следовательно, повышается способность циклоспорина A распределяться, понижается кристаллизационная способность in vivo, и скорость растворения заметно возрастает. Кроме того, композиция данного изобретения содержит очень небольшое количество этанола, и следовательно, по существу не имеет недостатков, обусловленных испарением этанола. Композиция данного изобретения обладает преимуществом также в том, что она может быть легко получена в твердой форме.
Композиция данного изобретения предпочтительно может вводиться перорально. Терапевтически эффективные количества циклоспорина A, которые следует вводить, хорошо известны, например ежедневная доза составляет от приблизительно 2 мг/кг до приблизительно 14-17,5 мг/кг.
Приведенные далее примеры и опыты даны для иллюстрации данного изобретения более конкретно, без ограничения его области.
Пример
1
4 г циклоспорина A (PINEFLOW,
Matsutani Chemical Co. (Япония), удельный объем: 8,5 см3/г и 2 г полоксамера 407 растворяют в 20 г этанола. Раствор 10 г пористого декстрина в 40 г
очищенной воды добавляют в этанольный
раствор, смесь перемешивают в течение 10 мин. Полученный продукт сушат распылительной сушкой (температура на входе 105oC, температура на выходе 75oC, давление распыляющего
воздуха 3 кг/см2) с получением композиции данного изобретения в форме порошка. Содержание этанола в порошке определяют высокоэффективной жидкостной
хроматографией (ВЖХ), результаты
представлены в таблице 1 ниже.
Примеры 2-5
Композиции данного изобретения в виде порошкообразных рецептур получают по методике примера 1,
используя циклоспорин A, полоксамер
407, этанол, пористый декстрин и очищенную воду в количествах, указанных в таблице 1. Измеряют содержание этанола, результаты представлены в таблице 1 ниже.
Пример 6
4 г
циклоспорина A, 2 г тилоксапола и 3 г полоксамера 407, которые используются в качестве эмульгаторов, растворяют в этаноле. 10 г пористого декстрина добавляют в
этанольный раствор, из полученного
продукта традиционным способом изготавливают гранулы. Содержание этанола в гранулах определяют методом ВЖХ, результаты представлены в таблице 2 ниже.
Пример 7
Композиции
данного изобретения в виде гранул получают по методике примера 6, используя циклоспорин A, поликсамер 407, этанол, пористый декстрин и очищенную воду в количествах,
указанных в таблице 2. Измеряют
содержание в них этанола, результаты представлены в таблице 2 ниже.
Испытание 1. Тест на растворение (1)
Порошки, полученные в примерах 1-5,
помещают в твердые капсулы,
капсулы испытывают в описанных далее условиях. Результаты представлены в таблице 3 ниже. В качестве образца для сравнения используют простые смеси циклоспорина A,
эмульгатора и декстрина, а также
мягкие капсулы SANDIMMUN.
Условия проведения оценки растворения:
Раствор для испытания: искусственный желудочный сок (pH 1,2) 900 мл;
Температура: 37 ± 0,5oC.
Метод: метод размешивания (paddle method).
Сравнительные образцы:
Сравнительный образец 1:
Циклоспорин A:
Полоксамер 407: пористый декстрин
= 2 : 1 : 5.
Сравнительный образец 2:
Циклоспорин A: Полоксамер 407 = 2 : 1.
Сравнительный образец 3:
Мягкие
капсулы SANDIMMUM.
Испытание 2. Тест на растворение (2)
Гранулы, полученные в примерах 6 и 7, помещают в твердые капсулы, капсулы испытывают в условиях, описанных далее.
Результаты представлены в таблице 4
ниже. В качестве образцов для сравнения используют образец смеси циклоспорина A, эмульгатора и декстрина, а также мягкие капсулы SANDIMMUN.
Условия
проведения испытания на
растворение:
Раствор для испытания: искусственный желудочный сок (pH 1,2) 900 мл;
Температура: 37 ± 0,5oC.
Метод: метод размешивания (paddle method).
Сравнительные образцы:
Сравнительный образец 1:
Циклоспорин A: Полоксамер 407 : пористый декстрин = 2 : 1 : 5.
Сравнительный образец 2:
Циклоспорин A: Полоксамер 407 = 2 : 1.
Сравнительный образец 3:
Мягкие капсулы SANDIMMUN.
Испытание 3. Оценка биологической доступности.
Гранулы, полученные в примере 7, помещают в твердые капсулы, которые подвергаются испытанию. В качестве сравнительного образца используются мягкие капсулы SANDIMMUN.
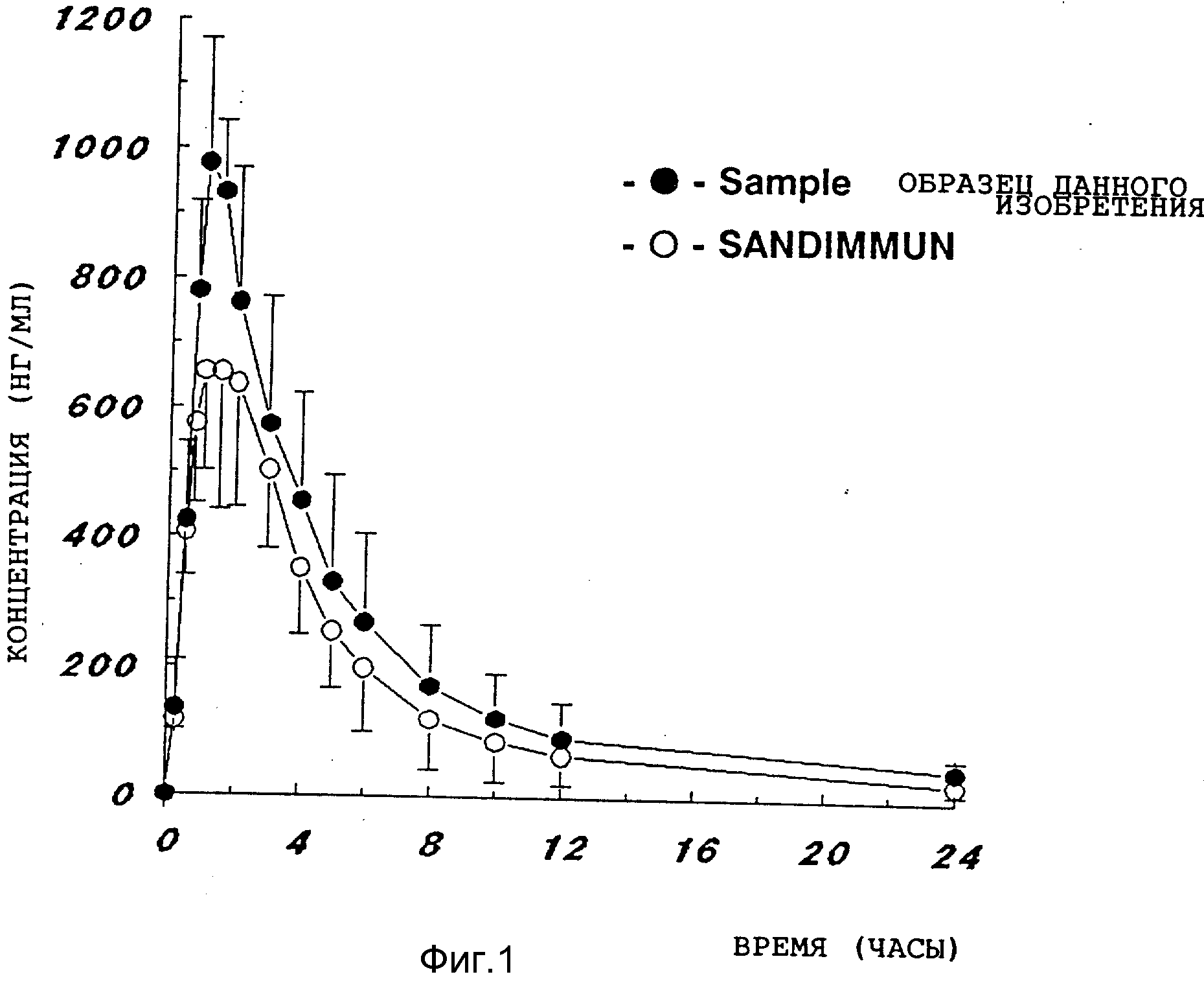
Испытываемые капсулы и сравнительные капсулы вводят перорально собакам (Beagl Dog) (9-12 кг) в дозе 10 мг/кг циклоспорина A. Собак выдерживают без пищи в течение 16 часов перед введением и 4 часа после введения лекарства, давая только воду. Пробы крови берут в количестве по 10 мкл через 0,25, 0,5, 0,75, 1, 1,5, 2, 3, 4, 5, 6, 8, 10, 12 часов и через 24 часа после введения лекарства. Концентрацию циклоспорина A в крови измеряют способом радиоиммунооценки, результаты представлены на рисунке 1.
Как видно из рисунка 1, максимальная концентрация в крови (Cmax) композиции, полученной в соответствии со способом данного изобретения, выше концентрации сравнительного образца приблизительно в 1,5 раза и площадь под кривой (ППК) композиция данного изобретения больше площади под кривой сравнительного образца приблизительно в 1,3 раза.
Из представленных выше результатов видно, что композиция данного изобретения обладает значительно улучшенной скоростью растворения, а также лучшей биодоступностью.
Следует учитывать, что в пределах области данного изобретения, определенной в приведенной далее формуле изобретения, могут быть внесены различные модификации и изменения.
Реферат
Изобретение относится к области медицины. Иммуносупрессорную композицию получают путем растворения циклоспорина А в этаноле с эмульгатором, добавления пористого декстрина, перемешивания и сушки полученной смеси. Полученная композиция обладает улучшенной стабильностью, высокой скоростью растворения и высокой концентрацией выделяемого циклоспорина в крови. 3 н.п., 8 з.п.ф-лы, 4 табл., 1 ил.
Формула
Циклоспорин А - 1,0 - 40
Эмульгатор - 0,1 - 30
Пористый декстрин - 5,0 - 80
2. Композиция по п.1, отличающаяся тем, что содержит в качестве эмульгатора Тилоксапол, Полоксамер или их смесь.

Комментарии