Трансгенные растения, экспрессирующие ген ацетил-соа-карбоксилазы - RU2187555C2
Код документа: RU2187555C2
Чертежи


















































Описание
Предпосылки изобретения
Ацетил СоА карбоксилаза (АССаза) представляет собой энзим, участвующий во многих важных схемах метаболизма в клетках растений, животных и бактерий. Этот энзим особенно важен для синтеза жирных кислот
в растениях и чувствителен к ингибированию некоторыми типами гербицидов. Структурно АССазы биотинилированы и представляют достаточно крупные энзимы, состоящие из одной или более субъединиц. Так
например, большинство АССаз животных, высших растений и дрожжей представляют димеры с MB 420-700 кД и содержат субъединицы от 200 до 280 кД. Диатомовые и водорослевые АССазы представляют 700-740 кД
тетрамеры из субъединиц в 160-180 кД. Бактериальные АССазы состоят из трех диссоциируемых протеинов: биотинкарбоксилазы (51 кД), биотинкарбоксильного протеина-носителя (22,5 кД) и
биотинтранскарбоксилазы (130 кД).
Ацетил СоА карбоксилаэа (АССаза) катализирует образование малонил-СоА из ацетил-СоА и бикарбоната в клетках животных, растений и бактерий. Малонил-СоА
представляет необходимый субстрат для (I) де ново синтеза жирной кислоты (Fa), (II) удлинения жирной кислоты, (III) синтеза таких вторичных метаболитов, как флавоноиды и антоцианы и (IV) малонизации
некоторых аминокислот и вторичных метаболитов. Синтез малонил-СоА представляет первую стадию синтеза флавоноида и жирной кислоты, и существующие доказательства позволяют предположить, что АССаза
катализирует лимитирующую скорость стадию синтеза жирной кислоты. Образование малонил-СоА за счет АСС происходит в результате двух отдельных реакций и требует наличия биотиновой группы:
(I)
Е-биотин+АТР+НСО3-->Е-биотин-CO2+ADP+Pi
(II) Е-биотин-СО2+Ацетил-СоА-->Е-биотин+малонил-СоА
(NET) Ацетил-СоА+АТР+НСО3
-->малонил-CoA+ADP+Pi
В E.coli эти реакции катализируются тремя различными компонентами: биотинкарбоксилазой, биотинтранскарбоксилазой и биотинкарбоксильным протеином-носителем,
которые можно разделить, и при этом все еще сохраняется частичная активность. Растительные и животные АССазы содержат все три активности в одном полипетиде.
В растениях большинство АССазных активностей расположено в пластидах зеленых и незеленых растительных тканей, включая листья и семена масличных. АССазная активность в листьях расположена, главным образом, в мезофильных клетках, но меньшие количества были обнаружены в С-4 клетках обкладки сосудистых пучков и в эпидермальных клетках. Подклеточное расположение АССазной активности в эпидермальных клетках неизвестно, но, так как синтез жирных кислот с очень длинными цепями (VLCFA) для образования восков, кутина и суберина происходит на эндоплазмическом ретикулуме (ER), малонил-СоА также можно получить из цитозольных АССаз. Напротив, АССазы у крыс являются, главным образом, цитозольными или ассоциированными с внешней митохондриальной мембраной.
Синтез де ново жирной кислоты в хлоропластах включает последовательное присоединение 2-х углеродов к ацетату, с использованием малоната в качестве 2-С донора. Все промежуточные присоединены к ацильному протеину-носителю (АСР). Синтез в пластидах напоминает синтез в E.coli тем, что комплекс синтеза жирной кислоты может быть разделен на отдельные энзимы: β-кетоацил-АСР синтазу (KAS), β-кетоацил-АСР редуктазу, β-гидрокси-АСР дегидратазу и еноил-АСР редуктазу, ацетил-СоА: АСР трансацитазу и малонил-СоА: АСР трансацилазу. Высокоактивный KAS III изоцим катализирует конденсацию ацетил-СоА и малонил-АСР. Последовательное присоединение малонил-СоА к ацил-АСР катализируемое KAS 1 приводит к образованию С16 ацил-АСР, некоторые из которых превращаются в С19 ацил-АСР за счет KAS II, а затем в С18:1-АСР. Затем метаболизм жирной кислоты разделяется: деэстерификация обеспечивает направление к цитоплазме (схема для эукариотов), где жирные кислоты можно далее превратить в ненасыщенные и/или удлинить за счет присоединения малонил-СоА в ER. В другом варианте жирные кислоты связываются с глицерин-3-фосфатом (схема для прокариотов), превращаются в ненасыщенные и используются для синтеза липидов хлоропласта. Часть цитоплазмических липидов возвращается в хлоропласт. Относительные вклады этих двух схем видоспецифичны но, по-видимому, должны быть относительно гибкими в мутантах в каждой из схем. В маслосохраняющих органах, таких, как семядоли и зародыши однодольных, триацилглицериды хранятся в цитоплазмических масляных телах, окруженных отдельной мембраной.
Конденсация малонил-СоА с фенилпропионил-СоА или ацетил-СоА приводит к синтезу флавоноидов, антоцианов или полиацетатов.
Конденсирование усиливается под действием света, элиситоров или патогенеза и может оказаться ограничивающей скорость стадией синтеза некоторых фитоалексинов. Помимо вторичных метаболитов, полученных за счет де ново синтеза, в растениях находятся малонильные конъюгаты флавоноидгликозидов, образованные за счет малонил-СоА: флавоноидгликозид малонилтрансферазы, D-аминокислоты и 1-амино-карбоксил-циклопропан (предшественник этилена). Малонилированные соединения накапливаются в вакуолях, вероятно, после синтеза в цитоплазме.
Важным свойством АССаз является центральная роль, которую они играют в синтезе жирных кислот и накоплении их в растениях и семенах. Доступное доказательство подтверждает идею о том, что АССазная активность является ограничивающей скорость стадией для синтеза де ново жирных кислот в растениях. Высокие скорости АССазной активности ин витро параллельна или несколько предшествует высоким скоростям отложения липидов или включения [14С] ацетата в липиды в развивающиеся листья или семена масличных. Значительные изменения в активности АССаз растений происходят во время развития хлоропластов и возрастание АССазной активности коррелирует с отложением липидов в развивающиеся семена масличных. Turnham et al., Biochem. J., 212:223 (1983); Beittenmiller et al., Plant Physiol., 100:923 (1992).
Среди других свойств следует отметить, что АССазы в большинстве однодольных также ингибируются некоторыми гербицидами. Включение [14С] ацетата в липиды кукурузы в значительной степени ингибируется флуазифопом и сетоксидимом за счет ингибирования пластидных АССаз. Однако, в ячмене флуазифоп оказывает слабое воздействие на включение [14С] ацетата в жирные кислоты с очень длинными цепями. Так как синтез жирных кислот с очень длинными цепями происходит в цитозоле на ER, а синтез де ново жирных кислот происходит в пластидах, цитозольный малонил-СоА может быть дополнен нечувствительным к гербицидам АССазным изоцимом.
Существует три общих механизма, с помощью которых растения могут быть устойчивыми по отношению к гербицидам или переносить их. Эти механизмы включают невосприимчивость по сайту действия гербицида (обычно энзима), быстрый метаболизм (конъюгацию или деградацию) гербицида, или незначительный захват и транслокацию гербицида. Замена сайта действия гербицида с восприимчивого на невосприимчивый является предпочтительным способом придания толерантности восприимчивым видам растений. Это происходит потому, что толерантность этой природы, по-видимому, является характерной чертой, кодируемой одним геном, и, по-видимому охватывает целые семейства соединений, которые разделяют единый сайт действия, а не отдельные химикалии. Поэтому подробная информация относительно биохимических сайтов и механизма действия гербицидов является очень важной и может быть использована двумя способами. Во-первых, эту информацию можно использовать для разработки стратегии селекции клеток для эффективной идентификации и выделения соответствующих устойчивых к гербицидам вариантов. Во-вторых, ее можно использовать для характеристики вариантов клеточных линий и регенерированных растений, результатов селекции.
Способы культуры тканей используют для отбора по устойчивости (или переносимости), используя различные гербициды и виды растений (см. обзор Meredith and Carlson 1982, in Herbicide Resistance in Plants eds. Lebaron and Gressel pp.275-291, John Wiley and Sons, NY). Так например, P.C. Anderson и др. в патенте США 4761373 раскрывает использование методов культуры тканей для получения растений кукурузы, устойчивых к гербицидным имидазолидонам и сульфонамидам. Устойчивость связана с присутствием видоизмененной синтазы ацетогидроксикислоты, которая устойчива к дезактивации этими гербицидами.
Некоторые 1,3-циклогександионы демонстрируют общую и селективную гербицидную активность против растений. Одним таким циклогександионом является сетоксидим (2-[1-(этокси-мино)-бутил] -5-[2-(этилтио)пропил]-3-гидрокси-2-циклогексан-1-он). Сетоксидим коммерчески доступен от BASF (Parsippany, ТМ New Jersey) под торговой маркой POASTТМ.
Другие гербицидные циклогександионы включают клетодим, (Е,Е)-(±)-2-[1-[[(3-хлор-2-пропенил)окси] имино] пропил]-5-[2-(этилтио)пропил]-3-гидрокси-2-циклогексен-1-он; доступный как SELESTТМ от Chevron Chemical (Valent) (Fresno, California); клопроксидим, (Е,Е)-2-[1-[[(3-хлор-2-пропенил)окси] имино] бутил]-5-[2-(этилтио)пропил]-3-гидрокси-2-циклогексен-1-он; доступный как SELECTONEТМ от Chevron Chemical (Valent) (Fresno, California) и тралкоксидим, 2-[1-(этоксиимино)пропил] -3-гидрокси-5-мезитилциклогекс-2-енон, доступный как GRASPТМ от Dow Chemical USA (Midland, Michigan).
Для целей настоящего описания гербициды, раскрытые в двух предшествующих пунктах, и другие структурно родственные гербицидные соединения называют общим термином: семейство циклогександионовых гербицидов.
Некоторые арилоксифеноксипропановые кислоты демонстрируют общую и селективную гербицидную активность против растений. В этих соединениях арилоксигруппа может быть фенокси, пиридинилокси или хиноксалинильной группой. Одной из таких гербицидных арилоксифеноксипропановых кислот является галоксифор, (2-[4-[[3-хлор-5-(трифторметил)-2-пиридинил] окси]фенокси]-пропановая кислота), которая доступна как VERDICTТМ от Dow Chemical USA (Michigan, Midland). Другой является диклофоп, ((±)-2-[4-(2,4-дихлорфенокси)-фенокси]пропановая кислота), доступная как HOELONТМ от Hoechst-Roussel Agri-Vet Company (Somerville, New Jersey).
Другие члены этого семейства гербицидов включают феноксиапроп, (± )-2-[4-[(6-хлор-2-бензоксазолил)окси] фенокси] пропановую кислоту, доступную как WHIPТМ от Hoechst-Roussel Agri-Vet Company (Sommerville, New Jersey); флуазифоп, (± )-2-[4-[[-5-(трифторметил)-2-пиридинил] окси] фенокси] пропановую кислоту; доступную как FUSILADEТМ от ICI Americas (Wilmington, Delaware); флуазифоп-Р, (R)-2-[4-[[5-(трифторметил)-2-пиридинил]окси]фенокси]пропановую кислоту, доступную как FUSILADE 2000ТМ от ICI Americas (Wilmington, Delaware); и хизалофоп (± )-2-[4-[(6-хлор-2-хиноксалинил)-окси]фенокси]пропановую кислоту, доступную как ASSUREТМ от E.I.DuPont de Nemours (Willmington, Delaware).
Для целей настоящего описания гербициды, перечисленные в двух предшествующих абзацах, и другие, структурно родственные гербицидные соединения называют общим термином гербицидные арилоксифеноксипропановые кислоты.
Так, существует необходимость в способах создания растений, которые устойчивы по отношению к гербицидам или их переносят. Существует также необходимость в повышении содержания в растениях и их семенах масла и/или жирных кислот, а также в способах повышения их устойчивости к гербицидам. Более того, существует необходимость в идентификации и клонировании генов, играющих важную роль в придании устойчивости к гербицидам и в повышении содержания масла в растениях.
Краткое содержание изобретения
В настоящем изобретении предложены выделенная и очищенная молекула ДНК:
включающая ДНК сегмент, кодирующий ген ацетил-СоА-карбоксилазы кукурузы и способы придания устойчивости к гербицидам и/или изменения содержания масла в растениях путем введения и экспрессии гена
ацетил-СоА-карбоксилазы растения в растительные клетки. Молекула ДНК, кодирующая ацетил-СоА-карбоксилазу растения, может кодировать неизмененную ацетил-СоА-карбоксилазу растения, или измененную
ацетил-СоА-карбоксилазу растения, практически толерантную к ингибированию циклогександионовыми гербицидами, или гербицидами арилоксифеноксипропановой кислоты, а также кодировать антисмысловую ДНК
последовательность, которая практически комплементарна гену ацетил-СоА-карбоксилазы растения или его части. ДНК молекула настоящего изобретения может далее содержать терминальную транзитную пептидную
последовательность хлоропласта растения, операбельно связанную с геном ацетил-СоА-карбоксилазы кукурузы.
Способы придания растению толерантности к циклогександионовым гербицидам и к гербицидам арилоксифеноксипропановой кислоты включают стадии введения химерической молекулы ДНК, включающий ген, кодирующий ацетил-СоА-карбоксилазу растения или его измененный или функциональный мутант, операбельно связанный с промотором, функциональным в клетке растения, в клетки рассматриваемого растения. Этот промотор может быть индуцируемым или ткане-специфичным промотором, чтобы обеспечить сверхэкспрессию, по крайней мере, двукратного количества нативной ацетил-СоА-карбоксилазы растения. Функциональная связь промотора с химерической ДНК молекулой приводит к экспрессионной кассете. Экспрессия химерической ДНК молекулы осуществляется в количестве, эффективном для придания ацетил-СоА-карбоксилазе и/или тканям растения значительной толерантности к гербицидам по сравнению с нативной ацетил-СоА-карбоксилазой, присутствующей в указанном растении. Устойчивости к гербицидам можно достичь в растениях, по крайней мере, двумя способами, включая повышение уровня генной экспрессии нативной или неизмененной ацетил-СоА-карбоксилазы, или путем введения измененного гена, кодирующего ацетил-СоА-карбоксилазу, который менее чувствителен к ингибированию за счет гербицидов. Уровень генной экспрессии можно повысить либо комбинируя ген ацетил-СоА-карбоксилазы растения с промотором, который обеспечивает высокий уровень генной экспрессии, такой, как промотор вируса мозаики 35S цветной капусты (CaMV), или вводя в клетку множественные копии гена, с тем, чтобы эти множественные копии гена были интегрированы в геном трансформированных растительных клеток. Предпочтительными растительными клетками, в которые следует вводить экспрессионную кассету настоящего изобретения для достижения толерантности к гербицидам, являются клетки однодольных растений. После того, как получают трансформированные клетки растения, демонстрирующие толерантность к гербицидам, из них можно воссоздать трансгенные растения и семена, и провести оценку стабильности наследования свойства толерантности к гербицидам.
В настоящем изобретении предложен также способ изменения, предпочтительно, повышения содержания масла в растении. Этот способ включает стадии введения
химерической ДНК молекулы, содержащей ген, кодирующий ацетил-СоА-карбоксилазу растения или его измененный или функциональный мутант, операбельно связанный с промотором, функциональным в клетке
растения, в клетки тканей растения и экспрессию гена в количестве, эффективном для изменения содержания масла в клетках растения. Изменение содержания масла может включать изменение полного содержания
масла по сравнению с количеством, обычно присутствующим в этом типе клеток растения, или изменение типа масла, присутствующего в клетках. Изменения содержания масла в клетках растения по способу
настоящего изобретения может быть достигнуто двумя способами, включая:
(1) усиление или ослабление экспрессии измененного ацетил-СоА-карбоксилазного гена; или
(2) путем введения
измененного или функционального мутанта гена ацетил-СоА-карбоксилазы растения.
Уровень генной экспрессии неизмененного гена ацетил-СоА-карбоксилазы растения можно повысить, либо комбинируя неизмененную ацетил-СоА-карбоксилазу растения с промотором, который обеспечивает высокий уровень экспрессии, или вводя множество копий экспрессионной кассеты в клетки с тем, чтобы это множество копий было интегрировано в геном. Если измененный или функциональный мутант гена ацетил-СоА-карбоксилазы растения кодирует энзим, который демонстрирует возрастание специфической активности, это может привести к увеличению полного содержания масла в растительной клетке. Если измененный ген или функциональный мутант гена ацетил-СоА-карбоксилазы растения кодирует энзим со снижением специфической активности, это может привести к снижению полного содержания масла в растительной клетке. Предпочтительно, вводить экспрессионную кассету в двудольные растения, такие, как соя, канола (canola) и подсолнечник. В наиболее предпочтительном варианте трансформированные клетки, демонстрирующие в 1,2-5 раз увеличение полного содержания масла и/или экспрессии специфической активности ацетил-СоА-карбоксилазы, отбирают и используют для создания трансгенных растений и семян, демонстрирующих существенное увеличение содержания масла. Существенное повышение содержания масла зависит от содержания масла, обычно присутствующего в растениях и семенах, и может составлять примерно 1,2-20-кратное увеличение.
В настоящем изобретении предложен также способ получения растительной ацетил-СоА-карбоксилазы в клетках хозяина. Этот способ включает стадии введения экспрессионной кассеты, содержащей химерический ген, кодирующий растительную ацетил-СоА-карбоксилазу или измененную или функциональную мутацию ацетил-СоА-карбоксилазы растения, операбельно связанную с промотором в клетке хозяина и экспрессирующую ген в количестве, достаточном дчя обеспечения кристаллизации ацетил-СоА-карбоксилазы растения. Экспрессионная кассета может включать промотор, который функционален либо в эукариотных, либо в прокариотных клетках. Предпочтительно, чтобы экспрессионная кассета была введена в такие прокариотные клетки, как клетки E.coli, которые обычно используют для получения рекомбинантно полученных протеинов. Рекомбинантно полученная и кристаллизованная ацетил-СоА-карбоксилаза растения может быть затем использована для идентификации других гербицидов и их связывания с ацетил-СоА-карбоксилазой и ее ингибирования в растениях. Кроме того, доступность больших количеств очищенного энзима может позволить проведение скринирования по эффективности таких гербицидов с точки зрения их способности связываться с энзимом или каким-либо другим образом ингибировать активность этого энзима.
В настоящем изобретении предложена также выделенная и очищенная ДНК молекула из, по крайней мере, семи нуклеотидных оснований, которая гибридизуется в очень жестких условиях с ДНК молекулой, содержащей ДНК сегмент, кодирующий ацетил-СоА-карбоксилазу растения и обеспечивающий гибридизацию зонда, содержащего выделенную и очищенную ДНК молекулу из, по крайней мере, семи нуклеотидных оснований, которая содержит детектируемую метку, или которая связывается с детектируемой меткой, причем эта молекула ДНК гибридизуется в очень жестких условиях с некодирующей цепочкой ДНК молекулы, содержащей ДНК сегмент, кодирующий ацетил-СоА-карбоксилазу растения. Очень жесткие условия определяются следующим образом: гибридизация при 65oС в течение, по крайней мере 16 часов в 5 x SSC, 1 x раствор Денхардта, 50 мМ Tris-НСl, рН 8,0, 0,2% SDS, 10 мМ EDTA, 0,1 мг/мл ДНК спермы лосося, с последующей двукратной промывкой в течение 5 минут в 2 x SSC, 0,5% SDS при 25oС, один раз в течение 10 минут в 0,2 x SSC, 0,1% SDS при 25oС и дважды в течение 30 минут в 0,2 x SSC, 0,1% SDS при 65oС.
В настоящем изобретении предложен также способ введения экзогенного гена ацетил-СоА-карбоксилазы в клетки хозяина, включающий трансформацию клеток хозяина ин витро экспрессионной кассетой, включающей химерическую молекулу ДНК, кодирующую ген ацетил-СоА-карбоксилазы растения, операбельно связанный с промотором, функциональным в клетке хозяина, размножение трансформированных клеток хозяина ин витро и идентификацию трансформированных клеток хозяина, которые экспрессируют химерическую ДНК молекулу.
Термин "состоящий практически из" в том смысле, как использован в отношении рассматриваемых ДНК молекул, означает, что основная часть нуклеотидной последовательности кодирует АССазу, и что отсутствуют нуклеотидные последовательности, которые кодируют протеины, отличные от АССаз или их функциональных эквивалентов.
Фиг. 1 представляет схематическое изображение схемы биосинтеза жирных кислот в растениях.
Фиг. 2 представляет график зависимости роста каллюса мутантной кукурузы от действия сетоксидима.
Фиг. 3 представляет график зависимости удлинения корней сеянцев кукурузы через семь дней после их обработки различными концентрациями сетоксидима.
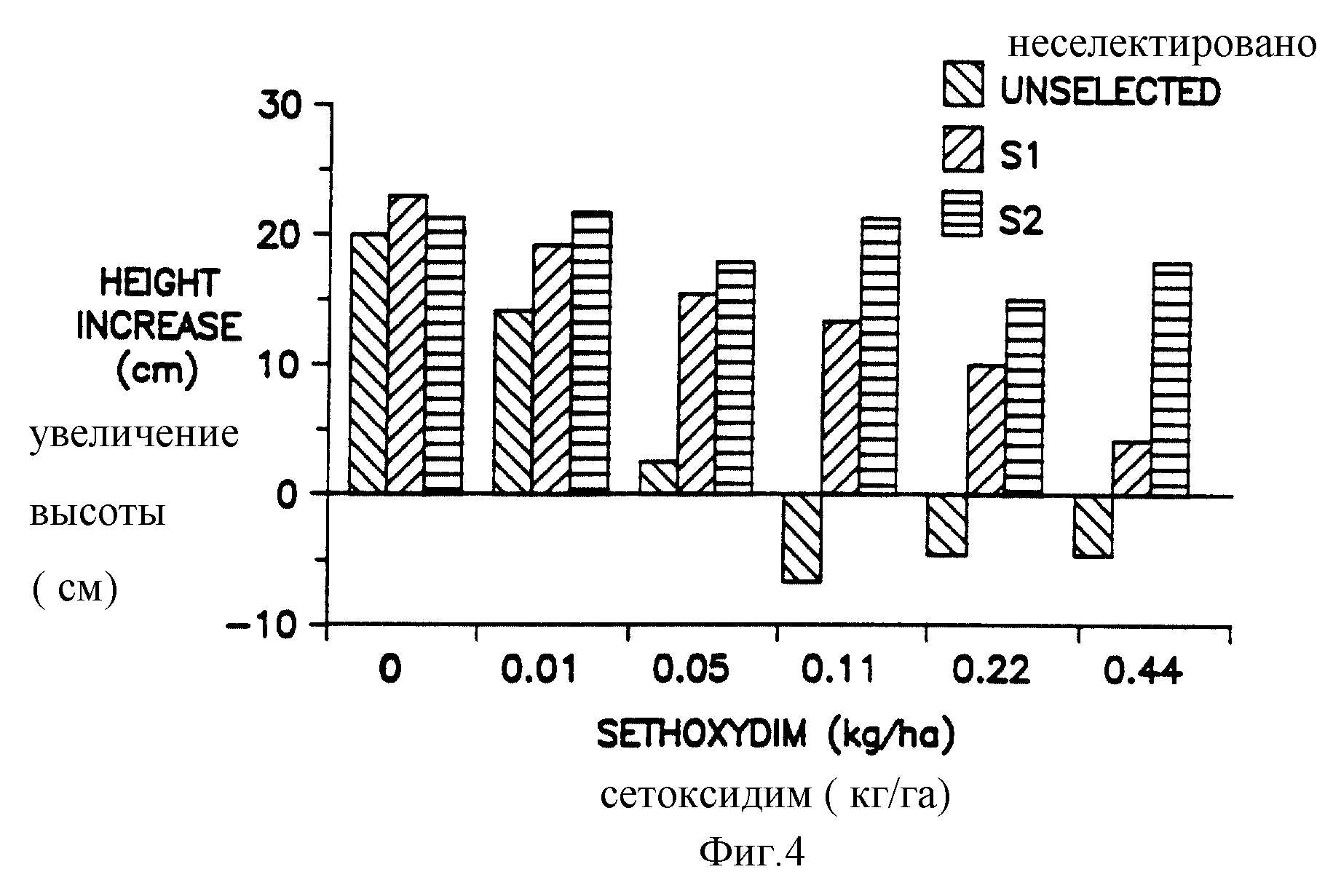
Фиг. 4 представляет график зависимости удлинения корней сеянцев кукурузы через 14 дней после обработки различными концентрациями сетоксидима.
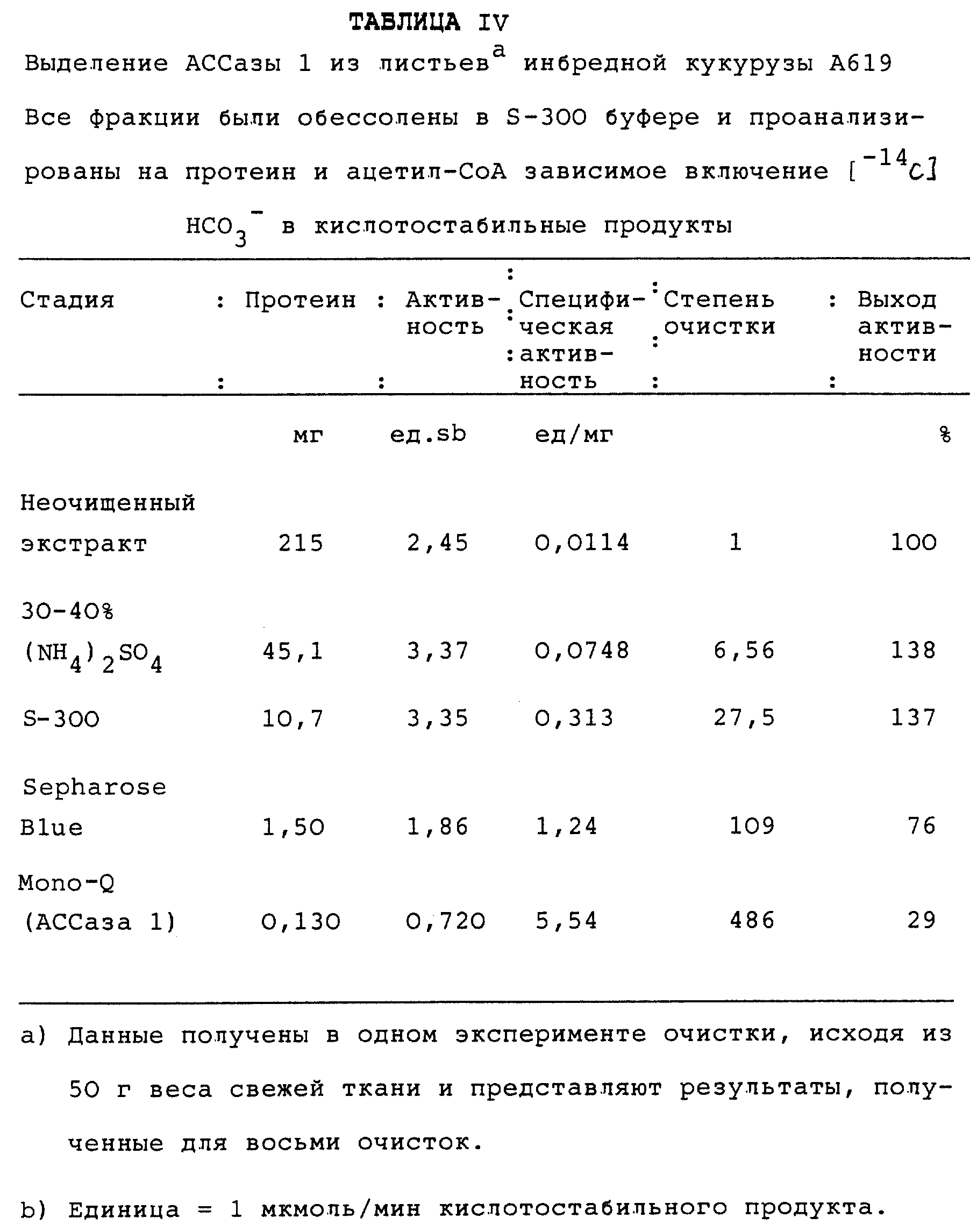
Фиг.5 представляет полные растворимые и биотинилированные полипептиды во фракциях очистки АССаз из листьев сеянцев кукурузы инбредной линии А619. Протеины разделены с помощью SDS-PAGE в 7, 5% гелях, а затем окрашены серебром (фиг.А). Идентичный гель подвергнут Вестерн-блоттингу и продольный срез каждой из полос зондирован авидином (фиг.В). Полосы были: 1:сырой (10 мкг), 2: (NH4)2SO4 (10 мкг); 3:S-300 (5 мкг); 4:синяя сефароза (2 мкг); 5:моно-Q АССаза II (5 мкг) и 6:моно-Q АССаза 1 (5 мкг). Диагональные линии между полосами указывают положения маркеров молекулярных весов, представленных слева.
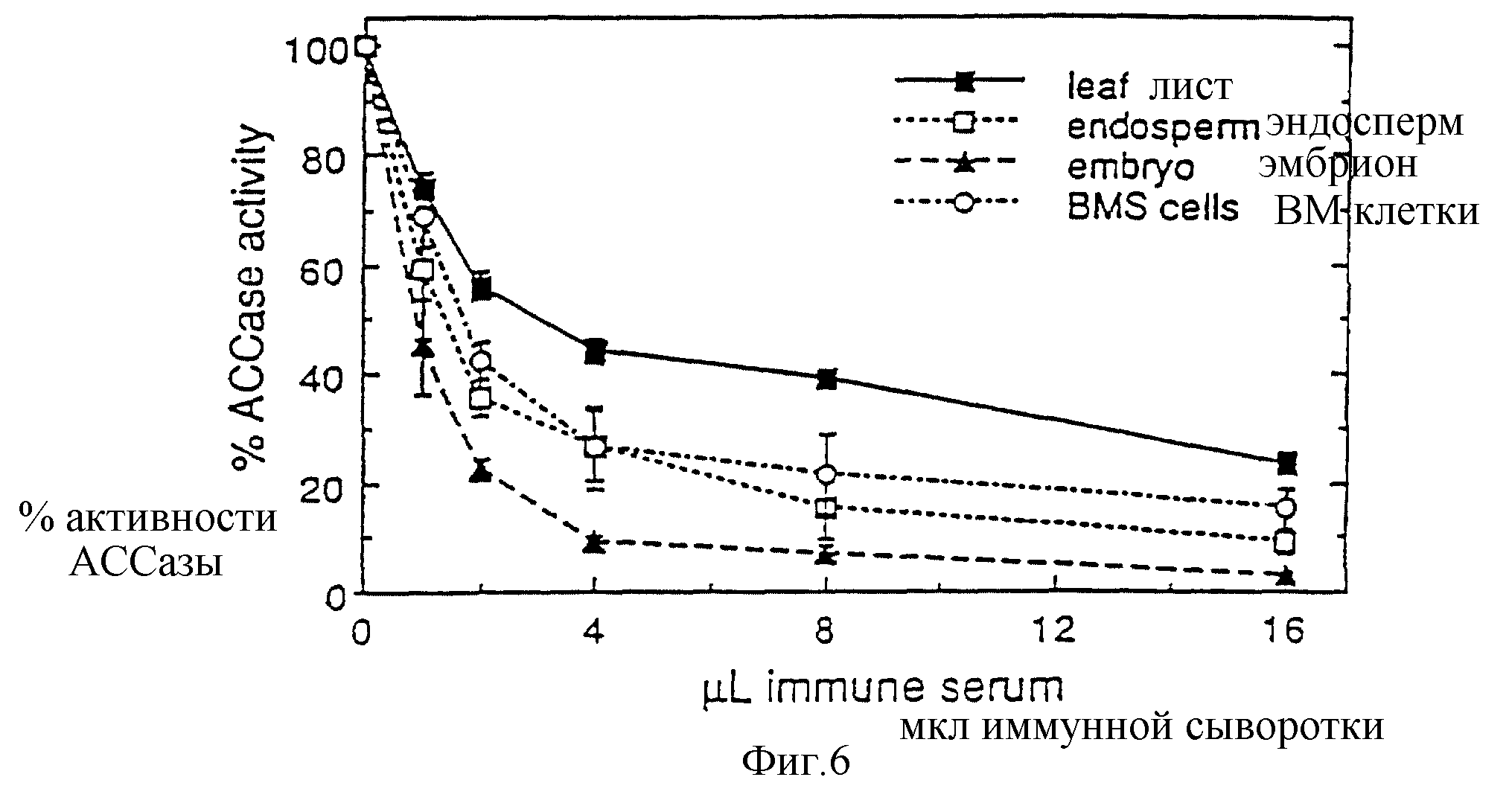
Фиг. 6 - иммуноосаждение Ассазной активности из В73 листа, эмбриона, эндосперма и BMS культивированных в суспензии клеток. Эквивалентные активности (0,58 нмолей/мин) инкубируют с 16 мкл сыворотки (иммунная плюс преиммунная). Иммунный комплекс осаждают с помощью протеин-А-агарозы, а активность АССазы, оставшуюся в образовавшейся надосадочной фракции, измеряют по сравнению с контролем-преиммунной сывороткой.
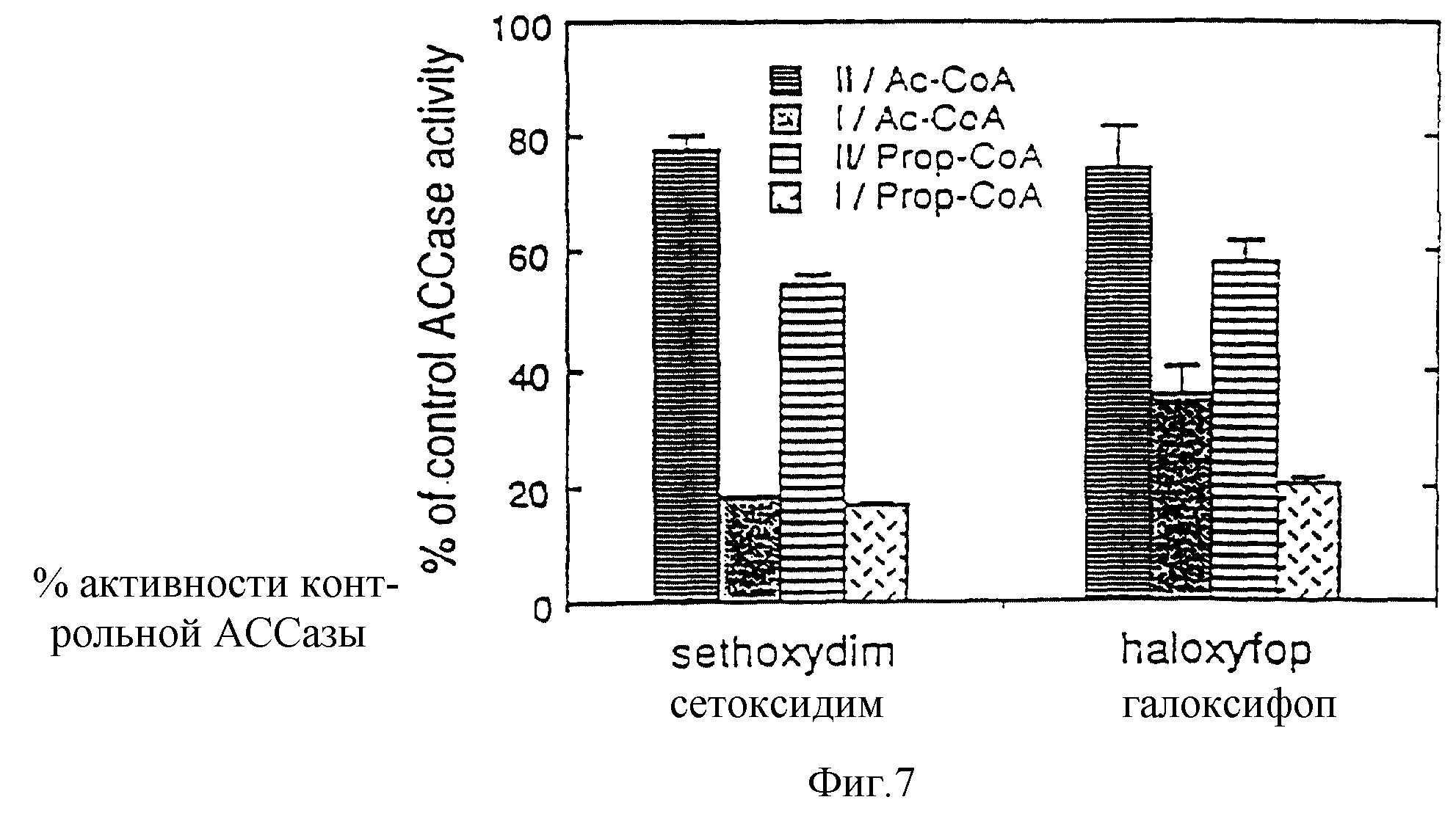
Фиг. 7 - ингибирование гербицидами ацетил-(АсСоА) или пропионил-СоА (проп-СоА)-зависимое Н14СО3-включение в кислотно-стабильный продукт за счет фракций АССазы 1 и II моно-Q активности в присутствии галоксифора (1 мкМ) относительно минус гербицидного контроля.
Фиг. 8 - сравнение пептидной последовательности клонов кДНК кукурузы 15-14 и 18-5 с АССазой цыпленка. Приблизительное положение биотинкарбоксилата, биотин связывающего сайта и биотинтранскарбоксилазного функциональных доменов показано для последовательности цыпленка. Процент идентичности аминокислот показан заштрихованными наискось прямоугольниками для кодирующей последовательности кукурузы. Участки геномных ДНК последовательностей клонов типа 1 и типа II, совпадающие с кДНК 18-5, указаны твердыми жирными линиями. Указаны примерные положения субклона 28 и 16 клонов из геномного типа 1 и субклона 34 из геномного типа II.
Фиг. 9 - норзернблоттинг полной РНК из листа, незрелого эмбриона и ткани эндосперма (через 16 дней после опыления) и клетки Black Mexican Sweet кукурузы (BMS). Полосы, содержащие 10 мкг полной РНК, зондируют 2 кb EcoRI фрагментом лямбда клона 15-14.
Фиг. 10 - ДНК последовательность (последовательность ID 1) 2 кb EcoRI фрагмент лямбда клона 15-14, включая участок гена АССазы кукурузы, расположенный по основаниям 2883 до 83 с 3' стоп кодона.
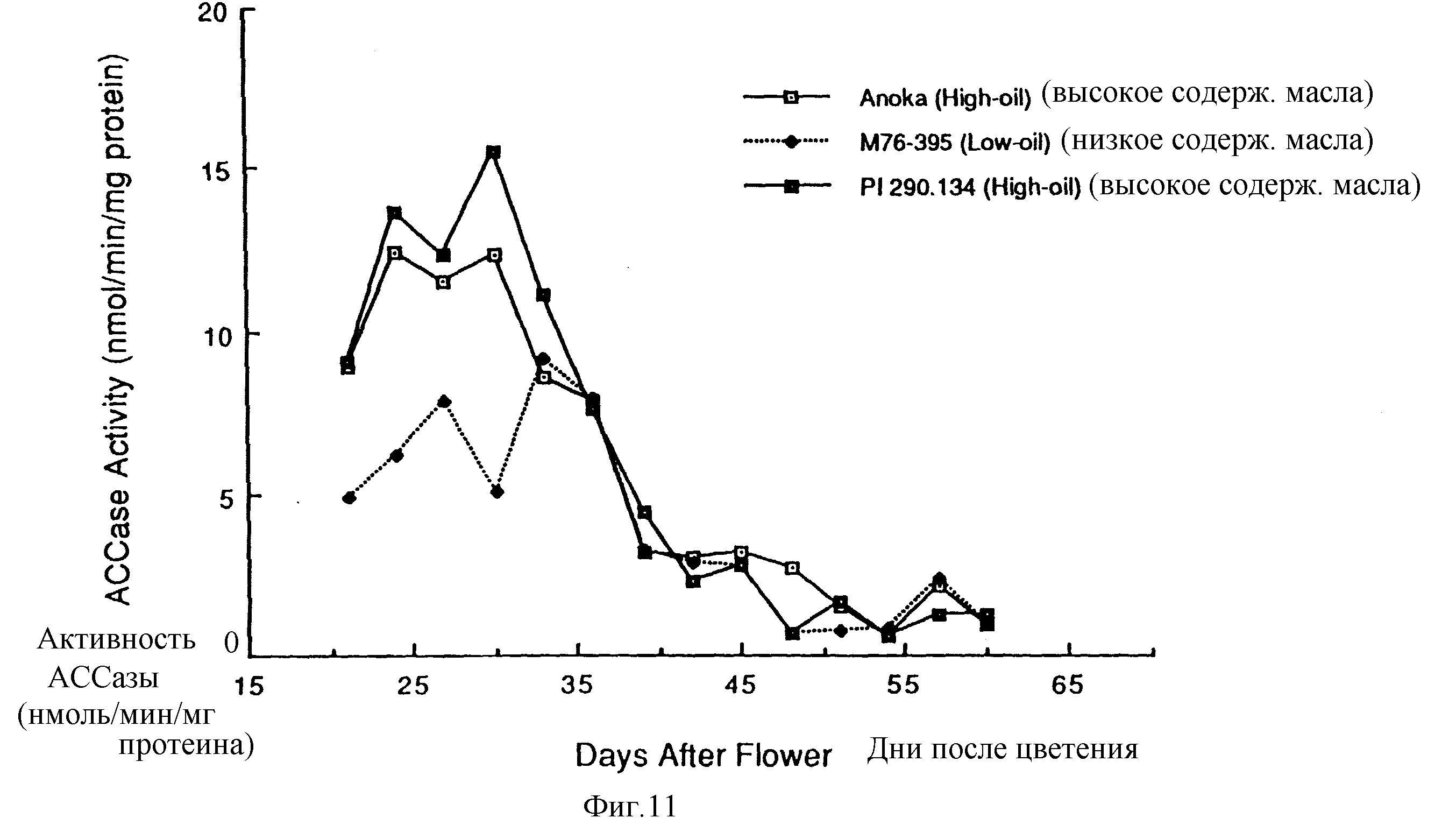
Фиг. 11 - график АССазной активности во время развития семян для двух клеточных линий сои с высоким содержанием масла и одной клеточной линии сои с низким содержанием масла.
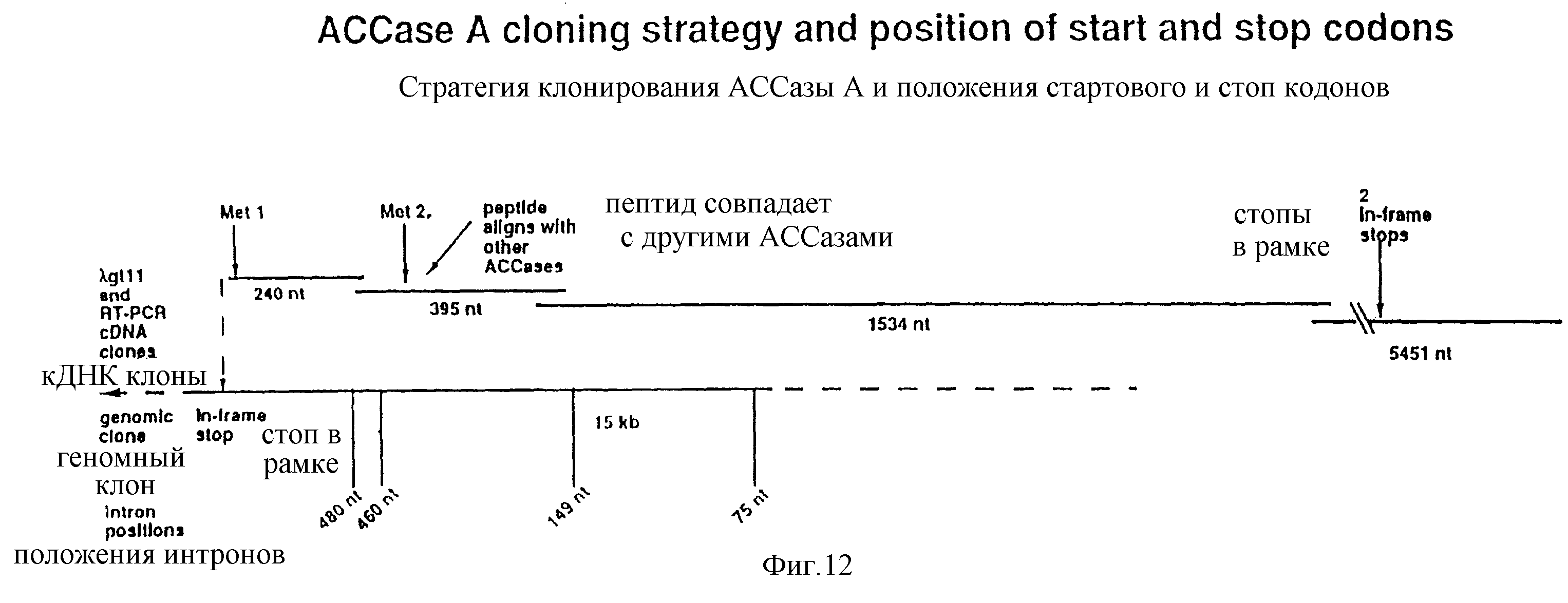
Фиг. 12 - стратегия клонирования для получения полной кодирующей последовательности гена АССазы кукурузы.
Фиг. 13 - ДНК последовательность (последовательность ID 5) 7470 пар оснований кДНК гена АССазы кукурузы (генный банк, регистрационный U19183).
Фиг. 14 - предсказанная аминокислотная последовательность полного АССазного гена кукурузы (последовательность ID 6).
Фиг.15 - рестрикционная карта АССазных геномных клонов.
Фиг. 16 - частичная нуклеотидная последовательность типа А1АССазного геномного клона (последовательность ID 12).
Фиг. 17 - частичная нуклеотидная последовательность клона 5А, типа А АССазного геномного клона (последовательность ID 13).
Фиг.18 - частичная нуклеотидная последовательность шести типа А2АССазных геномных клонов (A-F) (последовательности ID 14, 15, 16, 17, 18 и 19).
Фиг. 19 - частичная нуклеотидная последовательность трех типа В АССазных клонов (последовательности ID 20, 21 и 22).
Фиг.20 - SDS/PAGE анализ включения в хлоропласт35S-меченых АССазных полипептидов. (А) хлоропласты горошка и кукурузы, инкубированные с35S-мечеными АССазными полипептидами в течение 30 минут. (В) анализ во времени включения35S-меченых АССазных полипептидов в хлоропласты кукурузы.
Подробное описание изобретения
В настоящем изобретении предложена ДНК молекула, кодирующая ген ацетил-СоА-карбоксилазы и способы придания толерантности к гербицидам и/или изменения
содержания масла в растениях путем введения и экспрессии гена ацетил-СоА-карбоксилазы растения в растительные клетки. В растениях ацетил-СоА-карбоксилаза играет центральную роль в регулировании
синтеза жирных кислот и в восприимчивости однодольных к циклогександионовым гербицидам или гербицидам арилоксифенокси пропановой кислоты.
В соответствии с настоящим изобретением ген ацетил-СоА-карбоксилазы растения идентифицируют, выделяют и объединяют с промотором, функциональным в растительной клетке, для получения рекомбинантной экспрессионной кассеты. Ген ацетил-СоА-карбоксилазы растения можно вводить и экспрессировать в растительной клетке. В зависимости от типа растительной клетки уровень генной экспрессии и активность энзима, кодируемого геном, введение гена ацетил-СоА-карбоксилазы растения в растительные клетки может придать устойчивости к гербицидам и/или привести к изменению содержания масла в растительных клетках.
В однодольных экзогенно встроенный ген ацетил-СоА-карбоксилазы растения может быть экспрессирован на уровне, эффективном для придания клеткам ткани растения значительной толерантности к циклогександионовым гербицидам и к гербицидам арилоксифеноксипропановой кислоты, уровни которых обычно ингибируют нативную или эндогенную ацетил-СоА-карбоксилазу. Нативная ацетил-СоА-карбоксилаза представляет энзим, который обычно кодируется и экспрессируется в клетки растений до трансформации. Экзогенно введенный ген ацетил-СоА-карбоксилазы растения представляет собой ген, который был выделен и амплифицирован либо из того же самого, либо из другого типа клеток. Экзогенное введение и экспрессия гена ацетил-СоА-карбоксилазы растения как в однодольные, так и в двудольные, может привести к изменению содержания масла и качества тканей и семян растения. Экзогенное введение и экспрессия в клетки хозяина, такого, как бактерия, может обеспечить достаточные количества ацетил-СоА-карбоксилазы растения для обеспечения кристаллизации и выделения энзима. Кристаллизованная ацетил-СоА-карбоксилаза растения пригодна для идентификации других гербицидов, которые связываются с ацетил-СоА-карбоксилазой растения и могут его ингибировать. Этот энзим можно также использовать для скринирования потенциальных гербицидных соединений по их эффективности.
А.
Образование экспрессионной кассеты
Экспрессионная кассета настоящего изобретения может включать химерическую ДНК молекулу, кодирующую ген ацетил-СоА-карбоксилазы растения или его измененный
или функциональный мутант, операбельно связанный с промотором, функциональным в растительной клетке. Ген может кодировать ацетил-СоА-карбоксилазу растения, которая практически толерантна к гербицидам,
предпочтительно к циклогександионовым гербицидам и/или гербицидам арилоксифеноксипропановой кислоты. Экспрессионная кассета настоящего изобретения может также включать антисмысловую ДНК
последовательность, которая практически комплементарна гену ацетил-СоА-карбоксилазы или его части, операбельно связанной с промотором, функциональным в растительной клетке.
1.
Выделение и идентификация гена, кодирующего ацетил-СоА-карбоксилазу растения
Ген, кодирующий ацетил-СоА-карбоксилазу растения, можно идентифицировать и выделить стандартными способами, как
раскрыто у Sambrook и др.. Guide to Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, NY (1989). Этот ген
можно получить из клеток либо однодольных, либо двудольных растений. Если ген,
кодирующий ацетил-СоА-карбоксилазу растения, получают из двудольного растения, энзим, кодируемый геном, демонстрирует толерантность к циклогександионовым гербицидам или гербицидам
арилоксифеноксипропановой кислоты. Этот ген можно получить также из клеточной линии кукурузы, толерантной к гербицидам, полученной по способу патента США 5162602.
Ген, кодирующий ацетил-СоА-карбоксилазу растения, можно идентифицировать при скринировании ДНК или кДНК библиотек, созданных из растительных клеток. Скринирование на предмет ДНК фрагментов, которые кодируют весь или часть гена, кодирующего ацетил-СоА-карбоксилазу растения, можно усовершенствовать путем комплементации ауксотрофного мутанта ацетил-СоА-карбоксилазы в E.coli (fabE) (Bachman, Microbiological Reviews, 47:180 (1983) или дрожжи (accl) (Michionada, Eur. J.Biochem, 111:79 (1980) или путем скринирования бляшек на предмет связывания с антителами, которые специфически распознают ацетил-СоА-карбоксилазу растения. ДНК фрагменты, которые могут сохранять АССазную активность в E.coli или дрожжах и/или в бляшках, содержащих ДНК фрагменты, которые иммунореактивны с антителами к растительной АССазе, можно суб-клонировать в вектор и секвенировать и/или использовать в качестве зондов для идентификации других кДНК или геномных последовательностей, кодирующих весь или часть ацетил-СоА-карбоксилазного растительного гена.
Специфические примеры кДНК последовательностей, кодирующих часть гена ацетил-СоА-карбоксилазы растения, включают ДНК фрагменты, которые включают ДНК последовательность, которая существенно соответствует кодирующей последовательности для активного сайта транскарбоксилазы ацетил-СоА-карбоксилазы растения, ДНК фрагменты, которые включают ДНК последовательность, которая существенно соответствует кодирующей последовательности для сайта связывания биотина ацетил-СоА-карбоксилазы растения, ДНК фрагмент, кодирующий 5'транскрипционную стартовую последовательность гена ацетил-СоА-карбоксилазы растения, и ДНК фрагмент, кодирующий 3'-транскрипционную стоп-последовательность для гена ацетил-СоА-карбоксилазы. Существенно соответствующие ДНК последовательности гомологичны на от около 90% до около 100% ДНК последовательности. Особенно предпочтительны кДНК зонды, которые можно получить из лямбда клона 18-5, который включает ДНК последовательности, соответствующие домену активного сайта транскарбоксилазы, и домен сайта связывания биотина. Лямбда клон 18-5 включает EcoRI субклоны в 3,9 кb, 1,2 кb или 0,23 кb. Лямбда субклон 18-51 представляет 3,9 кЬ EcoRI субклон. Лямбда субклон 18-51 был депонирован в Американской коллекции типовых культур (American Type Culture Collection, Rockville, MD) под регистрационным номером 69236.
В предпочтительном варианте ген ацетил-СоА-карбоксилазы растения идентифицируют и выделяют из клеточной линии кукурузы, толерантной к гербицидам, полученной по способу примера II. кДНК библиотеку можно получить с помощью олиго dT примирования. Бляшки, содержащие ДНК фрагменты, можно скринировать антителами, специфическими для ацетил-СоА-карбоксилазы кукурузы. ДНК фрагменты, кодирующие часть ацетил-СоА-карбоксилазного гена, можно субклонировать и секвенировать и использовать в качестве зондов для идентификации гена геномной ацетил-СоА-карбоксилазы. ДНК фрагменты, кодирующие часть ацетил-СоА-карбоксилазы кукурузы, можно подтвердить, определяя гомологичность последовательности другими известными ацетил-СоА-карбоксилазами, такими, как ацетил-СоА-карбоксилазы цыпленка или дрожжей, или за счет гибридизации с ацетил-СоА-карбоксилазной специфической информационной РНК. После того, как получены ДНК фрагменты, кодирующие части 5', середины и 3' концов, а также активный сайт транскарбоксилазы или связывающий биотин сайт ацетил-СоА-карбоксилазы растения, их можно использовать для идентификации и клонирования полной геномной копии гена ацетил-СоА-карбоксилазы кукурузы.
Для выделения полной копии гена ацетил-СоА-карбоксилазы кукурузы, геномную библиотеку кукурузы можно зондировать кДНК зондами, полученными как указано ранее. Части геномной копии или копий гена ацетил-СоА-карбоксилазы растения можно секвенировать и 5'-конец гена идентифицируют стандартными способами, используя либо ДНК последовательность, гомологичную другому гену ацетил-СоА-карбоксилазы, либо за счет РНКазного протекционного анализа, как раскрыто у Sambrook и др. Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, Cold Spring Harbor, New York (1989). После того, как участки 5' конца гена идентифицированы, полные копии ацетил-СоА-карбоксилазы растения можно получить стандартными способами, которые включают клонирование или полимеразную цепную реакцию (PCR) с использованием олигонуклеотидных праймеров, комплементарных ДНК последовательности у 5' конца гена. Присутствие выделенной полной длины копии гена ацетил-СоА-карбоксилазы растения можно проверить с помощью гибридизации, частичного анализа последовательности, или за счет экспрессии энзима ацетил-СоА-карбоксилазы растения. Ген ацетил-СоА-карбоксилазы кукурузы, клонированный и экспрессированный в клеточной линии кукурузы, устойчивой к гербицидам, может оказать помощь при оценке толерантности к циклогександионовым гербицидам или гербицидам арилоксифеноксипропановой кислоты стандартными способами, как указано в примере 1.
Экспрессионная кассета настоящего изобретения может также содержать антисмысловую ДНК последовательность. Антисмысловой ДНК последовательностью является такая последовательность, которая практически комплементарна всей или части кодирующей последовательности гена ацетил-СоА-карбоксилазы растения. Существенно комплементарная последовательность гомологична на от около 90 до около 100% ДНК последовательности с кодирующей последовательностью всей или части ацетил-СоА-карбоксилазы растения. Будучи экспрессирована, антисмысловая ДНК последовательность может ингибировать синтез и экспрессию нативной ацетил-СоА-карбоксилазы растения. Антисмысловые последовательности имеют, предпочтительно, от около 200 до 1000 нуклеотидов в длину, для того, чтобы обеспечить достаточное ингибирование синтеза и/или экспрессии нативной ацетил-СоА-карбоксилазы. Ингибирование синтеза ацетил-СоА-карбоксилазы и генной экспрессии за счет антисмысловых ДНК последовательностей может быть подтверждено в трансформированных растительных клетках стандартными способами для определения присутствия и/или активности энзима, как это раскрыто в примерах 1 и V.
Экспрессионная кассета настоящего изобретения может также включать функциональный мутант гена ацетил-СоА-карбоксилазы растения. Мутанты гена ацетил-СоА-карбоксилазы растения существенно гомологичны гену ацетил-СоА-карбоксилазы растения и являются функциональными, если экспрессированная ацетил-СоА-карбоксилаза сохраняет значительную энзиматическую активность. Мутанты, существенно гомологичные ацетил-СоА-карбоксилазе растения, могут совпадать на от около 90% до 99,99% ДНК последовательности с этим геном. Так например, мутантный ген ацетил-СоА-карбоксилазы может кодировать ацетил-СоА-карбоксилазу, устойчивую к гербицидам, или ацетил-СоА-карбоксилазу с измененной специфичностью к субстрату таким образом, что полное количество содержания масла в растениях или семенах окажется повышенным, или энзим с измененной специфичностью к субстрату таким образом, что будет понижен синтез таких вторичных метаболитов, как флавоноиды или антоцианины. Предпочтительным мутантом является ген, кодирующий ацетил-СоА-карбоксилазу, которая значительно устойчива к циклогександионовым гербицидам или гербицидам арилоксифеноксипропановой кислоты.
Измененные или функциональные мутанты гена, кодирующего ацетил-СоА-карбоксилазу растения, можно
получить различными способами. Изменение или мутацию АССазного гена можно осуществить различными способами, которые включают следующие способы (но ими не ограничиваются):
1. Спонтанная
вариация и непосредственный отбор мутантов в культурах.
2. Процедуры прямого или косвенного мутагенеза на культурах тканей всех типов клеток, семян или растений.
3. Мутация клонированного гена ацетил-СоА-карбоксилазы такими способами, как сайтспецифичный мутагенез (Sambrook и др. см.ранее), мутагенез, осуществляемый с помощью транспозона (Berg et al.. Biotechnology, 1:417 (1983)) и делеционный мутагенез (Mitra et al., Molec. Gen. Genetic., 215:294 (1989)).
Мутанты можно идентифицировать по изменению функциональной активности энзима, кодируемого геном, или определяя изменение в ДНК последовательности, используя рестрикционное картирование энзима или частичный анализ последовательности.
В предпочтительном варианте функциональный мутантный ген, кодирующий ацетил-СоА-карбоксилазу, устойчивую к циклогександионовым гербицидам или к гербицидам арилоксифеноксипропановой кислоты, выделяют из клеточной линии, устойчивой к гербицидам кукурузы. Клеточную линию устойчивой к гербицидам кукурузы получают по способу патента США 5162602, выданного 10 ноября 1992 г. , раскрытие которого включено в примеры 1-III. Короче, частично дифференцированные клеточные культуры выращивают и субклонируют при непрерывном экспонировании низким уровням гербицида. Затем концентрации гербицидов постепенно повышают в течение нескольких интервалов субкультур. Клетки кукурузы или ткани, выращиваемые в присутствии нормальных токсичных уровней содержания гербицидов, повторно субкультивируют в присутствии гербицида и характеризуют. Стабильность такой характеристики, как устойчивость к гербицидам, культивированных клеток можно оценить при выращивании отобранных клеточных линий в отсутствие гербицидов в течение различных промежутков времени, а затем анализируя их рост после экспонирования этих тканей гербицидам.
Клеточные линии кукурузы, которые обладают устойчивостью, связанной с наличием измененного энзима ацетил-СоА-карбоксилазы, можно селектировать путем идентификации клеточных линий, обладающих энзиматической активностью в присутствии нормальных токсических уровней сетоксидима или галоксифопа. Клетки устойчивой кукурузы можно далее оценить с точки зрения того, изменена ли ацетил-СоА-карбоксилаза до менее восприимичивой формы, или в ней повышен уровень экспрессии.
Клеточные линии кукурузы с ацетил-СоА-карбоксилазой, менее восприимчивой к ингибированию под действием гербицидов, можно использовать для выделения функционального мутантного гена ацетил-СоА-карбоксилазы растения. ДНК библиотеку из клеточных линий кукурузы, устойчивых к гербицидам, можно создать и ДНК фрагменты, кодирующие весь или часть гена ацетил-СоА-карбоксилазы, можно идентифицировать с помощью гибридизации с кДНК зондом, кодирующим часть гена АССазы кукурузы. Полную копию измененного гена можно получить либо клонированием и лигированием, либо PCR синтезом, используя соответствующие праймеры. Выделение измененного гена, кодирующего ацетил-СоА-карбоксилазу, можно подтвердить в трансформированных растительных клетках, определяя факт сохранения энзиматической активности экспрессированной ацетил-СоА-карбоксилазы при экспонировании нормальным токсическим уровням гербицидов.
2. Промоторы
После того как ген
ацетил-СоА-карбоксилазы или его функциональный мутант или антисмысловая ДНК последовательность получены и амплифицированы, их объединяют с промотором, функциональным в растительной клетке, для
образования экспрессионной кассеты.
Большинство генов содержит участки ДНК последовательности, которые известны как промоторы и которые регулируют генную экспрессию. Промоторные участки обычно расположены во фланкирующих ДНК последовательностях в обратном направлении от кодирующей последовательности как в прокариотных, так и в эуакариотных клетках. Промоторные последовательности, предназначенные для регулирования транскрипции в прямом направлении генной последовательности, обычно содержат от около 50 до около 2000 пар нуклеотидных оснований. Промоторные последовательности содержат также такие регуляторные последовательности, как энхансерные последовательности, которые могут влиять на уровень генной экспрессии. Некоторые выделенные промоторные последовательности могут обеспечить генную экспрессию гетерологичных генов, то есть, генов, отличающихся от нативного или гомологичного генов. Промоторные последовательности, как известно, могут быть сильными или слабыми или индуцируемыми. Сильный промотор обеспечивает высокий уровень генной экспрессии, тогда как слабый промотор обеспечивает очень низкие уровни генной экспрессии. Индуцируемым промотором является промотор, который обеспечивает "включение и выключение" генной экспрессии в ответ на экзогенно добавляемый агент или на стимулы окружающей среды или развития. Промоторы могут также обеспечить тканеспецифическое регулирование или регулирование, связанное с развитием. Изолированная промоторная последовательность, которая является сильным промотором для гетерологичных генов, выгодна, так как обеспечивает достаточный уровень генной экспрессии, что обеспечивает легкое детектирование и селекцию трансформированных клеток, а также обеспечивает при желании высокий уровень генной экспрессии.
Промотор в экспрессионной кассете настоящего изобретения может обеспечить сверхэкспрессию ацетил-СоА гена ацетил-СоА-карбоксилазы растения или его функционального мутанта. Сверхэкспрессия гена представляет такое количество генной экспрессии, которое приведет к усилению устойчивости растительных клеток к гербициду или к увеличению полного содержания масла в клетках. Сверхэкспрессия гена ацетил-СоА-карбоксилазы соответствует, предпочтительно, 2-20-кратному усилению экспрессии ацетил-СоА-карбоксилазы по сравнению с уровнем экспрессии нативной ацетил-СоА-карбоксилазы.
Промотор можно индуцировать таким образом, что генная экспрессия будет включаться или выключаться с помощью экзогенно добавляемого агента. Так например, такой бактериальный промотор, как РТАС промотор, можно индуцировать для изменения уровней экспрессии гена в зависимости от изотио-пропилгалактозида, добавляемого к трансформированным бактериальным клеткам. Может оказаться также предпочтительным объединить ген с промотором, который обеспечивает тканеспецифическую экспрессию регулируемой развитием генной экспрессии в растениях.
Специфические промоторы, функциональные в растительных клетках, включают промотор вируса мозаики 35S цветной капусты, промотор нопалинсинтазы (NOS) и т. п. В настоящее время предпочтительным промотором для экспрессии в однодольные является промотор вируса мозаики 35S цветной капусты.
Ген ацетил-СоА-карбоксилазы можно объединить с промотором стандартными способами, описанными у Sambrook (см. ранее). Короче, можно сконструировать плазмиду, содержащую такой промотор, как 35S промотор вируса мозаики цветной капусты, по способу, раскрытому Jefferson, Plant Molecular Biology Reporter, 5,387 (1987), или получить из Clontech Lab в Раlo Alto, СА (например, рВ1121 или рB1221). Обычно эти плазмиды конструируют таким образом, чтобы обеспечить множество сайтов клонирования со специфичностью для различных рестрикционных энзимов в прямом направлении от промотора. Ген ацетил-СоА-карбоксилазы растения можно субклонировать в прямом направлении от промотора, используя рестрикционные энзимы для подтверждения встраивания гена в правильной ориентации по отношению к промотору, для того, чтобы ген мог экспрессироваться. В предпочтительном варианте ацетил-СоА-карбоксилаза операбельно связана с 35S САМV промотором в такой плазмиде, как рВ1121 или рВ1221. После того, как ген ацетил-СоА-карбоксилазы растения операбельно связан с промотором и плазмидой, полученную таким образом экспрессионную кассету можно субклонировать в другие плазмиды или векторы.
3. Необяаательные последовательности в экспрессиоиной кассете
Экспрессионная кассета может также необязательно содержать другие ДНК последовательности. Далее экспрессионная кассета может содержать последовательность транзитного пептида хлоропласта, операбельно
связанную между промотором и геном ацетил-СоА-карбоксилазы растения. Если экспрессионную кассету необходимо ввести в растительную клетку, экспрессионная кассета может также содержать сигнал окончания
транскрипции в растении и сигнал полиаденилирования, и трансляционные сигналы, связанные с 3' концами гена ацетил-СоА-карбоксилазы растения. Экспрессионная кассета может также необязательно содержать
плазмиду.
Так как одним из сайтов действия для схемы биосинтеза, включающим ацетил-СоА-карбоксилазу растения, является
хлоропласт, экспрессионную кассету настоящего
изобретения можно объединить при необходимости с экзогенной ДНК последовательностью, кодирующей транзитный пептид. Транзитным пептидом хлоропласта является пептид, который не кодируется геном
ацетил-СоА-карбоксилазы растения. Транзитный пептид хлоропласта обычно содержит от 40 до 70 аминокислот в длину и функционирует посттрансляционно для направления протеина к хлоропласту. Транзитный
пептид отщепляется либо во время, либо сразу после доставки в хлоропласт для получения зрелого протеина. Полная копия гена, кодирующего ацетил-СоА-карбоксилазу растения, может содержать
последовательность транзитного пептида хлоропласта. В этом случае может не возникнуть необходимости в объединении экзогенно полученной последовательности транзитного пептида хлоропласта с
экспрессионной кассетой.
Экзогенные последовательности, кодирующие транзитный пептид хлоропласта, можно получить из различных генов ядер растений, если только продукты этих генов экспрессируются как протеины, содержащие аминотерминальный транзитный пептид, и транспортируются в хлоропласт. Примеры известных продуктов генов растений, включающие последовательности транзитных пептидов, включают небольшие субъединицы рибулозобифосфаткарбоксилазы, ферредоксин, хлорофилловый а/b протеин связывания, рибосомные протеины хлоропласта, кодируемые ядерными генами, некоторые термошоковые протеины, энзимы биосинтеза аминокислот, такие, как синтаза ацетогидрокси кислоты, 3-енолпирувилфосфошикимат-синтаза, дигидродипиколинат-синтаза и т.п. В другом варианте ДНК фрагмент, кодирующей транзитный пептид, можно химически синтезировать либо полностью, либо частично из известных последовательностей таких транзитных пептидов, как те, которые были перечислены ранее.
Вне зависимости от источника ДНК фрагмента, кодирующего транзитный пептид, он должен включать кодон инициирования трансляции и аминокислотную последовательность, которая распознается хлоропластом растения хозяина и будет функционировать в нем должным образом. Следует также обратить внимание на аминокислотную последовательность на связи между транзитным пептидом и энзимом ацетил-СоА-карбоксилазы растения, по которой он отщепляется с образованием зрелого энзима. Были идентифицированы некоторые консервативные аминокислотные последовательности и они могут служить ориентиром. Правильное слияние последовательности, кодирующей транзитный пептид, с последовательностью, кодирующей ацетил-СоА-карбоксилазу, может потребовать манипуляций одной или обеих ДНК последовательностей для введения, например, удобного рестрикционного сайта. Это может быть осуществлено способами, включающими сайт-направленный мутагенез, встраивание химически синтезированных олигонуклеотидных линкеров и т.п.
После того, как получена последовательность транзитного пептида хлоропласта, ее можно соответствующим образом связать с промотором и геном ацетил-СоА-карбоксилазы растения в экспрессионной кассете, используя стандартные способы. Короче, плазмиду, содержащую промотор, функциональный в растительных клетках и содержащий множественные сайты клонирования в прямом направлении, можно сконструировать по способу Jefferson (см. ранее). Последовательность транзитного пептида хлоропласта можно встроить в прямом направлении от промотора, используя рестрикционные энзимы. Ген ацетил-СоА-карбоксилазы растения можно затем встроить непосредственно в прямом направлении от и в рамке с 3' концом последовательности транзитного пептида хлоропласта таким образом, чтобы транзитный пептид хлоропласта был связан с аминоконцом ацетил-СоА-карбоксилазы растения. После того, как сформирована экспрессионная кассета, ее можно субклонировать в другие плазмиды или векторы.
Если экспрессионную кассету необходимо ввести в растительную клетку, эта экспрессионная кассета может также необязательно включать 3' нетранслируемые регуляторные ДНК последовательности растения. 3' нетранслируемая регуляторная ДНК последовательность предпочтительно включает от около 300 до 1000 нуклеотидных пар оснований и содержит последовательности окончания транскрипции и трансляции растения. Специфические примеры 3' нетранслируемых регуляторных ДНК последовательностей, функциональных в растительных клетках, включают около 500 пар оснований 3' фланкирующей ДНК последовательности маленькой субъединицы Е9 гена рибулозо-бифосфат-карбоксилазы горошка, 3'-фланкируюшую ДНК последовательность гена октопинсинтазы и 3'-фланкирующую ДНК последовательность гена нопалинсинтазы. Эти 3' нетранслируемые регуляторные последовательности можно получить по способу, описанному в An. Methods in Enzymology, 153: 292 (1987), или они уже присутствуют в плазмидах, которые можно получить из коммерческих источников таких, как Clontech, Palo Alto, CA. 3' нетранслируемые регуляторные последовательности могут быть операбельно связаны с 3' концами гена ацетил-СоА-карбоксилазы растения стандартными способами.
Экспрессионная кассета настоящего изобретения может далее содержать плазмиду. Плазмидные векторы включают дополнительные ДНК последовательности, которые обеспечивают простоту отбора, амплификации и трансформации экспрессионной кассеты в прокариотных и эукариотных клетках. Дополнительные ДНК последовательности включают источники репликации, которые обеспечивают автономную репликацию вектора, селективные маркерные гены, предпочтительно кодирующие устойчивость к антибиотикам, уникальные множественные сайты клонирования, множественные сайты для встраивания ДНК последовательностей генов, кодирующих экспрессионную кассету, и последовательности, которые усиливают трансформацию прокариотных или эукариотных клеток. Предпочтительными векторами настоящего изобретения являются плазмидные векторы. Наиболее предпочтительным вектором является рВ1121 или рВ1221 вектор, полученный по способу Jefferson (см. ранее).
Другим вектором, который пригоден для экспрессии как в растительные клетки, так и в прокариотные клетки, является бинарный Ti вектор PGA582. Этот бинарный Ti вектор был ранее описан An (см. ранее) и доступен от Dr. An. Этот бинарный Ti вектор может быть реплицирован в такие прокариотные бактерии, как E.coli и Agrobacterium. Agrobacterium плазмидные векторы можно использовать для переноса экспрессионной кассеты в растительные клетки. Бинарные Ti векторы предпочтительно включают нопалиновые Т ДНК правую и левую границы, чтобы обеспечить эффективную трансформацию растительных клеток, селективный маркерный ген, уникальные множественные сайты клонирования в Т граничных участках, co1E1 репликацию источника и репликон широкого спектра хозяев.
Бинарные Ti векторы, содержащие экспрессионную кассету настоящего изобретения, можно использовать для трансформации как прокариотных, так и эукариотных клеток, но предпочтительно, использовать их для трансформации растительных клеток.
В. Способ скринироваиия по экспрессии и/или сверхэкспрессии гена ацетил-СоА-карбоксилазы растений
В
настоящем изобретении предложен также способ скринирования экспрессии и сверхэкспрессии гена ацетил-СоА-карбоксилазы растений. После того, как сконструирована экспрессионная кассета, содержащая ген
ацетил-СоА-карбоксилазы, ее можно субклонировать в известный вектор экспрессии. Способ скринирования настоящего изобретения включает стадии введения вектора экспрессии в клетку хозяина и
детектирования и/или количественного определения экспрессии гена ацетил-СоА-карбоксилазы растения. Этот способ скринирования пригоден для идентификации экспрессионных кассет, обеспечивающих
сверхэкспрессию гена ацетил-СоА-карбоксилазы растения, антисмысловые молекулы которого эффективно ингибируют синтез ацетил-СоА-карбоксилазы и экспрессию ацетил-СоА-карбоксилазы в хлоропласт
трансформированной растительной клетки.
Подходящие известные векторы экспрессии включают плазмиды, которые автономно реплицируют в прокариотных и эукариотных клетках. Специфические примеры включают такие плазмиды, как рВ1121 или рВ1221 плазмиды, сконструированные по способу Jefferson (см. ранее), такой бинарный вектор Тi, как PG582, как описано An (см. ранее, PUC119 или PBR322). Предпочтительной экспрессионной системой является рВ1121 или РВ1221 плазмида.
Экспрессионную кассету настоящего изобретения можно субклонировать в вектор экспрессии обычными способами. Затем вектор экспрессии можно ввести в прокариотные или эукариотные клетки стандартными способами, включающими трансформацию протопластов, трансформацию осуществляемую с помощью Agrobacterium, электропорацию, микробомбардировку и липосомы. Вектор экспрессии можно вводить в такие растительные клетки, как клетки табака, Brassica черной мексиканской сладкой кукурузы и Arabidopsis клетки. Вектор можно также вводить в такие прокариотные клетки, как E.coli или Agrobacterium. Трансформированные клетки можно затем селектировать, обычно используя маркер селекции, закодированный на векторе экспрессии.
Кратковременную экспрессию гена ацетил-СоА-карбоксилазы растения можно определить и определить количественно в трансформированных клетках. Количественно определить генную экспрессию можно с помощью количественного Вестерн-блоттинга, используя антитела, специфические для клонированной ацетил-СоА-карбоксилазы, или детектируя повышение специфической активности энзима. Тканевое и субклеточное расположение клонированной ацетил-СоА-карбоксилазы можно определить способами иммунохимического окрашивания, используя антитела, специфические дня клонированной ацетил-СоА-карбоксилазы. Чувствительность клонированной ацетил-СоА-карбоксилазы к гербицидам также можно оценить. Затем экспрессионные кассеты, обеспечивающие сверхэкспрессию растительной ацетил-СоА-карбоксилазы или ацетил-СоА-карбоксилазы, устойчивой к гербицидам, можно затем использовать для трансформации клеток тканей однодольных и/или двудольных растений и для воссоздания трансформированных растений и семян.
С. Способ придания растению устойчивости по отношению х цихлогександионовым гербицидам или к гербицидам арилоксифеноксипропановой кислоты
В настоящем изобретении предложен способ придания растению устойчивости к циклогександионовым гербицидам и гербицидам арилоксифеноксипропановой кислоты. Этот способ включает стадии введения
экспрессионной кассеты, содержащей ген, кодирующий ацетил-СоА-карбоксилазу растения или его функциональный мутант, операбельно связанный с промотором в клетках тканей растения и экспрессирования этого
гена в количестве, эффективном для придания клеткам тканей растения значительной устойчивости к гербицидам. Эффективное количество генной экспрессии для придания клеткам тканей растения существенной
устойчивости к гербицидам зависит от того, кодирует ли ген неизмененный ген ацетил-СоА-карбоксилазы или мутантную или измененную форму гена, который менее чувствителен к гербицидам. Экспрессия
неизмененного гена ацетил-СоА-карбоксилазы растения в эффективном количестве соответствует такому количеству, которое обеспечивает 2-50-кратное повышение устойчивости к гербицидам и предпочтительно
повышает количество ацетил-СоА-карбоксилаэы в, по крайней мере, 2-20 раз по сравнению с количеством нативного энзима. Измененную форму энзима можно экспрессировать на уровнях, сравнимых с уровнем
нативного энзима или менее, если измененная форма энзима обладает более высокой активностью. Ацетил-СоА-карбоксилаза, которая существенно устойчива против гербицидов, представляет такой энзим, который
устойчив к уровням гербицидов, которые обычно ингибируют нативную ацетил-СоА-карбоксилазу и, предпочтительно, может функционировать в концентрациях гербицида, в 2-20 раз более высоких, нежели
концентрации, токсичные для нативного энзима.
Гербицидной устойчивости можно достичь, по крайней мере, двумя способами, которые включают: (1) повышение уровня генной экспрессии нативного или неизмененного гена ацетил-СоА-карбоксилазы; или (2) введение измененного гена, кодирующего ацетил-СоА-карбоксилазу, который менее восприимчив к ингибированию гербицидами. Уровень генной экспрессии можно повысить, либо комбинируя ген ацетил-СоА-карбоксилазы растения с промотором, который обеспечивает высокий уровень генной экспрессии (такой, как 35S CaMV промотор), или вводя ген в клетки таким образом, чтобы множественные копии гена были интегрированы в геном трансформированной растительной клетки. Создание экспрессионной кассеты включает ген ацетил-СоА-карбоксилазы растения, операбельно связанный с промотором, который может быть экспрессирован в эффективном количестве для придания устойчивости к гербицидам, как было указано ранее.
Большинство однодольных, но не двудольных, восприимчивы к циклогександионовым гербицидам и/или к гербицидам арилоксифеноксипропановой кислоты. Предпочтительными растительными клетками для введения экспрессионной кассеты настоящего изобретения для достижения устойчивости к гербицидам для растительных клеток являются клетки однодольных растений. Однодольные растения включают кукурузу, пшеницу, ячмень, сорго, рис и др. Экспрессионную кассету настоящего изобретения можно вводить способами трансформации, особенно эффективной для однодольных, включая biolistic трансформацию типа II эмбриогенной суспензии клеток, как раскрыто W.J. Gordon-Kamm и др. Plant Cell, 2. 603-618 (1990), M. E. Fromm и др. Bio/Technology, 8, 833-839 (1990) и D.A. Walters и др. Plant Molecular Biology 18, 189-200 (1992), или электропорацию типа I эмбриогенных каллюсов, описанную D'Hafluin и др., The Plant Cell, 4,1495 (1992). Трансформированные клетки можно отбирать по присутствующему селектируемому маркерному гену. Кратковременную экспрессию гена ацетил-СоА-карбоксилазы растения можно детектировать в трансгенном эмбриогенном каллюсе, используя антитела, специфические для клонированной ацетил-СоА-карбоксилазы растения. Трансформированный эмбриогенный каллюс можно использовать для создания трансгенных растений, которые демонстрируют стабильное наследование либо измененного гена ацетил-СоА-карбоксилазы, либо сверхэкспрессию гена ацетил-СоА-карбоксилазы. Клеточные линии кукурузы, демонстрирующие удовлетворительные уровни устойчивости к гербицидам, проводят через схему регенерации растения для получения зрелых растений кукурузы и семян, экспрессирующих свойства устойчивости, как указано у D'Hafluin (см. ранее), или An (см. ранее). Схема регенерации растений позволяет обеспечить развитие соматических эмбрионов и последующий рост корней и побегов. Для определения того, что свойство устойчивости к гербицидам экспрессируется в дифференцированные органы растения, а не только в недифференцированные клеточные культуры, регенерированные растения экспонируют таким уровням гербицидов, которые обычно ингибируют рост и образование корней и побегов.
Затем зрелые растения кукурузы получают из клеточных линий кукурузы, которые, как известно, экспрессируют это свойство. Если это только возможно, воссозданные растения оказываются самоопыляющимися. В другом варианте пыльцу, полученную от регенерированных растений, используют для скрещивания их с растениями, выращенными из семян растений агрономически важных инбредных линий. Напротив, пыльцу от растений этих инбредных линий используют для опыления регенерированных растений. Затем генетику этого свойства характеризуют, оценивая расщепление этого свойства в первом и последующих поколениях потомства. Стабильное наследование сверхэкспрессии ацетил-СоА-карбоксилазы растения или функционального мутанта ацетил-СоА-карбоксилазы растения, придающего растению устойчивость к гербицидам, достигается, если растение сохраняет устойчивость к гербицидам, по крайней мере, на протяжении трех-шести поколений.
Семена от трансформированных однодольных растений, регенерированных из культур трансформированных тканей, выращивают в поле и самоопыляют для получения гомозиготных растений. Потомство от этих растений становится чистыми линиями разведения, которые оценивают по устойчивости к гербицидам на поле в различных условиях окружающей среды. Устойчивость к гербицидам должна быть достаточной для того, чтобы защитить однодольные растения при максимальных дозах обработки в полевых условиях, которые способствуют наиболее высокой активности гербицидов. Подходящими гербицидными концентрациями и способами их нанесения являются те, которые известны и были разработаны для рассматриваемых циклогександионовых гербицидов и/или гербицидов арилоксифеноксипропановой кислоты.
В предпочтительном варианте экспрессионную кассету, содержащую ген ацетил-СоА-карбоксилазы кукурузы, выделенный из клеточной линии кукурузы, устойчивой к сетоксидиму и галоксифопу и связанный с 35S CaMV промотором, вводят в ткани восприимчивого к гербицидам однодольного растения, используя (biolistic) биолитическую трансформацию. Трансформированные каллюсы селектируют и используют для создания трансгенных растений. Трансформированные каллюсы и трансгенные растения можно оценить по их устойчивости к сетоксидиму и галоксифопу и по стабильности наследования свойства устойчивости.
Д. Способ изменения содержания масла в
растении
В настоящем изобретении предложен также способ изменения содержания масла в растении. Этот способ включает стадии введения экспрессионной кассеты, содержащей ген, кодирующий
ацетил-СоА-карбоксилазу растения или ее функциональный мутант, операбельно связанные с промотором, функциональным в растительной клетке, в клетки тканей растения и экспрессирования этого гена в
количестве, эффективном для изменения содержания масла в клетках растения. Изменение содержания масла в клетке растения может включать изменение полного содержания масла по сравнению с обычно
присутствующим в этом типе растительных клеток, или изменение типа масла, которое обычно присутствует в клетках этого растения. Эспрессия гена в количестве, эффективном для изменения содержания масла,
зависит от того, кодирует ли ген неизмененную ацетил-СоА-карбоксилазу или ее мутант, или ее измененную форму. Экспрессия гена ацетил-СоА-карбоксилазы растения в эффективном количестве соответствует
такому количеству, которое может обеспечить изменение содержания масла в клетке примерно в 1,2-20 раз по сравнению с количеством, которое обычно присутствует в клетке растения, и предпочтительно,
повышает количество ацетил-СоА-карбоксилазы примерно в 2-20 раз по сравнению с количеством энзима, которое обычно присутствует в клетке растения. Измененная форма энзима может быть экспрессирована на
уровнях, сравнимых с уровнями нативного энзима или меньше, если измененная форма энзима обладает более высокой специфической активностью.
Изменения содержания масла в клетках растений
по способу настоящего изобретения можно достичь, по крайней мере, двумя способами, которые включают:
(1) повышение или понижение экспрессии неизмененного гена ацетил-СоА-карбоксилазы растений
или
(2) введение измененного или функционального мутантного гена ацетил-СоА-карбоксилазы растения, кодирующего энзим, который демонстрирует изменение специфической активности.
Уровень генной экспрессии неизмененного гена ацетил-СоА-карбоксилазы растения можно повысить, либо объединяя неизмененный ген ацетил-СоА-карбоксилазы с промотором, который обеспечивает высокий уровень генной экспрессии, таким, как 35S вирус мозаики подсолнечника, или путем введения экспрессионной кассеты и/или отбора растительных клеток, содержащих множественные копии гена ацетил-СоА-карбоксилазы растения, интегрированные в геном. Понижения экспрессии неизмененной ацетил-СоА-карбоксилазы можно достичь с помощью трансформации антисмысловым геном АССазы, содержащим экспрессионную кассету. Если измененный или функциональный мутант гена ацетил-СоА-карбоксилазы растения кодирует энзим, который обладает повышенной специфической активностью, это может привести к повышению полного содержания масла в растительной клетке, даже если уровень генной экспрессии сопоставим с уровнем экспрессии нативного энзима. Если измененный или функциональный мутант гена ацетил-СоА-карбоксилазы кодирует энзим, обладающий пониженной специфической активностью, это может привести к снижению полного содержания масла в растительной клетке по сравнению с количеством, которое присутствует обычно.
Описанную ранее экспрессионную кассету можно ввести либо в однодольные, либо в двудольные растения. Предпочтительно, вводить экспрессионную кассету в такие двудольные растения, как соя, канола и подсолнечник. Экспрессионную кассету можно вводить стандартными способами, включающими трансформацию протопласта, осуществляемую с помощью Agrobacterium трансформацию, обработку в микрофуге, электропорацию и т.п. Трансформированные клетки или ткани можно отбирать по присутствию селектируемого маркерного гена.
Кратковременную экспрессию гена ацетил-СоА-карбоксилазы растения можно определить в трансформированных клетках или тканях по иммунореактивности с антителами, специфическими для клонирования ацетил-СоА-карбоксилазы. Сверхэкспрессию ацетил-СоА-карбоксилазы можно определить с помощью количественного вестернблоттинга. Изменение специфической активности энзима можно определить, измеряя активность энзима в трансформированных клетках. Изменение полного содержания масла можно определить стандартными способами, как указано у Clark and Snyder, JACS, 66:1316 (1989).
Трансгенные растения и семена можно создать из трансформированных клеток и тканей, которые демонстрируют изменение содержания масла или изменение количества специфической активности ацетил-СоА-карбоксилазы растения стандартными способами. Наиболее предпочтительно, чтобы повышалось содержание масла в листьях, семенах или плодах.
В предпочтительном варианте ген ацетил-СоА-карбоксилазы кукурузы объединяют с 35S промотором вируса мозаики подсолнечника в вектор, такой, как рВ1121 или рВ1221, и вводят в клетки сои, используя способ микробомбардировки. Трансформированные клетки сои, демонстрирующие возрастание экспрессии ацетил-СоА-карбоксилазы, по крайней мере, примерно в 2 раза, или по крайней мере, в 1,2 раза по содержанию масла, отбирают. Трансформированные клетки сои, демонстрирующие сверхэкспрессию ацетил-СоА-карбоксилазы или демонстрирующие повышение полного содержания масла, используют для создания трансгенных растений и семян.
Е. Способ получения растительной ацетил-СоА-карбоксилазы
В настоящем изобретении предложен
способ получения растительной ацетил-СоА-карбоксилазы в клетке хозяина. Этот способ включает стадии введения экспрессионной кассеты, включающий ген, кодирующий ацетил-СоА-карбоксилазу растения, или ее
функциональный мутант, в клетку хозяина и экспрессию этого гена в количестве, достаточном для обеспечения кристаллизации растительной ацетил-СоА-карбоксилазы. Количество, достаточное для
кристаллизации растительной ацетил-СоА-карбоксилазы, примерно в 20-100 раз превышает количество растительной ацетил-СоА-карбоксилазы, которое обычно выделяют из растительных клеток, предпочтительно
около 2-10 мг протеина. Кристаллизованную растительную ацетил-Соа-карбоксилазу можно использовать для идентификации других гербицидов, которые могут связывать и ингибировать функцию
ацетил-СоА-карбоксилазы. Кроме того, доступность больших количеств очищенного энзима обеспечивает возможность скринирования гербицидов по эффективности.
Экспрессионная кассета может включать промотор, который функционален как в эукариотных, так и в прокариотных клетках. Экспрессионную кассету можно ввести в такие прокариотные клетки, как E.coli, или в эуакариотные клетки, такие, как клетки растений или дрожжи. Предпочтительными клетками являются прокариотные клетки, которые обычно используют для получения рекомбинантных протеинов, например, клетки Е. coli. Экспрессионную кассету можно ввести, и трансформированные клетки селектировать стандартными способами.
Ген растительной ацетил-СоА-карбоксилазы можно экспрессировать в прокариотные клетки до получения достаточного количества энзима с тем, чтобы он мог кристаллизоваться. Растительную ацетил-СоА-карбоксилазу можно выделить из бактериальных клеток, используя стандартные способы, включая способы, описанные в примере V. Затем очищенную ацетил-СоА-карбоксилаэу можно кристаллизовать и охарактеризовать стандартными способами.
Пример 1
Выяснение механиама действия
и места действия гербицида
Целью этого примера является выяснение механизма, с помощью которого сетоксидим и/или галоксифоп ингибируют синтез жирных кислот в кукурузе. Результаты, полученные
J. D. Burton и др., Biochem. Biophys. Res. Comm., 148, 1039 (ноябрь 13, 1987), показывают, что сетоксидим и галоксифоп ингибируют ацетил-СоА-карбоксилазу (АССазу) (ЕС 6.4.1.2) в хлоропластах
кукурузы.
А. Химикалии
Буферы и кофакторы закупают у Sigma Chemical Company (St.Lonis, Missouri); [2-14С]ацетат у Research Produkts International; [2-14
С]пируват и [14C] NaHCO3 закупают у New England Nuclear; и [2-14С]малонилкоэнзим А закупают у Amersham. Сетоксидим - подарок от BASF (Parsippany, New Jersey), а
галоксифоп предоставлен Dow Chemical USA (Midland, Michigan).
В. Условия выращивания растения
Семена кукурузы (L.Mays L.,B37 x Oh43') проращивают в темноте в
течение 96 часов в вермикулите в инкубационной камере, условия в которой поддерживаются: 30oС, 80% относительной влажности. Затем проростки переносят в камеру для выращивания при 16-часовом
освещении (25oС) и 8 часов темноты (20oС) (цикл), 90% относительной влажности (OВ). После прозеленения в течение 48 часов ростки возвращают в темноту инкубационной камеры на 12
часов для истощения резервов крахмала хлоропласта. Сеянцы собирают через шесть дней после высадки. Сеянцы горошка (P.Sativum L., 'РI 9901-С') выращивают в камере для выращивания с циклом: 16 часов
освещенности (21oС) и 8 часов темноты (16oС), OВ 80%. Горошек собирают на 10-13 дней после посадки. Суспензию культур кукурузы Black Mexican Sweet (BMS) поддерживают в
дополненной Murashige-Skoog(MS) среде (С.Е. Green. Hort. Sci. 12. 7-10 (1977)) и субкультивируют еженедельно, разбавляя в 20 раз суспензию культуры свежей средой.
С. Выделение
хлоропласта
Хлоропласты из сеянцев кукурузы и горошка выделяют при 4oС (K. Cline и др. J. Biol.Chem., 260, 3691-3696 (1985)). Сеянцы (50 г корней) гомогенизируют в 200 мл буфеpa A
(50 мМ HEPES-NaOH, pH 7,5, 330 мМ сорбитол, 0,1% вес/объем BSA: 1 мМ МgСl2, 2 мМ EDTA, 5 мМ изоаскорбат, 1,3 мМ глутатион) в миксере (пять 3-х секундных обработок на полной скорости).
Полученный гомогенат фильтруют через шесть слоев марли и два слоя "мираклос", а затем центрифугируют при 3000 g в течение 3 минут с торможением вручную. Осадок осторожно снова суспендируют в буфере А
и помещают на предварительно подготовленный Percoll градиент (50 мМ HEPES-NaOH, pH 7,5, 330 мМ сорбитол, 1,9 мМ изоаскорбат, 1,08 мМ глутатион, 0,1% вес/объем BSA, 50% Percoll), который центрифугируют
при 3000 g в течение 20 минут в Sorvall HB роторе. Нижнюю полосу градиента, содержащую интактный хлоропласт, дважды промывают, осторожно повторно суспендируя в 20 мл буфера В (50 мМ HEPES-NaOH, pH 7,5
и 330 мМ сорбитол), затем снова получая осадок (3000 g, 5 минут). Окончательный осадок, состоящий из интактных хпоропластов, снова суспендируют в 2-3 мл буфера В и хранят на льду в темноте до
использования.
Д. Синтез жирных кислот
[14С] ацетат и [14С] пируват используют в качестве предшественников для определения биосинтеза жирных кислот в
выделенных хлоропластах. (B. Liedvogel и др., Planta, 169, 481-489 (1986)). Включение [14С] ацетата анализируют в 0,5 мл объеме, содержащем: 50 мМ HEPES-NaOH (pH 7,5), 330 мМ сорбитола, 5
мМ KH2PO4, 10 мМ NaHCO3, 1 мМ MgCl2, 1 мМ АТР, 0,1 мМ СоА, 0,15 мМ [14С] ацетата (3,33 миллиКюри/ммоль) и хлоропласты (20-50 мкг хлорофилла).
[14С] пирувата включение в жирные кислоты определяют в той же самой среде, за исключением того, что она включает 2 мМ ТРР, 1 мМ NAD-, 0,15 мМ [14С] пирувата (1,33
миллиКюри/ммоль), но без ацетата. Анализируемую суспензию освещают 1400 мкЕ/м2•с PAR при 25oС. Анализ инициируют, добавляя меченый субстрат, и останавливают, добавляя 0,5
мл 40% КОН. Для определения включения радиометки в неполярные фракции (жирная кислота) каждую из обработок омыляют при 90oС в течение 30 минут в закрытых ампулах (P.B.Hoj и др., Carlsberg
Res. Commun. 47, 119-141 (1982)). Ампулы подкисляют 0,5 мл 40% H2SO4 и добавляют жирные кислоты-носители (по 20 мкг каждой из С 14:0, С 16:0 и С 18: 0). Анализируемую смесь
экстрагируют дважды 4 мл гексана. Полученные экстракты объединяют, сушат в атмосфере азота и снова растворяют в 0,3 мл гексана. Определяют радиоактивность аликвот (50 мкл) с помощью жидкостной
сцинтилляционной спектрометрии.
Включение [14С] малонил-СоА в жирные кислоты (Р.В.Ноj и др., см. ранее; и J. B. Ohlrogge и др. Proc.Natl.Acad.Sci. USA, 76, 1194-1198 (1979)) анализируют, используя не содержащие клеток препараты из BMS тканевых культур. Клетки собирают во время фазы логарифмического роста и замораживают в жидком азоте, измельчают в ступке пестиком и оттаивают в среде, содержащей: 0,1 М HEPES-KOH, рН 7,5; 0,3 М глицерина и 5 мМ ДТТ (буфер:ткань, 2:1, объем/вес). Гомогенат центрифугируют при 12000 g в течение 20 минут. Надосадочную жидкость фильтруют через мираклос и центрифугируют (125000 g) в течение 60 минут, а затем фильтруют через мираклос и анализируют. Анализ осуществляют при 25oС в 0,4 мл объеме, содержащем: 1,0 мМ АТР, 0,32 мМ NADPH, 0,38 мМ NADH, 25 мкМ СоА, 10 мкМ ацетил-СоА, 25 мкг ацил-протеин-носитель и 23 мкМ малонил-СоА (11,54 мкКюри/мкмоль). Реакции инициируют, добавляя [14С] малонил-СоА, и останавливают, добавляя 0,4 мл 40% КОН. Включение меток в жирные кислоты определяют как указано ранее. Хлорофилл определяют в соответствии с работой D.I. Arhon, Plant Physicl 25,1-15 (1949) и протеин в соответствии с Р.К. Smith и др.. Anal Biochem. 150, 76-85 (1985).
Е. Активность ацетил-Коэнзим А-карбоксилазы (АССазы)
Хлоропласты кукурузы, выделенные как указано ранее,
суспендируют в буфере С (0,1 М Tricine-KOH, рН 8,0; 0,3 М глицерина и 1 мМ DTT) и гомогенизируют в стеклянном гомогенизаторе тканей. Разрушенные фракции хлоропласта центрифугируют при 16000 g в
течение 15 минут. Надосадочную жидкость обессоливают на колонке Sephadex G-25 (1,5 • 5 см), уравновешенной 0,1 М Tricine-KOH, рН 8,0; и 0,3 М глицерина, и анализируют непосредственно. АССазную
активность (B.J. Nikolau и др. Arch.Biochem.Biophys., 211, 605-612 (1981)) анализируют при 30oС в 0,2 мл объеме, который содержит 1 мМ АТР, 3 мМ ацетил-коэнзима А, 2,5 мМ МgСl2,
50 мМ КСl, 0,5 мМ DTT и 15 мМ [14C] NaHCO3 (0,17 мКюри/ммоль).
Реакции инициируют, добавляя ацетил-коэнзим А, и останавливают, добавляя 25 мкл 12 н. НСl. Образование продукта определяют по радиоактивности, обнаруживаемой в стабильной фракции кислоты с помощью жидкостной сцинтилляционной спектрометрии. Активность энзима линейна в течение 15 минут.
F. Результаты
Для того чтобы выяснить сайт гербицидной активности сетоксидима и галоксифопа, используют по отдельности меченые ацетат, пируват и малонил-СоА в качестве
предшественников синтеза жирных кислот. Выделенные хлоропласты из сеянцев кукурузы включали [14С]-ацетат и [14С]пируват в неполярных фракциях (жирные кислоты). Включение ацетата
оказывается линейным в течение 30 минут после 5 минут lag периода, и зависит от добавления свободного ацетил-коэнзима А. Добавление либо 10 мкМ сетоксидима, либо 1 мкМ галоксифопа ингибирует включение
[14С]ацетата в жирные кислоты на 90 и 80% соответственно, как представлено в таблице 1 далее. Сетоксидим (10 мкМ) и галоксифоп (1 мкМ) также ингибируют включение [14С] пирувата в
жирные кислоты на 98 и 99%, соответственно.
Влияние 10 мкМ сетоксидима и 1 мкМ галоксифопа на включение [14С] малонил-СоА в жирные кислоты определяют, используя не содержащие клеток экстракты из суспензионных культур кукурузы. Ни сетоксидим (10 мкМ), ни галоксифоп (1 мкМ) не ингибируют активность синтетазы жирных кислот. Таким образом, оба гербицида ингибируют синтез жирной кислоты в интактных хлоропластах из сеянцев кукурузы как с ацетатом, так и с пируватом в качестве предшественника, но не ингибируют включение малонил-СоА в жирные кислоты. Это позволяет предположить, что АССаза, которая катализирует образование малонил-СоА, и является сайтом действия этих гербицидов.
Пример 2
Селекция и характеризация клеточных линий,
устойчивых к гербицидам
Схема селекции для идентификации и выделения клеток кукурузы, устойчивых к гербицидам, создается таким образом, чтобы свести к минимуму вредные эффекты высоких
концентраций гербицидов на развитие соматического эмбриона и способность растения к регенерации. Эта процедура включает экспонирование ткани постепенно возрастающим концентрациям гербицида, начиная с
концентрации сетоксидима, составляющей 1/20 летальной дозы, и удваивания концентрации гербицида с примерно двухнедельными интервалами до достижения летальной дозы (10 мкМ сетоксидима). Таким образом
гербицид имеет возможность оказывать медленное воздействие при непрерывном селекционном давлении, что позволяет устойчивым к гербицидам клеткам накапливаться со временем, при этом не затрагивая
потенциал регенерации растения.
А. Отбор клеточной линии, устойчивой к сетоксидиму
Ряд селекции осуществляют, используя схему селекции, описанную в предшествующем параграфе.
Отбор одной такой устойчивой к сетоксидиму линии, которая была идентифицирована и охарактеризована, описывается далее более подробно.
Примерно 100 г интенсивно растущей, регенерируемой, рыхлой эмбриогенной каллюсной ткани кукурузы, образованной из F1 незрелого эмбриона, полученного при скрещивании А188 • B73, переносят на отвержденную агаром поддерживающую среду (Armstrong and Green, Planta 164, 207 (1985)) в чашках Петри, содержащих 0,5 мкМ сетоксидима (BASF)(Parsippany, New Jersey). Эту каллюсную линию обозначают 2167-9/2160-154. Подготавливают сорок пластин и пять комочков каллюсной ткани весом около 0,5 г каждый помещают на каждую пластину. Концентрацию 0,5 мкМ сетоксидима выбирают из исследований по ингибированию роста для обеспечения менее 10-20% ингибирования роста в течение первых двух недель экспонирования гербицида. Спустя 14 дней 0,25-0,5-граммовые кусочки ткани, демонстрирующей высокую скорость роста и сохраняющие эмбриогенную морфологию (т.е. присутствие соматического эмбриона), субкультивируют на свежей среде, содержащей 1,0 мкМ сетоксидима. Приготавливают восемь пластин, содержащих пять кусочков ткани на пластине. Для каждого из последующих переносов все каллюсные ткани, демонстрирующие рост и способность образовывать соматический эмбрион, помещают на свежую среду, содержащую удвоенную концентрацию сетоксидима. Поэтому каллюс переносят с двухнедельными интервалами в чашки Петри, содержащие 0,5, 1,0, 2,0, 5,0 и 10,0 мкМ сетоксидима. В процессе селекции полное количество клеточных линий уменьшается по мере того, как становится более интенсивным ингибирование роста, осуществляемое гербицидом. Клеточные линии, демонстрирующие рост на 10 мкМ сетоксидима, обозначают как устойчивые к гербициду, и присваивают им идентификационный номер. Были выделены две устойчивые к сетоксидиму линии, которые демонстрируют ингибирование роста при 10 мкМ сетоксидима. Эти линии обозначены как 2167-9/ 2160-154 S-1 и 2167-9/2160-154 S-2.
В. Характеризация клеточной линии кукурузы, устойчивой к гербициду, 2167-9/2160-154 S-2
Устойчивую клеточную линию 2167-9/2160-154
S-2 ("S-2") характеризуют, оценивая (1) степень устойчивости к сетоксидиму; (2) перекрестную устойчивость к галоксифопу; и (3) биохимическую основу устойчивости. Каллюсовую ткань от S-2, которая
поддерживалась на 10 мкМ сетоксидима, переносят на среду, содержащую вплоть до 100 мкМ сетоксидима. 0,5 г ткани S-2 помещают на 7 см фильтровальную бумагу в виде газона, перекрывающего 50 мл
отвержденной агаром культуральной среды, содержащей 0,05, 1,0, 2,0, 5,0, 10,0, 50,0 и 100 мкМ сетоксидима, и культивируют в течение двух недель. Контрольную клеточную линию 2167-9/2160-154 высевают
аналогично на среду, содержащую тот же уровень сетоксидима. Результаты этого исследования суммированы в таблице 2. Контрольная клеточная линия, выращиваемая в течение двух недель, ингибируется на 50%
при концентрации 1 мкМ сетоксидима. Рост S-2 не ингибируется при концентрации 100 мкМ сетоксидима, что указывает на то, что S-2 оказывается, по крайней мере, в 100 раз более устойчива, нежели
контрольная клеточная линия.
Рост S-2 ингибируется 0,65 мкМ галоксифопа, тогда как контрольная клеточная линия ингибируется на 50% 0,02 мкМ, что соответствует примерно 30-кратному возрастанию устойчивости.
С. Активность ацетил-Коэнзим А-карбоксилазы (АССазы) клеточной линии S-2 кукурузы
Анализ осуществляют для определения того, изменяется ли АССаза,
экстрагированная из клеточной линии S-2, в отношении гербицидной активности. Активность АССазы контрольной ткани на 50% ингибируется либо 1,5 мкМ сетоксидима, либо 0,25 мкМ галоксифопа. АССазная
активность ткани S-2 ингибируется на 50% либо 70 мкМ сетоксидима, либо 1,8 мкМ галоксифопа, что сответствует 40-кратному и 7-кратному понижению чувствительности в расчете на концентрацию,
соответственно.
Пример 3
Регенерация растений и получение устойчивых к гербицидам семян
А. Схема регенерации растений
Шестнадцать кусочков каллюса S-2
примерно по 150 мг переносят в чашки Петри (25 • 100 мм), содержащую в твердом агаре 6 основные соли и 6% сахарозы, и инкубируют в течение 7-14 дней в условиях слабой освещенности (20 мкЕ м-2•с-1). Приготавливают несколько пластин, содержащих каллюс на регенерирующей растения среде. Каллюсы переносят на отвержденную агаром среду Murashige-Skoog (MS) без гормонов
и инкубируют при высокой степени освещенности (200 мкЕ м-2•с-1) для удлинения корней. Развивающиеся растения (1-3 см длиной) извлекают с поверхности каллюса и переносят в
магнитные ящики, содержащие в отвержденном агаре MS соли, 2% сахарозы без гормонов, на две недели для дальнейшего роста. Когда растения достигают стадии 2-3 листьев, их пересаживают в торфяные
горшочки, содержащие горшечную почву, и инкубируют в помещении для выращивания до стабильного роста. Выжившие растения переносят в почву в пластиковые горшки диаметром 10 см (4'') и выращивают в
теплице.
В. Экспрессия устойчивости к гербицидам в растениях, регенерированных из S-2 каллюсной ткани
Группы из восьми контрольных (2167-9/2160-154 неселектированных) и
восьми S-2 растений опрыскивают каждой из доз 0,0, 0,01, 0,05, 0,11, 0,22 или 0,44 кг/га сетоксидима для определения устойчивости к сетоксидиму целых выращенных в теплице растений. Контрольные
растения погибают при дозе сетоксидима 0,05 кг/га или более. Растения, регенерированные из клеточной линии S-2, выживают при 0,44 кг/га сетоксидима, что указывает на то, что растения S-2 демонстрируют,
по крайней мере, двукратную устойчивость к сетоксидиму по сравнению с контролем. Фиг.3 демонстрирует изменение роста регенерированных растений через семь дней после обработки сетоксидимом в дозе 0,44
кг/га. Как видно на фиг.4, длина корней регенерированных S-2 растений лишь слегка уменьшается через 14 дней после обработки сетоксидимом в дозе 0,44 кг/га.
С. Получение семян от S-2
растений
Растения, которые перенесли обработку сетоксидимом в дозе вплоть до 0,44 кг/га, пересаживают на генетические делянки территории университета Миннесоты, St. Paul, Minnesota. На поле
высаживают дополнительные S-2 растения, которые не подвергались опрыскиванию гербицидами. На поле выращивают шестьдесят пять 2167-9/2160-154 контрольных растений и девяносто пять S-2 растений до
зрелости. Растения либо самоопыляются, либо подвергаются перекрестному опылению инбредными линиями кукурузы А188, А619, А641, А661, А665, В37, В73, R806 и W153R. Контрольные семена получают за счет
самоопыления 2167-9/2160-154 регенерированных растений, или за счет скрещивания их с перечисленными выше инбредными линиями.
Д. Экспрессия устойчивости к гербицидам в потомстве
регенерированных растений
Семена, полученные в результате процедуры переопыления, описанной ранее, оказываются жизнеспособными и нормально прорастают. Семена от тридцати S-2 самоопыленных
растений и пятнадцати 2167-9/2160-154 контрольных растений высаживают в лотки 25 • 50 см с почвой (по 28 семян от каждого растения на одном лотке) и выращивают в теплице. Сеянцы на стадии 3-4
листьев обрабатывают дозами сетоксидима 0,1, 0,44 и 1,1 кг/га, и визуально оценивают повреждения, нанесенные гербицидами и длину корней. На основании визуальных оценок гербицидных повреждений после
двух недель после обработки, собственное потомство, полученное от самоопыления S-2 растений, разделилось примерно как 1: 2: 1 для здоровых, неповрежденных растений: для растений частично поврежденных:
для погибших растений, соответственно, при дозах обработки сетоксидимом 0,44 и 1,1 кг/га. Все контрольное потомство 2167-9/2160-154 контрольных растений погибло при обработке дозами 0,1 кг/га и при
более высоких уровнях сетоксидима. Эти результаты демонстрируют доминантную экспрессию устойчивости к сетоксидиму, указывающую на то, что устойчивость к сетоксидиму в S-2 растениях является
наследуемым свойством. Аналогичные тесты проводят на потомстве S-2 растений, скрещенных с другими инбредными линиями. Во всех случаях эти тестируемые потомства скрещиваний, обработанные дозами 0,44
кг/га сетоксидима, разделяются в отношении 1:1 для растущих корней против погибших корней, независимо от того, использовали ли S-2 растения в качестве опылителей или опыляемых растений. Эти результаты
подтверждают, что устойчивость к сетоксидиму регулируется одним доминантным ядерным геном. Во всех случаях, контрольные растения, скрещенные с другими инбредными линиями, погибли и поэтому оказались
восприимчивыми к сетоксидиму.
Е. Способ получения однородных устойчивых к гербициду семян
Потомство S-2 растений, переживших обработку сетоксидимом в дозах 0,44 и 1,1 кг/га и
не демонстрирующих гербицидных повреждений, переносят в теплицу и выращивают до зрелости. Эти растения могут самоопыляться, и их потомство оценивают по устойчивости к сетоксидиму и галоксифопу для
выявления устойчивых к гербицидам линий кукурузы чистого разведения.
Потомство S-2 растений, скрещенных с инбредными линиями и демонстрирующих устойчивость к сетоксидиму, можно периодически подвергать обратному скрещиванию с теми же самыми инбредными линиями. Потомство каждого из скрещиваний можно скринировать по устойчивости к сетоксидиму, и устойчивые растения выращивать до зрелости, и затем снова скрещивать с периодическим родителем. После 6-7 таких циклов бэккроссинга устойчивые к сетоксидиму растения можно подвергнуть самоопылению, и их потомство скринировать по устойчивости с тем, чтобы получить гомозиготные, устойчивые к седоксидиму инбредные линии кукурузы.
Пример 4
Отбор дополнительных устойчивых к гербицидам клеточных линий
кукурузы
Выбирают одну клеточную линию кукурузы, устойчивую к сетоксидиму, 2167-9/2160-154 S-1 и две клеточные линии кукурузы, устойчивые к галоксифопу, 2167-9/2160-154 Н-1 и 2167-9/2160-154
Н-2, и характеризуют их следующим образом:
А. Отбор клеточной линии кукурузы 2167-9/2160-154 S-1
Клеточную линию кукурузы 2167-9/2160-154 S-1 отбирают из клеточной культуры кукурузы,
используя схему, подробно описанную ранее в разделе отбора линии 2167-9/2160-154 S-2. Примерно 70 растений регенерируют из линии 2167-9/2160-154 S-1, и либо самоопыляют, либо проводят перекрестное
опыление инбредными линиями кукурузы А188, А619, А641, А665, В37, В73, R806 и W153R.
В. Отбор клеточной линии кукурузы 2167-9/2160-154 Н-1
Линию 2167-9/2160-154 Н-1 отбирают
из клеточной культуры кукурузы, используя схему, аналогичную описанной ранее, за исключением того, что ткань каллюса кукурузы отбирают, используя гербицид галоксифоп. Ткань каллюса кукурузы вначале
помещают на 0,01 мкМ галоксифоп. С двухнедельными интервалами выжившую ткань субкультивируют на 0,05, 0,10
и 0,20 мкМ галоксифопе. Примерно 50 растений регенерируют из линии 2167-9/2160-154
Н-1, а затем самоопыляют.
С. Отбор клеточной линии кукурузы 2167-9/2160-154 Н-2
Линию 2167-9/2160-154 Н-2 отбирают из клеточной культуры кукурузы, используя схему,
аналогичную подробно описанной для линии 2167-9/2160-154 Н-1. Из этой линии не удалось регенирировать ни одного растения.
Д. Характеризация линий 2167-9/2160-154 S-1, Н-1 и Н-2
Устойчивые клеточные культуры характеризуют для определения степени устойчивости к сетоксидиму и галоксифопу. Ткань каллюса из этих линий оценивают в экспериментах, как указано ранее, для
характеризации линии 2167-9/2160-154 S-2. В таблице II суммированы результаты этих исследований. Линия 2167-9/2160-154 S-1 и линия 2167-9/2160-154 Н-2 демонстрируют четырехкратное увеличение
устойчивости к галоксифопу, тогда как линия 2167-9/2160-154 Н-1 демонстрирует примерно 60-кратное увеличение устойчивости к галоксифопу. Ни одна из линий, отобранных по галоксифопу, не демонстрирует
значительной устойчивости к сетоксидиму, тогда как отобранная по сетоксидиму линия S-1 демонстрирует примерно 100-кратное увеличение устойчивости к сетоксидиму.
Е. Ингибирование
гербицидами ацетил-Коэнзим А-карбоксилазы клеточных линий кукурузы S-1, H-1 и Н-2
Ацетил-Коэнзим А-карбоксилазу (АССаза) экстрагируют из клеточных линий S-1, H-1 и Н-2 и анализируют, как
подробно указано ранее, для клеточной линии кукурузы S-2. В таблице III далее суммированы результаты этих исследований. АССаза из линии S-1 оказывается более устойчивой как к сетоксидиму, так и к
галоксифопу, тогда как АССаза из линии Н-1 оказывается более устойчивой к галоксифопу, а не к сетоксидиму. АССаза из линии Н-2 не отличается от неселектированной родительской линии 2167-9/2160-154 по
восприимчивости к любому из гербицидов.
Однако, клеточная линия Н-2 демонстрирует примерно пятикратное повышение уровня АССазной активности по сравнению с уровнем неселектированной родительской линии 2167-9/2160-154. Таким образом, селекция по устойчивости к сетоксидиму или галоксифопу приводит к меньшей восприимчивости АС-Сазы в клеточной линии S-1 и H-1, а также к более высокому уровню активности АССазы в клеточной линии Н-2.
Числа представляют кратность повышения концентраций гербицида, которая ингибирует активность АССазы селектированной клеточной линии на 50% по сравнению с неселектированной родительской клеточной линией 2167-9/2160-154.
Депонирование семян
Семена от представительных S-2 растений (пример 3 (В)) и H-1
растений (пример 4 (В)) были депонированы в американской коллекции типовых культур American Type Culture Collection 12301 Parclawn Drive, Rockville MD 20852 USA, 25 октября 1988 г. под
регистрационными номерами АТСС 40507 и АТСС 40508, соответственно.
Пример 5
Конструирование кДНК кдонов, кодирующих АССазу
А. Выделение АССазы
Энзим
ацетил-СоА-карбоксилазу выделяют и очищают из тканей растений и характеризуют. Очищенный энзим используют для создания реагентов антител, пригодных для идентификации кДНК клонов, кодирующих ген или
участок гена для АССазы.
АССазу экстрагируют из замороженных корней семидневных сеянцев кукурузы (Zea Mays L. инбред А619 или В73),выращенных в растительной камере (24oС, 90% OВ, 16 часов дневного света, 210 мкЕ м-2 сек-1). Самый верхний лист и пластинку удаляют, а остаток корня замораживают в жидком азоте. Эмбрионы и ткань эндосперма с развивающихся зерен отбирают с выращенных в полевых условиях початков на 36-40 день после оплодотворения (DAP). Суспензию клеток кукурузы сорта Black Mexican Sweet corn (BMS) получают из культуры, как это было описано ранее (W.B. Parker и др. Plant Physiol., 92, 1220-1225 (1990)). Ткани хранят в жидком азоте до использования.
Стадии экстрагирования и очистки осуществляют при температуре 0-4oС. Сырые экстракты клеток листьев, обкладки сосудистых волокнистых пучков, эмбрионов, эндосперма и BMS приготавливают из замороженной ткани по способу W.B. Parker и др. Proc. Natl.Acad.Sci.USA 87, 7175-7179 (1990), за исключением того, что экстракционный буфер содержит 0,1 М Tricine-KOH, pH 8,3, 0,3 М глицерина, 5 мМ DTT, 2 мМ Na2EDTA и 0,5 мМ фенилметонилсульфонилфторида (PMSF). К экстракту обкладки сосудисто-волокнистых пучков добавляют Triton X-100 (0,01% вес/вес) и к некоторым экстрактам целых листьев. Для некоторых экспериментов включают дополнительные ингибиторы протеаз (леупептин, 2 мкг/мл; пепстатин А, 100 мкг/мл; бензамидин, 1 мМ; амино-n-капроновая кислота, 5 мМ; и ингибитор соевого трипсина, 10 мкг/мл). Отфильтрованные гомогенаты центрифугируют в течение 20 минут при 30000 g. Часть неочищенной надосадочной фракции немедленно кипятят в течение 5 минут в 1 объеме SDS образцового буфера (W. B. Parker и др. Plant Physiol., 92, 1220-1225 (1990)) для SDS-PAGE анализа; остальное обессоливают на 10 мл Sephadex G25 колонке в экстракционном буфере без PMSF.
АССазу выделяют из надосадочной жидкости неочищенного экстракта в четыре стадии. Эту фракцию доводят до 30% насыщения твердым (NH4)2SO4, перемешивают в течение 15 минут и центрифугируют в течение 20 минут при 20000 g. Затем надосадочную жидкость доводят до насыщения 40% раствором (NH4)2SO4, перемешивают в течение 30 минут и центрифугируют. Осадок растворяют в 5 мл экстракционного буфера, обрабатывают в микрофуге в течение 5 минут, и полученную надосадочную жидкость вводят в гель-фильтрационную колонку Sephacryl S-300 (Pharmacia; 2,5 • 46 см), уравновешенную S-300 буфером (0,1 М Tricine-KOH, pH 8,3, 0,5 М глицерина, 0,5 мМ DTT, 2 мМ Na, 50 мМ КСl). В более поздних экспериментах используют колонку Sephacryl S-400. Фракции (2,5 мл) элюируют со скоростью 0,75 мл/мин. АССазная активность элюируется вскоре после А280 пика несорбирующегося материала (V0=75 мл). Активные фракции собирают, доводят до 4,25 мМ МgСl2 (из 0,5 М раствора) и вводят со скоростью 0,2 мл/мин в Blue Sepharose CL-6B (Pharmacia; 1,5 • 15 см), уравновешенную Blue Sepharose буфером (S-300 буфер, содержащий 4,25 мМ MgCl2 и 10 мМ NaHCO3). Колонку промывают в течение ночи 150 мл буфера (0,45 мл/мин). Затем активность АССазы эпюируют 50 мл буфера плюс 10 мМ АТР (0,45 мл/мин). Активные фракции собирают и вводят в анионо-обменную колонку FPLC Mono-Q HR 5/5 (Pharmacia), уравновешенную S-300 буфером минус КС1. Эту колонку промывают 30 мл S-300 буфера минус КСl, а затем 48 мл 0-500 мМ КСl градиента в S-3000 буфере (0,25 мл/мин). Фракции (по 1 мл) из двух пиков АССазной активности собирают отдельно. Все фракции очистки обессоливают в S-300 буфере и анализируют на АССазную активность и протеин.
АССазу анализируют также из мезофилхлоропластов и обкладки сосудисто-волокнистых пучков. Мезофильные хлоропласты из гомогенатов 7-8-дневных сеянцев, которые выдерживались в течение 24 часов в темноте перед сбором, выделяют при линейном градиенте Percoll по способу J.D. Burton и др., Pesticide Biochemistry and Physiology, 34,76-85 (1989), за исключением того, что буферы содержат 0,6 М сорбита, а силу g при центрифугировании снижают на 25%. Затем интактные хлоропласты отбирают из дискретной нижней зеленой полосы, присутствующей после центрифугирования с градиентом Percoll (G.Morioux и др. . Plant Physiol., 67, 470-473 (1981)). Oсажденные хлоропласты подвергают лизису за счет повторного суспендирования их в АССазном экстракционном буфере плюс PMSF и 0,01% (объем/объем) Triton X-100. Обкладки сосудисто-волокнистых пучков получают из материала исходного листового гомогената, удержанного на 70-мкм фильтре после пятикратной регомогенизации ретената в 2 л буфера. Обработанные Triton-Х обессоленные экстракты листьев мезофильного хлоропласта и обкладки сосудисто-волокнистых пучков анализируют по активности Rubisco (G. Zhu и др., Plant Physiol., 97,1348-1353 (1991)), NADP-зависимой малат-дегидрогеназы (M. D. Hatch и др., Biochem. Biophys.Res.Commun., 34, 589-593 (1969)), фосфоенолпируваткарбоксилазы (R. C. Leegood и др., "Isolation of Membranes and Organelles from Plant Ceels", Academic Press, New York 185-210 (1983)), каталазы (Worthington Biochemicals, 1972) и фумаразы (R.L. Hill и др. Methods Enzymol., 13, 91-99 (1969)) и по полному хлорофиллу (D.E. Arnon, Plant Physiol. , 24, 1-5 (1949)). Препараты мезофильных хлоропластов по оценке относительно свободны от примесей обкладок сосудисто-волокнистых пучков, так как они содержат в 3 раза больше NADP-зависимой малатдегидрогеназы и одну десятую Rubisco активности (мг-1 хлорофилла) по сравнению с экстрактами обкладки сосудисто-волокнистых пучков. Препараты мезофильного хлоропласта содержат также лишь - 2,6% каталазной, фумаразной и фосфоенолпируваткарбоксилазной активностей (мг-1 хлорофилла) от экстрактов целых листьев, что указывает на то, что они относительно свободны от пероксисомальных, митохондриальных или цитоплазматических компонент.
АССазная активность, измеренная по данным включения ацетил-СоА-зависимого Н14 CO3 (ICN. 2,07 GBg ммоль-1) в кислотостабильный продукт, который, как было показано ранее, является малонил-СоА (I.D. Burton и др.. Pesticide Biochemistry and Physiology, 34, 76-85 (1989)). Анализы обессоленных очищенных фракций или сырых, обессоленных экстрактов тканей содержат вплоть до 50 и 25% (объем/объем) энзима, соответственно. В некоторых экспериментах метилкротонил-СоА или пропионил-СоА заменяют на ацетил-СоА (E.S. Wurtele и др. Archives of Biochemistry and Biophysics, 278, 179-186 (1990)). В некоторые анализы включают авидин (10 ед/мл). Анализы по ингибированию гербицидами включают 1% (объем/объем) этанола плюс или минус 1 мкМ галоксифопа (2-[4-[[3-хлор-5-(трифторметил)-2-пиридинил]окси]фенокси]пропановую кислоту, Dow Chemical Co. аналитической степени чистоты рацемическая смесь) или 10 мкМ сетоксидима (2-[1-[(этоксиимино)бутил] -5-[2-(этилтио)-пропил] -3-гидрокси-2-циклогексен-1-он, литиевая соль, BASF Corp., техническая степень чистоты). Данные представляют собой среднее плюс стандартная ошибка из трех анализов.
Концентрации протеинов определяют с повторами в анализе связывания синего красителя Bio-Rad Coomassie, в соответствии с рекомендациями изготовителей, используя BSA в качестве стандарта.
Центрифугированные неочищенные экстракты и протеины в очищенных фракциях и иммуноосажденные надосадочные жидкости разделяют с помощью SDS-PAGE в 6 или 7,5% гелях, как было указано ранее (W.B. Parker и др. Plant.Physiol., 92, 1220-1225 (1990)). Очищенные фракции осаждают в 10% (об/об) ТСА, промывают 80% (объем/объем) ацетоном и сушат воздухом в течение 10 минут перед электрофорезом. Протеины в гелях окрашивают серебром (I.Heukeshoven и др., Electrophoresis, 6, 103-112 (1985)). Протеиновые стандарты с высоким молекулярным весом для SDS-PAGE (Pharmacia) используют для определения масс полипептидов.
Четырехстадийная процедура очистки, представленная в таблице IV, обычно дает от 30 до 190 мкг хорошо очищенной АССазы из 50 г (свежий вес) листьев инбредных сеянцев кукурузы А619 или В73. Активность АССазы в неочищенных фракциях надосадочной жидкости осаждается между 30 и 40% насыщения за счет (NH4)2SO4, что, по-видимому, повышает полную АССазную активность примерно на 38%. Компоненты неочищенных экстрактов могут подавлять скорость реакции, представленную в таблице IV, так как аналитическая смесь содержит 50% энзима (объем/объем). В тестах фракций из других очисток, энзимная скорость пропорциональна концентрации энзима в анализируемых смесях, содержащих вплоть до 25% (объем/объем) неочищенного экстракта, но 50% (объем/объем) смеси не тестировали. АССазная активность элюируется из гель-фильтрационной колонки Sephacryl S-300 несколько позже зеленого пика неадсорбирующегося материала. Примерно 56% S-300 фракции АССазной активности выделяют из колонки Blue Sepharose, главным образом, в начальных АТР-содержащих фракциях (12,5 мл). Как 10 мм NaHCO3, так и 4,25 мМ MgCl2 (1- и 0,85-кратные стандартные аналитические концентрации, соответственно) включены в Blue Sepharose буфер, так как они повышают полную и специфическую АССазную активность, остающуюся после абсорбции порции на шариках Blue Sepharose, элюирования за счет АТР и обессоливания в экстракционном буфере минус PMSF. Ни NaHCO3, ни МgСl2 не повышают энзимную стабильность неочищенных экстрактов. С помощью Mono-Q анионообменной хроматографии разделяют два пика АССазной активности, которые элюируются на примерно 210 мМ (обозначают как АССаза II) и 250 мМ КСl (обозначают как АССаза 1), как это ранее наблюдали для гибридных вариантов кукурузы (J.L. Howard и др., FEBS Lett., 261, 261-264 (1990)). АССаза 1 содержит около 85% полной активности, выделенной из колонки (29% от исходной активности неочищенного экстракта) и обладает высокой специфической активностью (таблица IV). Специфическая активность АССазы II составляет менее 30% от активности АССазы I. Обе активности ингибируются более чем на 90% авидином, как сообщалось ранее (I. L. Howard и др., FEBS Lett., 261, 261-264 (1990)). По данным, полученным с помощью гель-фильтрации на Superose 6, масса нативной АССазы составляет примерно 490 кД.
В. Образование и специфичность антител к АССазе
Антитела являются восприимчивыми реагентами, которые позволяют идентифицировать генные продукты из кДНК и других клонированных генов. Антитела к очищенной АССазе получают и используют для
скринирования по кДНК клонам, кодирующим весь или часть гена АССазы.
Антисыворотку к АССазе кукурузы получают, иммунизуя самок новозеландского белого кролика (Egli и др. Plant Physiol., 101, 499 (1993)). Осуществляют внутримышечную инъекцию 100 мкг Mono-Q-очищенной SDS-денатурированной АССазы 1 в полном адъюванте Фреунда с последующими подкожными инъекциями 20-100 мкг очищенного на геле полипептида АССазы в акриламиде плюс неполный адъюван каждые 4-6 недель до полного числа инъекций 6. Сыворотку хранят при -20oС в 0,02% (вес/ объем) NaN3.
Для получения вестернблоттов протеины в SDS гелях электрофоретически переносят на Immobilon (W. B. Parker и др., Plant Physiol., 92, 1220-1225 (1990)) в течение 1 часа при 20 V в Bio-Rad Transphor устройстве для проведения полусухого блоттинга, а затем окрашивают Ponceau S (E. Harlow и др., "Antibodies - A Laboratory Manual, Cold Spring Harbor Laboratory, Cold Spring Harbor, New York). Обесцвеченные блоты блокируют Tris-буферированным физиологическим раствором плюс 0,5% (об/об) Tween-20 (Bio-Rad) и 10% (вес/объем) бычьей сыворотки (только для антисывороточных блотов). АССазу и биотинилированные протеины детектируют иммунной сывороткой (1/10000) плюс конъюгат щелочной фосфатазы с козьим антителом к IgG кролика или авидин-щелочной фосфатазой (W.B. Parker и др.. Plant Physiol., 92, 1220-1225 (1990)). Блоты повторяют, по крайней мере, трижды.
Для иммуноосаждения равные АССазные активности (0,58 нмоль/мин) в неочищенных экстрактах обессоливают в S-300 буфере, содержащем 0,1 М КСl, и инкубируют в течение 1 часа при 25oС с 16 мкл буфера или с 16 мкл сыворотки, содержащей от 1 до 100% антисыворотки к АССазе в преиммунной сыворотке. Иммунные комплексы инкубируют в течение 1 часа при 25oС с двукратным избытком (IgG связывание) протеин А-агарозы, а затем обрабатывают на микрофуге в течение 5 минут для получения иммуноосажденных фракций надосадочной жидкости. Активность АССазы надосадочных жидкостей выражают как процент от 100% контрольной преиммунной сыворотки. Данные представляют собой среднее плюс SE из трех повторных анализов для каждого из двух сетов экстрактов.
Вестернблоты и окрашенные серебром гели очищенных фракций разделяют с помощью 7,5% SDS-PAGE, что показывает, что ни АССазы I, ни АССазы II Mono-Q фракции, не содержат биотинилированных полипептидов с размером менее 212 кД. Полипептиды более 212 кД представляют основную протеиновую компоненту АССазы I Mono-Q фрагмента (фиг. 5). Фракция АССазы II содержит биотинилированный полипептид более 212 кД и большое количество небиотинилированного полипептида 55 кД. Фракции из более ранних стадий очистки содержат дополнительные биотинилированные протеины примерно 74,75 и 125 кД (фиг.5).
Для лучшего сравнения биотинилированных полипептидов более 212 кД во фракциях АССазы I и II, используют 6% SDS-PAGE, который показывает, что масса АССазы II составляет величину, которая примерно на 8 кД меньше, чем масса АССАазы I. Молекулярные массы были оценены как 219 кД (АССаза II) и 227 кД (АССаза I) на основании сравнений с полипептидными стандартами и наблюдений (N. R. Palosaari, Plant Physiol. , 99 (S), 359 (1992)) того, что на "быстрых гелях" (Pastgels, Pharmacia)) полипептид АССазы I несколько меньше, чем додекамерный ферритин селезенки лошади (238 кД; M. Heusterspreute и др., FEBS Lett. , 129, 322-327 (1981)). Все фракции очистки через стадию Blue Sepharose содержат полипептиды как АССазы I, так и АССазы II. Быстрая экстракция листьев в буфере, содержащем пять дополнительных ингибиторов протеаз, или четырехчасовое инкубирование экстрактов при 25oС оказывает слабое влияние или вовсе его не оказывает на относительные количества двух полипептидов, что предполагает, что АССаза II не является продуктом деструкции АССазы I.
Антисыворотка к АССазе I эффективно распознает полипептид АССазы I в сырых экстрактах и слабо, либо вовсе не распознает полипептиды АССазы II. Преиммунная сыворотка не распознает никаких полос. Предположив, что авидин связывается аналогично с полипептидами АССазы I и АССазы II, оказывается, что количество АССазы II на Вестерн-блотах несколько меньше, чем количество АССазы I. Однако, сравнительное окрашивание антителом при сравнении с авидином показывает, что антитело имеет значительно меньшую афинность к АССазе II, нежели к АССазе I.
Для определения того, одни и те же ли полипептиды АССазы экспрессированы в различные типы клеток кукурузы, разделяют с помощью SDS-PAGE протеины в мезофильных хлоропластах и неочищенных экстрактах листьев, тканях эндосперма, эмбрионах и BMS клетках. Все препараты содержат преобладающий биотинилированный полипептид примерно 227 кД (АССаза), который прекрасно распознается АССазной антисывороткой или авидином. Аналогично, полоса с плотностью 227 кД наблюдаются, если полосы геля зондируют либо авидином, либо АССазной антисывороткой. 219 кД полипептид АССазы II легко определяется в листьях только за счет связывания авидина, но либо его мало, либо он не детектируется в экстрактах из других тканей. Только лишь 227 кД АССазы I полипептид детектируется в очищенных мезофильных хлоропластах, однако, это позволяет предположить, что 219 кД полипептид АССазы II локализован где-либо еще в мезофильных клетках, или в других типах клеток молодых листьев. АССазная активность и биотинилированный пептид (пептиды) более 212 кД также обнаружены в экстрактах обкладки сосудисто-волокнистых пучков, но их низкие выходы не позволяют определить тип присутствующей АССазы. Два других основных биотинилированных полипептида 75 и 76 кД обнаружены во всех тканях. Другие небиотинилированные протеины 66 кД (слабый) и 55 кД также распознаются АССазной антисывороткой. Полипептид 55 кД найден только в листьях; он присутствует также в обеих Mono Q фракциях АССазы I и АССазы II (фиг.5), и был идентифицирован как крупная субъединица Rubisco на основании его комиграции с протеином, иммуноосажденным шпинатной Rubisco антисывороткой.
АССазная антисыворотка осаждает, по крайней мере, 75% АССазной активности из неочищенных экстрактов листьев, тканей эндосперма, эмбриона и BMS клеток (фиг.6), что указывает, что большая часть АССазной активности в этих тканях иммунологически связана с полипептидом АССазы I листьев. Меньше активности осаждается из листьев (75%) нежели из других тканей, особенно эмбрионов (98%). По сравнению с иммуноосаждением, ингибирование АССазной активности антисывороткой в растворе составляло менее 20% эффективности снижения АССазной активности.
Специфичность субстрата АССазы из различных фракций очистки исследуют для сравнения с включением [14С] НСО3- в присутствии различных ацил-СоА субстратов. Как АССаза I, так и АССаза II используют пропионил-СоА на 40-50% столь же быстро, как и ацетил-СоА, при 50-500 мкМ субстрата, даже хотя они не содержат биотинилированных полипептидов (фиг.5) размера известных пропионил-СоА-карбоксилаз (70-75 кД; см. E.S. Wurtele и др. Archives of Biochemistry and Biophysics., 278, 179-186 (1990)). Активности в присутствии как ацетил-СоА, так и пропионил-СоА (250-500 мкМ каждая) составляют примерно от 90 (АССаза I) до 130% (АССаза II) от активности 500 мкМ одной ацетил-СоА. Неочищенные экстракты листьев используют пропионил-СоА-карбоксилазу и метилкротонил-СоА на 60% столь же эффективно, как ацетил-СоА. Метил кротонил-СоА-карбоксилазная активность снижается на 85% за счет гельфильтрации и полностью удаляется при Blue Sepharose афинной хроматографии.
АССаза I и II значительно отличаются по ингибированию их либо галоксифопом, либо сетоксидимом (фиг. 7). Ацетил-СоА- или пропионил-СоА-зависимое Н14СО3- включение АССазой I сильно ингибируется (65-80%) 1 мкМ гапоксифопа или 10 мкМ сетоксидима, тогда как активность АССазы II ингибируется менее чем на 50% для всех исследованных комбинаций гербицид/субстрат.
С. Клонирование и идентификация кДНК клонов кукурузы, кодирующих АССазу
кДНК клоны кукурузы, кодирующие часть гена АССазы, идентифицируют, скринируя ДНК
библиотеку, созданную для кукурузы. кДНК клоны используют для идентификации последовательности гена АССазы и для идентификации геномных ДНК фрагментов, кодирующих ген или гены АССазы.
Библиотеку λ gt11 кДНК из инбредных А188 сеянцев кукурузы получают стандартными способами для олиго-dT примирования, как указано для кДНК горошка (Gantt and Key, Eur. J. Biochem., 166:119-125 (1987). Лифты бляшек кДНК библиотеки кукурузы скринируют АССазной антисывороткой к АССазе кукурузы (Egli и др. Plant Physiol., 101, 499 (1993)) для идентификации бляшек, экспрессирующих АССазо-подобные протеины, по способу, описанному у Sambrook и др. (см. ранее, 1989). Первоначальное скринирование 800000 бляшек дает 120 позитивов. Повторное скринирование и выделение бляшек снижает число позитивов до 14. Все 14 клонов связывают антитела к АССазе, то есть, при элюировании из лифтов бляшек (J. Hammarback и др., J.Biol.Chem., 265:12763 (1990)), распознают 227-кД биотинилированный полипептид на SDS-PAGE вестернблотах неочищенных экстрактах эмбриона и листа. Наиболее сильные реакции вестернблоттинга получают для кДНК клонов 15-14. Шесть наилучших клонов переваривают EcoRI для исключения вставок кДНК кукурузы. Размеры вставок оказываются в интервале от 1,2 до 5,1 кb, что указывает на то, что эти клоны, по-видимому, не содержат полной кодирующей последовательности для зрелых полипептидов АССазы 219-кД и 227-кД (минимальные оценки 6,1 и 6,3 кb , соответственно). Клон 15-14, содержащий три EcoRI фрагмента в 2,0, 1,2 и 0,23 кb, представлен на фиг.8. Саузернблоты демонстрируют, что 1,2 и 2,0 кb фрагменты клона 15-14 каждый гибридизованы с различными фрагментами в других пяти клонах, за исключением клона 4-4, который содержит только фрагмент 1,2 кb. Шесть клонов кДНК кукурузы содержат EcoRI фрагменты, которые гибридизованы с крупным транскриптом (примерно 7,8 кb) на Нозернблотах полной РНК из листьев, эмбрионов и эндосперма (фиг. 9). РНК клеточной культуры BMS также содержит 7,8 кb транскрипт, но сигнал гибридизации не очевиден на этой картинке (фиг.9). Относительное содержание 7,8 кb транскрипта в эмбрионах выше, нежели в других источниках, что соответствует их АССазной активности.
Эти три EcoRI фрагмента субклонируют из кДНК клона 15-14 в вектор Bluescript и секвенируют с помощью способа дидеоксицепной терминации (секвеназа 2,0 USB), вначале используя Т3 и Т17 праймеры, а затем олигонуклеотидные праймеры на основании встроенной последовательности. Аналогичным способом секвенируют клон 16-6. Клон 16-6 включает три EcoRI фрагмента 3,1 кb, 1,2 кb и 0,23 кb и содержит дополнительную последовательность, расположенную в обратном направлении от направления в клоне 15-14. После сравнения и определения того, что последовательность та же самая, секвенируют дополнительную 1,2 кb последовательность у 5' конца.
Клон 18-5 секвенируют аналогичным способом. Клон 18-5 включает 3,9 кb, 1,2 кb и 0,23 кb EcoRI фрагменты и содержит дополнительно 1,9 кb 5' последовательность из клона 15-14. Субклон 18-51 (3,9 кb EcoRI фрагмент) был депонирован в американской коллекции типовых культур под регистрационным номером 69236.
Был проведен поиск в банках данных GenBank, PIR-29 и Swiss-Prot 19 на гомологичность аминокислоты с соответствующими последовательностями аминокислот из трех субклонов клона 8-5. Пептидные последовательности, соответствующие субклонам кДНК кукурузы, обладают большим сходством с АССазами цыпленка, крысы и дрожжей, нежели с любой другой последовательностью в данных банков. Фиг.8 иллюстрирует относительную организацию 3,9, 1,2 и 0,23 кb EcoRI фрагментов клона 18-5 и их колинеарность степени идентичности аминокислот с кДНК последовательностью АССазы цыпленка. Такое сравнение показывает, что клон кукурузы 18-5 содержит большой участок вблизи 3' конца с высокой идентичностью аминокислот (40-60%) с АССазой цыпленка, более длинный участок с идентичностью 23% в середине 3,9 кb последовательности и короткий участок с идентичностью 52% вблизи 5' последовательности 3,9 кb.
Участки последовательности субклона 18-51 были идентифицированы как кодирующие домены энзима АССазы функциональной значимости. Эти функциональные участки включают фрагмент, который охватывает предполагаемый активный сайт транскарбоксилазы в энзиме, содержащем последовательность ID 2 (см. в конце описания).
Этот функциональный домен заключен в последовательности 1112-856 пар оснований из 3' стоп кодона или участка карбоксиконца последовательности, кодирующей АССазу кукурузы. Эта транскарбоксилазная активная последовательность присутствует также в клоне 15-14.
Другой функциональный
участок, который был идентифицирован, охватывает последовательность из 12 пар оснований, кодирующую сайт связывания биотина с пептидной последовательностью ID 3:
5' GTT ATG AAG ATG 3'
Val Met Lys Met
Сайт связывания биотина кодируется примерно на 30% из 5' (N-конца) конца генов крысы, цыпленка и дрожжей АССазы. Эти функциональные домены пригодны для картирования и
дальнейшей идентификации других кДНК и/или геномных фрагментов, кодирующих гены АССазы.
Клоны кДНК, кодирующие участки генов ацетил-СоА-карбоксилазы, пригодны для идентификации последовательности гена или генов и могут использоваться в качестве зондов дня определения положения геномных копий гена или генов. Так как антитела к АССазе, используемые для скринирования λ gt11 библиотеки, распознают как 219, так и 227 кД полипептиды АССазы, не было определено, который из полипептидов кодируется этими неполной длины клонами. По-видимому, большинство клонов кодирует 227 кД полипептид, так как этот полипептид присутствует в большем количестве в библиотеке ДНК, источником которой служат ткани листьев, а антитела обладают большей афинностью для полипептида АССазы 227 кД.
Пример 6
Выделение и секвенирование генов АССазы, кодирующих геномы, и полная кДНК последовательность гена АССазы кукурузы
Геном кукурузы был проанализирован для
определения числа копий и положения геномных копий гена или генов АССазы. Было идентифицировано четыре различных типа геномных клонов АССазы кукурузы, и они были названы А1, А2, В1 и В2 (см.
далее).
Для получения геномных копий генов АССазы геномную библиотеку кукурузы В73 (Clontech, Palo Alto, СА) скринируют субклоном 2 кb из 15-14 и несколько клонов примерно в 15 кb идентифицируют как обладающие гомологичностью с кДНК АССазы. Рестрикционное картирование и частичное секвенирование позволяют выделить два типа геномных клонов (типы А и В), которые различаются по рестрикционным сайтам и их положениям относительно частичной кДНК последовательности АССазы, как представлено на фиг.8.
Было показано, что 2,5 кb EcoRI-Sall фрагмент ( 16) из геномного клона типа А, и 3,0 кb EcoRI-EcoRI фрагмент ( 34) из геномного клона типа В, гибридизуются с 3,9 кb зондом из 18-5, и они были клонированы в вектор Blue Script и секвенированы. Примерно 1,5 кb ДНК последовательности из геномного типа А 2,5 кb фрагмента оказались на 100% идентичны кодирующей последовательности из 3,9 кb кДНК субклона 18-51, описанного в примере 5; а остальная последовательность не демонстрирует идентичности с кДНК клоном, и предположительно представляет некодирующую интронную последовательность. Последовательность из 350 нуклеотидов, полученная из геномного типа В 3,0 кb фрагмента, примерно на 95% идентична кДНК клону, указывая, что его кодирующая последовательность отличается от геномной кодирующей последовательности типа А. Эти результаты показывают также, что геном кукурузы кодирует, по крайней мере, два различных гена, кодирующих полипептид, обладающий активностью ацетил-СоА-карбоксилазы.
Для идентификации и клонирования остальной части гена, представляющей аминоконец АССазы кукурузы, были субклонированы и частично секвенированы дополнительные участки геномного клона типа А. 3,5 кb Hind III-Hind III фрагмент ( 28) был секвенирован на примерно 400 нуклеотидов с каждого конца. 3' конец 28 демонстрирует значительную гомологичность с аминокислотной последовательностью из последовательности цыпленка, расположенной примерно на 0,5 кb от начала генома цыпленка.
Полную последовательность для фрагмента 28 можно получить и проанализировать для определения того, содержит ли она 5' конец кодирующего АССазу участка. Начало транскрибированного участка и, следовательно, по-видимому, начало участка, кодирующего АССазу, можно определить, используя геномные клоны в защитном анализе РНК-азы (J. Sambrook и др., "Molecular Cloning - A Laboratory Manual", Cold Spring Harbor Press, Cold Spring Harbor, New York (1989)). На основании данных секвенирования геномных клонов, совпадения (как показано на фиг.8) с последовательностями других АССазы и определения потенциальных открытых считывающих рамок, можно сконструировать олигонуклеотидные праймеры для синтеза кДНК молекул, представляющих аминоконец гена АССазы. Эти молекулы можно гибридизовать с фрагментами геномной типа А ДНК, такими, как 28, и негибридизующиеся части переварить S1 нуклеазой. Конец защищенного фрагмента определяют с помощью анализа на ДНК секвенирующем геле.
Для синтеза остающегося кодирующего участка между концом кДНК клона 18-5 и стартом транскрипции, были синтезированы
два олигонуклеотидных праймера. Праймер 1 комплементарен ДНК последовательности ID 4:
5' GCCAGATTCC ACCAAAGCAT ATATCC 3'
вблизи 5' конца кДНК субклона 18-51 и может быть использован
в качестве праймера для синтеза ДНК молекул из РНК сеянцев, листьев или эмбрионов кукурузы.
Праймер, соответствующий ДНК последовательности вблизи сайта старта транскрипции, можно использовать в комбинации с праймером 1 для амплификации ДНК в полимеразной цепной реакции (PCR). Затем секвенируют несколько независимых клонов, и их последовательности сравнивают с известной последовательностью геномного клона типа А для определения точной кодирующей последовательности, соответствующей последовательности гена кукурузы для АССазы. Аналогичный подход можно использовать для получения полной кодирующей последовательности для геномной типа В АССазы.
Остальную кДНК последовательность получают в результате трех последовательных циклов RT-PCR, используя олигонуклеотидные праймеры на основе геномного очевидного эксона (5') и известных кДНК (3') последовательностей. Для амплификации нуклеотидов 1-240 кДНК были использованы праймеры 28 sst-a5+ (последовательность ID 7) и 28 sst-6at3+ (последовательность ID 8), нуклеотиды 217-610 кДНК были 28 sst-5+ (последовательность ID 9) и 28-2t3+ (последовательность ID 10) и нуклеотиды 537-2094 кДНК были ACCPCR5' (последовательсность ID 4) (таблица V). PCR продукты, соответствующие нуклеотидам 1-240, 217-610 и 537-2094 конечной последовательности, были клонированы в PCR-скрипт (Stratagene).
Исходный 5,4-кb кДНК клон 18-5 и PCR продукты из, по крайней мере, трех отдельных PCR на пару олигонуклеотидов, секвенировали в обоих направлениях по способу дидеоксицепной терминации, используя либо секвеназу II (U.S. Biochemicals), либо АВ1 373 (Applied Biosystems, Inc.) схемы. В участках перекрывания клонов не было обнаружено различия в последовательностях. Полная последовательность кДНК АССазы кукурузы (нуклеотиды 1-7470 последовательность ID 5) и соответствующая ей аминокислотная последовательность (аминокислоты 1-2325, последовательность ID 6) представлены на фиг.1 и 14. 7470 bp кДНК включает 459 нуклеотидов 3' нетранслируемого участка и 36 нуклеотидов 5' нетранслируемых последовательностей.
Первый Met кодон в кДНК (нуклеотиды 37-39) был идентифицирован как стартовый кодон, на основании его сходства с консенсусными последовательностями инициирования (Kozak, J. Cell Biol. 108, 229 (1989); Lutcke и др. Embo. J. 6, 43 (1987). Сигнал стоп в рамке был обнаружен в геномной последовательности на 6 нуклеотидов в обратном направлении от секвенированной кДНК, и RT-PCR анализ этого участка позволяет предположить, что стоп кодон в рамке уже присутствует в кДНК. 3' конец кодирующей последовательности определяется двумя стоп кодонами, присутствующими в большой открытой считывающей рамке после нуклеотида 7011. Транслированная кодирующая последовательность, предваряющая полипептид из 2325 аминокислот (257 кД, последовательность ID 6), которая на 79-81% идентична мультифункциональным (MF) АССазам из альфа-альфа (Shorrosh и др., Proc.Natl.Acad.Sci., 91, 4323 (1994)) и пшеницы (Gornicki и др. Proc.Natl.Acad.Sci. 91, 6860 (1994) и 118 аминокислотам, предшествующим полипептиду, экспрессируемому последовательностью tag риса (Genbank, регистрационный Д39099, T. Sasaki) всего лишь на 53-55% идентична АССазам из других эукариотов.
Вдобавок, группа растительных АССаз (Genetics Computer Group, Madison, Wisconsin), Met 1 АССаз как кукурузы, так и Brassica napus, расположена примерно на 130 аминокислот в обратном направлении от консервативной последовательности VDEFCKALGG по сравнению с лишь 25 аминокислотами в обратном направлении для других растительных АССаз. Предсказанные 2325 аминокислот АССазы кукурузы содержат биотинилированный сайт в положении 806: в консервативном фрагменте МКМ (Ton с сотр., Eur. J. Biochem. 215, 687 (1993)). Организация и аминокислотная последовательность связывающих сайтов (Shorrosh и др. , Proc. Natl. Acad.Sci.91, 4323 (1994)) для АТР (аминокислоты 318-333), биотина (аминокислоты 799-811; биотин на 806), ацетил-СоА (аминокислоты 1952-1961) и карбоксибиотина (аминокислоты 1662-1711) оказались высоко консервативными среди всех MF АССаз.
Пример 7
Характеризация других геномных клонов
Первоначальный анализ полиморфизма длины рестрикционного фрагмента (RFLP) EcoRI-переваренных полных ДНК из трех инбредных линий
кукурузы дает одну полосу при зондировании 2 кb субклоном из 15-14 (внутри гена) и две полосы при зондировании 1,2 кb субклоном (вблизи 3' конца гена). Фрагменты, гомологичные 2 кb зонду, были
мономорфичны, а более интенсивная из двух полос, гибридизующаяся с 1,2 кb зондом, была диморфной. Как обсуждалось в примере 5, эти результаты подтверждают точку зрения, что кукуруза содержит, по
крайней мере, два различимых АССазных гена, и что они могут быть очень похожими в большей части кодирующего участка. Дополнительные геномные саузернблоты набора рекомбинантных инбредных линий
используют для определения полиморфизмов АССазных зондов для хромосом кукурузы. Один полиморфизм приписывают короткому плечу хромосомы 2; другие полиморфизмы оказываются неочевидными в этих
первоначальных тестах для идентификации хромосомного расположения для других генов АССазы кукурузы.
Выделение и рестрикционное картирование дополнительных геномных клонов их В73 геномной библиотеки (Clontech) приводит к идентификации четырех различных типов клонов, названных А1, А2, В1 и В2 (фиг.16-19), которые характеризуются 96% идентичности нуклеотидных последовательностей. Типы А и В соответствуют ранее опубликованным рА3 и рА4 кДНК (Ashton и др., Plant.Mol.Biol. , 24, 35 (1994)) и отличаются от рА3 и рА4 примерно в 4% их кодирующих последовательностей.
Типы А и В геномных клонов обладают гомологичностью линейных последовательностей за исключением вставки и интрона генов типа В около 1400 bp 3'А1 (последовательность ID 5) сайта старта трансляции. Анализ границ вставки выявил удвоение мишеневого сайта 3-bр и прямой повтор 6-bр, и дальнейший анализ последовательности выявил присутствие двух новых и уникальных LINE элементов (Long Interspersed Nuclear Elements - длинные, разбросанные ядерные элементы) в В1 и В2. LINE элементы млекопитающих находятся в большом количестве (104 -105) копий, имеют в длину 6-7 кb и имеют частые делеции с 5' конца и А-обогащенные 3' концы. Они фланкированы короткими прямыми повторами и содержат две ORF (открытые считывающие рамки), одна из которых кодирует обратную транскриптазу. Три LINE элемента (Cin 4, 50-100 копий в кукурузе; del 2, 250000 копий в лилиях; BNR1, 2-5% генома в сахарной свекле) были описаны в растениях (Leeton и др. Mol. Gen. Genetic 237, 97 (1993); Schmidt и др. Chromo Res. 3, 335 (1995); Swart-Sommer и др., ЕМВО J. 6, 3873 (1987)). В1 АССаза кукурузы содержит один уникальный LINE элемент, а В2 - содержит два. Два В2 LINE элементы были охарактеризованы по разностям в их последовательности обратной транскриптазы. Вставки В геномного клона имеют характеристические LINE особенности, включающие цистеиновый фрагмент и возможный поли А хвост, и содержатся в большом количестве. LINE вставка была также обнаружена в интроне кукурузы Shrunken-2 гене (Hannah и др.. Plant Physiol., 98, 1214 (1992)).
Частичная нуклеотидная последовательность (3489 нуклеотидов) геномного клона АССазы типа А1 представлена на фиг.16 (последовательность ID 12). Клон представляет Hind III фрагмент, который включает нуклеотиды 1-931 кДНК на фиг. 13 (последовательность ID 5) и первые четыре интрона внутри кодирующего участка в положениях 240 (460 нуклеотидов), 296 (480 нуклеотидов) и 872 (76 нуклеотидов) последовательности ID 5. Этот клон содержит также 1395 нуклеотидов в 5' направлении от кДНК последовательности ID 5 (т.е. 1431 нуклеотид в направлении 5' от старта трансляции в положении нуклеотида 1432).
Частичная нуклеотидная последовательность (1328 нуклеотидов) другого клона типа А представлена на фиг.17 (последовательность ID 13). Эта частичная последовательность представляет всю 5' нетранслируемую последовательность и содержит вставку в 7 оснований между нуклеотидами 279-290, но во всем остальном идентична последовательности ID 12.
Частичная нуклеотидная последовательность шести типа A2 клонов представлена на фиг. 18 (1565, 1168, 638, 558, 976 и 852 нуклеотидов последовательности 14, 15, 16, 17, 18 и 19, соответственно).
Внутри пары клонов А1-А2 идентифицированные различия находятся в интронах и 5'UTR последовательностях. А2 геномный клон слабо амплифицирован типа A1 PCR праймерами, специфическими для 5' UTR, если используемый 3' праймер является праймером для консервативной аминокислотной последовательности, найденной во всех АССазах (например, 28 sst-110F, ACTGTGCGTTTGAGAAGGTC, последовательность ID 23 и 28 sst-2Т3+, CCTCTACGTAATTGGTCAGC, последовательность ID 24). A2 амплифицированный продукт того же самого размера, что и продукт из геномного клона типа A1, и рестрикционный анализ выявляет различие в последовательности по сравнению с A1. Различия в 5' участке должны обеспечить средства для определения различий между экспрессией генов АССазы A1 и А2, и для определения того, кодирует ли A2 также СТР.
Частичная нуклеотидная последовательность (231, 207 и
180 нуклеотидов) трех клонов типа В представлена на фиг.19 (последовательности ID 20, 21 и 22, соответственно).
кДНК, соответствующие геномным клонам А2, В1 и В2, клонируют и секвенируют способом, аналогичным описанному ранее. Полученные аминокислотные последовательности сравнивают с известными АССазными последовательностями. Если идентифицированы предполагаемые СТР последовательности, описанным ранее способом тестируют их функциональности. Также, если ткане-специфичность и время развития экспрессии отличны для различных генов АССазы, последовательности промоторных участков соответствующих геномных клонов подвергают сравнению. Гено-специфические зонды для специфических АССазных генов могут предоставить больше информации относительно их роли в синтезе липидов (пластидные и цитоплазмические изоформы), вторичном метаболизме (цитоплазмические изоформы) и устойчивости к гербицидам (подобно пластидным изоформам).
3' зонд кДНК АССазы типа А1 картирован до хромосомы 2S (Egli и др. Maize Genetics Newsletter 68, 92 (1994)) и до 10L (Caffrey и др., Maize Gen.Coop., 69, 3 (1995)). Два 5' зонда кДНК типа А1, которые перекрывают транзитный пептид, картированный до хромосомы 2S, в том же положении, что и 3' зонд (см. генетическую карту, вариант 1996, Maize Genomie Database) PCR праймеры 28 sst-97F (CCTTTTTATGGCACTGTGCG, последовательность ID 25) и 28 sst-6t3+; (CATCGTAGCCTATATGAGGACG, последовательность ID 26), расположенные в некодирующих участках А1, которые перекрывают транзитный пептид хлоропласта, используют для амплификации В73 хромосомо-специфического продукта, который выделяется свойством устойчивости. Близкий 5' праймер (28 sst-a5+, последовательность ID 7) амплифицирует все генотипы и функционирует как позитивный контроль. Гербицидная устойчивость, связанная с Acc1-S3 мутацией, выделяется (29/29 индивидуумов до настоящего времени) продуцированием типа А 5' эндо-специфического PCR продукта, полученного из мутантного родителя, тогда как восприимчивые к гербицидам растения не содержат этой транзитной последовательности (15/17 потомство). Два индивидуальных растения, которые содержат В73-специфическую ДНК в этом положении, погибают от неизвестных причин, при выращивании в присутствии гербицида.
Мутации в кукурузе, которые придают устойчивость к циклогександионовым гербицидам и гербицидам арилоксифеноксипропановой кислоты за счет измененной АССазной мишени, обнаружены в двух неаллельных локусах, Асс1 и Асс2. А1 и А2, по-видимому, кодируют пластидные АССазы и соответствуют Асс1 и Асс2 локусам гербицидной устойчивости. Асс2 был картирован до 10L (VanDee, M.S. Thesis, University of Minnesota (1994)). Acc1 представлен сайт из пяти аллельных мутаций, включая Acc1-S2 и S-3 (Marshall и др., Theor.Applied Genet., 83, 435 (1992)), и был картирован до хромосомы 2.
Только один пластидный АССазный полипептид был идентифицирован с помощью SDS-PAGE экстрактов листьев кукурузы, хотя анализ 2-Д геля мог бы предоставить доказательства для второй, весьма сходной изоформы. Из двух АССазных изоформ, только одна АССаза 1 демонстрирует измененное ингибирование под действием гербицидов в Acc1-S2 мутантах, и большая часть АССазной активности в листьях и развивающихся эмбрионах устойчива к гербицидам, и таким образом, приписана Accl-S2 генному продукту.
Хотя 3' АССазный зонд был картирован как до 10L вблизи Acc2-S5, так и до 2S, консервативная последовательность генов АССазы не демонстрирует полиморфизма в множественных полосах, что усложняет идентификацию генов, кодируемых в этом локусе. Ген АССазы типа 1, вероятно, расположен на хромосоме 2, так как (1) 5' нетранслируемый и хлоропластный транзитный пептидный зонды из типа А1 гибридизуются с двумя полосами (темной и светлой) в инбредах кукурузы и (ii) анализ кукурузы-овса дополнительных линий, содержащих хромосомы кукурузы 2-9, показывает, что темная полоса существует на хромосоме 2, а светлая полоса - на хромосоме 1 или 10.
Гены АССазы типа В, по-видимому, кодируют цитозольные изоформы. Принимая, что цитозольная малонил-СоА является предшественником в синтезе многих вторичных метаболитов, включая флавоноиды (например, майзин, компоненту шелка кукурузы, связанную с устойчивостью к червю коробочному кукурузы), эти цитозольные АССазы могут иметь применение в агрономии.
Анализ норзернблоттинга полной РНК кукурузы АССазным зондом (нуклеотиды 3400-5932) дает одну полосу 8,3 кb. Для определения того, является ли экспрессия АССазной РНК регулируемой развитием, блоты полной РНК из 16-42 ДАР (дни после опыления) эмбрионов зондируют фрагментом кДНК АССазы. Количество транскрипта с пиком примерно на 23 ДР и равномерный характер сходны с ин витро активностями энзима АССазы и протеином, измеренными для развивающихся эмбрионов. Типа А- и В-специфические32Р-СТР-меченые антисмысловые транскрипты были 780 нт длиной (662 нт из АССазной последовательности + 118 нт последовательности вектор/промотор) и были идентичны, за исключением 15 оснований, не подходящих друг другу, рассеянных по их длине. Каждый антисмысловой транскрипт гибридизуют с полной РНК из эмбрионов на 16, 20, 23 и 42 ДАР, и переваривают смесью РНКаза А/Т1 до получения фрагмента из 662 оснований, специфического для используемого зонда. Эти результаты показывают, что транскрипт типа А находится в большем количестве, нежели типа В на всех тестированных стадиях, и что только тип А остается в большом количестве в более взрослых эмбрионах. Типы А и В имеют сходный характер экспрессии, и их пики приходятся на около 20-23 ДАР. Отношение типов А:В в листьях составляет около 2: 1, что сходно с их относительным содержанием в кДНК экспрессионных библиотеках.
Пример 8
Экспрессия
транзитного пептида хлоропласта АССазы кукурузы
N-конец предсказанного АССазного полипептида кукурузы более длинен, нежели предсказанные цитозольные АССазные изо-формы, и имеет несколько
характеристик, типичных для транзитных пептидов хлоропласта внутри первых примерно 73 аминокислот предсказанной N-терминальной последовательности. Фрагмент сайта СТР расщепления не найден в
предполагаемом СТР АССазы кукурузы, хотя только около 30% известных СТР содержат эту последовательность (Gavel and von Hejne FEBS Lett, 261, 455 (1990)). Однако, N-конец АССазы кукурузы, по-видимому,
имеет несколько других свойств, типичных для известных СТР: (1) отсутствие кислотных остатков в аминокислотах 1-49, (2) высокое содержание Ser+Thr (69% в аминокислотных остатках 23-35), (3) и
R-обогащенный участок между S- и D-обогащенными участками в аминокислотных остатках 36-49 и (4) предсказанный поворот _→β листа в аминокислотных остатках 58-73 (von Hejne and
Nishikawa, FEBS Lett, 278, 1 (1991)).
Способность аминокислотной последовательности, содержащейся внутри N-терминальных 100 аминокислотах транслированной кДНК ацетил-СоА-карбоксилазы (АССазы) кукурузы, управлять N-терминальной частью домена биотинкарбоксилазы АССазы кукурузы в хлоропластах, тестируют ин витро способами, использованными интенсивно в литературе (cм. Cline и др., J. Biol. Chem, 260, 3691 (1985); Lubben и Keegstra, Proc.Nat'1. Acad. Sci., 83, 5502 (1986)). Критерием для импорта было то, что ин витро-синтезированный S-меченый протеин импортируется в хлоропласт и (2) транспортированный протеин был меньше, нежели исходный продукт трансляции, на величину, которая соответствует удалению ожидаемого СТР. Исследования импорта использовали хлоропласты либо кукурузы, либо горошка. Хлоропласты горошка, как сообщалось, соответствуют импорту протеинов из различных видов, включая кукурузу (Nieto-Sotelo и др. Plant Physiol. , 93, 1321 (1990)). В другом варианте, функции предлагаемого СТР АССазы кукурузы тестируют, встраивая первые 258 кодирующих нуклеотидов АССазы кукурузы в рамку с и 5' GUS репортерного гена в РВ1121 (Clontech). Эту конструкцию и рВАР плазмиду используют для ко-трансформации суспензии клеток кукурузы сорта "Black Mexican Sweet" с помощью бомбардировки частицами. Basta-устойчивые трансформанты отбирают, и анализируют GUS активность и/или протеин в выживших культурах или в плазмидах, выделенных из трансформантов.
Античную конструкцию АССазы, содержащую нуклеотиды 1-833 последовательности ID 5, включающей предполагаемый СТР (нуклеотиды 37-256) и первый домен внутри участка биотинкарбоксилазы (идентифицированный за счет сравнения аминокислотной последовательности с E.coli биотинкарбоксилазой; см. Waldrop и др., Biochem. 33, 6249 (1994) амплифицируют с помощью PCR и клонируют в сайт EcoRV PCR-скрипта (Stratagenе) для создания плазмиды pBCN1. Приготавливают также соответствующие плазмидные последовательности без СТР (нуклеотиды 278-833) (-pBCN1). Протеин, кодируемый -pBCN1, начинается у аминокислотного остатка 83 (Val-Met).
Конструкции трансформируют в E.coli SURE клетки (Stratagene). Рестрикционный анализ pBCN1 с помощью BamH1 и Hind III показывает, что 5' конец АССазы расположен рядом с сайтом связывания Т7 РНК полимеразы в PCR-скрипте. Частичная последовательность pBCN1, полученная с использованием Т7 праймера секвенирования и АВ1373 автоматизированной схемы секвенирования, подтверждает эту ориентацию и показывает, что последовательность pBCN1 вставки идентична кДНК АССазы кукурузы, по крайней мере, в первых 300 нуклеотидах и что она включает ATG Met1 АССазы кукурузы. Клон ацильного протеина-носителя, содержащий СТР (АСР11 шпината, подарок от Dr.John Ohirogge, Michigan State University), можно использовать в качестве позитивного контроля. Эти конструкции используют для ин витро транскрипции, трансляции, импорта хлоропласта и SDS-PAGE анализа продуктов так же, как используют pBCN1.
Очищенную pBCN1 переваривают EcoRI для линеаризации плазмиды по 3' концу BCN1 вставки, обрабатывают электрофоретически на 1,5 агарозе, и плазмидную полосу примерно 3,8 кб иссекают и проводят генную очистку (Gene-Cleaned, BioLab 101). Выделенную полосу переваривают 20 мкг протеиназы К для удаления любых остатков РНКазы, экстрагируют фенолом, затем хлороформом в условиях без РНКазы. Содержание ДНК оценивают по флуоресценции этидиумбромида в капельках, по сравнению с λ ДНК стандартом (Sambrook и др.Molecular Cloning, A Laboratory Manual, 2-е изд. (1989). Один мкг pBCN1 ДНК транскрибируют в кэппед РНК с помощью набора Т7/ мМесседж MMacline (Ambion). Транскрипты без кэппа (Sp6 РНК полимераза; Promega) горошка RUBISCO мелкие субъединицы (SSU; Anderson и др., Biochem. J. 240, 709 (1986)) также транскрибируют.
Выход РНК оценивают, определяя % включения32Р-АТР (Amersham) в осаждаемый продукт, в соответствии с инструкциями изготовителя набора Ambion.
Электрофорез и авторадиография32Р-меченого продукта показывают, что он содержит, как и ожидалось, одну РНК полосу примерно в 895 нуклеотидов.
РНК транскрипты транслируют в25S-меченые полипептиды с помощью набора Ambion зародышей пшеницы IVT и примерно 45 мкКюри35S-метионина (Amersham; 37 ТВg//ммоль) в 50-мкл реакции, меченые протеины хранят на льду в течение 6 часов перед использованием в экспериментах по импорту хлоропластов.
Растения горошка (сорт "Little Marvel") и кукурузы (инбредная А 188) выращивают в растительной камере при 25oС при длине светового дня 16 часов. Хлоропласты выделяют из листьев горошка и кукурузы через 7 дней после посадки, соответственно, как было указано ранее (Burton и др., Pestic Biochem. and Physiol. , 34, 76 (1989); Egli и др.. Plant Physiol., 101, 499 (1993)). Интактные мезофильные хлоропласты промывают в ресуспензионном буфере (50 мМ HEPES-KOH, рН 7,8 плюс 0,33 М (горошек) или 0,66 М (кукуруза) сорбитола) в препаратах для анализа импорта. Суспензии разбавляют до получения 75 мкг хлорофилла/0,3 мл (Arnon, Plant Physiol., 24, 1 (1949)).
Эксперименты по импорту осуществляют практически в соответствии с описанием Cline и др. (J. Biol. Chem., 260, 3691 (1985)). Импортные реакционные смеси, содержащие 0,3 мл суспензии хлоропластов горошка или кукурузы, 40 мкл35S-трансляционной смеси, 3 мМ Мg-АТР и 10 мМ Met, инкубируют на свету в течение 1-30 минут при 25oС. Неимпортированные протеины переваривают в течение 30 минут 40 мкг термолизина, и протеолиз останавливают 10 мМ EDTA.
Хлоропласты снова выделяют, центрифугируя их через 1-мл 40% (объем/объем) градиенты Percoll в присутствии ресуспензионного буфера плюс 3 мм Мg-АТР, 10 мМ Met, и 20 мМ EDTA, дважды промывают в том же самом буфере и снова суспендируют в 65 мкл 1 мМ MgCl2/10 мМ Tris буфера, рН 8,0. Хлоропласты подвергают лизису в течение трех циклов замораживания-оттаивания в жидком азоте, обрабатывают в микрофуге, и аликвоты надосадочной жидкости и исходных ин витро транслированных протеинов анализируют с помощью SDS-PAGE с 8-25% градиентом Phast гелей (Pharmacia) с последующим непосредственным детектированием радиомеченых протеинов во влажных гелях (AMBIS) (фиг.20).
Как установлено с помощью SDS-PAGE, 30-минутный импорт превращает исходный 32-кД BCN1 полипептид в дублет с 27,2 и 27,5 кД для кукурузы и дает дополнительную 30-кД полосу для горошка (фиг.20А). Ни хлоропласты кукурузы, ни горошка не импортируют -pBCN1-полученных попипептидов. Образование полипептида 27,2-кД, по-видимому, является результатом расщепления после аминокислоты 47-49, очевидно, сайта расщепления, так как он находится между S- и Д-обогащенными участками, a R остатки расположены у -2, -7 и -8 (S.Gavel и G. Von Heijne, FEBS Lett., 261, 455 (1990).
Далее исследуют временную зависимость BCN1 импорта (1-30 минут) (фиг. 20В) для определения того, не является ли какой-либо из полипептидов результатом неполного процессинга или протеолиза. Импорт оказывается максимальным через 15 минут, но время импорта не оказывает никакого влияния на относительные количества продуктов импорта различного размера. Более высокие количества АТР (5 мМ) стимулируют импорт по сравнению с меньшими количествами АТР (менее 0,2 мМ). Эти данные предполагают, что в кукурузе эффективное расщепление BCN1 происходит по двум близко расположенным сайтам, и что частично процессированные продукты также образуются во время BCN1 импорта хлоропластами горошка. Поэтому нуклеотиды 1-833 гена АССазы кукурузы кодируют СТР.
Пример 9
Экспрессия клона кДНК или геномных клонов, кодирующих ген АССазы
Клоны кДНК и геномные клоны, кодирующие весь или часть гена
АССазы, были субклонированы в известную экспрессионную систему и генные продукты, реакционноспособные с антителами, специфическими для АССазы кукурузы, можно идентифицировать, используя
Вестернблоттинг. Так например, клоны кДНК АССазы встраивают в две трансформированные плазмиды: (i) Giblexp, которая содержит эмбрио-специфический промотор Глобулина 1 кукурузы (Gibl) и 3' участок
(Belander и др.. Genetics, 129, 863 (1991); и (ii) pAHC17, которая содержит конституитивный промотор кукурузы убихитин (Ubi-1) и первый эксон и интрон и NOS 3' терминатор (Christensen и др., Plant
Mol. Biol., 18, 675 (1992); Toki и др., Plant Physiol., 100, 1503 (1992)). 3' конец А1 кДНК имеет уникальный SalI сайт сразу в 3' направлении от стоп кодона, который используют для
лигирования в SalI сайт в обеих плазмидах перед конструированием терминатора. Другие сайты клонирования добавляют при необходимости к плазмидам или кДНК для завершения лигирования 5'-конца. Генные
продукты можно далее охарактеризовать структурно и/или энзиматически. Это обеспечит возможность скринировать геномные и кДНК клоны, которые кодируют ацетил-СоА-карбоксилазу, на наличие промоторов,
которые обеспечат сверхпродуцирование нативного или устойчивого к гербициду АССазного энзима в растениях.
Так например, 2 кb EcoRI фрагмент из клона 15-14 можно субклонировать в плазмиды трансформирования растения рВ1121 или рВ1221 в прямом направлении от 35S CaMV промотора и в обратном направлении от сигнальной последовательности полиаденилирования nopaline 3', по способу Jefferson Plant Mol. Biol. Kept. , 5, 387-405 (1987)). Затем эту плазмиду можно использовать для трансформации растительных клеток, таких как клетки табака, Brassica и Arabidopsis клетки, используя трансформацию протопласта или биолитическую трансформацию по способу W. J. Gordon-Kamm и др.. Plant Cell., 2, 603-618 (1990); M. E. Fromm и др., Bio/Technology, 8, 833-839 (1990); An Methods in Enzymology, 153, 292 (1987); и D'Hafluin, The Plant Cell, 4, 1495 (1992). Возрастание кратковременной экспрессии можно определить, используя количественный Вестернблоттинг с антителами, специфическими для АССазных энзимов. Поликлональные антитела к АССазе кукурузы, по-видимому, в значительной степени не реагирует перекрестно с АССазой из таких двудольных, как табак или Arabidopsis.
В другом варианте, ген АССазы можно субклонировать вместе с 35S CaMV промотором в бинарный Ti вектор pGA482, по способу An (см. ранее), который представляет собой бинарную Ti векторную систему и может быть использован для трансформирования растительных клеток в осуществляемой с помощью Agrobacterium трансформацией. Стабильно трансформированные растения можно создать стандартными способами, как указано в примере 3, а уровни экспрессии генов АССазы можно определить с помощью количественного Вестернблоттинга по способу Harlow и Lane, Antibodies. Cold Spring Harder Laboratories (1988). Способность управлять экспрессией клонированных АССазных генов позволит идентифицировать промоторы, которые обеспечивают повышенную экспрессию гена АССазы. Экспрессионную систему можно использовать для скринирования по тем промоторам, которые повышают генную экспрессию гена АССазы, по крайней мере, в 5-10 раз по сравнению с эндогенными уровнями АССазы, которые продуцируются обычно в клетках растений. Так как промотор 35S CaMV известен как сильный промотор, по-видимому, этот промотор обеспечит, по крайней мере, 5-10-кратное усиление экспрессии АССазы по сравнению с тем, которое обычно продуцируется в клетке растения.
Кроме того, экспрессионную систему можно использовать для скринирования антисмысловой ДНК последовательности. Так например, можно получить антисмысловую последовательность, которая комплементарна в примерно 0,5 кb участке кДНК АССазы кукурузы, которая имеет высокую гомологичность с участком гена АССазы цыпленка, и содержит последовательность для предполагаемого домена активного сайта транскарбоксилазы, как представлено на фиг.8. Антисмысловую последовательность можно субклонировать в рВ1121 или рВ1221 экспрессию под контролем индуцируемого растительного промотора, такого как промотор нитритредуктазы (Back и др.. Plant Molec. Biology, 17:9-18(1991)). Способность антисмысловой последовательности ингибировать экспрессию нативного гена АССазы можно оценить в трансформированных клетках, например, по способу Hamilton и др.. Nature, 346:284-287 (1990).
Пример 10
Идентификация и
клонироваиие гена из клеточной линии кукурузы, устойчивой к гербицидам
Устойчивость к гербицидам клеточных линий кукурузы создают, как указано в примерах 1, 2 и 4. Устойчивые к гербицидам
клеточные линии, как было показано, продуцируют АССазный энзим, который менее восприимчив к ингибированию сеток-сидимом и галоксифопом. Гены, кодирующие устойчивые к гербицидам формы АССазы,
идентифицируют и клонируют, используя стандартные способы, описанные у Sambrook и др.. Guide to Molecular Cloning; A Laboratory Manual (1989). Гены, кодирующие устойчивые к гербицидам формы АССазы,
можно затем ввести в восприимчивые к гербицидам виды растений стандартными способами для приданиям им устойчивости к гербицидам. Так например, АССазный энзим в клеточной линии кукурузы 2167-9/2160-154
S-1, по крайней мере, в 100 раз менее восприимчив в сетоксидиму, нежели дикий тип.
ДНК из клеточной линии или растений можно получить и переварить EcoRI и/или другими подходящими рестрикционными энзимами, в соответствии со стандартными способами. Перевар рестрикционных энзимов выделяют с помощью электрофореза на агарозном геле и зондируют либо 2 кb, либо 3,9 кb кДНК АССазным зондом, описанным в примере 5. Фрагменты, гибридизующиеся с 2 кb или 3,9 кb зондами, субклонируют вектор Blue Script, и участки гена секвенируют по способу примера 5 для того, чтобы проверить, полный ли АССазный ген был выделен.
Для подтверждения того, что клон кодирует ген АССазы, его субклонируют в экспрессионный вектор рВ1121 или рВ1221 по способу примера 8. Продукт гена АССазы, экспрессированный клоном либо в клетки черной сладкой мексиканской кукурузы, либо в клетки табака, оценивают по реакционной способности в отношении специфических к АССазе антител, по активности энзима и/или по устойчивости активности энзима к ингибированию сетоксидимом и/или галоксифопом. По-видимому, клонированный ген кодирует АССазу, которая устойчива к ингибированию сетоксидимом и галоксифопом. Затем этот ген вводят в восприимчивые к гербицидам эмбриогенные растительные клетки или эмбрион, включая клетки кукурузы или незрелые эмбрионы, для придания устойчивости к гербицидам этим видам растений после регенерации.
Полную кодирующую последовательность, кодирующую устойчивую к гербицидам форму АССазного энзима, клонируют в такой вектор трансформации растения как рВ1121 или рВ1221, по способу Jefferson, Plant Molec. Biol. Reporter, 5: 387-405 (1987). Этот вектор содержит 35S CaMV конститутивный промотор, β-глюкуронидазный структурный ген и сигналы 3' полиаденилирования нопалинсинтазы. Ген β-глюкуронидазы заменяют клонированным АССазным геном. Необязательно, клонированный АССазный ген можно объединить с природной или полученной синтетически последовательностью транзитного пептида хлоропласта из горошка по способу Keegstra и Olsen, Ann. Rev. Plant Physiol./Mol. Biol., 40:471-501 (1989) и/или с уникальными рестрикционными сайтами, вводимыми таким образом, чтобы клонированный ген отличался от эндогенного АССазного гена кукурузы. Стандартные способы субклонирования можно использовать в соответствии с указаниями в книге Sambrook и др. (см. ранее).
Для трансформации клеток кукурузы типа II каллюс можно трансформировать по способу W.J. Gordon-Kamm и др., Plant Cell, 2, 603-618 (1980); M.E. Fromm и др. , Вiо/Тесhnоlоgy 8, 833-839 (1990); и D.A. Walters и др., Plant Molecular Biology 18, 189-200 (1992).
В другом варианте, типа 1 эмбриогенный каллюс можно трансформировать, используя электропорацию после механического или энзиматического поранения каллюса по способу D'Hafluin и др.. The Plant Cell, 4:1495 (1992). После того, как клонированный ген вводят в эти клетки и трансформанты отбирают, обычно по устойчивости к гербицидам, фертильные трансгенные растения кукурузы можно регенерировать по способу D'Hafluin и др. (см. ранее). Фертильные трансгенные растения можно оценить по их устойчивости к гербицидам по способу примера 3. Очевидно, что фертильные трансгенные растения, содержащие и экспрессирующие клонированный ген АССазы, такой, как АССаза, устойчивая к сетоксидиму и/или галоксифопу, будут демонстрировать устойчивость к гербицидам по сравнению с соответствующими нетрансформированными растениями.
Пример 11
Создание
трансгенных растений, обладающих повышенным содержанием масла
После идентификации и клонирования ген или гены ацетил-СоА-карбоксилазы кукурузы можно ввести в однодольные или двудольные виды
растений, включая кукурузу, под контролем промотора, который обеспечивает сверхэкспрессию АССазного энзима. Сверхэкспрессия АССазного энзима, по-видимому, приводит к повышению содержания масла в
растениях и семенах.
Были определены природные сорта сои с высоким и низким содержанием масла. Ацетил-СоА-карбоксилаза из обоих типов сои была выделена по способу примера 5. Активность энзима определяют как функцию времени развития семян, и результаты представлены на фиг.11.
Представленные на фиг.11 результаты показывают, что более высокое содержание масла в сое связано с 2-кратным усилением АССазной активности на ранних и средних стадиях развития, по сравнению с соей с низким содержанием масла. Таким образом, экспрессия гена АССазы коррелирует с повышением содержания масла в семенах. Полное содержание масла в семенах можно также определить в момент зрелости (60 дней). Клеточные линии, продуцирующие высокое содержание масла Ahoka и Р128С. 134, имеют полное содержание масла 21,8 и 19,9% соответственно. Напротив, линия сои с низким содержанием масла, М76-395, содержит 13,6% масла. Таким образом, усиление экспрессии АССазы на ранних стадиях развития семян коррелирует с более высоким полным содержанием масла в семенах в стадии зрелости.
Можно выделить ген, кодирующий геномную ацетил-СоА-карбоксилазу по способу примера 5, и использовать его для трансформации видов растений за счет трансформации протопластов или биолитической трансформации. Если объединить ген с сильным промотором, таким как промотор вируса мозаики подсолнечника 35S, можно достичь сверхэкспрессии гена АССазы. В другом варианте, отбирая трансформированные клетки с множественными копиями гена, можно также получить в трансформированных клетках сверхэкспрессию гена АССазы. Этот ген можно клонировать в такой вектор, как рВ1121 или рВ1221, по способу Jefferson (см. ранее). Этот вектор содержит промотор вируса мозаики подсолнечника 35S, структурный ген β-глюкуронидазы и сигналы 3' полиаденилирования нопалинсинтазы. Клонированный ген АССазы можно заменить геном β-глюкуронидазы, а затем использовать для трансформации клеток растений, включая кукурузу, по способу примера 8.
Трансформированные клетки можно скринировать по сверхэкспрессии АССазы. Наличие клонированного гена можно проверить с помощью идентификации уникальных рестрикционных энзимных сайтов, включенных в клонированный ген. Уровни АССазы можно оценить стандартными способами энэиматического анализа и количественным Вестернблоттингом, используя антитела, специфические для АССазы кукрузы. Содержание жирной кислоты и липидов в клетках соответствует сверхпродуцированию АССазы и, по-видимому, можно повысить и оценить, используя стандартные способы, описанные Clark и Snyder, JACS, 66:1316 (1989). Трансформированные клеточные линии, сверхпродуцирующие АССазу и с повышенным полным содержанием масла, можно использовать для регенерации фертильных трансгенных растений и семян, как это описано у D'Hafluin (см. ранее).
Пример 12
Создание трансгенных растений с повышенной активностью АССазы в
пластидах
Эмбрионы кукурузы трансформируют смысловыми и антисмысловыми кДНК конструкциями, кодирующими пластидные А1 АССазы. Отобранные трансгенные культуры и регенерированные трансгенные
растения и их потомство детально анализируют по уровням транскрипта АССазы; по активности АССазы 1 (пластидные) и АССазы II (предположительно, цитозольные) в различных тканях растений; по синтезу
жирных кислот; по накоплению липидов в зернах (преимущественно в эмбрионах) и по другим свойствам растений. Кульминацией этих тестов является тест, который показывает, можно ли модифицировать
активность АССазы пластидов за счет трансформации и можно ли повлиять на синтез жирных кислот.
1. Трансформация эмбрионов кукурузы и регенерация растений
Незрелые эмбрионы
кукурузы Hi-II генотипа трансформируют за счет бомбардировки частицами для легкой модификации в соответствии с описанными ранее способами (Fromm и др., Biotech., 8, 833 (1990); Koziel и др., Biotech.,
11, 194 (1993)). Эту процедуру можно использовать для исследования трансформации для бомбардировки примерно 15000 эмбрионов, которые были затем отобраны по Basta-устойчивому каллюсу (экспрессия
маркерного гена bar селектируемого) и регенерированы в растения. Трансформированные (Basta-устойчивые) растения получают из 1-2% исходных эмбрионов, и, если разделенные плазмиды используют для
котрансформации, неселектированный трансген выделяют в примерно 50% Basta-устойчивых растений.
Basta-устойчивые, гемизиготные трансформированные (Т0 = F1) растения тестируют с помощью PCR или Саузернблотов на присутствие А1 АССазных последовательностей, уникальных для вектора трансформирования, выращивают до зрелости в растительных камерах, теплице или на поле и самоопыляют при возможности, или осуществляют бэккросс с нетрансформированным родителем. F2 или бэккроссное потомство выращивают в теплице и поле, и тестируют по Basta устойчивости и наличию А1 АССазного трансгена для идентификации гомозиготных трансгенных растений. Затем вырабатывают гомозиготные инбредные трансгенные линии.
2. Анализ АССазных А1 трансформантов
Растения, выделенные из 100 независимых актов трансформации (т.е. из различных подвергнутых бомбардировке эмбрионов)
как для UBI1 и GLB1 векторов, выделяют. Регенерированные растения тестируют по
присутствию интактного АССазного А1 трансгена и его косегрегации с Basta-устойчивым маркером. Гомозиготные и гетерозиготные трансгенные линии анализируют на полную АССазную активность в листьях для
UBI1 трансформантов и в развивающихся эмбрионах (22-26 ДАР) на UBI1 и GLB1 трансформанты. Ингибирование сетоксидимом и галоксифопом используют дня быстрого определения уровней гербицидно-восприимчивой
АССазы 1 (пластидной) и гербицидоустойчивой АССазной II активности как в листьях, так и в эмбрионах. Усиление экспрессии трансгена А1 АССазы вносит вклад в АССазную активность, но не в активность
АССазы II. Содержание в зернах жирной кислоты и масла анализируют при достижении зрелости, и их связь с АССазой 1 определяют известными специалистам способами.
Трансформанты, которые отличаются по активности АССазы и/или содержанию жирной кислоты и масла в зернах, затем отбирают для более подробного анализа эмбрионов в процессе развития (с 4-х дневными интервалами с 16 ДАР до зрелости). Эти анализы включают анализ защиты РНКазы для определения полного А1 + А2 уровня транскриптов, используя неспецифический зонд, и для определения относительных уровней эндогенного А1 в зависимости от трансгенных А1 транскриптов, используя антисмысловые рибозонды, перекрывающие 5'UTP участок А1 трансгенной конструкции. Вестернблоты полных протеинов, выделенных на SDS-PAGE гелях, зондируют АССазо 1-специфическим антителом, описанным ранее, или авидином и анализируют с помощью денситометра для выявления изменений в изо-формах 227 кД АССазы 1 и 219-кд АССазы II. Активность АССазы 1, содержание жирных кислот и липидов определяют в эмбрионах на каждой из стадий развития. Эти анализы определяют, повышает ли экспрессия дополнительного гена (генов) для пластидной АССазы активность АССазы и соответственно, содержание жирных кислот и масла в тканях кукурузы, особенно в эмбрионах.
3. Трансформация антисмысловыми векторами трансформации АССазы 1
кукурузы
Антисмысловые векторы трансформации были сконструированы за счет лигирования тупых концов нуклеотидов 1-833 последовательности ID 5 в обратной ориентации в сайты мультиклонирования
как GLB1, так и UBI1 плазмид. Была также получена смысловая конструкция с той же самой 833-bр кДНК последовательностью с GLB1 плазмидой, которая должна служить для контроля трансформации. Ориентации
вставок проверены рестрикционным картированием. UBI1 антисмысловая, GLB1 антисмысловая и GLB1 смысловая конструкции были введены в более чем 2100, 2900 и 2000 эмбрионов, соответственно, и были
отобраны Basta-устойчивые каллюсы.
Если антисмысловая экспрессия приводит к значительному снижению активности АССазы, может оказаться невозможным получить жизнеспособный каллюс или растений из конститутивно UBI1 антисмысловых трансформантов. Аналогично, растения, трансформированные эмбрио-специфической GLB1 антисмысловой конструкцией, могут демонстрировать вредное воздействие на развитие эмбрионов. Таким образом, невозможность получить трансгенное потомство, содержащее антисмысловой АССазный ген, из этих трансформантов, может указывать на то, что активность АССазы нельзя понизить без потери жизнеспособности.
4. Анализ антисмысловых трансформаитов АССазы А1
Все Basta-устойчивые культуры были регенерированы. Присутствие UBI1 и GLBI
антисмысловых конструкций определяют с помощью PCR анализа для уникальных трансгенных последовательностей, таких, как Ubi-1 интрон/АССаза А1 соединение, или GLbl 5' UTR/АССаза А1 соединение, или с
помощью Саузернблоттинга для определения уникальных фрагментов. Растения и линии, гомозиготные или гетерозиготные для трансгена, анализируют по состоянию уровня антисмысловых транскриптов АССазы А1 в
соответствующих тканях/органах (таких, как листья, кисти, колосья, эмбрионы и эндосперм для UBI1; листья и эмбрионы для GLB1), используя смысловые рибозонды АССазы А1 для гибридизации на РНК блотах
или для анализов защиты РНКазы. Полную активность АССазы (как АССазы 1, так и АССазы II изоформ) и содержание жирных кислот и липидов определяют для антисмысловых трансгенных линий и для
соответствующих тканей из нетрансформированных контрольных растений. Эти анализы показывают, экспрессированы ли антисмысловые трансгены АССазы А1 в растения, и, если да, то связана ли эта экспрессия с
пониженной активностью АССазы и измененным содержанием жирной кислоты и липидов в кукурузе.
Пример 13
Экспрессия пластидных и цитозольных АССаз в процессе развития
растения
Интактные эмбрионы выделяют из развивающихся зерен, выращенных в полевых условиях инбредов В73, с 2- и 4-дневными интервалами между 16-42 ДАР, и замораживают немедленно в жидком
азоте. Таким образом образцы хранят для определений свежего и сухого веса. Образцы с каждой из стадий анализируют на полное содержание липидов и жирных кислот. Отбирают образцы листьев сеянцев наряду
со срезами листьев из этиолированных, меристемных базальных участков до полностью раскрытых, зеленых концов. Листья и другие ткани (например, эпидермис) генотипов кукурузы, которые накапливают
пигменты, также анализируют для определения того, действительно ли специфическая АССаза (например, цитозольная АССаза) более интенсивно экспрессируется в ткани, в которых малонил-СоА также необходим в
качестве субстрата для хальконсинтазы во флавоноидной схеме, приводящей к синтезу антоцианина.
Гено-специфические антисмысловые рибозонды в РНКазном защитном анализе используют для определения уровней транскриптов А1, А2, В1 и В2. Соответствующие смысловые транскрипты получают ин витро и используют в качестве стандартов для проверки специфичности и количественного определения уровней транскриптов в образцах. Количественное определение проводят на AMBIS системе с радиоаналитическим изображением. Ингибирование гербицидами полной активности АССазы обеспечивает оценку уровней гербицидо-восприимчивой АССазы I (пластидной) и гербицидо-устойчивой АССазы II активности в этих тканях. Изоформы АССазы I и АССазы II разделяют с помощью ионообменной хроматографии. Полные протеины разделяют с помощью SDS-PAGE и вестернблоты зондируют авидином для определения биотинилированных изоформ 227-кД АССазы I и 219-кД АССазы II, или зондируют АССазы-I специфическими антителами.
Хотя настоящее изобретение было описано в связи с предпочтительным вариантом его воплощения, следует учитывать, что специалистам будут очевидны многие модификации, и рассматриваемая заявка охватывает любые адаптации или варианты его. Настоящее изобретение может быть ограничено только формулой изобретения и его эквивалентами.
Реферат
Изобретение относится к генной инженерии и может быть использовано в селекции растений. Введение молекулы ДНК, кодирующей ацетил-СоА-карбоксилазу, в клетку растения обеспечивает изменение содержания масла в регенерированном из клетки растении. Растения, трансформированные кассетой, включающей последовательность ДНК, кодирующую ацетил-СоА-карбоксилазу, сцепленную с последовательностью ДНК, кодирующей аминоконцевой транзитный пептид хлоропласта, обладают устойчивостью к гербицидам циклогексадиону и арилоксипропановой кислоты. 9 с. и 24 з.п. ф-лы, 20 ил., 5 табл.


Комментарии