Новые способы получения олигонуклеотидов - RU2719641C1
Код документа: RU2719641C1
Чертежи



















Описание
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к новым способам получения олигонуклеотидов, которые подходят для применения в получении химически модифицированных олигонуклеотидов, таких которые применяют в терапии.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Химический синтез олигонуклеотидов и модифицированных олигонуклеотидов при помощи фосфорамидитного метода хорошо известен и в течение нескольких десятилетий представлял собой предпочтительный способ, применяемый для синтеза указанных биополимеров с определенной последовательностью. Процесс синтеза, как правило, проводят как твердофазный синтез с последовательным добавлением одиночных нуклеотидов, при этом добавление каждого нуклеотида требует цикла из нескольких химических стадий для добавления и удаления защитных групп с растущего олигонуклеотида («олиго») при подготовке к следующей стадии. По завершении последовательного добавления нуклеотидов олигонуклеотид освобождается от твердофазного носителя, происходит дальнейшее удаление защитных групп, и затем неочищенный олигонуклеотид дополнительно очищается при помощи колоночной хроматографии.
При том, что данный способ может считаться рутинным и может быть автоматизированным, у данной методики существует несколько недостатков, особенно если задачей является получение олигонуклеотидов в крупном масштабе, что необходимо для терапевтических средств на основе олигонуклеотидов. Указанные недостатки включают, без ограничения:
1) Практические ограничения, связанные с использованием хроматографии, делают ее неподходящей для очистки олигонуклеотидов в больших количествах. Использование хроматографии в крупном масштабе является дорогостоящим и трудно осуществимым в связи с ограничениями по размеру колонки и производительности.
2) По мере увеличения длины синтезируемого олигонуклеотида накапливаются ошибки. Соответственно, в результате линейной последовательности операций, лежащих в основе данного процесса, происходит снижение выхода в геометрической прогрессии. Например, если выход в каждом цикле добавления нуклеотидов составляет 99%, то выход 20-мера составит 83%.
3) Количественные ограничения синтезаторов синтетических олигонуклеотидов и оборудования для последующей очистки и выделения: в настоящее время максимальное количество продукта, которое может быть получено в одной партии, составляет порядка 10 кг.
Таким образом, для увеличения выхода необходимо как сократить использование колоночной хроматографии (или, в идеальном варианте, отказаться от нее), так и проводить синтез таким образом, чтобы это не была линейная последовательность операций.
Для синтеза олигонуклеотидов для использования в молекулярной биологии и в схожих областях часто применяют ДНК-полимеразу. Однако ДНК полимераза не подходит для синтеза терапевтических олигонуклеотидов как из-за относительно небольшой длины олигонуклеотидов, так и из-за необходимости различения нуклеотидов с различными модификациями дезоксирибозы или рибозы. Например, терапевтические олигонуклеотиды часто имеют размер в диапазоне от 20 до 25 нуклеотидов. ДНК полимеразе требуется по меньшей мере 7 или 8 нуклеотидов, а оптимально от 18 до 22 нуклеотидов в качестве праймера в каждом направлении, поэтому в попытках синтезировать терапевтический олигонуклеотид можно добиться совсем немногого, если праймеры совпадают с требуемым продуктом по размеру. Кроме того, ДНК-полимеразе требуется, чтобы все нуклеотиды присутствовали в реакционной смеси и при объединении поступающих нуклеотидов она работает по принципу Уотсон-Криковского спаривания оснований. Таким образом, она не способна дифференцировать какие-либо модификации дезоксирибозы или рибозы, например, необходимые для гэпмеров, и в результате в заданном положении окажется смесь модификаций дезоксирибозы или рибозы.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В изобретении предложен способ получения одноцепочечного олигонуклеотидного продукта, имеющего по меньшей мере один модифицированный нуклеотидный остаток, при котором:
а) берут олигонуклеотидную матрицу (I), комплементарную последовательности продукта, причем указанная матрица обладает свойствами, позволяющими отделять ее от продукта;
b) берут пул олигонуклеотидов (II);
c) приводят в контакт (I) и (II) в условиях, обеспечивающих отжиг;
d) изменяют условия для отделения любых примесей, в том числе осуществляют денатурацию гибридизованной матрицы и примесных олигонуклеотидных цепей и отделяют примеси; и
e) изменяют условия для отделения продукта, в том числе осуществляют денатурацию гибридизованной матрицы и цепей олигонуклеотидного продукта и отделяют продукт.
Такой способ может применяться для выделения одноцепочечного олигонуклеотидного продукта от примесей, например, в качестве способа очистки.
В изобретении также предложен способ получения одноцепочечного олигонуклеотидного продукта, имеющего по меньшей мере один модифицированный нуклеотидный остаток, при котором:
a) берут олигонуклеотидную матрицу (I), комплементарную последовательности продукта, причем указанная матрица обладает свойствами, позволяющими отделять ее от продукта;
b) берут пул олигонуклеотидов (II), содержащий олигонуклеотиды, представляющие собой сегменты последовательности продукта, где по меньшей мере один сегмент содержит по меньшей мере один модифицированный нуклеотидный остаток;
c) приводят в контакт (I) и (II) в условиях, обеспечивающих отжиг;
d) объединяют сегменты-олигонуклеотиды с образованием продукта;
e) изменяют условия для отделения любых примесей, в том числе осуществляют денатурацию гибридизованной матрицы и примесных олигонуклеотидных цепей и отделяют примеси; и
f) изменяют условия для отделения продукта, в том числе осуществляют денатурацию гибридизованной матрицы и цепей олигонуклеотидного продукта и отделяют продукт.
Такой способ может применяться для получения одноцепочечного олигонуклеотидного продукта и его отделения от примесей, например, в качестве способа получения и очистки.
Изобретение также охватывает модифицированные олигонуклеотиды, полученные указанными способами, и лигазы для применения в указанных способах.
ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 схематически изображен способ по изобретению, включающий стадию изменения условий для удаления примесей, например, стадию отмывки.
На Фиг. 2 схематически изображен способ по изобретению, включающий стадию объединения/лигирования олигонуклеотидных сегментов для образования продукта и стадию изменения условий для удаления примесей.
На Фиг. 3 схематически представлены матрицы различной конфигурации.
На Фиг. 4 представлена упрощенная схема способа по изобретению, осуществляемого в проточной системе.
На Фиг. 5 представлена подробная схема способа по изобретению, осуществляемого в проточной системе: а) этап лигазной реакции, b) этап очистки продукта лигазной реакции, а также с) альтернативный вариант этапа лигазной реакции и d) альтернативный вариант этапа очистки. Прим.: этапы а) и b) (альтернативные этапы с) и d)) можно осуществлять в одну стадию, например, сосуд для сбора на этапе а) = выход после стадии лигирования в b).
На Фиг. 6 показаны примеры примесей, которые могут образовываться при осуществлении способа по изобретению.
На Фиг. 7 приведена хроматограмма, показывающая результаты лигазной реакции при использовании коммерческой лигазы Т4 NEB (SEQ ID NO:3) и немодифицированной ДНК (Пример 1).
На Фиг. 8 приведена хроматограмма, показывающая результаты лигазной реакции при использовании лигазы Т4, связанной с PERLOZA (SEQ ID NO:4), и немодифицированной ДНК (Пример 1).
На Фиг. 9 приведена хроматограмма, показывающая результаты лигазной реакции при использовании лигазы Т4, связанной с PERLOZA, экспрессированной согласно Примеру 2, и 2'-ОМе-модифицированных олигонуклеотидных фрагментов.
На Фиг. 10 приведены хроматограммы HPLC (высокоэффективной жидкостной хроматографии) для примера 4: Верхняя хроматограмма (а) - контроль без лигазы. Нижняя хроматограмма (b) - клон А4. В данном способе продукт и матрица элюировались вместе в процессе HPLC. На хроматограмме клона А4 на 10,3 и 11,2 минутах можно заметить два промежуточных лигированных фрагмента (сегмента).
На Фиг. 11 схематически изображен «узел с тремя матрицами», применявшийся в Примере 13, содержащий материал-носитель, обозначаемый как «узел» и три матричных последовательности.
На Фиг. 12 схематически изображена установка для полунепрерывного лигирования, применявшаяся в Примере 13.
На Фиг. 13 схематически изображена установка для тупиковой фильтрации, применявшаяся в Примере 14.
На Фиг. 14 схематически изображена установка для тангенциальной фильтрации, применявшаяся в Примере 14.
На Фиг. 15 приведены хроматограммы, демонстрирующие результаты экспериментов с тупиковой фильтрацией, в которых использовали мембрану NADIR с MWCO 10 кДа при 60°С в Примере 14. Фиг. а) представляет собой хроматограмму раствора ретентата, остающегося в фильтровальной ячейке и преимущественно содержащего узел с тремя матрицами после диафильтрации двумя объемами буфера; хроматограмма b) представляет собой хроматограмму пермеата, обогащенного продуктом раствора, после диафильтрации двумя объемами буфера.
На Фиг. 16 приведены хроматограммы, демонстрирующие результаты экспериментов с тангенциальной фильтрацией, в которых использовали мембрану Snyder с MWCO 5 кДа при 50°С и давлении 3,0 бар в Примере 14. Фиг. а) представляет собой хроматограмму раствора ретентата, преимущественно содержащего узел с тремя матрицами и продукт, после диафильтрации 20 объемами буфера; Фиг. b) представляет собой хроматограмму пермеата, преимущественно содержавшего олигонуклеотидные сегменты, после диафильтрации 20 объемами буфера.
На Фиг. 17 приведены хроматограммы, демонстрирующие результаты экспериментов с тангенциальной фильтрацией, в которых использовали мембрану Snyder с MWCO 5 кДа при 80°С и давлении 3,1 бар в Примере 14. На Фиг. 17 а) показана хроматограмма раствора ретентата, содержащего только узел с тремя матрицами после диафильтрации 20 объемами буфера; Фиг. b) представляет собой хроматограмму раствора пермеата, содержавшего только продукт, после диафильтрации двумя объемами буфера.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ОПРЕДЕЛЕНИЯ
В данном описании термин «олигонуклеотид» или сокращенно «олиго», обозначает полимер из нуклеотидных остатков, представляющих собой либо дезоксирибонуклеотиды (когда образующимся в результате олигонуклеотидом является ДНК), либо рибонуклеотиды (когда образующимся в результате олигонуклеотидом является РНК), либо их смесь. Олигонуклеотид может полностью состоять из нуклеотидных остатков, встречающихся в природе, или может содержать по меньшей мере один модифицированный нуклеотид или по меньшей мере одну модифицированную связь между нуклеотидами. Олигонуклеотиды могут быть одноцепочечными или двухцепочечными. Олигонуклеотид по изобретению может быть конъюгирован с другой молекулой, например, с N-ацетилгалактозамином (GalNAc) или с его множеством (кластеры GalNAc).
В данном описании термин «терапевтический олигонуклеотид» обозначает олигонуклеотид, который применяют в терапии. Такой олигонуклеотид обычно содержит один или более чем один модифицированный нуклеотидный остаток или связь. Терапевтические олигонуклеотиды имеют один или несколько различных механизмов действия, включая, без ограничения, антисмысловой механизм, механизм переключения сплайсинга или пропуска экзонов, иммуностимуляцию и РНК-интерференцию (RNAi), например посредством микроРНК (miRNA) и малых интерферирующих РНК (siRNA). Терапевтический олигонуклеотид может представлять собой аптамер. Терапевтические олигонуклеотиды, как правило, но не всегда, имеют определенную последовательность.
В данном описании термин «матрица» обозначает олигонуклеотид, последовательность которого на 100% комплементарна последовательности целевого олигонуклеотида (или продукта).
Если не указано иное, в данном описании термин «комплементарный» обозначает 100% комплементарность.
В данном описании термин «продукт» обозначает требуемый олигонуклеотид, имеющий конкретную последовательность, также обозначаемый в данном документе как «целевой олигонуклеотид».
В данном описании термин «пул» относится к группе олигонуклеотидов, последовательность которых может варьировать, может быть короче или длиннее по сравнению с целевой последовательностью и может не быть такой же, как целевая последовательность. Пул олигонуклеотидов может быть продуктом синтеза олигонуклеотидов, например твердофазного химического синтеза при помощи фосфорамидитного метода, используемым после очистки или без очистки. Пул олигонуклеотидов может состоять из сегментов целевой последовательности. Каждый сегмент сам по себе может быть представлен пулом указанного сегмента и может быть продуктом синтеза олигонуклеотидов, например твердофазного химического синтеза при помощи фосфорамидитного метода.
В данном описании термин «отжиг» обозначает гибридизацию комплементарных олигонуклеотидов сайт-специфическим образом. «Условия, обеспечивающие отжиг» будут зависеть от Tm (температуры плавления) гибридизованных комплементарных олигонуклеотидов и будут очевидными специалистам в области техники. Например, температура отжига может быть ниже Tm гибридизованных олигонуклеотидов. В альтернативном варианте температура отжига может быть близкой к Tm гибридизованных олигонуклеотидов, например, +/- 1, 2 или 3°С. Температура отжига, как правило, не превышает более чем на 10°С Tm гибридизованных олигонуклеотидов. Конкретные условия, обеспечивающие отжиг, приведены в разделе «Примеры».
В данном описании термин «денатурация» применительно к двухцепочечным олигонуклеотидам используют для обозначения, что комплементарные цепи больше не являются гибридизованными. Денатурация происходит в результате изменения условий и иногда в данном описании обозначается разделением олигонуклеотидных цепей. Такое разделение цепей можно производить, например, повышая температуру, изменяя рН или изменяя концентрацию соли в буферном растворе. Денатурация двухцепочечного олигонуклеотида («дуплекса») приводит в результате к одноцепочечным олигонуклеотидам, которые могут быть продуктом или примесью, «освобождающимися» от матрицы.
В данном описании термин «примесь» или «примеси» обозначает олигонуклеотиды, которые не имеют последовательности требуемого продукта. Эти олигонуклеотиды могут включать олигонуклеотиды, которые короче, чем продукт (например, короче на 1, 2, 3, 4, 5 или более нуклеотидных остатков), или которые длиннее, чем продукт (например, длиннее на 1, 2, 3, 4, 5 или более нуклеотидных остатков). Когда способ получения включает стадию, на которой между сегментами образуются связи, примеси включают олигонуклеотиды, которые остаются, если одна или более связей не образуются. Примеси также включают олигонуклеотиды, в которые были включены неправильные нуклеотиды, в результате чего возникает несоответствие при спаривании с матрицей. Примесь может обладать одной или более чем одной из описанных выше характеристик. На Фиг. 6 показаны некоторые из возможных возникающих примесей.
В данном описании термин «сегмент» представляет собой небольшую часть более длинного олигонуклеотида, в частности меньшую часть продукта или целевого олигонуклеотида. Применительно к конкретному продукту, этот продукт образуется, когда все его сегменты гибридизованы с матрицей и лигированы друг с другом.
В данном описании термин «ферментативное лигирование» обозначает, что связь между двумя смежными нуклеотидами образуется под воздействием фермента. Эта связь может быть фосфодиэфирной связью естественного происхождения (РО) или модифицированной связью, включая, без ограничения, фосфоротиоатную (PS) или фосфорамидитную (РА) связь.
В данном описании термин «лигаза» обозначает фермент, катализирующий присоединение, т.е. ковалентное присоединение, двух молекул олигонуклеотидов, например в результате образования фосфодиэфирной связи между 3' концом одного олигонуклеотида (или сегмента) и 5' концом такого же или другого олигонуклеотида (или сегмента). Эти ферменты часто обозначаются ДНК-лигазами или РНК-лигазами и в качестве кофакторов используют: АТФ (ДНК-лигазы эукариот, вирусов и архебактерий) или НАД (ДНК-лигазы прокариот). Несмотря на то, что они встречаются у всех организмов, ДНК-лигазы демонстрируют большое разнообразие аминокислотных последовательностей, молекулярных масс и свойств (Nucleic Acids Research, 2000, Vol. 28, No. 21, 4051-4058). Как правило, они являются представителями класса ферментов ЕС 6.5, согласно определению Международного Союза Биохимии и Молекулярной Биологии, т.е. лигазы используются для образования фосфодиэфирных связей. Изобретение охватывает лигазу, способную присоединять немодифицированный олигонуклеотид к другому немодифицированному олигонуклеотиду; лигазу, способную присоединять немодифицированный олигонуклеотид к модифицированному олигонуклеотиду (т.е. модифицированный 5' олигонуклеотид к немодифицированному 3' олигонуклеотиду и немодифицированный 5' олигонуклеотид к модифицированному 3' олигонуклеотиду); и также лигазу, способную присоединять модифицированный олигонуклеотид к другому модифицированному олигонуклеотиду.
В данном описании «термостабильная лигаза» представляет собой лигазу, которая является активной при повышенных температурах, т.е. при температуре, превышающей температуру человеческого тела, т.е. выше 37°С. Термостабильная лигаза может быть активной, например, при 40°С-65°С или при 40°С-90°С и т.д.
В данном описании термин «модифицированный нуклеотидный остаток» или «модифицированный олигонуклеотид» обозначает нуклеотидный остаток или олигонуклеотид, который имеет по меньшей мере одну химическую характеристику, отличающуюся от нуклеотидного остатка или олигонуклеотида естественного происхождения. Такие модификации могут возникать в любой части нуклеотидного остатка, например затрагивать сахарид, основание или фосфат. Примеры модификаций нуклеотидов приведены ниже.
В данном описании термин «модифицированная лигаза» обозначает лигазу, которая отличается от лигазы естественного происхождения, или лигазы «дикого типа» одним или более чем одним аминокислотным остатком. Такие лигазы не встречаются в природе. Такие лигазы могут применяться в новых способах по изобретению. Примеры модифицированных лигаз приведены ниже. Термины «модифицированная лигаза» и «мутантная лигаза» используются взаимозаменяемо.
В данном описании термин «гэпмер» обозначает олигонуклеотид, имеющий внутренний «гэп» сегмент, фланкированный двумя наружными сегментами «крыльями», где «гэп»-сегмент состоит из множества нуклеотидов, поддерживающих расщепление РНКазой Н, а каждый из сегментов-«крыльев» состоит из одного или более чем одного нуклеотида, которые химически отличаются от нуклеотидов «гэп»-сегмента.
В данном описании термин «материал-носитель» обозначает высокомолекулярное соединение или материал, который увеличивает молекулярную массу матрицы, тем самым позволяя ей удерживаться при выделении примесей и продуктов из реакционной смеси.
В данном описании «процент идентичности» между искомой нуклеотидной последовательностью и найденной схожей нуклеотидной последовательностью представляет собой показатель «идентичности», выраженный в процентах, который рассчитывают при помощи алгоритма BLASTN, когда найденная схожая нуклеотидная последовательность на 100% совпадает с искомой нуклеотидной последовательностью после попарного выравнивания при помощи BLASTN. Указанное попарное выравнивание при помощи BLASTN между искомой нуклеотидной последовательностью и найденной схожей нуклеотидной последовательностью выполняется при использовании алгоритма BLASTN, доступ к которому можно получить на веб-сайте Национального Центра Института Биотехнологии, с настройками по умолчанию с отключением фильтра для областей низкой сложности. Важно отметить, что искомая нуклеотидная последовательность может быть описана нуклеотидной последовательностью, охарактеризованной в одном или нескольких пунктах приведенной формулы изобретения. Искомая нуклеотидная последовательность может быть на 100% идентична найденной схожей нуклеотидной последовательности или она может включать некоторое целое число нуклеотидных замен по сравнению с найденной схожей нуклеотидной последовательностью, так что % идентичности будет менее 100%. Например, искомая нуклеотидная последовательность может быть по меньшей мере на 80, 85, 90, 95, 96, 97, 98 или 99% идентична найденной схожей нуклеотидной последовательности.
ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном аспекте изобретения предложен способ получения одноцепочечного олигонуклеотидного продукта, имеющего по меньшей мере один модифицированный нуклеотидный остаток, при котором:
a) берут олигонуклеотидную матрицу (I), комплементарную последовательности продукта, причем указанная матрица обладает свойствами, позволяющими отделять ее от продукта;
b) берут пул олигонуклеотидов (II);
c) приводят в контакт (I) и (II) в условиях, обеспечивающих отжиг;
d) изменяют условия для отделения любых примесей, в том числе осуществляют денатурацию гибридизованной матрицы и примесных олигонуклеотидных цепей и отделяют примеси; и
e) изменяют условия для отделения продукта, в том числе осуществляют денатурацию гибридизованной матрицы и цепей олигонуклеотидного продукта и отделяют продукт.
Указанный способ может применяться для очистки продукта от примесей, например, пула олигонуклеотидов, полученных путем химического синтеза при помощи фосфорамидитного метода, например, твердофазного химического синтеза при помощи фосфорамидитного метода.
В следующем воплощении изобретения предложен способ, при котором:
a) берут олигонуклеотидную матрицу (I), комплементарную последовательности продукта, причем указанная матрица обладает свойствами, позволяющими отделять ее от продукта;
b) берут пул олигонуклеотидов (II), содержащий короткие олигонуклеотиды, представляющие собой сегменты целевой последовательности, где по меньшей мере один сегмент содержит по меньшей мере один модифицированный нуклеотидный остаток;
c) приводят в контакт (I) и (II) в условиях, обеспечивающих отжиг;
d) соединяют сегменты-олигонуклеотиды;
e) изменяют условия для отделения любых примесей, в том числе осуществляют денатурацию гибридизованной матрицы и примесных олигонуклеотидных цепей и отделяют примеси; и
f) изменяют условия для отделения продукта, в том числе осуществляют денатурацию гибридизованной матрицы и цепей олигонуклеотидного продукта и отделяют продукт.
В одном воплощении изобретения в резервуаре для проведения реакции практически отсутствуют нуклеотиды. В одном воплощении изобретения в резервуаре для проведения реакции отсутствуют нуклеотиды. В частности, резервуар для проведения реакции не содержит пул нуклеотидов, т.е. реакционная смесь по существу свободна, предпочтительно, свободна от нуклеотидов.
В другом воплощении изобретения предложен способ, описанный выше, где денатурация происходит в результате повышения температуры.
В одном воплощении изобретения предложен способ, описанный выше, где олигонуклеотидные сегменты соединяют при помощи ферментативного лигирования. В следующем воплощении ферментативное лигирование осуществляют при помощи лигазы.
В другом воплощении изобретения предложен способ, такой как описано выше, где олигонуклеотидные сегменты соединяют при помощи химического лигирования. В следующем воплощении химическое лигирование представляет собой реакцию клик-химии. В одном воплощении изобретения химическое лигирование олигонуклеотидных сегментов происходит в реакциях на матрицах, где образуются фосфорамидитные связи, как подробно описано Kalinowski et al. в ChemBioChem 2016, 17, 1150-1155.
В другом воплощении изобретения предложен способ, описанный выше, где олигонуклеотидные сегменты имеют длину от 3 до 15 нуклеотидов. В следующем воплощении изобретения олигонуклеотидные сегменты имеют длину от 5 до 10 нуклеотидов. В следующем воплощении изобретения олигонуклеотидные сегменты имеют длину от 5 до 8 нуклеотидов. В следующем воплощении изобретения олигонуклеотидные сегменты имеют длину 5, 6, 7 или 8 нуклеотидов. В конкретном воплощении имеются три сегмента олигонуклеотидов: 5' сегмент, который имеет длину 7 нуклеотидов, центральный сегмент, который имеет длину 6 нуклеотидов и 3' сегмент, который имеет длину 7 нуклеотидов, которые при лигировании образуют олигонуклеотид, который имеет длину 20 нуклеотидов («20-мер»). В конкретном воплощении имеются три сегмента олигонуклеотидов: 5' сегмент, который имеет длину 6 нуклеотидов, центральный сегмент, который имеет длину 8 нуклеотидов и 3' сегмент, который имеет длину 6 нуклеотидов, которые при лигировании образуют олигонуклеотид, который имеет длину 20 нуклеотидов («20-мер»). В конкретном воплощении имеются три сегмента олигонуклеотидов: 5' сегмент, который имеет длину 5 нуклеотидов, центральный сегмент, который имеет длину 10 нуклеотидов и 3' сегмент, который имеет длину 5 нуклеотидов, которые при лигировании образуют олигонуклеотид, который имеет длину 20 нуклеотидов («20-мер»). В конкретном воплощении имеются четыре сегмента олигонуклеотидов: 5' сегмент, который имеет длину 5 нуклеотидов, 5'-центральный сегмент, который имеет длину 5 нуклеотидов, центральный-3' сегмент, который имеет длину 5 нуклеотидов и 3' сегмент, который имеет длину 5 нуклеотидов, которые при лигировании образуют олигонуклеотид, который имеет длину 20 нуклеотидов («20-мер»).
В одном воплощении изобретения предложен способ, описанный выше, где продукт имеет длину от 10 до 200 нуклеотидов. В следующем воплощении изобретения продукт имеет длину от 15 до 30 нуклеотидов. В воплощении изобретения продукт имеет длину 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов. В воплощении изобретения продукт имеет длину 20 нуклеотидов, «20-мер». В воплощении изобретения продукт имеет длину 21 нуклеотид, «21-мер». В воплощении изобретения продукт имеет длину 22 нуклеотида, «22-мер». В воплощении изобретения продукт имеет длину 23 нуклеотида, «23-мер». В воплощении изобретения продукт имеет длину 24 нуклеотида, «24-мер». В воплощении изобретения продукт имеет длину 25 нуклеотидов, «25-мер». В воплощении изобретения продукт имеет длину 26 нуклеотидов, «26-мер». В воплощении изобретения продукт имеет длину 27 нуклеотидов, «27-мер». В воплощении изобретения продукт имеет длину 28 нуклеотидов, «28-мер». В воплощении изобретения продукт имеет длину 29 нуклеотидов, «29-мер». В воплощении изобретения продукт имеет длину 30 нуклеотидов, «30-мер».
В одном воплощении изобретения способ представляет собой способ получения терапевтического олигонуклеотида. В одном воплощении изобретения способ представляет собой способ получения одноцепочечного терапевтического олигонуклеотида. В одном воплощении изобретения способ представляет собой способ получения двухцепочечного терапевтического олигонуклеотида.
В другом воплощении изобретения предложен способ, описанный выше, где свойством, которое позволяет отделять матрицу от продукта является то, что матрица присоединена к материалу-носителю. В следующем воплощении изобретения материал-носитель представляет собой растворимый материал-носитель. В еще одном воплощении изобретения растворимый материал-носитель выбран из группы, состоящей из: полиэтиленгликоля, растворимого органического полимера, ДНК, белка, дендримера, полисахарида, олигосахарида и углевода. В воплощении изобретения материал-носитель представляет собой полиэтиленгликоль (ПЭГ). В следующем воплощении изобретения материал-носитель представляет собой нерастворимый материал-носитель. В следующем воплощении изобретения материал-носитель представляет собой твердый материал-носитель. В еще одном воплощении изобретения твердый материал-носитель выбран из группы, состоящей из: стеклянной гранулы, полимерной гранулы, волокнистого носителя, мембраны, покрытой стрептавидином гранулы и целлюлозы. В одном воплощении твердый материал-носитель представляет собой покрытые стрептавидином гранулы. В следующем воплощении твердый материал-носитель представляет собой часть самого резервуара для проведения реакции, т.е. его стенку.
В одном воплощении изобретения предложен способ, описанный выше, где множество повторяющихся копий матрицы непрерывно присоединены к материалу-носителю через единственную точку присоединения. Множество повторяющихся копий матрицы могут быть разделены линкером, например, как показано на Фиг. 3. Множество повторяющихся копий матрицы могут быть непосредственными повторами, например, они не разделены линкером.
В еще одном воплощении изобретения предложен способ, описанный выше, где свойством, которое позволяет отделять матрицу от продукта является молекулярная масса матрицы. Например, повторяющиеся копии матричной последовательности могут находиться в составе одного олигонуклеотида, как с линкерной последовательностью, так и без нее.
В другом воплощении изобретения предложен способ, описанный выше, где матрицу или матрицу и материал-носитель подвергают переработке для использования в последующих реакциях, например, как подробно описано ниже. В другом воплощении изобретения предложен способ, описанный выше, где реакция протекает с применением непрерывного или полунепрерывного поточного процесса, например, как показано на Фиг. 4 или Фиг. 5.
В одном воплощении изобретения способ предназначен для крупномасштабного получения олигонуклеотидов, в частности, терапевтических олигонуклеотидов. В контексте данного изобретения крупномасштабное производство олигонуклеотидов означает производство в масштабе, превосходящем или равном 1 л, например, способ осуществляют в реакторе объемом 1 л или более. В качестве альтернативы или дополнения, в контексте данного изобретения крупномасштабное производство олигонуклеотидов означает производство продукта в граммовом диапазоне, в частности, получение 10 граммов продукта или более. В одном воплощении изобретения количество получаемого олигонуклеотидного продукта находится в граммовом диапазоне. В одном воплощении изобретения количество получаемого продукта превышает или равно: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 20, 30, 40, 50, 60, 70, 80, 90 или 100 граммов. В одном воплощении изобретения количество получаемого продукта превышает или равно: 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950 граммов. В одном воплощении изобретения количество получаемого олигонуклеотидного продукта составляет 500 граммов или более. В одном воплощении изобретения олигонуклеотидный продукт получают в килограммовом диапазоне. В одном воплощении изобретения количество получаемого олигонуклеотидного продукта составляет 1 кг или более. В одном воплощении изобретения количество получаемого олигонуклеотидного продукта превышает или равно: 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 кг. В одном воплощении изобретения количество получаемого олигонуклеотидного продукта превышает или равно: 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95 или 100 кг.
В одном воплощении изобретения количество получаемого продукта составляет от 10 граммов до 100 кг. В одном воплощении изобретения количество получаемого продукта оставляет от 10 граммов до 50 кг. В одном воплощении изобретения количество получаемого продукта составляет от 100 граммов до 100 кг. В одном воплощении изобретения количество получаемого продукта составляет от 100 граммов до 50 кг. В одном воплощении изобретения количество получаемого продукта составляет от 500 граммов до 100 кг. В одном воплощении изобретения количество получаемого продукта составляет от 500 граммов до 50 кг. В одном воплощении изобретения количество получаемого продукта составляет от 1 кг до 50 кг. В одном воплощении изобретения количество получаемого продукта составляет от 10 кг до 50 кг.
В одном воплощении изобретения производство олигонуклеотида осуществляют в масштабе, превышающем или равном: 2, 3, 4, 5, 6, 7, 8, 9, 10 литров, например в реакторе объемом 2, 3, 4, 5, 6, 7, 8, 9 или 10 л. В одном воплощении изобретения производство олигонуклеотида осуществляют в масштабе, превышающем или равном: 20, 25, 30, 35, 40, 45, 50, 55, 60, 65 70, 75, 80, 85, 90, 95, 100 литров, например в реакторе объемом 20, 25, 30, 35, 40, 45, 50, 55, 60, 65 70, 75, 80, 85, 90, 95, 100 л. В одном воплощении изобретения производство олигонуклеотида осуществляют в масштабе, превышающем или равном: 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000 литров, например в реакторе объемом 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000 л.
В одном воплощении изобретения объем реактора составляет приблизительно 10000 л, приблизительно 5000 л, приблизительно 2000 л, приблизительно 1000 л, приблизительно 500 л, приблизительно 125 л, приблизительно 50 л, приблизительно 20 л, приблизительно 10 л или приблизительно 5 л.
В одном воплощении изобретения объем реактора составляет от 5 до 10000 л, от 10 до 5000 л, от 20 до 2000 л или от 50 до 1000 л.
Олигонуклеотид по настоящему изобретению может иметь по меньшей мере одну модификацию остова и/или по меньшей мере одну модификацию сахарида и/или по меньшей мере одну модификацию основания при сравнении с олигонуклеотидом на основе РНК или ДНК.
В одном воплощении изобретения предложен способ, описанный выше, где продукт содержит по меньшей мере 1 модифицированный нуклеотидный остаток. В следующем воплощении модификация находится в 2' положении сахаридной группировки.
Олигонуклеотиды, используемые в способе по изобретению, могут иметь модификации сахаридов, т.е. модифицированные варианты рибозильной группировки, такие как 2'-O-модифицированная РНК, такая как 2'-O-алкил или 2'-O-(замещенный) алкил, например 2'-O-метил, 2'-O-(2-цианоэтил), 2'-О-(2-метокси)этил (2'-МОЕ), 2'-O-(2-тиометил)этил, 2'-O-бутирил, 2'-O-пропаргил, 2'-O-аллил, 2'-O-(3-амино)пропил, 2'-O-(3-(диметиламино)пропил), 2'-O-(2-амино)этил, 2'-O-(2-(диметиламино)этил); 2'-дезокси (ДНК); 2'-O-(галогеналкокси)метил (Arai K. et al. Bioorg. Med. Chem. 2011, 21, 6285), наприме, 2'-O-(2-хлорэтокси)метил (МСЕМ), 2'-O-(2,2-дихлорэтокси)метил (DCEM); 2'-O-алкоксикарбонил, например 2'-O-[2-(метоксикарбонил)этил] (МОСЕ), 2'-O-[2-(N-метилкарбамоил)этил] (MCE), 2'-O-[2-(N,N-диметилкарбамоил)этил] (DCME); 2'-галоген, например 2'-F, FANA (2'-F арабинозил нуклеиновая кислота); карбоаналоги и азааналоги сахарида; 3'-O-алкил, например 3'-O-метил, 3'-O-бутирил, 3'-O-пропаргил и их производные.
В одном воплощении изобретения модификация сахарида выбрана из группы, состоящей из 2'-фтор (2'-F), 2'-O-метил (2'-ОМе), 2'-O-метоксиэтил (2'-МОЕ) и 2'-амино. В еще одном воплощении модификация представляет собой 2'-МОЕ.
Другие модификации сахаридов включают «мостиковые» или «бициклические» нуклеиновые кислоты (BNA), например «запертые» нуклеиновые кислоты (LNA), ксило-LNA, α-L-LNA, β-D-LNA, cEt LNA (конформационная свобода рибозы ограничена присоединением этильной группировки к 2'-O и 4'-С атомам), cMOEt LNA (конформационная свобода рибозы ограничена присоединением метоксиэтильной группировки к 2'-O и 4'-С атомам), нуклеиновые кислоты с этиленовым мостиком (ENA), трицикло-ДНК; незамкнутые нуклеиновые кислоты (UNA); циклогексенил-нуклеиновые кислоты (CeNA), альтрит-нуклеиновые кислоты (ANA), гексит-нуклеиновые кислоты (HNA), фторированные HNA (F-HNA), пиранозил-РНК (p-RNA), 3'-дезоксипиранозил-ДНК (p-DNA); морфолино (как например, в РМО, РРМО, PMOPlus, РМО-Х) и их производные.
Олигонуклеотиды, используемые в способе по настоящему изобретению, могут содержать другие модификации, такие как пептидо-нуклеиновые кислоты (PNA), модифицированные бором PNA, окси-пептидные нуклеиновые кислоты на основе пирролидина (POPNA), нуклеиновые кислоты на основе гликоля или глицерина (GNA), нуклеиновые кислоты на основе треозы (TNA), нуклеиновые кислоты на основе ациклического треонинола (aTNA), олигонуклеотиды с интегрированными основаниями и остовами (ONIB), пирролидинамидные олигонуклеотиды (РОМ) и их производные.
В одном воплощении изобретения модифицированный олигонуклеотид содержит фосфородиамидат морфолино олигомер (РМО), запертую нуклеиновую кислоту (LNA), пептидо-нуклеиновую кислоту (PNA), мостиковые нуклеиновые кислоты (BNA), такие как (S)-cEt-BNA или SPIEGELMER.
В следующем воплощении модификация затрагивает нуклеотидное основание. Модификации оснований включают модифицированные варианты естественных пуриновых и пиримидиновых оснований (например, аденина, урацила, гуанина, цитозина и тимина), такие как инозин, гипоксантин, оротовая кислота, агматидин, лизидин, 2-тиопиримидин (например, 2-тиоурацил, 2-тиотимин), G-clamp и его производные, 5-замещенный пиримидин (например, 5-метилцитозин, 5-метилурацил, 5-галогенурацил, 5-пропинилурацил, 5-пропинилцитозин, 5-аминометилурацил, 5-гидроксиметилурацил, 5-аминометилцитозин, 5-гидроксиметилцитозин, Super Т), 2,6-диаминопурин, 7-деазагуанин, 7-деазааденин, 7-аза-2,6-диаминопурин, 8-аза-7-деазагуанин, 8-аза-7-деазааденин, 8-аза-7-деаза-2,6-диаминопурин, Super G, Super А, а также N4-этилцитозин или их производные; N2-циклопентилгуанин (cPent-G), N2-циклопентил-2-аминопурин (cPent-AP) и N2-пропил-2-аминопурин (Pr-АР) или их производные; а также вырожденные или универсальные основания, такие как 2,6-дифтортолуол или отсутствующие основания, такие как сайты, лишенные азотистого основания (например, 1-дезоксирибоза, 1,2-дидезоксирибоза, 1-дезокси-2-O-метилрибоза или производные пирролидина, у которых атом кислорода кольца заменен на атом азота (азарибоза)). Примеры производных Super A, Super G и Super Т можно найти в US 6683173. Показано, что cPent-G, cPent-AP и Pr-АР снижают иммуностимулирующее влияние при включении в siRNA (Peacock Н. et al. J. Am. Chem. Soc. (2011), 133, 9200).
В одном воплощении изобретения модификация нуклеотидного основания выбрана из группы, состоящей из 5-метилпиримидинов, 7-деазагуанозинов и нуклеотидов с удаленным азотистым основанием. В одном воплощении модификация представляет собой 5-метилцитозин.
Олигонуклеотиды, используемые в способе по настоящему изобретению, могут содержать модификации остова, например, модифицированный вариант фосфодиэфира, присутствующего в РНК, такой как фосфоротиоат (PS), фосфородитиоат (PS2), фосфоноацетат (РАСЕ), фосфоноацетамид (РАСА), тиофосфоноацетат, тиофосфоноацетамид, фосфоротиоатное пролекарство, Н-фосфонат, метилфосфонат, метилфосфонотиоат, метилфосфат, метилфосфоротиоат, этилфосфат, этилфосфоротиоат, боранофосфат, боранофосфоротиоат, метилборанофосфат, метилборанофосфоротиоат, метилборанофосфонат, метилборанофосфонотиоат и другие их производные. Другие модификации включают фосфорамидит, фосфорамидат, N3'→Р5' фосфорамидат, фосфородиамидат, фосфотиодиамидат, сульфамат, диметиленсульфоксид, сульфонат, триазол, оксалил, карбамат, метиленимино (MMI) и тиоацетамидо-нуклеиновую кислоту (TANA) и их производные.
В следующем воплощении модификация находится в остове и выбрана из группы, состоящей из: фосфоротиоата (PS), фосфорамидата (РА) и фосфородиамидата. В одном воплощении изобретения модифицированный олигонуклеотид представляет собой морфолиновый олигомер (РМО). РМО имеет остов из метиленморфолиновых колец, соединенных фосфородиамидатными связями. В одном воплощении изобретения продукт имеет фосфоротиоатный (PS) остов.
В одном воплощении изобретения олигонуклеотид содержит комбинацию двух или более модификаций, описанных выше. Специалисту в области техники известно, что существует множество синтетических производных олигонуклеотидов.
В одном воплощении изобретения продукт представляет собой гэпмер. В одном воплощении изобретения 5' и 3' «крылья» гэпмера содержат или состоят из 2'-МОЕ модифицированных нуклеотидов. В одном воплощении изобретения «гэп»-сегмент гэпмера содержит или состоит из нуклеотидов, содержащих водород в 2' положении сахаридной группировки, т.е. является ДНК-подобным. В одном воплощении изобретения 5' и 3' «крылья» гэпмера состоят из 2'-МОЕ модифицированных нуклеотидов, и «гэп» сегмент гэпмера состоит из нуклеотидов, содержащих водород в 2' положении сахаридной группировки (т.е. из дезоксинуклеотидов). В одном воплощении изобретения 5' и 3' «крылья» гэпмера состоят из 2'-МОЕ модифицированных нуклеотидов, и «гэп» сегмент гэпмера состоит из нуклеотидов, содержащих водород в 2' положении сахаридной группировки (т.е. из дезоксинуклеотидов), и связи между всеми нуклеотидами представляют собой фосфоротиоатные связи.
В одном воплощении изобретения предложен способ, описанный выше, где получаемый продукт является более чем на 90% чистым. В следующем воплощении продукт является более чем на 95% чистым. В следующем воплощении продукт является более чем на 96% чистым. В следующем воплощении продукт является более чем на 97% чистым. В следующем воплощении продукт является более чем на 98% чистым. В следующем воплощении продукт является более чем на 99% чистым. Чистоту олигонуклеотида можно определять любым подходящим способом, например, при помощи высокоэффективной жидкостной хроматографии (HPLC) или масс-спектрометрии (MS), в частности, жидкостной хроматографией с масс-спектрометрией (LCMS), HPLCMS или капиллярным электрофорезом с масс-спектрометрией (CEMS).
В еще одном воплощении изобретения предложен способ получения двухцепочечных олигонуклеотидов, где 2 комплементарных одноцепочечных олигонуклеотида получают способом по любому из предшествующих воплощений, и затем смешивают в условиях, обеспечивающих отжиг. В одном воплощении изобретения продукт представляет собой siRNA.
В одном воплощении изобретения предложен олигонуклеотид, полученный способом, описанным выше. В одном воплощении изобретения получаемый олигонуклеотид представляет собой РНК. В одном воплощении изобретения получаемый олигонуклеотид представляет собой ДНК. В одном воплощении изобретения получаемый олигонуклеотид содержит как РНК, так и ДНК. В следующем воплощении изобретения получаемый олигонуклеотид представляет собой модифицированный олигонуклеотид. В одном воплощении изобретения получаемый олигонуклеотид представляет собой антисмысловой олигонуклеотид. В одном воплощении изобретения получаемый олигонуклеотид представляет собой аптамер. В одном воплощении изобретения получаемый олигонуклеотид представляет собой miRNA. В одном воплощении изобретения продукт представляет собой терапевтический олигонуклеотид.
В изобретении, описанном в данном документе, свойства связывания олигонуклеотидов используются для обеспечения улучшенного способа их получения. Создание олигонуклеотидной матрицы, которая на 100% комплементарна целевой последовательности, и регулирование условий реакции таким образом, чтобы продукт освобождался и отделялся в определенных условиях, позволяют получать продукт высокой степени чистоты.
Освобождение продукта (или примеси) от матрицы, т.е. денатурация дуплекса продукт (или примесь):матрица и отделение продукта (или примеси)
Освобождение продукта (или любых примесей, когда способ включает стадию освобождения примесей) от матрицы требует разрушения Уотсон-Криковского спаривания оснований между олигонуклеотидными цепями матрицы и продукта (или примеси). Затем продукт (или примесь) может быть отделен от матрицы. Это может происходить в ходе двух отдельных стадий или в ходе одной объединенной стадии.
Освобождение и отделение продукта (или примеси) может происходит в одну стадию, если способ осуществляют в реакторе, представляющем собой колонку. Пропускание буфера, изменяющего рН или концентрацию соли, или содержащего химический агент, который нарушает спаривание оснований (такой как формамид или мочевина) вызовет денатурацию олигонуклеотидных цепей, и продукт (или примесь) будет элюироваться в буфер.
Когда способ осуществляют в разных резервуарах для проведения реакции, освобождение и отделение продукта (или примеси) может происходить в две стадии. Вначале для разделения цепей разрушают Уотсон-Криковское спаривание оснований, а затем продукт (или примесь) удаляют из резервуара для проведения реакции. Когда освобождение и отделение продукта происходит в две стадии, разрушение Уотсон-Криковского спаривания оснований может достигаться посредством изменения буферных условий (рН, соли) или добавления химического агента, разрушающего связи (формамида, мочевины). В альтернативном варианте повышение температуры также будет вызывать диссоциацию двух цепей. Затем продукт (или примеси) могут быть удалены из резервуара для проведения реакции способами, включающими разделение по молекулярной массе, разделение по заряду, разделение по гидрофобности, разделение по специфической последовательности или комбинацией перечисленных способов.
Когда способ осуществляют в непрерывном или полунепрерывном поточном реакторе, освобождение и отделение продукта (или примеси) может происходить в одну стадию или в две стадии. Например, освобождение и отделение продукта (или примеси) в одну стадию может достигаться путем повышения температуры для диссоциации двух цепей и разделения освобожденных цепей по молекулярной массе в той же части реактора, которая использовалась для повышения температуры. Освобождение и отделение продукта (или примеси) в две стадии может достигаться путем повышения температуры для диссоциации двух цепей в одной части реактора и разделения освобожденных цепей по молекулярной массе в другой части реактора.
Специфическое освобождение и отделение примесей от матрицы при сохранении продукта на матрице
Примеси образуются, когда в ходе удлинения цепи в олигонуклеотидную цепь встраивается неправильный нуклеотид или когда реакция удлинения цепи заканчивается преждевременно. Примеси также образуются, когда реакция включает стадию лигирования олигонуклеотидных сегментов и одна или более стадий лигирования не проходят должным образом. Виды примесей, которые могут образовываться, показаны на Фиг. 6.
Свойства Уотсон-Криковского спаривания оснований можно использовать для специфического отделения любых примесей, связанных с матрицей, перед отделением продукта. Каждый двухцепочечный олигонуклеотид будет диссоциировать при определенных условиях, и такие условия отличаются для последовательностей, которые не обладают 100% комплементарностью по сравнению с последовательностями, обладающими 100% комплементарностью. Определение таких условий находится в компетенции специалиста в области техники.
Стандартным способом денатурации олигонуклеотидов является повышение температуры. Температура, при которой половина пар оснований диссоциирует, т.е. когда 50% дуплекса находится в одноцепочечном состоянии, называется температурой плавления Tm. Наиболее надежным и точным способом определения температуры плавления является эмпирическое определение. Однако это трудоемко и обычно не является обязательным. Для расчета значений Tm можно использовать несколько формул (Nucleic Acids Research 1987, 15 (13): 5069-5083; PNAS 1986, 83 (11): 3746-3750; Biopolymers 1997, 44 (3): 217-239) и в интернете можно найти различные калькуляторы температуры плавления, предоставляемые поставщиками реагентов и университетами. Известно, что для заданной олигонуклеотидной последовательности вариант, у которого все связи фосфоротиоатные, будет плавиться при более низкой температуре, чем вариант, у которого все связи фосфодиэфирные. Увеличение числа фосфоротиоатных связей в олигонуклеотиде способствует понижению Tm олигонуклеотида от его мишени.
Для специфического отделения примесей от реакционной смеси вначале рассчитывают температуру плавления дуплекса продукт:матрица. Затем резервуар для проведения реакции нагревают до первой температуры, например, температуры ниже температуры плавления дуплекса продукт:матрица, например, на 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 градусов Цельсия ниже температуры плавления. Это вызовет денатурацию матрицы от олигонуклеотидов, которые не являются продуктом, т.е. не являются на 100% комплементарными матрице. Затем их можно удалить из резервуара для проведения реакции с помощью одного из способов, указанных выше, например, разделения по молекулярной массе, разделения по заряду, разделения по гидрофобности, разделения по специфической последовательности или комбинации указанных способов. Затем резервуар для проведения реакции нагревают до второй, более высокой температуры, например, температуры выше рассчитанной температуры плавления, например, на 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 градусов Цельсия выше температуры плавления для денатурации продукта от матрицы. Затем продукт можно удалить из резервуара для проведения реакции с помощью одного из способов, указанных выше, например, разделения по молекулярной массе, разделения по заряду, разделения по гидрофобности, разделения по специфической последовательности или комбинации указанных способов.
Аналогичный способ можно использовать, когда агент, вызывающий разрыв связей, представляет собой агент, вызывающий изменение рН, концентрации соли, или химический агент, вызывающий разрыв связей. Концентрацию агента, вызывающего разрыв связей, повышают до тех пор, пока она не окажется чуть ниже концентрации, при которой продукт будет диссоциировать, чтобы вызвать денатурацию матрицы от олигонуклеотидов, которые не являются продуктом. Затем эти примеси можно удалить из резервуара для проведения реакции с помощью одного из способов, указанных выше. Затем концентрацию агента, вызывающего разрыв связей, повышают выше концентрации, при которой продукт диссоциирует с матрицы. Затем продукт можно удалить из резервуара для проведения реакции с помощью одного из способов, указанных выше.
Продукт, полученный способом, который изложен выше, имеет высокую степень чистоты и не требует дальнейших стадий очистки. Например, полученный продукт является более чем на 95% чистым.
Свойства матрицы
Матрица должна обладать свойством, которое позволит ей удерживаться в резервуаре для проведения реакции при удалении продукта, чтобы предотвратить ее превращение в примесь в продукте. Другими словами, матрица обладает свойствами, которые позволяют отделять ее от продукта. В одном воплощении изобретения это удержание достигается посредством связывания матрицы с материалом-носителем. Такое связывание приводит к образованию комплекса матрица-носитель, обладающего высокой молекулярной массой и, следовательно, удерживающегося в реакционном сосуде при удалении примесей и продукта, например, посредством фильтрации. Матрица может быть присоединена к твердому материалу-носителю, такому как полимерные гранулы, волокнистые носители, мембраны, покрытые стрептавидином гранулы и целлюлоза. Матрица может быть также связана с растворимым материалом-носителем, таким как полиэтиленгликоль, растворимый органический полимер, ДНК, белок, дендример, полисахарид, олигосахарид и углевод.
Каждый материал-носитель может иметь множество точек, к которым может присоединяться матрица, и к каждой точке присоединения может присоединяться множество матриц, например, так, как показано на Фиг. 3.
Сама матрица может иметь высокую молекулярную массу, не будучи присоединенной к материалу-носителю, например, она может быть молекулой с множеством копий матрицы, например, разделенных линкером, так, как показано на Фиг. 3.
Способность матрицы удерживаться в реакционном сосуде также позволяет перерабатывать матрицу для последующих реакций, либо благодаря ее восстановлению, либо благодаря применению в непрерывном или полунепрерывном поточном процессе.
Способы отделения матрицы от продукта (или от примесей)
Свойства матрицы, описанные выше, позволяют разделять матрицу и продукт или разделять связанный с матрицей продукт и примеси. Может применяться разделение по молекулярной массе, разделение по заряду, разделение по гидрофобности, разделение по специфической последовательности или комбинация перечисленных способов.
В случае, когда матрица присоединена к твердому носителю, отделение матрицы от продукта или отделение примесей от продукта, связанного с матрицей, достигается благодаря промыванию твердого носителя в соответствующих условиях. В случаях, когда матрица связана с растворимым носителем или сама состоит из повторяющихся матричных последовательностей, отделение матрицы от продукта или отделение продукта, связанного с матрицей, от примесей может достигаться посредством разделения по молекулярной массе. Это может достигаться с применением таких способов, как ультрафильтрация или нано-фильтрация, когда материал фильтра выбирают таким образом, чтобы более крупные молекулы удерживались фильтром, а более мелкие молекулы проходили через него. В случаях, когда одной стадии отделения примесей от комплекса матрицы и продукта или отделения продукта от матрицы недостаточно, можно использовать несколько последовательных стадий фильтрации для того, чтобы увеличить эффективность разделения и за счет этого получить продукт, имеющий требуемую чистоту.
Желательно разработать способ разделения таких олигонуклеотидов, который был бы эффективным и мог бы применяться в промышленном масштабе. В "Therapeutic oligonucleotides: The state of the art in purification technologies" Sanghvi et. al. Current Opinion in Drug Discovery (2004) Vol. 7 No. 8 представлен обзор способов, применяющихся для очистки олигонуклеотидов.
В WO-A-01/55160 раскрыта очистка олигонуклеотидов посредством образования иминных связей с примесями, последующее удаление имино-связанных примесей при помощи хроматографии или других методов. В "Size Fractionation of DNA Fragments Ranging from 20 to 30000 Base Pairs by Liquid/Liquid chromatography" Muller et al. Eur. J. Biochem (1982) 128-238 раскрыто применение колонки для твердофазной экстракции, заполненной микрокристаллической целлюлозой, на которую нанесена фаза PEG/декстран, для разделения нуклеотидных последовательностей. В "Separation and identification of oligonucleotides by hydrophilic interaction chromatography." Easter et. al. The Analyst (2010); 135(10) раскрыто разделение олигонуклеотидов с использованием варианта HPLC с использованием твердофазного носителя на основе силикагеля. В "Fractionation of oligonucleotides of yeast soluble ribonucleic acids by countercurrent distribution" Doctor et al. Biochemistry (1965) 4(1) 49-54 раскрыто применение колонки, заполненной сухой DEAE-целлюлозой. В "Oligonucleotide composition of a yeast lysine transfer ribonucleic acid" Madison et al; Biochemistry, 1974, 13(3) раскрыто применение твердофазной хроматографии для разделения нуклеотидных последовательностей.
Известным способом разделения является жидкостно-жидкостная хроматография. В "Countercurrent Chromatography The Support-Free Liquid Stationary Phase" Billardello, В.; Berthod, A; Wilson & Wilson's Comprehensive Analytical Chemistry 38; Berthod, A., Ed.; Elsevier Science B.V.: Amsterdam (2002) pp 177-200 приведено содержательное общее описание жидкостно-жидкостной хроматографии. Известны различные методы жидкостно-жидкостной хроматографии. Одним из методов является жидкостно-жидкостная противоточная хроматография (в данном документе обозначаемая «ССС»). Другим известным методом является центробежная распределительная хроматография (в данном документе обозначаемая «СРС»).
Для отделения олигонуклеотидного продукта, например, от матрицы и/или примеси, можно применять описанные выше способы и способы, описанные в WO 2013/030263.
Олигонуклеотиды, используемые в качестве исходного материала
Олигонуклеотиды, используемые в качестве исходного материала в способах по изобретению, в данном документе описывают как «пул», определение которого приведено выше. Пул представляет собой негомогенный набор олигонуклеотидов. Олигонуклеотиды, образующие пул, получают другими способами получения олигонуклеотидов и поэтому могут содержать примеси в большом количестве. Таким образом, когда этот пул олигонуклеотидов используют в способе по изобретению, возможность специфически удалять примеси, как описано в данном документе, обусловливает возникновение стадии очистки.
Пул может содержать олигонуклеотиды, которые должны быть одинаковой длины с матричным олигонуклеотидом (хотя он будет содержать примеси различной длины, а также неправильно включенные остатки). Пул также может состоять из сегментов олигонуклеотидных продуктов, которые соединяются друг с другом в процессе сборки на матрице. Каждый сегмент будет представлять собой негомогенный набор с примесями различной длины и неправильно включенными остатками.
Лигазы
В одном аспекте изобретения предложена лигаза. В одном воплощении изобретения лигаза представляет собой АТФ-зависимую лигазу. АТФ-зависимые лигазы варьируют по размеру от 30 до более 100 кДа. В одном воплощении изобретения лигаза представляет собой НАД-зависимую лигазу. НАД-зависимые лигазы высокогомологичны и представляют собой мономерные белки 70-80 кДа. В одном воплощении изобретения лигаза представляет собой термостабильную лигазу. Термостабильная лигаза может происходить из термофильной бактерии.
В одном воплощении изобретения лигаза представляет собой модифицированную лигазу. Например, модифицированная лигаза включает модифицированную ДНК-лигазу Т4, модифицированную лигазу фага энтеробактерий СС31, модифицированную лигазу фага шигеллы Shfl25875 и модифицированную лигазу хлореллы.
В одном воплощении ДНК-лигаза Т4 дикого типа модифицирована по аминокислоте, находящейся в положении 386, или по аминокислоте, находящейся в положении 371 SEQ ID NO:3.
В одном воплощении мутантная лигаза содержит или состоит из SEQ ID NO:3, где аминокислота в положении 368 представляет собой R или K.
В одном воплощении мутантная лигаза содержит или состоит из SEQ ID NO:3, где аминокислота в положении 371 представляет собой любую из следующих аминокислот: L, K, Q, V, P, R.
В одном воплощении соответствующие остатки, указанные выше применительно к ДНК-лигазе Т4, мутированы в любой из следующих лигаз: лигаза фага энтеробактерий СС31, лигаза фага шигеллы Shfl25875 и лигаза хлореллы. Консервативные области ДНК лигаз изложены в Chem. Rev. 2006, 106, 687-699 and Nucleic Acids Research, 2000, Vol. 28, No. 21, 4051-4058. В одном воплощении лигаза модифицирована в линкерной области.
В одном воплощении изобретения лигаза содержит или состоит из SEQ ID NO:23 или лигаза имеет последовательность по меньшей мере на 90% идентичную ей, за исключением лигазы дикого типа, например, лигазы фага энтеробактерий СС31.
В одном воплощении изобретения лигаза содержит или состоит из любой из следующих аминокислотных последовательностей: SEQ ID NO:10-28.
В одном воплощении изобретения лигаза иммобилизована, например, на грануле.
В одном аспекте изобретения предложено применение лигазы, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:6 или SEQ ID NO:8, для лигирования 5' сегмента, содержащего одну или более чем одну модифицированную сахаридную группировку, с 3' сегментом, где все сахаридные группировки в составе 3' сегмента являются немодифицированными. В одном воплощении изобретения предложено применение лигазы, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:6 или SEQ ID NO:8, для лигирования 5' сегмента, содержащего одну или более чем одну сахаридную группировку с 2'-OMe модификацией, с 3' сегментом, где все сахаридные группировки в составе 3' сегмента являются немодифицированными. В одном воплощении все сахаридные группировки в 5' сегменте содержат 2'-OMe модификацию. В одном воплощении 5' сегмент содержит 5 сахаридных группировок с 2'-OMe модификацией.
Данное изобретение охватывает следующие объекты:
1. Способ получения одноцепочечного олигонуклеотидного продукта, при котором:
a) берут олигонуклеотидную матрицу (I), комплементарную последовательности продукта, причем указанная матрица обладает свойствами, позволяющими отделять ее от продукта;
b) берут пул олигонуклеотидов (II);
c) приводят в контакт (I) и (II) в условиях, обеспечивающих отжиг; и
d) изменяют условия для удаления продукта.
2. Способ по п. 1, при котором:
a) берут олигонуклеотидную матрицу (I), комплементарную последовательности продукта, причем указанная матрица обладает свойствами, позволяющими отделять ее от продукта;
b) берут пул олигонуклеотидов (II);
c) приводят в контакт (I) и (II) в условиях, обеспечивающих отжиг;
d) изменяют условия для удаления примесей; и
e) изменяют условия для удаления продукта.
3. Способ по п. 1 или 2, при котором:
a) берут олигонуклеотидную матрицу (I), комплементарную последовательности продукта, причем указанная матрица обладает свойствами, позволяющими отделять ее от продукта;
b) берут пул олигонуклеотидов (II), содержащий олигонуклеотиды, представляющие собой сегменты последовательности продукта;
c) приводят в контакт (I) и (II) в условиях, обеспечивающих отжиг;
d) объединяют олигонуклеотидные сегменты для образования продукта;
e) изменяют условия для удаления примесей; и
f) изменяют условия для удаления продукта.
4. Способ по любому из предшествующих пунктов, который осуществляют в резервуаре для проведения реакции, при этом изменение условий для удаления продукта включает стадию отделения гибридизованных олигонуклеотидных цепей и стадию удаления продукта из резервуара для проведения реакции.
5. Способ по любому из пп. 2-4, который осуществляют в резервуаре для проведения реакции, при этом изменение условий для удаления примесей включает стадию отделения гибридизованных олигонуклеотидных цепей и стадию удаления примесей из резервуара для проведения реакции.
6. Способ по пп. 4 или 5, при котором разделение цепей происходит в результате повышения температуры.
7. Способ по п. 6, включающий две стадии повышения температуры: i) для отделения гибридизованных примесей и ii) для отделения гибридизованного продукта.
8. Способ по пп. 3-7, где олигонуклеотидные сегменты соединяют при помощи ферментативного лигирования.
9. Способ по п. 8, где фермент представляет собой лигазу.
10. Способ по любому из пп. 3-9, где сегменты имеют длину от 3 до 15 нуклеотидов.
11. Способ по любому из предшествующих пунктов, где продукт имеет длину от 10 до 200 нуклеотидов.
12. Способ по п. 11, где продукт имеет длину от 20 до 25 нуклеотидов.
13. Способ по п. 12, включающий три сегмента олигонуклеотидов: 5' сегмент, который имеет длину 7 нуклеотидов, центральный сегмент, который имеет длину 6 нуклеотидов и 3' сегмент, который имеет длину 7 нуклеотидов.
14. Способ по п. 12, включающий три сегмента олигонуклеотидов: 5' сегмент, который имеет длину 6 нуклеотидов, центральный сегмент, который имеет длину 8 нуклеотидов и 3' сегмент, который имеет длину 6 нуклеотидов.
15. Способ по п. 12, включающий три сегмента олигонуклеотидов: 5' сегмент, который имеет длину 5 нуклеотидов, центральный сегмент, который имеет длину 10 нуклеотидов и 3' сегмент, который имеет длину 5 нуклеотидов.
16. Способ по любому из предшествующих пунктов, где свойством, позволяющим отделять матрицу от продукта является то, что матрица присоединена к материалу-носителю.
17. Способ по п. 16, где материал-носитель представляет собой растворимый материал-носитель.
18. Способ по п. 17, где материал-носитель представляет собой полиэтиленгликоль.
19. Способ по любому из пп. 11-18, где несколько повторяющихся копий матрицы последовательно присоединены к материалу-носителю через единственную точку присоединения.
20. Способ по любому из пп. 1-15, где свойством, позволяющим отделять матрицу от продукта, является молекулярная масса матрицы.
21. Способ по любому из предшествующих пунктов, где матрицу или матрицу и материал-носитель подвергают переработке для использования в будущих реакциях.
22. Способ по любому из предшествующих пунктов, где реакцию проводят с использованием непрерывного поточного процесса.
23. Способ по любому из предшествующих пунктов, где продукт содержит по меньшей мере один модифицированный нуклеотидный остаток.
24. Способ по п. 23, где по меньшей мере один сегмент содержит по меньшей мере один модифицированный нуклеотидный остаток.
25. Способ по п. 23 или 24, где модификация находится в 2' положении сахаридной группировки.
26. Способ по п. 25, где модификация выбрана из группы, состоящей из 2'-F, 2'-ОМе, 2'-МОЕ и 2'-амино.
27. Способ по п. 24, где олигонуклеотид содержит РМО, LNA, PNA, BNA или Spiegelmer™.
28. Способ по п. 23 или 24, где модификация находится в нуклеотидном основании.
29. Способ по п. 28, где модификация выбрана из группы, состоящей из 5-метилпиримидинов, 7-деазагуанозинов и нуклеотидов, лишенных азотистого основания.
30. Способ по п. 23 или 24, где модификация находится в остове.
31. Способ по п. 30, где модификация выбрана из группы, состоящей из фосфоротиоата, фосфорамидата и фосфородиамидата.
32. Способ по любому из предшествующих пунктов, где получаемый продукт имеет степень чистоты по меньшей мере 90%.
33. Способ по п. 32, где продукт имеет степень чистоты по меньшей мере 95%.
34. Способ получения двухцепочечных олигонуклеотидов, где 2 комплементарных одноцепочечных олигонуклеотида получают способом по любому из предшествующих пунктов и затем смешивают в условиях, обеспечивающих отжиг.
35. Способ по любому из предшествующих пунктов, предназначенный для получения терапевтического олигонуклеотида.
36. Олигонуклеотид, получаемый способом по любому из пп. 1-35.
37. Олигонуклеотид по п. 36, где олигонуклеотид представляет собой модифицированный олигонуклеотид, получаемый способом по любому из пп. 23-35.
38. Олигонуклеотид по п. 37, где олигонуклеотид представляет собой гэпмер.
39. Лигаза, содержащая аминокислотную последовательность, приведенную в SEQ ID NO:3, где аминокислота в положении 368 заменена на R или K; и/или аминокислота в положении 371 заменена на L, K, Q, V, Р или R.
40. Лигаза, содержащая аминокислотную последовательность, приведенную в любой из SEQ ID NO:10-28.
41. Применение лигазы, содержащей аминокислотную последовательность, приведенную в SEQ ID NO:6 или SEQ ID NO:8, для лигирования 5' сегмента, содержащего одну или более чем одну сахаридную группировку с 2'-ОМе модификацией, с 3' сегментом, где все сахаридные группировки в составе 3' сегмента являются немодифицированными.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Аббревиатуры
Пример 1. Сборка сегментов олигонуклеотида (ДНК) и лигирование ДНК-лигазой Т4 дикого типа
1.1. Химический синтез стартовых и контрольных последовательностей
Чтобы продемонстрировать, что множество коротких олигонуклеотидов («сегментов») могут быть собраны в правильном порядке на комплементарной цепи матрицы и лигированы с образованием требуемого конечного («целевого») продукта, при помощи стандартных способов химически синтезировали последовательности сегментов, целевого олигонуклеотида и матрицы, приведенные в Таблице 1.
1.2. Анализ методом HPLC
Анализ при помощи HPLC проводили с применением колонки Agilent ZORBAX Eclipse Plus XDB-C18 (4,6 × 150 мм, размер гранул 5 мкм Agilent P/N 993967-902) при скорости тока 0,2 мл/мин, регистрировали поглощение при 258 нм. Поддерживали температуру колонки 60°С. Инжектировали 20 мкл образца и пропускали градиент 20-31% буфера В в течение 20 минут, после чего переходили к 80% буфера В в течение 5 минут.
Буфер А: 75 мл 1 М НАА, 300 мл изопропилового спирта, 200 мл ацетонитрила, 4425 мл воды
Буфер В: 650 мл изопропилового спирта, 350 мл ацетонитрила

1.3 Способ сборки и лигирования олигонуклеотида с использованием коммерческой ДНК-лигазы Т4 (SEQ ID NO:3)
Проводили сборку 5' сегмента, центрального сегмента и 3' сегмента на матрице: каждый сегмент и матрицу растворяли в воде в концентрации 1 мг/мл и затем смешивали следующим образом:
Объединенный раствор олигонуклеотидов инкубировали при 94°С в течение 5 минут и охлаждали до 37°С, после чего дополнительно инкубировали при 37°С в течение 5 минут, чтобы сегменты могли гибридизоваться с матрицей. Затем добавляли 2 мкл (эквивалент 2 мкг) ДНК-лигазы Т4 (NEB) и 4 мкл 1 х буфера для ДНК-лигазы Т4 (NEB) и инкубировали реакционную смесь (общий объем реакционной смеси 50 мкл) при комнатной температуре в течение одного часа. После этого добавляли 40 мкл покрытых стрептавидином магнитных гранул и инкубировали суспензию при комнатной температуре в течение 10 минут, чтобы биотинилированная матрица связалась со стрептавидиновыми гранулами. Стрептавидиновые гранулы промывали 2 × 100 мкл PBS для удаления несвязавшихся сегментов. Промывку анализировали при помощи HPLC. Инкубировали реакционную смесь при 94°С в течение 10 минут для отделения связанных продуктов лигирования (или каких-либо связанных сегментов) от матрицы, а затем быстро охлаждали на льду для «плавления» ДНК и остановки повторной гибридизации олигонуклеотидных продуктов (или сегментов) с матрицей. Затем анализировали реакцию лигирования при помощи HPLC.
1.4 Способ сборки и лигирования олигонуклеотида с использованием суспензии гранул с ДНК-лигазой Т4 собственного производства
1.4.1. Получение суспензии гранул
Лигазу Т4 (SEQ ID NO:4), слитый N-концом с целлюлозо-связывающим доменом (CBD), получали с помощью стандартных методов клонирования, экспрессии и выделения. Аминокислотная последовательность указанной лигазы Т4 отличается от последовательности коммерческой лигазы Т4 (SEQ ID NO:3) тем, что N-концевой метионин (М) был заменен на глицин и серин (GS). Это было сделано для того, чтобы способствовать выработке и экспрессии слитого с CBD белка. Слитый белок CBD-лигаза Т4 экспрессировали в клетках BL21 A1 (INVITROGEN). Собирали надосадочную жидкость и добавляли к 600 мкл гранул PERLOZA 100 (PERLOZA) и встряхивали при 26°С в течение 1 ч. Затем собирали целлюлозные гранулы PERLOZA и промывали 2 мл буфера (50 мМ Tris рН 8,0, 200 мМ NaCl, 0,1% Tween 20, 10% глицерин), затем 5 мл PBS и, наконец, ресуспендировали в 200 мкл PBS (10 мМ PO43-, 137 мМ NaCl, 2,7 мМ KCl рН 7,4). Для анализа экспрессии белка 15 мкл суспензии гранул PERLOZA смешивали с 5 мкл буфера для нанесения образцов, содержащего SDS, и инкубировали при 80°С в течение 10 мин, а затем проводили электрофорез в SDS PAGE в градиентном геле (4-20%) согласно стандартному протоколу.
1.4.2. Сборка олигонуклеотида и лигирование с использованием суспензии гранул
Способ сборки и лигирования для лигазы Т4, связанной с гранулами PERLOZA, приведенный выше в пункте 1.3, модифицировали следующим образом. В исходной смеси сегментов 36 мкл H2O снижали до 8 мкл H2O. После отжига 2 мкл коммерческой ДНК-лигазы Т4 заменяли на 20 мкл суспензии гранул PERLOZA. Перед добавлением покрытых стрептавидином магнитных гранул центрифугировали гранулы PERLOZA и удаляли надосадочную жидкость. К надосадочной жидкости добавляли покрытые стрептавидином магнитные гранулы и инкубировали при комнатной температуре в течение 10 минут, чтобы биотинилированная матрица связалась со стрептавидиновыми гранулами.
1.5 Результаты и выводы
Продукт, матрица и все три олигонуклеотидных сегмента хорошо разделялись на контрольной хроматограмме.
Анализ лигазной реакции методом HPLC показал, что оставались некоторые нелигированные олигонуклеотидные сегменты, однако коммерческая ДНК-лигаза Т4 (NEB) была способна катализировать лигирование трех сегментов с образованием требуемого олигонуклеотидного продукта (Фиг. 7). ДНК-лигаза Т4, связанная с гранулами PERLOZA, оказалась менее эффективной при лигировании олигонуклеотидных сегментов, при этом олигонуклеотидные сегменты появлялись как в контрольном промывочном образце, так и в образце смеси, где протекала реакция (Фиг. 8). Однако нельзя быть уверенными, что количество фермента, добавленного на гранулах, было таким же, как и в случае коммерческого фермента, поэтому невозможно проводить прямое сравнение эффективности лигирования.
Пример 2. Сборка олигонуклеотидных сегментов с 2'-ОМе модификацией рибозы и лигирование ДНК-лигазой Т4 дикого типа
2.1 2' ОМе в каждом нуклеотиде каждого сегмента
Для определения, способна ли ДНК-лигаза Т4 лигировать олигонуклеотидные сегменты с модификацией в 2' положении рибозного кольца, синтезировали олигонуклеотидные сегменты с такими же последовательностями, как в Примере 1, но 2' положение рибозного кольца было замещено группой ОМе, а тимидин был заменен на уридин, как показано ниже.

(р)=фосфат
Сборку, лигирование и анализ при помощи HPLC осуществляли с использованием методов, описанных в Примере 1, используя как коммерческую лигазу NEB, так и слитую с CBD лигазу Т4, связанную с гранулами PERLOZA. Количество воды, использованной в реакционной смеси для коммерческой ДНК-лигазы Т4 (NEB), составляло 26 мкл вместо 36 мкл, поэтому общий объем реакционной смеси составлял 40 мкл. Количество воды, использованной в реакционной смеси для эксперимента с суспензией гранул ДНК-лигазы Т4 собственного приготовления, составляло 23 мкл, а количество использовавшихся гранул составляло 5 мкл, поэтому общий объем реакционной смеси также составлял 40 мкл. Параллельно проводили контрольные эксперименты с использованием немодифицированной ДНК в отличие от 2'-ОМе ДНК.
Результаты контрольных экспериментов согласовывались с Примером 1. В экспериментах с 2'-ОМе продукт не определялся при помощи HPLC, что указывало на то, что ДНК-лигаза Т4 не способна лигировать олигонуклеотидные сегменты, полностью модифицированные 2'-ОМе, независимо от того, применяли ли коммерческую ДНК-лигазу Т4 или слитую с CBD ДНК-лигазу Т4 собственного приготовления, связанную с гранулами PERLOZA.
2.2 2' ОМе в каждом нуклеотиде в одном сегменте
Используя раствор каждого олигонуклеотида в концентрации 1 мг/мл, готовили реакционные смеси, подробно описанные в Таблице 3.

Сборку и лигирование осуществляли с использованием методов, описанных в Примере 1, с коммерческой лигазой NEB и с ДНК-лигазой Т4 собственного приготовления, связанной с PERLOZA.
Реакционные смеси инкубировали при 94°С в течение 5, затем инкубировали в течение 5 минут при 37°С для обеспечения отжига. К каждой реакционной смеси добавляли 4 мкл буфера для ДНК-лигазы Т4 NEB наряду с 5 мкл (приблизительно 2 мкг) ДНК-лигазы Т4 собственного приготовления или 2 мкл (приблизительно 2 мкг) коммерческой ДНК-лигазы Т4 (кроме Эксперимента 1, который служил контролем без лигазы) и проводили реакцию лигирования в течение 2 ч при комнатной температуре. Затем к каждой реакционной смеси добавляли покрытые стрептавидином магнитные гранулы и нагревали до 94°С, а затем быстро охлаждали на льду, как описано в Примере 1, для отделения исходных материалов и продуктов от матрицы.
После проведения реакции смеси делили на две части: половину анализировали при помощи HPLC, как описано в Примере 1 (раздел 1.2). Другую половину образца оставляли для масс-спектрометрии для подтверждения результатов HPLC.
Лигирование немодифицированных олигонуклеотидных сегментов (эксперимент 5) протекало, как и ожидалось, с образованием полноразмерного продукта. Как показано на Фиг. 9, если 5' сегмент был 2'-ОМе замещенным (эксперимент 3), наблюдали небольшое количество лигированного продукта, однако, когда 3' сегмент был 2'-ОМе замещенным (эксперимент 2), лигирование не наблюдали. Когда все три сегмента были 2'-ОМе замещенными (эксперимент 4), продукт практически не регистрировался, что согласовывалось с разделом описания 2.1.
2.3 Вывод
ДНК-лигаза Т4 дикого типа плохо лигирует 2'-ОМе замещенные олигонуклеотидные сегменты, однако немного менее чувствительна к модификации 5' олигонуклеотидного сегмента, чем к модификации 3' сегмента.
Пример 3. Сборка олигонуклеотидных сегментов с 2'-ОМе модификацией рибозы и лигирование лигазой дикого типа и мутантными лигазами
3.1 Материалы
Лигазу фага энтеробактерий СС31 дикого типа (SEQ ID NO:6), лигазу фага шигеллы Shfl25875 (SEQ ID NO:8) и 10 мутантных лигаз Т4 с последовательностями SEQ ID NO:10-19, каждая из которых была слита N-концом с CBD, получали с использованием стандартных методов клонирования, экспрессии и выделения. Как описано в 1.4.1, для создания и экспрессии слитых с CBD белков, N-концевой метионин (М) в каждом случае заменяли на глицин и серин (GS) (например, SEQ ID NO:7 для лигазы фага энтеробактерий СС31 и SEQ ID NO:9 для лигазы фага шигеллы Shfl25875).
Следующие олигонуклеотиды синтезировали при помощи стандартных твердофазных методов.

Примечание: ОМе означает заместитель метокси в 2' положении рибозного кольца (р)=фосфат
* первые 5 нуклеотидов (GGCCA) являются 2'-ОМе модифицированными, а последний А является немодифицированным
3.2 Сборка олигонуклеотида и лигирование с использованием суспензии гранул с лигазой
3.2.1. Получение суспензии гранул
Лигазы, слитые с CBD, связывали с гранулами PERLOZA, как описано в 1.4 для получения суспензии гранул.
3.2.2. Сборка олигонуклеотида и лигирование с использованием суспензии гранул
Реакционные смеси для лигирования готовили в 96-луночном планшете из компонентов, приведенных ниже, в конечном объеме 50 мкл:
Реакционную смесь инкубировали в течение 15 минут при комнатной температуре перед добавлением суспензии гранул PERLOZA, чтобы сегменты могли гибридизоваться с матрицей. Добавляли суспензию гранул PERLOZA и инкубировали реакционную смесь при комнатной температуре в течение 1 ч. После часовой инкубации раствор переносили в фильтровальный планшет ACOPREP advance 350 (PN 8082), а фильтровальный планшет помещали поверх суперпланшета ABGENE (Thermo Scientific, #АВ-2800) и центрифугировали в течение 10 минут при 4000 об/мин для удаления суспензии гранул PERLOZA. Затем растворы анализировали при помощи HPLC согласно методу, описанному в Примере 1 (раздел 1.2).
Сборку каждого олигонуклеотида и лигирование повторяли 6 раз с каждой лигазой.
3.3 Результаты и выводы
Лигаза фага энтеробактерий СС31 дикого типа (SEQ ID NO:6) и лигаза фага шигеллы Shfl25875 дикого типа (SEQ ID NO:8) способны лигировать 2' ОМе замещенный 5' сегмент, содержащий пять 2'-ОМе нуклеотидных оснований и одно дезоксинуклеотидное основание, с сегментом, содержащим только немодифицированную ДНК. Кроме того, в то время как ДНК-лигаза Т4 дикого типа (SEQ ID NO:3 и 4) плохо осуществляет данную реакцию, как показано в Примере 2 и подтверждено в данном Примере, ряд мутаций в положениях 368 и 371 (SEQ ID NO:10-19) придают лигазе способность лигировать 2'-OMe замещенный 5' сегмент, содержащий пять 2' ОМе нуклеотидных оснований и одно дезоксинуклеотидное основание, с сегментом, содержащим только немодифицированную ДНК.
Пример 4. Сборка олигонуклеотидных сегментов с 2'-МОЕ модификацией рибозы и модификацией 5-метилпиридин и лигирование мутантными ДНК-лигазами
4.1 Материалы
Модифицированные олигонуклеотидные сегменты, приведенные в Таблице 5 ниже, синтезировали стандартными твердофазными методами.


(р)=фосфат, mX=основания с модификацией МОЕ, dX=ДНК-основания все 5-метилпиримидины
Мутантные ДНК-лигазы (SEQ ID NO:20-28) на основе лигазы фага энтеробактерий СС31 дикого типа, лигазу Т4 дикого типа и лигазу фага шигеллы Shfl25875 дикого типа, каждая из которых была слита N-концом с целлюлозо-связывающим доменом (CBD), получали с применением стандартных методов клонирования, экспрессии и выделения. Лигазы, слитые с CBD, связывали с гранулами PERLOZA, как описано в 1.4 для получения суспензии гранул. Для отделения лигаз от гранул PERLOZA к суспензии добавляли 2 мкл протеазы TEV и инкубировали в течение ночи при 4°С. Расщепленный белок, лишенный целлюлозо-связывающего домена, собирали при помощи центрифугирования в течение 10 мин при 4000 об/мин.
4.2 Метод
Реакционную смесь готовили следующим образом:
Перед добавлением ДНК-лигазы все компоненты смешивали и перемешивали на вортексе. Реакционные смеси инкубировали в течение 1 ч при 35°С. Через 1 час реакции останавливали путем нагревания до 95°С в течение 5 минут в блоке для проведения ПЦР.
Образцы анализировали при помощи HPLC и LCMS для подтверждения подлинности продукта согласно протоколу HPLC, применявшемуся в Примере 1 (раздел 1.2). В качестве контроля включали коммерческую ДНК-лигазу Т4 NEB и отрицательный контроль (H2O вместо лигазы).
4.3 Результаты и выводы
На Фиг. 10 показаны хроматограммы HPLC для контрольной реакции и для реакции, катализируемой лигазой с последовательностью SEQ ID NO:23 (клон А4 - мутантная лигаза фага энтеробактерий СС31). Продукт и матрица элюировались совместно при использовании данного метода HPLC, поэтому продукт наблюдается как увеличение площади пика «продукт+матрица». В случае хроматограммы (b), соответствующей мутантной лигазе, увеличивается не только пик «продукт+матрица», но также появляются два новых пика на 10,3 и 11,2 минутах. Эти пики соответствуют лигированию центрального сегмента либо с МОЕ 5' сегментом, либо с МОЕ 3' сегментом. Кроме того, пики, соответствующие исходным сегментам, значительно меньше, чем в контроле, что согласуется с увеличением пиков продукта и промежуточных продуктов. Хроматограмма, соответствующая коммерческой лигазе Т4 NEB (а), демонстрирует небольшое увеличение площади пика «матрица+продукт», небольшое количество промежуточного продукта лигирования наряду с сопутствующим уменьшением исходных олигонуклеотидных сегментов. Однако, мутантная лигаза (SEQ ID NO:23) демонстрировала значительно большую площадь пика «продукт+матрица» и сопутствующее уменьшение площади пиков, соответствующих исходным олигонуклеотидным сегментам. Таким образом, мутантная лигаза (SEQ ID NO:23) является гораздо более эффективной для 2' МОЕ замещенных сегментов, чем коммерческая ДНК-лигаза Т4. Аналогичное улучшение было продемонстрировано для других мутантных лигаз (SEQ ID NO:20, 21, 24-28).
Пример 5. Влияние спаривания различных нуклеотидов в сайте лигирования
5.1 Материалы
Мутантную лигазу фага энтеробактерий СС31 (SEQ ID NO:23), слитую N-концом с целлюлозо-связывающим доменом (CBD), получали с использованием стандартных методов клонирования, экспрессии и выделения. Выделенную лигазу фага энтеробактерий СС31 добавляли к 25 мл целлюлозных гранул PERLOZA 100 (PERLOZA) и встряхивали при 20°С в течение 1 ч. Затем собирали гранулы PERLOZA и промывали 250 мл буфера (50 мМ Tris рН 8,0, 200 мМ NaCl, 0,1% Tween 20, 10% глицерин), затем 250 мл PBS и, наконец, ресуспендировали в 10 мл PBS (10 мМ РО43-, 137 мМ NaCl, 2,7 мМ KCl рН 7,4). Для анализа экспрессии белка 15 мкл суспензии гранул PERLOZA смешивали с 5 мкл буфера для нанесения образцов, содержащего SDS, и инкубировали при 80°С в течение 10 мин перед разделением при помощи SDS PAGE в градиентном геле (4-20%) согласно стандартному протоколу. Для отделения лигазы от гранул добавляли 70 мкл протеазы TEV и инкубировали в течение ночи при 4°С при встряхивании. Собирали лигазу путем промывания гранул 80 мл PBS после отщепления от них лигазы. Затем концентрировали лигазу до 1,2 мл при помощи фильтра Amicon с MWCO 30 кДа.
Следующие биотинилированные ДНК-олигонуклеотиды, служившие матрицей (Таблица 6) и ДНК-олигонуклеотиды, служившие сегментами (Таблица 7), синтезировали при помощи стандартных твердофазных методов. Следует отметить, что нуклеотиды, выделенные жирным шрифтом, являются нуклеотидами, находящимися в сайте лигирования (т.е. нуклеотидами, которые соединялись друг с другом в реакции лигирования - Таблица 7, и нуклеотидами, которые комплементарны нуклеотидам, соединяющимся в реакции лигирования - Таблица 6).


(р)=фосфат
Примечание: Следует отметить, что в отличие от предыдущих примеров, реакции лигирования в данном Примере включали объединение вместе двух сегментов: 5'-сегмента и 3'-сегмента, т.е. центральный сегмент отсутствовал.
5.2 Метод
Реакционную смесь готовили следующим образом:


На каждые 50 мкл реакционной смеси:
Каждую реакционную смесь инкубировали при температуре 35°С в течение 30 минут и в течение 1 часа. Каждую реакцию останавливали путем нагревания при 95°С в течение 5 минут. Проводили анализ методом HPLC.
5.3 Результаты и выводы
Анализ методом HPLC показал образование продукта во всех реакциях через 1 час инкубации. Следовательно, метод лигирования работает для всех комбинаций нуклеотидов, находящихся в местах соединения. Оптимизация для улучшения выхода продукта возможна, но не являлась необходимой, поскольку были получены убедительные результаты, и было очевидно, что реакция проходила при всех комбинациях нуклеотидов, находящихся в местах соединения.
Пример 6. Влияние различных модификаций в сайте лигирования
6.1 Материалы
Мутантную лигазу фага энтеробактерий СС31 (SEQ ID NO:23) получали, как описано в разделе 5.1, а ДНК-лигазу вируса хлореллы (SEQ ID NO:29, имеющаяся в продаже как лигаза SplintR, NEB) приобретали.
Следующие биотинилированные олигонуклеотиды, служившие матрицей, и олигонуклеотиды, служившие сегментами (Таблица 9), синтезировали при помощи стандартных твердофазных методов.

ОМе означает заместитель метокси в 2' положении рибозного кольца
F означает заместитель фтор в 2' положении рибозного кольца
Все остальные сахаридные остатки представляют собой дезоксирибозные остатки
Me означает 5-метилцитозины
6.2 Метод
Реакционные смеси готовили следующим образом:

На каждые 50 мкл реакционной смеси:
Для мутантной лигазы фага энтеробактерий СС31 (SEQ ID NO:23)
Для ДНК-лигазы вируса хлореллы (SEQ ID NO:29, имеющейся в продаже как лигаза SplintR, NEB)
Каждую реакционную смесь инкубировали при температуре 20°С в течение 1 часа. Каждую реакцию останавливали путем нагревания при 95°С в течение 10 минут. Проводили анализ методом HPLC, используя способ, описанный в Примере 1.
6.3 Результаты и выводы
Анализ методом HPLC показал образование продукта во всех реакциях. Следовательно, метод лигирования работает для всех исследованных комбинаций модификаций, находящихся в местах соединения. Оптимизация для улучшения выхода продукта возможна, но не являлась необходимой, поскольку были получены убедительные результаты, и было очевидно, что реакция проходила при всех исследованных комбинациях модификаций, находящихся в местах соединения.
Пример 7. Возможность использования разного количества сегментов для построения олигонуклеотидов большего размера
7.1 Материалы
Мутантную лигазу фага энтеробактерий СС31 (SEQ ID NO:23) получали, как описано в разделе 5.1.
Следующие биотинилированные ДНК-олигонуклеотиды, служившие матрицей, и ДНК-олигонуклеотиды, служившие сегментами (Таблица 11), синтезировали при помощи стандартных твердофазных методов.

(р)=фосфат 7.2 Метод
Реакционные смеси готовили следующим образом:

Реакции проводили в фосфатном солевом буфере, рН=7,04 в общем объеме 100 мкл, реакционные смеси готовили следующим образом:
Матрица (конечная концентрация 20 мкМ)
Каждый сегмент (конечная концентрация 20 мкМ)
MgCl2 (конечная концентрация 10 мМ)
АТФ (конечная концентрация 100 мкМ)
Мутантная ДНК-лигаза СС31 (конечная концентрация 25 мкМ)
Каждую реакционную смесь инкубировали при 28°С в течение ночи, затем реакцию останавливали путем нагревания при 94°С в течение 1 минуты. Анализировали продукты при помощи HPLC с масс спектрометрией.
7.3 Результаты и выводы
В реакции, в которой использовали 4 сегмента, образовывался полностью лигированный продукт длиной 27 пар оснований. В реакции, в которой использовали 5 сегментов, образовывался продукт длиной 33 пары оснований. В обоих случаях зарегистрированная масса продукта соответствовала ожидаемой массе требуемой последовательности. Таким образом, доказана возможность сборки множества сегментов для образования олигонуклеотидов требуемой длины с последовательностью, которая определяется соответствующей комплементарной последовательностью матрицы.
Пример 8. Сборка и лигирование сегментов 5-10-5 с образованием гэпмера, где 5' и 3' сегменты содержат (i) 2'-ОМе модификации сахарида рибозы, (ii) фосфоротиоатные связи или (iii) 2'-ОМе модификации сахарида рибозы и фосфоротиоатные связи; и где центральный сегмент представляет собой немодифицированную ДНК
8.1 Материалы
Мутантную лигазу фага энтеробактерий СС31 (SEQ ID NO:23) получали, как описано в разделе 5.1, следующие биотинилированные ДНК-олигонуклеотиды, служившие матрицей, и олигонуклеотиды, служившие сегментами (Таблица 13), синтезировали при помощи стандартных твердофазных методов.


ОМе означает заместитель метокси в 2' положении рибозного кольца
Все остальные сахаридные остатки представляли собой дезоксирибозные остатки
* фосфоротиоат
8.2 Метод
Реакционные смеси готовили следующим образом:

Каждую из реакционных смесей 1, 2 и 3 готовили из следующих компонентов в фосфатном солевом буфере в конечном объеме 100 мкл:
Каждую реакционную смесь инкубировали при температуре 20°С в течение ночи.
Каждую реакцию останавливали путем нагревания при 95°С в течение 10 минут.
Проводили анализ при помощи HPLC с масс-спектрометрией.
8.3 Результаты и выводы
Во всех трех реакциях получали олигонуклеотидный продукт, соответствующий успешному лигированию всех трех фрагментов.
Соответственно, мутантная лигаза фага энтеробактерий СС31 (SEQ ID NO:23) способна лигировать вместе 3 сегмента с образованием «гэпмера», где 5' и 3' «крылья» имеют фосфоротиоатный остов, тогда как центральная область имеет фосфодиэфирный остов, и все сахаридные остатки в составе гэмпера представляют собой остатки дезоксирибозы. Лигаза фага энтеробактерий СС31 (SEQ ID NO:23) также способна лигировать вместе 3 сегмента с образованием «гэпмера», где 5' и 3' «крылья» имеют остатки 2'-метоксирибозы (2'-OMe), тогда как центральная область имеет остатки дезоксирибозы, и все связи представляют собой фосфодиэфирные связи. Наконец, лигаза фага энтеробактерий СС31 (SEQ ID NO:23) способна лигировать вместе 3 сегмента с образованием «гэпмера», где 5' и 3' «крылья» имеют сочетание модификаций (фосфоротиоатный остов и остатки 2'-метоксирибозы), тогда как центральная область имеет остатки дезоксирибозы и фосфодиэфирные связи.
Пример 9. Сборка и лигирование сегментов, содержащих «запертые» нуклеиновые кислоты (LNA)
9.1 Материалы
Мутантную лигазу фага энтеробактерий СС31 (SEQ ID NO:23) получали, как описано в разделе 5.1. Мутантную НАД-зависимую лигазу золотистого стафилококка (NAD-14) получали, как описано в разделе 13.1.
Следующие биотинилированные ДНК-олигонуклеотиды, служившие матрицей, и олигонуклеотиды, служившие сегментами (Таблица 15), синтезировали при помощи стандартных твердофазных методов.

(р)=фосфат
LNA=запертая нуклеиновая кислота
9.2 Метод
Реакционные смеси готовили следующим образом:
Реакции проводили, варьируя ферменты (мутантную лигазу фага энтеробактерий СС31 (SEQ ID NO:23) или NAD-14), двухвалентные катионы (Mg2+или Mn2+) и комбинации олигонуклеотидных сегментов, как показано в Таблице 16.

Каждую реакционную смесь инкубировали при температуре 28°С в течение ночи.
Каждую реакцию останавливали путем нагревания при 94°С в течение 1 минуты. Проводили анализ методом HPLC с масс-спектрометрией.
9.3 Результаты и выводы
Олигонуклеотидный продукт получали в контрольных реакциях (только с немодифицированными олигонуклеотидами) и когда в месте лигирования присутствовала единственная «запертая» нуклеиновая кислота, входящая в один сегмент, независимо от того, находилась ли она в 3' или 5' направлении от места соединения. Когда «запертые» нуклеиновые кислоты располагались с обеих сторон (олиго 1 + олиго 2), продукт не определялся. Результаты были аналогичными для обоих ферментов, независимо от использования Mg2+ или Mn2+.
Возможно производить мутации ферментов и/или селективный скрининг для идентификации фермента, способного лигировать сегменты с «запертой» нуклеиновой кислотой, находящейся как в 3', так и в 5' направлении от места соединения.
Пример 10. Сборка и лигирование трех сегментов (7-6-7) с образованием гэпмера, в котором 5' и 3' сегменты содержат 2' МОЕ модификации сахарида рибозы и все связи представляют собой фосфоротиоатные связи, с использованием варианта лигазы фага энтеробактерий СС31 в присутствии Mg2+ или Mn2+
10.1. Образование фосфоротиоатной связи
Для определения способности мутантной лигазы фага энтеробактерий СС31 (SEQ ID NO:23) лигировать модифицированные олигонуклеотидные сегменты с фосфоротиоатным остовом, 2' МОЕ модификациями сахарида рибозы и 5-метилированными пиримидиновыми основаниями, реакции проводили, используя олигонуклеотидные сегменты, приведенные в Таблице 15. Реакции проводили в присутствии ионов Mg2+и Mn2+.
10.2 Материалы
Олигонуклеотиды химически синтезировали с использованием стандартных способов, как показано ниже:


(р)*=5'-фосфоротиоат, *=фосфоротиоатная связь, mX=основания с модификацией МОЕ, dX=ДНК-основания
все сегменты и продукты имели 5-метилпиримидины (за исключением матрицы) mT и m (Me)U считали эквивалентными
Примечание: целевая молекула 2'МОЕ PS, полученная путем лигирования сегментов из Таблицы 17, при гибридизации с биотинилированной матрицей, приведенной в Таблице 17, представляла собой 5'-mG*mG*mC*mC*mA*dA*dA*dC*dC*dT*dC*dG*dG*dC*dT*mU*rnA*mC*mC*mU-3' (SEQ ID NO:1)
Очищенную мутантную лигазу фага энтеробактерий СС31 (SEQ ID NO:23) получали, как описано в Примере 5.1. Проводили анализ методом HPLC.
10.3 Способ сборки олигонуклеотида и лигирования с использованием варианта лигазы фага энтеробактерий СС31 (SEQ ID NO:23)
Реакционные смеси готовили следующим образом:
Реакционная смесь с MgCl2
*1х буфер содержит 50 мМ Tris-HCl, 10 мМ MgCl2, 1 мМ АТФ, 10 мМ DTT, рН 7,5
Реакционная смесь с MnCl2
*1х буфер содержит 50 мМ Tris-HCl, 10 мМ DTT, рН 7,5
Конечные реакционные смеси содержали по 20 мкМ каждого сегмента и матрицы, 5 мМ MgCl2 или 5 мМ MnCl2, 1 мМ АТФ, 50 мМ Tris-HCl, 10 мМ DTT, рН 7,5 и 4,9 мкМ лигазы. Готовили дополнительные реакционные смеси, не содержавшие фермент и служившие в качестве отрицательного контроля. Реакционные смеси инкубировали в течение 16 ч при 25°С, и затем останавливали реакции путем нагревания до 95°С в течение 5 минут. Осажденные белки удаляли путем центрифугирования и анализировали образцы при помощи HPLC.
10.4 Результаты и выводы
Продукт, матрица и олигонуклеотидные сегменты хорошо разделялись на контрольной хроматограмме, и лигирование не наблюдалось. Лигазные реакции, проводившиеся в присутствии 5 мМ MgCl2, приводили к образованию промежуточного продукта, образующегося при лигировании 5' сегмента и центрального сегмента, однако полноразмерный продукт не обнаруживался. Лигазные реакции, проводившиеся в присутствии MnCl2, приводили к образованию как полноразмерного продукта, так и промежуточного продукта (состоявшего из 5' сегмента и центрального сегмента). Было показано, что в обеих лигазных реакциях оставались нелигированные олигонуклеотидные сегменты. Тем не менее, возможна оптимизация протокола для увеличения выхода продукта.
Пример 11. Сборка и лигирование трех сегментов (7-6-7) с образованием гэпмера, в котором 5' и 3' сегменты содержали 2' МОЕ модификации сахарида рибозы и все связи представляли собой фосфоротиоатные связи, с использованием ДНК-лигазы вируса хлореллы дикого типа в присутствии нативного Mg2+
11.1 Материалы
Для определения способности ДНК-лигазы вируса хлореллы (SEQ ID NO:29, имеющейся в продаже как лигаза SplintR, NEB) лигировать модифицированные олигонуклеотидные сегменты с фосфоротиоатным остовом, 2' МОЕ модификациями сахарида рибозы и 5-метилированными пиримидиновыми основаниями, реакции проводили, используя олигонуклеотидные сегменты, приведенные в Таблице 17 в Примере 10.2. Для исследования влияния температуры на ферментативную активность реакции проводили при 25°С, 30°С и 37°С.
11.2 Способ сборки олигонуклеотида и лигирования с помощью коммерческой ДНК-лигазы вируса хлореллы (SEQ ID NO:29)
Каждый олигонуклеотидный сегмент и матрицу растворяли в свободной от нуклеаз воде, согласно подробному описанию ниже:
Реакционные смеси готовили следующим образом:
*1х буфер содержит 50 мМ Tris-HCl, 10 мМ MgCl2, 1 мМ АТФ, 10 мМ DTT, рН 7,5
Конечные реакционные смеси содержали по 20 мкМ каждого сегмента и матрицы, 50 мМ Tris-HCl, 10 мМ MgCl2, 1 мМ АТФ, 10 мМ DTT, рН 7,5 и 2,5 Ед/мкл лигазы. Реакционные смеси инкубировали при 25°С, 30°С и 37°С. Готовили дополнительные реакционные смеси, не содержавшие фермент и служившие в качестве отрицательного контроля. Через 16 часов инкубации реакции останавливали путем нагревания до 95°С в течение 10 минут. Осажденные белки удаляли путем центрифугирования и анализировали образцы при помощи HPLC.
11.3 Результаты и выводы
Продукт, матрица и олигонуклеотидные сегменты хорошо разделялись на контрольной хроматограмме, и лигирование не наблюдалось. HPLC анализ лигазной реакции показал, что оставались нелигированные олигонуклеотидные сегменты, однако ДНК-лигаза вируса хлореллы была способна с успехом лигировать сегменты. Активность лигазы увеличивалась с повышением температуры. При 25°С ДНК-лигаза вируса хлореллы была способно успешно лигировать 5' сегмент и центральный сегмент, однако полноразмерный продукт не наблюдался. При 30°С и 37°С помимо промежуточного продукта, образованного 5' сегментом и центральным сегментом, обнаруживали полноразмерный продукт.
Пример 12. Скрининг панели 15 АТФ- и НАД-зависимых лигаз по активности при лигировании трех сегментов (7-6-7) для образования гэпмера, в котором 5' и 3' сегменты содержат 2' МОЕ модификации сахарида рибозы и все связи представляют собой фосфоротиоатные связи
12.1 Материалы
Все АТФ- и НАД-зависимые лигазы дикого типа, описанные в Таблицах 18 и 19, были слиты N-концом с CBD. Гены синтезировали, клонировали в рЕТ28а и экспрессировали в Е. coli BL21(DE3) при помощи стандартных методов клонирования, экспрессии и выделения.


Лигазы, слитые с CBD, связывали с гранулами PERLOZA, как описано в разделе 1.4, со следующими модификациями. Слитые белки лигаза-CBD экспрессировали в клетках BL21(DE3) (NEB), выращенных из одиночной колонии и в 50 мл среды. Клетки собирали при помощи центрифугирования, ресуспендировали в 5-10 мл Tris-HCl (50 мМ, рН 7,5) и лизировали при помощи ультразвука. Лизат просветляли путем центрифугирования и добавляли к надосадочной жидкости 1 мл гранул ERLOZA 100 (PERLOZA) (50% суспензия, предварительно уравновешенная 50 мМ Tris-HCl рН 7,5) и оставляли перемешиваться при 20°С в течение 1 ч. Затем собирали целлюлозные гранулы PERLOZA и промывали 30 мл буфера (50 мМ Tris рН 8,0, 200 мМ NaCl, 0,1% Tween 20, 10% глицерин), затем 10 мл Tris-HCl (50 мМ, рН 7,5) и, наконец, ресуспендировали в 1 мл Tris-HCl (50 мМ, рН 7,5). Для анализа экспрессии белка 20 мкл суспензии гранул PERLOZA смешивали с 20 мкл буфера для нанесения образцов, содержащего SDS, и инкубировали при 95°С в течение 5 мин, а затем разделяли при помощи SDS PAGE в градиентном геле (4-20%) согласно стандартному протоколу.
12.2 Способ сборки и лигирования олигонуклеотида с модификацией 2' МОЕ и фосфоротиоатными связями
Использовали модифицированные олигонуклеотидные сегменты с фосфоротиоатным остовом, 2' МОЕ модификациями сахарида рибозы и 5-метилированными пиримидиновыми основаниями, приведенные в Таблице 17 Примера 10.2. Каждый олигонуклеотидный сегмент и матрицу растворяли в свободной от нуклеаз воде, согласно подробному описанию ниже:
Смесь реагентов, содержащую АТФ, готовили следующим образом:
Смесь реагентов, содержащую НАД, готовили следующим образом:
Каждый иммобилизованный белок (40 мкл, 50% суспензия гранул PERLOZA) помещали в пробирку для ПЦР (полимеразной цепной реакции). Гранулы осаждали путем центрифугирования и удаляли надосадочную жидкость путем пипетирования. Для каждой реакции в пробирки добавляли смесь реагентов (40 мкл) (итоговые реакционные смеси содержали по 20 мкМ каждого сегмента и матрицы, 50 мМ Tris-HCl, 10 мМ MgCl2, 1 мМ АТФ или 100 мкМ НАД, 10 мМ DTT, рН 7,5 и 40 мкл лигазы на гранулах PERLOZA). Реакционная смесь, не содержавшая белка, служила в качестве отрицательного контроля. Реакционные смеси инкубировали в течение 18 ч при 30°С, а затем останавливали реакции путем нагревания до 95°С в течение 10 минут. Осажденные белки удаляли путем центрифугирования и анализировали образцы при помощи HPLC.
12.3 Результаты и выводы
Продукт, матрица и олигонуклеотидные сегменты хорошо разделялись на контрольной хроматограмме, и лигирование не наблюдалось. Анализ лигазных реакций методом HPLC показал, что все белки успешно катализировали лигирование 5' сегмента и центрального сегмента с образованием промежуточного продукта, однако только некоторые лигазы катализировали лигирование всех трех сегментов с образованием полноразмерного продукта, как показано в Таблице 20. НАД-зависимая лигаза золотистого стафилококка (SaNAD, SEQ ID NO:61) обеспечивала наибольший выход полноразмерного продукта. Оптимизация для улучшения выхода продукта возможна и находится в компетенции специалиста.
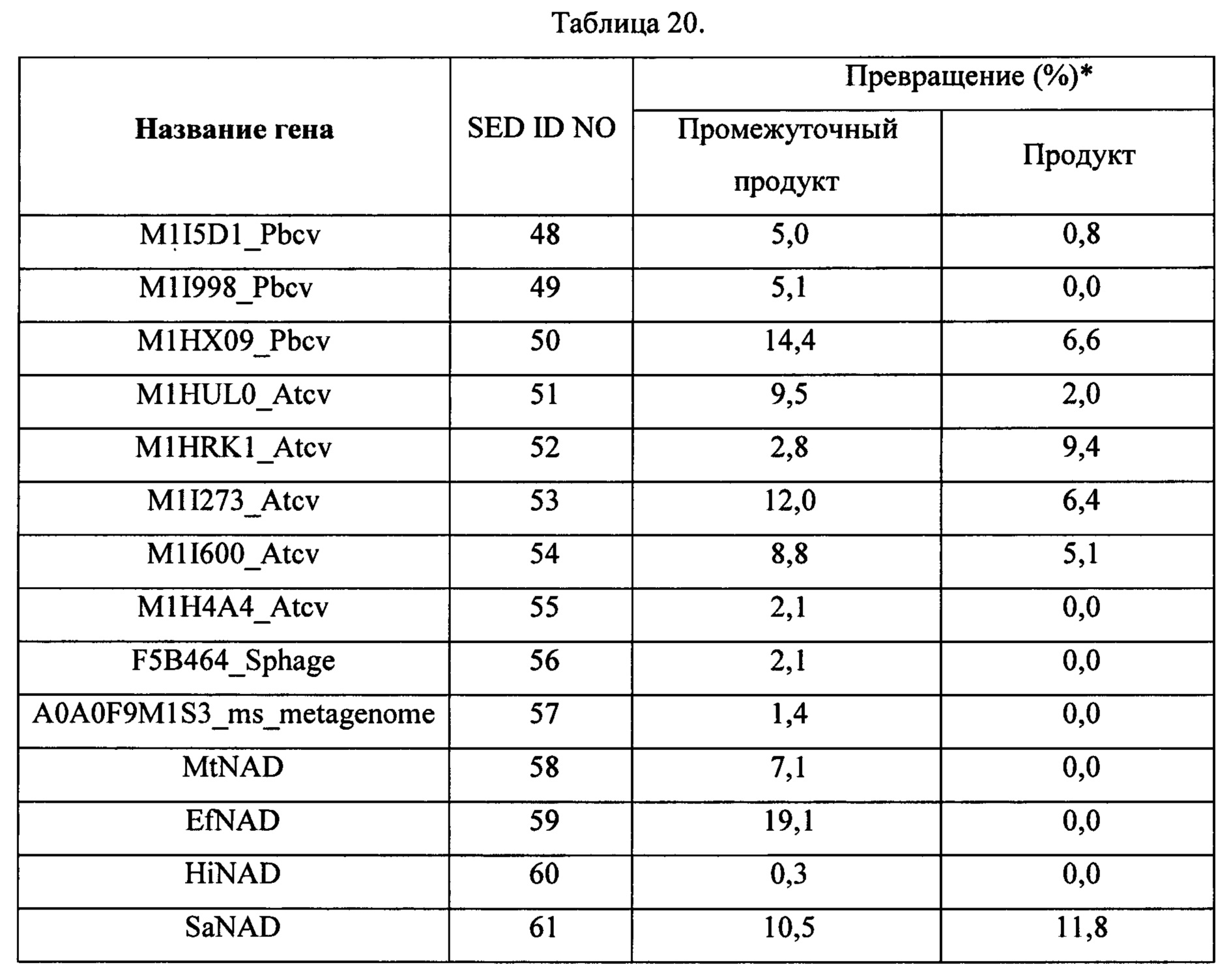

* превращение рассчитывали по площади пика HPLC по отношению к матрице, которая не расходавалась в ходе реакции и служила внутренним стандартом. Превращение = площадь пика продукта / (площадь пика матрицы + продукта)* 100
Пример 13. Полунепрерывная реакция лигирования
13.1 Материалы
Мутантную лигазу золотистого стафилококка (NAD-14), слитую N-концом с CBD, получали с применением стандартных методов клонирования, экспрессии и выделения. Затем мутантную лигазу связывали с гранулами PERLOZA: 50 мл белкового лизата добавляли к 7,5 мл гранул PERLOZA, инкубировали при комнатной температуре в течение 1 ч и затем собирали гранулы в стеклянную колонку (BioRad Econo-Column #7372512 длиной 10 см, диаметром 2,5 см). Гранулы промывали 200 мл буфера Y (50 мМ Tris рН 8,0, 500 мМ NaCl, 0,1% Tween 20, 10% глицерин), затем 200 мл буфера Z (50 мМ Tris рН 8,0, 200 мМ NaCl, 0,1% Tween 20, 10% глицерин) и 200 мл PBS. По оценкам, концентрация мутантной лигазы NAD-14 на гранулах составляла 69 мкМ лигазы на мл гранул.
Следующие ДНК-олигонуклеотиды, служившие матрицей, и олигонуклеотиды, служившие сегментами (Таблица 21), синтезировали при помощи стандартных твердофазных методов.

(p) = фосфат, mX = основания с модификацией МОЕ, dX = ДНК-основания все 5-метилпиримидины
все связи представляли собой фосфодиэфирные связи
Получали «узел с тремя матрицами» (приблизительно 24 кДа), включающий материал носитель, обозначаемый «узлом» и три матричных последовательности (Фиг. 11). Каждая копия матрицы была ковалентно связана с «узлом» в своей собственной точке присоединения. Молекула «узла с тремя матрицами» имеет больший молекулярный вес, чем целевой олигонуклеотид (продукт) (на 100% комплементарный последовательности матрицы), что позволяет ей удерживаться при отделении примесей и продуктов от реакционной смеси. Следует отметить, что в данном конкретном случае матрица имела последовательность SEQ ID NO:30, и к узлу были присоединены три копии. В следующем примере также получали узел с тремя матрицами, однако матрицы имели другую последовательность. Соответственно, поскольку последовательности матрицы в этих примерах различались, различались и узлы с тремя матрицами.
Готовили следующую реакционную смесь (общий объем 5 мл):
13.2 Методы
Полунепрерывная система была организована, как показано на Фиг. 12.
4 мл гранул PERLOZA и иммобилизованную мутантную лигазу NAD-14 помещали в колонку Pharmacia XK16 (В). Для поддержания температуры колонки при 30°С, с помощью водяного отсека колонки, применяли водяную баню и перистальтический насос (С). Гранулы уравновешивали, пропуская 120 мл (30x объемов колонки) буфера, содержащего 50 мМ KH2PO4 с рН 7,5 в течение 120 минут со скоростью тока 1 мл/мин. Для подачи раствора в колонку Pharmacia XK16 использовали насос AKTA explorer Al (А).
После уравновешивания колонки 5 мл реакционной смеси (хорошо перемешанной на вортексе) загружали в колонку, собирали в пробирку-резервуар (D) и осуществляли рециркуляцию через колонку, используя насос AKTA explorer Al. Реакционную смесь рециркулировали через систему со скоростью тока 1 мл/мин в непрерывном режиме в течение 16 ч. Образцы собирали через 30 мин, 60 мин, 90 мин, 4 часа, 5 часов, 6 часов, 7 часов, 14 часов и 16 часов для анализа методом HPLC.
13.3 Результаты и выводы

Процентное соотношение каждого из сегментов, промежуточного продукта и продукта выражали как площадь пика фракции по отношению к площади пика узла с тремя матрицами.
В заключение, полунепрерывная поточная реакция протекала успешно и через 16 часов реакция была практически завершена.
Пример 14. Разделение олигонуклеотидов различного размера путем фильтрации: а) разделение олигонуклеотида 20-мера (SEQ ID NO:l) и узла, содержащего три некомплементарных олигонуклеотида 20-мера (SEQ ID NO:30); (b) разделение олигонуклеотида 20-мера (SEQ ID NO:l) от гексамерного и октамерного сегментов олигонуклеотида (см. Таблица 1) и узла, содержащего три комплементарных олигонуклеотида 20-мера (SEQ ID NO:2)
14.1 Материалы
Все использованные олигонуклеотиды синтезировали при помощи стандартных твердофазных методов.
Использовали узел с тремя матрицами, описанный в разделе 13.1 (Фиг. 11).
Использовали несколько фильтров с различным номинальным отсечением по молекулярной массе от разных производителей, показанные в Таблицах 23 и 24.
14.2 Методы
14.2.1 Тупиковая фильтрация и протокол для скрининга полимерных мембран (протокол 1)
Установка для тупиковой фильтрации, показанная на Фиг. 13, содержала фильтровальную ячейку МЕТ для тупиковой фильтрации, помещенную в водяную баню, размещенную на магнитной мешалке и нагревательной плитке. Давление внутри ячейки обеспечивалось током азота.
Вначале вырезали образец исследуемой мембраны нужного размера (14 см2) и помещали в ячейку. Сначала мембрану обрабатывали водой для HPLC (200 мл) и затем буфером PBS (200 мл). Затем сбрасывали давление в ячейке, удаляли оставшийся раствор PBS и замещали раствором, содержащим олигонуклеотиды (40 мл олигонуклеотидов в PBS в концентрации 1 г/л). Ячейку помещали на горячую нагревательную плитку с перемешиванием и нагревали раствор до требуемой температуры при перемешивании с помощью магнитной мешалки. Нагнетали давление в ячейке (целевой уровень составлял приблизительно 3,0 бар; фактическое давление в каждом случае регистрировали). Перемешивание раствора либо останавливали, либо продолжали, и собирали раствор пермеата (приблизительно 20 мл) и анализировали методом HPLC. Регистрировали скорость прохождения жидкостей через мембрану. Затем в системе сбрасывали давление, чтобы было возможным отбирать пробы и проводить анализ раствора ретентата методом HPLC. Затем в фильтровальную ячейку добавляли больше буфера PBS (20 мл) и повторяли предыдущую процедуру 3 раза. Наконец, мембрану промывали буфером PBS.
Все образцы анализировали при помощи HPLC без какого-либо разведения.
14.2.2 Тангенциальная фильтрация и протокол для скрининга полимерных мембран (протокол 2)
Установка для тангенциальной фильтрации показана на Фиг. 14. Подающий резервуар (1), представляющий собой коническую колбу, содержал раствор олигонуклеотидов, подлежащих очистке. Раствор прокачивали через ячейку для тангенциальной фильтрации (4), используя насос HPLC (2), при этом поддерживали температуру внутри ячейки с помощью нагревательной плитки (3). Раствор внутри ячейки рециркулировали при помощи шестеренного насоса (6). Измеритель давления (5) позволял измерять давление в ходе эксперимента. Образцы раствора ретентата брали через клапан для отбора проб (7), а образцы раствора пермеата брали из резервуара для сбора пермеата (8).
Вначале вырезали образец исследуемой мембраны нужного размера и помещали в ячейку. Промывали систему раствором PBS (100 мл). Температуру раствора доводили до установленного значения. В систему подавали раствор, содержащий олигонуклеотидные продукты в PBS (7,5 мл с концентрацией 1 г/л). Затем в систему закачивали раствор PBS, используя насос от установки для HPLC при скорости тока, совпадающей со скоростью тока раствора пермеата (как правило, 3 мл/мин). Регистрировали давление при помощи датчика давления. Брали образцы раствора ретентата для анализа методом HPLC при прохождении каждых 5 объемов буфера. Брали образцы раствора пермеата для анализа методом HPLC при прохождении каждого объема буфера. Эксперимент останавливали после диафильтрации 20 объемами буфера.
В случае, когда в эксперименте использовали мембрану Snyder с номинальным отсечением по молекулярной массе 5 кДа (номер лота 120915R2), а также SEQ ID NO:46 и SEQ ID NO:30, описанную выше методику модифицировали следующим образом. Вначале вырезали образец исследуемой мембраны нужного размера и помещали в ячейку. Промывали систему раствором фосфата калия (100 мл, 50 мМ, рН 7,5). Температуру раствора доводили до установленного значения. К этилендиаминтетрауксусной кислоте (EDTA) (230 мкл 500 мМ раствора) добавляли раствор, содержащий олигонуклеотидные продукты в фосфате калия (приблизительно 1 г/л). Затем раствор подавали в систему. Затем в систему закачивали раствор фосфата калия, используя насос от установки для HPLC при скорости тока, совпадающей со скоростью тока раствора пермеата (как правило, 4 мл/мин). Регистрировали давление при помощи датчика давления. Брали образцы раствора ретентата для анализа методом HPLC при прохождении каждых 5 объемов буфера. Брали образцы раствора пермеата для анализа методом HPLC при прохождении каждого объема буфера. Эксперимент останавливали после диафильтрации 15 объемами буфера.
14.3 Результаты.

MWCO = номинальное отсечение по молекулярной массе
В эксперименте с использованием мембраны NADIR с MWCO 10 кДа при 60°С было продемонстрировано четкое разделение продукта с последовательностью SEQ ID NO:1 и некомплементарным узлом с тремя матрицами (включающими SEQ ID NO:30). На Фиг. 15 показана а) хроматограмма раствора ретентата, остающегося в фильтровальной ячейке и преимущественно содержащего узел с тремя матрицами после диафильтрации 2 объемами буфера; и b) хроматограмма пермеата, обогащенного продуктом раствора, после диафильтрации 2 объемами буфера.


MWCO = номинальное отсечение по молекулярной массе
* концентрация растворенных веществ слишком низкая, чтобы провести полноценный анализ
В эксперименте с использованием мембраны Snyder с MWCO 5 кДа при 50°С и давлении 3,0 бар продемонстрировали четкое разделение сегментов с последовательностями, приведенными в Таблице 1, и комплементарного узла с тремя матрицами (включающими SEQ ID NO:2) и продукта (SEQ ID NO:l). На Фиг. 16 показана а) хроматограмма раствора ретентата, преимущественно содержащего узел с тремя матрицами и продукт после диафильтрации 20 объемами буфера; и b) хроматограмма пермеата, преимущественно содержавшего олигонуклеотидные сегменты, после диафильтрации 20 объемами буфера.
В эксперименте с использованием мембраны Snyder с MWCO 5 кДа при 80°С и давлении 3,1 бар продемонстрировали четкое разделение комплементарного узла с тремя матрицами (включающим SEQ ID NO:2) и продукта (SEQ ID NO:1). На Фиг. 17 показана а) хроматограмма раствора ретентата, содержавшего только узел с тремя матрицами после диафильтрации 20 объемами буфера; и b) хроматограмма раствора пермеата, содержавшего только продукт, после диафильтрации двумя объемами буфера.
14.4. Выводы
Олигонуклеотиды различной длины и молекулярной массы могут быть разделены при помощи фильтрации. Как показано выше, на степень разделения влияют тип мембраны и условия, такие как температура. Для заданного набора олигонуклеотидов с различной длиной/молекулярной массой, можно подобрать подходящие мембраны и условия для обеспечения надлежащего разделения. Например, авторы изобретения показали, что олигонуклеотидные сегменты (короткие олигонуклеотиды длиной 6 и 8 нуклеотидов), приведенные в Таблице 1, могут быть отделены от олигонуклеотидного продукта (олигонуклеотид 20-мер, имеющий последовательность SEQ ID NO:1) и узла с тремя матрицами (содержащего 3 олигонуклеотида длиной 20 нуклеотидов с последовательностью SEQ ID NO:2, присоединенные к твердому носителю), а олигонуклеотидный продукт и узел с тремя матрицами, в свою очередь, могут быть отделены друг от друга.
Общие выводы
Авторы изобретения показали, что возможно синтезировать олигонуклеотиды, включая олигонуклеотиды со спектром терапевтически значимых химических модификаций, в растворе путем сборки коротких олигонуклеотидных сегментов на комплементарной матрице, лигирования сегментов друг с другом и отделения олигонуклеотидного продукта как от примесей, так и от его комплементарной матрицы, используя эффективный способ, который является масштабируемым и подходит для крупномасштабного производства терапевтических олигонуклеотидов.
Благодаря синтезу олигонуклеотидов в растворе авторам изобретения удалось избежать ограничений, накладываемых твердофазными методами. Используя присущие ДНК свойства специфически распознавать комплементарные последовательности и связывать комплементарные последовательности с аффинностью, которая отражает как степень совпадения комплементарной последовательности, так и длину комплементарной последовательности, авторы изобретения смогли получить олигонуклеотиды высокой чистоты, не требующие хроматографической очистки. Это позволило улучшить эффективность способа получения и масштабируемость способа. Выделение матрицы в неизменном состоянии в ходе процесса разделения позволило авторам изобретения повторно использовать матрицу в последующих циклах синтеза и благодаря этому избежать экономических потерь, связанных с необходимостью создания одного эквивалента матрицы для каждого эквивалента образующегося олигонуклеотидного продукта.
В заключение, несмотря на то, что лигазы дикого типа эффективно лигируют нормальную ДНК, авторы изобретения показали, что модификации ДНК приводят к снижению эффективности лигирования, и множество модификаций ДНК оказывает аддитивный эффект, снижая эффективность лигирования, что в некоторых случаях может сделать ДНК-лигазу полностью неэффективной. Авторы изобретения показали, что благодаря соответствующим мутациям и изменениям ДНК-лигаз эффективность лигирования может быть восстановлена и надлежащим образом модифицированные ДНК-лигазы эффективно катализируют синтез олигонуклеотидов, содержащих множественные модификации.
Перечень последовательностей




SEQ ID NO:1

SEQ ID NO:2

SEQ ID NO:3

SEQ ID NO:4

SEP IQ NO:5

SEQ ID NO:6

SEQ ID NO:7

SEQ ID NO:8

SEQ ID NO:9


SEQ ID NO:10

SEQ ID NO:11

SEQ ID NO:12


SEQ ID NO:13

SEQ ID NO:14

SEQ ID NO:15


SEQ ID NO:16

SEQ ID NO:17

SEQ ID NO:18

SEQ ID NO:19

SEQ ID NO:20

SEQ ID NO:21

SEQ ID NO:22


SEQ ID NO:23

SEQ ID NO:24

SEQ ID NO:25
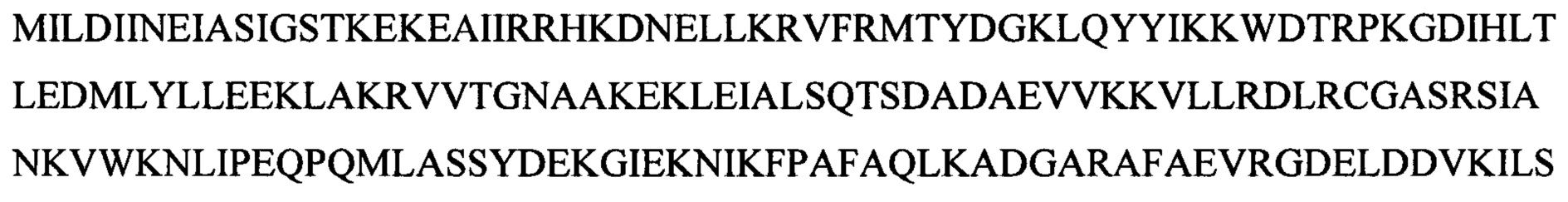

SEQ ID NO:26

SEQ ID NO:27

SEQ ID NO:28


SEQ ID NO:29

SEQ ID NO:30

SEQ ID NO:31

SEQ ID NO:32

SEQ ID NO:33

SEQ ID NO:34

SEQ ID NO:35

SEQ ID NO:36

SEQ ID NO:37

SEQ ID NO:38

SEQ ID NO:39

SEQ ID NO:40

SEQ ID NO:41

SEQ ID NO:42
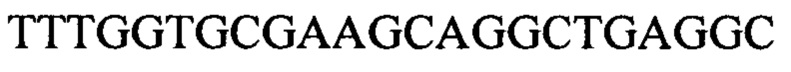
SEQ ID NO:43

SEQ ID NO:44
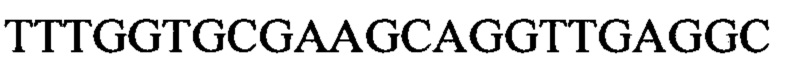
SEQ ID NO:45
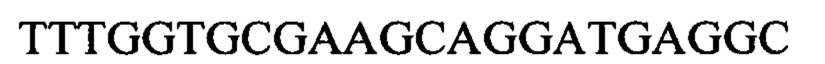
SEQ ID NO:46

SEQ ID NO:47

SEQ ID NO:48

SEQ ID NO:49

SEQ ID NO:50


SEQ ID NO:51

SEQ ID NO:52

SEQ ID NO:53

SEQ ID NO:54

SEQ ID NO:55


SEQ ID NO:56

SEQ ID NO:57

SEQ ID NO:58

SEQ ID NO:59


SEQ ID NO:60

SEQ ID NO:61

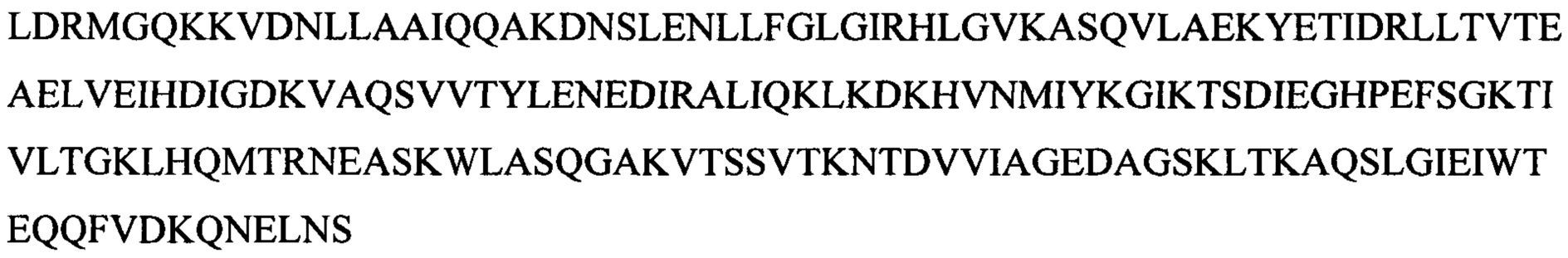
SEQ ID NO:62

Реферат
Изобретение относится к способам получения олигонуклеотидных продуктов, которые могут быть использованы в фармацевтической промышленности. Предложен способ получения одноцепочечного олигонуклеотидного продукта длиной от 10 до 200 нуклеотидов, имеющего по меньшей мере один нуклеотидный остаток, модифицированный в положении 2’ сахаридной группировки, нуклеотидном основании или остове, в граммовом, или килограммовом, или большем масштабе, и/или в реакторе объемом 1 л или более, где берут олигонуклеотидную матрицу (I), комплементарную последовательности продукта, где матрица присоединена к материалу-носителю; берут пул олигонуклеотидов (II), представляющих собой сегменты последовательности продукта длиной от 3 до 15 нуклеотидов, где по меньшей мере один сегмент содержит по меньшей мере один вышеуказанный модифицированный нуклеотидный остаток; приводят в контакт (I) и (II) в условиях, обеспечивающих отжиг; соединяют олигонуклеотидные сегменты при помощи ферментативного лигирования с использованием лигазы с образованием продукта; изменяют условия для отделения любых примесей, в том числе осуществляют денатурацию гибридизованной матрицы и примесных олигонуклеотидных цепей и отделяют примеси; изменяют условия для отделения продукта, в том числе осуществляют денатурацию гибридизованной матрицы и цепей олигонуклеотидного продукта и отделяют продукт; и подвергают переработке матрицу для использования в будущих реакциях. Также предложен способ получения двухцепочечного олигонуклеотидного продукта, где 2 комплементарных одноцепочечных олигонуклеотида получают вышеуказанным способом и затем смешивают в условиях, обеспечивающих отжиг. Предложены новые эффективные способы получения олигонуклеотидных продуктов, позволяющие получать олигонуклеотиды в больших количествах. 2 н. и 15 з.п. ф-лы, 17 ил., 24 табл., 14 пр.

Комментарии