Конструкции нуклеиновой кислоты, содержащие кластер генов биосинтеза пирипиропена и маркерный ген - RU2576001C2
Код документа: RU2576001C2
Чертежи



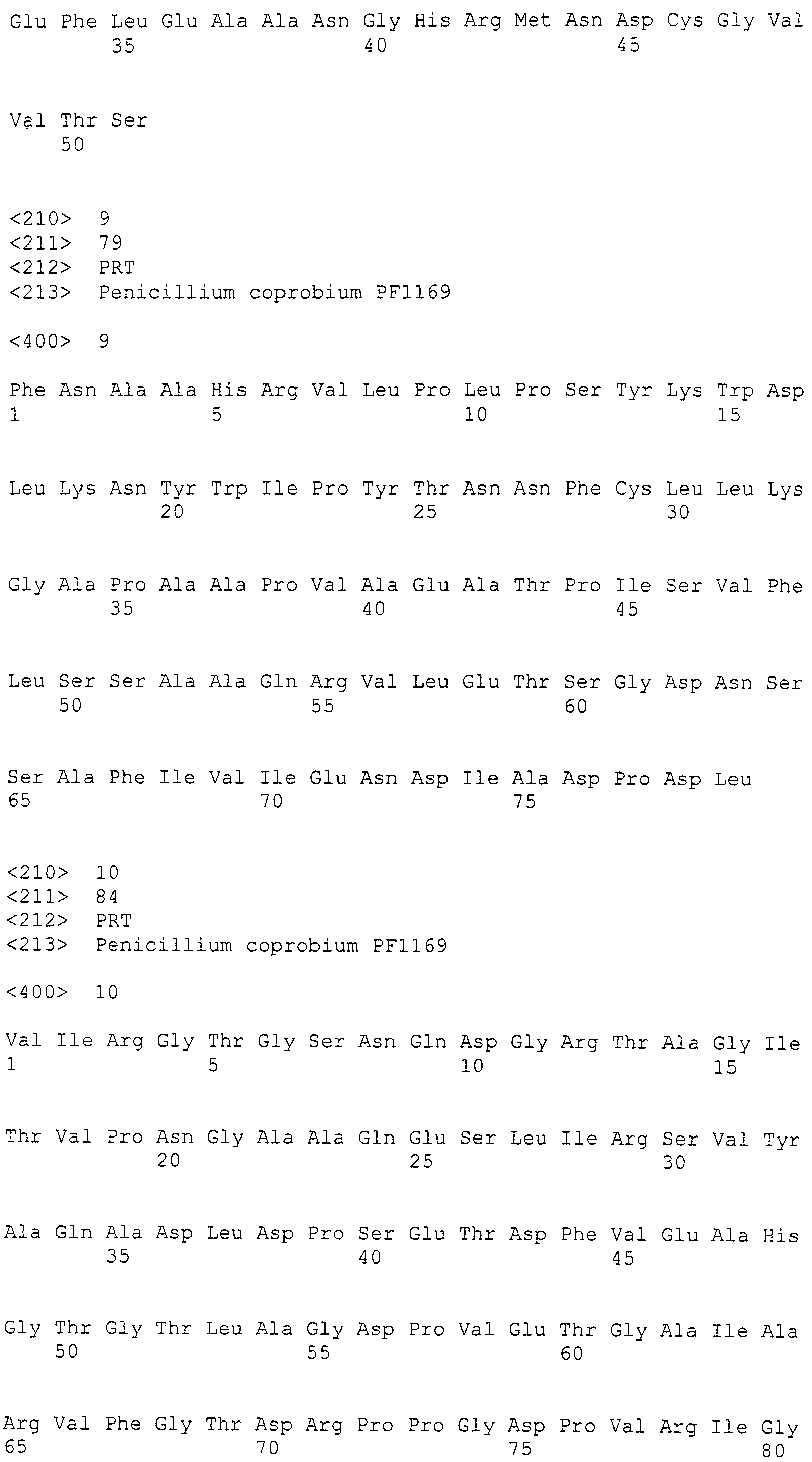



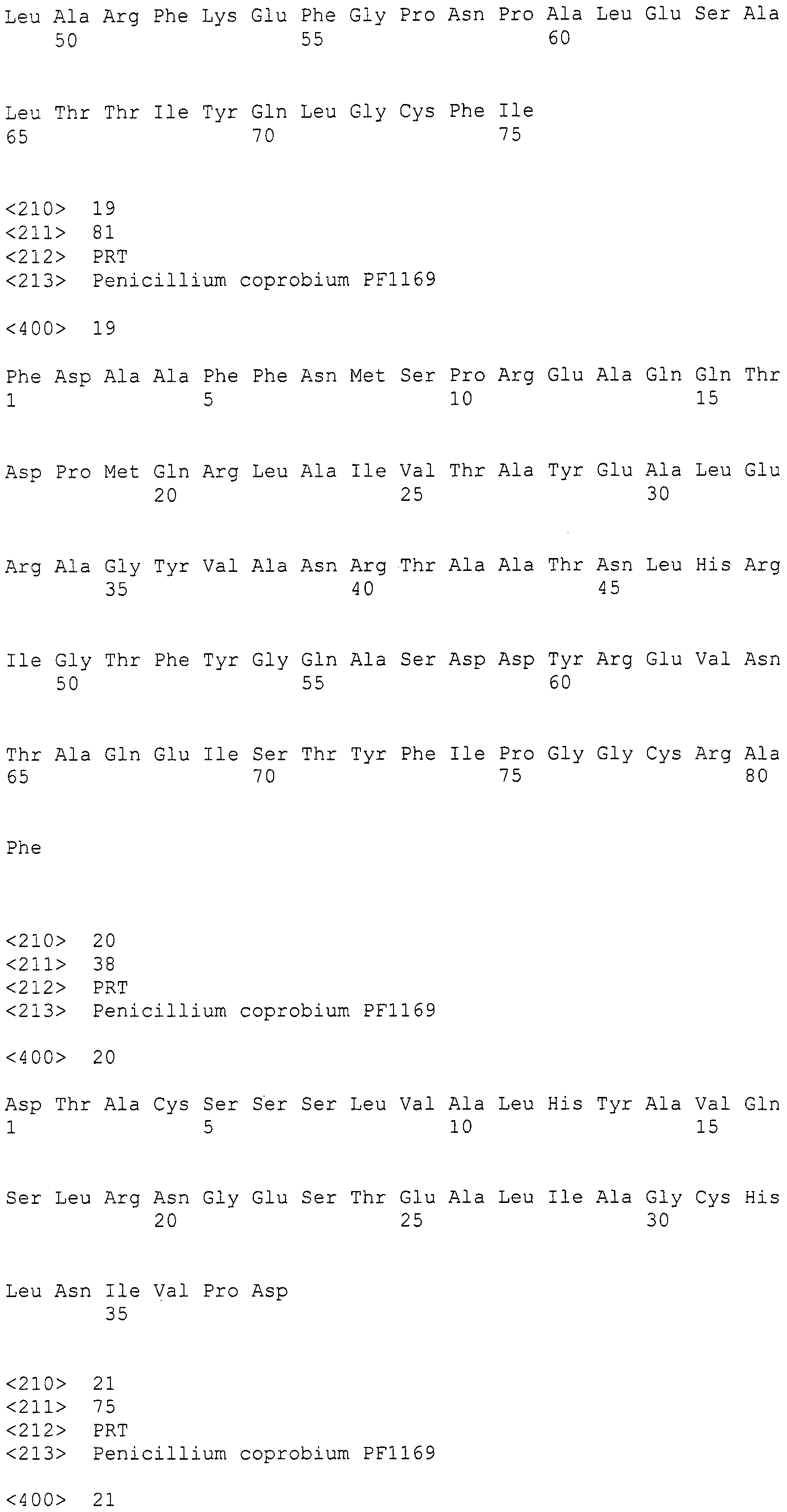

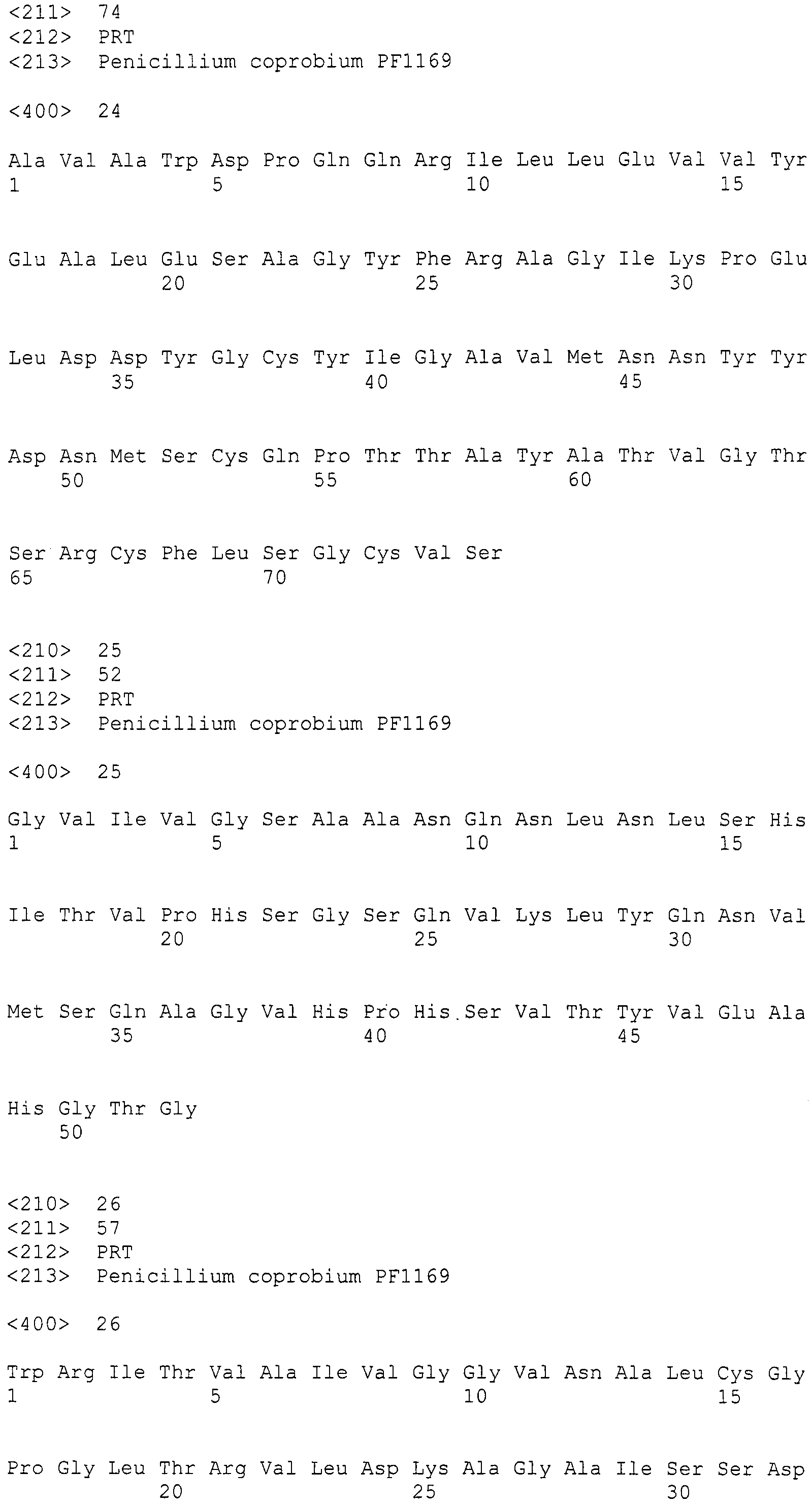
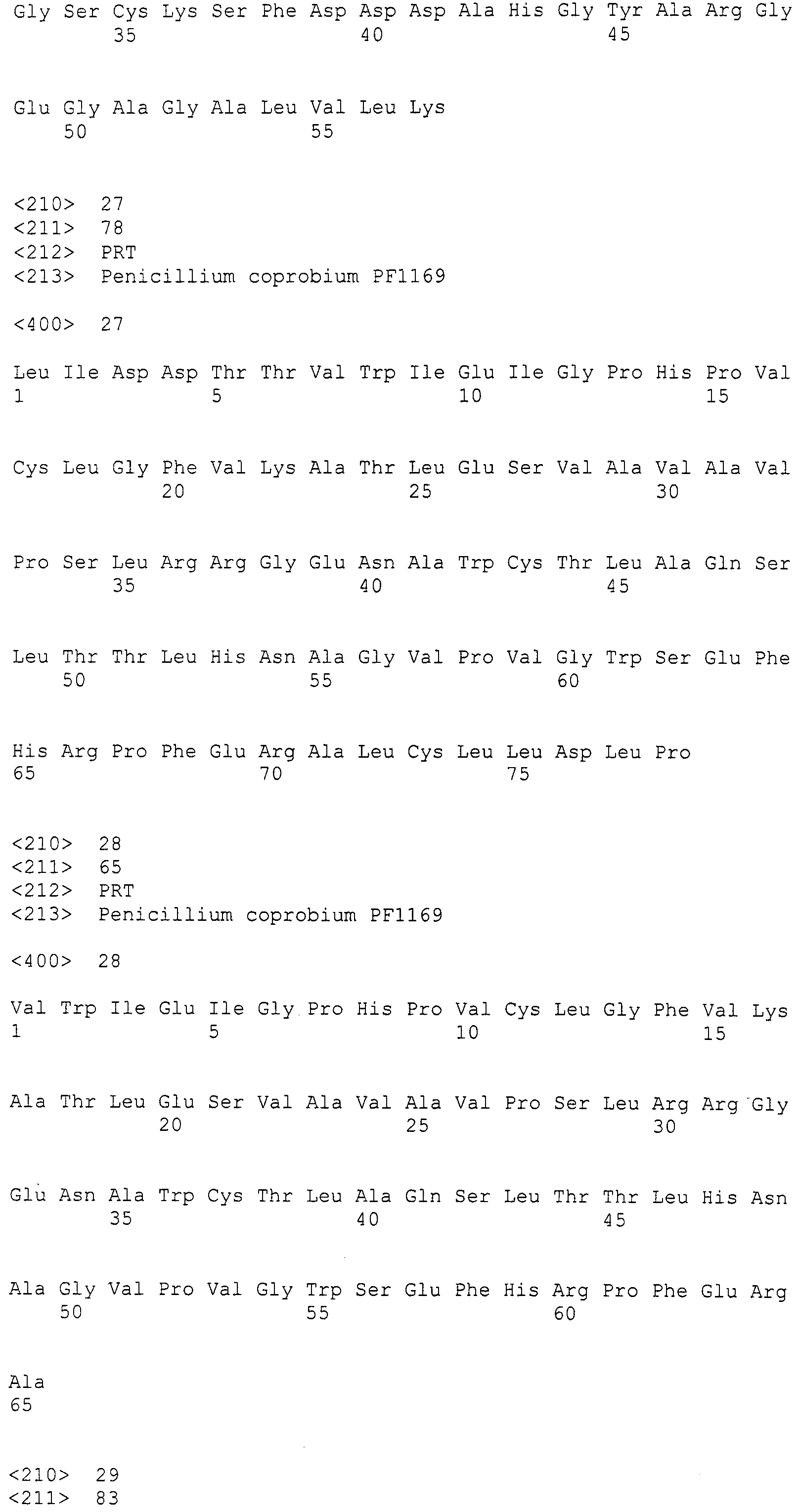










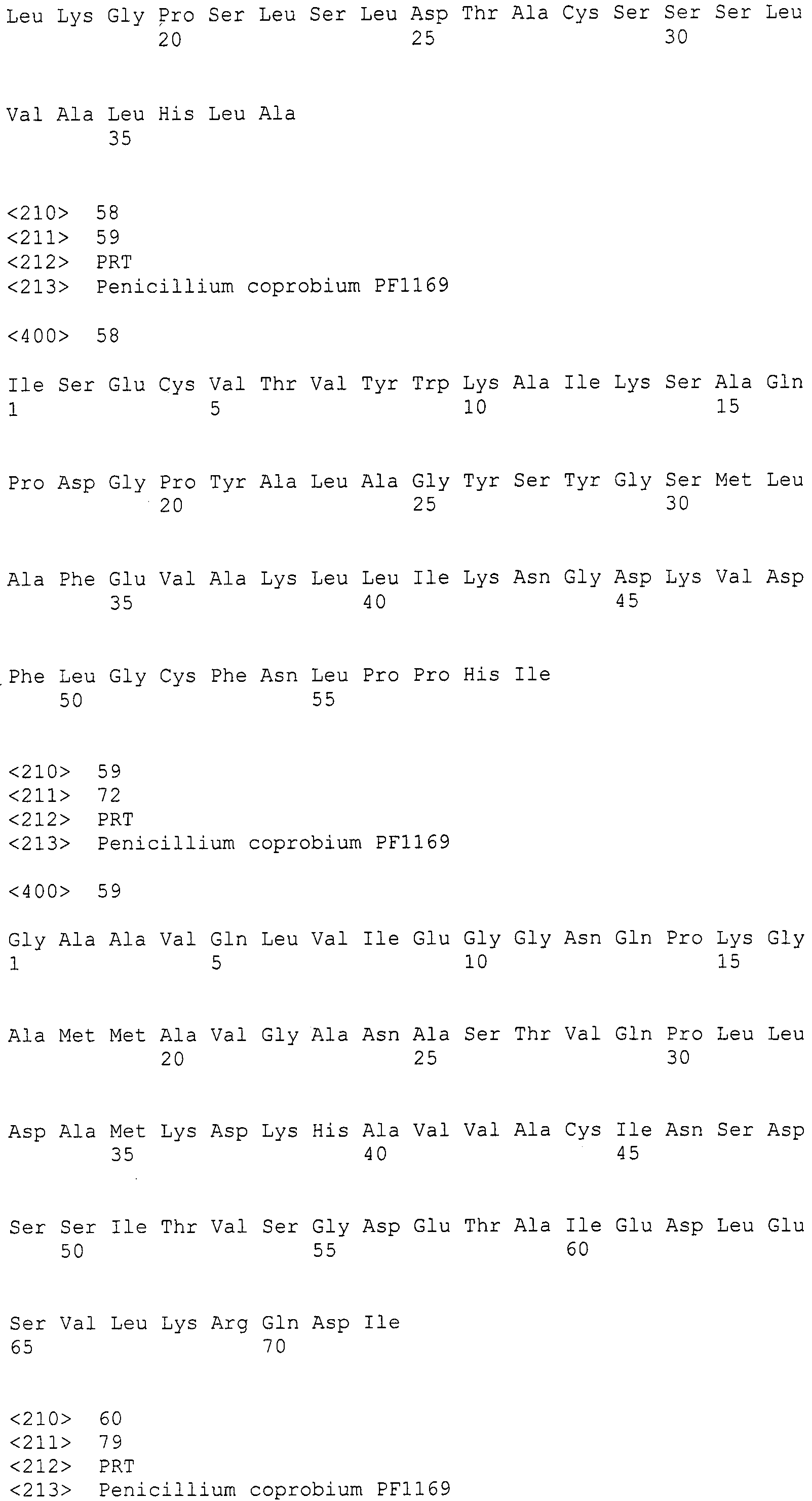
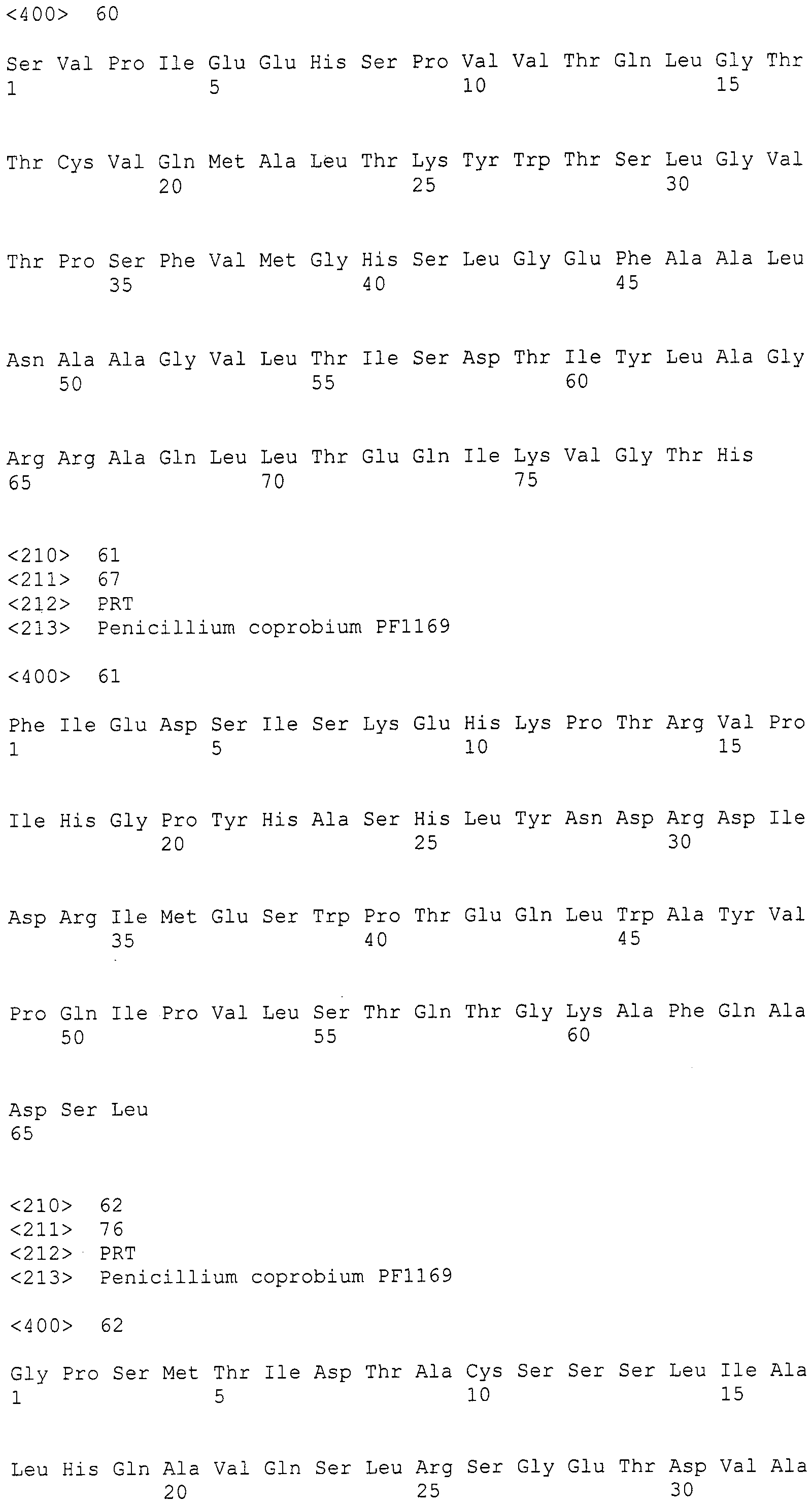













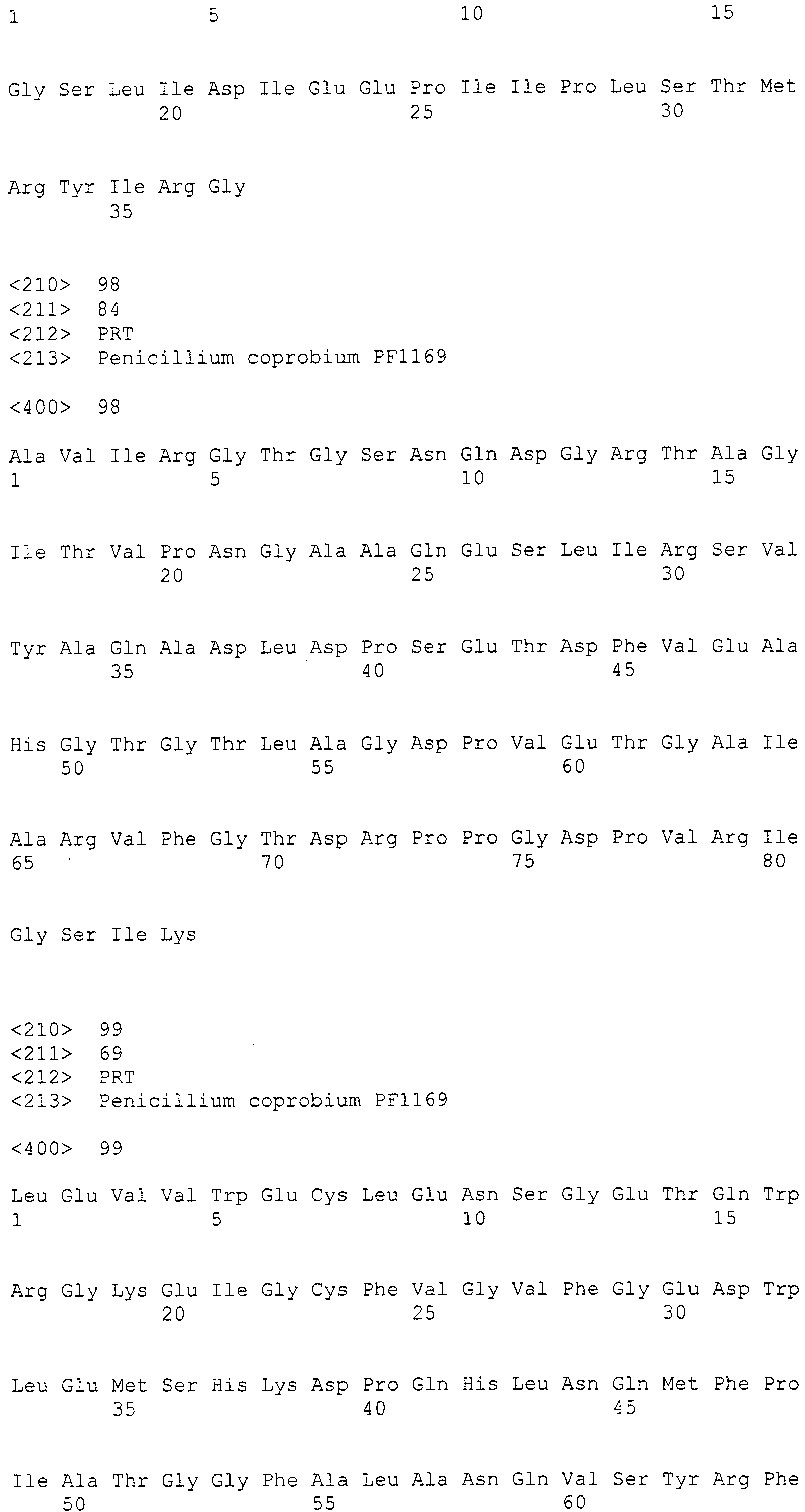

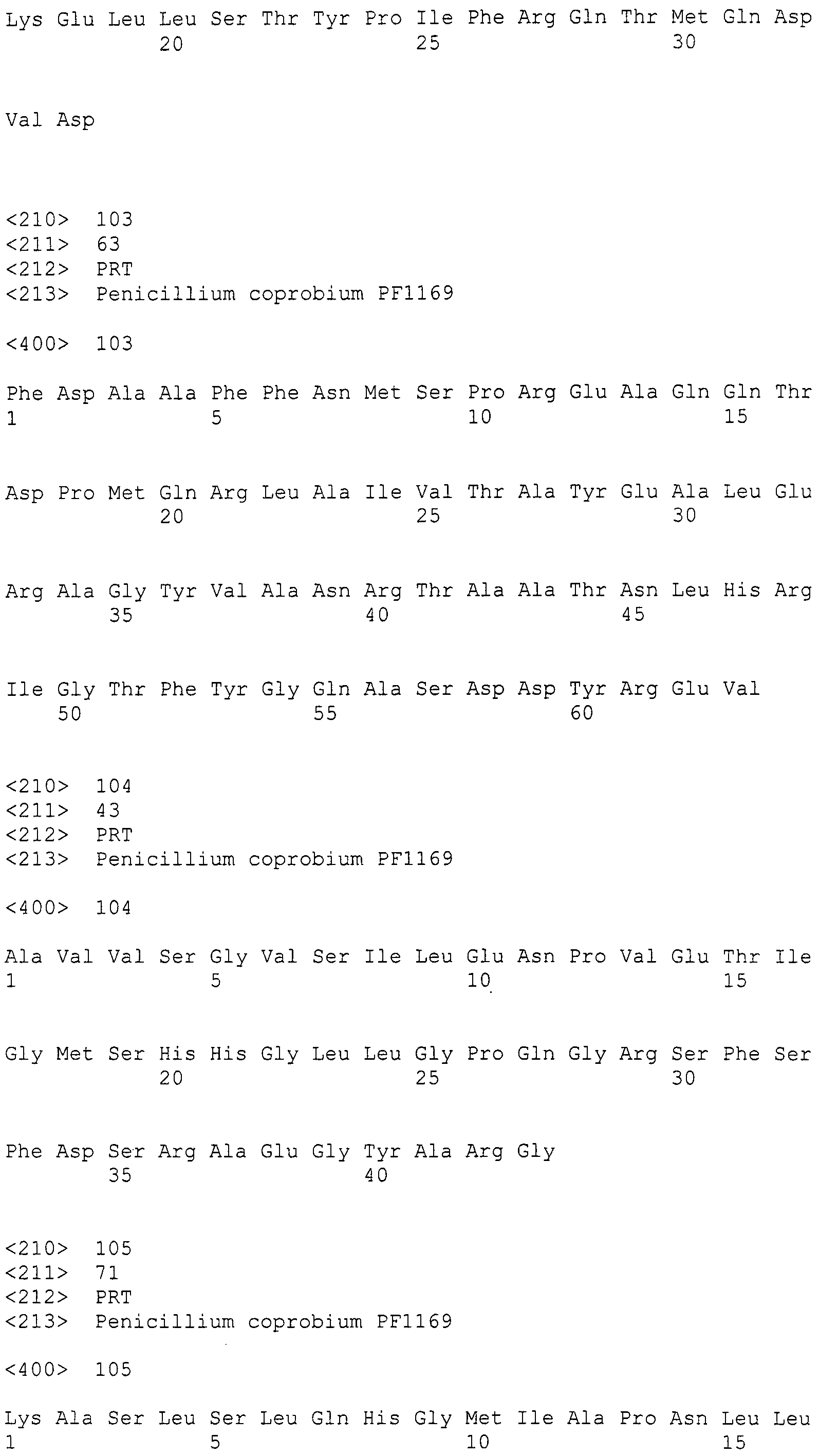



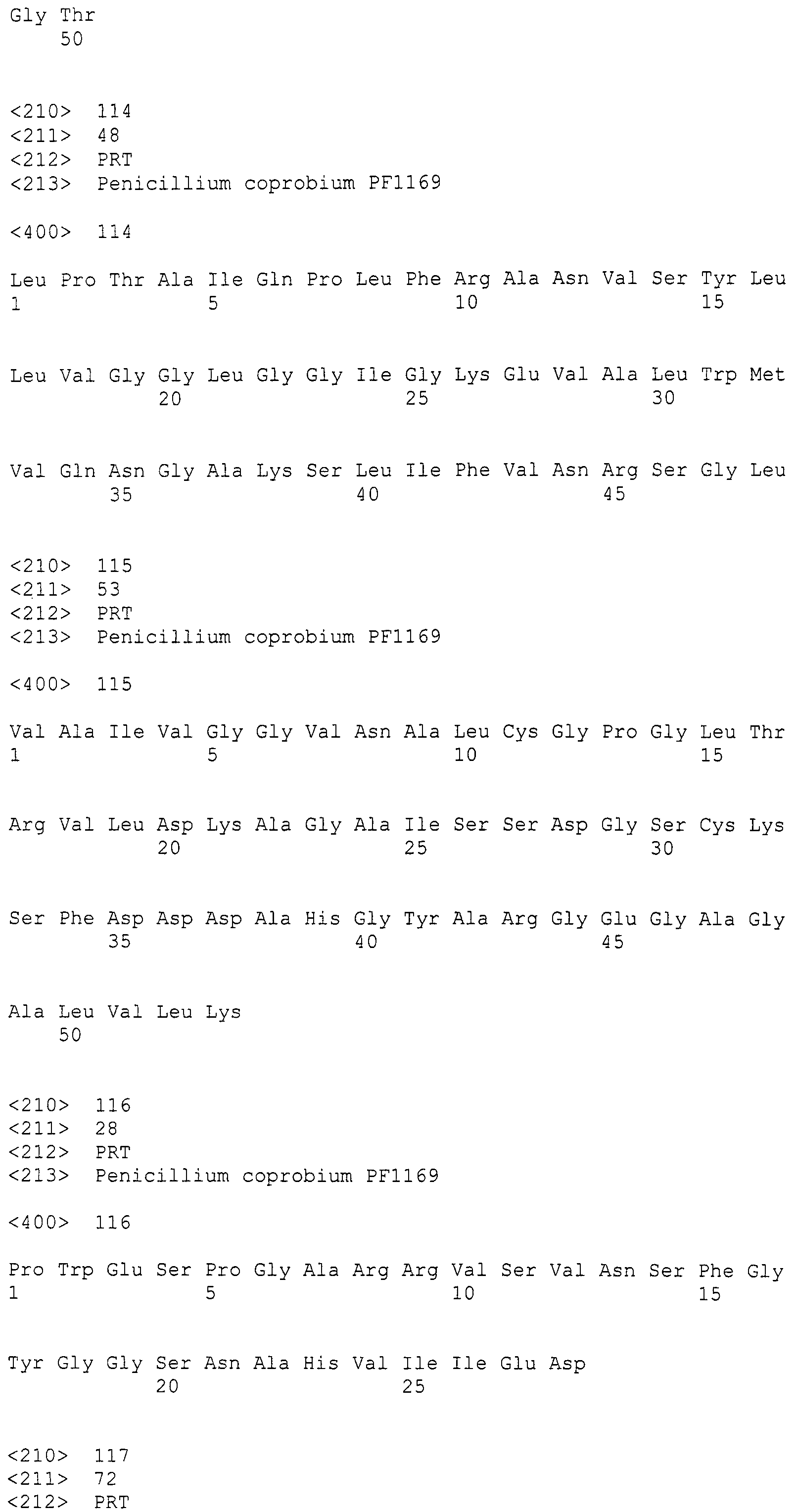




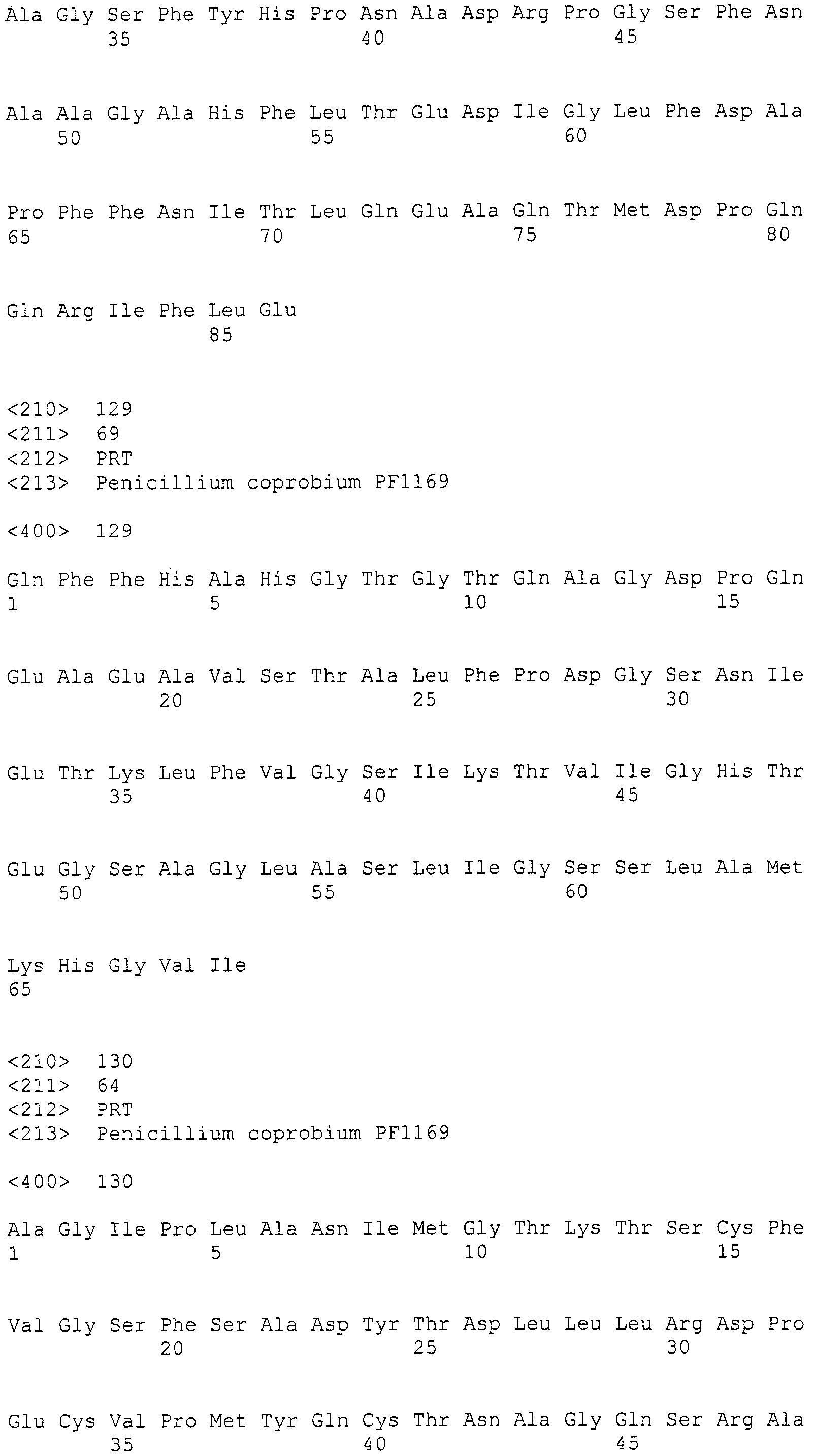
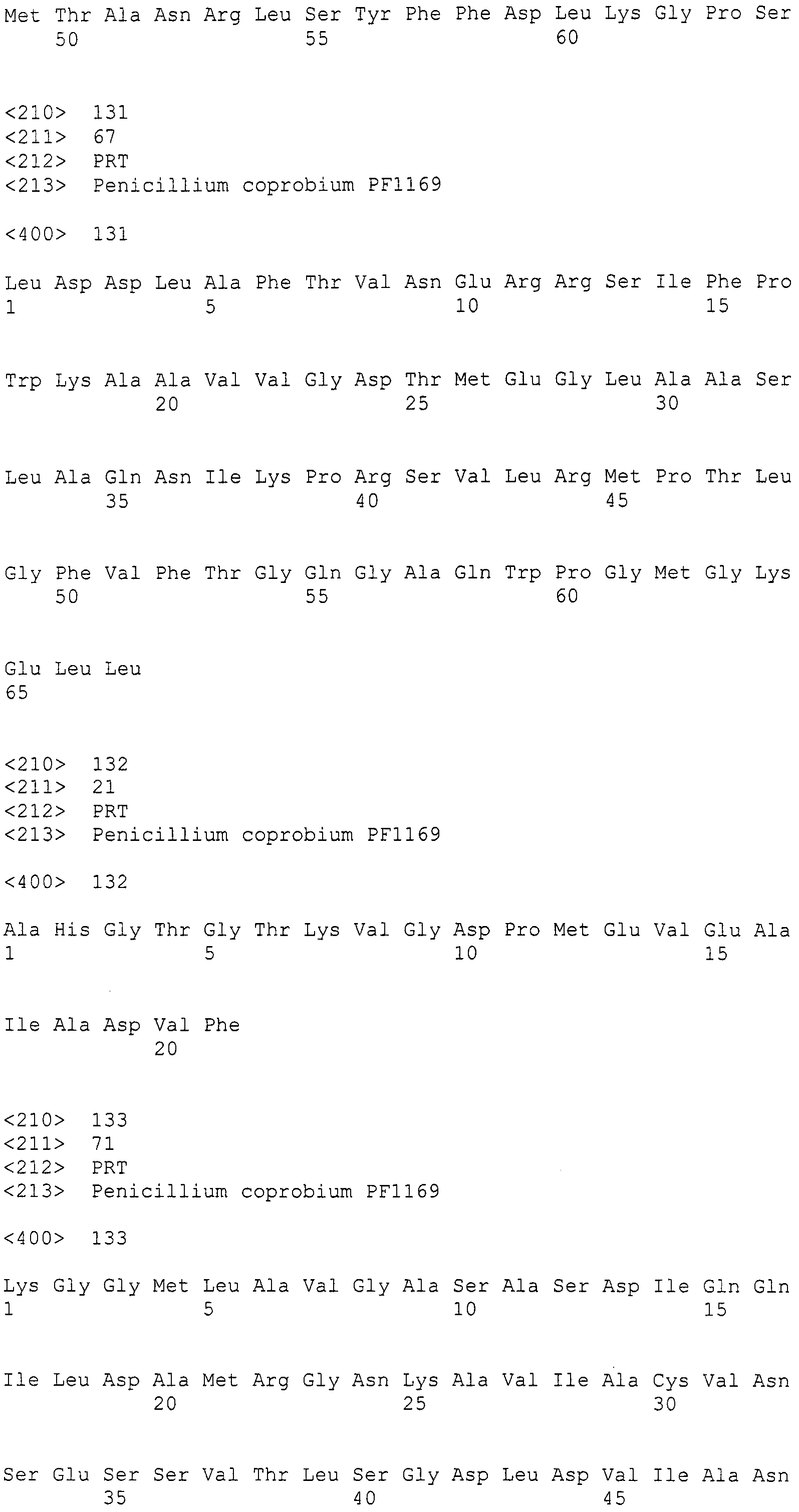
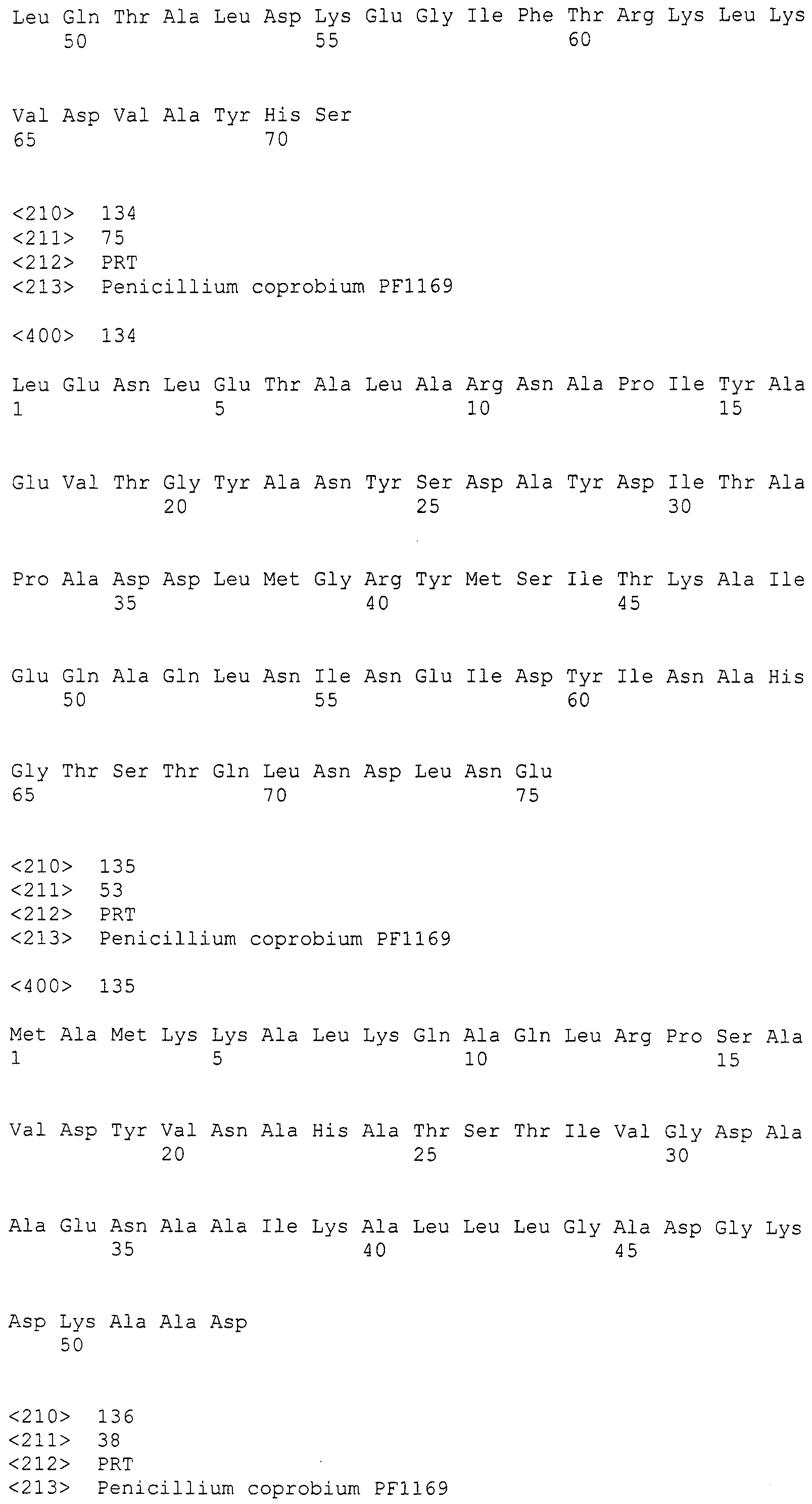

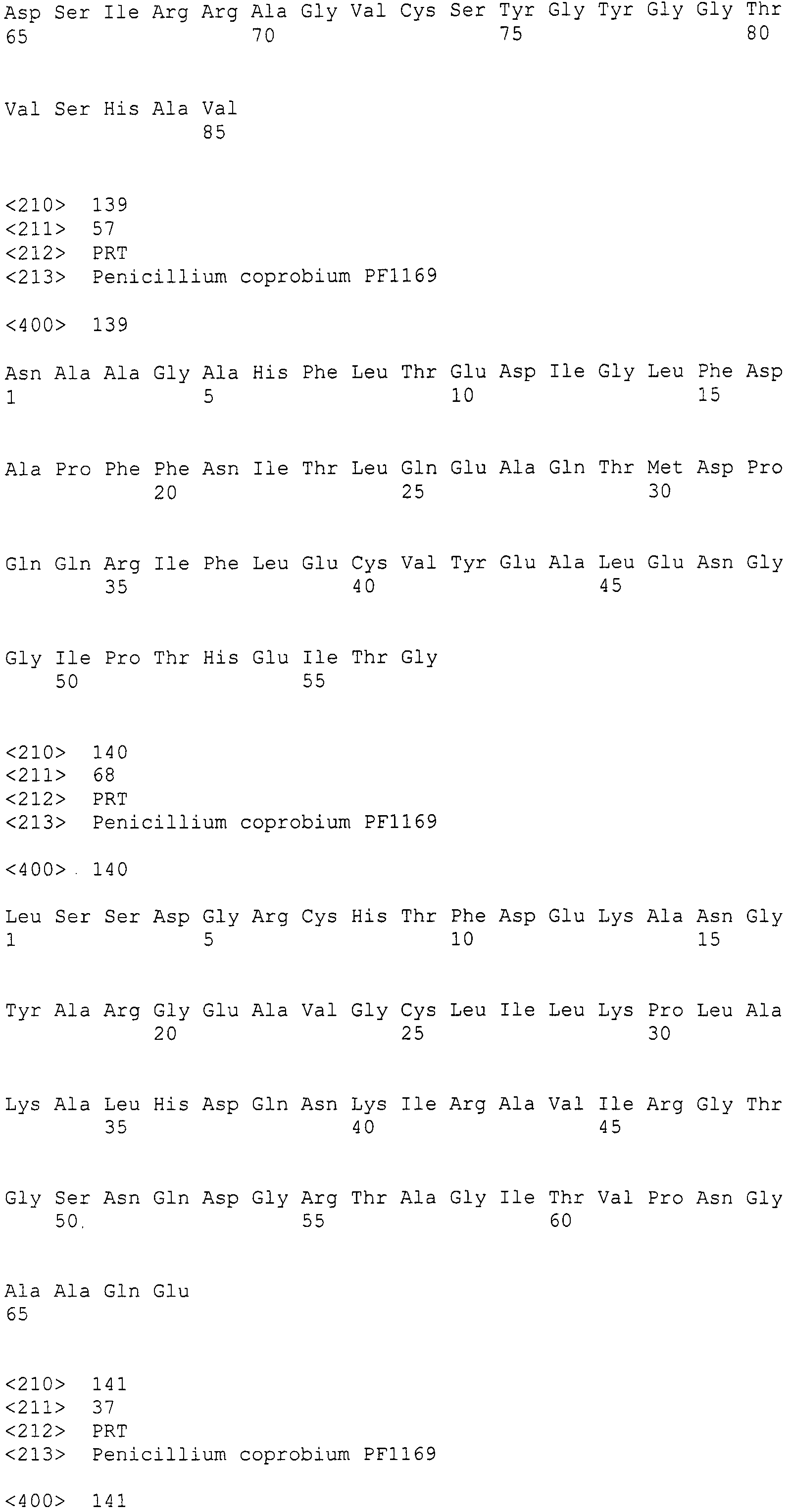



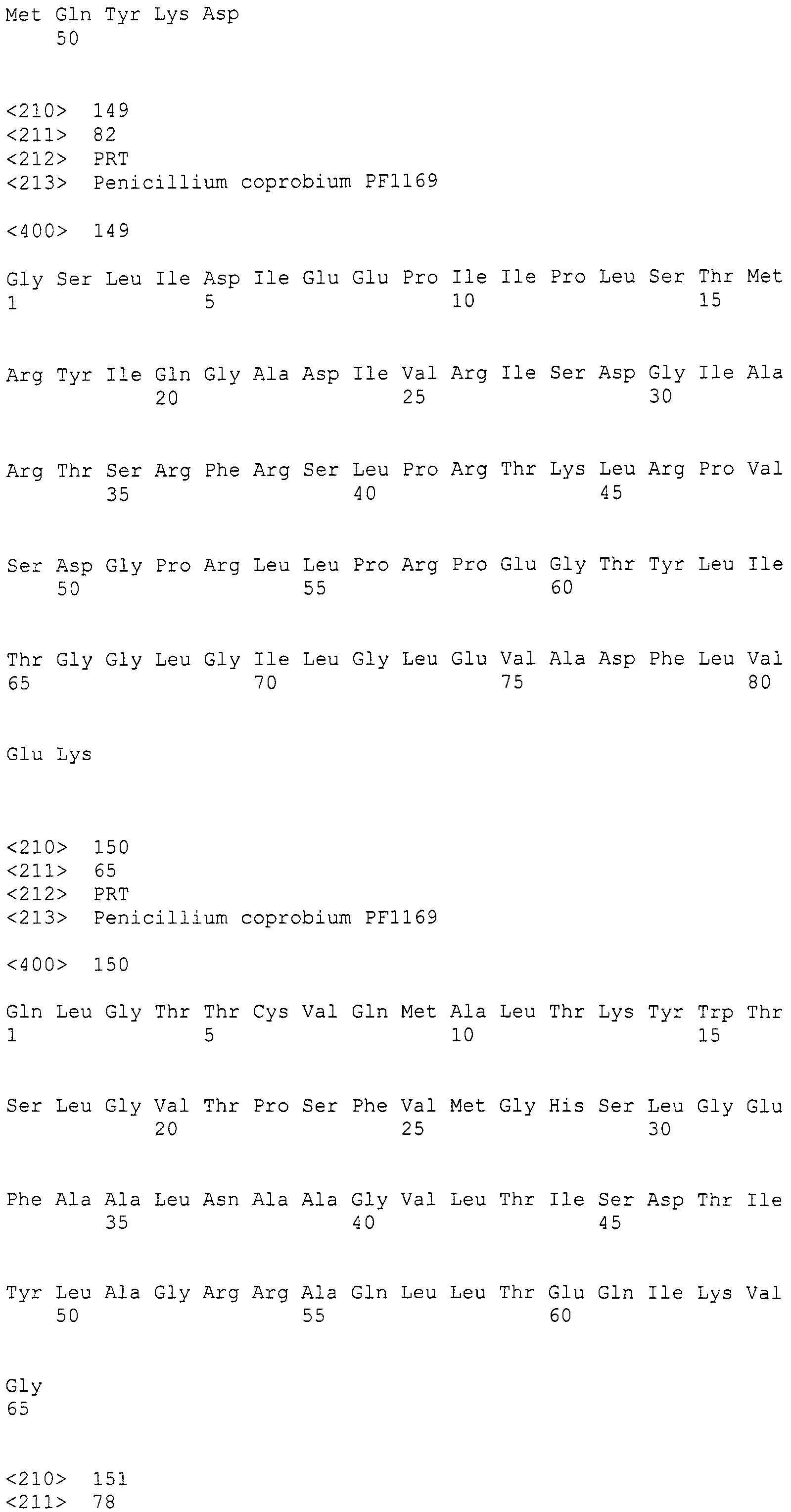



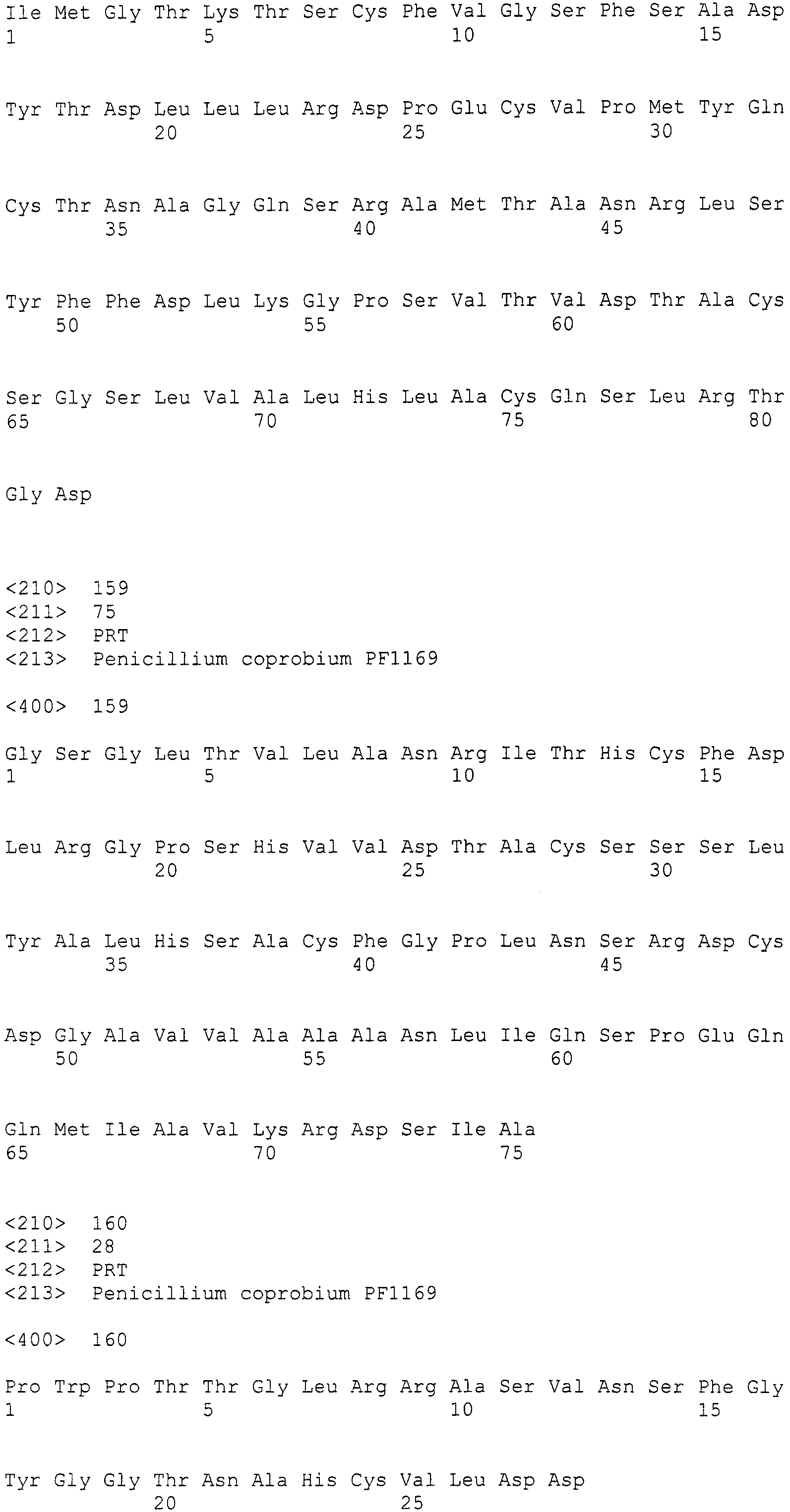






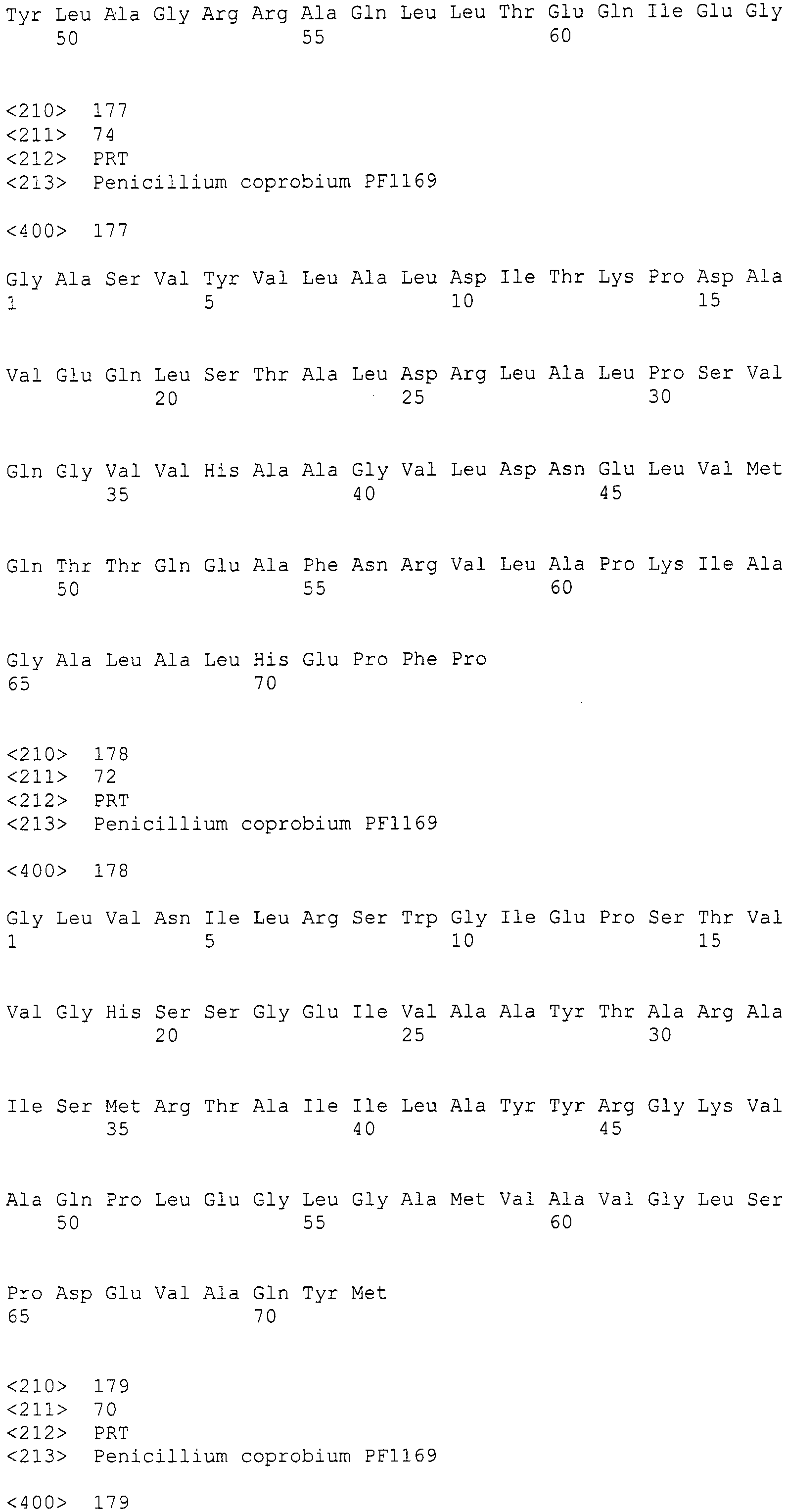
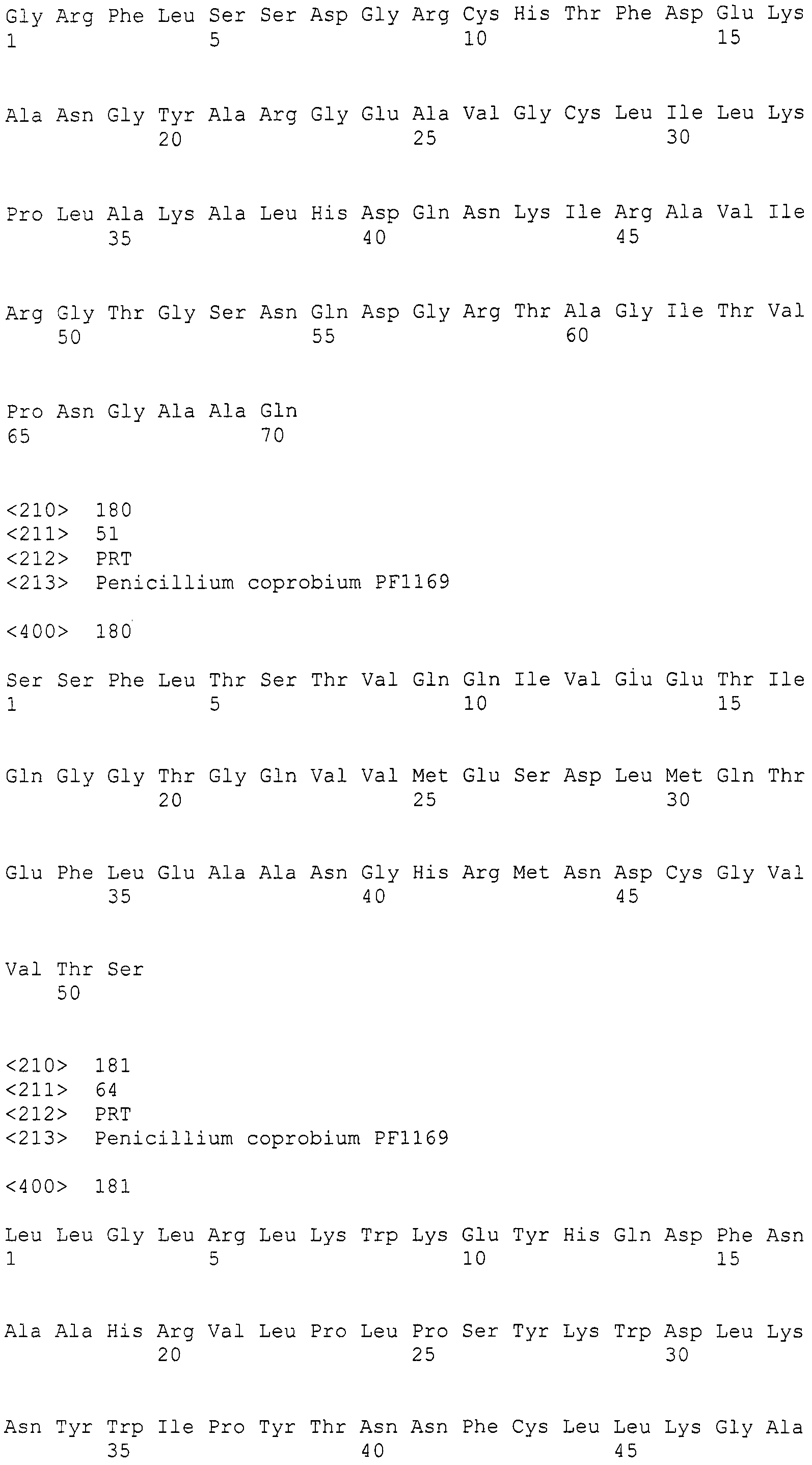





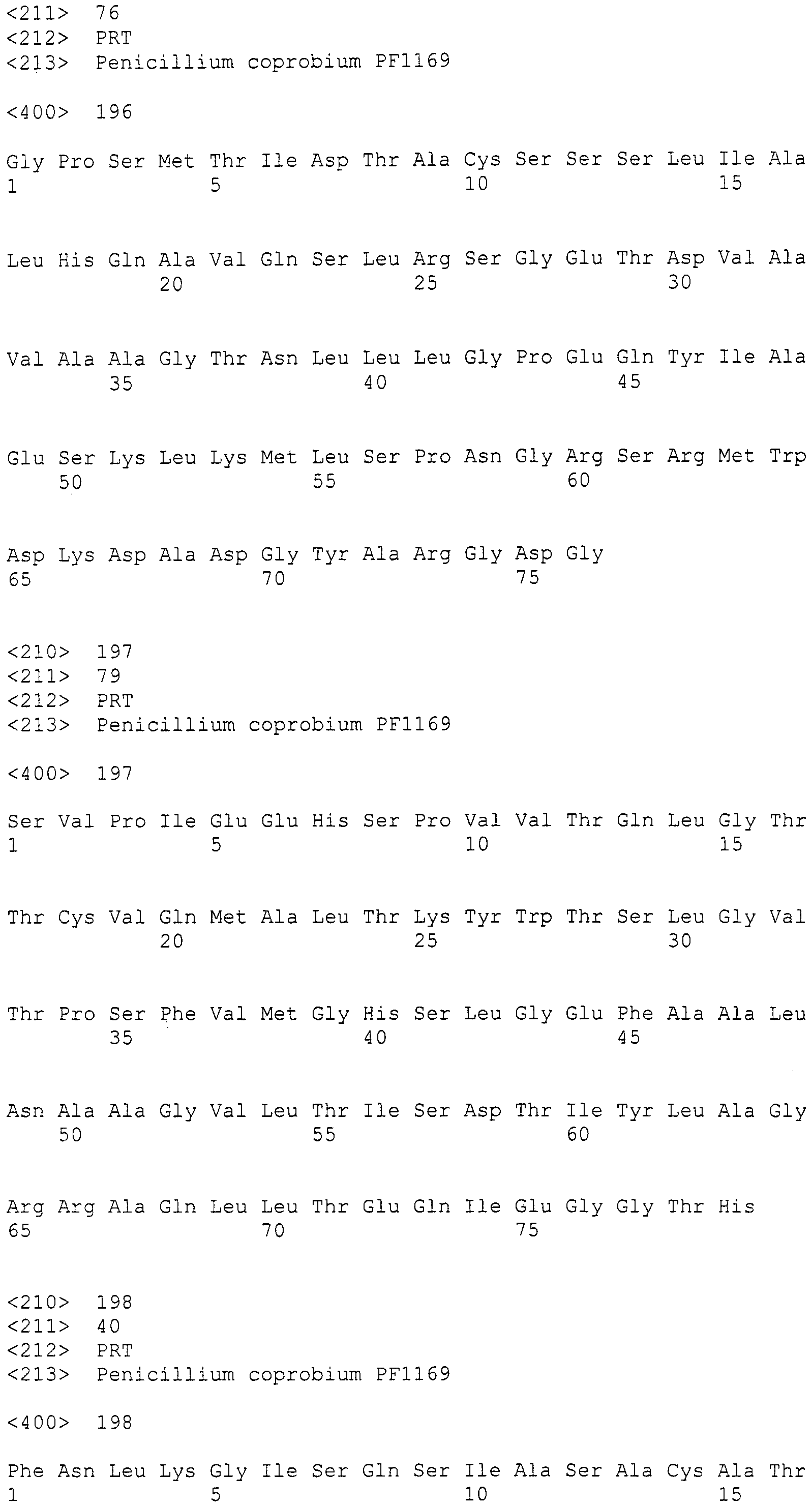



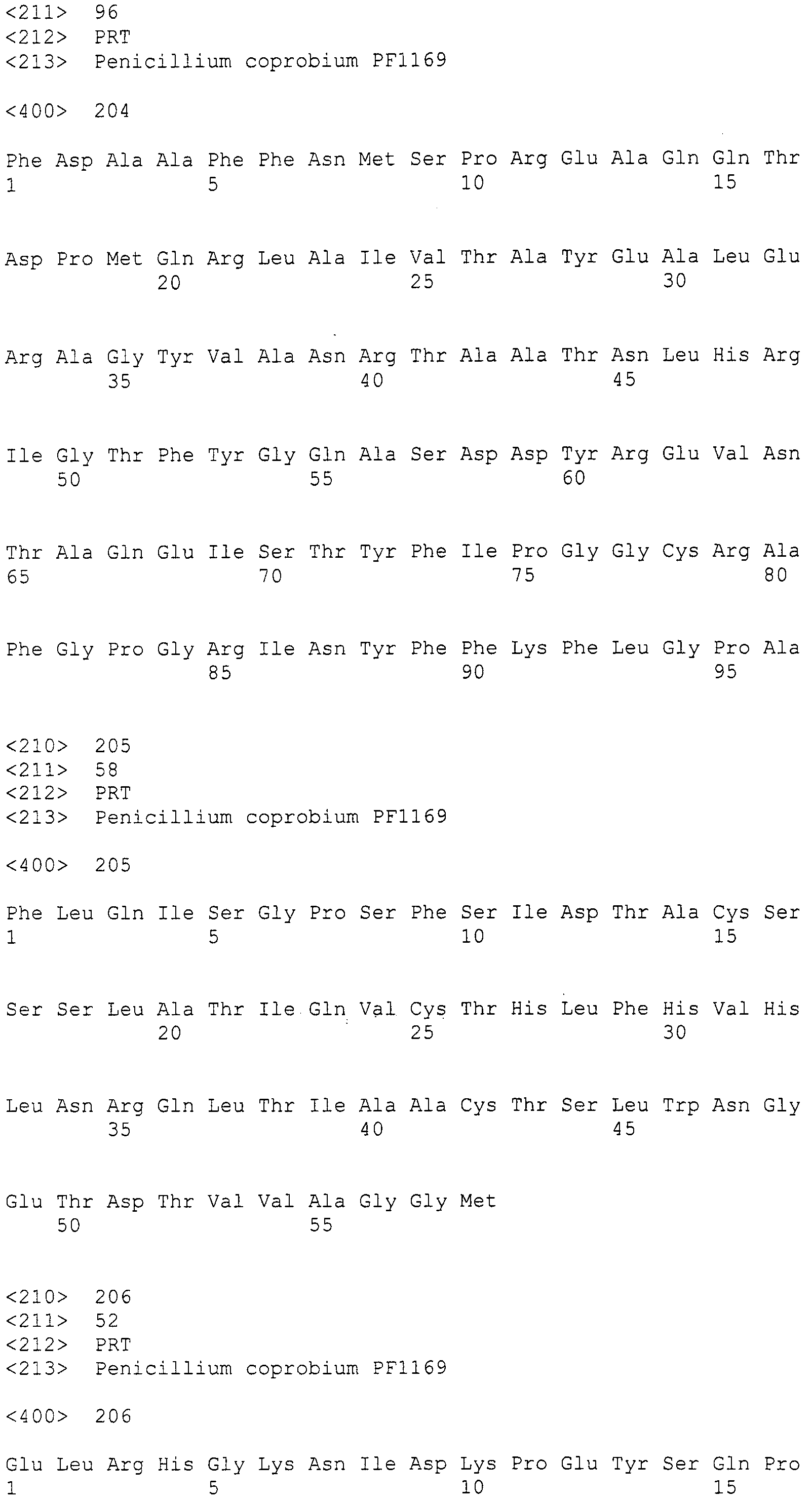

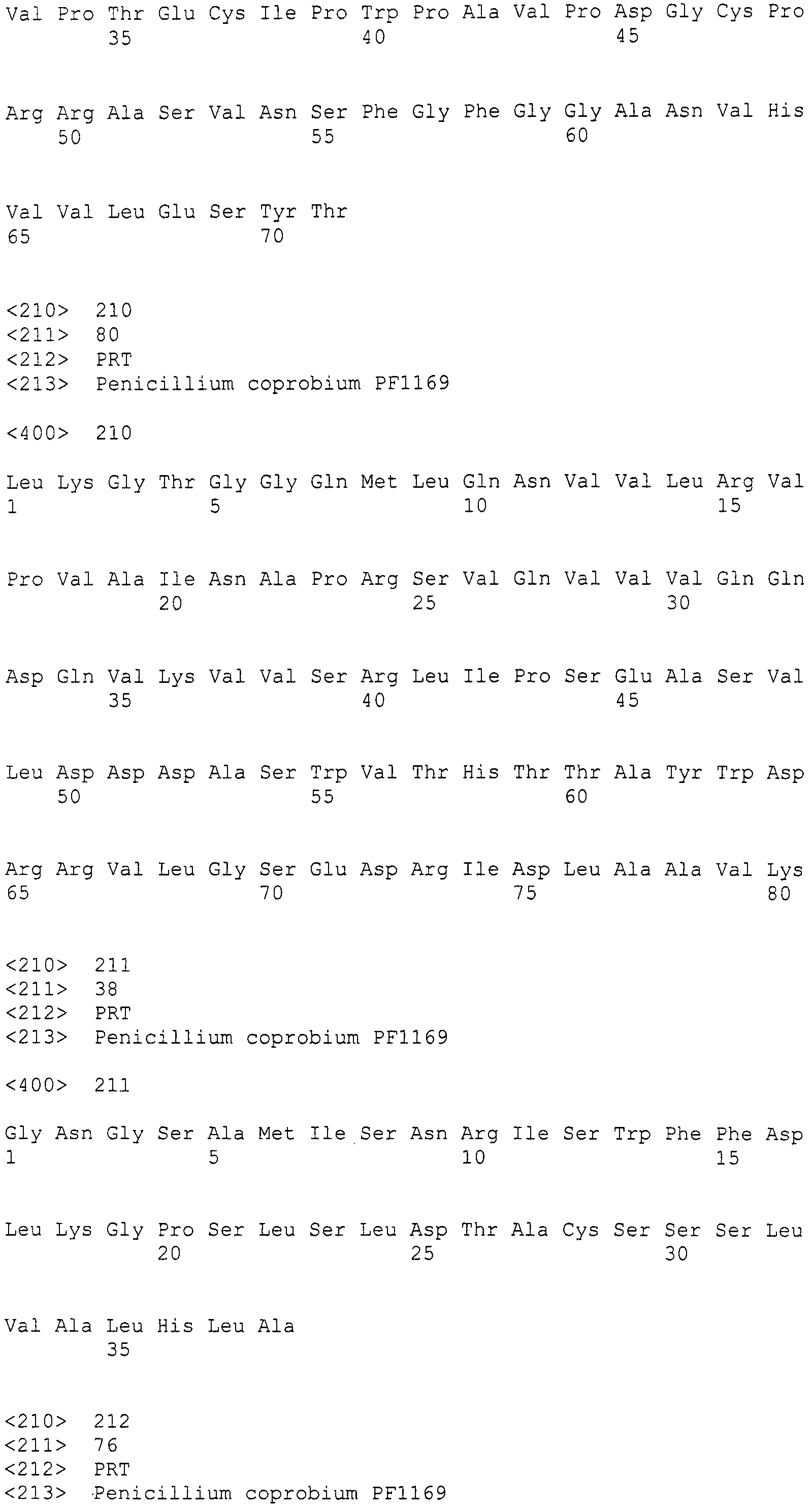


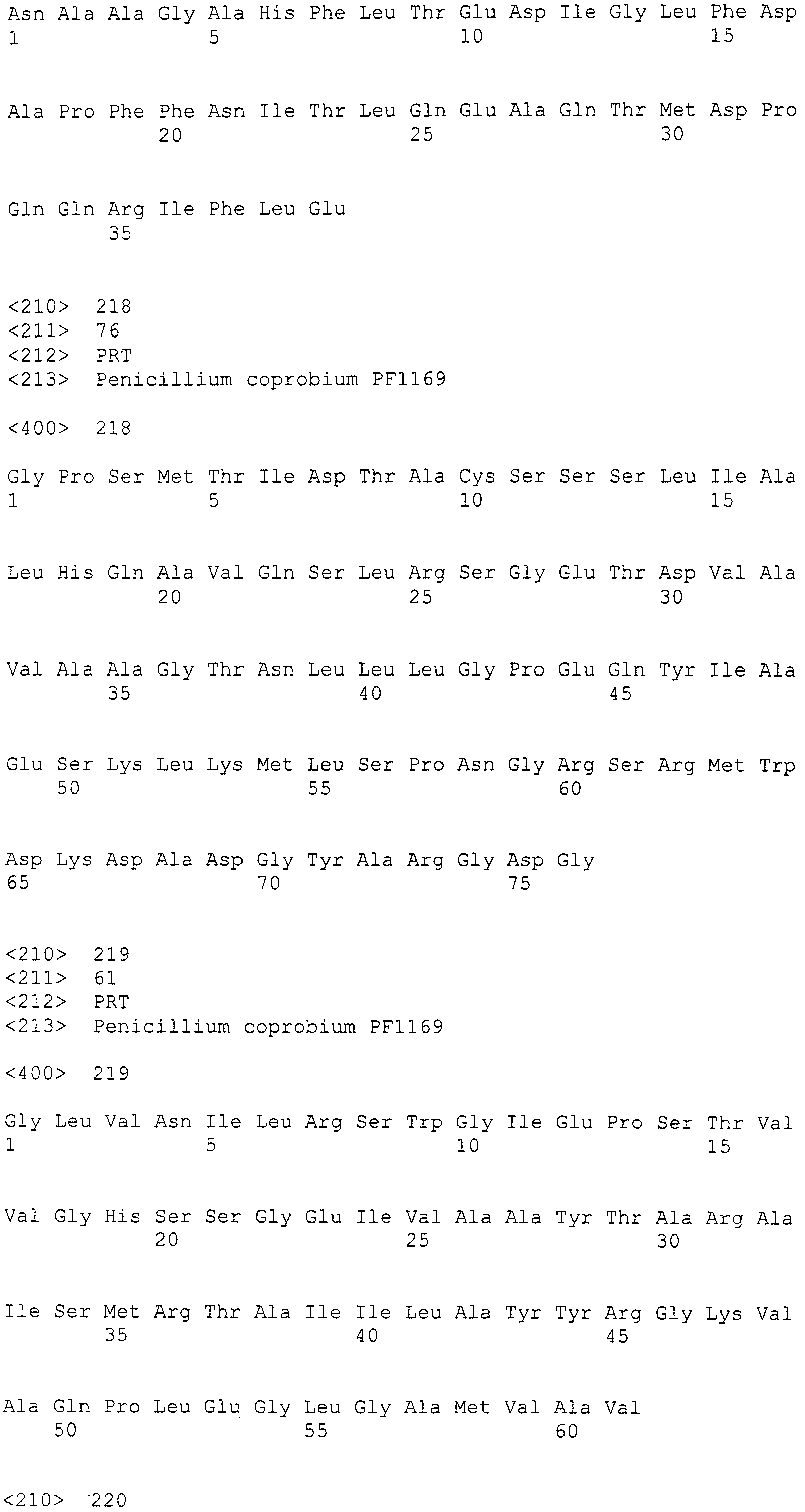
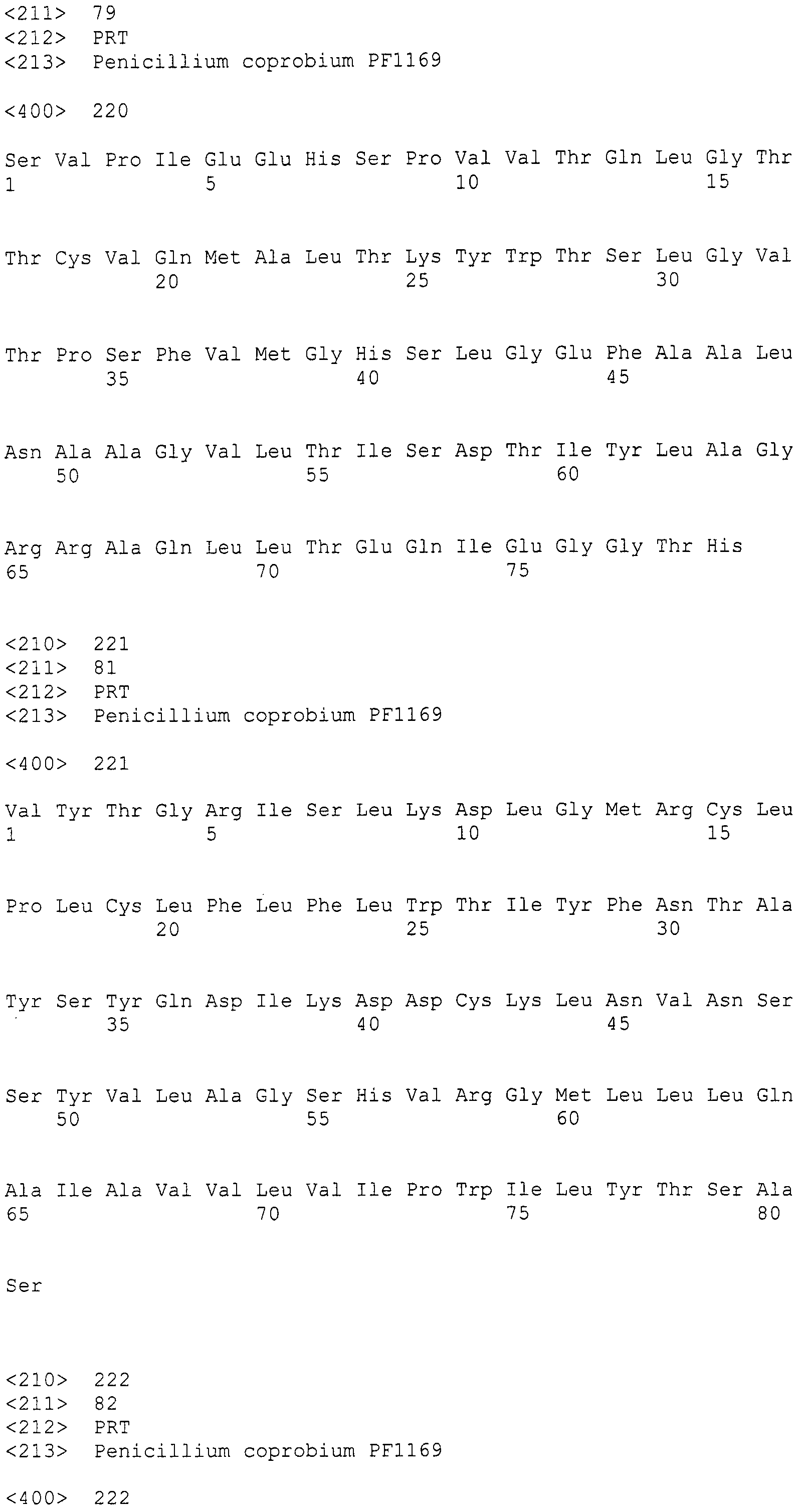




























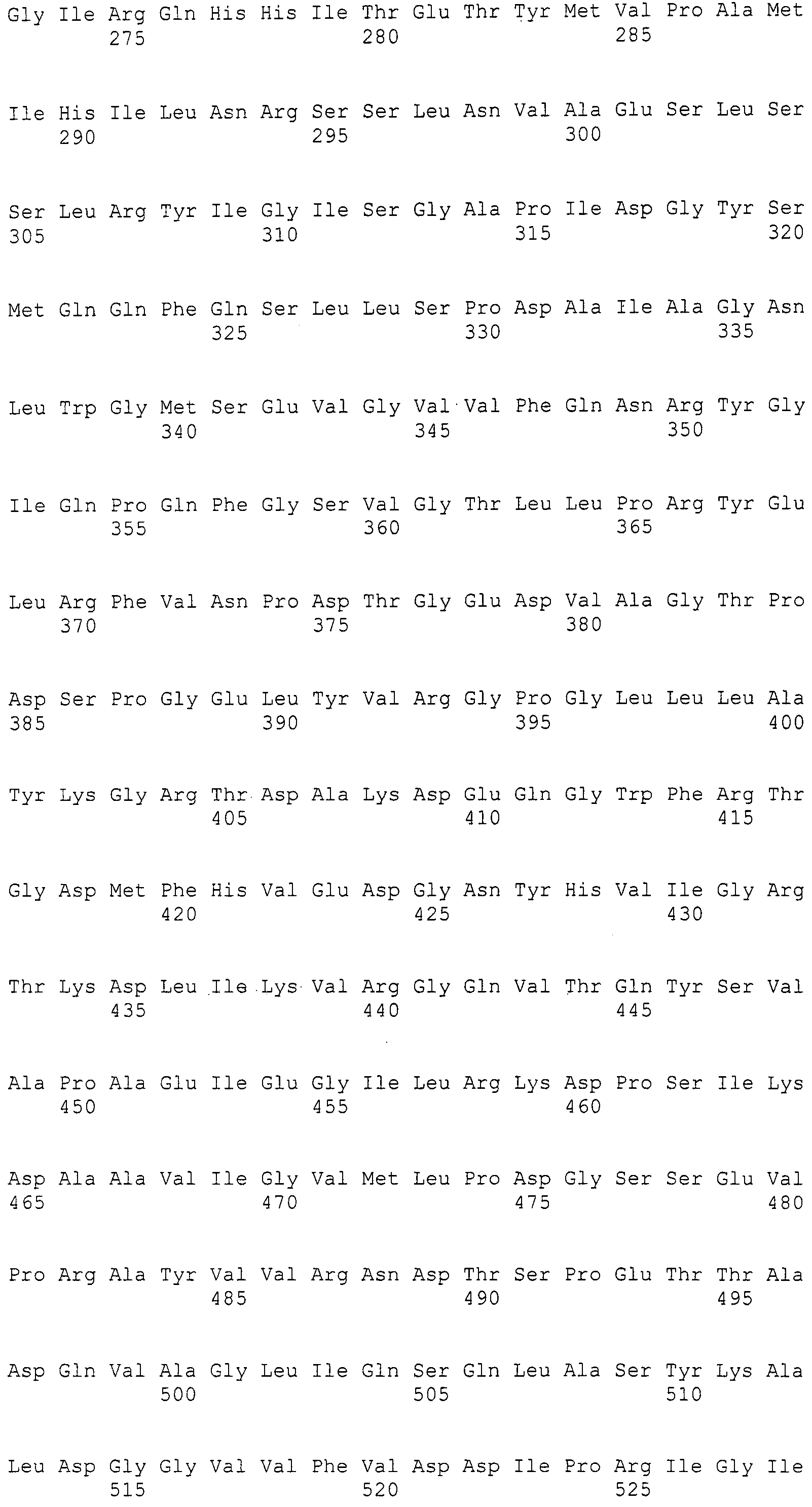
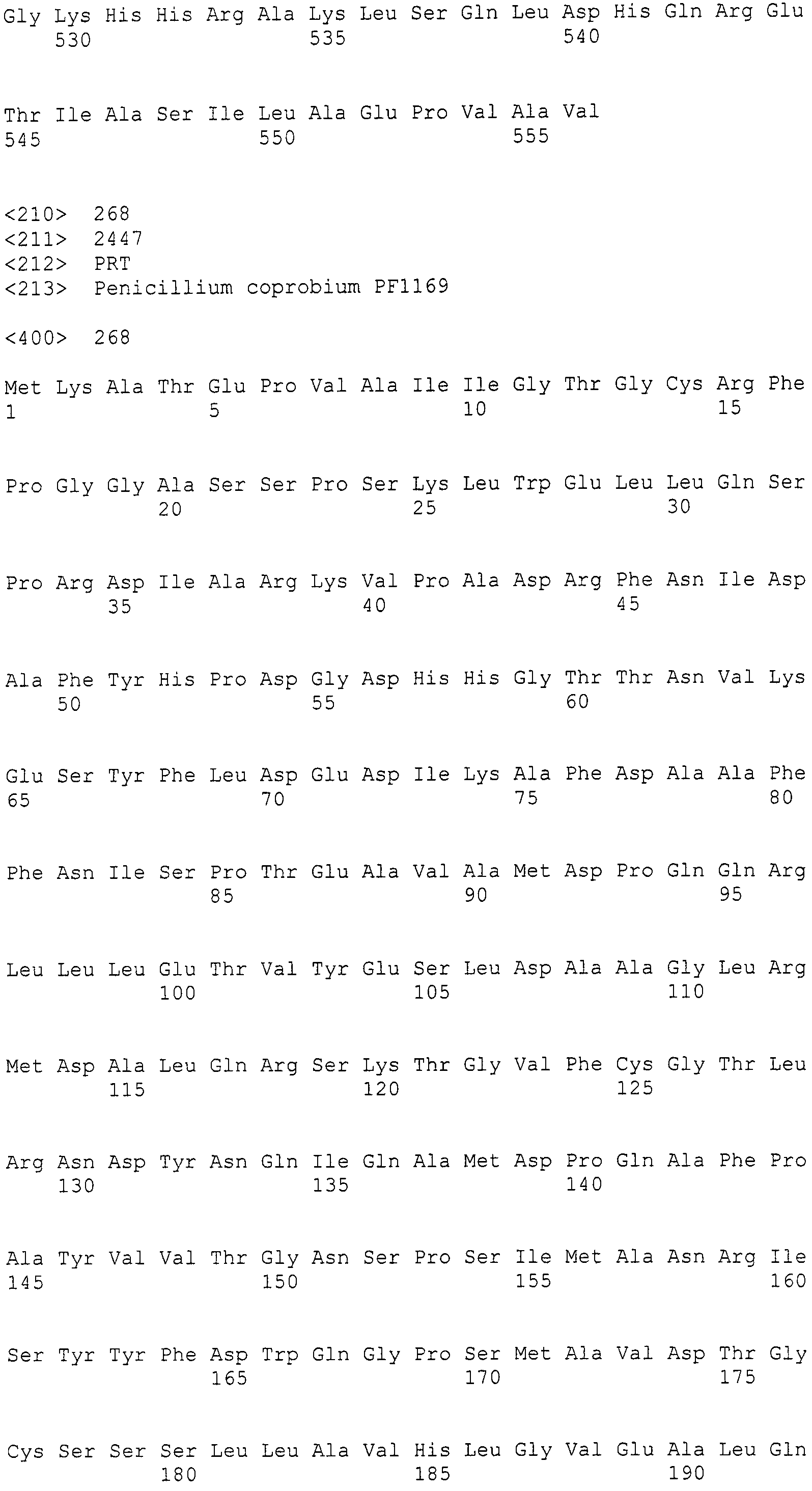

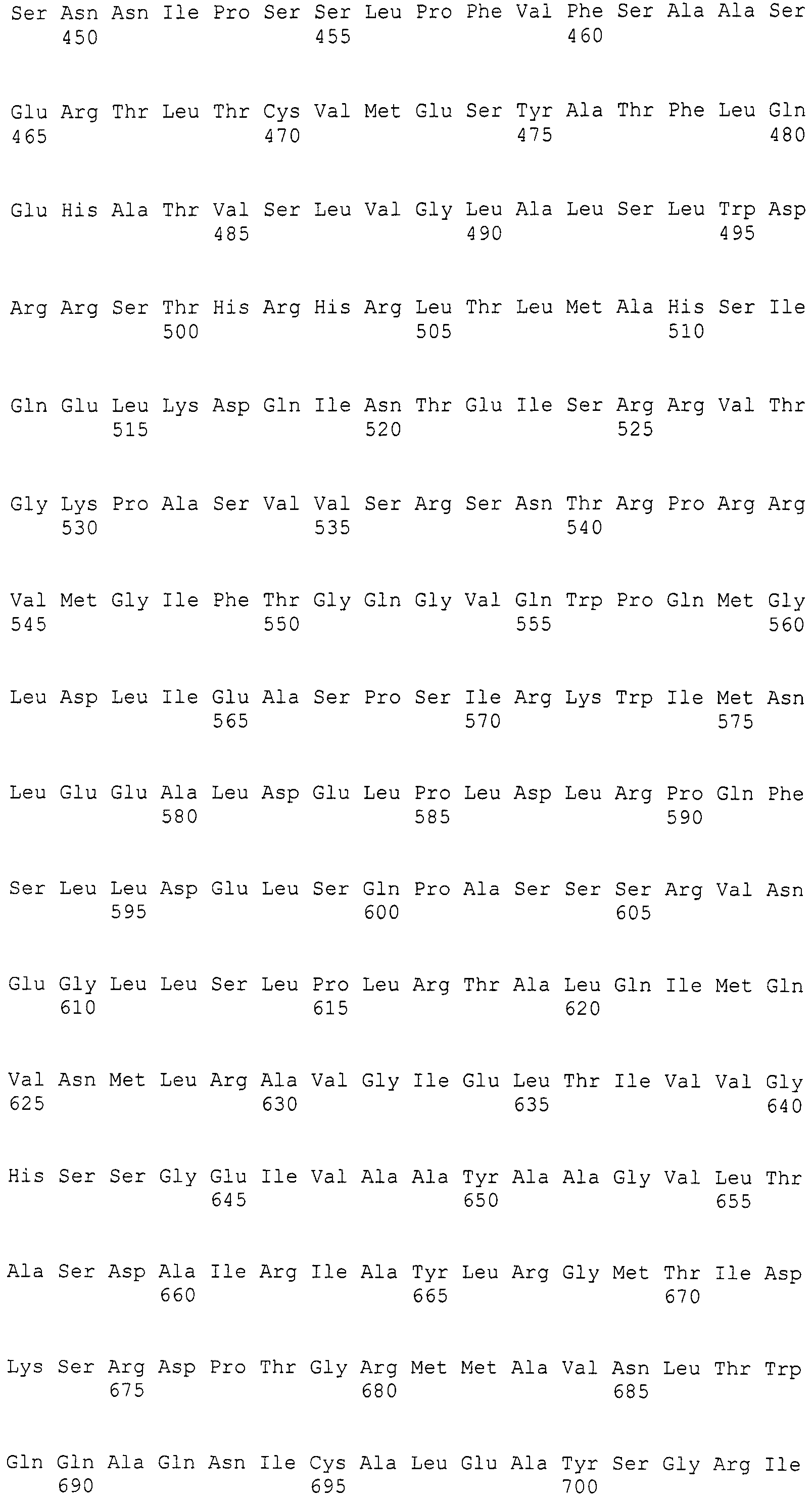
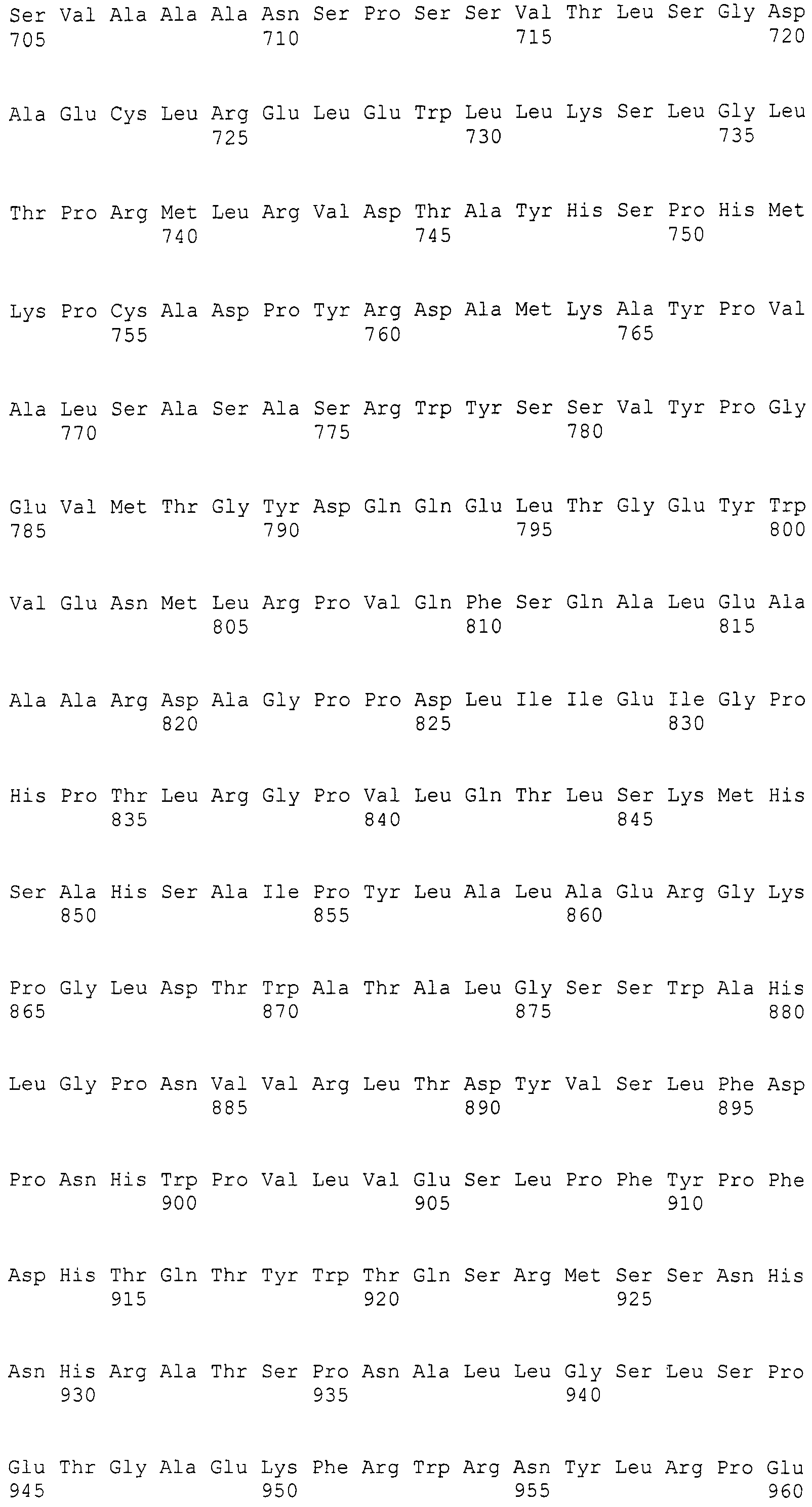

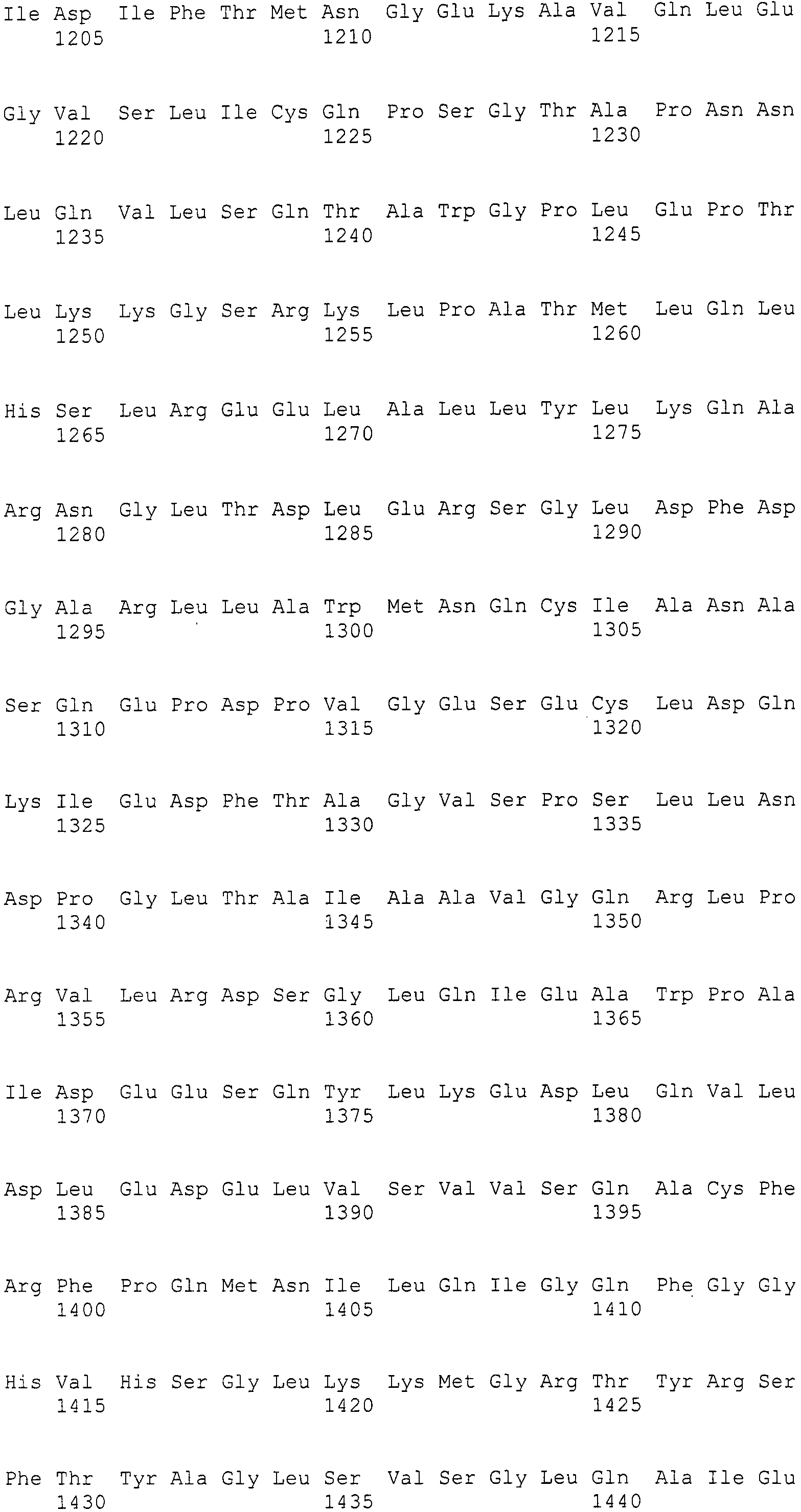




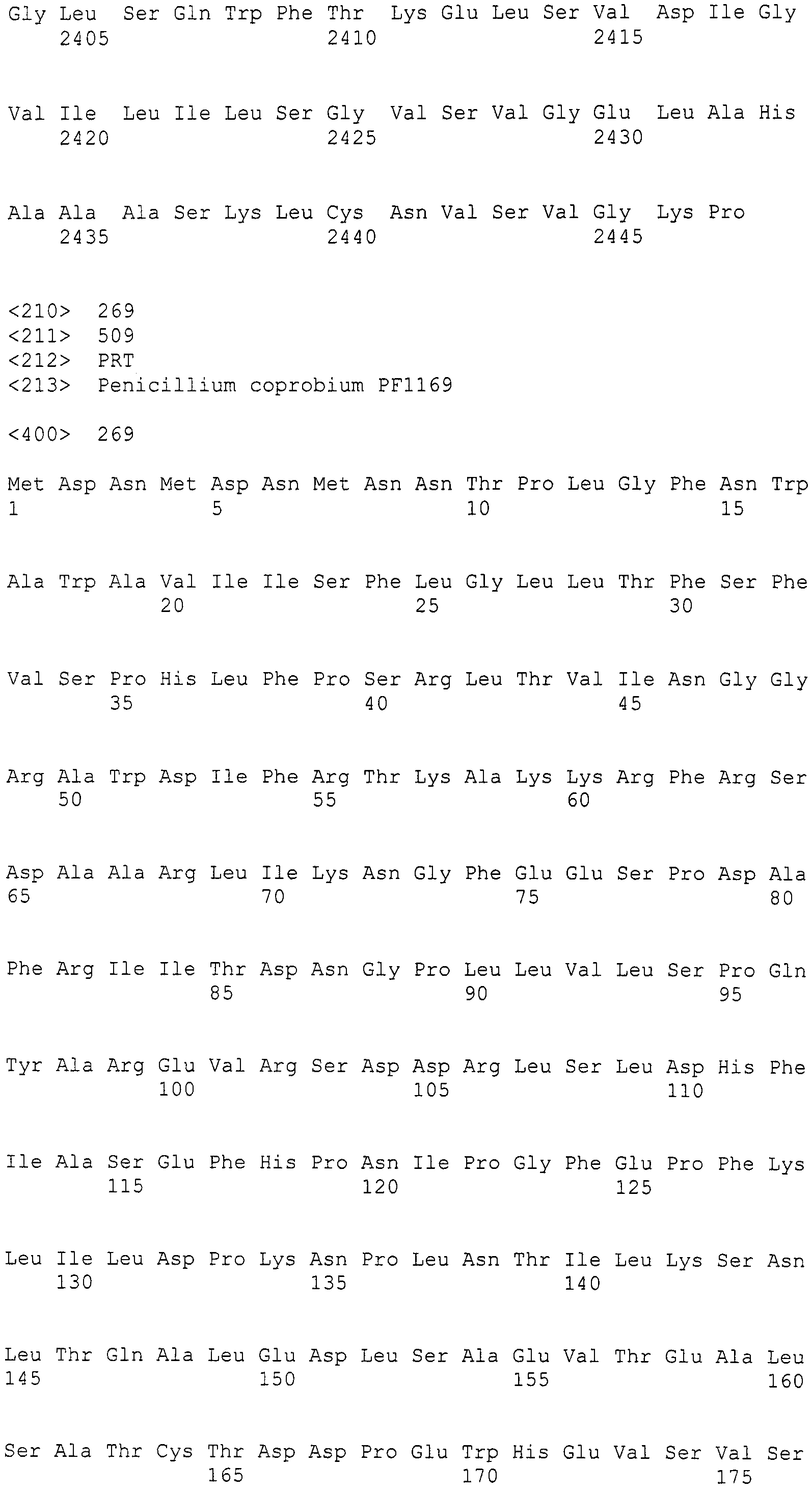







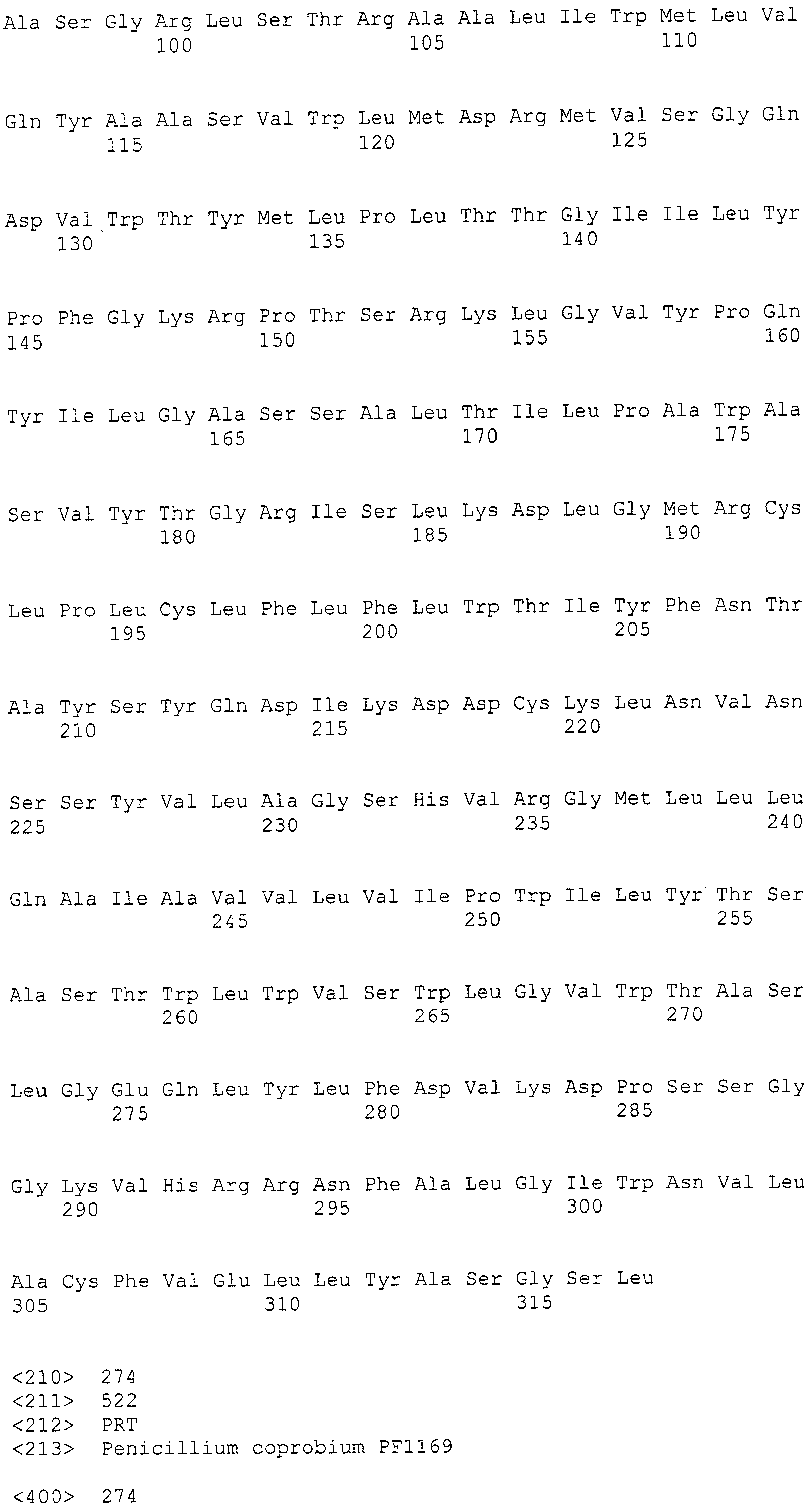
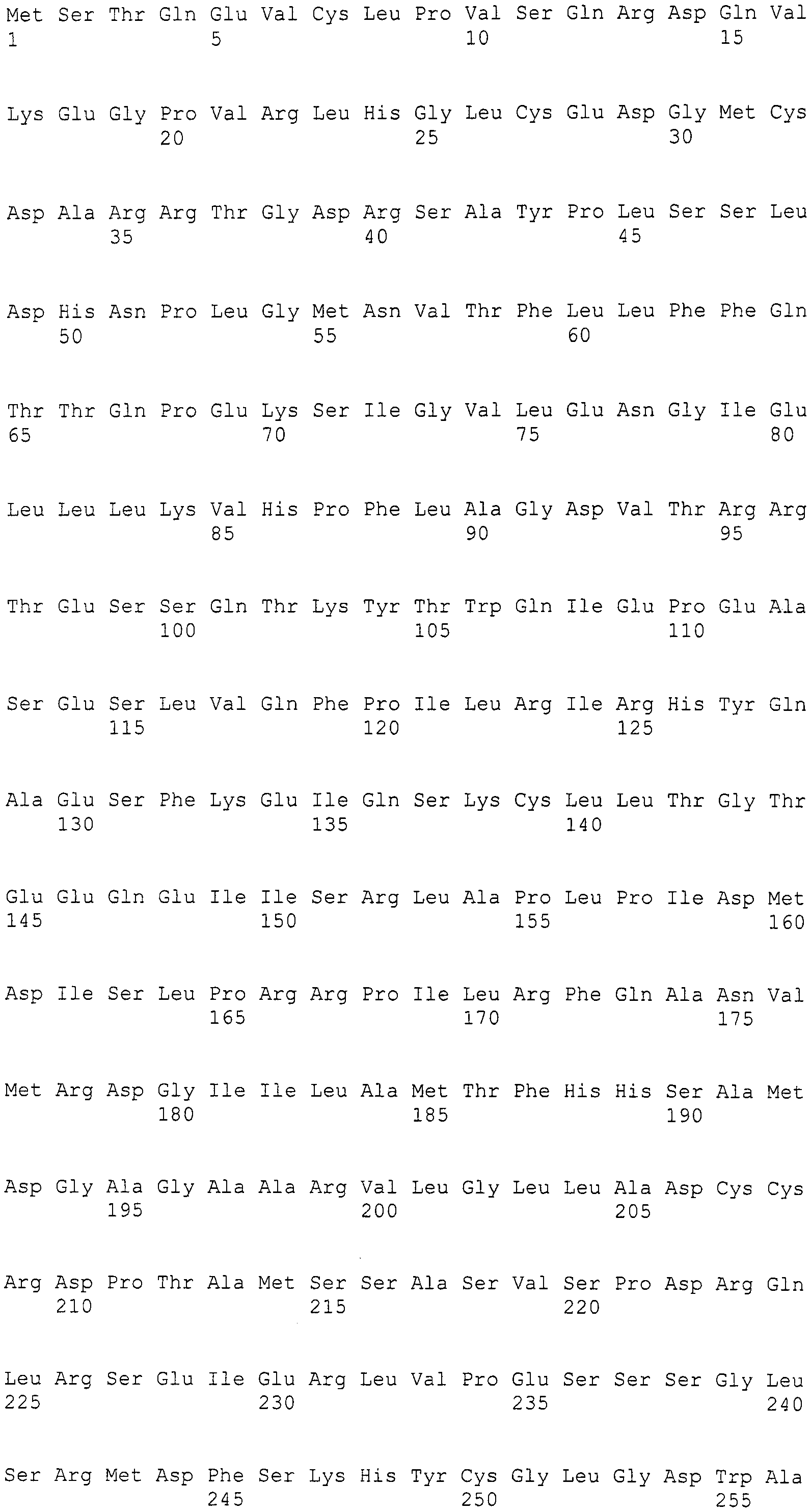
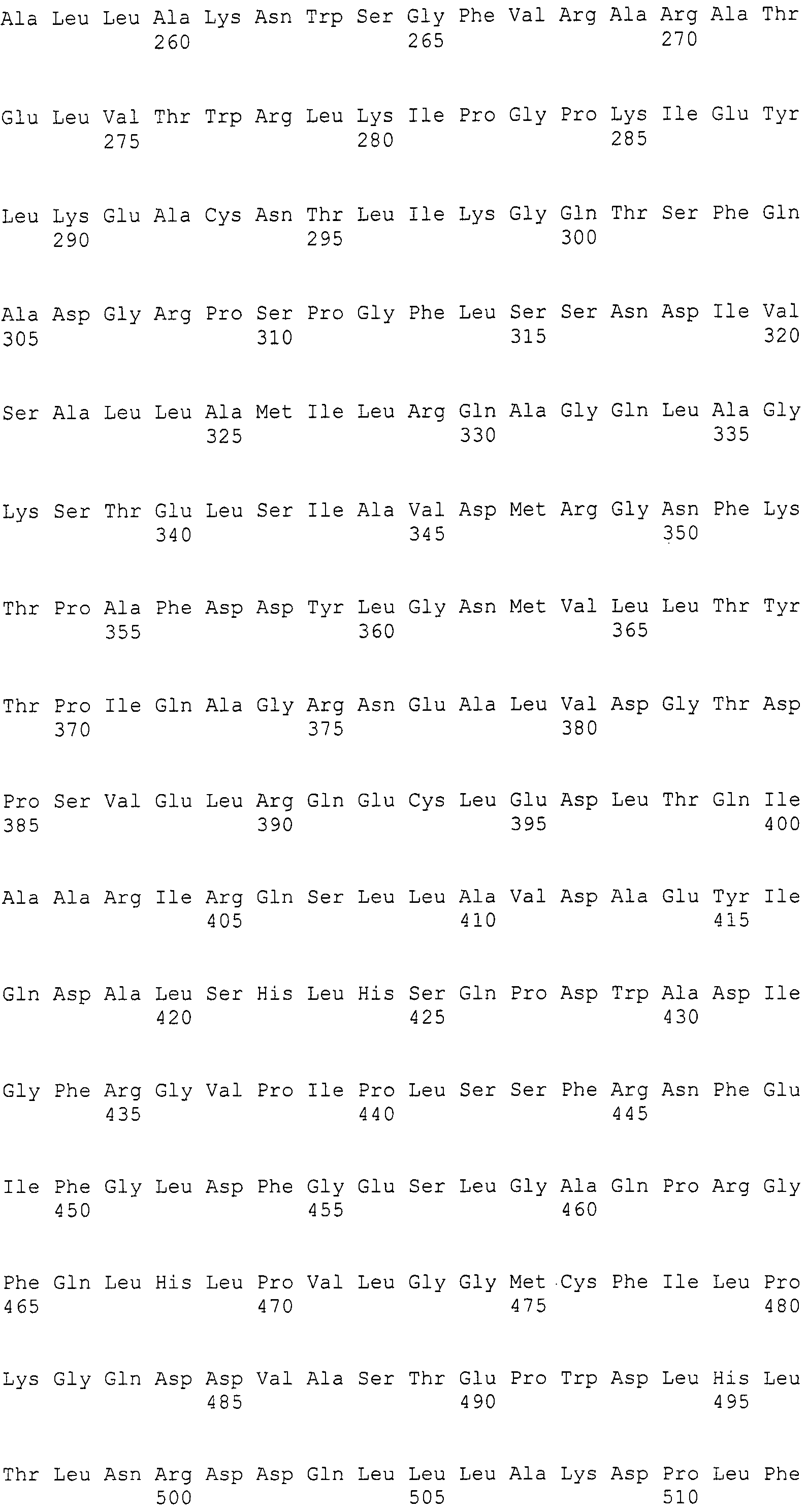

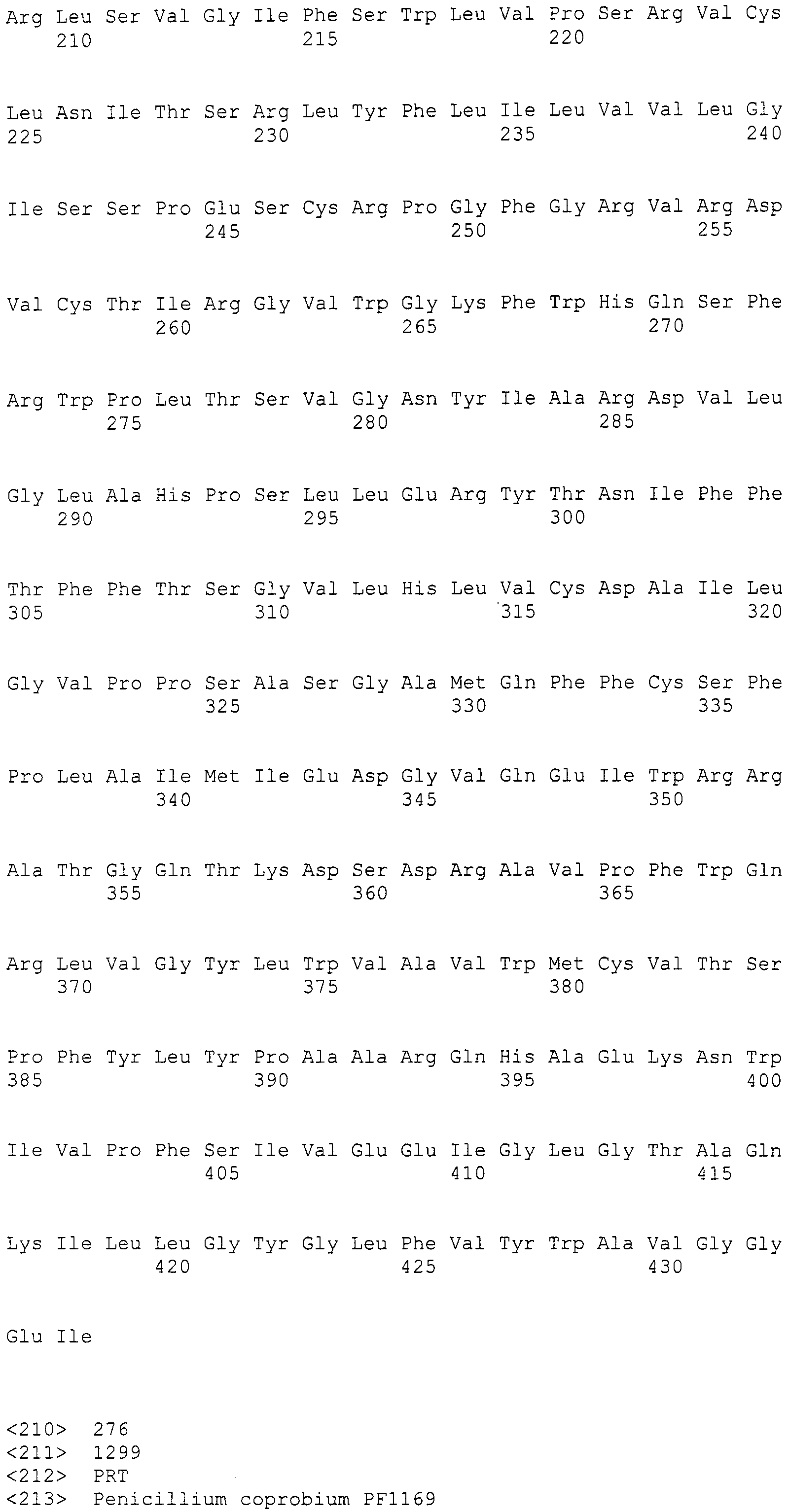
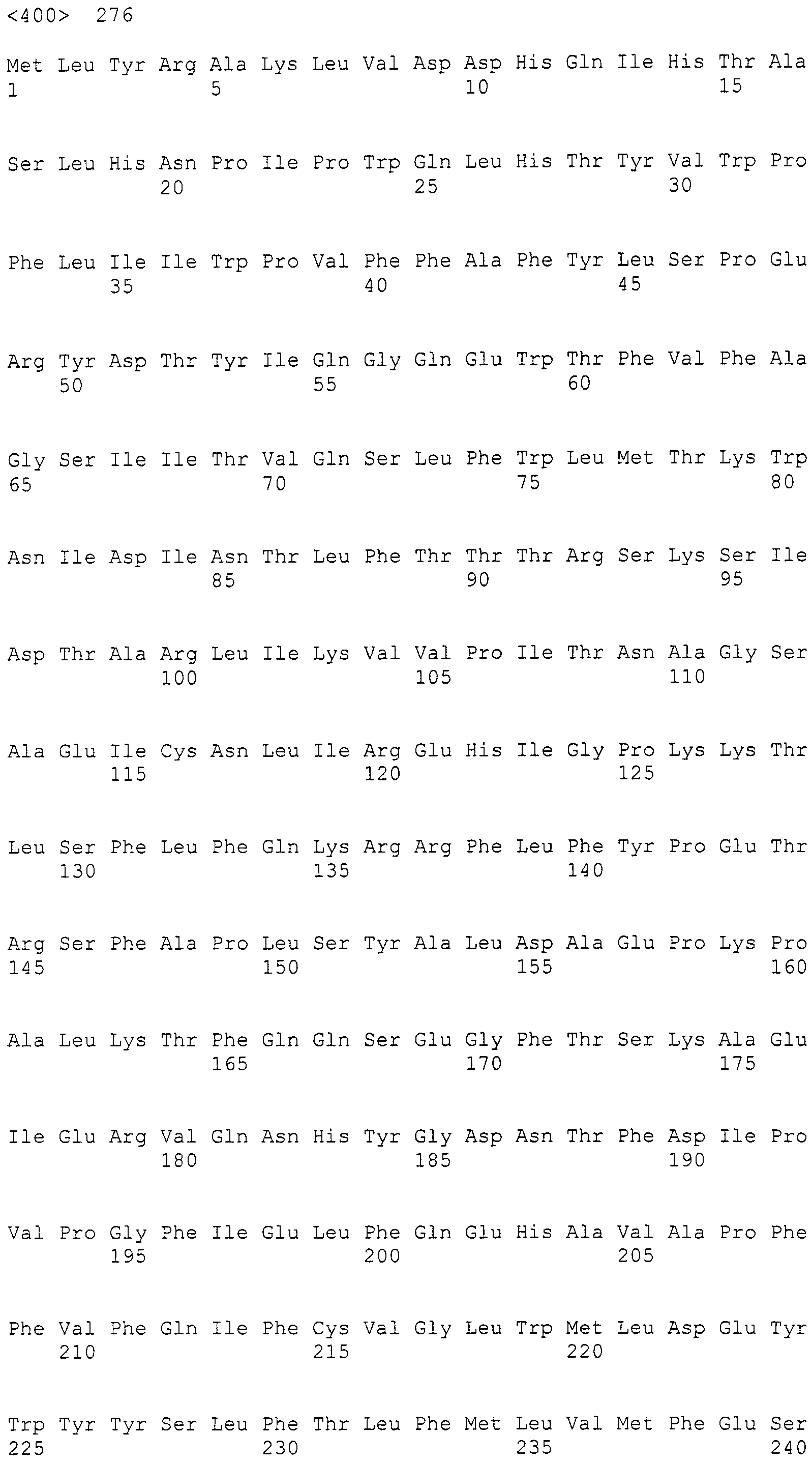

























Описание
ОПИСАНИЕ
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
По данной патентной заявки испрашивается приоритет по патентной заявке Японии No. 14700/2010, поданной 26 января 2010 года, и по патентной заявке Японии No. 253183/2010, поданной 11 ноября 2010 года, содержание которых включено в настоящий документ путем ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Область изобретения
Настоящее изобретение относится к конструкции нуклеиновой кислоты, содержащей кластер генов биосинтеза пирипиропена и маркерный ген.
Предшествующий уровень техники
На сегодняшний день установлено, что существует 18 типов природных аналогов пирипиропена от пирипиропена A до пирипиропена R, отличающихся структурой их боковых цепей (Непатентный документ 1).
Выявлено, что пирипиропены обладают ACAT ингибиторной активностью (Патентный документ 1). Предполагается возможность их применения для лечения заболеваний, вызванных накоплением холестерина или т.п. Также выявлено, что пирипиропены обладают инсектицидной активностью против личинок Helicoverpa armigera (Непатентный документ 2), личинок капустной моли (Патентный документ 2), Tenebrio molitor (Патентный документ 2) или афид (Патентный документ 3), и предполагается возможность их применения в качестве инсектицидов.
Известно, что пирипиропены продуцируются как вторичные метаболиты нитевидными грибами. Например, выявлено, что штамм Penicilliumcoprobium PF1169 (Патентный документ 4), штамм Aspergillusfumigatus IFO-1289 (Патентный документ 5), штамм Eupenicillium reticulosporum NRRL-3446 (Непатентный документ 2) или штамм Penicilliumgriseofulvum F1959 (Патентный документ 2) продуцируют пирипиропены.
Промышленное производство пирипиропенов осуществляют за счет культивирования указанных выше бактерий-продуцентов и получения пирипиропенов. В основном, количество продуктов вторичного метаболизма, продуцируемых изолированным природным микроорганизмом, мало. Для промышленного использования необходимо увеличить выработку желаемых продуктов.
Чтобы увеличить выработку желаемых продуктов, ведутся исследования способа культивирования микроорганизмов продуцентов желаемых продуктов, исследования компонентов среды для культивирования и модификаций условий ферментации, таких как добавление предшественников, а также модификаций бактериальных штаммов при помощи мутаций, вызванных ультрафиолетом или мутагенами. Кроме того, дополнительно к этим способам, для увеличения выработки недавно начали применять генетическую рекомбинацию.
В основе способа улучшения выработки при помощи генетической рекомбинации лежит усиление экспрессии генов биосинтеза. Например, используя данный способ, предложили способ увеличения выработки вещества PF1022, продуцируемого Agonomycetales (Патентный документ 6). Для применения данного способа необходимо выделить гены биосинтеза желаемого продукта и разработать способ трансформации ими микроорганизмов продуцентов желаемого продукта.
Что касается пирипиропенов, до настоящего времени не сообщалось о выделении кластера генов их биосинтеза. Кроме того, способ трансформации пирипиропен-продуцирующих грибов, в качестве хозяина, не был показан. Таким образом, до настоящего времени представлялось трудным введение кластера генов биосинтеза пирипиропенов в пирипиропен-продуцирующие микроорганизмы, и невозможно было достичь увеличения выработки при помощи генетической рекомбинации.
ИЗВЕСТНЫЙ УРОВЕНЬ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[Патентный документ 1] Выложенная патентная заявка Японии No. 184158/1994
[Патентный документ 2] WO2004/060065
[Патентный документ 3] WO2006/129714
[Патентный документ 4] Journal of Technical Disclosure No. 500997/2008
[Патентный документ 5] Выложенная патентная заявка Японии No. 360895/1992
[Патентный документ 6] Патентная заявка Японии No. 3961289
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[Непатентный документ 1] Journal of Antibiotics (1996), 49(3), 292-298
[Непатентный документ 2] Applied and Environmental Microbiology (1995), 61 (12), 4429-4435
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что за счет экспрессии конструкции нуклеиновой кислоты, содержащей кластер генов биосинтеза пирипиропена и маркерный ген, у хозяина значительно увеличивалась выработка пирипиропенов. Настоящее изобретение осуществлено на основании данного наблюдения.
Таким образом, цель настоящего изобретения заключается в предоставлении конструкции нуклеиновой кислоты, содержащей кластер генов биосинтеза пирипиропена и маркерный ген.
В соответствии с одним из вариантов осуществления настоящего изобретения предоставляется конструкция нуклеиновой кислоты, содержащая кластер генов биосинтеза пирипиропена и маркерный ген.
Также, в соответствии с другим вариантом осуществления настоящего изобретения предоставляется трансформант, полученный за счет введения указанной выше конструкции нуклеиновой кислоты в хозяина.
Дополнительно, в соответствии с другим вариантом осуществления настоящего изобретения предоставляется трансформант, полученный за счет одновременного или раздельного введения конструкции нуклеиновой кислоты, содержащей указанный выше кластер генов биосинтеза пирипиропена, и конструкция нуклеиновой кислоты, содержащая указанный выше маркерный ген, в хозяина.
Кроме того, в соответствии с другим вариантом осуществления настоящего изобретения предоставляется способ производства пирипиропенов, включающий культивирование указанных выше трансформантов и получение пирипиропенов из культуры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
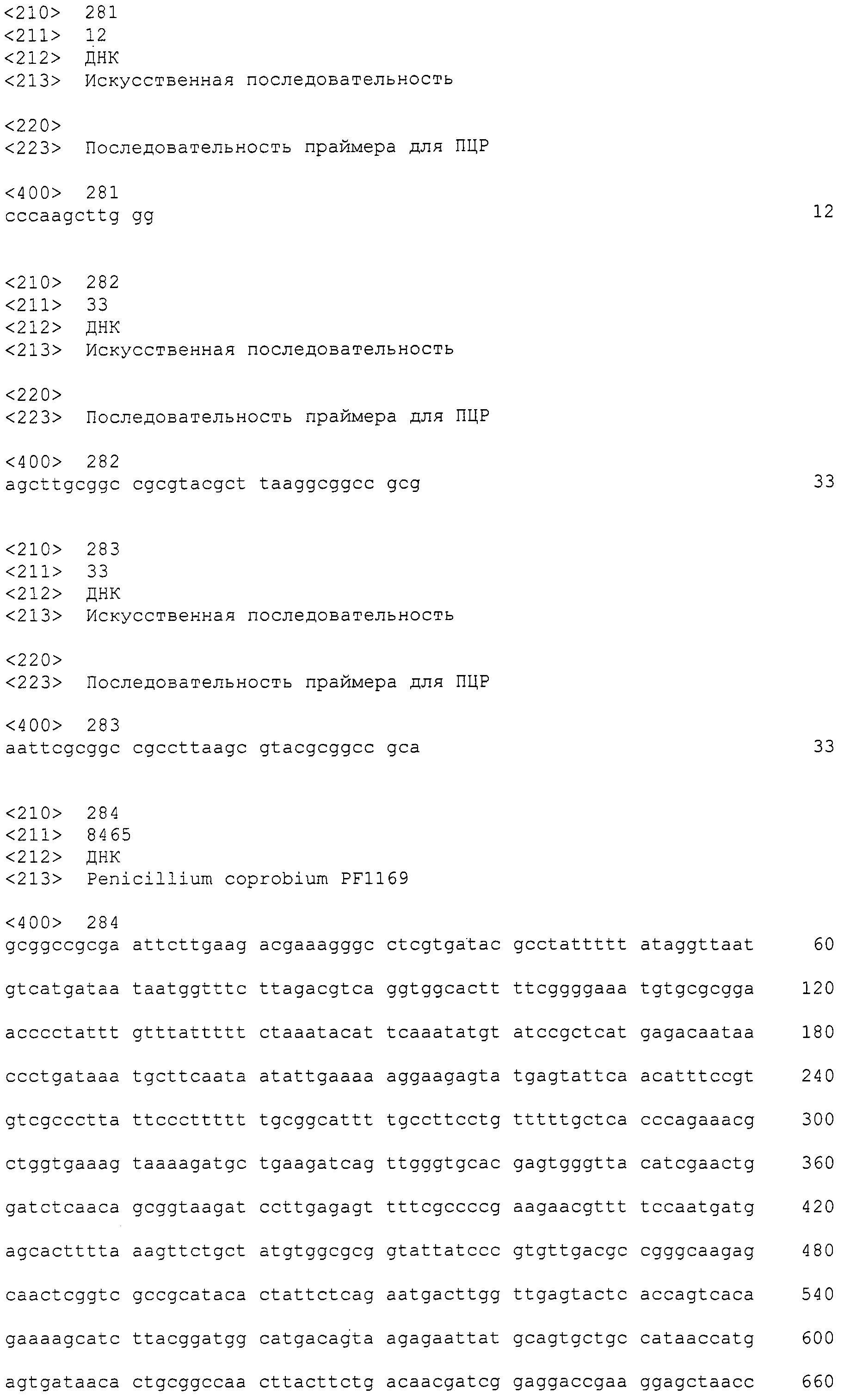
[Фиг.1] На фиг.1 представлена электрофоретический картина ПЦР продуктов в агарозном геле. Для электрофореза ПЦР продукты амплифицировали, используя следующие праймеры: M: маркер молекулярной массы (лэддер в 100 п.н.), дорожка 1: праймеры SEQ ID NO:1 и 2, дорожка 2: праймеры SEQ ID NO:239 и 240, дорожка 3: праймеры SEQ ID NO:237 и 238, дорожка 4: праймеры SEQ ID NO:241 и 242, дорожка 5: праймеры SEQ ID NO:247 и 248, дорожка 6: праймеры SEQ ID NO:251 и 252, дорожка 7: праймеры SEQ ID NO:245 и 246, дорожка 8: праймеры SEQ ID NO:243 и 244, дорожка 9: праймеры SEQ ID NO:249 и 250, дорожка 10: праймеры SEQ ID NO:235 и 236, дорожка 11: праймеры SEQ ID NO:233 и 234, дорожка 12: праймеры SEQ ID NO:227 и 228, дорожка 13: праймеры SEQ ID NO:229 и 230, дорожка 14: праймеры SEQ ID NO:231 и 232.
[Фиг.2] Аналогично фиг.1, на фиг.2 представлена электрофоретическая картина ПЦР продуктов в агарозном геле. Для электрофореза ПЦР продукты амплифицировали, используя следующие праймеры: M: маркер молекулярной массы (лэддер в 100 п.н.), дорожка 1: праймеры SEQ ID NO:253 и 254, дорожка 2: праймеры SEQ ID NO:257 и 258, дорожка 3: праймеры SEQ ID NO:259 и 260, дорожка 4: праймеры SEQ ID NO:255 и 256, дорожка 5: праймеры SEQ ID NO:261 и 262.
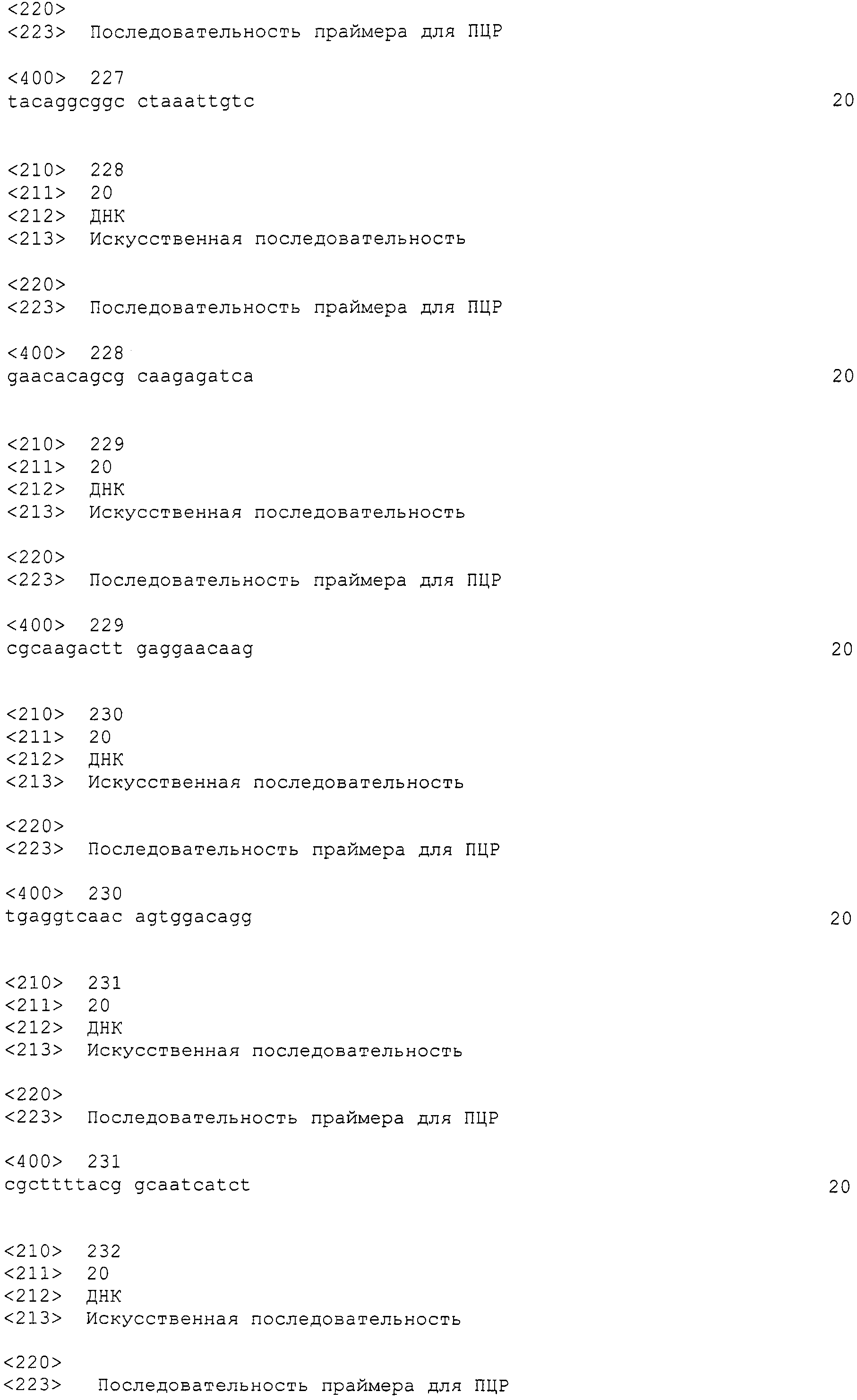
[Фиг.3] Аналогично фиг.1, на фиг.3 представлена электрофоретическая картина ПЦР продуктов в агарозном геле. Для электрофореза, ПЦР продукты амплифицировали, используя следующие праймеры: дорожка 1: маркер молекулярной массы (лэддер в 100 п.н.), дорожка 2: праймеры SEQ ID NO:264 и 265 (амплифицированный фрагмент в 400 п.н.).
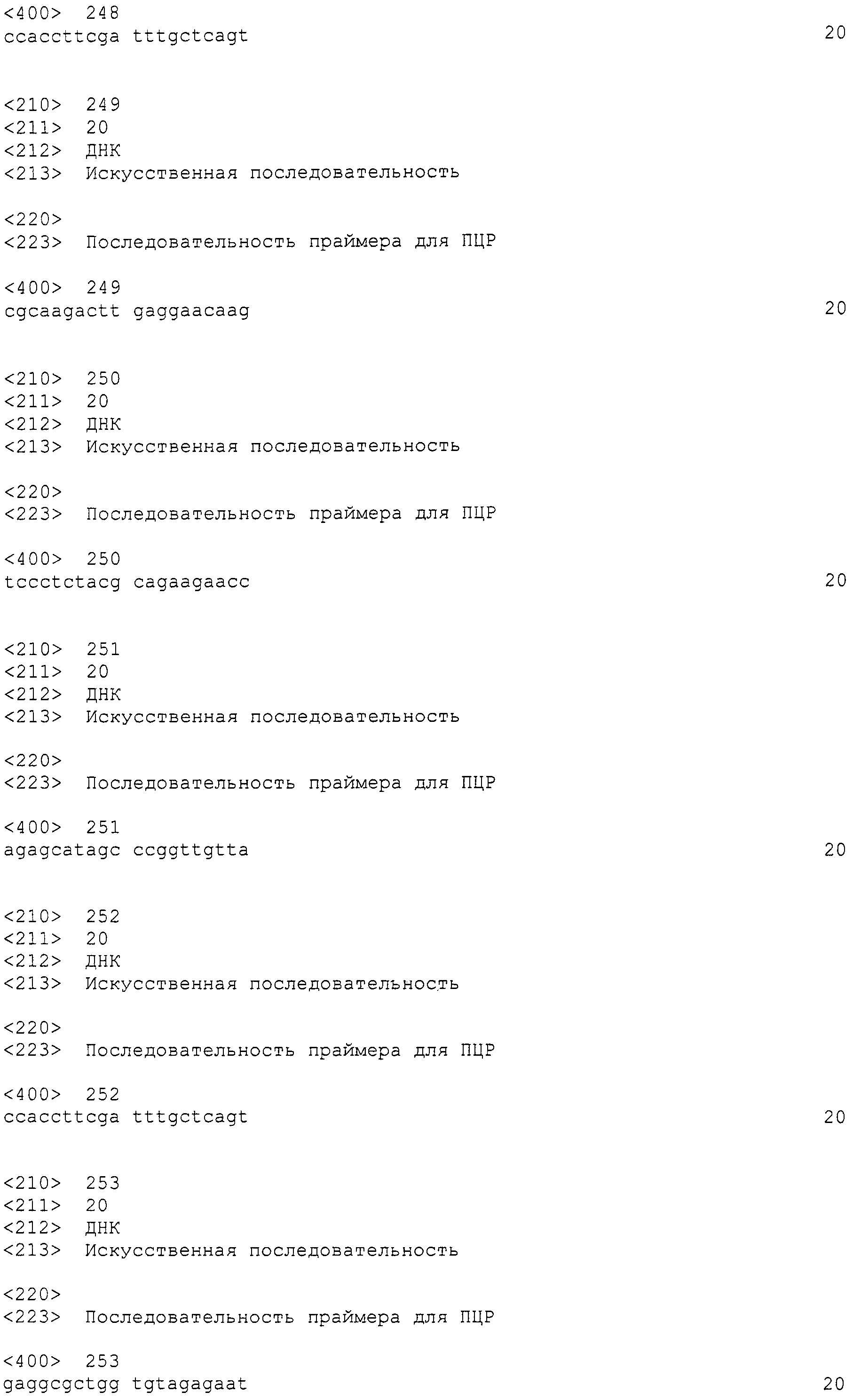
[Фиг.4] На фиг.4 представлена карта плазмидного вектора pBI-AnGPD-EGFP, используемого для нитевидных грибов. На данной фигуре, RB относится к правой границе, HYGr относится к области, кодирующей устойчивость к гигромицину, PAngpdA относится к промотеру глицеральдегид-3-фосфат дегидрогеназы Aspergillus nidulans, EGFP относится к области, кодирующей усиленный зеленый флуоресцентный белок, TAngpdA относится к терминатору глицеральдегид-3-фосфат дегидрогеназы Aspergillus nidulans, и LB относится к левой границе.
[Фиг.5A] На фиг.5A слева показаны устойчивые к гигромицину колонии, образованные при заражении Agrobacterium, и справа показаны результаты наблюдения флуоресценции GFP.
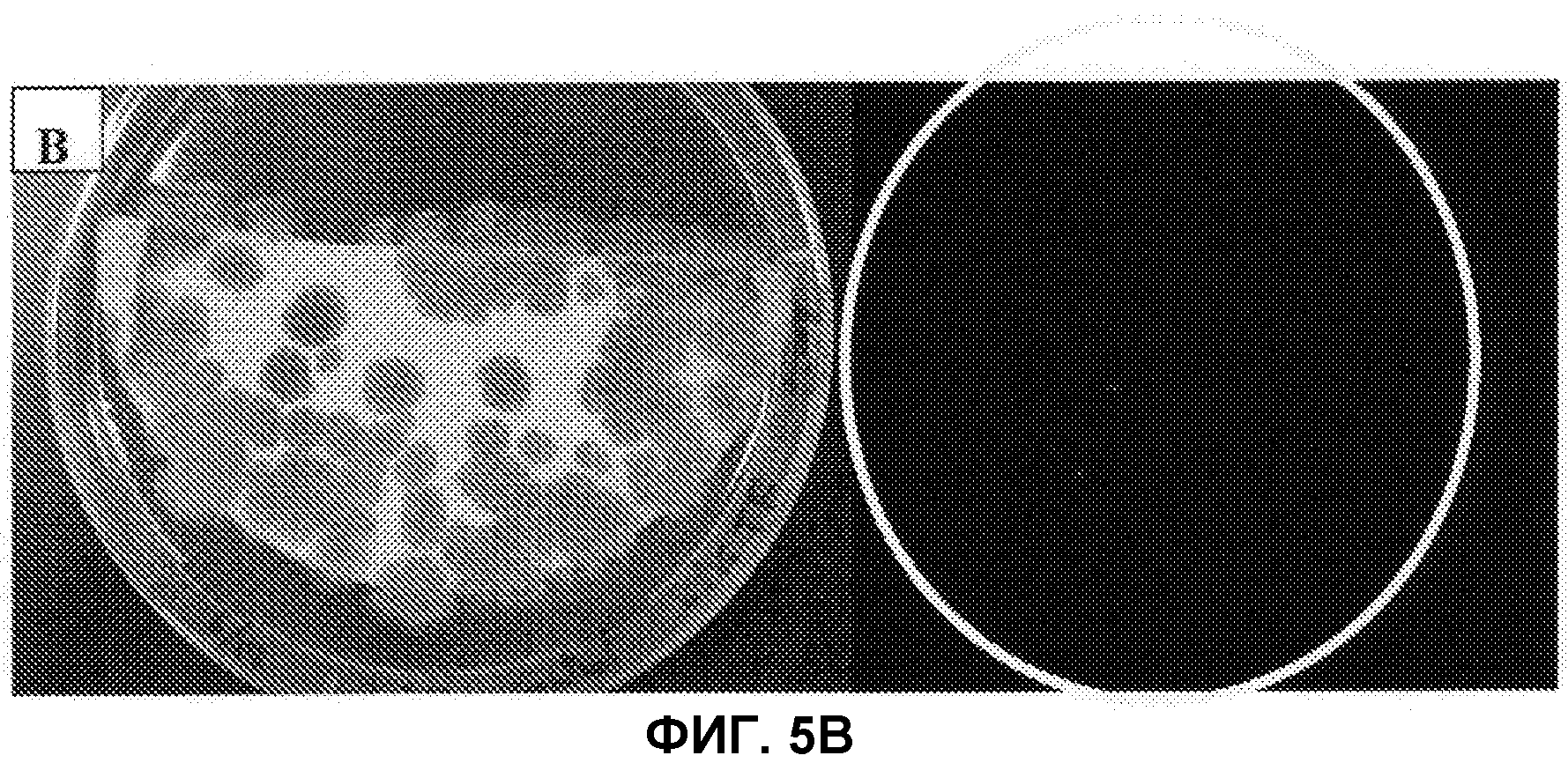
[Фиг.5B] На фиг.5B слева показаны колонии штамма Penicilliumcoprobium PF1169 без заражения Agrobacterium, причем колонии образовались на среде, не содержащей гигромицин, и справа показаны результаты наблюдения флуоресценции GFP.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Депонирование микроорганизмов
Escherichiacoli(Escherichiacoli EPI300TM-T1R), трансформированную плазмидой pCC1-PP1, депонировали в Международном Депозитарии Организмов для Целей Патентования, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под инвентарным номером FERM BP-11133 (преобразован из внутреннего депонирования под инвентарным номером FERM P-21704) (идентификационная ссылка: Escherichiacoli EPI300TM-T1R/pCC1-PP1) 9 октября 2008 года (дата депонирования).
Escherichiacoli, трансформированную плазмидой pPYRI02, депонировали в Международном Депозитарии Организмов для Целей Патентования, National Institute of Advanced Industrial Science and Technology (Адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под инвентарным номером FERM BP-11203 (идентификационная ссылка: XL1-Blue MRA/pPYRI02) 14 декабря 2009 года.
Escherichiacoli, трансформированную космидой pPYRI07, депонировали в Международном Депозитарии Организмов для Целей Патентования, National Institute of Advanced Industrial Science и Technology (Address: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под инвентарным номером FERM BP-11316 (идентификационная ссылка: XL1-Blue MRA/pPYRI07) 1 декабря 2010 года.
Кластер генов биосинтеза пирипиропена
Кластер генов биосинтеза пирипиропена в настоящем изобретении помещают в конструкцию нуклеиновой кислоты таким образом, чтобы иметь возможность экспрессировать его вместе с ниже описанным маркерным геном в хозяине. При условии, что кластер генов вовлечен в биосинтез пирипиропенов, он никак не ограничивается. Предпочтительно, предлагается конструкция, содержащая по меньшей мере одну полноразмерную нуклеотидную последовательность, выбранную из нижеуказанных нуклеотидных последовательностей согласно (I)-(IV), или ее часть:
(I) участок от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266;
(II) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной участку от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266, и кодирующая белок, по существу эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266;
(III) нуклеотидная последовательность полинуклеотида участка от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266 в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который кодирует белок, по существу эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266; и
(IV) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом участка от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266, и которая кодирует белок, по существу эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO:266.
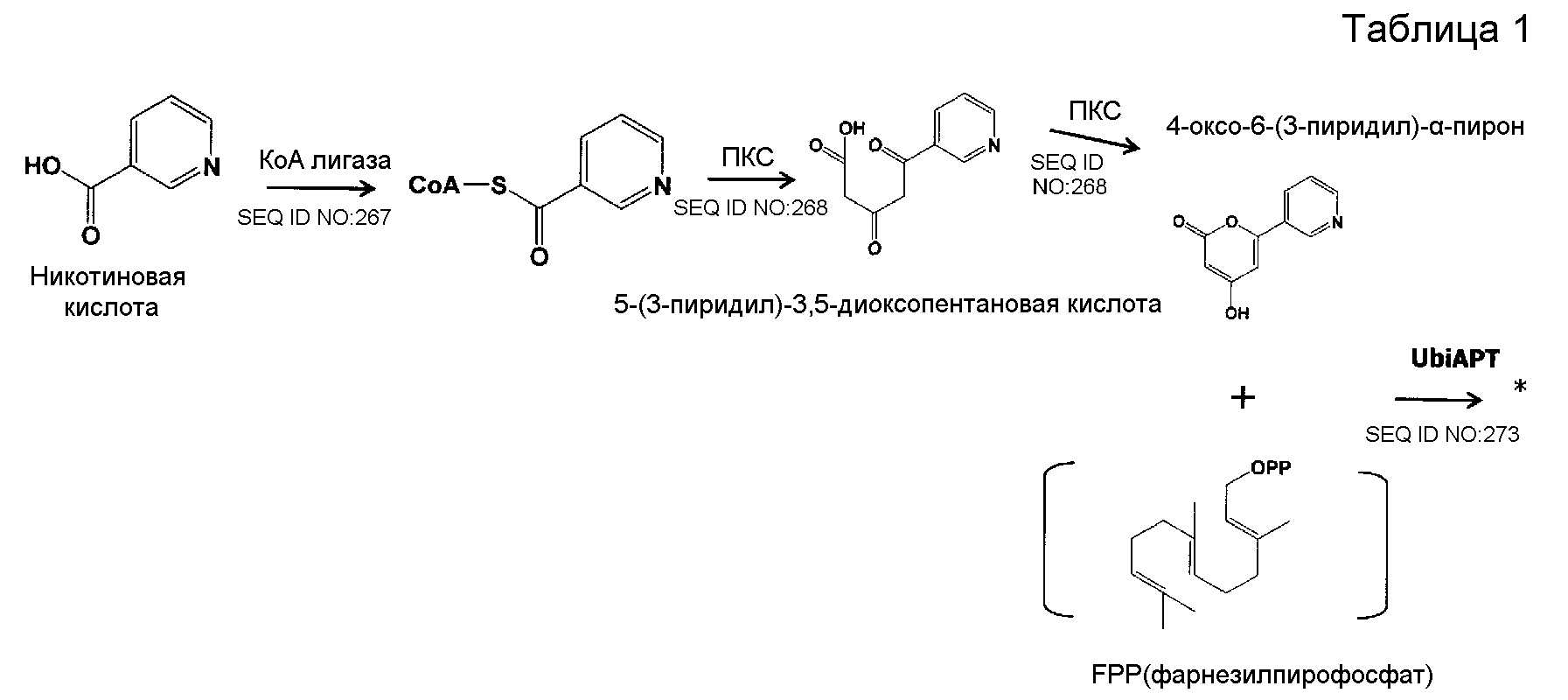
В соответствии с другим предпочтительным вариантом осуществления кластер генов биосинтеза пирипиропена в настоящем изобретении представляет собой кластер генов, содержащий интересующий ген и область регуляции экспрессии. В настоящем описании интересующий ген представляет собой один или более генов, кодирующих белок, участвующий в биосинтезе пирипиропенов. Также, область регуляции экспрессии никак не ограничивается при условии, что она содержит нуклеотидную последовательность, необходимую для регуляции экспрессии указанного выше интересующего гена в хозяине. Например, включаются промоторы и терминаторы, являющиеся нуклеотидными последовательностями, регулирующими уровень транскрипции интересующего гена в хозяине. Кроме того, белок, участвующий в биосинтезе пирипиропенов представляет собой, например, белок, каким-либо образом участвующий в пути биосинтеза, представленном на нижеследующей схеме 1.
Схема 1
В соответствии с предпочтительным вариантом осуществления интересующего гена в настоящем изобретении конструкция нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую по меньшей мере одну аминокислотную последовательность, выбранную из SEQ ID NO:267-275, или аминокислотную последовательность по существу эквивалентную представленным выше.
В соответствии с другим предпочтительным вариантом осуществления интересующего гена в настоящем изобретении предлагается конструкция нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, выбранную из нижеуказанных нуклеотидных последовательностей согласно (1)-(4):
(1) нуклеотидная последовательность согласно (a)-(i):
(a) нуклеотидная последовательность участка от 3342 до 5158 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(b) нуклеотидная последовательность участка от 5382 до 12777 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(c) нуклеотидная последовательность участка от 13266 до 15144 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(d) нуклеотидная последовательность участка от 16220 до 18018 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(e) нуклеотидная последовательность участка от 18506 до 19296 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(f) нуклеотидная последовательность участка от 19779 до 21389 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(g) нуклеотидная последовательность участка от 21793 до 22877 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(h) нуклеотидная последовательность участка от 23205 до 24773 нуклеотидной последовательности, представленной в SEQ ID NO:266, и
(i) нуклеотидная последовательность участка от 25824 до 27178 нуклеотидной последовательности, представленной в SEQ ID NO:266;
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной нуклеотидной последовательности по (1), и кодирующая белок по существу эквивалентный белку, кодируемому любой из вышеуказанных нуклеотидных последовательностей;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности по (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который кодирует белок по существу эквивалентный белку, кодируемому любой из вышеуказанных нуклеотидных последовательностей; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности по (1), и которая кодирует белок по существу эквивалентный белку, кодируемому любой из вышеуказанных нуклеотидных последовательностей.
В соответствии с еще одним предпочтительным вариантом осуществления интересующего гена в настоящем изобретении предлагается конструкция нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, выбранную из нижеследующих нуклеотидных последовательностей согласно (1)-(4):
(1) нуклеотидная последовательность, содержащая все полноразмерные нуклеотидные последовательности, указанные выше согласно (a)-(i) или (a)-(h);
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной нуклеотидной последовательности согласно (1), и кодирующая белок, по существу эквивалентный белку, кодируемому данной нуклеотидной последовательностью;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности согласно (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который кодирует белок, по существу эквивалентный белку, кодируемому данной нуклеотидной последовательностью; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности по (1), и которая кодирует белок, по существу эквивалентный белку, кодируемому данной нуклеотидной последовательностью.
В соответствии с предпочтительным вариантом осуществления области регуляции экспрессии в настоящем изобретении, предлагается конструкция нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, выбранную из нижеуказанных нуклеотидных последовательностей согласно (1)-(4):
(1) полноразмерная нуклеотидная последовательность, выбранная из нижеуказанных последовательностей согласно (j)-(s), или их часть:
(j) нуклеотидная последовательность участка от 2911 до 3341 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(k) нуклеотидная последовательность участка от 5159 до 5381 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(l) нуклеотидная последовательность участка от 12778 до 13265 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(m) нуклеотидная последовательность участка от 15145 до 16219 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(n) нуклеотидная последовательность участка от 18019 до 18505 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(o) нуклеотидная последовательность участка от 19297 до 19778 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(p) нуклеотидная последовательность участка от 21390 до 21792 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(q) нуклеотидная последовательность участка от 22878 до 23204 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(r) нуклеотидная последовательность участка от 24774 до 25823 нуклеотидной последовательности, представленной в SEQ ID NO:266, и
(s) нуклеотидная последовательность участка от 27179 до 27797 нуклеотидной последовательности, представленной в SEQ ID NO:266;
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с нуклеотидной последовательностью по (1), и имеющая функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности по (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который имеет функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности согласно (1), и имеющая функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей.
В соответствии с более предпочтительным вариантом осуществления области регуляции экспрессии в настоящем изобретении предлагается конструкция нуклеиновой кислоты, содержащая по меньшей мере одну нуклеотидную последовательность, выбранную из нижеуказанных нуклеотидных последовательностей согласно (1)-(4):
(1) нуклеотидная последовательность, содержащая все полноразмерные нуклеотидные последовательности, указанные выше согласно (j)-(s) или (j)-(r);
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с нуклеотидной последовательностью по (1), и имеющая функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности по (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который имеет функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности согласно (1), и имеющая функции, по существу эквивалентные любой из указанных выше нуклеотидных последовательностей.
В качестве кластера генов биосинтеза пирипиропена в настоящем изобретении можно использовать полноразмерный или часть кластера генов биосинтеза, выделенного из пирипиропен-продуцирующих грибов, предпочтительно, можно использовать полноразмерный или часть кластера генов биосинтеза пирипиропена, полученного из штамма Penicilliumcoprobium PF1169, представленного в SEQ ID NO:266, и более предпочтительно, можно использовать полноразмерный кластер генов биосинтеза пирипиропена, полученный из штамма Penicilliumcoprobium PF1169, представленный в SEQ ID NO:266.
В настоящем изобретении термин "по существу эквивалентная аминокислотная последовательность" означает аминокислотную последовательность полипептида, активность которого не изменилась несмотря на то, что одна или несколько аминокислот подверглись замене, делеции, добавлению или вставке. Предпочтительно, чтобы аминокислотная последовательность, измененная за счет аминокислотных замен, делеций, добавлений или вставок, имела 70% идентичность или более, предпочтительно, 80% или более, более предпочтительно, 90% или более, еще более предпочтительно, 95% или более и, еще более предпочтительно, 98% идентичность или более аминокислотной последовательности до изменений и т.п. Кроме того, количество измененных аминокислотных остатков находится в пределах, предпочтительно, 1-40, более предпочтительно, 1-20, еще более предпочтительно, 1-10, еще более предпочтительно, 1-8 и, наиболее предпочтительно, 1-4.
Кроме того, примеры изменений, не влияющих на активность, включают консервативные замены. Термин "консервативная замена" означает замену, предпочтительно, 1-40, более предпочтительно, 1-20, более предпочтительно, 1-10, еще более предпочтительно, 1-8 и, наиболее предпочтительно, 1-4 аминокислотных остатков другими химически схожими аминокислотными остатками так, что активность полипептида по существу не изменяется. Примеры подобных замен включают случаи, когда некоторый гидрофобный аминокислотный остаток заменяется другим гидрофобным аминокислотным остатком и случаи, когда некоторый полярный аминокислотный остаток заменяется другим полярным аминокислотным остатком, имеющим такой же заряд. Функционально схожие аминокислоты, подходящие для подобных замен, являются известными в данной области для каждой аминокислоты. Конкретно, примеры не полярных (гидрофобных) аминокислот включают аланин, валин, изолейцин, лейцин, пролин, триптофан, фенилаланин, метионин и т.п. Примеры полярных (нейтральных) аминокислот включают глицин, серин, треонин, тирозин, глутамин, аспарагин, цистеин и т.п. Примеры положительно заряженных (основных) аминокислот включают аргинин, гистидин, лизин и т.п. Примеры отрицательно заряженных (кислотных) аминокислот включают аспарагиновую кислоту, глутаминовую кислоту и т.п.
Термин "жесткие условия" в настоящем изобретении означает условия, при которых проводится процедура отмывки мембран после гибридизации, включающие высокую температуру и раствор с низкой концентрацией солей, специалисты в данной области могут соответствующим образом выбрать условия, например, условия для отмывки в растворе с 2×SSC (1×SSC: 15 мМ трицитрата натрия, 150 мМ хлорида натрия) и 0,5% SDS при 60°C в течение 20 минут, и условия отмывки в растворе с 0,2×SSC (1×SSC: 15 мМ трицитрата натрия, 150 мМ хлорида натрия) и 0,1% SDS при 60°C в течение 15 минут.
Гибридизацию можно проводить в соответствии с известными способами. Также, в случае использования коммерчески доступной библиотеки, гибридизацию можно проводить в соответствии со способом, описанным в прилагающейся инструкции.
В настоящем описании, термин "идентичность" (также обозначаемый как гомология) нуклеотидных последовательностей означает степень совпадения оснований между двумя сравниваемыми последовательностями. При этом учитываются наличие пропусков и характеристики аминокислот. Любые значения "идентичности", указанные в настоящем описании, могут быть значениями, рассчитанными с помощью программ для определения идентичности, известных специалистам в данной области. Например, значения легко вычисляются при использовании FASTA, BLAST или т.п. с параметрами, установленными по умолчанию (начальная установка).
В настоящем описании "идентичность" нуклеотидных последовательностей равняется 90% или более, предпочтительно, 95% или более, более предпочтительно, 98% или более, еще более предпочтительно, 99% или более.
В настоящем описании термин "один или более нуклеотидов удалены, заменены, вставлены или добавлены к полинуклеотиду" означает, что были сделаны изменение известным способом, таким как сайт-специфический мутагенез, замена и т.п. множества нуклеотидов в той степени, в которой они встречаются в природе. Количество измененных нуклеотидов равняется одному или более нуклеотидам (например, от одного до нескольких нуклеотидов или 1, 2, 3 или 4 нуклеотида).
Термин "нуклеотидная последовательность, которая кодирует белок, по существу эквивалентный белку, кодируемому (любой из указанных) нуклеотидной последовательностью" означает нуклеотидную последовательность, кодирующую белок, который обладает активностью эквивалентной активности «белка, кодируемого (любой из указанных) нуклеотидной последовательностью."
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 3342 до 5158 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел КоА-лигазную активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 5382 до 12777 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел LovB-подобную поликетидсинтазную (ПКС) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 13266 до 15144 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел цитохром P450 монооксигеназную (1) (P450-1) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 16220 до 18018 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел цитохром P450 монооксигеназную (2) (P450-2) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 18506 до 19296 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел циклазную активность (IMP: Интегральный мембранный белок).
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 19779 до 21389 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел ФАД-зависимую монооксигеназную (FMO) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 21793 до 22877 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел UbiA-подобную пренилтрансферазную (UbiAPT) активность.
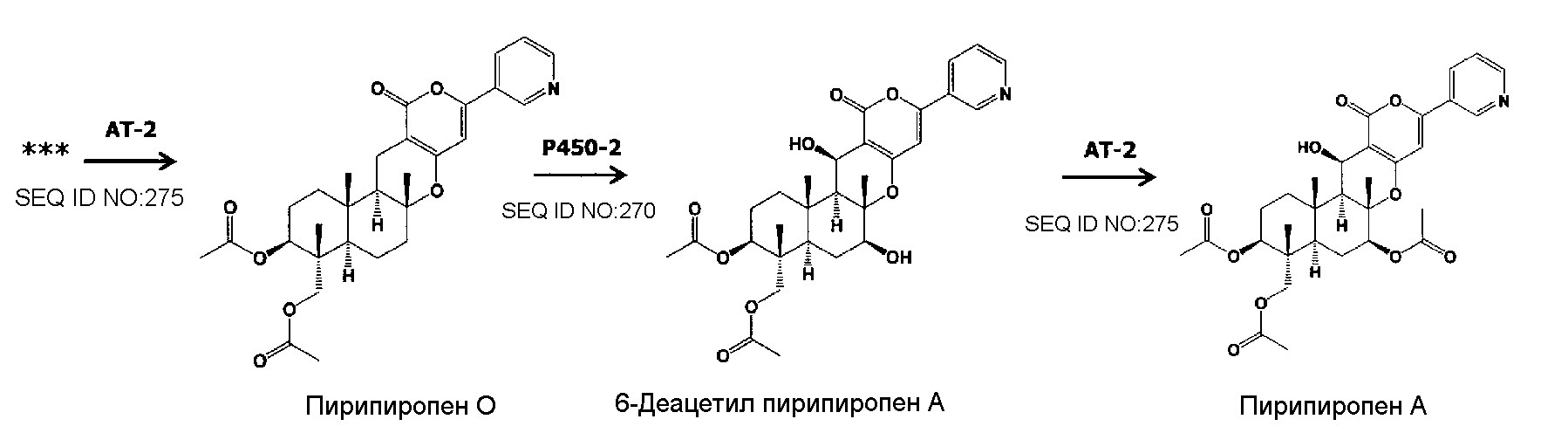
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 23205 до 24773 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел ацетилтрансферазную (AT) активность.
Предпочтительно, чтобы белок, по существу эквивалентный белку, кодируемому участком нуклеотидной последовательности от 25824 до 27178 нуклеотидной последовательности, представленной в SEQ ID NO:266, имел ацетилтрансферазную-2 (AT-2) активность.
"Нуклеотидная последовательность, имеющая функцию, по существу эквивалентную любой из указанных нуклеотидных последовательностей" никак не ограничивается при условии, что она обладает функцией, эквивалентной "любой из указанных нуклеотидных последовательностей" и, например, означает обладание функцией, эквивалентной области регуляции экспрессии интересующего гена, и, более конкретно, например, функцией, эквивалентной активности промотора или активности терминатора.
Указанный выше интересующий ген и область регуляции экспрессии можно получить, осуществляя амплификацию ДНК при помощи ПЦР, используя геномную ДНК, выделенную из пирипиропен-продуцирующих грибов или т.п., в качестве матрицы и используя подходящие праймеры, синтезированные на основании указанной выше нуклеотидной последовательности, или осуществляя общий химический синтез.
Пирипиропены
Пирипиропены в настоящем изобретении включают от пирипиропена A до пирипиропена R, и, предпочтительно, представляют собой пирипиропен A, E и O, где пирипиропен A является наиболее предпочтительным.
Способ выделения кластера генов биосинтеза пирипиропена
Кластер генов биосинтеза пирипиропена можно выделить, например, следующим способом. Например, геномную ДНК пирипиропен-продуцирующих грибов выделяют и расщепляют подходящими рестрикционными ферментами, после чего создают библиотеку, состоящую из геномной ДНК, используя космидный вектор. Затем, основываясь на нуклеотидной последовательности, содержащейся в кластере генов биосинтеза пирипиропена, такой как последовательность цитохрома P450, синтезируют подходящие праймеры так, как описано в примере 12. Для амплификации фрагмента ДНК, содержащего часть кластера генов биосинтеза, проводят ПЦР, используя полученные праймеры и геномную ДНК, полученную из пирипиропен-продуцирующих грибов в качестве матрицы. Используя данный фрагмент ДНК в качестве зонда можно выделить полноразмерный или часть кластера генов биосинтеза пирипиропена, проводя скрининг геномной библиотеки.
Кластер генов биосинтеза пирипиропена, экспрессируемый в хозяине, в настоящем изобретении может быть получен с помощью, вдобавок к указанному выше способу, лигирования интересующего гена под контроль области регуляции экспрессии, работающей в организме хозяина. Можно использовать любой способ лигирования интересующего гена и области регуляции экспрессии при условии, что интересующий ген будет экспрессироваться в хозяине. Например, существует способ функционального лигирования промотора выше интересующего гена и терминатора ниже него. Лигирование интересующего гена с областью регуляции экспрессии по настоящему изобретения можно проводить в соответствии с любым известным способом.
Маркерный ген
Маркерный ген по настоящему изобретению встраивают в конструкцию нуклеиновой кислоты таким образом, чтобы он мог экспрессироваться вместе с вышеописанным кластером генов биосинтеза пирипиропена в хозяине и позволял осуществлять селекцию трансформантов, за счет соответствующего селективного признака. Например, можно использовать гены, кодирующие устойчивость к лекарственным средствам и гены ауксотрофности. Примеры генов, кодирующих устойчивость к лекарственным средствам, включают гены против лекарственных средств, таких как дестомицин, гигромицин, беномил, олигомицин, G418, блеомицин, биалафос, бластицидин S, флеомицин, фосфинотрицин, ампициллин или канамицин, предпочтительными являются ген устойчивости к дестомицину или ген устойчивости к гигромицину. Примеры генов ауксотрофности, включают гены, такие как amdS, pyrG, argB, trpC, niaD, TRP1, LEU2 или URA3.
Эти маркерные гены можно выделить, амплифицировать, или синтезировать, используя такой же способ как, например, для кластера генов биосинтеза пирипиропена.
Конструкция нуклеиновой кислоты
Конструкция нуклеиновой кислоты в настоящем изобретении может находиться в любой форме при условии, что его можно ввести в геном хозяина, предпочтительной является форма, встроенная в вектор, который введен в хозяина. Таким образом, в соответствии с предпочтительным вариантом осуществления настоящего изобретения предлагается рекомбинантный вектор, содержащий конструкцию нуклеиновой кислоты по настоящему изобретению.
Рекомбинантный вектор по настоящему изобретению можно получить, встроив кластер генов биосинтеза пирипиропена и маркерный ген, экспрессируемые в хозяине, в подходящий вектор.
В качестве способа для создания рекомбинантного вектора, можно использовать любой общепринятый способ генетической инженерии.
В качестве вектора, который можно использовать в настоящем изобретении, можно использовать любой вектор при условии, что его можно ввести в хозяина. Примеры таких векторов включают космиды, фаговые векторы, плазмиды на основе pUC, плазмиды на основе pBluescript, плазмиды pBR322 и т.п.
Хозяин
Хозяин, который может быть использован в настоящем изобретении, никак не ограничивается при условии, что он при введении конструкции нуклеиновой кислоты по настоящему изобретению способен продуцировать пирипиропены. Хозяин, предпочтительно, представляет собой микроорганизм, способный продуцировать пирипиропены даже в состоянии, до введения конструкции нуклеиновой кислоты по настоящему изобретению. Более предпочтительно, он представляет собой нитевидный гриб, еще более предпочтительно, микроорганизм, принадлежащий роду Penicillium, роду Eupenicillium или роду Aspergillus, еще более предпочтительно, Penicilliumcoprobium, Penicilliumgriseofulvum, Eupenicilliumreticulosporum или Aspergillusfumigatus. Среди них, наиболее предпочтителен Penicilliumcoprobium, предпочтительно, штамм Penicilliumcoprobium PF1169.
Получение трансформанта
По настоящему изобретению предлагается трансформант с введенным кластером генов биосинтеза пирипиропена, полученный при трансформации указанного выше хозяина указанной выше конструкции нуклеиновой кислоты. Способ введения конструкции нуклеиновой кислоты в хозяина никак не ограничивается при условии, что в результате осуществляется введение в хозяина. Например, конструкцию нуклеиновой кислоты можно ввести в хозяина следующим способом, используя рекомбинантный вектор.
Введение конструкции нуклеиновой кислоты в хозяина, используя рекомбинантный вектор, можно проводить в соответствии с традиционным способом. Примеры способов введения включают электропорацию, обработку полиэтиленгликолем, способ с использованием Agrobacterium, способ с использованием солей лития, способ с использованием хлорида кальция и т.п. Выбирается способ наиболее эффективный для клетки-хозяина. В случае использования Penicilliumcoprobium в качестве хозяина, предпочтительна обработка полиэтиленгликолем.
В соответствии с предпочтительным вариантом осуществления настоящего изобретения, предлагается трансформант, полученный при введении плазмиды pPYRI02 в хозяина (инвентарный номер E.coli, трансформированной плазмидой pPYRI02: FERM BP-11203) или космиды pPYRI07 в хозяина (инвентарный номер E.coli, трансформированной космидой pPYRI07: FERM BP-11316).
Культивирование трансформанта и получение пирипиропенов
По настоящему изобретению предлагается способ получения пирипиропенов, включающий культивирование полученных как описано выше трансформантов и получение пирипиропенов из культуры, предпочтительно, способ получения пирипиропенов в большом количестве.
Культивирование трансформантов можно проводить соответствующим образом выбрав среду, условия культивирования и т.п. в соответствии с традиционным способом. В составе среды часто используются следующие компоненты, например, в качестве источника углерода можно использовать глюкозу, сахарозу, целлюлозу, крахмальный сироп, декстрин, крахмал, глицерин, патоку, животные и растительные масла или т.п. Также, в качестве источника азота можно использовать соевую муку, проростки пшеницы, pharmamedia, кукрузный эктракт, хлопковый жмых, бульон, пептон, полипептон, солодовый экстракт, дрожжевой экстракт, сульфат аммония, нитрат натрия, мочевину или т.п. Кроме того, при необходимости, является эффективным добавление натрия, калия, кальция, магния, кобальта, хлора, фосфорной кислоты, серной кислоты или неорганических солей, которые могут генерировать ионы, таких как хлорид калия, карбонат кальция, двухосновный калий фосфат, сульфат магния, калий дигидроген фосфат, сульфат цинка, сульфат марганца или сульфат меди. Также, при необходимости, можно добавлять минорные компоненты такие как различные витамины, такие как тиамин (тиамина гидрохлорид или т.п.), аминокислоты, такие как глутаминовая кислота (глутамат натрия или т.п.) или аспарагин (DL-аспарагин или т.п.), или нуклеотиды; или селектирующие вещества, такие как антибиотики. Кроме того, можно соответствующим образом добавлять органические вещества или неорганические вещества, которые способствуют росту грибов и стимулируют продукцию пирипиропенов.
В качестве способа культивирования можно использовать культивирование при перемешивании в аэробных условиях, культивирование при перемешивании с продуванием воздуха или глубинное аэробное культивирование, в частности, наиболее подходящим является культивирование при перемешивании с продуванием воздуха. pH среды находится в диапазоне, например, приблизительно 6-8. Подходящая температура для культивирования находится в пределах от 15°C до 40°C и, во многих случаях, культивирование проводят при температуре в пределах от 26°C до 37°C. Производство пирипиропенов варьирует в зависимости от среды и условий культивирования, или используемого хозяина. При любом способе культивирования накопление продукта, как правило, достигает пика через промежуток от 2 суток до 25 суток.
Культивирование прекращают в момент, когда количество пирипиропенов, получаемых в ходе культивирования, достигает пика, после чего пирипиропены собирают из культуры и, в соответствии с требованиями, выделяют и очищают. В случае, когда продуцируется множество типов пирипиропенов, множество типов пирипиропенов можно одновременно собрать и, в соответствии с требованиями, выделить и очистить; или множество типов пирипиропенов можно разделить и, в соответствии с требованиями, выделить и очистить.
ПРИМЕРЫ
Настоящее изобретение далее подробно иллюстрируется следующими примерами, которые никак не ограничивают настоящее изобретение.
Пример 1
Получение геномной ДНК штамма Penicilliumcoprobium PF1169
Стерильную NB среду (500 мл) помещают в колбу Эрленмейера (1 л). Штамм Penicilliumcoprobium PF1169 (Journal of Technical Disclosure No. 500997/2008 (Патентный документ 4)) предварительно культивируют в 1/2 CMMY агаровой среде при 28°C в течение 4 суток, после чего добавляют к указанной выше среде и культивируют в жидкой среде при 28°C в течение 4 суток. Фильтрацию проводят, используя Miracloth для получения 5 г клеток грибов. Из этих клеток грибов, получают 30 мкг геномной ДНК в соответствии с руководством, прилагающимся к набору для выделения геномной ДНК Genomic-tip 100/G (изготовленному Qiagen K.K.).
Пример 2
Вырожденные праймеры для амплификации поликетидсинтазы (ПКС) и амплификации ее фрагментов
Основываясь на консервативной среди различных поликетидсинтаз нитевидных грибов аминокислотной последовательности, разработали и синтезировали следующие праймеры в качестве вырожденных праймеров для амплификации:
LC1: GAYCCIMGITTYTTYAAYATG (SEQ ID NO:1)
LC2c: GTICCIGTICCRTGCATYTC (SEQ ID NO:2)
(где R=A/G, Y=C/T, M=A/C, I=инозин).
Используя данные вырожденные праймеры, геномную ДНК, полученную в примере 1, и ExTaq полимеразу (изготовленную Takara Bio Inc.) проводили реакцию, в соответствии с прилагающимся руководством. В результате был обнаружен амплифицированный фрагмент длиной приблизительно 700 п.н. (фиг.1). После этого указанный выше амплифицированный фрагмент анализировали для определения последовательности его внутренней части длиной 500 п.н. (SEQ ID NO:3).
Пример 3
Крупномасштабное секвенирование геномной ДНК и поиск гомологичных аминокислотных последовательностей
Геномную ДНК штамма Penicilliumcoprobium PF1169, полученную в примере 1, подвергали крупномасштабному секвенированию и осуществляли поиск гомологии аминокислотных последовательностей. Конкретнее, часть из 50 мкг геномной ДНК предварительно обработали и после этого поместили в ДНК секвенатор Roche 454FLX, в результате чего получили 103 тысячи фрагментов последовательностей длиной приблизительно 250 п.н. (общая длина последовательностей 49 м.п.н.).
Для этих последовательностей провели поиск гомологичных последовательностей, используя программное обеспечение blastx, среди известных последовательностей поликетидсинтаз и пренилтрансфераз для анализа выбрали следующие пять последовательностей (последовательности поликетидсинтаз: Aspergillus(A.)fumigatus ПКС 2146 а.к. и Penicillium(P.) griseofluvum синтаза 6-метилсалициловой кислоты 1744 а.к.; а также пренилтрансфераз: Aspergillus (A.) fumigatus пренилтрансфераза, Aspergillus(A.) fumigatus пренилтрансфераза (4-гидроксибензоатоктапренилтрансфераза) и Penicillium(P.) marneffeiпренилтрансфераза), получив тем самым 89, 86, 2, 1 и 3 гомологичные последовательности, соответственно (см. таблицу 2). Далее, используя гомологичные последовательностей A.fumigatus ПКС 2146 а.к. и P. griseofluvum синтазы 6-метилсалициловой кислоты 1744 а.к., получили 19 и 23 последовательности контига соответственно (контиги, полученные при помощи последовательности A.fumigatus ПКС 2146 а.к.: SEQ ID NO:179-197; последовательности контига, полученные при помощи последовательности P. griseofluvum синтазы 6-метилсалициловой кислоты 1744 а.к.: SEQ ID NO:198-220) (см. таблицу 2).
Пример 4
ПЦР амплификация геномной ДНК
Из найденных blastx результатов, полученных в примере 3, для поликетидсинтаз синтезировали 13 типов пар праймеров, представленных в SEQ ID NO:227-252. Также, для пренилтрансфераз синтезировали 5 типов пар праймеров, представленных в SEQ ID NO:253-262. При проведении ПЦР геномной ДНК с использованием данных праймеров, наблюдали амплифицированные фрагменты ожидаемой величины для всех пар праймеров (см. фиг.1 и фиг.2).
Пример 5
Конструирование фаговой геномной библиотеки
Создали λ фаговую геномную библиотеку штамма Penicilliumcoprobium PF1169, используя λ BlueSTAR Xho I Half-site Arms Kit (изготовленный Takara Bio Inc., номер по каталогу 69242-3) в соответствии с прилагавшимся руководством. То есть, геномную ДНК частично расщепляли, используя фермент рестриктазу Sau3A1. Фрагмент ДНК длиной приблизительно 20 т.п.н. (0,5 мкг) лигировали с 0,5 мкг ДНК λ BlueSTAR, прилагающимся к набору. Данный раствор для лигирования подвергали in vitro упаковке, используя Lambda INN Packaging kit (изготовленный Nippon Gene Co., Ltd.), основываясь на прилагающемся к набору руководстве, чтобы получить 1 мл раствора. Этим раствором с упакованными фагами (10 мкл) инфицировали к 100 мкл штамма E.coliER1647 и культивировали в бляшкообразующей среде при 37°C в течение ночи, в результате получая приблизительно 500 клонов бляшек. Таким образом, создали геномную библиотеку, содержащую приблизительно 50000 клонов фагов, в каждом из которых встроено, путем инфицирования клонов, от 10 до 20 т.п.н. геномной ДНК штамма Penicilliumcoprobium PF1169.
Пример 6
Скрининг фаговой библиотеки
Для 10000 клонов из фаговой библиотеки, полученной в примере 5, первичный скрининг проводили при помощи гибридизации бляшек, используя в качестве зонда продукт ПЦР, амплифицированный с использованием пары праймеров LC1-LC2c, полученных как описано выше. Для мечения и обнаружения зондов использовали AlkPhos Direct Labelling and Detection System с CDP-Star (изготовленную GE Healthcare, номер по каталогу RPN3690). Указанную выше гибридизацию проводили в соответствии с прилагающимся руководством.
В результате первичного скрининга оставили 6 клонов в качестве кандидатов для дальнейшей работы. Далее, в результате вторичного скрининга при помощи гибридизации бляшек получили 4 клона. Этими положительными клонами инфицировали штамм E.coliBM25.8, и данные фаги преобразовали в плазмиды в соответствии с прилагающимся руководством, тем самым получив 4 типа плазмид, содержащих интересующую область.
Пример 7
Получение фосмидной геномной библиотеки
Сконструировали геномную библиотеку штамма Penicilliumcoprobium PF1169 в соответствии с руководством, прилагающимся к CopyControl Fosmid Library Production Kit (изготовленную EPICENTRE, номер по каталогу CCFOS110). То есть, получали 0,25 мкг фрагментов ДНК размером приблизительно 40 т.п.н. геномной ДНК с тупыми концами и затем встраивали их в фосмидный вектор pCCFOS (изготовленный Epicentre). Данный раствор для лигирования подвергали in vitro упаковке, используя MaxPlax Lambda Packaging Extract, прилагающийся к набору, основываясь на руководстве, прилагающемся к набору. Данным раствором с упакованными вирусами (10 мкл) инфицировали 100 мкл штаммаE.coliEPI300TM-T1Rи культивировали на среде, содержащей хлорамфеникол при 37°C в течение ночи и, таким образом, отобрали приблизительно 300 колоний клонов. Таким образом, получили приблизительно 30000 клонов фосмид, в которые встроены 40 т.п.н. геномной ДНК штамма Penicilliumcoprobium PF1169, путем инфицирования. Затем разделили их на аликвоты и поместили в 96-луночный планшет так, чтобы на одну лунку приходилось приблизительно 50 клонов. Таким образом, создали геномную библиотеку, состоящую из 96 пулов, содержащих приблизительно 4800 клонов.
Пример 8
Скрининг фосмидной библиотеки
В соответствии с руководством, прилагающимся к фосмидам, плазмидные ДНК индивидуально получили из 96 пулов библиотеки, полученной в примере 7. Используя вырожденные праймеры к поликетидсинтазной амплификации, синтезированные в примере 2, проводили ПЦР амплификацию 96 пулов этих образцов плазмидной ДНК. В результате получили амплифицированные фрагменты ДНК длиной приблизительно 700 п.н. из 9 пулов. Далее, получали чашки Петри, содержащие колонии приблизительно 300 клонов или более из положительного пула, и проводили повторный скрининг при помощи гибридизации колоний. В результате, используя пару праймеров LC1-LC2c, получали 9 типов фосмид из приблизительно 4800 клонов.
Пример 9
Крупномасштабное секвенирование геномной ДНК и поиск гомологичных аминокислотных последовательностей
Геномную ДНК штамма Penicilliumcoprobium PF1169, полученную в примере 1, подвергали крупномасштабному секвенированию и проводили поиск гомологии для аминокислотных последовательностей. Конкретнее, часть 50 мкг геномной ДНК подвергали первичной обработке и затем секвенировали, используя ДНК секвенатор Roche 454FLX, получив в результате 1405 фрагмент последовательности со средней длиной контига 19.621 т.п.н. (общая длина последовательности 27,568160 м.п.н.).
Для этих последовательностей проводили поиск гомологичных последовательностей, используя программное обеспечение blastx, среди известных последовательностей поликетидсинтаз и пренилтрансфераз для анализа выбрали следующие пять последовательностей (последовательности поликетидсинтаз: Penicillium(P.) griseofluvum синтаза 6-метилсалициловой кислоты 1744 а.к. (P22367) и Aspergillus(A.) fumigatus ПКС 2146 а.к. (Q4WZA8); а также пренилтрансферазы: Penicillium(P.) marneffei пренилтрансфераза (Q0MRO8), Aspergillus (A.) fumigatus пренилтрансфераза (Q4WBI5), Aspergillus(A.) fumigatus пренилтрансфераза (4-гидроксибензоатоктапренилтрансфераза) (Q4WLD0)), получив тем самым 22 (P22367), 21 (Q4WZA8), 2 (Q0MRO8), 3 (Q4WBI5) и 3 (Q4WLD0) гомологичные последовательности соответственно.
Пример 10
Скрининг фосмидной библиотеки и анализ последовательности генов кластера
В соответствии с руководством, прилагающимся к набору для получения фосмид (изготовленному EPICENTRE, CopyControl Fosmid Library Production Kit), получали по отдельности плазмидную ДНК из 96 пулов библиотеки, полученной в примере 7. Основываясь на нуклеотидной последовательности, определенной с помощью секвенатора ДНК Roche 454FLX, проводили поиск гомологов аминокислотных последовательностей, чтобы найти области соседние с поликетидсинтазой и пренилтрансферазой. Основываясь на нуклеотидной последовательности пренилтрансферазы из найденной области, синтезировали пару праймеров (No.27), позволяющих амплифицировать фрагмент ДНК длиной 400 п.н. Используя праймеры, проводили ПЦР 48 пулов образцов плазмидной ДНК. В результате получили ожидаемые амплифицированные фрагменты ДНК длиной приблизительно 400 п.н. (SEQ ID NO:263) из 11 пулов (см. фиг.3). Далее, используя клоны из 6 пулов положительного пула, получали чашки Петри, содержащие колонии приблизительно 300 или более клонов, и проводили повторный скрининг при помощи гибридизации колоний. В результате, используя пару праймеров 27F+27R (27F праймер: SEQ ID NO:264, 27R праймер: SEQ ID NO:265), получали 4 типа фосмид из приблизительно 4800 клонов. Одну из них назвали pCC1-PP1 и определяли полноразмерную последовательность встроенного фрагмента (SEQ ID NO:266)).
Полученной pCC1-PP1 проводили трансформацию штамма Escherichiacoli EPI300TM-T1R (прилагающегося к набору для получения фосмид), тем самым получив штамм Escherichiacoli EPI300TM-T1R/pCC1-PP1 (номер по каталогу FERM BP-11133).
При проведении поиска гомологии между указанной выше последовательностью SEQ ID NO:266 и ферментами, такими как КоА лигаза; LovB-подобная поликетидсинтаза (ПКС); цитохром P450 монооксигеназа, циклаза, ФАД-зависимая монооксигеназа (FMO), которые представляют собой гидроксилазы; UbiA-подобная пренилтрансфераза (UbiAPT); ацетилтрансфераза (AT), ацетилтрансфераза-2 (AT-2), которые представляют собой ацетилтрансферазы; и катион-транспортирующая АТФаза (указанные выше ферменты получены из штамма Aspergillusfumigatus Af293), обнаруживалась высокая гомология, составляющая 70% или более, для каждого поиска.
Нуклеотиды 3342-5158 последовательности SEQ ID NO:266 кодируют КоА лигазу, и аминокислотная последовательность соответствующего полипептида представлена в SEQ ID NO:267; нуклеотиды 5382-12777 последовательности SEQ ID NO:266 кодируют LovB-подобную поликетидсинтазу (ПКС), и аминокислотная последовательность соответствующего полипептида представлена в SEQ ID NO:268; нуклеотиды 13266-15144 последовательности SEQ ID NO:266 (далее в настоящем документе белок, кодируемый этой нуклеотидной последовательностью (P450-1), обозначается как цитохром P450 монооксигеназа (1)) и нуклеотиды 16220-18018 (далее в настоящем документе белок, кодируемый этой нуклеотидной последовательностью (P450-2), обозначается как цитохром P450 монооксигеназа (2)) кодируют цитохром P450 монооксигеназы, и аминокислотные последовательности соответствующих полипептидов представлены в SEQ ID NO:269 и 270, соответственно; нуклеотиды 18506-19296 последовательности SEQ ID NO:266 кодируют циклазу, и аминокислотная последовательность соответствующего полипептида представлена в SEQ ID NO:271; нуклеотиды 19779-21389 последовательности SEQ ID NO:266 кодируют ФАД-зависимую монооксигеназу (FMO), и аминокислотная последовательность соответствующего полипептида представлена в SEQ ID NO:272; нуклеотиды 21793-22877 SEQ ID NO:266 кодируют UbiA-подобную пренилтрансферазу (UbiAPT), и аминокислотная последовательность соответствующего полипептида представлена в SEQ ID NO:273; нуклеотиды 23205-24773 последовательности SEQ ID NO:266 кодируют ацетилтрансферазу (AT), и аминокислотная последовательность соответствующего полипептида представлена в SEQ ID NO:274; нуклеотиды 25824-27178 последовательности SEQ ID NO:266 кодируют ацетилтрансферазу-2 (AT-2), и аминокислотная последовательность соответствующего полипептида представлена в SEQ ID NO:275; и нуклеотиды 27798-31855 последовательности SEQ ID NO:266 кодируют катион-транспортирующую АТФазу, и аминокислотная последовательность соответствующего полипептида представлена в SEQ ID NO:276.
Пример 11
Получение библиотеки геномной ДНК
Конструировали космидный вектор pMFCOS1, способный трансформировать грибы, следующим образом. Из плазмиды pMKD01 (Патентная заявка Японии No. 3593134) получали фрагмент XbaI длиной приблизительно 3,0 т.п.н., содержащий ген устойчивости к дестомицину, являющийся маркерным геном для трансформации грибов, и делали тупыми его концы, используя T4 полимеразу. Этот фрагмент лигировали с коммерчески доступным космидным вектором Super Cos1 (Stratagene), который был подвергнут двойному расщеплению ферментами рестрикции SmaI и StuI, тем самым получая космидный вектор pMFCOS1.
Затем штамм Penicilliumcoprobium PF1169 (Journal of Technical Disclosure No. 500997/2008 (Патентный документ 4)), являющийся пирипиропен A-продуцирующим грибом, инокулировали в жидкую среду (3% глицерин, 0,8% питательный бульон, 0,3% солодовый экстракт, 0,2% дрожжевой экстракт, 0,1% глутамат натрия, pH 7,0) и культивировали при 26°C в течение 48 часов. По окончании культивирования клетки грибов собирали при помощи центрифугирования и из этих клеток грибов выделяли хромосомную ДНК. После частичного расщепления хромосомной ДНК ферментом рестрикции Sau3AI, ее обрабатывали щелочной фосфатазой, чтобы дефосфорилировать концы ДНК. Чтобы получить рекомбинантный космидный вектор, этот фрагмент ДНК лигировали с космидным вектором pMFCOS1, предварительно обработанным ферментом рестрикции XbaI, дефосфорилированным за счет обработки щелочной фосфатазой, и затем расщепляли ферментом рестрикции BamHI. Этот рекомбинантный космидный вектор подвергали in vitro упаковке, используя MAXPLAX Lambda Packaging Extract, изготовленный Epicentre, и инфицировали им E.coliXLI-Blue MRA, тем самым получив библиотеку геномной ДНК.
Пример 12
Скрининг библиотеки геномной ДНК
В качестве зонда для скрининга библиотеки геномной ДНК, полученной в примере 1, использовали ген цитохрома P450, так как определено, что он является одним из генов, участвующих в биосинтезе пирипиропена A. Зонд изготовили при помощи ПЦР как показано ниже.
ПЦР проводили, используя геномную ДНК, описанную в примере 1, в качестве матрицы и используя олигонуклеотиды 5'-ATGATCGAGCTCAAAGATGC-3' (SEQ ID NO:277) и 5'-CTTCTTTCCAGTCAATACCT-3' (SEQ ID NO:278) в качестве праймеров. ПЦР проводили, используя Prime STAR HS DNA polymerase (Takara Bio Inc.) в качестве ДНК полимеразы и используя PERKIN ELMER GeneAmp PCR System 9700. Реакционный раствор содержал 0,5 мкл (количество, эквивалентное 0,5 мкг) геномной ДНК, 25 мкл реакционного буфера 2-кратной концентрации, прилагавшегося к ферменту, 4 мкл 2,5 мМ раствора dNTP, 0,5 мкл каждого из указанных выше праймеров, доведенных до концентрации 100 пМ/мкл, 0,5 мкл фермента и 19 мкл стерильной воды, добавленные для достижения конечного объема 50 мкл. После предварительной обработки при 94°C в течение 5 минут проводили реакцию, включающую 25 циклов последовательных инкубаций при 98°C в течение 10 секунд, 50°C в течение 5 секунд и 72°C в течение 2 минут. После завершения реакции, часть реакционной смеси подвергали электрофорезу в агарозном геле, в результате подтвердившему, что специфически амплифицировался фрагмент ДНК длиной приблизительно 1,8 т.п.н. Оставшийся реакционный раствор экстрагировали, используя смесь фенол:хлороформ:изоамиловый спирт (25:24:1) с последующим осаждением этанолом. Осадок повторно растворили в стерильной воде и подвергли электрофорезу в агарозном геле. Вырезали полосу, соответствующую приблизительно 1,8 т.п.н. в соответствии с традиционным способом выделения фрагмента ДНК.
Гибридизацию колоний проводили, используя указанный выше фрагмент ДНК в качестве зонда при помощи ECL Direct DNA/RNA Labeling and Detection System (изготовленной Amersham Pharmacia Biotech Inc.), и провели скрининг таким образом приблизительно 5000 колоний. Получили множество положительных клонов. Из одного из этих клонов выделили плазмиду pPYRI02. Кроме того, определили нуклеотидную последовательность концов встроенного в данную плазмиду pPYRI02 фрагмента и это, в результате, подтвердило, что он содержит участок от 1 до 25000 последовательности SEQ ID NO:266 и соответствующую вышележащую область.
Пример 13
Получение трансформантов
Штамм Penicilliumcoprobium PF1169, являющийся пирипиропен-продуцирующим грибом, инокулировали в жидкую среду (3% глицерин, 0,8% питательный бульон, 0,3% солодовый экстракт, 0,2% дрожжевой экстракт, 0,1% глутамат натрия, 2% глицин, pH 7,0) и культивировали при 26°C в течение 24 часов и после этого собирали клетки грибов посредством центрифугирования. Полученные клетки грибов промывали 1,0M KCl и суспендировали в 10 мл раствора ферментов для формирования протопластов (3 мг/мл β-глюкуронидаза, 1 мг/мл хитиназа, 3 мг/мл лизирующий фермент, 1,0M KCl) и фильтровали на 0,45 мкм фильтре. Суспензию перемешивали при 30°C в течение от 60 до 90 минут, и в итоге гифы превращались в протопласты. Данную суспензию фильтровали и центрифугировали, чтобы отделить протопласты, которые затем промывали SUTC буферным раствором (0,5 моль/л сахароза, 10 мМ хлорид кальция, 10 мМ tris-HCl [pH7,5]).
Полученные протопласты суспендировали в 1 мл SUTC буферном растворе. К 100 мкл суспензии добавляли 10 мкг раствора ДНК pPYRI02 (20 мкл) и смесь оставляли стоять на льду в течение 5 минут. Затем добавляли 400 мкл PEG раствора (60% PEG4000, 10 мМ хлорида кальция, 10 мМ tris-HCl [pH7,5]), перемешивали и оставляли стоять на льду в течение 20 минут. Далее добавляли 10 мл SUTC буферного раствора и центрифугировали, чтобы собрать клетки грибов, превратившиеся в протопласты. Полученные клетки грибов суспендировали в 1 мл SUTC буферного раствора и затем центрифугировали при 4000 об./мин в течение 5 минут, и окончательно суспендировали в 100 мкл SUTC буферного раствора.
Клетки грибов, обработанные вышеописанным способом, наносили на картофельно-декстрозный агар, содержащий 200 мкг/мл гигромицина B и 1,0 M сахарозы вместе с мягкой картофельно-декстрозной агаровой средой, содержащей 1,0 M сахарозы. После культивирования при 26°C в течение 4 суток, образовавшиеся колонии использовали в качестве трансформантов.
Пример 14
Культивирование трансформантов и количественное определение пирипиропенов в среде для культивирования
Для культивирования трансформанта в качестве начальной среды для культивирования использовали среду (pH 7,0 перед стерилизацией), содержащую 2,0% крахмала, 1,0% глюкозы, 0,5% полипептона, 0,6% ростков пшеницы, 0,3% дрожжевого экстракта, 0,2% соевого жмыха и 0,2% карбоната кальция. Также, в качестве среды для продуцирования, использовали среду (pH 7,0 перед стерилизацией), содержащую 10,0% глюкозы, 1,3% обезжиренной сои, 0,3% глутамата натрия, 0,8% ростков пшеницы, 0,125% хлорида натрия, 0,15% карбоната кальция и 0,2% никотинамида.
Указанную выше начальную среду для культивирования (40 мл) разделяли на аликвоты и помещали в 250 мл колбы Эрленмейера, которые предварительно стерилизовали при 122°C в течение 20 минут. После этого, трансформант, описанный в примере 13, отбирали платиновой петлей и высевали, и культивировали при встрахивании при 26°C в течение 3 суток. Среду для продуцирования (20 мл) разделяли на аликвоты и помещали в 250 мл колбы Эрленмейера, которые предварительно стерилизовали при 122°C в течение 20 минут. После этого 0,5 мл вышеописанного начального раствора с культурой асептически высеивали и культивировали при встрахивании при 26°C в течение 8 суток. К 0,5 мл полученного раствора с культурой, добавляли 9,5 мл метанола для экстракции пирипиропенов. Итоговый раствор фильтровали, тем самым получая раствор экстракта. 10 мкл экстракта анализировали, используя анализ ВЭЖХ. Анализ ВЭЖХ проводили, используя ВЭЖХ систему LC-2010C (Shimadzu Corporation). Анализ проводили при следующих условиях: колонка: Inertsil ODS-3 4,6×250 мм, подвижная фаза: ацетонитрил:вода=60:40, скорость потока: 1,0 мл/мин, температура колонки: 40°C и длина волны УФ: 320 нм. Полученный паттерн сравнивали с стандартами пирипиропенов. Определяли пики, специфичные для пирипиропенов. С их помощью оценили количество пирипиропенов. Количественно определили аналоги пирипиропенов, а именно, пирипиропен A, E и O, продуцируемые данными грибами.
В то же время, штамм Penicilliumcoprobium PF1169, являющийся родительским штаммом для трансформантов, культивировали и определяли количество пирипиропенов в среде для культивирования сходным образом.
В результате, как показано ниже в таблице 3, обнаружено, что продукция пирипиропенов трансформантом приблизительно в 2,6 раз выше, чем родительский штамм, и что трансформант, трансформированный pPYRI02, не содержащим полноразмерного кластера генов биосинтеза пирипиропена, еще обладает повышенной продукцией пирипиропенов.
Пример 15
Трансформация Penicilliumcoprobium при помощи Agrobacterium tumefaciens
Штамм Penicilliumcoprobium PF1169 культивировали в 1/2 CMMY агаровой среде при 28°C в течение 3 суток, и гифы собирали соскабливанием. Споры получали за счет фильтрации через стерильный Miracloth (изготовленный Carbiochem, номер по каталогу 475855) и разбавляли IM жидкой средой (1,74 г/л K2HPO4, 1,36 г/л KH2PO4, 0,14 г/л NaCl, 0,49 г/л MgSO4·7H2O, 0,10 г/л CaCl2·2H2O, 100 мк/л 9 мМ FeSO4, 0,53 г/л (NH4)2SO2, 1,8 г/л глюкоза, 8,53 г/л MES (2-морфолиноэтансульфоновая кислота), 5 мл/л глицерин, pH 5,3) до 103/мл для получения суспензии спор Penicilliumcoprobium.
Штамм Agrobacterium tumefaciens EHA105 с введенной pBI-AnGPD-EGFP (RIKEN), показанной на фиг.4, инокулировали в IM жидкую среду, содержащую 50 м.д. канамицина (Km), и культивировали при 28°C в течение ночи. Полученный раствор разбавляли IM жидкой средой, содержащей 50 м.д. Km, так, чтобы поглощение проходящего света при 660 нм находилось в диапазоне от 0,3 до 0,45. Добавляли ацетосирингон (AS) до конечной концентрации 500 мкм, и культивировали при 28°C в течение 6 часов, чтобы создать среду для культивирования Agrobacterium. Hybond-N+ (изготовленный GE Health Science, 82 мм в диаметре, номер по каталогу RPN82B) помещали на агаровую среду для совместного культивирования (1,74 г/л K2HPO4, 1,36 г/л KH2PO4, 0,14 г/л NaCl, 0,49 г/л MgSO4·7H2O, 0,10 г/л CaCl2·2H2O, 100 мкл/л 9 мМ FeSO4, 0,53 г/л (NH4)2SO2, 0,9 г/л глюкоза, 8,53 г/л MES (2-морфолиноэтансульфоновая кислота), 5 мл/л глицерин, 15 г/л агар, pH 5,3), содержащую 50 м.д. Km и 500 мкМ AS. И смесь из 100 мкл суспензии спор Penicilliumcoprobium и 100 мкл среды для культивирования Agrobacterium, которые обе получали вышеописанными способами, равномерно распределяли по Hybond-N+. После совместного культивирования при 25°C в течение 2 суток получившийся раствор переносили на MM агаровую среду (1,74 г/л K2HPO4, 1,36 г/л KH2PO4, 0,14 г/л NaCl, 0,49 г/л MgSO4·7H2O, 0,10 г/л CaCl2·2H2O, 100 мкл/л 9 мМ FeSO4, 0,53 г/л (NH4)2SO2, 1,8 г/л глюкоза, 15 г/л агар), содержащую 50 м.д. гигромицина и 25 м.д. меропенема (изготовленного Sumitomo Pharmaceuticals) и культивировали в течение 4 суток. Полученные колонии переносили на 1/2 CMMY агаровую среду, содержащую 25 м.д. гигромицина и 25 м.д. меропенема, получая тем самым готовых трансформантов. Как показано на фиг.5A, изображающей полученные устойчивые к гигромицину колонии и наблюдаемую флуоресценцию GFP, флуоресценция обнаруживается у большинства полученных устойчивых к гигромицину колоний. С другой стороны, как показано на фиг.5B, у контрольных колоний штамма Penicilliumcoprobium PF1169, не инфицированных Agrobacterium, флуоресценция не наблюдается. Кроме того, введение гена устойчивости к гигромицину и гена GFP подтверждали у устойчивых к гигромицину колоний при помощи ПЦР, эти данные не приведены.
Пример 16
Скрининг 2 библиотеки геномной ДНК
Нуклеотидная последовательность концов фрагментов, встроенных в плазмиду pPYRI02, полученную в примере 12, представляет собой последовательность участка от 1 до 25000 последовательности SEQ ID NO:266 и соответствующей вышележащей области. Для получения полноразмерного кластера генов биосинтеза пирипиропена, где дополнительно добавляли нижележащую область кластера генов биосинтеза пирипиропена, полноразмерный кластер генов биосинтеза конструировали лигированием нижележащей области кластера генов биосинтеза пирипиропена, который отдельно клонировали с вставленным фрагментом pPYI02, как описано выше.
В способе конструирования полноразмерного кластера генов биосинтеза нижележащую область кластера клонировали из библиотеки геномной ДНК, полученной в примере 11, используя в качестве зонда ген O-ацетилтрансферазы, который является геном биосинтеза пирипиропена A, не содержащимся в pPYRI02.
ПЦР проводили при тех же условиях, как и в примере 12, за исключением того, что в качестве матрицы использовали геномную ДНК, описанную в примере 11, и использовали олигонуклеотиды 5'-ATGGATTCCCTATTGACGAG-3' (SEQ ID NO:279) и 5'-TTAAATCTCCCCACCAACCG-3' (SEQ ID NO:280) в качестве праймеров для амплификации фрагмента ДНК, для применения его в качестве зонда.
Гибридизацию колоний проводили, используя указанный выше фрагмент ДНК в качестве зонда, используя ECL Direct DNA/RNA Labeling and Detection System, подвергнув скринингу таким образом приблизительно 5000 колоний. Получили множество положительных клонов. Из одного из этих клонов выделили плазмиду pPYRI03. ПЦР анализ клона подтвердил, что он содержит нижележащую область кластера генов биосинтеза, и что в отличии от вышележащей области он содержит область цитохром P450 монооксигеназу и не содержит область аденилат-образующего фермента (КоА лигазы).
Космиды, содержащие полноразмерный кластер генов биосинтеза, создавали, используя фрагмент, встроенный в pPYRI02, полученную в примере 12, и фрагмент, встроенный в pPYRI03, полученную как описано выше. Анализ нуклеотидной последовательности каждой космиды может помочь найти сайты распознавания рестрикционных ферментов в кластере. Дополнительно, обнаружили, что полноразмерный кластер генов биосинтеза можно сконструировать лигируя фрагмент BsiWI (приблизительно 20,2 т.п.н.) pPYRI02, используемый в качестве вышележащей области кластера генов биосинтеза, с фрагментом BsiWI-AflII (приблизительно 4,9 т.п.н.) pPYRI03, используемым в качестве нижележащей области.
Плазмиду pSET152 для конъюгационного переноса в Actinomyces, описанную в [Bierman, M. et al. «Gene», (Netherlands) 1992, 116, p43-49], расщепляли рестриктазой SphI, получали тупые концы посредством T4 ДНК полимеразы и лигировали с HindIII линкером (5'-CCCAAGCTTGGG-3' (SEQ ID NO:281), изготовленным Takara Shuzo) для конструирования плазмиды pSET153. Для того, чтобы изменить сайт множественного клонирования pSET153 на HindIII-NotI-BsiWI-AflII-NotI-EcoRI, синтетические олигонуклеотиды Hin-Not-Bsi-Afl-Not-Eco-1 (5'-AGCTTGCGGCCGCGTACGCTTAAGGCGGCCGCG-3') (SEQ ID NO:282) и Hin-Not-Bsi-Afl-Not-Eco-2 (5'-AATTCGCGGCCGCCTTAAGCGTACGCGGCCGCA-3') (SEQ ID NO:283) отжигали и затем лигировали с pSET153, которую предварительно расщепляли двумя ферментами рестрикции HindIII и EcoRI, с получением плазмиды pSET201. Фрагмент BsiWI-AflII длиной приблизительно 4,9 т.п.н., полученный из pPYRI03, вставляли в сайт BsiWI-AflII pSET201 для получения плазмиды pPYRI05. Фрагмент BsiWI длиной приблизительно 20,2 т.п.н., полученный из pPYRI02, вставляли в сайт BsiWI pPYRI05, и отбирали клоны, в которых фрагмент BsiWI встраивался в том же направлении как и в природном кластере генов биосинтеза, получив плазмиду pPYRI06. Из-за того, что pPYRI06, являющаяся плазмидой, содержащей полноразмерный кластер генов биосинтеза, не содержит маркера для трансформации грибов, встроенный фрагмент встраивали в космидный вектор pMFCOS1. Более конкретно, фрагмент NotI космидного вектора длиной приблизительно 8,5 т.п.н., полученный из pPYRI02, и фрагмент NotI длиной приблизительно 25,1 т.п.н., полученный из pPYRI06, лигировали, получив космиду pPYRI07 (транслируемая область: SEQ ID NO:284, нетранслируемая область: SEQ ID NO:285). pPYRI07 представляет собой космиду, содержащую полноразмерный кластер генов биосинтеза, и который также содержит маркерный ген для трансформации грибов.
Анализ нуклеотидной последовательности концов встроенного в pPYRI07 фрагмента подтвердил, что pPYRI07 содержит участок от 2446 до 27505 последовательности SEQ ID NO:266 и соответствующую вышележащую область, содержащую нуклеотидную последовательность вектора, и, что pPYRI07 содержит полноразмерный кластер генов биосинтеза пирипиропена.
Пример 17
Получение трансформанта, используя pPYRI07
Трансформант получали в тех же условиях, как в примере 13, за исключением того, что использовали pPYRI07, полученную в примере 16.
Пример 18
Культивирование трансформанта и количественное определение пирипиропенов в среде для культивирования
Способы культивирования трансформанта, полученного в примере 17, и количественной оценки содержания пирипиропенов в среде для культивирования являются такими же, как описанные в примере 14. Количественно определяемые аналоги пирипиропенов представляли собой пирипиропен A, E и O, продуцируемые данными грибами. В то же время, штамм Penicillium coprobium PF1169, который является родительским штаммом трансформанта, культивировали и определяли количество пирипиропенов в среде для культивирования сходным образом.
В результате, как показано ниже в таблице 4, обнаружили, что продукция пирипиропенов трансформантом составляла приблизительно в 3,6 раз выше, чем родительский штамм. Из результатов следует, что введение полноразмерного кластера генов биосинтеза пирипиропена увеличивает продуктивность штамма Penicilliumcoprobium PF1169.
Пример 19
Получение трансформанта, используя Penicilliumcoprobium
Для подтверждения того, что введение полноразмерного кластера генов биосинтеза пирипиропена также увеличивает продуктивность штаммов Penicilliumcoprobium, отличных от штамма Penicilliumcoprobium PF1169, трансформировали штамм Penicilliumcoprobium ATCC58615 (см. Studies in Mycology (2004), 49, p84-85).
Трансформант получали тем же способом, как в примере 13, за исключением того, что использовали pPYRI07, полученную в примере 16.
Пример 20
Культивирование трансформанта и количественное определение пирипиропенов в среде для культивирования
Способы культивирования трансформантов, полученных в примере 19, и измерения количества пирипиропенов в среде для культивирования являлись такими же, как в примере 14, за исключением того, что культивирование проводили в течение 4 суток. Количественно определяемые аналоги пирипиропенов представляли собой пирипиропен A, E и O, продуцируемые данными грибами. В то же время, штамм Penicilliumcoprobium ATCC58615, который является родительским штаммом для трансформанта, культивировали и определяли количество пирипиропенов в среде для культивирования сходным образом.
В результате, как показано ниже в таблице 5, обнаружили, что продукция пирипиропенов трансформантом составляла приблизительно в 2,5 раз выше, чем родительским штаммом. Из результатов следует, что введение полноразмерного кластера генов биосинтеза пирипиропена увеличивает продуктивность штамма Penicilliumcoprobium, отличного от штамма Penicilliumcoprobium PF1169. Кроме того обнаружили, что продуктивность Penicilliumcoprobium линии PF1169 возрастает сильнее, чем продуктивность штамма Penicilliumcoprobium ATCC58615.
Инвентарные номера
FERM BP-11133
FERM BP-11203
FERM BP-11316
Реферат
Группа изобретений относится к области биохимии. Предложена конструкция нуклеиновой кислоты, содержащая кластер генов биосинтеза пирипиропена и маркерный ген. Предложен трансформант, полученный путем введения вышеуказанной конструкции нуклеиновой кислоты в клетку-хозяина нитевидного гриба, продуцирующего пирипиропены. Также предложен трансформант, полученный путем одновременного или раздельного введения конструкции нуклеиновой кислоты, содержащей кластер генов биосинтеза пирипиропена, и конструкции нуклеиновой кислоты, содержащей маркерный ген, в клетку-хозяина нитевидного гриба, продуцирующего пирипиропены. Предложен способ продукции пирипиропенов А, Е или О с использованием вышеуказанных трансформантов. Группа изобретений позволяет получить повышенную продукцию указанных пирипиропенов трансформантом по сравнению с родительской клеткой. 4 н. и 6 з. п. ф-лы., 7 ил., 5 табл., 20 пр.
Формула
(I) участок от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266;
(II) участок от 1 до 25000 нуклеотидной последовательности SEQ ID NO: 266;
(III) участок от 2446 до 27505 нуклеотидной последовательности SEQ ID NO: 266;
(IV) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной участку от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266, и кодирующая белок, функционально эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266;
(V) нуклеотидная последовательность полинуклеотида участка от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266, в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который кодирует белок, функционально эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266; и
(VI) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом участка от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266, и кодирующая белок, функционально эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266, и
где указанный маркерный ген представляет собой ген устойчивости к лекарственному средству или ген ауксотрофности.
(1) нижеуказанная нуклеотидная последовательность согласно (а)-(i):
(a) нуклеотидная последовательность участка от 3342 до 5158 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(b) нуклеотидная последовательность участка от 5382 до 12777 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(c) нуклеотидная последовательность участка от 13266 до 15144 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(d) нуклеотидная последовательность участка от 16220 до 18018 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(e) нуклеотидная последовательность участка от 18506 до 19296 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(f) нуклеотидная последовательность участка от 19779 до 21389 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(g) нуклеотидная последовательность участка от 21793 до 22877 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(h) нуклеотидная последовательность участка от 23205 до 24773 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(i) нуклеотидная последовательность участка от 25824 до 27178 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной нуклеотидной последовательности согласно (1), и кодирующая белок, функционально эквивалентный белку, кодируемому любой из вышеуказанных нуклеотидных последовательностей;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности согласно (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который кодирует белок, функционально эквивалентный белку, кодируемому любой из вышеуказанных нуклеотидных последовательностей; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности согласно (1), и которая кодирует белок, функционально эквивалентный белку, кодируемому любой из вышеуказанных нуклеотидных последовательностей.
(1) нуклеотидная последовательность из нижеуказанных последовательностей согласно (j)-(s):
(j) нуклеотидная последовательность участка от 2911 до 3341 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
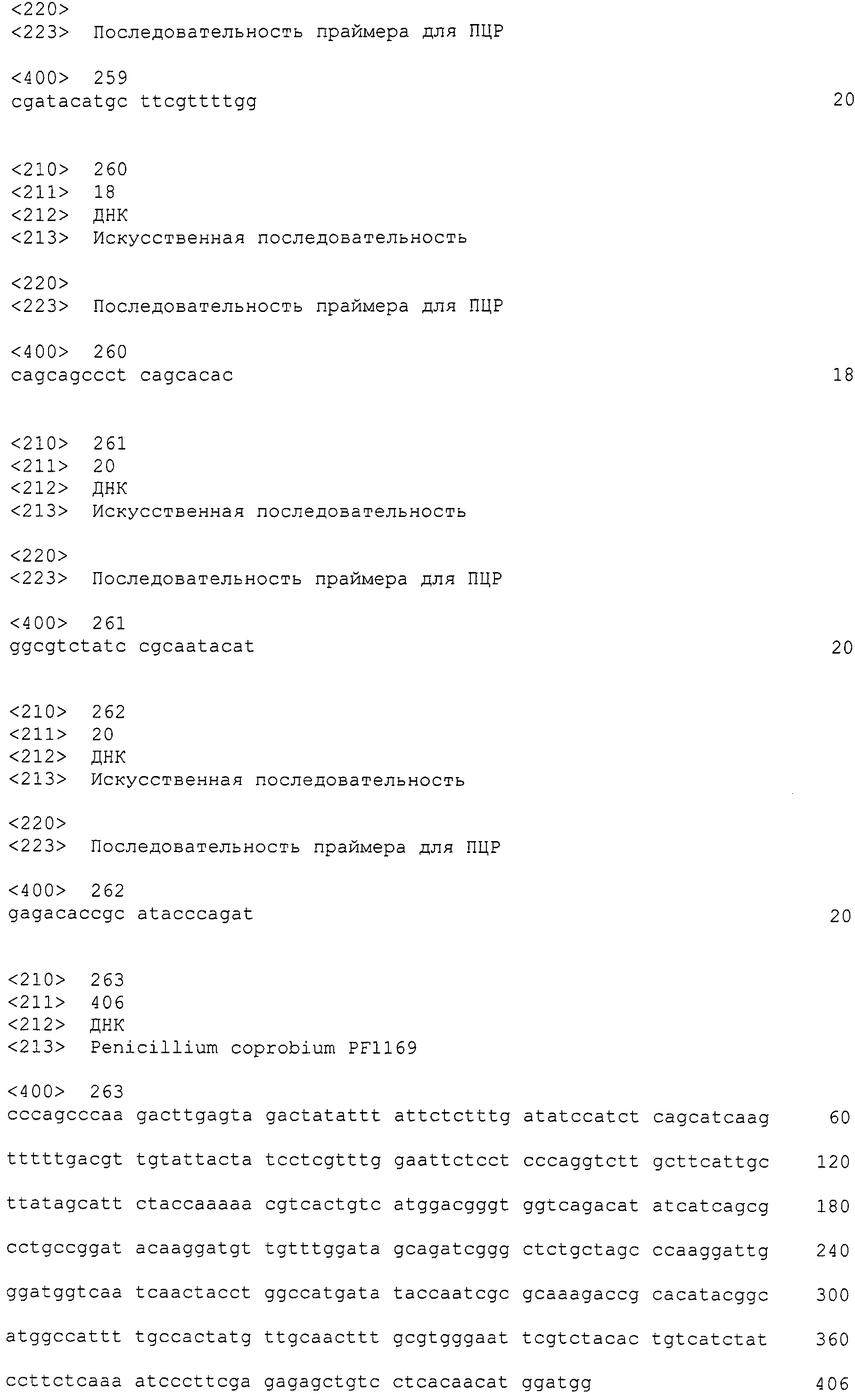
(k) нуклеотидная последовательность участка от 5159 до 5381 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(l) нуклеотидная последовательность участка от 12778 до 13265 нуклеотидной последовательности, представленной в SEQ ID NO:266,
(m) нуклеотидная последовательность участка от 15145 до 16219 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(n) нуклеотидная последовательность участка от 18019 до 18505 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(о) нуклеотидная последовательность участка от 19297 до 19778 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(р) нуклеотидная последовательность участка от 21390 до 21792 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(q) нуклеотидная последовательность участка от 22878 до 23204 нуклеотидной последовательности, представленной в SEQ ID NO: 266,
(r) нуклеотидная последовательность участка от 24774 до 25823 нуклеотидной последовательности, представленной в SEQ ID NO: 266, и
(s) нуклеотидная последовательность участка от 27179 до 27797 нуклеотидной последовательности, представленной в SEQ ID NO: 266;
(2) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной нуклеотидной последовательности согласно (1), и имеющая функцию, по существу эквивалентную любой из указанных выше нуклеотидных последовательностей;
(3) нуклеотидная последовательность полинуклеотида нуклеотидной последовательности согласно (1), в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который имеет функцию, по существу эквивалентную любой из указанных выше нуклеотидных последовательностей; и
(4) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом нуклеотидной последовательности согласно (1), и имеющая функцию, по существу эквивалентную любой из указанных выше нуклеотидных последовательностей.
где указанный кластер генов биосинтеза пирипиропена содержит по меньшей мере одну нуклеотидную последовательность, выбранную из нуклеотидных последовательностей согласно (I)-(VI) ниже:
(I) участок от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266;
(II) участок от 1 до 25000 нуклеотидной последовательности SEQ ID NO: 266;
(III) участок от 2446 до 27505 нуклеотидной последовательности SEQ ID NO: 266;
(IV) нуклеотидная последовательность, способная к гибридизации в жестких условиях с последовательностью, комплементарной участку от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266, и кодирующая белок, функционально эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266;
(V) нуклеотидная последовательность полинуклеотида участка от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266, в котором один или более нуклеотидов удалены, заменены, вставлены или добавлены, и который кодирует белок, функционально эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266; и
(VI) нуклеотидная последовательность, имеющая по меньшей мере 90% идентичность с полинуклеотидом участка от 2911 до 277 97 нуклеотидной последовательности SEQ ID NO: 266, и кодирующая белок, функционально эквивалентный белку, кодируемому участком от 2911 до 27797 нуклеотидной последовательности SEQ ID NO: 266, и
где указанный маркерный ген представляет собой ген устойчивости к лекарственному средству или ген ауксотрофности.



Комментарии